Область техники, к которой относится изобретение
Настоящее изобретение относится к модуляторам ванилоидного рецептора, в частности к антагонистам TRPV1.
Уровень техники
Ванилоидный рецептор типа 1 (TRPV1-The Transient Receptor Potential Vanilloid 1) в большой степени вовлечен в возникновение термической и механической гипералгезии и, как предполагается, играет ключевую роль в различных патологических состояниях, включая нейропатическую боль и урологические растройства.
Известны антагонисты ванилоидного рецептора, содержащие биарильный фрагмент; WO 2004/0567741 раскрывает, среди прочих, следующие замещенные ариламиды биарил-4-карбоновых кислот:

Описание изобретения
В настоящее время найдено, что заменой пиридинового фрагмента в вышеуказанных соединениях на 5-изохинолиновый цикл могут быть получены антагонисты TRPV1 с улучшенными свойствами.
Таким образом, изобретение предлагает улучшенные модуляторы ванилоидного рецептора типа 1 общей формулы (I).
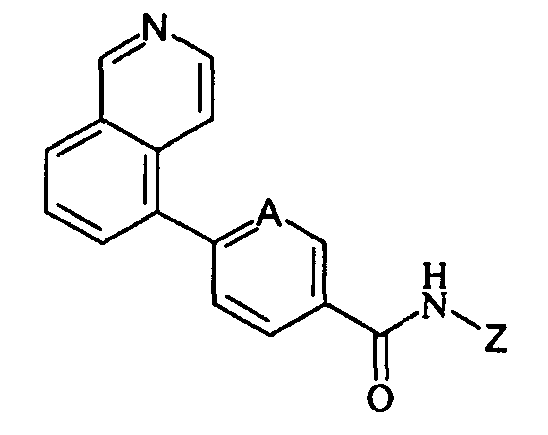
(I)
где:
А представляет собой CH или N;
Z представляет собой фенильное или пиридиновое кольцо, необязательно замещенное одним или несколькими группами R, которые могут быть одинаковыми или отличаться одна от другой и выбираются из C1-C4 алкила, предпочтительно метила, изопропила или трет-бутила, C1-C4 галогеналкила, предпочтительно трифторметила или галогена.
Для целей настоящего описания, галоген означает атом галогена, выбранный из фтора, хлора, брома и иода, предпочтительно хлор.
Первой группой предпочтительных соединений изобретения является группа формулы (Ia)

(Ia)
в которой Z соответствует вышеуказанному определению.
Второй группой предпочтительных соединений, согласно изобретению, является группа формулы (Ib)

(Ib)
в которой Z соответствует вышеуказанному определению.
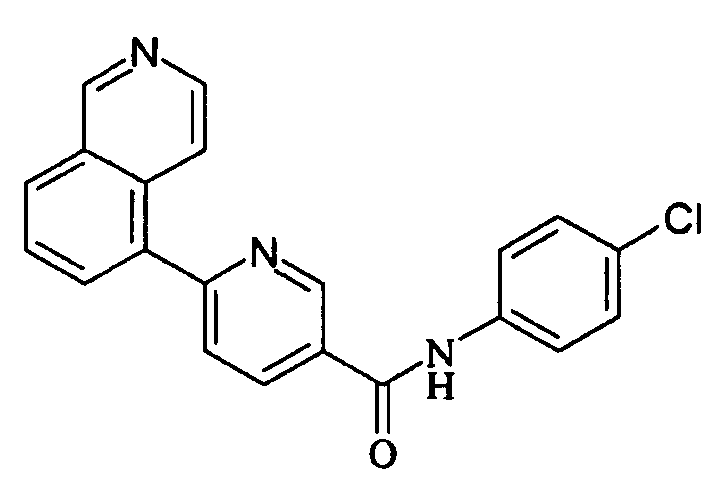
В соединениях формул (Ia) и (Ib) Z предпочтительно представляет собой фенильное кольцо, замещенное в пара-положении группой R, отличной от атома водорода, предпочтительно - атом хлора. Согласно изобретению наиболее предпочтительное соединение представляет собой N-(4-хлорфенил)-6-(изохинолин-5-ил)пиридин-3-карбоксамид (в дальнейшем называемый V394).
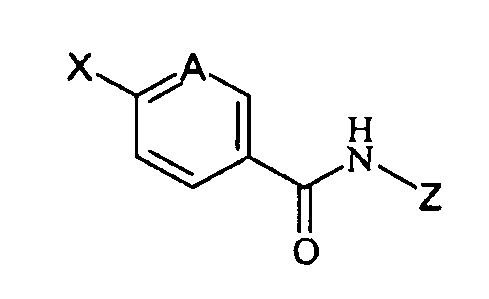
Соединение формулы (I) может быть получено с помощью обычных методов, таких как реакция соединений формулы (II)

(II)
где А соответствует вышеуказанному определению и карбоксильная группа активирована преобразованием в хлорангидрид,
с соединением формулы (III)
Z-NH 2
(III)
где Z соответствует вышеуказанному определению.
Предпочтительно соединение формулы (I) может быть получено реакцией Сузуки2 между соединением формулы (IV)
(IV)
где А и Z соответствуют вышеуказанному определению и X представляет собой атом галогена, выбранный из иода или брома,
и борной кислотой (V).
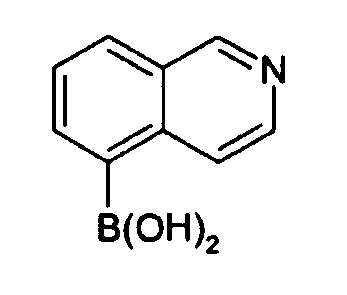
(V)
Например, соединение V394 обычно получают реакцией Сузуки между 6-бромо- или 6-хлоро-N-(4-хлорфенил)пиридин-3-карбоксамидом и 5-изохинолинборной кислотой.
Соединение формулы (I) модулирует ванилоидный рецептор TRPV1; для предпочтительного соединения V394 значение Ki составляет 15 нМ (13-17) в спинном мозге крысы и значение IC50 составляет 0,83 нМ (0,74-0,93) на культивированных нейронах ганглиев дорсального корешка крысы. Соответственно, соединения изобретения могут быть использованы для получения фармацевтических композиций для лечения воспалительных состояний, таких как хроническая боль или воспалительная гипералгезия. Эти композиции могут быть получены стандартными способами и со стандартными наполнителями, например, раскрытыми в Remington's Pharmaceutical Science Handbook, XVII ed. Mack Pub., N.Y., U.S.A.
Изобретение далее иллюстрируется с помощью следующих примеров.
ПРИМЕРЫ
Материалы и методы
Все коммерчески доступные соединения были куплены в Aldrich и использовались без дополнительной очистки. За ходом реакций следили методом тонкослойной хроматографии на силикагеле (покрытые пластины F254 Merck), пятна изучали под УФ-излучением и проявляли водным раствором KMnO4. Флэш-хроматографию проводили с использованием силикагеля Merck (230-240 меш). Спектры 1H-ЯМР регистрировали на спектрометре Varian 400 МГц, используя ТМС в качестве внутреннего стандарта. Масс-спектры были получены на спектрометре Waters-Micromass ZMD. Температуры плавления определяли в аппарате Buchi-Tottoli и не исправляли.
Пример - N-(4-хлорфенил)-6-(-изохинолин-5-ил)пиридин-3-карбоксамид (V394)
Стадия а) - 6-Хлоро-N-(4-хлорфенил)пиридин-3-карбоксамид
Коммерчески доступный хлорангидрид 6-хлорникотиновой кислоты (56,8 ммоль, 10 г) растворили в 50 мл безводного CH2Cl2 и добавили по каплям к раствору диизопропилэтиламина (ДИЭА) (1,2 эквивалента, 68,2 ммоль, 11,67 мл) и 4-хлоранилина (1,2 экв., 68,2 ммоль, 8,70 г) в 50 мл CH2Cl2 при 0°С. Смесь перемешивали при комнатной температуре в течение 20 ч, затем разбавили CH2Cl2 (200 мл) и промыли водой (1×200 мл) и насыщенным раствором хлорида натрия (1×100 мл). Органический слой высушили над сульфатом натрия и сконцентрировали. Неочищенный остаток кристаллизовали из диэтилового эфира и получили 13 г белого твердого вещества. Выход = 86%. 1Н ЯМР (CDCl3, 200 МГц) δ 7,35(2Н, д, J=8,8 Гц), 7,47(1Н, д, J=8,2 Гц), 7,58(2Н, д, J=8,8 Гц), 7,88(1Н, ушир.с), 8,16(1Н, дд, J=8,4 Гц, J'=2,8 Гц,), 8,84(1Н, д, J=2,4 Гц).
Стадия б) - Изохинолин-5-ил-5-борная кислота
К 2,5 М раствору н-BuLi (1,2 экв., 3 ммоль, 1,2 мл) в 20 мл свежеперегнанного ТГФ, охлажденному до -78°С, добавили раствор 5-бромизохинолина (2,5 ммоль, 520 мг) в 5 мл ТГФ. Полученная смесь реагировала при этой температуре в течение 45 мин. Затем добавили раствор триизопропилбората (1,2 экв., 3 ммоль, 0,7 мл) и смесь перемешивали при этой же температуре 5 мин и затем дали ей нагреться до комнатной температуры и перемешивали дополнительный час. Смесь гидролизовали медленным добавлением 5% раствора NaOH (30 мл). Водный слой отделили и подкислили до pH 5/6 добавлением 10% HCl при 0°С. Экстракция этилацетатом, упаривание органической фазы и кристаллизация из диэтилового эфира дают 250 мг белового твердого вещества. Выход = 58%. 1Н ЯМР (d6-DMSO, 200 МГц) δ 7,66(1Н, т, J=7,2 Гц), 8,07(1Н, д, J=5,8 Гц), 8,13(1Н, д, J=8,0 Гц), 8,34(1Н, д), 8,47(1Н, д), 8,50(2Н, ушир.с), 9,29(1Н, с). [M+1] 174,1 (C9H8BNO2 вычислено 172,98).
Стадия с) - N-(4-хлорфенил)-6-(изохинолин-5-ил)пиридин-3-карбоксамид (реакция Сузуки)
Смесь изохинолин-5-ил-5-борной кислоты (1,5 экв., 8,4 ммоль, 1,46 г), 6-хлор-N-(4-хлорфенил)пиридин-3-карбоксамида (5,6 ммоль, 1,5 г), ацетата палладия (4% моль, 48 мг), трифенилфосфина (2 экв., 2,94 г), 15% Na2CO3 (4 мл), EtOH (4 мл) и толуола (50 мл) нагревали при 80°С в течение 16 ч. После упаривания добавили насыщенный раствор гидрокарбоната натрия и выпавший твердый осадок отфильтровали и затем промыли этилацетатом. Осадок перекристаллизовали из метанола и получили 1,4 г соединения V394 в виде белого твердого вещества. Т.пл. (диэтиловый эфир)=258°С. Выход = 69%.1Н ЯМР (d6-DMSO, 400 МГц) δ 7,471(2Н, д, J=8,8 Гц), 7,838(1Н, м), 7,852(2Н, д, J=8,8 Гц), 7,953(1Н, д, J=8,0 Гц), 8,049(1Н, дд, J=7,2 Гц, J'=0,8 Гц,), 8,085(1Н, д, J=6,0 Гц), 8,290(1Н, д, J=8,4 Гц), 7,490(1Н, дд, J=8,4 Гц, J'=2,2 Гц,), 8,543(1Н, д, J=6,0 Гц), 9,300(1Н, д, J=1,6 Гц), 9,438(1Н, с), 10,695(1Н, с). [M+1] 360,4 (C21H14ClN3O вычислено 359,81).
Определение биологической активности
Использовались новорожденные и зрелые крысы линии Sprague-Dawley (~250 г) (Harlam, Италия). Все эксперименты соответствовали национальным протоколам и были одобрены региональным комитетом по этическим нормам.
Анализ радиолигандного связывания
Для испытаний использовались самцы крыс линии Sprague-Dawley с массой тела между 250 и 350 г к моменту исследования. Для анализа связывания крыс декапитировали под анестезией, и спинной мозг извлекали и разрушали с использованием тканевого гомогенизатора Polytron в ледяном буфере, содержащем 5 мМ KCl, 5,8 мМ NaCl, 0,75 мМ CaCl2, 2мМ MgCl2, 320 мМ сахарозы, 10 мМ Hepes (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), pH 8,6.5 Гомогенизированную ткань центрифугировали при 1000 × g в течение 10 мин при 4°С, и супернатант снова центрифугировали в течение 30 мин при 35000 × g при 4°С (Beckman Avanti J25). Осадок ресуспендировали в том же буфере, описанном выше, и использовали в экспериментах по связыванию. В экспериментах по насыщению 150 мкг суспензии белок/образец из суспензий мембран инкубировали с [3Н]-резинифератоксином ([3H]RTX) (0,003-3 нМ) в исследуемом буфере, содержащем 0,25 мг/мл бычьего сывороточного альбумина (BSA) без жирных кислот, при 37°С в течение 60 мин. В экспериментах по конкурирующему связыванию, мембраны инкубировали при 37°С в течение 60 мин с [3H]RTX (0,4 нМ) и повышали концентрации изучаемых соединений (от 0,1 нМ до 3 мкм).
Неспецифическое связывание определяли в присутствии 1 мкм RTX. После инкубации реакционную смесь охладили до 0°С и в течение 15 мин инкубировали с бычьим α1-кислым гликопротеином (200 мкг на пробирку) для уменьшения неспецифического связывания RTX. Мембраносвязанный RTX отделили от свободного RTX центрифугированием образцов при 18500 × g в течение 15 мин. Конец http://www.multitran.ru/c/m.exe?t=2748032_2_1и, содержащий осадок, отрезали и радиоактивность измеряли сцинтилляционным методом (Packard 2500 TR). Концентрацию белка определяли согласно методу Bio-Rad c бычьим сывороточным альбумином в качестве стандарта (Bradford, 1976). Результаты исследования по насыщению и конкурентному связыванию анализировали программой Ligand6.
Измерение Са 2+ методом флуоресцентного анализа в культивированных нейронах ганглиев дорсального корешка крысы
Взрослых крыс необратимо анестезировали и декапитировали. Ганглии дорсального корешка были выделены и помещены в холодный раствор фосфатного буфера (PBS) перед тем, как их перенесли в раствор коллагеназы (10 мг/мл), трипсина (5 мг/мл) и ДНКазы (1 мг/мл) на 35 мин при 37°С. Ганглии, помещенные в холодную среду DMEM (модифицированная по способу Дульбекко среда Игла) с добавлением 10% сыворотки эмбрионов коров, 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина, диссоциировали на одиночные клетки несколькими пропусканиями через группу инъекционных игл (23G вплоть до 25G). Среду и ганглии отфильтровали для удаления дебриса, добавили 8 мл среды DMEM и центрифугировали (200 × g 5 мин). Целевой осадок клеток ресуспендировали в среде DMEM [с добавлением 100 нг/мл фактора роста нервов мыши (мыши NGF-7S) и свободного основания цитозин-β-D-арабинофуранозида (ARA-C) 2,5 мкм]. Клетки высеивали на покрытые поли-L-лизином (8,3 мкм) и ламинином (5 мкм) 25 мм покровные стекла и выдерживали в течение от 5 до 8 дней при 37°С во влажной камере, заполненной 5% СО2 и воздухом, затем добавили эфир Fura-2-АМ (3 мкм) в растворе Са2+ буфера следующего состава (мМ): CaCl2 1,4, KCl 5.4, MgSO4 0.4, NaCl 135, D-глюкоза 5, HEPES 10 с BSA (0,1%), при pH 7,4 на 40 мин при 37°С. Клетки затем дважды промыли раствором Са2+ буфера и перенесли в ячейку на предметном столике микроскопа Nikon eclipse TE300. Эфир Fura-2-АМ возбуждали при 340 нм и 380 нм чтобы измерить относительные изменения концентрации [Са2+]i с помощью отношения F340/F380, которое фиксировалось системой анализа динамического изображения (Laboratory Automation 2,0, RCS, Флоренция, Италия) и клетки оставили (по крайней мере на 10 мин) для достижения стабильной флуоресценции перед началом эксперимента. Калибровочная кривая была получена с использованием буфера, содержащего эфир Fura-2-АМ и заданную концентрацию свободного Са2+. Затем эту кривую использовали для преобразования данных, полученных из отношения F340/F380 в [Ca2+]i (нМ)8. Было изучено влияние премедикации капсазепином (CPZ), SB366791 и V394 на повышение [Ca2+]i, обусловленное 0,1 мкм капсаицина.
Вызванная капсаицином вторичная аллодиния у крыс
Капсаицин (20 нмоль/50 мкл/лапу) был введен в лишенный волос участок кожи подошвенной поверхности правой лапы крысы, под анестезией диэтиловым эфиром (Chaplan et al., 1994). Соединение V394 было введено перорально (30 мкмоль/кг) за 2 часа до инъекции касаицина. Тактильная аллодиния была оценена через 90 мин после введения капсаицина.
Лекарственные вещества и реагенты
Лекарственные вещества и реагенты были получены у указанных компаний: [3Н]-Резинифератоксин (Perkin Elmer, Бостон, MA), SB-366791 (Tocris, Великобритания), капсаицин, капсазепин, иономицин, ламинин, поли-L-лизин, вещество P (Sigma, Италия); мыши NGF-7S и коллагеназа/диспаза (Roche Diagnostics, Италия); модифицированная по способу Дульбекко среда Игла (DMEM), сыворотка эмбрионов коров (FBS) инактивированная нагреванием, L-глутамин (200 мМ), пенициллин/стрептомицин (10,000 МЕ/мл ± 10,000 мкг/мл), (Gibco, Италия); эфир Fura-2-AM (Società Italiana Chimici, Италия). Исходные концентрации капсаицина (10 мМ), капсазепина (10 мМ), (Е)-3-(4-хлорфенил)-N-(3-метоксифенил)акриламид (обозначенный как SB-366791) (1 мМ) и V394 были приготовлены в 50% DMSO и 50% Твина 80 (Tween 80). Эфир Fura-2-AM и иономицин растворяли в 100% DMSO. Все другие лекарственные вещества растворяли в дистиллированной воде. Растворы с подходящими степенями разбавления затем были приготовлены в буферном растворе Кребса.
Результаты
Тест связывания радиолигандов
Кривая насыщения [3H]-RTX на рецепторах TRPV1, выделенных из спинного мозга крыс, показывает значение KD равное 0,21 (0,16-0,27) и значение Bmax, равное 57 (53-62) фмоль/мг белка. График Скэтчарда фактически линейный и компьютерный анализ данных показывает, что присутствует только один тип сайтов связывания с высокой аффинностью. Эксперименты по конкурентному связыванию [3H]-RTX показали, что V394 и эталон SB-366791 обладают значениями Ki, равными 15(13-17) нМ и 36(30-43) нМ соответственно.
Ca 2+ флуоресценция
Капсаицин (0.1 мкм) вызвал увеличение [Ca2+] в подавляющем большинстве (95%) нейронов ганглия дорсального корешка, которые по этой причине были определены как TRPV1 экспрессирующие нейроны. Значение IC50 V394, которое ингибируют вызываемую капсаицином активацию [Ca2+]i, составило 0,83 нМ (0,74-0,93). Эталонные антагонисты TRPV1, капсазепин и SB-366791 ингибировали отклик капсаицина со значениями IC50, равными (676-1330) нМ и 8,7 (3,4-17,3) нМ соответственно. Результаты выражали в виде среднего значения и границ 95% доверительного интервала.
Вызванная капсаицином вторичная аллодиния у крыс
Через 90 мин после введения капсаицина, соединение V394 вызвало превентивный эффект (55%) против проаллодинического эффекта капсаицина.
ССЫЛКИ

| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТЫ VRI ВАНИЛОИДНОГО РЕЦЕПТОРА НА ОСНОВЕ ИОНОНА | 2007 |
|
RU2447064C2 |
| АГОНИСТЫ TRPV1, СОДЕРЖАЩИЕ ИХ ПРЕПАРАТЫ И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2379282C2 |
| МОДУЛЯТОРЫ А3 -РЕЦЕПТОРОВ АДЕНОЗИНА | 1999 |
|
RU2250904C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНОНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ВАНИЛОИДНЫХ АНТАГОНИСТОВ | 2005 |
|
RU2396261C2 |
| АНТАГОНИСТЫ TRPV1, ВКЛЮЧАЮЩИЕ ДИГИДРОКСИГРУППУ В КАЧЕСТВЕ ЗАМЕСТИТЕЛЯ, И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2621708C2 |
| ПРОИЗВОДНЫЕ СОЕДИНЕНИЯ ПИРАЗОЛА | 2012 |
|
RU2600983C2 |
| ТЕТРАЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРОВ CB КАННАБИНОИДОВ С ВЫСОКОЙ СЕЛЕКТИВНОСТЬЮ К ПОДТИПАМ РЕЦЕПТОРОВ CB/CB | 2005 |
|
RU2354650C2 |
| 3,4-ДИГИДРОБЕНЗОКСАЗИНОВЫЕ СОЕДИНЕНИЯ И ИНГИБИТОРЫ АКТИВНОСТИ ВАНИЛЛОИДНЫХ РЕЦЕПТОРОВ ПОДТИПА 1 (VR1) | 2006 |
|
RU2427579C2 |
| СЕЛЕКТИВНЫЕ К ПОДТИПУ РЕЦЕПТОРА АЗАБИЦИКЛОАЛКАНОВЫЕ ПРОИЗВОДНЫЕ | 2008 |
|
RU2417984C1 |
| 5-СУЛЬФАНИЛ-4Н-1,2,4-ТРИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА | 2002 |
|
RU2367655C2 |
Настоящее изобретение относится к новым производным биарилкарбоксиариламидам общей формулы (I), где: А представляет собой N; Z представляет собой фенильное кольцо, замещенное группой R, выбранной из атома галогена. Также изобретение относится к применению соединения формулы (I) и к фармацевтической композиции на основе соединения формулы (I). Технический результат: получены новые производные биарилкарбоксиариламида, полезные в качестве модулятора ванилоидного рецептора типа 1. 3 н. и 6 з.п. ф-лы, 1 пр.
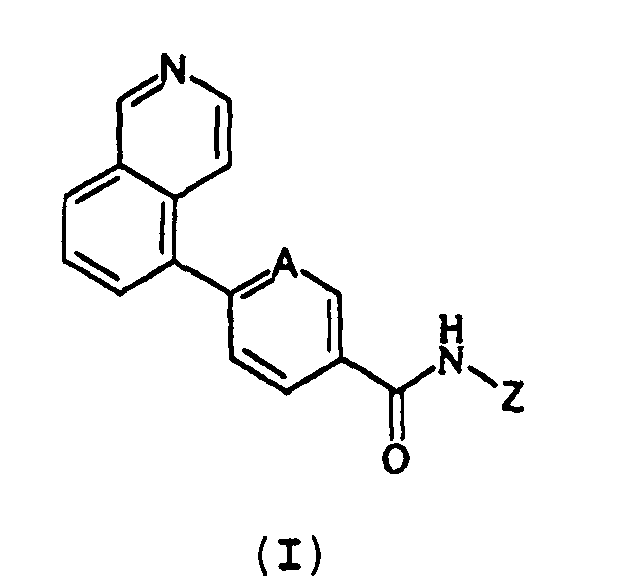
1. Соединения общей формулы (I)

где А представляет собой N;
Z представляет собой фенильное кольцо, замещенное группой R, выбранной из атома галогена.
2. Соединение по п.1 формулы (Ia)

в которой Z соответствует определению в п.1
3. Соединение по п.1 формулы (Ib)
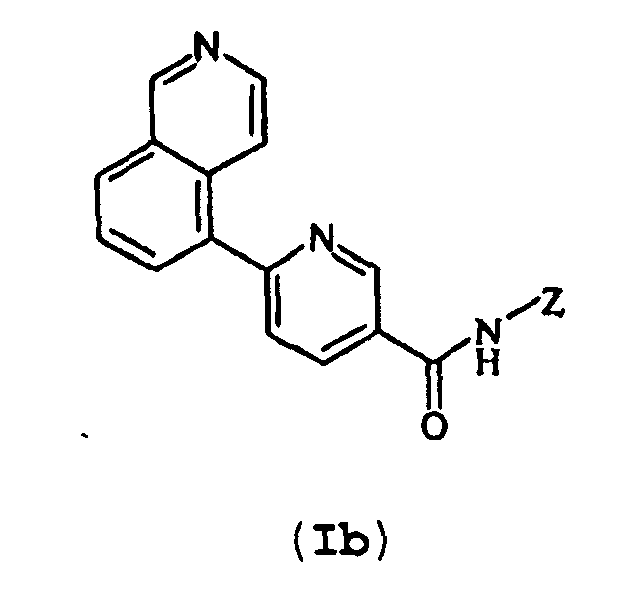
в которой Z соответствует определению в п.1.
4. Соединение по п.3 формулы
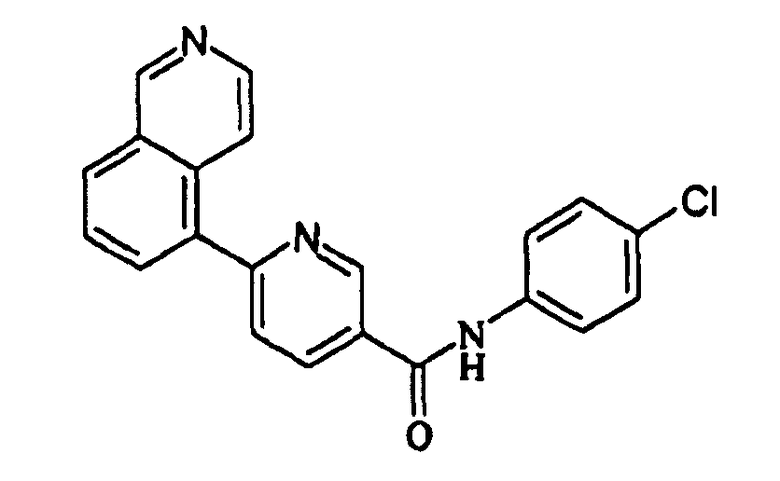
5. Соединение по любому из пп.1-4 в качестве модулятора ванилоидного рецептора типа 1, в частности антагониста TRPV1, для лечения воспалительных заболеваний и урологических расстройств.
6. Применение соединения по любому из пп.1-5 для получения лекарственных средств для лечения воспалительных заболеваний и урологических расстройств.
7. Применение по п.6, где воспалительное заболевание представляет собой нейропатическую боль.
8. Фармацевтическая композиция модулятора ванилоидного рецептора типа 1, в частности антагониста TRPV1, содержащая соединение по любому из пп.1-5 в смеси с фармацевтически приемлемым носителем и/или наполнителем.
9. Фармацевтическая композиция по п.8 для лечения воспалительных заболеваний и урологических расстройств.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| RU 2004132844 А, 10.06.2005. | |||
Авторы
Даты
2012-11-27—Публикация
2007-07-02—Подача