Область изобретения
Настоящее изобретение относится к некоторым производным пиразоло-триазоло-пиримидина, триазоло-триазоло-пиримидина и имидазоло-триазоло-пиримидина и их применению в практике медицины в качестве модуляторов А3-рецепторов аденозина.
Предпосылки изобретения
Фармакологически охарактеризованы три основных класса рецепторов аденозина, классифицируемые как A1, A2 и А3. A1-рецепторы связаны с ингибированием аденилатциклазы через Gi белки, и также было показано, что связаны с другими системами вторичных переносчиков, включая ингибирование или стимуляцию обмена фосфоинозита и активацию ионных каналов. А2-рецепторы дополнительно подразделяются на два подтипа, А2A и А2B, на которых агонисты аденозина активируют аденилатциклазу с высокой и низкой аффинностью соответственно. Последовательность А3-рецепторов была впервые идентифицирована в опытах с крысиной библиотекой кДНК, и было показано, что эта последовательность, позднее клонированная гомологично по отношению к другим рецепторам, связанным с G-белком из библиотеки кДНК мозга крыс, соответствует новому функциональному рецептору аденозина.
Обнаружение А3-рецептора открыло новые лечебные перспективы в области пуринов. В частности, А3-рецепторы участвуют в процессах воспаления, гипотонии и дегрануляции тучных клеток. Вероятно, этот рецептор также играет роль в центральной нервной системе. Селективный А3-агонист IB-MECA индуцирует поведенческую депрессию и при долговременном введении защищает от церебральной ишемии. Было также установлено, что селективные А3-агонисты в высоких концентрациях индуцируют апоптоз в клетках лейкемии человека HL-60. Эти и другие обнаруженные факты делают А3-рецепторы обещающей терапевтической мишенью. Идет поиск селективных антагонистов для А3-рецепторов в качестве потенциальных противовоспалительных и, возможно, антиишемических агентов в головном мозге. В последнее время на стадии разработки находятся А3-антагонисты для применения в качестве препаратов против астмы, антидепрессантов, против аритмии, для защиты почек, против болезни Паркинсона и для усиления познавательной функции.
Следовательно, целью настоящего изобретения является обеспечение соединений и способов их получения и применения, которые являются агонистами, неполными агонистами и/или антагонистами А3-рецептора аденозина.
Краткое описание изобретения
Раскрываются соединения, полезные в качестве эффективных, к тому же селективных модуляторов А3-рецептора аденозина с активностью антагонистов для данного рецептора и способы их получения и применения.
Соединения имеют следующую общую формулу:
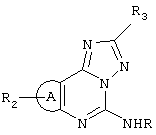
или
где:
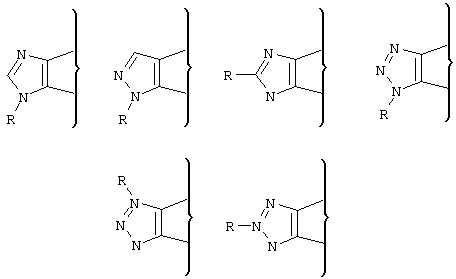
А является имидазолом, пиразолом или триазолом;
R является -C(X)R1, -C(X)-N(R1)2, -C(X)OR1, -C(X)SR1, -SOnR1, -SOnOR1, -SOnSR1 или -SOn-N(R1)2;
R1 является водородом, алкилом, замещенным алкилом, алкенилом, замещенным алкенилом, алкинилом, замещенным алкинилом, арилом, гетероарилом, гетероциклом, низшим алкенилом, низшим алканоилом или, если связан с атомом азота, затем взятый вместе с атомом азота, образует азетидиновое кольцо или 5-6-членное гетероциклическое кольцо, содержащее один или более гетероатомов, таких как N, О, S;
R2 является водородом, алкилом, алкенилом, алкинилом, замещенным алкилом, замещенным алкенилом, замещенным алкинилом, аралкилом, замещенным аралкилом, гетероарилом, замещенным гетероарилом или арилом;
R3 является фураном, пирролом, тиофеном, бензофураном, бензопирролом, бензотиофеном, необязательно замещенными одним или более заместителями, как описано для замещенных гетероарильных колец;
Х является О, S или NR1;
n равно 1 или 2;
их меченные радиоактивным изотопом аналоги, их меченные флуоресцентной меткой аналоги и
их фармацевтически приемлемые соли.
Предпочтительно R1 является водородом, C1-C8алкилом; С2-С7алкенилом; С2-С7алкинилом; С3-С7циклоалкилом; C1-C5алкилом, замещенным одним или более атомами галогена, гидроксигруппами, C1-C4алкокси, С3-С7циклоалкилами или группами формулы -NR
Предпочтительными C1-C8алкильными группами являются метил, этил, пропил, бутил и изопентил. Примеры С3-С7циклоалкильных групп включают циклопропил, циклопентил и циклогексил. Примеры C1-C5алкильных групп, замещенных С3-С7циклоалкильными группами, включают циклогексилметил, циклопентилметил и 2-циклопентилэтил. Примеры замещенных C1-C5алкильных групп включают 2-гидроксиэтил, 2-метоксиэтил, трифторметил, 2-фторэтил, 2-хлорэтил, 3-аминопропил, 2-(4-метил-1-пиперазин)этил, 2-(4-морфолинил)этил, 2-аминокарбонилэтил, 2-диметиламиноэтил, 3-диметиламинопропил. Арил предпочтительно является фенилом, необязательно замещенным Cl, F, метокси, нитро, циано, метилом, трифторметилом, дифторметокси группами. Примеры 5-6-членных кольцевых гетероциклических групп, содержащих N, О и/или S, включают пиперазинил, морфолинил, тиазолил, пиразолил, пиридил, фурил, тиенил, пирролил, триазолил, тетразолил. Примеры С7-С10аралкильных групп включают бензил или фенетил, необязательно замещенные одним или более заместителями, выбранными из Cl, F, метокси, нитро, циано, метила, трифторметила и дифторметокси. Предпочтительно R1 является водородом, C1-C8алкилом, арилом или С7-С10аралкилом, необязательно замещенным предпочтительно атомами галогена. Предпочтительно Х является О, R2 является C2-С3алкилом или замещенным алкилом, и R3 является фураном.
Особенно предпочтительными соединениями являются те, в которых R представляет фенетильную группу, в которой фенильное кольцо замещается одним или более заместителями, выбранными из группы, состоящей из атомов хлора, фтора, метокси, нитро, циано, метила, трифторметила и дифторметокси.
Возможные значения А можно представить следующими структурными формулами:
Соединения можно применять в способе модуляции А3-рецепторов аденозина у млекопитающего, включая человека. Способы включают введение эффективного количества соединения формулы I, достаточного для модуляции А3-рецепторов аденозина у млекопитающего. Применения соединений включают:
- лечение гипертензии;
- лечение воспалительных заболеваний, таких как ревмато-идный артрит и псориаз;
- лечение аллергических заболеваний, таких как сенная лихорадка и аллергический ринит;
- дегрануляцию тучных клеток;
- противоопухолевые препараты;
- лечение кардиальной гипоксии и
- защиту от церебральной ишемии;
- диагностические применения, например, для определения наличия одного или более вышеуказанных заболеваний или для скринингового анализа при определении эффективности других соединений на связывание с А3-рецептором аденозина (т.е. посредством конкурентного ингибирования, как определяется различными тестами связывания), как описано в Jacobson and Van Rhee, Purinergic approaches to experimental therapy, Jacobson and Jarvis, ed., Wiley, New York, 1997, pp.101-128; Mathot et al., Brit. J. Pharmacol., 116:1957-1964 (1995); van der Wenden et al., J. Med. Chem., 38:4000-4006 (1995); и van Calenbergh, J. Med. Chem., 40:3765-3772 (1997), содержание которых включено здесь в качестве ссылки.
Соединения также можно использовать в способе полного или частичного ингибирования аденилатциклазы (А3) у млекопитающего, включая человека. Способы включают введения эффективного количества соединения формулы I, достаточного для полного или частичного ингибирования аденилатциклаэы у млекопитающего. Соединения также можно пометить и использовать для обнаружения наличия опухолевых клеток, содержащих А3-лиганды аденозина, у пациента или в пробе клеток путем контактирования клеток с меченым соединением, связывания соединения с А3-рецепторами и детектирования присутствия метки.
Соединения можно использовать в фармацевтической композиции, которая включает соединение формулы I и один или более эксципиентов. Различные химические промежуточные продукты можно использовать для получения данных соединений.
Краткое описание чертежей
Фиг.1 является графиком, показывающим насыщение связывания [125I]AB-MECA (фмоль/мг белка) с А3-рецепторами человека, экспрессированными в клетках НЕК 293 против молярной концентрации [125I]АВ-МЕСА.
Фиг.2 является графиком, показывающим насыщение связывания [125I]AB-MECA (фмоль/мг белка) с А3-рецепторами человека, экспрессированными в клеточной линии JURKAT против молярной концентрации [125I]AB-MECA. Как показано на фигуре, детектируемая плотность А3-рецептора равнялась примерно 300 фмоль/мг белка в мембранах клеток JURKAT при использовании [125I]AB-MECA.
Фиг.3 и 4 являются графиками, показывающими насыщение связывания меченного тритием аналога соединения 47-5-[[(4-метоксифенил)амино]карбонил]амино-8-пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединение 102) (фмоль/мг белка) с А3-рецепторами, экспрессированными в клеточной линии JURKAT против молярной концентрации соединения 102. Данные на этих фигурах показывают присутствие А3-рецепторов аденозина в опухолевых клетках человека в высокой плотности. Например, было обнаружено примерно 1300 фмоль/мг белка в клетках JURKAT и 650 фмоль/мг белка детектировано в клетках HL60. Следовательно, соединение 102 является значительно более чувствительным инструментом для обнаружения А3-рецепторов аденозина, чем [125I]AB-MECA. Эти обнаруженные факты облегчают определение присутствия А3-рецептора во многих опухолях человека.
Детальное описание изобретения
Настоящая заявка раскрывает соединения, полезные в качестве эффективных, к тому же селективных модуляторов рецепторов аденозина с активностью как А3-агонистов, так и в некоторых случаях А3-антагонистов, и способы их получения и применения.
Соединения можно использовать в способе модуляции А3-рецепторов аденозина у млекопитающего, включая человека. Способы включают введение эффективного количества соединения формулы I, достаточного для модуляции А3-рецепторов аденозина, млекопитающему.
Соединения можно использовать в фармацевтической композиции, которая включает соединение формулы I и один или более эксципиентов. Различные химические полупродукты можно использовать для получения данных соединений.
Определения
Как здесь использовано, соединение является агонистом А3-рецептора аденозина, если оно способно полностью ингибировать аденилатциклазу (А3) и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является неполным агонистом А3-рецептора аденозина, если оно способно частично ингибировать аденилатциклазу (А3) и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является антагонистом А3-рецептора аденозина, если оно способно предупредить ингибирование за счет агониста и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является селективным для А3-рецептора, если соотношение активности A1/А3 и A2/А3 выше, чем примерно 50, предпочтительно находится между 50 и 100 и наиболее предпочтительно выше, чем примерно 100.
Как здесь использовано, термин “алкил” относится к одновалентным прямым, разветвленным или циклическим алкильным группам, предпочтительно имеющим от 1 до 20 атомов углерода, более предпочтительно от 1 до 10 атомов углерода (“низший алкил”) и наиболее предпочтительно от 1 до 6 атомов углерода. Этот термин поясняется примерами групп, таких как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, н-гексил и тому подобное. Термины “алкилен” и “низший алкилен” относится к двухвалентным радикалам соответствующего алкана. Кроме того, как здесь использовано, другие фрагменты, имеющие названия, производные от алканов, такие как алкоксил, алканоил, алкенил, циклоалкенил и т.д., когда модифицированы “низшими”, имеют углеродные цепи из 10 или менее атомов углерода. В этих случаях, когда минимальное число атомов углерода выше, чем один, например, алкенил (минимум из двух атомов углерода) и циклоалкил (минимум из трех атомов углерода), следует понимать, что “низший” означает по меньшей мере минимальное число атомов углерода.
Как здесь использовано, термин “замещенный алкил” относится к алкильной группе, предпочтительно из от 1 до 10 атомов углерода (“замещенный низший алкил”), имеющей от 1 до 5 заместителей и предпочтительно от 1 до 3 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, аминоацилокси, оксиациламино, циано, галогена, гидроксила, кето, тиокето, карбоксила, карбоксилалкила, тиола, тиоалкокси, замещенного тиоалкокси, арила, арилокси, гетероарила, гетероарилокси, гетероцикла, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SO2-замещенного алкила, -SО2-арила, -SO2-гетероарила и моно и ди-алкиламино, моно- и ди-(замещенный алкил)амино, моно- и ди-ариламино, моно- и ди-гетероариламино, моно- и ди-гетероциклического амино и несимметричных дизамещенных аминов, имеющих различные заместители, выбранные из алкила, арила, гетероарила и гетероцикла. Как здесь использовано, другие фрагменты имеющие префикс “замещенный”, предназначены для включения одного или более заместителей, перечисленных выше.
Как здесь использовано, “алкарил” относится к алкилу с арильным заместителем. Связывание имеет место через алкильную группу. “Аралкил” относится к арильной группе с акильным заместителем, где связывание происходит через арильную группу.
Как здесь использовано, термин “алкокси” относится к группе “алкил-O-”, где алкил является таким, как определено выше. Предпочтительные алкокси группы включают в качестве примера метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси, 1,2-диметилбутокси и тому подобное.
Как здесь использовано, термин “алкенил” относится к алкенильным группам, предпочтительно имеющим от 2 до 10 атомов углерода и более предпочтительно от 2 до 6 атомов углерода и имеющим по меньшей мере 1 и предпочтительно 1-2 двойные ненасыщенные связи. Предпочтительные алкенильные группы включают этенил (-CH=CH2), н-пропенил (-CH2CH=CH2), изо-пропенил (-С(СН3)=CH2) и тому подобное.
Как здесь использовано, термин “алкинил” относится к алкинильным группам, предпочтительно имеющим от 2 до 10 атомов углерода и более предпочтительно от 2 до 6 атомов углерода и имеющим по меньшей мере одну и предпочтительно 1-2 тройных ненасыщенных связи.
Как здесь использовано, термин “ацил” относится к группам: алкил-С(О)-, замещенный алкил-С(О)-, циклоалкил-С(О)-, замещенный циклоалкил-С(О)-, арил-С(О)-, гетероарил-С(О)- и гетероцикл-С(О)-, где алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, арил, гетероарил и гетероцикл являются такими, как здесь определено.
Как здесь использовано, термин “ациламино” относится к группе -C(O)NRR, где каждый R независимо является водородом, алкилом, замещенным алкилом, арилом, гетероарилом или гетероциклом, где алкил, замещенный алкил, арил, гетероарил и гетероцикл являются такими, как здесь определено.
Как здесь использовано, термин “арил” относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных (слитых) колец (например, нафтил или антрил). Предпочтительные арилы включают фенил, нафтил и тому подобное. Если нет иного ограничения определения арильного заместителя, такие арильные группы могут быть необязательно замещены 1-5 заместителями и предпочтительно 1-3 заместителями, выбранными из группы, состоящей из гидрокси, ацила, алкила, алкокси, алкенила, алкинила, замещенного алкила, замещенного алкокси, замещенного алкенила, замещенного алкинила, амино, замещенного амино, аминоацила, ацилокси, ациламино, алкарила, арила, арилокси, азидо, карбоксила, карбоксилалкила, циано, галогена, нитро, гетероарила, гетероарилокси, гетероцикла, гетероциклоокси, аминоацилокси, оксиациламино, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тиогетероарилокси, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SО2-замещенного алкила, -SО2-арила, -SО2-гетероарила, тригалогенметила. Предпочтительные заместители включают алкил, алкокси, галоген, циано, нитро, тригалогенметил и тиоалкокси.
Как здесь использовано, термин “циклоалкил” относится к циклическим алкильным группам из 3-12 атомов углерода, имеющим одно циклическое кольцо или несколько конденсированных колец. Такие циклоалкильные группы включают в качестве примера единичные кольцевые структуры, такие как циклопропил, циклобутил, циклопентил, циклооктил и тому подобное, или множественные кольцевые структуры, такие как адамантил и тому подобное.
Как здесь использовано, термины “гало” или “галоген” относятся к фтору, хлору, брому и йоду и предпочтительно являются либо фтором, либо хлором.
Как здесь использовано, термин “гетероарил” относится к ароматической карбоциклической группе из 1-15 атомов углерода и 1-4 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, по меньшей мере, в одном кольце (если имеется больше, чем одно кольцо).
Если нет иного ограничения определения гетероарильного заместителя, такие гетероарильные группы могут быть необязательно замещены 1-5 заместителями и предпочтительно 1-3 заместителями, выбранными из группы, состоящей из гидрокси, ацила, алкила, алкокси, алкенила, алкинила, замещенного алкила, замещенного алкокси, замещенного алкенила, замещенного алкинила, амино, замещенного амино, аминоацила, ацилокси, ациламино, алкарила, арила, арилокси, азидо, карбоксила, карбоксилалкила, циано, галогена, нитро, гетероарила, гетероарилокси, гетероцикла, гетероциклоокси, аминоацилокси, оксиациламино, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тиогетероарилокси, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SO2-замещенного алкила, -SО2-арила, -SО2-гетероарила и тригалогенметила. Предпочтительные заместители включают алкил, алкокси, галоген, циано, нитро, тригалогенметил и тиоалкокси. Такие гетероарильные группы могут иметь одно кольцо (например, пиридил или фурил) или несколько конденсированных колец (например, индолизинил или бензотиенил).
“Гетероцикл” или “гетероциклический” относится к одновалентной насыщенной или ненасыщенной группе, имеющей одно кольцо или несколько конденсированных колец из от 1 до 15 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода в кольце.
Если нет иного ограничения определения гетероциклического заместителя, такие гетероциклические группы могут быть необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, алкокси, замещенного алкокси, арила, арилокси, галогена, нитро, гетероарила, тиола, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тригалогенметила и тому подобное. Такие гетероциклические группы могут иметь одно кольцо или несколько конденсированных колец.
В отношении любой из вышеуказанных групп, которая содержит 1 или более заместителей, конечно понятно, что такие группы не содержат замещение или образец замещения, которые стерически неосуществимы и/или синтетически невыполнимы.
Как здесь использовано, “производные карбоновой кислоты” и “производные сульфоновой кислоты” относятся к -C(X)R1, -С(Х)-N(R1)2, -C(X)OR1, -C(X)SR1, -SOnR1, -SOnOR1, -SOnSR1 или -SOn-N(R1)2, где Х является О, S или NR1, где R1 является водородом, алкилом, замещенным алкилом или арилом, и их активированные производные, такие как ангидриды, сложные эфиры и галогениды, такие как хлориды, бромиды и йодиды, которые можно использовать для сочетания производных карбоновой кислоты и сульфоновой кислоты с 5’-амином, используя обычную химию сочетания.
“Фармацевтически приемлемые соли” относятся к фармацевтически приемлемым солям соединения формул IA, IB или IC, которые являются производными различных органических и неорганических противоионов, хорошо известных в данной области, и включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и тому подобное; и когда молекула содержит основную функциональность, в качестве фармацевтически приемлемой соли можно использовать соли органических и неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и тому подобное.
Термин “защитная группа” или “блокирующая группа” относится к любой группе, которая когда присоединена к одной или более гидроксильным, амино или карбоксильным группам данных соединений (включая их промежуточные продукты, такие как аминолактамы, аминолактоны и т.д.) предотвращает реакции, имеющие место с этими группами, и которую можно удалить обычной химической или ферментативной стадиями для восстановления гидроксильной, амино или карбоксильной группы. Предпочтительные удаляемые блокирующие группы для аминогруппы включают обычные заместители, такие как трет-бутоксикарбонил (t-BOC), бензилоксикарбонил (CBZ) и тому подобное, которые можно удалить в обычных условиях, совместимых с природой продукта.
Здесь используются следующие сокращения: [125I]АВ-МЕСА - [125I]N6-(4-амино-3-йодбензил)аденозин-5’-N-метил-уронамид; (R)-PIA - (R)-N6-(фенилизопропил)аденозин; ДМСО - диметилсульфоксид; I-AB-MECA - N6-(4-амино-3-йодбензил)аденозин-5’-N-метилуронамид; IB-MECA - N6-(3-йодбензил) аденозин-5’-N-метилуронамид; Ki - равновесная константа ингибирования; NECA - 5’-N-этилкарбоксамидоаденозин; ТГФ - тетрагидрофуран; Трис - трис-(гидроксиметил)аминометан.
Получение соединений
Специалисты в области органической химии оценят, что реакционноспособные и лабильные функциональные группы часто должны быть защищены перед определенной реакцией или последовательностью реакций и затем восстановлены до их первоначальной формы после завершения последней реакции. Обычно группы защищаются при их превращении в относительно стабильное производное. Например, гидроксильную группу можно превратить в эфирную группу и аминогруппу можно превратить в амид или карбамат. Способы защиты и снятия защиты также известны как “блокирование” и “деблокирование”, хорошо известны и широко практикуются в данной области, например, смотри Т.Green, “Protective Groups in Organic Synthesis”, John Wiley, New York (1981) или “Protective Groups in Organic Chemistry”, Ed. J.F.W. McOmie, Plenum Press, Лондон (1973).
Соединения предпочтительно получают взаимодействием соединения формулы II, ниже, с подходящим производным карбоновой кислоты или сульфоновой кислоты, используя известную химию.
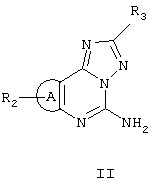
Соединения формулы II можно получить, используя следующие схемы I и II, проиллюстрированные для R3, являющегося фураном.
Схема I
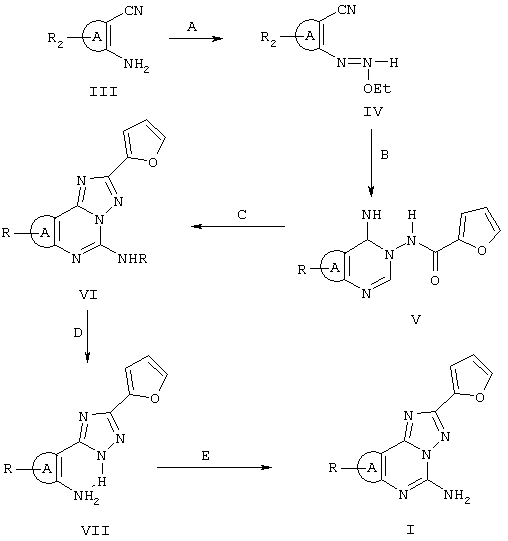
Реагенты: А) триэтилортоформиат; В) гидразид 2-фуранкарбоновой кислоты, 2-метоксиэтанол; С) PhOPh, 260°C; D) 10% НСl, при кипячении с обратным холодильником; Е) цианамид, pTsOH, N-метилпирролидон.
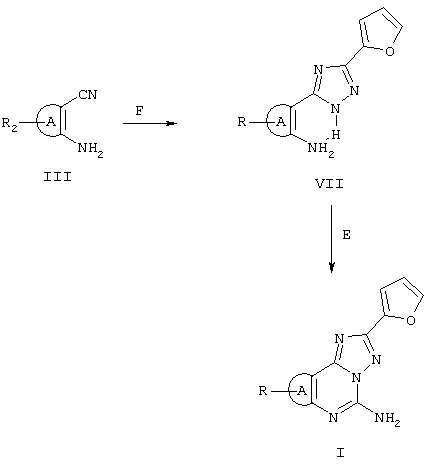
Реагенты: F) гидразид 2-фуранкарбоновой кислоты, дифениловый эфир; Е) цианамид, рТsОН, N-метилпирролидон.
Соединения формулы II можно получить либо опосредованным путем, представленным на схеме I, либо прямым путем, представленным на схеме II. Пригодными исходными соединениями для обеих схем являются гетероциклические орто-аминонитрилы формулы III, обычно полученные синтетическими способами, известными в литературе, о которых сообщается в книге E.C.Taylor and A.McKillop (vol. 7 of the series “Advances in Organic Chemistry”, Ed. Interscience, 1970).
Орто-аминонитрилы III превращаются в соответствующие имидаты формулы IV при взаимодействии с избытком этилортоформиата при кипячении с обратным холодильником в течение от 8 до 10 ч. Реакция после выпаривания этилортоформиата приводит к по существу чистым соответствующим имидатам IV с высоким выходом по данным анализа ИК и 1Н ЯМР сырых продуктов реакции.
Затем имидаты формулы IV подвергаются последовательности двух реакций с получением трициклических структур формулы VI с высоким выходом.
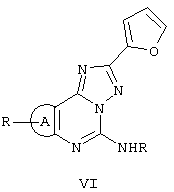
Последовательность реакций включает: а) реакцию с гидразидом 2-фуранкарбоновой кислоты в растворе 2-метоксиэтанола при температуре кипения с обратным холодильником в течение 8-10 ч с получением промежуточных соединений формулы V; b) термическую циклизацию последних в соответствующие соединения формулы VI при нагревании в дифениловом эфире при температуре 260°С в течение 0,5-1 ч.
Трициклические соединения VI затем гидролизуют HCl при кипячении с обратным холодильником в течение 1-3 ч с получением триазолов VII, которые окончательно циклизуются в требуемые соединения II с цианамидом в N-метилпирролидоне при кипячении с обратным холодильником и в присутствии пара-толуолсульфоновой кислоты (схема I).
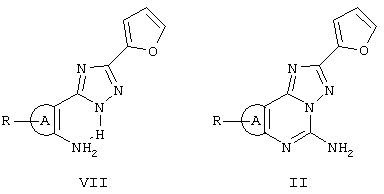
В некоторых случаях триазолы VII можно получить непосредственно нагреванием в дифениловом эфире орто-аминонитрила III с гидразидом 2-фуранкарбоновой кислоты. Триазолы VII затем циклизуются, как представлено выше на схеме II. На следующих схемах III, IV и V более детально представлен синтез соединений формулы II, в которых А является триазоловым кольцом.
Схема III
Синтез производных 5-амино-7-замещенный-2(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
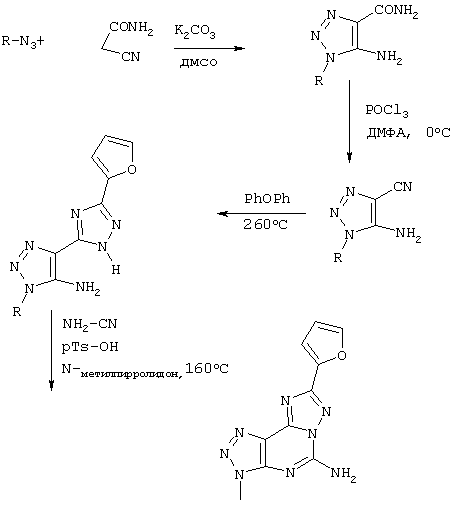
Схема IV
Синтез производных 5-амино-8-замещенный-2(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
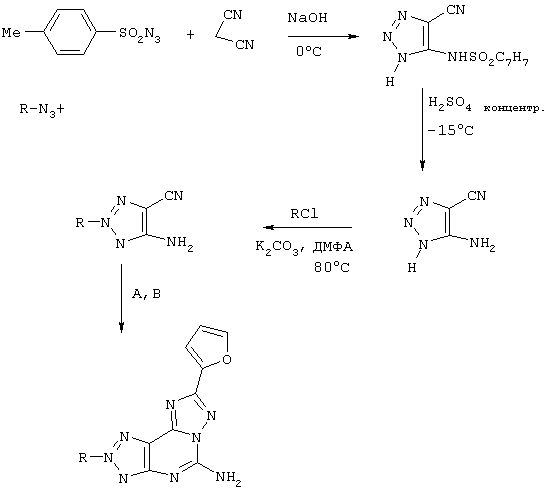
Реагенты: А) гидразид 2-фуранкарбоновой кислоты, PhOPh, 260°C; В) NH2CN, pTsOH, N-метилпирролидон.
Схема V
Синтез производных 5-амино-9-замещенный-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
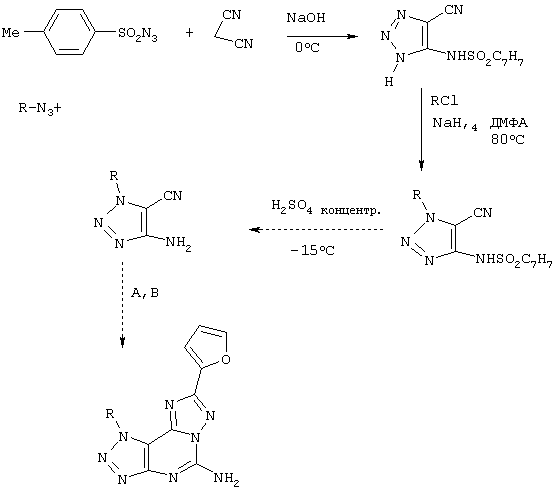
Реагенты: А) гидразид 2-фуранкарбоновой кислоты, PhOPh, 260°С; В) NH2CN, pTsOH, N-метилпирролидон.
Наконец, 5-амин-содержащие соединения II подвергают взаимодействию с карбоновыми кислотами, сульфоновыми кислотами, активированными карбоновыми кислотами, активированными сульфоновыми кислотами, тиокарбоновыми кислотами, активированными тиокарбоновыми кислотами и тому подобными с образованием требуемых соединений. Активированные карбоновые кислоты включают галогенангидриды, сложные эфиры, ангидриды и другие производные, известные как реагирующие с аминами с образованием амидов. Активированные сульфоновые кислоты включают сульфонилгалогениды, такие как сульфонилхлориды.
Нет необходимости во всех случаях использовать активированные производные карбоновой кислоты и сульфоновой кислоты. Кислоты сами по себе можно сочетать с аминами, используя стандартную реакцию сочетания, например, используя дициклогексилдиимид (DCI) и другие обычно используемые агенты для сочетания. Пригодные условия сочетания для образования амидных связей хорошо известны специалистам в области синтеза пептидов.
Обычно вышеуказанную реакцию можно использовать для получения 8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло [1,5-с]пиримидинов, когда в качестве исходных веществ используют 3-циано-2-аминопиразолы. 3-Циано-2-аминопиразолы могут взаимодействовать с алкилгалогениды (RX) в полярном апротонном растворителе, таком как диметилформамид (ДМФА) для получения R-группы на одном из азотов кольца. Полученное соединение можно кипятить с обратным холодильником с триэтилортоформиатом для обеспечения иминэтилового эфира, который может взаимодействовать с фуранкарбоновым гидразидом, предпочтительно используя ловушку Дина-Старка для азеотропного удаления воды, образовавшейся в реакции, для получения 8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов. Продукты можно очистить хроматографией, например, в смеси EtOAc/гексан (1:1) для использования в последующей реакции.
Продукт этой реакции может взаимодействовать с приемлемой кислотой, такой как HCl, при кипячении с обратным холодильником, с последующей реакцией с цианамидом в растворителе, таком как N-метилпирролидон, с катализатором пара-толуолсульфоновой кислотой при повышенной температуре для обеспечения 5-амино-8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов.
Аминзамещенные соединения могут реагировать с соответствующими изоцианатами с образованием соединений мочевины, с активированными карбоновыми кислотами, такими как галогенангидриды, для получения амидов, с активированными сульфоновыми кислотами, такими как галогенангидриды сульфоновой кислоты с образованием сульфонамидов или с другими реакционноспособными производными карбоновой кислоты или сульфоновой кислоты с образованием других требуемых соединений.
Соединения триазоло-триазоло-пиримидина можно получить, используя аналогичную химию, но начиная с подходящего функционально-способного азида, и при взаимодействии азида с H2NC(O) CH2CN с образованием первоначального гетероциклического кольца с последующим взаимодействием амидной группы с дегидратирующим реагентом, таким как РОСl3, с образованием нитрила. Полученный цианоаминотриазол может реагировать таким же образом, как 3-циано-2-аминопиразолы, которые обсуждались выше, с получением триазоло-триазоло-пиримидинов.
Синтез меченных радиоактивным изотопом аналогов
Соединения можно пометить любым пригодным радиоактивным изотопом. Примеры пригодных радиоактивных меток включают 3H и 14С, но можно использовать любую в основном нетоксичную радиоактивную метку, обычно используемую в фармакокинетических исследованиях. Способы включения радиоактивных меток в органические соединения хорошо известны специалистам в данной области.
Когда соединения являются 5-[[замещенный фенил)амино]карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинами или 5-амино-8-(ар)алкил-2-(2-фурил) пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинами, то довольно легко включить тритиевую метку.
В одном воплощении пригодным исходным веществом является соединение, в котором (ар)алкильная группа в 8-положении включает двойную связь. Может иметь место реакция с тритием по двойной связи в присутствии пригодного катализатора, например палладия на угле или других известных катализаторов для гидрирования.
Например, 5-[[(4-метоксифенил)амино]карбонил]амино-8-(1,2-дитритиопропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (соединение 102) можно получить добавлением трития по двойной связи 5-[[(4-метоксифенил)амино]карбонил]амино-8-1-пропенил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединение 101). Соединение 102 обсуждается ниже в отношении различных исследований по аффинности связывания на опухолевых клетках JURKAT.
Альтернативно тритиевая метка может присутствовать в соединениях, используемых для взаимодействия с 5-аминогруппой с образованием амидов, мочевин и других групп в 5-положении. Например, изоцианаты, используемые для получения 5-аминокарбониламино соединений, описанных здесь, могут включать тритий или другие радиоактивные изотопы и, следовательно, могут легко быть включены в конечный продукт.
В другом воплощении радиоактивный изотоп можно включить в молекулу во время образования кольцевой системы. Как обсуждалось выше в отношении синтеза соединений формулы II, различные трициклические соединения формулы VI гидролизуются HCl с получением триазолов формулы VII, которые циклизуются с цианамидом при кипячении с обратным холодильником в присутствии пара-толуолсульфоновой кислоты, как показано на схеме I. Относительно легко включить 14С-метку на этой стадии синтеза, используя 14С-меченый цианамид.
Йодированные соединения можно получить, например, при включении радиоактивного йода в ароматическое соединение, используемое для реакции с 5-аминогруппой. Включение йода в ароматические кольца хорошо известно специалистам в данной области. Легко включить атом йода в ароматические соединения, используемые для взаимодействия с 5-аминогруппой, с получением соединений, описанных здесь.
Следовательно, обычный специалист в данной области может легко получить пригодные меченные радиоактивным изотопом аналоги.
Синтез меченных флуоресцентной меткой аналогов
Как и в случае меченных радиоактивным изотопом соединений, синтез соединений с флуоресцентной меткой является относительно простым. Предпочтительно флуоресцентные группы находятся в R2-положении, хотя замещение в R3-положении также осуществимо. В одном воплощении флуоресцентная группа(ы) включают фурановое кольцо, которое может присоединяться в R3-положении. Альтернативно, можно использовать другие ароматические кольца. Флуоресцентные метки хорошо известны специалистам в данной области и могут легко присоединяться к соединениям, описанным здесь, с использованием известной химии.
Способы применения соединений
Соединения можно применять при всех показаниях для агонистов и антагонистов А3-рецептора, включая:
- лечение гипертензии;
- лечение воспалительных заболеваний, таких как ревматоидный артрит и псориаз;
- лечение аллергических заболеваний, таких как сенная лихорадка и аллергический ринит;
- дегрануляцию тучных клеток;
- противоопухолевые препараты;
- лечение кардиальной гипоксии и
- защиту от церебральной ишемии;
как описано, например, у Jacobson, TIPS May 1998, pp.185-191, содержание которой включено в качестве ссылки.
Предпочтительным применением данных соединений является таковое для обнаружения и/или лечения рака. Как обсуждается ниже, было показано, что опухолевые клетки экспрессируют А3-рецептор. Полагают, что А3-рецептор защищает клетки от ишемического повреждения, когда они не получают адекватной поставки крови. Действие нескольких имеющихся в продаже лекарственных препаратов, а также препаратов, находящихся в настоящее время на стадии разработки, направлено на ингибирование экспрессирования VEGF, что приводит к отключению поставки крови к опухолевым клеткам. Однако агонизм А3-рецепторов аденозина может привести к защитному эффекту, предупреждая гибель опухолевых клеток, когда клетки не получают адекватной поставки крови. При введении антагонистов указанных рецепторов вместе с соединениями с активностью против VEGF или другими антиангиогенными соединениями опухолевые клетки можно отключить от новой поставки крови, а также освободить от защиты от ишемического повреждения, которое обеспечивает агонизм А3-рецепторов.
Соединение можно вводить пациенту посредством любых приемлемых в медицине способов. Пригодные способы введения включают пероральное, ректальное, местное или парентеральное (включая подкожное, внутримышечное и внутривенное) введение, хотя предпочтительным является пероральное или парентеральное введение.
Количество соединения, необходимое, чтобы быть эффективным в качестве модулятора рецептора аденозина, будет, конечно, колебаться для отдельного млекопитающего, которое подвергается лечению, и в конечном итоге, является полномочием медицинского или ветеринарного врача. Факторы, которые следует учитывать, включают заболевание, которое лечится, путь введения, природу композиции, массу тела млекопитающего, площадь поверхности, возраст и общее состояние и конкретное соединение, которое вводится. Однако пригодная эффективная доза находится в пределах примерно от 0,1 мкг/кг до примерно 10 мг/кг массы тела в день, предпочтительно в пределах примерно от 1 мг/кг до примерно 3 мг/кг в день.
Общую суточную дозу можно вводить в виде единичной дозы, многократных доз, например от двух до шести раз в день, или внутривенных вливаний в течение выбранного периода времени. Дозы больше или меньше приведенных выше пределов входят в объем настоящего изобретения и могут вводиться отдельному пациенту, если желательно или необходимо. Например, млекопитающему с массой тела 75 кг пределы доз будут составлять примерно от 75 мг до примерно 220 мг в день, обычная доза будет равняться примерно 150 мг в день. Если показаны раздельные многократные дозы, лечение обычно может составлять 50 мг соединения, даваемых 3 раза в день.
В другом воплощении меченные радиоактивным изотопом соединения можно вводить пациенту в целях постановки теста для определения наличия или отсутствия раковых опухолевых клеток, экспрессирующих А3-рецепторы. Соединения, описанные здесь как имеющие относительно высокую аффинность для рецепторов подтипа А3, преимущественно вводятся пациенту, и после того как соединения связываются с А3-рецепторами, имеющимися в опухолевых клетках, можно установить локализацию соединений определением локализации меченных радиоактивным изотопом соединений. Приборы для определения локализации и плотности меченных радиоактивным изотопом соединений являются хорошо известными специалистам в данной области.
Полезным также может быть применение меченных радиоактивным изотопом и/или флуоресцентной меткой соединений во время операции с целью удаления раковой ткани. Часто хирургам требуется убедиться в полном удалении раковой ткани. Меченные радиоактивным изотопом или флуоресцентной меткой соединения можно вводить пациенту либо до, либо во время операции, и оно будет связываться с опухолевыми клетками, имеющимися у пациента. Время введения будет варьировать в зависимости, среди прочих факторов, от поглощения отдельного соединения отдельными опухолевыми клетками и локализации опухоли в организме. Таким образом, хирург обладает относительно простым тестом определения наличия остаточных раковых клеток после удаления опухоли. Присутствие остаточных опухолевых клеток можно определить при измерении флуоресценции или радиоактивности в месте операции, используя аналитические приборы, хорошо известные специалистам в данной области.
Обнаружение раковых клеток in vitro можно проводить при введении соединений в суспензию клеток в клеточной культуральной среде, связыванием соединения с А3-рецепторами аденозина на раковых клетках, и детектировании метки.
Композиции
Описанные выше соединения предпочтительно вводятся в композицию, включающую активное соединение, т.е. соединение формулы I, вместе с приемлемым для способа введения носителем. Пригодные фармацевтически приемлемые носители являются хорошо известными для специалистов в данной области.
Композиции могут необязательно включать другие терапевтически активные ингредиенты, такие как антивирусные, противоопухолевые препараты, антибактериальные, противовоспалительные средства, анальгетики и иммунодепрессанты. Носитель должен быть фармацевтически приемлемым, т.е. в смысле быть совместимым с другими ингредиентами композиции и не быть вредным для его реципиента.
Композиции могут включать носители, пригодные для перорального, ректального, местного или парентерального (включая подкожное, внутримышечное и внутривенное) введения. Предпочтительными носителями являются пригодные для перорального или парентерального введения.
Композиции, пригодные для парентерального введения, обычно включают стерильный водный препарат активного соединения, который предпочтительно является изотоническим с кровью реципиента. Таким образом, такие композиции могут обычно содержать дистиллированную воду, 5% декстрозу в дистиллированной воде или физиологическом растворе. Пригодные композиции также включают концентрированные растворы или твердые вещества, содержащие соединение формулы (I), которое при растворении в соответствующем растворителе дает раствор, пригодный для парентерального введения, указанного выше.
Для энтерального введения соединение можно включать в инертный носитель в отдельных единицах, таких как капсулы, облатки, таблетки или лепешки, каждая содержащая предопределенное количество активного соединения в виде порошка, или гранул, или суспензии, или раствора в водной жидкости или неводной жидкости, например сироп, эликсир, эмульсия или вытяжка. Пригодными носителями могут быть крахмалы или сахара и включают смазывающие вещества, вкусовые вещества, связующие агенты и другие материалы той же природы.
Таблетка может быть приготовлена прессованием или формованием необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки можно приготовить прессованием в соответствующем аппарате активного соединения в свободно сыпучей форме, например порошка или гранул, необязательно смешанных с вспомогательными ингредиентами, например связующими агентами, смазывающими веществами, инертными разбавителями, поверхностно-активными веществами и диспергирующими агентами. Формованные таблетки можно сделать формованием в соответствующем аппарате смеси порошкообразного активного соединения с пригодным носителем.
Сироп или суспензию можно приготовить добавлением активного соединения к концентрированному водному раствору сахара, например сахарозы, к которому можно добавить любые вспомогательные ингредиенты. Такие вспомогательные ингредиенты могут включать вкусовое вещество, агент для замедления кристаллизации сахара или агент для повышения растворимости любого другого ингредиента, например многоатомный спирт, такой как глицерин или сорбит.
Соединения можно также применять местно при наружной аппликации раствора, мази, крема, геля, лосьона или полимерного материала (например, Pluronic, BASF), которые можно приготовить обычными способами известными в области фармации. В дополнении к раствору, мази, крему, гелю, лосьону или полимерной основе и активному ингредиенту такие композиции для местного применения могут также содержать консерванты, ароматизаторы и дополнительные активные фармацевтические агенты.
Композиции для ректального введения могут быть представлены в виде суппозитория с обычным носителем, например какао-маслом или Witepsol S55 (торговое название Dynamite Nobel Chemical, Германия) для основы суппозитория.
Альтернативно соединение можно вводить в липосомах или микросферах (или микрочастицах). Способы получения липосом и микросфер для введения пациенту хорошо известны специалистам в данной области. В патенте США №4789734, содержание которого включено здесь в качестве ссылки, описываются способы инкапсулирования биологических веществ в липосомы. В основном соединение растворяется в водном растворе, добавляются соответствующие фосфолипиды и липиды вместе с поверхностно-активными веществами, если необходимо, и соединение подвергается диализу или обрабатывается ультразвуком, как необходимо. Обзор известных способов предоставляется G.Gregoriadis, Chapter 14, “Liposomes”, Drug Carriers in Biology and. Medicine, pp.287-341 (Academic Press, 1979). Микросферы, образованные из полимеров или белков, хорошо известны специалистам в данной области и могут быть сконструированы для прохождения через желудочно-кишечный тракт непосредственно в кровяное русло. Альтернативно можно включить соединение и микросферы или состав микросфер, имплантировать для медленного высвобождения в течение периода времени в пределах от дней до месяцев. Например, смотри патенты США №4906474, 4925673 и 3625214, содержание которых включено здесь в качестве ссылки.
Предпочтительными микрочастицами являются приготовленные из биодеградируемых полимеров, таких как полигликолид, полилактид и их сополимеры. Специалисты в данной области могут легко определить соответствующую систему носителей в зависимости от различных факторов, включая желаемую скорость высвобождения лекарственного препарата и желаемую дозировку.
Композиции могут соответственно находиться в единичной лекарственной форме, и их можно приготовить любым из способов, хорошо известных в области фармации. Все способы включают стадию объединения активного соединения с носителем, который составляют один или более вспомогательных ингредиентов. В основном композиции готовят, равномерно смешивая и, в конечном итоге, объединяя активное соединение с жидким носителем или мелко размельченным твердым носителем и затем, если желательно, формируя продукт в желаемую единичную лекарственную форму.
В дополнение к вышеуказанным ингредиентам композиции дополнительно могут включать один или более необязательных вспомогательных ингредиентов, используемых в области фармацевтических композиций, например разбавители, буферы, вкусовые вещества, связующие агенты, поверхностно-активные вещества, сгустители, смазывающие вещества, суспендирующие агенты, консерванты (включая антиоксиданты) и тому подобное.
Определение степени активности соединений
Активность соединений можно легко определить постановкой не более чем обычных опытов, используя следующие тесты.
Тест связывания с A1- и A2а-рецепторами аденозина крысы
Приготовление мембран:
Крыс самцов Вистар (200-250 г) декапитируют и на лед извлекают цельный головной мозг (минус ствол мозга, полосатое тело и мозжечок). Ткани мозга разрушают в Polytron’e (установка на 5) в 20 объемах 50 мМ Трис-HCl, рН 7,4. Затем гомогенат центрифугируют при 48000 g в течение 10 мин и осадок после центрифугирования повторно разводят в Трис-HCl, содержащем 2 МЕ/мл аденозиндеаминазы, тип VI (Sigma Chemical Company, St. Louis, Mo., США). Через 30 мин инкубации при 37°С мембраны центрифугируют и осадки после центрифугирования хранят при -70°С. Ткани полосатого тела гомогенизируют в Polytron’e в 25 объемах 50 мМ Трис-HCl буфера, содержащего 10 мМ MgCl2 рН 7,4. Затем гомогенат центрифугируют при 48000 g в течение 10 мин при 4°С и повторно разводят в Трис-HCl буфере, содержащем 2 МЕ/мл аденозиндеаминазы. Через 30 мин инкубации при 37°С мембраны центрифугируют и осадок после центрифугирования хранят при -70°С.
Тесты связывания меченного радиоактивным изотопом лиганда:
Связывание [3H]-DPCPX (1,3-дипропил-8-циклопентилксантин) с мозговыми мембранами крысы в основном можно проводить способом, ранее описанным Bruns et al., Proc. Natl, Acad. Sci. 77, 5547-5551, 1980. Опыты с вытеснением проводят в 0,25 мл буфера, содержащего 1 нМ [3H]-DPCPX, 100 мкл разбавленных мембран крысиного мозга (100 мкг белка/тест) и по меньшей мере 6-8 различных концентраций испытуемых соединений. Неспецифическое связывание определяют в присутствии 10 мкМ СНА (N6циклогексиладенозин), и оно всегда ≤10% от общего связывания. Время инкубации обычно 120 мин при 25°С.
Связывание [3H]-SCP 58261 (5-амино-7(2-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин) с мембранами полосатого тела крысы (100 мкг белка/тест) можно проводить способами, описанными Zocchi et al., J.Pharin. and Exper. Ther. 276:398-404 (1996). В опытах с конкуренцией следует использовать по меньшей мере 6-8 различных концентраций испытуемых соединений. Неспецифическое связывание можно определить в присутствии 50 мкМ NECA (5’-(N-этилкарбоксамидо) аденозин). Время инкубации обычно 60 мин при 25°С.
Связанную и свободную радиоактивность можно разделить фильтрованием анализируемой смеси через стекловолокнистые фильтры Ватман GF/B, используя коллектор клеток Brandel (Gaithersburg, MD, США). Инкубационную смесь разбавляют 3 мл охлажденного на льду буфера для инкубации, быстро фильтруют в вакууме и фильтр промывают три раза 3 мл буфера для инкубации. Связанную с фильтром радиоактивность можно измерить, например, жидкостной сцинтилляционной спектрометрией. Концентрацию белка можно определить, например, методом Bio-Rad (Bradford, Anal. Biochem. 72: 248 (1976)) с бычьим альбумином в качестве стандарта.
Тест связывания с клонированными А3-рецепторами аденозина человека
Тесты связывания с рецептором: тесты связывания можно проводить способами, описанными Salvatore et al., Proc. Natl. Acad. Sci. 90: 10365-10369 (1993). В опытах с насыщением аликвоту мембран (8 мг белка/мл) из клеток НЕК-293, трансфектированных рекомбинантным А3-рецептором аденозина человека (Research Biochemical International, Natick, MA, США), инкубируют с 10-12 различными концентрациями [125I]АВ-МЕСА в пределах от 0,1 до 5 нМ. Опыты по конкуренции проводят двукратно с конечным объемом 100 мкл в опытных пробирках, содержащих 0,3 нМ [125I]AB-MECA, 50 мМ Трис НСl буфера, 10 мМ MgCl2, pH 7,4 и 20 мкл разбавленных мембран (12,4 мг белка/мл) и по меньшей мере 6-8 различных концентраций испытуемых лиганд.
Время инкубации равнялось 60 мин при 37°С соответственно результатам предшествующих опытов по выяснению продолжительности времени. Связанную и свободную радиоактивность разделяли фильтрованием анализируемой смеси через стекловолокнистые фильтры Ватман GF/B, используя коллектор клеток Brandel. Неспецифическое связывание определяли как связывание в присутствии 50 мкМ R-PIA, и оно составляло примерно 30% от общего связывания. Инкубационную смесь разбавляли 3 мл охлажденного на льду буфера для инкубации, быстро фильтровали в вакууме и фильтр промывали три раза 3 мл буфера для инкубации. Связанную с фильтром радиоактивность определяли на гамма-счетчике 5500В у Beckman. Концентрацию белка определяли методом Bio-Rad (3) с бычьим альбумином в качестве стандарта.
Данные анализа
Значения константы ингибирования связывания Ki можно вычислить из IC50 по уравнению Cheng & Prusoff (Cheng and Prusoff, Biochem. Pharmacol. 22:3099-3108 (1973)), Ki=IC50/(1+[С*]/К
Для компьютерного анализа данных опытов по насыщению и ингибированию можно использовать программу Ligand на основе нелинейной кривой средневзвешенных минимальных площадей (Munson and Rodbard, Anal. Biochem., 107: 220-239 (1990)). Данные обычно выражены в виде средней геометрической с уровнем достоверности 95% или 99%.
Примеры
Следующие примеры иллюстрируют аспекты данного изобретения, но их не следует растолковывать как ограничения. Предполагается, что символы и превращения, использованные в примерах, соответствуют таковым в современной международной химической литературе, например, the Journal of the American Chemical Society (“J.Am.Chem.Soc.”) и Tetrahedron.
Пример 1: получение 8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов (соединения 18-25)
8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидины получают синтезом, представленным на следующей схеме VI.
Схема VI: общие способы получения 8-(Ар)алкил-2-(2-фурил)пиразоло [4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (18-25)
Реагенты: a) NaH, ДМФА, RX; b) НС(ОЕt)3, кипячение с обратным холодильником; с) 2-фуранкарбоновый гидразид, МеО(СН2)2OН; d) Ph2O, 260°C, флэш-хроматография.
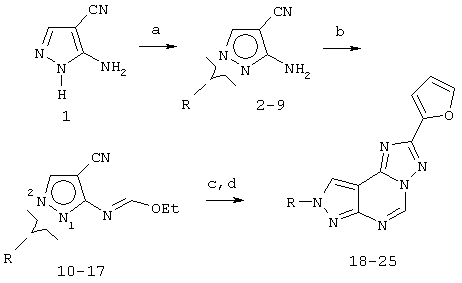
При получении соединений 18-25 раствор 1 (10 ммоль) в 40 мл ДМФА, охлажденный до 0°С, обрабатывают NaH (60% в масле, 12 ммоль) в несколько порций в течение 10 мин. Через 45 мин добавляют соответствующий (ар)алкилгалогенид (12 ммоль) и реакционной смеси дают нагреться до 25°С и перемешивают в течение 3-5 ч (ТСХ:ЕtOАс/гексан 1:1). Реакцию гасят добавлением H2O (80 мл) и водный слой экстрагируют EtOAc (5×25 мл). Органические слои вновь объединяют, сушат (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением алкилированного пиразола (2-9) в виде неразделяемой смеси N1- и N2-изомеров (соотношение примерно 1:4). Затем смесь N1- и N2-замещенных-4-циано-5-аминопиразолов (2-9) растворяют в триэтилортоформиате (60 мл) и раствор кипятят с обратным холодильником в атмосфере азота в течение 8 ч. Затем растворитель удаляют в вакууме и маслянистый остаток, представляющий смесь имидатов (10-17), растворяют в 2-метоксиэтаноле (50 мл) и добавяют гидразид 2-фуранкарбоновой кислоты (13 ммоль). Смесь кипятят с обратным холодильником в течение 5-10 ч, затем после охлаждения растворитель удаляют при пониженном давлении и темный маслянистый остаток затем циклизуют без какой-либо другой очистки в дифениловом эфире (50 мл) при 260°С, используя аппарат Дина-Старка для азеотропного удаления воды, образовавшейся в ходе реакции. Через 1,5 ч смесь выливают в гексан (300 мл) и охлаждают. Осадок фильтруют и очищают хроматографией (EtOAc/гексан 1:1). Таким путем получают основной продукт (N8-алкилированный) (18-25) с хорошим выходом.
Следуя приведенному общему способу, получают следующие соединения:
8-Mетил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (18)
выход 45%; желтое твердое вещество; т. пл.155-156°С; (ЕtОАс-петролейный эфир); ИК (КВr):1615, 1510 см-1; 1H ЯМР (ДМСО-d6) δ: 4,1 (с, 1H), 6,32 (м, 1H), 7,25 (м, 1Н), 8,06 (м, 1H), 8,86 (с, 1H), 9,38 (с, 1H).
8-этил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (19)
выход 50%; бледно-желтое твердое вещество; т.пл. 188-189°С; (EtOAc-петролейный эфир); ИК (КВr):1620, 1500 см-1; 1H ЯМР (ДМСО-d6) δ: 1,67 (т, 2Н, J=7), 4,53 (kb, 2H, J=7), 6,59 (м, 1H), 7,23 (м, 1H), 7,64 (с, 1H), 8,34 (с, 1H), 9,10 (с, 1H).
8-Пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (20)
выход 60%; желтое твердое вещество; т.пл. 189-190°С; (EtOAc-петролейный эфир); ИК (КВr):1600, 1505 см-1; 1H ЯМР (ДМСО-d6) δ: 0,98 (т, 2 H, J=7), 2,03-2,10 (м, 2H), 4,41 (кв, 2H, J=7), 6,60 (м, 1 H), 7,24 (м, 1 H), 7,64 (с, 1 H), 8,32 (с, 1 H), 9,10 (с, 1 H).
8-Бутил-2-(2-фурил) пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (21)
выход 50%; бледно-желтое твердое вещество; т. пл. 245-247°С; (EtOAc-петролейный эфир); ИК (КВr):1610, 1500 см-1; 1H ЯМР (ДМСО-d6) δ: 0,9 (м, 3 Н), 1,3 (м, 2 H), 1,9 (м, 2 H), 4,5 (т, 2 H, J=7,2), 6,2 (м, 1 H), 7,3 (м, 1 H), 8,0 (м, 1 H), 8,9 (с, 1 H), 9,4 (с, 1 H).
8-Изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (22)
выход 54%; бледно-желтое твердое вещество; т.пл. 235-237°С; (EtOAc-петролейный эфир); ИК (КВr):1635, 1510, 1450 см-1; 1H ЯМР (ДМСО-d6) δ: 1,0 (д, 6Н, J=6,2), 1,5-1,9 (м, 3Н), 4,6 (т, 2 H, J=7,4), 6,6 (м, 1 H), 7,3 (м, 1 H), 7,7 (м, 1 H), 8,8 (с, 1 H), 9,1 (с, 1 H).
8-(2-Изопентенил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидин (23)
выход 48%; желтое твердое вещество; т.пл. 210-212°С; (EtOAc-петролейный эфир); ИК (КВr):1625, 1500, 1430 см-1; 1H ЯМР (ДМСО-d6) δ: 1,79 (с, 3 H), 1,87 (с, 3 H), 5,05 (д, 2 H, J=6), 5,55-5,63 (м, 1 H), 6,60 (м, 1 H), 7,24 (м, 1 H), 7,64 (с, 1 H), 8,34 (с, 1 H), 9,10 (с, 1 H).
8-(2-Фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (24)
выход 56%; т.пл. 268-270°С; (EtOAc-петролейный эфир); ИК (KBr):1660, 1510, 1450 см-1; 1H ЯМР (ДМСО-d6) δ: 3,32 (т, 2 H, J=6,7), 4,72 (т, 2 H, J=6,7), 6,73 (с, 1 H), 7,23 (м, 5 Н), 7,95 (с, 1 H), 8,8 (с, 1 H), 9,41 (с, 1 H). Анал. (C18H14N6O) С, Н, N.
8-(3-фенилпропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (25)
выход 63%; желтое твердое вещество; т.пл. 165-166°С; (EtOAc-петролейный эфир); ИК (KBr):1630, 1500, 1440 см-1; 1H ЯМР (ДМСО-d6) δ: 2,34-2,48 (м, 2 H), 2,67 (т, 3 H, J=7,5), 4,43 (т, 2 H, J=7,5), 6,61 (м, 1 H), 7,16-7,32 (м, 6 Н), 7,64 (д, 1 H, J=2), 8,29 (с, 1 H), 9,02 (с, 1 H).
Пример 2: получение 5-амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов (соединения 33-40)
5-Амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидины можно получить синтезом, представленным на следующей схеме VII.
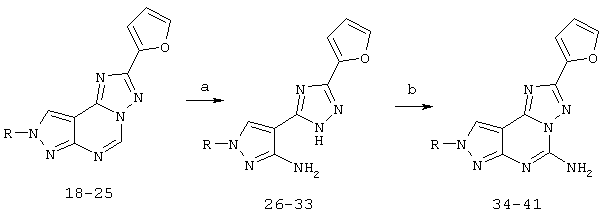
Схема VII: общие способы получения 5-амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (33-40)
Реагенты: а) НСl, кипячение с обратным холодильником; b) NH2CN, 1-метил-2-пирролидон, рТsОН, 140°С.
При получении соединений 33-40 раствор смеси триазолопиримидина (18-25) (10 ммоль) в водной 10% НСl (50 мл) кипятят с обратным холодильником в течение 3 ч. Затем раствор охлаждают и нейтрализуют насыщенным раствором NаНСО3 при 0°С. Соединения (26-33) экстрагируют EtOAc (3×20 мл), органические слои сушат Na2SO4 и выпаривают в вакууме. Полученный сырой амин (26-33) растворяют в N-метилпирролидоне (40 мл), добавляют цианамид (60 ммоль) и п-толуолсульфоновую кислоту (15 ммоль), и смесь нагревают при 160°С в течение 4 ч. Затем вновь добавляют цианамид (60 ммоль) и раствор нагревают в течение ночи. Затем раствор разбавляют EtOAc (80 мл) и осадок (избыток цианамида) отфильтровывают; фильтрат концентрируют при пониженном давлении и промывают водой (3×30 мл). Органический слой сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают хроматографией (EtOAc/петролейный эфир 2:1) с получением желаемого продукта (34-41) в виде твердого вещества.
Следуя приведенному общему способу, получают следующие соединения:
5-Амино-8-метил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидин (34)
выход 53%; желтое твердое вещество; т.пл. 167-168°С; (EtOAc-петролейный эфир); ИК (KBr):3500-2950, 1680, 1645, 1610, 1560, 1455 см-1; 1H ЯМР (ДМСО-d6) δ: 4,12 (с, 3 H), 6,70 (м, 1 H), 6,99 (шир. с, 2 H), 7,18 (м, 1 H), 7,81 (с, 1 H), 8,42 (с, 1 H).
5-Амимо-8-этил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидин (35)
выход 65%; желтое твердое вещество; т.пл. 249-250°С; (EtOAc-петролейный эфир); ИК (KBr):3430-2950, 1680, 1655, 1620, 1550, 1455 см-1; 1H ЯМР (ДМСО-d6) δ: 1,46 (т, 2 H, J=7), 4,30 (д, 2 H, J=7), 6,72 (м, 1 H), 7,18 (м, 1 H), 7,93 (шир. с,2 H), 7,93 (с, 1 H), 8,62 (с, 1 H).
5-Амино-8-пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидин (36)
выход 57%; бледно-желтое твердое вещество; т.пл. 209-210°С; (EtOAc-петролейный эфир); ИК (KBr):3400-2900, 1660, 1645, 1610, 1545, 1430 см-1; 1H ЯМР (ДМСО-d6) δ: 0,83 (т, 2 H, J=7), 1,81-1,91 (м, 2 H), 4,22 (д, 2 H, J=7), 6,71 (м, 1 H), 7,19 (м, 1 H), 7,63 (шир. с, 2 H), 7,93 (с, 1 H), 8,61 (5, 1 H).
5-Амино-8-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло-[1,5-с]пиримидин (37)
выход 47%; белое твердое вещество; т.пл. 200-203°С; (EtOAc-петролейный эфир); ИК (KBr):3500-2900, 1685, 1640, 1620, 1550, 1450 см-1; 1H ЯМР (ДМСО-d6) δ: 0,9 (т, 3 H), 1,2 (м, 2 H), 1,8 (м, 2 H), 4,2 (т, 2 H), 6,7 (м, 1 H), 7,2 (м, 2 H), 7,6 (с, 1 H), 8,0 (с, 1 H), 8,6 (с, 1 H).
5-Амино-8-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (38)
выход 60%; не совсем белое твердое вещество; т.пл. 212-213°С; (EtOAc-петролейный эфир); ИК (KBr):3500-2850, 1670, 1650, 1615, 1560, 1455 см-1; 1H ЯМР (ДМСО-d6) δ: 0,96 (д, 6 Н, J=6,4), 1,59 (м, 1 H), 1,86 (м, 2 H), 4,32 (т, 2 H, J=6,4), 6,58 (м, 1 H), 6,72 (шир. с, 2 H), 7,21 (д, 1 H, J=4,2), 7,63 (д, 1 H, J=1,2), 8,10 (с, 1 H).
5-Амино-8-(2-иэопентенил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (39)
выход 58%; бледно-желтое твердое вещество; т.пл. 178-179°С; (EtOAc-петролейный эфир); ИК (KBr):3520-2950, 1665, 1640, 1610, 1555, 1450 см-1; 1H ЯМР (CDCl3) δ: 1,74 (с, 3 H), 1,77 (с, 3 H), 4,87 (д, 2 H, J=7), 5,43-5,46 (м, 1 H), 6,72 (м, 1 H), 7,18 (м, 1 H), 7,62 (шир. с, 2 H), 7,93 (с, 1 H), 8,55 (с,1 H).
5-Амино-8-(2-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (40)
выход 45%; белое твердое вещество; т.пл. 183-185°С; (EtOAc-петролейный эфир); ИК (KBr):3500-2900, 1670, 1645, 1620, 1530, 1455 см-1; 1H ЯМР (ДМСО-d6) δ: 3,21 (т, 2 H, J=6,4), 4,53 (т, 2 H, J=6,4), 6,7 (с, 1 H), 7,1-7,4 (м, 6 Н), 7,65 (шир. с, 2 H), 7,93 (с, 1 H), 8,45 (с, 1 H).
5-Амино-8-(3-фенилпропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (41)
выход 57%; желтое твердое вещество; т.пл. 168-170°С; (EtOAc-петролейный эфир); ИК (KBr):3510-2950, 1665, 1640, 1615, 1520, 1455 см-1; 1H ЯМР (ДМСО-d6) δ: 2,14-2,21 (м, 2 H), 2,54 (т, 2 H, J=7), 4,29 (т, 2 H, J=6,4), 6,71 (с, 1 H), 7,14-7,32 (м, 6Н), 7,64 (шир. с, 2 H), 7,93 (с, 1 H), 8,64 (с, 1 H).
Пример 3: получение 5-[[(замещенный фенил)амино]карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединения 42-57)
5-[[(замещенный фенил)амино]карбонил]амино-8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидины можно получить синтезом, представленным на следующей схеме VIII.
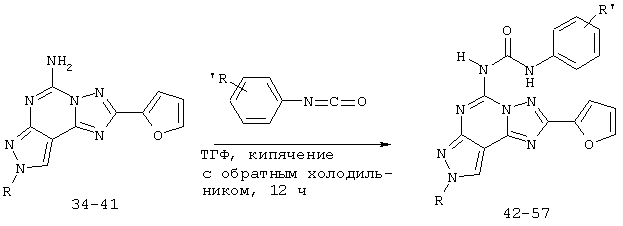
Схема VIII: общие способы получения 5-[[(замещенный фенил)амино]карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (42-57)
При получении соединений 42-57 соответствующее аминосоединение (34-41) (10 ммоль) растворяют в свежеперегнанном ТГФ (15 мл) и добавляют соответствующий изоцианат (13 ммоль). Смесь кипятят с обратным холодильником в атмосфере аргона в течение 18 ч. Затем растворитель удаляют при пониженном давлении и остаток очищают флэш-хроматографией (EtOAc-петролейный эфир 4:6) с получением желаемых соединений 42-57.
Следуя приведенному общему способу, получают следующие соединения:
5-[[(3-Хлорфенил)амино]карбонил]амино-8-метил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (42)
выход 98%; бледно-желтое твердое вещество; т.пл. 142-145°С; (Еt2O-петролейный эфир); ИК (KBr):3210-2930, 1660, 1630, 1610, 1500 см-1; 1H ЯМР (CDCl3) δ: 4,21 (с, 3 H), 6,60 (м, 1 H), 7,11 (д, 1 H, J=8), 7,13-7,28 (м, 2 H), 7,55 (д, 1 H, J=8), 7,65 (с, 1 H), 7,78 (д, 1 H, J-2), 8,22 (с, 1 H), 8,61 (шир. с, 1 H), 11,24 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-метил-2-(2-фу-рил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (43)
выход 99%; желтое твердое вещество; т.пл. 193-195°С; (Еt2O-петролейный эфир); ИК (KBr):3200-2900, 1664, 1625, 1600, 1500 см-1; 1H ЯМР (CDCl3) δ: 3,81 (с, 3 H), 4,20 (с, 3 H), 6,61 (м, 1 H), 6,85 (д, 2 H, J=9), 7,26 (м, 1 H), 7,55 (д, 2 H, J=9), 7,65 (с, 1 H), 8,21 (с, 1 H), 8,59 (шир. с, 1 H), 10,96 (шир. с,1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-этил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (44)
выход 98%; бледно-желтое твердое вещество; т.пл. 204-205°С; (Еt2O-петролейный эфир); ИК (KBr):3220-2930, 1660, 1620, 1600, 1500 см-1; 1H ЯМР (CDCl3) δ: 1,71 (т, 3 H, J=7); 4,50 (kb, 2 H, J=7), 6,67 (м, 1 H), 7,20 (д, 1 H, J=8), 7,31 (м, 1 H), 7,61 (д, 1 H, J=8), 7,70 (с, 1 H), 7,84 (с, 1 H), 8,30 (с, 1 H), 8,67 (шир. с, 1 H), 11,30 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-этил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (45)
выход 99%; бледно-желтое твердое вещество; т.пл. 200-201°С; (Et2O-петролейный эфир); ИК (KBr):3250-2950, 1665, 1620, 1610, 1520 см-1; 1H ЯМР (CDCl3) δ: 1,71 (т, 3 H, J=7), 3,85 (с,3 H), 4,49 (с, 3 H), 6,65 (м, 1 H), 6,88 (д, 2 H, J=9), 7,26 (м,1 H), 7,58 (д, 2 H, J=9), 7,69 (с, 1 H), 8,28 (с, 1 H), 8,63 (шир. с, 1 H), 10,99 (шир. с, 1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (46)
выход 95%; белое твердое вещество; т.пл. 138-139°С; (Et2О-петролейный эфир); ИК (KBr):3210-2920, 1655, 1615, 1600, 1510 см-1; 1H ЯМР (CDCl3) δ: 1,71 (т, 3 H, J=7), 2,04 (м, 2 H), 4,36 (q, 2 H, J=7), 6,62 (м, 1 H), 7,12 (д, 1 H, J=8), 7,27 (м, 1 H), 7,56 (д, 1 H, J=8), 7,66 (с, 1 H), 7,80 (с, 1 H), 8,24 (с, 1 H), 8,62 (шир. с, 1 H), 11,08 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (47)
выход 98%; бледно-желтое твердое вещество; т.пл. 146-148°С; (Еt2O-петролейный эфир); ИК (KBr):3230-2950, 1660, 1620, 1600, 1530 см-1; 1H ЯМР (CDCl3) δ: 0,98 (т, 3 H, J=7), 2,04-2,08 (м, 2 H), 3,82 (с, 3 H), 4,35 (т, 2 H, J=7), 6,61 (м, 1 H), 6,89 (д, 2 H, J=9), 7,25 (м, 1 H), 7,56 (д, 2 H, J=9), 7,65 (с, 1 H), 8,23 (с, 1 H), 8,59 (шир. с, 1 H), 10,95 (шир. с, 1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (48)
выход 97%; белое твердое вещество; т.пл. 210-212°С; (Еt2O-петролейный эфир); ИК (KBr):3240-2970, 1650, 1610, 1510 см-1; 1H ЯМР (CDCl3) δ: 1,00 (т, 3 H, J=7), 1,39-1,41 (м, 2 H), 1,99-2,03 (м, 2 H), 4,41 (кв, 2 H, J=7), 6,63 (м, 1 H), 7,14 (д, 1 H, J=8), 7,29 (м, 1 H), 7,56 (д, 1 H, J=8), 7,67 (с, 1 H), 7,80 (с, 1 H), 8,25 (с, 1 H), 8,63 (шир. с, 1 H), 11,26 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (49)
выход 96%; белое твердое вещество; т.пл. 197-198°С; (Et2O-петролейный эфир); ИК (KBr): 3250-2960, 1665, 1610, 1600, 1520 см-1; 1H ЯМР (CDCl3) δ: 0,98 (т, 3 H, J=7), 1,38-1,42 (м,2 H), 2,02-2,05 (м, 2 H), 3,82 (с, 3 H), 4,39 (т, 2 H, J=7), 6,63 (м, 1 H), 6,92 (д, 2 H, J=9), 7,25 (м, 1 H), 7,57 (д, 2 H, J=9), 7,67 (с, 1 H), 8,23 (с, 1 H), 8,60 (шир. с, 1 H), 10,95 (шир. с,1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-иэопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триаэоло[1,5-с]пиримидин (50)
выход 97%; бледно-желтое твердое вещество; т.пл. 199-200°С; (Еt2O-петролейный эфир); ИК (KBr):3230-2930, 1655, 1600, 1510 см-1; 1H ЯМР (CDCl3) δ: 1,01 (д, 6Н, J=7,5), 1,49-1,51 (м, 1 H), 1,88-2,03 (м, 2 H), 4,42 (т, 2 H, J=7), 6,62 (м, 1 H), 7,13 (д, 1 H, J=8), 7,34 (м, 1 H), 7,57 (д, 1 H, J=8), 7,67 (с, 1 H), 7,80 (с, 1 H), 8,24 (с, 1 H), 8,63 (шир. с, 1 H), 11,25 (шир. с,1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (51)
выход 98%; белое твердое вещество; т.пл. 192-193°С; (Еt2O-петролейный эфир); ИК (KBr):3230-2970, 1660, 1615, 1600, 1500 см-1; 1H ЯМР (CDCl3) δ: 0,99 (д, 6 Н, J=7,5), 1,58-1,22 (м, 1 H), 1,87-1,97 (м, 2 H), 3,82 (с, 3 H), 4,40 (т, 2 H, J=7), 6,62 (м, 1 H), 6,91 (д, 2 H, J=9), 7,23 (м, 1 H), 7,58 (д, 2 H, J=9), 7,66 (с, 1 H), 8,23 (с, 1 H), 8,59 (шир. с, 1 H), 10,94 (шир. с,1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-(2-изопентенил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (52)
выход 99%; белое твердое вещество; т.пл. 204-205°С; (Еt2O-петролейный эфир); ИК (KBr):3245-2960, 1650, 1600, 1510 см-1; 1H ЯМР (CDCl3) δ: 1,84 (с, 3 H), 1,88 (с, 3 H), 5,01 (д, 2 H, J=8), 5,57 (м, 1 H), 6,62 (м, 1 H), 7,12 (д, 1 H, J=8), 7,29 (м,1 H), 7,56 (д, 1 H, J=8), 7,66 (с, 1 H), 7,80 (с, 1 H), 8,26 (с,1 H), 8,60 (шир. с, 1 H), 11,26 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-(2-изопентенил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (53)
выход 96%; бледно-желтое твердое вещество; т.пл. 198-199°С; (Et2O-петролейный эфир); ИК (KBr):3235-2950, 1665, 1620, 1600, 1510 см-1; 1H ЯМР (CDCl3) δ: 1,83 (с, 3 H), 1,87 (с, 3 H), 3,81 (с, 3 H), 4,97 (д, 2 H, J=7), 5,57 (м, 1 H), 6,61 (м, 1 H), 6,93 (д, 2 H, J=9), 7,24 (м, 1 H), 7,54 (д, 2 H, J=9), 7,66 (с,1 H), 8,25 (с, 1 H), 8,58 (шир. с, 1 H), 10,96 (шир. с, 1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-(2-фенилэтил)-2-(2-фурил)пирааоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (54)
выход 98%; белое твердое вещество; т.пл. 186-187°С; (Еt2O-петролейный эфир); ИК (KBr):3250-2970, 1660, 1610, 1515 см-1; 1H ЯМР (CDCl3) δ: 3,33 (т, 2 H, J=7), 4,62 (т, 2 H, J=7), 6,60 (м, 1 H), 7,19-7,35 (м, 7 Н), 7,57 (д, 1 H, J=8), 7,61 (с,1 H), 7,81 (с, 1 H), 7,89 (с, 1 H), 8,63 (шир. с, 1 H), 11,27 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-(2-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (55)
выход 99%; белое твердое вещество; т.пл. 180-181°С; (Еt2O-петролейный эфир); ИК (KBr):3245-2960, 1660, 1615, 1600, 1500 см-1; 1H ЯМР (CDCl3) δ: 3,42 (т, 2 H, J=7), 3,82 (с, 3 H), 4,60 (т, 2 H, J=7), 6,60 (м, 1 H), 6,93 (д, 2 H, J=9), 7,09 (м, 2 H), 7,20-7,28 (м, 4 Н), 7,56 (д, 2 H, J=8), 7,60 (с, 1 H), 7,89 (с, 1 H), 8,59 (шир. с, 1 H), 10,96 (шир. с, 1 H).
5-[[(3-Хлорфенил)амино]карбонил]амино-8-(3-фенилпропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (56)
выход 99%; бледно-желтое твердое вещество; т.пл. 183-184°С; (Et2O-петролейный эфир); ИК (KBr):3245-2960, 1665, 1610, 1515 см-1; 1H ЯМР (CDCl3) δ: 2,46 (м, 2 H), 2,73 (т, 2 H, J=7), 4,43 (т, 2 H, J=7), 6,66 (м, 1 H), 7,19-7,40 (м, 8Н), 7,59 (д, 1 H, J=8), 7,64 (с, 1 H), 7,85 (м, 1 H), 8,25 (с, 1 H), 8,67 (шир. с, 1 H), 11,30 (шир. с, 1 H).
5-[[(4-Метоксифенил)амино]карбонил]амино-8-(3-фенилпропил)-2-(2-фурил)пираэоло[4,3-е]-1,2,4-гриазоло[1,5-с]пиримидин (57)
выход 98%; белое твердое вещество; т.пл. 174-175°С; (Et2O-петролейный эфир); ИК (KBr): 3240-2950, 1665, 1615, 1600, 1510 см-1; 1H ЯМР (CDCl3) δ: 2,46 (м, 2 H), 2,73 (т, 2 H, J=7), 4,42 (т, 2 H, J=7), 6,67 (м, 1 H), 6,96 (д, 2 H, J=9), 7,22-7,41 (м, 6Н), 7,60 (д, 2 H, J=8), 7,64 (с, 1 H), 8,25 (с, 1 H), 8,65 (шир. с, 1 H), 11,16 (шир. с, 1 H).
Пример 4: получение 5-[(Бензил)карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединения 58-59)
5-[(Бензил)карбонил]амино-8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидины можно получить синтезом, представленным на следующей схеме IX.
Схема IX: общие способы получения 5-[(бензил)карбонил] амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (58-59)
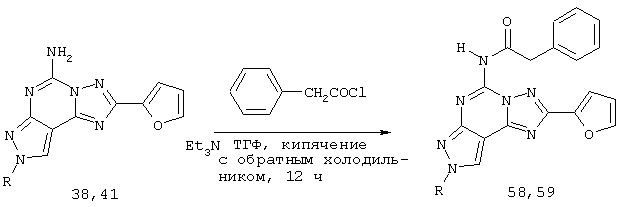
При получении соединений 58-59 соответствующее аминосоединение (38 или 41) (10 ммоль) растворяют в свежеперегнанном ТГФ (15 мл), добавляют соответствующий галогенангидрид кислоты (13 ммоль) и триэтиламин (13 ммоль). Смесь кипятят с обратным холодильником в атмосфере аргона в течение 18 ч. Затем растворитель удаляют при пониженном давлении и остаток растворяют в EtOAc (30 мл) и дважды промывают водой (15 мл). Органическую фазу сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (EtOAc-петролейный эфир 4:6) с получением желаемых соединений 58,59. Следуя предложенному общему способу, получают следующие соединения:
5-[(Бензил)карбонил]амино-8-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (58)
выход 85%; бледно-желтое твердое вещество; т.пл. 144-145°С; (Еt2O-петролейный эфир); ИК (KBr):3255-2930, 1673, 1620, 1610, 1520 см-1; 1H ЯМР (CDCl3) δ: 0,98 (д, 6 Н, J=7,5), 1,60 (м, 1 H), 1,91 (м, 1 H), 4,40 (т, 2 H, J=7), 4,53 (с, 2 H), 6,60 (м, 1 H), 7,18 (м, 1 H), 7,26-7,39 (м, 5 Н), 7,64 (с, 1 H), 8,22 (с, 1 H), 9,11 (шир. с, 1 H).
5-[(Бензил)карбонил]амино-8-(3-фенилпропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (59)
выход 95%; бледно-желтое твердое вещество; т.пл. 116-117°С; (Еt2O-петролейный эфир); ИК (KBr):3250-2900, 1675, 1625, 1600, 1500 см-1; 1H ЯМР (CDCl3) δ: 2,39 (м, 2 H), 2,67 (т, 2 H. J=7), 4,37 (т, 2 H, J-7), 4,53 (с, 2 H), 6,61 (м, 1 H), 7,16-7,43 (м, 11 H), 7,65 (с, 1 H), 7,64 (с, 1 H), 8,19 (с, 1 H), 9,12 (шир. с, 1 H).
Пример 5: получение 1-замещенных-4-циано-5-аминопиразолов Способами, описанными в J.Org. Chem. 1956, 21, 1240; J.Am. Chem. Soc. 1956, 78, 784 и в цитированных здесь ссылках, получают следующие соединения, начиная с имеющегося в продаже этоксиметиленмалонодинитрила и N1-замещенных гидразинов, которые в основном также имеются в продаже:
1-метил-4-циано-5-аминопиразол
1-н-бутил-4-циано-5-аминопиразол
1-изопентил-4-циано-5-аминопиразол
1-(2-циклопентил)этил-4-циано-5-аминопиразол
1-гидроксиэтил-4-циано-5-аминопиразол
1-фенил-4-циано-5-аминопиразол
1-трет-бутил-4-циано-5-аминопираэол
1-фенилэтил-4-циано-5-аминопиразол
1-(2-хлорфенил)-4-циано-5-аминопиразол.
Указанные соединения можно использовать в качестве промежуточных соединений для получения соединений пиразоло-триазоло-пиримидина, как здесь описано.
Пример 6: получение 1-замещенных-4-циано-3-аминопиразолов
Исходя из с 4-циано-5-аминопиразола, полученного способом, о котором сообщается в Chem. Pharm. Bull. 1970, 18, 2353 или в J.Heterocyclic Chem. 1979, 16, 1113, можно получить 1-замещенные-4-циано-3-аминопиразолы прямым алкилированием соответствующим алкилгалогенидом в диметилформамиде при 80°С в течение 1-2 ч в присутствии безводного карбоната калия. Из реакционной смеси, содержащей два N1- и N2-алкилированных изомера по положению примерно в соотношении 1:2, можно выделить N2-изомер однократной кристаллизацией или колоночной хроматографией на силикагеле, элюируя смесями этмлацетата и петролейного эфира. Используя указанные способы, получают следующие соединения:
1-метил-4-циано-3-аминопиразол
1-бутил-4-циано-3-аминопиразол
1-бензил-4-циано-3-аминопиразол
1-изопентил-4-циано-3-аминопиразол
1-фенилэтил-4-циано-3-аминопиразол.
Данные соединения можно использовать в качестве промежуточных соединений для получения соединений пиразоло-триазоло-пиримидина, как здесь описано.
Пример 7: получение фенилэтил-4-циано-3-аминопиразолов
а) К суспензии безводного карбоната калия (30 ммоль) в ДМФА (50 мл) добавляют 3-амино-4-цианопиразол (20 ммоль), нагревая до температуры 80°С в течение 30 мин. К суспензии добавляют фенэтилбромид (25 ммоль) и нагревают до 80°С в течение 2 ч. После охлаждения до комнатной температуры смесь выпаривают досуха в вакууме и полученный остаток переводят в дистиллированную воду (100 мл) и экстрагируют этилацетатом (3×50 мл). Объединенные органические экстракты высушивают над безводным сульфатом натрия и выпаривают досуха в вакууме. Полученный остаток состоит из смеси 1:3 1-фенилэтил-4-циано-5-аминопиразола (20%) и 1-фенилэтил-4-циано-3-аминопиразола (60%), которую можно использовать как таковую в примере 9, или ее хроматографируют на колонке с силикагелем, элюируя смесью этилацетат/ гексан с получением: 1-фенилэтил-4-циано-5-аминопиразола, т.пл. 172-173°С; (20%); 1H ЯМР (ДМСО-d6): 3,04 (т, 2 H), 4,12 (т, 2 H), 5,85 (шир. с, 2 H), 7,21-7,30 (м, 5 Н), 7,41 (с, 1 H), 1-(3-фенилэтил-4-циано-3-аминопиразола, т.пл. 98-100°С (60%); 1H ЯМР (CDCl3): 3,07 (т, 2 H), 4,10 (т, 2 H), 4,23 (шир. с, 2 H), 7,17 (с, 1 H), 7,00-7,28 (м, 5 Н).
b) Раствор 1-β-фенилэтил-4-циано-5-аминопиразола (20 ммоль) в триэтилортоформиате (40 мл) кипятят с обратным холодильником в атмосфере азота в течение 8 ч. Избыток ортоформиата выпаривают досуха в вакууме и оставшееся желтое масло растворяют в этилацетате и пропускают через силикагель с получением соответствующего иминоэфира (выход 87%). Полученный после выпаривания ортоформиата остаток является практически чистым и непосредственно используется на следующей стадии. Раствор иминоэфира (20 ммоль) и гидразида 2-фуранкарбоновой кислоты (2,5 г, 22 ммоль) в 2-метоксиэтаноле (50 мл) кипятят с обратным холодильником в течение 5-10 ч. После охлаждения раствор выпаривают досуха с получением маслянистого остатка, который подвергают термической циклизации в дифениловом эфире (50 мл), используя аппарат Дина-Старка, чтобы азеотропно удалить воду, образовавшуюся в реакции. Через 1,5 ч реакцию проверяют ТСХ (этилацетат:петролейный эфир 2:1), и когда исходное соединение полностью отсутствует, смесь охлаждают и добавляют гексан. Полученный осадок отфильтровывают и кристаллизуют с получением 7-(β-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина; т.пл. 174-175°С (20%); 1H ЯМР (ДМСО-d6): 3,23 (т, 2 H), 4,74 (т, 2 H), 6,75 (с, 1 H), 7,14-7,17 (м, 5 Н), 7,28 (с, 1 H), 7,98 (с, 1 H), 8,53 (с, 1 H), 9,56 (с, 1 H).
Аналогичным образом исходя из 1-β-фенилэтил-4-циано-3-аминопиразола получают 8-(β-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 268-270°С (600 А); 1H ЯМР (ДМСО-d6): 3,32 (т, 2 H), 4,72 (т, 2 H), 6,73 (с, 1 H), 7,23 (м, 5 Н), 7,95 (с, 1 H), 8,8 (с, 1 H), 9,41 (с, 1 H).
с) Суспензию продукта со стадии b) (10 ммоль) в 10% HCl (5,0 мл) кипятят с обратным холодильником при перемешивании в течение 3 ч. После охлаждения раствор подщелачивают концентрированной гидроксидом аммония при 0°С и полученный осадок отфильтровывают или экстрагируют этилацетатом (3×100 мл), высушивают и выпаривают досуха в вакууме с получением соответствующего 1-(β-фенилэтил)-4-[3-(2-фурил)-1,2,4-триазол-5-ил]-5-аминопиразола; т.пл. 175-176°С; 1H ЯМР (ДМСО-d6): 3,15 (т,2 H), 4,48 (т, 2 H), 5,78 (с, 1 H), 6,37 (с, 1 H), 6,68 (с, 1 H), 7,1 (с, 1 H), 7,27-7,28 (м, 5Н), 7,82 (с, 1 H), 14,51 (шир. с, 2 H); аналогичным образом получают 1-(β-фенилэтил)-4-[3-(2-фурил)-1,2,4-триазол-5-ил]-3-аминопиразол; т.пл. 205-206°С; 1H ЯМР (ДМСО-d6): 3,12 (т, 2 H), 4,46 (т, 2 H), 5,75 (с, 1 H), 14,41 (шир. с, 2 H).
d) Цианамид (60 ммоль) добавляют к суспензии амина со стадии с) (10 ммоль) в N-метилпирролидоне (40 мл) с последующим добавлением п-толуолсульфоновой кислоты (15 ммоль). Смесь нагревают при 160°С при перемешивании. Через 4 ч добавляют вторую порцию цианамида (60 ммоль) и нагревание продолжают в течение ночи. Затем смесь обрабатывают горячей водой (200 мл) и осадок отфильтровывают, промывают водой и кристаллизуют из этанола с получением соответствующего 5-амино-7-(β-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина; т.пл. 225-226°С; 1H ЯМР (ДМСО-d6): 3,21 (т, 2 H), 4,51 (т, 2 H), 6,65 (с, 1 H), 7,1-7,44 (м, 5 Н, аром и 1 H), 7,78 (с, 1 H), 7,89 (шир. с, 2 H), 8,07 (с, 1 H).
Аналогичным образом получают 5-амино-8-(β-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 212-213°С; 1H ЯМР (ДМСО-d6): 3,21 (т, 2 H), 4,53 (т, 2 H), 6,7 (с, 1 H), 7,1-7,4 (м, 5 Н, аром и 1 H), 7,65 (шир. с, 2 H), 7,93 (с, 1 H), 8,45 (с, 1 H).
Пример 8: получение 4-циано-5-амино-1,2,3-триазолов К суспензии карбоната калия (0,23 моль) в ДМСО (70 мл) последовательно добавляют цианоацетамид (70 ммоль) и п-фторбензилазид (54,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 1 ч и затем выливают в большой объем воды (1,5 л). Отделившийся осадок отфильтровывают, промывают водой и высушивают в сушильном шкафу при 70°С с получением 1-(п-фторбензил)-4-карбоксамидо-5-амино-1,2,3-триазола (выход 96,1%); т.пл. 198-199°С; 1H ЯМР (ДМСО-d6): 7,5-7,1 (м, 6Н), 6,4 (с, 2 H), 5,4 (с, 2 H). К перемешанной и охлажденной до 0°С суспензии амида (0,005 моль) в ДМФА (5 мл) добавляют оксихлорид фосфора (0,01 моль). Полученный раствор перемешивают в течение 5 мин при 0°С, 10 мин при 25°С и 15 мин при 80°С. После охлаждения до комнатной температуры добавляют 5 мл 1 H HCl и смесь кипятят с обратным холодильником в течение 5 мин. 1-(п-фторбензил)-4-циано-5-амино-1,2,3-триазол выделяют из охлажденного раствора (выход 90%); т.пл. 185-186°С; 1H ЯМР (ДМСО-d6): 7,3-7,0 (м, 6 Н), 5,5 (с, 2 H); ИК (KBr): 3400, 3220, 2220, 1655 см-1.
Аналогично получают следующие соединения:
1-или 2-бензил-4-циано-5-амино-1,2,3-триазол
1-или 2-(о-фторбензил)-4-циано-5-амино-1,2,3-триазол 1-или 2-(п-фторбензил)-4-циано-5-амино-1,2,3-триазол
1-или 2-бутил-4-циано-5-амино-1,2,3-триазол
1-или 2-изопентил-4-циано-5-амино-1,2,3-триазол 1-или 2-(2-метоксиэтил)-4-циано-5-амино-1,2,3-триазол
1-или 2-гептил-4-циано-5-амино-1,2,3-триазол
1-или 2-октил-4-циано-5-амино-1,2,3-триазол.
Полученные соединения можно использовать в качестве промежуточных соединений для получения соединений триазоло-триазоло-пиримидина, как здесь описано.
Пример 9: получение этоксиметиленаминогетероциклов
Получение этоксиметиленаминогетероциклов формулы IV проводят при кипячении с обратным холодильником соответствующего орто-аминонитрила с этилортоформиатом. В качестве примера описывается получение 4-циано-5-(этоксиметиленамино)-1-бутил-пиразола. Раствор 4-циано-5-амино-1-бутилпиразола (20 ммоль) в триэтилортоформиате (40 мл) нагревают до температуры кипения в атмосфере азота в течение 8 ч. Избыток ортоформиата выпаривают досуха в вакууме и оставшееся желтое масло растворяют в этил-ацетате и элюируют через силикагель с получением чистого вещества (выход 87%). Во многих случаях остаток, полученный после выпаривания ортоформиата, является в основном чистым и используется как таковой на последующей стадии. ИК (нуйол): 3140, 2240, 1640 см-1; 1H ЯМР (CDCl3): 8,4 (с, 1 H), 7,9 (с, 1 H), 4,5 (т, 2 H), 4,3 (кв, 2 H), 1,8 (м, 2 H), 1,5 (м, 2 H), 1,4 (т, 3 H), 0,9 (т, М).
Пример 10: циклизация этоксиметиленаминогетероциклов
Раствор этоксиметиленаминогетероцикла (20 ммоль) и гидразида 2-фуранкарбоновой кислоты (2,5 г, 22 моль) в 2-метоксиэтаноле (50 мл) кипятят с обратным холодильником в течение 5-10 ч. После охлаждения раствор выпаривают досуха с получением остаточного масла, которое подвергают термической циклизации в дифениловом эфире (50 мл), используя круглодонную колбу, снабженную аппаратом Дина-Старка для азеотропного удаления воды, образовавшейся во время реакции. Через различные периоды времени (3-5 ч) реакцию проверяют ТСХ (этилацетат : петролейный эфир 2:1), и когда полностью исчезает исходный продукт, смесь охлаждают и добавляют гексан. Полученный осадок отфильтровывают и кристаллизуют из подходящего растворителя. В некоторых случаях вязкое масло отделяется от раствора, которое затем декантируют и затем экстрагируют. Маслянистый остаток затем хроматографируют на силикагеле, элюируя смесями этилацетат/петролейный эфир с получением трициклического соединения VI.
В качестве примера приводятся аналитические и спектроскопические характеристики некоторых соединений, полученных приведенными способами:
7-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин. 1H ЯМР (ДМСО-d6): 9,6 (с, 1 H), 8,6 (с, 1 H), 8,0 (м,1 H), 7,4 (м, 1 H), 6,7 (м, 1 H), 4,5 (т, 2 H), 1,9 (м, 2 H), 1,3 (м, 2 H), 0,9 (т, 3 H).
8-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]-пиримидин. 1H ЯМР (ДМСО-d6): 9,4 (с, 1 H), 8,9 (с, 1 H), 8,0 (м,1 H), 7,3 (м, 1 H), 6,2 (м, 1 H), 4,5 (т, 2 H), 1,9 (м, 2 H), 1,0 (м, 2 H), 0,9 (м, 3 H). В 2D-ЯМР (NOESY) спектре, сигнал N-CH2, резонирующий при 4,5, показывает перекрестные пики с сигналом С9-Н, резонирующим при 8,9.
7-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин. 1H ЯМР (CDCl3): 9,1 (с, 1 H), 8,8 (с, 1 H), 7,7 (м,1 H), 7,3 (м, 1 H), 6,6 (м, 1 H), 4,6 (т, 2 H), 1,18-1,7 (м, 3 H), 1,0 (д, 6 Н).
8-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин. 1H ЯМР (CDCl3): 9,1 (с, 1 H), 8,8 (с, 1 H), 7,7 (м, 1 H), 7,3 (м, 1 H), 6,6 (м, 1 H), 4,6 (т, 2 H), 1,9-1,5 (м, 3 H), 1,0 (д, 6 Н).
Следуя приведенному способу, получают следующие соединения:
7-метил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
8-метил-2-(2-фурил)пиразоло-[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
7-(2-хлорфенил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
7-фенилэтил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
7-трет-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
7-(2-циклопентил)этил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
8-бензил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
7-бензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-(2-фторбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-(4-фторбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-бутил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-изопентил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-(2-метокси)этил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-гептил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
7-октил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-бензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-(2-фторбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-(4-фторбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-бутил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-изопентил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-гексил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-гептил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
8-октил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин
9-бензил-2-(2-фурил)-1,2,3-триазоло[4,5-е]-1,2,4-триазоло[1,5-с]пиримидин
9-(2-фторбензил)-2-(2-фурил)-1,2,3-триазоло[4,5-е]-1,2,4-триазоло[1,5-с]пиримидин
9-(4-фторбензил)-2-(2-фурил)-1,2,3-триазоло[4,5-е]-1,2,4-триазоло[1,5-с]пиримидин.
Приведенные соединения можно использовать в качестве промежуточных соединений для получения триазоло-триазоло-пиримидинов и пиразоло-триазоло-пиримидинов, как здесь описано.
Пример 11: получение 5-амино-7-[аралкил]-2-(2-фурил)пиразоло [4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов
К суспензии аминов формулы (VII) (10 ммоль) в N-метилпирролидоне (40 мл) добавляют цианамид (60 ммоль) с последующим добавлением п-толуолсульфоновой кислоты (15 ммоль). Смесь нагревают до 160°С при перемешивании магнитной мешалкой. Через 4 ч добавляют вторую порцию цианамида (60 ммоль) и нагревание продолжают в течение ночи. Затем смесь обрабатывают горячей водой (200 мл) и выпавшее твердое вещество отфильтровывают, промывают водой и кристаллизуют из этанола. Если выпадения осадка не происходит, раствор экстрагируют этилацетатом (4×100 мл), экстракты промывают рассолом (2×50 мл), высушивают и выпаривают досуха в вакууме. Остаток затем хроматографируют на колонке с силикагелем, элюируя этилацетатом.
Далее приводятся аналитические и спектроскопические данные для некоторых соединений, полученных данным способом:
5-амино-7-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло [1,5-с] пиримидин; т.пл. 157-158°С; 1H ЯМР (ДМСО-d6): 8,1 (с,1 H), 8,0 (с, 2 H), 7,9 (м, 1 H), 7,2 (м, 1 H), 6,7 (м, 1 H), 4,2 (т, 1 H), 1,9 (м, 2 H), 1,5 (м, 2 H), 0,9 (т, 3 H)
5-амино-8-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с] пиримидин; т.пл. 183-185°С; 1H ЯМР (ДМСО-d6): 8,6 (с,1 H), 8,0 (с, 1 H), 7,6 (с, 2 H), 7,2 (м, 1 H), 6,7 (м, 1 H), 4,2 (т, 1 H), 1,8 (м, 2 H), 1,2 (м, 2 H), 0,9 (т, 3 H)
5-амино-7-бензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 295-297°С; 1H ЯМР (ДМСО-d6): 8,5 (с, 2 H), 8,0 (с, 1 H), 7,3 (м, 6Н), 6,7 (м, 1 H), 5,7 (с, 2 H)
5-амино-7-о-фторбензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 310-312°С; 1H ЯМР (ДМСО-d6): 8,5 (с, 2 H), 8,0 (с, 1 H), 7,3 (м, 5 Н), 6,8 (с, 1 H), 5,75 (с, 2 H)
5-амино-7-метил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 210-213°С
5-амино-7-трет-бутил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 238-240°С
5-амино-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 248-250°С
5-амино-7-(2-гидроксиэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 258-260°С
5-амино-7-фенил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 295-297°С
5-амино-7-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 208-210°С
5-амино-8-изопентил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 200-203°С
5-амино-7-фенетил-2-(2-фурил)пиразоло-[4,3-е]-1,2,4-триазоло[1,5-с]-пиримидин; т.пл. 225°С
5-амино-7-бензилоксиэтил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин
5-амино-7-[β-(4-изобутилфенэтил)]-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 207-210°С.
Приведенные соединения могут взаимодействовать с пожходящими производными карбоновой кислоты или сульфоновой кислоты для получения соединений формулы 1, раскрытых здесь.
Пример 12: получение замещенных-4-карбоксамидо-5-амино-1,2,3-триазолов
п-Фторбензилазид (15,1 г, 0,1 моль) и цианацетамид (10,8 г, 0,13 моль) добавляют в таком порядке к суспензии порошкообразного карбоната калия (57,5 г, 0,42 моль) в диметилсульфоксиде (150 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Смесь вливают в 3 л воды и твердое вещество, которое отделилось, отфильтровывают и тщательно промывают водой с получением 22,47 г (96%) 1-п-фторбензил-4-карбоксамидо-5-амино-1,2,3-триазола; т.пл. 198-199°С; 1H ЯМР (ДМСО-d6): 7,5-7,1 (м, 6 Н), 6,4 (с, 2 H), 5,4 (с, 2 H).
Аналогично получают 2-фтор-6-хлорбензил-4-карбоксамидо-5-амино-1,2,3-триазол; т.пл. 230-231°С; 1H ЯМР (ДМСО-d6): 5,40 (с, 2 H), 6,52 (шир. с, 2 H), 7,12-7,45 (м, 5Н).
3-фторбензил-4-карбоксамидо-5-амино-1,2,3-триазол; т.пл. 211°С; 1H ЯМР (ДМСО-d6): 5,46 (с, 2 H), 6,47 (шир. с, 2 H), 7,00-7,52 (м, 6Н)
2-фторбензил-4-карбоксамидо-5-амино-1,2,3-триазол; т.пл. 195-197°С
1-(β-фенилэтил)-4-карбоксамидо-5-амино-1,2,3-триазол; т.пл. 181-183°С; 1H ЯМР (ДМСО-d6): 3,04 (т, 2 H), 4,35 (т, 2 H), 6,30 (шир. с, 2 H), 7,20-7,47 (м, 7Н).
Пример 13: получение замещенных-4-циано-5-амино-1,2,3-триазолов
К суспензии 1-п-фторбензил-4-карбоксамидо-5-амино-1,2,3-триазола (23,4 г, 0,1 моль) в ДМФА, перемешиваемой магнитной мешалкой при 0°С, добавляют 20,8 мл (0,2 моль) РОСl3. Раствор перемешивают в течение 5 ч при 0°С, в течение 10 ч при комнатной температуре и, наконец, 15 ч при 80°С. После охлаждения добавляют 1 H HCl (100 мл) и полученный раствор кипятят с обратным холодильником в течение 5 ч; при охлаждении осаждается 1,5-п-фторбензил-4-циано-5-амино-1,2,3-триазол (18,54 г, 90%); т. пл. 185-186°С; 1H ЯМР (ДМСО-d6): 7,3-7,0 (м, 6 Н), 5,5 (с, 2 H), ИК (KBr): 3400, 3220, 2220, 1655 см-1.
Аналогично получают следующие соединения:
2-фтор-6-хлорбензил-4-циано-5-амино-1,2,3-триазол; т.пл. 181-185°С; 1H ЯМР (ДМСО-d6): 5,40 (с, 2 H), 7,26-7,50 (м, 5Н)
3-фторбензил-4-циано-5-амино-1,2,3-триазол; т.пл. 195-197°С; 1H ЯМР (ДМСО-d6): 5,44 (с, 2 H), 7,00-7,43 (м, 6Н)
2-фторбензил-4-циано-5-амино-1,2,3-триазол; т.пл. 195-197°С
1(β-фенилэтил)-4-циано-5-амино-1,2,3-триазол; т.пл. 149-150°С; 1H ЯМР (ДМСО-d6): 3,04 (т, 2), 4,36 (т, 2 H), 7,03 (шир. с, 2 H), 7,23-7,28 (м, 5 Н).
Пример 14: получение замещенных-4-[3-(2-фурил)-1,2,4-триазол-5-ил]-5-амино-1,2,3-триазолов
Суспензию 1-п-фторбензил-4-циано-5-амино-1,2,3-триазола (20 ммоль) и гидразида 2-фуранкарбоновой кислоты (22 ммоль) в дифениловом эфире (30 мл) перемешивают и нагревают до кипячения с обратным холодильником (260°С) с использованием аппарата Дина-Старка, пока не исчезнет исходное соединение (ТСХ, 1-2 ч). После охлаждения смесь разбавляют петролейным эфиром и полученный осадок либо отфильтровывают, либо отделяют декантированием и хроматографируют на колонке с силикагелем, элюируя смесью этилацетата и петролейного эфира 2:1.
1-п-фторбензил-4-[3-(2-фурил)-1,2,4-триазол-5-ил]-5-амино-1,2,3-триазол; т.пл. 266-268°С; 1H ЯМР (ДМСО-d6): 14,5 (с,1 H); 7,8 (с, 1 H); 7,4-7,1 (м, 5 Н); 6,6 (с, 1 H); 6,5 (с, 2 H); 5,5 (с, 2 H).
Аналогично получают 1-(β-фенилэтил)-4-[3-(2-фурил)-1,2,4-триазол-5-ил]-3-амино-1,2,3-триазол (50%); т.пл. 200-202°С; 1H ЯМР (ДМСО-d6): 3,07 (т, 2 H), 4,16 (т, 2 H), 5,50 (шир. с, 2 H), 6,61 (с, 1 H), 6,95 (с, 1 H), 7,2-7,4 (м, 5 Н), 7,78 (с, 1 H), 13,8 (шир. с, 1 H).
Пример 15: получение 5-амино-7-замещенный-2-(2-фурил)-1,2,3-триазоло [5,4-е]-1,2,4-триазоло[1,5-с]пиримидинов
К суспензии 1-п-фторбензил-4-[3-(2-фурил)-1,2,4-триаэол-5-ил]-5-амино-1,2,3-триазола (0,325 г, 1 ммоль) в N-метилпирролидоне (4 мл) добавляют цианамид (6 ммоль) с последующим добавлением п-толуолсульфоновой кислоты (1,5 ммоль). Смесь нагревают при 160°С при перемешивании магнитной мешалкой. Через 4 ч добавляют вторую порцию цианамида (6 ммоль) и нагревание продолжают в течение ночи. Затем смесь обрабатывают горячей водой (20 мл) и выпавший осадок отфильтровывают, промывают водой и кристаллизуют из этанола. Если не происходит выпадения осадка, раствор экстрагируют этилацетатом (4×10 мл), экстракты промывают рассолом (2×50 мл), высушивают и выпаривают досуха в вакууме. Остаток хроматографируют на колонке с силикагелем, элюируя этилацетатом с получением 105 мг (выход 30%) 5-амино-7-п-фторбензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло [1,5-с] пиримидина; т.пл. 266-268°С; 1H ЯМР (ДМСО-d6): 8,5 (шир. с, 2 H), 7,95 (с, 1 H), 7,4-7,1 (м, 6Н), 6,7 (с, 1 H), 5,7 (с, 2 H).
Аналогично получают:
5-амино-7-о-фторбензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 310°С.
5-амино-7-бензил-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 295-297°С.
5-амино-7-(2-фтор-6-хлорбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 218-220°С; 1H ЯМР (ДМСО-d6): 8,51 (шир. с, 2 H), 7,98 (с, 1 H), 7,55-7,28 (м, 4 Н), 6,77 (м, 1 H), 5,73 (с, 2 H).
5-амино-7-(м-фторбензил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 280-283°С; 1H ЯМР (ДМСО-d6): 8,45 (шир. с, 2 H), 7,98 (с, 1 H), 7,4-7,1 (м, 5 Н), 6,76 (с, 1 H), 5,75 (с, 2 H).
5-амино-7-(β-фенилэтил)-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидин; т.пл. 269-271°С; 1H ЯМР (ДМСО-d6): 8,4 (шир. с, 2 H), 7,98 (с, 1 H), 7,3-7,15 (м, 6 Н), 6,8 (с, 751 H), 4,71 (т, 2 H), 3,31 (т, 2 H).
Пример 16: дополнительные соединения
Используя вышеописанные химические способы, получают следующие дополнительные соединения:
Пример 17: оценка биологической активности соединений
Несколько соединений, описанных выше, тестировали на их аффинность для A1- и А2A-рецепторов крысы и А3-рецепторов человека, используя следующие тесты.
Тест связывания с A1- и А2A-рецепторами аденозина крысы
Крыс самцов Вистар декапитировали и цельный головной мозг и полосатое тело извлекали на лед. Ткани разрушали в гомогенезаторе Polytron при установке на 5 в течение 3 сек в 25 объемах 50 мМ Трис HCl, рН 7,4, содержащего 10 мМ MgCl2. Гомогенат центрифугировали при 48000 g в течение 10 мин и осадок после центрифугирования повторно разводили в том же буфере, содержащем 2 МЕ/мл аденозиндеаминазы. Через 30 мин инкубации при 37°С мембраны центрифугировали и осадок после центрифугирования хранили при -80°С. Перед замораживанием отбирали аликвоту гомогената на анализ белка с бычьим альбумином в качестве стандарта. Тесты связывания проводили с мембранами мозга и полосатого тела крысы соответственно в присутствии 10 мМ MgCl2 при 25°С. Все буферные растворы доводили до поддержания постоянного рН 7,4.
Опыты с вытеснением проводили в 500 мкл Трис HCl буфера, содержащего 1 нМ селективного лиганда A1-рецептора аденозина [3H]CHA (N6-циклогексиладенозина) и мембраны мозга крысы (150-200 мкг белка/тест).
Опыты с вытеснением проводили в 500 мкл Трис HCl буфера, содержащего 10 мМ MgCl2, 0,2 нМ селективного лиганда A2A-рецептора аденозина [3H]SCH58261 (5-амино-7-(2-фенилэтил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиридина) и мембраны полосатого тела крысы (80-100 мкг белка/тест). Для определения значений IC50 (где IC50 является концентрацией ингибитора, при котором вытесняется 50% меченого лиганда) испытуемое соединение добавляли троекратно к пробам в тесте связывания минимально в шести различных концентрациях. Разделение связанного и свободного меченного радиоактивным изотопом лиганда проводили быстрым фильтрованием через фильтры Ватман GF/3, которые три раза промывали охлажденным на льду буфером. Радиоактивность, связанную с фильтром, измеряли сцинтилляционной спектрометрией после добавления 5 мл Aquassure. Неспецифическое связывание определялось как связывание в присутствии 10 мкМ R-PLA (N13- (фенилизопропил) аденозина) и 10 мкМ NECA (5’-(N-этилкарбоксамидо)аденозина соответственно, и оно всегда составляло 10% от общего связывания. Время инкубации находилось в пределах от 150 мин при 0°С до 75 мин при 30°С соответственно результатам предшествующих опытов по выяснению продолжительности времени. Значения Ki вычисляли по уравнению Cheng-Prusoff. Все данные по связыванию анализировали, используя компьютерную программу LIGAND.
Тесты связывания с клонированными А3-рецепторами человека
Для тестов связывания использовали аликвоту мембран (8 мг белка/мл) из клеток НЕК-293, трансфектированных рекомбинантными А3-рецепторами аденозина человека. На фиг.1 показано типичное насыщение [125I]AB-MECA (N6-(4-амино-3-йодбензил)–5’-(N-метилкарбамоил)аденозином) с клетками НЕК-293. Опыты по ингибированию проводили двукратно в конечном объеме 100 мкл в опытной пробирке, содержащей 0,3 нМ [125I]АВ-МЕСА, 50 нМ Трис HCl буфера, 10 мМ MgCl2; pH 7,4, 20 мкл разбавленных мембран (12,4 мг белка/мл) и по меньшей мере 6-8 различных концентраций типичных антагонистов рецепторов аденозина. Неспецифическое связывание определяли в присутствии 50 мкМ R-PIA, и оно составило примерно 30% от общего связывания. Время инкубации равнялось 60 мин при 37°С соответственно результатам предшествующих опытов по выяснению продолжительности времени. Связанную и свободную радиоактивность разделяли фильтрованием анализируемой смеси через стекловолокнистые фильтры Ватман GF/B, используя коллектор клеток Brandel.
Результаты и обсуждение
Соединения 34-59 тестировали в тестах связывания радиоактивного лиганда на аффинность на A1-, А2A-рецепторах мозга крысы и А3-рецепторе человека, и результаты обобщены в таблице 1.
Данные показывают, что соединения, теряющие крупные группы (соединения 38, 40 и 41) в N5-положении, проявляют большую аффинность для А2А-рецепторов аденозина с низкой селективностью против A1 и низкую аффинность на рецепторах аденозина человека подтипа А3, к что соединения с замещенной фенилкарбамоильной цепью в N5-положении обладают аффинностью на наномолярном уровне на рецепторах подтипа чА3 с различной степенью селективности против рецепторов подтипа A1 и А2A. В частности, 4-метоксифенилкарбамоильная группа (соединения 51, 55 и 57) проявляет более высокую аффинность, примерно на 3 порядка, чем 3-хлорфенилкарбамоильная группа (соединения 50, 54 и 56).
Введение в N8-положение цепей с различными стерическими характеристиками позволяет сконструировать производные с высоким эффектом на А3-рецепторах аденозина человека и с лучшей селективностью против рецепторов подтипов A1 и А2A.
На фиг.1 показана кривая насыщения [125I]AB-MECA с А3-рецептором аденозина, и линейный характер графика Scatchard на вставке в экспериментальных условиях заявителей указывает на наличие одного класса сайтов связывания со значением КD 0,9±0,01 нМ и значением Вmах 62±1 фмоль/мг белка (n=3).
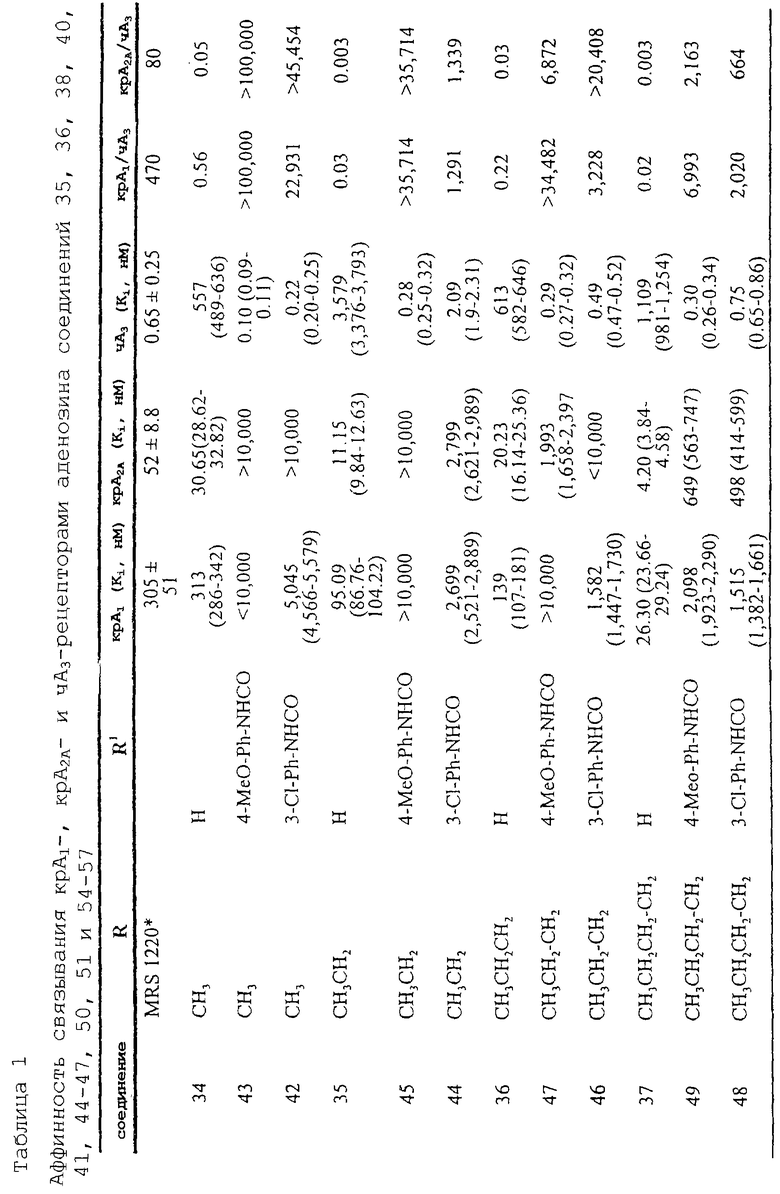
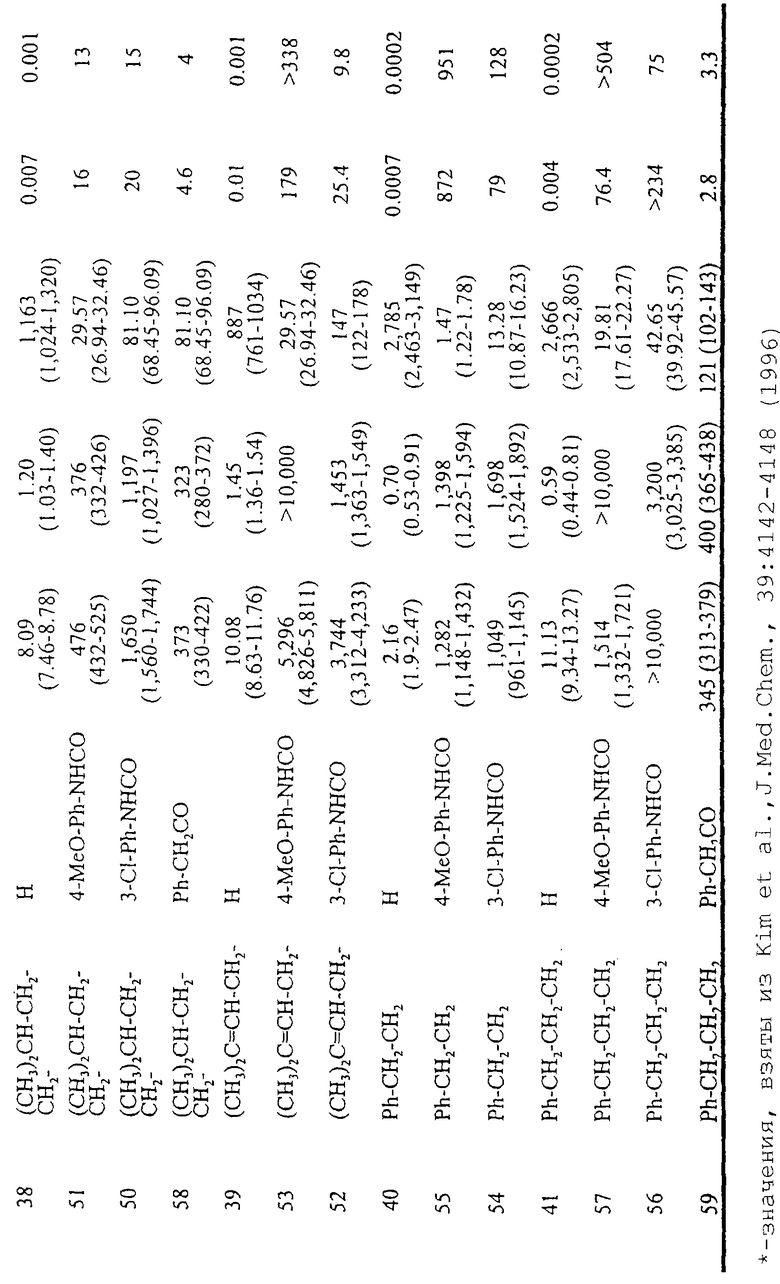
Приведенные данные показывают, что заместители с небольшими цепями (C1-3) в 8-положении 5-[[(замещенный фенил)амино]карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов, описанные здесь, в частности, группы метил, этил и пропил, являются предпочтительными по сравнению с более крупными цепями, такими как группы пентил и гексил. В частности, соединения 45 и 47, 8-метил, 8-этил и 8-пропил, 5-(4-метоксифенил)замещенные соединения показали наиболее высокую аффинность и селективность и действительно предполагается, что они имеют наиболее высокую аффинность и селективность для рецептора подтипа А3 человека (чА3) из всех синтезированных соединений.
Метильная, этильная и пропильная цепи могут быть замещены фенильной или замещенными фенильными группами, и тем не менее показывают относительно высокую аффинность и селективность для рецептора подтипа А3, но аффинность снижается с коэффициентом между 10-100. Однако соединение с β-фенилэтильной цепью в N8-положении и 4-МеО-фенилкарбомоильной цепью в N5-положении (соединение 55) показывают относительно высокое значение в отношении аффинности и селективности (KiчA3=l,47 нМ, крА1/чА3=872, крА2А/чА3=951).
Даже с относительно крупными пентильными группами, присутствующими в соединениях 50 и 51, соединения показывают относительно высокую аффинность для рецептора подтипа А3 (81,10 и 29,57 нМ соответственно), хотя селективность падает с коэффициентом примерно 10-100.
В предыдущих исследованиях было показано, что аффинность 5-амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов для рецептора аденозина подтипа A2 имела тенденцию возрастать с размером группы в 8-положении. Оказалось, что противоположная тенденция верна в отношении аффинности соединений, описанных здесь для рецептора подтипа А3. Оказалось, что C1-3 заместители представляют идеальные стерические и липофильные характеристики для взаимодействия с рецептором подтипа А3.
Пример 18: опыты по связыванию с меченным радиоактивным изотопом соединением
Провели серию опытов по связыванию на клетках различных опухолевых линий, используя 0,5 нМ [125I]AB-MECA при определении неспецифического связывания в присутствии 50 мкМ R-PIA или 200 мкМ NECA на мембранах клеток клеточных линий. Специфическое связывание определяли при вычитании неспецифического связывания из общего связывания. Клеточными линиями были клеточные линии HL 60, NB4, SKN-MC, SKN-Be2C, SKN-SH и JURKAT. Результаты опытов по связыванию представлены ниже в таблице 2.
Результаты в графической форме представлены на фиг.2. Оказалось, что клеточные линии JURKAT обеспечивают наилучшие результаты из тестированных клеточных линий. Опыт по насыщению проводили, используя клеточные линии JURKAT при 37°С, со временем инкубации один час, используя [125I]AB-MECA (0,125-1,5 нМ) при определении специфического связывания с использованием R-PIA (50 мкМ). KD (нМ) равнялся 4 и Вmах (фмоль/кг белка) составило 290. Результаты также представлены на фигуре 2.
Был поставлен другой тест для определения наличия A1-рецептора. Тест вытеснения проводили при 0°С в течение 150 мин на клетках JURKAT, используя [3H]DPCPX, специфический антагонист A1 (0,5 нМ) при определении неспецифического связывания с использованием R-PIA (50 нМ). Общее связывание равнялось 13208, неспецифическое связывание составило 2997 и специфическое связывание было 10211 (77%). Следовательно, наблюдали значительное связывание с A1.
В следующих опытах впервые была дана характеристика А3-рецепторов в некоторых опухолевых клеточных линиях человека, таких как HL60, промиелоцитная лейкемия человека и JURKAT, Т-клеточная лейкемия человека при использовании нового селективного антагониста (соединение 102), описанного здесь. В этих опытах мембраны (0,5 мг белка/мл) из клеток JURKAT и HL60 инкубировали с 10-12 различными концентрациями соединения 102 в пределах от 0,2 до 15 нМ и от 0,1 до 10 нМ для клеток JURKAT и HL60 соответственно. На фиг.3 показана кривая насыщения связывания соединения 102 с А3-рецепторами аденозина в мембранах клеток JURKAT, и линейный характер графика Scatchard на вставке указывает на наличие одного класса сайтов связывания со значением КD 1,9±0,2 нМ и значением Вmах 1,30±0,03 пмоль/мл белка (n=3). На фиг.4 показана кривая насыщения связывания соединения 102 с А3-рецепторами адекозина в мембранах HL60, и линейный характер графика Scatchard на вставке указывает на наличие одного класса сайтов связывания со значением КD 1,2±0,1 нМ и значением Вmах 626±42 фмоль/мл белка (n=3).
Приведенные результаты показывают, что многие клеточные линии содержат относительно большие количества рецепторов аденозина. Поскольку известно, что соединение 102 связывается с А3-рецепторами с высокой аффинностью и селективностью, вероятно, имеется относительно высокое присутствие А3-рецепторов в опухолевых клетках.
Пример 19: фармацевтические композиции
(А) Трансдермальная система - на 1000 лепешек
(В) Таблетка для перорального введения - на 1000 таблеток
Активное соединение и крахмал гранулируют с водой и высушивают. Добавляют стеарат магния к высушенным гранулам и смесь тщательно перемешивают. Перемешанную смесь прессуют в таблетки.
(С) Инъекция - на 1000 ампул по 1 мл.
Активное соединение и буферные агенты растворяют в пропиленгликоле примерно при 50°С. Затем добавляют воду для инъекции при перемешивании и полученный раствор фильтруют, разливают в ампулы, запаивают и стерилизуют в автоклаве.
(D) Вливание - на 1000 мл
Специалисты в данной области узнают или будут способны установить, используя проведение не более чем обычных опытов, множество эквивалентов для определенных воплощений изобретения, описанных здесь. Некоторые эквиваленты предназначаются для включения в следующую формулу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТРИАЗОЛО [4,5-d]ПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ПУРИНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2002 |
|
RU2317084C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ТРИАЗОЛДИАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2274639C2 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| ТРИАЗОЛО[1,5-a]ХИНОЛИНЫ В КАЧЕСТВЕ ЛИГАНДОВ РЕЦЕПТОРА АДЕНОЗИНА А3 | 2008 |
|
RU2489432C2 |
| ПРОИЗВОДНОЕ ГЕТЕРОАРИЛ[4,3-с]ПИРИМИДИН-5-АМИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2764655C2 |
| Ингибитор ДНК-зависимой протеинкиназы | 2020 |
|
RU2835434C2 |
| ПРОИЗВОДНЫЕ 8-МЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-a]ПИРИДИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 2002 |
|
RU2297416C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2019 |
|
RU2806758C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2534804C1 |
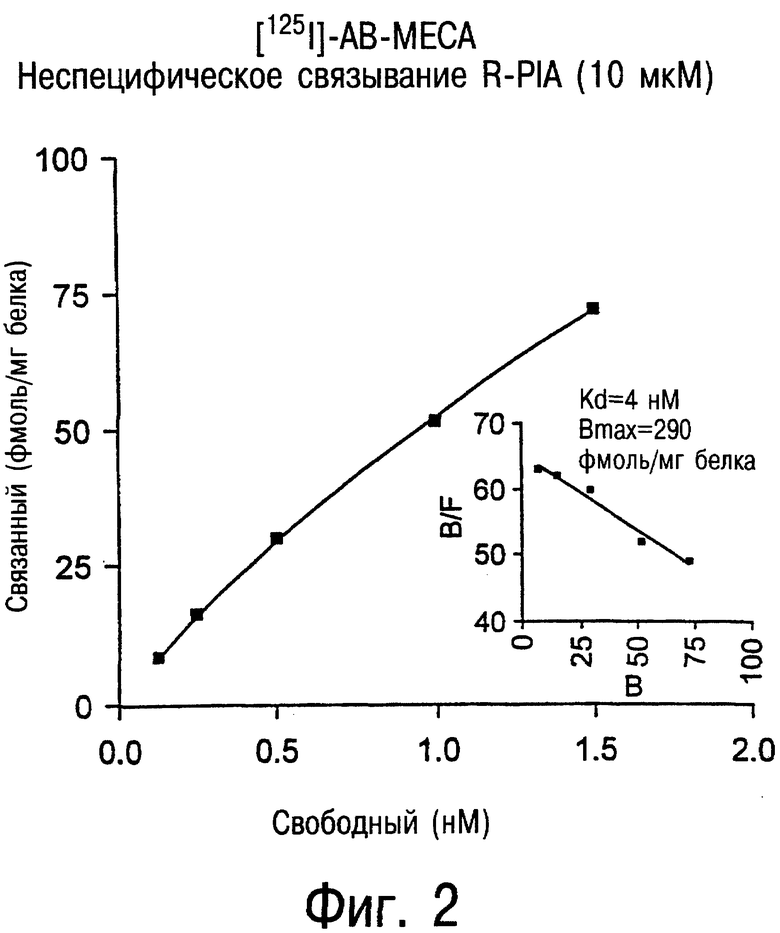
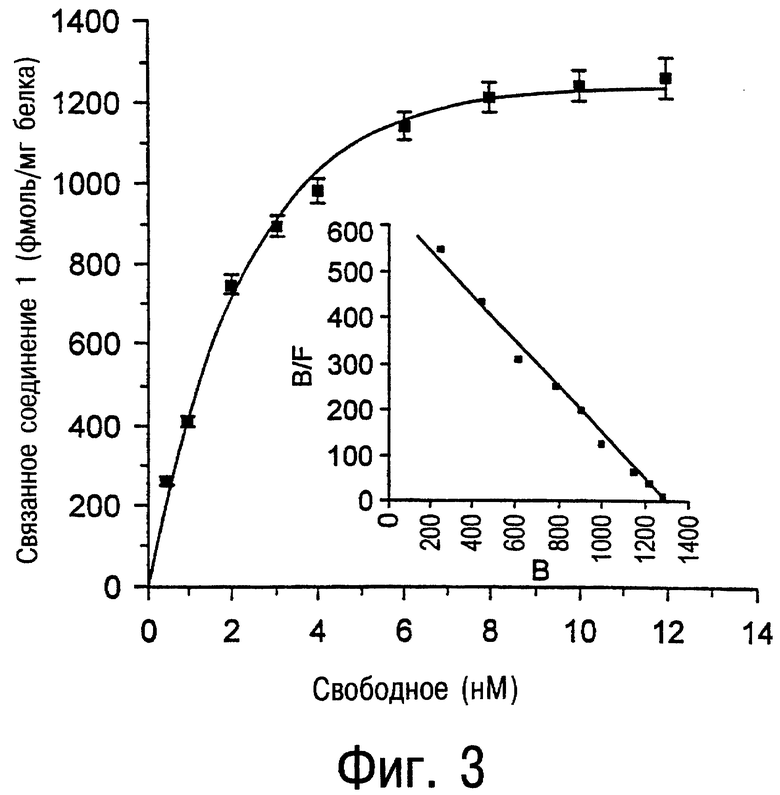
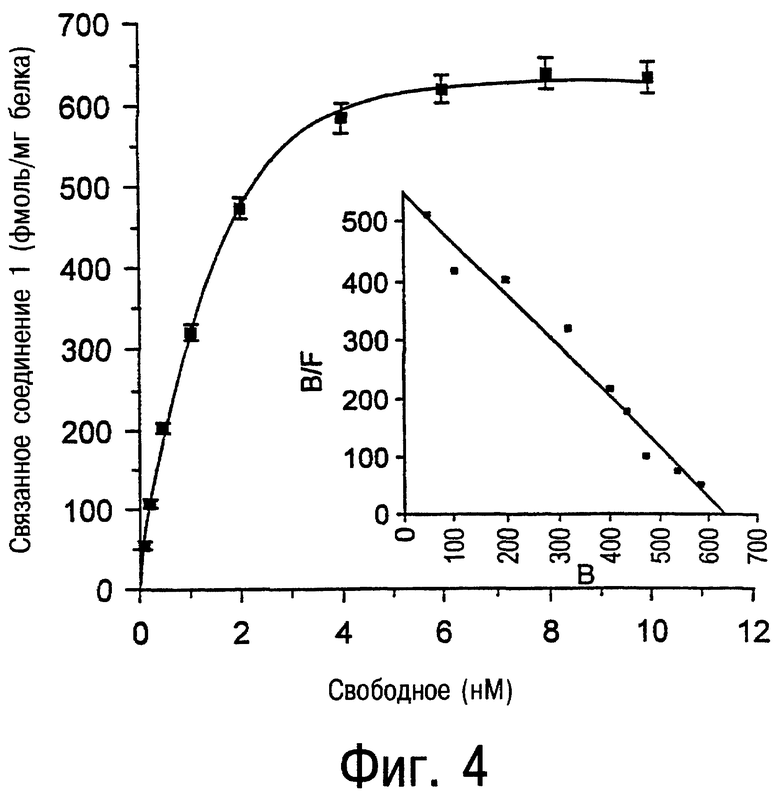
Изобретение относится к области органической химии и медицины и касается новых производных имидазола формулы I, используемых в качестве модуляторов А3-рецепторов аденозина, а также способа лечения рака и определения наличия опухолевых клеток с помощью указанных соединений. Соединения обладают повышенной активностью. 5 с и 8 з.п. ф-лы, 4 ил.
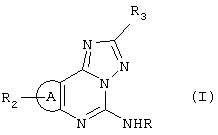
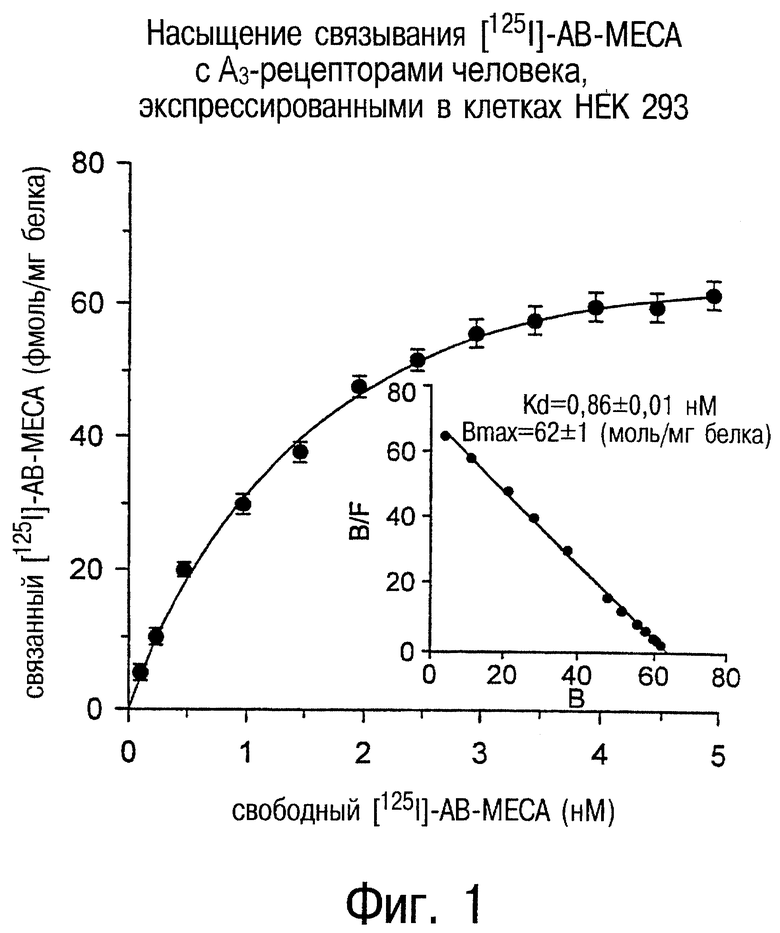
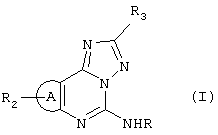
где
А является имидазольм кольцом,
R является -C(X)R1, -С(X)-N(R1)2, -C(X)OR1, -C(X)SR1, -SOnR1, -SOnOR1, -SOnSR1 или -SOn-N(R1)2;
R1 является водородом, алкилом, замещенным алкилом, алкенилом, замещенным алкенилом, алкинилом, замещенным алкинилом, арилом;
R2 является водородом, алкилом, замещенным алкилом, аралкилом, замещенным аралкилом;
R3 является фурилом;
Х является О, S или NR1;
n равно 1 или 2; и
его фармацевтически приемлемые соли.
a) введение пациенту соединения по п.1, которое содержит метку, которую можно детектировать после связывания соединения с опухолевыми клетками;
b) связывание соединения с опухолевыми клетками;
c) детектирование метки.
а) приготовление суспензии клеток в клеточной культуральной среде;
b) введение в клетки соединения формулы I, которое содержит метку, которую можно детектировать после связывания соединения с опухолевыми клетками;
c) связывание соединения с опухолевыми клетками;
d) детектирование метки.
a) введение пациенту до, после или во время хирургического удаления опухоли соединения по п.1, которое содержит метку, которую можно детектировать после связывания соединения с остаточными опухолевыми клетками;
b) связывание соединения с остаточными опухолевыми клетками;
c) детектирование метки.
По всем пунктам формулы установлен конвенционный приоритет от 16.09.1998 согласно первой заявке №09/154435, Поданной в Патентное Ведомство США.
| Способ получения производных имидазо (1,2- @ ) пурина или их кислотноаддитивных солей | 1978 |
|
SU1066463A3 |
| Способ определения никеля в никелевом электролите | 1951 |
|
SU95289A1 |
| Прибор для стрельбы дробинками из ручного огнестрельного оружия | 1926 |
|
SU4134A1 |
| ПРОИЗВОДНЫЕ 5-(ЗАМЕЩЕННЫЙ АМИНО)-1,2,4-ТРИАЗОЛ-[1,5А]-ПИРИМИДИНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ КАРДИОТОНИЧЕСКИМ И КОРОНАРОРАСШИРЯЮЩИМ ДЕЙСТВИЕМ, И СПОСОБ КАРДИОТОНИЧЕСКОГО И/ИЛИ КОРОНАРОРАСШИРЯЮЩЕГОСЯ ВОЗДЕЙСТВИЯ НА СЕРДЦЕ | 1992 |
|
RU2097382C1 |
Авторы
Даты
2005-04-27—Публикация
1999-09-15—Подача