1. Область техники
Настоящее изобретение относится к новым металлоценовым соединениям, подходящим для использования в качестве компонентов в катализаторах полимеризации, к катализаторам, содержащим такие металлоценовые соединения, к способу полимеризации олефинов, в частности пропилена, и к олефиновым гомополимерам, статистическим и ударопрочным сополимерам, полученным при использовании металлоценовых катализаторов.
2. Уровень техники
Один из наиболее важных факторов, определяющих успех катализатора, заключается в его универсальности, то есть возможности его использования для получения наиболее широкого из возможных диапазона продуктов. В течение продолжительного периода времени ограничениями для разработки металлоценовых катализаторов получения полипропилена являлись их неспособность приводить к получению сополимеров пропилен-этилен, имеющих высокую молярную массу, поскольку этилен для большинства металлоценов ведет себя как регулятор степени полимеризации. Данный эффект наблюдали для всех основных металлоценовых структур, таких как синдиоспецифический Cs-симметричный Me2C(Cp)(Flu)ZrCl2, аспецифический C2v-симметричный Me2Si(Flu)2ZrCl2 и как С2-симметричный рац-Me2C(3-iPr-Ind)2ZrCl2, так и флуктуирующий (2-Ph-Ind)2ZrCl2 катализаторы получения эластомерного полипропилена. Данный эффект также обнаружили и для изоспецифических С2-симметричных рац-Me2Si(2-Me-4,5-Benz-Ind)2ZrCl2 и рац-Me2Si(2-Me-4-Ph-Ind)2ZrCl2 катализаторов [L. Resconi, C. Fritze, «Metallocene Catalysts for Propylene Polymerization» In Polypropylene Handbook (N. Pasquini, Ed.), ch. 2.2, Hanser Publishers, Munic 2005]. В то время как 2-Ме-замещение в данном виде катализаторов подавляет перенос β-водорода на мономер пропилен и, таким образом, предотвращает образование полимера, имеющего низкую молярную массу, он не предотвращает перенос β-водорода на сомономер этилен в случае присутствия последнего. Данный перенос β-водорода на сомономер этилен становится предпочтительным механизмом обрыва цепи и приводит к образованию сополимеров пропилен-этилен, имеющих низкую молярную массу [A. Tynys et al., Macromol. Chem. Phys. 2005, vol. 206, pp. 1043-1056: «Ethylene-Propylene Copolymerizations: Effect of Metallocene Structure on Termination Reactions and Polymer Microstructure»]. Исключения выявили для некоторых цирконоценов, имеющих высокообъемные лиганды, таких как рац-Me2C(3-tBu-Ind)2ZrCl2, которые демонстрируют значительное увеличение молярных масс в результате введения этилена. Однако данному катализатору свойственны недостатки, выражаемые в молярной массе гомополимера и активности.
Еще одно ключевое требование к металлоценовому катализатору заключается в его способности обеспечивать получение полипропилена, имеющего высокую температуру плавления. Это эквивалентно катализатору, который характеризуется очень высокими стереоспецифичностью и региоселективностью. В пределах вида катализаторов рац-Alk2Si(2-Alk-Ind)2ZrCl2 стереоспецифичность и региоселективность непрерывно улучшали в течение последних 15 лет. Документ ЕР-А1 834 519 относится к металлоценам в виде рац-Me2Si(2-Me-4-Ar-Ind)2ZrCl2 для получения высокожестких полипропиленов, характеризующихся высоким значением Tm и очень высокой стереорегулярностью и очень низкими количествами региопогрешностей. Несмотря на отсутствие испытаний металлоценов, описанных в документе ЕР-А1 834 519, на эксплуатационные характеристики при сополимеризации они предвосхитили схемы замещения в положении 2, которые позднее были идентифицированы как в особенности, подходящие для использования при получении статистических сополимеров пропилен/этилен в случае объединения с дополнительными заместителями в определенных положениях. Однако высокостерео- и региорегулярные полипропилены в коммерчески приемлемых технологических условиях не получались и страдали от чрезмерно низких уровней активности/производительности.
В документе US-A1 2001/0053833 описываются металлоцены, имеющие в положении 2 заместители, состоящие из незамещенного гетероароматического кольца или гетероароматического кольца, имеющего, по меньшей мере, один заместитель, связанный с кольцом. Такие катализаторы в условиях, обычных для производства в промышленных масштабах, то есть на носителе и при температурах от 60°С и более, позволяют получать С3/С2 сополимеры, имеющие достаточно высокую молярную массу, но не позволяют получать гомополимеры, характеризующиеся высоким значением Tm. Кроме того, неудовлетворительными являются и производительности данного вида катализаторов.
Документ WO 01/058970 относится к ударопрочным сополимерам, характеризующимся высокой температурой плавления и высокой молярной массой каучука и получаемым при использовании катализаторов, содержащих металлоцены из вида рац-Me2Si(2-Alk-4-Ar-Ind)2ZrCl2. Высокие молярные массы каучука пропилен/этилен достигались тогда, когда оба заместителя Alk представляли собой изопропильные группы. В документе WO 02/002576 описываются мостиковые металлоцены из вида (2-R-4-Ph-Ind)2ZrCl2, характеризующиеся особенными комбинациями из заместителей в положениях 2 инденильных лигандов и заместителей Ph. Высокой температуре плавления полипропилена (ПП) благоприятствует демонстрация группой Ph схемы замещения в положениях 3 и 5, в частности, в случае бутильных заместителей. Комбинация из высокой температуры плавления гомополимера и высокой молярной массы сополимера достигается тогда, когда оба заместителя R в положении 2 представляют собой изопропильные группы. Основной недостаток заключается в очень низкой активности/производительности катализаторов рац-Me2Si(2-R-4-Ar-Ind)2ZrCl2 в случае разветвленности обоих лигандов R в α-положении. В документе WO 03/002583 описываются мостиковые металлоцены из вида (2-R-4-Ph-Ind)2ZrCl2, характеризующиеся конкретными комбинациями из заместителей в положении 2 инденильных лигандов и заместителей 4-Ph. Высокой температуре плавления ПП благоприятствует демонстрация группой Ph схемы замещения в положении 2, в частности, в случае бифенильных заместителей. Комбинация из высокой температуры плавления гомополимера и высокой молярной массы сополимера достигается тогда, когда оба заместителя R в положении 2 инденильного лиганда представляют собой изопропильные группы. Один основной недостаток заключается в очень низкой активности/производительности катализаторов рац-Me2Si(2-R-4-Ar-Ind)2ZrCl2 в случае разветвленности обоих лигандов R в α-положении. Кроме того, наивысшие возможные молярные массы гомополимеров, полученных при использовании таких катализаторов, являются относительно низкими, что соответствует относительно высоким скоростям течения расплава. Это, в свою очередь, исключает применение таких металлоценов в общественном питании, таких как в случае трубы, пленки, полученной в результате экструдирования с раздувом, пленки, полученной розливом, и изделия, полученного в результате литьевого формования с раздувом и вытяжкой.
Документы ЕР-А2 1 250 365, WO 97/40075 и WO 03/045551 относятся к металлоценам, имеющим заместителей в положениях 2 любого из инденильных лигандов при обязательном требовании разветвленности или циклизованности в α-положении, по меньшей мере, одного из лигандов в положении 2. Документ WO 04/106351 относится к металлоценам, имеющим заместителей в положениях 2 инденильных лигандов, при том условии, что один лиганд является неразветвленным или связанным через sp2-гибридизованный атом углерода, а другой лиганд является разветвленным в α-положении. Такие катализаторы делают возможным получение гомополимеров, имеющих высокие значения Tm, и сополимеров пропилен/этилен, имеющих высокие молярные массы. Однако все еще существуют ограничения в отношении активности/производительности катализатора и наинизшей достижимой скорости течения расплава гомополимера.
Короче говоря, основной недостаток систем катализаторов, нанесенных на носитель и содержащих металлоцены, вышеупомянутого предшествующего уровня техники заключается в отсутствии обнаруженного к настоящему моменту какого-либо катализатора, который в случае использования при гомополимеризации пропилена обеспечивал бы получение изотактического полипропилена, имеющего высокую температуру плавления и очень высокую молярную массу (или очень низкую скорость течения расплава) и который в случае использования при сополимеризации пропилена и этилена обеспечивал бы получение сополимеров пропилен/этилен, имеющих высокую молярную массу, и где все они характеризовались бы очень высокой производительностью катализатора. Как следствие в сопоставлении с катализаторами Циглера/Натта промышленная применимость данных катализаторов является ограниченной, поскольку определенные области применения, которые требуют наличия сополимера или сополимерного компонента, характеризующихся комбинацией из высокой температуры плавления, очень низкой скорости течения расплава и/или высокой молярной массы, таких как в случае ударопрочных сополимеров, при конкурентоспособных производительностях недоступны.
Цель настоящего изобретения заключается в устранении данного недостатка металлоценовых соединений современного уровня техники и в предложении металлоценов, которые улучшают требуемые характеристики, такие как в случае гомополимеров, имеющих высокую температуру плавления и высокую молярную массу, и сополимеров, имеющих высокую молярную массу, и осуществляют это при повышенных производительностях в случае использования в качестве компонентов катализаторов, нанесенных на носитель, в соответствующих требованиям промышленности условиях проведения полимеризации при температурах в диапазоне от 50°С до 100°С. В дополнение к этому изобретения настоящего примера предлагают получение данных преимуществ в результате использования металлоцена, имеющего симметрично замещенные положения 2 в инденильной группе. Это значительно более рентабельно и поэтому намного более предпочтительно в сопоставлении со сравнительными примерами, которые имеют асимметричное замещение.
Еще одна цель настоящего изобретения заключается в предложении способа полимеризации олефинов, в частности пропилена, этилена и необязательно одного или нескольких высших 1-олефинов.
Кроме того, цель настоящего изобретения заключается в предложении олефиновых полимеров, в частности пропиленовых гомополимеров, статистических сополимеров пропилена и этилена и/или высших 1-олефинов, ударопрочных сополимеров, образованных из пропилена, этилена и/или необязательно высших 1-олефинов, и статистических ударопрочных сополимеров, образованных из пропилена, этилена и/или необязательно высших 1-олефинов.
Предлагаются определенные металлоценовые соединения, которые в случае использования в качестве компонента в катализаторе полимеризации, нанесенном на носитель, в соответствующих требованиям промышленности условиях проведения полимеризации делают возможным получение имеющих высокую молярную массу гомополимеров или сополимеров, подобных полипропилену или сополимерам пропилен/этилен, в отсутствие потребности в каком-либо α-разветвленном заместителе в любом из двух доступных положений 2 инденильных лигандов. Заместитель в положении 2 одного инденильного лиганда может представлять собой любой радикал, содержащий водород, метил или любой другой С2-С40 углеводород, который не является разветвленным в α-положении, и заместитель в положении 2 другого инденильного лиганда может представлять собой любой С4-С40 углеводородный радикал при том условии, что данный углеводородный радикал является разветвленным в β-положении. Данная топология металлоцена делает возможным получение гомополипропилена, имеющего высокую температуру плавления и очень высокую молярную массу, и сополимеров на пропиленовой основе, имеющих очень высокую молярную массу. Кроме того, уровни активности/производительности катализаторов, содержащих металлоцены настоящего изобретения, являются исключительно высокими.
Несмотря на описание различных металлоценов, например, в публикации США № 2006/0116490, улучшение в полимеризации олефинов, достигаемое благодаря топологии металлоцена настоящего изобретения, является новым и неожиданным.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует отдельные стадии способа получения соединений переходных металлов в виде мостикового металлоценового соединения изобретения.
Как обнаружили заявители, данная цель достигается при использовании системы катализатора, нанесенного на носитель, содержащей, по меньшей мере, один специфически замещенный и мостиковый металлоцен, по меньшей мере, один сокатализатор, по меньшей мере, один носитель и при желании, по меньшей мере, одно соединение металла и, кроме того, один компонент добавки. В соответствии с настоящим изобретением систему катализатора получают в результате перемешивания, по меньшей мере, одного специфически замещенного и мостикового металлоцена, по меньшей мере, одного сокатализатора, по меньшей мере, одного носителя и при желании, по меньшей мере, одного соединения металла и одного дополнительного компонента добавки.
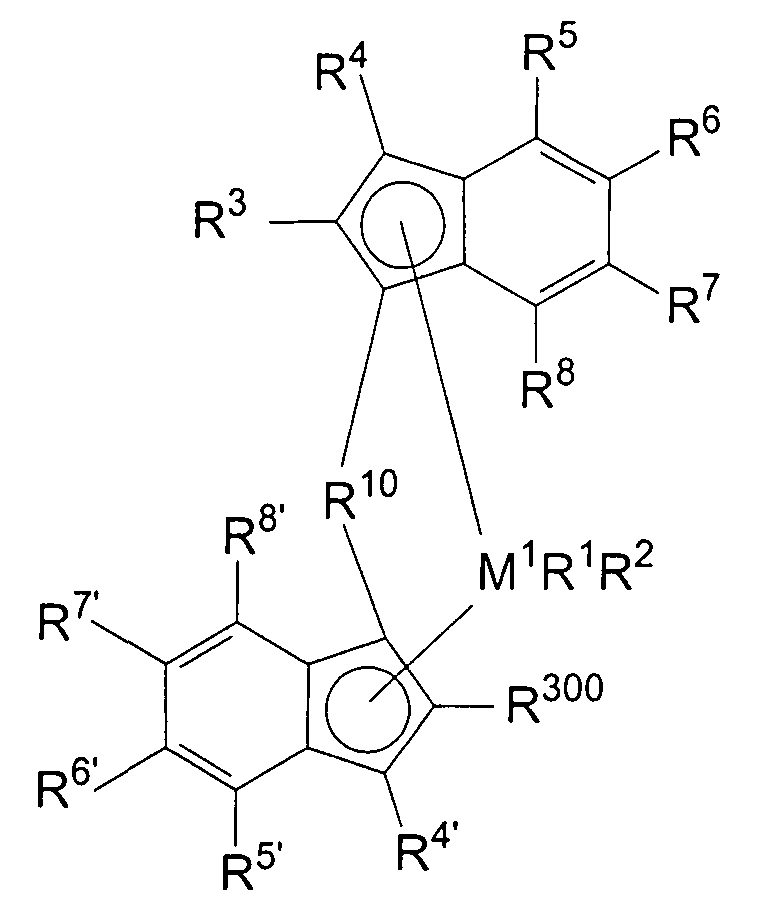
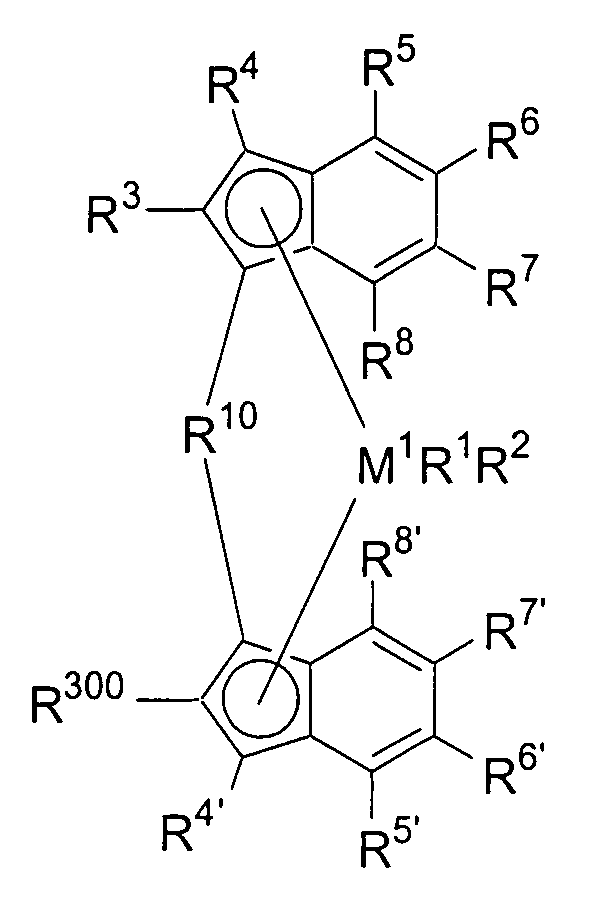
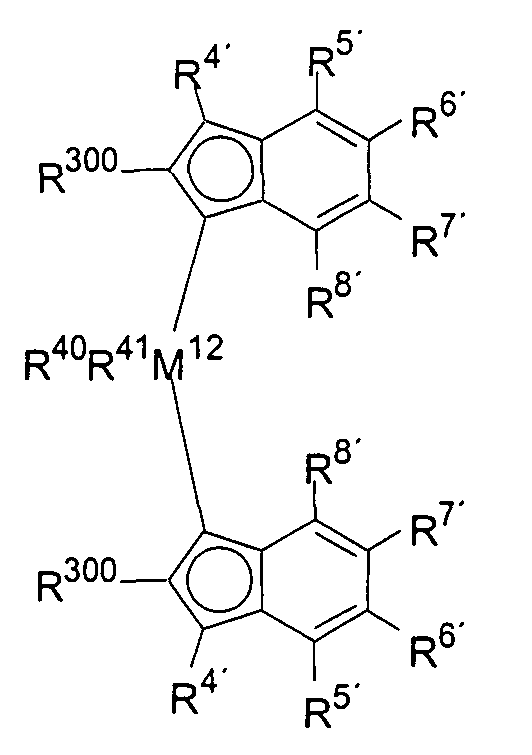
Первый вариант реализации изобретения относится к замещенному мостиковому металлоценовому компоненту общей формулы 1, приведенной далее

(Формула 1)
где М1 представляет собой металл из группы IVb периодической таблицы элементов, предпочтительно цирконий или гафний и, в частности, предпочтительно цирконий.
R1 и R2 являются идентичными или различными, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, группу ОН, атом галогена или группу NR2 32, где R32 представляет собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 14 атомов углерода, и R1 и R2 могут формировать одну систему или несколько кольцевых систем. Предпочтительно R1 и R2 являются идентичными или различными и представляют собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, или атом галогена, или R1 и R2 совместно могут формировать одну систему или несколько кольцевых систем. В частности, предпочтительно R1 и R2 являются идентичными или различными и представляют собой метил, хлор или фенолят.
R4 и R4' являются идентичными или различными, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 1 до 20 атомов углерода, алкенильную группу, содержащую от 2 до 20 атомов углерода, арильную группу, содержащую от 6 до 20 атомов углерода, арилалкильную группу, содержащую от 7 до 40 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу. Группа может содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или может содержать атомы галогенов, подобные F, Cl или Br. Предпочтительно R4 и R4' являются идентичными или различными, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 20 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу. Группы могут быть галогенированными. В особенности предпочтительно как R4, так и R4' представляют собой водород.
R10 представляет собой мостиковую группу, где R10 выбирают из:
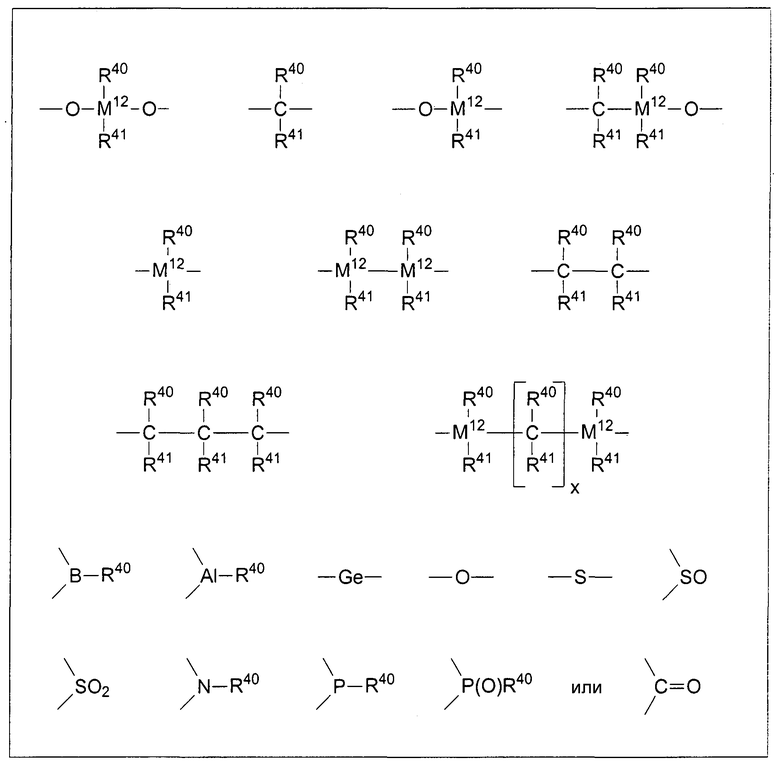
где
R40 и R41 даже в случае наличия одного и того же индекса могут быть идентичными или различными, и каждый из них представляет собой атом водорода, С1-С40 группу, такую как алкильная группа, содержащая от 1 до приблизительно 30 атомов углерода, арильная группа, содержащая от 6 до приблизительно 40 атомов углерода, фторалкильная группа, содержащая от 1 до приблизительно 10 атомов углерода, алкоксигруппа, содержащая от 1 до приблизительно 10 атомов углерода, арилоксигруппа, содержащая от 6 до приблизительно 10 атомов углерода, алкенильная группа, содержащая от 2 до приблизительно 10 атомов углерода, арилалкильная группа, содержащая от 7 до приблизительно 40 атомов углерода, алкиларильная группа, содержащая от 7 до приблизительно 40 атомов углерода, замещенная или незамещенная алкилсилильная, алкил(арил)силильная или арилсилильная группа или арилалкенильная группа, содержащая от 8 до приблизительно 40 атомов углерода. R40 и R41 совместно с атомами, соединяющими их, могут формировать одну или несколько циклических систем, или R40 и/или R41 могут содержать дополнительные гетероатомы (то есть не атомы углерода), подобные Si, B, Al, O, S, N или Р, или атомы галогена, подобные Cl или Br,
x представляет собой целое число в диапазоне от 1 до 18,
М12 представляет собой кремний, германий или олово, и
R10 также может соединять друг с другом два звена формулы 1.
Предпочтительно R10 представляет собой R40R41Si=, R40R41Ge=, R40R41C= или -(R40R41C-CR40R41)-, где R40 и R41 являются идентичными или различными, и каждый из них представляет собой атом водорода, углеводородную группу, содержащую от 1 до приблизительно 30 атомов углерода, в частности алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 14 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 14 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную или арилсилильную группу.
В частности, предпочтительно мостиковое звено R10 представляет собой R40R41Si= или R40R41Ge=, где R40 и R41 являются идентичными или различными и представляют собой метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, циклопентил, циклопентадиенил, циклогексил, фенил, нафтил, бензил, триметилсилил или 3,3,3-трифторпропил.
R11 и R11' являются идентичными или различными, и каждый из них представляет собой двухвалентную С2-С40 группу, которая совместно с циклопентадиенильным кольцом формирует дополнительную насыщенную или ненасыщенную кольцевую систему, имеющую размер кольца в диапазоне от 5 до 7 атомов, где R11 и R11' могут содержать гетероатомы Si, Ge, N, P, O или S в кольцевой системе, сконденсированной с циклопентадиенильным кольцом. Предпочтительно группы R11 и R11' являются идентичными или различными, и каждая из них представляет собой двухвалентную группу, выбираемую из тех, которые приводятся в формулах 1α, β, γ, δ, φ и ν и в формулах 1α', β', γ', δ', φ' и ν' соответственно. Звездочки «*» и «**» в формуле 1 и формулах 1α-ν и 1α'-ν' соответственно обозначают химические связи, соединяющие R11 и R11' с циклопентадиенильными кольцами. В порядке иллюстрации можно сказать то, что в случае описания R11 формулой 1γ и описания R11' формулой 1γ' будет получаться структура, приведенная в формуле 1а (смотрите далее). В частности, предпочтительно R11 и R11' являются идентичными или различными, и R11 представляет собой двухвалентную группу, описывающуюся формулой 1γ, а R11' выбирают из двухвалентных групп, описывающихся формулами 1α', β' и γ', или R11 и R11' являются идентичными или различными и представляют собой двухвалентные группы, описывающиеся формулами 1α и 1α', или формулами 1β и 1β', или формулами 1γ и 1γ', или формулами 1δ и 1δ', или формулами 1φ и 1φ', или формулами 1ν и 1ν' соответственно.
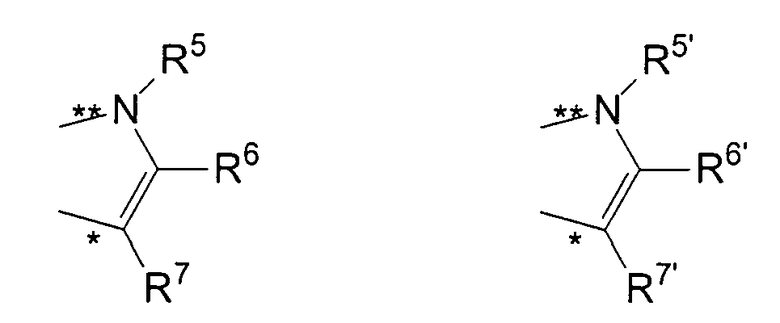

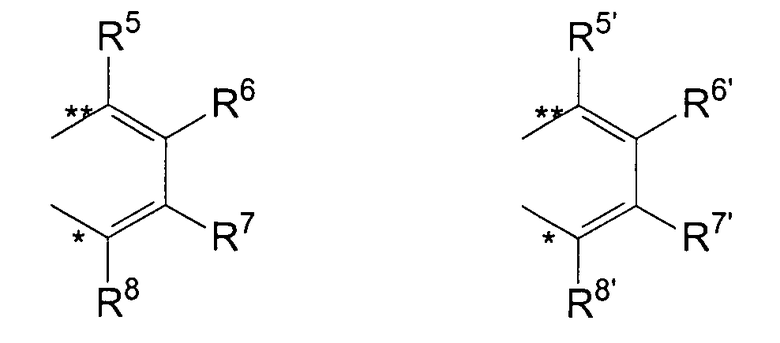
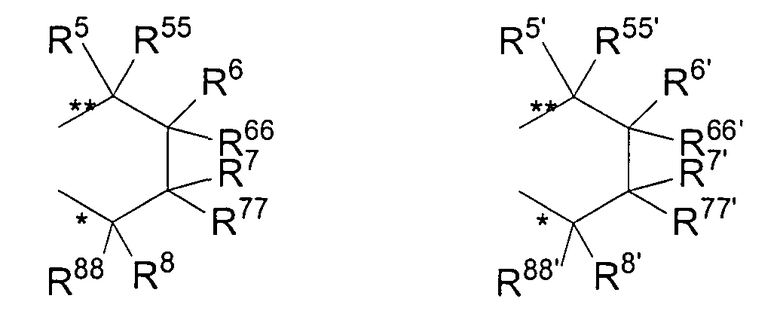
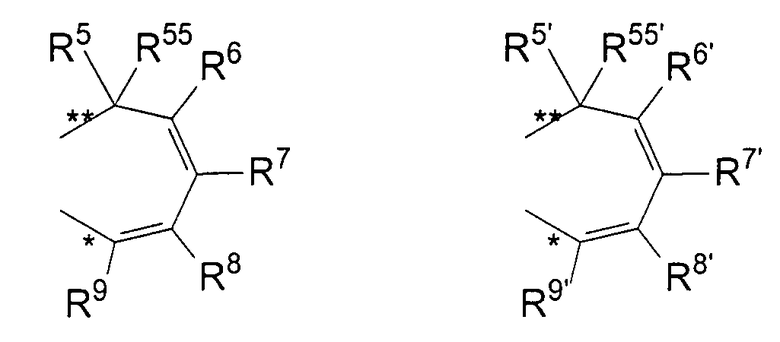
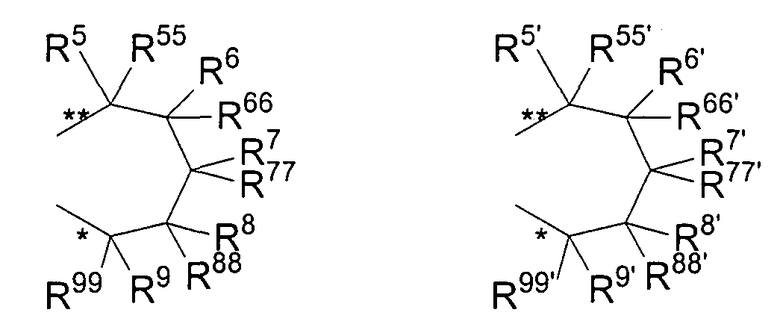
R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9', кроме того, R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' являются идентичными или различными, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 2 до приблизительно 20 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу. Два соседних радикала R5, R6, или R5', R6', или R6, R7, или R6', R7', или R7, R8, или R7', R8', или R8, R9, или R8', R9', кроме того, R55, R66, или R55', R66', или R66, R77, или R66', R77', или R77, R88 или R77', R88', или R88, R99, или R88', R99' в каждом случае могут формировать насыщенную или ненасыщенную углеводородную кольцевую систему. Группы могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, такие как F, Cl или Br.
Предпочтительно каждый из R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' представляет собой атом водорода, и R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9' являются идентичными или различными, и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, и группы могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, такие как F, Cl или Br. Два соседних радикала R5/R6, а также R5'/R6' могут формировать углеводородную кольцевую систему, или R5 и R5' являются идентичными или различными, и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
В частности, предпочтительно каждый из R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' представляет собой атом водорода, и R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9' являются идентичными или различными, и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода. Два соседних радикала R5, R6, а также R5', R6' совместно могут формировать кольцевую систему, или R5 и R5' являются идентичными или различными, и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
R300 представляет собой группу -СН2-CR301R302R303 или -СН=CR302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и каждый из R301, R302, R303 представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 20 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу, и группы могут содержать один или несколько гетероатомов, таких как Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br, при том условии, что R302 и R303 не представляют собой атом водорода.
Предпочтительно R300 представляет собой группу -СН2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и каждый из R301, R302, R303 представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R302 и R303 не представляют собой атом водорода.
В частности, предпочтительно R300 представляет собой группу -СН2-CR301R302R303, где R301 представляет собой атом водорода и где R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и каждый из R302 и R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R300 содержит более чем 6 атомов углерода.
Наиболее предпочтительно R300 представляет собой группу -СН2-CR301R302R303, где R301 и R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и каждый из R301, R302, R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R300 содержит более чем 6 атомов углерода.
R3 имеет значение R300 (но не обязан быть идентичным R300), или R3 представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, и/или может содержать один или несколько гетероатомов, таких как Si, B, Al, O, S, N или Р, например алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, алкилалкенильную группу, содержащую от 3 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, или алкиларилалкенильную группу, содержащую от 9 до приблизительно 40 атомов углерода, при том условии, что R3 не является циклическим или разветвленным в α-положении.
Предпочтительно R3 имеет значение R300 (но не обязан быть идентичным R300), или R3 представляет собой линейную, циклическую или разветвленную углеводородную группу, содержащую от 1 до приблизительно 20 атомов углерода, например алкильную группу, содержащую от 1 до 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкилалкенильную группу, содержащую от 3 до приблизительно 20 атомов углерода, или алкиларилалкенильную группу, содержащую от 9 до приблизительно 20 атомов углерода, при том условии, что R3 не является циклическим или разветвленным в α-положении.
Более предпочтительно R3 и R300 являются идентичными, или R3 представляет собой метильную группу или линейную, циклическую или разветвленную углеводородную группу, содержащую от 7 до приблизительно 10 атомов углерода, которая может быть галогенированной, алкиларильную группу, содержащую от 7 до приблизительно 10 атомов углерода, или алкилалкенильную группу, содержащую от 7 до приблизительно 10 атомов углерода, при том условии, что R3 не является циклическим или разветвленным в α-положении.
В частности, предпочтительно R3 и R300 являются идентичными и представляют собой группу -СН2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что не более чем один из R301, R302 и R303 представляет собой атом водорода.
Более предпочтительно R3 и R300 являются идентичными и представляют собой группу -СН2-CR301R302R303, где R303 представляет собой атом водорода и где R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
Наиболее предпочтительно R3 и R300 являются идентичными и представляют собой группу -СН2-CR301R302R303, где R303, R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
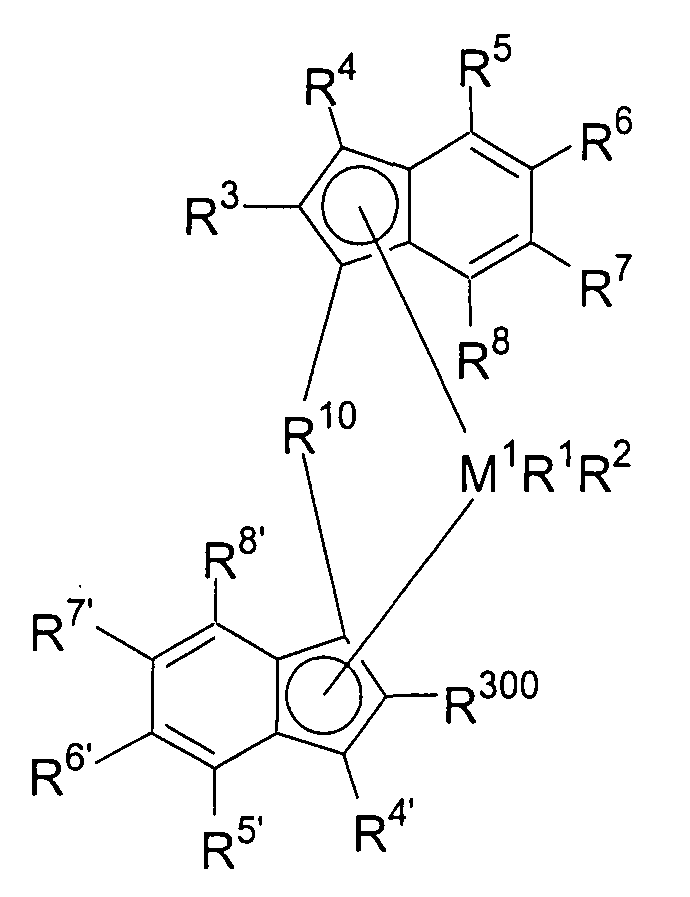
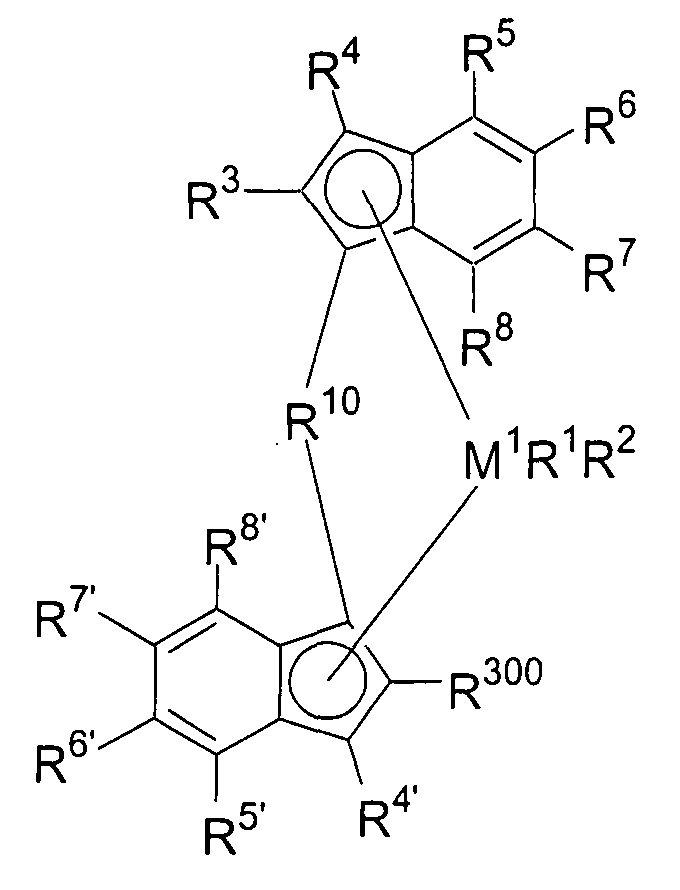
Предпочтительно специфически замещенный мостиковый металлоценовый компонент первого варианта реализации изобретения описывается приведенной далее формулой 1а.
Формула 1а
М1, R1, R2, R3, R4, R4', R10 и R300 имеют значение, приведенное ранее в отношении формулы 1.
В случае заместителей R5, R6, R7 и R8, а также R5', R6', R7' и R8' формулы 1а будут существовать две равноправные схемы замещения.
При первой схеме замещения R5, R6, R7 и R8, а также R5', R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу. Группы могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br, и/или два соседних радикала R5, R6, или R6, R7, или R7, R8, а также R5', R6', или R6', R7', или R7', R8' в каждом случае могут формировать углеводородную кольцевую систему.
Предпочтительно R5, R6, R7 и R8, а также R5', R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, которые могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br, и/или два соседних радикала R5, R6, а также R5', R6' могут формировать насыщенную или ненасыщенную углеводородную кольцевую систему.
В частности, предпочтительно R5, R6, R7 и R8, а также R5', R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, и/или два соседних радикала R5, R6, а также R5', R6' совместно могут формировать насыщенную или ненасыщенную кольцевую систему.
При второй схеме замещения R6, R7, R8, а также R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу. Два соседних радикала R6, R7 или R7, R8, а также R6', R7' или R7', R8' в каждом случае могут формировать углеводородную кольцевую систему. Группы могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br. R5 и R5' являются идентичными или различными, и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода. Они могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br.
Предпочтительно R6, R7 и R8, а также R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, которые могут содержать один или несколько гетероатомов, подобных Si, B, Al, O, S, N или Р, и/или могут содержать атомы галогенов, подобные F, Cl или Br. R5 и R5' являются идентичными или различными, и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
В частности, предпочтительно R6, R7 и R8, а также R6', R7' и R8' являются идентичными или различными, и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 10 атомов углерода. R5 и R5' являются идентичными или различными, и каждый из них представляет собой нафтил, 4-(С1-С10 алкил)фенил или 4-(С6-С20 арил)фенил, такой как 4-метилфенил, 4-бифенил, 4-этилфенил, 4-н-пропилфенил, 4-изопропилфенил, 4-трет-бутилфенил, 4-втор-бутилфенил, 4-циклогексилфенил, 4-триметилсилилфенил, 4-адамантилфенил, 4-(С1-С10 фторалкил)фенил, 3-(С1-С10 алкил)фенил, 3-(С1-С10 фторалкил)фенил, 3-(С6-С20 арил)фенил, подобный 3-бифенилу, 3,5-ди(С1-С10 алкил)фенил, такой как 3,5-диметилфенил, 3,5-ди(С1-С10 фторалкил)фенил, такой как 3,5-ди(трифторметил)фенил, или 3,5-(С6-С20 арил)фенил, подобный 3,5-терфенилу.
В частности, не ограничивающие примеры очень предпочтительных металлоценовых соединений, описывающихся формулами 1 и 1а, представлены далее:
диметилсиландиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-триметилсилилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-(2-метокси-2-метилпропил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-(2,6-диметилбензил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-(2,4,6-триметилбензил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(2-нафтил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3-бифенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорид;
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-третбутилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)-6-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-третбутилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)-7-метилинденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)-7-метилинденил]цирконийдихлорид,
а также аналогичные цирконийдиметильные соединения и цирконийбифеноляты и цирконийбисфеноляты.
Вместо предпочтительных чистых хиральных мостиковых рацемических или псевдорацемических металлоценовых соединений формул 1 и 1а, при получении катализатора могут быть использованы смеси металлоценов формул 1 и 1а и соответствующих мезо- или псевдомезо-металлоценов. Однако получение изомерно чистой рацемической формы является в особенности предпочтительным при использовании металлоценов для полимеризации олефинов до получения изотактических полиолефинов, поскольку соответствующая мезоформа может приводить к получению нежелательного атактического полипропилена («ПП»). «Изомерно чистая» рацемическая форма понимается как обозначение соотношения рац:мезо, большего чем 5:1, предпочтительно равного, по меньшей мере, 10:1, более предпочтительно, по меньшей мере, 15:1, а наиболее предпочтительно, по меньшей мере, 20:1.
В соответствии с использованием в настоящем документе термин «рацемический» (или «рац») включает «псевдорацемический» (или «псевдорац»), а термин «мезо» включает «псевдомезо».
Настоящее изобретение также включает способ получения соединений переходных металлов формул 1 и 1а изобретения.
Таким образом, одна цель изобретения представляет собой способ получения соединений формулы 1а
(Формула 1а)
в которой переменные R и М1 имеют указанное ранее значение, включая предпочтительные варианты реализации, включающие стадии:
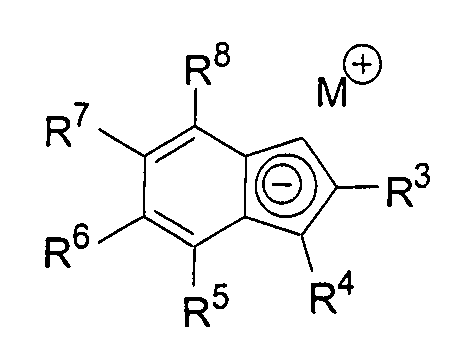
а) депротонирование соединения формулы 2:
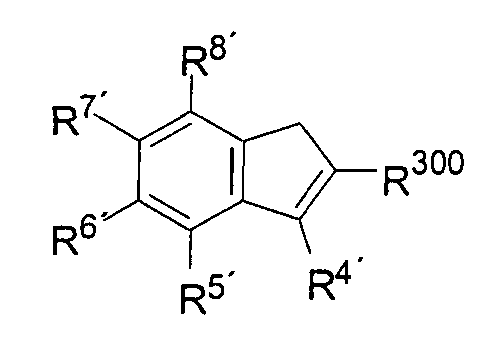
(Формула 2)
под действием основания, где R300, R4', R5', R6', R7' и R8' имеют указанное ранее значение.
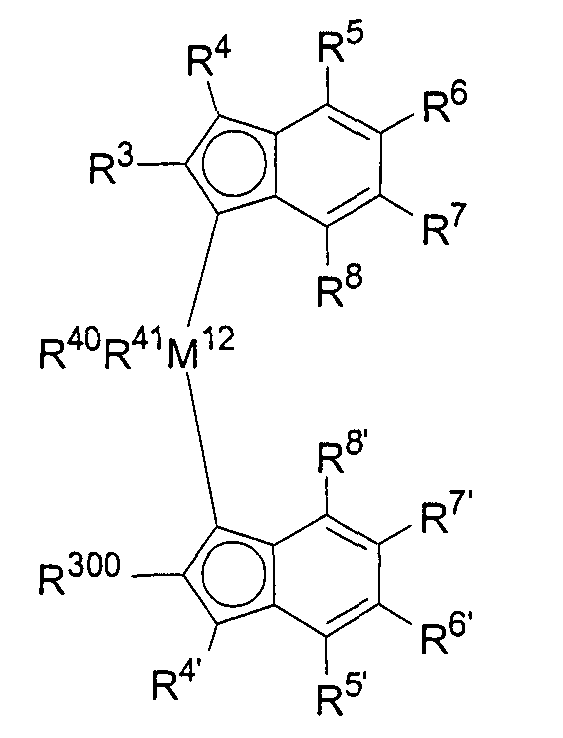
b) если R10 будет иметь значение M12R40R41, где М12, R40 и R41 имеют указанные ранее значения, то тогда дальнейшее получение будет протекать по реакции между депротонированными соединениями со стадии (а) и R40R41M12X2 с образованием соединения формулы 3 или формулы 4 в зависимости от использующихся количественных соотношений, где R40, R41 и М12 имеют указанные ранее значения, а Х могут быть идентичными или различными и обозначают атом галогена, предпочтительно хлор, бром или иод, или другую уходящую группу, предпочтительно трифторметансульфонат, тозилат или мезилат.
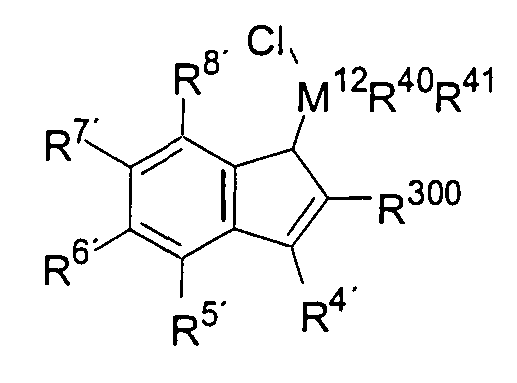
с) после получения хлорсиланинденов или хлоргерманинденов формулы 3 их вводят в реакцию с соединением металл-инден формулы 5
(Формула 5)
в которой М обозначает Li, Na или К, а R3, R4, R5, R6, R7 и R8 имеют указанные ранее значения, до получения соединения формулы 6.
(Формула 6)
d) реакция между соединением формулы 4 или 6 и основанием и добавление M1Cl4, в котором М1 обозначает цирконий, титан или гафний, с образованием соединения формулы 1а.
На стадии (а) соединение формулы 2, например 2-(циклогексилметил)-7-(4'-трет-бутилфенил)инден, в инертном растворителе, который состоит из одного или нескольких ароматических или алифатических углеводородов и/или одного или нескольких полярных апротонных растворителей, депротонируют под действием сильного основания, например н-бутиллития. Депротонирование проводят при температурах в диапазоне от -70°С до 80°С, а предпочтительно от 0°С до 80°С. После этого получающуюся в результате соль металла на стадии (b) непосредственно без дополнительного выделения вводят в реакцию с соединением кремния или соединением германия, которые имеют две уходящие группы. Предпочтительное получение соединения формулы 3 или соединения формулы 4 может быть проведено в результате регулирования количественных соотношений. Соединения формулы 3 на стадии (с) вводят в реакцию с металл-инденильным соединением формулы 5. На последующей стадии (d) бис(инденил)силаны формул 4 или 6 дважды депротонируют под действием сильного основания, такого как н-бутиллитий, в инертном растворителе, который состоит из одного или нескольких ароматических или алифатических углеводородов и/или одного или нескольких полярных апротонных растворителей, а таким образом полученную бислитиевую соль без выделения непосредственно вводят в реакцию с источником Ti, Zr или Hf до получения соединения, описывающегося формулой 1а. Депротонирование проводят при температурах в диапазоне от -70°С до 80°С, а предпочтительно от 0°С до 80°С. В зависимости от природы системы лигандов, представленных формулами 4 или 6, металлоцены выделяют непосредственно из реакционной смеси при соотношениях рац:мезо или соотношениях псевдорац:мезо, больших чем 5:1, предпочтительно равных, по меньшей мере, 10:1, более предпочтительно, по меньшей мере, 15:1, а наиболее предпочтительно, по меньшей мере, 20:1, или в целях получения подходящего катализатора необходимо применить дополнительные стадии разделения рац:мезо для достижения соотношений рац:мезо или соотношений псевдорац:мезо, равных, по меньшей мере, 5:1, предпочтительно, по меньшей мере, 10:1, более предпочтительно, по меньшей мере, 15:1, а наиболее предпочтительно, по меньшей мере, 20:1.
На фигуре 1 для примера одного предпочтительного варианта реализации продемонстрированы отдельные стадии изобретенного способа получения соединений переходных металлов, представленных формулами 1а.
В дополнение к этому, настоящее изобретение относится к системе катализатора, содержащей, по меньшей мере, одно соединение, описывающееся формулами 1 или 1а, и, по меньшей мере, один сокатализатор.
Подходящий сокатализаторный компонент, который в соответствии с настоящим изобретением может присутствовать в системе катализатора, содержит, по меньшей мере, одно соединение, относящееся к типу алюмоксана, кислоту Льюиса или ионное соединение, которые вступают в реакцию с металлоценом, превращая последний в катионное соединение.
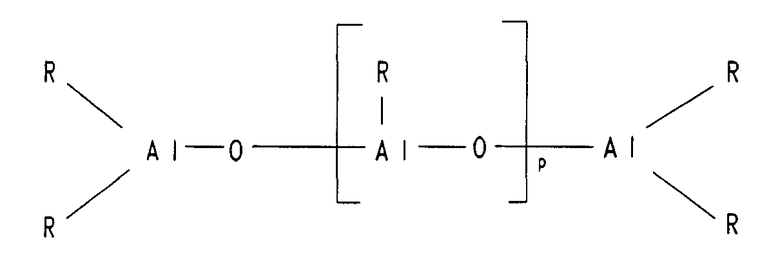
Алюмоксаны представляют собой олигомерные или полимерные алюминийокси-соединения, которые могут существовать в форме линейных, циклических, клеточных или полимерных структур. Несмотря на все еще отсутствие сведений по точной структуре (структурам) алюмоксанов широко признанным является описание алкилалюмоксанов общей формулой 7.
(R-Al-O)p (Формула 7)
Примеры циклических, линейных или клеточных структур алюмоксанов описываются в формулах 8, 9 и 10:

(Формула 8)
(Формула 9)
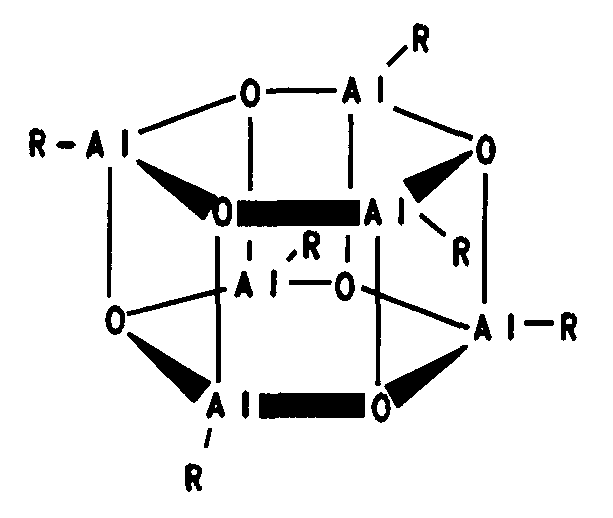
(Формула 10)
Радикалы R в формулах (7), (8), (9) и (10) могут быть идентичными или различными, и каждый из них представляет собой группу С1-С20, такую как алкильная группа, содержащая от 1 до приблизительно 6 атомов углерода, арильная группа, содержащая от 6 до приблизительно 18 атомов углерода, бензил или водород, а р представляет собой целое число в диапазоне от 2 до 50, предпочтительно от 10 до 35.
Предпочтительно радикалы R являются идентичными и представляют собой метил, изобутил, н-бутил, фенил или бензил, в частности предпочтительно метил.
В случае различия радикалов R они предпочтительно представляют собой метил и водород, метил и изобутил или метил и н-бутил, при этом водород, изобутил или н-бутил предпочтительно присутствуют с долей в диапазоне от 0,01 до 40% (по количеству радикалов R).
Алюмоксан может быть получен различным образом по известным способам. Один из способов включает реакцию между соединением алюминий-углеводород и/или соединением гидридоалюминий-углеводород и водой, которая может быть газообразной, твердой, жидкой или связанной в виде кристаллизационной воды, в инертном растворителе, таком как толуол. Для получения алюмоксана, имеющего различные алкильные группы R, два различных типа триалкилалюминия (AlR3 + AlR'3), соответствующие желательным составу и реакционной способности, вводят в реакцию с водой, смотрите публикацию S. Pasynkiewicz, Polyhedron 9 (1990) 429 и документ ЕР-А-0 302 424.
Вне зависимости от способа получения все растворы алюмоксанов общим между собой имеют переменное содержание непрореагировавшего исходного соединения алюминия, которое присутствует в свободной форме или в виде аддукта.
Кроме того, вместо алюмоксановых соединений, описывающихся формулами 7, 8, 9 или 10, также могут быть использованы и модифицированные алюмоксаны, в которых углеводородные радикалы или атомы водорода были отчасти замещены алкокси-, арилокси-, силокси- или амидо-радикалами.
Количества алюмоксана и металлоцена, использующиеся при получении системы катализатора, нанесенного на носитель, могут варьироваться в широких пределах. Однако, как было установлено, выгодным является использование металлоценового соединения формулы 1 или 1а и алюмоксановых соединений в таких количествах, чтобы соотношение между атомами алюминия из алюмоксановых соединений и переходного металла из металлоценового соединения находилось бы в диапазоне от 10:1 до 1000:1, предпочтительно от 20:1 до 500:1, а в частности, в диапазоне от 30:1 до 400:1. В случае метилалюмоксана предпочтение отдается использованию толуольных растворов при крепости ≥ 30%, но возможным является также и использование растворов с 10%-ной крепостью.
В качестве кислоты Льюиса предпочтение отдается использованию соединений формулы 11.
М2Х1Х2Х3 (Формула 11)
где М2 представляет собой элемент из группы 13 периодической таблицы элементов, в частности В, Al или Ga, предпочтительно В или Al, Х1, Х2 и Х3 являются идентичными или различными, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, арильную группу, содержащую от 6 до приблизительно 15 атомов углерода, при этом каждый из алкиларила, арилалкила, галогеналкила или галогенарила содержит от 1 до 10 атомов углерода в алкильном радикале и 6-20 атомов углерода в арильном радикале, или фтор, хлор, бром или иод. Предпочтительные примеры Х1, Х2 и Х3 представляют собой метил, пропил, изопропил, изобутил или трифторметил, ненасыщенные группы, такие как арил или галогенарил, подобные фенильной, толильной, бензильной группам, п-фторфенилу, 3,5-дифторфенилу, пентахлорфенилу, пентафторфенилу, 3,4,5-трифторфенилу и 3,5-ди(трифторметил)фенилу.
Предпочтительные кислоты Льюиса представляют собой триметилалюминий, триэтилалюминий, триизобутилалюминий, трибутилалюминий, трифторборан, трифенилборан, трис(4-фторфенил)боран, трис(3,5-дифторфенил)боран, трис(4-фторметилфенил)боран, трис(2,4,6-трифторфенил)боран, трис(пентафторфенил)боран, трис(толил)боран, трис(3,5-диметилфенил)боран, трис(3,5-дифторфенил)боран и/или трис(3,4,5-трифторфенил)боран.
Особенное предпочтение отдается трис(пентафторфенил)борану.
В качестве ионных сокатализаторов предпочтение отдается использованию соединений, которые содержат некоординирующий анион, таких как тетракис(пентафторфенил)борат, тетрафенилборат, SbF6 -, CF3SO3 - или ClO4 -. Подходящие противоионы представляют собой катион либо кислоты Льюиса, либо кислоты Бренстеда.
В качестве кислот Бренстеда особенное предпочтение отдается протонированным аминовым или анилиновым производным, таким как метиламмоний, анилиний, диметиламмоний, диэтиламмоний, N-метиланилиний, дифениламмоний, N,N-диметиланилиний, триметиламмоний, триэтиламмоний, три-н-бутиламмоний, метилдифениламмоний, пиридиний, п-бром-N,N-диметиланилиний или п-нитро-N,N-диметиланилиний, N,N-диметилбензиламмоний, N,N-диметилциклогексиламмоний.
Подходящими катионами кислот Льюиса являются катионы формулы 12
[(Ya +)Q1Q2..Qz]d + (Формула 12)
где Y представляет собой элемент из групп от 1 до 16 периодической таблицы элементов, от Q1 до Qz представляют собой однократно отрицательно заряженные группы, такие как С1-С28 алкил, С6-С15 арил, алкиларил, арилалкил, галогеналкил, галогенарил, каждая из которых содержит от 6 до 20 атомов углерода в арильном радикале и от 1 до 28 атомов углерода в алкильном радикале, циклоалкильные группы, содержащие от 3 до приблизительно 10 атомов углерода, которые в качестве заместителей, в свою очередь, могут иметь алкильные группы, содержащие от 1 до приблизительно 10 атомов углерода, галоген, алкоксигруппы, содержащие от 1 до 28 атомов углерода, арилоксигруппы, содержащие от 6 до 15 атомов углерода, силильные или меркаптильные группы.
а представляет собой целое число 1-6,
z представляет собой целое число в диапазоне от 0 до 5, а
d соответствует разности а-z, но d является большим или равным 1.
В особенности подходящими катионами являются карбониевые катионы, такие как трифенилкарбений, оксониевые катионы, сульфониевые катионы, такие как тетрагидротиофений, фосфониевые катионы, такие как триэтилфосфоний, трифенилфосфоний и дифенилфосфоний, а также катионные комплексы переходных металлов, такие как катион серебра и 1,1'-диметилферроцениевый катион.
Предпочтительные ионные соединения, которые могут быть использованы в соответствии с настоящим изобретением, включают:
триэтиламмонийтетра(фенил)борат,
трибутиламмонийтетра(фенил)борат,
триметиламмонийтетра(толил)борат,
трибутиламмонийтетра(толил)борат,
трибутиламмонийтетра(пентафторфенил)борат,
трибутиламмонийтетра(пентафторфенил)алюминат,
трипропиламмонийтетра(диметилфенил)борат,
трибутиламмонийтетра(трифторметилфенил)борат,
трибутиламмонийтетра(4-фторфенил)борат,
N,N-диметилциклогексиламмонийтетракис(пентафторфенил)борат,
N,N-диметилбензиламмонийтетракис(пентафторфенил)борат,
N,N-диметиланилинийтетра(фенил)борат,
N,N-диэтиланилинийтетра(фенил)борат,
N,N-диметиланилинийтетракис(пентафторфенил)борат,
N,N-диметиланилинийтетракис(пентафторфенил)алюминат,
ди(пропил)аммонийтетракис(пентафторфенил)борат,
ди(циклогексил)аммонийтетракис(пентафторфенил)борат,
трифенилфосфонийтетракис(фенил)борат,
триэтилфосфонийтетракис(фенил)борат,
дифенилфосфонийтетракис(фенил)борат,
три(метилфенил)фосфонийтетракис(фенил)борат,
три(диметилфенил)фосфонийтетракис(фенил)борат,
трифенилкарбенийтетракис(пентафторфенил)борат,
трифенилкарбенийтетракис(пентафторфенил)алюминат,
трифенилкарбенийтетракис(фенил)алюминат,
ферроценийтетракис(пентафторфенил)борат и/или
ферроценийтетракис(пентафторфенил)алюминат.
Предпочтение отдается трифенилкарбенийтетракис(пентафторфенил)борату, N,N-диметилциклогексиламмонийтетракис(пентафторфенил)борату или N,N-диметилбензиламмонийтетракис(пентафторфенил)борату.
Возможным также является и использование смесей всех из упомянутых ранее и далее катионообразующих соединений. Предпочтительные смеси содержат алюмоксаны и ионное соединение и/или кислоту Льюиса.
Другие подходящие сокатализаторные компоненты подобным образом представляют собой борановые или карборановые соединения, такие как
7,8-дикарбаундекаборан (13),
ундекагидридо-7,8-диметил-7,8-дикарбаундекаборан,
додекагидридо-1-фенил-1,3-дикарбанонаборан,
три(бутил)аммонийдекагидридо-8-этил-7,9-дикарбаундекаборат,
4-карбанонаборан (14),
бис(три(бутил)аммоний)нонаборат,
бис(три(бутил)аммоний)ундекаборат,
бис(три(бутил)аммоний)додекаборат,
бис(три(бутил)аммоний)декахлордекаборат,
три(бутил)аммоний-1-карбадекаборат,
три(бутил)аммоний-1-карбадодекаборат,
три(бутил)аммоний-1-триметилсилил-1-карбадекаборат,
три(бутил)аммонийбис(нонагидридо-1,3-дикарбанонаборато)кобальтат (III),
три(бутил)аммонийбис(ундекагидридо-7,8-дикарбаундекаборато)феррат (III).
Количество кислот Льюиса или ионных соединений, содержащих катионы кислоты Льюиса или кислоты Бренстеда, предпочтительно находится в диапазоне от 0,1 до 20 эквивалентов, предпочтительно от 1 до 10 эквивалентов, при расчете на количество металлоценового соединения формулы 1 или 1а.
Подобным же образом важными в качестве сокатализаторных систем являются комбинации из, по меньшей мере, одного основания Льюиса и биметаллических соединений, относящихся к типу Ri 17M3(-O-M3Rj 18)v или Ri 18M3(-O-M3Rj 17)v (формула 13), как это описывается в патентной заявке WO 99/40129.
В данном отношении R17 и R18 являются идентичными или различными и представляют собой атом водорода, атом галогена, С1-С40 углеродсодержащую группу, в особенности алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, галогеналкил, содержащий от 1 до приблизительно 20 атомов углерода, алкокси, содержащий от 1 до приблизительно 10 атомов углерода, арил, содержащий от 6 до приблизительно 20 атомов углерода, галогенарил, содержащий от 6 до приблизительно 20 атомов углерода, арилокси, содержащий от 6 до приблизительно 20 атомов углерода, арилалкил, содержащий от 7 до приблизительно 40 атомов углерода, галогенарилалкил, содержащий от 7 до приблизительно 40 атомов углерода, алкиларил, содержащий от 7 до приблизительно 40 атомов углерода, или галогеналкиларил, содержащий от 7 до приблизительно 40 атомов углерода. R17 также может представлять собой группу -OSiR51 3, в которой группы R51 являются идентичными или различными и имеют то же самое значение, что и R17, М3 являются идентичными или различными и представляют собой элемент из основной группы III периодической таблицы элементов, каждый из i, j и v обозначает целое число 0, 1 или 2, а сумма i + j + v неравна 0.
Предпочтительные системы сокатализаторов представляют соединения формул (А) и (В)
где R17 и R18 имеют то же самое значение, что и указанное ранее.
Кроме того, соединениями, которые в общем случае считаются предпочтительными, являются те, которые образуются по реакции между, по меньшей мере, одним соединением, описывающимся формулами (С), и/или (D), и/или (Е), и, по меньшей мере, одним соединением, описывающимся формулой (F).
в которых
R27 может представлять собой атом водорода или не содержащую бор С1-С40 углеродсодержащую группу, такую как алкил, содержащий от 1 до приблизительно 20 атомов углерода, арил, содержащий от 6 до приблизительно 20 атомов углерода, арилалкил, содержащий от 7 до приблизительно 40 атомов углерода, и алкиларил, содержащий от 7 до приблизительно 40 атомов углерода, и в которых R17, R18 имеют то же самое значение, что и указанное ранее,
D представляет собой элемент из основной группы VI периодической таблицы элементов или группу NR61, где R61 представляет собой атом водорода или С1-С20 углеводородную группу, такую как алкил, содержащий от 1 до приблизительно 20 атомов углерода, или арил, содержащий от 6 до приблизительно 20 атомов углерода,
f представляет собой целое число в диапазоне от 0 до 3,
g представляет собой целое число в диапазоне от 0 до 3, где сумма f + g соответствует валентности бора, a
h представляет собой целое число в диапазоне от 1 до 10.
Биметаллические соединения формулы 13 могут быть объединены с металлоорганическим соединением формулы 14, то есть [M4R19 q]k, в которой М4 представляет собой элемент из основной группы I, II или III периодической таблицы элементов, R19 являются идентичными или различными и представляют собой атом водорода, атом галогена, С1-С40 углеродсодержащую группу, алкильную группу, содержащую от 1 до приблизительно 20 атомов углерода, арильную группу, содержащую от приблизительно 6 до приблизительно 40 атомов углерода, арилалкил, содержащий от 7 до приблизительно 40 атомов углерода, и алкиларил, содержащий от 7 до приблизительно 40 атомов углерода, q представляет собой целое число в диапазоне от 1 до 3, а k представляет собой целое число в диапазоне от 1 до 4.
Металлоорганические соединения формулы 14 предпочтительно представляют собой нейтральные кислоты Льюиса, в которых М4 обозначает литий, магний и/или алюминий, в особенности алюминий. Примеры предпочтительных металлоорганических соединений формулы 14 представляют собой триметилалюминий, триэтилалюминий, триизопропилалюминий, тригексилалюминий, триоктилалюминий, три-н-бутилалюминий, три-н-пропилалюминий, триизопреналюминий, диметилалюминиймонохлорид, алюминиймонохлорид, диизобутилалюминиймонохлорид, метилалюминийсесквихлорид, этилалюминийсесквихлорид, диметилалюминийгидрид, алюминийгидрид, диизопропилалюминийгидрид, диметилалюминий(триметилсилоксид), диметилалюминий(триэтилсилоксид), фенилалан, пентафторфенилалан и о-толилалан.
Система катализатора изобретения в качестве сокаталитически активного химического соединения содержит бор-алюминийорганическое соединение, которое содержит звенья, описывающиеся формулой 13. Предпочтительными являются соединения, описывающиеся формулой 13, в которой М3 обозначает бор или алюминий. Соединения, которые содержат звенья, описывающиеся формулой 13, могут присутствовать в виде мономеров или в виде линейных, циклических или клеткоподобных олигомеров. Два и более химических соединения, которые содержат звенья, описывающиеся формулой 13, в результате взаимодействий кислота-основание Льюиса также могут формировать димеры, тримеры или высшие комбинации из них самих.
Предпочтительные сокаталитически активные биметаллические соединения описываются формулами 15 и 16.
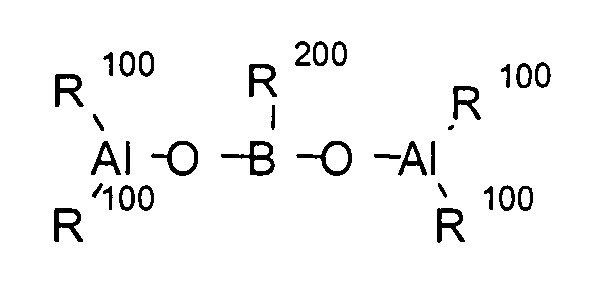
(формула 15)
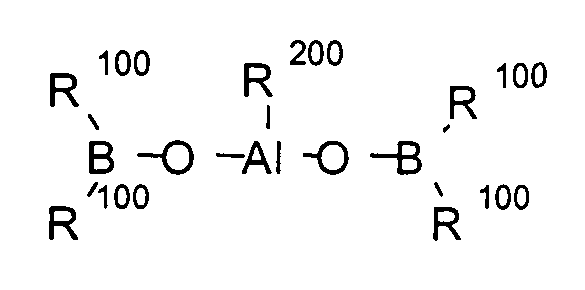
(формула 16)
в которых R100 и R200 имеют то же самое значение, что и заместители R17 и R18 в формуле 13.
Примеры сокаталитически активных соединений, описывающихся формулами 15 и 16, представляют собой
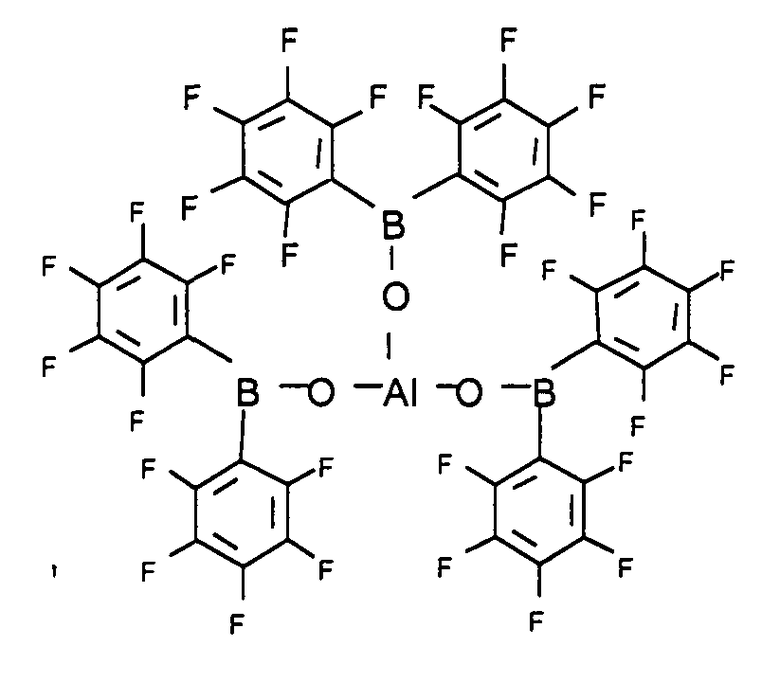
В качестве дополнительных сокатализаторов могут быть использованы соединения, названные в документах EP-A-924223, DE 196 22 207.9, EP-A-601830, EP-A-824112, EP-A-824113, WO 99/06,414, EP-A-811,627, WO 97/11775, DE 196 06 167.9 и DE 198 04 970, которые могут присутствовать в форме, не нанесенной или нанесенной на носитель.
Количество сокатализаторов, описывающихся формулами 13, и/или 15, и/или 16, использующееся в катализаторе настоящего изобретения, может варьироваться в диапазоне от 0,1 до 500 эквивалентов, предпочтительно от 1 до 300 эквивалентов, наиболее предпочтительно от 5 до 150 эквивалентов, при расчете на использующееся количество металлоценового соединения, описывающегося формулами 1 или 1а.
Система катализатора настоящего изобретения, кроме того, в качестве дополнительного компонента может содержать соединение металла формулы 17,
M5(R22)r(R23)s(R24)t (Формула 17)
где
М5 представляет собой щелочной, щелочноземельный металл или металл из группы 13 периодической таблицы элементов,
R22 представляет собой атом водорода, алкил, содержащий от 1 до приблизительно 10 атомов углерода, арил, содержащий от 6 до приблизительно 15 атомов углерода, или алкиларил или арилалкил, каждый из которых содержит от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильной части,
каждый из R23 и R24 представляет собой атом водорода, атом галогена, алкил, содержащий от 1 до приблизительно 10 атомов углерода, С6-С15 арил, содержащий от приблизительно 6 до приблизительно 15 атомов углерода, или алкиларил, арилалкил или алкокси, каждый из которых содержит от 1 до 10 атомов углерода в алкильной части и от 6 до 20 атомов углерода в арильном радикале,
r представляет собой целое число в диапазоне от 1 до 3, а s и t представляют собой целые числа в диапазоне от 0 до 2, где сумма r + s + t соответствует валентности М5,
где данный компонент неидентичен вышеупомянутым соединениям сокатализаторов. Также могут быть использованы и смеси различных соединений металлов формулы 17.
В числе соединений металлов, описывающихся формулой 17, предпочтение отдается тем, в которых М5 представляет собой литий, магний или алюминий, а каждый из R23 и R24 представляет собой алкил, содержащий от 1 до приблизительно 10 атомов углерода. В особенности предпочтительные соединения металлов, описывающиеся формулой 17, представляют собой н-бутиллитий, н-бутил-н-октилмагний, н-бутил-н-гептилмагний, три-н-гексилалюминий, триизобутилалюминий, триэтилалюминий, триметилалюминий или их смеси.
В случае использования соединения металла, описывающегося формулой 17, предпочтительно в системе катализатора оно присутствует в таком количестве, что молярное соотношение между М5 и переходным металлом из металлоценового соединения, описывающегося формулами 1 или 1а, будет находиться в диапазоне от 800:1 до 1:1, в частности от 200:1 до 2:1.
Компонент-носитель системы катализатора настоящего изобретения может представлять собой любое органическое или неорганическое инертное твердое вещество или смесь таких твердых веществ, в частности пористые твердые вещества, такие как гидроталькиты, тальк, неорганические оксиды и тонкоизмельченные полимерные порошки.
Подходящие неорганические оксиды, которые предпочтительно используют, включают оксиды металлов из групп 1, 2, 3, 4, 5, 12, 13 и 14 периодической таблицы элементов, такие как диоксид кремния, оксид алюминия, алюмосиликаты, цеолиты, MgO, ZrO2, TiO2 или В2О3, СаО, ZnO, ThO2, Na2O, K2O, Li2O или смешанные оксиды, подобные оксидам Al/Si, оксидам Mg/Al или оксидам Al/Mg/Si. Другие подходящие неорганические материалы носителей представляют собой Na2CO3, K2CO3, CaCO3, MgCl2, Na2SO4, Al2(SO4)3, BaSO4, KNO3, Mg(NO3)2 и Al(NO3)3.
Подходящие полимерные порошки представляют собой гомополимеры, сополимеры, сшитые полимеры или полимерные смеси. Примеры таких полимеров представляют собой полиэтилен, полипропилен, полибутен, полистирол, полистирол, сшитый дивинилбензолом, поливинилхлорид, сополимер акрилонитрил-бутадиен-стирол, полиамид, полиметакрилат, поликарбонат, сложный полиэфир, полиацеталь или поливиниловый спирт.
Предпочтительные материалы носителей характеризуются площадью удельной поверхности в диапазоне от 10 до 1000 м2/г, объемом пор в диапазоне от 0,1 до 5 см3/г и средним размером частиц в диапазоне от 1 до 500 мкм. Предпочтение отдается носителям, характеризующимся площадью удельной поверхности в диапазоне от 50 до 500 м2/г, объемом пор в диапазоне от 0,5 до 3,5 см3/г и средним размером частиц в диапазоне от 5 до 250 мкм. Особенное предпочтение отдается носителям, характеризующимся площадью удельной поверхности в диапазоне от 200 до 400 м2/г, объемом пор в диапазоне от 0,8 до 3,0 см3/г и средним размером частиц в диапазоне от 10 до 100 мкм.
Для регулирования определенных свойств носителя, таких как уровень содержания воды и/или гидроксильных групп, материалы носителей могут быть подвергнуты термической и/или химической предварительной обработке.
В случае низких уровня влагосодержания или уровня содержания остаточного растворителя в материале носителя обезвоживание или высушивание перед использованием могут быть опущены. В противном случае, как и при использовании в качестве материала носителя силикагеля, рекомендуются обезвоживание или высушивание. Термические обезвоживание или высушивание материала носителя могут быть проведены при пониженном давлении одновременно при наличии или в отсутствие атмосферы инертного газа (азота). Температура высушивания находится в диапазоне от 80°С до 1000°С, предпочтительно от 150°С до 800°С, а наиболее предпочтительно от 150°С до 400°С. Продолжительность процесса высушивания может находиться в диапазоне от 1 до 24 часов. Но возможными также являются и более короткие или более продолжительные периоды высушивания.
В одном предпочтительном варианте реализации настоящего изобретения используют материалы носителей, характеризующиеся потерей массы при высушивании (ПМВ), равной 0,5% (мас.) и менее, а еще более предпочтительно значением ПМВ, равным 0,3% (мас.) и менее. Возможными являются и более высокие количества физически адсорбированной воды, доходящие вплоть до 1% (мас.), но в результате это приведет к пониженным активностям катализатора. Потеря массы при прокаливании (ПМП) у материала носителя предпочтительно составляет 1% (мас.) и более или еще более предпочтительно находится в диапазоне от 1,5 до 3,5% (мас.). Таким образом, потерю массы при высушивании (ПМВ) определяют как потерю массы в диапазоне от комнатной температуры до 300°С, а потерю массы при прокаливании (ПМП) определяют как потерю массы в диапазоне от 300°С до 1000°С.
В дополнительном или альтернативном варианте обезвоживание или высушивание материала носителя также могут быть проведены при использовании химических средств в результате проведения реакции между адсорбированной водой и/или поверхностными гидроксильными группами и подходящими пассиваторами. Реакция с пассиватором может полностью или частично перевести гидроксильные группы в форму, которая не обнаруживает какого-либо неблагоприятного взаимодействия с каталитически активными центрами. Подходящие пассиваторы представляют собой галогениды кремния, силаны или амины, например тетрахлорид кремния, хлортриметилсилан, дихлордиалкилсиланы, диметиламинотрихлорсилан, N,N-диметиланилин или N,N-диметилбензиламин, или металлоорганические соединения алюминия, бора и магния, например алюмоксаны, триметилалюминий, триэтилалюминий, триизобутилалюминий, диизобутилалюминийгидрид, триэтилборан или дибутилмагний.
Как было представлено ранее, также могут быть использованы и органические материалы носителей, такие как тонкоизмельченные полимерные порошки, и перед использованием они подобным образом должны быть освобождены от каких-либо приставшей влаги, остатков растворителя или других примесей в результате проведения надлежащих операций очистки и высушивания.
Предпочтение отдается использованию в качестве материалов носителя силикагелей, характеризующихся определенными параметрами. В сопоставлении с марками гранулированного диоксида кремния предпочтительными являются марки диоксида кремния, подвергнутого распылительной сушке, которые по самой своей природе обнаруживают наличие мезо- и макро-пор, полостей и каналов.
Система катализатора, нанесенного на носитель, соответствующая данному изобретению, может быть получена различными способами.
В одном варианте реализации настоящего изобретения, по меньшей мере, один из описанных ранее металлоценовых компонентов, описывающихся формулами 1 или 1а, в подходящем растворителе вводят в контакт, по меньшей мере, с одним сокатализаторным компонентом, что предпочтительно приводит к получению растворимого продукта реакции, аддукта или смеси. Полученную композицию перемешивают с обезвоженным или пассивированным материалом носителя, растворитель удаляют, а получающуюся в результате систему металлоценового катализатора, нанесенного на носитель, высушивают для обеспечения удаления растворителя из пор материала носителя полностью или в основном. Катализатор, нанесенный на носитель, получают в виде свободнотекучего порошка.
В порядке примера способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
а) получение смеси металлоцен/сокатализатор в подходящих растворителе или суспензионной среде, где металлоценовый компонент обладает одной из описанных ранее структур,
b) нанесение смеси металлоцен/сокатализатор на пористый, предпочтительно неорганический носитель, в случае необходимости подвергнутый термической или химической предварительной обработке,
с) удаление из получающейся в результате смеси основной части растворителя,
d) выделение системы катализатора, нанесенного на носитель, и
е) при желании форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
В еще одном варианте реализации настоящего изобретения композицию металлоцен/сокатализатор перемешивают с обезвоженным или пассивированным материалом носителя, катализатор, нанесенный на носитель, извлекают и необязательно промывают ароматическим углеводородным и/или парафиновым углеводородным растворителем. После этого выделенный катализатор диспергируют в нереакционно-способных суспензионных средах, таких как парафиновый углеводородный растворитель, минеральное масло или воск или их смеси.
В одном дополнительном варианте реализации настоящего изобретения катализатор получают в соответствии с методикой, описанной в документах WO 06/60544, WO 00/05277 и WO 98/01481.
В порядке примера в документе WO 06/60544 систему свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, получают, включая следующие стадии:
а) введение, по меньшей мере, одного материала носителя в контакт с первой порцией, по меньшей мере, одного сокатализатора в подходящем растворителе,
b) импрегнирование носителя, содержащего введенный сокатализатор, суспензией или раствором, которые содержат, по меньшей мере, один металлоцен и вторую порцию, по меньшей мере, одного сокатализатора в подходящем растворителе,
с) выделение системы катализатора, нанесенного на носитель, и
f) при желании форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
Таким образом, в порядке примера соответствующий документу WO 06/60544 способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
а) введение материала носителя в контакт с первой композицией, которая содержит, по меньшей мере, один алюмоксан в первом растворителе, при температуре в диапазоне приблизительно от 10 до 30°С со следующими далее выдерживанием смеси при приблизительно 20°С в течение периода времени продолжительностью от 0 до 12 часов, последовательно нагреванием получающейся в результате смеси до температуры в диапазоне от 30 до 200°С и выдерживанием смеси при температуре в диапазоне от 30 до 200°С в течение периода времени продолжительностью от 30 минут до 20 часов, необязательно с последующим удалением всего количества или части первого растворителя и/или необязательно идущими затем одной или несколькими стадиями (стадией) промывания при использовании подходящего растворителя,
b) суспендирование и/или растворение, соответственно, по меньшей мере, одного металлоцена, описывающегося формулами 1 и/или 1а, и второй порции алюмоксана или смеси алюмоксанов или ионного соединения и/или кислоты Льюиса во вторых растворителе или суспензионной среде при температуре в диапазоне от 0 до 100°С, необязательно с последующим прохождением времени предварительной активации продолжительностью от 1 минуты до 200 часов при температуре в диапазоне от 10 до 100°С,
с) нанесение смеси, полученной в b), на материал носителя, содержащий введенный алюмоксан и полученный в а), при температуре в диапазоне от 10 до 100°С и времени введения в контакт продолжительностью от 1 минуты до 24 часов,
d) удаление из получающейся в результате смеси основной части растворителя и необязательно промывание получающегося в результате катализатора, нанесенного на носитель, в подходящем растворителе,
е) выделение системы катализатора, нанесенного на носитель, и
f) необязательно форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
Говоря более конкретно, в порядке примера соответствующий документу WO 06/60544 способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
способ получения системы свободнотекучего катализатора, нанесенного на носитель, соответствующий настоящему изобретению, включает следующие стадии:
а) введение материала носителя в контакт с первой композицией, которая содержит, по меньшей мере, 5 ммоль алюмоксана или смеси алюмоксанов на один г материала носителя в первом растворителе, при температуре, равной приблизительно 20°С, со следующими далее выдерживанием смеси при приблизительно 20°С в течение периода времени продолжительностью от 0,15 до 2 часов, последовательно нагреванием получающейся в результате смеси до температуры в диапазоне от 50 до 160°С и выдерживанием смеси при температуре в диапазоне от 50 до 160°С в течение периода времени продолжительностью от 1 до 6 часов, необязательно с последующим удалением всего количества или части первого растворителя и/или необязательно идущими затем одной или несколькими стадиями (стадией) промывания при использовании подходящего растворителя,
b) суспендирование и/или растворение, соответственно, по меньшей мере, 0,5 ммоль второй порции алюмоксана или смеси алюмоксанов на один г материала носителя и, по меньшей мере, 0,1% (моль) от использованной второй порции алюмоксана или смеси алюмоксанов на один г материала носителя, по меньшей мере, одного металлоцена, описывающегося формулами 1 и/или 1а, во вторых растворителе или суспензионной среде при температуре в диапазоне от 20 до 50°С, необязательно с последующим прохождением времени предварительной активации продолжительностью от 1 минуты до 200 часов при температуре в диапазоне от 20 до 30°С,
с) нанесение смеси, полученной в b), на материал носителя, содержащий введенный алюмоксан и полученный в а), при температуре в диапазоне от 10 до 100°С и времени введения в контакт продолжительностью от 1 минуты до 24 часов,
d) удаление из получающейся в результате смеси основной части растворителя и
е) необязательно промывание получающегося в результате катализатора, нанесенного на носитель, подходящим растворителем и/или высушивание получающегося в результате катализатора, нанесенного на носитель, при температурах в диапазоне от 30 до 60°С и
f) необязательно форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
В одном предпочтительном варианте реализации в порядке примера соответствующий документу WO 06/60544 способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
а) введение материала носителя в виде необязательно подвергнутого термической предварительной обработке диоксида кремния в контакт, по меньшей мере, с 10 ммоль алюмоксана на один г материала носителя в толуоле при температуре, равной приблизительно 20°С, со следующими далее последовательно нагреванием получающейся в результате смеси до температуры в диапазоне от 50 до 110°С и выдерживанием смеси при температуре в диапазоне от 50 до 110°С в течение периода времени продолжительностью от 1 до 6 часов, необязательно с последующим удалением всего количества или части толуола и/или необязательно идущими затем одной или несколькими стадиями (стадией) промывания при использовании подходящего растворителя,
b) суспендирование и/или растворение, соответственно, по меньшей мере, 0,5 ммоль второй порции алюмоксана на один г материала носителя и, по меньшей мере, 0,1% (моль) от использованной второй порции алюмоксана или смеси алюмоксанов на один г материала носителя, по меньшей мере, одного металлоцена, описывающегося формулами 1 и/или 1а, в толуоле при температуре в диапазоне от 20 до 50°С, необязательно с последующим прохождением времени предварительной активации продолжительностью от 1 минуты до 200 часов при температуре в диапазоне от 20 до 30°С,
с) нанесение смеси, полученной в b), на материал носителя, содержащий введенный алюмоксан и полученный в а), при температуре в диапазоне от 10 до 100°С и времени введения в контакт продолжительностью от 1 минуты до 24 часов,
d) удаление из получающейся в результате смеси основной части толуола и
е) необязательно промывание получающегося в результате катализатора, нанесенного на носитель, подходящим растворителем и/или высушивание получающегося в результате катализатора, нанесенного на носитель, при температурах в диапазоне от 30 до 60°С и
f) необязательно форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
В одном более предпочтительном варианте реализации в порядке примера соответствующий документу WO 06/60544 способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
а) введение материала носителя в виде необязательно подвергнутого термической предварительной обработке диоксида кремния, характеризующегося потерей массы при высушивании (ПМВ), равной 0,5% (мас.) и менее, и потерей массы при прокаливании (ПМП), равной 1,0% (мас.) и более, в контакт с первой композицией, которая содержит, по меньшей мере, 10 ммоль метилалюмоксана на один г материала носителя в толуоле, при температуре, равной приблизительно 20°С, со следующими далее последовательно нагреванием получающейся в результате смеси до температуры 110°С и выдерживанием смеси при 110°С в течение периода времени продолжительностью от 1 до 6 часов, необязательно с последующим удалением всего количества или части толуола и/или необязательно идущими затем одной или несколькими стадиями (стадией) промывания при использовании подходящего растворителя,
b) суспендирование и/или растворение, соответственно, по меньшей мере, 1 ммоль второй порции метилалюмоксана на один г материала носителя и, по меньшей мере, 0,1% (моль) от использованной второй порции метилалюмоксана на один г материала носителя, по меньшей мере, одного металлоцена, описывающегося формулами 1 и/или 1а, в толуоле при температуре в диапазоне от 20 до 50°С, необязательно с последующим прохождением времени предварительной активации продолжительностью от 1 минуты до 200 часов при температуре в диапазоне от 20 до 30°С,
с) нанесение смеси, полученной в b), на материал носителя, содержащий введенный метилалюмоксан и полученный в а), в результате перепускания импрегнирующих суспензии или раствора b) через материал носителя, содержащий введенный метилалюмоксан, при непосредственном течении или в результате использования методики импрегнирования до достижения начальной влажности, когда объем импрегнирующих суспензии или раствора или совокупный объем жидкости, использующийся на стадии импрегнирования, соответственно, не превышают 250% от совокупного объема пор материала носителя, при температуре в диапазоне от 10 до 100°С и времени введения в контакт продолжительностью от 1 минуты до 24 часов,
d) удаление из получающейся в результате смеси основной части толуола и
е) необязательно промывание получающегося в результате катализатора, нанесенного на носитель, подходящим растворителем и/или высушивание получающегося в результате катализатора, нанесенного на носитель, при температурах в диапазоне от 30 до 60°С и
f) необязательно форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
В частности, в одном предпочтительном варианте реализации в порядке примера соответствующий документу WO 06/60544 способ получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включает следующие стадии:
а) введение материала носителя в виде необязательно подвергнутого термической предварительной обработке диоксида кремния, характеризующегося потерей массы при высушивании (ПМВ), равной 0,3% (мас.) или менее, и потерей массы при прокаливании (ПМП) в диапазоне от 1,5 до 3,5% (мас.), в контакт, по меньшей мере, с 10 ммоль метилалюмоксана на один г материала носителя в толуоле при температуре, равной приблизительно 20°С, со следующими далее последовательно нагреванием получающейся в результате смеси до температуры 110°С и выдерживанием смеси при 110°С в течение периода времени продолжительностью от 1 до 6 часов, необязательно с последующим удалением всего количества или части толуола и/или необязательно идущими затем одной или несколькими стадиями (стадией) промывания при использовании подходящего растворителя,
b) суспендирование и/или растворение, соответственно, по меньшей мере, 1 ммоль второй порции метилалюмоксана на один г материала носителя и, по меньшей мере, 0,1% (моль) от использованной второй порции метилалюмоксана на один г материала носителя, по меньшей мере, одного металлоцена, описывающегося формулой 1а, в толуоле при температуре в диапазоне от 20 до 50°С, необязательно с последующим прохождением времени предварительной активации продолжительностью от 1 минуты до 200 часов при температуре в диапазоне от 20 до 30°С,
с) нанесение смеси, полученной в b), на материал носителя, содержащий введенный метилалюмоксан и полученный в а), в результате перепускания импрегнирующих суспензии или раствора b) через материал носителя, содержащий введенный метилалюмоксан, а) при непосредственном течении или в результате использования методики импрегнирования до достижения начальной влажности, когда объем импрегнирующих суспензии или раствора или совокупный объем жидкости, использующийся на стадии импрегнирования, соответственно, не превышают 250% от совокупного объема пор материала носителя, при температуре в диапазоне от 10 до 100°С и времени введения в контакт продолжительностью от 1 минуты до 24 часов,
d) удаление из получающейся в результате смеси основной части толуола и
е) необязательно промывание получающегося в результате катализатора, нанесенного на носитель, подходящим растворителем и/или высушивание получающегося в результате катализатора, нанесенного на носитель, при температурах в диапазоне от 30 до 60°С и
f) необязательно форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
В соответствии с настоящим изобретением для получения системы свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, на стадии b) упомянутых ранее вариантов получения катализатора вместо алюмоксана или смеси алюмоксанов может быть использовано, по меньшей мере, одно алкильное соединение элементов из основных групп от I до III периодической таблицы, например магнийалкил, литийалкил или алюминийалкил, подобный триметилалюминию, триэтилалюминию, триизобутилалюминию, триизопропилалюминию, тригексилалюминию, триоктилалюминию, три-н-бутилалюминию, три-н-пропилалюминию, триизопреналюминию, диметилалюминиймонохлориду, алюминиймонохлориду, диизобутилалюминиймонохлориду, метилалюминийсесквихлориду, этилалюминийсесквихлориду, диметилалюминийгидриду, алюминийгидриду, диизопропилалюминийгидриду, диметилалюминий(триметилсилоксиду), диметилалюминий(триэтилсилоксиду), фенилалану, пентафторфенилалану и о-толилалану. Предпочтительные алюминийалкилы представляют собой триметилалюминий, триэтилалюминий, триизобутилалюминий.
В еще одном дополнительном варианте реализации настоящего изобретения получают систему свободнотекучего и при желании форполимеризованного катализатора, нанесенного на носитель, включая следующие стадии:
а) получение смеси триалкилалюминий/бориновая кислота в подходящих растворителе или суспензионной среде,
b) нанесение смеси триалкилалюминий/бориновая кислота на пористый, предпочтительно неорганический носитель, при необходимости подвергнутый термической или химической предварительной обработке, который прежде подвергли обработке основанием, подобным N,N-диэтилбензиламину, N,N-диметилбензиламину, N-бензилдиметиламину, N-бензилдиэтиламину, N-бензилбутиламину, N-бензил-трет-бутиламину, N-бензилизопропиламину, N-бензилметиламину, N-бензилэтиламину, N-бензил-1-фенилэтиламину, N-бензил-2-фенилэтиламину, N,N-диметилбензиламину, N,N-диэтилбензиламину, N-метил-N-этилбензиламину, N-метилдибензиламину и N-этилди(бензил)амину,
с) удаление из получающейся в результате смеси основной части растворителя для получения сокатализатора, нанесенного на носитель,
d) получение смеси металлоцен/сокатализатор, нанесенный на носитель, в подходящих растворителе или суспензионной среде, где металлоценовый компонент обладает одной из описанных ранее структур,
е) выделение системы катализатора, нанесенного на носитель, и
f) при желании форполимеризация для получающейся в результате системы катализатора, нанесенного на носитель, при использовании одного или нескольких олефиновых мономеров (мономера) до получения системы форполимеризованного катализатора, нанесенного на носитель.
Предпочтительные растворители при получении смеси металлоцен/сокатализатор представляют собой углеводороды и углеводородные смеси, которые являются жидкими при выбранной температуре реакции и в которых предпочтительно растворяются индивидуальные компоненты. Однако растворимость индивидуальных компонентов не является непременным условием до тех пор, пока будет обеспечена растворимость в выбранном растворителе продукта реакции между металлоценовым и сокатализаторным компонентами. Подходящими растворителями являются алканы, такие как пентан, изопентан, гексан, изогексан, гептан, октан и нонан, циклоалканы, такие как циклопентан и циклогексан, и ароматика, такая как бензол, толуол, этилбензол и диэтилбензол. В частности, очень большое предпочтение отдается толуолу, гептану и этилбензолу.
Для предварительной активации металлоцен в форме твердого вещества растворяют в растворе сокатализатора в подходящем растворителе. Металлоцен также может быть отдельно растворен в подходящем растворителе, а после этого данный раствор объединен с раствором сокатализатора. Предпочтение отдается использованию толуола. Время предварительной активации находится в диапазоне от 1 минуты до 200 часов. Предварительная активация может проходить при комнатной температуре 25°С. В отдельных случаях использование повышенных температур может уменьшить требуемое время предварительной активации и обеспечить дополнительное увеличение активности. В данном случае повышенные температуры относятся к диапазону от 25°С до 100°С.
После этого предварительно активированный раствор или смесь металлоцен/сокатализатор объединяют с инертным материалом носителя, обычно силикагелем, который имеет форму сухого порошка или суспензии в одном из вышеупомянутых растворителей. Материал носителя предпочтительно используют в виде порошка. Либо предварительно активированный раствор комбинации металлоцен/сокатализатор или смесь металлоцен/сокатализатор могут быть добавлены к первоначально загруженному материалу носителя, либо материал носителя может быть введен в первоначально загруженный раствор.
Объем предварительно активированного раствора или смеси металлоцен/сокатализатор может превышать 100% от совокупного объема пор использованного материала носителя или же доходить вплоть до 100% от совокупного объема пор.
Температура, при которой предварительно активированный раствор или смесь металлоцен/сокатализатор вводят в контакт с материалом носителя, может варьироваться в диапазоне от 0°С до 100°С. Однако возможными также являются и более низкие или более высокие температуры.
Во время удаления растворителя из системы катализатора, нанесенного на носитель, полностью или в основном смесь может быть перемешана и при желании также нагрета. Предпочтительно удаляют как видимую часть растворителя, так и его часть, находящуюся в порах материала носителя. Удаление растворителя может быть проведено обычным образом при использовании пониженного давления и/или при продувке инертным газом. Во время процесса высушивания смесь может быть нагрета вплоть до удаления свободного растворителя, на что обычно затрачивается от 1 до 3 часов при предпочтительной температуре в диапазоне от 30°С до 60°С. Свободный растворитель представляет собой видимую часть растворителя в смеси. Для целей настоящего изобретения остаточным растворителем является часть, находящаяся в порах.
В качестве альтернативного варианта полному удалению растворителя система катализатора, нанесенного на носитель, также может быть высушена вплоть до оставления только определенного уровня содержания остаточного растворителя, при этом свободный растворитель удаляется полностью. После этого система катализатора, нанесенного на носитель, может быть промыта низкокипящим углеводородом, таким как пентан или гексан, и опять высушена.
Система катализатора, нанесенного на носитель, полученная в соответствии с настоящим изобретением, может быть либо использована непосредственно для полимеризации олефинов, либо перед использованием в способе полимеризации подвергнута форполимеризации при использовании одного или нескольких олефиновых мономеров с применением или без применения водорода в качестве регулятора степени полимеризации. Методика форполимеризации для систем катализаторов, нанесенных на носитель, описывается в документе WO 94/28034.
В качестве добавки во время или после получения системы катализатора, нанесенного на носитель, может быть добавлено небольшое количество олефина, предпочтительно альфа-олефина, такого как стирол или фенилдиметилвинилсилан, в качестве компонента, увеличивающего активность, или антистатика, как это описывается в публикации U. S. Ser. No. 08/365280. Молярное соотношение между добавкой и металлоценовым компонентом, описывающимся формулами 1 или 1а, предпочтительно находится в диапазоне от 1:1000 до 1000:1, в частности очень предпочтительно от 1:20 до 20:1.
Настоящее изобретение также предлагает способ получения полиолефина в результате полимеризации одного или нескольких олефинов в присутствии системы катализатора настоящего изобретения, содержащей, по меньшей мере, один компонент на основе переходного металла, описывающийся формулами 1 или 1а. Для целей настоящего изобретения термин полимеризация относится как к гомополимеризации, так и к сополимеризации, а термин сополимеризация включает терполимеризацию или сополимеризацию более чем трех различных мономеров.
Предпочтение отдается полимеризации олефинов формулы Rm-CH=CH-Rn, где Rm и Rn являются идентичными или различными и каждый из них представляет собой атом водорода или радикал, содержащий от 1 до 20 атомов углерода, в частности от 1 до 10 атомов углерода, и Rm и Rn совместно с соединяющими их атомами могут формировать одно или несколько колец.
Подходящими олефинами являются 1-олефины, например этен, пропен, 1-бутен, 1-пентен, 1-гексен, 4-метил-1-пентен или 1-октен, стирол, диены, такие как 1,3-бутадиен, 1,4-гексадиен, винилнорборнен, норборнадиен, этилнорборнадиен, и циклические олефины, такие как норборнен, тетрациклододецен или метилнорборнен. В способе настоящего изобретения предпочтение отдается гомополимеризации пропена или этена или сополимеризации пропена с этеном и/или одним или несколькими 1-олефинами, содержащими от 4 до 20 атомов углерода, например 1-бутеном или гексеном, и/или одним или несколькими диенами, содержащими от 4 до 20 атомов углерода, например 1,4-бутадиеном, норборнадиеном, этилиденнорборненом или этилнорборнадиеном. Очень хорошо подходящими для использования сополимерами являются сополимеры этен-пропен, сополимеры пропен-1-пентен и терполимеры этен-пропен-1-бутен, этен-пропен-1-пентен или этен-пропен-1,4-гексадиен.
Полимеризацию проводят при температуре в диапазоне от -60°С до 300°С, предпочтительно от 50°С до 200°С, в частности очень предпочтительно от 50°С до 95°С. Давление находится в диапазоне от 0,5 до 2000 бар, предпочтительно от 5 до 100 бар.
Полимеризация может быть проведена в растворе, в массе, в суспензии или в газовой фазе, непрерывно или периодически, в одну или несколько стадий. В порядке примера в более чем одну стадию предпочтительно получают ударопрочные сополимеры. У такого полимера получения уровня содержания гомополимера или статистического сополимера можно добиваться на первой стадии (стадиях), а получения уровня содержания сополимерного каучука можно добиваться на последующей стадии (стадиях).
Система катализатора, нанесенного на носитель, полученная в соответствии с настоящим изобретением, может быть использована в качестве единственного компонента катализатора полимеризации олефинов или предпочтительно в комбинации, по меньшей мере, с одним алкильным соединением элементов из основных групп от I до III периодической таблицы, например с алюминийалкилом, магнийалкилом, или литийалкилом, или алюмоксаном. Алкильное соединение добавляют к мономеру или суспензионной среде и используют для освобождения мономера от веществ, которые могут ухудшить каталитическую активность. Количество добавленного алкильного соединения зависит от качества использующихся мономеров.
Для получения олефиновых полимеров, характеризующихся широким или бимодальным молекулярно-массовым распределением или широким или бимодальным диапазоном плавления, рекомендуется использовать систему катализатора, содержащую два и более различных металлоцена и/или два и более различных сокатализатора. В альтернативном варианте две и более различные системы катализаторов настоящего изобретения могут быть использованы в виде смеси.
В качестве регулятора степени полимеризации и/или для увеличения активности при необходимости добавляют водород.
Система катализатора в полимеризационную систему может быть подана в виде твердого вещества или в форме пасты или суспензии в углеводороде или может быть подвергнута обработке инертными компонентами, такими как парафины, масла или воска, для обеспечения лучшего дозирования. В случае необходимости дозирования системы катализатора в реактор совместно с полимеризуемым мономером или полимеризуемой смесью мономеров смесительную установку и линию дозирования предпочтительно будут охлаждать.
Кроме того, в способе настоящего изобретения может быть использована добавка, такая как антистатик или спирт, например, для улучшения морфологии частиц олефинового полимера. В общем случае могут быть использованы все антистатики, которые являются подходящими для использования в способах полимеризации олефинов. Антистатик предпочитается дозировать непосредственно в полимеризационную систему либо совместно с использующейся системой катализатора, либо отдельно от нее.
Полимеры, полученные при использовании систем катализаторов настоящего изобретения, характеризуются однородной морфологией частиц и не содержат каких-либо частиц мелких фракций. При полимеризации с использованием системы катализатора настоящего изобретения не получают каких-либо агломератов или отложений.
Системы катализаторов настоящего изобретения приводят к получению полимеров, таких как полипропилен, имеющий высокую молекулярную массу, и покрывают широкий диапазон стереоспецифичности и региоспецифичности.
Сополимеры, которые могут быть получены при использовании системы катализатора на основе металлоценов, описывающихся формулами 1 или 1а настоящего изобретения, имеют значительно более высокую молярную массу в сопоставлении с тем, что имело место на предшествующем уровне техники. В то же самое время при использовании системы катализатора настоящего изобретения такие сополимеры могут быть получены при высокой производительности и при соответствующих требованиям промышленности технологических параметрах без образования отложений.
Полимеры, полученные по способу настоящего изобретения, являются подходящими для использования, в частности, при получении продуктов, таких как волокна, элементарные нити, детали, сформованные по способу литьевого формования, пленки, листы, пробки, крышки, бутылки или большие пустотелые тела, такие как трубы, обладающие превосходными свойствами.
ПРИМЕРЫ
Общие методики
Получение и переработку металлоорганических соединений проводили в атмосфере аргона при использовании методик Шленка или в скафандре. Все растворители продували аргоном и перед использованием высушивали над молекулярными ситами.
Полученные металлоцены характеризовали по методу спектроскопии 1Н-ЯМР при использовании спектрометра Bruker DMX 500, работающего при 500 МГц, с использованием в качестве растворителя CDCl3.
Полученные полимеры характеризовали по методам 1Н-ЯМР, 13С-ЯМР, ДСК, ГПХ, ЭФПТ/АЭФПТ, скорости течения расплава и ИК-спектроскопии.
1. Гельпроникающая хроматография (ГПХ), определение значений Mw и Mw/Mn
Для определения данных по молярной массе образцов использовали прибор Waters Alliance/GPCV2000, оборудованный рефрактометром, трехкапиллярным поточным вискозиметром (Waters Corporation, 34 Maple Street, Milford, Massachusetts, 01757 USA) и детектором светорассеяния PD 2040 (Precision Detectors Inc., 34 Williams Way, Bellingham, MA, USA). Растворы образцов в 1,2,4-трихлорбензоле с концентрацией 0,05% (мас.) анализировали при температуре 145°С с использованием колонки, определяющей качество светорассеяния, Mixed B (Polymer Labs 1110-6100LS) и защитной колонки Mixed B (Polymer Labs 1110-1120). Среднемассовую молярную массу (Mw) и соотношение между среднемассовой молярной массой и среднечисленной молярной массой (Mw/Mn) рассчитывали при использовании методики Cumulative Matching % Broad Standard, которая доступна в модуле программного обеспечения Waters Millenium 3.2 GPC.
2. Спектроскопия ЯМР
Образцы получали в результате отвешивания 0,32 г полимера в 2,5 мл смеси 1,2,4-трихлорбензол/дейтеробензол-d6 (4:1 (об.)). Образцы нагревали до 125°С и перемешивали вплоть до получения гомогенного раствора (обычно 1-4 часа). Спектры получали при 120°С на приборе Varian Inova 500 (Varian Inc., 3120 Hansen Way, Palo Alto, CA, 94304, USA), работающем при частоте 13С-спектрометра 125,7 МГц и использующем зонд в 10 мм. Спектры получали при использовании 5000 сканирований с применением π/2-импульса в 10,0 мкс, задержки повторного цикла 10,0 с и времени сбора данных 2,5 с. Для повышения соотношения «сигнал-шум» вследствие влияния ядерного эффекта Оверхаузера на всей последовательности импульсов сохраняли развязку Waltz-16. Спектры обрабатывали при уширении линий в 1 Гц. В качестве внутреннего эталона химического сдвига использовали пик mmmm в метильной области спектра, который определили в положении 21,85 м. д.
3. Дифференциальная сканирующая калориметрия (ДСК), определение температуры плавления полимера Tm
Измерения по методу ДСК проводили при использовании прибора Mettler Toledo DSC 822e (Mettler-Toledo Inc., 1900 Polaris Parkway, Columbus, OH, 43240, USA). В стандартную алюминиевую кювету отвешивали 4 мг образца и реализовали воздействие следующего температурного режима.
Образцы нагревали от комнатной температуры до 220°С при скорости нагревания 20°С/мин, выдерживали при данной температуре в течение 5 мин, после этого охлаждали до -55°С при скорости охлаждения 20°С/мин, выдерживали при той же самой температуре в течение 5 мин, затем нагревали до 220°С при скорости нагревания 20°С/мин. Температуру плавления определяли по второму проходу нагревания как температуру, при которой на кривой наблюдали основной пик.
Аналитическое ЭФПТ (АЭФПТ)
Эксперимент по ЭФПТ (элюционному фракционированию при повышении температуры) проводят в системе ЭФПТ, сконструированной из модифицированного прибора Waters 2000CV (Waters Corporation, 34 Maple Street, Milford, MA, 01757 USA). Прибор 2000CV выдерживают при 140°С при перепускании растворителя о-дихлорбензола (ОДХБ) со скоростью течения 1 мл/мин. Для обнаружения полиолефиновых фракций, элюирующихся из колонки ЭФПТ, система использует обогреваемый инфракрасный детектор IR4 (PolymerChar Company, Valencia Technology Park, P. O. Box 176, Valencia, VA, E-46980, PATERNA, Spain). Для охлаждения и нагревания колонки ЭФПТ система использует программируемую по температуре масляную баню HAAKE Phoenix II (Thermo Electron Corporation, 401 Millcreek Road, Marietta, OH 45750, USA). Разделительной колонкой ЭФПТ является колонка из нержавеющей стали длиной 100 мм и диаметром 0,75 мм, заполненная 20-микрометровыми сшитыми полистирольными гранулами. Данную колонку ЭФПТ перед проведением анализа образцов выдерживают при температуре 140°С в масляной бане. Образцы полимеров при 140°С растворяют в растворителе ОДХБ с концентрацией 2 мг/мл. Один мл образца для испытаний в виде получающегося в результате раствора ОДХБ вводят в колонку ЭФПТ при использовании системы автоматического введения прибора Waters 2000CV со скоростью течения ОДХБ, выставленной на 1 мл/мин. После введения образца поток ОДХБ от колонки ЭФПТ отводят. Во время выдерживания образца внутри колонки колонке дают возможность охладиться в масляной бане от 140°С до 0°С при скорости охлаждения 1,5°С/мин. На данной стадии охлаждения молекулы полимеров в образце для испытаний осаждаются на гранулы набивки в колонке ЭФПТ. При нахождении колонки все еще при температуре 0°С в колонку ЭФПТ на 2 минуты повторно вводят поток горячего ОДХБ при 1 мл/мин для элюирования из полимерного образца растворимой фракции и проводят детектирование при использовании ИК-детектора, выставленного на длину волны 3,4 микрометра. После этого температуру увеличивают при скорости нагревания 2°С/мин с одновременным выдерживанием потока ОДХБ через колонку ЭФПТ на уровне 1 мл/мин для элюирования более высокоплавких полимерных фракций, которые в поточном режиме детектируют при использовании детектора IR4.
5. Скорость течения расплава (СТР)
Значение СТР для образцов определяли в соответствии с документом ISO 1133 при 230°С. Использовали две различные загрузки: 2,16 кг и 5 кг. Значения СТР приводят в виде величин СТР(230/2,16) и СТР(230/5) соответственно.
6. Производительность
Производительность катализатора определяют в результате деления полученной массы полипропилена на массу использующегося катализатора и время реакции.
7. Выход
Выход для образца определяют в результате деления выделенного количества требуемого продукта на теоретически достижимое количество продукта.
Используют следующие далее сокращения:
ПП = полипропилен
МЦ = металлоцен
Кат = система катализатора, нанесенного на носитель
ч = час
Tg = температура стеклования в °С, определяют по методу дифференциальной сканирующей калориметрии (ДСК, условия смотрите ранее)
Синтез металлоценов:
Пример 1:
Диметилсиландиилбис(2-(циклогексилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
(2-бромэтил)циклогексан
В круглодонную колбу объемом 1 л, снабженную дефлегматором, при охлаждении в бане со льдом к 88,7 г (0,693 моль) 2-циклогексилэтанола последовательно добавляли 164 г концентрированной серной кислоты и 200 г бромистоводородной кислоты (48% в воде). Смесь выдерживали при кипячении в течение 6 ч и после охлаждения до комнатной температуры вводили к 400 г льда. Водную фазу экстрагировали при использовании 400 мл пентана. Органический слой промывали раствором NaOH с концентрацией 2 моль/л и водой, высушивали над сульфатом магния и в вакууме удаляли растворитель. Продукт перегоняли в вакууме до получения 112,7 г (85%) (2-бромэтил)циклогексана в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3): δ=3,40 (2Н, т, CH 2Br), 1,73-1,61 (м, 7Н), 1,44 (м, 1Н), 1,26-1,11 (м, 3Н), 0,92-0,84 (м, 2Н), м. д.
1-(2-хлорфенил)-3-циклогексилпропан-1-он
В круглодонную колбу объемом 1 л, снабженную капельной воронкой и дефлегматором, помещали 15,57 г (640 ммоль) магниевой стружки и добавляли 50 мл ТГФ. Магний слегка подвергали травлению несколькими кристаллами иода, а после этого добавляли 2 г (2-бромэтил)циклогексана, и смесь подвергалась локальному разогреванию. После начала образования реактива Гриньяра в течение периода времени 20 мин добавляли остаток (2-бромэтил)циклогексана в 350 мл ТГФ (112,65 г в совокупности, 589 ммоль). Смесь выдерживали при кипячении в течение 1,5 ч, а после этого охлаждали до комнатной температуры. В отдельной круглодонной колбе объемом 2 л в 130 мл ТГФ растворяли 70,5 г (513 ммоль) 2-хлорбензонитрила и 156 мг (0,16% моль) иодида меди (I). В течение периода времени 30 мин по каплям добавляли раствор реактива Гриньяра и реакционную смесь выдерживали при кипячении в течение 3 ч. После выдерживания в течение ночи при комнатной температуре очень осторожно добавляли смесь 190 мл воды и 127 мл концентрированной соляной кислоты, вызывая прохождение сильно экзотермической реакции. Смесь перемешивали при 50°С в течение 1 ч и слои разделяли. Водный слой два раза экстрагировали каждый раз при использовании 150 мл толуола. Объединенные органические слои промывали два раза серной кислотой с концентрацией 2 моль/л, один раз насыщенным раствором бикарбоната натрия и один раз насыщенным раствором хлорида натрия. После высушивания над сульфатом магния растворитель выпаривали в вакууме до получения 133,5 г (количественно) требуемого фенона в виде масла светло-коричневого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,41-7,14 (м, 4Н, ароматика), 2,91 (т, 2Н, СОСН 2), 1,71-1,55, 1,28-1,10, 0,93-0,85 (3 × м, 13Н), м. д.
7-хлор-2-циклогексилметилиндан-1-он
В круглодонную колбу объемом 500 мл помещали 66 г (263 ммоль) 1-(2-хлорфенил)-3-циклогексилпропан-1-она, 77,5 г (2,1 экв.) уротропина и 72,6 г (2,7 экв.) уксусного ангидрида и смесь в течение 4 ч перемешивали при 80°С. После этого добавляли 100 мл воды и 100 мл раствора NaOH с концентрацией 2 моль/л и смесь экстрагировали два раза каждый раз при использовании 200 мл дихлорметана. Органический слой промывали два раза при использовании 100 мл насыщенного водного раствора хлорида аммония и высушивали над сульфатом магния. Количество растворителя уменьшали в вакууме до получения в совокупности объема 150 мл и раствор в течение периода времени 2,5 ч по каплям добавляли к 660 г горячей (70-75°С) концентрированной серной кислоты. После перемешивания еще в течение 30 мин при 75°С смеси давали возможность отстояться при комнатной температуре в течение ночи. Смесь вводили к приблизительно 500 г льда и экстрагировали три раза каждый раз при использовании 150 мл дихлорметана. Органический слой промывали два раза при использовании 150 мл насыщенного раствора бикарбоната натрия и один раз при использовании 100 мл насыщенного раствора хлорида натрия. После высушивания над сульфатом магния растворитель удаляли в вакууме. Продукт очищали по методу колоночной хроматографии на диоксиде кремния (гептан/дихлорметан 5:1) до получения 40,0 г (61%) требуемого продукта в виде масла слегка беловатого цвета, которое медленно кристаллизовалось. 1Н-ЯМР (400 МГц, CDCl3): δ=7,42 (т, 1Н, ароматика), 7,29 (д, 1Н, ароматика), 7,24 (д, 1Н, ароматика), 3,25 (дд, 1Н, СОСН), 2,71 (м, 2Н, бензил), 1,78-0,87 (м, 13Н, алифатика), м. д.
7-(4'-трет-бутилфенил)-2-циклогексилметилиндан-1-он
В круглодонную колбу объемом 2 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 60 г (228 ммоль) 7-хлор-2-циклогексилметилиндан-1-она, 49 г (1,2 экв.) 4-трет-бутилбензолбороновой кислоты, 53 г карбоната натрия, 750 мл этиленгликоля и 150 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 103 мг (0,2% (моль)) ацетата палладия, 3 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 2 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 4 ч). Добавляли 300 мл воды и смесь экстрагировали три раза каждый раз при использовании 150 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 87,2 г (количественно) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,54 (т, 1Н, ароматика), 7,43, 7,38 (2×д, 4Н, ароматика), 7,24 (м, 2Н, ароматика), 3,30 (м, 1Н, СОСН), 2,80-2,67 (3 × м, 2Н, бензил), 1,85-1,47 (м, 7Н, алифатика), 1,35 (с, 9Н, С(СН3)3), 1,27-0,87 (м, 6Н, алифатика), м. д.
7-(4'-трет-бутилфенил)-2-циклогексилметил-1Н-инден
В круглодонной колбе объемом 1 л, снабженной дефлегматором, в 292 мл толуола растворяли 82,3 г (229 ммоль) 7-(4'-трет-бутилфенил)-2-циклогексилметилиндан-1-она. Добавляли 9,5 г (1,1 экв.) боргидрида натрия. После этого при 50°С добавляли 40 мл (4,3 экв.) метанола и смесь в течение 3 ч перемешивали при 50°С. Добавляли дополнительный 1 г боргидрида натрия и 5 мл метанола и смесь еще в течение 2 ч перемешивали при 50°С. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 350 мл толуола растворяли «сырой» инданол. После добавления 0,7 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния, выпаривание растворителя и кристаллизация из 800 мл этанола приводили к получению 67,3 г (86%) требуемого индена в виде кристаллов белого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,45, 7,33, 7,25, 7,14 (4 × м, 7Н, ароматика), 6,69 (с, 1Н, =СН), 3,35 (с, 2Н, бензил), 2,34 (д, 2Н, алифатика), 1,71-1,50 (м, 6Н, алифатика), 1,39 (с, 9Н, С(СН 3)3), 1,24-0,87 (м, 5Н, алифатика), м. д.
Диметилсиландиилбис(2-(циклогексилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
В круглодонной колбе объемом 1000 мл в 340 мл толуола и 20 мл ТГФ растворяли 20 г (58 ммоль) 7-(4'-трет-бутилфенил)-2-циклогексилметил-1Н-индена. При комнатной температуре добавляли 24,4 мл н-бутиллития (2,6 моль/л в толуоле, 63,4 ммоль, 1,1 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 3,5 мл (3,74 г, 29 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 8,5 ч перемешивали при 60°С. Смесь растворителей удаляли в вакууме (в соответствии с анализом по методу ГХ степень чистоты лиганда > 99%) и лиганд растворяли в 200 мл диэтилового эфира (желтоватая суспензия вследствие присутствия LiCl). При комнатной температуре добавляли 23,8 мл н-бутиллития (61,9 ммоль, 1,07 экв. по отношению к «индену», 2,6 моль/л в толуоле) и смесь в течение ночи перемешивали при комнатной температуре. После этого порционно добавляли 7,1 г (30,5 ммоль, 0,525 экв. по отношению к «индену») тетрахлорида циркония. Оранжево-желтую суспензию в течение 5 ч перемешивали при комнатной температуре и в результате фильтрования выделяли твердое вещество. Промывание 2-мя порциями каждая по 30 мл диэтилового эфира и высушивание в вакууме приводило к получению 22,7 г «сырого» комплекса (рац/мезо = 1,5:1, при содержании хлорида лития). В результате фракционной кристаллизации из толуола выделяли рацемический комплекс. Выход: 8,1 г (9 ммоль, 31%) в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,61 (д, 2Н, ароматика), 7,57, 7,44 (2×д, 8Н, ароматика), 7,36 (д, 2Н, ароматика), 7,22, 7,15, 7,07 (3×м, 10Н, ароматика + толуол), 6,94 (с, 2Н, инденил-Н), 2,64 («дд», 2Н, инденил-СН2), 2,34 (с, толуол), 2,13 («дд», 2Н, инденил-СН2), 1,75-1,45 (м, 10Н, алифатика), 1,33 (с, 18Н, С(СН3)3), 1,31 (с, 6Н, Si(СН3)2), 1,12-0,76 (м, 12Н, алифатика), м. д.
Пример 2
Диметилсиландиилбис(2-(циклогексилметил)-4-(1-нафтил)-1-инденил)цирконийдихлорид
7-(1-нафтил)-2-циклогексилметилиндан-1-он
В круглодонную колбу объемом 1 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 18,5 г (70,4 ммоль) 7-хлор-2-циклогексилметилиндан-1-она, 14,5 г (1,2 экв.) нафтилбороновой кислоты, 16,4 г карбоната натрия, 230 мл этиленгликоля и 45 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 32 мг (0,2% (моль)) ацетата палладия, 0,94 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 3 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 5 ч). Добавляли 100 мл воды и смесь экстрагировали три раза каждый раз при использовании 100 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 24 г (96%) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,86 (д, 2Н, ароматика), 7,63 (м, 1Н, ароматика), 7,52 (м, 2Н, ароматика), 7,43 (м, 2Н, ароматика), 7,33 (м, 3Н, ароматика), 2,39 (м, 1Н, (С=О)СН), 2,85, 2,67 (2×м, 2Н, бензил), 1,90-0,80 (м, 13Н, алифатика), м. д.
7-(1-нафтил)-2-циклогексилметил-1Н-инден
В круглодонной колбе объемом 500 мл, снабженной дефлегматором, в 85 мл толуола растворяли 24 г (68 ммоль) 7-(1-нафтил)-2-циклогексилметилиндан-1-она. Добавляли 2,82 г (1,1 экв.) боргидрида натрия. После этого при 50°С добавляли 11,8 мл (4,3 экв.) метанола и смесь в течение 5 ч перемешивали при 50°С. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 250 мл толуола растворяли «сырой» инданол. После добавления 0,5 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя приводили к получению 21,65 г (95%) требуемого индена в виде масла слегка беловатого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,88 (м, 2Н, ароматика), 7,73 (д, 1Н, ароматика), 7,55-7,19 (м, 7Н, ароматика), 6,10 (с, 1Н, С=СН), 3,40 (с, 2Н, бензил), 2,25 (д, 2Н, СН 2Су), 1,67-0,80 (м, 11Н, алифатика), м. д.
Диметилсиландиилбис(2-(циклогексилметил)-4-(1-нафтил)-1-инденил)цирконийдихлорид
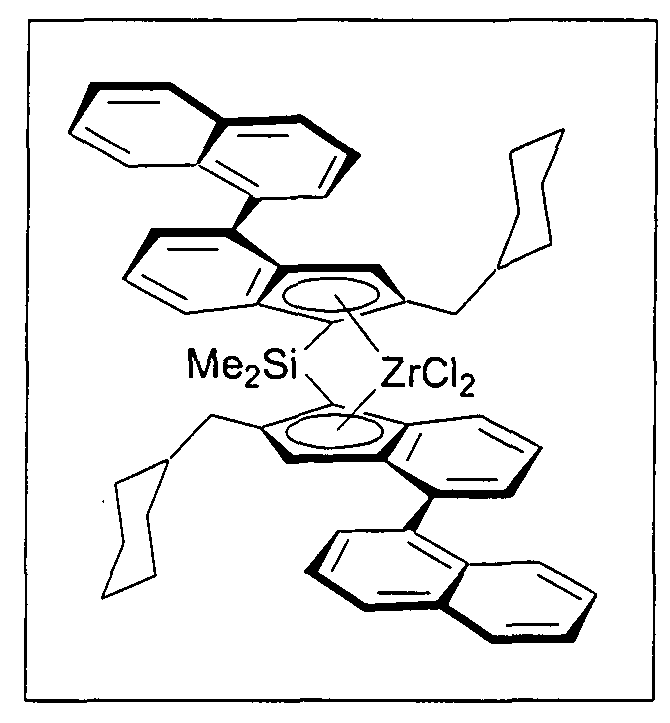
В круглодонной колбе объемом 500 мл в 170 мл толуола и 10 мл ТГФ растворяли 10 г (30 ммоль) 7-(1-нафтил)-2-циклогексилметил-1Н-индена. При комнатной температуре добавляли 12,4 мл н-бутиллития (2,6 моль/л в толуоле, 31 ммоль, 1,05 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 1,91 г (15 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 22 ч перемешивали при 60°С. Смесь растворителей удаляли в вакууме и лиганд растворяли в 100 мл диэтилового эфира. При комнатной температуре добавляли 12,4 мл н-бутиллития (2,6 моль/л в толуоле, 31 ммоль, 1,05 экв.) и смесь в течение ночи перемешивали при комнатной температуре. После этого порционно добавляли 3,65 г (15,6 ммоль, 0,52 экв. по отношению к «индену») тетрахлорида циркония. Суспензию оранжево-желтого цвета в течение 6 ч перемешивали при комнатной температуре и в результате фильтрования выделяли твердое вещество. Промывание 2-мя порциями каждая по 30 мл диэтилового эфира и высушивание в вакууме приводило к получению 11,3 «сырого» комплекса (рац/мезо = 1,7:1, при содержании хлорида лития). В результате фракционной кристаллизации из толуола выделяли рацемический комплекс. Выход: 2,77 г (3 ммоль, 21%) в виде порошка ярко-оранжевого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,85 (м, 4Н, ароматика), 7,71 (м, 4Н, ароматика), 7,51 (м, 4Н, ароматика), 7,43-7,10 (4×м, 8Н, ароматика), 6,40 (с, 2Н, инденил-СН), 2,67, 2,03 (2×м, 4Н, СН2Су), 1,65-0,68 (м, 28Н, алифатика + Si(СН3)2), м. д.
Пример 3:
Диметилсиландиилбис(2-(циклогексилметил)-4-(4'-метилфенил)-1-инденил)цирконийдихлорид
7-(4'-метилфенил)-2-циклогексилметилиндан-1-он
В круглодонную колбу объемом 1 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 24,16 г (91,9 ммоль) 7-хлор-2-циклогексилметилиндан-1-она, 15,0 г (1,2 экв.) 4-метилфенилбороновой кислоты, 19,49 г карбоната натрия, 303 мл этиленгликоля и 57 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 41 мг (0,2% (моль)) ацетата палладия, 1,2 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 2 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 8 ч). Добавляли 100 мл воды и смесь экстрагировали три раза каждый раз при использовании 100 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 30,57 г (количественно) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,60-7,19 (м, 7Н, ароматика), 3,31 (м, 1Н, (С=О)СН), 2,91-2,61 (м, 2Н, бензил), 2,38 (с, 3Н, Ph-СН3), 1,80-0,85 (м, 10Н, алифатика), м. д.
7-(4'-метилфенил)-2-циклогексилметил-1Н-инден
В круглодонной колбе объемом 500 мл, снабженной дефлегматором, в 89 мл толуола растворяли 30,5 г (95,7 ммоль) 7-(4'-метилфенил)-2-циклогексилметилиндан-1-она. Добавляли 3,62 г (1,0 экв.) боргидрида натрия. После этого при 50°С добавляли 17,9 мл (4,35 экв.) метанола и смесь в течение 8 ч перемешивали при 50°С. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 200 мл толуола растворяли «сырой» инданол. После добавления 0,4 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя приводили к получению 29 г (количественно) требуемого индена в виде масла слегка беловатого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,42-7,14 (м, 7Н, ароматика), 6,66 (с, 1Н, С=СН), 3,36 (с, 2Н, бензил), 2,41 (с, 3Н, PhCH3), 2,35 (д, 2Н, СН2Су), 1,70-0,83 (м, 11Н, алифатика), м. д.
Диметилсиландиилбис(2-(циклогексилметил)-4-(4'-метилфенил)-1-инденил)цирконийдихлорид
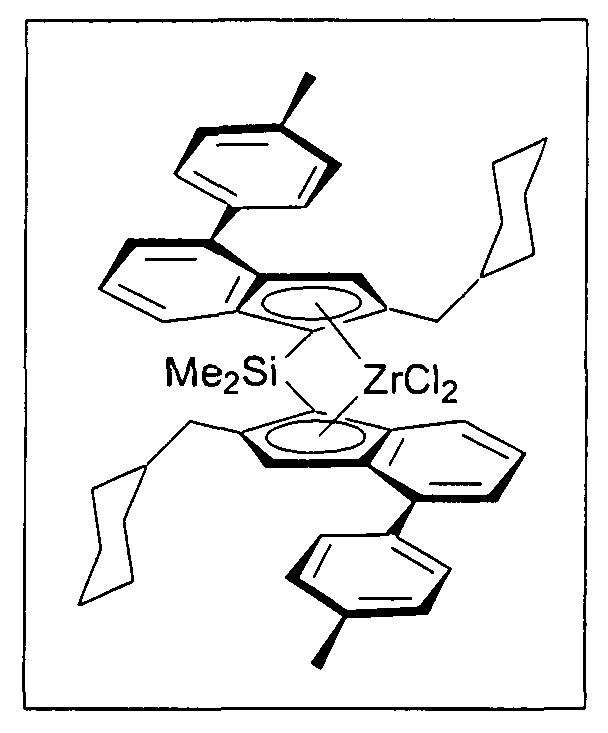
В круглодонной колбе объемом 250 мл в 97 мл толуола и 5,7 мл ТГФ растворяли 5 г (16,5 ммоль) 7-(4'-метилфенил)-2-циклогексилметил-1Н-индена. При комнатной температуре добавляли 6,9 мл н-бутиллития (2,5 моль/л в толуоле, 17,4 ммоль, 1,05 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 1,0 мл (8,3 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 6 ч перемешивали при 60°С. Смесь растворителей удаляли в вакууме и лиганд растворяли в 55 мл диэтилового эфира. При комнатной температуре добавляли 6,6 мл н-бутиллития (2,5 моль/л в толуоле, 16,5 ммоль, 1,0 экв.) и смесь в течение ночи перемешивали при комнатной температуре. После этого порционно добавляли 1,93 г (8,3 ммоль, 0,5 экв. по отношению к «индену») тетрахлорида циркония. Суспензию оранжево-желтого цвета в течение 3 ч перемешивали при комнатной температуре и в результате фильтрования выделяли твердое вещество. Промывание 2-мя порциями каждая по 30 мл диэтилового эфира и высушивание в вакууме приводило к получению 4,24 «сырого» комплекса (рац/мезо = 1,8:1, при содержании хлорида лития). В результате фракционной кристаллизации из толуола выделяли рацемический комплекс. Выход: 0,76 г (0,9 ммоль, 11%) в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,61 (д, 2Н, ароматика), 7,52 (д, 4Н, ароматика), 7,35 (д, 2Н, ароматика), 7,27-7,06 (м, 6Н, ароматика), 6,89 (с, 2Н, инденил-СН), 2,64, 2,11 (2×м, 4Н, СН2Су), 2,36 (с, 6Н, PhCH3), 1,66-0,73 (м, 28Н, алифатика + Si(СН3)2), м. д.
Пример 4:
Диметилсиландиилбис(2-(циклогексилметил)-4-(3',5'-диметилфенил)-1-инденил)цирконийдихлорид
7-(3',5'-диметилфенил)-2-циклогексилметилиндан-1-он
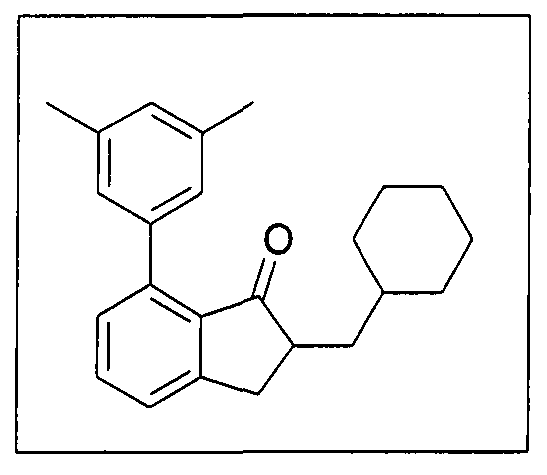
В круглодонную колбу объемом 1 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 20 г (76 ммоль) 7-хлор-2-циклогексилметилиндан-1-она, 13,7 г (1,2 экв.) 2,3-диметилфенилбороновой кислоты, 17,75 г карбоната натрия, 250 мл этиленгликоля и 50 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 34 мг (0,2% (моль)) ацетата палладия, 1 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 2 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 4 ч). Добавляли 100 мл воды и смесь экстрагировали три раза каждый раз при использовании 100 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 27,7 г (количественно) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,55 (т, 1Н, ароматика), 7,39 (д, 1Н, ароматика), 7,28-7,02 (м, 3Н, ароматика), 3,34 (м, 1Н, (С=О)СН), 2,81-2,69 (м, 2Н, бензил), 2,37 (с, 6Н, Ph-СН3), 1,89-0,89 (м, 10Н, алифатика), м. д.
7-(3',5'-диметилфенил)-2-циклогексилметил-1Н-инден
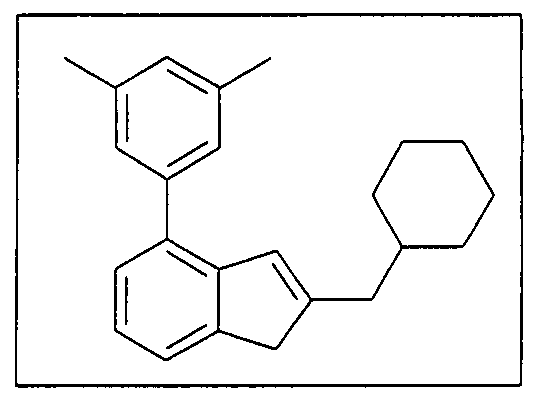
В круглодонной колбе объемом 500 мл, снабженной дефлегматором, в 90 мл толуола растворяли 25,3 г (76,1 ммоль) 7-(3',5'-диметилфенил)-2-циклогексилметилиндан-1-она. Добавляли 3,17 г (1,1 экв.) боргидрида натрия. После этого при 50°С добавляли 13,3 мл (4,35 экв.) метанола и смесь в течение 3 ч перемешивали при 50°С. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 90 мл толуола растворяли «сырой» инданол. После добавления 0,3 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя приводили к получению 22,1 г (92%) требуемого индена в виде масла слегка беловатого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,35 (д, 1Н, ароматика), 7,24 (м, 1Н, ароматика), 7,15 (м, 3Н, ароматика), 7,01 (с, 1Н, ароматика), 6,68 (с, 1Н, С=СН), 3,37 (с, 2Н, бензил), 2,39 (с, 6Н, PhCH3), 2,36 (д, 2Н, СН2Су), 1,74-0,91 (м, 11Н, алифатика), м. д.
Диметилсиландиилбис(2-(циклогексилметил)-4-(3',5'-диметилфенил)-1-инденил)цирконийдихлорид
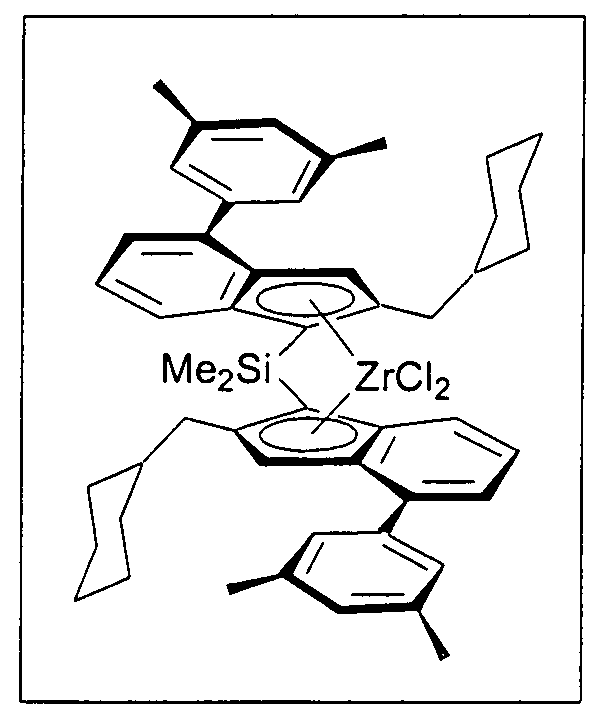
В круглодонной колбе объемом 100 мл в 34 мл толуола и 2 мл ТГФ растворяли 2 г (6,32 ммоль) 7-(3',5'-диметилфенил)-2-циклогексилметил-1Н-индена. При комнатной температуре добавляли 2,65 мл н-бутиллития (2,5 моль/л в толуоле, 6,63 ммоль, 1,05 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 408 мг (3,2 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 18 ч перемешивали при 60°С. После охлаждения до комнатной температуры при комнатной температуре добавляли 2,65 мл н-бутиллития (2,5 моль/л в толуоле, 6,63 ммоль, 1,05 экв.) и смесь в течение 1 ч перемешивали при 80°С. После охлаждения до комнатной температуры порционно добавляли 781 мг (3,35 ммоль, 0,53 экв. по отношению к «индену») тетрахлорида циркония. Оранжево-желтую суспензию в течение 20 ч перемешивали при комнатной температуре и в результате фильтрования на целите удаляли LiCl. Целитовую кювету промывали один раз при использовании 20 мл толуола и растворитель удаляли в вакууме. В результате фракционной кристаллизации из толуола выделяли рацемический комплекс с последующим промыванием диэтиловым эфиром. Выход: 0,20 г (0,24 ммоль, 7,5%) в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,59 (д, 2Н, ароматика), 7,35 (д, 2Н, ароматика), 7,28-6,92 (м, 8Н, ароматика), 6,78 (с, 2Н, инденил-СН), 2,65, 2,15 (2×м, 4Н, СН2Су), 2,38 (с, 12Н, PhCH3), 1,64-0,86 (м, 28Н, алифатика + Si(СН3)2), м. д.
Пример 5:
Диметилсиландиилбис(2-(трет-бутилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
1-бром-3,3-диметилбутан
В круглодонную колбу объемом 1 л, снабженную дефлегматором, при охлаждении в бане со льдом к 100 г (0,98 моль) 3,3-диметил-1-бутанола последовательно добавляли 232 г концентрированной серной кислоты и 283 г бромистоводородной кислоты (48% в воде). Смесь выдерживали при кипячении в течение 6 ч и после охлаждения до комнатной температуры вводили к 400 г льда. Водную фазу экстрагировали при использовании 400 мл пентана. Органический слой промывали раствором NaOH с концентрацией 2 моль/л и водой, высушивали над сульфатом магния и в вакууме удаляли растворитель. Продукт перегоняли в вакууме до получения 88,1 г (55%) 1-бром-3,3-диметилбутана в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3): δ=3,35 (м, 2Н, CH2Br), 1,80 (м, 2Н, СН 2), 0,90 (с, 9Н, трет-Bu), м. д.
1-(2-хлорфенил)-4,4-диметилпентан-1-он
В круглодонную колбу объемом 1 л, снабженную капельной воронкой и дефлегматором, помещали 14,1 г (580 ммоль) магниевой стружки и добавляли 60 мл ТГФ. Магний слегка подвергали травлению несколькими кристаллами иода, а после этого добавляли 2 г 1-бром-3,3-диметилбутана, и смесь подвергалась локальному разогреванию. После начала образования реактива Гриньяра в течение периода времени 20 мин добавляли остаток 1-бром-3,3-диметилбутана в 350 мл ТГФ (88,1 г в совокупности, 533 ммоль). Смесь выдерживали при кипячении в течение 1,5 ч, а после этого охлаждали до комнатной температуры. В отдельной круглодонной колбе объемом 2 л в 265 мл ТГФ растворяли 63,9 г (464 ммоль) 2-хлорбензонитрила и 141 мг (0,16% (моль)) иодида меди (I). В течение периода времени 30 мин по каплям добавляли раствор реактива Гриньяра и реакционную смесь выдерживали при кипячении в течение 3 ч. После выдерживания в течение ночи при комнатной температуре очень осторожно добавляли смесь 190 мл воды и 127 мл концентрированной соляной кислоты, вызывая прохождение сильно экзотермической реакции. Смесь перемешивали при 50°С в течение 1 ч и слои разделяли. Водный слой экстрагировали два раза каждый раз при использовании 150 мл толуола. Объединенные органические слои промывали два раза серной кислотой с концентрацией 2 моль/л, один раз насыщенным раствором бикарбоната натрия и один раз насыщенным раствором хлорида натрия. После высушивания над сульфатом магния растворитель выпаривали в вакууме до получения 103,8 г (количественно) требуемого фенона в виде масла светло-коричневого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,41-7,26 (м, 4Н, ароматика), 2,87 (м, 2Н, СОСН2), 1,59 (м, 2Н, СН2-трет-Bu), 0,90 (с, 9Н, трет-Bu), м. д.
7-хлор-2-(2,2-диметилпропил)индан-1-он
В круглодонную колбу объемом 1000 мл помещали 101,8 г (453 ммоль) 1-(2-хлорфенил)-4,4-диметилпентан-1-она, 133,4 г (2,1 экв.) уротропина и 124,7 г (2,7 экв.) уксусного ангидрида и смесь в течение 4 ч перемешивали при 80°С. После этого добавляли 200 мл воды и 200 мл раствора NaOH с концентрацией 2 моль/л и смесь экстрагировали два раза каждый раз при использовании 250 мл дихлорметана. Органический слой промывали два раза при использовании 150 мл насыщенного водного раствора хлорида аммония и высушивали над сульфатом магния. Количество растворителя уменьшали в вакууме до получения в совокупности объема 250 мл и раствор в течение периода времени 2,5 ч по каплям добавляли к 1000 г горячей (70-75°С) концентрированной серной кислоты. После перемешивания еще в течение 30 мин при 75°С смеси давали возможность отстояться при комнатной температуре в течение ночи. Смесь вводили к приблизительно 800 г льда и ее экстрагировали три раза каждый раз при использовании 250 мл дихлорметана. Органический слой промывали два раза при использовании 250 мл насыщенного раствора бикарбоната натрия и один раз при использовании 200 мл насыщенного раствора хлорида натрия. После высушивания над сульфатом магния растворитель удаляли в вакууме. Продукт очищали по методу колоночной хроматографии на диоксиде кремния (гептан/дихлорметан 1:1) до получения 79,4 г (74%) требуемого продукта в виде масла слегка беловатого цвета, которое медленно кристаллизовалось. 1Н-ЯМР (400 МГц, CDCl3): δ=7,44 (т, 1Н, ароматика), 7,30 (д, 1Н, ароматика), 7,27 (д, 1Н, ароматика), 3,38 (дд, 1Н, СОСН), 2,79, 2,60 (2×м, 2Н, бензил), 2,10, 1,21 (2×м, 1Н, СН2-трет-Bu), 0,90 (с, 9Н, трет-Bu), м. д.
7-(4'-трет-бутилфенил)-2-(2,2-диметилпропил)индан-1-он
В круглодонную колбу объемом 1 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 35 г (148 ммоль) 7-хлор-2-(2,2-диметилпропил)индан-1-она, 31,6 г (1,2 экв.) трет-бутилфенилбороновой кислоты, 34,5 г карбоната натрия, 438 мл этиленгликоля и 88 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 67 мг (0,2% (моль)) ацетата палладия, 1,94 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 2 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 4 ч). Добавляли 100 мл воды и смесь экстрагировали три раза каждый раз при использовании 100 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 58,82 г (количественно) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,58 (т, 1Н, ароматика), 7,48-7,17 (м, 6Н, ароматика), 3,48 (м, 1Н, (С=О)СН), 2,88, 2,63 (2×м, 2Н, бензил), 2,38 (с, 1Н), 2,13 (м, 1Н, СН2-трет-Bu), 1,40 (с, 9Н, Ph-трет-Bu), 1,03 (с, 9Н, СН2-трет-Bu), м. д.
4-(4'-трет-бутилфенил)-2-(2,2-диметилпропил)-1Н-инден
В круглодонной колбе объемом 500 мл, снабженной дефлегматором, в 180 мл толуола растворяли 50 г (150 ммоль) 7-(4'-трет-бутилфенил)-2-(2,2-диметилпропил)индан-1-она. Добавляли 6,22 г (1,1 экв.) боргидрида натрия. После этого при 50°С добавляли 26,1 мл (4,3 экв.) метанола и смесь в течение 4 ч перемешивали при 50°С. Добавляли дополнительные 3,11 г боргидрида натрия и 10,3 г метанола и смесь перемешивали при 50°С в течение ночи. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 300 мл толуола растворяли «сырой» инданол. После добавления 1 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния, выпаривание растворителя и перекристаллизация из 500 мл этанола приводили к получению 35,3 г (74%) требуемого индена в виде кристаллов белого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,47 (с, 4Н, ароматика), 7,34 (д, 1Н, ароматика), 7,25 (д, 1Н, ароматика), 7,16 (т, 1Н, ароматика), 6,72 (с, 1Н, С=СН), 3,44 (с, 2Н, бензил), 2,36 (с, 2Н, СН2-трет-Bu), 1,37 (с, 9Н, Ph-трет-Bu), 0,96 (с, 9Н, СН2-трет-Bu), м. д.
Диметилсиландиилбис(2-(трет-бутилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
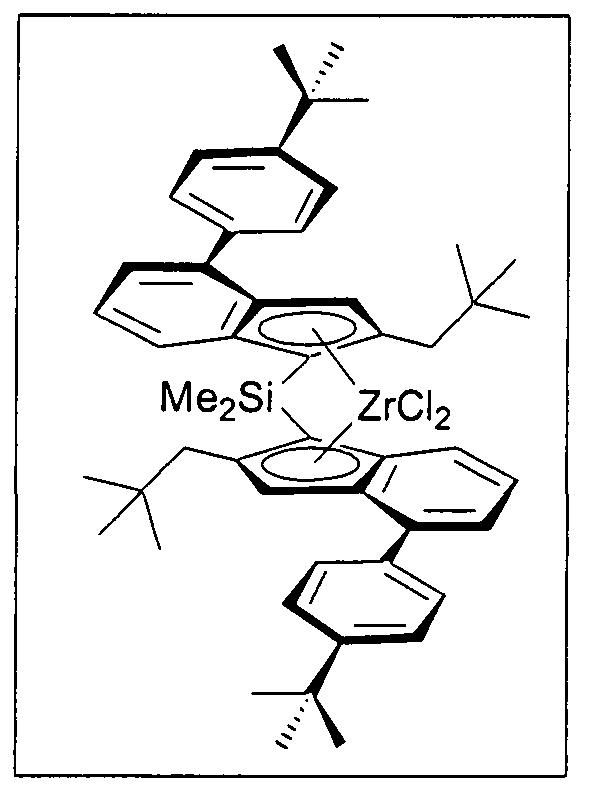
В круглодонной колбе объемом 100 мл в 34 мл толуола и 2 мл ТГФ растворяли 2 г (6,28 ммоль) 4-(4-трет-бутилфенил)-2-(2,2-диметилпропил)-1Н-индена. При комнатной температуре добавляли 2,64 мл н-бутиллития (2,5 моль/л в толуоле, 6,6 ммоль, 1,05 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 405 мг (3,2 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 17 ч перемешивали при 60°С. Растворитель удаляли в вакууме и добавляли 20 мл диэтилового эфира. При комнатной температуре добавляли 2,64 мл н-бутиллития (2,5 моль/л в толуоле, 6,6 ммоль, 1,05 экв.) и смесь в течение ночи перемешивали при комнатной температуре. После охлаждения до комнатной температуры порционно добавляли 776 мг (3,3 ммоль, 0,53 экв. по отношению к «индену») тетрахлорида циркония. Оранжево-желтую суспензию в течение 5 ч перемешивали при комнатной температуре и в результате фильтрования и промывания диэтиловым эфиром выделяли комплекс, получая 1,59 г «сырого» комплекса. В результате фракционной перекристаллизации из толуола выделяли рацемическую форму. Выход: 0,65 г (24%) в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,62 (д, 2Н, ароматика), 7,58, 7,45 (2×д, 8Н, ароматика), 7,37 (д, 2Н, ароматика), 7,23, 7,16, 7,08 (3×м, 10Н, ароматика + толуол), 6,93 (с, 2Н, инденил-Н), 2,64 (д, 2Н, инденил-СН2), 2,34 (с, толуол), 2,15 (д, 2Н, инденил-СН2), 1,35 (с, 6Н, Si(СН3)2), 1,32 (с, 18Н, Ph-трет-Bu), 0,83 (с, 18Н, СН2-трет-Bu), м. д.
Пример 6:
Диметилсиландиилбис(2-(1-адамантилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
1-(2-бромэтил)адамантан
В круглодонную колбу объемом 1 л, снабженную дефлегматором, при охлаждении в бане со льдом к 126,20 г (0,70 моль) 2-(1-адамантил)этанола последовательно добавляли 164 г концентрированной серной кислоты и 200 г бромистоводородной кислоты (48% в воде). Смесь выдерживали при кипячении в течение 6 ч и после охлаждения до комнатной температуры вводили к 400 г льда. Водную фазу экстрагировали при использовании 400 мл пентана. Органический слой промывали раствором NaOH с концентрацией 2 моль/л и водой, высушивали над сульфатом магния и в вакууме удаляли растворитель. Продукт перегоняли в вакууме до получения 153,2 г (90%) 1-(2-бромэтил)адамантана в виде бесцветного масла. 1Н-ЯМР (400 МГц, CDCl3): δ=3,29 (2Н, т, CH2Br), 1,71 (т, 2Н, CCH2CH2Br), 1,56-1,17 (м, 15Н, алифатика), м. д.
1-(2-хлорфенил)-3-(1-адамантил)пропан-1-он
В круглодонную колбу объемом 1 л, снабженную капельной воронкой и дефлегматором, помещали 15,57 г (640 ммоль) магниевой стружки и добавляли 50 мл ТГФ. Магний слегка подвергали травлению несколькими кристаллами иода, а после этого добавляли 2 г 1-(2-бромэтил)адамантана, и смесь подвергалась локальному разогреванию. После начала образования реактива Гриньяра в течение периода времени 20 мин добавляли остаток 1-(2-бромэтил)адамантана в 350 мл ТГФ (143,5 г в совокупности, 590 ммоль). Смесь выдерживали при кипячении в течение 1,5 ч, а после этого охлаждали до комнатной температуры. В отдельной круглодонной колбе объемом 2 л в 130 мл ТГФ растворяли 70,5 г (513 ммоль) 2-хлорбензонитрила и 156 мг (0,16% (моль)) иодида меди (I). В течение периода времени 30 мин по каплям добавляли раствор реактива Гриньяра и реакционную смесь выдерживали при кипячении в течение 3 ч. После выдерживания в течение ночи при комнатной температуре очень осторожно добавляли смесь 190 мл воды и 127 мл концентрированной соляной кислоты, вызывая прохождение сильно экзотермической реакции. Смесь перемешивали при 50°С в течение 1 ч и слои разделяли. Водный слой экстрагировали два раза каждый раз при использовании 150 мл толуола. Объединенные органические слои промывали два раза серной кислотой с концентрацией 2 моль/л, один раз насыщенным раствором бикарбоната натрия и один раз насыщенным раствором хлорида натрия. После высушивания над сульфатом магния растворитель выпаривали в вакууме до получения 178,7 г (количественно) требуемого фенона в виде масла светло-коричневого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,39-7,12 (м, 4Н, ароматика), 2,55 (т, 2Н, СОСН2), 1,40-1,13 (м, 17Н, алифатика), м. д.
7-хлор-2-(1-адамантилметил)индан-1-он
В круглодонную колбу объемом 500 мл помещали 78,7 г (260 ммоль) 1-(2-хлорфенил)-3-(1-адамантил)пропан-1-она, 77,5 г (2,1 экв.) уротропина и 72,6 г (2,7 экв.) уксусного ангидрида и смесь в течение 4 ч перемешивали при 80°С. После этого добавляли 100 мл воды и 100 мл раствора NaOH с концентрацией 2 моль/л и смесь экстрагировали два раза каждый раз при использовании 200 мл дихлорметана. Органический слой промывали два раза при использовании 100 мл насыщенного водного раствора хлорида аммония и высушивали над сульфатом магния. Количество растворителя уменьшали в вакууме до получения в совокупности объема 150 мл и раствор в течение периода времени 2,5 ч по каплям добавляли к 660 г горячей (70-75°С) концентрированной серной кислоты. После перемешивания еще в течение 30 мин при 75°С смеси давали возможность отстояться при комнатной температуре в течение ночи. Смесь вводили к приблизительно 500 г льда и экстрагировали три раза каждый раз при использовании 150 мл дихлорметана. Органический слой промывали два раза при использовании 150 мл насыщенного раствора бикарбоната натрия и один раз при использовании 100 мл насыщенного раствора хлорида натрия. После высушивания над сульфатом магния растворитель удаляли в вакууме. Продукт очищали по методу колоночной хроматографии на диоксиде кремния (гептан/дихлорметан 5:1) до получения 58 г (71%) требуемого продукта в виде стеклообразного твердого вещества слегка беловатого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,39 (т, 1Н, ароматика), 7,27 (д, 1Н, ароматика), 7,21 (д, 1Н, ароматика), 3,37 (дд, 1Н, СОСН), 2,70 (м, 2Н, бензил), 1,36-1,18 (м, 17Н, алифатика), м. д.
7-(4'-трет-бутилфенил)-2-(1-адамантилметил)индан-1-он
В круглодонную колбу объемом 2 л, снабженную механическим перемешивающим устройством и дефлегматором, помещали 71,8 г (228 ммоль) 7-хлор-2-(1-адамантилметил)индан-1-она, 49 г (1,2 экв.) 4-трет-бутилбензолбороновой кислоты, 53 г карбоната натрия, 750 мл этиленгликоля и 150 мл воды. Смесь дегазировали три раза в результате легкого вакуумирования и повторного напускания аргона. Добавляли предварительно перемешанный раствор катализатора, состоящий из 103 мг (0,2% (моль)) ацетата палладия, 3 мл трис(натрий-м-сульфонатофенил)фосфина (2,6 моль/л в воде, 0,8% (моль)) и 2 мл воды, и смесь выдерживали при кипячении при 125°С вплоть до полного превращения (приблизительно 6 ч). Добавляли 300 мл воды и смесь экстрагировали три раза каждый раз при использовании 150 мл толуола. Объединенные органические слои промывали два раза при использовании 100 мл воды и один раз при использовании 100 мл насыщенного раствора хлорида натрия. Высушивание над сульфатом магния и выпаривание растворителя в вакууме приводило к получению 94,1 г (количественно) требуемого продукта в виде липкого масла желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,52 (т, 1Н, ароматика), 7,41, 7,36 (2×д, 4Н, ароматика), 7,21 (м, 2Н, ароматика), 3,37 (м, 1Н, СОСН), 2,77-2,68 (м, 2Н, бензил), 1,42-1,18 (м, 26Н, алифатика и С(СН3)3), м. д.
7-(4'-трет-бутилфенил)-2-(1-адамантилметил)-1Н-инден
В круглодонной колбе объемом 1 л, снабженной дефлегматором, в 291 мл толуола растворяли 94,0 г (229 ммоль) 7-(4'-трет-бутилфенил)-2-(1-адамантилметил)индан-1-она. Добавляли 9,5 г (1,1 экв.) боргидрида натрия. После этого при 50°С добавляли 40 мл (4,3 экв.) метанола и смесь в течение 6 ч перемешивали при 50°С. Добавляли серную кислоту с концентрацией 2 моль/л вплоть до прекращения газовыделения. После добавления 100 мл воды слои разделяли и органический слой промывали два раза серной кислотой с концентрацией 2 моль/л и один раз насыщенным раствором хлорида натрия. Растворитель выпаривали и приблизительно в 350 мл толуола растворяли «сырой» инданол. После добавления 0,7 г п-толуолсульфоновой кислоты смесь нагревали, выдерживая при кипячении с использованием ловушки Дина-Старка вплоть до выявления по методу ТСХ полного превращения (90 мин). Раствор промывали два раза насыщенным раствором NaHCO3, один раз водой и один раз насыщенным раствором хлорида натрия. Высушивание над сульфатом магния, выпаривание растворителя и кристаллизация из 900 мл этанола приводили к получению 76,9 г (85%) требуемого индена в виде кристаллов белого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,44, 7,32, 7,23, 7,12 (4×м, 7Н, ароматика), 6,63 (с, 1Н, =СН), 3,32 (с, 2Н, бензил), 2,29 (д, 2Н, алифатика), 1,69-1,15 (м, 15Н, алифатика), 1,38 (с, 9Н, С(СН 3)3), м. д.
Диметилсиландиилбис(2-(1-адамантилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид

В круглодонной колбе объемом 1000 мл в 340 мл толуола и 20 мл ТГФ растворяли 23 г (58 ммоль) 7-(4'-трет-бутилфенил)-2-(1-адамантилметил)-1Н-индена. При комнатной температуре добавляли 24,4 мл н-бутиллития (2,6 моль/л в толуоле, 63,4 ммоль, 1,1 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 3,5 мл (3,74 г, 29 ммоль, 0,5 экв.) диметилдихлорсилана и смесь в течение 8,5 ч перемешивали при 60°С. Смесь растворителей удаляли в вакууме (в соответствии с анализом по методу ГХ степень чистоты лиганда > 94%) и лиганд растворяли в 200 мл диэтилового эфира (желтоватая суспензия вследствие присутствия LiCl). При комнатной температуре добавляли 23,8 мл н-бутиллития (61,9 ммоль, 1,07 экв. по отношению к «индену», 2,6 моль/л в толуоле) и смесь в течение ночи перемешивали при комнатной температуре. После этого порционно добавляли 7,1 г (30,5 ммоль, 0,525 экв. по отношению к «индену») тетрахлорида циркония. Суспензию оранжево-желтого цвета в течение ночи перемешивали при комнатной температуре и в результате фильтрования выделяли твердое вещество. Промывание 2-мя порциями каждая по 35 мл диэтилового эфира и высушивание в вакууме приводило к получению 25,1 г «сырого» комплекса (рац/мезо = 1,6:1, при содержании хлорида лития). В результате фракционной кристаллизации из толуола выделяли рацемический комплекс. Выход: 9,8 г (9,7 ммоль, 33%) в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,62 (д, 2Н, ароматика), 7,55, 7,42 (2×д, 8Н, ароматика), 7,32 (д, 2Н, ароматика), 7,21, 7,15, 7,08 (3×м, 10Н, ароматика + толуол), 6,83 (с, 2Н, инденил-Н), 2,53 («дд», 2Н, инденил-СН 2), 2,34 (с, толуол), 2,09 («дд», 2Н, инденил-СН2), 1,75-1,15 (м, 30Н, алифатика), 1,34 (с, 18Н, С(СН3)3), 1,32 (с, 6Н, Si(СН3)2), м. д.
Пример 7:
(Метил)(н-пропил)силандиилбис(2-(циклогексилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорид
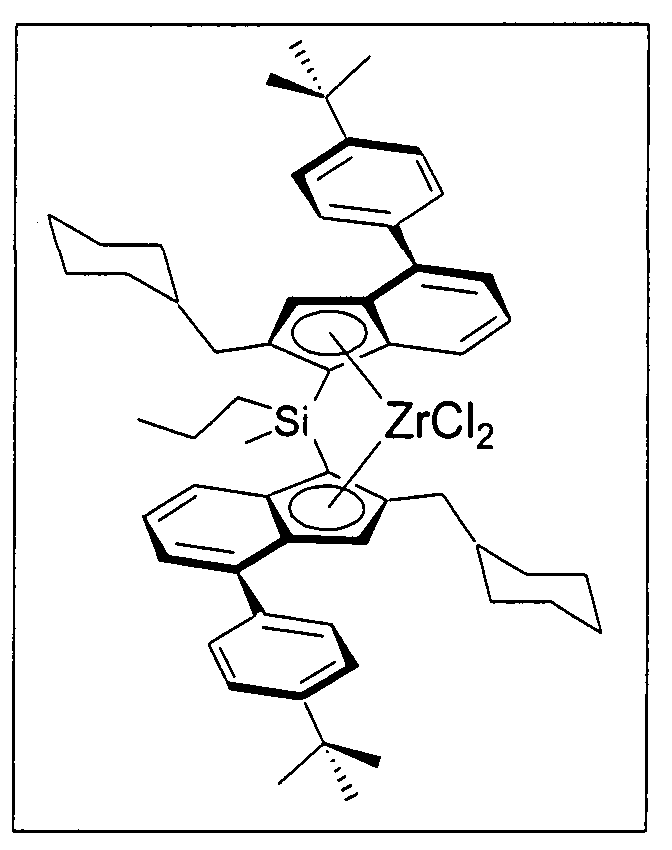
В круглодонной колбе объемом 100 мл в 10 мл диметоксиэтана растворяли 2,0 г (5,8 ммоль) 7-(4'-трет-бутилфенил)-2-циклогексилметил-1Н-индена. При комнатной температуре добавляли 2,44 мл н-бутиллития (2,6 моль/л в толуоле, 6,34 ммоль, 1,1 экв.) и раствор в течение 1 ч перемешивали при 80°С. После охлаждения до 40°С одной порцией добавляли 456 мг (2,9 ммоль, 0,5 экв.) (метил)(н-пропил)дихлорсилана и смесь в течение 17 ч перемешивали при 60°С. Смесь растворителей удаляли в вакууме (в соответствии с анализом по методу ГХ степень чистоты лиганда > 99%) и лиганд растворяли в 20 мл диэтилового эфира (желтоватая суспензия вследствие присутствия LiCl). При комнатной температуре добавляли 2,44 мл н-бутиллития (6,34 ммоль, 1,05 экв. по отношению к «индену», 2,6 моль/л в толуоле) и смесь в течение ночи перемешивали при комнатной температуре. После этого порционно добавляли 718 мг (3,08 ммоль, 0,53 экв. по отношению к «индену») тетрахлорида циркония. Суспензию оранжево-желтого цвета в течение 5 ч перемешивали при комнатной температуре и в результате фильтрования и двукратного промывания каждый раз при использовании 5 мл диэтилового эфира удаляли хлорид лития. Растворитель удаляли в вакууме, а остаток перекристаллизовывали из гептана, получая 660 мг (0,707 ммоль, 24%) рацемического комплекса в виде порошка ярко-желтого цвета. 1Н-ЯМР (400 МГц, CDCl3): δ=7,62 (д, 2Н, ароматика), 7,57, 7,44 (2×д, 8Н, ароматика), 7,35 (д, 2Н, ароматика), 7,11-7,06 (м, 2Н, ароматика), 6,94 (с, 2Н, инденил-Н), 2,63 («дд», 2Н, инденил-СН2), 2,13 («дд», 2Н, инденил-СН2), 1,88 (м, 4Н, алифатика), 1,67-1,45 (м, 12Н, алифатика), 1,35 (с, 18Н, С(СН3)3), 1,32 (с, 3Н, SiCH 3), 1,31-0,76 (м, 14Н, алифатика), м. д.
Сравнительный пример 8:
Диметилсиландиилбис(2-метилинденил)цирконийдихлорид
Получение диметилбис(2-метилинденил)силана
В 175 мл толуола и 13 мл ТГФ вводили 8,0 г (61,4 ммоль) 2-метилиндена и без перерыва при комнатной температуре добавляли 24,6 мл н-бутиллития (2,5 моль/л в толуоле). После завершения данного добавления смесь нагревали до 80°С и при данной температуре перемешивали в течение одного часа. Смеси давали возможность охладиться до 40°С, после этого медленно по каплям добавляли 3,96 г (30,7 ммоль) диметилдихлорсилана. После данного добавления реакционный раствор перемешивали в течение трех часов при 60°С, а после этого в течение ночи при комнатной температуре. Добавляли 70 мл воды и фазы, которые формировались, разделяли. Органическую фазу промывали при использовании 100 мл воды, а водную фазу экстрагировали три раза при использовании в совокупности 100 мл толуола. Объединенные органические фазы высушивали над сульфатом магния. После отделения сульфата магния растворитель удаляли, а остаток очищали по методу колоночной хроматографии. Требуемый продукт выделяли с выходом 8,16 г (84%) (степень чистоты 99%).
1Н-ЯМР (400 МГц, CDCl3):
7,55-7,12 (м, 8Н, ароматика-Н), 6,40 (с, уш, 2Н, олефин-Н-инден), 3,51, 3,48 (каждый с, каждый 1Н, SiC-H), 2,09, 2,04 (каждый с, каждый 3Н, СН3), 1,71 (с, 6Н, СН3), 0,08 (с, 6Н, SiMe2).
Диметилсиландиилбис(2-метилинденил)цирконийдихлорид
Раствор 5,0 г (15,8 ммоль) диметилбис(2-метилинденил)силана в 45 мл тетрагидрофурана подвергали обработке при использовании 12,6 мл раствора н-бутиллития (2,5 моль/л в гексане) и в течение 16 часов перемешивали при комнатной температуре. Реакционный раствор охлаждали до 0°С и порционно добавляли 1,84 г (7,9 ммоль) тетрахлорида циркония. После данного добавления раствор нагревали до комнатной температуры и в течение двух часов перемешивали при данной температуре. Осадок, который формировался, отфильтровывали через пористый стеклянный фильтр G3 и остаток промывали один раз при использовании 10 мл диэтилового эфира. После этого остаток высушивали в вакууме и получали требуемый продукт с выходом 1,89 г (50%) при соотношении рац:мезо, близком к 1:1. Для получения селективных катализаторов полимеризации пропилена изомеры на последующей стадии должны быть разделены.
1Н-ЯМР (400 МГц, CDCl3):
7,75-6,85 (м, 10Н, ароматика-Н), 2,24 (с, 6Н, СН3), 1,25 (с, 6Н, алифатика-Н).
Сравнительный пример 9:
Диметилсиландиилбис(2-метил-4,5-бензоинденил)цирконийдихлорид
Диметилбис(2-метил-4,5-бензоинденил)силан
Раствор 7,0 г (38,8 ммоль) смеси изомеров 2-метил-4,5-бензоиндена и 2-метил-6,7-бензоиндена в 65 мл тетрагидрофурана подвергали обработке при использовании 15,6 мл раствора н-бутиллития (2,5 моль/л в гексане) и нагревали, выдерживая при кипячении, в течение одного часа. После этого получающийся в результате красный раствор при комнатной температуре по каплям добавляли к раствору 2,51 г (19,4 ммоль) диметилдихлорсилана в 10 мл ТГФ и получающийся в результате раствор нагревали, выдерживая при кипячении, в течение 5-6 часов. Затем реакционный раствор охлаждали до комнатной температуры и выливали в воду со льдом. Водную фазу неоднократно экстрагировали при использовании 60 мл диэтилового эфира. После высушивания органической фазы сульфатом магния растворитель удаляли, а остаток очищали по методу колоночной хроматографии. Требуемый продукт выделяли с выходом 4,85 г (60%).
1Н-ЯМР (400 МГц, CDCl3):
8,01-7,36 (м, 12Н, ароматика-Н), 7,21 (с, уш, 2Н, олефин-Н-инден), 3,96 (с, 2Н, SiC-H), 2,43 (с, 6Н, СН3), -0,22 (с, 6Н, SiMe2).
Диметилсиландиилбис(2-метил-4,5-бензоинденил)цирконийдихлорид
Раствор 3,0 г (7,2 ммоль) диметилбис(2-метил-4,5-бензоинденил)силана в 30 мл тетрагидрофурана подвергали обработке при использовании 5,8 мл раствора н-бутиллития (2,5 моль/л в гексане) и в течение 16 часов перемешивали при комнатной температуре. Реакционный раствор охлаждали до 0°С и порционно добавляли 1,68 г (7,2 ммоль) тетрахлорида циркония. После данного добавления раствор нагревали до комнатной температуры и в течение двух часов перемешивали при данной температуре. Осадок, который формировался, отфильтровывали через пористый стеклянный фильтр G3 и остаток промывали один раз при использовании 5 мл диэтилового эфира. После этого остаток высушивали в вакууме и получали требуемый продукт с выходом 2,32 г (56%) при соотношении рац:мезо, равном приблизительно 1:1. Для получения селективных катализаторов полимеризации пропилена изомеры на последующей стадии должны быть разделены.
1Н-ЯМР (400 МГц, CDCl3):
7,85-7,10 (м, 14Н, ароматика-Н), 2,25 (с, 6Н, СН3), 1,30 (с, 6Н, СН3).
Сравнительный пример 10:
Диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)цирконийдихлорид
Диметилбис(2-метил-4-(4'-трет-бутилфенил)инденил)силан
В 180 мл толуола и 10 мл ТГФ вводили 8,0 г (30,5 ммоль) 2-метил-4-(4'-трет-бутилфенил)-1-индена, после этого без перерыва при комнатной температуре добавляли 12,4 мл раствора н-бутиллития (2,5 моль/л в толуоле). После завершения данного добавления смесь нагревали до 80°С и при данной температуре перемешивали в течение одного часа. Смеси давали возможность охладиться до 40°С, после этого медленно по каплям добавляли 2,0 г (15,3 ммоль) диметилдихлорсилана. После данного добавления реакционный раствор перемешивали в течение трех часов при 60°С, а после этого в течение ночи при комнатной температуре. Добавляли 80 мл воды и фазы, которые формировались, разделяли. Органическую фазу промывали при использовании 80 мл воды, а водную фазу экстрагировали три раза при использовании в совокупности 80 мл толуола. Объединенные органические фазы высушивали над сульфатом магния. После отделения сульфата магния растворитель удаляли, а остаток очищали по методу колоночной хроматографии. Требуемый продукт выделяли с выходом 7,27 г (80%) (степень чистоты 97%).
1Н-ЯМР (400 МГц, CDCl3):
7,73-7,12 (м, 16Н, ароматика-Н), 6,75 (с, уш, 2Н, олефин-Н-инден), 3,76 (с, 2Н, SiC-H), 2,17 (с, 6Н, СН3), -0,20 (м, 6Н, SiMe2).
Диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)инденил)цирконийдихлорид
В 2,4 л толуола и 143 мл тетрагидрофурана вводили 143 г (0,54 моль) 2-метил-4-(4'-трет-бутилфенил)-1-индена и без перерыва при комнатной температуре добавляли 234 мл раствора н-бутиллития (2,5 моль/л в толуоле). После завершения данного добавления смесь нагревали до 80°С и при данной температуре перемешивали в течение одного часа. Смеси давали возможность охладиться до 40°С, после этого к данному раствору по каплям добавляли 33,6 г (0,26 моль) диметилдихлорсилана. Реакционный раствор перемешивали в течение трех часов при 60°С. Раствор затем охлаждали до комнатной температуры и затем по каплям добавляли 218 мл раствора н-бутиллития (2,5 моль/л в толуоле). После завершения данного добавления раствор нагревали до 80°С и при данной температуре перемешивали в течение одного часа. Смеси давали возможность охладиться до комнатной температуры, после этого порционно добавляли 71,1 г (0,305 моль) тетрахлорида циркония. Раствор в течение двух часов перемешивали при 45°С, а осадок, который формировался, отделяли в результате фильтрования через пористый стеклянный фильтр G3 и после этого тщательно промывали порциями тетрагидрофурана в 700 мл. Остаток высушивали в вакууме масляного насоса и получали продукт с выходом 155 г (80%) и при соотношении рац:мезо 1:1. Для получения селективных катализаторов полимеризации пропилена изомеры на дополнительной стадии должны быть разделены.
1Н-ЯМР (400 МГц, CDCl3):
7,63-6,85 (м, 16Н, ароматика-Н), 2,44 (с, 3Н, мезо-СН3), 2,24 (с, 3Н, рац-СН3), 1,46 (с, 1,5Н, мезо-SiMe2), 1,33-1,29 (м, 21Н, трет-бутил, рац-SiMe2), 1,23 (с, 1,5Н, мезо-СН3).
Сравнительный пример 11:
Диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)цирконийдихлорид
Диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)-1-инден)(2-изопропил-4-(4'-трет-бутилфенил)-1-инден)
В 131 мл толуола и 5,0 мл ТГФ вводили 16,8 г (57,7 ммоль) 2-изопропил-4-(4'-трет-бутилфенил)-1-индена и без перерыва при комнатной температуре добавляли 21,5 мл раствора н-бутиллития (2,68 моль/л в толуоле). После завершения данного добавления смесь нагревали до 80°С и при данной температуре перемешивали в течение одного часа. После этого смеси давали возможность охладиться до комнатной температуры. Получающийся в результате реакционный раствор в течение периода времени один час по каплям добавляли к раствору 20,5 г (57,7 ммоль) (2-метил-4-(4'-трет-бутилфенил)-1-инденил)диметилхлорсилана в 246 мл толуола. Смесь перемешивали в течение ночи при комнатной температуре. После этого добавляли 60 мл воды и фазы, которые формировались, разделяли. Органическую фазу промывали при использовании 100 мл воды, а объединенную водную фазу экстрагировали два раза при использовании в совокупности 100 мл толуола. Объединенные органические фазы высушивали над сульфатом магния. После отфильтровывания сульфата магния растворитель удаляли, а остаток высушивали в вакууме масляного насоса. Требуемый продукт выделяли с выходом 31,6 г (90%) (степень чистоты: 90%).
1Н-ЯМР (400 МГц, CDCl3):
7,51-7,1 (м, 14Н, ароматика-Н), 6,71, 6,62 (каждый с, каждый 1Н, олефин-Н-инден), 3,35, 3,31 (каждый с, каждый 2Н, СН2-Н), 2,65 (м, 1Н, СН-изопропил), 2,41 (с, 3Н, СН3-Н), 1,35, 1,33 (каждый с, каждый 9Н, трет-бутил), 1,15 (д, 6Н, изопропил-CH3), 0,2, 0,0 (каждый д, каждый 3Н, SiCH 3).
Диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)цирконийдихлорид
В 366 мл диэтилового эфира вводили 36,6 г (60 ммоль) диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)-1-инден)(2-изопропил-4-(4'-трет-бутилфенил)-1-индена) и без перерыва при комнатной температуре добавляли 44,9 мл раствора н-бутиллития (2,68 моль/л в толуоле). После завершения данного добавления смесь при данной температуре перемешивали в течение ночи. Смеси давали возможность охладиться до 0°С и после этого порционно добавляли 14,0 г (60 ммоль) тетрахлорида циркония. Смеси давали возможность разогреться до комнатной температуры и при данной температуре ее перемешивали в течение еще двух часов. Осадок, который формировался, отделяли в результате фильтрования через пористый стеклянный фильтр G3 и промывали двумя порциями тетрагидрофурана в 50 мл и одной порцией пентана в 70 мл. Остаток высушивали в вакууме масляного насоса и получали продукт с выходом 23,5 г (50%) и при соотношении рац:мезо, равном приблизительно 1:1. Для получения селективных катализаторов полимеризации пропилена изомеры на последующей стадии должны быть разделены.
1Н-ЯМР (400 МГц, CDCl3):
7,7-6,9 (м, 14Н, ароматика-Н), 3,26 (м, 1Н, СН-изопропил), 2,23 (с, 3Н, СН3), 1,31 (с, 18Н, трет-бутил), 1,33, 1,32 (каждый с, каждый 3Н, Si-СН3), 1,08, 1,03 (каждый д, каждый 3Н, изопропил-СН3).
Получение диоксида кремния, подвергнутого обработке метилалюмоксаном:
Пример 12:
К перемешиваемой суспензии 293 г диоксида кремния (Grace XPO2107, высушен при 180°С и 1 мбар в течение 16 часов, ПМВ < 0,5% (мас.) и ПМП = 2,6% (мас.)) в 1500 мл толуола при комнатной температуре медленно добавляют 300 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation). Во время добавления температура не должна превышать 30°С. После завершения добавления смесь перемешивают в течение двух часов при комнатной температуре и разделяют в результате фильтрования. Остаток промывают двумя порциями толуола в 1500 мл и тремя порциями изогексана в 1500 мл и высушивают в вакууме до достижения постоянной массы. Диоксид кремния, подвергнутый обработке метилалюмоксаном, получают в виде свободнотекучего порошка с выходом 408 г.
Получение металлоценовых катализаторов, нанесенных на носитель:
Пример 13:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 326 мг рац-диметилсиландиилбис(2-(циклогексилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в примере 1). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 12,0 г.
Пример 14:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 321 мг рац-диметилсиландиилбис(2-(циклогексилметил)-4-(1-нафтил)-1-инденил)цирконийдихлорида (полученного в примере 2). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 11,8 г.
Пример 15:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 295 мг рац-диметилсиландиилбис(2-(циклогексилметил)-4-(4'-метилфенил)-1-инденил)цирконийдихлорида (полученного в примере 3). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 11,0 г.
Пример 16:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 305 мг рац-диметилсиландиилбис(2-(циклогексилметил)-4-(3',5'-диметилфенил)-1-инденил)цирконийдихлорида (полученного в примере 4). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 12,1 г.
Пример 17:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 307 мг рац-диметилсиландиилбис(2-(трет-бутилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в примере 5). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 11,4 г.
Пример 18:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 363 мг рац-диметилсиландиилбис(2-(1-адамантилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в примере 6). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 11,8 г.
Пример 19:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 333 мг рац-(н-пропил)(метил)силандиилбис(2-(циклогексилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в примере 7). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 10,7 г.
Сравнительный пример 20:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 171 мг рац-диметилсиландиилбис(2-метилинденил)цирконийдихлорида, (полученного в сравнительном примере 8). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка красноватого цвета с выходом 12,2 г.
Сравнительный пример 21:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 207 мг рац-диметилсиландиилбис(2-метил-4,5-бензоинденил)цирконийдихлорида (полученного в сравнительном примере 9). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка оранжевого цвета с выходом 11,5 г.
Сравнительный пример 22:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 267 мг рац-диметилсиландиилбис(2-метил-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в сравнительном примере 10). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка оранжевого цвета с выходом 11,9 г.
Сравнительный пример 23:
10,0 г полученного в примере 12 диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 27 мл толуола и 13,6 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation) перемешивают 277 мг рац-диметилсиландиил(2-метил-4-(4'-трет-бутилфенил)инденил)(2-изопропил-4-(4'-трет-бутилфенил)инденил)цирконийдихлорида (полученного в сравнительном примере 11). Суспензию перемешивают при комнатной температуре в течение одного часа до получения раствора оранжевого цвета. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка оранжевого цвета с выходом 11,9 г.
Пример 24:
К перемешиваемой суспензии 100 г диоксида кремния (Grace XPO8001, высушен при 180°С и 1 мбар в течение 16 часов, ПМВ < 0,5% (мас.) и ПМП = 2,5% (мас.)) в 480 мл толуола при комнатной температуре медленно добавляют 250 мл раствора метилалюмоксана в толуоле с концентрацией 30% (мас.) (Albemarle Corporation). Во время добавления температура не должна превышать 30°С. После завершения добавления смесь перемешивают в течение получаса при комнатной температуре, а после этого нагревают и обеспечивают ее выдерживание при кипячении в течение четырех часов. После охлаждения до комнатной температуры растворитель отделяют в результате фильтрования. Остаток промывают двумя порциями толуола в 500 мл и тремя порциями изогексана в 500 мл и высушивают в вакууме до достижения постоянной массы. Диоксид кремния, подвергнутый обработке метилалюмоксаном, получают в виде свободнотекучего порошка с выходом 180 г.
10,0 г диоксида кремния, подвергнутого обработке метилалюмоксаном, помещают в пористый стеклянный фильтр в виде колонки с гладкой поверхностью. Добавляют минимальное количество толуола и подвергнутый обработке диоксид кремния осторожно перемешивают шпателем для удаления каких-либо воздушных карманов в колонке. Избыток толуола удаляют в результате фильтрования, оставляя после этого гладкую поверхность. В отдельной колбе с 10 мл толуола и 33,4 мл раствора триизобутилалюминия в гептане с концентрацией 10% (мас.) (Akzo Nobel) перемешивают 363 мг рац-диметилсиландиилбис(2-(1-адамантилметил)-4-(4'-трет-бутилфенил)-1-инденил)цирконийдихлорида (полученного в примере 6). Суспензию перемешивают при комнатной температуре в течение одного часа. После этого данный раствор осторожно добавляют поверх диоксида кремния, подвергнутого обработке метилалюмоксаном, и медленно отфильтровывают в течение приблизительно 30 минут. При достижении поверхностью окрашенного раствора верха диоксида кремния процесс фильтрования прекращают, а осадок на фильтре тщательно и осторожно перемешивают при помощи шпателя. После этого катализатор оставляют в покое на один час. Остаточный растворитель отфильтровывают, а катализатор промывают два раза изогексаном (20 мл) и высушивают при продувании азота до достижения постоянной массы. Катализатор получают в виде свободнотекучего порошка с выходом 12 г.
Полимеризации:
Методика полимеризации (периодическая гомо- и сополимеризации пропилена):
В сухой и продуваемый азотом автоклав объемом 5 дм3, снабженный перемешивающим устройством, загружают при желании 100 г слоя затравки металлоценового полимера. Необязательно производят дозированную подачу определенного количества водорода. Производят дозированную подачу триизобутилалюминия (1 см3 раствора в гептане с концентрацией 10% (мас.)), жидкого пропилена (половины от совокупного количества, использующегося для прогона) и необязательно определенного количества этилена и смесь при 20°С перемешивают в течение, по меньшей мере, 5 минут (скорость вращения перемешивающего устройства 200 об/мин). После этого в жидком пропилене (половине от совокупного количества, использующегося для прогона) вводят нанесенный на носитель металлоценовый катализатор, суспендированный в 5 см3 белого масла. Реактор в течение 11 минут нагревают до измеряемой внутри температуры прогона (65, 60 или 30°С). Реакции полимеризации дают возможность протекать при температуре прогона в течение либо 15, либо 60 минут. Во время 60-минутных прогонов сополимеризации давление в реакторе выдерживали в результате непрерывной подачи этилена и пропилена. Полимеризацию прекращают в результате стравливания мономера и охлаждения реактора. Полимер выгружают и высушивают при пониженном давлении.
Пятьдесят восемь отдельных испытаний из примеров изобретения и сравнительных примеров и результаты в совокупности продемонстрированы в таблицах 1 и 2. В дополнение к этому, таблицы от 3 до 12 составлены для выделения различных условий в реакторе.
Анализ результатов
Несмотря на такую исключительность изобретения настоящей заявки, что оно демонстрирует неожиданное улучшение для всего класса металлоценов, заявители отмечают то, что подлинные сопоставления для эффекта от данного изобретения должны быть оценены на примере металлоценов, обладающих подобной структурой инденильной группы в положении, отличном от 2. Поэтому несмотря на проведение в части данного анализа совокупных сопоставлений между несколькими примерами изобретения и сравнительными примерами сопоставления индивидуальных катализаторов необходимо делать только в случае идентичности замещений во всех позициях инденильных групп, отличных от положения 2, что обеспечит проведение корректного сопоставления. Поэтому сопоставления индивидуальных катализаторов должны быть проведены только между примерами изобретения 13, 17 и 18 (различные β-разветвления в положении два инденильной группы) и сравнительными примерами 22 (прямая цепь в положении два инденильной группы) и 23 (α-разветвление в положении два инденила), поскольку замещения во всех положениях инденильных групп, отличных от положения 2, являются идентичными.
Таблица 1 и таблица 2 приводят исходные данные, представляемые в прогонах испытаний; остальные таблицы 3-12 соотносят эти данные к соотношению между количествами пропилена и этилена (или пропиленовому гомополимеру) и использованию водорода в способе полимеризации.
Пропиленовые гомополимеры
Анализ 1: Получение пропиленовых полимеров в отсутствие сомономера этилена и не в присутствии водорода
Таблица 3 демонстрирует результаты по восьми экспериментальным металлоценовым катализаторам, соответствующим требованиям изобретения, в сопоставлении с четырьмя сравнительными примерами. В совокупности катализаторы настоящего изобретения обнаружили более чем 50%-ное увеличение производительности при демонстрации в то же самое время более чем 200%-ного увеличения молекулярной массы и увеличения температуры плавления почти что на два градуса Цельсия (что является значащим при диапазоне температур плавления для гомополимерного полипропилена в пределах от 144 до 153). Кроме того, катализаторы настоящего изобретения приводили к получению продуктов, характеризующихся совокупным значением СТР 2,16, меньшим чем 1,5% от того, что имеет место для сравнительных продуктов, и совокупным значением СТР 5, немного большим чем 2% от того, что имеет место в сравнительных примерах. Данное радикальное уменьшение значения СТР указывает на радикальное увеличение молекулярной массы (более чем на 200%) и в полной мере открывает доступ к областям применения, подобным пленке, трубе или листам, где высокая молекулярная масса является непременным условием.
Сопоставления индивидуальных катализаторов между образцами изобретения 13, 17 и 18 и сравнительными примерами 22 и 23 являются настолько же драматическими. Как следует из сопоставления примеров 13, 17 и 18 со сравнительным примером 22, все три примера изобретения характеризуются значительно меньшими уровнями значений СТР 2,16, СТР 5 и увеличением молекулярной массы. Говоря конкретно, в случае значения СТР 2,16 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 60% и более чем 99% и более чем 99% в сопоставлении с первоначальным значением в примере 22. В случае значения СТР 5 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 78%, 89% и более чем 99%, в сопоставлении с первоначальным значением в примере 22. Что касается молекулярной массы, то примеры изобретения 13, 17 и 18 демонстрируют соответственное увеличение на 16%, 5% и 26% в сопоставлении с первоначальным значением. Еще более удивительной является демонстрация примерами изобретения данного радикального улучшения свойств продукта при приблизительно тех же самых уровнях производительности, а в случае примера изобретения 13 при 59%-ном увеличении производительности.
Как следует из сопоставления примеров 13, 17 и 18 со сравнительным примером 23, все три примера изобретения характеризуются значительно меньшими уровнями значений СТР 2,16, СТР 5 и увеличением молекулярной массы. Говоря конкретно, в случае значения СТР 2,16 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 88%, более чем 99% и более чем 99% в сопоставлении с первоначальным значением в примере 23. В случае значения СТР 5 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 90%, 95% и более чем 99% в сопоставлении с первоначальным значением в примере 23. Что касается молекулярной массы, то примеры изобретения 13, 17 и 18 демонстрируют соответственное увеличение на 118%, 97% и 137% в сопоставлении с первоначальным значением. Производительность также масштабно улучшилась, соответственно, при увеличении на 277%, 93% и 103% в сопоставлении с первоначальным значением.
Анализ 2: Получение пропиленовых полимеров в отсутствие сомономера этилена и в присутствии водорода
Таблица 4 демонстрирует результаты по восьми экспериментальным металлоценовым катализаторам, соответствующим требованиям изобретения, в сопоставлении с четырьмя сравнительными примерами. Однако в данном случае для улучшения производительности катализатора и регулирования молекулярной массы во время процесса полимеризации добавляли водород. В совокупности катализаторы настоящего изобретения обнаружили более чем 94%-ное увеличение производительности при демонстрации в то же самое время более чем 32%-ного увеличения молекулярной массы и увеличения температуры плавления почти что на одну целую три десятых градуса Цельсия (что является значащим при диапазоне температур плавления для гомополимерного полипропилена в пределах от 144 до 153). Кроме того, катализаторы настоящего изобретения приводили к получению продуктов, характеризующихся совокупным значением СТР 2,16, меньшим чем 34% от того, что имеет место для сравнительных продуктов, и совокупным значением СТР 5, немного большим чем 31% от того, что имеет место в сравнительных примерах.
Сопоставления индивидуальных катализаторов между образцами изобретения 13, 17 и 18 и сравнительными примерами 22 и 23 опять-таки являются драматическими.
Как следует из сопоставления примеров 13, 17 и 18 со сравнительным примером 23, все три примера изобретения характеризуются значительно меньшими уровнями значений СТР 2,16, СТР 5 и увеличением молекулярной массы. Говоря конкретно, в случае значения СТР 2,16 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 76%, 60% и 76% в сопоставлении с первоначальным значением в примере 23. В случае значения СТР 5 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 78%, 64% и 80% в сопоставлении с первоначальным значением в примере 23. Что касается молекулярной массы, то примеры изобретения 13, 17 и 18 демонстрируют соответственное увеличение на 61%, 18% и 65% в сопоставлении с первоначальным значением. Производительность также значительно улучшилась, соответственно, при увеличении на 109%, 84% и 84% в сопоставлении с первоначальным значением.
Как следует из сопоставления примеров 13, 17 и 18 со сравнительным примером 22, производительность значительно улучшилась, соответственно, при увеличении на 67%, 47% и 47% в сопоставлении с первоначальным значением, при одновременном получении продукта, обладающего сопоставимым коммерческим качеством. В данном случае непосредственное сопоставление значений СТР и молекулярной массы неприменимо. Металлоцен из сравнительного примера хорошо известен как дающий неудовлетворительный отклик по водороду, что будет сохранять молекулярную массу высокой, а значение СТР низким. Все примеры изобретения обеспечивают получение гораздо лучшего отклика по водороду, что должно приводить к получению радикально меньших молекулярных масс и больших значений СТР. Получение в примерах изобретения подобных откликов по молекулярным массам и значениям СТР (продуктов, обладающих подобным качеством) при значительно повышенных производительностях представляет собой исключительно неожиданный результат.
Сополимеры пропилен/этилен
Свойства продуктов, полученных при использовании катализаторов изобретения, подвергали испытаниям при различных уровнях соотношения в смеси этилен/пропилен для получения сополимеров. При введении новой переменной - соотношения между количествами пропилена и этилена - для сополимеров при каждом соотношении отбирали намного меньше экспериментальных точек, поскольку ресурсы стали ограниченными. В каждом случае испытанию подвергали катализатор изобретения из примера 13, обычно в сопоставлении со сравнительным катализатором из примера 23. Время от времени испытания проводили и для других катализаторов изобретения, но не проводя испытаний для значительного количества катализаторов изобретения, для каждого соотношения между количествами пропилена и этилена совокупное количество испытаний не будет статистически значимым за исключением соотношения 0,38, для которого имелось множество экспериментальных точек. Однако анализ проводили в совокупности для всех сополимеров, что обнаружило получение значащих и неожиданных результатов.
Анализ 3: Совокупные значения для всех сополимеров пропилен/этилен
Таблица 5 приводит средние значения производительности, СТР и молекулярной массы для всех прогонов при испытаниях катализаторов изобретения в случае их использования при получении сополимера пропилен/этилен в сопоставлении с тем, что имеет место для сравнительных катализаторов в случае их использования при получении того же самого. Каждый раз при приведении значения в виде «меньшего чем» или «большего чем» некое значение данное значение доводят до ближайшего числа, которое придавало бы примерам изобретения наихудший вид, а сравнительным примерам наилучший. Короче говоря, таблица 5 составлена в известном смысле в целях демонстрации наихудшего случая для примеров изобретения и наилучшего случая для сравнительных примеров.
Даже при данных доводках катализаторы изобретения в совокупности демонстрируют радикальное улучшение в сопоставлении со сравнительными катализаторами. Совокупная производительность в примерах изобретения в случае использования при получении сополимеров обнаруживает небольшое улучшение (1,5%) в сопоставлении с тем, что имеет место в сравнительных примерах. Однако данное улучшение оказывается вполне значащим при его рассмотрении в свете радикального улучшения значений СТР 2,16, СТР 5 и молекулярной массы, где все это представляет собой исключительно требуемые качества. В совокупности при получении сополимеров катализаторы изобретения обеспечивают получение значения СТР 2,16, которое является меньшим чем 0,2% от того, что имеет место для сравнительных катализаторов, что демонстрирует исключительно значащее улучшение. Подобным же образом в совокупности при получении сополимеров катализаторы изобретения обеспечивают получение значения СТР 5, которое составляет 0,5% от того, что имеет место для сравнительных катализаторов, что опять-таки демонстрирует исключительно значащее улучшение. В совокупности при получении сополимеров катализаторы изобретения обеспечивают увеличение молекулярной массы на 74% от того, что имеет место для сравнительных катализаторов. В совокупности катализаторы изобретения являются отчетливо и неожиданно намного превосходящими сравнительные катализаторы.
Анализ 4: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 48, и не в присутствии водорода
В данном случае испытания проводили только для одного катализатора изобретения (пример 13) в сопоставлении с одним сравнительным катализатором (пример 23), при этом результаты приведены в таблице 6. Как и раньше, катализатор изобретения продемонстрировал значительное улучшение в сопоставлении со сравнительным катализатором по всем измеренным уровням. Говоря конкретно, в случае значения СТР 2,16 пример изобретения 13 продемонстрировал 50%-ное уменьшение в сопоставлении с первоначальным значением в примере 23. В случае значения СТР 5 пример изобретения 13 продемонстрировал 45%-ное уменьшение в сопоставлении с первоначальным значением в примере 23. Молекулярная масса в примере изобретения 13 продемонстрировала увеличение на 26% в сопоставлении с первоначальным значением. Производительность также значительно улучшилась, при этом пример изобретения характеризуется 118%-ным увеличением в сопоставлении со значением из сравнительного примера.
Анализ 5: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 31,5, и не в присутствии водорода
В данном случае испытания проводили для двух катализаторов изобретения (примеры 13 и 14) и одного сравнительного катализатора (пример 23), при этом результаты приведены в таблице 7. Однако, как отмечалось ранее, единственное корректное сопоставление может быть проведено между катализатором изобретения (пример 13) и сравнительным катализатором (пример 23) вследствие идентичности замещений во всех положениях, отличных от положения 2 инденильной группы. Пример изобретения 14 в данном анализе не рассматривается, и делать это было бы некорректно.
Как и раньше, катализатор изобретения продемонстрировал улучшение в сопоставлении со сравнительным катализатором по всем измеренным уровням. Несмотря на идентичность значения СТР 2,16 в обоих примерах в случае значения СТР 5 пример изобретения 13 продемонстрировал 14%-ное уменьшение в сопоставлении с первоначальным значением в примере 23. Молекулярная масса в примере изобретения 13 продемонстрировала увеличение на 11,5% в сопоставлении с первоначальным значением. Производительность значительно улучшилась, при этом пример изобретения характеризуется 73%-ным увеличением в сопоставлении со значением из сравнительного примера.
Анализ 6: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 15,8, и не в присутствии водорода
В данном случае испытания проводили для двух катализаторов изобретения (примеры 13 и 14) и одного сравнительного катализатора (пример 23), при этом результаты приведены в таблице 8. Однако, как отмечалось ранее, единственное корректное сопоставление может быть проведено между катализатором изобретения (пример 13) и сравнительным катализатором (пример 23) вследствие идентичности замещений во всех положениях, отличных от положения 2 инденильной группы. Пример изобретения 14 в данном анализе не рассматривается, и делать это было бы некорректно.
В данном случае опять-таки катализатор изобретения обеспечивает достижение значительно улучшенной производительности (12,5%) при одновременном все еще получении сопоставимого продукта, имеющего подобную коммерческую ценность. Значительно повышенная производительность в сочетании с ранее упомянутым фактом намного более легкого и более экономичного получения симметрично замещенных металлоценовых катализаторов в положении 2 в сопоставлении с асимметрично замещенными металлоценами демонстрирует наличие неожиданного преимущества у данного металлоценового катализатора.
Анализ 7: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 10,1, и не в присутствии водорода
В данном случае испытания проводили для двух катализаторов изобретения (примеры 13 и 14) и одного сравнительного катализатора (пример 23), при этом результаты приведены в таблице 9. Однако, как отмечалось ранее, единственное корректное сопоставление может быть проведено между катализатором изобретения (пример 13) и сравнительным катализатором (пример 23) вследствие идентичности замещений во всех положениях, отличных от положения 2 инденильной группы. Пример изобретения 14 в данном анализе не рассматривается, и делать это было бы некорректно.
Как и при анализе 6, катализатор изобретения в данном примере обеспечивает достижение лучшей производительности (1,8%) при одновременном все еще получении сопоставимого продукта, имеющего подобную коммерческую ценность. Повышенная производительность в сочетании с ранее упомянутым фактом значительно более легкого и более экономичного получения симметрично замещенных металлоценовых катализаторов в положении 2 в сопоставлении с асимметрично замещенными металлоценами демонстрирует наличие неожиданного преимущества у данного металлоценового катализатора.
Анализ 8: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 0,5, и не в присутствии водорода
В данном случае испытания проводили для двух катализаторов изобретения (примеры 13 и 19) и одного сравнительного катализатора (пример 21), при этом результаты приведены в таблице 10. Однако, как отмечалось ранее, единственное корректное сопоставление может быть проведено для катализатора изобретения, имеющего замещения, которые идентичны во всех позициях инденильной группы, отличных от положения 2. Данные случаи не дают какой-либо возможности проведения сравнительного анализа, но представлены только в информационных целях.
Анализ 9: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 0,5, и не в присутствии водорода
В данном случае испытания проводили для двух катализаторов изобретения (примеры 13 и 19) и двух сравнительных катализаторов (примеры 20 и 21), при этом результаты приведены в таблице 11. Однако, как отмечалось ранее, единственное корректное сопоставление может быть проведено для катализатора изобретения, имеющего замещения, которые идентичны во всех позициях инденильной группы, отличных от положения 2. Данные случаи не дают какой-либо возможности проведения сравнительного анализа, но представлены только в информационных целях.
Анализ 10: Получение сополимеров пропилен/этилен при соотношении количеств пропилен/этилен, равном приблизительно 0,5, и не в присутствии водорода
Таблица 12 демонстрирует результаты по восьми экспериментальным металлоценовым катализаторам, соответствующим требованиям изобретения, в сопоставлении с четырьмя сравнительными примерами. В совокупности катализаторы настоящего изобретения обнаружили более чем 525%-ное увеличение молекулярной массы. Кроме того, катализаторы настоящего изобретения приводили к получению продуктов, характеризующихся совокупным значением СТР 2,16, меньшим чем 0,15% от того, что имеет место для сравнительных продуктов, и совокупным значением СТР 5, немного большим чем 0,43% от того, что имеет место в сравнительных примерах. Производительность у данных образцов в данных случаях не могла быть определена, поскольку во всех данных примерах и сравнительных примерах получали аморфные каучуки пропилен/этилен. Такие полимеры в общем случае прилипают к стенкам автоклава и к перемешивающему устройству, и количественная выгрузка из автоклава была невозможна, что делает определение производительностей ненадежным. С коммерческой точки зрения полимеры, содержащие такие каучуковые компоненты, получают по двухстадийной полимеризации, где на первой стадии получают гомополимер, а на второй стадии получают каучук. Данная мера уменьшает липкость материала и делает возможными коммерческое получение и использование таких важных материалов в областях применения, в которых требуется наличие низкотемпературной ударной вязкости (в областях применения, подобных бамперам для автомобилей, упаковке продуктов питания, ящикам и лоткам для холодильников и морозильников глубокого замораживания).
Сопоставления индивидуальных катализаторов между образцами изобретения 13, 17 и 18 и сравнительным примером 22 являются настолько же драматическими. (Можно напомнить о том, что другие сопоставления не были бы корректными вследствие альтернативных замещений во всех положениях инденильной группы, отличных от положения 2). Как следует из сопоставления примеров 13, 17 и 18 со сравнительным примером 22, все три примера изобретения характеризуются значительно меньшими уровнями значений СТР 2,16 и СТР 5. Молекулярные массы оставались неизменными или увеличивались. Говоря конкретно, в случае значения СТР 2,16 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 34%, 98% и более чем 99% в сопоставлении с первоначальным значением в примере 22. В случае значения СТР 5 примеры изобретения 13, 17 и 18 демонстрируют соответственное уменьшение на 36%, 98% и более чем 99% в сопоставлении с первоначальным значением в примере 22. Что касается молекулярной массы, то пример изобретения 13 приводил к получению той же самой молекулярной массы, что и сравнительный пример 22, а примеры 17 и 18 демонстрируют соответственное увеличение на 159% и 347% в сопоставлении с первоначальным значением.
Примеры катализатора изобретения в сопоставлении со сравнительными примерами воспроизводимо демонстрируют радикальное улучшение по увеличению производительности и молекулярной массы и уменьшению значений СТР.
Полимеризации
[г полимера/г катализатора*
час]
Свойства полимеров
[градус С]
[г/10 мин]
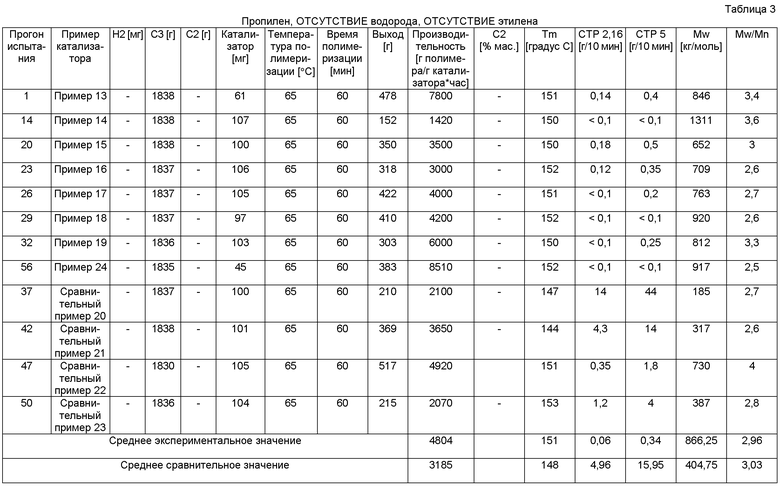
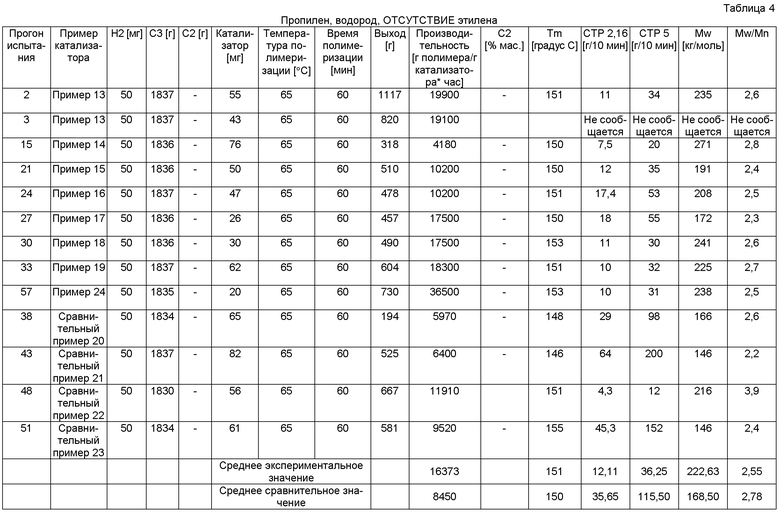
Совокупная краткая сводка всех значений по сополимерам
[% мас.]
[градус С]
[г/10 мин]
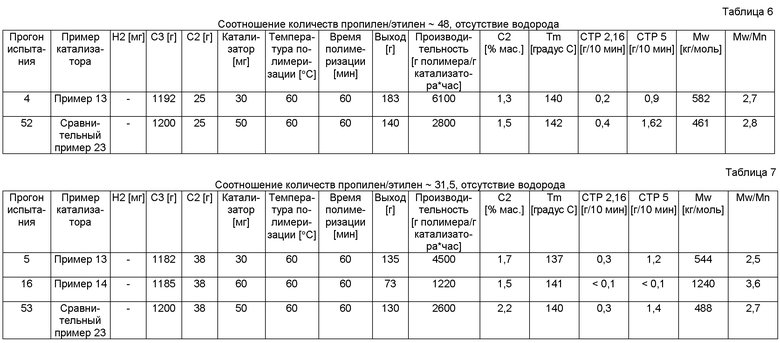
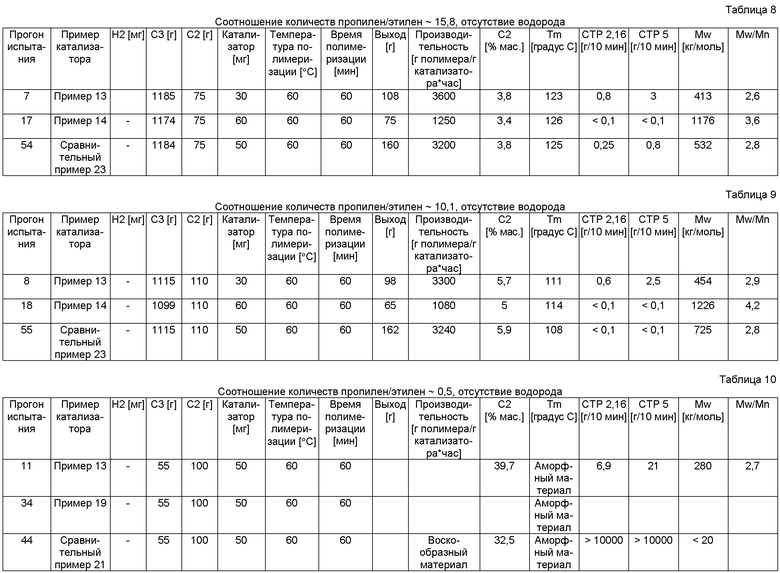
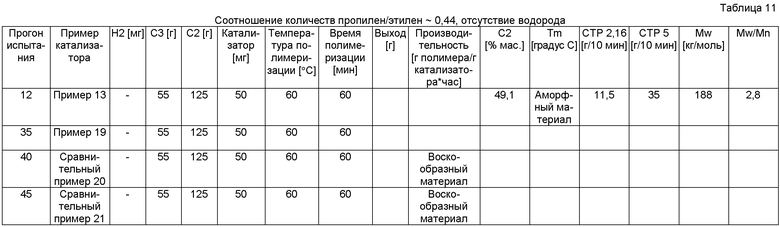
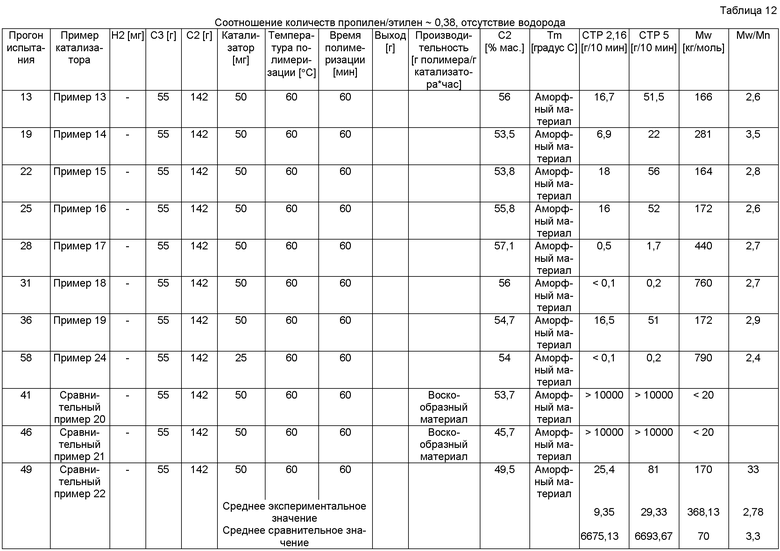
Несмотря на содержание в вышеизложенном описании изобретения множества конкретных признаков, они должны восприниматься не в качестве ограничений изобретения, а просто в качестве примеров, подтверждающих варианты его реализации.

Изобретение относится к мостиковому металлоцену общей формулы 1
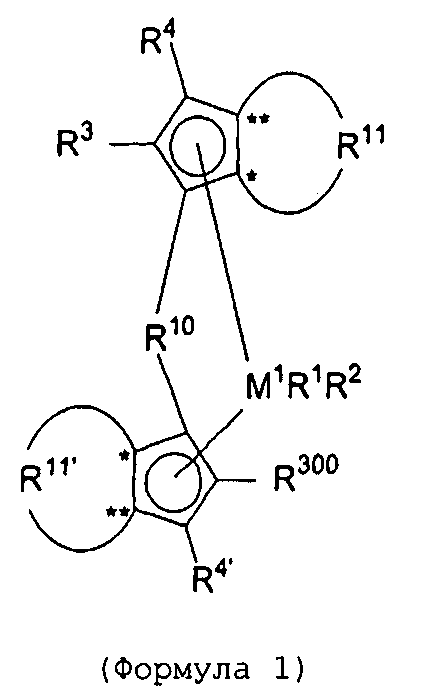
где М1 представляет собой металл из группы IVb периодической таблицы элементов, значения радикалов R1, R2, R3, R4, R4', R10, R11, R11' и R300 такие, как указано в формуле изобретения. Также предложены способы полимеризации олефинов. Мостиковые металлоцены используются в качестве компонентов в катализаторах полимеризации и демонстрируют улучшение по увеличению производительности, молекулярной массы олефинового полимера и уменьшению значений скорости течения расплава. 4 н. и 62 з.п. ф-лы, 1 ил., 12 табл., 24 пр.
1. Мостиковый металлоцен общей формулы 1
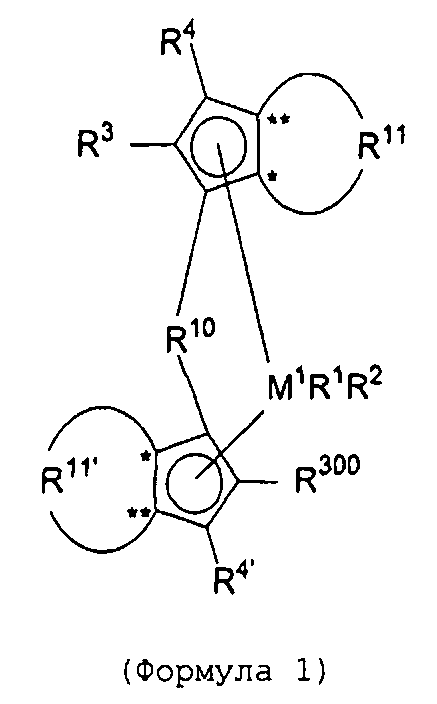
где М1 представляет собой металл из группы IVb Периодической таблицы элементов,
R1 и R2 являются идентичными или различными и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, группу ОН, атом галогена или группу 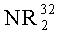 , где R32 представляет собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 14 атомов углерода, и R1 и R2 могут формировать одну или несколько кольцевых систем (систему),
, где R32 представляет собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 14 атомов углерода, и R1 и R2 могут формировать одну или несколько кольцевых систем (систему),
R4 и R4' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, необязательно содержащую один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br,
R10 представляет собой мостиковую группу, где R10 выбирают из:

где R40 и R41 даже в случае наличия одного и того же индекса могут быть идентичными или различными и могут необязательно содержать гетероатомы, выбираемые из группы, состоящей из Si, В, Al, О, S, N, Р, Cl и Br, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 30 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, фторалкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, замещенный или незамещенный алкилсилил, алкил(арил)силильную группу, арилсилильную группу или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или где R40 и R41 совместно с атомами, соединяющими их, могут формировать одну или несколько циклических систем,
х представляет собой целое число от 1 до 18,
М12 представляет собой кремний, германий или олово, и
R10 также может соединять друг с другом два звена формулы 1,
R11 и R11' являются идентичными или различными и каждый из них представляет собой двухвалентную С2-С40 группу, которая совместно с циклопентадиенильным кольцом формирует дополнительную насыщенную или ненасыщенную кольцевую систему, имеющую размер кольца от 5 до 7 атомов, где R11 и R11' необязательно содержат гетероатомы Si, Ge, N, Р, О или S в кольцевой системе, сконденсированной с циклопентадиенильным кольцом,
R300 представляет собой группу -CH2-CR301R302R303 или CH=R302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и R301, R302, R303 выбирают из группы состоящей из атома водорода или линейной, циклической или разветвленной углеводородной группы, выбираемой из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 20 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы или арилсилильной группы, где группы необязательно содержат один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, при том условии, что как R302, так и R303 не представляют собой атомы водорода,
R3 имеет значение R300 или R3 представляет собой атом водорода.
2. Металлоцен по п.1, где R1 и R2 являются идентичными или различными и представляют собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода или атом галогена, или R1 и R2 совместно могут формировать одну или несколько кольцевых систем (систему), а М1 представляет собой цирконий или гафний.
3. Металлоцен по п.1, где R1 и R2 являются идентичными или различными и представляют собой метил, хлор или фенолят.
4. Металлоцен по п.1, где R4 и/или R4' представляют собой атом водорода, алкильную группу, содержащую от 1 до 20 атомов углерода, алкенильную группу, содержащую от 2 до 20 атомов углерода, арильную группу, содержащую от 6 до 20 атомов углерода, арилалкильную группу, содержащую от 7 до 40 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 40 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
5. Металлоцен по п.1, где R4 и/или R4' представляют собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
6. Металлоцен по п.1, где как R4, так и R4' представляют собой водород.
7. Металлоцен по п.1, где R10 представляет собой -(R40)(R41)Si-, -(R40)(R41)Ge-, -(R40)(R41)C- или -(R40R41C-CR40R41)-, где R40 и R41 являются идентичными или различными и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 14 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 14 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
8. Металлоцен по п.1, где мостиковое звено R10 представляет собой -(R40)(R41)Si- или -(R40)(R41)Ge-, где R40 и R41 являются идентичными или различными и представляют собой метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, циклопентил, циклопентадиенил, циклогексил, фенил, нафтил, бензил, триметилсилил или 3,3,3-трифторпропил.
9. Металлоцен по п.1, где группы R11 и R11' являются идентичными или различными и каждая из них представляет собой двухвалентную группу, выбираемую из тех, которые приводятся в формулах 1α, β, γ, δ, φ и ν и в формулах 1α', β', γ', δ', φ' и ν' соответственно, где звездочки «*» и «**» в формуле 1 и формулах 1α-ν и 1α'-ν' соответственно обозначают химические связи, соединяющие R11 и R11' с циклопентадиенильными кольцами
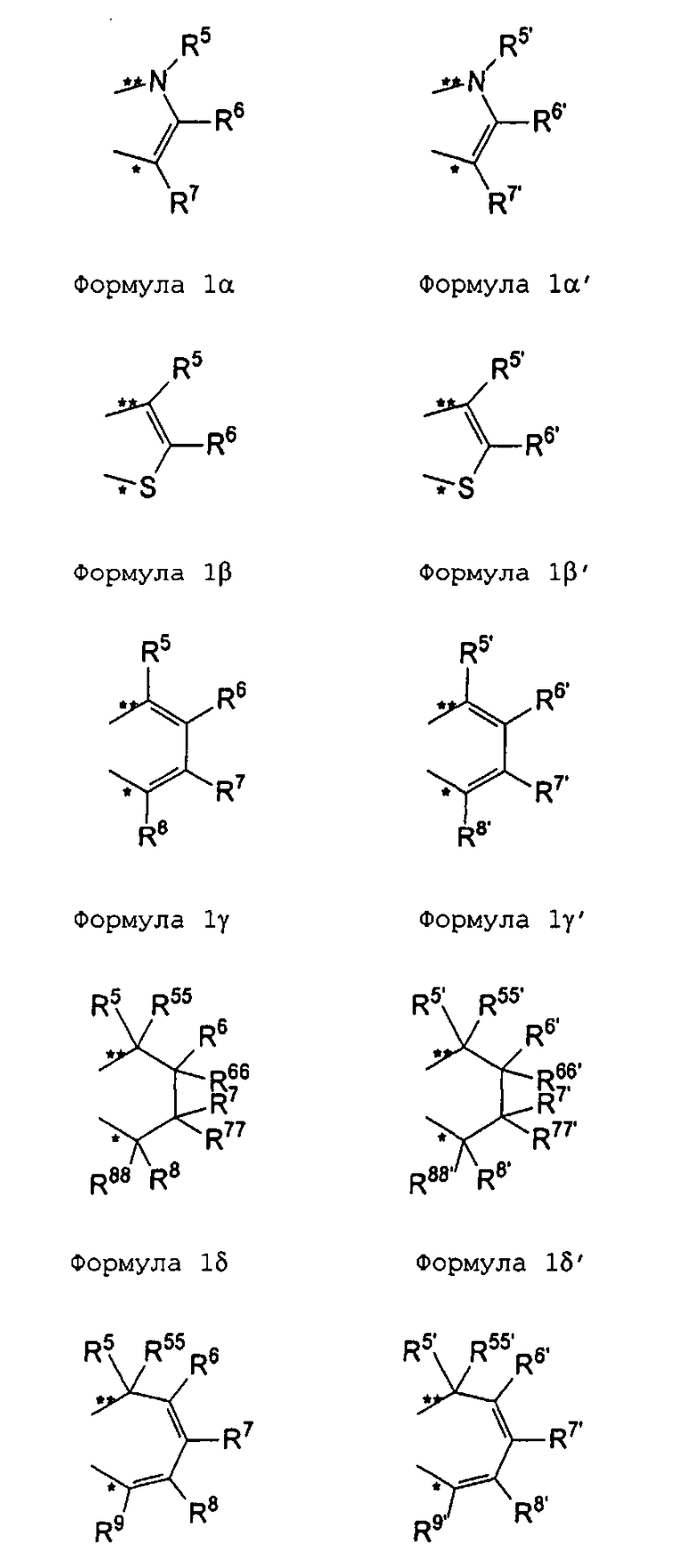
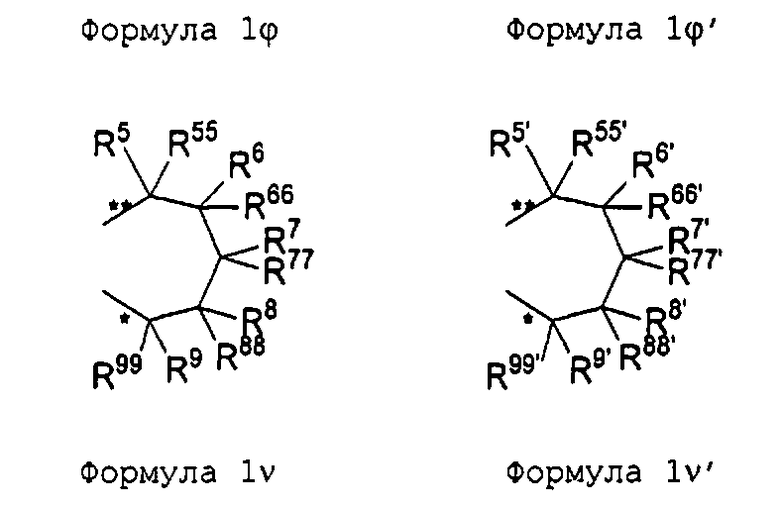
где R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9', кроме того, R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, содержащую или не содержащую гетероатомы, выбираемые из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, и где упомянутые R5, R6, R7, R8, R9, R5', R6', R7', R8', R9', R55, R66, R77, R88, R99, R55', R66', R77', R88', R99' индивидуально выбирают из алкильной группы, содержащей от 2 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 40 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, или замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы или арилсилильной группы, или где два соседних радикала R5, R6 или R5', R6', или R6, R7 или R6', R7', или R7, R8 или R7', R8', или R8, R9 или R8', R9', кроме того, R55, R66 или R55', R66', или R66, R77 или R66', R77', или R77, R88 или R77', R88', или R88, R99 или R88', R99' в каждом случае могут формировать насыщенную или ненасыщенную углеводородную кольцевую систему.
10. Металлоцен по п.9, где R11 и R11' являются идентичными или различными и R11 представляет собой двухвалентную группу формулы 1γ, a R11' выбирают из двухвалентных групп формул 1α', β' и γ', или R11 и R11' являются идентичными или различными и представляют собой двухвалентные группы формул 1α и 1α', или формул 1β и 1β', или формул 1γ и 1γ', или формул 1δ и 1δ', или формул 1φ и 1φ', или формул lν и lν' соответственно.
11. Металлоцен по п.9, где каждый из R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' представляет собой атом водорода, и R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9' являются идентичными или различными и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, и группы могут содержать один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, или где два соседних радикала R5/R6 и R5'/R6' формируют углеводородную кольцевую систему, или R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
12. Металлоцен по п.9, где каждый из R55, R66, R77, R88 и R99 и R55', R66', R77', R88' и R99' представляет собой атом водорода и R5, R6, R7, R8 и R9 и R5', R6', R7', R8' и R9' являются идентичными или различными и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, или где два соседних радикала R5, R6, а также R5', R6' совместно формируют кольцевую систему, или R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
13. Металлоцен по п.1, где R300 представляет собой группу -СН2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, где каждый из R301, R302, R303 представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, или R302 и R303 совместно могут формировать кольцевую систему, или R301, R302 и R303 совместно могут формировать кольцевую систему, при том условии, что R302 и R303 не представляют собой атом водорода.
14. Металлоцен по п.13, где каждый из R301, R302, R303 индивидуально выбирают из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 20 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода.
15. Металлоцен по п.1, где R300 представляет собой группу -СН2-CR301R302R303, где R301 представляет собой атом водорода, R302 и R303 являются идентичными или различными и каждый из R302 и R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, или R302 и R303 совместно могут формировать кольцевую систему при том условии, что R300 содержит более чем 6 атомов углерода.
16. Металлоцен по п.15, где каждый из R302 и/или R303 индивидуально выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арильной группы, содержащей от 6 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода.
17. Металлоцен по п.1, где R300 представляет собой группу -СН2-CR301R302R303, где R301 и R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из R301, R302, R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R300 содержит более чем 6 атомов углерода.
18. Металлоцен по п.1, где R3 имеет значение R300.
19. Металлоцен по п.1, где R3 и R300 являются идентичными.
20. Металлоцен по п.1, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, при этом упомянутую углеводородную группу выбирают из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R302 и R303 не представляют собой атом водорода.
21. Металлоцен по п.1, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303 представляет собой атом водорода и где R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, при этом упомянутую углеводородную группу выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
22. Металлоцен по п.1, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303 и R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной и которую выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
23. Металлоцен по п.1, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303 и R301 и R302 являются идентичными или различными и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, или арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
24. Способ полимеризации олефинов, включающий введение одного или нескольких олефинов, каждый из которых содержит от 2 до приблизительно 20 атомов углерода, в условиях проведения реакции полимеризации олефинов в контакт с системой катализатора, содержащей мостиковый металлоценовый компонент формулы 1
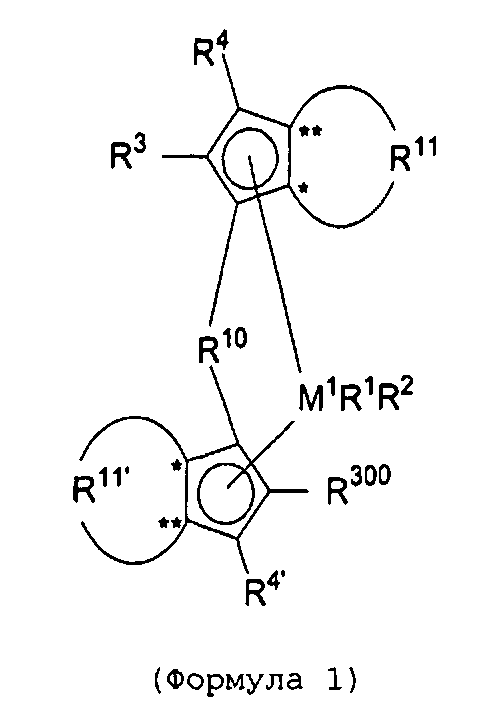
где М1 представляет собой металл из группы IVb Периодической таблицы элементов,
R1 и R2 являются идентичными или различными и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 20 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, группу ОН, атом галогена или группу 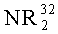 , где R32 представляет собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 14 атомов углерода, и R1 и R2 могут формировать одну или несколько кольцевых систем (систему),
, где R32 представляет собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 14 атомов углерода, и R1 и R2 могут формировать одну или несколько кольцевых систем (систему),
R4 и R4' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, необязательно содержащую один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br,
R10 представляет собой мостиковую группу, где R10 выбирают из:
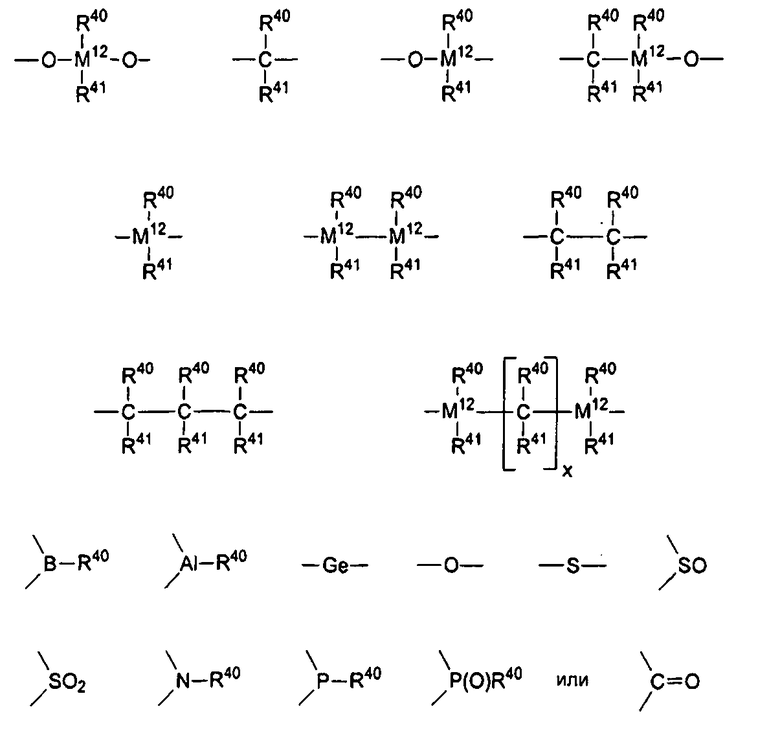
где R40 и R41 даже в случае наличия одного и того же индекса могут быть идентичными или различными и могут необязательно содержать гетероатомы, выбираемые из группы, состоящей из Si, В, Al, О, S, N, Р, О и Br, и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 30 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, фторалкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 40 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 40 атомов углерода, замещенный или незамещенный алкилсилил, алкил(арил)силильную группу, арилсилильную группу или арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, или где R40 и R41 совместно с атомами, соединяющими их, могут формировать одну или несколько циклических систем,
х представляет собой целое число от 1 до 18,
М представляет собой кремний, германий или олово, и
R10 также может соединять друг с другом два звена формулы 1,
R11 и R11' являются идентичными или различными и каждый из них представляет собой двухвалентную С2-С40 группу, которая совместно с циклопентадиенильным кольцом формирует дополнительную насыщенную или ненасыщенную кольцевую систему, имеющую размер кольца от 5 до 7 атомов, где R11 и R11' необязательно содержат гетероатомы Si, Ge, N, Р, О или S в кольцевой системе, сконденсированной с циклопентадиенильным кольцом,
R300 представляет собой группу -CH2-CR301R302R303 или -CH=CR302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему, и R301, R302, R303 выбирают из группы, состоящей из атома водорода или линейной, циклической или разветвленной углеводородной группы, выбираемой из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 20 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы или арилсилильной группы, где группы необязательно содержат один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, при том условии, что как R302, так и R303 не представляют собой атом водорода,
R3 имеет значение R300 или R3 представляет собой атом водорода.
25. Способ по п.24, где R1 и R2 являются идентичными или различными и представляют собой алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, арилоксигруппу, содержащую от 6 до приблизительно 10 атомов углерода или атом галогена, или R1 и R2 совместно могут формировать одну или несколько кольцевых систем (систему), а М1 представляет собой цирконий или гафний.
26. Способ по п.24, где R1 и R2 являются идентичными или различными и представляют собой метил, хлор или фенолят.
27. Способ по п.24, где R4 и/или R4' представляют собой атом водорода, алкильную группу, содержащую от 1 до 20 атомов углерода, алкенильную группу, содержащую от 2 до 20 атомов углерода, арильную группу, содержащую от 6 до 20 атомов углерода, арилалкильную группу, содержащую от 7 до 40 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 40 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 40 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
28. Способ по п.24, где R4 и/или R4' представляют собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 8 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
29. Способ по п.24, где как R, так и R4' представляют собой водород.
30. Способ по п.24, где R10 представляет собой -(R40)(R41)Si-, -(R40)(R41)Ge-, -(R40)(R41)C- или -(R40R41C-CR40R41)-, где R40 и R41 являются идентичными или различными и каждый из них представляет собой атом водорода, алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 14 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 14 атомов углерода, замещенную или незамещенную алкилсилильную группу, алкил(арил)силильную группу или арилсилильную группу.
31. Способ по п.24, где мостиковое звено R10 представляет собой -(R40)(R41)Si- или -(R40)(R41)Ge-, где R40 и R41 являются идентичными или различными и представляют собой метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, циклопентил, циклопентадиенил, циклогексил, фенил, нафтил, бензил, триметилсилил или 3,3,3-трифторпропил.
32. Способ по п.24, где группы R11 и R11' являются идентичными или различными и каждая из них представляет собой двухвалентную группу, выбираемую из тех, которые приводятся в формулах 1α, β, γ, δ, φ и ν и в формулах 1α', β', γ', δ', φ' и ν' соответственно, где звездочки «*» и «**» в формуле 1 и формулах 1α-ν и 1α'-ν' соответственно обозначают химические связи, соединяющие R11 и R11' с циклопентадиенильными кольцами.
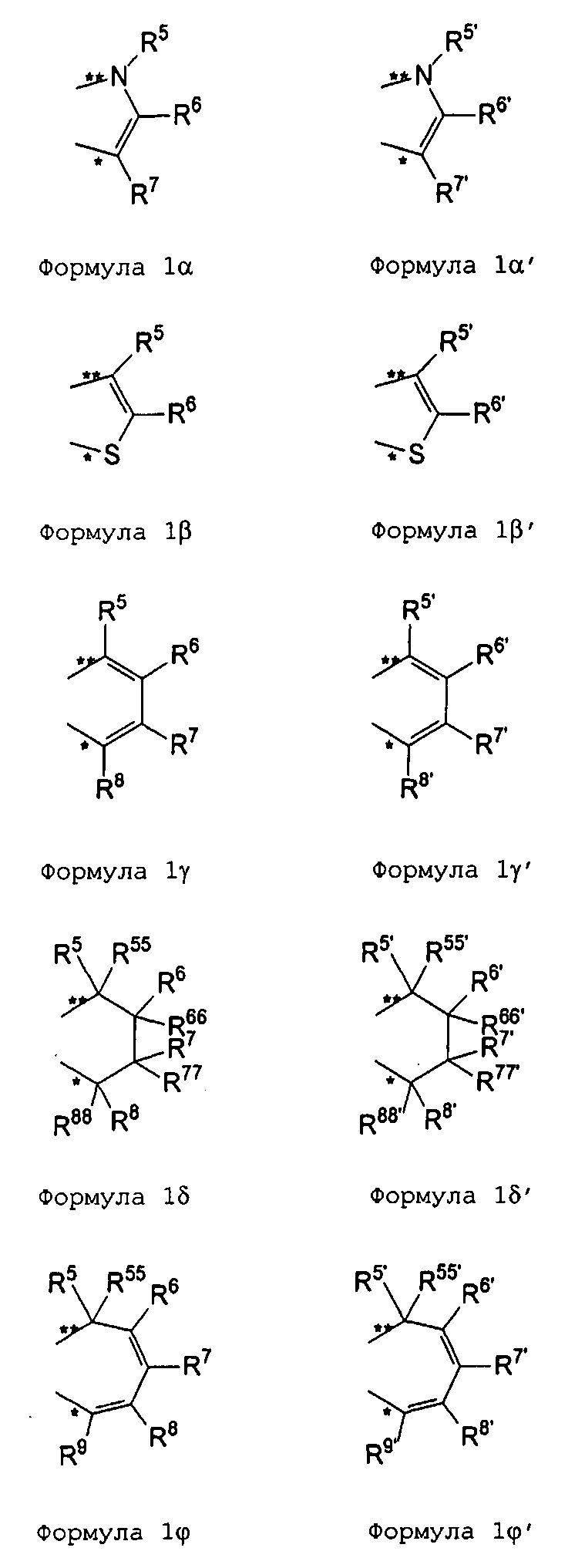

где R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9', кроме того, R55, R66, R77, R88 и R99, а также R55', R66', R77', R88' и R99' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, содержащую или не содержащую гетероатомы, выбираемые из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, и где упомянутые R5, R6, R7, R8, R9, R5, R6', R7', R8', R9', R55, R66, R77, R88, R99, R55', R66', R77', R88' и R99' индивидуально выбирают из алкильной группы, содержащей от 2 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 40 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, или замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы или арилсилильной группы, или где два соседних радикала R5, R6 или R5', R6', или R6, R7 или R6', R7', или R7, R8 или R7', R8', или R8, R9 или R8', R9', кроме того, R55, R66 или R55', R66', или R66, R77 или R66', R77', или R77, R88 или R77', R88', или R88, R99 или R88', R99' в каждом случае могут формировать насыщенную или ненасыщенную углеводородную кольцевую систему.
33. Способ по п.32, где R11 и R11' являются идентичными или различными и R11 представляет собой двухвалентную группу формулы 1γ, a R11' выбирают из двухвалентных групп формул 1α', β' и γ', или R11 и R11' являются идентичными или различными и представляют собой двухвалентные группы формул 1α и 1α', или формул 1β и 1β', или формул 1γ и 1γ', или формул 1δ и 1δ', или формул 1φ и 1φ', или формул lν и 1ν' соответственно.
34. Способ по п.32, где каждый из R55, R66, R77, R88 и R99, а также R55, R66', R77', R88' и R99' представляет собой атом водорода, R5, R6, R7, R8 и R9, а также R5', R6', R7', R8' и R9' являются идентичными или различными и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, и группы могут содержать один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Аl, О, S, N, Р, F, Cl и Br, или где два соседних радикала R5/R6 и R5'/R6' формируют углеводородную кольцевую систему, или R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
35. Способ по п.32, где каждый из R55, R66, R77, R88 и R99 и R55, R66', R77', R88' и R99' представляет собой атом водорода и R5, R6, R7, R8 и R9 и R5', R6', R7', R8' и R9' являются идентичными или различными и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, или где два соседних радикала R5, R6, а также R5', R6' совместно формируют кольцевую систему, или R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
36. Способ по п.24, где R300 представляет собой группу -CH2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, где каждый из R301, R302, R303 представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, или R302 и R303 совместно могут формировать кольцевую систему, или R301, R302, R303 совместно могут формировать кольцевую систему, при том условии, что R302 и R303 не представляют собой атом водорода.
37. Способ по п.36, где каждый из R301, R302, R303 индивидуально выбирают из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 20 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода.
38. Способ по п.24, где R300 представляет собой группу -CH2-CR301R302R303, где R301 представляет собой атом водорода и где R302 и R303 являются идентичными или различными и каждый из R302 и R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, или R302 и R303 совместно могут формировать кольцевую систему, при том условии, что R300 содержит более чем 6 атомов углерода.
39. Способ по п.38, где каждый из R302 и/или R303 индивидуально выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арильной группы, содержащей от 6 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, или арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода.
40. Способ по п.24, где R300 представляет собой группу -CH2-CR301R302R303, где R301, и R302, и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из R301, R302, R303 представляет собой линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, и которую выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арильной группы, содержащей от 6 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, или арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R300 содержит более чем 6 атомов углерода.
41. Способ по п.24, где R3 имеет значение R300.
42. Способ по п.24, где R3 и R300 являются идентичными.
43. Способ по п.24, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R301, R302 и R303 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему, и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, при этом упомянутую углеводородную группу выбирают из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R302 и R303 не представляют собой атом водорода.
44. Способ по п.24, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303 представляет собой атом водорода и где R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая необязательно может быть галогенированной, при этом упомянутую углеводородную группу выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
45. Способ по п.24, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303 и R301 и R302 являются идентичными или различными, и/или R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, например алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, алкенильную группу, содержащую от 2 до приблизительно 10 атомов углерода, арилалкильную группу, содержащую от 7 до приблизительно 20 атомов углерода, алкиларильную группу, содержащую от 7 до приблизительно 20 атомов углерода, арилалкенильную группу, содержащую от 8 до приблизительно 20 атомов углерода, алкоксигруппу, содержащую от 1 до приблизительно 10 атомов углерода, и арилоксигруппу, содержащую от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
46. Способ по п.24, где R3 и R300 являются идентичными и представляют собой группу -CH2-CR301R302R303, где R303, и R301, и R302 являются идентичными или различными, и/или R301, R302 и R303 совместно могут формировать кольцевую систему и каждый из них представляет собой линейную, циклическую или разветвленную углеводородную группу, которая может быть галогенированной, и которую выбирают из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 20 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 20 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 20 атомов углерода, алкоксигруппы, содержащей от 1 до приблизительно 10 атомов углерода, и арилоксигруппы, содержащей от 6 до приблизительно 20 атомов углерода, при том условии, что R3 и R300 содержат более чем 6 атомов углерода.
47. Способ по п.24, где олефины включают пропилен и/или этилен.
48. Способ по п.24, где олефины включают, по меньшей мере, один олефин формулы Rm-CH=CH-Rn, где Rm и Rn являются идентичными или различными и каждый из них индивидуально представляет собой атом водорода или радикал, содержащий от 1 до приблизительно 20 атомов углерода, или Rm и Rn совместно могут формировать одно или несколько колец.
49. Способ по п.24, где олефины включают одно или несколько соединений, выбираемых из группы, состоящей из этилена, пропилена, 1-бутена, 1-пентена, 1-гексена, 4-метил-1-пентена или 1-октена, стирола, 1,3-бутадиена, 1,4-гексадиена, винилнорборнена, норборнадиена, этилнорборнадиена, норборнена, тетрациклододецена и метилнорборнена.
50. Мостиковый металлоцен общей формулы 1а
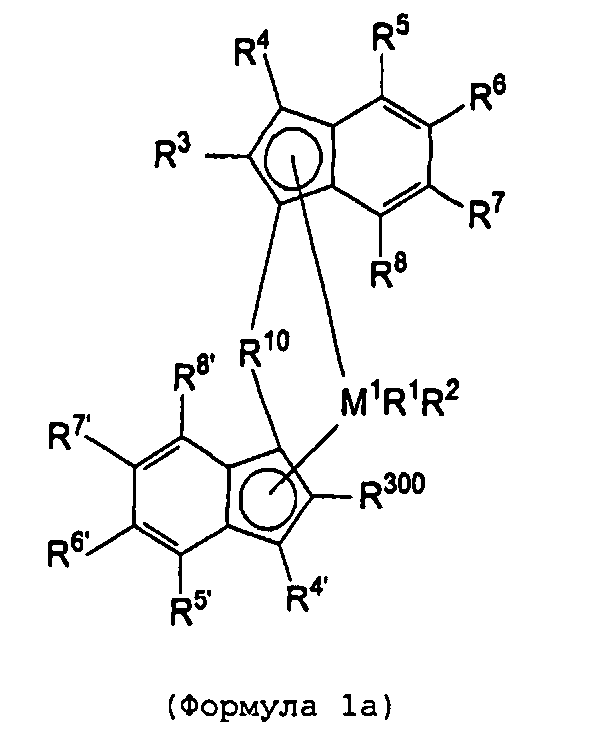
где R5, R6, R7 и R8, а также R5', R6', R7' и R8' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, выбираемую из алкильной группы, содержащей от 1 до приблизительно 20 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 20 атомов углерода, арильной группы, содержащей от 6 до приблизительно 40 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы и арилсилильной группы, причем R1, R2, R3, R300 и М1 определены в п.1.
51. Металлоцен по п.50, где линейные, циклические или разветвленные углеводородные группы содержат один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, и/или два соседних радикала R5, R6, или R6, R7, или R7, R8, а также R5', R6', или R6', R7', или R7', R8' в каждом случае могут формировать углеводородную кольцевую систему.
52. Металлоцен по п.50, где R5, R6, R7 и R8, а также R5', R6', R7' и R8' являются идентичными или различными и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, и где два соседних радикала R5, R6, а также R5', R6' могут формировать насыщенную или ненасыщенную углеводородную кольцевую систему.
53. Металлоцен по п.50, где R6, R7, R8, а также R6', R7' и R8' являются идентичными или различными и каждый из них представляет собой атом водорода, линейную, циклическую или разветвленную углеводородную группу, выбираемую из алкильной группы, содержащей от 1 до приблизительно 10 атомов углерода, алкенильной группы, содержащей от 2 до приблизительно 10 атомов углерода, арильной группы, содержащей от 6 до приблизительно 20 атомов углерода, арилалкильной группы, содержащей от 7 до приблизительно 40 атомов углерода, алкиларильной группы, содержащей от 7 до приблизительно 40 атомов углерода, арилалкенильной группы, содержащей от 8 до приблизительно 40 атомов углерода, замещенной или незамещенной алкилсилильной группы, алкил(арил)силильной группы и арилсилильной группы, и/или два соседних радикала R6, R7 или R7, R8, а также R6', R7' или R7', R8' в каждом случае могут формировать углеводородную кольцевую систему, и где R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода, которые могут содержать один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br.
54. Металлоцен по п.53, где линейные, циклические или разветвленные углеводородные группы могут содержать один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br.
55. Металлоцен по п.50, где R6, R7 и R8, а также R6', R7' и R8' являются идентичными или различными и каждый из них представляет собой атом водорода, замещенную или незамещенную алкилсилильную или арилсилильную группу, линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, которые могут содержать один или несколько гетероатомов, выбираемых из группы, состоящей из Si, В, Al, О, S, N, Р, F, Cl и Br, и где R5 и R5' являются идентичными или различными и каждый из них представляет собой замещенную или незамещенную арильную группу, содержащую от 6 до приблизительно 40 атомов углерода.
56. Металлоцен по п.50, где R6, R7 и R8, а также R6', R7' и R8' являются идентичными или различными и каждый из них представляет собой атом водорода или линейную, циклическую или разветвленную алкильную группу, содержащую от 1 до приблизительно 10 атомов углерода, или арильную группу, содержащую от 6 до приблизительно 10 атомов углерода, и где R5 и R5' являются идентичными или различными и каждый из них представляет собой нафтил, 4-(С1-С10алкил)фенил или 4-(С6-С10арил)фенил, такой как 4-метилфенил, 4-бифенил, 4-этилфенил, 4-н-пропилфенил, 4-изопропилфенил, 4-трет-бутилфенил, 4-втор-бутилфенил, 4-циклогексилфенил, 4-триметилсилилфенил, 4-адамантилфенил, 4-(С1-С10фторалкил)фенил, 3-(С1-С10алкил)фенил, 3-(С1-С10фторалкил)фенил, 3-(С6-С20арил)фенил, подобный 3-бифенилу, 3,5-ди(С1-С10алкил)фенил, такой как 3,5-диметилфенил, 3,5-ди(С1-С10фторалкил)фенил, такой как 3,5-ди(трифторметил)фенил, или 3,5-(С6-С20арил)фенил, подобный 3,5-терфенилу.
57. Металлоцен по п.50, где металлоцен представляет собой соединение, выбираемое из группы, состоящей из:
диметилсиландиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циююгептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-триметилсилилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-(2-метокси-2-метилпропил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-(2,6-диметилбензил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-(2,4,6-триметилбензил)-4-(4-трет-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис [2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циююгексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циююгептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2Л]гептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1] гептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(н-пропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-трет-бутилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклопентилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогексилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-циклогептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-адамантилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(1-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(2-нафтил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-метилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-этилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-н-пропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-изопропилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-третбутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-втор-бутилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-циклогексилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-триметилсилилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(4-адамантилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3-бифенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-ди(трифторметил)фенил)инденил]цирконийдихлорида,
(метил)(3,3,3-трифторпропил)силандиилбис[2-бицикло[2.2.1]гептилметил-4-(3,5-терфенил)инденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-трет-бутилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)-6-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(2-нафтил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-бифенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-этилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-н-пропилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-изопропилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-трет-бутилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-втор-бутилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-циклогексилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-триметилсилилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(4-адамантилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3-бифенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)-7-метилинденил]цирконийдихлорида,
диметилсиландиилбис[2-циклогексилметил-4-(3,5-ди(трифторметил)фенил)-7-метилинденил]цирконийдихлорида и
диметилсиландиилбис[2-циклогексилметил-4-(3,5-терфенил)-7-метилинденил]цирконийдихлорида.
58. Способ полимеризации олефинов, включающий введение одного или нескольких олефинов, каждый из которых содержит от 2 до приблизительно 20 атомов углерода, в условиях проведения реакции полимеризации олефинов в контакт с системой катализатора, содержащей мостиковый металлоценовый компонент по п.50.
59. Способ по п.58, где олефины включают пропилен и/или этилен.
60. Способ по п.58, где олефины включают, по меньшей мере, один олефин формулы Rm-CH=CH-Rn, где Rm и Rn являются идентичными или различными и каждый из них индивидуально представляет собой атом водорода или радикал, содержащий от 1 до приблизительно 20 атомов углерода, или Rm и Rn совместно могут формировать одно или несколько колец.
61. Способ по п.58, где олефины включают одно или несколько соединений, выбираемых из группы, состоящей из этилена, пропилена, 1-бутена, 1-пентена, 1-гексена, 4-метил-1-пентена или 1-октена, стирола, 1,3-бутадиена, 1,4-гексадиена, винилнорборнена, норборнадиена, этилнорборнадиена, норборнена, тетрациклододецена и метилнорборнена.
62. Металлоцен по п.50, где металлоцен представляет собой соединение, выбираемое из группы, состоящей из:
диметилсиландиилбис[2-трет-бутилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(1-нафтил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-метилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-циклогексилметил-4-(3,5-диметилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-адамантилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
(метил)(н-пропил)силандиилбис[2-циклогексилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид;
диметилсиландиилбис[2-трет-бутилметил-4-(4-трет-бутилфенил)инденил]цирконийдихлорид.
63. Металлоцен по п.1, где R1 и R2 представляют собой атомы галогена; R4 и R4' представляют собой атом водорода; R10 представляет группу - M12(R40)(R41), где R40 и R41 представляют алкильную группу с числом атомов углерода от 1 до приблизительно 30; М12 представляет собой кремний, германий или олово; R11 и R11' независимо представляют собой двухвалентную С3-С40 группу, которая совместно с циклопентадиенильным кольцом формирует дополнительную насыщенную или ненасыщенную кольцевую систему, имеющую размер кольца от 5 до 7 атомов.
64. Способ по п.24, где R1 и R2 представляют собой атомы галогена; R4 и R4' представляют собой атом водорода; R10 представляет группу -M12(R40)(R41), где R40 и R41 представляют алкильную группу с числом атомов углерода от 1 до приблизительно 30; М12 представляет собой кремний, германий или олово; R11 и R11' независимо представляют собой двухвалентную С3-С40 группу, которая совместно с циклопентадиенильным кольцом формирует дополнительную насыщенную или ненасыщенную кольцевую систему, имеющую размер кольца от 5 до 7 атомов.
65. Металлоцен по п.63, где R3 и R300 представляют собой -СН2-CR301R302R303, где R301, R302, R303 представляют собой атом водорода или алкильную группу с числом атомов углерода от 1 до приблизительно 20; или R302 и R303 вместе образуют кольцевую систему при условии, что R302 и R303 одновременно не являются атомами водорода.
66. Способ по п.64, где R3 и R300 представляют собой -CH2-CR301R302R303, где R301, R302, R303 представляют собой атом водорода или алкильную группу с числом атомов углерода от 1 до приблизительно 20 или R302 и R303 вместе образуют кольцевую систему при условии, что R302 и R303 одновременно не являются атомами водорода.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| RU 2002120465 А, 10.01.2004 | |||
| Устройство для шагового перемещения и накопления изделий цилиндрической формы | 1985 |
|
SU1298148A1 |
Авторы
Даты
2012-12-20—Публикация
2007-10-25—Подача