Изобретение относится к последовательности и структурным признакам двухцепочечных (дц)РНК-молекул, требующихся для опосредования мишень-специфических модификаций нуклеиновых кислот, таких как РНК-интерференция и/или метилирование ДНК.
Термин «интерференция РНК» (РНКи) был создан после обнаружения, что инъецирование дцРНК в нематоду С. elegans приводит к специфической индукции молчания генов, имеющих высокую гомологию последовательности относительно введенной дцРНК (Fire et al., 1998). Затем РНКи наблюдали также у насекомых, лягушек (Oelgeschlager et al., 2000) и других животных, в том числе мышей (Svoboda et al., 2000; Wianny and Zernicka-Goetz, 2000), и она, вероятно, существует также у человека. РНКи тесно связана с посттранскрипционным механизмом превращения генов в молчащие гены (PTGS) посредством косупрессии в растениях и набухания в грибах (Catalanotto et al., 2000; Cogoni and Macino, 1999; Dalmay et al., 2000; Ketting and Plasterk, 2000; Mourrain et al., 2000; Smardon et al., 2000), и некоторые компоненты аппарата РНКи являются также необходимыми для посттранскрипционного индуцирования молчания генов косупрессией (Catalanotto et al., 2000; Dernburg et al., 2000; Ketting and Plasterk, 2000). Эта тема обсуждалась недавно (Bass, 2000; Bosher and Labouesse, 2000; Fire, 1999; Plasterk and Ketting, 2000; Sharp, 1999; Sijen and Kooter, 2000), см. Также весь выпуск Plant Molecular Biology, vol. 43, issue 2/3, (2000).
В растениях, наряду с PTGS, введенные трансгены могут также приводить к транскрипционному индуцированию молчания генов через РНК-управляемое метилирование ДНК цитозинов (см. ссылки в Wassenegger, 2000). Геномные мишени, такие короткие как 30 п.н., метилируются в растениях РНК-управляемым образом (Pelisser, 2000). Метилирование ДНК присутствует также и у животных.
Природная функция РНКи и косупрессии является, по-видимому, защитой генома против инвазии мобильными генетическими элементами, такими как ретротранспозоны и вирусы, которые продуцируют аберрантную РНК или дцРНК в клетке-хозяине, когда они становятся активными (Jensen et al., 1999; Ketting et al., 1999; Ratcliff et al., 1999; Tabara et al., 1999). Специфическая деградация мРНК предотвращает репликацию транспозонов и вирусов, хотя некоторые вирусы способны преодолевать или предотвращать этот процесс экспрессией белков, которые супрессируют PTGS (Lucy et al., 2000; Voinnet et al., 2000).
ДцРНК запускает специфическую деградацию гомологичных РНК только в районе идентичности с дцРНК (Zamore et al., 2000). Эта дцРНК процессируется до РНК-фрагментов размером 21-23 нуклеотидов (нт) и сайты расщепления РНК-мишени регулярно отстоят друг от друга на 21-23 нт. Таким образом, было сделано предположение, что фрагменты размером 21-23 нт являются «руководящими» РНК (направляющими РНК) для узнавания мишени (Zamore et al., 2000). Эти короткие РНК детектировались также в экстрактах, полученных из клеток Шнайдера S2 D. melanogaster, которые были трансфицированы дцРНК перед лизисом клеток (Hammond et al., 2000), однако фракции, которые проявляли последовательность-специфическую нуклеазную активность, также содержали большую фракцию остаточной дцРНК. Роль фрагментов размером 21-23 нт в руководстве расщеплением мРНК дополнительно поддерживается наблюдением, что фрагменты размером 21-23 нт, выделенные из процессированной дцРНК, способны, в некоторой степени, опосредовать специфическую деградацию мРНК (Zamore et al., 2000). Молекулы РНК сходного размера накапливаются также в ткани растений, которая проявляет PTGS (Hamilton and Baulcombe, 1999).
В данном изобретении авторы используют установленную in vitro систему Drosophila (Tuschl et al., 1999; Zamore et al., 2000) для дополнительного выяснения механизма РНКи. Авторы демонстрируют, что короткие РНК размером 21 и 22 нт, при спаривании оснований с 3'-выступающими концами, действуют как руководящие РНК в отношении последовательность-специфической деградации мРНК. Короткие дцРНК размером 30 п.н. являются неспособными опосредовать интерференцию РНК (РНКи) в этой системе, так как они уже не процессируются до РНК размером 21-22 нт. Кроме того, авторы определили сайты расщепления РНК-мишени относительно коротких (21 и 22 нт) интерферирующих РНК (siRNA) и обеспечили доказательство, что направление процессинга дцРНК определяет, может ли расщепляться смысловая или антисмысловая РНК-мишень продуцируемым комплексом siRNA-эндонуклеаза. Кроме того, siRNA могут быть важными инструментами для транскрипционной модуляции, например индуцирования молчания генов млекопитающих посредством управления метилированием ДНК.
Дополнительные эксперименты в системах культур клеток человека in vitro (клеток HeLa) показывают, что молекулы двухцепочечных РНК, имеющие длину предпочтительно 19-25 нт, имеют РНКи-активность (активность интерференции РНК). Таким образом, в противоположность результатам, полученным на Drosophila, имеющие длину 24 и 25 нт молекулы дцРНК также являются эффективными для иттерференции РНК (РНКи).
Целью, лежащей в основе данного изобретения, является обеспечение новых агентов, способных опосредовать мишень-специфическую интерференцию РНК или другие мишень-специфические модификации нуклеиновых кислот, такие как метилирование ДНК, причем указанные агенты имеют улучшенную эффективность и безопасность в сравнении с агентами предыдущего уровня техники.
Решение этой проблемы обеспечено выделенной двухцепочечной молекулой РНК, где каждая цепь РНК имеет длину 19-25, в частности 19-23 нуклеотида, где указанная молекула РНК способна опосредовать мишень-специфические модификации нуклеиновых кислот, в частности интерференцию РНК и/или метилирование ДНК. Предпочтительно, по меньшей мере одна цепь имеет 3'-выступ из 1-5 нуклеотидов, более предпочтительно из 1-3 нуклеотидов и наиболее предпочтительно из 2 нуклеотидов. Другая цепь может иметь тупые концы или имеет 3'-выступ до 6 нуклеотидов. Кроме того, если обе цепи дцРНК имеют длину точно 21 или 22 нуклеотида (нт), можно наблюдать некоторую интерференцию РНК, когда оба конца являются тупыми (выступ 0 нуклеотидов). Эта молекула РНК предпочтительно является синтетической молекулой РНК, которая по существу не содержит примесей, встречающихся в клеточных экстрактах, например из эмбрионов Drosophila. Кроме того, эта молекула РНК предпочтительно по-существу не содержит никаких неспецифических в отношении мишени примесей, в частности неспецифических в отношении мишени молекул РНК, например из примесей, встречающихся в клеточных экстрактах.
Далее, данное изобретение относится к использованию выделенных двухцепочечных молекул РНК, где каждая цепь РНК имеет длину 19-25 нуклеотидов, для опосредования последовательность-специфических модификаций нуклеиновых кислот, в частности интерференции РНК (РНКи), в клетках млекопитающих, в частности в клетках человека.
Неожиданно было обнаружено, что синтетические короткие двухцепочечные молекулы РНК, особенно с выступающими 3'-концами, являются последовательность-специфическими медиаторами РНКи и опосредуют эффективное расщепление РНК-мишени, причем сайт расщепления локализован вблизи центра района, охватываемого этой «руководящей» короткой РНК.
Предпочтительно, каждая цепь этой молекулы РНК имеет длину 20-22 нуклеотида (или 20-25 нуклеотидов в клетках млекопитающих), причем длина каждой цепи может быть одной и той же или различной. Предпочтительно длина 3'-выступа достигает 1-3 нуклеотида, причем длина выступа может быть одной и той же или различной. Эти РНК-цепи предпочтительно имеют 3'-гидроксильные группы; 5'-конец предпочтительно содержит фосфатную, дифосфатную, трифосфатную или гидроксильную группу. Большинство эффективных дцРНК состоят из двух состоящих из 21 нуклеотида цепей, которые спарены таким образом, что выступы из 1-3, в частности 2-3 нуклеотидов (нт), присутствуют на обоих концах дцРНК.
Реакция расщепления РНК-мишени, управляемая siRNA, является высоко последовательность-специфической. Однако не все положения siRNA равным образом способствуют узнаванию мишени. Ошибочные спаривания в центре siRNA-дуплекса являются наиболее критическими и по существу элиминируют расщепление РНК-мишени. В противоположность этому 3'-нуклеотид цепи siRNA (например, положение 21), который комплементарен одноцепочечной РНК-мишени, не способствует специфичности узнавания мишени. Далее, последовательность неспаренного 3'-выступа из 2 нт цепи siRNA с той же самой полярностью, что и РНК-мишень, не является критическим для расщепления РНК-мишени, так как только антисмысловая цепь siRNA “руководит” узнаванием мишени. Таким образом, из одноцепочечных выступающих нуклеотидов только предпоследнее положение антисмысловой siRNA (например, положение 20) должно спариваться со смысловой мРНК-мишенью.
Неожиданно двухцепочечные молекулы РНК данного изобретения проявляют высокую стабильность in vivo в сыворотке или среде для выращивания культур клеток. Для дополнительного усиления стабильности 3'-выступы могут быть стабилизированы против деградации, например они могут быть выбраны таким образом, что они состоят из пуриновых нуклеотидов, в частности аденозиновых или гуанозиновых нуклеотидов. Альтернативно, замена пиримидиновых нуклеотидов модифицированными аналогами, например замена уридина 3'-выступов из 2 нт 2'-дезокситимидином, является переносимой и не влияет на эффективность интерференции РНК. Отсутствие 2'-гидроксила значимо усиливает устойчивость к нуклеазам этого выступа в среде для культуры ткани.
В особенно предпочтительном варианте данного изобретения молекула РНК может содержать по меньшей мере один модифицированный аналог нуклеотида. Аналоги нуклеотидов могут быть локализованы в положениях, где мишень-специфическая активность, например опосредующая РНКи активность, по существу не подвергается действию, например в районе при 5'-конце и/или 3'-конце двухцепочечной молекулы РНК. В частности, эти выступы могут быть стабилизированы включением модифицированных аналогов нуклеотидов.
Предпочтительные аналоги нуклеотидов выбраны из рибонуклеотидов с модифицированным сахаром или модифицированным скелетом молекулы. Однако следует отметить, что рибонуклеотиды с модифицированными нуклеооснованиями, т.е. рибонуклеотиды, содержащие не встречающееся в природе нуклеооснование вместо природно встречающегося нуклеооснования, такие как уридины или цитидины, модифицированные в положении 5, например, 5-(2-амино)пропилуридин, 5-бромуридин; аденозины и гуанозины, модифицированные в положении 8, например, 8-бромгуанозин; деазануклеотиды, например 7-деазааденозин; О- и N-алкилированные нуклеотиды, например N6-метиладенозин, являются пригодными. В предпочтительных сахар-модифицированных рибонуклеотидах 2'-ОН-группа заменена группой, выбранной из Н, OR, R, галогена, SH, SR, NH2, NHR, NR2 или CN, где R обозначает С1-С6-алкил, алкенил или алкинил, а галоген обозначает F, Cl, Br или I. В предпочтительных скелет-модифицированных рибонуклеотидах фосфоэфирная группа, соединяющая с соседними рибонуклеотидами, заменена модифицированной группой, например фосфотиоатной группой. Следует отметить, что вышеупомянутые модификации могут комбинироваться.
Последовательность двухцепочечной молекулы РНК данного изобретения должна иметь достаточную идентичность относительно молекулы нуклеиновой кислоты-мишени для опосредования мишень-специфической РНКи и/или мишень-специфического метилирования ДНК. Предпочтительно, эта последовательность имеет идентичность по меньшей мере 50%, в частности по меньшей мере 70% относительно желаемой молекулы-мишени в двухцепочечной части этой молекулы РНК. Более предпочтительно, идентичность равна по меньшей мере 85%, и наиболее предпочтительно, 100% в двухцепочечной части этой молекулы РНК. Идентичность двухцепочечной молекулы РНК относительно заранее заданной молекулы нуклеиновой кислоты-мишени, например, молекулы мРНК-мишени, может быть определена следующим образом:
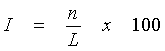
где I обозначает идентичность в процентах, n равно числу идентичных нуклеотидов в двухцепочечной части дцРНК и мишени, а L является длиной перекрывания последовательностей двухцепочечной части этой дцРНК и мишени.
Альтернативно, идентичность двухцепочечной молекулы РНК относительно последовательности-мишени может быть определена с включением 3'-выступа, в частности выступа, имеющего длину из 1-3 нуклеотидов. В этом случае идентичность последовательности предпочтительно равна по меньшей мере 50%, более предпочтительно 70% и наиболее предпочтительно по меньшей мере 85% относительно последовательности-мишени. Например, нуклеотиды из 3'-выступа и до 2 нуклеотидов из 5'- и/или 3'-конца двойной цепи могут быть модифицированы без существенной потери активности.
Двухцепочечная молекула РНК данного изобретения может быть получена с использованием способа, предусматривающего стадии:
(а) синтеза двух цепей РНК, каждая из которых имеет длину по меньшей мере 19-25, например 19-23 нуклеотида, где указанные цепи РНК способны образовывать двухцепочечную молекулу РНК, причем предпочтительно по меньшей мере одна цепь имеет 3'-выступ из 1-5 нуклеотидов,
(b) объединения этих синтезированных цепей РНК в условиях, в которых образуется двухцепочечная молекула РНК, которая способна опосредовать мишень-специфические модификации нуклеиновых кислот, в частности интерференцию РНК и/или метилирование ДНК.
Способы синтеза молекул РНК известны в данной области. В этом контексте, в частности, даются ссылки на способы химического синтеза, описанные Verma and Eckstein (1998).
Одноцепочечные РНК могут быть также получены ферментативной транскрипцией из синтетических ДНК-матриц или из ДНК-плазмид, выделенных из рекомбинантных бактерий. Обычно используют РНК-полимеразы фагов, такие как РНК-полимераза Т7, Т3 или SP6 (Milligan and Uhlenbeck (1989)).
Следующий аспект данного изобретения относится к способу опосредования мишень-специфической модификации нуклеиновых кислот, в частности интерференции РНК и/или метилирования ДНК в клетке или в организме, предусматривающему стадии:
(а) контактирования клетки или организма с двухцепочечной молекулой РНК данного изобретения в условиях, в которых могут происходить мишень-специфические модификации нуклеиновых кислот, и
(b) опосредования мишень-специфической модификации нуклеиновой кислоты, выполняемой этой двухцепочечной РНК в отношении нуклеиновой кислоты-мишени, имеющей часть последовательности, по существу соответствующую этой двухцепочечной РНК.
Предпочтительно, стадия контактирования (а) предусматривает введение двухцепочечной молекулы РНК в клетку-мишень, например, в выделенную клетку-мишень, например в клеточную культуру, одноклеточный микроорганизм или клетку-мишень или множество клеток-мишеней в многоклеточном организме. Более предпочтительно, стадия введения предусматривает опосредованную носителем доставку, например посредством липосомных носителей или посредством инъекции.
Способ данного изобретения может быть использован для определения функции гена в клетке или организме или даже для модуляции функции гена в клетке или организме, будучи способным опосредовать интерференцию РНК. Эта клетка является предпочтительно эукариотической клеткой или линией клеток, например растительной клеткой или клеткой животного, такой как клетка млекопитающего, например эмбриональной клеткой, плюрипотентной стволовой клеткой, опухолевой клеткой, например клеткой тератокарциномы или инфицированной вирусом клеткой. Организм предпочтительно является эукариотическим организмом, например растением или животным, таким как млекопитающее, в частности человек.
Ген-мишень, на который нацелена молекула РНК данного изобретения, может быть ассоциирован с патологическим состоянием. Например, этот ген может быть патоген-ассоциированным геном, например вирусным геном, опухоль-ассоциированным геном или геном, ассоциированным с аутоиммунным заболеванием. Ген-мишень может быть также гетерологичным геном, экспрессируемым в рекомбинантной клетке или генетически измененном организме. Посредством определения или модуляции, в частности ингибирования функции такого гена, могут быть получены ценная информация и терапевтические выгоды в области сельского хозяйства или в медицине или ветеринарии.
ДцРНК обычно вводят в виде фармацевтической композиции. Введение может проводиться известными способами, в которых нуклеиновую кислоту вводят в желаемую клетку-мишень in vitro или in vivo. Обычно используемые способы переноса генов включают в себя кальций-фосфатный, ДЭАЭ-декстрановый способы, способы электропорации и микроинъекции и вирусные способы (Graham, F.L. and van der Eb, A.J. (1973) Virol. 52, 456; McCutchan, J.H. and Pagano, J.S. (1968), J. Natl. Cancer Inst. 41, 351; Chu, G. et al (1987), Nucl. Acids Res. 15, 1311, Fraley, R. et al. (1980), J. Biol. Chem. 255, 10431; Capecchi, M.R. (1980), Cell 22, 479). Недавним дополнением к этому арсеналу способов для введения ДНК в клетки является применение катионных липосом (Felgner, P.L. et al. (1987), Proc. Natl. Acad. Sci USA 84, 7413). Коммерчески доступными формами катионных липидов являются Tfx 50 (Promega) или липофектамин 2000 (Life Technologies).
Таким образом, данное изобретение относится также к фармацевтическим композициям, содержащим в качестве активного агента по меньшей мере одну двухцепочечную молекулу РНК, описанную выше, и фармацевтический носитель. Эта композиция может быть использована для диагностических и для терапевтических применений в медицине или в ветеринарии.
Для диагностических или терапевтических применений эта композиция может быть в форме раствора, например инъекционного раствора, крема, мази, таблетки, суспензии или т.п. Композицию можно вводить любым подходящим способом, например инъекцией, пероральным, местным, назальным, ректальным введением и т.д. Носителем может быть любой подходящий фармацевтический носитель. Предпочтительно, используют носитель, который способен увеличивать эффективность молекул РНК в отношении вхождения в клетки-мишени. Подходящими примерами таких носителей являются липосомы, в частности катионные липосомы. Дополнительным предпочтительным способом введения является инъекция.
Следующим предпочтительным применением способа интерференции РНК является функциональный анализ эукариотических клеток или эукариотических организмов (не человека), предпочтительно клеток или организмов млекопитающих и наиболее предпочтительно клеток человека, например клеточных линий, таких как HeLa или 293, или грызунов, например, крыс и мышей. Трансфекцией подходящих двухцепочечных молекул РНК, которые гомологичны заранее заданным гену-мишени или молекулам ДНК-мишеням, кодирующим подходящую двухцепочечную молекулу РНК, может быть получен фенотип с нокаутом гена в клетке-мишени, например, в культуре клеток или в организме-мишени. Неожиданно было обнаружено, что присутствие коротких двухцепочечных молекул РНК не приводит к интерфероновой реакции клетки-хозяина или организма-хозяина.
Таким образом, следующим предметом данного изобретения является эукариотическая клетка или эукариотический организм (не человек), проявляющие фенотип со специфическим в отношении гена-мишени нокаутом, включающий в себя по меньшей мере частично недостаточную экспрессию по меньшей мере одного эндогенного гена-мишени, где указанные клетка или организм трансфицированы по меньшей мере одной двухцепочечной молекулой РНК, способной ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени, или ДНК, кодирующей по меньшей мере одну молекулу двухцепочечной РНК, способную ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени. Следует отметить, что данное изобретение обеспечивает возможность мишень-специфического нокаута нескольких различных эндогенных генов вследствие специфичности интерференции РНК (РНКи).
Фенотипы клеток или организмов (не человека) с геноспецифическим нокаутом, в частности клеток человека или млекопитающих (не являющихся человеком), могут быть использованы в аналитических процедурах, например, в функциональном и/или фенотипическом анализе сложных физиологических процессов, таком как анализ профилей экспрессии генов и/или протеомов (белковых эквивалентов генома). Например, можно получить фенотипы с нокаутом генов человека в культивируемых клетках, которые предположительно являются регуляторами процессов альтернативного сплайсинга. Среди этих генов находятся, в частности, члены семейства факторов сплайсинга SR, например, ASF/SF2, SC35, SRp20, SRp40 или SRp55. Кроме того, может анализироваться действие белков SR на профили мРНК заранее заданных альтернативно сплайсированных генов, таких как CD44. Предпочтительно, этот анализ проводят высокопроизводительными способами с использованием чипов на основе олигонуклеотидов.
С применением технологий нокаутов на основе РНКи экспрессию эндогенного гена-мишени можно ингибировать в клетке-мишени или организме-мишени. Эндогенный ген может быть комплементирован экзогенной нуклеиновой кислотой-мишенью, кодирующей белок-мишень или вариантную или мутированную форму этого белка-мишени, например геном или кДНК, которые могут быть необязательно слиты с дополнительной последовательностью нуклеиновой кислоты, кодирующей детектируемый пептид или полипептид, например аффинную метку, в частности множественную аффинную метку. Варианты или мутированные формы гена-мишени отличаются от эндогенного гена-мишени тем, что они кодируют генный продукт, который отличается от продукта эндогенного гена на уровне аминокислот заменами, инсерциями и/или делециями одной или множественных аминокислот. Эти варианты или мутированные формы могут иметь ту же самую биологическую активность, что и эндогенный ген-мишень. С другой стороны, вариант или мутированный ген-мишень могут также иметь биологическую активность, которая отличается от биологической активности эндогенного гена-мишени, например частично делетированную активность, полностью делетированную активность, усиленную активность и т.д.
Комплементация может выполняться коэкспрессией полипептида, кодируемого экзогенной нуклеиновой кислотой, например, слитого белка, содержащего белок-мишень и аффинную метку, и молекулы двухцепочечной РНК для нокаута эндогенного гена в клетке-мишени. Эта коэкспрессия может выполняться с использованием подходящего экспрессирующего вектора, экспрессирующего как полипептид, кодируемый экзогенной нуклеиновой кислотой, например модифицированный меткой белок-мишень, так и молекулу двухцепочечной РНК, или альтернативно, с использованием комбинации экспрессирующих векторов. Белки и белковые комплексы, при синтезе de novo в клетке-мишени, будут содержать продукт экзогенного гена, например модифицированный слитый белок. Во избежание супрессии экспрессии продукта экзогенного гена этой дуплексной молекулой РНКи нуклеотидная последовательность, кодирующая экзогенную нуклеиновую кислоту, может быть изменена на уровне ДНК (с индукцией или без индукции мутаций на уровне аминокислот) в части последовательности, которая гомологична молекуле двухцепочечной РНК. Альтернативно, эндогенный ген-мишень может быть комплементирован соответствующими последовательностями нуклеотидов из других видов, например из мыши.
Предпочтительными применениями клетки или организма данного изобретения является анализ профилей экспрессии генов и/или протеомов (белковых эквивалентов генома). В особенно предпочтительном варианте проводят анализ варианта или мутантной формы одного или нескольких белков-мишеней, причем указанные варианты или мутантные формы повторно вводят в клетку или организм с использованием экзогенной нуклеиновой кислоты-мишени, как описано выше. Комбинирование нокаута эндогенного гена и спасения с использованием мутированной, например частично делетированной экзогенной мишени, имеет преимущества по сравнению с использованием клетки с нокаутом гена. Кроме того, этот способ особенно пригоден для идентификации функциональных доменов белка-мишени. В следующем предпочтительном варианте проводят сравнение, например, профилей экспрессии генов и/или протеомов и/или фенотипических характеристик по меньшей мере двух клеток или организмов. Эти организмы выбраны из:
(i) контрольной клетки или контрольного организма без ингибирования гена-мишени,
(ii) клетки или организма с ингибированием клетки-мишени и
(iii) клетки или организма с ингибированием гена-мишени плюс комплементацией гена-мишени экзогенной нуклеиновой кислотой-мишенью.
Способ и клетка данного изобретения пригодны также в процедуре для идентификации и/или характеристики фармакологических агентов, например идентификации новых фармакологических агентов из коллекции тест-веществ и/или характеристики механизмов действия и/или побочных действий известных фармакологических агентов.
Таким образом, данное изобретение относится также к системе для идентификации и/или характеристики фармакологических агентов, действующих по меньшей мере на один белок-мишень, содержащей:
(а) эукариотическую клетку или эукариотический организм (не человека), способные экспрессировать по меньшей мере один эндогенный ген-мишень, кодирующий указанный белок-мишень,
(b) по меньшей мере одну двухцепочечную молекулу РНК, способную ингибировать экспрессию указанного по меньшей мере одного эндогенного гена-мишени, и
(с) тест-вещество или коллекцию тест-веществ, где фармакологические свойства указанных тест-веществ или указанной коллекции подлежат идентификации и/или характеристике.
Кроме того, описанная выше система предпочтительно содержит:
(d) по меньшей мере одну экзогенную нуклеиновую кислоту-мишень, кодирующую белок-мишень или вариант или мутированную форму этого белка-мишени, причем указанная экзогенная нуклеиновая кислота-мишень отличается от эндогенного гена-мишени на уровне нуклеиновой кислоты таким образом, что экспрессия этой экзогенной нуклеиновой кислоты-мишени существенно менее ингибируется двухцепочечной молекулой РНК, чем экспрессия эндогенного гена-мишени.
Кроме того, способ комплементации нокаута РНК может быть использован для препаративных целей, например для аффинной очистки белков или белковых комплексов из эукариотических клеток, в частности клеток млекопитающих и, более конкретно, клеток человека. В этом варианте данного изобретения экзогенная нуклеиновая кислота-мишень предпочтительно кодирует белок-мишень, который слит с аффинной меткой.
Препаративный способ может использоваться для очистки высокомолекулярных белковых комплексов, которые предпочтительно имеют массу ≥ 150 кД и, более предпочтительно, ≥ 500 кД, которые необязательно могут содержать нуклеиновые кислоты, такие как РНК. Конкретными примерами являются гетеротримерный белковый комплекс, состоящий из белков с М.м. 20 кД, 60 кД и 90 кД частицы нмРНП U4/U6, фактор сплайсинга SF3b из нмРНП U2 17S, состоящий из 5 белков, имеющих молекулярные массы 14, 49, 120, 145 и 155 кД, и частица три-нмРНП U4/U6/U5 25 S, содержащая молекулы нмРНК U4, U5 и U6 и приблизительно 30 белков, которая имеет молекулярную массу около 1,7 МД.
Этот способ пригоден также для функционального анализа протеома в клетках млекопитающих, в частности клетках человека.
Далее данное изобретение объясняется более подробно в следующих фигурах и примерах.
Подписи к фигурам
Фиг. 1: Двухцепочечная РНК с длиной всего лишь 38 п.н. может опосредовать интерференцию РНК (РНКи).
(А) Графическое представление дцРНК, используемых для нацеливания на мРНК Рр-luc. Получали три серии дцРНК с тупыми концами, охватывающими диапазон 29-504 п.н. Положение первого нуклеотида смысловой цепи дцРНК показано относительно стартового кодона мРНК Рр-luc (р1). (В) Анализ интерференции РНК (Tuschl et al., 1999). Отношение активности Рр-luc-мишени к активности контроля Rr-luc нормализовали относительно буферного контроля (черный столбец). ДцРНК (5 нМ) предынкубировали в лизате Drosophila в течение 15 минут при 25оС перед добавлением 7-метилгуанозин-кэппированных мРНК Рр-luc и Rr-luc (~50 пМ). Инкубирование продолжали еще в течение одного часа и затем анализировали двойным люциферазным анализом (Promega). Данные представлены в виде среднего из по меньшей мере четырех независимых экспериментов ± стандартное отклонение.
Фиг. 2: ДцРНК размером 29 п.н. уже не процессируется до фрагментов размером 21-23 нт. Временной ход образования 21-23-мера из процессинга 32Р-меченых внутри дцРНК (5 нМ) в лизате Drosophila. Указаны длина и источники этих дцРНК. Маркер размера РНК (М) наносили в левой дорожке и указаны размеры фрагментов. Двойные полосы при времени нуль обусловлены неполностью денатурированными дцРНК.
Фиг. 3: Короткие дцРНК расщепляют мРНК-мишень только один раз.
(А) Денатурирующий гель-электрофорез стабильных продуктов 5'-расщепления, получаемых посредством 1-часового инкубирования 10 нМ смысловой или антисмысловой РНК, 32Р-меченой при кэпе, 10 нМ дцРНК серии р133 в лизате Drosophila. Маркеры длин генерировали частичным расщеплением нуклеазой Т1 и частичным щелочным гидролизом (ОН) кэп-меченой РНК-мишени. Районы, на которые нацелены эти дцРНК, показаны в виде черных столбцов на обеих сторонах. Показано расстояние 20-23 нт между преобладающими сайтами расщепления для дцРНК с длиной 111 п.н. Горизонтальная стрелка указывает неспецифическое расщепление, не обусловленное интерференцией РНК (РНКи). (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. Последовательности кэппированных смысловой 177 нт и антисмысловой 180 нт РНК-мишеней представлены в антипараллельной ориентации, так что комплементарные последовательности противостоят друг другу. Районы, на которые нацелены эти различные дцРНК, показаны различно окрашенными стержнями, расположенными между смысловой и антисмысловой последовательностями-мишенями. Сайты расщепления показаны кружками: большой кружок для сильного расщепления, малый кружок для слабого расщепления. 32Р-радиоактивно меченая фосфатная группа указана звездочкой.
Фиг. 4: РНК-фрагменты размером 21 и 22 нт получены по РНКаза III-подобному механизму.
(А) Последовательности РНК из ~21 нт после процессинга дцРНК. РНК-фрагменты из ~21 нт, генерированные процессингом дцРНК, направленным образом клонировали и секвенировали. Олигорибонуклеотиды, происходящие из смысловой цепи дцРНК, показаны в виде синих линий, олигорибонуклеотиды, происходящие из антисмысловой цепи, в виде красных линий. Толстые стержни используются, если одна и та же последовательность присутствует во множественных клонах, причем число справа показывает частоту встречаемости. Сайты расщепления РНК-мишени, опосредованного дцРНК, показаны в виде оранжевых кружков, большой кружок для сильного расщепления, малый кружок для слабого расщепления (см. фиг. 3В). Кружки над смысловой цепью показывают сайты расщепления в смысловой мишени, а кружки ниже дцРНК показывают сайт расщепления в антисмысловой мишени. До пяти дополнительных нуклеотидов были идентифицированы во фрагментах из ~21 нт, происходящих из 3'-концов дцРНК. Эти нуклеотиды являются случайными комбинациями преимущественно остатков С, G или А и были, наиболее вероятно, добавлены безматричным образом во время Т7-транскрипции дцРНК-составляющих цепей. (В) Анализ с использованием двухмерной тонкослойной хроматографии (ТСХ) нуклеотидного состава РНК из ~21 нт. РНК из ~21 нт получали инкубированием радиоактивно меченой внутри дцРНК размером 504 п.н. Рр-luc в лизате Drosophila, очищали из геля и затем расщепляли до мононуклеотидов нуклеазой Р1 (верхний ряд) или рибонуклеазой Т2 (нижний ряд). ДцРНК радиоактивно метили внутри транскрипцией в присутствии одного из указанных α-32Р-нуклеозидтрифосфатов. Радиоактивность детектировали фосфор-томографией. Нуклеозид-5'-монофосфаты, нуклеозид-3'-монофосфаты, нуклеозид-5',3'-дифосфаты и неорганический фосфат показаны как pN, Np, pNp и pi, соответственно. Черные кружки показывают УФ-поглощающие пятна из нерадиоактивных нуклеотидов-носителей. 3',5'-бисфосфаты (красные кружки) идентифицировали комиграцией с радиоактивно мечеными стандартами, полученными 5'-фосфорилированием нуклеозид-3'-монофосфатов полинуклеотидкиназой Т4 с использованием γ-32Р-АТФ.
Фиг. 5: Синтетические РНК из 21 и 22 нт опосредуют расщепление РНК-мишени.
(А) Графическое представление контрольной дцРНК размером 52 п.н. и синтетических дцРНК из 21 и 22 нт. Смысловая цепь коротких интерферирующих РНК из 21 и 22 нт (siRNA) показана синим цветом, антисмысловая цепь - красным цветом. Последовательности siRNA происходят из клонированных фрагментов дцРНК размером 52 и 111 п.н. (фиг. 4А), за исключением антисмысловой цепи 22 нт дуплекса 5. siRNA в дуплексе 6 и 7 были уникальными в отношении реакции процессинга дцРНК 111 п.н. Два 3'-выступающих нуклеотида, показанные зеленым цветом, присутствуют в последовательности синтетической антисмысловой цепи дуплексов 1 и 3. Обе цепи контрольной дцРНК размером 52 п.н. получали транскрипцией in vitro, и фракция транскриптов может содержать безматричное добавление 3'-нуклеотидов. Сайты расщепления РНК-мишени, управляемые дуплексами siRNA, показаны оранжевыми кружками (см. подпись к фиг. 4А) и были определены, как показано на фиг. 5В. (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. РНК-последовательности-мишени являются такими же, как описанные на фиг. 3В. Контрольную дцРНК размером 52 п.н. (10 нМ) или РНК-дуплексы из 21 и 22 нт 1-7 (100 нМ) инкубировали с РНК-мишенью в течение 2,5 часов при 25оС в лизате Drosophila. Стабильные 5'-продукты расщепления разделяли на геле. Сайты расщепления показаны на фиг. 5А. Район, на который нацелена дцРНК размером 52 п.н., или смысловая (s) или антисмысловая (as) цепи, показаны сбоку от геля. Все сайты расщепления локализованы в районе идентичности этих дцРНК. Для точного определения сайтов расщепления антисмысловой цепи использовали более низкопроцентный гель.
Фиг. 6: Длинные 3'-выступы на коротких дцРНК ингибируют интерференцию РНК (РНКи).
(А) Графическое представление конструкций дцРНК размером 52 п.н. 3'-удлинения смысловой и антисмысловой цепей показаны синим и красным цветом, соответственно. Наблюдаемые сайты расщепления на РНК-мишенях представлены в виде оранжевых кружков, аналогично фиг. 4А, и были определены, как показано на фиг. 6В. (В) Положение сайтов расщепления на смысловой и антисмысловой РНК-мишенях. Последовательности РНК-мишеней являются такими же, как показанные на фиг. 3В. ДцРНК (10 нМ) инкубировали с РНК-мишенью в течение 2,5 часов при 25оС в лизате Drosophila. Стабильные 5'-продукты расщепления разделяли на геле. Главные сайты расщепления показаны горизонтальной стрелкой и также представлены на фиг. 6А. Область, на которую нацелена дцРНК размером 52 п.н., представлена в виде черного стержня на обеих сторонах геля.
Фиг. 7: Предлагаемая модель интерференции РНК (РНКи).
Предсказывается, что РНКи начинается с процессинга дцРНК (смысловая цепь изображена черным цветом, антисмысловая цепь красным цветом) до преимущественно коротких 21 и 22 нт интерферирующих РНК (siRNA). Короткие выступающие 3'-нуклеотиды, если они присутствуют на дцРНК, могут быть выгодными для процессинга коротких дцРНК. Белки процессинга дцРНК, которые еще должны быть охарактеризованы, представлены зелеными и синими овалами, и собираются на дцРНК асимметричным образом. В модели авторов это иллюстрируется связыванием гипотетического синего белка или домена белка с цепью siRNA в 3'-5'-направлении, тогда как гипотетический зеленый белок или домен белка всегда связан с противолежащей цепью siRNA. Эти белки или подсерия остаются связанными с дуплексом siRNA и сохраняют свою ориентацию, определяемую направлением реакции процессинга дцРНК. Только последовательность siRNA, связанная с синим белком, способна «руководить» (управлять) расщеплением РНК-мишени. Эндонуклеазным комплексом называется малый интерферирующий рибонуклеопротеиновый комплекс или siRNР. Здесь предполагается, что эндонуклеаза, которая расщепляет дцРНК, может также расщеплять РНК-мишень, возможно, временным смещением пассивной цепи siRNA, не используемой для узнавания мишени. Затем РНК-мишень расщепляется в центре района, узнаваемого последовательность-комплементарной «руководящей» siRNA.
Фиг. 8: Репортерные конструкции и siRNA-дуплексы.
(а) Иллюстрированы районы репортерного гена люциферазы светляка (Рр-luc) и морской фиалки (sea pansy) (Rr-luc) из плазмид pGL2-Control, pGL3-Control и pRL-TK (Promega). Указаны регуляторные элементы SV40, промотор тимидинкиназы HSV и два интрона (линии). Последовательность люциферазы GL3 на 95% идентична GL2, но RL является совершенно неродственной с ними. Экспрессия люциферазы из pGL2 приблизительно в 10 раз ниже, чем экспрессия из pGL3 в трансфицированных клетках млекопитающих. Район, на который нацелены siRNA-дуплексы, показан черным стержнем ниже кодирующей области генов люциферазы. (b) Показаны смысловая (верхняя) и антисмысловая (нижняя) последовательности siRNA-дуплексов, нацеленных на люциферазу GL2, GL3 и RL. siRNA-дуплексы GL2 и GL3 отличаются только 3 заменами отдельных нуклеотидов (заключенных в серые блоки). В качестве неспецифического контроля синтезировали дуплекс с обращенной последовательностью GL2, invGL2. 3'-Выступ из 2 нуклеотидов с 2'-дезокситимидинами показан как ТТ; uGL2 сходен с siRNA GL2, но содержит 3'-выступ с рибоуридинами.
Фиг. 9: Интерференция РНК siRNA-дуплексами.
Отношения контрольной люциферазы-мишени нормализовали относительно буферного контроля (bu, черные столбцы); серые столбцы показывают отношения люцифераз GL2 или GL3 Photinus pyralis (Pp-luc) к люциферазе RL Renilla reniformis (Rr-luc) (левая ось), белые столбцы показывают отношения RL к GL2 или GL3 (правая ось). Панели а, с, е, g и i описывают эксперименты, проводимые с комбинацией репортерных плазмид pGL2-Control и pRL-TK, панели b, d, f, h и j с репортерными плазмидами pGL3-Control и pRL-TK. Клеточная линия, используемая для эксперимента с интерференцией, указана над каждым графиком. Отношения Рр-luc/Rr-luc для буферного контроля (bu) варьировали между 0,5 и 10 для pGL2/pRL и между 0,03 и 1 для pGL3/pRL, соответственно, перед нормализацией и между различными испытанными клеточными линиями. Приведенные в виде диаграмм данные являются средними из трех независимых экспериментов ± стандартное отклонение (S.D.).
Фиг. 10: Действия siRNA из 21 нт, дцРНК размером 50 п.н. и размером 500 п.н. на экспрессию люциферазы в клетках HeLa.
Точная длина длинных дцРНК указана под столбцами. Панели а, с и е описывают эксперименты, выполняемые с репортерными плазмидами pGL2-Control и pRL-TK, панели b, d и f - с репортерными плазмидами pGL3-Control и pRL-TK. Данные являются средними из двух независимых экспериментов ± стандартное отклонение (S.D.). (а), (b) - Абсолютная экспрессия Рр-luc, представленная в произвольных единицах люминесценции. (с), (d) - Экспрессия Rr-luc, представленная в произвольных единицах люминесценции. (е), (f) - Отношения нормализованной люциферазы-мишени к контрольной люциферазе. Эти отношения люциферазной активности в отношении siRNA-дуплексов были нормализованы относительно буферного контроля (bu, черные столбцы); отношения люминесценции для дцРНК размером 50 или 500 п.н. нормализовали относительно соответствующих отношений, наблюдаемых для дцРНК размером 50 и 500 п.н. из гуманизированного GFP (hG, черные столбцы). Следует отметить, что общие различия в последовательностях между дцРНК размером 49 и 484 п.н., нацеленных на GL2 и GL3, являются недостаточными для придания специфичности между мишенями GL2 и GL3 (непрерываемая идентичность 43 нт в сегменте размером 49 п.н., наивысшая непрерываемая идентичность 239 нт в сегменте размером 484 п.н.).
Фиг. 11: Варьирование 3'-выступа дуплексов siRNA из 21 нт.
(А) Схема экспериментальной стратегии. Изображена кэппированная и полиаденилированная смысловая мРНК-мишень и показаны относительные положения смысловой и антисмысловой siRNA. Были получены восемь серий дуплексов в соответствии с восемью различными антисмысловыми цепями. Последовательности siRNA и число выступающих нуклеотидов изменяли в однонуклеотидных стадиях. (В) Нормализованная относительная люминесценция люциферазы-мишени (Photinus pyralis, Pp-luc) относительно контрольной люциферазы (Renilla reniformis, Rr-luc) в лизате эмбрионов D. melanogaster в присутствии 5 нМ дцРНК с тупыми концами. Отношения люминесценции, определенные в присутствии дцРНК, нормализовали относительно отношения, полученного для буферного контроля (bu, черный столбец). Нормализованные отношения, меньшие чем 1, указывают на специфическую интерференцию. (С-J) Нормализованные отношения интерференции для восьми серий siRNA-дуплексов из 21 нт. Последовательности siRNA-дуплексов изображены над диаграммами в виде столбцов. Каждая панель показывает отношение интерференции для набора дуплексов, образованных с указанной антисмысловой «руководящей» siRNA и 5 различными смысловыми siRNA. Число выступающих нуклеотидов (3'-выступы, положительные числа; 5'-выступы, отрицательные числа) указано на оси х. Точки данных являются средними из по меньшей мере 3 независимых экспериментов, столбики ошибок обозначают стандартные отклонения.
Фиг. 12: Варьирование длины смысловой цепи siRNA-дуплексов.
(А) Графическое представление эксперимента. Три антисмысловые цепи из 21 нт спаривали с восемью смысловыми siRNA. Эти siRNA варьировали по длине на их 3'-конце. 3'-выступ антисмысловой siRNA был 1 нт (В), 2 нт (С) или 3 нт (D), тогда как выступ смысловой siRNA варьировали для каждой серии. Показаны последовательности siRNA-дуплексов и соответствующие отношения интерференции.
Фиг. 13: Варьирование длины siRNA-дуплексов с сохраняемыми 2-нуклеотидными 3'-выступами.
(А) Графическое представление эксперимента. 21-нуклеотидный siRNA-дуплекс идентичен по последовательности 21-нуклеотидному siRNA-дуплексу, показанному на фиг. 11Н или 12С. siRNA-дуплексы удлиняли на 3'-стороне смысловой siRNA (В) или 5'-стороне смысловой siRNA (С). Показаны последовательности siRNA-дуплексов и соответствующие отношения интерференции.
Фиг. 14: Замена 2'-гидроксильных групп рибозных остатков siRNA.
2'-гидроксильные группы (ОН) в цепях siRNA-дуплексов заменяли группами 2'-дезокси (d) или 2'-О-метила (Ме). 2-нуклеотидные и 4-нуклеотидные 2'-дезокси-замены на 3'-концах указаны как 2-нт d и 4-нт d, соответственно. Остатки уридина заменяли 2'-дезокситимидином.
Фиг. 15: Картирование расщепления смысловой и антисмысловой РНК-мишени 21-нуклеотидными siRNA-дуплексами с 2-нуклеотидными 3'-выступами.
(А) Графическое представление меченых 32Р-кэпом (звездочка) смысловых и антисмысловых РНК-мишеней и siRNA-дуплексов. Положение расщепления смысловых и антисмысловых РНК-мишеней указано треугольниками над и под siRNA-дуплексами, соответственно. (В) Картирование сайтов расщепления РНК-мишени. После 2 часов инкубирования 10 нМ мишени с 100 нМ siRNA-дуплексом в лизате эмбрионов D. melanogaster 5'-кэп-меченый субстрат и 5'-продукты расщепления разделяли на секвенирующих гелях. Маркеры длин получали частичным расщеплением РНКазой Т1 (Т1) и частичным щелочным гидролизом (ОН-) РНК-мишеней. Жирные линии слева от изображений показывают район, охватываемый цепями siRNA 1 и 5 той же ориентации, что и мишень.
Фиг. 16: 5'-конец “руководящей” siRNA определяет положение расщепления РНК-мишени.
(А, В) Графическое представление экспериментальной стратегии. Антисмысловая siRNA была одинаковой во всех siRNA-дуплексах, но смысловая цепь варьировалась между 18-25 нуклеотидами изменением 3'-конца (А) или 18-23 нуклеотидами изменением 5'-конца (В). Положение расщепления смысловой и антисмысловой РНК-мишени указано треугольниками над и под siRNA-дуплексами, соответственно. (С, D) Анализ расщепления РНК-мишени с использованием кэп-меченых смысловой (верхняя панель) или антисмысловой (нижняя панель) РНК-мишеней. Показаны только кэп-меченые 5'-продукты расщепления. Показаны последовательности siRNA-дуплексов и над панелью помечена длина смысловых цепей siRNA. Контрольная дорожка, отмеченная штрихом в панели (С), показывает РНК-мишень, инкубированную в отсутствие siRNA. Маркеры были такими же, как описанные на фиг. 15. Стрелки в (D), нижней панели, указывают сайты расщепления РНК-мишени, которые отличаются 1 нт.
Фиг. 17: Варьирование последовательности 3'-выступа siRNA-дуплексов.
2-нт 3'-выступ (NN, серый цвет) изменяли по последовательности и составу, как указано (Т, 2'-дезокситимидин, dG, 2'-дезоксигуанозин; звездочка, siRNA-дуплекс дикого типа). Нормализованные отношения интерференции определяли, как описано на фиг. 11. Последовательность дикого типа была такой же, как изображенная на фиг. 14.
Фиг. 18: Специфичность последовательности узнавания мишени.
Показаны последовательности ошибочно спаренных siRNA-дуплексов, модифицированные сегменты последовательностей или отдельные нуклеотиды показаны серым цветом. Ссылочный дуплекс (ref) и siRNA-дуплексы 1-7 содержат 2-нуклеотидные выступы с 2'-дезокситимидином. Эффективность индукции молчания модифицированного тимидином ссылочного дуплекса сравнима с последовательностью дикого типа (фиг. 17). Нормализованные отношения интерференции определяли, как описано на фиг. 11.
Фиг. 19: Варьирование длины siRNA-дуплексов с сохраняемыми 2-нуклеотидными 3'-выступами.
siRNA-дуплексы удлиняли на 3'-конце смысловой siRNA (А) или 5'-конце смысловой siRNA (В). Показаны последовательности siRNA-дуплексов и соответствующие отношения интерференции. Для клеток HeLa SS6 siRNA-дуплексы (0,84 мкг), нацеленные на люциферазу GL2, трансфицировали вместе с плазмидами pGL-Control и pRL-TK. Для сравнения показаны РНКи-активности siRNA-дуплексов, испытанных в лизате D. melanogaster.
Пример 1
Интерференция РНК, опосредованная малыми синтетическими РНК
1.1. Экспериментальные процедуры
1.1.1 РНКи in vitro
Интерференцию РНК (РНКи) in vitro и получения лизатов выполняли, как описано ранее (Tuschl et al., 1999; Zamore et al., 2000). Для оптимальной регенерации АТФ критическим является использование свежерастворенной креатинкиназы (Roche). Анализы РНКи на основе трансляции (фиг. 1) выполняли с концентрациями дцРНК 5 нМ и периодом предварительного инкубирования 15 минут при 25оС перед добавлением in vitro транскрибированных, кэппированных и полиаденилированных репортерных мРНК Рр-luc и Rr-luc. Инкубирование продолжали в течение 1 часа и относительное количество белка Рр-luc и Rr-luc анализировали с использованием двойного люциферазного анализа (Promega) и люменометра Monolight 3010C (PharMingen).
1.1.2 Синтез РНК
Для транскрипции in vitro РНК с ПЦР-матриц, несущих промоторные последовательности Т7 или SP6, использовали стандартные процедуры, см., например (Tuschl et al., 1998). Синтетическую РНК получали с использованием Expedite РНК-фосфорамидитов (Proligo). 3'-адапторный олигонуклеотид синтезировали с использованием диметокситритил-1,4-бензолдиметанолсукциниламинопропил-CPG. Эти олигорибонуклеотиды освобождали от защитных групп в 3 мл смеси 32% аммиак/этанол (3/1) в течение 4 часов при 55оС (Expedite RNA) или 16 часов при 55оС (химерные олигонуклеотиды 3'- и 5'-адапторная ДНК/РНК) и затем десилилировали и очищали из геля, как описано ранее (Tuschl et al., 1993). РНК-транскрипты для получения дцРНК, включающих в себя длинные 3'-выступы, получали с ПЦР-матриц, которые содержали промотор Т7 в смысловой и промотор SP6 в антисмысловой ориентации. Матрицу транскрипции для смысловой и антисмысловой РНК-мишени ПЦР-амплифицировали с GCGTAATACGACTCACTATAGAACAATTGCTTTTACAG (подчеркнут промотор Т7) в качестве 5'-праймера и ATTTAGGTGACACTATAGGCATAAAGAATTGAAGA (подчеркнут промотор SP6) в качестве 3'-праймера и линеаризованной плазмиды Pp-luc (pGEM-luc-последовательности) (Tuschl et al., 1999) в качестве матрицы; Т7-транскрибированная смысловая РНК имела длину 177 нт с последовательностью Рр-luc между положениями 113-273 относительно стартового кодона и последующими 17 нт комплемента промоторной последовательности SP6 на 3'-конце. Транскрипты для образования дцРНК с тупыми концами получали транскрипцией с двух различных ПЦР-продуктов, которые содержали только одну промоторную последовательность.
Отжиг дцРНК проводили с использованием экстракции смесью фенол/хлороформ. Эквимолярную концентрацию смысловой и антисмысловой РНК (50 нМ - 10 мкМ, в зависимости от доступной длины и количества) в 0,3 М NaOAc (рН 6) инкубировали в течение 30 секунд при 90оС и затем экстрагировали при комнатной температуре с равным объемом смеси фенол/хлороформ с последующей экстракцией хлороформом для удаления остаточного фенола. Полученную дцРНК осаждали добавлением 2,5-3 объемов этанола. Осадок растворяли в лизисном буфере (100 мМ KCl, 30 мМ HEPES-КОН, рН 7,4, 2 мМ Mg(OAc)2) и качество этой дцРНК подтверждали стандартным электрофорезом в агарозном геле в 1 х ТАЕ-буфере. ДцРНК 52 из п.н. с 3'-выступами размером 17 нт и 20 нт (фиг. 6) отжигали инкубированием в течение 1 минуты при 95оС, затем быстро охлаждали до 70оС с последующим медленным охлаждением до комнатной температуры на протяжении 3-часового периода (50 мкл реакционная смесь отжига, 1 мкМ концентрация цепи, 300 мМ NaCl, 10 мМ Трис-HCl, рН 7,5). Затем эти дцРНК экстрагировали смесью фенол/хлороформ, осаждали этанолом и растворяли в лизисном буфере.
Транскрипцию 32Р-радиоактивно меченой внутри молекулы РНК, используемую для получения дцРНК (фиг. 2 и 4), выполняли с использованием 1 мМ АТФ, ЦТФ, ГТФ, 0,1 или 0,2 мМ УТФ и 0,2-0,3 мкМ 32Р-УТФ (3000 Ки/ммоль) или соответствующего соотношения для радиоактивно меченых нуклеозидтрифосфатов, иных, чем УТФ. Мечение кэпа РНК-мишени выполняли, как описано ранее. РНК-мишени очищали из гелей после кэп-мечения.
1.1.3 Картирование сайта расщепления
Стандартные реакции интерференции РНК (РНКи) проводили предынкубированием 10 нМ дцРНК в течение 15 минут с последующим добавлением 10 нМ кэп-меченой РНК-мишени. Реакцию останавливали после еще 2 часов (фиг. 2А) или 2,5 часов инкубирования (фиг. 5В и 6В) обработкой протеиназой К (Tuschl et al., 1999). Затем эти пробы анализировали на 8-10% секвенирующих гелях. Синтетические РНК-дуплексы из 21 и 22 нт использовали в конечной концентрации 100 нМ (фиг. 5В).
1.1.4 Клонирование размером РНК ~21 нт
РНК размером 21 нт получали инкубированием радиоактивно меченой дцРНК в лизате Drosophila в отсутствие РНК-мишени (реакционная смесь 200 мкл, время инкубации 1 час, 50 нМ дцР111 или 100 нМ дцР52 или дцР39). Затем реакционную смесь обрабатывали протеиназой К (Tuschl et al., 1999) и продукты процессинга дцРНК разделяли на денатурирующем 15% полиакриламидном геле. Полосу, включающую диапазон размеров по меньшей мере 18-24 нт, вырезали, элюировали 0,3 М NaCl в течение ночи при 4оС в силиконизированных пробирках. РНК выделяли осаждением этанолом и дефосфорилировали (реакционная смесь 30 мкл, 30 минут, 50оС, 10 Единиц щелочной фосфатазы, Roche). Реакцию останавливали экстракцией смесью фенол/хлороформ и РНК осаждали этанолом. Затем 3'-адапторный олигонуклеотид (pUUUaaccgcatccttctcx: заглавные буквы, РНК; строчные буквы, ДНК; р, фосфат; х, 4-гидроксиметилбензил) лигировали с дефосфорилированной РНК размером ~21 нт (реакционная смесь 20 мкл, 30 минут, 37оС, 5 мкМ 3'-адаптор, 50 мМ Трис-HCl, рН 7,6, 10 мМ MgCl2, 0,2 мМ АТФ, 0,1 мг/мл ацетилированного БСА, 15% ДМСО, 25 Единиц РНК-лигазы Т4, (Amersham-Pharmacia) (Pan and Uhlenbeck, 1992). Реакцию лигирования останавливали добавлением равного объема смеси для остановки реакции 8 М мочевина/50 мМ ЭДТА и сразу же наносили на 15% гель. Выходы лигирования были более 50%. Продукт лигирования извлекали из геля и 5'-фосфорилировали (реакция 20 мкл, 30 минут, 37оС, 2 мМ АТФ, 5 Единиц полинуклеотидкиназы Т4, NEB). Реакцию фосфорилирования останавливали экстракцией смесью фенол/хлороформ и РНК осаждали этанолом. Затем 5'-адапторный олигонуклеотид (tactaatacgactcactAAA: заглавные буквы, РНК; строчные буквы, ДНК) лигировали с фосфорилированным продуктом лигирования, как описано выше. Новый продукт лигирования очищали на геле и элюировали из среза геля в присутствии праймера обратной транскрипции (GACTAGCTGGAATTCAAGGATGCGGTTAAA: жирный шрифт, сайт EcoRI), используемого в качестве носителя. Обратная транскрипция (реакция 15 мкл, 30 минут, 42оС, 150 Единиц обратной транскриптазы Superscript II, Life Technologies) сопровождалась ПЦР с использованием 5'-праймера CAGCCAACGGAATTCATACGACTCACTAAA (жирный шрифт, сайт EcoRI) и 3'-ОТ-праймера. ПЦР-продукт очищали экстракцией смесью фенол/хлороформ и осаждали этанолом. Затем ПЦР-продукт расщепляли EcoRI (NEB) и конкатамеризовали с использованием ДНК-лигазы Т4 (высокой концентрации, NEB). Конкатамеры с диапазоном размеров 200-800 п.н. разделяли на плавящемся при низкой температуре агарозном геле, извлекали из геля стандартными процедурами плавления и экстракции фенолом и осаждали этанолом. Неспаренные концы достраивали инкубированием с полимеразой Taq в стандартных условиях в течение 15 минут при 72оС и ДНК-продукт непосредственно лигировали в вектор pCR2.1-TOPO с использованием набора для клонирования ТОРО-ТА (Invitrogen). Колонии подвергали скринингу с использованием ПЦР и обратных секвенирующих праймеров М13-20 и М13. ПЦР-продукты сразу же подвергали общепринятому секвенированию (Sequence Laboratories Gottingen GmbH, Germany). В среднем получали четыре-пять 21-мерных последовательностей на клон.
1.1.5 Двухмерный (2D)-ТСХ-анализ
Расщепление нуклеазой Р1 радиоактивно меченых, очищенных на геле siRNA и 2D-ТСХ проводили, как описано (Zamore et al., 2000). Расщепление нуклеазой Т2 проводили в 10 мкл-реакциях в течение 3 часов при 50оС в 10 мМ ацетате аммония (рН 4,5) с использованием 2 мкг/мкл тРНК-носителя и 30 Единиц рибонуклеазы Т2 (Life Technologies). Миграцию нерадиоактивных стандартов наблюдали с использованием УФ-экранирования. Идентичность нуклеозид-3',5'-дифосфатов подтверждали комиграцией продуктов расщепления Т2 со стандартами, полученными 5'-32Р-фосфорилированием коммерческих нуклеозид-3'-монофосфатов с использованием γ-32Р-АТФ и полинуклеотидкиназы Т4 (данные не показаны).
1.2 Результаты и обсуждение
1.2.1 Требования в отношении длины для процессинга дцРНК до РНК-фрагментов размером 21 и 22 нт
Лизат, полученный из синцитиальных эмбрионов D. melanogaster, повторяет интерференцию РНК (РНКи) in vitro, обеспечивая новый инструмент для биохимического анализа механизма интерференции РНК (РНКи) (Tuschl et al., 1999; Zamore et al., 2000). Анализ in vitro и in vivo требований в отношении длины дцРНК для РНКи выявил, что короткие дцРНК (<150 п.н.) являются менее эффективными, чем более длинные дцРНК в деградации мРНК-мишени (Caplen et al., 2000; Hammond et al., 2000; Ngo et al., 1998; Tuschl et al., 1999). Причины уменьшения эффективности деградации мРНК являются непонятными. Таким образом, авторы исследовали требования точной длины дцРНК для деградации РНК-мишени при оптимизированных условиях в лизате Drosophila (Zamore et al., 2000). Синтезировали несколько серий дцРНК и их направляли против репортерной РНК люциферазы светляка (Рр-luc). Специфическую супрессию экспрессии РНК-мишени наблюдали с использованием двойного люциферазного анализа (Tuschl et al., 1999) (фиг. 1А и 1В). Авторы обнаружили специфическое ингибирование экспрессии РНК-мишени для такой короткой дцРНК, как 38 п.н., но дцРНК с длиной 29-36 п.н. не были эффективны в этом процессе. Это действие не зависело от положения мишени, и степень ингибирования экспрессии мРНК Рр-luc коррелировала с длиной дцРНК, т.е. более длинные дцРНК были более эффективными, чем короткие дцРНК.
Было сделано предположение, что РНК-фрагменты размером 21-23 нт, генерируемые процессингом дцРНК, являются медиаторами (посредниками) интерференции и косупрессии РНК (Hamilton and Baulcombe, 1999; Нammond et al., 2000; Zamore et al., 2000). Таким образом, авторы анализировали интенсивность образования фрагментов размером 21-23 нт для субпопуляции дцРНК в диапазоне размеров между 501-29 п.н. Образование фрагментов размером 21-23 нт в лизате Drosophila (фиг. 2) было легко детектируемым для дцРНК с длиной 39-501 п.н., но было значительно задержанным для дцРНК длиной 29 п.н. Это наблюдение согласуется с ролью фрагментов размером 21-23 нт в управлении расщеплением мРНК и обеспечивает объяснение для отсутствия интерференции РНК посредством дцРНК 30 п.н. Зависимость от длины образования 21-23-мера, вероятно, отражает биологически релевантный контрольный механизм для предотвращения нежелательной активации интерференции РНК короткими внутримолекулярными структурами спаренных оснований нормальных клеточных РНК.
1.2.2 ДцРНК размером 39 п.н. опосредует расщепление РНК-мишени в единственном сайте
Добавление дцРНК и 5'-кэппированной РНК-мишени к лизату Drosophila приводит к последовательность-специфической деградации этой РНК-мишени (Tuschl et al., 1999). мРНК-мишень расщепляется только в районе идентичности с этой дцРНК и многие сайты расщепления мишени были разделены 21-23 нт (Zamore et al., 2000). Таким образом, ожидалось, что число сайтов расщепления для конкретной дцРНК примерно соответствует длине дцРНК, деленой на 21. Авторы картировали сайты расщепления мишени на смысловой и антисмысловой РНК-мишени, которая была 5'-радиоактивно меченой при кэпе (Zamore et al., 2000) (фиг. 3А и 3В). Стабильные 5'-продукты расщепления разделяли на секвенирующем геле и положение расщепления определяли сравнением с лестницей (лэддером) частичного гидролиза РНКазой Т1 и щелочного гидролиза из РНК-мишени.
В соответствии с более ранним наблюдением (Zamore et al., 2000), все сайты расщепления РНК-мишени были локализованы в районе идентичности с дцРНК. Смысловая или антисмысловая мишень расщеплялась только один раз с помощью дцРНК из 39 п.н. Каждый сайт расщепления был локализован в 10 нт от 5'-конца района, охватываемого дцРНК (фиг. 3В). ДцРНК из 52 п.н., которая имеет один и тот же 5'-конец, что и дцРНК из 39 п.н., дает тот же самый сайт расщепления на смысловой мишени, локализованный в 10 нт от 5'-конца района идентичности с этой дцРНК, наряду с двумя более слабыми сайтами расщепления в 23 и 24 нт справа от первого сайта. Антисмысловая мишень расщеплялась только один раз, опять на расстоянии 10 нт от 5'-конца района, охватываемого его соответствующей дцРНК. Картирование сайтов расщепления для дцРНК размером 38-49 п.н., представленное на фиг. 1, показало, что первый и преобладающий сайт расщепления всегда был локализован на 7-10 нт справа от района, охватываемого этой дцРНК (данные не показаны). Это предполагает, что точка расщепления РНК-мишени определяется концом дцРНК, и можно считать, что процессинг до 21-23-меров начинается от концов дуплекса.
Сайты расщепления на смысловой и антисмысловой мишени для более длинной дцРНК 111 п.н. были гораздо более частыми, чем ожидалось, и большинство из них появляются в кластерах, разделенных 20-23 нт (фиг. 3А и 3В). Как и для более коротких дцРНК, первый сайт расщепления на смысловой мишени находится на расстоянии 10 нт от 5'-конца района, охватываемого данной дцРНК, а первый сайт расщепления на антисмысловой мишени локализован в 9 нт от 5'-конца района, охватываемого данной дцРНК. Неясно, что вызывает это неупорядоченное расщепление, но одной из возможностей могло бы быть то, что более длинные дцРНК могут не только процессироваться от концов, но также и внутри, или имеются некоторые детерминанты специфичности для процессинга дцРНК, которые пока еще непонятны для авторов. Некоторые нерегулярности в отношении интервала 21-23 нт отмечались также ранее (Zamore et al., 2000). Для лучшего понимания молекулярной основы процессинга дцРНК и узнавания РНК-мишени авторы решили анализировать последовательности фрагментов 21-23 нт, образуемых процессингом дцРНК из 39, 52 и 111 п.н. в лизате Drosophila.
1.2.3 ДцРНК процессируется до РНК размером 21 и 22 нт по РНКаза III-подобному механизму
Для характеристики РНК-фрагментов размером 21-23 нт авторы исследовали 5'- и 3'-концы этих РНК-фрагментов. Окисление периодатом гель-очищенных РНК размером 21-23 нт с последующей β-элиминацией показало присутствие концевых 2'- и 3'-гидроксильных групп. 21-23-меры были также чувствительными к обработке щелочными фосфатазами, что указывало на присутствие 5'-концевой фосфатной группы. Присутствие 5'-фосфата и 3'-гидроксильных концов предполагает, что эта дцРНК могла бы процессироваться ферментативной активностью, сходной с РНКазой III E. coli (в отношении обзоров см. (Dunn, 1982; Nicholson, 1999; Robertson, 1990; Robertson, 1982)).
Направленное клонирование РНК-фрагментов размером 21-23 нт проводили лигированием 3'- и 5'-адапторного олигонуклеотида к очищенным 21-23-мерам с использованием РНК-лигазы Т4. Продукты лигирования обратно-транскрибировали, ПЦР-амплифицировали, конкатамеризовали, клонировали и секвенировали. Более 220 коротких РНК секвенировали из реакций процессинга дцРНК с размерами 39, 52 и 111 п.н. (фиг. 4А). Авторы нашли следующее распределение длин: 1% 18 нт, 5% 19 нт, 12% 20 нт, 45% 21 нт, 28% 22 нт, 6% 23 нт и 2% 24 нт. Анализ последовательности 5'-концевого нуклеотида процессированных фрагментов показал, что олигонуклеотиды с 5'-гуанозином были недостаточно представленными. Эта неоднозначность, наиболее вероятно, была введена РНК-лигазой Т4, которая дискриминирует против 5'-фосфорилированного гуанозина в качестве донорного олигонуклеотида; не было значимой неоднозначности последовательности при 3'-конце. Многие из фрагментов из ~21 нт, произведенные с 3'-концов смысловой или антисмысловой цепи дуплексов, включают в себя 3'-нуклеотиды, которые произведены из безматричного присоединения нуклеотидов во время синтеза РНК с использованием РНК-полимеразы Т7. Интересно, что было клонировано также значительное число эндогенных РНК размером ~21 нт Drosophila, некоторые из которых происходили из LTR- и не-LTR-ретротранспозонов (данные не показаны). Это согласуется с возможной ролью интерференции РНК в индукции молчания транспозонов.
РНК из ~21 нт появляются в собранных кластерами группах (фиг. 4А), которые охватывают полные последовательности дцРНК. По-видимому, реакция процессинга разрезает дцРНК, оставляя ступенчатые 3'-концы, что является другой характеристикой расщепления РНКазой III. Для дцРНК размером 39 п.н. были обнаружены два кластера из РНК ~21 нт из каждой дцРНК-составляющей цепи, включающей выступающие 3'-концы, но только один сайт расщепления детектировали на смысловой и антисмысловой мишени (фиг. 3А и 3В). Если фрагменты из ~21 нт присутствовали бы в виде одноцепочечных руководящих РНК в комплексе, который опосредует деградацию мРНК, можно было бы предположить, что существуют по меньшей мере два сайта расщепления мишени, но это не так. Это предполагает, что РНК из ~21 нт могут присутствовать в двухцепочечной форме в эндонуклеазном комплексе, но что только одна из этих цепей может быть использована для узнавания и расщепления РНК-мишени. Применение только одной из цепей ~21 нт для расщепления мишени может быть простым образом определено по ориентации, в которой дуплекс из ~21 нт связан с нуклеазным комплексом. Эта ориентация определяется направлением, в котором процессируется исходная дцРНК.
Кластеры ~21-меров для дцРНК из 52 п.н. и 111 п.н. являются менее хорошо определяемыми по сравнению с дцРНК из 39 п.н. Эти кластеры распространены на районах из 25-30 нт, наиболее вероятно, представляя несколько различающихся субпопуляций дуплексов из ~21 нт и, следовательно, управляя расщеплением мишени в нескольких соседних сайтах. Эти районы расщепления все еще преимущественно разделены интервалами 20-23 нт. Правила, определяющие, как нормальная дцРНК может процессироваться до фрагментов размером ~21 нт, пока еще непонятны, но ранее наблюдали, что интервал 21-23 нт сайтов расщепления мог быть изменен рядом уридинов (Zamore et al., 2000). Специфичность расщепления дцРНК РНКазой III E. coli, по-видимому, контролируется, главным образом, антидетерминантами, т.е. исключением некоторых специфических пар оснований в конкретных положениях относительно сайта расщепления (Zhang and Nicholson, 1997).
Для исследования, присутствуют ли модификация сахара, оснований или кэп-модификация в процессированных РНК-фрагментах из ~21 нт, авторы инкубировали радиоактивно меченую дцРНК Рр-luс размером 505 п.н. в лизате в течение 1 часа, выделяли продукты из ~21 нт и расщепляли их нуклеазой Р1 или Т2 до мононуклеотидов. Затем эту смесь нуклеотидов анализировали 2D-тонкослойной хроматографией (фиг. 4В). Ни один из четырех природных рибонуклеотидов не был модифицированным, как показало расщепление с использованием Р1 или Т2. Авторы ранее анализировали превращение аденозина в инозин во фрагментах из ~21 нт (после 2 часов инкубации) и обнаружили небольшую степень (<0,7%) дезаминирования (Zamore et al., 2000); более кратковременное инкубирование в лизате (1 час) уменьшало фракцию инозина до едва детектируемых уровней. РНКаза Т2, которая расщепляет справа (3') от фосфодиэфирной связи, давала нуклеозид-3'-фосфат и нуклеозид-3',5'-дифосфат, указывая на присутствие 5'-концевого монофосфата. Все четыре нуклеозид-3',5'-дифосфата были детектированы, и это предполагает, что межнуклеотидная связь расщеплялась с малой специфичностью в отношении последовательности или без специфичности в отношении последовательности. Таким образом, фрагменты из ~21 нт являются немодифицированными и образовывались из дцРНК таким образом, что на 5'-конце присутствовали 5'-монофосфаты, а на 3'-конце присутствовали 3'-гидроксилы.
1.2.4 Синтетические РНК размером 21 и 22 нт опосредуют расщепление РНК-мишени
Анализ продуктов процессинга дцРНК показал, что фрагменты из ~21 нт образовывались реакцией со всеми характеристиками реакции расщепления РНКазой III (Dunn, 1982; Nicholson, 1999; Robertson, 1990; Robertson, 1982). РНКаза III производит два ступенчатых разреза в обеих цепях дцРНК, оставляя 3'-выступ около 2 нт. Авторы химически синтезировали РНК размером 21 и 22 нт, идентичные по последовательности некоторым клонированным фрагментам из ~21 нт, и тестировали их на их способность опосредовать деградацию РНК-мишени (фиг. 5А и 5В). РНК-дуплексы из 21 и 22 нт инкубировали при 100 нМ концентрациях в лизате, при в 10 раз более высоких концентрациях, чем концентрация контрольной дцРНк из 52 п.н. При этих условиях расщепление РНК-мишени являлось легко детектируемым. Уменьшение концентрации дуплексов из 21 и 22 нт со 100 до 10 нМ все еще вызывало расщепление РНК-мишени. Однако увеличение концентрации дуплекса со 100 нМ до 1000 нМ не давало дополнительного увеличения расщепления мишени, возможно, вследствие недостатка белкового фактора в лизате.
В противоположность дцРНК размером 29 или 30 п.н., которые не опосредуют интерференцию РНК, дцРНК из 21 и 22 нт с выступающими 3'-концами из 2-4 нт опосредовали эффективную деградацию РНК-мишени (дуплексы 1, 3, 4, 6, фиг. 5А и 5В). ДцРНК из 21 или 22 нт с тупыми концами (дуплексы 2, 5 и 7, фиг. 5А и 5В) имели уменьшенную способность деградировать мишень и показывают, что выступающие 3'-концы являются критическими для восстановления комплекса РНК-белок нуклеазы. Эти одноцепочечные выступы могут быть необходимыми для высокоаффинного связывания дуплекса из ~21 нт с белковыми компонентами. 5'-концевой фосфат, хотя он и присутствует после процессинга дцРНК, не требовался для опосредования расщепления РНК-мишени и отсутствовал в коротких синтетических РНК.
Синтетические дуплексы из 21 и 22 нт управляли расщеплением смысловых, а также антисмысловых мишеней в районе, охватываемом этим коротким дуплексом. Это является важным результатом с учетом того, что дцРНК размером 39 п.н., которая образует две пары кластеров фрагментов из ~21 нт (фиг. 2), расщепляла смысловую или антисмысловую мишень только один раз, а не два раза. Авторы интерпретируют этот результат предположением, что только одна цепь из двух цепей, присутствующих в дуплексе из ~21 нт, способна «руководить» расщеплением РНК-мишени и что ориентация дуплекса из ~21 нт в комплексе с нуклеазой определяется начальным направлением процессинга дцРНК. Однако предоставление уже точно процессированного дуплекса из ~21 нт системе in vitro не позволяет образовываться активному последовательность-специфическому нуклеазному комплексу с двумя возможными ориентациями симметричного РНК-дуплекса. Это приводит к расщеплению как смысловой, так и антисмысловой мишени в районе идентичности с РНК-дуплексом из 21 нт.
Сайт расщепления мишени локализован в 11 или 12 нт справа от первого нуклеотида, который комплементарен руководящей последовательности из 21 или 22 нт, т.е. сайт расщепления находится вблизи центра района, охватываемого РНК из 21 или 22 нт (фиг. 4А и 4В). Смещение смысловой цепи дуплекса из 22 нт на два нуклеотида (сравните дуплексы 1 и 3 на фиг. 5А) смещало сайт расщепления только антисмысловой цепи на два нуклеотида. Смещение как смысловой, так и антисмысловой цепи на два нуклеотида сдвигало оба сайта расщепления на два нуклеотида (сравните дуплексы 1 и 4). Авторы предсказывают, что будет возможным конструирование пары РНК из 21 или 22 нт для расщепления РНК-мишени почти в любом конкретном положении.
Специфичность расщепления РНК-мишени, регулируемая РНК из 21 и 22 нт, кажется очень совершенной, так как не детектируются аберрантные сайты расщепления (фиг. 5В). Однако следует отметить, что нуклеотиды, присутствующие в 3'-выступе РНК-дуплекса из 21 и 22 нт, могут в меньшей степени способствовать узнаванию субстрата, чем нуклеотиды вблизи сайта расщепления. Это основано на наблюдении, что самый правый (3') нуклеотид в 3'-выступе активных дуплексов 1 или 3 (фиг. 5А) не является комплементарным мишени. Подробный анализ специфичности интерференции РНК может быть легко предпринят с использованием синтетических РНК из 21 и 22 нт.
На основе доказательства, что синтетические РНК из 21 и 22 нт с выступающими 3'-концами опосредуют интерференцию РНК, авторы предлагают называть РНК ~21 нт “короткими интерферирующими РНК” или siRNA, а соответствующий комплекс РНК-белок “малой интерферирующей рибонуклеопротеиновой частицей” или siRNР.
1.2.5 3'-выступы из 20 нт на коротких дцРНК ингибируют интерференцию РНК (РНКи)
Авторы показали, что короткие дцРНК с тупыми концами процессируются, по-видимому, от концов дцРНК. Во время исследования авторами зависимости от длины дцРНК в интерференции РНК, авторы анализировали также дцРНК с выступающими 3'-концами из 17-20 нт и нашли к их удивлению, что они были менее эффективными, чем дцРНК с тупыми концами. Ингибирующее действие длинных 3'-концов было особенно выраженным для дцРНК, имеющих до 100 п.н., но менее разительным для более длинных дцРНК. На основе анализа в нативном геле (данные не показаны), это действие не было обусловлено дефектным образованием дцРНК. Авторы испытывали, не может ли ингибирующее действие длинных выступающих 3'-концов быть использовано в качестве инструмента для направления процессинга дцРНК на только один из двух концов короткого РНК-дуплекса.
Авторы синтезировали четыре комбинации модельной дцРНК из 52 п.н., с тупыми концами, с 3'-удлинением только на смысловой цепи, с 3'-удлинением только на антисмысловой цепи и двойным 3'-удлинением на обеих цепях, и картировали сайты расщепления РНК-мишени после инкубирования в лизате (фиг. 6А и 6В). Первый и преобладающий сайт расщепления смысловой мишени был потерян при удлинении 3'-конца антисмысловой цепи этого дуплекса, и, наоборот, сильный сайт расщепления антисмысловой мишени был потерян при удлинении 3'-конца смысловой цепи этого дуплекса. 3'-удлинения на обеих цепях делали дцРНК из 52 п.н. фактически неактивной. Одним из объяснений для инактивации дцРНК 3'-удлинениями размером ~20 нт могла бы быть ассоциация связывающих одноцепочечную РНК белков, которые могли бы препятствовать ассоциации одного из дцРНК-процессирующих факторов на этом конце. Этот результат согласуется также с моделью авторов, где только одна из цепей siRNA-дуплекса в собранном siRNР способна управлять расщеплением РНК-мишени. Ориентация цепи, которая управляет расщеплением РНК, определяется направлением реакции процессинга дцРНК. Вероятно, присутствие 3'-ступенчатых концов может облегчать сборку комплекса процессинга. Блок на 3'-конце смысловой цепи будет разрешать дцРНК-процессинг только от противолежащего 3'-конца антисмысловой цепи. Это, в свою очередь, генерирует siRNР-комплексы, в которых только антисмысловая цепь siRNА-дуплекса способна управлять расщеплением смысловой РНК-мишени. То же самое является верным для обратной ситуации.
Менее выраженное ингибирующее действие длинных 3'-удлинений в случае более длинных дцРНК (≥500 п.н., данные не приведены) предполагает, что длинные дцРНК могут также содержать внутренние сигналы процессинга дцРНК или могут стать процессированными кооперативно вследствие ассоциации множественных факторов расщепления.
1.2.6 Модель управляемого дцРНК расщепления мРНК
Эти новые биохимические данные модернизируют модель для выяснения, каким образом дцРНК вызывает деструкцию мРНК (фиг. 7). Двухцепочечная РНК сначала процессируется до коротких РНК-дуплексов длиной преимущественно 21 и 22 нт и со ступенчатыми 3'-концами сходным образом с РНКаза III-реакцией (Dunn, 1982; Nicholson, 1999; Robertson, 1982). На основе длины 21-23 нт процессированных РНК-фрагментов уже обсуждалось, что в интерференции РНК может участвовать РНКаза III-подобная активность (Bass, 2000). Эта гипотеза дополнительно подтверждается присутствием 5'-фосфатов и 3'-гидроксилов на концах siRNA, как наблюдалось в продуктах реакции РНКазы III (Dunn, 1982; Nicholson, 1999). Было показано, что бактериальная РНКаза III и эукариотические гомологи Rnt1p в S. cerevisiae и Pac1p в S. pombe функционируют в процессинге рибосомной РНК, а также низкомолекулярной РНК (snRNA) и малой нуклеолярной РНК (snoRNA) (см., например, Chanfreau et al., 2000).
Мало известно о биохимии гомологов РНКазы III из растений, животных или человека. Два семейства ферментов РНКазы III были идентифицированы преимущественно с использованием направляемого базой данных анализа последовательности или клонированием кДНК. Первое семейство РНКаз III представлено белком drosha D. melanogaster из 1327 аминокислот (Acc. AF116572). С-конец составлен из двух доменов РНКазы III и одного дцРНК-связывающего домена, а функция N-конца является неизвестной. Близкие гомологи обнаружены также в С. elegans (Acc. AF160248) и человеке (Acc. AF189011) (Filippov et al., 2000; Wu et al., 2000). Drosha-подобная РНКаза III человека была недавно клонирована и охарактеризована (Wu et al., 2000). Этот ген повсеместно экспрессируется в тканях человека и клеточных линиях, и этот белок локализован в ядре и ядрышке этих клеток. На основании результатов, полученных из исследований антисмыслового ингибирования, предполагается роль этого белка в процессинге рРНК. Второй класс представлен геном С. elegans K12H4.8 (Acc. S44849), кодирующим белок с длиной 1822 аминокислот. Этот белок имеет N-концевой РНК-геликазный мотив, за которым следуют 2 каталитических домена РНКазы III и дцРНК-связывающий мотив, сходный с мотивом семейства РНКаз III drosha. Имеются близкие гомологи в S. pombe (Acc. Q09884), A. thaliana (Acc. AF187317), D. melanogaster (Acc. AE003740) и человеке (Acc. AB028449) (Filippov et al., 2000; Jacobsen et al., 1999; Matsuda et al., 2000). Возможно, К12Н4.8 РНКаза III/геликаза является вероятным кандидатом для участия в интерференции РНК (РНКи).
Генетические скрининги в С. elegans идентифицировали rde-1 и rde-4 как существенные для активации интерференции РНК без действия на мобилизацию транспозонов или косупрессию (Dernburg et al., 2000; Grishok et al., 2000; Ketting and Plasterk, 2000; Tabara et al., 1999). Это привело к гипотезе, что эти гены являются важными для процессинга дцРНК, но не участвуют в деградации мРНК-мишени. Функция обоих генов все еще неясна, продукт гена rde-1 является членом семейства белков, сходных с белком кролика elF2C (Tabara et al., 1999), а последовательность rde-4 еще не была описана. Дальнейшая биохимическая характеристика этих белков должна выявить их молекулярную функцию.
Процессинг siRNA-дуплексов начинается, по-видимому, с концов обеих дцРНК с тупыми концами или дцРНК с короткими (1-5 нт) 3'-выступами и продолжается в виде ступеней приблизительно 21-23 нт. Длинные (~20 нт) 3'-ступенчатые концы на коротких дцРНК подавляют интерференцию РНК (РНКи), возможно, через взаимодействие со связывающими одноцепочечную РНК белками. Супрессия интерференции РНК одноцепочечными районами, фланкирующими короткие дцРНК, и отсутствие образования siRNA из коротких дцРНК размером 30 п.н. могут объяснять, почему структурированные районы, часто встречающиеся в мРНК, не приводят к активации интерференции РНК.
Не желая быть связанными теорией, авторы предполагают, что белки процессинга дцРНК или их субпопуляция остаются связанными с siRNA-дуплексом после реакции процессинга. Ориентация siRNA-дуплекса относительно этих белков определяет, какая из двух комплементарных цепей функционирует в управлении деградацией РНК-мишени. Химически синтезированные siRNA-дуплексы управляют расщеплением смысловой, а также антисмысловой РНК-мишени, так как они способны ассоциироваться с белковыми компонентами в одной из двух возможных ориентаций.
Замечательное открытие того, что синтетические siRNA-дуплексы из 21 и 22 нт могут быть использованы для эффективной деградации мРНК, обеспечивает новые инструменты для последовательность-специфической регуляции экспрессии генов в функциональной геномике, а также биомедицинских исследованиях. siRNA могут быть эффективными в системах млекопитающих, где не могут быть использованы длинные дцРНК вследствие активации PKR-реакции (Clеmens, 1997). Как таковые siRNA-дуплексы представляют новую альтернативу антисмысловым или рибозимным терапевтическим агентам.
Пример 2
Интерференция РНК в культурах тканей человека
2.1 Способы
2.1.1 Получение РНК
РНК из 21 нт синтезировали химически с использованием Expedite РНК-фосфорамидитов и тимидинфосфорамидита (Proligo, Germany). Синтетические олигонуклеотиды освобождали от защитных групп и гель очищали (Пример 1) с последующей очисткой с использованием патрона Sep-Pak C18-cartridge (Waters, Milford, MA, USA) (Tuschl, 1993). Последовательности siRNA, нацеленные на люциферазу GL2 (Acc. X65324) и люциферазу GL3 (Acc. U47296), соответствовали кодирующим районам 153-173, относительно первого нуклеотида стартового кодона, siRNA, нацеленная на RL (Acc. AF025846), соответствовала району 119-129 после стартового кодона. Более длинные РНК транскрибировались РНК-полимеразой Т7 из ПЦР-продуктов с последующей очисткой на геле и с использованием Sep-Pak. ДцРНК GL2 или GL3 размером 49 и 484 п.н. соответствовали положению 113-161 и 113-596, соответственно, относительно старта трансляции; дцРНК RL размером 50 и 501 п.н. соответствовали положению 118-167 и 118-618, соответственно. ПЦР-матрицы для синтеза дцРНК, нацеленной на гуманизированную GFP (hG), амплифицировали из pAD3 (Kehlenbach, 1998), в результате чего дцРНК hG размером 50 и 501 п.н. соответствовали положению 118-167 и 118-618, соответственно, относительно стартового кодона.
Для отжига siRNA, 20 мкМ отдельные цепи инкубировали в буфере для отжига (100 мМ ацетат калия, 30 мМ HEPES-КОН при рН 7,4, 2 мМ ацетат магния) в течение 1 минуты при 90оС и затем в течение 1 часа при 37оС. Стадию инкубирования при 37оС продлевали на ночь для дцРНК размером 50 и 500 п.н., и эти реакции отжига проводили при концентрациях цепей 8,4 мкМ и 0,84 мкМ, соответственно.
2.1.2 Культура клеток
Клетки S2 размножали в среде Шнайдера для Drosophila (Life Technologies), дополненной 10% ФТС, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина, при 25оС. Клетки 293, NIH/3T3, HeLa S3, COS-7 выращивали при 37оС в модифицированной Дульбекко среде Игла, дополненной 10% ФТС, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Клетки регулярно пассировали для поддержания экспоненциального роста. За 24 часа перед трансфекцией при конфлюэнтности приблизительно 80% клетки млекопитающих трипсинизировали и разбавляли 1:5 свежей средой без антибиотиков (1-3 х 105 клеток/мл) и переносили в 24-луночные планшеты (500 мкл/лунка). Клетки S2 не трипсинизировали перед разделением. Трансфекцию проводили с использованием реагента липофектамина 2000 (Life Technologies), как описано изготовителем для прикрепленных клеточных линий. На лунку наносили 1,0 мкг pGL2-Control (Promega) или pGL3-Control (Promega), 0,1 мкг pRL-TK (Promega) и 0,28 мкг siRNA-дуплекса или дцРНК, приготовленных в липосомах; конечный объем был 600 мкл на лунку. Клетки инкубировали 20 часов после трансфекции и они казались жизнеспособными после этого. Экспрессию люциферазы последовательно подвергали мониторингу с использованием двойного люциферазного анализа (Promega). Эффективности трансфекции определяли флуоресцентной микроскопией для линий клеток млекопитающих после котрансфекции 1,1 мкг hGFP-кодирующей pAD3 и 0,28 мкг invGL2 в GL2-siRNA и они были равны 70-90%. Репортерные плазмиды амплифицировали в XL-1 Blue (Stratagene) и очищали с использованием набора Qiagen EndoFree Maxi Plasmid Kit.
2.2 Результаты и обсуждение
Для испытания, способны ли также siRNA опосредовать интерференцию РНК в культуре ткани, авторы синтезировали siRNA-дуплексы из 21 нт с симметричными 3'-выступами из 2 нт, направленные против репортерных генов, кодирующих люциферазу морской фиалки (Renilla reniformis), и два варианта последовательности люцифераз светляка (Photinus pyralis, GL2 и GL3) (фиг. 8а, b). siRNA-дуплексы котрансфицировали с комбинациями репортерных плазмид pGL2/pRL или pGL3/pRL в клетки Шнайдера S2 D. melanogaster или в клетки млекопитающих с использованием катионных липосом. Активности люциферазы определяли спустя 20 часов после трансфекции. Во всех испытанных клеточных линиях авторы наблюдали специфическое снижение экспрессии репортерных генов в присутствии родственных siRNA-дуплексов (фиг. 9а-j). Примечательно, что абсолютные уровни экспрессии люциферазы не подвергались действию неродственных siRNA, что указывает на отсутствие вредных побочных эффектов РНК-дуплексов из 21 нт (например, фиг. 10а-d для клеток HeLa). В клетках S2 D. melanogaster (фиг. 9а, b) специфическое ингибирование люцифераз было полным. В клетках млекопитающих, где репортерные гены экспрессировались в 50-100 раз более сильно, специфическая супрессия была менее полной (фиг. 9с-j). Экспрессия GL2 уменьшалась в 3-12 раза, экспрессия GL3 в 9-25 раз и экспрессия RL в 1-3 раза в ответ на родственные siRNA. Для клеток 293 нацеливание на люциферазу RL посредством siRNA RL было неэффективным, хотя мишени GL2 и GL3 давали специфическую реакцию (фиг. 9i, j). Отсутствие снижения экспрессии RL в клетках 293 может быть обусловлено ее в 5-20 раз более высокой экспрессией в сравнении с любой другой испытанной клеточной линией млекопитающих и/или ограниченной доступностью последовательности-мишени вследствие вторичной структуры РНК или ассоциированных белков. Тем не менее, специфическое нацеливание на люциферазы GL2 и GL3 родственными siRNA-дуплексами показало, что интерференция РНК функционирует также в клетках 293.
3'-выступ из 2 нт во всех siRNA-дуплексах, за исключением uGL2, был образован из (2'-дезокси)тимидина. Замена уридина тимидином в 3'-выступе хорошо переносилась в системе in vitro D. melanogaster, и последовательность этого выступа не была решающей для узнавания мишени. Тимидиновый выступ был выбран, поскольку предполагалось, что он усиливает устойчивость siRNA к нуклеазам в среде для культуры ткани и в трансфицированных клетках. Действительно, модифицированная тимидином siRNA GL2 была слегка более эффективной, чем немодифицированная siRNA uGL2, во всех испытанных клеточных линиях (фиг. 9а, с, е, g, i). Понятно, что дополнительные модификации 3'-выступающих нуклеотидов могут обеспечивать дополнительные выгоды для доставки и стабильности siRNA-дуплексов.
В экспериментах по котрансфекции использовали 25 нМ siRNA-дуплексы относительно конечного объема среды для культуры ткани (фиг. 9, 10). Увеличение концентрации siRNA до 100 нМ не усиливало эффекты специфической индукции молчания генов, но начинало действовать на эффективности трансфекции вследствие конкуренции за инкапсулирование липосомами между плазмидной ДНК и siRNA (данные не приведены). Снижение концентрации siRNA до 1,5 нМ не уменьшало специфический эффект индукции молчания (данные не показаны) даже в том случае, когда концентрации siRNA были лишь в 2-20 раз более высокими, чем концентрации ДНК-плазмид. Это свидетельствует о том, что siRNA являются чрезвычайно сильными реагентами для опосредования молчания генов и что siRNA являются эффективными при концентрациях, которые являются на несколько порядков более низкими, чем концентрации, применяемые в общепринятых экспериментах нацеливания на гены с использованием антисмысловых последовательностей или рибозимов.
Для мониторинга действия более длинных дцРНК на клетки млекопитающих получали дцРНК размерами 50 и 500 п.н., родственные репортерным генам. В качестве неспецифического контроля использовали дцРНК из гуманизированного GFP (hG). (Kehlenbach, 1998). При котрансфекции дцРНК в количествах (не в концентрациях), идентичных siRNA-дуплексам, экспрессия репортерного гена сильно и неспецифически уменьшалась. Этот эффект иллюстрируется для клеток HeLa в качестве репрезентативного примера (фиг. 10а-d). Абсолютные активности люциферазы уменьшались неспецифически в 10-20 раз котрансфекцией дцРНК из 50 п.н. и в 20-200 раз котрансфекцией дцРНК из 500 п.н. Подобные неспецифические эффекты наблюдали для клеток COS-7 и NIH/3T3. Для клеток 293 неспецифическое уменьшение в 10-20 раз наблюдали только для дцРНК из 500 п.н. Неспецифическое уменьшение экспрессии репортерного гена дцРНК >30 п.н. ожидалось в качестве части интерфероновой реакции.
Неожиданно, несмотря на сильное неспецифическое уменьшение экспрессии репортерных генов, авторы воспроизводимо детектировали дополнительное последовательность-специфическое дцРНК-опосредуемое индуцирование молчания генов. Однако специфические эффекты индукции молчания генов были очевидными только в том случае, когда относительные активности репортерных генов нормализовали относительно дцРНК hG-контролей (фиг. 10е, f). В других трех испытанных клеточных линиях млекопитающих также наблюдали специфическое уменьшение в 2-10 раз в ответ на родственную дцРНК (данные не показаны). Специфические эффекты индукции молчания с использованием дцРНК (356-1662 п.н.) сообщались ранее в клетках СНО-К1, но количества дцРНК, требующиеся для детектирования специфического уменьшения в 2-4 раза, были приблизительно в 20 раз более высокими, чем в экспериментах авторов настоящего изобретения (Ui-Tei, 2000). Клетки СНО-К1 являются также, по-видимому, дефектными по интерфероновой реакции. В другом сообщении клетки 293, NIH/3T3 и ВНК-21 испытывали на интерференцию РНК с использованием комбинаций люцифераза/репортер lacZ и специфической для lacZ дцРНК из 829 п.н. или неспецифической дцРНК GFR из 717 п.н. (Caplen, 2000). Неуспех обнаружения интерференции РНК в этом случае может быть обусловлен менее чувствительным анализом комплекса люцифераза/репортер lacZ и различиями длин дцРНК-мишени и контрольной дцРНК. Взятые вместе, результаты авторов изобретения свидетельствуют о том, что интерференция РНК является активной в клетках млекопитающих и что эффект индукции молчания трудно детектировать, если интерфероновую систему активируют дцРНК > 30 п.н.
Таким образом, авторы впервые продемонстрировали siRNA-опосредованную индукцию молчания генов в клетках млекопитающих. Применение коротких siRNA является многообещающим для инактивации функции генов в культуре тканей человека и в развитии геноспецифических терапевтических агентов.
Пример 3
Специфическое ингибирование экспрессии генов посредством интерференции РНК
3.1 Материалы и способы
3.1.1 Получение РНК и анализ интерференции РНК (РНКи)
Химический синтез РНК, отжиг и анализы интерференции РНК (РНКи) на основе люциферазы выполняли, как описано в примерах 1 или 2 или в предыдущих публикациях (Tuschl et al., 1999; Zamore et al., 2000). Все siRNA-дуплексы были направлены против люциферазы светляка, и последовательность мРНК люциферазы получали из pGEM-luc (GenBank acc. X65316), как описано (Tuschl et al., 1999). siRNA-дуплексы инкубировали в реакции РНКи/трансляции D. melanogaster в течение 15 минут перед добавлением мРНК. Интерференцию РНК на основе трансляции проводили по меньшей мере в трех повторностях.
Для картирования расщепления смысловой РНК-мишени получали транскрипт 177 нт, соответствующий последовательности люциферазы светляка между положениями 113-273 относительно стартового кодона, с последующими 17 нт, комплементарными последовательности промотора SP6. Для картирования расщепления антисмысловой РНК-мишени транскрипт 166 нт получали из матрицы, которую амплифицировали из плазмидной последовательности при помощи ПЦР с использованием 5'-праймера TAATACGACTCACTATAGAGCCCATATCGTTTCATA (подчеркнут промотор Т7) и 3'-праймера AGAGGATGGAACCGCTGG. Последовательность-мишень соответствует комплементу последовательности люциферазы светляка между положениями 50-215 относительно стартового кодона. Мечение гуанилилтрансферазой выполняли, как описано ранее (Zamore et al., 2000). Для картирования расщепления РНК-мишени 100 нМ siRNA-дуплекс инкубировали с 5-10 нМ РНК-мишенью в лизате эмбрионов D. melanogaster при стандартных условиях (Zamore et al., 2000) в течение 2 часов при 25оС. Реакцию останавливали добавлением 8 объемов буфера протеиназы К (200 мМ Трис-HCl, рН 7,5, 25 мМ ЭДТА, 300 мМ NaCl, 2% масса/объем додецилсульфат натрия). Протеиназу К (E.M. Merck, растворенную в воде) добавляли в конечной концентрации 0,6 мг/мл. Затем реакции инкубировали в течение 15 минут при 65оС, экстрагировали смесью фенол/хлороформ/изоамиловый спирт (25:24:1) и осаждали 3 объемами этанола. Пробы локализовали на 6% секвенирующих гелях. Стандарты длин получали частичным расщеплением РНКазой Т1 и частичным щелочным гидролизом кэп-меченых смысловой или антисмысловой РНК-мишеней.
3.2 Результаты
3.2.1 Варьирование 3'-выступа в дуплексах siRNA из 21 нт
Как описано выше, 2 или 3 неспаренных нуклеотида на 3'-конце siRNA-дуплексов были более эффективными в деградации РНК-мишени, чем соответствующие дуплексы с тупыми концами. Для выполнения более обстоятельного анализа функции концевых нуклеотидов авторы синтезировали пять смысловых siRNA из 21 нт, каждая из которых смещалась на один нуклеотид относительно РНК-мишени, и восемь антисмысловых siRNA из 21 нт, каждая из которых смещалась на один нуклеотид относительно мишени (фиг. 11А). Комбинированием смысловых и антисмысловых siRNA получали восемь серий siRNA-дуплексов с синтетическими выступающими концами, охватывающими диапазон 7-нуклеотидный 3'-выступ - 4-нуклеотидный 5'-выступ. Интерференцию siRNA-дуплексов измеряли с использованием системы двойного анализа люциферазы (Tuschl et al., 1999; Zamore et al., 2000). siRNA-дуплексы были направлены против мРНК люциферазы светляка, и мРНК люциферазы морской фиалки использовали в качестве внутреннего контроля. Отношение люминесценции мишени к активности люциферазы контроля определяли в присутствии siRNA-дуплекса и нормализовали относительно этого отношения, наблюдаемого в отсутствие дцРНК. Для сравнения отношения интерференции длинных дцРНК (39-504 п.н.) показаны на фиг. 11В. Отношения интерференции определяли при концентрациях 5 нМ для длинных дцРНК (фиг. 11А) и при 100 нМ для siRNA-дуплексов (фиг. 11С-J). Были выбраны концентрации 100 нМ siRNA, так как полный процессинг 5 нМ дцРНК размером 504 п.н. приводил бы к 120 нМ общих siRNA-дуплексов.
Способность siRNA-дуплексов из 21 нт опосредовать интерференцию РНК (РНКи) зависит от числа выступающих нуклеотидов или образующихся п.н. Дуплексы с 4-6 3'-выступающими нуклеотидами были неспособны опосредовать интерференцию РНК (фиг. 11С-F), как и дуплексы с двумя или более 5'-выступающими нуклеотидами (фиг. 11G-J). Дуплексы с 2-нуклеотидными 3'-выступами были наиболее эффективными в опосредовании интерференции РНК, хотя эффективность индукции молчания была также последовательность-зависимой, и наблюдали различия до 12-кратных различий для различных siRNA-дуплексов с 2-нуклеотидными 3'-выступами (сравните фиг. 11D-H). Дуплексы с затупленными концами, с 1-нуклеотидным 5'-выступом или 1-3-нуклеотидными 3'-выступами были иногда функциональными. Небольшой эффект индукции молчания, наблюдаемый для siRNA-дуплекса с 3'-выступом из 7 нуклеотидов (фиг. 11С), может быть обусловлен антисмысловым эффектом длинного 3'-выступа, а не интерференцией РНК. Сравнение эффективности интерференции РНК между длинными дцРНК (фиг. 11В) и наиболее эффективными siRNA-дуплексами из 21 нт (фиг. 11Е, G, H) указывает на то, что единственный siRNA-дуплекс при концентрации 100 нМ может быть таким же эффективным, что и 5 нМ дцРНК размером 504 п.н.
3.2.2 Варьирование длины смысловой siRNA, спаренной с инвариантной 21-нуклеотидной антисмысловой siRNA
Для исследования влияния длины siRNA на интерференцию РНК авторы получали 3 серии siRNA-дуплексов комбинированием трех 21-нуклеотидных антисмысловых цепей с восемью смысловыми цепями из 18-25 нуклеотидов. 3'-выступы антисмысловой siRNA фиксировали до 1, 2 или 3 нт в каждой серии siRNA-дуплексов, тогда как смысловую siRNA варьировали на ее 3'-конце (фиг. 12А). Независимо от длины смысловой siRNA, авторы обнаружили, что дуплексы с 2-нуклеотидным 3'-выступом антисмысловой siRNA (фиг. 12С) были более активными, чем дуплексы с 1- или 3-нуклеотидным 3'-выступом (фиг. 12В, D). В первой серии, с 3'-выступом из 1 нт антисмысловой siRNA, наиболее активными были дуплексы со смысловыми siRNA из 21 и 22 нт, несущими 3'-выступ из 1 нт и 2 нт, соответственно. Дуплексы со смысловыми siRNA из 19-25 нт также были способны опосредовать РНКи, но в меньшей степени. Подобным образом, во второй серии, с 2-нуклеотидным 3'-выступом антисмысловой siRNA, наиболее активным был siRNA-дуплекс из 21 нт с 2-нуклеотидным 3'-выступом и любая другая комбинация со смысловыми siRNA из 18-25 нт была активной в значительной степени. В последней серии, с 3-нуклеотидным 3'-выступом антисмысловой siRNA, только дуплекс с 20-нуклеотидной смысловой siRNA и 2-нуклеотидным смысловым 3'-выступом был способен уменьшать экспрессию РНК-мишени. Взятые вместе, эти результаты указывают на то, что длина siRNA, а также длина 3'-выступа являются важными и что дуплексы siRNA из 21 нт с 3'-выступом из 2 нт являются оптимальными для интерференции РНК.
3.2.3 Варьирование длины siRNA-дуплексов с константным 2-нуклеотидным 3'-выступом
Затем авторы исследовали влияние одновременного изменения длины обеих цепей siRNA при сохранении симметричных 2-нуклеотидных 3'-выступов (фиг. 13А). Получали две серии siRNA-дуплексов, в том числе 21-нуклеотидный siRNA-дуплекс фиг. 11Н в качестве ссылочного дуплекса. Длину этих дуплексов варьировали между 20 и 25 п.н. посредством удлинения сегмента со спаренными основаниями на 3'-конце смысловой siRNA (фиг. 13В) или на 3'-конце антисмысловой siRNA (фиг. 13С). Дуплексы из 20-23 п.н. вызывали специфический регресс активности люциферазы-мишени, но siRNA-дуплекс из 21 нт был по меньшей мере в 8 раз более эффективным, чем любой из других дуплексов. siRNA-дуплексы из 24 и 25 нт не приводили к какой-либо детектируемой интерференции. Последовательность-специфические эффекты были минорными, так как варьирования на обоих концах этого дуплекса производили одинаковые эффекты.
3.2.4 2'-дезокси- и 2'-О-метил-модифицированные siRNA-дуплексы
Для оценки важности рибозных остатков siRNA для интерференции РНК исследовали дуплексы с 21-нуклеотидными siRNA и 2-нуклеотидными 3'-выступами с 2'-дезокси- или 2'-О-метил-модифицированными цепями (фиг. 14). Замена 2-нуклеотидных 3'-выступов 2'-дезоксинуклеотидами не оказывала действия, и даже замена двух дополнительных рибонуклеотидов, смежных с этими выступами в спаренном районе, производила значимо активные siRNA. Так, 8 из 42 нт siRNA-дуплекса заменяли ДНК-остатками без потери активности. Однако полная замена одной или обеих siRNA-цепей 2'-дезокси-остатками элиминировала интерференцию РНК, как и замена 2'-О-метильными остатками.
3.2.5 Определение сайтов расщепления РНК-мишени
Положения расщепления РНК-мишени определяли ранее для 22-нуклеотидных siRNA-дуплексов и для 21-нуклеотидного-22 нуклеотидного дуплекса. Было обнаружено, что положение расщепления РНК-мишени локализовано в центре района, охватываемого данным siRNA-дуплексом, в 11 или 12 нт справа от первого нуклеотида, который был комплементарен 21-нуклеотидной или 22-нуклеотидной руководящей последовательности siRNA. Пять различных 21-нуклеотидных siRNA-дуплексов с 2-нуклеотидным 3'-выступом (фиг. 15А) инкубировали с 5'-кэппированной смысловой или антисмысловой РНК-мишенью в лизате D. melanogaster (Tuschl et al., 1999; Zamore et al., 2000). Продукты 5'-расщепления разделяли на секвенирующих гелях (фиг. 15В). Количество расщепленной смысловой РНК-мишени коррелирует с эффективностью siRNA-дуплексов, определяемой в анализе на основе трансляции, и siRNA-дуплексы 1, 2 и 4 (фиг. 15В и 11Н, G, E) расщепляют РНК-мишень быстрее, чем дуплексы 3 и 5 (фиг. 15В и 11F, D). Примечательно, что сумма радиоактивности продукта 5'-расщепления и введенной РНК-мишени не была постоянной на протяжении времени и продукты 5'-расщепления не накапливались. Предположительно, продукты расщепления после высвобождения из комплекса siRNA-эндонуклеаза быстро деградируются вследствие отсутствия либо поли(А)-хвоста, либо 5'-кэпа.
Сайты расщепления для обеих, смысловой и антисмысловой, РНК-мишеней локализованы в середине района, охватываемого siRNA-дуплексами. Сайты расщепления для каждой мишени, производимые 5 различными дуплексами, изменялись на 1 нт в соответствии со смещением на 1 нуклеотид этих дуплексов вдоль последовательностей-мишеней. Мишени расщеплялись точно на 11 нт справа от положения мишени, комплементарного самому правому (3') нуклеотиду последовательность-комплементарной руководящей siRNA (фиг. 15А, В).
Для определения, устанавливает ли 5'- или 3'-конец руководящей siRNA правила для расщепления РНК-мишени, авторы разработали экспериментальную стратегию, очерченную на фиг. 16А и В. 21-нуклеотидную антисмысловую siRNA, которую сохраняли инвариантной для этого исследования, спаривали со смысловыми siRNA, которые были модифицированы на их либо 5'-, либо 3'-концах. Положение расщепления смысловой и антисмысловой РНК-мишеней определяли, как описано выше. Изменения в 3'-конце смысловой siRNA, наблюдаемые в отношении 1-нуклеотидного 5'-выступа - 6-нуклеотидного 3'-выступа не влияли на положение расщепления ни смысловой, ни антисмысловой РНК-мишени (фиг. 16С). Изменения в 5'-конце смысловой siRNA не влияли на расщепление смысловой РНК-мишени (фиг. 16D, верхняя панель), как и ожидалось, поскольку антисмысловая siRNA была неизменяемой. Однако расщепление антисмысловой РНК-мишени испытывало влияние и сильно зависело от 5'-конца смысловой siRNA (фиг. 16D, нижняя панель). Антисмысловая мишень расщеплялась только в том случае, когда смысловая siRNA имела размер 20 или 21 нт, и положение расщепления отличалось на 1 нуклеотид, что предполагает, что 5'-конец узнающей мишень siRNA устанавливает правило для расщепления РНК-мишени. Это положение локализовано между нуклеотидами 10 и 11 при счете в 5'-направлении от нуклеотида мишени, спаренного с крайним 5'-нуклеотидом руководящей siRNA (см. также фиг. 15А).
3.2.6 Влияния последовательности и 2'-дезоксизамен в 3'-выступе
2-нуклеотидный 3'-выступ является предпочтительным для функции siRNA. Авторы хотели выяснить, способствует ли последовательность выступающих нуклеотидов узнаванию мишени или является ли она только признаком, требующимся для восстановления эндонуклеазного комплекса (RISC или siRNР). Авторы синтезировали смысловые и антисмысловые siRNA с 3'-выступами АА, СС, GG, UU и UG и включили 2'-дезокси-модификации TdG и TT. siRNA дикого типа содержали АА в 3'-выступе смысловой и UG в 3'-выступе антисмысловой цепи (АА/UG). Все siRNA-дуплексы были функциональными в анализе интерференции и уменьшали экспрессию мишени по меньшей мере в 5 раз (фиг. 17). Наиболее эффективными siRNA-дуплексами, которые уменьшали экспрессию мишени более чем в 10 раз, были siRNA-дуплексы с последовательностью типа NN/UG, NN/UU, NN/TdG и NN/TT (N обозначает любой нуклеотид). siRNA-дуплексы с 3'-выступом антисмысловой цепи АА, СС или GG были менее активными в 2-4 раза в сравнении с последовательностью UG дикого типа или мутантом UU. Это уменьшение эффективности интерференции РНК обусловлено, по-видимому, вкладом предпоследнего 3'-нуклеотида в последовательность-специфическое узнавание мишени, так как 3'-концевой нуклеотид был изменен с G на U без какого-либо влияния.
Изменения в последовательности 3'-выступа смысловой siRNA не обнаруживали никаких последовательность-зависимых эффектов, что и ожидалось, так как смысловая siRNA не должна способствовать узнаванию смысловой мРНК-мишени.
3.2.7 Последовательность-специфичность узнавания мишени
Для исследования последовательность-специфичности узнавания мишени авторы вводили изменения последовательности в спаренные сегменты siRNA-дуплексов и определяли эффективность индукции молчания генов. Изменения последовательности вводили инвертированием коротких сегментов длиной 3 или 4 нт или в виде точковых мутаций (фиг. 18). Изменения последовательности в одной цепи siRNA компенсировали в комплементарной цепи siRNA во избежание пертурбации структуры siRNA-дуплекса со спаренными основаниями. Последовательность всех 3'-выступов из 2 нт была ТТ (Т, 2'-дезокситимидин) для уменьшения расходов по синтезу. Ссылочный siRNA-дуплекс ТТ/ТТ сравнивали по интерференции РНК с siRNA-дуплексом дикого типа АА/UG (фиг. 17). Способность опосредовать деструкцию репортерной мРНК определяли количественно с использованием анализа люминесценции на основе трансляции. Дуплексы siRNA с инвертированными сегментами последовательности показали разительно уменьшенную способность в отношении нацеливания на репортер люциферазы светляка (фиг. 18). Изменения последовательности, локализованные между 3'-концом и серединой антисмысловой siRNA, полностью элиминировали узнавание РНК-мишени, но мутации вблизи 5'-конца антисмысловой siRNA проявляли небольшую степень индукции молчания генов. Трансверсия пары оснований А/U, локализованной прямо напротив предсказанного сайта расщепления РНК-мишени, или одного нуклеотида, расположенного далее вне предсказанного сайта, предотвращала расщепление РНК-мишени, свидетельствуя, следовательно, о том, что единственная мутация в центре siRNA-дуплекса дискриминирует между ошибочно спаренными мишенями.
3.3 Обсуждение
siRNA являются ценными реагентами для инактивации экспрессии генов не только в клетках насекомых, но также в клетках млекопитающих, с большим потенциалом в отношении терапевтического применения. Авторы провели систематический анализ структурных детерминант siRNA-дуплексов, необходимых для стимуляции эффективной деградации РНК-мишеней в лизате эмбрионов D. melanogaster, обеспечив тем самым правила для конструирования наиболее эффективных siRNA-дуплексов. Безупречный siRNA-дуплекс способен прекращать экспрессию генов с эффективностью, сравнимой с дцРНК размером 500 п.н., при условии использования сравнимых количеств тотальной РНК.
3.4 Руководство для пользователя siRNA
Эффективно индуцирующие молчание генов siRNA-дуплексы состоят предпочтительно из 21-нуклеотидных антисмысловых siRNA и должны быть выбраны для образования двойной спирали размером 19 п.н. с 2-нуклеотидными 3'-выступающими концами. 2'-дезокси-замены 2-нуклеотидных 3'-выступающих рибонуклеотидов не влияют на интерференцию РНК, но помогают уменьшить стоимость синтеза РНК и могут усиливать устойчивость к РНКазам siRNA-дуплексов. Однако более интенсивные 2'-дезокси- или 2'-О-метил-модификации уменьшают способность siRNA опосредовать интерференцию РНК, возможно предотвращением связывания белка для сборки siRNР.
Узнавание мишени является в высокой степени последовательность-специфическим процессом, опосредуемым комплементарностью siRNA с мишенью. Самый крайний 3'-нуклеотид этой “руководящей” siRNA не способствует специфичности узнавания мишени, тогда как предпоследний нуклеотид 3'-выступа влияет на расщепление РНК-мишени, и ошибочное спаривание снижает интерференцию РНК в 2-4 раза. 5'-конец руководящей siRNA также является, по-видимому, более пермиссивным в отношении узнавания ошибочно спаренной РНК-мишени в сравнении с 3'-концом. Нуклеотиды в центре siRNA, локализованные напротив сайта расщепления РНК-мишени, являются важными детерминантами специфичности, и даже замены единственного нуклеотида уменьшают интерференцию РНК до недектируемого уровня. Это предполагает, что siRNA-дуплексы могут быть способны дискриминировать мутантные или полиморфные аллели в экспериментах по нацеливанию на гены, что может стать важным признаком для дальнейших терапевтических разработок.
Предполагается, что смысловая и антисмысловая siRNA при связывании с белковыми компонентами комплекса эндонуклеазы или заключающего эндонуклеазу комплекса играют различные роли; относительная ориентация siRNA-дуплекса в этом комплексе определяет, какая цепь может быть использована для узнавания мишени. Синтетические siRNA-дуплексы имеют диадную симметрию в связи с двухспиральной структурой, но не в связи с последовательностью. Ассоциация siRNA-дуплексов с РНКи-белками в лизате D. melanogaster приведет к образованию двух асимметричных комплексов. В таких гипотетических комплексах хиральное окружение является различным для смысловой и антисмысловой siRNA и, следовательно, их функции. Это прогнозирование, очевидно, не применимо к палиндромным siRNA-последовательностям или к белкам РНКи, которые могли бы ассоциироваться в виде гомодимеров. Для минимизации эффектов последовательности, которые могут влиять на соотношение смыслового и антисмыслового нацеливания siRNР, авторы предлагают использовать siRNA-последовательности с идентичными 3'-выступающими последовательностями. Авторы рекомендуют приспосабливать последовательность выступа смысловой siRNA к последовательноси антисмыслового 3'-выступа, так как смысловая siRNA не имеет мишени в типичных экспериментах с нокдауном генов. Асимметрия в образовании расщепляющих смысловую цепь и антисмысловую цепь siRNР могла бы быть (частично) ответственной за варьирование эффективности интерференции РНК, наблюдаемое для различных 21-нуклеотидных siRNA-дуплексов с 2-нуклеотидными 3'-выступами, используемых в данном исследовании (фиг. 14). Альтернативно, нуклеотидная последовательность в сайте-мишени и/или доступность структуры РНК-мишени может быть ответственной за варьирование эффективности для этих siRNA-дуплексов.
Литература
Bass, B. L. (2000). Double-stranded RNA as a template for gene silencing. Cell 101, 235-238.
Bosher, J. M., and Labouesse, M. (2000). RNA interference: genetic wand and genetic watchdog. Nat. Cell Biol. 2, E31-36.
Caplen, N. J., Fleenor, J., Fire, A., and Morgan, R. A. (2000). dsRNA-mediated gene silencing in cultured Drosophila cells: a tissue culture model for the analysis of RNA interference. Gene 252, 95-105.
Catalanotto, C., Azzalin, G., Macino, G., and Cogoni, C. (2000). Gene silencing in worms and fungi. Nature 404, 245.
Chanfreau, G., Buckle, M., and Jacquier, A. (2000). Recognition of a conserved class of RNA tetraloops by Saccharomyces cerevisiae RNase III. Proc. Natl. Acad. Sci. USA 97, 3142-3147.
Clemens, M. J. (1997). PKR--a protein kinase regulated by double-stranded RNA. Int. J. Biochem. Cell Biol. 29, 945-949.
Cogoni, C., and Macino, G. (1999). Homology-dependent gene silencing in plants and fungi: a number of variations on the same theme. Curr. Opin. 25 Microbiol. 2, 657-662.
Dalmay, T., Hamilton, A., Rudd, S., Angell, S., and Baulcombe, D. C. (2000). An RNA-dependent RNA polymerase gene in Arabidopsis is required for posttranscriptional gene silencing mediated by a transgene but not by a virus. Cell 101, 543-553.
Dernburg, A. F., Zalevsky, J., Colaiacovo, M. P., and Villeneuve, A. M. (2000). Transgene-mediated cosuppression in the C. elegans germ line. Genes & Dev. 14, 1578-1583.
Dunn, J. J. (1982). Ribonuclease III. In The enzymes, vol 15, part B, P. D. Boyer, ed. (New York: Academic Press), pp. 485-499.
Filippov, V., Solovyev, V., Filippova, M., and Gill, S. S. (2000). A novel type of RNase III family proteins in eukaryotes. Gene 245, 213-221.
Fire, A. (1999). RNA-triggered gene silencing. Trends Genet. 15, 358-363.
Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., and Mello, C. C. (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806-811.
Grishok, A., Tabara, H., and Mello, C. C. (2000). Genetic requirements for inheritance of RNAi in C. elegans. Science 287, 2494-2497.
Hamilton, A. J., and Baulcombe, D. C. (1999). A species of small antisense RNA in posttranscriptional gene silencing in plants. Science 286, 950-952.
Hammond, S. M., Bernstein, E., Beach, D., and Hannon, G. J. (2000). An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature 404, 293-296.
Jacobsen, S. E., Running, M. P., and M., M. E. (1999). Disruption of an RNA helicase/RNase III gene in Arabidopsis causes unregulated cell division in floral meristems. Development 126, 5231-5243.
Jensen, S., Gassama, M. P., and Heidmann, T. (1999). Taming of transposable elements by homology-dependent gene silencing. Nat. Genet. 21, 209-212.
Kehlenbach, R. H., Dickmanns, A. & Gerace, L. (1998). Nucleocytoplasmic shuttling factors including Ran and CRM1 mediate nuclear export of NFAT In vitro. J. Cell Biol. 141, 863-874.
Kennerdell, J. R., and Carthew, R. W. (1998). Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell 95, 1017-1026.
Ketting, R. F., Haverkamp, T. H., van Luenen, H. G., and Plasterk, R. H. (1999). Mut-7 of C. elegans, required for transposon silencing and RNA interference, is a homolog of Werner syndrome helicase and RNaseD. Cell 99, 133-141.
Ketting, R. F., and Plasterk, R. H. (2000). A genetic link between co-suppression and RNA interference in C. elegans. Nature 404, 296-298.
Lucy, A. P., Guo, H. S., Li, W. X., and Ding, S. W. (2000). Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus. EMBO J. 19, 1672-1680.
Matsuda, S., Ichigotani, Y., Okuda, T., Irimura, T., Nakatsugawa, S., and Hamaguchi, M. (2000). Molecular cloning and characterization of a novel human gene (HERNA) which encodes a putative RNA-helicase. Biochim. Biophys. Acta 31, 1-2.
Milligan, J.F., and Uhlenbeck, O.C. (1989). Synthesis of small RNAs using T7 RNA polymerase. Methods Enzymol. 180, 51-62.
Mourrain, P., Beclin, C., Elmayan, T., Feuerbach, F., Godon, C., Morel, J. B., Jouette, D., Lacombe, A. M., Nikic, S., Picault, N., Remoue, K., Sanial, M., Vo, T. A., and Vaucheret, H. (2000). Arabidopsis SGS2 and SGS3 genes are required for post-transcriptional gene silencing and natural virus resistance. Cell 101, 533-542.
Ngo, H., Tschudi, C., Gull, K., and Ullu, E. (1998). Double-stranded RNA induces mRNA degradation in Trypanosoma brucei. Proc. Natl. Acad. Sci. USA 95, 14687-14692.
Nicholson, A. W. (1999). Function, mechanism and regulation of bacterial ribonucleases. FEMS Microbiol. Rev. 23, 371-390.
Oelgeschlager, M., Larrain, J., Geissert, D., and De Robertis, E. M. (2000). The evolutionarily conserved BMP-binding protein Twisted gastrulation promotes BMP signalling. Nature 405, 757-763.
Pan, T., and Uhlenbeck, 0. C. (1992). In vitro selection of RNAs that undergo autolytic cleavage with Pb2+. Biochemistry 31, 3887-3895.
Pelissier, T., and Wassenegger, M. (2000). A DNA target of 30 bp is sufficient for RNA-directed methylation. RNA 6, 55-65.
Plasterk, R. H., and Ketting, R. F. (2000). The silence of the genes. Curr. Opin. Genet. Dev. 10, 562-567.
Ratcliff, F. G., MacFarlane, S. A., and Baulcombe, D. C. (1999). Gene Silencing without DNA. RNA-mediated cross-protection between viruses. Plant Cell 11, 1207-1216.
Robertson, H. D. (1990). Escherichia coli ribonuclease III. Methods Enzymol. 181, 189-202.
Robertson, H. D. (1982). Escherichia coli ribonuclease III cleavage sites. Cell 30, 669-672.
Romaniuk, E., McLaughlin, L. W., Neilson, T., and Romaniuk, P. J. (1982). The effect of acceptor oligoribonucleotide sequence on the T4 RNA ligase reaction. Eur J Biochem 125, 639-643.
Sharp, P. A. (1999). RNAi and double-strand RNA. Genes & Dev. 13, 139-141.
Sijen, T., and Kooter, J. M. (2000). Post-transcriptional gene-silencing: RNAs on the attack or on the defense? Bioessays 22, 520-531.
Smardon, A., Spoerke, J., Stacey, S., Klein, M., Mackin, N., and Maine, E. (2000). EGO-1 is related to RNA-directed RNA polymerase and functions in germ-line development and RNA interference in C. elegans. Curr. Biol. 10, 169-178.
Svoboda, P., Stein, P., Hayashi, H., and Schultz, R. M. (2000). Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA inter-ference. Development 127, 4147-4156.
Tabara, H., Sarkissian, M., Kelly, W. G., Fleenor, J., Grishok, A., Timmons, L., Fire, A., and Mello, C. C. (1999). The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell 99, 123-132.
Tuschl, T., Ng, M. M., Pieken, W., Benseler, F., and Eckstein, F. (1993). Importance of exocyclic base functional groups of central core guanosines for hammerhead ribozyme activity. Biochemistry 32, 11658-11668.
Tuschl, T., Sharp, P. A., and Bartel, D. P. (1998). Selection in vitro of novel ribozymes from a partially randomized U2 and U6 snRNA library. EMBO J. 17, 2637-2650.
Tuschl, T., Zamore, P. D., Lehmann, R., Bartel, D. P., and Sharp, P. A. (1999). Targeted mRNA degradation by double-stranded RNA in vitro. Genes & Dev. 13, 3191-3197.
Ui-Tei, K., Zenno, S., Miyata, Y. & Saigo, K. (2000). Sensitive assay of RNA interference in Drosophila and Chinese hamster cultured cells using firefly luciferase gene as target. FEBS Letters 479, 79-82.
Verma, S., and Eckstein, F. (1999). Modified oligonucleotides: Synthesis and strategy for users. Annu. Rev. Biochem. 67, 99-134.
Voinnet, О., Lederer, C., and Baulcombe, D. C. (2000). A viral movement protein prevents spread of the gene silencing signal in Nicotiana benthamiana. Cell 103, 157-167.
Wassenegger, M. (2000). RNA-directed DNA methylation. Plant Mol. Biol. 43, 203-220.
Wianny, F., and Zernicka-Goetz, M. (2000). Specific interference with gene function by double-stranded RNA in early mouse development. Nat. Cell Biol. 2, 70-75.
Wu, H., Xu, H., Miraglia, L. J., and Crooke, S. T. (2000). Human RNase III is a 160 kDa Protein Involved in Preribosomal RNA Processing. J. Biol. Chem. 17, 17.
Yang, D., Lu, H. and Erickson, J.W. (2000) Evidence that processed small dsRNAs may mediate sequence-specific mRNA degradation during RNAi in drosophilia embryos. Curr. Biol., 10, 1191-1200.
Zamore, P. D., Tuschl, T., Sharp, P. A., and Bartel, D. P. (2000). RNAi: Double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell 101, 25-33.
Zhang, K., and Nicholson, A. W. (1997). Regulation of ribonuclease III processing by double-helical sequence antideterminants. Proc. Natl. Acad. Sci. USA 94, 13437-13441.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАЛЫЕ МОЛЕКУЛЫ РНК, ОПОСРЕДУЮЩИЕ ИНТЕРФЕРЕНЦИЮ РНК | 2001 |
|
RU2322500C2 |
| МОЛЕКУЛЫ ХИМИЧЕСКИ МОДИФИЦИРОВАННОЙ КОРОТКОЙ ИНТЕРФЕРИРУЮЩЕЙ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ОПОСРЕДУЮТ ИНТЕРФЕРЕНЦИЮ РНК | 2006 |
|
RU2418068C2 |
| МОДИФИЦИРОВАННАЯ ЛИПИДОМ ДВУХЦЕПОЧЕЧНАЯ РНК, ОБЛАДАЮЩАЯ ЭФФЕКТОМ РНК-ИНТЕРФЕРЕНЦИИ | 2008 |
|
RU2489167C2 |
| Двухцепочечная РНК, способная снижать экспрессию мутантного аллеля с.607GA гена GNAO1 человека | 2022 |
|
RU2816137C1 |
| МОЛЕКУЛЫ РНК | 2018 |
|
RU2819868C2 |
| МОЛЕКУЛЫ РНК, ВКЛЮЧАЮЩИЕ НЕКАНОНИЧЕСКИЕ ПАРЫ ОСНОВАНИЙ | 2019 |
|
RU2812710C2 |
| РЕГУЛИРОВАНИЕ ПРОДУКТИВНЫХ ПРИЗНАКОВ У ПТИЦ | 2008 |
|
RU2518681C2 |
| МОДИФИЦИРОВАННАЯ ЛИПИДАМИ ДВУХЦЕПОЧЕЧНАЯ РНК, ОБЛАДАЮЩАЯ МОЩНЫМ ЭФФЕКТОМ РНК-ИНТЕРФЕРЕНЦИИ | 2009 |
|
RU2501859C2 |
| ОПОСРЕДУЕМОЕ РНК-ИНТЕРФЕРЕНЦИЕЙ ИНГИБИРОВАНИЕ ЭКСПРЕССИИ ГЕНОВ ВИРУСА ГЕПАТИТА B (HBV) С ПРИМЕНЕНИЕМ МАЛОЙ ИНТЕРФЕРИРУЮЩЕЙ НУКЛЕИНОВОЙ КИСЛОТЫ (миНК) | 2011 |
|
RU2624045C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЯВЛЕНИЯ КРОВОТЕЧЕНИЯ У БОЛЬНОГО ГЕМОФИЛИЕЙ | 2018 |
|
RU2801263C2 |
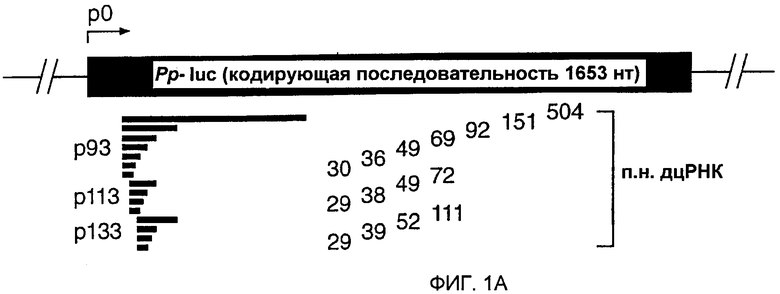
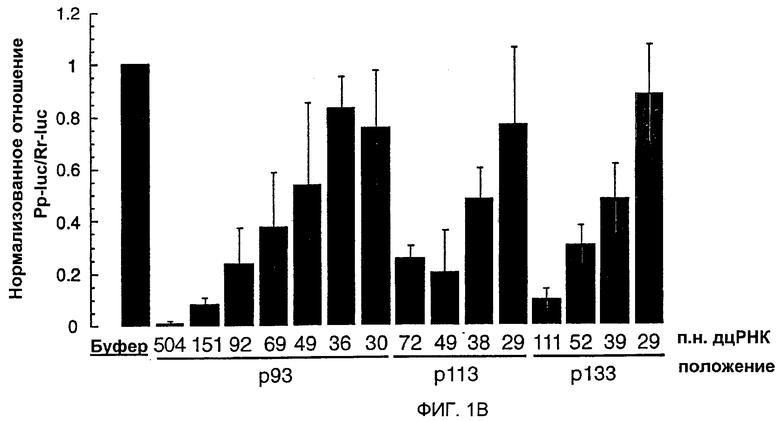
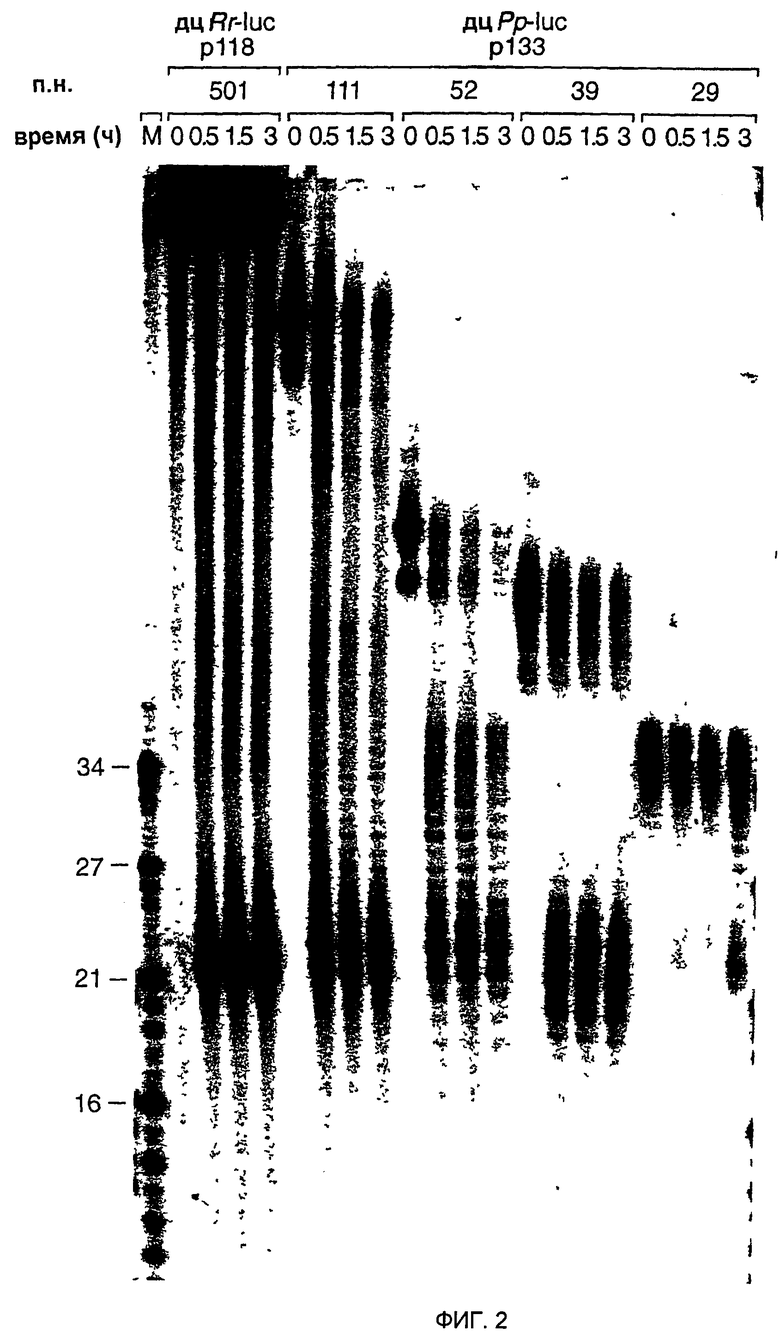

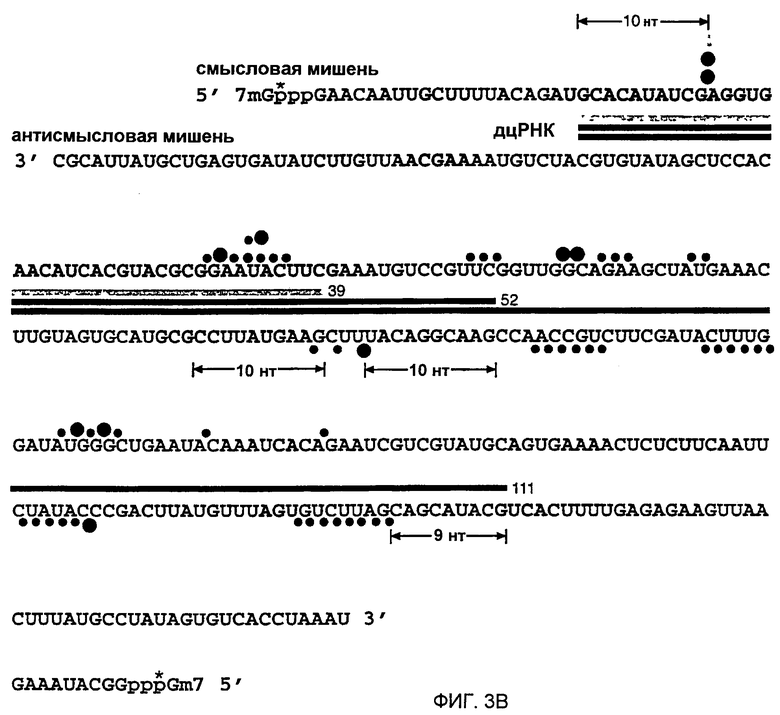

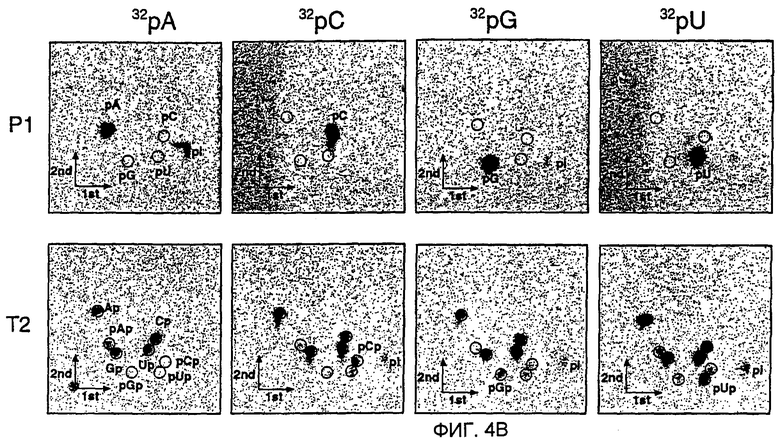
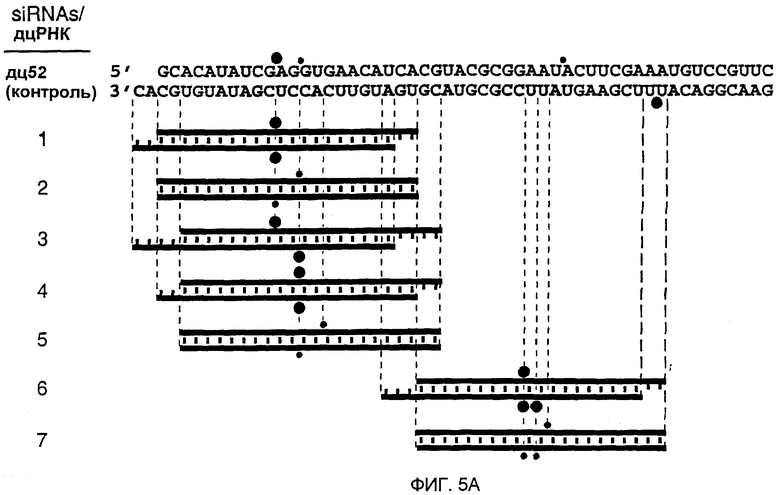
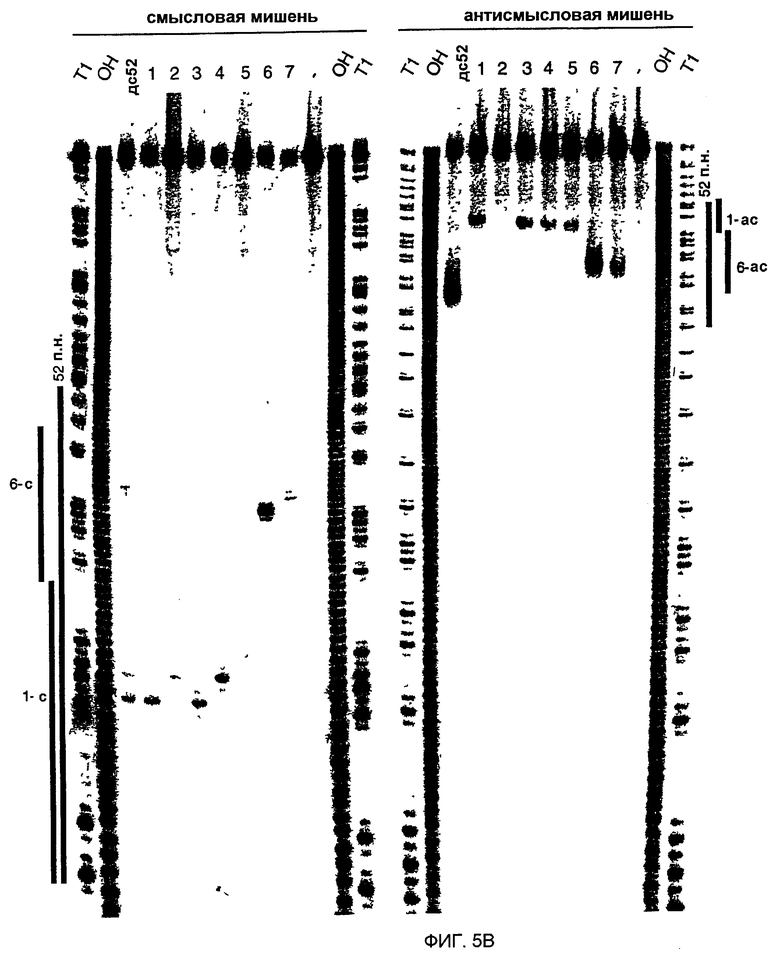
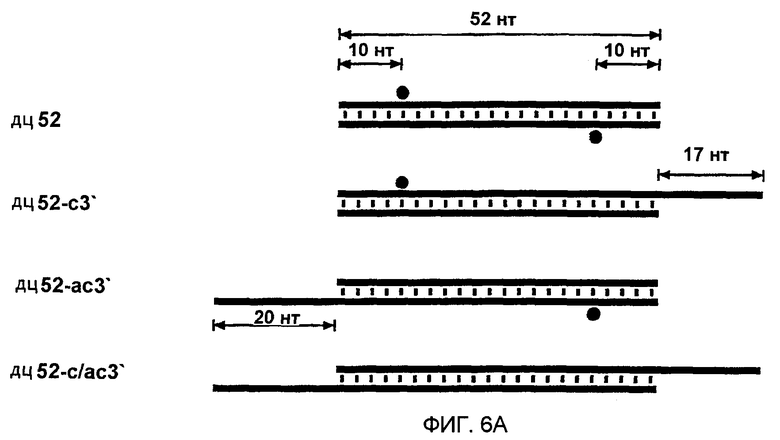
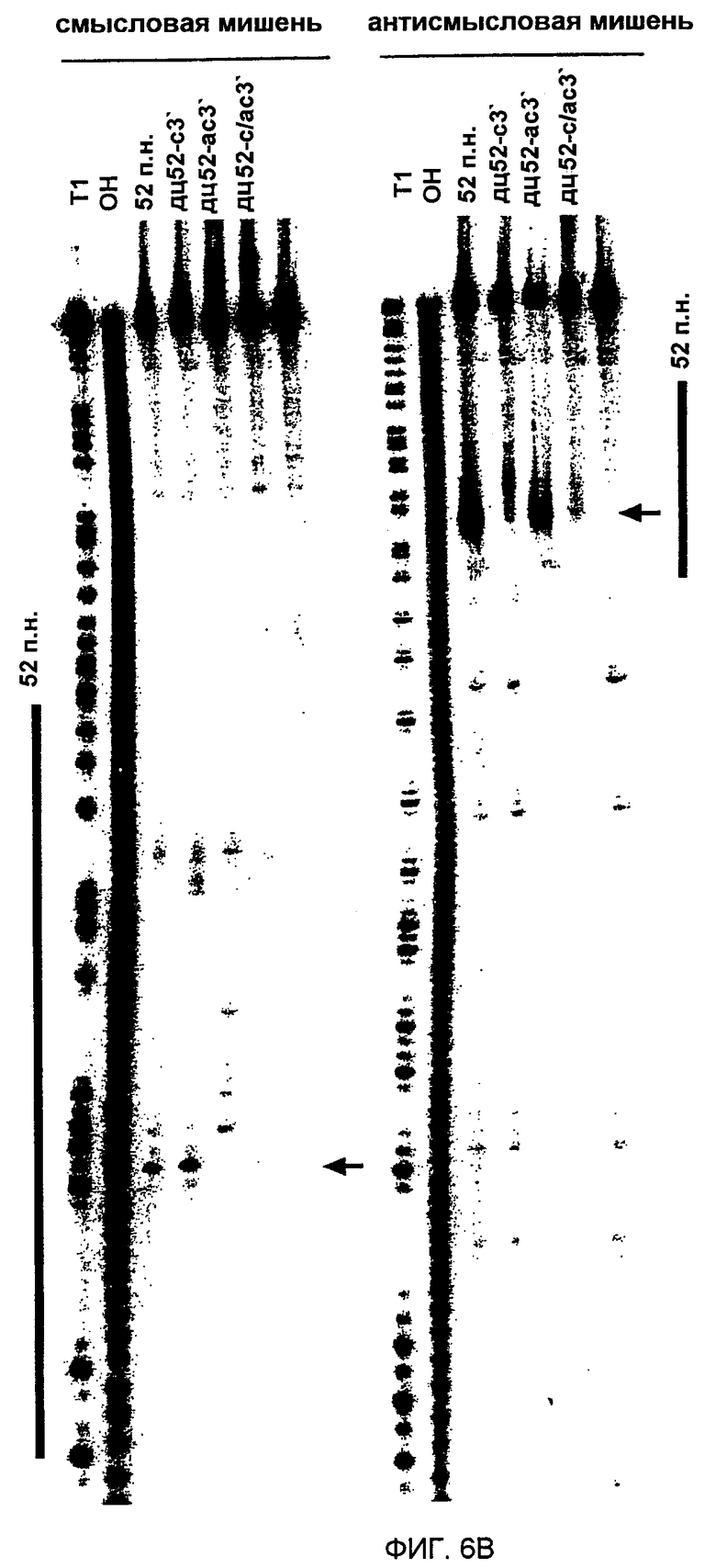
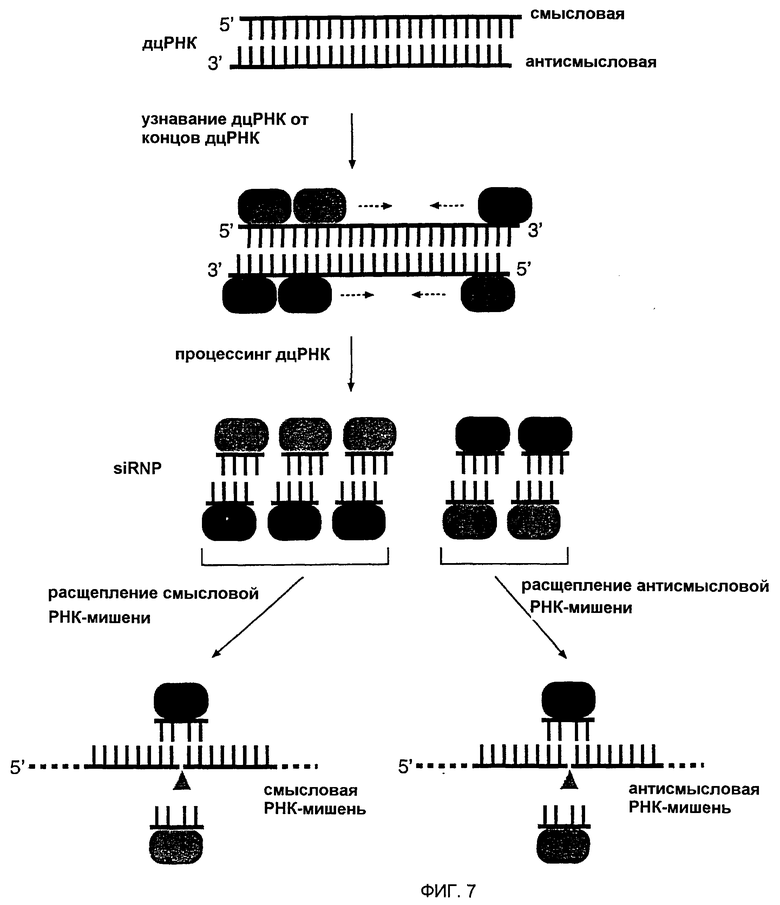
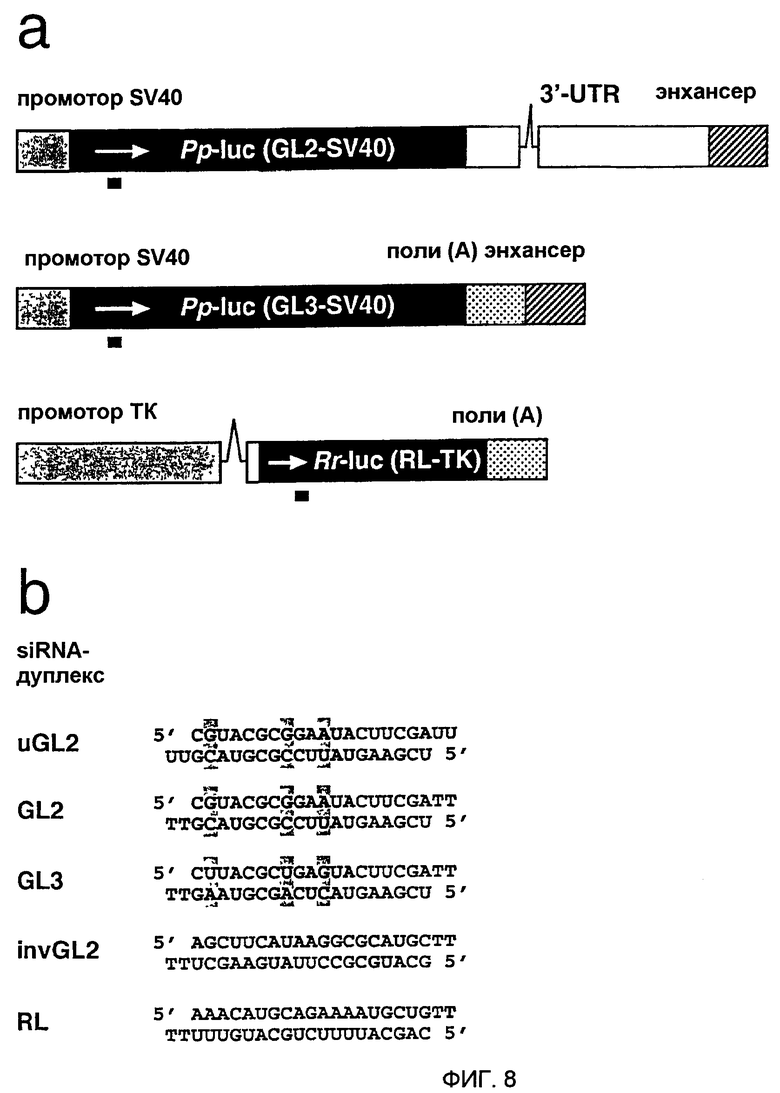
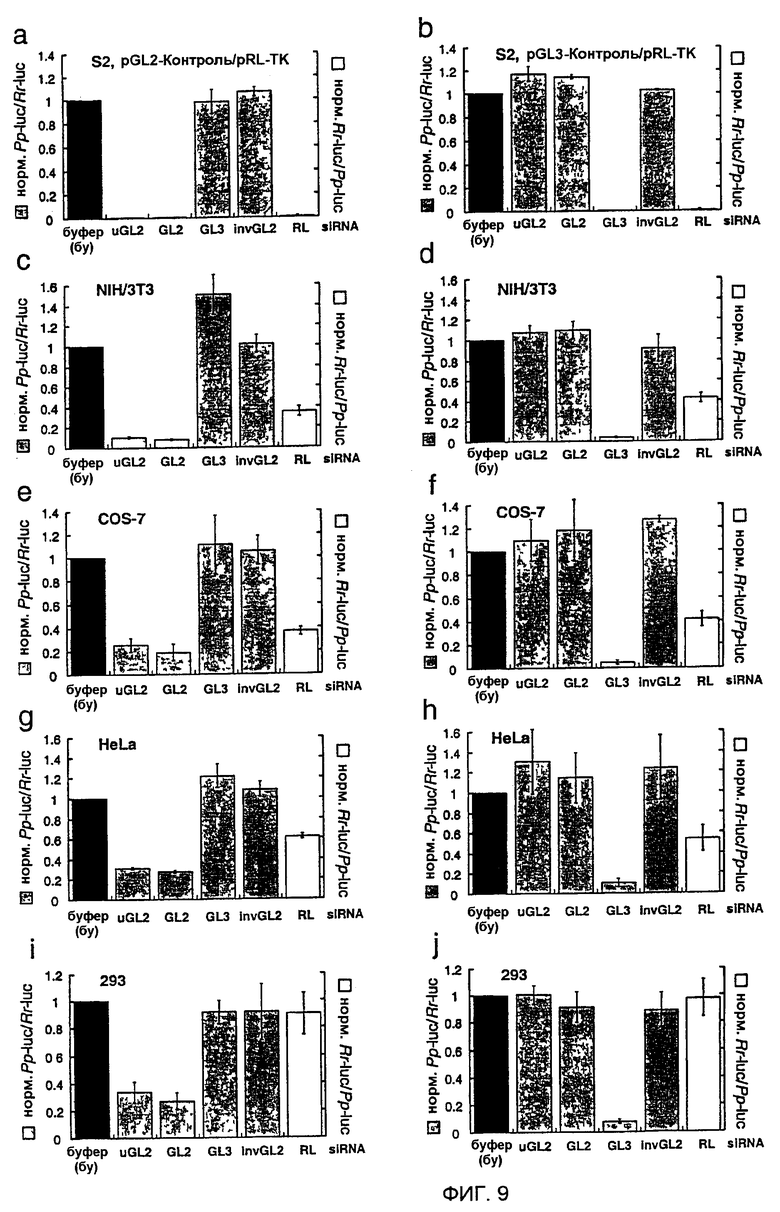
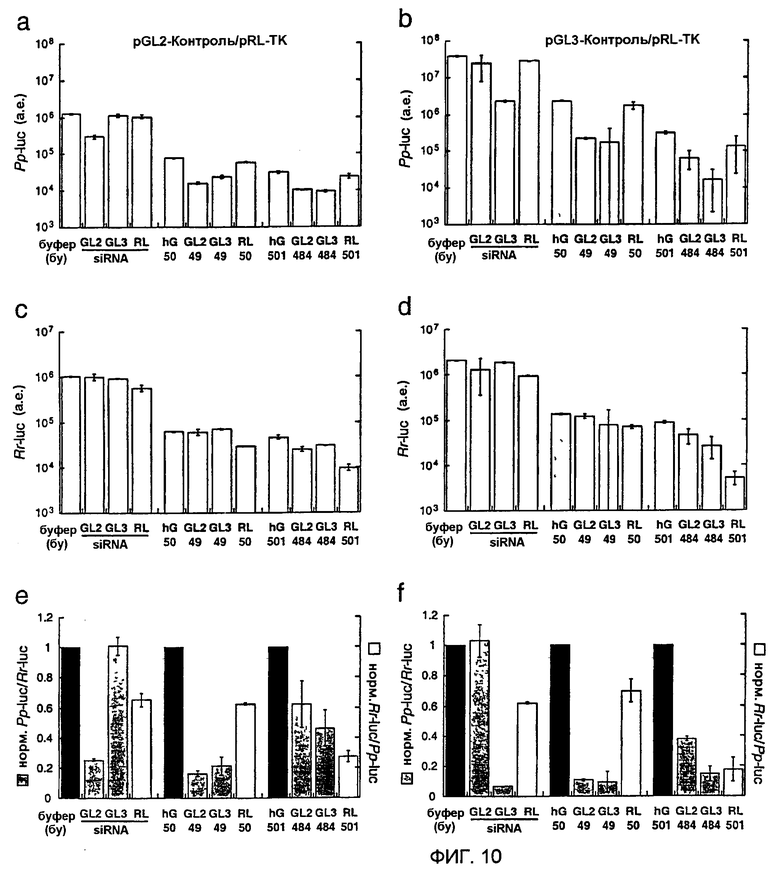
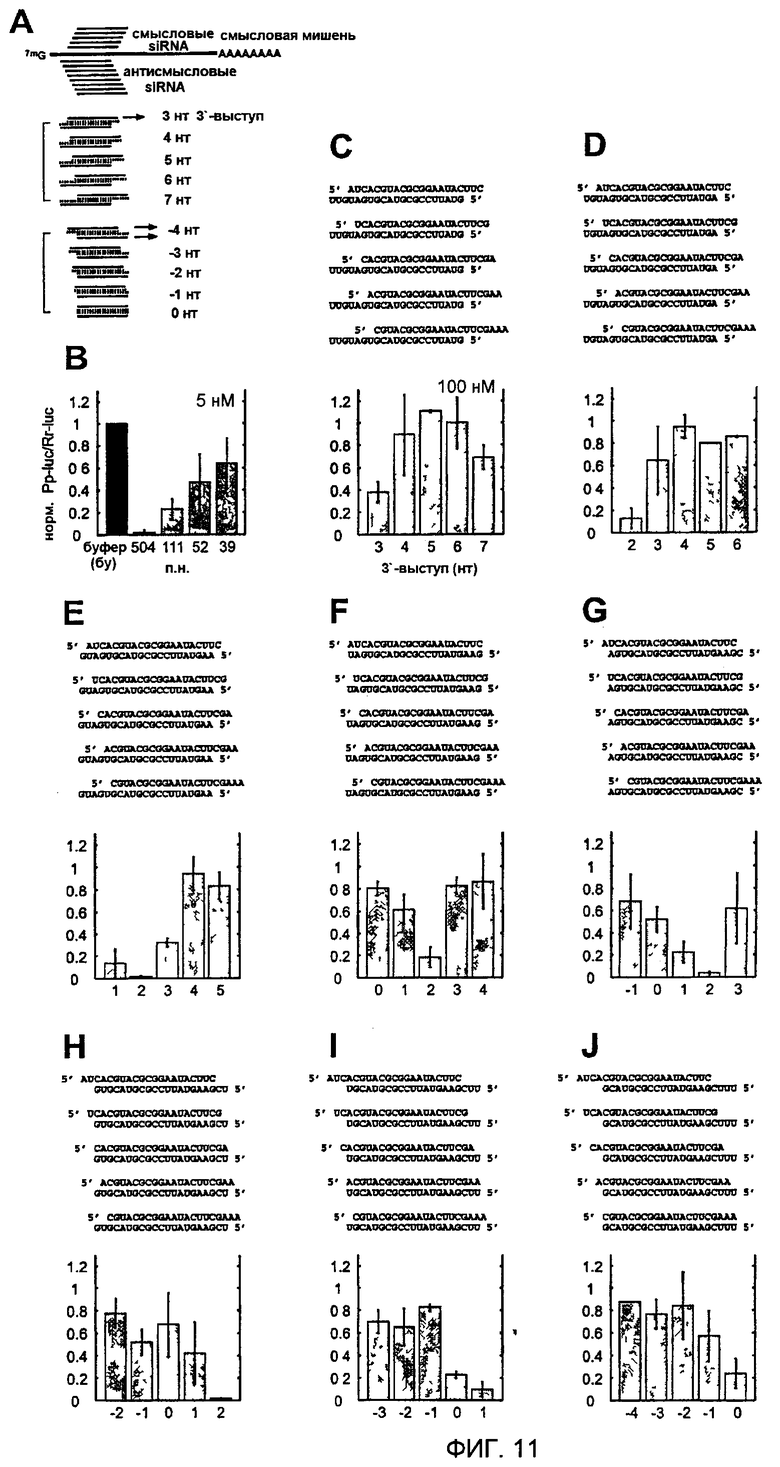
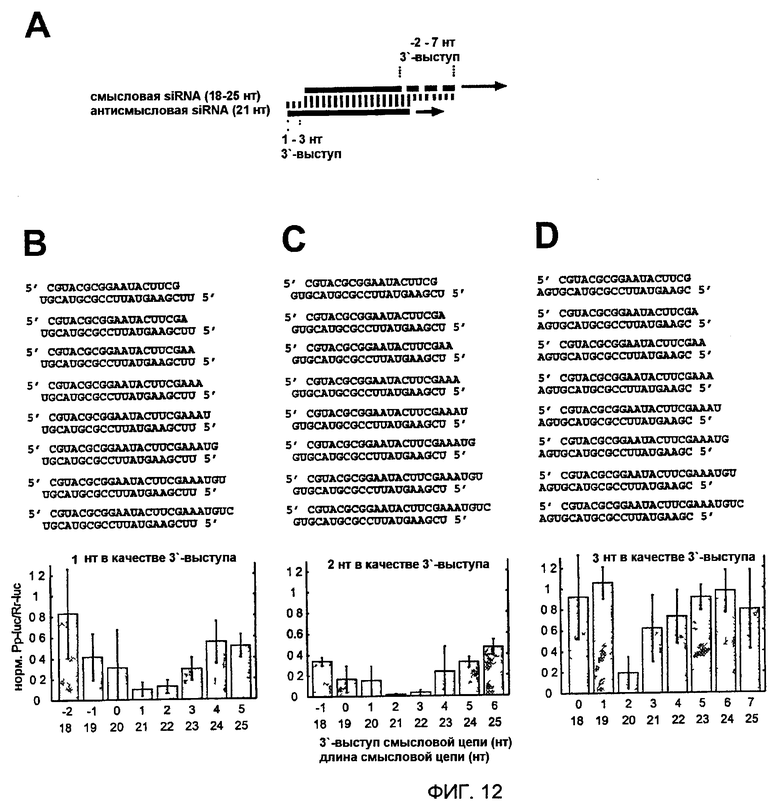
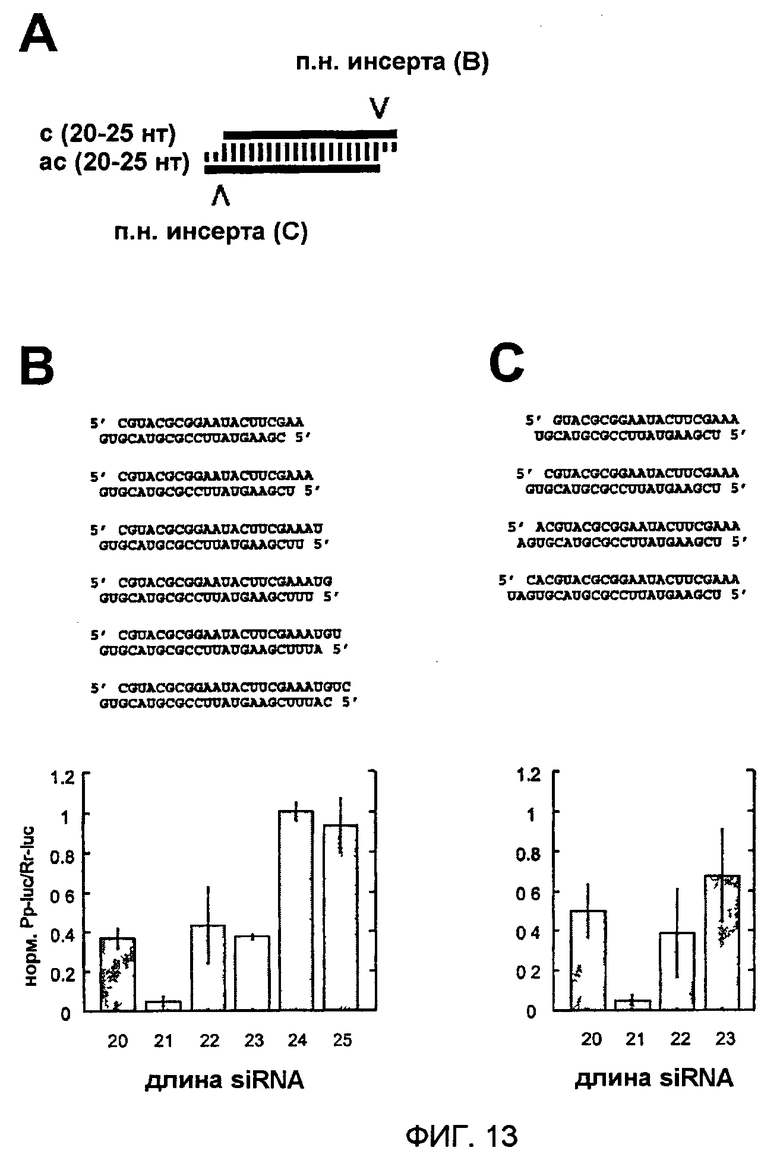
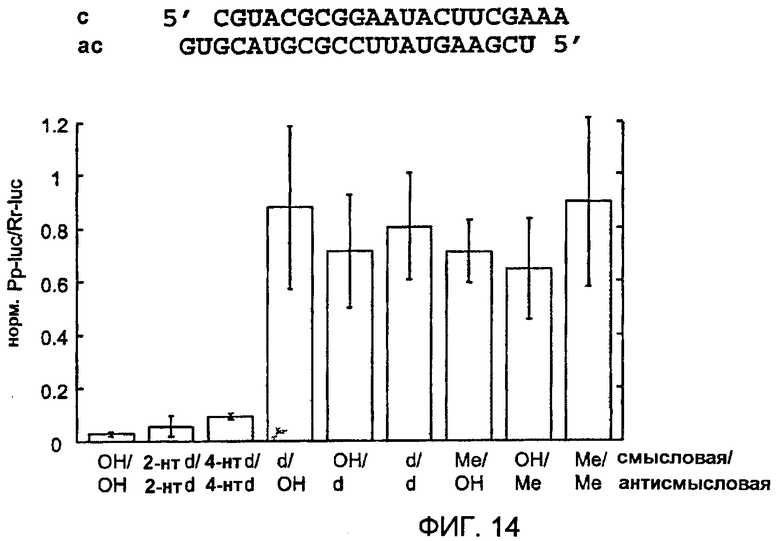
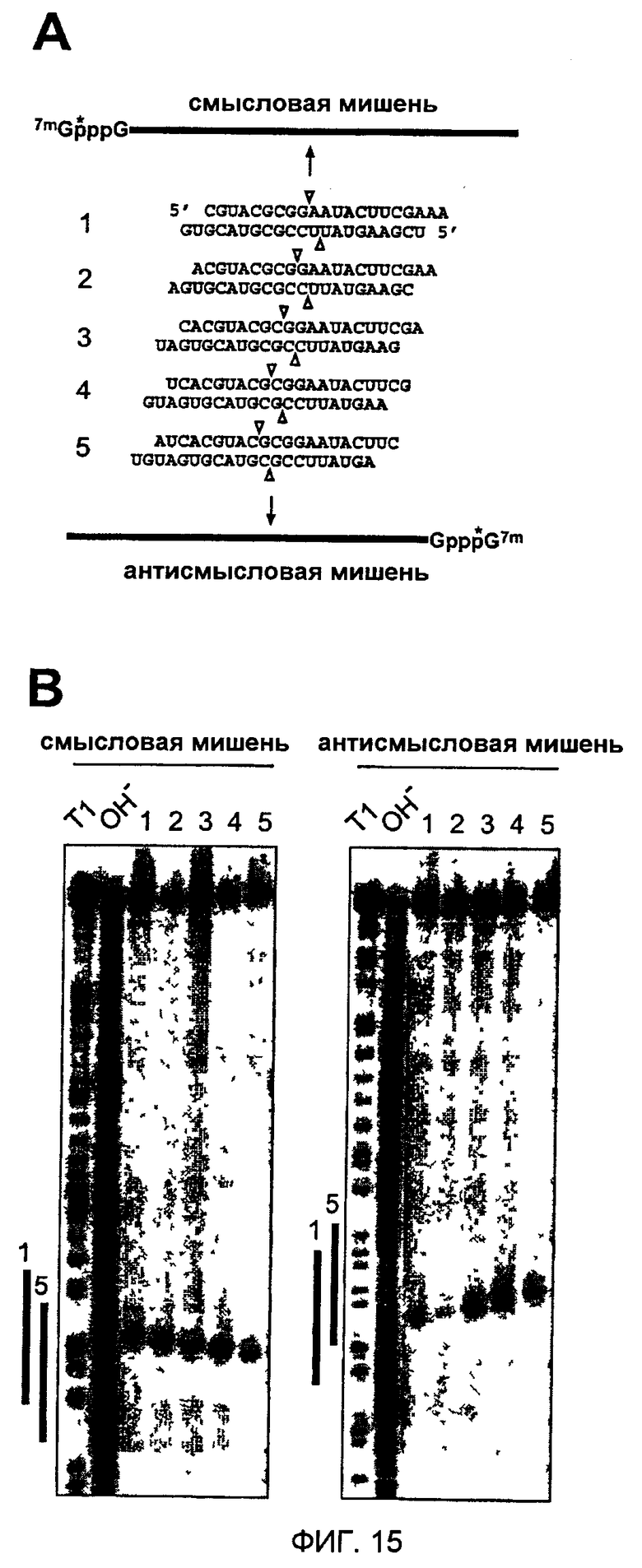
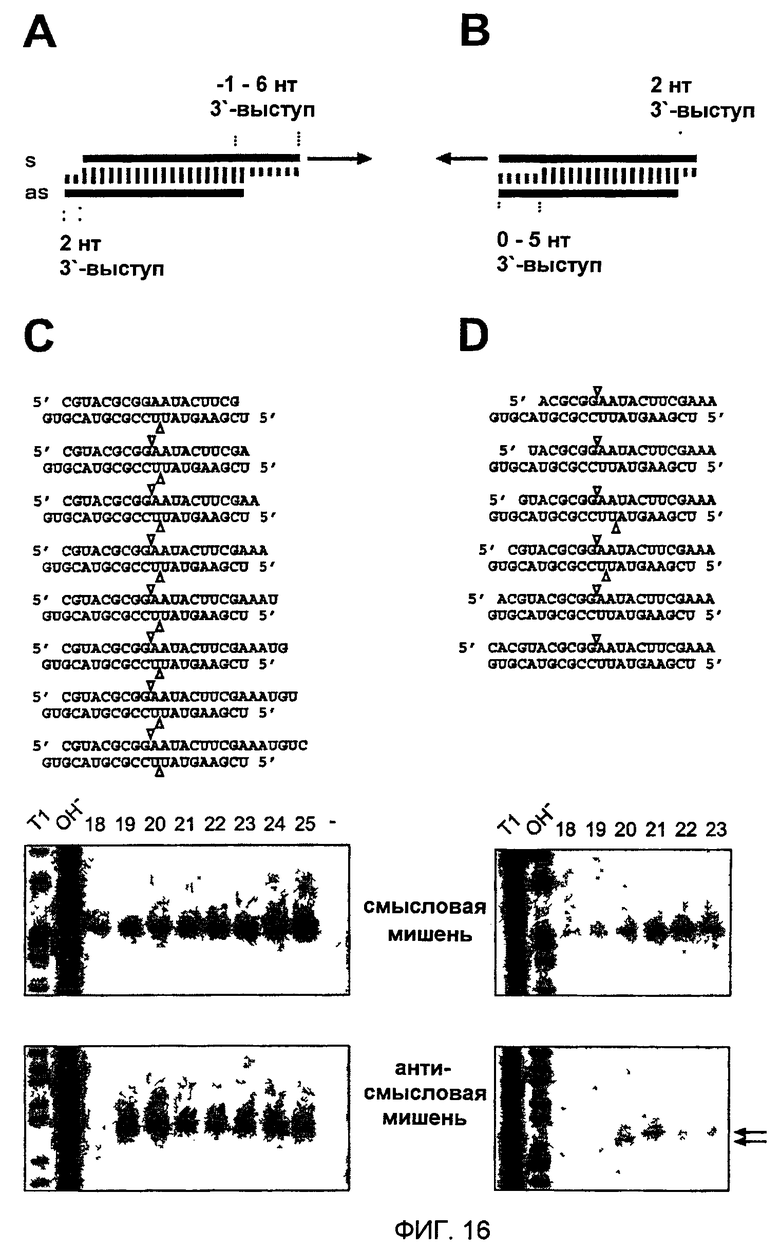
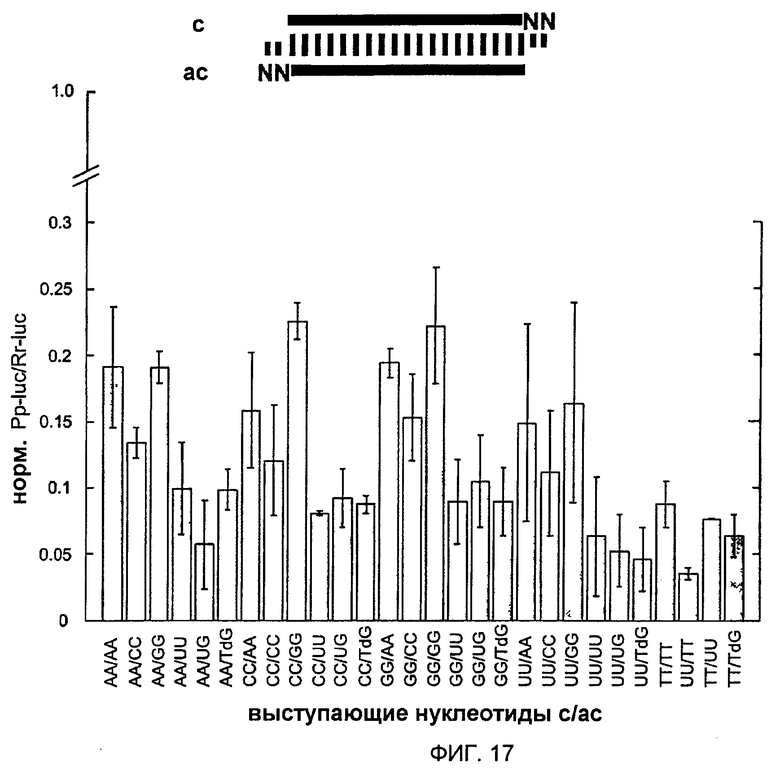
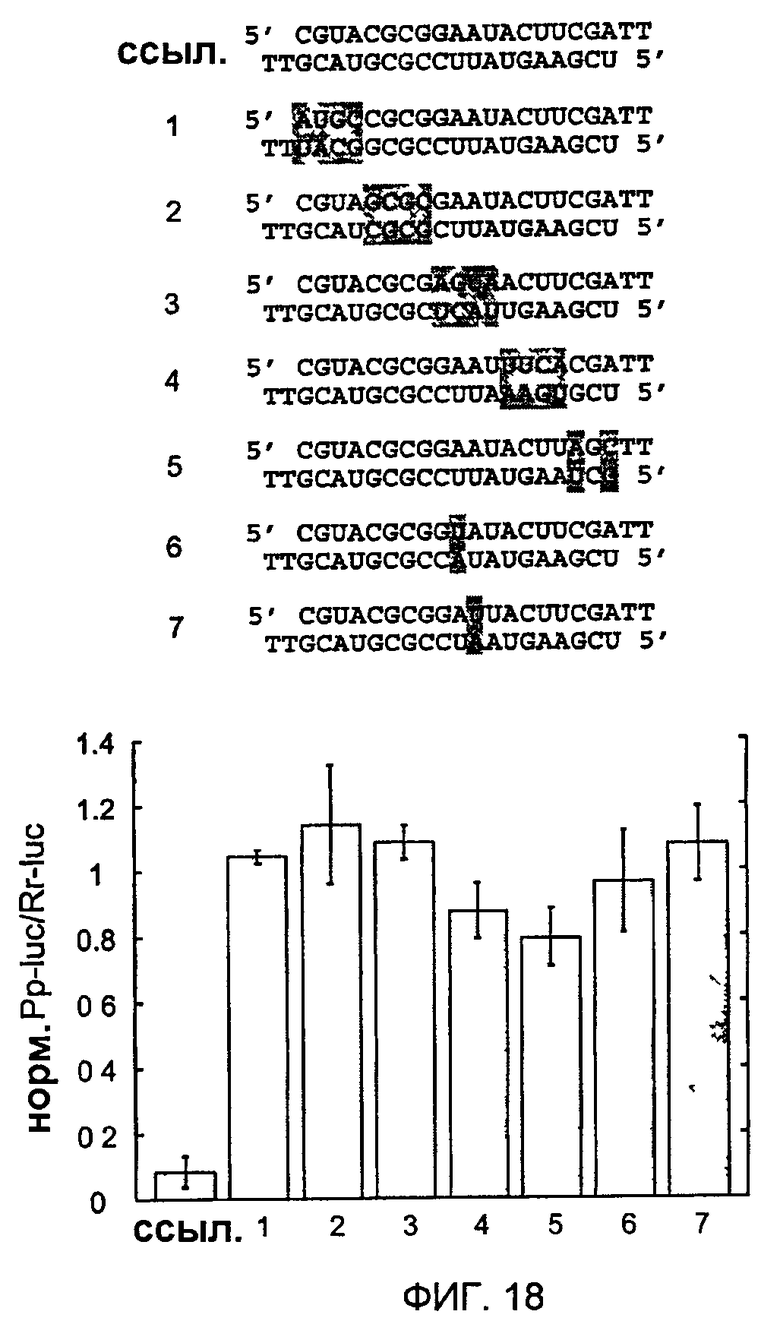
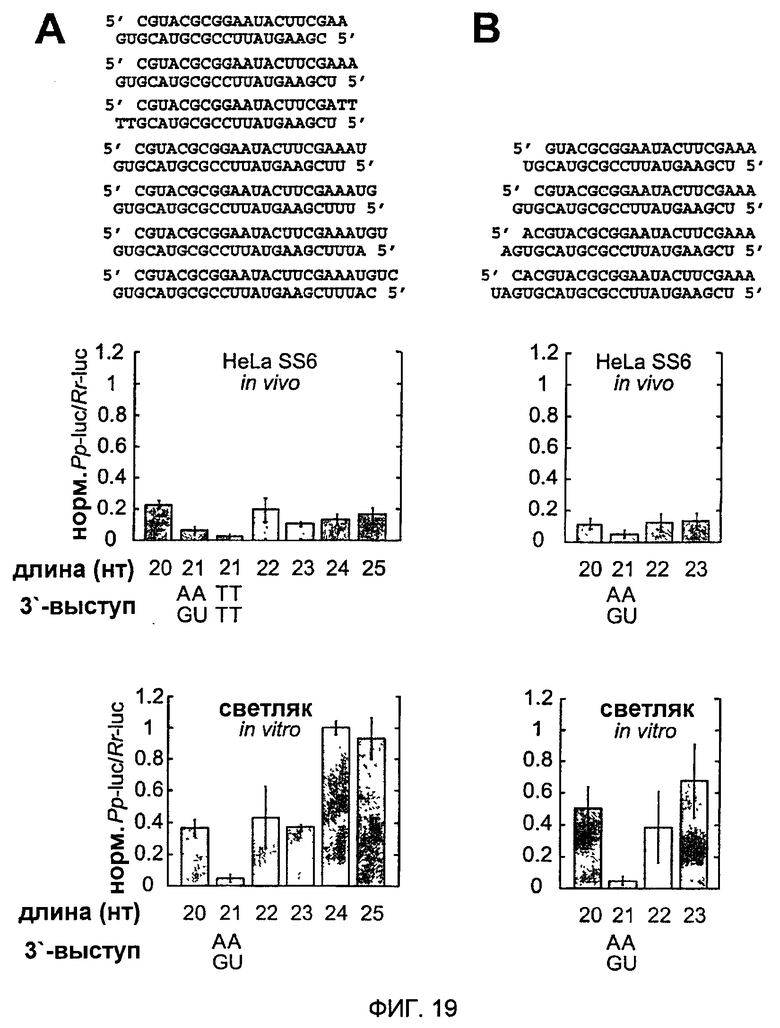
Изобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медицине и в фармацевтической промышленности. Молекула РНК, способная к мишень-специфической интерференции РНК, представляет собой двухцепочечную молекулу РНК размером 23 нуклеотида, имеющую 3'-выступ из 1-5 нуклеотидов. Ее получают объединением двух цепей РНК и используют для получения фармацевтической композиции. При введении в многоклеточный эукариотический организм или в клетку многоклеточного эукариотического организма данная молекула РНК обеспечивает содействие мишень-специфической интерференции РНК и приводит к уменьшению уровня экспрессии гена-мишени или к нокауту гена-мишени. Способ содействия мишень-специфической интерференции РНК с помощью данной молекулы РНК применяют для определения или модуляции функции гена. Клетку, содержащую эндогенную нуклеиновую кислоту-мишень, молекулу РНК, способную к мишень-специфической интерференции РНК, и экзогенную нуклеиновую кислоту-мишень используют в аналитических процедурах. Применение изобретения обеспечивает молчание гена-мишени, опосредованное мишень-специфической интерференцией РНК. 8 н. и 32 з.п. ф-лы, 24 ил., 3 пр.
1. Выделенная двухцепочечная молекула РНК, которая, по существу, соответствует части нуклеотидной последовательности мишеневой нуклеиновой кислоты, где каждая цепь РНК имеет длину 23 нуклеотида и по меньшей мере одна цепь имеет 3'- выступ из 1-5 нуклеотидов, причем указанная молекула РНК способна к мишень-специфической РНК-интерференции.
2. Молекула РНК по п.1, где 3'-выступ состоит из 1-3 нуклеотидов.
3. Молекула РНК по п.1 или 2, где 3'-выступ стабилизирован против деградации.
4. Молекула РНК по пп.1-3, которая содержит по меньшей мере один модифицированный аналог нуклеотида.
5. Молекула РНК по п.4, где модифицированный аналог нуклеотида выбран из рибонуклеотидов с модифицированным сахаром или скелетом молекулы.
6. Молекула РНК по п.4 или 5, где аналог нуклеотида является сахар-модифицированным рибонуклеотидом, где группа 2'-ОН заменена группой, выбранной из Н, OR, R, галогена, SH, SR1, NH2, NHR, NR2 или CN, где R обозначает C1-С6-алкил, алкенил или алкинил и галоген обозначает F, Cl, Вr или I.
7. Молекула РНК по п.4 или 5, где аналог нуклеотида является скелет-модифицированным рибонуклеотидом, содержащим фосфотиоатную группу.
8. Молекула РНК по любому из пп.1-7, которая имеет последовательность, имеющую идентичность по меньшей мере 50% относительно заранее заданной молекулы мРНК-мишени.
9. Молекула РНК по п.8, где эта идентичность равна по меньшей мере 70%.
10. Способ получения двухцепочечной молекулы РНК по любому из пп.1-9, предусматривающий стадии:
(a) синтеза двух цепей РНК, каждая из которых имеет длину 23 нуклеотида, где указанные цепи РНК способны образовывать двухцепочечную молекулу РНК,
(b) объединение этих синтезированных цепей РНК в условиях, в которых образуется двухцепочечная молекула РНК, которая способна к мишень-специфической РНК-интерференции.
11. Способ по п.10, где эти цепи РНК являются химически синтезированными.
12. Способ по п.10, где эти цепи РНК являются ферментативно синтезированными.
13. Способ опосредования мишень-специфической РНК-интерференции в клетке или организме, предусматривающий стадии:
(a) контактирования указанной клетки или организма с двухцепочечной молекулой РНК по любому из пп.1-9 в условиях, при которых может происходить мишень-специфическая РНК-интерференция, и
(b) опосредование мишень-специфической РНК-интерференции, осуществляемой этой двухцепочечной РНК, в отношении нуклеиновой кислоты-мишени, имеющей часть последовательности, по существу, соответствующую этой двухцепочечной РНК.
14. Способ по п.13, где указанное контактирование предусматривает введение указанной молекулы двухцепочечной РНК в клетку-мишень, в которой может происходить мишень-специфическая РНК-интерференция.
15. Способ по п.14, где это введение предусматривает опосредованную носителем доставку или инъекцию.
16. Применение способа по любому из пп.13-15 для определения функции гена в клетке или организме.
17. Применение способа по любому из пп.13-15 для модуляции функции гена в клетке или организме.
18. Применение по п.16 или 17, где этот ген ассоциирован с патологическим состоянием.
19. Применение по п.18, где этот ген является патогенассоциированным геном.
20. Применение по п.19, где этот ген является вирусным геном.
21. Применение по п.18, где этот ген является ассоциированным с опухолью геном.
22. Применение по п.18, где этот ген является ассоциированным с аутоиммунным заболеванием геном.
23. Фармацевтическая композиция для применения при состояниях, обусловленных экспрессией гена, содержащая в качестве активного агента по меньшей мере одну двухцепочечную молекулу РНК по любому из пп.1-9, способную вступать в процесс интерференции РНК с мРНК указанного гена, и фармацевтический носитель.
24. Композиция по п.23 для диагностических применений.
25. Композиция по п.23 для терапевтических применений.
26. Эукариотическая клетка, которая трансфицирована по меньшей мере одной двухцепочечной молекулой РНК по п.1, проявляющая фенотип со специфическим в отношении гена-мишени нокаутом, где указанная клетка трансфицирована по меньшей мере одной двухцепочечной молекулой РНК, способной ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени путем мишень-специфической РНК-интерференции, или ДНК, кодирующей по меньшей мере одну молекулу двухцепочечной РНК, способную ингибировать экспрессию по меньшей мере одного эндогенного гена-мишени путем мишень-специфической РНК-интерференции.
27. Клетка по п.26, которая является клеткой млекопитающего.
28. Клетка по п.27, которая является клеткой человека.
29. Клетка по любому из пп.26-28, которая дополнительно трансфицирована по меньшей мере одной экзогенной нуклеиновой кислотой-мишенью, кодирующей белок-мишень или вариант или мутированную форму этого белка-мишени, где указанная экзогенная нуклеиновая кислота-мишень отличается от эндогенного гена-мишени на уровне нуклеиновой кислоты таким образом, что экспрессия этой экзогенной нуклеиновой кислоты-мишени существенно менее ингибируется двухцепочечной молекулой РНК, чем экспрессия эндогенного гена-мишени.
30. Клетка по п.29, где экзогенная нуклеиновая кислота-мишень слита с дополнительной последовательностью нуклеиновой кислоты, кодирующей детектируемый пептид или полипептид.
31. Применение клетки по любому из пп.26-30 для аналитических процедур.
32. Применение по п.31 для анализа профилей экспрессии генов.
33. Применение по п.31 для анализа протеома.
34. Применение по любому из пп.31-33, где проводят анализ варианта или мутантной формы белка-мишени, кодируемого экзогенной нуклеиновой кислотой-мишенью.
35. Применение по п.34 для идентификации функциональных доменов белка-мишени.
36. Применение по любому из пп.31-35, где проводят сравнение по меньшей мере двух клеток, выбранных из:
(i) контрольной клетки без ингибирования гена-мишени,
(ii) клетки с ингибированием клетки-мишени и
(iii) клетки с ингибированием гена-мишени плюс комплементацией гена-мишени экзогенной нуклеиновой кислотой-мишенью.
37. Применение по любому из пп.31-36, где анализ включает в себя функциональный и/или фенотипический анализ.
38. Применение по п.37 для выделения белков или белковых комплексов из эукариотических клеток.
39. Применение по п.38 для выделения высокомолекулярных белковых комплексов, которые могут необязательно содержать нуклеиновые кислоты.
40. Применение по любому из пп.31-39 в процедуре для идентификации и/или характеристики фармакологических агентов.
| HAMMOND S.M | |||
| et al | |||
| An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells//Nature | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| YANG D | |||
| et al | |||
| Evidence that processed small dsRNAs may mediate sequence-specific mRNA degradation during RNAi in Drosophila embryos//Curr Biol | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2012-12-20—Публикация
2007-08-16—Подача