ОБЛАСТЬ ТЕХНИКИ
[0001] Изобретение относится к методам и композициям, пригодным для приготовления пентафторидов арилсеры.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Соединения пентафторида арилсеры применяются для введения одной или нескольких групп пентафторида серы в молекулы разных коммерческих органических веществ. В частности, пентафториды арилсеры были описаны в качестве пригодных соединений (в качестве продукта или промежуточного соединения) для разработки жидких кристаллов, биологически активных химикатов, таких как фунгициды, гербициды и инсектициды, и других подобных веществ [см. Fluorine-containing Synthons (ACS Symposium Series 911), под ред. V.A.Soloshonok, American Chemical Society (2005), cc.108-113]. Однако, как указано в данном документе, обычные синтетические методики получения пентафторидов арилсеры не оправдали себя на практике и представляют проблему в рамках уровня техники.
[00031 Обычно, пентафториды арилсеры синтезируют, используя один из следующих синтетических методов: (1) фторирование диарилдисульфидов или трифторида арилсеры с помощью AgF2 [см. J. Am. Chem. Soc., т.84 (1962), сс.3064-3072, и J. Fluorine Chem. т.112 (2001), сс.287-295]; (2) фторирование ди(нитрофенил)дисульфидов, нитробензолтиолов, или трифторидов нитрофенилсеры с помощью молекулярного фтора (F2) [см. Tetrahedron, т.56 (2000), сс.3399-3408; Eur. J. Org. Chem., т.2005, сс.3095-3100; и патент США 5,741,935]; (3) фторирование диарилдисульфидов или арентиолов с помощью F2, СF3ОF или CF2(OF)2 в присутствии или отсутствие источника фторида (см. публикацию патента США №2004/0249209 А1); (4) фторирование диарилдисульфидов с помощью XeF2 [см. J. Fluorine Chem., т.101 (2000), сс.279-283]; (5) реакция 1,4-бис(ацетокси)-2-циклогексена с SF5Br с последующими реакциями дегидробромирования или гидролиза и, затем, ароматизации [см. J. Fluorine Chem., т.125 (2004), сс.549-552]; (6) реакция 4,5-дихлор-1-циклогексена с SF5Cl с последующим дегидрохлорированием [см. Organic Letters, т.6 (2004), сс.2417-2419 и РСТ WO 2004/011422 А1]; и (7) реакция SF5Cl с ацетиленом, с последующим бромированием, дегидробромированием и восстановлением цинком с получением пентафторсульфанилацетилена, который затем вводится в реакцию с бутадиеном, с последующей реакцией ароматизации при очень высокой температуре [см. J. Org. Chem., т.29 (1964), cc.3567-3570].
[0004] Каждый из упомянутых ранее синтетических методов имеет один или несколько недостатков, делающих указанные методы или непрактичными (время или выход), чрезмерно дорогими и/или чрезмерно опасными для осуществления. Например, синтетические методы (1) и (4) обеспечивают низкие выходы и требуют дорогих реагентов, например, AgF2 и XeF2. Методы (2) и (3) требуют использования F2, CF3OF или CF2(OF)2, каждый из которых является токсичным, взрывоопасным и едким, а продукты с использованием этих методов получаются с относительно низким выходом. Отметим, что оперирование с этими газами является дорогим с точки зрения их производства, хранения и использования. Кроме того, синтетические методы, которые требуют использования F2, CF3OF и/или CF2(OF)2, ограничены получением деактивированных пентафторидов арилсеры, таких как пентафториды нитрофенилсеры, из-за их чрезвычайной реакционной способности, которая приводит к побочным реакциям, таким как фторирование ароматических колец, в случае, если последние не являются деактивированными. Методы (5) и (6) также требуют дорогих реагентов, например, SF5Cl или SF5Br, и обладают узкой применимостью, потому, что исходные производные циклогексена ограничены. В заключение, способ (7) требует дорогого реагента SF5Cl и включает множество реакционных стадий, приводящих к пентафториду арилсеры (значительные затраты времени и низкий выход). Вследствие этого, проблемы с методами получения пентафторидов арилсеры приводили к трудностям при приготовлении вещества безопасным, экономичным и оперативным образом.
[0005] Хлортетрафторид фенилсеры, хлортетрафторид п-метилфенилсеры и хлортетрафторид п-нитрофенилсеры были обнаружены при реакции дифенилдисульфида, бис(п-метилфенил)дисульфида и бис(п-нитрофенил)дисульфида, соответственно, с XeF2 в присутствии хлорида тетраэтиламмония (см. Can. J. Chem., т.75, сс.1878-1884). Химическое строение хлортетрафторидных соединений устанавливали с помощью анализа данных ЯМР реакционной смеси, но эти соединения не выделяли. Вследствие этого, физические свойства хлортетрафторидов неизвестны. Этот метод синтеза с использованием XeF2 был промышленно непрактичным, потому что XeF2 является чрезмерно дорогим для крупномасштабного производства.
[0006] Настоящее изобретение направлено на преодоление одной или нескольких проблем, рассмотренных выше.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
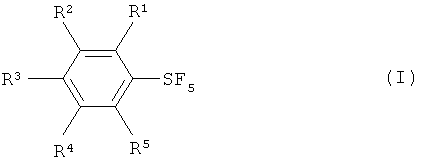
[0007] Настоящее изобретение обеспечивает новые способы получения пентафторида арилсеры, изображаемого формулой (I):
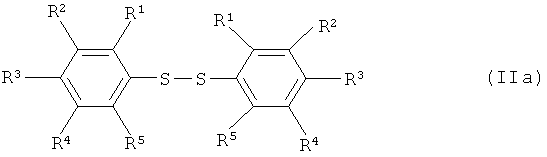
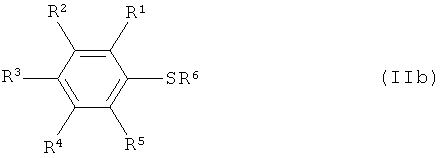
Варианты осуществления изобретения включают взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или (IIb),
с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора (М+F-, формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV):
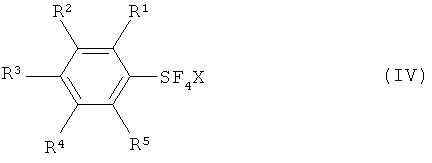
Галотетрафторид арилсеры (формула IV) вводят в реакцию с источником фторида с получением пентафторида арилсеры (формула I).
[0008] Варианты осуществления настоящего изобретения также обеспечивают способы получения пентафторида арилсеры (формула I) путем взаимодействия, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или (IIb), с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора (M+F-, формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV):
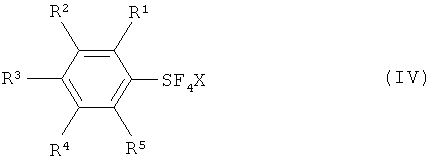
Галотетрафторид арилсеры (формула IV) вводят в реакцию с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением пентафторида арилсеры (формула I).
[0009] Варианты осуществления настоящего изобретения также обеспечивают способы получения пентафторидов арилсеры (формула I) путем взаимодействия трифторида арилсеры, имеющего формулу (V):
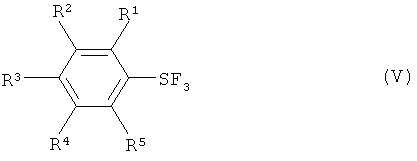
с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора (формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV):
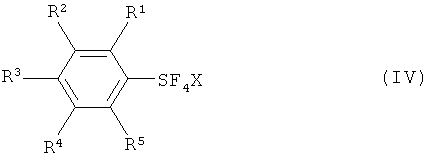
Галотетрафторид арилсеры (формула IV) вводят в реакцию с источником фторида с получением пентафторида арилсеры (формула I).
[0010] Варианты осуществления настоящего изобретения также обеспечивают способы получения пентафторидов арилсеры (формула I) путем взаимодействия трифторида арилсеры, имеющего формулу (V):
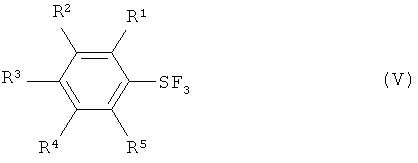
с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора (формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV).
[0011] Галотетрафторид арилсеры (формула IV) вводят в реакцию с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением пентафторида арилсеры (формула I).
[0012] Варианты осуществления настоящего изобретения дополнительно обеспечивают способы получения галотетрафторида арилсеры (формула IV) путем взаимодействия, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или (IIb), с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, имеющего формулу (IV).
[0013] Варианты осуществления настоящего изобретения обеспечивают способы получения пентафторида арилсеры (формула I) путем взаимодействия галотетрафторида арилсеры, имеющего формулу (IV) с источником фторида. В некоторых вариантах, источник фторида имеет температуру кипения приблизительно 0°С или выше при давлении 1 атм.
[0014] В заключение, варианты осуществления настоящего изобретения обеспечивают способы получения пентафторида арилсеры (формула I) путем взаимодействия галотетрафторида арилсеры, имеющего формулу (IV), с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением пентафторида арилсеры.
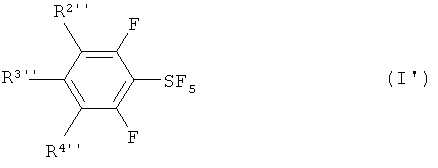
[0015] Кроме того, настоящее изобретение обеспечивает новый хлортетрафторид арилсеры, изображаемый формулой (IV'), и фторированный пентафторид арилсеры, изображаемый формулой (I'):
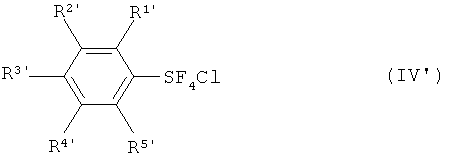
[0016] Эти и различные другие отличительные признаки, а также преимущества, которые характеризуют варианты осуществления изобретения, будут видны при чтении нижеследующего подробного описания и обзора прилагаемой формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0017] Варианты осуществления настоящего изобретения обеспечивают промышленно пригодные способы получения пентафторидов арилсеры, изображаемых формулой (I). Приготовленные пентафториды арилсеры могут быть использованы, среди прочего, для введения одной или нескольких групп пентафторида серы (SF5) в разные целевые органические соединения. В отличие от методов, предложенных ранее в данной области техники, в способе согласно изобретению для приготовления соединений пентафторида арилсеры с умеренными - высокими выходами используют реагенты с низкой стоимостью. Более того, методы согласно изобретению обеспечивают большую степень общей безопасности по сравнению с большинством методик известного уровня техники (например, с использованием газообразного F2).
[0018] Отличие настоящего изобретения заключается в том, что предложенные способы, по сравнению с другими общепринятыми методами, выполняют с более низкими затратами. Например, реагенты для выполнения реакций на основе Хе являются чрезмерно дорогими, тогда как в настоящем изобретении используют вещества с низкой стоимостью: галогены, такие как Cl2, Br2 и I2.
[0019] Варианты осуществления изобретения охватывают способы, которые включают (см., например Схема 1, Процессы I и II) взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или формулу (IIb), с галогеном, выбранным из группы, состоящей из хлора, брома, йода и межгалоидных соединений, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, изображаемого формулой (IV). Галотетрафторид арилсеры затем вводят во взаимодействие с источником фторида с получением пентафторида арилсеры, имеющего формулу (I).
Схема 1: (Процессы I и II)
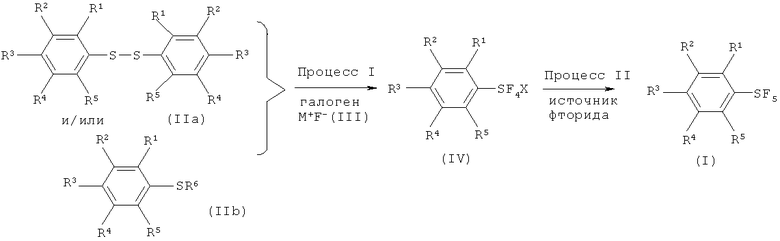
[0020] Что касается формул (I), (IIа), (IIb), (III) и (IV): заместители R1, R2, R3, R4 и R5 каждый независимо означают атом водорода; атом галогена, то есть атом фтора, атом хлора, атом брома или атом йода; замещенную или незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; замещенную или незамещенную арильную группу, имеющую от 6 до 30 атомов углерода, предпочтительно от 6 до 15 атомов углерода; нитро группу; циано группу; замещенную или незамещенную алкансульфонильную группу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; замещенную или незамещенную аренсульфонильную группу, имеющую от 6 до 30 атомов углерода, предпочтительно от 6 до 15 атомов углерода; замещенную или незамещенную алкокси группу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; замещенную или незамещенную арилокси группу, имеющую от 6 до 30 атомов углерода, предпочтительно от 6 до 15 атомов углерода; замещенную или незамещенную ацилокси группу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; замещенную или незамещенную алкансульфонилокси группу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; замещенную или незамещенную аренсульфонилокси группу, имеющую от 6 до 30 атомов углерода, предпочтительно от 6 до 15 атомов углерода; замещенную или незамещенную алкоксикарбонильную группу, имеющую от 2 до 18 атомов углерода, предпочтительно от 2 до 10 атомов углерода; замещенную или незамещенную арилоксикарбонильную группу, имеющую от 7 до 30 атомов углерода, предпочтительно от 7 до 15 атомов углерода; замещенную карбамоильную группу, имеющую от 2 до 18 атомов углерода, предпочтительно от 2 до 10 атомов углерода; замещенную аминогруппу, имеющую от 1 до 18 атомов углерода, предпочтительно от 1 до 10 атомов углерода; и группу SF5; и R6 означает атом водорода, силильную группу, атом металла, остаток аммония, остаток фосфония или атом галогена.
[0021] Что касается М, М означает атом металла, остаток аммония или остаток фосфония, и что касается X, Х означает атом хлора, атом брома или атом йода.
[0022] Использованный здесь термин "алкил" означает линейный, разветвленный или циклический алкил. Алкильная часть алкансульфонила, алкокси, алкансульфонилокси или алкоксикарбонильной группы, как использовано здесь, также означает линейную, разветвленную или циклическую алкильную часть. Использованный здесь термин "замещенный алкил" означает алкильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0023] Использованный здесь термин "замещенный арил" означает арильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0024] Использованный здесь термин "замещенный алкансульфонил" означает алкансульфонильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0025] Использованный здесь термин "замещенный аренсульфонил" означает аренсульфонильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0026] Использованный здесь термин "замещенный алкокси" означает алкокси остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0027] Использованный здесь термин "замещенный арилокси" означает арилокси остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0028] Использованный здесь термин "замещенный ацилокси" означает ацилокси остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0029] Использованный здесь термин "замещенный алкансульфонилокси" означает алкансульфонилокси остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0030] Использованный здесь термин "замещенный аренсульфонилокси" означает аренсульфонилокси остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0031] Использованный здесь термин "замещенный алкоксикарбонил" означает алкоксикарбонильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0032] Использованный здесь термин "замещенный арилоксикарбонил" означает арилоксикарбонильный остаток, имеющий один или несколько заместителей, таких как атом галогена, замещенная или незамещенная алкильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0033] Использованный здесь термин "замещенный карбамоил" означает карбамоильный остаток, имеющий один или несколько заместителей, таких как замещенная или незамещенная алкильная группа, замещенная или незамещенная арильная группа, и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0034] Использованный здесь термин "замещенный амино" означает амино остаток, имеющий один или несколько заместителей, таких как замещенная или незамещенная ацильная группа, замещенная или незамещенная алкансульфонильная группа, замещенная или незамещенная аренсульфонильная группа и любая другая группа с или без гетероатома(ов), таких как атом(ы) кислорода, атом(ы) азота и/или атом(ы) серы, который не ограничивает реакции данного изобретения.
[0035] Среди заместителей, R1, R2, R3, R4 и R5, описанных выше, атом водорода, атом галогена, замещенная или незамещенная алкильная группа, замещенная или незамещенная арильная группа, нитрогруппа, циано группа, замещенная или незамещенная алкансульфонильная группа, замещенная или незамещенная аренсульфонильная группа, замещенная или незамещенная алкокси группа, замещенная или незамещенная арилоксигруппа, замещенная или незамещенная ацилоксигруппа и замещенная или незамещенная алкоксикарбонильная группа являются предпочтительными, а атом водорода, атом галогена, замещенная или незамещенная алкильная группа, замещенная или незамещенная арильная группа и нитрогруппа являются более предпочтительными с точки зрения доступности исходных веществ.
[0036] Следует заметить, что в соответствии с номенклатурой каталога Chemical Abstract, и в соответствии с настоящим раскрытием, например, С6Н5-SF5 называют пентафторфенилсерой; п-Cl-C6H4-SF5 называют (4-хлорфенил)пентафторсерой; и п-СН3-С6Н4-SF5 называют пентафтор(4-метилфенил)серой. С6Н5-SF4Cl называют хлортетрафторфенилсерой; п-СН3-С6Н4-SF4Cl называют хлортетрафтор(4-метилфенил)серой; и п-NO2-C6H4-SF4Cl называют хлортетрафтор(4-нитрофенил)серой.
[0037] Соединения галотетрафторида арилсеры формулы (IV) включают изомеры, такие как транс-изомеры и цис-изомеры, показанные ниже; галотетрафторид арилсеры изображают формулой ArSF4X:
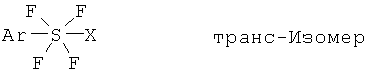

[0038] Таблица 1 обеспечивает названия структур и формулы, упомянутые при рассмотрении Схем 1, 3~10 и Примеров 1~34:




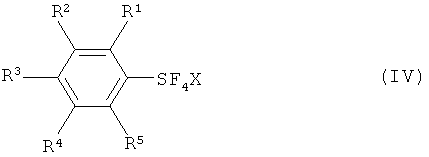

Процесс I (Схема 1)
[0040] Процесс I включает взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или (IIb), с галогеном, выбранным из группы, включающей хлор, бром, йод и межгалоидные соединения, и солью фтора (M+F-, формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV).
[0041] Заместитель(и), R1, R2, R3, R4 и R5 продуктов, изображаемых формулой (IV), могут быть отличными от заместителя(ей), R1, R2, R3, R4 и R5 исходных веществ, изображаемых формулами (IIa) и/или (IIb). Таким образом, варианты осуществления настоящего изобретения включают превращение R1, R2, R3, R4 и R5 в другие R1, R2, R3, R4 и R5, которое может иметь место во время осуществления реакции согласно настоящему изобретению, или в данных реакционных условиях до превращения фрагмента -S-S- или -S-остатка в группу(ы) -SF4X.
[0042] Иллюстративные соединения арилсеры согласно изобретению, изображаемые формулой (IIa), включают, но не ограничиваются перечисленным: дифенилдисульфид, каждый изомер бис(фторфенил)дисульфида, каждый изомер бис(дифторфенил)дисульфида, каждый изомер бис(трифторфенил)дисульфида, каждый изомер бис(тетрафторфенил)дисульфида, бис(пентафторфенил)дисульфид, каждый изомер бис(хлорфенил)дисульфида, каждый изомер бис(дихлорфенил)дисульфида, каждый изомер бис(трихлорфенил)дисульфида, каждый изомер бис(бромфенил)дисульфида, каждый изомер бис(дибромфенил)дисульфида, каждый изомер бис(йодфенил)дисульфида, каждый изомер бис(хлорфторфенил)дисульфида, каждый изомер бис(бромфторфенил)дисульфида, каждый изомер бис(бромхлорфенил)дисульфида, каждый изомер бис(фторйодфенил)дисульфида, каждый изомер бис(толил)дисульфида, каждый изомер бис[(метоксиметил)фенил]дисульфида, каждый изомер бис{[(циклогексилокси)метил]фенил}дисульфида, каждый изомер бис[(фенилметил)фенил]дисульфида, каждый изомер бис[(цианометил)фенил]дисульфида, каждый изомер бис[(нитрометил)фенил]дисульфида, каждый изомер бис {[(метансульфонил)метил]фенил} дисульфида, каждый изомер бис{[(бензолсульфонил)метил]фенил}дисульфида, каждый изомер бис(этилфенил)дисульфида, каждый изомер бис[(метоксиэтил)фенил]дисульфида, каждый изомер бис[(нитроэтил)фенил]дисульфида, каждый изомер бис[(фенилэтил)фенил]дисульфида, каждый изомер бис[хлор(метил)фенил]дисульфида, бис[бром(метил)фенил]дисульфид, каждый изомер бис[(трифторметил)фенил] дисульфида, каждый изомер бис(диметилфенил)дисульфида, каждый изомер бис[хлор(диметил)фенил]дисульфида, каждый изомер бис[ди(трифторметил)фенил]дисульфида, каждый изомер бис(триметилфенил)дисульфида, каждый изомер бис[хлор(триметил)фенил]дисульфида, каждый изомер бис(тетраметилфенил)дисульфида, каждый изомер бис[хлор(тетраметил)фенил]дисульфида, бис(пентаметилфенил)дисульфид, каждый изомер бис(этилфенил)дисульфида, каждый изомер бис[(2,2,2-трифторэтил)фенил]дисульфида, каждый изомер бис[(перфторэтил)фенил]дисульфида, каждый изомер бис(диэтилфенил)дисульфида, каждый изомер бис(этилметилфенил)дисульфида, каждый изомер бис(пропилфенил)дисульфида, каждый изомер бис(изопропилфенил)дисульфида, каждый изомер бис(бутилфенил)дисульфида, каждый изомер бис(втор-бутилфенил)дисульфида, каждый изомер бис(изобутилфенил)дисульфида, каждый изомер бис(трет-бутилфенил)дисульфида, каждый изомер бис(циклопропилфенил)дисульфида, каждый изомер бис(циклопентилфенил)дисульфида, каждый изомер бис(циклогексилфенил)дисульфида, каждый изомер бис {[(циклогексил)циклогексил] фенил} дисульфида, каждый изомер бис(бифенил)дисульфида, каждый изомер бис(толилфенил)дисульфида, каждый изомер бис[(хлорфенил)фенил]дисульфида, каждый изомер бис[(бромфенил)фенил]дисульфида, каждый изомер бис[(нитрофенил)фенил]дисульфида, каждый изомер бис(терфенилил)дисульфида, каждый изомер бис[(фенил)терфенилил]дисульфида, каждый изомер бис[(метансульфонил)фенил]дисульфида, каждый изомер бис[(трифторметансульфонил)фенил]дисульфида, каждый изомер бис[(бензолсульфонил)фенил]дисульфида, каждый изомер бис[(толуолсульфонил)фенил]дисульфида, каждый изомер бис(метоксифенил)дисульфида, каждый изомер бис(этоксифенил)дисульфида, каждый изомер бис(пропоксифенил)дисульфида, каждый изомер бис(бутоксифенил)дисульфида, каждый изомер бис(циклопропилфенил)дисульфида, бис(циклогексилоксифенил)дисульфид, каждый изомер бис[(трифторметокси)фенил]дисульфида, каждый изомер бис[(перфторэтокси)фенил]дисульфида, каждый изомер бис[(трифторэтокси)фенил]дисульфида, каждый изомер бис[(тетрафторэтокси)фенил]дисульфида, каждый изомер бис[(перфторпропокси)фенил]дисульфида, каждый изомер бис(фенилоксифенил)дисульфида, каждый изомер бис(фторфенилоксифенил)дисульфида, каждый изомер бис(хлорфенилоксифенил)дисульфида, каждый изомер бис(бромфенилоксифенил)дисульфида, каждый изомер бис(нитрофенилоксифенил)дисульфида, каждый изомер бис[(динитрофенилокси)фенил]дисульфида, каждый изомер бис[(пентафторфенилокси)фенил]дисульфида, каждый изомер бис(трифторметилфенилоксифенил)дисульфида, каждый изомер бис(цианофенилоксифенил)дисульфида, каждый изомер бис(нафтилоксифенил)дисульфида, каждый изомер бис[(гептафторнафтилокси)фенил]дисульфида, каждый изомер бис[ацетоксифенил]дисульфида, каждый изомер бис[(бензоилокси)фенил]дисульфида, каждый изомер бис[(метансульфонилокси)фенил]дисульфида, каждый изомер бис[(бензолсульфонилокси)фенил]дисульфида, каждый изомер бис[(толуолсульфонилокси)фенил]дисульфида, каждый изомер бис[(метоксикарбонил)фенил]дисульфида, каждый изомер бис[(этоксикарбонил)фенил]дисульфида, каждый изомер бис[(феноксикарбонил)фенил]дисульфида, каждый изомер биc[(N,N-диметилкарбамоил)фенил]дисульфида, каждый изомер бис[(N,N-диэтилкарбамоил)фенил]дисульфида, каждый изомер бис[(N,N-дифенилкарбамоил)фенил]дисульфида, каждый изомер биc[(N,N-дибензилкарбамоил)фенил]дисульфида, каждый изомер бис[(N-ацетил-N-метиламино)фенил]дисульфида, каждый изомер бис[(N-ацетил-N-фениламино)фенил]дисульфида, каждый изомер бис[(N-ацетил-N-бензиламино)фенил]дисульфида, каждый изомер бис[(N-бензоил-N-метиламино)фенил]дисульфида, каждый изомер бис[N-метансульфонил-N-метиламино)фенил]дисульфида, каждый изомер бис[(N-толуолсульфонил-N-метиламино)фенил]дисульфида, каждый изомер бис[(N-толуолсульфонил-N-бензиламино)фенил]дисульфида и каждый изомер бис[(пентафторсульфанил)фенил]дисульфида. Каждое из упомянутых выше соединений формулы (IIa) является доступным для приобретения (см., например Sigma, Acros, TCI, Lancaster, Alfa Aesar и т.д.), или может быть приготовлено согласно понятным принципам синтетической химии.
[0043] Иллюстративные соединения арилсеры согласно изобретению, изображаемые формулой (IIb), включают, но не ограничиваются перечисленным: бензолтиол, каждый изомер фторбензолтиола (о-, м-, и п-фторбензолтиол), каждый изомер хлорбензолтиола, каждый изомер бромбензолтиола, каждый изомер йодбензолтиола, каждый изомер дифторбензолтиола, каждый изомер трифторбензолтиола, каждый изомер тетрафторбензолтиола, пентафторбензолтиол, каждый изомер дихлорбензолтиола, каждый изомер хлорфторбензолтиола, каждый изомер метилбензолтиола, каждый изомер (трифторметил)бензолтиола, каждый изомер диметилбензолтиола, каждый изомер бис(трифторметил)бензолтиола, каждый изомер метил(трифторметил)бензолтиола, каждый изомер триметилбензолтиола, каждый изомер тетраметилбензолтиола, пентаметилбензолтиол, каждый изомер этилбензолтиола, каждый изомер (2,2,2-трифторэтил)бензолтиола, каждый изомер (перфторэтил)бензолтиола, каждый изомер диэтилбензолтиола, каждый изомер этилметилбензолтиола, каждый изомер пропилбензолтиола, каждый изомер изопропилбензолтиола, каждый изомер бутилбензолтиола, каждый изомер втор-бутилбензолтиола, каждый изомер изобутилбензолтиола, каждый изомер трет-бутилбензолтиола, каждый изомер нитробензолтиола, каждый изомер динитробензолтиола, каждый изомер цианобензолтиола, каждый изомер фенилбензолтиола, каждый изомер толилбензолтиола, каждый изомер (хлорфенил)бензолтиола, каждый изомер (бромфенил)бензолтиола, каждый изомер (нитрофенил)бензолтиола, каждый изомер (метансульфонил)бензолтиола, каждый изомер (трифторметансульфонил)бензолтиола, каждый изомер (бензолсульфонил)бензолтиола, каждый изомер (толуолсульфонил)бензолтиола, каждый изомер (метоксикарбонил)бензолтиола, каждый изомер (этоксикарбонил)бензолтиола, каждый изомер (феноксикарбонил)бензолтиола, каждый изомер (N,N-диметилкарбамоил)бензолтиола, каждый изомер (N,N-диэтилкарбамоил)бензолтиола, каждый изомер (N,N-дибензилкарбамоил)бензолтиола, каждый изомер (N,N-дифенилкарбамоил)бензолтиола, каждый изомер (N-ацетил-N-метиламино)бензолтиола, каждый изомер (N-ацетил-N-фениламино)бензолтиола, каждый изомер (N-ацетил-N-бензиламино)бензолтиола, каждый изомер (N-бензоил-N-метиламино)бензолтиола, каждый изомер (N-метансульфонил-N-метиламино)бензолтиола, каждый изомер (N-толуолсульфонил-N-метиламино)бензолтиола, каждый изомер (N-толуолсульфонил-N-бензиламино)бензолтиола и каждый изомер (пентафторсульфанил)бензолтиола; литиевые, натриевые и калиевые соли соединений бензолтиола, приведенных здесь в качестве примеров; аммониевые, диэтиламмониевые, триэтиламмониевые, триметиламмониевые, тетраметиламмониевые, тетраэтиламмониевые, тетрапропиламмониевые и тетрабутиламмониевые соли соединений бензолтиола, приведенных здесь в качестве примеров; тетраметилфосфониевые, тетраэтилфосфониевые, тетрапропилфосфониевые, тетрабутилфосфониевые и тетрафенилфосфониевые соли соединений бензолтиола, приведенных здесь в качестве примеров; и S-триметилсилильное, S-триэтилсилильное, S-трипропилсилильное, S-диметил-трет-бутилсилильное и S-диметилфенилсилильное производное соединений бензолтиола, приведенных здесь в качестве примеров. Примерами соединений арилсеры формулы (IIb), где R6 означает атом галогена, являются бензолсульфенилхлорид, каждый изомер нитробензолсульфенилхлорида, каждый изомер динитробензолсульфенилхлорида и другие подобные соединения. Каждое из упомянутых выше соединений формулы (IIb) является доступным для приобретения (см., например, Sigma, Acros, TCI, Lancaster, Alfa Aesar и т.д.), или может быть приготовлено согласно понятным принципам синтетической химии.
[0044] Типичные галогены, пригодные для использования в настоящем изобретении, включают хлор (Cl2), бром (Br2), йод (I2) и межгалоидные соединения, такие как ClF, BrF, ClBr, ClI, Cl3I и BrI. Среди них, из-за его низкой стоимости, предпочтительным является хлор (Cl2).
[0045] Солями фтора, имеющими формулу (III), являются те соли, например, фториды металлов, фториды аммония и фториды фосфония, которые легко доступны. Примерами пригодных фторидов металлов являются фториды щелочных металлов, такие как фторид лития, фторид натрия, фторид калия (включая высушенный распылением фторид калия), фторид рубидия и фторид цезия. Примерами пригодных фторидов аммония являются фторид тетраметиламмония, фторид тетраэтиламмония, фторид тетрапропиламмония, фторид тетрабутиламмония, фторид бензилтриметиламмония, фторид бензилтриэтиламмония и т.д. Примерами пригодных фторидов фосфония являются фторид тетраметилфосфония, фторид тетраэтилфосфония, фторид тетрапропилфосфония, фторид тетрабутилфосфония, фторид тетрафенилфосфония, фторид тетратолилфосфония и т.д. Фториды щелочных металлов, такие как фторид калия и фторид цезия, являются предпочтительными с точки зрения доступности и способности приводить к высокому выходу продуктов, а фторид калия является наиболее предпочтительным с точки зрения стоимости.
[0046] В качестве соли фтора (формула III) может быть использована смесь фторида металла и фторида аммония или фосфония, смесь фторида аммония и фторида фосфония, и смесь фторида металла, фторида аммония и фторида фосфония.
[0047] В качестве соли фтора (формула III) также может быть использована смесь фторида металла и соли аммония, имеющей анионную часть другую, чем F-; смесь соли металла, имеющей анионную часть другую, чем F-, и фторида аммония; смесь фторида металла и соли фосфония, имеющей анионную часть другую, чем F-; смесь соли металла, имеющей анионную часть другую, чем F-, и фторида фосфония; смесь фторида аммония и соли фосфония, имеющей анионную часть другую, чем F-; и смесь соли аммония, имеющей анионную часть другую, чем F-, и фторида фосфония. Более того, может быть использована смесь фторида металла, фторида аммония и соли фосфония, имеющей анионную часть другую, чем F-; смесь фторида металла, соли аммония, имеющей анионную часть другую, чем F-, и фторида фосфония; смесь соли металла, имеющей анионную часть другую, чем F-, фторида аммония и фторида фосфония; смесь фторида металла, соли аммония, имеющей анионную часть другую, чем F-, и соли фосфония, имеющей анионную часть другую, чем F-; и т.д. Эти соли могут вступать во взаимную реакцию обмена анионных частей между и среди этих солей (например, см. Схему 2).
Схема 2: Взаимная анионная реакция обмена между солями

[0048] Комбинация этих солей может ускорять реакции в Процессе I, потому что реакция может зависеть от растворимости соли фтора в используемом растворителе. По существу, высокая концентрация фторид-анионов (F-) будет увеличивать количество доступных фторид-анионов во время реакции. Следовательно, можно подбирать пригодную комбинацию этих солей, для того чтобы повысить эффективную концентрацию F-. Количество (используемое взамен количества фторида металла, фторида аммония и/или фторида фосфония) соли металла, аммония и фосфония, имеющей анионную часть другую, чем F-, может быть выбрано в диапазоне от каталитических количеств до любых количеств, которые не нарушают реакций или не снижают выходов продуктов. Анионная часть другая, чем F-, может быть выбрана из любых анионов, которые не ограничивают реакций или не снижают выходов продуктов. Примеры анионных частей, других, чем F-, включают, но не ограничиваются перечисленным, Cl-, Br-, I-, BF4 -, PF6 -, SO4 -, -ОСОСН3, -OCOCF3, -OSO2CH3, -OSO2CF3, -OSO2C4F9, -OSO2C6H5, -OSO2C6H4CH3, -OSO2C6H4 Br и т.д. Среди них, анионные части (другие, чем F-), которые не имеют кислородного аниона(нов), являются предпочтительными, а Cl-, BF4 - и PF6 - являются более предпочтительными вследствие обеспечения высоких выходов реакций. Кроме того, из-за низкой стоимости, наиболее предпочтительным анионом является Cl-.
[0049] С точки зрения эффективности и выходов реакций, Процесс I предпочтительно проводят в присутствии одного или нескольких растворителей. Растворителем предпочтительно является инертный, полярный, апротонный растворитель. Предпочтительные растворители по существу не будут реагировать с исходными веществами и реагентами, промежуточными соединениями и конечными продуктами. Пригодные растворители включают, но не ограничиваются перечисленными, нитрилы, простые эфиры, нитросоединения и т.д., и их смеси. Иллюстративными нитрилами являются ацетонитрил, пропионитрил, бензонитрил и т.д. Иллюстративными простыми эфирами являются тетрагидрофуран, диэтиловый эфир, дипропиловый эфир, дибутиловый эфир, трет-бутилметиловый эфир, диоксан, глим, диглим, триглим и т.д. Иллюстративными нитросоединениями являются нитрометан, нитроэтан, нитропропан, нитробензол и т.д. Ацетонитрил является предпочтительным растворителем для использования в Процессе I с точки зрения обеспечения более высоких выходов продуктов.
[0050] Для того чтобы в Процессе I получить продукт с хорошими выходами, температура реакции может быть выбрана в диапазоне приблизительно -60°С~+70°С. Более предпочтительно, температура реакции может быть выбрана в диапазоне приблизительно -40°С~+50°С. Более того, предпочтительно, температура реакции может быть выбрана в диапазоне приблизительно -20°С~+40°С.
[0051] Реакционные условия Процесса I оптимизируют для получения экономически хороших выходов продукта. В одном иллюстративном варианте осуществления изобретения, с приблизительно 1 молем соединения арилсеры (формула IIа) объединяют от приблизительно 5 моль до приблизительно 20 моль галогена с получением хорошего выхода галотетрафторидов арилсеры (формула IV). В другом варианте осуществления изобретения, с 1 молем соединения арилсеры формулы IIb (R6=атом водорода, силильная группа, атом металла, остаток аммония или остаток фосфония) объединяют от приблизительно 3 до приблизительно 12 моль галогена с получением хороших выходов галотетрафторидов арилсеры (формула IV). В следующем варианте с 1 молем соединения арилсеры формулы IIb (R6=атом галогена) объединяют от приблизительно 2 до приблизительно 8 моль галогена с получением хороших выходов галотетрафторидов арилсеры (формула IV). Количество соли фтора (формула III), используемое в вариантах осуществления Процесса I, может находиться в диапазоне от приблизительно 8 до приблизительно 24 моль на 1 моль соединения арилсеры формулы (IIа) с получением экономически хороших выходов продукта. Количество соли фтора (формула III), используемое в вариантах осуществления Процесса I, может находиться в диапазоне от приблизительно 4 до приблизительно 12 моль на 1 моль соединения арилсеры формулы (IIb) с получением экономически хороших выходов продукта.
[0052] Следует заметить, что время реакции Процесса I варьируется в зависимости от температуры реакции, типов и количеств субстратов, реагентов и растворителей. По существу, время реакции обычно определяется как промежуток времени, необходимый для завершения отдельной реакции, тем не менее, оно может составлять от приблизительно 0.5 ч до нескольких дней, предпочтительно, в рамках нескольких дней.
[0053] Схема 3: Механизм реакции Процесса I
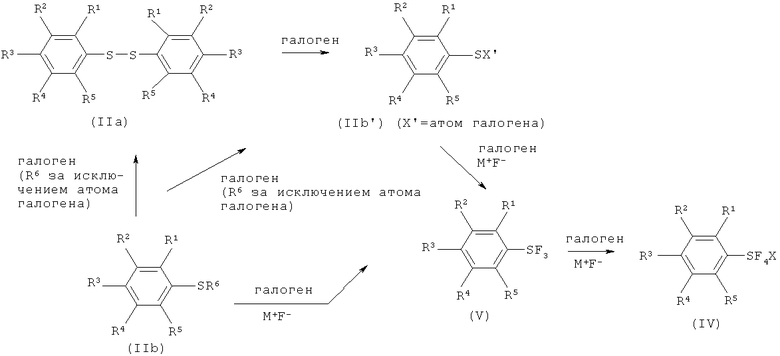
[0054] Более полный механизм реакции Процесса I показан на Схеме 3 выше. Соединение арилсеры формулы (IIa) реагирует с галогеном с получением галогенида арилсеры (IIb'=IIb, когда R6-атом галогена), который затем реагирует с галогеном и солью фтора (М+F-) с получением трифторида арилсеры (формула V). Трифторид арилсеры далее реагирует с галогеном и солью фтора с получением галотетрафторида арилсеры (формула (IV)). По существу, соединения, изображаемые формулой (V), выполняют функции промежуточных соединений в образовании соединений формулы (IV). Соединения, изображаемые формулой (IIb'), также выполняют функции промежуточных соединений. Исходное соединение арилсеры формулы (IIb, когда R6=атом водорода) реагирует с галогеном и солью фтора с получением трифторида арилсеры. Соединения арилсеры, изображаемые формулой (IIb, когда R6=атом галогена, атом металла, остаток аммония или остаток фосфония), реагируют с галогеном с получением соединений арилсеры, изображаемых формулой (IIa) или формулой (IIb'), которые затем реагируют с галогеном и солью фтора с получением трифторида арилсеры (формула V). По существу, соединения, изображаемые формулой (IIa) или (IIb'), выполняют функции промежуточных соединений в образовании соединений формулы (IV) из соединений арилсеры формулы (IIb, R6 за исключением атома галогена). Механизм реакции получения галотетрафторида арилсеры (формула IV) через трифторид арилсеры (формула V) был подтвержден с помощью 19F ЯМР исследования промежуточной реакционной смеси. Кроме того, трифторид арилсеры может быть превращен в галотетрафторид арилсеры (формула IV) в подобных реакционных условиях, как показано с помощью, по меньшей мере, Примера 14.
Процесс II (Схема 1)
[0055] Варианты осуществления изобретения включают Процесс II: реакцию галотетрафторида арилсеры, полученного с помощью Процесса I, с источником фторида, как показано на Схеме 1.
[0056] Заместитель(и), R1, R2, R3, R4 и R5 продуктов, изображаемых формулой (I), могут быть отличными от заместителя(ей), R1, R2, R3, R4 и R5, веществ, изображаемых формулой (IV). Таким образом, варианты осуществления настоящего изобретения включают превращение R1, R2, R3, R4 и R5 в другие R1, R2, R3, R4 и R5, которое может иметь место во время реакции согласно настоящему изобретению или в реакционных условиях до тех пор, пока -SF4X превратится в группу -SF5.
[0057] Источниками фторидов, пригодными для использования в Процессе II, являются безводные соединения, которые демонстрируют фторидную активность по отношению к галотетрафториду арилсеры (формула IV). Источники фторида могут быть выбраны из фторидов типичных элементов Периодической системы, фторидов переходных элементов Периодической системы, и смесей или соединений между или из этих фторидов типичных элементов и/или переходных элементов. Источник фторида может быть смесью, солью или комплексом с органической(ими) молекулой(ами), которая(ые) не ограничивают реакции данного изобретения. Источники фторида также включают смеси или соединения источников фторида с соединениями, активирующими источник фторида, такими как SbCl3, AlCl3, PCl5, BCl3 и т.д. Процесс II может быть проведен с использованием одного или нескольких источников фторида.
[0058] Пригодные примеры фторидов типичных элементов включают фториды элементов группы 1 Периодической системы, такие как фтороводород (HF) и фториды щелочных металлов, LiF, NaF, KF, RbF и CsF; фториды элементов группы 2 (фториды щелочноземельных металлов), такие как BeF2, MgF2, MgFCl, CaF2, SrF2, BaF2 и т.д.; фториды элементов группы 13, такие как BF3, BF2Cl, BFCl2, AlF3, AlF2Cl, AlFCl2, GaF3, InF3 и т.д.; фториды элементов группы 14, такие как SiF4, SiF3Cl, SiF2Cl2, SiFCl3, GeF4, GeF2Cl2, SnF4, PbF2, PbF4 и т.д.; фториды элементов группы 15, такие как PF5, AsF5, SbF3, SbF5, SbF4Cl, SbF3Cl2, SbF2Cl3, SbFCl4, BiF5 и т.д.; фториды элементов группы 16, такие как OF2, SeF4, SeF6, TeF4, TeF6 и т.д.; фториды элементов группы 17, такие как F2, ClF, ClF3, BrF, BrF3, IF6 и т.д.
[0059] Пригодные примеры фторидов переходных элементов (фториды переходных металлов) включают фториды элементов группы 3 Периодической системы, такие как ScF3, YF3, LaF3 и т.д.; фториды элементов группы 4, такие как TiF4, ZrF3, ZrF4, HfF4 и т.д.; фториды элементов группы 5, такие как VF3, VF5, NbF5, TaF5 и т.д.; фториды элементов группы 6, такие как CrF3, MoF6, WF6 и т.д.; фториды элементов группы 7, такие как MnF2, MnF3, ReF6 и т.д.; фториды элементов группы 8, такие как FeF3, RuF3, RuF4, OsF4, OsF5, OsF6 и т.д.; фториды элементов группы 9, такие как CoF2, CoF3, RhF3, IrF6 и т.д.; фториды элементов группы 10, такие как NiF2, PdF2, PtF2, PtF4, PtF6 и т.д.; фториды элементов группы 11, такие как CuF2, CuFCl, AgF, AgF2 и т.д.; фториды элементов группы 12, такие как ZnF2, ZnFCl, CdF2, HgF2 и т.д.
[0060] Пригодные примеры смесей или соединений между или из фторидов типичных элементов и/или переходных элементов включают, но не ограничиваются перечисленным, HBF4 [соединение фтороводорода (HF) и BF3], HPF6, HAsF6, HSbF6, LiF/HF [смесь или соль фторида лития (LiF) и фтороводорода (HF)], NaF/HF, KF/HF, CsF/HF, (CH3)4NF/HF, (C2H5)4NF/HF, (C4H9)4NF/HF, ZnF2/HF, CuF2/HF, SbF5/SbF3, SbF5/SbF3/HF, ZnF2/SbF5, ZnF2/SbF5/HF, KF/SbF5, KF/SbF5/HF и т.д.
[0061] Пригодные примеры смесей, солей или комплексов фторидов с органическими молекулами включают, но не ограничиваются перечисленным, BF3 диэтилэфират [BF3·O(С2Н5)2], BF3 диметилэфират, BF3 дибутилэфират, BF3 тетрагидрофурановый комплекс, BF3 ацетонитрильный комплекс (BF3·NCCH3), HBF4 диэтилэфират, HF/пиридин (смесь фтороводорода и пиридина), НF/метилпиридин, HF/диметилпиридин, HF/триметилпиридин, HF/триметиламин, HF/триэтиламин, HF/диметиловый эфир, HF/диэтиловый эфир и т.д. В качестве смеси HF/пиридин, из-за доступности предпочтительной является смесь приблизительно 70 мас.% фтороводорода и приблизительно 30 мас.% пиридина.
[0062] Среди этих примеров источников фторида, упомянутых выше, предпочтительными являются фториды переходных металлов, фториды элементов 13~15 групп, фтороводород и их смеси или соединения, и смеси, соли, или комплексы этих фторидов с органическими молекулами.
[0063] Среди фторидов переходных металлов, примерами предпочтительно являются фториды элементов 11 группы (Cu, Ag, Au) и 12 группы (Zn, Cd, Hg). Более того, ZnF2 и CuF2 являются предпочтительными с точки зрения практической работы, выходов и стоимости. Среди фторидов элементов 13~15 групп, примерами предпочтительно являются BF3, AlF3, AlF2Cl, SbF3, SbF3, SbF4Cl и SbF3Cl2. Фториды элементов 13~15 групп предпочтительно могут быть использованы для получения полифторированных пентафторидов арилсеры. Среди органических молекул, пригодных для приготовления смесей, солей или комплексов с фторидами, являются предпочтительными пиридин, простые эфиры, такие как диметиловый эфир, диэтиловый эфир, дипропиловый эфир и диизопропиловый эфир, алкиламины, такие как триметиламин и триэтиламин, и нитрилы, такие как ацетонитрил и пропионитрил. Среди них, пиридин, диэтиловый эфир, триэтиламин и ацетонитрил являются более предпочтительными из-за доступности и цены.
[0064] В некоторых случаях, поскольку реакция галотетрафторида арилсеры и источника фторида может быть замедлена с помощью текущего инертного газа, такого как азот (см. Примеры 18 и 19), не является предпочтительным, когда пары реакционной смеси и/или газ, которые могут выделяться из реакционной смеси, удаляются, например, текучим над или через реакционную смесь инертным газом, или другими методами. Этот факт был неожиданным открытием, обнаруженным изобретателем, поскольку нельзя было ожидать, что удаление паров реакционной смеси замедлит реакцию. Вследствие этого, является предпочтительным случай, когда реакцию проводят в закрытом или герметичном реакторе, путем поддержания реактора при постоянном давлении, или путем оснащения реактора баллоном, наполненным инертным газом, таким как азот, или любым другим подобным образом. Следовательно, осуществление изобретения облегчает присутствие паров реакционной смеси.
[0065] Процесс II может быть проведен в присутствии или без растворителя. Однако, во многих случаях, в отличие от большинства органических реакций, настоящее изобретение типично не требует растворителя. Это представляет дополнительное преимущество для осуществления вариантов изобретения (из-за низкой стоимости, отсутствия необходимости отделения растворителя). В некоторых случаях, использование растворителя является предпочтительным для проведения спокойных и эффективных реакций. В случае использования растворителя, могут быть использованы алканы, галоуглероды, простые эфиры, нитрилы, нитросоединения. Примеры алканов включают нормальные, разветвленные, циклические изомеры пентана, гексана, гептана, октана, нонана, декана, додекана, ундекана и других подобных соединений. Иллюстративные галоуглероды включают дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, трихлорэтан, тетрахлорэтан, трихлортрифторэтан, хлорбензол, дихлорбензол, трихлорбензол, гексафторбензол, бензотрифторид, бис(трифторметил)бензол, перфторгексан, перфторциклогексан, перфторгептан, перфтороктан, перфторнонан, перфтордекан, перфтордекалин и другие подобные соединения. Иллюстративные простые эфиры включают диэтиловый эфир, дипропиловый эфир, ди(изопропиловый) эфир, дибутиловый эфир, трет-бутилметиловый эфир, диоксан, глим (1,2-диметоксиэтан), диглим, триглим и другие подобные соединения. Иллюстративные нитрилы включают ацетонитрил, пропионитрил, бензонитрил и другие подобные соединения. Иллюстративные нитросоединения включают нитрометан, нитроэтан, нитробензол и другие подобные соединения. Когда используемый в реакции источник фторида является жидкостью, он может быть использован в виде, как реагента, так и растворителя. Типичным примером такого источника является фтороводород и смесь фтороводорода и пиридина. Фтороводород и смесь фтороводорода и пиридина могут быть пригодны в качестве растворителя.
[0066] Что касается Процесса II, с целью оптимизирования выхода температуру реакции выбирают в диапазоне от приблизительно -100°С до приблизительно +250°С. Более типично, температуру реакции выбирают в диапазоне от приблизительно -80°С до приблизительно +230°С. Наиболее типично, температуру реакции выбирают в диапазоне от приблизительно -60°С до приблизительно +200°С.
[0067] Для того чтобы получать экономически хорошие выходы продуктов, количество источника фторида, который обеспечивает n частиц реакционно-способного фторида (пригодных для использования в реакции) на молекулу, может быть выбрано в диапазоне от приблизительно 1/n до приблизительно 20/n моль на 1 моль галотетрафторида арилсеры (см. формулу IV). Более типично, с точки зрения выхода и стоимости, количество может быть выбрано в диапазоне от приблизительно 1/n до приблизительно 10/n моль, так как небольшие количества источника фторида уменьшают выход(ы), а дополнительные количества источника фторида улучшают выход(ы) незначительно.
[0068] Как описано в Процессе I, время реакции Процесса II также варьируется в зависимости от температуры реакции, субстратов, реагентов, растворителей и их использованных количеств. Вследствие этого, можно модифицировать реакционные условия для определения количества времени, необходимого для завершения реакции Процесса II, тем не менее, оно может составлять от приблизительно 0.1 ч до нескольких дней, предпочтительно, в рамках нескольких дней.
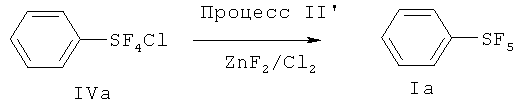
[0069] Варианты осуществления изобретения охватывают способ, который включает (см., например. Схему 4, Процессы I и II') взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIа) или формулу (IIb), с галогеном, выбранным из группы, состоящей из хлора, брома, йода и межгалоидных соединений, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, изображаемого формулой (IV). Галотетрафторид арилсеры затем вводят во взаимодействие с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением пентафторида арилсеры изображаемого формулой (I).
Схема 4 (Процессы I и II')
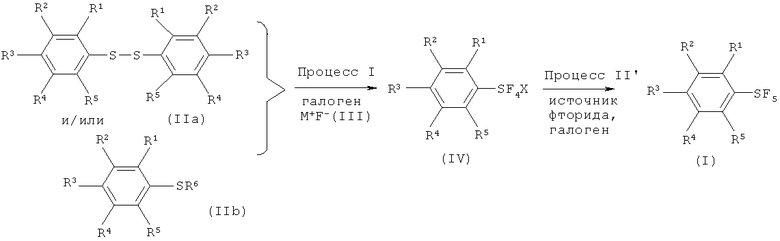
[0070] Процесс I описан выше.
[0071] Процесс II' является таким же, как и упомянутый ранее Процесс II, за исключением следующих модификаций: Реакция галотетрафторида арилсеры и источника фторида может быть ускорена с помощью галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения (см. Примеры 15~17).
[0072] Заместитель(и), R1, R2, R3, R4 и R5 продуктов, изображаемых формулой (I), могут быть отличными от заместителя(ей), R1, R2, R3, R4 и R5 веществ, изображаемых формулой (IV). Таким образом, варианты осуществления настоящего изобретения включают превращение R1, R2, R3, R4 и R5 в другие R1, R2, R3, R4 и R5, которое может иметь место во время реакции согласно настоящему изобретению или в реакционных условиях до тех пор, пока -SF4X превратится в группу -SF5.
[0073] Ускорение реакций с помощью присутствия галогена в некоторых случаях было неожиданным и удивительным открытием, которое обнаружено изобретателем. Без привязки к детальному механизму, предполагают, что галоген активирует источник фторида и/или предупреждает диспропорционирование галотетрафторида арилсеры (формула IV), которое может случаться во время этой реакции. Вследствие этого, другие соединения, активирующие источник фторида и/или предотвращающие диспропорционирование, входят в объем изобретения. Реакция в присутствии галогена может быть проведена с помощью методов, таких как прибавление галогена к реакционной смеси, растворение галогена в реакционную смесь, пропускание газообразного галогена или паров через реакционную смесь или реактор, или другие подобные методики. Среди галогенов, из-за его стоимости, предпочтительным является хлор (Cl2).
[0074] Используемое количество галогена находится в диапазоне от каталитических количеств до значительного избытка. С точки зрения стоимости, может быть предпочтительно выбран диапазон от каталитических количеств до 5 моль галогена на 1 моль галотетрафторида арилсеры (формула IV).
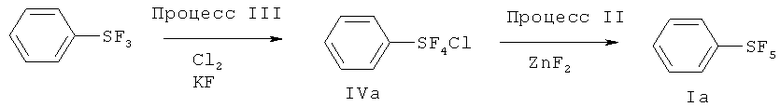
[0075] Варианты осуществления настоящего изобретения включают способ, который включает (Процесс III) взаимодействие трифторида арилсеры, имеющего формулу (V), с галогеном (хлор, бром, йод или межгалоидные соединения) и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, имеющего формулу (IV), и (Процесс II) взаимодействие полученного галотетрафторида арилсеры с источником фторида с получением пентафторида арилсеры, имеющего формулу (I). Схема 5, показывающая Процессы III и II, показана ниже:
Схема 5 (Процессы III и II)
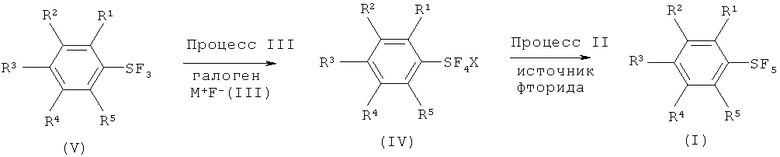
[0076] Что касается формул (I), (III), (IV) и (V), R1, R2, R3, R4, R5, R6, М и Х имеют определенные выше значения.
Процесс III (Схема 5)
[0077] Варианты осуществления настоящего изобретения обеспечивают способ получения пентафторидов арилсеры (формула I) путем взаимодействия трифторида арилсеры, имеющего формулу (V), с галогеном, выбранным из группы, состоящей из хлора, брома, йода и межгалоидных соединений, и солью фтора (формула III) с получением галотетрафторида арилсеры, имеющего формулу (IV).
[0078] Заместитель(и), R1, R2, R3, R4 и R5 продуктов, изображаемых формулой (IV), могут быть отличными от заместителя(ей), R1, R2, R3, R4 и R5 исходных веществ, изображаемых формулой (V). Таким образом, варианты осуществления настоящего изобретения включают превращение R1, R2, R3, R4 и R5 в другие R1, R2, R3, R4 и R5, которое может иметь место во время реакции согласно настоящему изобретению или в реакционных условиях до тех пор, пока -SF3 превратится в -SF4X.
[0079] Иллюстративные трифториды арилсеры согласно изобретению, изображаемые формулой (V), могут быть приготовлены, как описано в литературе [см. J. Am. Chem. Soc., т.84 (1962), сс.3064-3072, и Synthetic Communications т.33 (2003), сс.2505-2509], и их примерами являются, без ограничения перечисленным, трифторид фенилсеры, каждый изомер трифторида фторфенилсеры, каждый изомер трифторида дифторфенилсеры, каждый изомер трифторида трифторфенилсеры, каждый изомер трифторида тетрафторфенилсеры, трифторид пентафторфенилсеры, каждый изомер трифторида хлорфенилсеры, каждый изомер трифторида бромфенилсеры, каждый изомер трифторида хлорфторфенилсеры, каждый изомер трифторида бромфторфенилсеры, каждый изомер трифторида толилсеры, каждый изомер трифторида хлор(метил)фенилсеры, каждый изомер трифторида диметилфенилсеры, каждый изомер трифторида хлор(диметил)фенилсеры, каждый изомер трифторида триметилфенилсеры, каждый изомер трифторида этилфенилсеры, каждый изомер трифторида пропилфенилсеры, каждый изомер трифторида бутилфенилсеры, каждый изомер трифторида нитрофенилсеры, каждый изомер трифторида динитрофенилсеры и т.д.
[0080] Как упомянуто в механизме реакции для Процесса I, трифториды арилсеры (формула V) могут быть промежуточными соединениями в Процессе I.
[0081] Галоген, пригодный для использования в настоящем изобретении для Процесса III, является таким же, что и для Процесса I, описанного выше, за исключением количества, используемого для реакции.
[0082] Соли фтора, имеющие формулу (III) для Процесса III, являются такими же, что и для Процесса I, описанного выше, за исключением количества, используемого для реакции.
[0083] Является предпочтительным, когда реакцию Процесса III проводят с использованием растворителя. Примеры пригодных растворителей являются такими же, что и для Процесса I, описанного выше.
[0084] Для того чтобы получить экономически хорошие выходы продуктов, температура реакции для Процесса III может быть выбрана в диапазоне -60°С~+70°С. Более предпочтительно, температура может быть выбрана в диапазоне -40°С~+50°С. Более того, предпочтительно, температура может быть выбрана в диапазоне -20°С~+40°С.
[0085] Для того чтобы получить экономически хорошие выходы продукта, количество используемого галогена предпочтительно может быть выбрано в диапазоне от приблизительно 1 до приблизительно 5 моль, более предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль трифторида арилсеры (V).
[0086] Для того чтобы получить экономически хорошие выходы продуктов, количество используемой соли фтора (III) предпочтительно может быть выбрано в диапазоне от приблизительно 1 до приблизительно 5 моль на 1 моль трифторида арилсеры (V).
[0087] Время реакции Процесса III варьируется в зависимости от температуры реакции, субстратов, реагентов, растворителей и их использованных количеств. Вследствие этого, можно выбирать время, необходимое для завершения каждой реакции на основе модифицирования вышеупомянутых параметров, тем не менее, оно может составлять от приблизительно 0.5 ч до нескольких дней, предпочтительно, в рамках нескольких дней.
[0088] Процесс II описан выше.
[0089] Варианты осуществления настоящего изобретения охватывают способ, который включает (Процесс III) взаимодействие трифторида арилсеры, имеющего формулу (V) с галогеном (хлор, бром, йод или межгалоидные соединения) и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, имеющего формулу (IV), и (Процесс II') взаимодействие полученного галотетрафторида арилсеры с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением пентафторида арилсеры, имеющего формулу (I). Схема 6, показывающая Процессы III и II', показана ниже:
Схема 6 (Процессы III и II')
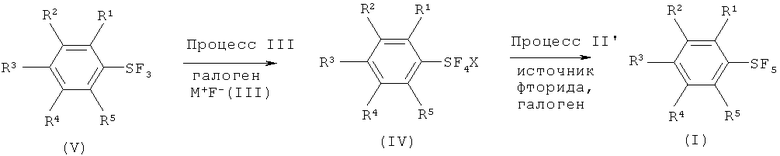
[0090] Что касается формул (I), (III), (IV) и (V), R1, R2, R3, R4, R5, R6, М и Х имеют определенные выше значения.
[0091] Процессы III и II' описаны выше.
[0092] Более того, настоящее изобретение охватывает способ (Схема 7, Процесс I) получения галотетрафторида арилсеры, имеющего формулу (IV), который включает взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIa) или формулу (IIb) с галогеном, выбранным из группы, состоящей из хлора, брома, йода и межгалоидных соединений, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры.
Схема 7 (Процесс I)
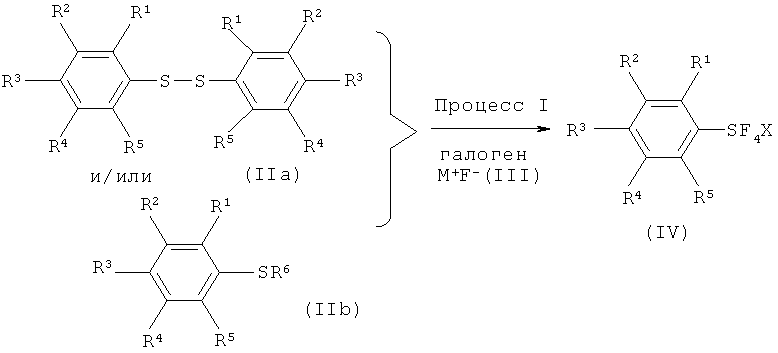
[0093] В формулах (IIa), (IIb), (III) и (IV), R1, R2, R3, R4, R5, R6, M и Х означают определенные выше значения.
[0094] Процесс I описан выше.
[0095] Более того, настоящее изобретение охватывает способ (Схема 8, Процесс III) получения галотетрафторида арилсеры, имеющего формулу (IV), который включает взаимодействие трифторида арилсеры, имеющего формулу (V), с галогеном, выбранным из группы, состоящей из хлора, брома, йода и межгалоидных соединений, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры.
Схема 8 (Процесс III)

[0096] В формулах (III), (IV) и (V), R1, R2, R3, R4, R5, M и Х означают определенные выше значения.
[0097] Процесс III описан выше.
[0098] Более того, настоящее изобретение охватывает способ (Схема 9, Процесс II'') получения пентафторида арилсеры, имеющего формулу (I), который включает взаимодействие галотетрафторида арилсеры, имеющего формулу (IV), с источником фторида, чья температура кипения составляет приблизительно 0°С или выше, с получением пентафторида арилсеры.
Схема 9 (Процесс II'')

[0099] В формулах (I) и (IV), R1, R2, R3, R4, R5 и Х означают определенные выше значения.
Процесс II'' (Схема 9)
[00100] Процесс II'' представляет собой реакцию галотетрафторида арилсеры, имеющего формулу (IV), с источником фторида, чья температура кипения составляет приблизительно 0°С или выше при давлении 1 атм, как показано на Схеме 9.
[00101] Заместитель(и), R1, R2, R3, R4 и R5 продуктов, изображаемых формулой (I), могут быть отличными от заместителя(ей), R1, R2, R, R4 и R5 исходных веществ, изображаемых формулой (IV). Таким образом, варианты осуществления настоящего изобретения включают превращение R1, R2, R3, R4 и R5 в другие R1, R2, R3, R4 и R5, которое может иметь место во время реакции согласно настоящему изобретению или в реакционных условиях до тех пор, пока -SF4X превратится в группу -SF5.
[00102] Процесс II'' является таким же, как Процесс II, описанный выше, и, источники фторида, пригодные для использования в Процессе II'', являются такими же, как источники фторида, рассмотренные ранее в отношении Процесса II, за исключением того, что источники фторида для Процесса II'' имеют температуры кипения, равные или выше 0°С при давлении 1 атм.
[00103] Более того, настоящее изобретение охватывает способ (Схема 10, Процесс II') получения пентафторида арилсеры, имеющего формулу (I), который включает взаимодействие галотетрафторида арилсеры, имеющего формулу (IV), с источником фторида в присутствии галогена, выбранного из группы, включающей хлор, бром, йод и межгалоидные соединения, с получением арилсерапентафторида.
Схема 10 (Процесс II')

[00104] В формулах (I) и (IV), R1, R2, R3, R4, R5 и Х означают определенные выше значения.
[00105] Процесс II' описан выше.
[00106] В соответствии с настоящим изобретением, пентафториды арилсеры, имеющие формулу (I), могут быть легко и экономично получены из легко доступных исходных веществ.
[00107] Настоящее изобретение обеспечивает новые хлортетрафториды арилсеры, изображаемые формулой (IV'), в качестве пригодных промежуточных соединений;
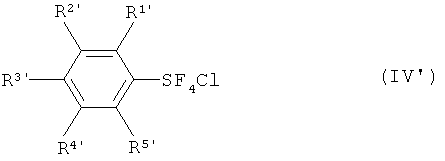
где R1', R2', R3', R4' и R5' каждый независимо означает атом водорода, атом галогена, линейную или разветвленную алкильную группу, имеющую от одного до четырех атомов углерода, или нитрогруппу; и где, когда R3' означает атом водорода, метильную группу или нитрогруппу, по меньшей мере, один из R1', R2', R4' и R5' означает атом галогена, линейную или разветвленную алкильную группу, имеющую от одного до четырех атомов углерода, или нитрогруппу. Атом галогена в данном случае означает атом фтора, атом хлора, атом брома или атом йода.
Среди них являются предпочтительными: каждый изомер хлортетрафторида трет-бутилфенилсеры, каждый изомер хлортетрафторида фторфенилсеры, каждый изомер хлортетрафторида хлорфенилсеры, каждый изомер хлортетрафторида бромфенилсеры, каждый изомер хлортетрафторида дифторфенилсеры, каждый изомер хлортетрафторида трифторфенилсеры и хлортетрафторид 2,3,4,5,6-пентафторфенилсеры, а хлортетрафторид 4-трет-бутилфенилсеры, хлортетрафторид 4-фторфенилсеры, хлортетрафторид 2-фторфенилсеры, хлортетрафторид 4-хлорфенилсеры, хлортетрафторид 4-бромфенилсеры, хлортетрафторид 3-бромфенилсеры, хлортетрафторид 2,6-дифторфенилсеры, хлортетрафторид 2,4,6-трифторфенилсеры и хлортетрафторид 2,3,4,5,6-пентафторфенилсеры являются более предпочтительными.
Настоящее изобретение также обеспечивает новые и пригодные фторированные пентафториды арилсеры, изображаемые формулой (I');
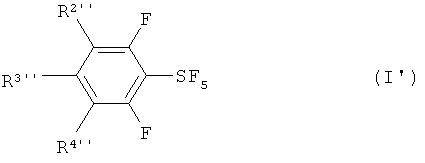
где, по меньшей мере, один из R2'', R3'' и R4'' означает атом галогена, и остальные переменные означают атом водорода. Атом галогена в данном случае означает атом фтора, атом хлора, атом брома или атом йода.
Среди них являются предпочтительными пентафторид 2,3,4,5,6-пентафторфенилсеры, пентафторид 2,4,6-трифторфенилсеры, пентафторид 3-хлор-2,4,6-трифторфенилсеры и пентафторид 3-хлор-2,6-дифторфенилсеры.
[00108] Настоящее изобретение будет более подробно проиллюстрировано следующими примерами, но следует понимать, что изобретение не ограничено ими.
ПРИМЕРЫ
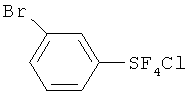
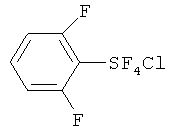
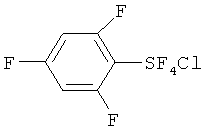
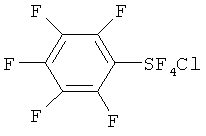
[00109] Следующие примеры обеспечивают исключительно иллюстративные цели и не предназначены для ограничения объема изобретения. Таблица 2 обеспечивает названия структур и формулы, упомянутые при рассмотрении нижеследующих примеров:
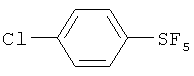
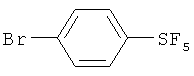
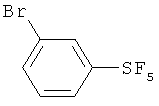
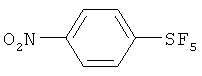
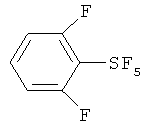
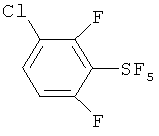
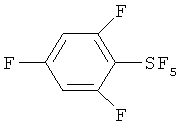
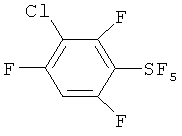
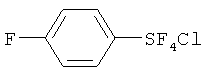
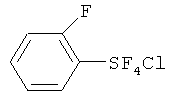
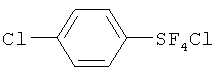
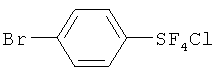

Пример 1. Синтез пентафторида фенилсеры из дифенилдисульфида
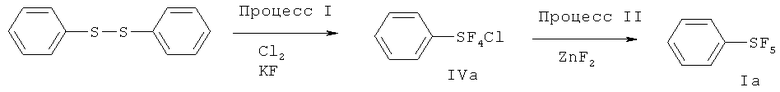
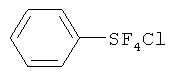
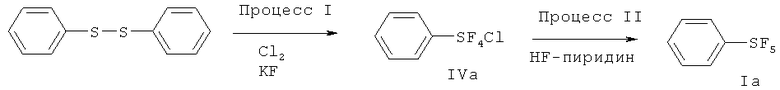
[00110] (Процесс I) В 500 мл круглодонную стеклянную колбу загружали дифенилдисульфид (33.0 г, 0.15 моль), сухой KF (140 г, 2.4 моль) и 300 мл сухого CH3CN. Перемешиваемую реакционную смесь охлаждали на льдо/водяной бане в токе N2 (18 мл/мин). Затем N2 останавливали, в реакционную смесь со скоростью приблизительно 70 мл/мин барботировали хлор (Cl2). Барботирование Cl2 осуществляли приблизительно 6.5 ч. Общее количество использованного Cl2 составляло приблизительно 1.2 моль. Затем Cl2 останавливали, реакционную смесь перемешивали в течение дополнительных 3 ч. Затем через смесь барботировали N2 в течение 2 ч для удаления избытка Cl2. Реакционную смесь затем фильтровали с 100 мл сухих гексанов на воздухе. К фильтрату добавляли приблизительно 1 г сухого KF. KF ограничивает возможное разложение продукта. Фильтрат упаривали в вакууме и получающийся остаток дистиллировали при пониженном давлении с получением бесцветной жидкости (58.0 г, 88%) - хлортетрафторида фенилсеры: т.кип. 80°С/20 мм Hg; 1H ЯМР (CD3CN) 7.79-7.75 (m, 2H, аромат.), 7.53-7.49 (m, 3Н. аромат.); 19F ЯМР (CD3CN) 136.7 (s, SF4Cl). ЯМР исследование показывало, что полученный хлортетрафторид фенилсеры является транс-изомером.
[00111] (Процесс II) В сухой камере, наполненной N2, в 100 мл фторполимерный (TEFLON®-PFA) сосуд загружали PhSF4Cl (44 г, 0.2 моль) и сухой ZnF2 (12.3 г, 0.12 моль). Сосуд затем оснащали холодильником, изготовленным из фторполимера, и баллоном, наполненным N2. Реакционную смесь медленно нагревали до 120°С на протяжении одного часа. Реакционная смесь меняла цвет с бесцветного на желтый, розовый и затем, в конечном счете, зеленый. Реакционную смесь перемешивали при 120°С в течение 20 ч. После охлаждения до комнатной температуры, к реакционной смеси добавляли приблизительно 50 мл пентана. Смесь фильтровали для удаления всего нерастворимого твердого вещества с получением желтого раствора, который концентрировали. Получающийся остаток дистиллировали при пониженном давлении с получением 30.6 г (75%) пентафторида фенилсеры; т.кип.70-71°С/120 мм Hg; 1H ЯМР (CDCl3) 7.77-7.74 (m, 2H, аромат.), 7.60-7.40 (m, 3Н, аромат.); 19F ЯМР (CDCl3) 85.20-84.13 (m, IF, SF5), 62.91 (d, 4F, SF5).
Примеры 2-10. Синтез пентафторидов арилсеры (I) из соединений арилсеры (IIa)
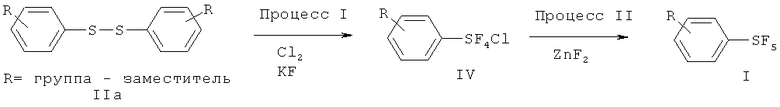
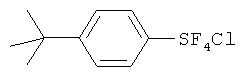
[00112] Замещенные пентафториды арилсеры (I) синтезировали из соответствующих соединений арилсеры (IIa) с помощью методики, подобной раскрытой в Примере 1. Таблица 3 показывает синтез замещенных пентафторидов арилсеры. Таблица 3 также показывает исходные вещества и другие химикаты, необходимые для Процессов I и II, растворители, реакционные условия и результаты, вместе с таковыми Примера 1. Продукт FC-72 (Fluorinert®) использовали в качестве растворителя в Процессе II в Примерах 9 и 10. Продукт Fluorinert® FC-72 был изготовлен фирмой 3М Company и представлял собой перфторированное органическое соединение, имеющее температуру кипения 56°С.
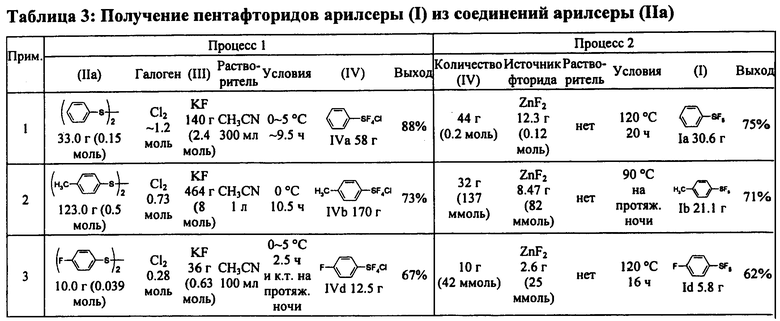
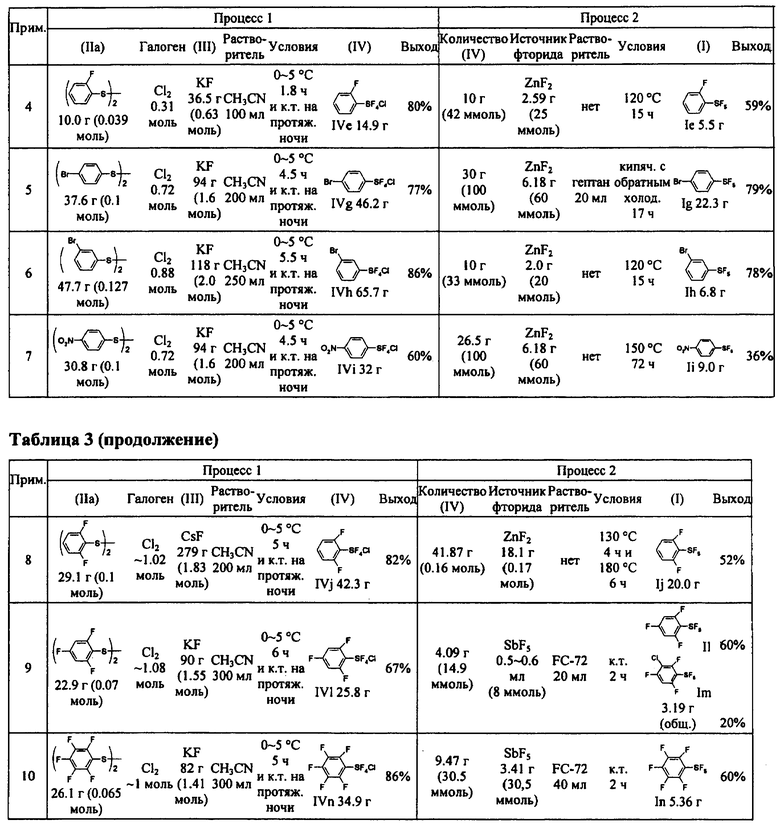
[00113] Свойства и спектральные данные продуктов, (IV) и (I), полученных согласно Примерам 2-10, показаны далее:
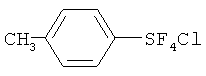
[00114] Хлортетрафторид п-метилфенилсеры; т.кип. 74-75°С/5 мм Hg; 1Н ЯМР (CD3CN) 7.65 (d, 2H, аромат.), 7.29 (d, 2H, аромат.), 2.36 (s, 3H, СН3); 19F ЯМР (CD3CN) 137.66 (s, SF4C1). Масс-спектр с высоким разрешением; найдено 235.986234 (34.9%) (рассчит. для C7H7F4S37Cl; 235.986363), найдено 233.989763 (75.6%) (рассчит. для C7H7F4S35Cl; 233.989313). ЯМР показывает, что полученный хлортетрафторид п-метилфенилсеры является транс-изомером.
[00115] Пентафторид п-метилфенилсеры; т.кип.95-96°С/80 мм Hg; 1Н ЯМР (CDCl3) 7.63 (d, 2H, аромат.), 7.24 (d, 2H, аромат.), 2.40 (s, 3H, СН3); 19F ЯМР (CDCl3) 86.55-84.96 (m, 1F, SF), 63.26 (d, 4F, SF4).
[00116] Хлортетрафторид п-фторфенилсеры; т.кип. 60°С/8 мм Hg; 1H ЯМР (CD3CN) 7.85-7.78 (m, 2H, аромат.), 7.25-7.15 (m, 2H, аромат.); 19F ЯМР (CD3CN) 137.6 (s, SF4Cl), -108.3 (s, CF); Масс-спектр с высоким разрешением; найдено 239.961355 (37.4%) (рассчит. для C6H4F5S37Cl; 239.961291), найдено 237.964201 (100%) (рассчит. для C6H4F5S35Cl; 237.964241). ЯМР показывает, что полученный хлортетрафторид п-фторфенилсеры является транс-изомером.
[00117] Пентафторид п-фторфенилсеры; т.кип. 71°С/80 мм Hg; 1H ЯМР (CDCl3) 7.80-7.73 (m 2H, аромат.), 7.17-7.09 (m, 2H, аромат.); 19F ЯМР (CDCl3) 87.78-83.17 (m, 1F, SF), 63.81 (d, 4F, SF4), -107.06 (s, 1F, CF); ГХ-МС m/z 222 (M+).
[00118] Хлортетрафторид о-фторфенилсеры; т.кип. 96-97°С/20 мм Hg; 1H ЯМР (CD3CN) 7.77-7.72 (m, 1Н, аромат.), 7.60-7.40 (m, 1Н, аромат.), 7.25-7.10 (m, 2H, аромат.); 19F ЯМР (CD3CN) 140.9 (d, SF4Cl), -107.6 (s, CF); Масс-спектр с высоким разрешением; найдено 239.961474 (25.4%) (рассчит. для C6H4F5S35Cl; 239.961291), найдено 237.964375 (69.8%) (рассчит. для C6H4F5S35Cl; 237.964241). ЯМР показывает, что полученный хлортетрафторид о-фторфенилсеры является транс-изомером.
[00119] Пентафторид о-фторфенилсеры; т.кип. 91-94°С/120 мм Hg; 1Н ЯМР (CDCl3) 7.78-7.73 (m, 1Н, аромат.), 7.55-7.48 (m, 1Н, аромат.), 7.27-7.17 (m, 2H, аромат.); 19F ЯМР (CDCl3) 82.38-81.00 (m, 1F, SF), 68.10 (dd, 4F, SF4), -108.07-(-108.35) (m, 1F, CF).
[00120] Хлортетрафторид п-бромфенилсеры (X); т.пл. 58-59°С; 1H ЯМР (CD3CN) δ 7.67 (s, 4H, аромат.); 19F ЯМР (CD3CN) δ 136.56 (s, SF4Cl); Масс-спектр с высоким разрешением; найдено 301.877066 (16.5%) (рассчит. для C6H4 81Br37ClF4S; 301.879178), найдено 299.880655 (76.6%) (рассчит. для C6H4 81Br35ClF4S; 299.881224 и рассчит. для C6H4 79Br37ClF4S; 299.882128), найдено 297.882761 (77.4%) (рассчит. для C6H4 79Br35ClF4S; 297.884174). Элементный анализ; рассчит. для C6H4BrClF4S; С, 24.06%; Н, 1.35%; найдено, С, 24.37%; Н, 1.54%. ЯМР показывал, что полученный хлортетрафторид п-бромфенилсеры является транс-изомером.
[00121] Пентафторид п-бромфенилсеры; т.кип. 77-78°С/10 мм Hg; 1H ЯМР (CDCl3) 7.63 (s, 4H, аромат.); 19F ЯМР (CDCl3) 84.13-82.53 (m, 1F, SF), 63.11 (d, 4F, SF4).
[00122] Хлортетрафторид м-бромфенилсеры; т.кип. 57-59°С/0.8 мм Hg; 1H ЯМР (CD3CN) 7.90-7.88 (m, 1Н, аромат.), 7.70-7.50 (m, 2H, аромат.), 7.40-7.30 (m, 1Н, аромат.); 19F ЯМР (CD3CN) 136.74 (s, SF4Cl). Масс-спектр с высоким разрешением; найдено 301.878031 (29.1%) (рассчит. для C6H4 81Br37ClF4S; 301.879178), найдено 299.881066 (100%) (рассчит. для C6H4 81Br35ClF4S; 299.881224 и рассчит. для C6H4 79Br37ClF4S; 299.882128), найдено 297.883275 (77.4%) (рассчит. для C6H4 79Br35ClF4S; 297.884174). ЯМР показывал, что полученный хлортетрафторид м-бромфенилсеры является транс-изомером.
[00123] Пентафторид м-бромфенилсеры; т.кип. 69-70°С/10 мм Hg; 1Н ЯМР (CDCl3) 7.91 (t, 1Н, аромат.), 7.72-7.64 (m, 2H, аромат.), 7.35 (t, 1Н, аромат.); 19F ЯМР (CDCl3) 83.55-82.47 (m, 1F, SF), 63.13 (d, 4F, SF4).
[00124] Хлортетрафторид п-нитрофенилсеры; т.пл. 130-131°С; 1H ЯМР (CD3CN) 8.29 (d, J=7.8 Гц, 2H, аромат.), 8.02 (d, J=7.8 Гц, 2Н, аромат.); 19F ЯМР (CD3CN) 134.96 (s, SF4Cl); Масс-спектр с высоким разрешением; найдено 266.956490 (38.4%) (рассчит. для C6H4 37ClF4NO2S; 266.955791), найдено 264.959223 (100%) (рассчит. для C6H4 35ClF4NO2S; 264.958741). Элементный анализ; рассчит. для C6H4ClF4NO2S; С, 27.13%; Н, 1.52%; N, 5.27%; найдено, С, 27.16%; Н, 1.74%; N, 4.91%. ЯМР показывает, что полученный хлортетрафторид п-нитрофенилсеры является транс-изомером.
[00125] Пентафторид п-нитрофенилсеры; т.кип. 74-76°С/3 мм Hg; 1Н ЯМР (CDCl3) 8.36-8.30 (m, 2H, аромат.), 7.99-7.95 (m, 2H, аромат.); 19F ЯМР (CDCl3) 82.32-80.69 (m, 1F, SF), 62.76 (d, 4F, SF4).
[00126] Хлортетрафторид 2,6-дифторфенилсеры: Продукт (т.кип. 120-122°С/95-100 мм Hg), полученный в Примере 8, представляет собой смесь 6:1 транс- и цис-изомеров хлортетрафторида 2,6-дифторфенилсеры. Транс-изомер выделяли в чистом виде с помощью кристаллизации; т.пл. 47.6-48.3°С; 19F ЯМР (CDCl3) δ 143.9 (t, J=26.0 Гц, 4F, SF4), -104.1 (квинтет, J=26.0 Гц, 2F, 2,6-F): 1Н ЯМР (CDCl3) δ 6.97-7.09 (m, 2H, 3,5-H), 7.43-7.55 (m, 1Н, 4-Н); 13С ЯМР (CDCl3) δ 157.20 (d, J=262.3 Гц), 133.74 (t, J=11.6 Гц), 130.60 (m), 113.46 (d, J=14.6 Гц); масс-спектр с высоким разрешением; найдено 257.950876 (37.6%) (рассчит. для C6H3 37ClF6S; 257.951869), найдено 255.955740 (100%) (рассчит. для C6H3 35ClF6S; 255.954819); элементный анализ; рассчит. для C6H3ClF6S; С, 28.08%, Н, 1.18%; найдено; С, 28.24%, Н, 1.24%. В случае цис-изомера определяли следующие параметры; 19F ЯМР (CDCl3) δ 158.2 (квартет, J=161.8 Гц, 1F, SF), 121.9 (m, 2F, SF2), 76.0 (m, 1F, SF). 19F ЯМР определение ароматических атомов фтора цис-изомера было невозможным из-за возможного наложения пиков транс-изомера.
[00127] Пентафторид 2,6-дифторфенилсеры: т.пл. 40.3-41.1°С; 1Н ЯМР (CDCl3) δ 7.51 (m, 1Н), 7.04 (m, 2H); 19F ЯМР (CDCl3) 82.32-80.69 (m, 1F, SF), 62.76 (d, 4F, SF4); масс-спектр с высоким разрешением; найдено 239.984509 (рассчит. для C6H3F7S; 239.984370); элементный анализ, рассчит. для C6H3F7S; С, 30.01%, Н, 1.26%; найдено. С, 30.20%, Н, 1.47%.
[00128] Хлортетрафторид 2,4,6-трифторфенилсеры: транс-изомер; т.пл. 55.8-56.7°С; 19F ЯМР (CDCl3) δ 144.07 (t, J=26.0 Гц, 4F, SF4), -99.80 (t, J=26.0 Гц, 2F, o-F), -100.35 (s, 1F, p-F); 1H ЯМР (CDCl3) δ 6.79 (t, J=17.5 Гц, m-H); 13C ЯМР (CDCl3) δ 164.16 (dt, J=164.2 Гц, 15.2 Гц, 4-С), 158.18 (dm, J=260.7 Гц, 2-С), 127.7 (m, 1-C), 102.1 (tm, J=27.8 Гц, 3-С). Элементный анализ; рассчит. для C6H2ClF7S; С, 26.24%; Н, 0.73%; найдено, С, 26.23%; Н, 1.01%. ЯМР показывает, что полученный хлортетрафторид 2,4,6-трифторфенилсеры является транс-изомером.
[00129] Пентафторид 2,4,6-трифторфенилсеры и пентафторид 3-хлор-2,4,6-трифторфенилсеры: Продукт (т.пл.~145°С), полученный в Эксперименте 9, представлял собой смесь 3:1 (молярное отношение) пентафторида 2,4,6-трифторфенилсеры и пентафторида 3-хлор-2,4,6-трифторфенилсеры. Эти продукты идентифицировали с помощью ЯМР и ГХ-Масс исследований. Пентафторид 2,4,6-трифторфенилсеры: 19F ЯМР (CDCl3) δ 78.7-75.3 (m, SF), 73.8-72.9 (m, SF4), -100.6 (m, 4-F), -100.7 (m, 2,6-F); 1H ЯМР (CDCl3) δ 6.80 (t, J=8.6 Гц, 3,5-H); ГХ-Масс m/z 258 (M+). Пентафторид 3-хлор-2,4,6-трифторфенилсеры: 19F ЯМР (CDCl3) δ 78.7-75.3 (m, SF), 73.8-72.9 (m, SF4), -101.3 (m, 2 или 6-F), -102.3 (m, 4-F), -102.6 (m, 2 или 6-F); 1H ЯМР (CDCl3) δ 6.95 (br.t, J=9.5 Гц, 5-H); ГХ-Масс m/z 294, 292 (M+).
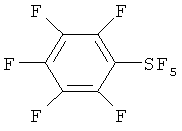
[00130] Хлортетрафторид 2,3,4,5,6-пентафторфенилсеры: Продукт (т.кип. 95-112°С/100 мм Hg), полученный в Эксперименте 10, представлял собой смесь 1.7:1 транс- и цис-изомеров хлортетрафторида 2,3,4,5,6-пентафторфенилсеры. Параметры изомеров определяли с помощью 19F ЯМР: Транс-изомер; 19F ЯМР (CDCl3) δ 144.10 (t, J=26.0 Гц, 4F, SF4), -132.7 (m, 2F, 2,6-F), -146.6 (m, 1F, 4-F), -158.9 (m, 2F, 3.5-F); 13C ЯМР (CDCl3) δ 143.5 (dm, J=265.2 Гц), 141.7 (dm, J=263.7 Гц), 128.3 (m). Цис-изомер; 19F ЯМР (CDCl3) δ 152.39 (квартет, J=158.9 Гц, 1F, SF), 124.32 (m, 2F, SF2), 79.4 (m, 1F, SF), -132.7 (m, 2F, 2,6-F), -146.6 (m, 1F, 4-F), -158.9 (m, 2F, 3,5-F). Масс-спектр с высоким разрешением смеси 1.7:1 транс- и цис-изомеров; найдено 311.923124 (15.5%) (рассчит. для C6 37ClF9S; 311.923604), найдено 309.926404 (43.1%) (рассчит. для C6 37ClF9S; 309.926554).
[00131] Пентафторид 2,3,4,5,6-пентафторфенилсеры: т.кип.135-137°С; 19F ЯМР (CDCl3) δ 74.8 (m, 5F, SF5), -133.4 (m, 2F, 2,6-F), -146.2 (m, 1F, 4-F), -158,6 (m, 2F, 3,5-F); 13C ЯМР (CDCl3) δ 143.6 (dm, J=262.2 Гц), 137.9 (dm, J=253.6 Гц), 126.7 (m). Масс-спектр с высоким разрешением; найдено 293.956492 (рассчит. для C6F10S; 293.956104).
Пример 11. Синтез пентафторида фенилсеры из дифенилдисульфида и смеси фтороводорода и пиридина в качестве источника фторида в Процессе II
[00132] (Процесс I) Хлортетрафторид фенилсеры с высоким выходом приготовляли способом, одинаковым с описанным в Процессе I Примера 1.
[00133] (Процесс II) В реакционный сосуд, изготовленный из фторполимера, загружали 341 мг (1.54 ммоль) хлортетрафторида транс-фенилсеры, и при комнатной температуре добавляли 0.5 мл смеси приблизительно 70 мас.% фтороводорода и приблизительно 30 мас.% пиридина. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и нагревали при 50°С в течение 3 часов. После завершения реакции, реакционную смесь охлаждали до комнатной температуры. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 93%.
Пример 12. Синтез пентафторида фенилсеры из тиофенола в качестве соединения арилсеры формулы (IIb)

[00134] (Процесс I) В перемешиваемую смесь 10.0 г (90.8 ммоль) тиофенола и 47.5 г (0.817 моль) сухого KF в 100 мл сухого ацетонитрила при 6~10°С со скоростью потока 27 мл/мин пропускали хлор (Cl2). Хлор пропускали в течение 3.7 ч, и общее количество прошедшего хлора составляло 10.2 л (0.445 моль). Затем к реакционной смеси добавляли 10 мл 1,1,2-трихлортрифторэтана, реакционную смесь фильтровали. После удаления растворителя в вакууме, получали хлортетрафторид фенилсеры (16.6 г, 83%) в виде светлой зелено-коричневой жидкости. Физические свойства и спектральные данные продукта показаны в Примере 1. Продукт является транс-изомером.
[00135] (Процесс II) Хлортетрафторид фенилсеры, полученный в упомянутом выше Процессе I, можно ввести в реакцию с ZnF2 по методике, одинаковой с описанной в Процессе II Примера 1, получая пентафторид фенилсеры с хорошим выходом.
Пример 13. Синтез пентафторида n-нитрофенилсеры из n-нитробензолсульфенилхлорида в качестве соединения арилсеры формулы (IIb)
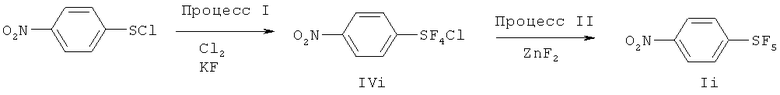
[00136] (Процесс I) В перемешиваемую смесь 5.00 г (26.4 ммоль) п-нитробензолсульфенилхлорида и 15.3 г (264 ммоль) сухого KF в 40 мл сухого ацетонитрила при 5~11°С со скоростью потока 37 мл/мин пропускали хлор (Cl2). Общее количество прошедшего хлора составляло 2.54 л (113 ммоль). Затем к реакционной смеси добавляли 5 мл 1,1,2-трихлортрифторэтана, реакционную смесь фильтровали. После удаления растворителя в вакууме, получали хлортетрафторид п-нитрофенилсеры (4.69 г, 76%) в виде твердого вещества. Физические свойства и спектральные данные продукта показаны в Примере 7. Продукт является транс-изомером.
[00137] (Процесс II) Хлортетрафторид п-нитрофенилсеры, полученный в упомянутом выше Процессе I, можно ввести в реакцию с ZnF2 по методике, одинаковой с описанной в Процессе II Примера 7, получая пентафторид п-нитрофенилсеры с хорошим выходом.
Пример 14. Синтез пентафторида фенилсеры из трифторида фенилсеры
[00138] (Процесс III) В перемешиваемую смесь 5.00 г (30.1 ммоль) трифторида фенилсеры и 8.74 г (150 ммоль) сухого KF в 20 мл сухого ацетонитрила при 6~9°С со скоростью потока 34 мл/мин пропускали хлор (Cl2). Хлор пропускали в течение 43 мин, и общее количество прошедшего хлора составляло 1.47 л (65.5 ммоль). Затем к реакционной смеси добавляли 3 мл 1,1,2-трихлортрифторэтана, реакционную смесь фильтровали. После удаления растворителя в вакууме, получали хлортетрафторид фенилсеры (5.62 г, 84%) в виде бесцветной жидкости. Физические свойства и спектральные данные продукта показаны в Примере 1. Продукт является транс-изомером.
[00139] (Процесс II) Хлортетрафторид фенилсеры, полученный в упомянутом выше Процессе III, можно ввести в реакцию с ZnF2 по методике, одинаковой с описанной в Процессе II Примера 1, получая пентафторид фенилсеры с хорошим выходом.
Пример 15. Реакция хлортетрафторида фенилсеры и ZnF2 в медленном токе хлора (присутствие галогена)
(Процесс II') транс-Хлортетрафторид фенилсеры (транс-PhSF4Cl), использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в 50 мл реакционный сосуд, изготовленный из фторполимера, загружали 10.0 г (0.045 моль) Транс-PhSF4Cl и 2.8 г (0.027 моль) сухого ZnF2. Реакционный сосуд вынимали из камеры с осушенной атмосферой и соединяли с системой подачи газа. Реакционную смесь, во время добавления газа Cl2 в реакционный сосуд со скоростью 4.6 мл/мин, медленно нагревали до 120°С. Ход реакции контролировали с помощью 19F ЯМР. Через 40 минут при 120°С было обнаружено присутствие в реакционной смеси трех главных соединений (транс-PhSF4Cl, цис-PhSF4Cl и пентафторид фенилсеры (PhSF5)). Мольное отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 составляло 0.5: 3.3: 100. После дополнительных 60 минут при 120°С, транс- и цис-PhSF4Cl исчезали, и с помощью 19F ЯМР обнаруживался исключительно PhSF5. Реакцию завершали в пределах 1.7 ч при 120°С. Затем, в течение 0.5 ч пропускали N2 (5.4 мл/мин), исследование реакционной смеси с помощью 19F ЯМР, используя бензотрифторид в качестве стандарта, показывало, что пентафторид фенилсеры получался с выходом 92%. Это эксперимент показывал, что реакция очень ускоряется в присутствии хлора, а продукт получается с высоким выходом. Этот эксперимент также показывал, что путем изомеризации транс-PhSF4Cl промежуточно образуется цис-phSF4Cl, а цис-PhSF4Cl превращается в продукт, PhSF5.
Пример 16. Реакция хлортетрафторида фенилсеры и ZnF2 в быстром токе хлора (присутствие галогена)
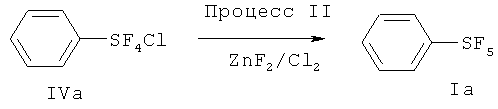
[00140] (Процесс II') транс-Хлортетрафторид фенилсеры (транс-PhSF4Cl), использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в 50 мл реакционный сосуд, изготовленный из фторполимера, загружали 10.0 г (0.045 моль) транс-PhF4Cl и 2.8 г (0.027 моль) сухого ZnF2. Реакционный сосуд вынимали из камеры с осушенной атмосферой и соединяли с системой подачи газа. Реакционную смесь, во время добавления газа Cl2 в реакционный сосуд со скоростью 23 мл/мин, медленно нагревали до 120°С. Ход реакции контролировали с помощью 19F ЯМР. Через 45 минут при 120°С было обнаружено присутствие в реакционной смеси трех главных соединений (транс-PhSF4Cl, цис-PhSF4Cl и пентафторид фенилсеры (PhSF5)). Мольное отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 составляло 18: 83: 100. После дополнительных 45 минут при 120°С транс- и цис-PhSF4Cl исчезали, и с помощью 19F ЯМР обнаруживался исключительно PhSF5. Реакцию завершали за приблизительно 1.5 ч при 120°С. Затем, в течение 1 ч пропускали N2 (26.9 мл/мин), исследование реакционной смеси с помощью 19F ЯМР, используя бензотрифторид в качестве стандарта, показывало, что пентафторид фенилсеры получался с выходом 83%. Этот эксперимент показывал, что реакция очень ускоряется в присутствии хлора, а продукт получается с высоким выходом. Этот эксперимент ясно показывал, что путем изомеризации транс-PhSF4Cl промежуточно образуется цис-PhSF4Cl, а цис-PhSF4Cl превращается в продукт, PhSF5.
Пример 17. Реакция хлортетрафторида 2,6-дифторфенилсеры и ZnF2 в токе хлора (присутствие галогена)
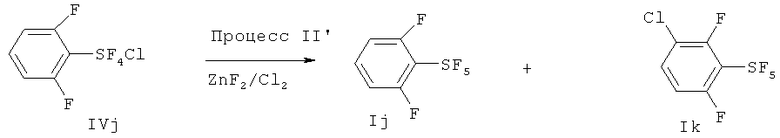
[00141] (Процесс II') Смесь 6:1 транс- и цис-хлортетрафторида 2,6-дифторфенилсеры, использованную в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примера 8. В камере с осушенной атмосферой, в 100 мл реакционный сосуд, изготовленный из фторполимера, загружали 13.03 г (0.126 моль) сухого ZnF2. Реакционный сосуд вынимали из камеры с осушенной атмосферой и соединяли с системой подачи газа. После продувки азотом, в реакционный сосуд со скоростью 15 мл/мин начинали подавать Cl2, а реакционный сосуд нагревали до температуры 130-140°С, при которой начинали добавление 32.36 г (0.126 моль) смеси транс- и цис-хлортетрафторида 2,6-дифторфенилсеры. В общем, в течение 1 ч добавляли 32.36 г (0.126 моль) смеси транс- и цис-хлортетрафторида 2,6-дифторфенилсеры. После этого, нагревание и ток хлора сохраняли в течение дополнительных 3 часов. На этой стадии, ЯМР исследование реакционной смеси показывало, что исходные вещества (транс- и цис-хлортетрафторид 2,6-дифторфенилсеры) были израсходованы, а пентафторид 2,6-дифторфенилсеры и пентафторид 3-хлор-2,6-дифторфенилсеры образовывались в молярном отношении 63:37. Реакционную смесь затем экстрагировали пентаном и промывали водным раствором карбоната натрия. Экстракт сушили сухим Na2SO4, фильтровали и концентрировали с получением остатка, который дистиллировали при пониженном давлении с получением четырех фракций продукта в диапазоне температур кипения 75~120°С при 110 мм Hg. Первые три фракции (в сумме 15.37 г) представляли собой смесь 1:1 (согласно ГХ) пентафторида 2,6-дифторфенилсеры и пентафторида 3-хлор-2,6-дифторфенилсеры. Конечная фракция (четвертая фракция, т.кип. 112-120°С/110 мм Hg) содержала 6.22 г пентафторида 3-хлор-2,6-дифторфенилсеры (93% чистота, определена с помощью ГХ). Спектральные данные пентафторида 3-хлор-2,6-дифторфенилсеры были такими, как изложено ниже; 19F ЯМР (CDCl3) δ 77.9-75.7 (m, 1F, SF), 73.2-72.5 (m, 4F, SF4), -103.3 (m, 1F), -105.2 (m, 1F); 1Н ЯМР (CDCl3) δ 7.60 (m, 1H), 7.04 (m, 1H); масс-спектр с высоким разрешением, найдено 275.942071 (36.0%) (рассчит. для C6H2 37ClF7S; 275.942447), найдено 273.945943 (100%) (рассчит. для C6H2 35ClF7S; 273.945397). Другой продукт, пентафторид 2,6-дифторфенилсеры, идентифицировали с помощью данных, полученных в Примере 8 (Процесс II).
Пример 18. Реакция хлортетрафторида фенилсеры и ZnF2 в медленном токе инертного газа (азот)

[00142] (Процесс II) транс-Хлортетрафторид фенилсеры (транс-PhSF4Cl), использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в 50 мл реакционный сосуд, изготовленный из фторполимера, загружали 10.0 г (0.045 моль) транс-PhSF4Cl и 2.8 г (0.027 моль) сухого ZnF2. Реакционный сосуд вынимали из камеры с осушенной атмосферой и соединяли с системой подачи газа. Реакционную смесь медленно нагревали до 120°С в текущем со скоростью 5.4 мл/мин N2. Реакционная смесь изменяла цвет с бесцветного на светло-желтый, розовый и, в конечном счете, коричневый в течение приблизительно 30 минут. Реакционную смесь перемешивали при 120°С в текущем N2 в течение 5 ч. После охлаждения до комнатной температуры, реакционную смесь анализировали с помощью 19F ЯМР. В реакционной смеси присутствовали три главных соединения (транс-PhSF4Cl, цис-PhSF4Cl и PhSF5). Отношение транс-PHSF4Cl: цис-PhSF4Cl: PhSF5 составляло 15:20:100. К реакционной смеси добавляли PhSF3 (1.0 г) и с помощью ЯМР определяли выход каждого соединения. Выход транс-PhSF4Cl составлял 2.4%, цис-PhSF4Cl - 14.6% и PhSF5 - 67.2%. Реакция не завершилась в течение 5 ч при 120°С. Следовательно, этот эксперимент показал, что реакция в токе азота замедлялась.
Пример 19. Реакция хлортетрафторида фенилсеры и ZnF2 в быстром токе инертного газа (азот)

[00143] (Процесс II) транс-Хлортетрафторид фенилсеры (транс-PhSF4Cl), использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в 50 мл реакционный сосуд, изготовленный из фторполимера, загружали 10.0 г (0.045 моль) транс-PHSF4Cl и 2.8 г (0.027 моль) сухого ZnF2. Реакционный сосуд вынимали из камеры с осушенной атмосферой и соединяли с системой подачи газа. Реакционную смесь медленно нагревали до 120°С в текущем со скоростью 26.9 мл/мин N2. Реакционная смесь изменяла цвет с бесцветного на светло-желтый, розовый и, в конечном счете, коричневый в течение приблизительно 30 минут. Реакционную смесь перемешивали при 120°С в текущем N2 в течение 5 ч. После охлаждения до комнатной температуры, реакционную смесь анализировали с помощью 19F ЯМР. В реакционной смеси присутствовали три главных соединения (транс-PhSF4Cl, цис-PhSF4Cl и PhSF5). Отношение транс-PhSF4Cl, цис-PhSF4Cl: PhSF5 составляло 22:117:100. К реакционной смеси добавляли PhCF3 (2.8 г) и с помощью 19F ЯМР определяли выход каждого соединения. Выход транс-PhSF4Cl составлял 6.7%, цис-PhSF4Cl составлял 42.1%, и PhSF5 составлял 38.4%. Реакция не завершилась в течение 5 ч при 120°С, и превращение PhSF4Cl в PhSF5 было ниже, чем в Примере 18. Эта реакция показала, что реакция в быстром токе азота замедлялась больше, чем реакция в медленном токе азота. В том и другом случае, ток инертного газа оказывает ингибирующее действие на выход реакции.
Пример 20. Синтез пентафторида фенилсеры путем использования SbF3 в качестве источника фторида
[00144] (Процесс II) транс-Хлортетрафторид фенилсеры, использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.397 г (2.22 ммоль) сухого SbF3. Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь перемешивали при 80°С в течение 5 часов. Исследование реакционной смеси с помощью 19F-ЯМР метода показывало, что пентафторид фенилсеры получался с выходом 33%.
Пример 21. Синтез пентафторида фенилсеры путем использования смеси SbF3 (источник фторида) и SbCl5 (соединение, активирующее источник фторида) в качестве источника фторида

[00145] (Процесс II) транс-Хлортетрафторид фенилсеры, использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры, 0.349 г (2.01 ммоль) SbF3, следовое количество SbCl5 и 2 мл сухого гексана. SbCl5 представлял собой соединение, активирующее источник фторида. SbCl5 (сильная кислота Льюиса) может образовывать комплекс с SbF3 с получением SbF2(SbFCl5), который также может быть приготовлен с помощью SbF2Cl и SbFCl4, оба из которых являются источниками фторидов, пригодными к использованию в данном изобретении. Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь перемешивали при комнатной температуре в течение 3 дней. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 54%.
Пример 22. Синтез пентафторида фенилсеры путем использования SnF4 в качестве источника фторида
[00146] (Процесс II) транс-Хлортетрафторид фенилсеры, использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.26 г (1.4 ммоль) сухого SnF4. Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь перемешивали при 80°С в течение 2 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 34%.
Пргшер 23. Синтез пентафторида фенилсеры путем использования TiF4 в качестве источника фторида
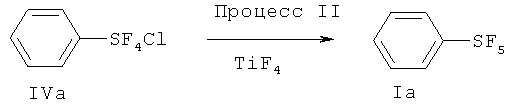
[00147] (Процесс II) транс-Хлортетрафторид фенилсеры, использованный в этом Процессе, приготовляли с высокими выходами с помощью Процесса I или III, как показано посредством Примеров 1, 11, 12 или 14. В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.17 г (1.4 ммоль) сухого TiF4. Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь перемешивали при 80°С в течение 16 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 35%.
Пример 24. Синтез хлортетрафторида фенилсеры из дифенилдисульфида
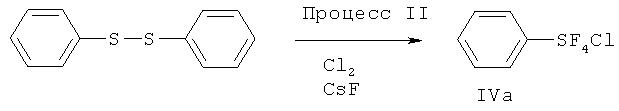
[00148] (Процесс I) В 500 мл круглодонную колбу загружали дифенилдисульфид (21.8 г, 0.1 моль), сухой CsF (243.2 г, 1.6 моль) и 200 мл сухого CH3CN. Реакционную смесь охлаждали на льдо/водяной бане и барботировали N2 (18 мл/мин) в течение 0.5 ч. Затем ток N2 останавливали, в реакционную смесь со скоростью 63 мл/мин в течение 4 ч барботировали Cl2. Общее количество использованного Cl2 составляло 0.68 моль. Реакционную смесь затем нагревали до комнатной температуры и перемешивали на протяжении ночи. Затем через смесь в течение 2 ч барботировали N2 (18 мл/мин) для удаления избытка хлора. Реакционную смесь фильтровали с 100 мл сухих гексанов в камере с осушенной атмосферой. Объединенный фильтрат упаривали в вакууме, и остаток дистиллировали при пониженном давлении с получением бесцветной жидкости хлортетрафторида фенилсеры (36.3 г, 83%). Физические свойства и спектральные данные продукта показаны в Примере 1. Продукт является транс-изомером.
Пример 25. Синтез хлортетрафторида n-хлорфенилсеры из бис(n-хлорфенил)дисульфида
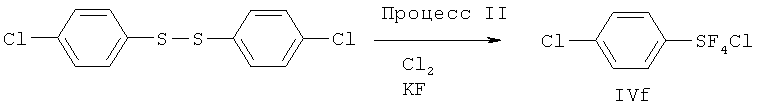
[00149] (Процесс I) В перемешиваемую смесь 25.0 г (87.0 ммоль) бис(п-хлорфенил)дисульфида и 86.0 г (1.48 моль) сухого KF в 200 мл сухого ацетонитрила при 5~8°С со скоростью потока 64 мл/мин пропускали хлор (Cl2). Хлор пропускали в течение 3.5 ч и общее количество прошедшего хлора составляло 12.8 л (571 ммоль). После этого, реакционную смесь фильтровали и промывали сухим гексаном. После удаления растворителя в вакууме, получали хлортетрафторид п-хлорфенилсеры (39.5 г, 88%) в виде бесцветной жидкости; т.кип. 65-66°С/2 мм Hg; 1H ЯМР (CDCl3) δ 7.38 (d, 2Н, J=9.1 Гц), 7.65 (d, 2H, J=9.1 Гц); 19F ЯМР (CDCl3) 137.4 (s, 4F, SF4Cl). Масс-спектр с высоким разрешением; найдено 257.927507 (13.3%) (рассчит. для C6H4F4S37Cl2; 257.928790), найдено 255.930746 (68.9%) (рассчит. для C6H4F4S37Cl35Cl; 255.931740), найдено 253.933767 (100.0%) (рассчит. для C6H4F4S35Cl2; 253.934690). ЯМР показывал, что полученный хлортетрафторид п-хлорфенилсеры является транс-изомером.
Пример 26. Синтез хлортетрафторида n-(трет-бутил)фенилсеры из n-(трет-бутил)бензолтиола
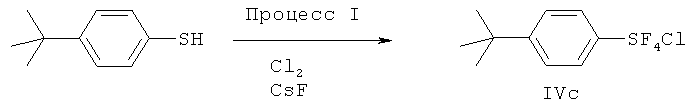
[00150] (Процесс I) В перемешиваемую смесь 10.0 г (60.2 ммоль) п-(трет-бутил)бензолтиола и 91.6 г (602 ммоль) сухого CsF в 150 мл сухого ацетонитрила при 5-10°С со скоростью потока 35 мл/мин пропускали хлор (Сl2). Хлор пропускали в течение 3.5 ч, и общее количество прошедшего хлора составляло 10.1 л (452 ммоль). После этого, реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь фильтровали под сухим азотом. После удаления растворителя при пониженном давлении, остаток дистиллировали с получением 14 г (84%) хлортетрафторида п-(трет-бутил)фенилсеры; т.кип. 98°С/0.3 мм Hg; т.пл. 93°С; 1Н ЯМР (CDCl3) δ 1.32 (s, 9H, С(СН3)3), 7.43 (d, J=9.2 Гц, 2Н, аромат.), 7.64 (d, J=9.2 Гц, 2H, аромат.); 19F ЯМР δ 138.3 (s, SF4Cl). Масс-спектр с высоким разрешением; найдено 278.034576 (8.8%) (рассчит. для C10H13 13ClF4S; 278.033313), найдено 276.037526 (24.7%) (рассчит. для C10H13 35ClF4S; 276.036263). Элементный анализ; Рассчит. для C10H13ClF4S; С, 43.40%; Н, 4.74%. Найдено; С, 43.69%, Н, 4.74%. ЯМР показывал, что полученный хлортетрафторид п-(трет-бутил)фенилсеры является транс-изомером.
Пример 27. Синтез пентафторида фенилсеры из хлортетрафторида фенилсеры и ZnF2
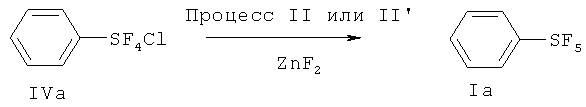
[00151] (Процесс II или II'') В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.281 г сухого ZnF2 (твердое вещество, т.пл. 872°С, т.кип. 1500°С). Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь нагревали при 80°С в течение 20 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 85%.
Пример 28. Синтез пентафторида фенилсеры из хлортетрафторида фенилсеры и ZnF2

[00152] (Процесс II или II'') В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.28 г (2.7 ммоль) сухого ZnF2 (твердое вещество, т.пл. 872°С, т.кип. 1500°С). Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь нагревали при 120°С в течение 4 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 88%.
Пример 29. Синтез пентафторида фенилсеры из хлортетрафторида фенилсеры и CuF2
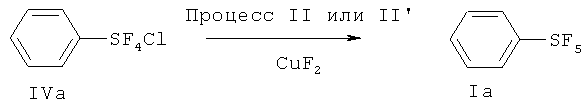
[00153] (Процесс II или II'') В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.54 ммоль) транс-хлортетрафторида фенилсеры и 0.284 г (2.79 ммоль) сухого CuF2 (твердое вещество, т.пл. ~785°С). Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь нагревали при 80°С в течение 22 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 57%.
Пример 30. Синтез пентафторида n-метилфенилсеры из хлортетрафторида n-метилфенилсеры и ZnF2
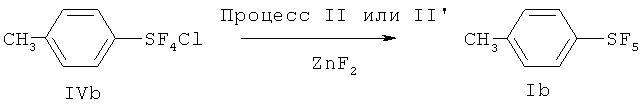
[00154] (Процесс II или II") В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.01 г (4.26 ммоль) транс-хлортетрафторида п-метилфенилсеры и 0.266 г (2.57 ммоль) сухого ZnF2 (твердое вещество, т.пл. 872°С, т.кип. 1500°С). Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным N2. Смесь нагревали при 80°С в течение 16 ч. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид п-метилфенилсеры получался с выходом 79%.
Пример 31. Синтез пентафторида фенилсеры из хлортетрафторида фенилсеры и диэтилэфирата HBF4
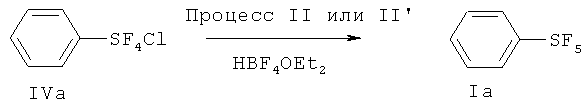
(Процесс II или II'') В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали 1.0 г (4.5 ммоль) транс-хлортетрафторида фенилсеры (транс-PhSF4Cl) и 4.5 мл сухого метиленхлорида. Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным азотом. В раствор медленно добавляли диэтилэфират HBF4 (жидкость) (HBF4OEt2) (0.88 г, 0.74 мл, 5.4 ммоль). Реакционную смесь перемешивали при комнатной температуре. Ход реакции контролировали с помощью 19F ЯМР. Через 7 ч в реакционной смеси присутствовали три главных соединения (транс-PhSF4Cl, цис-PhSF4Cl и PhSF5). Отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 составляло 156:716:100. Через 21 ч отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 изменялось на 3:6: 100. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры (PhSF5) получался с выходом 40%.
Пример 32. Синтез пентафторида фенилсеры из хлортетрафторида фенилсеры путем использования смеси ZnF2 (источник фторида) и SbCl5 (соединение, активирующее источник фторида) в качестве источника фторида

В камере с осушенной атмосферой, в реакционный сосуд, изготовленный из фторполимера, загружали сухой гептан (5 мл) и ZnF2 (твердое вещество) (0.84, 8.2 ммоль), и к смеси добавляли SbCl5 (жидкость) (0.41 г, 0.17 мл, 1.36 ммоль). К полученной смеси медленно добавляли транс-хлортетрафторид фенилсеры (транс-PhSF4Cl) (3.0 г, 13.6 ммоль). Реакционный сосуд вынимали из камеры с осушенной атмосферой и оснащали баллоном, наполненным азотом. SbCl5 представлял собой соединение, активирующее источник фторида. SbCl5 (сильная кислота Льюиса) может образовывать комплекс с ZnF2 с получением ZnF(SbFCl5), который также может быть приготовлен с помощью ZnFCl и SbFCl4, оба из которых являются источниками фторидов, пригодными к использованию в данном изобретении. Реакционную смесь перемешивали при комнатной температуре. Ход реакции контролировали с помощью 19F ЯМР. Через 10 мин отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 составляло 385: 0: 100. Через 90 мин отношение транс-PhSF4С1: цис-PhSF4Cl: PhSF5 изменялось на 63: следы: 100. Через 180 мин отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 изменялось на 34: следы: 100. Через 17 ч, отношение транс-PhSF4Cl: цис-PhSF4Cl: PhSF5 изменялось на 18: 2: 100. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры (PhSF5) получался с выходом 53%. Небольшое количество исходного транс-PhSF4Cl (9.4%) оставалось.
Пример 33. Реакция хлортетрафторида фенилсеры и газообразного BF3 (Сравнительный пример)
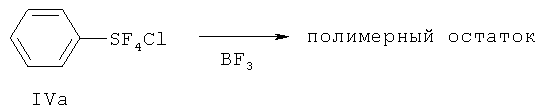
[00155] В реакционный сосуд, изготовленный из стали, загружали 1.0 г (4.5 ммоль) транс-хлортетрафторида фенилсеры и охлаждали на бане сухой лед-ацетон. Реакционный сосуд вакуумировали с помощью вакуумного насоса и в него, до тех пор, пока давление не достигло 18 фунтов на квадратный дюйм, вводили газообразный трифторид бора (BF3; температура кипения составляет -100°С при давлении 1 атм). Реакционную смесь затем нагревали до комнатной температуры и оставляли стоять в течение 3 дней. В это время, давление повышали до 100 фунтов на квадратный дюйм дополнительным количеством газообразного BF3. После завершения реакции, было найдено, что вся реакционная смесь превратилась в твердый остаток. Пентафторид фенилсеры обнаружен не был.
Пример 34. Реакция хлортетрафторида фенилсеры и газообразного BF3 в метиленхлориде (Сравнительный пример)
[00156] В реакционный сосуд, изготовленный из стали, загружали 1.42 г (6.44 ммоль) транс-хлортетрафторида фенилсеры и 6.4 мл сухого метиленхлорида и охлаждали до приблизительно -100°С путем использования бани из жидкого азота. Реакционный сосуд вакуумировали с помощью вакуумного насоса, и в реакционный сосуд, до тех пор, пока давление не достигло 80 фунтов на квадратный дюйм, вводили газообразный трифторид бора BF3 (температура кипения равна -100°С при давлении 1 атм). Реакционную смесь нагревали до комнатной температуры и оставляли стоять в течение 5 часов. В это время, давление повышали до 100 фунтов на квадратный дюйм дополнительным количеством газообразного BF3. Исследование реакционной смеси с помощью 19F-ЯМР показывало, что пентафторид фенилсеры получался с выходом 28%.
[00157] Примеры 33 и 34 подтверждали сообщение Ou и др., которыми было установлено, что хлортетрафторид фенилсеры медленно переходит в пентафторид фенилсеры при пропускании трифторида бора (температура кипения -100°С при давлении 1 атм) через раствор хлортетрафторида фенилсеры в дейтериевом метиленхлориде (см. Can. J. Chem., т.75, сс.1878-1884). Однако, как показано в этом документе, выход является очень низким или желаемый продукт, из-за протекания нежелательной полимеризации, не получается вовсе. Примеры 33 и 34 показывают выгодность настоящего изобретения над традиционным в данной области методом получения с использованием газообразного фторида, такого как трифторид бора, чья температура кипения равна - 100°С при давлении 1 атм. В настоящем изобретении предпочтительно используются фториды, представляющие собой жидкости или твердые вещества, по меньшей мере, при 0°С и давлении 1 атм, а не газообразный реагент. Жидкое или твердое вещество является предпочтительным, потому что оно является легким в обращении и реагирует более полно, чем газообразный реагент. К тому же, хотя и показана возможность осуществления реакции с реагентом Ou и др., при атмосферном давлении, потребовалось бы высокое давление для протекания реакции при заметной скорости с необходимым и минимальным количеством реагента.
[00158] В то время как изобретение было подробно показано и описано со ссылкой на множество вариантов осуществления, специалисты в данной области техники должны понимать, что разные варианты, раскрытые здесь, могут быть изменены в части формы и деталей осуществления, без отклонения от сущности и объема изобретения, и что раскрытые здесь разные варианты осуществления не предназначены для ограничения объема притязаний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-3-ХЛОР-5-ФТОР-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2545021C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-3-ХЛОР-5-ФТОР-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2539578C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2542985C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2632203C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2545074C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТАФТОРИДОВ СЕРЫ | 1996 |
|
RU2166498C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИС(ТРИФТОРМЕТИЛ)ИМИДО-СОЛЕЙ | 2002 |
|
RU2278109C2 |
| ФТОРПИКОЛИНОИЛФТОРИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2627659C2 |
| СТАБИЛЬНЫЕ (CF)N СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2257376C2 |
| ИНГИБИТОРЫ МАТРИКСНЫХ МЕТАЛЛОПРОТЕИНАЗ | 2004 |
|
RU2370488C2 |
Изобретение относится к новым способам приготовления пентафторидов арилсеры формулы (I)
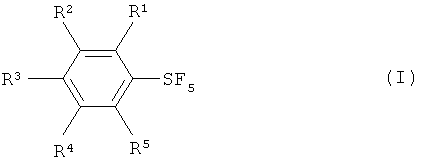
где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода или нитрогруппу; R6 означает атом водорода или атом галогена; М означает атом щелочного металла; и Х означает атом хлора, атом брома или атом йода. Способы включают взаимодействие, по меньшей мере, одного соединения арилсеры с галогеном и солью фтора с получением галотетрафторида арилсеры. Галотетрафторид арилсеры вводят в реакцию с источником фторида с получением целевого пентафторида арилсеры. 8 н. и 13 з.п. ф-лы, 3 табл., 34 примера.
1. Способ получения пентафторида арилсеры, имеющего формулу (I), как представлено ниже:

способ включает:
взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIа) или формулу (IIb):
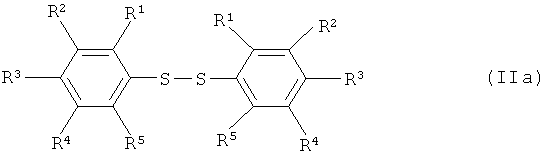
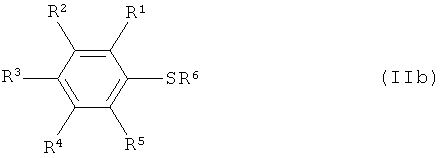
с галогеном, выбранным из группы, состоящей из хлора, брома, йода, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, имеющего формулу (IV):

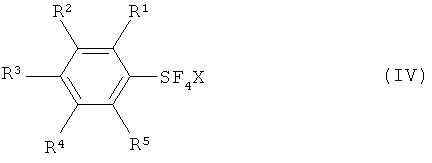
и взаимодействие полученного галотетрафторида арилсеры с источником фторида, выбранным из группы, состоящей из фторидов элементов группы 14; фторидов переходных элементов Периодической системы; и солей или комплексов фторидов с органическими соединениями, выбранными из группы, состоящей из ВF3 диэтилэфирата [ВF3·O(C2H5]2, ВF3 диметилэфирата, ВF3 дибутилэфирата, ВF3 тетрагидрофуранового комплекса, ВF3 ацетонитрильного комплекса (ВF3·NCCH3), HBF4 диэтилэфирата, с получением пентафторида арилсеры;
где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу;
R6 означает атом водорода или атом галогена;
М означает атом щелочного металла; и
Х означает атом хлора, атом брома или атом йода.
2. Способ по п.1, где галоген, взаимодействующий, по меньшей мере, с одним соединением арилсеры, представляет собой хлор (Cl2).
3. Способ по п.1, где источник фторида представляет собой, по меньшей мере, один представитель, выбранный из группы, состоящей из фторидов элементов группы 14, фторидов переходных элементов Периодической системы, смесей или соединений между или из этих фторидов элементов и/или переходных элементов и смесей, солей или комплексов этих фторидов с органическими соединениями.
4. Способ по п.1, в котором реакцию полученного галотетрафторида арилсеры с источником фторида осуществляют в присутствии галогена, выбранного из группы, включающей хлор, бром и йод, с получением пентафторида арилсеры.
5. Способ получения пентафторида арилсеры, имеющего формулу (I):

способ включает:
взаимодействие трифторида арилсеры, имеющего формулу (V):

с галогеном, выбранным из группы, состоящей из хлора, брома, йода, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры, имеющего формулу (IV):

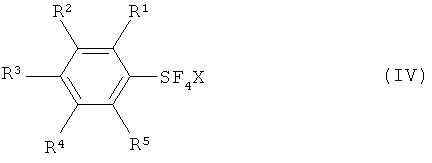
и взаимодействие полученного галотетрафторида арилсеры с источником фторида, выбранным из группы, состоящей из фторидов элементов группы 14; фторидов переходных элементов Периодической системы; и солей или комплексов фторидов с органическими соединениями, выбранными из группы, состоящей из ВF3 диэтилэфирата [ВF3·О(C2H5)2], ВF3 диметилэфирата, ВF3 дибутилэфирата, ВF3 тетрагидрофуранового комплекса, ВF3 ацетонитрильного комплекса (ВF3-NССН3), HBF4 диэтилэфирата, с получением пентафторида арилсеры;
где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу;
М означает атом щелочного металла; и
Х означает атом хлора, атом брома или атом йода.
6. Способ по п.5, в котором галоген, взаимодействующий с трифторидом арилсеры, представляет собой хлор (Сl2).
7. Способ по п.5, в котором источник фторида представляет собой, по меньшей мере, один представитель, выбранный из группы, состоящей из фторидов элементов группы 14, фторидов переходных элементов Периодической системы, смесей или соединений между или из этих фторидов элементов и/или переходных элементов и смесей, солей или комплексов этих фторидов с органическими соединениями.
8. Способ по п.5, в котором реакцию полученного галотетрафторида арилсеры с источником фторида осуществляют в присутствии галогена, выбранного из группы, включающей хлор, бром и йод, с получением пентафторида арилсеры.
9. Способ получения галотетрафторида арилсеры, имеющего формулу (IV):
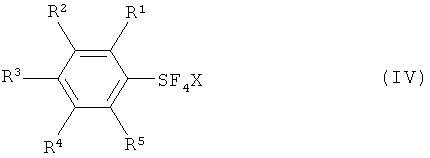
способ включает:
взаимодействие, по меньшей мере, одного соединения арилсеры, имеющего формулу (IIа) или формулу (IIb):


с галогеном, выбранным из группы, состоящей из хлора, брома, йода, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры,

где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу;
R6 означает атом водорода или атом галогена;
М означает атом щелочного металла; и
Х означает атом хлора, атом брома или атом йода.
10. Способ по п.9, в котором галоген, взаимодействующий, по меньшей мере, с одним соединением арилсеры, представляет собой хлор (Сl2).
11. Способ получения галотетрафторида арилсеры, имеющего формулу (IV):
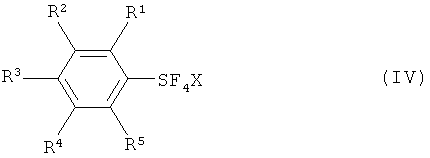
способ включает:
взаимодействие трифторида арилсеры, имеющего формулу (V):

с галогеном, выбранным из группы, состоящей из хлора, брома, йода, и солью фтора, имеющей формулу (III), с получением галотетрафторида арилсеры:

где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу;
М означает атом щелочного металла; и
Х означает атом хлора, атом брома или атом йода.
12. Способ по п.11, в котором галоген, взаимодействующий с трифторидом арилсеры, представляет собой хлор (Cl2).
13. Способ получения пентафторида арилсеры, имеющего формулу (I):

способ включает:
взаимодействие галотетрафторида арилсеры, имеющего формулу (IV);
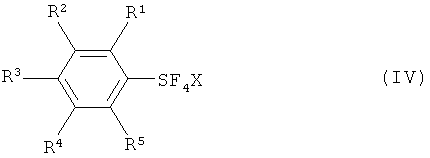
с источником фторида, где источник фторида имеет точку кипения приблизительно 0°С или выше при давлении 1 атм, и выбран из группы, состоящей из фторидов элементов группы 14; фторидов переходных элементов Периодической системы; и солей или комплексов фторидов с органическими соединениями, выбранными из группы, состоящей из ВF3 диэтилэфирата [ВF3·O(С2Н5)2], ВF3 диметилэфирата, ВF3 дибутилэфирата, ВF3 тетрагидрофуранового комплекса, ВF3 ацетонитрильного комплекса (ВF3·МССН3), HBF4 диэтилэфирата, с получением пентафторида арилсеры;
где: R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу; и
Х означает атом хлора, атом брома или атом йода.
14. Способ по п.13, в котором источник фторида, чья температура кипения при давлении 1 атм составляет 0°С или выше, является, по меньшей мере, одним представителем, выбранным из группы, состоящей из фторидов элементов группы 14, фторидов переходных элементов Периодической системы, смесей или соединений между или из этих фторидов элементов и/или переходных элементов и смесей, солей или комплексов этих фторидов с органическими соединениями.
15. Способ получения пентафторида арилсеры, имеющего формулу (I):

способ включает:
взаимодействие галотетрафторида арилсеры, имеющего формулу (IV):
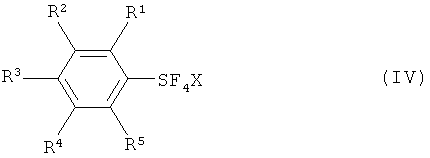
с источником фторида, выбранным из группы, состоящей из фторидов элементов группы 14; фторидов переходных элементов Периодической системы; солей или комплексов фторидов с органическими соединениями, выбранными из группы, состоящей из ВF3 диэтилэфирата [BF3·O(C2H5)2], ВF3 диметилэфирата, ВF3 дибутилэфирата, ВF3 тетрагидрофуранового комплекса, ВF3 ацетонитрильного комплекса (ВF3·МССН3), HBF4 диэтилэфирата, в присутствии галогена, выбранного из группы, включающей хлор, бром и йод, с получением пентафторида арилсеры,
где R1, R2, R3, R4 и R5 каждый независимо означает атом водорода, атом галогена, незамещенную алкильную группу, имеющую от 1 до 18 атомов углерода, или нитрогруппу; и
Х означает атом хлора, атом брома или атом йода.
16. Способ по п.15, в котором источник фторида представляет собой, по меньшей мере, один представитель, выбранный из группы, состоящей из фторидов элементов группы 14, фторидов переходных элементов Периодической системы, смесей или соединений между или из этих фторидов элементов и/или переходных элементов и смесей, солей или комплексов этих фторидов с органическими соединениями.
17. Хлортетрафторид арилсеры, изображаемый формулой (IV'):
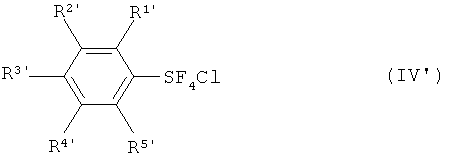
где R1', R2', R3', R4' и R5' каждый независимо означает атом водорода, атом галогена, линейную или разветвленную алкильную группу, имеющую от одного до четырех атомов углерода, или нитрогруппу; и где, когда R3' означает атом водорода, метильную группу, или нитрогруппу, по меньшей мере, один из R1', R2', R4' и R5' означает атом галогена, линейную или разветвленную алкильную группу, имеющую от одного до четырех атомов углерода, или нитрогруппу.
18. Хлортетрафторид арилсеры по п.17, выбранный из группы, состоящей из каждого изомера хлортетрафторида трет-бутилфенилсеры, каждого изомера хлортетрафторида фторфенилсеры, каждого изомера хлортетрафторида хлорфенилсеры, каждого изомера хлортетрафторида бромфенилсеры, каждого изомера хлортетрафторида дифторфенилсеры, каждого изомера хлортетрафторида трифторфенилсеры и хлортетрафторида 2,3,4,5,6-пентафторфенилсеры.
19. Хлортетрафторид арилсеры по п.17, который представляет собой хлортетрафторид 4-трет-бутилфенилсеры, хлортетрафторид 4-фторфенилсеры, хлортетрафторид 2-фторфенилсеры, хлортетрафторид 4-хлорфенилсеры, хлортетрафторид 4-бромфенилсеры, хлортетрафторид 3-бромфенилсеры, хлортетрафторид 2,6-дифторфенилсеры, хлортетрафторид 2,4,6-трифторфенилсеры и хлортетрафторид 2,3,4,5,6-пентафторфенилсеры.
20. Фторированный пентафторид арилсеры, изображаемый формулой (I'):

где, по меньшей мере, один из R2'', R3'' и R4'' означает атом галогена, и остальные переменные означают атом водорода.
21. Фторированный пентафторид арилсеры по п.20, который представляет собой пентафторид 2,3,4,5,6-пентафторфенилсеры, пентафторид 2,4,6-трифторфенилсеры, пентафторид 3-хлор-2,4,6-трифторфенилсеры или пентафторид 3-хлор-2,6-дифторфенилсеры.
| OU et al | |||
| "Oxidative addition and isomerization reactions | |||
| The synthesis of cis- and trans- ArSFCl and cis- and trans- PhTeFCl", Canadian journal of chemistry, vol.75(12), 1997, p.p.1878-1884 | |||
| OU et al | |||
| "Oxidative fluorination of S, Se and Те compounds", Journal of Fluorine Chemistry, vol.101, 2000, 279-283 | |||
| RU 97107003 A, |
Авторы
Даты
2013-01-20—Публикация
2008-03-21—Подача