Область изобретения
Данное изобретение, главным образом, относится к области частиц, загруженных активным средством, и, более конкретно, к композициям и способам доставки активных средств, загруженных в частицы PLGA (сополимер(D,L-лактида и гликолида)).
Предпосылки изобретения
Не ограничивая объема изобретения, его предпосылки описаны применительно к доставке активных фармацевтических средств.
Одной из наибольших проблем, связанных с молекулярной терапией, является доставка терапевтического средства к месту действия. В случае противораковых средств, таких как куркумин, существует необходимость соблюдать дозу на минимальных уровнях для защиты пациента. Понижение дозы, однако, может не полностью излечить заболевание. Таким образом, при помощи наведения устройства для доставки активных средств на определенное место действия посредством конъюгации различных антител можно разработать более эффективные схемы лечения.
Краткое описание изобретения
Данное изобретение включает композиции и способы создания активированной полимерной наночастицы для целенаправленной доставки активных средств, которая включает биосовместимый полимер и амфифильное стабилизирующее средство, которое нековалентно связано с линкером, содержащим по меньшей мере один электрофил, который избирательно реагирует с любым нуклеофилом на нацеливающем средстве и помещает нацеливающее средство на наружную поверхность биоразлагаемой нанооболочки, при этом активное средство загружено в нанооболочку. В некоторых вариантах осуществления нанооболочка включает один или несколько сложных полиэфиров и один или несколько амфифильных стабилизирующих средств. Сложным полиэфиром является полимолочная кислота, полигликолевая кислота, сополимер молочной и гликолевой кислот и их комбинации. В одном варианте осуществления амфифильным стабилизирующим средством является полиол, например, полиолом является поливиниловый спирт, полиэтиленгликоль, полипропиленгликоль, полипропилендиол, политетрагидрофуран и их комбинации. Нанооболочка может инкапсулировать активное средство, такое как плазмидная ДНК (дезоксирибонуклеиновая кислота), миРНК (малая интерферирующая РНК (рибонуклеиновая кислота)), белки, небольшие молекулы или противораковые средства (например, паклитаксел, куркумин), для контролируемой внутриклеточной доставки. С помощью данного изобретения композицию с нанооболочкой используют для контроля конечного размера и скорости доставки активного средства и/или нацеливающего средства, которое избирательно нацеливает нанооболочку на пораженные заболеванием ткань/клетки, тем самым минимизируя общую дозу для организма.
В нанооболочку можно загрузить активное средство, которое сочетает традиционные радиоизотопы и химиотерапевтическое средство. В другом варианте осуществления нанооболочку адаптируют для контролируемого высвобождения активных средств путем предопределения соотношений молочной и гликолевой кислот в полимере. Наночастица может также включать линкер, то есть линкер является гомофункциональным, гетерофункциональным, многофункциональным, с одним реакционным центром, с двумя активными реакционными центрами или со множественными активными реакционными центрами, водорастворимым, водонерастворимым или частично водорастворимым. Примеры нацеливающих средств для применения в данном изобретении включают антитело, небольшую молекулу, пептид, углевод, белок, нуклеиновую кислоту, антамер, вторую наночастицу, цитокин, хемокин, лифмокин, рецептор, липид, лектин, черный металл, магнитную частицу, линкер, изотоп и их комбинации. Другие активные средства могут включать противораковое лекарственное средство, антибиотик, противовирусное средство, противогрибковое средство, противоглистное средство, питательное вещество, небольшую молекулу, миРНК, антиоксидант и антитело. В одном определенном примере активным средством является противораковое лекарственное средство, например куркумин или его производное.
Данное изобретение также включает способ создания нацеливаемой, загружаемой наночастицы путем образования первой эмульсии, включающей биосовместимый полимер в первом растворителе и активное средство, при помощи, например, смешивания, обработки ультразвуком, встряхивания или другого перемешивания; получения второго раствора, включающего амфифильное стабилизирующее средство в воде, осадитель, применяемый для контроля предельного размера наночастицы, и линкер, содержащий по меньшей мере один электрофил; образования второй эмульсии путем смешивания первой эмульсии и второго раствора при помощи, например, обработки ультразвуком, встряхивания или других способов перемешивания, с образованием активированных, загруженных наночастиц с нековалентно связанными линкерами; отделения активированных, загруженных наночастиц; и связывания нацеливающего средства с частицей на одном или нескольких электрофилах на нековалентно связанных линкерах. Примерами линкеров являются гомофункциональный, гетерофункциональный, многофункциональный, с одним реакционным центром, с двумя активными реакционными центрами или со множественными активными реакционными центрами, водорастворимый, водонерастворимый или частично водорастворимый линкер. Нацеливающим средством для наночастицы может быть антитело, небольшая молекула, пептид, углевод, белок, нуклеиновая кислота, аптамер, вторая наночастица, цитокин, хемокин, лифмокин, рецептор, липид, лектин, черный металл, магнитная частица, линкер, изотоп и их комбинации. Активные средства для применения в способе по данному изобретению включают, например, противораковое лекарственное средство, антибиотик, противовирусное средство, противогрибковое средство, противоглистное средство, питательное вещество, небольшую молекулу, миРНК, антиоксидант и антитело. Нанооболочка может также включать один или несколько сложных полиэфиров и/или одно или несколько амфифильных стабилизирующих средств. Полиэфиры для применения в данном изобретении могут включать полимолочную кислоту, полигликолевую кислоту, сополимер молочной и гликолевой кислот и их комбинации. Одним неограничивающим примером амфифильного стабилизирующего средства является, например, полиол, поливиниловый спирт, полиэтиленгликоль, полипропиленгликоль, полипропилендиол, политетрагидрофуран, триблочные сополимеры поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид) (РЕО-РРО-РЕО) и их комбинации. Нанооболочка может инкапсулировать плазмидную ДНК, миРНК, белки, небольшие молекулы или противораковые средства (например, паклитаксел, куркумин) для контролируемой внутриклеточной доставки и/или применяется для контроля конечного размера и скорости доставки активного средства. Нацеливающее средство может избирательно нацеливать нанооболочку на пораженную заболеванием ткань/клетки, тем самым минимизируя общую дозу для организма, а в некоторых вариантах осуществления оно может быть присоединено к меченным радиоизотопом копъюгированным антителам на поверхности наночастицы. В нанооболочку можно загрузить активное средство, которое сочетает традиционные радиоизотопы и химиотерапевтическое средство, и/или адаптировать для контролируемого высвобождения активных средств при помощи предопределения соотношений молочной и гликолевой кислот в полимере. В одном определенном примере активным средством является противораковое лекарственное средство, например куркумин или его производное.
Краткое описание графических материалов
Для более полного понимания признаков и преимуществ данного изобретения теперь обратимся к детальному описанию данного изобретения вместе с сопровождающими фигурами.
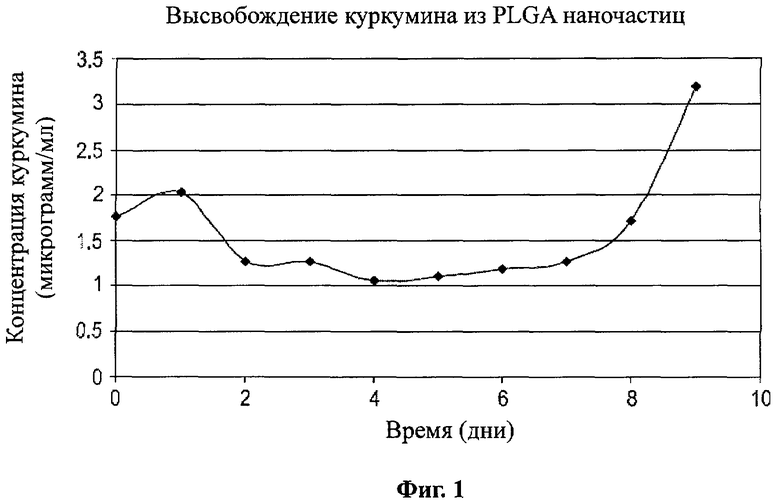
Фигура 1 является графиком, на котором показано высвобождение куркумина из наночастиц PLGA;
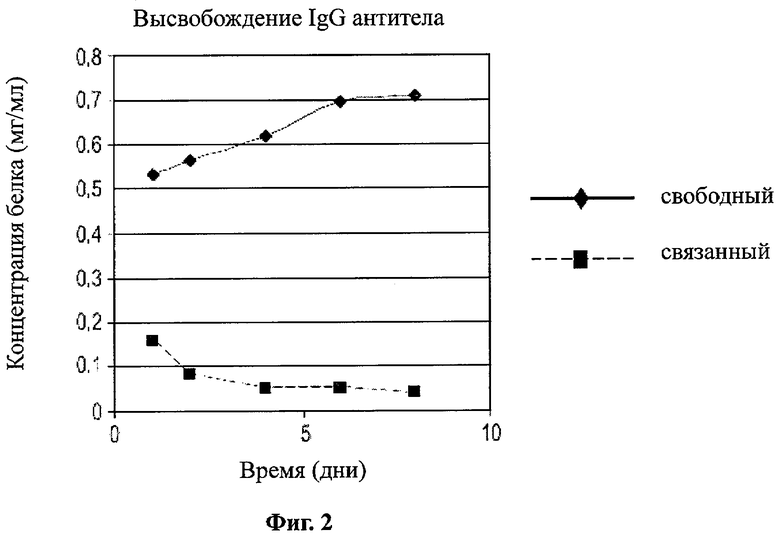
Фигура 2 является графиком колориметрического анализа высвобождения антител из активированных наночастиц;
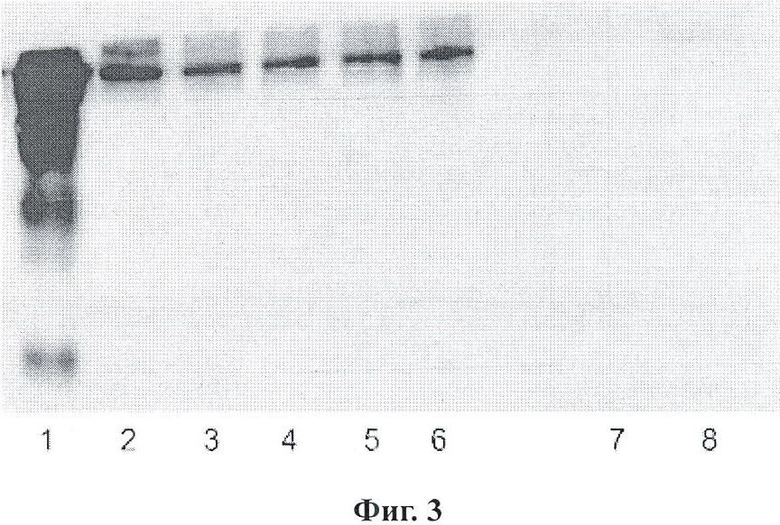
Фигура 3 является вестерн-блоттингом фракции наночастиц из конъюгированных с IgG наночастиц;
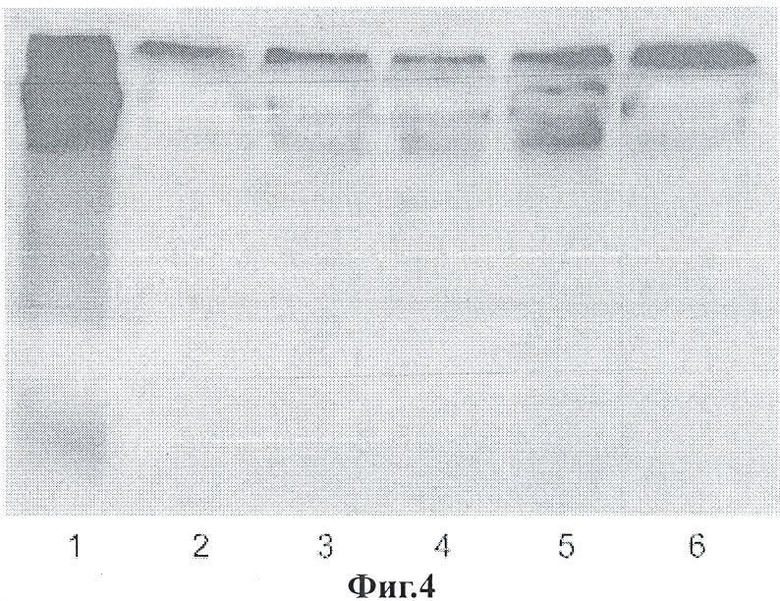
Фигура 4 является вестерн-блоттингом фракции супернатанта из конъюгированных с IgG наночастиц;
Фигура 5 является микроизображением трансмиссионного электронного микроскопа (ТЕМ) активированных бис(сукцинимидил) субератом (BS3) наночастиц PLGA, конъюгированных с антителом к мышиному Thy-1;
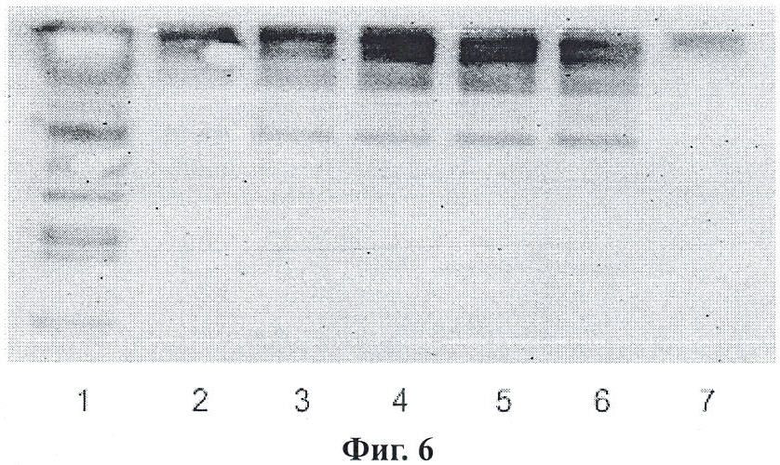
Фигура 6 является вестерн-блоттингом наночастиц, меченых Thy-1;
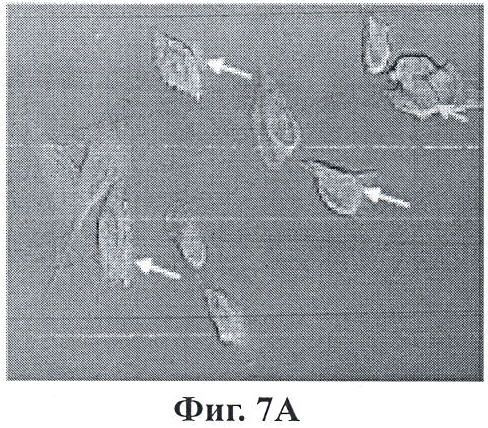
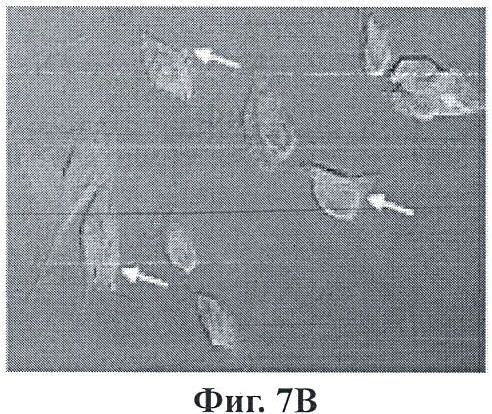
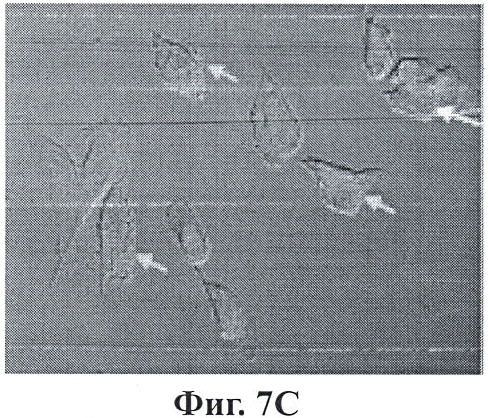
Фигуры 7А-7С являются микроизображениями ретинальных пигментных эпителиальных клеток, на которых воздействовали конъюгированными с Thy-1 наночастицами;
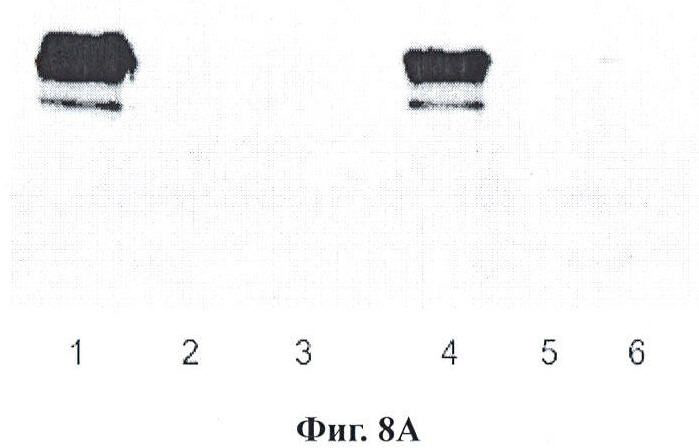
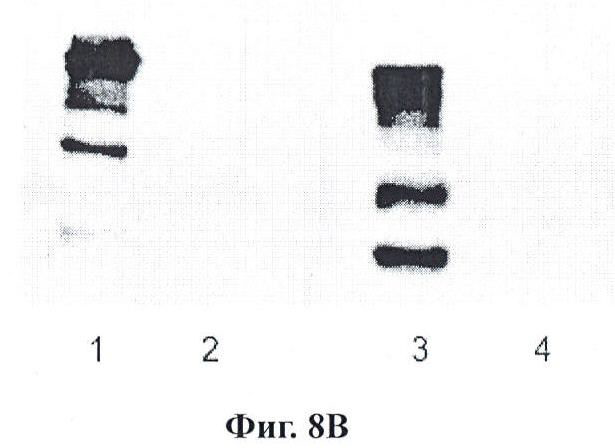
Фигуры 8А и 8В являются вестерн-блоттингами вариации перекрестно сшитых реагентов по данному изобретению;
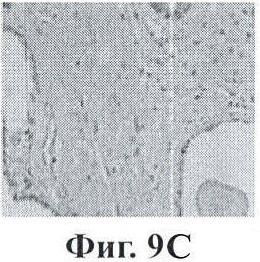
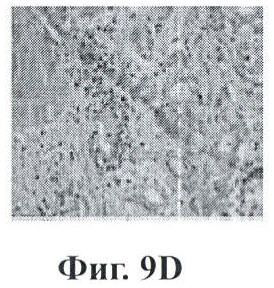
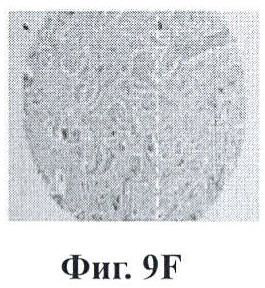
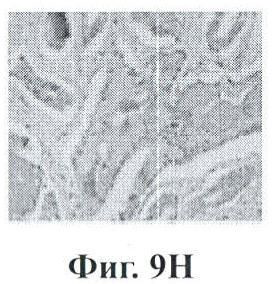
Фигуры 9А-9Н показывают экспрессию PSMA (простатический специфический мембранный антиген) в срезах ткани человеческой простаты с помощью данного изобретения;
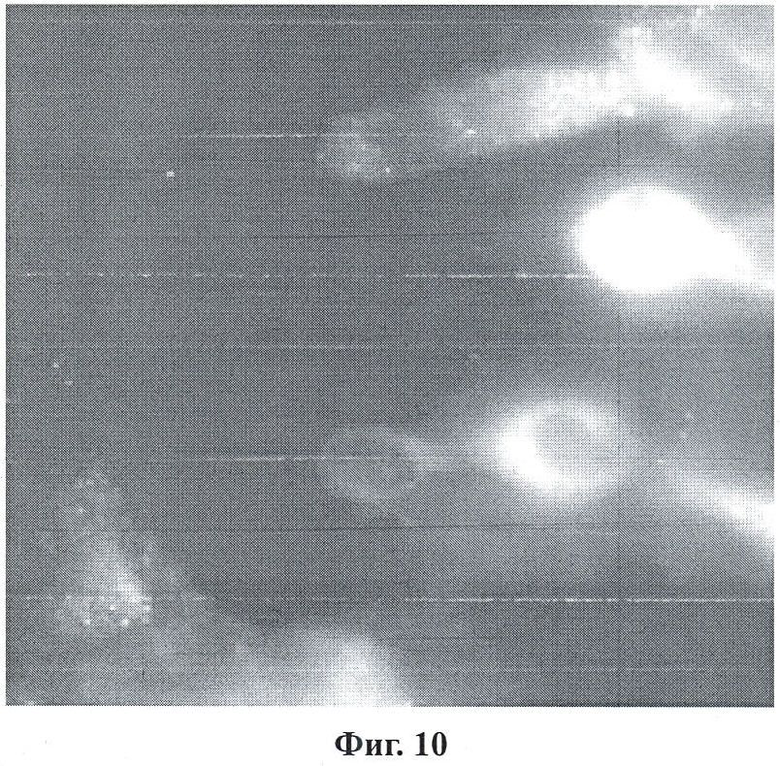
Фигура 10 является TIRF-анализом (анализ полного внутреннего отражения с флуоресценцией) специфичности ферментированного антитела к PSMA мыши в условиях совместного культивирования с помощью данного изобретения; и
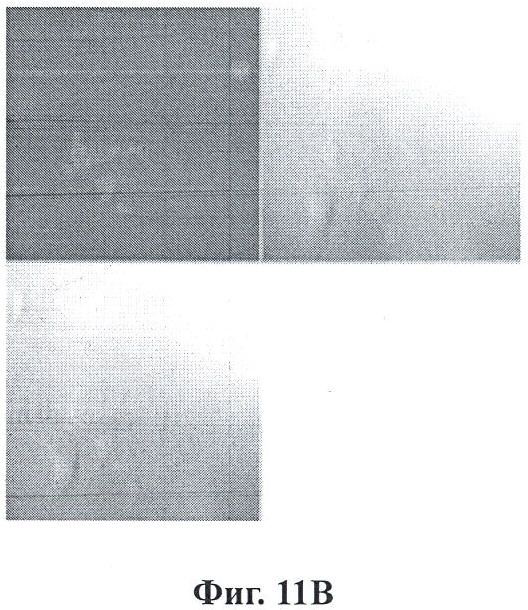
Фигуры 11А и 11В показывают нацеленные на PSMA наночастицы, которые проявляют предпочтительное внедрение в клетки LNCaP C4-2 через клетки РС-3 с помощью данного изобретения.
Детальное описание изобретения
Несмотря на то что создание и применение различных вариантов осуществления данного изобретения обсуждаются подробно ниже, нужно признать, что данное изобретение приводит множество применимых изобретательских замыслов, которые можно воплотить в большом разнообразии определенных контекстов. Определенные варианты осуществления, обсуждаемые в данном документе, всего лишь иллюстрируют определенные способы осуществления и применения данного изобретения и не ограничивают объем данного изобретения.
Для облегчения понимания данного изобретения ниже определен ряд выражений. Определяемые в данном документе выражения имеют значения, которые обычно понимаются рядовым специалистом в областях, имеющих отношение к данному изобретению. Формы единственного числа, как подразумевается, не означают только отдельную единицу, но включают общий класс, в котором определенный пример можно применять для иллюстрации. Терминологию в данном документе применяют для описания определенных вариантов осуществления данного изобретения, но ее применение не ограничивает данное изобретение, за исключением изложенного в формуле изобретения.
Детализирована методология составления активированных, загруженных куркумином наночастиц для вторичной конъюгации биологически активных средств (т.е. антител).
В таблице 1 (ниже) показаны параметры состава для создания загруженных куркумином наночастиц. Наночастицы изготовили с применением этанола или метанола в качестве осадителя. Наблюдается снижение эффективности загрузки при возрастании концентрации куркумина. Присутствует минимальное изменение размера наночастиц. Включение активного средства не влияет на размер или несущую способность наночастиц.
Фигура 1 является графиком, который показывает скорость высвобождения куркумина из наночастиц PLGA. 9 мг/мл загруженных куркумином наночастиц распределили в пробирки Эппендорфа и поместили на портативный рашпер при 37°C (окончательная концентрация наночастиц 1 мг/мл на пробирку). Ежедневные измерения проводили в течение 9 дней. Концентрацию куркумина определяли по абсорбции при 430 нм.
Фигура 2 является графиком колориметрического анализа высвобождения антител из активированных наночастиц. 5 мг/мл активированных наночастиц конъюгировали с мышиным IgG. 1 мг аликвоты распределили в 1,5 мл пробирки Эппендорфа и поместили на портативный рашпер при 37°C. В моменты времени 1, 3, 5, 7 и 9 дней аликвоты извлекли для анализа. Видно, что присутствие антител в супернатанте (фракция свободных антител) возрастает за данный период времени. Видно, что присутствие антител во фракции наночастиц (связаных нековалентно с наночастицей) снижается.
Фигура 3 является вестерн-блоттингом фракции наночастиц из конъюгированных с IgG наночастиц. Дорожка 1 представляет нативный денатурированный IgG мыши. Дорожки 2-6 представляют конъюгированные с IgG наночастицы, исходя из моментов времени 1, 3, 5, 7 и 9 дней, соответственно. Дорожка 7 представляет неактивированные наночастицы. Дорожка 8 представляет неконъюгированные активные наночастицы.
Фигура 4 также является вестерн-блоттингом фракции супернатанта (свободного антитела) из конъюгированных с IgG наночастиц. Дорожка 1 представляет нативный денатурированный IgG мыши. Дорожки 2-6 представляют конъюгированные с IgG наночастицы, исходя из моментов времени 1, 3, 5, 7 и 9 дней, соответственно.
Фигура 5 является ТЕМ-изображением активированных В S3 наночастиц PLGA, конъюгированных с антителом к мышиному Thy-1. Наночастицы визуализируют как белые сферические глобулы. Антитело к мышиному Thy-1 визуализировали на поверхности наночастиц путем реакции с антимышиным меченым коллоидным золотом вторичным антителом (выглядит как черные пятна на поверхности наночастиц).
Фигура 6 показывает вестерн-блоттинг меченых Thy-1 наночастиц. Дорожка 1 представляет нативный, денатурированный неконъюгированный мышиный Thy-1, показанный в концентрации 0,5 мг/мл. Дорожки 2-6 представляют повышающуюся концентрацию активированных BS3 наночастиц, с которыми конъюгирован мышиный Thy-1 (11,5, 18,4, 23,0, 27,6, 34,5 мкг наночастиц, соответственно). Наблюдается линейное возрастание в присутствии Thy-1 по мере возрастания концентрации наночастиц. Дорожка 7 представляет активированные наночастицы, указывая на миграцию наночастиц в гель. Наличие одного бэнда указывает на способность активированных наночастиц к избирательному конъюгированию с вторичным мышиным антителом с HRP (пероксидаза хрена).
Фигуры 7А-7С показывают эффекты воздействия конъюгированными с Thy-1 наночастицами на ретинальные пигментные эпителиальные клетки. Наночастицы загрузили сульфородамином 101 для визуализации (красный). Лазерную конфокальную микроскопию с помощью z-stack выполнили с 90 минутной дополнительной экспозицией к нацеленным наночастицам. Фигуры 7А, 7В и 7С представляют поперечные срезы на 8, 10 и 13 микрометров в пределах клеток. Желтые стрелки указывают на места концентрации наночастиц на поверхности клетки (огненно-красные пятна). Синие стрелки указывают на отсутствие этих огненных пятен, поскольку фокальный участок увеличивается или уменьшается.
Материалы. Сополимер(D,L-лактида и гликолида) 50:50; внутривенно (i.v.) 1,13 дл/г приобрели у Absorbable Polymers International (Pelham, AL). Поли(виниловый спирт), молекулярный вес 30000-70000, сульфородамин 101, этанол, метанол и хлороформ приобрели у Sigma-Aldrich (St. Louis, Mo.). Куркумин получили в качестве подарка от Dr. Shubash Chauhan, Медицинский центр Южной Дакоты (South Dakota Medical Center). Мышиное антитело к Thy-1 получили в качестве подарка от Dr. Neeraj Agarwal (UNTHSC при Fort Worth, TX). IgG мыши приобрели у Promega (San Louis Obispo, Ca.).
Составление наночастиц. Составление наночастиц выполнили посредством модифицированной методики двойных эмульсий. В данной методике 30 мг сополимера(D,L-лактида и гликолида) (PLGA) сначала растворили в 1 мл хлороформа при 4°C. Одновременно образовали 2 мл 2% вес/объем раствора поли(виниловый спирт) (PVA)/дистиллированная деионизированная вода. После растворения PVA в воде добавили 1 мл этанола или метанола в качестве осадителя к раствору PVA. Затем линкер бис-сульфосукцинимидил суберат (BS3) добавили к раствору PVA/этанол при концентрации 1 мМ и перемешали. Основной раствор 10 мг/мл куркумина образовали растворением куркумина в воде при щелочных условиях, применяя 0,5 М NaOH. Куркумин добавили к раствору PLGA/хлороформ в концентрациях 0,5, 1,0 и 2,0 мг/мл на 150 микролитров водного объема. Образование первичной эмульсии провели путем интенсивного перемешивания раствора куркумин-PLGA / хлороформ в течение 20 секунд, после этого провели обработку ультразвуком с помощью наконечника при 55 Вт в течение 1 минуты на Branson Sonifier модель W-350 (Branson, Danbury, CN). Первичную эмульсию затем добавили к раствору BS3/PVA/этанол с тем, чтобы инициировать образование вторичной эмульсии. Завершение образования вторичной эмульсии выполнили путем встряхивания в течение 20 секунд и обработки ультразвуком с помощью наконечника при 55 Вт в течение 2 минут. Устойчивые активированные наночастицы отобрали в 1,5 мл пробирки Эппендорфа и центрифугировали в течение 5 минут при 18000 g. Откачали хлороформ и супернатант остаточного PVA и посредством обработки ультразвуком с помощью наконечника ресуспендировали частицы в 1 мл PBS (фосфатно-солевой буферный раствор) pH 7,2. После ресуспендирования наночастицы поместили в -80°C на 1 час и лиофилизировали всю ночь. Лиофилизацию проводили в системе ATR FD 3,0 (ATR Inc, St. Louis, МО) под вакуумом 250 микроТорр. После лиофилизации наночастицы хранили при 4°C. После использования наночастицы отвесили в пробирки Эппепдорфа и ресуспендировали в 1 мл PBS pH 7,2.
Используя альтернативные осадители, наблюдали вариации размера при изготовлении наночастиц с этанолом и метанолом в трех концентрациях. Более 90% захвата наблюдали при концентрациях 1 мг/мл или меньше. Также, по-видимому, имеет место сильное взрывное высвобождение. Сделанные наблюдения находятся в соответствии с хорошо известным феноменом касательно высвобождения небольших молекул из нанооболочек на основе сополимера лактида и гликоля.
Конъюгация Thy-1 и IgG с поверхностью наночастицы. К 5 мг ресуспендированных активных наночастиц добавили 250 микролитров мышиного Thy-1 (0,5 мг/мл) и позволили прореагировать в течение ночи при 4°C. Наночастицы потом либо использовали немедленно для изучения, либо замораживали при -20°C, чтобы предотвратить значительное расщепление полимера PLGA.
Для конъюгации мышиного IgG к поверхности частицы 9 мг активированных наночастиц ресуспендировали в PBS pH 7,2. Затем добавили 250 микролитров мышиного IgG (0,2 мг/мл) и позволили прореагировать в течение ночи при 4°C.
Активированную полимерную наночастицу составляли с тем, чтобы использовать в качестве системы доставки целенаправленного активного средства. Эта система позволяет избирательно прикреплять любой нуклеофильный лиганд (антитело, белки рецептора, последовательности локализаций, органические молекулы) к внешней поверхности биоразлагаемой нанооболочки. Нанооболочку делают из сополимера молочной и гликолевой кислот, полимера, одобренного FDA (комиссия по контролю за лекарствами и питательными веществами). Благодаря свойствам нанооболочки можно инкапсулировать плазмидную ДНК, миРНК, белки, небольшие молекулы или химиотерапевтические средства (т.е. паклитаксел и куркумин) для контролируемой внутриклеточной доставки. Можно также изменять параметры состава нанооболочки для контроля конечного размера и скорости доставки активного средства. Нацеливание нанооболочек делает возможной локализацию к пораженным болезнью тканям/клеткам, тем самым минимизируя общую дозу организма. Также возможно пометить радиоизотопом конъюгированные антитела на поверхности наночастицы. Это позволит применять стратегию комбинированного лечения рака с использованием как традиционных радиоизотопов, так и химиотерапевтических средств. Контролируемое высвобождение терапевтических средств позволяет оптимизировать терапевтические стратегии для различных клинических заболеваний.
Композиции и способы по данному изобретению являются гибкими, позволяя пользователю выбирать из ряда растворителей для контроля конечного размера нанооболочки (например, чтобы улучшить для наночастиц свойства поглощения клеткой, довольно хорошо известные специалистам в области наночастиц).
Свойства контролируемого высвобождения получили путем смещения соотношений молочной и гликолевой кислот в полимере (известных специалистам в области наночастиц). Частицы являются стабильными, если ресуспендированы в изотонических буферах в течение ограниченного времени или обезвожены при 4°C неопределенно долгое время.
Данное изобретение отличается от существующих технологий методом, которым нацеливают частицы по данному изобретению. Самым общепринятым способом прикрепления лигандов к полимерным наночастицам является прикрепление путем прививания полиэтиленгликоля (ПЭГ) к полимерным цепям PLGA, получая таким образом сополимер PLGA-PEG. Связывание с молекулами ПЭГ выполняют при помощи стандартных химических соединений с реакционно-способной аминогруппой. Способ по данному изобретению образует активную частицу для прикрепления лиганда путем включения коммерчески доступных линкеров (BS3, Pierce Biotechnology, Rockford, IL.), присутствующих во время формирования вторичной эмульсии. BS3, присутствующий в растворе вторичной эмульсии, изолируют путем гидрофобных/гидрофильных взаимодействий между эмульсией PLGA и стабилизирующим средством PVA, также присутствующим в растворе вторичной эмульсии.
Другим преимуществом композиций и способов по данному изобретению является то, что любая биологически активная молекула с нуклеофильной группой может быть прикреплена к нанооболочкам и/или наночастицам путем реакции с доступной частью N-гидроксисукцинимидного (NHS) сложного эфира (т.е. электрофильной), что ведет к неограниченному диапазону нацеленных частиц для терапевтических целей.
Роль простатического специфического мембранного антигена (PSMA) как клеточного маркера во время развития рака простаты: Простатическим специфическим мембранным антигеном (PSMA) является интегральный мембранный гликопротеин 2 типа, изначально охарактеризованный при помощи моноклональных антител (mAB) 7Е11 в клетках LNCaP. (11, 12) PSMA содержит короткие внутриклеточные сегменты из 18 аминокислот, трансмембранную область, включающую 24 аминокислоты, и обширный внеклеточный С-концевой домен из 706 аминокислот. (13) Однако функциональная роль PSMA в данный момент все еще изучается; структура PSMA является идентичной глютамат карбоксипептидазе и фолат гидролазе I.
PSMA может быть интернализирован после распознания антигена. При корреляции с прогрессией рака простаты PSMA сильно экспрессируется в доброкачественном гроздевидном секреторном эпителии, PIN (внутриэпителиальной неоплазии простаты) и адепокарциноме простаты. Исследование уровней экспрессии PSMA обнаружили, что экспрессия наиболее высока при PIN высокой степени и при HRPC (гормоно-невосприимчивых раках простаты). Таким образом, по мере развития рака простаты экспрессия PSMA, как было показано, возрастает, делая привлекательным вариантом лечения применение целенаправленного терапевтического средства для лечения рака простаты на основе PSMA. Важным фактором, связанным с экспрессией PSMA, является то, что PSMA, как было обнаружено, экспрессируется только на опухоль-ассоциированных новообразованных сосудах, а не на нормальных здоровых сосудах. Также была продемонстрирована согласованная экспрессия PSMA и VEGF (фактором роста эндотелия сосудов). Экспрессия PSMA также наблюдалась на сосудистом эндотелии или других солидных опухолях, например, груди, легкого, яичника, почки, мочевого пузыря или кишечного тракта.
Варианты лечения рака простаты: после повышения уровней PSA (простатического специфического антигена) в сыворотке крови и постановки диагноза рака простаты начинается клиническое вмешательство. Основной формой вмешательства является применение терапий с целью андрогенной абляции. В то время как было показано, что эти терапии значительно уменьшают объем опухоли, часто происходит рецидив рака простаты до гормон-невосприимчивого состояния. Традиционные химиотерапевтические средства также использовались при лечении рака простаты. Как было показано, талидомид дает клинически эффективные результаты. Однако существует комбинированная терапия с использованием талидомида с таксанами, например, паклитакселем, которая показала более заметное уменьшение роста опухоли простаты. Недостатком использования талидомида и паклитаксела, однако, является его ограниченная растворимость в воде. Это требует более высоких доз терапевтических средств, чтобы они могли служить в качестве эффективных средств против различных форм рака простаты. Недавно было показано, что доцетаксел является эффективным вариантом лечения рака простаты. Привлекательным свойством доцетаксела является значительно повышенная растворимость в воде. Использование наночастиц в качестве векторов доставки может быть легко реализовано для наночастиц, загруженных или отдельными химиотерапевтическими средствами, или комбинированным химиотерапевтическим средством из двух соединений (например, преднизон и таксаны). В исследованиях, проведенных Sahoo et al., конъюгация трансферрина к наночастицам, содержащим паклитаксел, продемонстрировала пятикратное снижение в показателе IC50.
Также провели исследование по применению терапий антителами на основе PSMA. Радиоактивное мечение PSMA для лечения метастатического рака простаты продемонстрировало отсутствие системной цитотоксичности и способность локализоваться in vivo, а также в костные места метастазирующей опухоли. Показано, что PSMA-антитела, конъюгированные к токсинам, быстро интернализовались и уничтожили опухоли простаты у мышей без наблюдений токсичности. Таким образом, сочетанный эффект наночастиц, загруженных доцетакселем и нацеленных на места сосудистой системы опухоли с помощью PSMA, предоставляет привлекательное средство для лечения рака простаты.
Таблица 2 включает различные структуры, линкеры, активные средства, функциональность по данному изобретению.
ПАТЕНТ
дил) суберат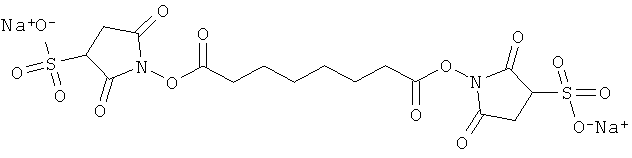
рин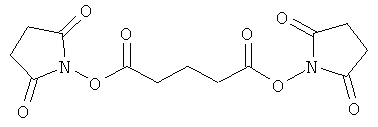
ПАТЕНТ
ты сделаны из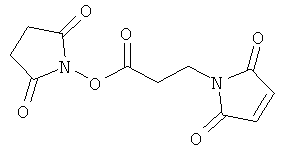
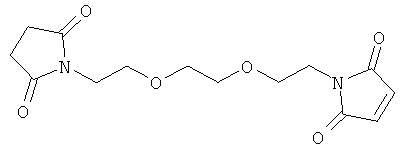
вый эфир пальметиновой кислоты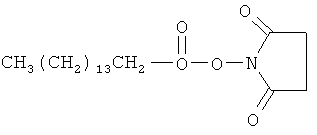
но
Фигура 8 - это вестерн-блоттинг для вариации линкера. Секция А, дорожка 1 представляет использование DSG (дисукцинимидила глутарата) (водорастворимый; гомо-бифункциональный аминореактив) для избирательного прикрепления мышиного антитела к р21. Дорожка 2 представляет активированные DSG наночастицы в условиях реакции блокирования, причем поддающийся определению бэнд отсутствует. Дорожка 3 представляет реакцию с вторичным HRP-антителом, применяемым для обнаружения реакции проконъюгировавших (оригинальное изображение отображает блеклый бэнд). Дорожка 4 представляет слияние EGS (этиленгликольбис(сукцинилмидилсукцинат)) (водорастворимый, гомо-бифункциональный аминореактив) для прикрепления мышиного антитела к аннексину А2. Дорожка 5 демонстрирует активированные EGS наночастицы в условиях реакции блокирования. Дорожка 6 представляет активированные EGS наночастицы, реагирующие с мышиным вторичным HRP, применяемым для определения. Секция В: Дорожка 1 представляет применение BMPS (N-[β-малеимидопропилокси]сукцинимидовый эфир) (водонерастворимый, гетеро-бифункциональный для аминов и сульфгидрилов) для конъюгации мышиного цитохрома С. Дорожка 2 - это аминоблокированные, активированные BMPS наночастицы. Дорожка 3 представляет EMCS ((N-[e-малеимидокапроилокси]сукцинимидовый эфир) (водорастворимый; гетеро-бифункциональный для аминов и сульфгидрилов) для конъюгации антитела к рецептору 2 VEGF (фактор роста эндотелия сосудов) кролика. Дорожка 4 отображает блокированные, активированные EMCS наночастицы. В случае примеров BMPS и EMCS, вследствие наличия только одного аминного реакционно-способного участка не представляется возможным видеть наличие реакции с вторичным HRP по причине степени реакции с данным нацеливающим антителом. Повышение концентрации активированных наночастиц позволило бы визуализировать активированную наночастицу саму по себе.
Фигура 9 представляет собой экспрессию PSMA в срезах ткани человеческой простаты. Стекла с биочипами для человеческой простаты зондировали с помощью мышиного антитела к PSMA. Секции А и В представляют высокие значения по шкале Глисона для нормальных и пораженных раком областей, соответственно. Изображения с более высоким увеличением данных образцов тканей показаны на секциях С и D. Секции Е и F представляют низкие значения по шкале Глисона для нормальных и пораженных раком областей, соответственно. Изображения с более высоким увеличением данных секций показаны на секциях G и Н. Очевидно, что экспрессия PSMA ограничена раковыми, а не нормальными участками опухолевого образования, и что по мере повышения значения по шкале Глисона наблюдается большая экспрессия PSMA.
Фигура 10 представляет собой TIRF-анализ (анализ полного внутреннего отражения с флуоресценцией) специфичности ферментированных антител к PSMA мыши в условиях совместного культивирования. Клетки РС-3 совместно культивировали с клетками LNCaP C4-2, фиксировали для иммуноцитохимии. Как можно увидеть на изображении, присутствует значительная клеточная реактивность для клеточной линии LNCap C4-2 и очень ограниченная перекрестная реактивность с клетками PC-3. Для данного исследования не предпринимали никаких шагов для клеточной пермеабилизации.
Фигура 11 представляет собой изображение предпочтительного поглощения нацеленных на PSMA наночастиц клетками LNCaP C4-2 над клетками PC-3. Секция А: нацеленные на PSMA наночастицы были загружены сульфородамином 101 (красный) и подвергли воздействию совместной культуры клеток PC-3 и LNCaP C4-2 в течение 30 минут при постоянном качательном движении. Образцы фиксировали в параформальдегиде и визуализировали при помощи лазерной конфокальной микроскопии. Клетки PC-3 указаны желтыми стрелками, клетки LNCaP C4-2 указаны зелеными стрелками. Очевидно, что существует предпочтительное поглощение нацеленных наночастиц клеточной линией LNCaP C4-2. Секция В: активированные наночастицы, загруженные сульфородамином 101, блокировали, чтобы предотвратить прикрепление лиганда, и подвергли воздействию идентичными условиями совместной культуры, как и в секции А. Не было видимой разницы в клеточном поглощении либо PC-3, либо LNCaP C4-2 клетками.
Предполагается, что любой вариант осуществления, обсуждаемый в данном описании, может быть реализован в отношении любого способа, набора, реагента или композиции данного изобретения и наоборот. Более того, композиции данного изобретения могут быть использованы для реализации способов данного изобретения.
Будет понятно, что описанные в данном документе конкретные варианты осуществления показаны с целью иллюстрации, а не в качестве ограничения данного изобретения. Основные признаки данного изобретения могут быть применены в различных вариантах осуществления без отступления от объема данного изобретения. Специалисты данной области оценят или смогут убедиться с помощью не более, чем общепринятого эксперимента во множестве эквивалентов конкретным, описанным в данном документе процедурам. Эти эквиваленты рассматривают как находящиеся в объеме данного изобретения и охватываемые формулой данного изобретения.
Все публикации и патентные заявки, упомянутые в описании, характерны для уровня знаний специалиста в данной области, к которой относится данное изобретение. Все публикации и патентные заявки включены в данном документе в виде ссылок в таком же объеме, как если бы каждая конкретная публикация или патентная заявка была конкретно и отдельно указана как необходимая для включения в виде ссылки.
Выражение «включающий», используемое в единственном числе в формуле изобретения и/или в описании, может обозначать «один», но также согласуется со значением «один или несколько», «по меньшей мере один» и «один или более одного». Выражение «или» в формуле изобретения используется для обозначения в качестве «и/или», если явно не указано как обозначающее только альтернативы, или альтернативы являются взаимоисключающими, хотя раскрытие совместимо с определением, которое относится только к альтернативам и «и/или». Во всей данной заявке выражение «приблизительно» используют, чтобы обозначить, что величина включает естественное отклонение ошибки для устройства, применяемого способа для определения значения, или отклонение, которое существует среди объектов изучения.
При использовании в данном описании и формуле изобретения слов «заключающий» (и любой его формы, например, «заключают» и «заключает»), «имеющий» (и любой его формы, например, «имеют» и «имеет»), «включающий» (и любой его формы, например, «включает» и «включают») или «содержащий» (и любой его формы, например, «содержит» и «содержат») являются охватывающими и допускающими изменения, и не исключают дополнительные, неуказанные элементы или этапы способа.
Используемое в данном документе выражение «или их комбинации» относится ко всем сочетаниям и комбинациям перечисленных объектов, предшествующих выражению. Например, «А, В, С или их комбинации» должны включать по меньшей мере один из А, В, С, АВ, АС, ВС или АВС, и если порядок важен в конкретном контексте, также ВА, СА, СВ, СВА, ВСА, АСВ, ВАС или CAB. В продолжении данного примера определенно включенными являются комбинации, которые содержат повторы одного или нескольких объектов или выражений, например, ВВ, ААА, MB, ВВС, АААВСССС, СВВААА, САВАВВ и так далее. Специалист в данной области поймет, что, как правило, не существует ограничения по числу объектов или выражений в любой комбинации, если иное не следует из контекста.
Все композиции и/или способы, раскрытые и заявленные в данном документе, могут быть выполнены и осуществлены без лишних экспериментов в свете данного раскрытия. Несмотря на то что композиции и способы по данному изобретению описаны через призму предпочтительных вариантов осуществления, для специалиста данной области будет очевидно, что можно применять вариации к композициям и/или способам и в этапах или в последовательности этапов способа, описанным в данном документе, без отступления от идеи, сущности и объема данного изобретения. Все эти подобные замены и модификации, очевидные для специалистов данной области, подразумевают относящимися к сущности, объему и идее данного изобретения, которые определяются прилагающейся формулой изобретения.






Данное изобретение включает композиции и способы получения активированной полимерной наночастицы для целенаправленной доставки лекарственного средства. Наночастица включает биосовместимый полимер и амфифильное стабилизирующее средство, нековалентно связанное с линкером, который включает, по меньшей мере, один электрофил, избирательно реагирующий с любым нуклеофилом на нацеливающем средстве, и размещает нацеливающее средство на внешней поверхности биоразлагаемой нанооболочки, при этом активное средство загружают в нанооболочку. Биосовместимый полимер включает один или несколько сложных полиэфиров, выбранных из группы, содержащей полимолочную кислоту, полигликолевую кислоту, сополимер молочной и гликолевой кислот и их комбинации. Амфифильное стабилизирующее средство включает полиол. Активное средство представляет собой противораковое лекарственное средство, в предпочтительном случае, куркумин. Изобретение обеспечивает доставку терапевтического средства к месту действия. 3 н. и 24 з.п. ф-лы, 11 ил., 2 табл.
1. Активированная полимерная наночастица для целенаправленной доставки активного средства, которая включает
биосовместимый полимер и амфифильное стабилизирующее средство, которое нековалентно связано с линкером, содержащим по меньшей мере один электрофил, который избирательно реагирует с нуклеофильным средством на нацеливающем средстве со связыванием нацеливающего средства с наружной поверхностью биоразлагаемой нанооболочки, где биосовместимый полимер включает один или несколько сложных полиэфиров, выбранных из группы, содержащей полимолочную кислоту, полигликолевую кислоту, сополимер молочной и гликолевой кислот и их комбинации;
где амфифильное стабилизирующее средство включает полиол;
где активное средство загружают в нанооболочку,
где активное средство представляет собой средство, выбранное из по меньшей мере противоракового лекарственного средства, антибиотика, противовирусного средства, противогрибкового средства, противоглистного средства, питательного вещества, небольшой молекулы, химиотерапевтического средства, белка, радиоактивной метки, антиоксиданта и антитела.
2. Наночастица по п.1, где амфифильным стабилизирующим средством является полиол.
3. Наночастица по п.1, амфифильное стабилизирующее средство содержит полиол, выбранный из группы, включающей поливиниловый спирт, полиэтиленгликоль, полипропиленгликоль, полипропилендиол, политетрагидрофуран или трехблочные сополимеры поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид)(РЕО-РРО-РЕО).
4. Наночастица по п.1, где нанооболочка инкапсулирует активное средство.
5. Наночастица по п.1, где композицию нанооболочки применяют для контроля конечного размера и скорости доставки активного средства.
6. Наночастица по п.1, где нацеливающее средство избирательно нацеливает нанооболочку на пораженные заболеванием ткань/клетки, тем самым минимизируя общую дозу для организма.
7. Наночастица по п.1, где нанооболочка, загруженная активным средством, сочетает традиционные радиоизотопы и химиотерапевтическое средство.
8. Наночастица по п.1, где нанооболочка адаптирована для контролируемого высвобождения активных средств путем предопределения полимерных соотношений молочной и гликолевой кислот в полимере.
9. Наночастица по п.1, где линкер является гомофункциональным, гетерофункциональным, многофункциональным, с одним реакционным центром, с двумя активными реакционными центрами или со множественными активными реакционными центрами, водорастворимым, водонерастворимым или частично водорастворимым.
10. Наночастица по п.1, где линкер определяют далее как включающий линкеры со множеством длин.
11. Наночастица по п.1, где нацеливающее средство выбрано из группы, включающей антитело, небольшую молекулу, пептид, углевод, миРНК, белок, нуклеиновую кислоту, аптамер, вторую наночастицу, цитокин, хемокин, лимфокин, рецептор, липид, лектин, черный металл, магнитную частицу, линкер, изотоп и их комбинации.
12. Наночастица по п.1, где активное средство включает куркумин или куркуминоид.
13. Способ создания нацеливаемой, загружаемой наночастицы, при котором:
формируют первую эмульсию, которая включает биосовместимый полимер в первом растворителе и активное средство;
готовят второй раствор, который включает амфифильное стабилизирующее средство в воде, осадитель и линкер, включающий по меньшей мере один электрофил;
формируют вторую эмульсию путем смешивания первой эмульсии и второго раствора с образованием активированных загруженных наночастиц с нековалентно связанными линкерами;
отделяют активированные загруженные наночастицы; и
связывают нацеливающее средство с частицей на одном или нескольких электрофилах на нековалентно связанных линкерах,
где активное средство выбрано из по меньшей мере противоракового лекарственного средства, антибиотика, противовирусного средства, противогрибкового средства, противоглистного средства, питательного вещества, небольшой молекулы, миРНК, антиоксиданта и антитела.
14. Способ по п.13, где линкер является гомофункциональным, гетерофункциональным, многофункциональным, с одним реакционным центром, с двумя активными реакционными центрами или со множественными активными реакционными центрами, водорастворимым, водонерастворимым или частично водорастворимым.
15. Способ по п.13, где линкер определяют далее как включающий линкеры со множественными длинами.
16. Способ по п.13, где нацеливающее средство выбирают из антитела, небольшой молекулы, пептида, углевода, белка, нуклеиновой кислоты, аптамера, второй наночастицы, цитокина, хемокина, лимфокина, рецептора, липида, лектина, черного металла, магнитной частицы, линкера, изотопа и их комбинаций.
17. Способ по п.13, где активное средство включает куркумин или куркуминоид.
18. Способ по п.13, где нанооболочка включает по меньшей мере одно из сложного полиэфира и/или амфифильного стабилизирующего средства.
19. Способ по п.13, где сложным полиэфиром является полимолочная кислота, полигликолевая кислота, сополимер молочной и гликолевой кислот и их комбинации.
20. Способ по п.15, где амфифильным стабилизирующим средством является полиол.
21. Способ по п.15, где полиолом является по меньшей мере одно из поливинилового спирта, полиэтиленгликоля, полипропиленгликоля, полипропилендиола, политетрагидрофурана или трехблочного сополимера поли(этиленоксид)-поли(пропиленоксид)-поли(этиленоксид)(РЕО-РРО-ЕО).
22. Способ по п.13, где нанооболочка инкапсулирует активное средство для контролируемой внутриклеточной доставки.
23. Способ по п.13, где композицию нанооболочки применяют для контроля конечного размера и скорости доставки активного средства.
24. Способ по п.13, где нацеливающее средство избирательно нацеливает нанооболочку на пораженные заболеванием ткань/клетки, тем самым минимизируя общую дозу для организма.
25. Способ по п.13, где нанооболочка, загруженная активным средством, сочетает традиционные радиоизотопы и химиотерапевтическое средство.
26. Способ по п.13, где нанооболочку адаптируют для контролируемого высвобождения активных средств путем предопределения соотношений молочной и гликолевой кислот в полимере.
27. Фармацевтическое средство, которое включает активированную полимерную наночастицу для целенаправленной доставки активного средства, включающую биосовместимый полимер и амфифильное стабилизирующее средство, которое нековалентно связано с линкером, содержащим по меньшей мере один электрофил, который избирательно реагирует с нуклеофилом на нацеливающем средстве со связыванием нацеливающего средства с наружной поверхностью биоразлагаемой нанооболочки, где активное средство загружено в нанооболочку и дополнительно включает фармацевтически приемлемый носитель.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СРЕДСТВО, СПОСОБ ПОЛУЧЕНИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ОРГАНОВ МАЛОГО ТАЗА И ЗАБОЛЕВАНИЙ ПРЯМОЙ КИШКИ | 2004 |
|
RU2288735C2 |
| RU 2001109448 A, 10.02.2002 | |||
| US 4767628 A, 30.08.1988. | |||
Авторы
Даты
2013-01-27—Публикация
2008-04-11—Подача