Область техники, к которой относится изобретение
Настоящее изобретение относится к полипептиду с активностью липолитического фермента и способу его получения.
Уровень техники
В WO 8802775 описывается липаза B из Candida antarctica (CALB). В работе Uppenberg, Hansen, Patkar, Jones, Structure 2, 293-308 (1994) описывается аминокислотная последовательность и трехмерная структура (3D) CALB. 3D-структура представлена также в банке данных белковых структур (Research Collaboratory for Structural Bioinformatics Protein Data Bank) (RCSB PDB) (http://www.rcsb.org/), идентификационный код 1TCA.
Варианты CALB описаны в работах: Zhang et al. Prot. Eng. 2003, 16, 599-605; Lutz. 2004, Tetrahedron: Asymmetry, 15, 2743-2748; Qian and Lutz, JACS, 2005, 127, 13466-13467; а также в WO 2004/024954.
В WO 9324619 описывается липаза из Hyphozyma sp. Аминокислотные последовательности для других липаз можно найти в банке данных UniProt [the Universal Protein Resource] с кодами доступа Q4pep1, Q7RYD2, Q2UE03, Q4WG73, Q6BVP4 и Q4HUY1.
Сущность изобретения
Авторы изобретения проводили симуляцию молекулярной динамики (MD) на структуре 1TCA. Этот анализ выявил два ранее неизвестных lid с высокой мобильностью: Lid1, состоящий из остатков от 135 или 136 до 155 или 160, и Lid2, состоящий из остатков 267-295. Симуляция выявила наличие более закрытой формы в водном растворе и более полно открытой формы в растворе органического растворителя. Этот анализ выявил в 3D-структуре важные области для воздействия на активность и функционирование липазы. Авторы данного изобретения использовали полученные результаты для создания вариантов липолитического фермента с увеличенной специфической активностью, особенно в отношении громоздких (bulky) субстратов (например, эфиров кислоты с разветвленной цепью или длинноцепочечной жирной кислоты, и/или вторичного спирта), и/или увеличенной активностью при высоких значениях pH (более высокого pH-оптимума), и/или повышенной энантиоселективностью.
Кроме того, авторы изобретения выделили аминокислотные остатки и сконструировали варианты липолитического фермента, основываясь на методе выравнивания последовательности CALB с некоторыми гомологичными липазными последовательностями.
Таким образом, в данном изобретении представлен способ получения полипептида, заключающийся в:
a) отборе родительского полипептида, обладающего активностью липолитического фермента, с аминокислотной последовательностью, по меньшей мере, на 30% идентичной CALB (SEQ ID NO:1);
b) отборе одного или более аминокислотных остатков в этой последовательности, соответствующих любому из остатков 1, 13, 25, 38-51, 53-55, 58, 69-79, 91, 92, 96, 97, 99, 103, 104-110, 113, 132-168, 173, 187-193, 197-205, 215, 223-231, 242, 244, 256, 259, 261-298, 303, 305, 308-313 или 315 последовательности CALB (SEQ ID NO:1);
c) изменении отобранной аминокислотной последовательности, которое состоит из замещения или делеции выбранного остатка(ов) или вставки, по меньшей мере, одного остатка, примыкающего к выбранному остатку(ам);
d) получении измененного полипептида с измененной аминокислотной последовательностью;
e) определении активности липолитического фермента или энантиоселективности по отношению к связям эфира карбоновой кислоты измененного полипептида; и
f) отборе измененного полипептида, обладающего более высокой активностью липолитического фермента или более высокой энантиоселективностью, чем родительский полипептид.
В данном изобретении также предоставлен полипептид, который:
a) обладает активностью липолитического фермента; и
b) содержит аминокислотную последовательность, которая, по меньшей мере, на 80% идентична (в том числе, по меньшей мере, на 90% или, по меньшей мере, на 95%
идентична) CALB (SEQ ID NO:1) и имеет отличие от CALB (SEQ ID NO:1), включающее аминокислотную замену, делецию или вставку в положении, соответствующем любому из остатков 1, 13, 25, 38-51, 53-55, 58, 69-79, 91, 92, 96, 97, 99, 103, 104-110, 113, 132-168, 173, 187-193, 197-205, 215, 223-231, 242, 244, 256, 259, 261-298, 303, 305, 308-313 или 315.
Наконец, в данном изобретении предусматривается использование указанного выше варианта полипептида в процессе, катализируемом липазой.
Краткое описание чертежей
На фиг.1 показано выравнивание аминокислотных последовательностей SEQ ID NO: 1-7.
Подробное описание изобретения
Родительский полипептид
Родительский полипептид обладает активностью липолитического фермента, а его аминокислотная последовательность, по меньшей мере, на 30% идентична (в том числе, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%) липазе B из Candida antarctica (CALB, SEQ ID NO:1), которая описана в WO8802775, и последовательность которой представлена в работе Uppenberg, J., Hansen, M. T., Patkar, S., Jones, T.A., Structure v2 pp.293-308, 1994. Родительским полипептидом может быть любая из нижеследующих липаз. Выравнивание последовательностей показано на фиг.1.
SEQ ID NO:1: липаза B из Candida antarctica (CALB), 1TCA
SEQ ID NO:2: Hyphozyma sp., WO 9324619
SEQ ID NO:3: Ustilago maydis, UniProt Q4pep1
SEQ ID NO:4: Gibberella zeae (Fusarium graminearum), UniProt Q4HUY1
SEQ ID NO:5: Debaryomyces hansenii, UniProt Q6BVP4
SEQ ID NO:6: Aspergillus fumigatus, UniProt Q4WG73
SEQ ID NO:7: Aspergillus oryzae, UniProt Q2UE03
SEQ ID NO:8: липаза из Neurospora crassa, UniProt Q7RYD2
Выравнивание последовательностей было проведено с помощью программы глобального выравнивания (needle program) пакета EMBOSS (http://www.emboss.org) версия 2.8.0 со следующими параметрами: штраф за открытие делеции: 10,00, штраф за продолжение делеции: 0,50, матрица аминокислотных замен: EBLOSUM62. Программное обеспечение описано в пакете EMBOSS: The European Molecular Biology Open Software Suite (2000), Rice, P. Longden, J. and Bleasby, A, Trends in Genetics 16, (6) pp 276-277. Программа needle осуществляет алгоритм глобального выравнивания аминокислотных последовательностей, описанный в работе Needleman, S. B. and Wunsch, C. D. (1970) J. Mol. Biol. 48, 443-453, and Kruskal, J.B. (1983).
Другие родительские полипептиды можно выровнять до последовательностей, представленных на фиг.1, тем же методом или методами, описанными в работе D.Sankoff and J.B.Kruskal, (ed.), Time warps, string edits and macromolecules: the theory and practice of sequence comparison, pp. 1-44 Addison Wesley.
Трехмерная структура (3D) и lid
В 3D-структуре 1TCA авторы изобретения идентифицировали два lid с высокой мобильностью при аминокислотных остатках от 135 или 136 до 155 или 160 (Lid1) и остатках 267-295 (Lid2) последовательности SEQ ID NO:1. MD симуляция показала, что следующие участки представляют особый интерес из-за особенно высокой мобильности: остатки 141-149 в Lid1 и следующие участки в Lid2: 267-269, 272, 275-276, 279-280, 282-283, 286-290.
Выбор аминокислотного остатка
Можно выбрать такой аминокислотный остаток, имеющий неводородный атом в пределах 8Ǻ от неводородного атома остатка в Lid1 или Lid2 в 3D-структуре. Этот критерий позволяет отобрать следующие остатки в структуре 1TCA: 38-51, 53-55, 58, 69-79, 104-110, 113, 132-168, 173, 187-193, 197-205, 223-231, 259, 261-298, 305, 308-313, 315 последовательности SEQ ID NO:1.
В частности, остаток можно выбрать в пределах 6Ǻ от lid, что приводит к выбору следующих остатков в 1TCA: 40-42, 46-51, 54, 58, 70-77, 79, 104-107, 109, 133-165, 167, 173, 187-192, 197-203, 223-225, 228-229, 261-297, 308-312.
Аминокислотный остаток можно выбрать также с помощью выравнивания гомологичных последовательностей липолитического фермента и выбора остатка в положении с вариабельностью, то есть положении, где различные последовательности имеют разные остатки. Таким образом, следующие остатки в последовательности CALB (SEQ ID NO:1) можно отобрать путем сравнения с липазой из Hyphozyma (SEQ ID NO:2), основываясь на выравнивании, показанном на фиг.1: 1, 3, 5, 10, 12-15, 25, 30, 31, 32, 57, 62, 66, 76, 78, 80, 83, 88, 89, 91, 92, 96, 97, 114, 121, 123, 143, 147-149, 159, 163, 164, 168, 169, 174, 188, 194, 195, 197, 199, 205, 210, 214, 215, 221, 223, 229, 238, 242, 244, 249, 251, 254, 256, 261, 265, 268, 269, 272-274, 277-280, 282-284, 287, 303-306, 309, 314, 315, 317.
Следующие остатки представляют особенный интерес: 1, 13, 25, 38, 42, 74, 140, 143, 147, 164, 168, 190, 199, 215, 223, 242, 244, 256, 265, 277, 280, 281, 283, 284, 285, 292, 303, 315 последовательности CALB (SEQ ID NO:1).
Соответствующие остатки в других липазах можно идентифицировать путем выравнивания последовательностей. Выравнивание нескольких последовательностей показано на фиг.1. Другие последовательности можно выровнять известными методами, такими как AlignX (компонент Vector NTI Suite 9.0.0) с использованием стандартных настроек.
Измененная аминокислотная последовательность
Измененная аминокислотная последовательность получена из родительской последовательности с помощью изменения аминокислот в одном или более выбранных положениях, а также, дополнительно, в других положениях. Каждое изменение аминокислоты состоит из замещения или делеции выбранного остатка или вставки, по меньшей мере, одного остатка, примыкающего к выбранному остатку с N- или C-концевой стороны.
Особенные замещения
Следующие изменения в последовательности SEQ ID NO:1 можно необязательно комбинировать:
- K13Q, A25G, P38V,L,S, T42N, N74Q, V78I, Y91S, A92S, N96S, L99V, W104H, D134L,M,N, T138L, L140E, P143S,L, D145S, A146T, L147N,F, A148P, V149P, S150A, W155Q,N, Q157N, T158S, L163F, T164V, R168D, V190IA S197L,G, L199P, V215I, D223G, T229Y, R242A, T244P, T256K, L261A, D265P, P268A, E269Q, L277I, P280V, A281S, A283K, A284N, I285E,D, G288D, N292C,Q, P303K, K308D или V315I.
• Множественные замещения:
ο I258D G288D
ο S197G L199P
ο T164V L163F
ο V190X Q157X
ο A281X W155X
ο D223X A281X
ο D223X I285X
ο A281X I285X
ο A281X W155X A148X
ο D145X K308X K138X
ο D223X A281X I285X
• Вставки: L147FN, G137ASV, V190GAH, L1QL, L1 QGPL
• Делеция: N97*
Исходя из выравнивания, такого, как показано на фиг.1, одна последовательность может использоваться как матрица для изменений в другой последовательности. Таким образом, Lid1 или Lid2 одной последовательности можно заместить соответствующим lid-участком другой последовательности. Следующие варианты сконструированы с помощью изменения Lid1 последовательности CALB с использованием указанного полипептида в качестве матрицы:
• Q7RYD2 (Neurospora crassa) как матрица: Y135F K136H V139M G142Y P143G D145C L147G A148N V149F S150GKVAKAGAPC A151P W155L
• Q4HUY1 (Fusarium graminearum) как матрица: V139I G142N P143I L144G D145G L147T A148G V149L S150IN A151T S153A W155V
• липаза из Hyphozyma sp. как матрица: L140E P143L L147F A148G V149L
• Q4PEP1 (Ustilago maydis) как матрица: V139I L140E P143L D145S A146T L147F A148G V149L S150A A151S P152Q.
Каждый из указанных выше вариантов можно необязательно комбинировать с N292C и/или D223G, и/или A281S, и/или I285E.
Следующие замещения могут быть сделаны в последовательности SEQ ID NO:2 (липаза из Hyphozyma sp.): V192I, Q159N, D136L,M,N, P41V,L, S50A, N45S, W106H.
Номенклатура для аминокислотных замещений
В данном описании аминокислотные замены описаны с использованием однобуквенных кодов, например W155Q. X используется для обозначения замещения любым отличным остатком (например, V190X). Множественные замены объединяются, например, S197G L199P, для обозначения варианта с двумя замещениями. Альтернативы обозначаются с помощью запятых, например, W155Q,N для обозначения замещения W155 с помощью Q или N. Звездочка обозначает делецию. Вставка обозначается как замена одного остатка двумя или более остатками (например, L147FN).
Активность липолитического фермента
Родительский или вариантный полипептиды обладают активностью липолитического фермента (в частности, активностью липазы), то есть они способны осуществлять гидролитическое расщепление связей карбонового эфира для высвобождения карбоксилата (КФ 3.1.1), в частности связей карбонового эфира в триглицеринах (активность липазы триацилглицерина, КФ 3.1.1.3).
Активность фермента может быть выражена как специфическая активность, то есть гидролитическая активность на мг ферментного белка. Количество ферментного белка может определяться, например, из поглощения при 280 нм или с помощью титрования активных центров (AST), как это описано в работе Rotticci et al. Biochim. Biophys. Acta 2000, 1483, 132-140.
Энантиоселективность
Энантиоселективность часто является важным параметров в CaLB-катализируемых реакциях, как в реакциях гидролиза, так и в реакциях синтеза. Субстратом может быть рацемическая смесь двух энантиомеров, или это может быть прохиральная мезо-форма. В обоих случаях часто желателен продукт одного энантиомера. Энантиомерный избыток (ee) определяется путем подсчета количества обоих энантиомеров продукта, а затем вычисления ee = (получаемое количество желаемого энантиомера - количество другого энантиомера)/(сумма обоих количеств). Количественная оценка часто проводится с помощью методов хиральной газовой хроматографии (GC) или высокоэффективной жидкостной хроматографии (HPLC).
Использование варианта липолитического фермента
Вариант липолитического фермента может использоваться для биокатализа в реакции, катализируемой липазой, в реакциях как гидролиза, так и синтеза эфира, например, при синтезе некоторых полимеров. Реакцией, катализируемой липазой, может быть:
a) гидролиз, при котором реактантами являются эфир карбоновой кислоты и вода, а продуктами реакции - свободная карбоновая кислота и спирт,
b) синтез эфира, при котором реактантами являются свободная карбоновая кислота и спирт, а продукт реакции - эфир карбоновой кислоты.
c) алкоголиз, при котором реактантами являются эфир карбоновой кислоты и спирт, а также
d) ацидолиз, при котором реактантами являются эфир карбоновой кислоты и свободная жирная кислота.
Как и CALB, вариант по данному изобретению может, в частности, использоваться в таких прикладных задачах, где важны хемо-, регио-, и/или стереоселективность фермента, стабильность и скорость реакции или способность связывать относительно широкий ранг субстратов. Продукты реакции обычно используются в химической, тонкой химической, фармакологической или агрохимической промышленности, а также в качестве пищевых ингредиентов. Данный вариант может быть иммобилизованным, например, с помощью адсорбции на адсорбционной смоле, такой как полипропилен.
Эфир в реакции, катализируемой липазой, может содержать громоздкую (bulky) кислотную группу или громоздкую (bulky) часть вторичного спирта, например, pNP 2-метилбутират, 6,8-дифлуро-4-метилумбеллиферил октаноат (6,8-difluro-4-methylumbelliferyl octanoate) (DiFMU октаноат) или эфир изопропиловой жирной кислоты (например, C16-C18 жирной кислоты, которая может быть как насыщенной, так и ненасыщенной).
Данный вариант может использоваться так, как это описано для CALB в работах A.J.J.Straathof, S.Panke, A.Schmid. Curr. Opin. Biotechnol. 2002, 13, 548-556; E.M.Anderson, K.M.Larsson, O.Kirk. Biocat. Biotrans, 1998, 16, 181-204; R.A.Gross, A.Kumar, B.Kaira. Chem. Rev. 2001, 101, 2097-2124).
ПРИМЕРЫ
Пример 1: Отбор аминокислотных остатков с помощью метода молекулярной динамики
Проведение симуляций молекулярной динамики показало, что 2 участка являются очень важными для активности липазы B из Candida antarctica, как следует далее.
Для подготовки структуры 1TCA для симуляций обычно использовали CHARMm. Атомы водорода добавляли как к белку, так и к молекулам воды с использованием команды HBUILD. В системе использовались четко определенные молекулы воды, и она была заключена в куб со стороной, равной 90 Ангстрем. Общее количество молекул воды составляет 24630, включая те, что уже присутствуют в структуре 1TCA. Симуляция проводилась при постоянной температуре 300K, постоянном давлении в 1,01325 атмосферы, в течение 20 наносекунд с использованием NAMD. Для поддерживания необходимых значений температуры и давления использовался метод спаривания Берендсена. Затем результаты симуляции анализировались с помощью CHARMm (Ссылки для CHARMM: MacKerell, A. D., Bashford, D., Bellott, M., Dunbrack, R. L., Evanseck, J. D., Field, M. J., Fischer, S., Gao, J., Guo, H., Ha, S., Joseph-McCarthy, D., Kuchnir, L., Kuczera, K., Lau, F. T. K., Mattos, C, Michnick, S., Ngo, T., Nguyen, D. T., Prodhom, B., Reiher, W. E., Roux, B., Schlenkrich, M., Smith, J. C, Stote, R., Straub, J., Watanabe, M., Wiorkiewicz-Kuczera, J., Yin, D., Karplus, M. J. Phys. Chem. B 1998, 102, 3586; MacKerell, A. D., Jr., Brooks, B., Brooks, C. L., Ill, Nilsson, L., Roux, B., Won, Y., Karplus, M. In The Encyclopedia of Computational Chemistry; Schleyer, P. v. R. et al., Eds.; John Wiley & Sons: Chichester, 1998; Vol. 1, p 271 ; Brooks, B. R., Bruccoleri, R. E., Olafson, B. D., States, D. J., Swaminathan, S., Karplus, M. J. Comput. Chem. 1983, 4, 187).
Проведенный анализ выявил ранее неизвестные lid с высокой мобильностью. Было обнаружено, что, если фермент находится в растворе, несколько участков подвижны. Был сделан вывод, что функционирование и специфичность фермента зависят от этой мобильности, и в среде, выбранной для реакций гидролиза или синтеза, обнаруживается специфическая структура. Симуляция показала наличие более закрытой формы в водном растворе и более полно открытой формы в растворе органического растворителя, то есть более схожей с кристаллической структурой в водном растворе, содержащем поверхностно-активное вещество.
С помощью вычисления изотропных среднеквадратичных смещений C-альфа-атомов остатков в CALB при проведении указанной выше симуляции были определены остатки с повышенной мобильностью. Было обнаружено, что мобильными lid-участками являлись остатки 136-160 для Lid1 и остатки 267-295 для Lid2. Был сделан вывод, что остатки, находящиеся в соседних положениях с этими ранее неизвестными lid, влияют на мобильность lid и являются, таким образом, очень важными для активности этого фермента.
Пример 2: Реакции гидролиза
Гидролитическая активность представленных вариантов оценивалась с использованием pNP-бутирата, рацемического pNP 2-метилбутирата и 6,8-дифлуро-4-метилумбеллиферил октаноата (6,8-difluro-4-methylumbelliferyl octanoate) (DiFMU октаноат). Рацемический pNP 2-метилбутират синтезировался в соответствии с методом, описанным в работе J. Biol. Chem. 1971, 246, 6019-6023. DiFMU октаноат, полученный от фирмы «Molecular Probes», был ранее описан в работе Lutz et al. (J. Am. Chem. Soc. 2005, 127, 13466-13467) при проведении анализа CALB. В то время как pNP 2-метилбутират отбирает варианты с улучшенным связыванием субстратов с громоздкой (bulky) кислотной группой, DiFMU октаноат отбирает варианты с улучшенным связыванием субстратов с громоздкой (bulky) спиртовой частью. Реакции проводились в 50-мМ водном фосфатном буфере, при значениях pH 7,0 с добавлением 0,1% Тритона X-100. Кинетика реакции отслеживалась в течение приблизительно 15 мин в титрационных микропланшетах с измерением при 405 нм (pNP) или 350/485 нм (ex/em для DiFMU). Активности были нормализованы на основе A280 фермента.
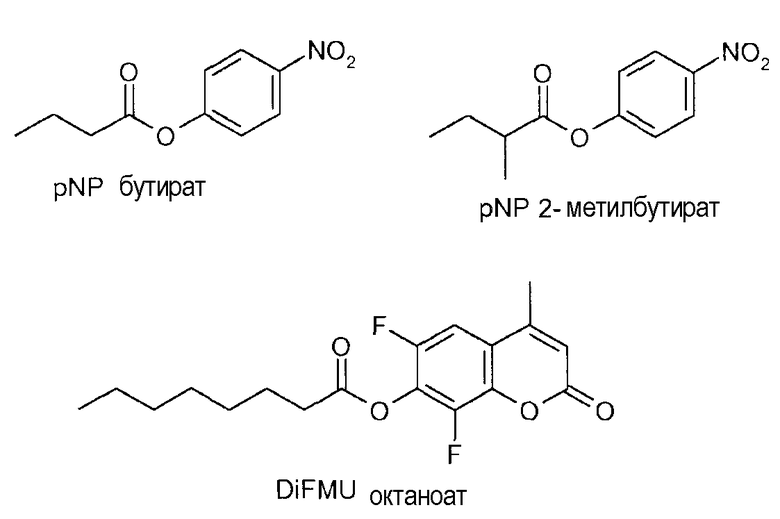
Результаты, представленные ниже, демонстрируют активность для различных субстратов в % от CALB дикого типа.
Эти результаты показывают, что специфическая активность в отношении громоздкого (bulky) субстрата (эфир с разветвленной цепью жирной кислоты) может быть увеличена до 37-кратного значения путем замещения одного выбранного аминокислотного остатка.
Пример 3: Варианты с lid-замещением
Варианты, основанные на CaLB дикого типа (SEQ ID NO:1), конструировались с помощью замещения Lid1 соответствующими остатками липазы из Fusarium (SEQ ID NO:4), липазы из Debaryomyces (SEQ ID NO:5) или липазы из Neurospora (SEQ ID NO:8). Дальнейшие варианты конструировались путем комбинирования вышеуказанного с единичной заменой выбранного остатка (A281S). Результаты представлены как активность в % от активности CALB на том же субстрате.
Эти результаты показывают, что специфическая активность в отношении громоздкого (bulky) субстрата может быть значительно увеличена путем замещения lid одной липазы на lid другой липазы, а в дальнейшем активность можно повысить с помощью комбинирования с единичной заменой выбранного остатка.
Пример 4: Энантиоселективность
Реакции гидролиза проводили в 2-мл колбах, используя в качестве субстрата 2 мМ pNP 2-метилбутират в 0,5 M-буфере фосфата натрия, при значениях pH 7,0 с добавлением 1% Тритона X-100. Реакции останавливали добавлением 2M HCl (0,1 мл), а затем экстрагировали в Et2O (2 мл). После проведения анализа с помощью хиральных GC (Varian CP-Chiralsil-DEX CB 10 m colum, температурная программа от 80 до 180°C при 2°C/мин) вычисляли E (энантиомерное соотношение) по формуле E=ln[eep(1-ees)/(eep+ees)]/ln[eep(1+ees)/(eep+ees)], где ees и eep - это ee (энантиомерный избыток) для субстрата и продукта соответственно. Реакции проводили в триплетах для каждого фермента (останавливали при различных конверсиях), а величину E представляли как среднее значение.
CALB тестировали и сравнивали с вариантом Y135F, K136H, V139M, G142Y, P143G, D145C, L147G, A148N, V149F, S150GKVAKAGAPC, A151P, W155L. В результате были получены значения E=2,4 для варианта и E=1,05 для родительской липазы (CALB). Эти данные показывают, что CALB является почти полностью неселективным, а вариант обладает повышенной энантиоселективностью.
Пример 5: Гидролиз эфира длинноцепочечной жирной кислоты
Для варианта CALB с pNP-лауратом в качестве длинноцепочечного субстрата были определены константы Михаэлиса-Ментен. Эксперименты проводились в 0,5 M-буфере фосфата натрия, при pH 7,0, содержащем 1% Тритон X-100 (для того, чтобы не допустить замутнения растворов при высоких концентрациях субстрата).
Результаты показывают, что данный вариант является в 23 раза активнее, чем родительская липаза на длинноцепочечном субстрате (оценивали как kcat/KM).
Пример 6: Гидролиз изопропилового эфира
Вариант, используемый в предыдущем примере, был также протестирован при проведении гидролиза изопропилпальмитата. Результаты показали, что для варианта степень гидролиза была на 26% выше, чем для CALB. Гидролиз проводили следующим образом.
В качестве субстрата использовался изопропилпальмитат, который добавлялся до концентрации 3 мг/мл в 50 мМ ацетат натрия при значениях pH 5,0 (= буфер), раствор нагревали до 60°C в течение 5 минут, гомогенизировали с помощью Ultra Turrax в течение 45 секунд и использовали сразу после приготовления. Очищенные ферментные препараты разводили до концентрации, соответствующей OD280=0,00016, в обессоленной воде и 10 м.д. (ppm) Тритона X-100. В ПЦР-планшетах смешивали 20 мкл буфера, 60 мкл субстрата и 20 мкл раствора фермента при 800 об/мин в течение 20 секунд. Полученную смесь переносили в ПЦР-термоциклер, где в течение 30 минут проводили реакцию при 30°C, а затем в течение 5 минут при 90°C инактивировали ферменты, после этого в раствор добавляли 20 мкл 10% раствора Тритона X-100 (в обессоленной воде). Количество получаемых жирных кислот определяли с использованием набора NEFA C фирмы «Wako», а результаты вычисляли как среднее из 6 определений с вычитанием бланка фермента.
Пример 7: Активность при высоких значениях pH
Активность липазы двух вариантов CALB измерялась при различных значениях pH при 30°C с использованием трибутирина в качестве субстрата и гуммиарабика в качестве эмульгатора. Результаты представлены в виде относительной активности, считая активность при pH 7,0 равной 100.
Как видно из таблицы, у вариантов наблюдается повышенная активность при щелочных значениях pH (pH 7-9) и более высокий pH оптимум.
Пример 8: Реакции синтеза
Варианты иммобилизовывали на пористом полипропилене (Accurel) с помощью метода физической адсорбции до концентрации 20 мг/г (на основе A280). Реакции проводились в пробирках Eppendorf, количество каждого реагента составляло 1 ммоль, приблизительно 0,8 мл гексана и 5 мг иммобилизированного фермента, при 40°C и 1200 об/мин. Образцы изымались для анализа с помощью методов ЯМР (NMR) и хиральных GC.
Результаты реакции синтеза, в которой реактантами являлись 2-этил-1-гексанол и винилацетат, представлены ниже как конверсия % (ee %):
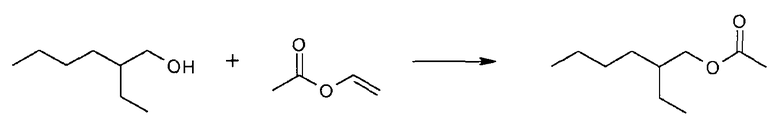
Энантиомерное соотношение подсчитывалось с помощью формулы, приведенной выше. Эти результаты составляли: E=1,9 для липазы родителя (CALB), и E=3,0, и E=3,2 для других двух вариантов. Таким образом, полученные результаты демонстрируют улучшенную энантиоселективность для этих двух вариантов.
Еще один эксперимент был проведен таким же способом, но в качестве реактантов использовали винилбензоат и 1-гексанол.
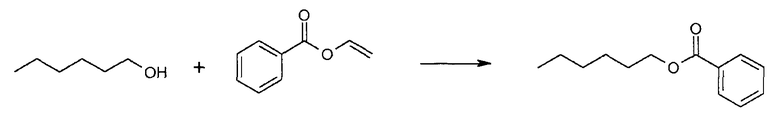
Через 72 часа для варианта I285E была обнаружена конверсия 17%, тогда как в родительской CALB эта величина составляла 9%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНОГО ЭФИРА УГЛЕРОДА, СЛОЖНОГО ЭФИРА БЕЛКА, СЛОЖНОГО ЭФИРА БЕЛКОВОЙ СУБЪЕДИНИЦЫ ИЛИ СЛОЖНОГО ЭФИРА ГИДРОКСИКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЛИПИДАЦИЛТРАНСФЕРАЗЫ | 2004 |
|
RU2371474C2 |
| СПОСОБ | 2004 |
|
RU2376868C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ, ИХ ПРИМЕНЕНИЕ ПРИ ИСПОЛЬЗОВАНИИ ПИЩЕВЫХ ПРОДУКТОВ | 2010 |
|
RU2538144C2 |
| ПОЛУЧЕНИЕ ЛИЗОГЛИКОЛИПИДА И БИОКОНВЕРСИЯ ГЛИКОЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА | 2005 |
|
RU2548805C2 |
| БЕЛКИ | 2004 |
|
RU2518345C2 |
| ВАРИАНТЫ ГЛИКОЛИПИДАЦИЛТРАНСФЕРАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2004 |
|
RU2377300C2 |
| ФЕРМЕНТАТИВНАЯ ОБРАБОТКА МАСЕЛ | 2004 |
|
RU2377307C2 |
| Стабильные при хранении ферментные препараты, их получение и применение | 2018 |
|
RU2783163C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАРИАНТА ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА И ЛИПОЛИТИЧЕСКИЙ ФЕРМЕНТ (ВАРИАНТЫ) | 1999 |
|
RU2235775C2 |















Изобретение относится к области биохимии. Описаны липолитический полипептид и способ его получения, включающий: 1) отбор родительской липазы с аминокислотной последовательностью, по меньшей мере, на 80% идентичной последовательности SEQ ID NO:1, представленной в описании; 2) отбор, по меньшей мере, одного аминокислотного остатка в последовательности; 3) изменение аминокислотной последовательности, где изменение включает одно или более из следующего: N74Q, P143S, A281S, P38S, N292Q, L1QGPL, L1QL, I285E, L147F, L147N, N292C, L140E, P143L, A146T, P280V, A283K, A284N, T103G+A148P, W104H+A148P, N74Q+A281S, V190A, L199P, T256K, T42N, R242A, V215I, T164V, L163F+T164V, D265P, P303K, R168D, A25G, V315I, T244P, K13Q, L277I, Y91S+A92S+N96S+N97*+L99V или D223G; 4) получение измененного полипептида с измененной аминокислотной последовательностью; 5) определение специфической активности липолитического фермента; и 6) отбор измененного полипептида, обладающего более высокой специфической активностью липолитического фермента, чем родительский полипептид. Также представлены способы проведения реакций, катализируемых описанной липазой, которые включают приведение реактантов во взаимодействие с указанным полипептидом, где реакцией является: гидролиз эфира карбоновой кислоты, синтез эфира карбоновой кислоты, алкоголиз эфира карбоновой кислоты или ацидолиз эфира карбоновой кислоты. Изобретение позволяет получить липазу, обладающую более высокой специфической активностью по сравнению с родительской. 4 н. и 5 з.п. ф-лы, 5 табл., 1 ил., 8 пр.
1. Способ получения полипептида, обладающего активностью липолитического фермента, включающий:
a) отбор такого родительского полипептида, который обладает активностью липолитического фермента и аминокислотной последовательностью, по меньшей мере, на 80% идентичной последовательности SEQ ID NO:1;
b) отбор, по меньшей мере, одного аминокислотного остатка в последовательности, соответствующего любому из остатков 1, 13, 25, 38, 42, 74, 91, 92, 96, 97, 99, 103, 104, 140, 143, 146, 147, 148, 163, 164, 168, 190, 199, 215, 223, 242, 244, 256, 265, 277, 280, 281, 283, 284, 285, 292, 303, или 315 последовательности SEQ ID NO:1;
c) изменение аминокислотной последовательности, где изменение включает одно или более из следующего: N74Q, P143S, A281S, P38S, N292Q, L1QGPL, L1QL, I285E, L147F, L147N, N292C, L140E, P143L, A146T, P280V, A283K, A284N, T103G+A148P, W104H+A148P, N74Q+A281S, V190A, L199P, T256K, T42N, R242A, V215I, T164V, L163F+T164V, D265P, P303K, R168D, A25G, V315I, T244P, K13Q, L277I, Y91S+A92S+N96S+N97*+L99V или D223G;
d) получение измененного полипептида с измененной аминокислотной последовательностью;
e) определение специфической активности липолитического фермента; и
f) отбор измененного полипептида, обладающего более высокой специфической активностью липолитического фермента, чем родительский полипептид.
2. Способ по п.1, где изменение включает замену отобранного остатка остатком, найденным в соответствующем положении любой из последовательностей SEQ ID NO:1-8.
3. Способ по п.1 или 2, где родительский полипептид выбирают из последовательностей SEQ ID NO:1-8.
4. Полипептид, который:
a) обладает активностью липолитического фермента; и
b) имеет аминокислотную последовательность, которая, по меньшей мере, на 80% идентична последовательности SEQ ID NO:1 и, по сравнению с последовательностью SEQ ID NO:1, содержит изменения в аминокислотной последовательности, выбранные из N74Q, P143S, A281S, P38S, N292Q, L1QGPL, L1QL, I285E, L147F, L147N, N292C, L140E, P143L, A146T, P280V, A283K, A284N, T103G+A148P, W104H+A148P, N74Q+A281S, V190A, L199P, T256K, T42N, R242A, V215I, T164V, L163F+T164V, D265P, P303K, R168D, A25G, V315I, T244P, K13Q, L277I, Y91S+A92S+N96S+N97*+L99V или D223G.
5. Полипептид по п.4 в иммобилизированной форме.
6. Способ проведения реакции, катализируемой липазой, который включает приведение реактантов во взаимодействие с полипептидом по любому предыдущему пункту, где реакцией является:
a) гидролиз, где реактантами являются эфир карбоновой кислоты и вода, а продуктами являются свободная карбоновая кислота и спирт; или
b) синтез эфира, где реактантами являются свободная карбоновая кислота и спирт, а продуктом является эфир карбоновой кислоты.
7. Способ по п.6, где реакцией является гидролиз изопропилового эфира или синтез эфира с изопропанолом в качестве реактанта.
8. Способ проведения реакции, катализируемой липазой, который включает приведение реактантов во взаимодействие с полипептидом по любому из пп.1-5, где реакцией является:
a) алкоголиз, где реактантами являются эфир карбоновой кислоты и спирт; или
b) ацидолиз, где реактантами являются эфир карбоновой кислоты и свободная жирная кислота.
9. Способ по п.8, где реакцией является алкоголиз с изопропанолом в качестве реактанта.
| WEN-CHEN SUEN, et al., "Improved activity and thermostability of Candida antarctica lipase В by DNA family shuffling", Protein Engineering, Design & Selection, 2004, vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| LUTZ S "ENGINEERING LIPASE В FROM CANDIDA ANTARCTICA", Tetrahedron: Asymmetry, Vol.15, No.18, 20.09.2004, pp.2743-2748 | |||
| NINGYAN ZHANG, et al., | |||
Авторы
Даты
2013-02-10—Публикация
2007-11-26—Подача