Перекрестная ссылка на связанные заявки
Эта заявка заявляет приоритет по предварительной заявке Соединенных Штатов, номер 60/923,688, поданной 16 апреля 2007 года, полное содержание которой включено в данное изобретение посредством ссылки.
Предпосылки заявки изобретения
Конфигурация гликозилирования гликопротеина часто играет важную роль в функции такого гликопротеина. При рассмотрении лишь нескольких примеров видно, что конфигурация гликозилирования гликопротеина может влиять на способность его молекул правильно складываться, на его устойчивость (например, устойчивость к протеолитическому и/или иному расщеплению), каталитическую активность, фармакодинамические и/или фармакокинетические свойства и/или на способность такого гликопротеина взаимодействовать должным образом с другими молекулами. Как альтернатива или дополнение конфигурация гликозилирования гликопротеина может влиять на перенос и наведение гликопротеина. Например, конфигурация гликозилирования гликопротеина может влиять на то, останется ли гликопротеин внутриклеточным (в том числе, например, правильное наведение гликопротеина в надлежащий субклеточный компартмент или компартменты), будет ли он мембранно-связанным и/или выделенным из клетки. По этим причинам важно иметь возможность идентификации и/или исследования конфигураций гликозилирования гликопротеина.
Сущность изобретения
Раскрытие сущности изобретения частично основано на понимании того, что гликаны клеточной поверхности могут обеспечить информацию о состоянии клетки, например, так, как показано в гликозилировании протеинов, продуцируемых клеткой. В частности, было обнаружено, что поверхность клеток гликанов может предоставить информацию о статусе гликозилирования гликопротеинов, продуцируемых (и по желанию секретированных) клеткой. Таким образом не требуется изолировать заказной протеин от клетки для получения информации о статусе его гликозилирования. Точнее, гликозилирование одного или более протеинов или липидов на клеточной поверхности может быть оценено для косвенного раскрытия одного или более аспектов гликозилирования целевого протеина. Это может упростить и облегчить анализ гликозилирования целевого протеина.
Среди всего прочего раскрытие сущности настоящего изобретения обеспечивает способы для выполнения анализа гликанов клеточной поверхности в тех клетках, которые производят, по меньшей мере, один заказной гликопротеин. Обнаружение гликанов клеточной поверхности служит заменителем обнаружения гликозилирования целевого гликопротеина (то есть обнаруженные гликаны не находятся ни на целевых гликопротеинах, ни выделенно от них). Во многих вариантах выполнения изобретения целевой гликопротеин - это гликопротеин, который не находится на клеточной поверхности. Например, целевой гликопротеин является растворимым или выделенным из клетки. В таких вариантах выполнения изобретения обнаружение гликанов клеточной поверхности служит в качестве заменителя для определения структуры конкретного гликана в гликопротеине, который произведен вне клеточной поверхности.
В определенных вариантах выполнения изобретения раскрытие сущности настоящего изобретения обеспечивает способы, когда клетка, которая продуцирует интересующий гликопротеин (например, гликопротеин, расположенный не на клеточной поверхности, или любой другой гликопротеин, отличный от того, чьи имеющие к нему отношение гликаны проанализированы напрямую), культивируется при условиях, которые позволяют найти экспрессию интересующего гликопротеина и затем вступить в реакцию с одним или более реагентами, обнаруживающими гликозилирование гликана на клеточной поверхности, которая не является частью интересующего гликопротеина. Обычно такие способы не включают стадию отщепления интересующего гликопротеина. К тому же во многих вариантах выполнения изобретения в такие стадии не входит любой прямой анализ интересующего гликопротеина. Соответственно, в таких вариантах выполнения изобретения анализ гликана клеточной поверхности используется как заменитель оценки гликозилирования целевого гликопротеина.
В некоторых вариантах выполнения изобретения согласно раскрытию его сущности важной рабочей клеткой является клетка млекопитающегося, например клетка яичника китайского хомячка (CHO). В некоторых вариантах выполнения изобретения согласно раскрытию его сущности видно, что целевой гликопротеин является средством, используемым как лекарство; в некоторых вариантах выполнения изобретения целевой гликопротеин содержит антитело или фрагмент антитела.
В некоторых аспектах раскрытие сущности изобретения обеспечивает способы идентификации свойства гликозилирования продуцируемого клеткой гликопротеина за счет оценки свойства гликана клетки, полученного на клеточной поверхности (например, гликан клеточной поверхности на гликопротеине или гликолипид на клеточной поверхности). В некоторых аспектах свойство гликана может коррелироваться в большей степени на общих основаниях по состоянию клетки, например по жизнеспособности клетки, ее морфологии, плотности или по другому свойству, на которое могут повлиять другие условия рабочего процесса, например те, что имеют место в процессе культивирования клетки, например в процессе производства продукта гликопротеина из клетки. Таким образом, варианты выполнения изобретения согласно раскрытию его сущности могут быть использованы в многообразии различных контекстов, например, среди всего прочего гликаны клеточной поверхности можно оценить для:
(а) оценки или прогнозирования характеристик гликозилирования продукта гликопротеина, например продукта лечебного гликопротеина;
(b) контроля качества продукта гликопротеина (например, структуры гликана) во время одного или более стадий процесса производства продукта гликопротеина;
(c) обнаружения изменений в условиях рабочего процесса производства продукта гликопротеина,
(d) предоставления информации (например, для сравнения) о различных партиях препарата гликопротеина,
(e) предоставления информации (например, для сравнения) о статусе клетки или продукта гликопротеина во время нескольких различных стадий процесса производства продукта гликопротеина;
(f) предоставления информации (например, для сравнения) о статусе клетки или продукта гликопротеина во время той самой стадии во множестве рабочих процессов для производства продукта гликопротеина; и/или
(g) предоставления информации (например, для сравнения) о характеристиках гликозилирования продукта гликопротеина, продуцируемого двумя или более клетками или популяциями клеток (например, клональными популяциями, полученными из отдельных клеток, которые выбираются из начальной популяции клетки), выращенных при аналогичных или идентичных условиях.
Краткое описание фигур
Фиг.1 показывает уровни фукозилирования ядра на экспрессивно выраженном гликопротеине антитела, не расположенного на клеточной поверхности, который получен в среде клеточной культуры вместе с увеличенным дополнением глюкозамином или без него.
Фиг.2 показывает уровни фукозилирования гликопротеинов клеточной поверхности, полученных в среде клеточной культуры вместе с дополнением в виде увеличенного дополнением глюкозамином или без него.
Фиг.3A-B показывают структуры гликана в гликопротеинах клеточной поверхности, выращенных в контролируемой среде (Фиг.3A) или в среде, содержащей увеличенное дополнение глюкозамином (Фиг.3Б).
Фиг.4 показывает проведение анализа с помощью жидкостной хроматографии применительно к уровням сиаловой кислоты для экспрессивно выраженных (не на клеточной поверхности) гликопротеинов клеточной поверхности с рекомбинантным антителом.
Фиг.5 показывает уровни сиаловой кислоты экспрессивно выраженного гликопротеина с антителом, продуцируемого в среде клеточной культуры, с повышенной концентрацией N-ацетилманнозамина или без нее так, как измерено в результате маркирования образца диметилбутадиеном или после применения высокоэффективной жидкостной хроматографии.
Фиг.6 показывает уровни сиаловой кислоты гликопротеинов клеточной поверхности в среде клеточной культуры при повышенной концентрации N-ацетилманнозамина или без нее так, как измерено в результате маркирования образца диметилбутадиеном или после применения высокоэффективной жидкостной хроматографии.
Фиг.7 показывает уровни сиаловой кислоты гликопротеинов клеточной поверхности в среде клеточной культуры при повышенной концентрации N-ацетилманнозамина или без нее так, как измерено с помощью фиксации лектина, специфичного к сиаловой кислоте, и проточной цитометрии.
Фиг.8 показывает содержание сиаловой кислоты на клеточной поверхности, которое определено с помощью ионообменной хроматографии, проведенной в отношении гликанов клеточной поверхности. На верхней хроматограмме показана перегруппировка нейтрального (NA2F), моносиализированного (A1), дисиализированного (A2) или трисиализированного (A3) стандартных образцов. На нижней хроматограмме показаны репрезентативные данные по гликанам клеточной поверхности для клеток яичника китайского хомячка и относительные процентные отношения.
Определения
Приблизительно, около, примерно: Использованные в данном изобретении термины “приблизительно”, “около” или “примерно” применительно к одному или более представляющим интерес значениям относятся к значению, которое соответствует установленному контрольному значению. В определенных вариантах выполнения изобретения термины “приблизительно”, “около” или “примерно” ссылаются на диапазон значений, которые оказываются в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или величины меньше установленного контрольного значения.
Биологический образец: В использованном здесь смысле термин “биологический образец” имеет отношение к любому твердому или жидкому образцу, полученному, выделенному или секретированному любой живой клеткой или организмом, включая, но, не ограничиваясь, тканевой культурой, образцом ферментера, тканью человека или животного, растением, фруктами, овощами, одноклеточными организмами (такими, как бактерии и дрожжи) и многоклеточными организмами. Например, биологический образец может быть биологической жидкостью, полученной, например, из крови, плазмы, сыворотки, мочи, желчи, семенной жидкости, спинномозговой жидкости, водянистой влаги или эндолимфы либо любой секреции человеческого тела, отечной жидкости, экссудата (например, жидкости, полученной из абсцесса или любого другого инфицированного или воспаленного участка тела), или жидкостью, полученной из сустава (например, здорового сустава или сустава, пораженного такой болезнью, как ревматоидный артрит, остеоартрит, подагра или септический артрит). Биологический образец также может быть, например, образцом, полученным из любого органа или ткани (включая образчики, полученные в результате биопсии или аутопсии), может содержать клетки (либо эмбриональные или культивируемые), быть средой, кондиционированной любой клеткой, тканью либо органом, тканевой культурой.
Гликопротеин клеточной поверхности: Термин “гликопротеин клеточной поверхности” в использованном здесь смысле имеет отношение к гликопротеину, по меньшей мере, часть которого присутствует на внешней клеточной поверхности. В некоторых вариантах выполнения изобретения гликопротеин клеточной поверхности представляет собой протеин, который располагается на клеточной поверхности так, что, по меньшей мере, одна из структур гликанов находится на внешней клеточной поверхности.
Гликан клеточной поверхности: “Гликан клеточной поверхности” - это тот гликан, который присутствует на внешней клеточной поверхности. Во многих вариантах выполнения изобретения из представленного раскрытия его сущности гликан клеточной поверхности ковалентно связан с пептидом как часть гликопротеина клеточной поверхности. Гликан клеточной поверхности также может быть связан с липидом клеточной мембраны.
Корреляция: Термин “корреляция” в использованном здесь смысле имеет отношение к установлению прогнозируемого взаимоотношения двух понятий. В описанных здесь вариантах выполнения изобретения конфигурация гликозилирования (или ее характеристика) на клеточной поверхности коррелируется с конфигурацией гликозилирования (или ее характеристикой) целевого гликоконъюгата (например, гликопротеина), продуцируемого клеткой. Скоррелированные конфигурации (или характеристики) не должны быть идентичными между собой столь долго, сколько одна из них может быть спрогнозирована на основании другой. После установления корреляции можно внести, например, ее данные письменно в журнал или иным образом зафиксировать на носителе или в памяти (например, на носителе, читаемом на компьютере или в базе данных либо на диске). После этого обнаружение скоррелированной конфигурации гликозилирования (или ее характеристики) может повлечь за собой ссылку на письменную или внесенную в носитель запись либо передачу данных на компаратор для проведения эксперимента, подтверждающего корреляцию, и т.д. Такой эксперимент с применением компаратора можно провести одновременно с оценкой конфигурации гликозилирования (или ее характеристики) или как эксперимент с привлечением к сравнению давних данных либо для прогнозирования будущей конфигурации.
Гликан: На основании того, что известно из предметной области и используется в данном изобретении, «гликаны» являются сахарами. Гликаны могут быть мономерами или полимерами сахарных остатков, однако они обычно содержат, по меньшей мере, три вида сахаров и могут иметь линейную или разветвленную структуру. Гликан может содержать остатки натурального сахара (например, глюкозу, N-ацетилглюкозамин, N-ацетилнейраминовую кислоту, галактозу, маннозу, фукозу, гексозу, арабинозу, рибозу, ксилозу и т.д.) и/или модицифированные сахара (например, 2'-фторорибозу, 2'-дезоксирибозу, фосфоманнозу, 6'-сульфо-N-ацетилглюкозамин и т.д.). Термин “гликан” включает гомополимеры и гетерополимеры сахарных остатков. Термин “гликан” также охватывает гликанный компонент гликоконъюгата (например, гликопротеин, гликолипид, протеогликан и т.д.). Этот термин также охватывает свободные гликаны, в том числе и те гликаны, которые были расщеплены или иным образом освобождены от гликоконъюгата.
Препарат гликана: Термин “препарат гликана” в использованном здесь смысле имеет отношение к набору гликанов, полученных согласно конкретному производственному способу. В некоторых вариантах выполнения изобретения препарат гликана имеет отношение к набору гликанов, полученных из препарата гликопротеина (смотрите ниже определение препарата гликопротеина).
Гликоконъюгат: Термин “гликоконъюгат” в использованном здесь смысле включает все молекулы, в которых, по меньшей мере, одна составляющая сахара ковалентно связана, по меньшей мере, с одной другой составляющей. Этот термин конкретно охватывает все биомолекулы с ковалентно присоединенными составляющими сахара, в том числе, например, N-связанными гликопротеинами, O-связанными гликопротеинами, гликолипидами, протеогликанами и т.д.
Гликоформ: Термин «гликоформ» используется в данном изобретении для ссылки на конкретную форму гликоконъюгата. То есть, когда та же самая составляющая остова белка (например, полипептида, липида и т.д.), которая является частью гликоконъюгата, может быть связана с другими гликанами или наборами гликанов, то на любой иной вариант выполнения гликоконъюгата (то есть там, где остов белка связан с конкретным набором гликанов) идет ссылка как на “гликоформ.”
Гликолипид: Термин “гликолипид” в использованном здесь смысле указывает на липид, содержащий один или более ковалентно связанных составляющих сахара (то есть гликанов). Составляющая (составляющие) сахара может быть представлена в форме моносахаридов, дисахаридов, олигосахаридов и/или гликанов. Составляющая (составляющие) сахара может охватывать отдельную неразветвленную цепь сахарных остатков или состоять из одной или более разветвленных цепей. В определенных вариантах выполнения изобретения сахарные составляющие могут содержать группы сульфатов и/или фосфатов. В определенных вариантах выполнения изобретения гликопротеины содержат O-связанные составляющие сахара; а в определенных вариантах выполнения изобретения - N-связанные составляющие сахара.
Гликопротеин: Термин “гликопротеин” в использованном здесь смысле указывает на белок, который содержит остов пептида, ковалентно связанного с одной или более составляющими сахара (то есть гликанами). Специалистам, квалифицированным в предметной области, понятно, что остов пептида обычно состоит из линейной цепи остатков аминокислот. В определенных вариантах выполнения изобретения остов пептида перекрывает клеточную мембрану так, что охватывает ее трансмембранную и внеклеточную часть. В определенных вариантах выполнения изобретения остов пептида гликопротеина, который перекрывает клеточную мембрану, охватывает ее внутриклеточную, трансмембранную и внеклеточную часть. В определенных вариантах выполнения настоящего изобретения способы раскрытия его сущности изобретения включают расщепление гликопротеина клеточной поверхности с помощью протеазы для высвобождения внеклеточной части гликопротеина или ее доли, причем такое воздействие незначительно разрушает клеточную мембрану. Составляющая (составляющие) сахара может быть представлена в форме моносахаридов, дисахаридов, олигосахаридов и/или гликанов. Составляющая (составляющие) сахара может охватывать отдельную неразветвленную цепь сахарных остатков или состоять из одной или более разветвленных цепей. В определенных вариантах выполнения изобретения сахарные составляющие могут содержать группы сульфатов и/или фосфатов. Как альтернатива или дополнение составляющие сахара могут содержать ацетил, гликолил, пропил или другие модификации алкильной группы. В определенных вариантах выполнения изобретения гликопротеины содержат O-связанные составляющие сахара; а в определенных вариантах выполнения изобретения - N-связанные составляющие сахара. В определенных вариантах выполнения изобретения способы, представленные в данном изобретении, охватывают стадию анализа любого или всех гликопротеинов клеточной поверхности, высвобожденных фрагментов (например, гликопептидов) гликопротеинов клеточной поверхности, гликанов клеточной поверхности, присоединенных к гликопротеинам клеточной поверхности, остовов пептидов гликопротеинов клеточной поверхности, фрагментов таких гликопротеинов, гликанов и/или остовов пептидов, а также комбинаций этих соединений.
Препарат гликопротеина: Термин “Препарат гликопротеина” в использованном здесь смысле указывает на набор отдельных молекул гликопротеина, каждая из которых содержит полипептид, куда входит последовательность конкретных аминокислот (которая включает, по меньшей мере, один сайт гликозилирования), и, по меньшей мере, один гликан, ковалентно присоединенный, по меньшей мере, к одному сайту гликозилирования. Отдельные молекулы конкретного гликопротеина в пределах препарата гликопротеина обычно представляют собой идентичные последовательности аминокислот, которые, тем не менее, могут отличаться наполняемостью, по меньшей мере, одного сайта гликозилирования и/или идентичностью гликанов, связанных, по меньшей мере, с одним сайтом гликозилирования. То есть препарат гликопротеина может содержать только один гликоформ конкретного гликопротеина, однако в нем обычно содержится множество гликоформ. Различные препараты одного и того же гликопротеина могут отличаться идентичностью присутствующих гликоформ (например, гликоформ, присутствующий в одном препарате, может отсутствовать в другом) и/или относительными количествами различных гликоформ.
Гликозидаза: Термин “гликозидаза” в использованном здесь смысле указывает на агент, который расщепляет ковалентную связь между последовательно расположенными сахарами в гликане или между сахаром и составляющей остова протеина (например, между сахаром и остовом пептида гликопротеина). В некоторых вариантах выполнения изобретения гликозидаза является ферментом. В определенных вариантах выполнения изобретения гликозидаза является протеином (например, протеиновым ферментом), состоящим из одной или более полипептидных цепей. В определенных вариантах выполнения изобретения гликозидаза является агентом химического расщепления.
Конфигурация гликозилирования: Термин “конфигурация гликозилирования” в использованном здесь смысле указывает на набор структур гликанов, присутствующий в конкретном образце. Например, конкретный гликоконъюгат (например, гликопротеин) или набор гликоконъюгатов (например, набор гликопротеинов) будет иметь конфигурацию гликозилирования. В некоторых вариантах выполнения изобретения делается ссылка на конфигурацию гликозилирования гликанов клеточной поверхности или на «конфигурацию гликозилирования поверхности». Термин «структура гликозилирования поверхности» в использованном здесь смысле может указывать на конфигурацию гликанов (или на «конфигурацию гликозилирования»), которая существует во внеклеточной области интересующего отдельного гликопротеина клеточной поверхности и/или гликолипида. В качестве дополнения или альтернативы термин «конфигурация гликозилирования поверхности» может указывать на конфигурацию гликанов (или на «конфигурацию гликозилирования»), которая существует во внеклеточной области множества гликопротеинов клеточной поверхности и/или гликолипидов. В определенных вариантах выполнения изобретения «конфигурация гликозилирования поверхности» описывает конфигурацию гликанов (или «конфигурацию гликозилирования»), которая существует во всем хромосомном наборе гликопротеинов и/или гликолипидов клеточной поверхности. Основываясь на контексте, специалисты обычной квалификации в предметной области быстро поймут, к чему относится термин «конфигурация гликозилирования поверхности» - к конфигурации гликозилирования отдельного гликопротеина клеточной поверхности и/или гликолипида либо к конфигурации гликозилирования множества гликопротеинов клеточной поверхности и/или гликолипидов. Конфигурация гликозилирования может характеризоваться, например, идентичностями гликанов, количествами (в абсолютных или относительных единицах) отдельных гликанов или гликанов конкретного типа, степенью заполнения сайтов гликозилирования и т.д. или комбинациями таких параметров.
N-гликан: Термин “N-гликан” в использованном здесь смысле указывает на полимер сахаров, который высвобожден из гликоконъюгата, однако ранее был связан с ним с помощью связи через азот (ниже смотрите определение N-связанного гликана).
N-связанные гликаны: N-связанными гликанами являются те гликаны, которые связаны с гликоконъюгатом с помощью связи через азот. Существует разнообразный набор N-связанных гликанов, однако он обычно основан на типичном сердцевинном пентасахариде (Man)3(GlcNAc)(GlcNAc).
O-гликан: Термин “O-гликан” в использованном здесь смысле указывает на полимер сахаров, который высвобожден из гликоконъюгата, однако ранее был связан с ним с помощью связи через кислород (ниже смотрите определение O-связанного гликана).
O-связанные гликаны: O- связанными гликанами являются те гликаны, которые связаны с гликоконъюгатом с помощью связи через кислород. O-связанные гликаны обычно присоединяются к гликопротеинам через N-ацетил-D-галактозамин (GalNAc) или же через N-ацетил-D-глюкозамин (GlcNAc), сцепляясь с гидроксильной группой L-серин (Ser) либо L-треонин (Thr). Некоторые O-связанные гликаны также имеют такие модификации, полученные после ацетилирования и сульфатирования. В некоторых случаях O-связанные гликаны присоединяются к гликопротеинам через фукозу или же через маннозу, сцепляясь с гидроксильной группой L-серин (Ser) либо L-треонин (Thr).
Фосфорилирование: В использованном здесь смысле термин «фосфорилирование» указывает на процесс ковалентного добавления одной или более фосфатных групп к молекуле (например, к гликану).
Протеаза: Термин “протеаза” в использованном здесь смысле указывает на агент, который расщепляет пептидную связь между последовательными аминокислотами в полипептидной цепи. В некоторых вариантах выполнения изобретения протеаза является ферментом (то есть протеолитическим ферментом). В определенных вариантах выполнения изобретения протеаза является протеином (например, протеиновым ферментом), состоящим из одной или более полипептидных цепей. В определенных вариантах выполнения изобретения протеаза - это агент химического расщепления.
Протеин: В общем случае «протеин» - это полипептид (то есть цепь, по меньшей мере, двух аминокислот, связанных друг с другом пептидными связями). Протеины могут включать составляющие, отличные от аминокислот (например, это могут быть гликопротеины), и/или подвергаться иной обработке или модификации. Специалистам обычной квалификации в предметной области следует обратить внимание на то, что “протеин” может быть полностью полипептидной цепью в том виде, в каком его образовала клетка (с сигнальной последовательностью или без нее), или функциональной частью этого. Специалистам обычной квалификации в дальнейшем следует обратить внимание на то, что иногда протеин может включать более одной полипептидной цепи, которая, например, присоединяется с помощью одной или более дисульфидных связей или посредством других средств.
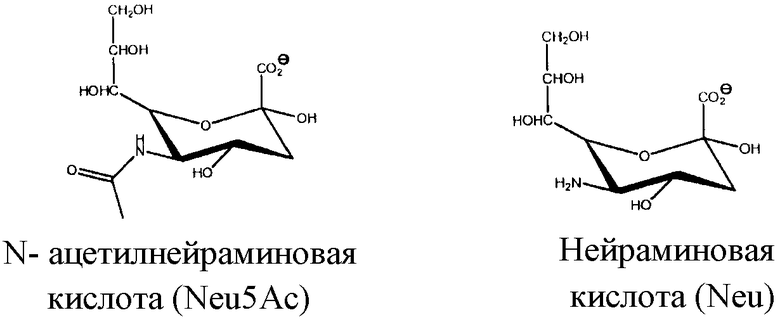
Сиаловая кислота: Термин “сиаловая кислота” в использованном здесь смысле является родовым термином N- или O-замещенных производных соединений нейраминовой кислоты, то есть 9-углеродным моносахаридом. Аминовая группа нейраминовой кислоты обычно привносит либо ацетиловую или гликольную группу в сиаловую кислоту. Гидроксильные заместители, которые присутствуют в сиаловой кислоте, могут быть модицированы ацетилированием, метилированием, сульфатированием и фосфорилированием. Доминирующая сиаловая кислота представляет собой N-ацетилнейраминовую кислоту (Neu5Ac). Сиаловые кислоты наделяют гликаны отрицательным зарядом, потому что карбоксильная группа имеет тенденцию диссоциировать протон физического водородного показателя pH. Типичные лишенные протонов сиаловые кислоты представлены ниже:
В основном: В использованном здесь смысле термин “в основном” указывает на качественное условие проявления в полной или почти полной мере или степени представляющей интерес характеристики или свойства. Специалист обычной квалификации по биологическим технологиям должен понимать, что биологические или химические явления редко, если вообще когда-либо, стремятся к завершению и/или продолжаются до полной завершенности либо достигают или отклоняются от абсолютного результата. Следовательно, термин “в основном” используется в данном изобретении для принятия во внимание возможного отсутствия завершенности, присущего многим биологическим или химическим явлениям. Дадим только один конкретный пример, когда сообщается, что обработка “в основном” не разрушает клеточные мембраны, и это указывает на следующее - все или большинство клеточных мембран остаются невредимыми во время и после обработки, вследствие чего, например, внутриклеточные гликопротеины или гликопептиды не высвобождаются из клеток. В определенных вариантах выполнения изобретения термин “в основном” применительно к невредимым клеточным мембранам, указывает на условие, когда 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или меньшее число клеток, подвергнутых конкретной обработке, демонстрируют измеримое количество поврежденных клеточных мембран. В определенных вариантах выполнения изобретения термин “в основном” применительно к невредимым клеточным мембранам, указывает на состояние дел, когда ни одна из клеток, подвергнутых конкретной обработке, не демонстрирует измеримое количество поврежденных клеточных мембран.
Подробное описание определенных вариантов выполнения изобретения
Как описано в данном изобретении, раскрытие сущности настоящего изобретения связано с обнаружением структур гликанов, находящихся на поверхности клеток, присутствие, идентичность и/или распределение (например, в относительных величинах) которых предоставляет информацию о состоянии клетки, например информацию о состоянии гликозилирования и/или характеристиках одного или более гликопротеинов, расположенных вне клеточной поверхности и продуцируемых клетками. То есть в одном аспекте раскрытия сущности изобретения гликаны клеточной поверхности действуют как заменитель способа для определения структур гликана и/или конфигурации гликозилирования, обнаруженной на гликопротеинах, расположенных вне клеточной поверхности. В некоторых вариантах выполнения изобретения согласно раскрытию его сущности гликопротеины, расположенные вне клеточной поверхности, относятся к лечебным гликопротеинам. В некоторых таких вариантах выполнения изобретения в клетку вносятся изменения для придания ей свойств лечебного протеина на предопределенном уровне или при заранее предопределенных условиях.
Гликаны клеточной поверхности
Для такого гликозилирования существуют много различных типов гликозилата клеток, по меньшей мере, некоторые продуцируемые ими протеины и/или липиды, а также несколько различных механизмов. Однако в общем случае цепи олигосахаридов связаны с цепью полипептида (то есть с протеином) и/или липида в эндоплазматической сети и в комплексе Гольджи с помощью либо N-связи или O-связи.
N-связанное гликозилирование
Обычно цепочки N-связанного олигосахарида добавляются к протеину в полости эндоплазматической сети (обратитесь к работе Alberts et al., журнал Molecular Biology of the Cell (Молекулярная биология клетки), 1994, указанной здесь посредством ссылки). Начальный олигосахарид (обычно 14-сахарный) конкретно добавляется в аминогруппу к боковой цепи остатка амида, которая входит в состав целевой консенсусной последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой за исключением пирролидин-карбоновой кислоты. Структура этого начального олигосахарида обычна для большинства эукариотов и содержит 3 остатка глюкозы, 9 остатков маннозы и 2 остатка 2 N-ацетилглюкозамина. Эта первоначальная цепочка олигосахарида обычно урезается посредством особых ферментов гликозидазы в эндоплазматической сети, что приводит к получению олигосахарида с короткой разветвленной сердцевиной ядра, состоящей из двух остатков N-ацетилглюкозамина и трех остатков маннозы.
N-гликаны могут быть подразделены на три отдельные группы, названные «маннозным типом высокого уровня» «гибридным типом» и «комплексным типом» с общим ядром пентасахарида (Man(α1,6)-(Man(α1,3))-Man(β1,4)-GlcpNAc(β1,4)-GlcpNAc(β1,N)-Asn), которое встречается во всех трех группах.
После начальной обработки в эндоплазматической сети гликопротеины вносятся в комплекс Гольджи, где происходит их дальнейшая обработка. Если гликан переносится в комплекс Гольджи перед моментом его полного урезания до структуры занимающего ядро пентасахарида, то он становится “высокоманнозным гликаном”.
Как альтернативу или дополнение одну или более моносахаридных единиц N-ацетилглюкозамина можно добавить к маннозных субъединицам ядра для образования «сложных олигосахаридов». К субъединицам N-ацетилглюкозамина можно добавить галактозу, а субъединицы сиаловой кислоты - к субъединицам галактозы, что приведет к получению цепей, оканчивающихся молекулами любого соединения - сиаловой кислоты, галактозы или N-ацетилглюкозаминового остатка. Кроме того, к остатку N-ацетилглюкозамина олигосахарида, занимающего положение ядра, можно добавить остаток фукозы. Каждая из этих добавок катализируется посредством особых гликозиловых трансфераз.
«Гибридные гликаны» охватывают характеристики как высокоманнозного, так и сложного гликана. Например, одна ветвь гибридного гликана может охватывать главным образом и исключительно остатки маннозы, тогда как другая ветвь N-ацетилглюкозамин - сиаловую кислоту, галактозу и/или фукозные сахара.
O-связанное гликозилирование
Цепи O-связанных олигосахаридов добавляются к специфическим остаткам серина или треонина в цепях полипептидов. Перенос первого остатка сахара, который во многих случаях представляет собой N-ацетилгалактозамин, обычно начинается в эндоплазматической сети и завершается в комплексе Гольджи. Остатки O-связанного олигосахарида добавляются по одному за один раз, и добавка каждого остатка катализируется конкретным ферментом. В противоположность N-связанному гликозилированию согласованная последовательность аминокислот для O-связанного гликозилирования определена менее надежно.
Целевые гликопротеины
Способы раскрытия сущности настоящего изобретения могут применяться для оценки состояния гликозилирования любого гликопротеина, расположенного вне клеточной поверхности, или любого другого интересующего гликопротеина, отличного от того, чьи гликаны анализируются непосредственно или производятся конкретной клеткой или популяцией клеток. Идентичность интересующего гликопротеина, расположенного вне клеточной поверхности, не предназначена для ограничения раскрытия сущности настоящего изобретения. Однако в большинстве вариантов выполнения изобретения клетка или клетки, как известно, производят определенный интересующий гликопротеин («целевой» гликопротеин), чье состояние гликозилирования следует оценить.
Во многих вариантах выполнения изобретения представляющим интерес целевым гликопротеином является тот, который не продуцируется клеткой естественным образом; наоборот, в клетку вносятся изменения для организации его производства. В некоторых вариантах выполнения изобретения целевым гликопротеином является тот, который продуцируется клеткой естественным образом; однако в клетку были внесены изменения для организации его производства на высоком уровне и/или согласно предопределенным условиям (например, в присутствии стимулирующего агента и т.д.).
Во многих вариантах выполнения изобретения целевой гликопротеин обладает лечебной активностью при вводе его животным (например, млекопитающим, таким как человекообразные). Для предоставления всего лишь нескольких примеров скажем, что эритропротеины, интерфероны, факторы свертывания крови, колониестимулирующие факторы, множество антител и определенные ферменты - все они являются гликопротеинами, которые в настоящее время производятся в таких линиях измененных клеток как биофармацевнические агенты. В некоторых вариантах выполнения изобретения из настоящего раскрытия его сущности видно, что гликаны на поверхности тех клеток, которые производят один или несколько из этих агентов, подвергаются химическому анализу так, как описано в данном изобретении, для оценки и контроля гликозилирования агента. Специалист обычной квалификации в предметной области должен иметь представление и о других коммерчески пригодных гликопротеинах, которые могут быть получены промышленным способом (например, в производственных биореакторах) в лечебных и прочих целях. Раскрытие сущности настоящего изобретения обеспечивает способы для контроля конфигурации гликозилирования таких коммерчески пригодных гликопротеинов.
Типичные коммерчески доступные продукты гликопротеина охватывают, например:
Специалистам обычной квалификации в предметной области следует обратить внимание на то, что конфигурации гликозилирования таких лечебных гликопротеинов могут потенциально влиять на их лечебные свойства. В раскрытии сущности настоящего изобретения предоставлены технологии, которые позволяют исследователям оценить гликозилирование этих протеинов, так как они были получены в клетках без необходимости в отщепления самих протеинов. Как будет обсуждено в дальнейшем ниже по тексту, раскрытие сущности настоящего изобретения, следовательно, обеспечивает среди всего прочего и оценку в реальном времени качества продуктов лечебного гликопротеина, так как последние генерируются в процессе гликозилирования.
Специалистам обычной квалификации в предметной области следует обратить внимание на то, что раскрытие сущности настоящего изобретения не ограничено оценкой гликозилирования на вышеупомянутых гликопротеинах или действительно на лечебных гликопротеинах либо на гликопротеинах, чья экспрессия (и/или степень или тайминг экспрессии) вставлены в клетку. Они представляют только определенный конкретный вариант выполнения изобретения из его данного раскрытия сущности; однако специалистам обычной квалификации в предметной области следует обратить внимание на то, что принципы раскрытия сущности изобретения применимы к любому целевому гликопротеину.
Производство целевых гликопротеинов в клетках
Специалистам обычной квалификации в предметной области будет легко оценить тот факт, что гликопротеины, чье гликозилирование следует проконтролировать так, как описано в данном изобретении, можно произвести в любой из множества клеток и/или линий клеток. И действительно, любая клетка, которая гликозилирует, по меньшей мере, некоторые из ее протеинов, может быть использована и выращена при любых условиях, позволяющих выполнение такого гликозилирования. К пригодным для этого клеткам относятся, но не ограничиваются ими, клетки млекопитающих, клетки птиц, клетки рыб, клетки насекомых, клетки растений, клетки грибов, клетки бактерий и гибридные клетки. В некоторых вариантах выполнения изобретения в клетки внесены изменения (например, генетическим и/или химическим путем) для получения одной или более характеристик гликозилирования, которые более сходны с характеристиками человеческих клеток.
К типичным клеткам млекопитающих, которые можно использовать согласно раскрытию сущности настоящего изобретения, относятся, но не ограничиваются ими, клетки яичника китайского хомячка (CHO), клетки HeLa, клетки почки собаки Мадина-Дарби (Madin-Darby) (MDCK), клетки почки детеныша хомячка (клетки BHK), клетки NS0, клетки MCF-7, клетки MDA-MB-438, клетки U87, клетки A172, клетки HL60, клетки A549, клетки SP10, клетки DOX, клетки DG44, клетки HEK 293, SHSY5Y, клетки Jurkat, клетки BCP-1, клетки COS, клетки Vero, клетки GH3, клетки 9L, клетки 3T3, клетки MC3T3, клетки C3H-10T1/2, клетки NIH-3T3 и клетки C6/36.
К типичным клеткам рыб, которые можно использовать согласно раскрытию сущности настоящего изобретения, относятся, но не ограничиваются ими, клетки ZF4, клетки AB9, клетки GAKS, клетки OLF-136, клетки CAEP, клетки CAF, клетки OLHE-131, клетки OLME-104, клетки ULF-23, клетки BRF41, клетки Hepa-E1, клетки Hepa-T1, клетки GEM-81, клетки GEM-199, клетки GEM-218, клетки GAKS, клетки D-11, клетки R1, клетки RTG-2, клетки RTO и клетки TPS. Более полный перечень можно найти в работе Фрайера и Ланнана (Fryer and Lannan), 2005, “Three decades of fish cell culture: a current listing of cell lines derived from fishes” [Три десятилетия культуры рыбных клеток: современный перечень линий клеток, полученных из рыб], J. Tissue Culture Methods [Журнал способов тканевой культуры], 16:87-94.
К типичным клеткам насекомых, которые можно использовать согласно раскрытию сущности настоящего изобретения, относятся, но не ограничиваются ими, клетки SFM, клетки Sf21, клетки Sf9, клетки Schneider, клетки S2, клетки T.ni, клетки SES-MaBr-1, клетки SES-MaBr-3, клетки NIAS-MB-25, клетки NIAS-MaBr-92, клетки FRI-SpIm-1229, клетки SES-MaBr-4, клетки NIAS-LeSe-11, клетки TUAT-SpLi-221, клетки NIAS-PX-64, клетки NIAS-MB-32, клетки NIAS-MaBr-93, клетки SES-MaBr-5, клетки BM-N, клетки NIAS-PX-58, клетки MBHL-2 и клетки MBHL-3.
Специалисты обычной квалификации в предметной области признают, что это типичный, но не исчерпывающий перечень различных клеток, которые можно использовать согласно раскрытию сущности настоящего изобретения. Другие клетки можно использовать преимущественно для производства целевого гликопротеина. Такие клетки могут относиться к культуре или рассматриваться в контексте ткани, органа или организма.
Специалисты, квалифицированные в предметной области, также обратят внимание на возможность использования многообразия экспрессивных систем и векторов для экспрессии интересующего протеина внутри клеток или линий клеток согласно раскрытию сущности настоящего изобретения (например, обратитесь к работе Molecular cloning: A Laboratory Manual [Молекулярное клонирование: Лабораторный журнал], под редакцией Сэмбрука (Sambrook), издательство CSHL Press, 2002).
Также любая из многообразия сред культуры клеток, включая сложные среды и/или свободные от сыворотки среды выращивания культуры, которые способны поддерживать рост одной или более клеток либо линий клеток, может быть использована согласно раскрытию сущности настоящего изобретения. Обычно среда клеточной культуры содержит буферный раствор, соли, источник питания, аминокислоты (например, натуральные аминокислоты, искусственные аминокислоты и т.д.), витамины и/или следовые элементы. Среды клеточных культур могут по желанию содержать многообразие других ингредиентов, включая, но, не ограничиваясь, источниками углерода (например, натуральные сахара, искусственные сахара и т.д.), коферментами, липидами, сахарами, нуклеозидами, компонентами, извлеченными из животных, гидролизатами, гормонами/факторами роста, поверхностно-активными веществами, индикаторами, минералами, активаторами/ингибиторами специфических ферментов и органическими веществами (например, бутиратом, который вызывает апоптоз, что, в свою очередь, высвобождает гликозилаты, часто замедляет темп роста клеток, который меняет уровни гликозилтрансферазы, тем самым может привести к более развившемуся гликозилированию и вызвать изменение энергии клеток; хлорохином, который влияет на внутриклеточный pH; бетаином, средством защиты от осмоса; аммиаком, который меняет уровни внутриклеточного pH и может изменить эффективность действия трансферазы гликозила и т.д.) и/или малыми молекулярными метаболитами (например, CMP-сиаловой кислотой, глюкозамином, производными от ненатуральных сахаров и т.д.). Среды клеточной культуры, пригодные для использования согласно раскрытию сущности настоящего изобретения, доступны для приобретения из множества источников, например, у компании ATCC (г. Манассас (Manassas), штат Вирджиния, США).
В определенных вариантах выполнения изобретения для роста клеток используется одна или более следующих сред: среда RPMI-1640, среда Dulbecco's Modified Eagle's, среда существенного минимума Eagle, среда F-12K и среда Iscove's Modified Dulbecco's Medium. Специалистам обычной квалификации в предметной области должно быть понятно, что в случае использования определенной свободной от сыворотки и/или пептонов среды она, как правило, существенно обогащается аминокислотами и следовыми элементами (обратитесь, например, к патенту США №5,122,469, выданному Матеру и др. (Mather et al.), и патенту США №5,633,162, выданному Кину и др. (Keen et al.)).
Различные среды клеточных культур могут влиять на конфигурацию гликозилирования гликопротеинов, экспрессивно выраженных в средах. Например, данная среда клеточной культуры может привести к производству гликопротеинов с возросшей конфигурацией гликозилирования, уменьшенной конфигурацией гликозилирования или к измененному процессу гликозилирования (например, возрастание определенных гликанов и уменьшение количества других гликанов). Специалист обычной квалификации в предметной области должен знать и уметь выбирать одну или более пригодных для использования сред клеточных культур для выращивания клеток, чьи гликаны клеточной поверхности следует проанализировать с помощью определенных способов согласно раскрытию сущности настоящего изобретения.
В некоторых вариантах выполнения изобретения клетки выращиваются как периодическая культура, культура с подпиткой, культура с кровоснабжением, статическая суспензия (например, вращающиеся флаконы, Т-образные колбы, микроносители, T150 и т.д.) и/или применение шейкеров.
Клетки, продуцирующие, по меньшей мере, один гликопротеин, расположенный вне клеточной поверхности (то есть целевой гликопротеин), согласно раскрытию сущности настоящего изобретения могут быть выращены при любых из многообразия условий клеточных культур.
В некоторых вариантах выполнения изобретения клетки выращиваются при таких условиях культивирования клетки, чтобы целевой гликопротеин, как ожидается, отображал желательную конфигурацию гликозилирования. В некоторых вариантах выполнения изобретения одно или более условий культивирования клеток регулируется или модифицируется для производства целевого гликопротеина с более желательной конфигурацией гликозилирования. Такие условия культивирования клеток, которые можно регулировать или модифицировать, охватывают, но не ограничиваются, pH, уровнями CO2, уровнями кислорода, темпом перемешивания культуры, условиями окисления-восстановления, температурой культуры, плотностью клетки, плотностью засевания культуры, продолжительностью жизни культуры, конструкцией реактора, темпом разбрызгивания и/или осмотической концентрацией раствора.
В случае необходимости любой из многообразия способов может быть использован для отщепления клеток от среды культивирования клеток. В определенных вариантах выполнения изобретения клетки выращиваются в суспензионной структуре. В таких вариантах выполнения изобретения клетки могут быть очищены от среды культивирования клеток за один или более циклов центрифугирования и промывки (например, с помощью пригодных для этого физиологических растворов, таких как солевой раствор, буферизированный фосфатом).
В определенных вариантах выполнения изобретения культура выращивается в среде культуры, полученной мазком. В таких вариантах выполнения изобретения клетки могут быть очищены от среды клеточной культуры в первом высвобождении их из поверхности размещения культуры. Например, клетки могут быть высвобождены из поверхности размещения культуры путем обработки их этилендиаминтетрауксусной кислотой (ЭДТК). Специалисты обычной квалификации в предметной области должны быть осведомлены и о других подходящих для этого агентах, которые можно использовать для высвобождения смежных клеток из поверхности размещения культуры. После высвобождения клетки могут быть очищены за один или более циклов центрифугирования и промывки (например, с помощью пригодных для этого физиологических растворов, таких как солевой раствор, буферизированным фосфатом). Как и в случае клеток, выращенных в суспензионной культуре, следует соблюдать осторожность, чтобы не подвергать клетки центрифугированию со слишком большой силой и тем самым избегнуть ненужного разрыва клеток.
Анализ гликанов клеточной поверхности
Для обнаружения гликанов на клеточной поверхности согласно раскрытию сущности настоящего изобретения можно использовать любой удобный способ. Гликаны можно обнаружить и/или проанализировать в клетке, например, в то время, как та произвела только часть гликопротеина. Например, согласно определенным вариантам выполнения изобретения гликаны обнаруживаются и/или анализируются на клетках при отсутствии обработки протеазой или гликозидазой. Как альтернатива или дополнение гликаны могут быть высвобождены из клеток и затем обнаружены и/или проанализированы. Гликаны могут быть высвобождены из клеток в результате обработки последних одной или более протеазами или гликодазами либо обоими ферментами. Например, гликопептид может быть высвобожден из клетки в результате его обработки одной или более протеазами без ограничений, такими как те, что описаны в данном изобретении, после чего высвобожденный гликопептид обрабатывается одной или более гликозидазами без ограничений, такими как те, что описаны в данном изобретении. В качестве ничем неограниченного примера гликаны могут быть высвобождены из клетки непосредственно за счет ее обработки гликозидазой без использования для такой обработки протеазы. Определенные типичные аналитические способы рассматриваются более подробно ниже по тексту, однако они не предназначены для ограничения объема раскрытия сущности настоящего изобретения.
Высвобождение гликопептидов
В определенных вариантах выполнения настоящего изобретения согласно раскрытию его сущности одна стадия в составе стадии анализа гликанов, расположенных на клеточной поверхности, предназначена для высвобождения таких гликанов из клеточной поверхности. Среди нескольких преимуществ, предлагаемых такими вариантами выполнения изобретения, - возможность получения популяции расположенных на клеточной поверхности гликанов высокой чистоты без значительного загрязнения гликанами, которые, главным образом, находятся внутри клетки. Например, при использовании определенных способов согласно раскрытию сущности настоящего изобретения происходит существенное избегание лизиса клеток в момент высвобождения гликанов клеточной поверхности из клетки. В качестве дополнения или альтернативы в определенных раскрытых в данном изобретении способах предлагаются значительные снижение количества стадий и/или устранение трудностей при выполнении стадий манипулирования по сравнению с доступными в настоящее время способами.
В определенных вариантах выполнения изобретения гликопротеины клеточной поверхности высвобождаются из поверхности клеток за счет обработки клетки одной или более протеазами. Протеазы разрывают амидные связи в пределах цепи полипептида. Существует несколько классов протеаз, включая как химические, так и ферментные агенты. К протеолитическим ферментам относятся, например, серин-протеазы, треонин-протеазы, цистеин-протеазы, протеазы аспарагиновой кислоты, металлопротеазы и протеазы глутаминовой кислоты. Неограниченные ничем примеры специфических протеолитических ферментов, которые можно использовать согласно раскрытию сущности настоящего изобретения, охватывают трипсин, химотрипсин, эластазу, субтилизин, протеиназу K, пепсин, фицин, бромелин, плазмепсин, ренин, химозин, папаин, катепсин (например, катепсин K), каспазу (например, CASP3, CASP6, CASP7, CASP14), калпаин 1, калпаин 2, гермолизин, карбоксипептидазу A или B, матричную металлопротеиназу, протеазу глутаминовой кислоты и/или комбинации вышеупомянутых ферментов. Специалисты обычной квалификации в предметной области должны знать ряд других протеиназ, которые можно использовать согласно раскрытию сущности настоящего изобретения для высвобождения гликопротеина из клеточной поверхности.
Современные способы анализа клеточных гликопротеинов, даже если они недвусмысленно определены как гликаны клеточной поверхности, обычно особо неизбирательные для гликанов клеточной поверхности. Например, в текущих способах обычно используется один или более сильнодействующих детергентов, предназначенных для экстракции протеинов мембраны, в результате воздействия которых сахара диализируются до момента их обработки агентами, удаляющими структуры гликана из протеинов и полипептидов. При таких условиях препараты гликанов загрязняются внутриклеточными гликанами, например теми из них, что поступают из эндоплазматической сети и/или комплекса Гольджи. Такие внутриклеточные гликаны обычно представляют собой типичные недоразвившиеся высокоманнозные гликаны. Таким образом, их включение может исказить результаты анализа структур гликанов, связанных с гликопротеинами из клеточной поверхности.
В некоторых вариантах выполнения настоящего изобретения согласно раскрытию его сущности анализ гликанов клеточной поверхности охватывает использование детергентов для высвобождения гликопротеинов клеточной поверхности из мембран. Однако в некоторых вариантах выполнения настоящего изобретения согласно раскрытию его сущности происходит минимизация обработки детергентами или ее полное устранение в пользу стратегических подходов, которые минимизируют нарушение целостности клеточных мембран. Например, в некоторых вариантах выполнения изобретения по меньшей мере, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или больше клеточных мембран остаются неповрежденными (например, так, как проконтролировано с помощью исключения трипанового синего бензидиного красителя). Среди всего прочего такие способы выгодны, так как могут снизить или исключить загрязнение, вносимое неразвившимися высокоманнозными гликопротеинами, которые находятся внутри клетки.
В определенных вариантах выполнения настоящего изобретения согласно раскрытию его сущности гликаны (в форме гликопептидов) высвобождаются из клеточной поверхности за счет ее обработки одной или более протеазами. В определенных вариантах выполнения изобретения клетки обрабатываются одной или более протеазами при условиях, которые минимизируют нарушение целостности клеточной мембраны. В некоторых вариантах выполнения настоящего изобретения согласно раскрытию его сущности гликаны высвобождаются из клеточной поверхности за счет ее обработки одной или более протеазами в течение ограниченного периода времени во избежание значительного лизиса клеточной мембраны. В определенных вариантах выполнения изобретения клетка обрабатывается одной или более протеазами в течение такого достаточно ограниченного периода времени, при котором существенный лизис клеточной мембраны не происходит.
Например, клетка может обрабатываться одной или более протеазами в течение периода времени, который составляет менее чем около 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 мин. В определенных вариантах выполнения изобретения клетка обрабатывается одной или более протеазами в течение периода времени, длящегося более чем 15 минут и столь продолжительного во избежание значительного лизиса клеточной мембраны. Например, достаточно низкая концентрация протеазы (протеаз), достаточно низкая температура и/или любой иной из многообразия других факторов или условий может быть использован таким образом, чтобы полная активность протеазы снизилась до величины, при которой существенный лизис клеточной мембраны не происходит. Специалисты обычной квалификации в предметной области должны знать и уметь использовать факторы или условия, которые гарантируют отсутствие существенного лизиса клеточной мембраны.
В определенных вариантах выполнения настоящего изобретения согласно раскрытию его сущности, по меньшей мере, приблизительно 50%, 60%, 70%, 80%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гликанов клеточной поверхности высвобождаются из клеток, например, в результате обработки протеазой. Для предоставления лишь одного конкретного примера скажем, что настоящее раскрытие сущности изобретения продемонстрировало случай, когда расщепление с помощью трипсина в течение 15 минут при температуре 37°C приводит к высвобождению более 50% гликанов клеточной поверхности.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки одной или более протеазами (например, протеолитическими ферментами) при концентрации, по меньшей мере, примерно 0,1 мг/мл. В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки одной или более протеазами (например, протеолитическими ферментами) при их концентрации менее чем примерно 2,0 мг/мл. В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки одной или более протеазами (например, протеолитическими ферментами) при концентрации примерно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,5, 3,0, 3,5, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0 мг/мл или выше.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки множеством протеаз. Например, клетка может обрабатываться 2, 3, 4, 5, 6, 7, 8, 9, 10 или более протеазами для высвобождения гликанов клеточной поверхности. Такое множество протеаз можно ввести в клетку одновременно или последовательно. В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки множеством протеаз одновременно, после чего высвобожденные гликаны (в форме гликопептидов) вычищаются из клетки.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются за счет обработки клетки первой протеазой (или множеством первых протеаз) в течение первого периода времени, после чего клетка обрабатывается второй протеазой (или множеством вторых протеаз) в течение второго периода времени. До обработки второй протеазой первая протеаза по желанию может быть удалена и/или инактивирована. В качестве примера первая протеаза может быть инактивирована инкубированием при температуре и в течение времени, достаточного для ее инактивации. В качестве дополнения или альтернативы первая протеаза может быть инактивирована инкубированием с помощью ингибитора, который специфичен по отношению к протеазе (например, антитело или другая молекула, которые определенным образом связывают первую протеазу и тормозят ее каталитическую активность). Другие способы инактивации первой протеазы должны быть известны специалистам обычной квалификации из предметной области. В случае когда первая протеаза инактивируется инкубированием с помощью специального ингибитора, следует обратить внимание на тот факт, что присутствие ингибитора не должно существенно тормозить активность второй протеазы.
В определенных вариантах выполнения изобретения протеаза (-ы) удаляется и/или инактивируется до высвобождения гликанов. В качестве примера протеаза может быть инактивирована инкубацией при температуре и в течение времени, достаточного для ее инактивации. В качестве альтернативы или дополнения протеаза может быть инактивирована инкубированием с помощью ингибитора или антитела либо других молекул, которые определенным образом связывают протеазу и тормозят ее каталитическую активность.
Высвобождение гликанов
В определенных вариантах выполнения настоящего изобретения согласно раскрытию его сущности гликаны клеточной поверхности расщепляются до проведения анализа. Например, в определенных вариантах выполнения изобретения одна или более структур гликанов расщепляется из гликопептидов клеточной поверхности после высвобождения их из клетки (например, с помощью обработки протеазами так, как описано более подробно выше). В определенных вариантах выполнения изобретения одна (или более) структура гликанов расщепляется из гликопротеинов клеточной поверхности, которые не были высвобождены из клетки.
В определенных вариантах выполнения изобретения одна (или более) структура гликанов высвобождается с помощью обработки ферментом или множеством ферментов, которые распознают и расщепляют структуры гликанов. Любой из многообразия глюкозидных и других ферментов, которые выделяют структуры гликана из гликопротеинов клеточной поверхности, могут быть использованы согласно раскрытию сущности настоящего изобретения. Несколько примеров таких ферментов рассматриваются в работах Р. А. О'Нейла (R.A. O'Neill), Enzymatic release of oligosaccharides from glycoproteins for chromatographic and electrophoretic analysis ([Ферментное высвобождение олигосахаридов из гликопротеинов для хроматографического и электрофоретического анализа], J. Chromatogr. [Журнал хроматографии], A 720, стр.201-215. 1996; и С. Прайма и др. (S. Prime, et al.), Oligosaccharide sequencing based on exo- and endo-glycosidase digestion and liquid chromatographic analysis of the products [Секвенирование олигосахаридов, основанное на расщеплении экзо- и эндогликозидазы и на анализе продуктов с помощью жидкостной хроматографии], J. Chromatogr. [Журнал хроматографии], A 720, стр.263-274, 1996, каждая из работ целиком включена в данную заявку ссылкой. В определенных вариантах выполнения изобретения фермент PNGase F (пептид N-гликозидаза F) используется для удаления гликанов из гликопептида или гликопротеина. Фермент PNGase F представляет собой амидазу, которая расщепляет амидовую связь между самой дальней GlcNAc и остатками аспарагина высокой маннозы, а также отделяет гибридные или комплексные олигосахариды от N-связанных гликопротеинов. Как дополнение или альтернатива ферменты PNGase A, O-гликанaзы, и/или Endo-H используются для удаления гликанов в определенных вариантах выполнения изобретения.
Для повышения доступности сайта гликозилирования к ферменту расщепления большинство гликопротеинов требуют выполнения стадии денатурации протеина. Обычно это выполняется с помощью детергентов (например, додецилсульфат натрия) и/или дисульфидвосстанавливающих агентов (например, бета-меркаптоэтанола), хотя способы денатурации гликопротеина для использования согласно раскрытию сущности настоящего изобретения не ограничиваются использованием таких агентов. Например, обработка высокой температурой может оказаться достаточной для денатурации гликопротеина так, чтобы пригодный фермент для расщепления структур гликана смог достичь сайта расщепления. В определенных вариантах выполнения изобретения гликопротеин денатурируется инкубированием гликопротеина при температуре 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 градусов по Цельсию или выше в течение периода времени, достаточного для денатурации гликопротеина.
В определенных вариантах выполнения изобретения комбинация детергентов, дисульфидвосстанавливающих агентов, высокой температуры и/или других агентов или условий реакции используются для денатурации гликопротеина. Специалисты обычной квалификации в предметной области должны иметь представление о пригодных для использования условиях, периодах инкубации и т.д., которые будут достаточны для денатурации гликопротеина. Отмечено, что олигосахариды, расположенные в законсервированных сайтах Fc иммуноглобулина G (IgG), легко расщепляются с помощью PNGase F. Таким образом, стадия денатурации протеина обычно не требуется для молекул IgG в случае применения этого фермента. Фермент PNGase F также способен удалять олигосахариды в разбавленном растворе гидроокиси аммония, стабилен в течение 24 часов при содержании мочевины при концентрации 2,5M и температуре 37°C и по-прежнему обладает 40% своей активности при содержании мочевины при концентрации 5M. Таким образом, фермент PNGase F характеризуется преимуществом в виде способности выделять гликаны из гликопротеинов при определенных условиях денатурации.
Другие пригодные для использования ферменты, которые можно применять для расщепления структур гликанов из гликопротеинов согласно раскрытию сущности настоящего изобретения, включают, но не ограничиваются, PNGase A, O-гликаназой и/или Endo-H. Специалисты обычной квалификации в предметной области должны иметь представление о других пригодных к употреблению ферментах для выделения гликанов из гликопротеинов. В определенных вариантах выполнения изобретения для выделения структур гликанов из гликопротеинов используется множество ферментов. В определенных вариантах выполнения изобретения такое множество ферментов расщепления вводится одновременно. В определенных вариантах выполнения изобретения такое множество ферментов расщепления вводится последовательно.
В определенных вариантах выполнения изобретения одна или более структур гликанов выделяется из гликопротеинов клеточной поверхности с помощью применения агента, отличного от фермента. В определенных вариантах выполнения изобретения химический агент или множество химических агентов (например, обработка такими агентами как гидразин, борогидрид натрия, эндогликозидазы и/или трифторометансульфоновая кислота (TFMS) и/или бета-удаление и т.д.) могут быть использованы для выделения структур гликанов из гликопротеинов. Например, использование химического гидразина было успешно реализовано для расщепления структур гликана. В качестве другого примера без ограничения предполагалось, что смесь аммиака и карбоната аммония можно использовать для высвобождения от щелочи как N-, так и O-связанных олигосахаридов в их естественном виде (обратитесь к работе Ю.Хуанга и др. (Y.Huang, et al.), Microscale nonreductive release of O-linked glycans for subsequent analysis through MALDI mass spectrometry and capillary electrophoresis [Микромасштабное невосстановительное высвобождение O-связанных гликанов для последующего анализа с применением масс-спектрометрии МАЛДИ и капиллярного электрофореза], Anal. Chem. (Анал. химии), 73, 6063-60, 2001, целиком включенной в это изобретение ссылкой). Специалисты обычной квалификации в предметной области должны иметь представление о других пригодных для использования химических агентах, которые можно применять согласно раскрытию сущности настоящего изобретения. В некоторых случаях использование химического агента для расщепления структур гликана из гликопротеина приводит к такому же разложению протеина, как и расщепление. Однако после расщепления структура гликана часто очищается от компонента протеина, входящего в состав гликопротеина, до проведения анализа и/или исследования. В таких ситуациях разложение компонента протеина после обработки химическим агентом не причиняет вреда практике раскрытия сущности настоящего изобретения. В некоторых случаях разложение компоненты протеина может даже способствовать процессу очищения расщепленной структуры (структур) гликанов.
В некоторых вариантах выполнения изобретения гликаны, которые высвобождались из гликопротеина и/или с клеточной поверхности, могут быть расщеплены с помощью одной или нескольких экзогликозидаз, а структура и/или композиция продуктов их расщепления может быть проанализирована.
Экзогликозидазы - это ферменты, которые устраняют концевые гликозидные связи из невосстанавливающейся конечной части цепи гликанов. Они, как правило, отличаются высокой спецификой по отношению к конкретным связям моносахаридов и к конфигурации сцепления остатка (anomericity) (α/β). В некоторых вариантах выполнения изобретения смежные конфигурации разветвленности смогут оказать влияние на специфичность экзогликозидаз. Обработка экзогликозидазами обычно приводит к получению гликанов, стандартные антеннальные связи которых расщеплены до сердцевины пентасахарида (M3N2), которая содержит 3 остатка маннозы и 2 остатка glcNAc. Однако необычно модифицированные виды (например, антеннальные или те, ядро которых фукозилировано, высокоманнозные или гибридные гликаны, гликаны, цепи которых растянуты за счет лактозамина, сульфурированные гликаны, фосфорилированные гликаны и т.д.) не поддаются обработке экзогликозидазами и могут быть представлены с нужным размещением и определены количественно на хроматограмме относительно пентасахарида M3N2.
В некоторых вариантах выполнения изобретения экзогликодазы, используемые согласно раскрытию сущности настоящего изобретения, распознают и расщепляют только один определенный тип гликозидной связи. В некоторых вариантах изобретения экзогликодазы, используемые согласно раскрытию сущности настоящего изобретения, распознают и расщепляют более одного определенного типа гликозидной связи. Типичные экзогликозидазы, которые можно использовать согласно раскрытию сущности настоящего изобретения, охватывают, но не ограничиваются сиалидазой, галактозидазой, гексозаминидазой, фукозидазой и маннозидазой. Экзогликозидазы можно получить из любого источника, включая коммерческие организации (например, у компаний QA-Bio, ProZyme, Roche, Sigma, NEB, EMD, Glyko и т.д.). Как альтернатива или дополнение экзогликозидазы могут быть выделены и/или очищены от источника клеточного строения (например, от бактерий, дрожжей, растений и т.д.).
В некоторых вариантах выполнения изобретения экзогликозидазы (например, сиалидазы, галактозидазы, гексозаминидазы, фукозидазы и маннозидазы) могут быть разделены на многочисленные категории или «подмножества». В некоторых вариантах выполнения изобретения различные подмножества проявляют различные возможности в процессе расщепления различных типов связей. В Таблице 1 представлены некоторые типичные экзогликозидазы, специфичность их связей и организм, из которого они были получены. Специалисту обычной квалификации из предметной области следует обратить внимание на то, что этот список экзогликозидаз представляет собой типичные примеры и не является всеобъемлющим, а любая экзогликозидаза с любой специфичностью связи может быть использована согласно раскрытию сущности настоящего изобретения.
Холерный вибрион Clostridium perfringens (анаэробная инфекция)
Streptococcus pneumonia (пневмококк)
Виды Xanthomonas (болезнь с/х культур)
Виды стрептококка
E.coli (кишечная палочка)
E.coli (кишечная палочка)
3.2.1.30
Streptococcus pneumonia (пневмококк)
Бактероиды
Канавалия мечевидная
3.2.1.111
Миндальная крошка
Согласно раскрытию сущности настоящего изобретения гликаны, которые были высвобождены из гликопротеина и/или клеточной поверхности, смогут быть расщеплены с помощью любой экзогликозидазы. В определенных вариантах выполнения изобретения гликаны расщепляются обработкой популяции гликанов множеством экзогликозидаз. Например, популяция гликанов может быть подвергнута обработке 2, 3, 4, 5, 6, 7, 8, 9, 10 или большим числом экзогликозидаз. В некоторых вариантах выполнения изобретения многочисленные экзогликозидазы вводятся одновременно. В некоторых вариантах выполнения изобретения многочисленные экзогликозидазы вводятся последовательно. В некоторых вариантах выполнения изобретения изменение идентичности вводимых экзогликозидаз раскрывает информацию о структуре и/или композиции гликана. В некоторых вариантах выполнения изобретения изменение последовательности ввода многочисленных экзогликозидаз раскрывает информацию о структуре и/или композиции гликана.
В некоторых вариантах выполнения изобретения последовательное расщепление с помощью многочисленных экзогликозидаз раскрывает информацию о структуре и/или композиции гликана, которая отличается от информации, раскрытой в результате одновременного расщепления с помощью того же самого набора экзогликозидаз. В некоторых вариантах выполнения изобретения последовательное расщепление с помощью многочисленных экзогликозидаз раскрывает информацию о структуре и/или композиции гликана, которая является такой же информацией, раскрытой в результате одновременного расщепления с помощью того же самого набора экзогликозидаз. Для более полного обсуждения практичности расщепления экзогликозидазами в анализе структуры гликана обратитесь к находящейся в процессе одновременного рассмотрения временной заявке на патент США U.S.S.N. 60/923,688, зарегистрированной 16 апреля 2007 года Парсонсом и др. (Parsons et al.) под заголовком “CHARACTERIZATION OF N-GLYCANS USING EXOGLYCOSIDASES” [ИССЛЕДОВАНИЕ N-ГЛИКАНОВ С ПОМОЩЬЮ ЭКЗОГЛИКОЗИДАЗ], которая включена в данное изобретение путем ссылки.
Анализ гликанов
Гликаны могут быть проанализированы любым методом, включая, например, связывание лигандов, масс-спектрометрию, ядерный магнитный резонанс и/или другие методологии. Разнообразие способов для анализа гликанов известно в предметной области. Например, обратитесь к работам Анумула (Anumula), Anal. Biochem (Анал. биохимии), 350(1): 1-23, 2006; Кляйна и др. (Klein et al.), Anal. Biochem., 179:162-66, 1989; и Таунсенда Р. Р. (Townsend R. R.), Carbohydrate Analysis: High Performance Liquid Chromatography and Capillary Electrophoresis [Углеводный анализ: высокопроизводительная жидкостная хроматография и капиллярный электрофорез]. Под редакцией З. Эл. Расси (Z. El Rassi), стр. 181-209, 1995, Юаня и др. (Yuan et al.), J. Chromatography A [Журнал хроматографии] (2005) 1067: 145-152, каждая из которых полностью включена в данное изобретение путем ссылки.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности высвобождаются из клетки до анализа их структуры (например, с помощью обработки протеазами и/или гликозидазами, такими как те, что описаны выше). Конфигурации гликозилирования высвобожденных гликопротеинов клеточной поверхности могут быть проанализированы одним или более способами, взятыми из их многочисленного набора. В качестве неограниченного примера гликозилирование конфигурации высвобожденных гликанов клеточной поверхности может характеризоваться такими способами, как ЯМР, масс-спектрометрия, жидкостная хроматография, 2-мерная хроматография, электрофорез в ПААГ, окрашивание антителами, окрашивание лектином, количественное определение моносахаридов, капиллярный электрофорез, электрофореза углеводов с использованием флуорофора (FACE), мицеллярная электрокинетическая хроматография (МЭКХ), обработка экзогликозидазой или эндогликозидазой и комбинации вышеуказанных методов. Специалисты обычной квалификации в предметной области должны знать и другие способы, которые можно использовать для исследования высвобожденных гликанов клеточной поверхности.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности не высвобождаются из клетки до анализа их структуры. Конфигурация гликанов клеточной поверхности, которые присоединены к поверхности клетки, может быть проанализирована одним или более из разнообразия способов.
Рассматриваемые в качестве неограниченных примеров гликаны клеточной поверхности могут быть исследованы такими способами, как связывание антител, связывание лектина, и их комбинациями. Связывание антитела, лектина или другого агента, который распознает одну или более специфических структур гликанов, может быть проконтролировано любым из множества способов, включая, например, иммунофлуоресценцию, хемилюминисценцию, твердофазные иммуноферментные анализы (ELISA), проточную цитометрию и т.д. Специалисты обычной квалификации в предметной области должны знать и другие способы, которые можно использовать для исследования конфигураций гликозилирования гликанов клеточной поверхности на поверхности клеток.
В определенных вариантах выполнения изобретения гликаны клеточной поверхности анализируются во время высвобождения из клеток, очищаются и затем снова анализируются. Например, в некоторых вариантах выполнения изобретения такие гликаны исследуются такими способами, как хроматографические способы, способы масс-спектрометрии, электрофоретические способы, способы ядерного магнитного резонанса (ЯМР) и комбинациями вышеупомянутых методов. Например, в некоторых вариантах выполнения изобретения гликаны исследуются одним или более способами, к которым относятся ЯМР, масс-спектрометрия, жидкостная хроматография, 2-мерная хроматография, электрофорез в ПААГ, окрашивание антителами, окрашивание лектином, количественное определение моносахаридов, капиллярный электрофорез, электрофорез углеводов с использованием флуорофора (FACE), мицеллярная электрокинетическая хроматография (МЭКХ), обработка экзогликозидазой или эндогликозидазой и комбинации вышеуказанных методов.
В некоторых вариантах выполнения изобретения структура и композиция N-гликана может быть проанализирована хроматографическими методами, включая, но не ограничиваясь, жидкостную хроматографию (ЖХ), высокоэффективную жидкостную хроматографию (ВЭЖХ), ультравысокоэффективную жидкостную хроматографию (УВЭЖХ), тонкослойную хроматографию (ТСХ), хроматографию с применением амидовой колонки и комбинации вышеуказанных способов.
В некоторых вариантах выполнения изобретения структура и композиция N-гликана могут быть проанализированы с помощью масс-спектрометрии (МС) и связанных с нею способов, включая, но, не ограничиваясь, тандемной МС, ЖХ-МС, ЖХ-МС/МС, масс-спектрометрией с матрично-активированной лазерной десорбцией/ионизацией (МАЛДИ-МС), масс-спектрометрией с преобразованием Фурье (FTMS), разделением подвижности ионов с помощью масс-спектрометрии (IMS-MS), диссоциацией с переносом электронов (ETD-MS) и комбинациями вышеуказанных способов.
В некоторых вариантах выполнения изобретения структура и композиция N-гликана могут быть проанализированы с применением электрофоретических способов, включая, но, не ограничиваясь, капиллярным электрофорезом (КЭ), КЭ-МС, гель-электрофорезом, электрофорезом в агарозном геле, электрофорезом в акриламидовом геле, электрофорезом в геле додецилсульфат натрия и полиакриламида (электрофорезом в ПААГ) с последующим вестерн-блоттингом на основе антител, которые распознают специфические структуры гликана и их комбинации.
В некоторых вариантах выполнения изобретения структура и композиция N-гликана могут быть проанализированы с применением ядерного магнитного резонанса (ЯМР) и связанных с ним способов, включая, но не ограничиваясь, одномерный ЯМР (1D-NMR), двумерный ЯМР (2D-NMR), ЯМР с вращением магнитного угла на базе корреляционной спектроскопии (COSY-NMR), ЯМР на базе полностью корреляционной спектроскопии (TOCSY-NMR), ЯМР на базе гетероядерной одноквантовой когеренции (HSQC-NMR), ЯМР на базе гетероядерной мультиквантовой когеренции (HMQC-NMR), ЯМР на базе спектроскопии вращательного ядерного эффекта Оверхаузера (ROESY-NMR), ЯМР на базе спектроскопии ядерного эффекта Оверхаузера (NOESY-NMR) и комбинациями вышеуказанных способов.
Специалисты обычной квалификации в предметной области должны знать и другие способы, которые можно использовать для исследования конфигураций гликозилирования гликопротеинов, высвобожденных из поверхности клетки.
В определенных вариантах выполнения изобретения гликопротеин клеточной поверхности и/или структуры гликана маркируются до проведения исследования. Специалистам обычной квалификации в предметной области известно, что маркирование может повысить сигнал или уменьшить фоновый шум во время исследования. Любой из множества маркеров может быть использован согласно раскрытию сущности настоящего изобретения, включая, но, не ограничиваясь, флуоресцентные метки, радиоактивные и/или хемилюминесцентные метки. В определенных вариантах выполнения изобретения структуры гликана маркируются флуоресцентным 2-аминобензамидом (“2-AB”). Специалисты обычной квалификации в предметной области должны знать и другие подходящие метки, которые можно использовать согласно раскрытию сущности настоящего изобретения.
Приложения
Следует обратить внимание на то, что способы, описанные в данном изобретении, могут быть использованы в любом из множества приложений. В общем случае эти способы полезны для любого приложения, которое охватывает структурное исследование гликанов, и особенно полезны там, где желательно исследовать гликаны, связанные с целевым гликоконъюгатом (например, гликопротеин), однако отщепление целевого гликоконъюгата занимает много времени и сил или озадачивает другими проблемами (например, теми, что связаны с неустойчивостью гликоконъюгата и т.д.).
Способы согласно раскрытию сущности настоящего изобретения можно применить в отношении гликанов, полученных из широкого разнообразия источников, включая, но, не ограничиваясь, формулы лекарств и биологические образцы (например, те, что содержат клетки). Такой биологический образец может подвергаться одному или нескольким стадиям анализа и/или очищения до или после анализа согласно раскрытию сущности настоящего изобретения. Для предоставления всего лишь нескольких примеров скажем, что в некоторых вариантах выполнения изобретения биологический образец обрабатывается одной или более протеазами и/или гликозидазами (например, такими, которые высвобождают гликаны); в некоторых вариантах выполнения изобретения гликаны клеточной поверхности в биологическом образце помечаются одним или более обнаруживаемыми маркерами или другими агентами, которые могут облегчить проведение анализа, например, с помощью масс-спектрометрии или ЯМР. Любой из множества стадий выделения и/или отщепления может быть применен к биологическому образцу согласно раскрытию сущности настоящего изобретения.
Раскрытие сущности настоящего изобретения может быть использовано для анализа гликанов клеточной поверхности в любом из множества состояний, включая, например, свободные гликаны, гликоконъюгаты (например, гликопептиды, гликолипиды, протеогликаны и т.д.) или клетки либо компоненты клеток и т.д.
Способы раскрытия сущности настоящего изобретения могут быть использованы на одном или на нескольких стадиях разработки производственного процесса для получения лечебного гликопротеина или другого интересующего гликопротеина, значимого в торговом отношении. Ничем не ограниченные примеры стадий разработки такого производственного процесса, в которых могут использоваться способы раскрытия сущности настоящего изобретения, включают выбор клетки, выбор клона, оптимизацию среды, условия культивирования, условия процесса и/или процедуру очистки. Специалисты обычной квалификации в предметной области должны знать и другие стадии разработки производственного процесса.
Раскрытие сущности настоящего изобретения также можно использовать для контроля степени и/или типа гликозилирования, происходящего в определенной культуре клеток, в результате чего допускается регулирование и возможное прекращение существования культуры, например, для достижения желательной конфигурации гликозилирования или во избежание развития особой нежелательной конфигурации гликозилирования.
Раскрытие сущности настоящего изобретения также можно использовать для оценки характеристик гликозилирования клетки или линий клеток, которые рассматриваются как кандидаты для производства конкретного желательного гликопротеина (например, даже до момента внесения изменений в клетки или линии клеток для производства гликопротеина или для производства гликопротеина на значимом в коммерческом отношении уровне).
В некоторых вариантах изобретения согласно раскрытию его сущности желательная конфигурация выполнения гликозилирования для конкретного целевого гликопротеина известна, а описанная в данном изобретении технология позволяет контролировать образцы культуры для оценки прогресса производства в направлении, предназначенном для создания желательной конфигурации гликозилирования. Например, там, где заказной гликопротеин относится к лечебному типу, например, прошедшему регуляторное обследование в одной или нескольких странах, часто желательно следить за развитием культур для оценки возможности создания с их помощью продукта с конфигурацией гликозилирования, приближенной как можно ближе к установленной конфигурации гликозилирования фармацевтического продукта независимо от его производства по точно такой же технологии. В использованном здесь смысле “близкий” указывает на конфигурацию гликозилирования, которая, по меньшей мере, примерно на 75%, 80%, 85%, 90%, 95%, 98% или 99% коррелируется с установленной конфигурацией гликозилирования фармацевтического продукта. В таких вариантах выполнения изобретения образцы производственной культуры обычно многократно выбираются в разные моменты времени и сравниваются с установленным стандартом или контрольной культурой для оценки относительного уровня гликозилирования.
В некоторых вариантах выполнения изобретения способы согласно раскрытию его сущности можно использовать для контроля конфигурации гликозилирования клеточной поверхности во время культивирования клеток, которые производят гликопротеин. Например, производство гликопротеина (например, коммерческое производство) может охватывать стадии (1) культивирования клеток, продуцирующих гликопротеин, (2) получения образцов через постоянные или непостоянные периоды времени в процессе культивирования клеток и (3) анализа конфигурации гликозилирования выращенного гликопротеина в полученных образцах. В некоторых вариантах выполнения изобретения такие способы могут дополнительно охватывать стадию сравнения конфигураций гликозилирования клеточной поверхности в полученных образцах друг с другом и/или конфигурации гликозилирования одного или нескольких гликопротеинов, находящихся вне клеточной поверхности и продуцируемых значимой клеткой (-ами). В некоторых вариантах выполнения изобретения такие способы могут дополнительно охватывать стадию сравнения конфигураций гликозилирования клеточной поверхности в одном или нескольких полученных образцах с конфигурациями гликозилирования эталонного образца.
В некоторых вариантах выполнения настоящего изобретения согласно его сущности желательные конфигурации гликозилирования (например, конфигурации гликозилирования клеточной поверхности и/или конфигурации гликозилирования, наблюдаемые с помощью продуцируемого вне клеточной поверхности гликопротеина) будут в большей степени всесторонними. Например, в некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования показывает высокое заполнение (например, больше чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более этого) сайтов гликозилирования; в некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования показывает высокую степень разветвленности (например, выше примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более при использовании три- или тетра-антеннальных структур).
В некоторых вариантах выполнения настоящего изобретения согласно его сущности желательные конфигурации гликозилирования будут в меньшей степени всесторонними. Например, в некоторых вариантах выполнения изобретения гликозилирование желательной конфигурации клеточной поверхности указывает на низкое заполнение (например, меньше примерно 50%, примерно 45%, примерно 40%, примерно 35%, примерно 30%, примерно 25%, примерно 20%, примерно 15%, примерно 15%, примерно 5%, примерно 1% или еще менее) сайтов гликозилирования и/или низкую степень разветвленности (например, меньше чем примерно 20%, примерно 15%, примерно на 10%, примерно 5%, примерно 1% или менее при использовании три- или тетра-антеннальных структур).
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет более всесторонней в некоторых аспектах и менее всесторонней в других. Например, может оказаться желательным применить линию клеток, которые характеризуются тенденцией выращивания гликопротеинов с длинными неразветвленными цепями олигосахаридов. В качестве альтернативы желательно использовать линию клеток, которые характеризуются тенденцией выращивания гликопротеинов с короткими существенно разветвленными цепями олигосахаридов.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет улучшена для получения определенной структуры гликана. Например, в некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет иметь низкие уровни (например, менее примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или еще менее) высоких маннозных или гибридных структур, высокие уровни (например, больше чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99%, или более) высоких маннозных структур, высокие уровни (например, больше чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более; например, по меньшей мере, одну на гликопротеин) фосфорилированной высокоманнозы; или низкие уровни (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или еще менее) фосфорилированной высокоманнозы.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования должна содержать, по меньшей мере, примерно одну сиаловую кислоту. В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет содержать высокий уровень (например, более чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более) концов цепи, которые сиализируются. В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования, которая включает сиализирование, продемонстрирует присутствие, по меньшей мере, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более содержимого N-ацетилнейраминовой кислоты и/или менее примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее содержимого N-гликолилнейраминовой кислоты.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования проявляет специфичность в виде удлинения цепи (например, выше, чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или большее удлинение разветвлений α-1,6-маннозы либо выше, чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или большее удлинение разветвлений α-1,3-маннозы).
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет проявлять низкий уровень (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее) или высокий уровень (например, более, чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или больше) фуколизирования ядра.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет проявлять низкий уровень содержания (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее) или высокий уровень (например, более чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более) сульфурированного гликана.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет проявлять низкий уровень содержания (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее) или высокий уровень (например, более чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более) фосфорилированного гликана.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет проявлять низкий уровень содержания (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее) или высокий уровень (например, более чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более) сиаловой кислоты, связанной с N-ацетилглюкозамином.
В некоторых вариантах выполнения изобретения желательная конфигурация гликозилирования будет проявлять низкий уровень содержания (например, менее чем примерно 20%, примерно 15%, примерно 10%, примерно 5%, примерно 1% или менее) или высокий уровень (например, более чем примерно 60%, примерно 65%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 95%, примерно 98%, примерно 99% или более) ацетилированного гликана.
Независимо от мониторинга производства конкретного целевого протеина для контроля качества раскрытие сущности настоящего изобретения может быть использовано, например, для контроля процесса гликозилирования на определенных стадиях разработки или при определенных условиях выращивания выходного продукта.
В некоторых вариантах выполнения изобретения существующие способы, описанные в данном изобретении, можно использовать для исследования и/или управления или сравнения качества лечебных продуктов. В качестве лишь одного примера скажем, что можно использовать современные методологии с целью оценки гликозилирования клеточной поверхности в клетках, продуцирующих лечебный протеиновый продукт. В высокой степени из-за того, что гликозилирование часто может оказывать влияние на активность, биологическую доступность и прочие характеристики лечебного протеинового продукта, особо необходимы способы оценки клеточного гликозилирования во время производства такого лечебного протеинового продукта. Среди всего прочего раскрытие сущности настоящего изобретения может облегчить анализ гликозилирования в системах производства лечебного протеина, который проводится в реальном времени.
Независимо от мониторинга производства конкретного целевого протеина для контроля качества раскрытие сущности настоящего изобретения может быть использовано, например, для контроля процесса гликозилирования на определенных стадиях разработки или при определенных условиях выращивания выходного продукта.
В некоторых вариантах выполнения изобретения способы, описанные в данном изобретении, можно использовать для исследования и/или управления или сравнения качества лечебных продуктов. В качестве лишь одного примера скажем, что можно использовать современные методологии с целью оценки гликозилирования в клетках, продуцирующих лечебный протеиновый продукт. В высокой степени из-за того, что гликозилирование часто может оказывать влияние на активность, биологическую доступность и прочие характеристики лечебного протеинового продукта, особо необходимы способы оценки клеточного гликозилирования во время производства такого лечебного протеинового продукта. Среди всего прочего раскрытие сущности настоящего изобретения может облегчить анализ гликозилирования в системах производства лечебного протеина, который проводится в реальном времени.
Типичные лечебные продукты на основе гликопротеина, чье производство и/или качество можно проконтролировать согласно раскрытию сущности настоящего изобретения, включают, например, любое из широкого набора гематологических лечебных средств (включая, например, эритропоэтин, факторы для свертывания крови и т.д.), интерфероны, колониестимулирующие витамины, антитела, ферменты и гормоны, в особенности те, которые явно выражены на клеточной поверхности.
В некоторых вариантах выполнения изобретения раскрытие сущности изобретения обеспечивает способы, с помощью которых гликаны клеточной поверхности, взятые из различных источников или образцов, сравниваются друг с другом. В некоторых таких примерах многочисленные образцы поступают из одного и того же источника по прошествии длительного времени, так что изменения конфигурации гликозилирования (и, в частности, конфигурации гликозилирования клеточной поверхности) находится под контролем. В некоторых вариантах выполнения изобретения гликансодержащие образцы удаляются через постоянные промежутки времени. В некоторых вариантах выполнения изобретения содержащие гликан образцы удаляются через примерно 30 секунд, примерно 1 минуту, примерно 2 минуты, примерно 5 минут, примерно 10 минут, примерно 30 минут, примерно 1 час, примерно 2 часа, примерно 3 часа, примерно 4 часа, примерно 5 часов, примерно 10 часов, примерно 12 часов или примерно через 18 часов либо даже через более продолжительные периоды времени. В некоторых вариантах выполнения изобретения содержащие гликан образцы удаляются через непостоянные периоды времени. В некоторых вариантах выполнения изобретения содержащие гликан образцы удаляются через периоды времени длительностью 5 часов.
В некоторых вариантах выполнения изобретения один из образцов является давним образцом или записью о давнем образце. В некоторых вариантах выполнения изобретения один из образцов является эталонным образцом.
Как описано в настоящем изобретении, в определенных его вариантах выполнения способы согласно раскрытию сущности настоящего изобретения полезны в случае определения одной или нескольких характеристик конфигурации гликозилирования гликопротеина, продуцируемого клеткой. В определенных вариантах выполнения изобретения такие способы могут охватывать стадии: определения различия в конфигурации гликозилирования между первой конфигурацией гликозилирования первой поверхности, присутствующей в случае использования первого набора условий применительно к поверхности клетки, которая продуцирует интересующий гликопротеин, и второй конфигурацией гликозилирования поверхности, присутствующей в случае использования второго набора условий применительно к поверхности клетки, и на основании определенного различия - установления одной или нескольких характеристик конфигурации гликозилирования интересующего гликопротеина, продуцируемого клеткой. Например, конфигурации гликозилирования интересующего гликопротеина по прошествии длительного времени могут быть определены в результате установления конфигурации гликозилирования, присутствующей на поверхности клеток в различные моменты времени существования клеточной культуры.
Как дополнение или альтернатива изменения конфигурации гликозилирования интересующего гликопротеина, выращенного при соблюдении одного или нескольких различных параметров роста, могут быть протестированы для определения одного или нескольких желательных параметров роста или комбинаций параметров, предназначенных для производства гликопротеина. В определенных вариантах выполнения изобретения различия в конфигурации гликозилирования определяются наблюдением и/или измерением таких характеристик конфигурации гликозилирования, как, без ограничения, степень заполнения сайта гликозилирования, идентичность связанных гликанов, относительные количества связанных гликанов, полная или частичная композиции связанных гликанов и относительные количества связанных гликанов. Способы раскрытия сущности настоящего изобретения охватывают наблюдение и/или измерение других характеристик конфигураций гликозилирования, известных специалистам средней квалификации предметной области.
В некоторых определенных вариантах выполнения изобретения описанные в нем способы можно использовать для исследования и/или управления или сравнения качества лечебных продуктов без необходимости в выделении самих продуктов. Для предоставления только одного примера согласно раскрытию сущности настоящего изобретения скажем, что методологии, описанные в данном изобретении, можно использовать для оценки гликозилирования в клетках, продуцирующих лечебный продукт на базе протеина. Особо подчеркивается, что гликозилирование может часто влиять на активность, биологическую доступность или другие характеристики лечебного продукта на базе протеина, а способы оценки клеточного гликозилирования во время производства лечебного продукта на базе протеина особо желательны. Среди всего прочего раскрытие сущности настоящего изобретения может облегчить проведение анализа гликозилирования для производственных систем выпуска лечебного протеина в реальном времени.
В некоторых вариантах выполнения изобретения предоставленные там способы используются для контроля степени и/или типа гликозилирования, происходящего в различных образцах (например, в различных культурах клеток).
В некоторых вариантах выполнения изобретения гликаны из различных образцов культуры клеток, подготовленных в условиях, которые отличаются по одному или более выбранным параметрам (например, тип клетки, тип культуры [например, сравнение непрерывной и дозированной стимуляции роста и т.д..], условия культуры [например, тип среды, присутствие или концентрация конкретного компонента определенной среды (сред), осмотическая концентрация раствора, pH, температура, тайминг или уровень сдвига в одном или нескольких компонентах, таких как осмотическая концентрация раствора, pH, температура и т.д.], время существования культуры, стадии отщепления и т.д.), однако в остальном остаются идентичными, сравниваются таким образом, чтобы определить влияние выбранного параметра (-ов) на конфигурации N-гликозилирования. В определенных вариантах выполнения изобретения гликаны из различных образцов культуры клеток, подготовленные на условиях, которые отличаются по отдельному выбранному параметру, сравниваются таким образом, чтобы определить влияние отдельного выбранного параметра на конфигурации гликозилирования. Следовательно, в других приложениях настоящие методы могут облегчить определение влияния определенных параметров на конфигурации гликозилирования в клетках.
В некоторых вариантах выполнения изобретения сравниваются гликаны клеточной поверхности из различных наборов клеток, которые производят интересующий гликопротеин (например, лечебный гликопротеин), независимо от того, каким способом он был подготовлен - тем самым или другим, и независимо от способа введения ферментов - одновременного или раздельного. В таких вариантах выполнения изобретения раскрытие сущности настоящего изобретения облегчает контроль качества приготовления гликопротеина (то есть приготовления препарата целевого гликопротеина). Как альтернатива или дополнение некоторые такие варианты выполнения изобретения облегчают контролирование прогресса развития конкретной культуры, которая продуцирует интересующий гликопротеин (например, когда в разные моменты времени из культуры удаляются образцы, которые потом анализируются и сравниваются друг с другом). В любом из этих вариантов выполнения изобретения можно зарегистрировать особенности анализа гликана, например, при записи данных о контроле качества. Как указано выше, в некоторых вариантах выполнения изобретения сравниваются с давними записями о наборе ранее полученного гликопротеина и/или со стандартным гликопротеином, и/или с эталонным образцом.
В определенных вариантах выполнения настоящего изобретения раскрытие его сущности может быть использовано в исследованиях для модификации характеристик гликозилирования клетки, например, с целью установления линии клеток и/или условий роста культуры клеток с одной или более желательными характеристиками гликозилирования. После этого, если нужно, такая линия клеток и/или условия роста культуры могут быть использованы для производства конкретного целевого гликоконъюгата (например, гликопротеина), в котором характеристика (-и) такого гликозилирования, как ожидается, окажется полезной.
Согласно раскрытию сущности настоящего изобретения описанные в нем методы можно использовать для обнаружения желательных или нежелательных гликанов, например для обнаружения и количественного определения присутствия одной или нескольких загрязняющих примесей в продукте или для обнаружения и количественного определения присутствия одного или нескольких активных и желательных видов.
В различных вариантах выполнения изобретения можно использовать способы для оценки гликозилирования одного или нескольких биологических маркеров, указывающих, например, на вхождение в болезнь до проявления ее симптомов и/или на прогрессирование самой болезни до не поддающегося или менее поддающегося лечению состояния за счет обнаружения одного или нескольких специфических гликанов, появление или уровень которых (независимо от того, каким он является, - абсолютным или относительным) могут быть скоррелированы относительно конкретного состояния болезни (включая восприимчивость к конкретной болезни) и/или изменения в концентрации таких гликанов по прошествии длительного времени. Например, в некоторых вариантах выполнения изобретения согласно раскрытию его сущности целевой гликоконъюгат является биологическим маркером.
В определенных вариантах выполнения изобретения способы, описанные в данном изобретении, облегчают обнаружение гликанов, которые присутствуют на очень низких уровнях в источнике (например, биологический образец, препарат гликана и т.д.). В таких вариантах выполнения изобретения можно обнаружить и/или по желанию количественно определить уровни гликанов, которые присутствуют на уровнях, примерно менее чем 10%, 5%, 4%, 3%, 2%, 1,5%, 1%, 0,75%, 0,5%, 0,25%, 0,1%, 0,075%, 0,05%, 0,025% или 0,01% в пределах популяции гликанов. В некоторых вариантах выполнения изобретения можно обнаружить и/или по желанию количественно определить уровни гликанов в диапазоне 0,1-5%, например 0,1-2%, например 0,1-1%, препарата гликана. В определенных вариантах выполнения изобретения можно обнаружить и/или по желанию количественно определить уровни гликанов в диапазоне примерно от 0,1 фмол до 1 ммол.
В некоторых вариантах выполнения изобретения описанные в нем способы могут комбинироваться с одной или более другими технологиями для обнаружения, анализа или отщепления гликанов или гликоконъюгатов.
Комплекты
Реактивы, полезные в случае практического применения одного или нескольких способов согласно раскрытию сущности настоящего изобретения, желательно поставлять вместе собранными в комплект. В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов, полезных для высвобождения гликопротеинов из клеточной поверхности (например, одна или более протеаз, гликозидаз и/или других агентов), и/или такие дополнительные компоненты, как буферные растворы, кофакторы и прочее. В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов, полезных для очистки и/или анализа высвобожденного гликопротеина клеточной поверхности, полученного в клетках, из которых он был высвобожден.
В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов, полезных для отделения структур гликана от гликопротеина или гликопептида (например, такие ферменты, как PNGase F, PNGase A, O-гликаназа и/или Endo-H). В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов, полезных для очистки структур гликана, отделенных от протеиновой компоненты гликопротеинов или гликопептидов (например, одна или более гликозидаз).
В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов, полезных для маркировки структур гликанов. Например, комплекты согласно раскрытию сущности настоящего изобретения могут включать флуоресцентные, радиоактивные и/или хемилюминисцентные маркеры. В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения включают флуоресцентный 2-аминобензамид (“2-AB”).
В определенных вариантах выполнения изобретения комплекты согласно раскрытию сущности настоящего изобретения содержат один или более реактивов для культивирования клеток (например, среды для культивирования клеток, буферные растворы, компоненты сред и т.д.) и/или для очистки клеток после их культивирования.
Вышеупомянутое описание следует понимать лишь как репрезентативное и не предназначенное в качестве ограничения. Альтернативные способы и материалы для реализации раскрытия сущности изобретения и дополнительные приложения, в отношении которых можно применить раскрытие сущности настоящего изобретения, должны быть очевидны специалисту обычной квалификации из предметной области и предназначены для включения в сопутствующие пункты формулы изобретения.
Пояснение примером
Пример 1: Обнаружение гликанов клеточной поверхности, высвобожденных с помощью обработки экзогликозидазой, указывает на параллельные изменения в поверхности клеток и на гликозилирование клеток, расположенных вне поверхности
Клетки яичника китайского хомячка, которые производят интересующий гликопротеин клеточной поверхности (в данном случае антитело, которое не находится в клеточной поверхности), были выращены согласно стандартным условиям в двух разных средах: в первой среде, содержащей первое количество глюкозамина, и во второй среде, содержащей второе количество глюкозамина, отличающееся тем, что второе количество глюкозамина было больше его первого количества.
После заданного периода для выращивания культуры были собраны клетки и культура, всплывающие из одной и той же предназначенной для их размещения колбы. Клетки были гранулированы и промыты физиологическим раствором с фосфатным буфером для удаления компонент среды, надосадочная жидкость культуры была очищена до начала отщепления антитела продукта.
Для выделения продукта надосадочная жидкость культуры в течение ночного времени была инкубирована шариками сефарозы протеина A. После этого шарики были гранулированы и промыты физиологическим раствором с фосфатным буфером для удаления компонент среды. Продукт был элюирован 0,1 M раствором аминоуксусной кислоты с низким pH.
Для высвобождения гликопептидов клеточной поверхности одна аликвотная проба промытых клеток была обработана протеазой. Неповрежденные клетки были отделены от высвобожденных гликопептидов клеточной поверхности с помощью центрифугирования.
Гликаны с помощью ферментов были высвобождены из отщепленного антитела продукта или из высвобожденных гликопептидов клеточной поверхности в результате применения PNGase F. Отщепленные гликаны были флуоресцентно помечены и обработаны с помощью экзогликозидазы (сиалидазы, галактозидазы и гексозаминидазы) для сплющивания N-связанных гликанов до ядра M3N2; гликаны, которые были высвобождены с помощью этой обработки, анализировались посредством жидкостной хроматографии и/или масс-спектроскопии таким образом, чтобы определить относительные количества фуколизированных и нефуколизированных гликанов.
На Фиг.1 показано процентное отношение нефуколизированных гликанов, полученное путем наблюдения за гликопротеином, находящимся вне клеточной поверхности (продукт антитела) в первой (контрольной) и во второй (с повышенным содержанием глюкозамина) среде; на Фиг.3A-B показано то же самое процентное отношение, полученное путем наблюдения за гликанами клеточной поверхности в той же самой среде. На Фиг.2 показаны репрезентативные спектры, полученные с помощью жидкостной хроматографии для гликанов клеточной поверхности в том виде, в котором они были включены в подытоженные данные из Фиг.3A-B.
При рассмотрении Фиг.1 и 3 очевидно, что одинаковое увеличение нефукозилированных структур (то есть потеря фуколизации ядра альфа 1-6) наблюдается в отношении популяций как гликанов, расположенных вне клеточной поверхности, так и гликанов клеточной поверхности. Эти данные демонстрируют как возможность простого обнаружения, отщепления и/или анализа гликанов клеточной поверхности в результате применения способов, используемых согласно раскрытию сущности настоящего изобретения, так и дополнительную возможность отображения изменений в конфигурации гликозилирования вне клеточной поверхности при аналогичных изменениях конфигураций гликозилирования клеточной поверхности так, чтобы обнаружение гликанов клеточной поверхности могло действовать как заменитель средства обнаружения гликанов, расположенных не на клеточной поверхности.
Пример 2: Обнаружение гликанов клеточной поверхности на неповрежденных клетках или на высвобожденных гликанах клеточной поверхности указывает на параллельные изменения в поверхности клеток и на гликозилирование клеток, расположенных вне поверхности
Клетки яичника китайского хомячка, которые производят интересующий гликопротеин клеточной поверхности (в данном случае антитело, которое не находится на клеточной поверхности), были выращены согласно стандартным условиям в двух разных средах: в первой среде, содержащей первое количество N-ацетилманнозамина, и во второй среде, содержащей второе количество N-ацетилманнозамина, отличающееся тем, что второе количество N-ацетилманнозамина было больше его первого количества.
После заданного периода для выращивания культуры были собраны клетки и культура, всплывающие из одной и той же предназначенной для их размещения колбы. Клетки были гранулированы и промыты физиологическим раствором с фосфатным буфером для удаления компонент среды. Надосадочная жидкость культуры была очищена.
Продукт антитела, расположенного вне клеточной поверхности, был выделен в течение ночного времени от надосадочной жидкости культуры с помощью инкубирования шариками сефарозы протеина A. После этого шарики были гранулированы и промыты физиологическим раствором с фосфатным буфером. Продукт был элюирован 0,1 M раствором аминоуксусной кислоты с низким pH.
Одна аликвотная проба промытых клеток была растворена после обработки гипотоническим раствором, а полученные в результате мембраны гранулированы.
Сиаловые кислоты были высвобождены из выделенного продукта антитела и мембран с помощью обработки кислотой и выделены с применением ионообменной хроматографии. Полученные в результате сиаловые кислоты впоследствии были помечены как DMB (1,2-диамино-4,5-метилэнедиоксибензин-2HCl) и проанализированы с помощью высокоэффективной жидкостной хроматографии.
Одновременно с этим вторая аликвотная проба промытых клеток была подвергнута окрашиванию лектином и проанализирована с помощью проточной цитометрии. Уровни сиаловой кислоты были определены как для образца гликана клеточной поверхности, так и для образца гликана, расположенного вне клетки, в одинаковых условиях выращивания.
На Фиг.4 показаны результаты анализа уровней содержания сиаловой кислоты в клеточной поверхности, полученные посредством жидкостной хроматографии. На Фиг.5-7 показаны относительные значения содержания сиаловой кислоты в гликанах клеточной поверхности и в гликанах, расположенных вне клеточной поверхности, при разных условиях выращивания. Когда клетки выращиваются при увеличенных уровнях содержания N-ацетилманнозамина, можно увидеть, что аналогичное увеличение уровней сиаловой кислоты наблюдается как в популяции гликана, расположенного вне клеточной поверхности, так и в популяции гликана клеточной поверхности.
Эти данные демонстрируют как возможность простого обнаружения, выделения и/или анализа гликанов клеточной поверхности в результате применения способов, используемых в данном изобретении, так и дополнительную возможность отображения изменений в конфигурациях гликозилирования вне клеточной поверхности при аналогичных изменениях конфигураций гликозилирования клеточной поверхности так, чтобы обнаружение гликанов клеточной поверхности могло действовать как заменитель средства обнаружения гликанов, расположенных вне клеточной поверхности. Важно, чтобы данные демонстрировали свою способность контролировать гликозилирование интересующего продукта в реальном времени без необходимости выделения самого продукта.
Пример 3: Влияние добавления глюкозамина на клеточную поверхность и на сиалирование продукта
Клетки яичника китайского хомячка, которые производят продукт гликопротеина, культивировались в присутствии или отсутствии глюкозамина. Через 5 дней клетки и продукт были собраны и раздельно проанализированы на содержание сиаловой кислоты. Содержание сиаловой кислоты на клеточной поверхности было определено с помощью анионобменной хроматографии так, как показано на Фиг.8. Изменение процентного отношения содержания сиаловой кислоты относительно отсутствия добавки глюкозамина показано ниже в Таблице 2 как для клеточной поверхности, так и для продукта. Данные в Таблице 2 показаны как среднеквадратичные отклонения (S.D.) повторений.
Эти данные демонстрируют, что снижение сиалирования клеточной поверхности, связанное с добавлением глюкозамина, коррелируется со снижением сиалирования продукта.
Эквиваленты
Специалисты, квалифицированные в предметной области, используя ничего свыше обычного экспериментирования, должны распознавать или мочь установить многие эквиваленты конкретных вариантов выполнения изобретения согласно раскрытию описанной здесь его сущности. Область применения, связанная с раскрытием сущности настоящего изобретения, не подлежит ограничению вышеуказанным описанием, а подразумевается так, как изложено в прилагаемых пунктах формулы изобретения.
В формуле изобретения понятия в единственном числе могут означать один или более чем один, если не указано иное, или очевидное иным образом не вытекает из контекста. Пункты формулы изобретения или описания, которые охватывают “или” между одним или более членами группы, считаются соответственными, если один, несколько или все члены группы присутствуют, используются или иным образом значимы по отношению к данному продукту или химическому процессу, если не указано иное, или очевидное иным образом не вытекает из контекста. Раскрытие сущности изобретения включает такие его варианты выполнения, в которых присутствует, используется или иным образом значим по отношению к данному продукту или химическому процессу ровно один член группы. Раскрытие сущности изобретения включает такие варианты выполнения изобретения, в которых присутствуют, используются или иным образом существенны по отношению к данному продукту или химическому процессу более чем один или все члены группы.
К тому же следует понимать, что раскрытие сущности изобретения включает все изменения, комбинации и перестановки, при которых одно или более ограничений, элементов, условий, описательных терминов и т.д., взятых из одного или нескольких пунктов формулы изобретения, вносятся в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который зависит от другого такого пункта, может быть модифицирован для учета одного или более ограничений, содержащихся в любом другом пункте, который зависит от такого же базового пункта формулы изобретения. К тому же там, где в формуле изобретения излагается композиция, следует понимать, что способы использования композиции для любой из раскрытых здесь целей учтены, а способы приготовления композиции согласно любому из раскрытых здесь способов ее приготовления или других способов, известных специалистам из предметной области, также учтены, если не указано иное или же специалисту обычной квалификации в предметной области не становится очевидными возникновения противоречия и несовместимости.
Там где элементы представлены как списки, например, в формате формулы изобретения Маркуша, следует понимать, что при этом также раскрывается каждая подгруппа элементов, и любой элемент (-ы) может быть удален из группы. Следует понять, что в общем случае там, где на раскрытие сущности изобретения или на аспекты согласно раскрытию сущности изобретения ссылаются как на аспекты, содержащие конкретные элементы, особенности и т.д., определенные варианты выполнения изобретения согласно раскрытию его сущности или аспекты согласно раскрытию сущности изобретения состоят или значимо состоят из таких элементов, особенностей и т.д. С целью упрощения такие варианты выполнения изобретения не были изложены конкретно словесно в данной работе. Отметим, что термин “включающий” предполагается открытым для применения и позволяет включение дополнительных элементов или стадий.
Там, где даются диапазоны, включены конечные точки. К тому же, следует понять, что если не указано иное, или очевидное иным образом не вытекает из контекста и понимания специалиста обычной квалификации в предметной области, то значения, которые выражены как диапазоны, могут принимать любое конкретное значение или оказаться в поддиапазоне в пределах установленных диапазонов в разных вариантах выполнения изобретения согласно раскрытию сущности изобретения до десятых единицы нижнего предела диапазона, если контекст явно не указывает на иное.
Помимо этого, следует понять, что любой конкретный вариант выполнения настоящего изобретения согласно раскрытию его сущности, который оказывается среди предшествующих технологий, может быть однозначно исключен из любого или нескольких пунктов формулы изобретения. Поскольку такие варианты выполнения изобретения полагаются известными специалисту обычной квалификации в предметной области, они могут быть исключены даже в том случае, если это исключение не изложено в явной форме в этой работе. Любой конкретный вариант выполнения изобретения по композициям согласно раскрытию сущности изобретения (например, любая экзогликозидаза, любая гликозидная связь, любое условие проведения реакции, любой метод очистки, любой метод анализа продукта и т.д.) может быть исключен из любого или нескольких пунктов формулы изобретения по любой причине, которая может иметь или не иметь отношение к существованию предшествующих технологий.
Обсужденные выше и представленные по тексту публикации обеспечиваются исключительно для раскрытия с их помощью сущности изобретения до даты регистрации настоящей заявки. В данной работе нет ничего, что может быть истолковано как допущение того факта, что изобретатели не имеют права датировать задним числом такое раскрытие сущности изобретения на основании предшествующего раскрытия его сущности.
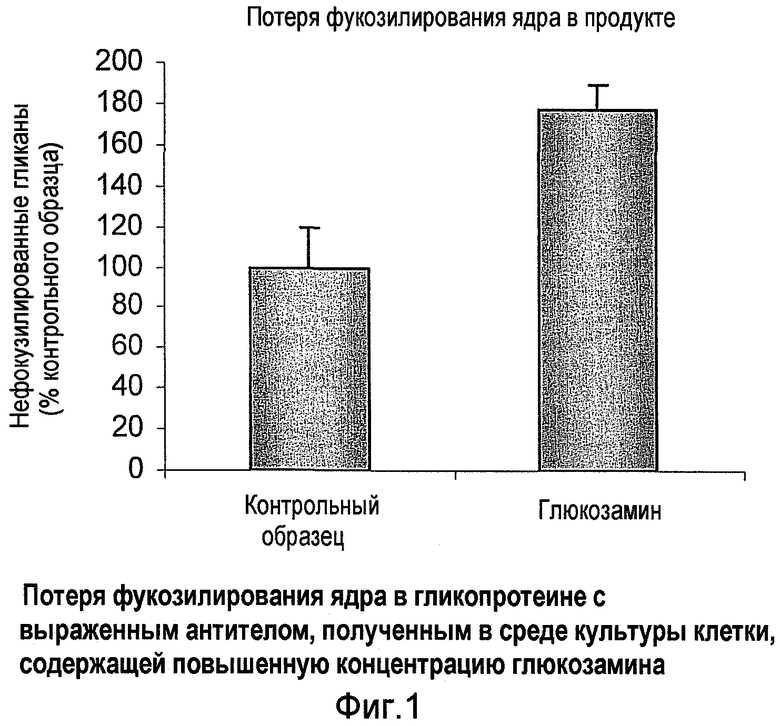
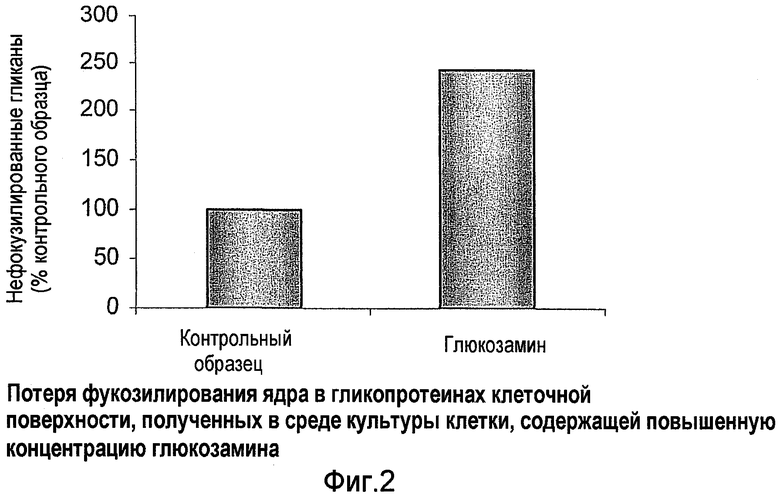
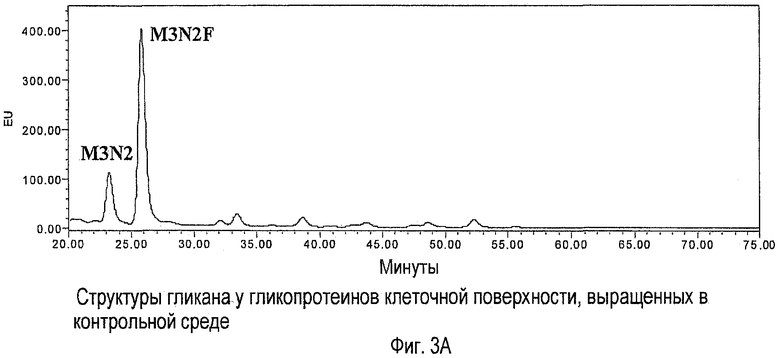
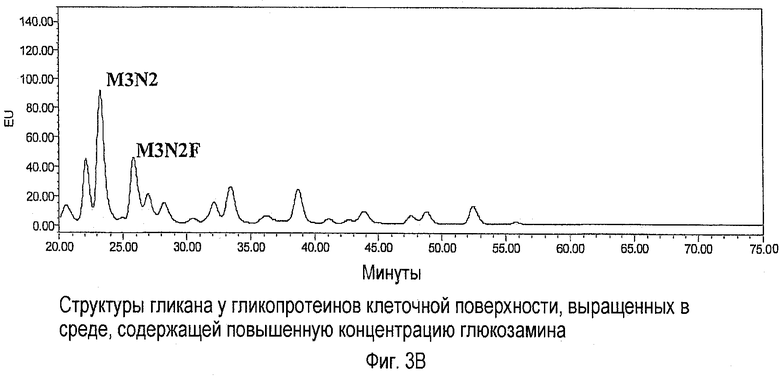
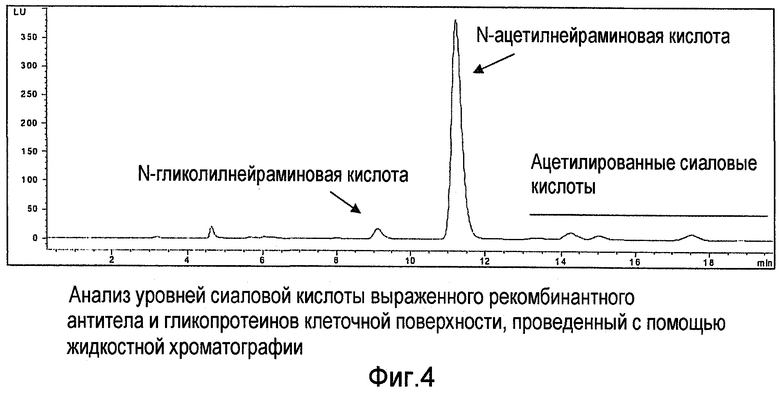
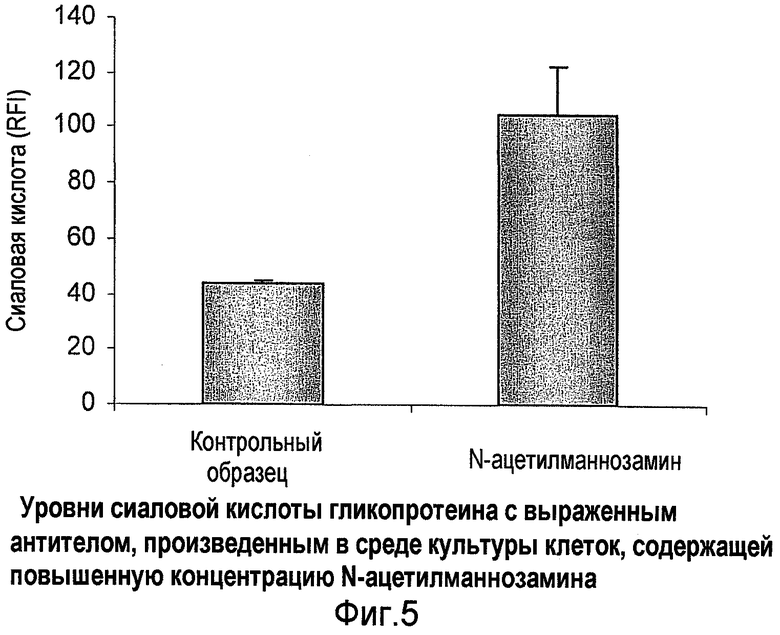
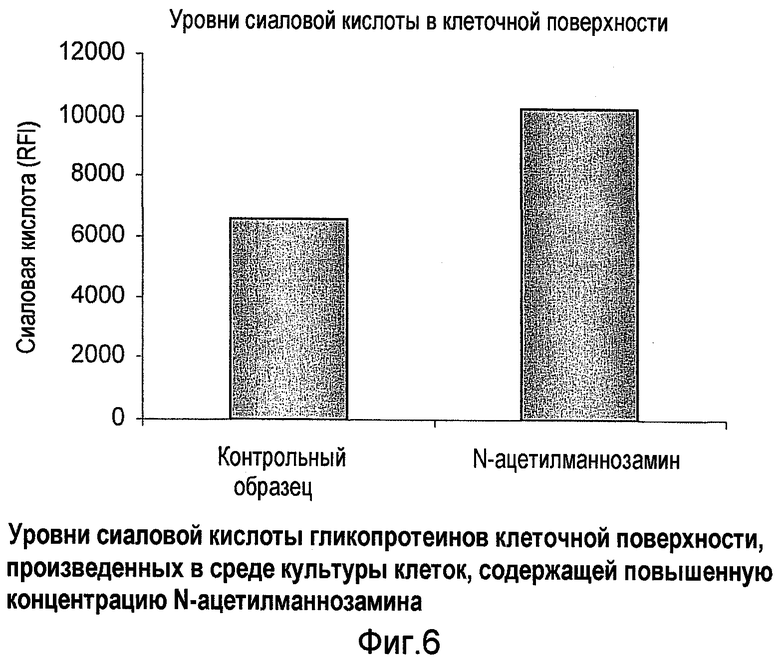
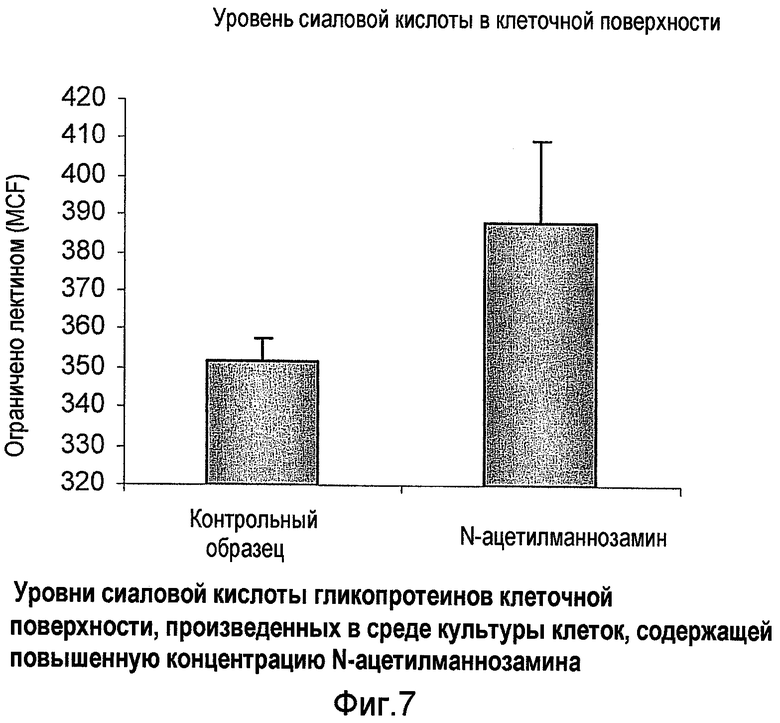
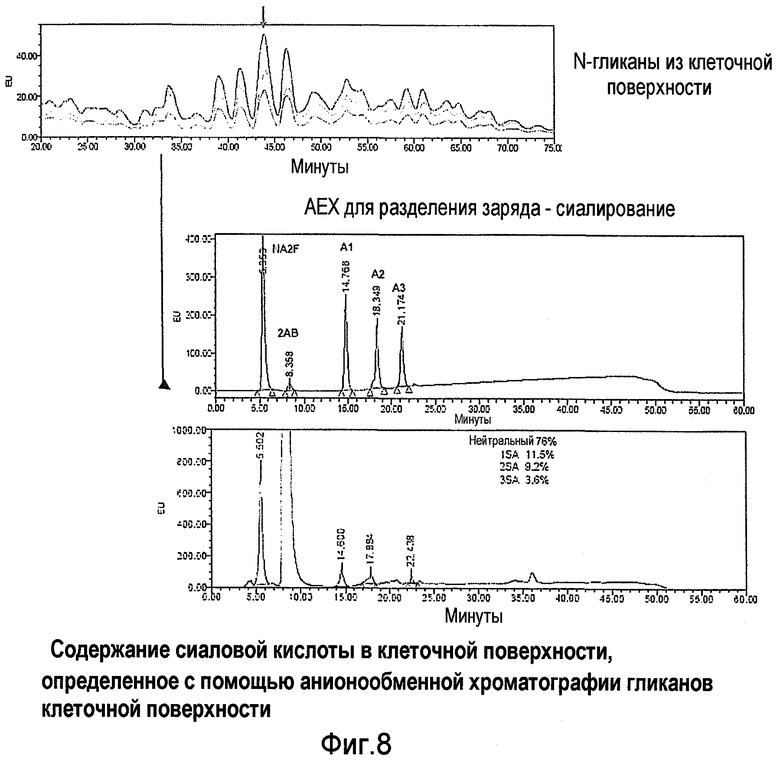
Изобретение относится к области биохимии, а именно лабораторным методам исследования. Сущность способа определения одной или нескольких характеристик конфигурации гликозилирования интересующего гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой, включает определение различия в конфигурации гликозилирования при разных наборах условий воздействия. Способ предполагает сравнение характеристик гликозилирования на поверхности клетки. На основе определенного различия устанавливают одну или несколько характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой. Использование заявленного способа позволяет точно установить одно или более различий в характеристике гликозилирования гликопротеина не на поверхности клетки, а также установить, что различия между первым гликаном клеточной поверхности и вторым гликаном клеточной поверхности коррелируют с одним или более различиями в конфигурации гликозилирования гликопротеина, расположенного не на клеточной поверхности. 5 н. и 26 з.п. ф-лы, 3 пр., 1 табл., 8 ил.
1. Способ определения одной или нескольких характеристик конфигурации гликозилирования интересующего гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой, включающий стадии:
a) определения различия в конфигурации гликозилирования между:
(i) первой конфигурацией гликозилирования поверхности при первом наборе условий для поверхности клетки, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности; и
(ii) второй конфигурацией гликозилирования поверхности при втором наборе условий для поверхности клетки; и
b) на основе определенного различия установление одной или нескольких характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой.
2. Способ по п.1, отличающийся тем, что одна или более характеристик включает изменение в конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности.
3. Способ по п.1, отличающийся тем, что стадия определения различия включает определение различия в сиалировании для первой и второй конфигураций гликозилирования поверхности.
4. Способ по п.3, отличающийся тем, что стадия установления одной или нескольких характеристик включает установление уровня сиалирования, присутствующего в конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности.
5. Способ по п.1, отличающийся тем, что:
клеткой, продуцирующей интересующий гликопротеин, расположенный не на клеточной поверхности, является культура клеток, продуцирующая интересующий гликопротеин, расположенный не на клеточной поверхности;
первый набор условий соответствует первому моменту времени так, чтобы первой конфигурацией гликозилирования поверхности являлась конфигурация, присутствующая на поверхности клеток культуры в первый момент времени, и второй набор условий соответствует второму моменту времени так, чтобы второй конфигурацией гликозилирования поверхности являлась конфигурация, присутствующая на поверхности клеток культуры во второй момент времени, так, чтобы стадия установления одной или нескольких характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, включала установление изменения во времени конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, и, следовательно, позволяла оценить статус или качество производства.
6. Способ по п.1, отличающийся тем, что:
клетка, продуцирующая интересующий гликопротеин, расположенный не на клеточной поверхности, представляет собой культуру клеток, продуцирующих интересующий гликопротеин, расположенный не на клеточной поверхности;
условия первого и второго наборов соответствуют различным наборам параметров роста, применимых к культуре клеток, продуцирующих интересующий гликопротеин, расположенный не на клеточной поверхности, так, чтобы установить желательные параметры роста для производства интересующего гликопротеина, расположенного не на клеточной поверхности.
7. Способ, определение влияния по меньшей мере одного параметра клеточной культуры на гликозилирование гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой в культуре, где способ включает стадии:
а) определения различия в конфигурации гликозилирования между:
(i) первой конфигурацией гликозилирования поверхности, присутствующей на поверхности клеток в первой культуре клеток;
(ii) второй конфигурацией гликозилирования поверхности, присутствующей на поверхности клеток в культуре, при этом первая культура и вторая культура отличаются друг от друга, по меньшей мере, одним параметром; и
b) на основе определения различия установление влияния, по меньшей мере, одного параметра для гликозилирования интересующих гликопротеинов, расположенных не на клеточной поверхности, продуцируемых клетками в культуре.
8. Способ по п.1 или 7, отличающийся тем, что стадия определения различия включает определение различия в характеристике, выбранной из группы, состоящей из: степени заполнения сайта гликозилирования, идентичности связанных гликанов, относительных количеств связанных гликанов, полной или частичной композиции связанных гликанов, относительных количеств связанных гликанов и комбинации вышеуказанных характеристик.
9. Способ по п.1, отличающийся тем, что стадия определения включает высвобождение, по меньшей мере, одного гликана клеточной поверхности из клетки и анализ высвобожденного гликана.
10. Способ по п.9, отличающийся тем, что стадия высвобождения включает обработку клетки протеазой.
11. Способ по п.10, отличающийся тем, что стадия обработки включает обработку протеазой таким образом, что высвобождается, по меньшей мере, один гликопротеин, расположенный не на клеточной поверхности, при этом обработка протеазой практически не повреждает клеточные мембраны.
12. Способ по п.1 или 7, отличающийся тем, что стадия определения не включает высвобождение гликанов из клеток.
13. Способ по п.9, отличающийся тем, что стадия высвобождения включает:
а) отщепление одного или нескольких протеин-связанных гликанов клеточной поверхности от гликопротеинов клеточной поверхности; и
b) исследование одного или нескольких отщепленных протеин-связанных гликанов клеточной поверхности.
14. Способ по п.13, отличающийся тем, что протеин-связанный гликан клеточной поверхности является N-связанным гликаном.
15. Способ по п.13, отличающийся тем, что протеин-связанный гликан клеточной поверхности является O-связанным гликаном.
16. Способ по п.13, отличающийся тем, что протеин-связанный гликан клеточной поверхности содержит, по меньшей мере, один остаток сиаловой кислоты.
17. Способ по п.1 или 7, дополнительно включающий стадию регистрации информации об определенном различии или, по меньшей мере, об одной из конфигураций гликозилирования на материальном носителе.
18. Способ определения одной или нескольких характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, продуцируемого клеткой, включающий:
a) получение клетки, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности, при этом клетка имеет, по меньшей мере, один гликан клеточной поверхности, присоединенный к поверхности клетки так, что клетка приобретает конфигурацию гликозилирования клеточной поверхности;
b) определение, по меньшей мере, одной характеристики конфигурации гликозилирования клеточной поверхности; и
c) на основании определенной характеристики установление одной или нескольких характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, при этом определенная характеристика коррелируется с одной или более характеристиками конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности.
19. Способ определения одного или нескольких различий в конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, включающий:
a) получение первой клетки, имеющей, по меньшей мере, первый гликан клеточной поверхности, присоединенный к поверхности первой клетки, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности;
b) исследование, по меньшей мере, первого гликана клеточной поверхности;
c) получение второй клетки, имеющей, по меньшей мере, второй гликан клеточной поверхности, присоединенный к поверхности второй клетки, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности;
d) исследование, по меньшей мере, второго гликана клеточной поверхности;
e) определение одного или более различий между первым гликаном клеточной поверхности и вторым гликаном клеточной поверхности; и
f) установление одного или более различий в конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, при этом определенное различие или различия между первым гликаном клеточной поверхности и вторым гликаном клеточной поверхности коррелируются с одним или более различиями в конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности.
20. Способ определения одной или более характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, включающий стадии:
a) получения клетки, содержащей, по меньшей мере, один гликан клеточной поверхности, присоединенный к поверхности клетки, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности; и
b) исследования, по меньшей мере, одного гликана клеточной поверхности; и
с) определения одной или более характеристик конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности, при этом, по меньшей мере, один исследованный гликан коррелируется с одной или более характеристиками конфигурации гликозилирования для интересующего гликопротеина, расположенного не на клеточной поверхности.
21. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что интересующий гликопротеин, расположенный не на клеточной поверхности, является гликопротеином, который не продуцируется клеткой в обычных условиях.
22. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что клетка, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности, была модифицирована для продуцирования интересующего гликопротеина, расположенного не на клеточной поверхности.
23. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что интересующий гликопротеин, расположенный не на клеточной поверхности, является гликопротеином, который не продуцируется клеткой в обычных условиях, и клетка, которая продуцирует интересующий гликопротеин, расположенный не на клеточной поверхности, была модифицирована для продуцирования интересующего гликопротеина, расположенного не на клеточной поверхности, на повышенном уровне или при предопределенных условиях.
24. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что интересующий гликопротеин, расположенный не на клеточной поверхности, является рекомбинантным гликопротеином.
25. Способ по п.24, отличающийся тем, что рекомбинантный гликопротеин выбран из группы, состоящей из соматотропина человека, фактора коагуляции VIIa, фактора коагуляции IX, интерферона алфакон-1, инсулина гларгин и инсулина.
26. Способ по п.24, отличающийся тем, что рекомбинантный гликопротеин представляет собой рекомбинантное антитело.
27. Способ по п.26, отличающийся тем, что рекомбинантное антитело выбрано из группы, состоящей из этанерцепта, инфликсимаба, адалимумаба, басиликсимаба, даклизумаба, омализумаба, гемтузумаба, алемтузумаба, ритуксимаба, цетуксимаба, бевацизумаба, паливизумаба и абциксимаба.
28. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что интересующий гликопротеин, расположенный не на клеточной поверхности, является коммерческим гликопротеином, который производится в промышленных масштабах.
29. Способ по любому из пп.1, 7, 18, 19 и 20, отличающийся тем, что интересующий гликопротеин, расположенный не на клеточной поверхности, является терапевтическим белковым продуктом.
30. Способ по п.29, отличающийся тем, что терапевтический белковый продукт является или включает продукт, выбранный из группы, состоящей из гематологического средства, интерферона, колониестимулирующего фактора, антитела, фермента и гормона.
31. Способ по п.30, отличающийся тем, что терапевтический белковый продукт является или включает антитело.
| WO 2004019040 A1, 04.03.2004 | |||
| DENNIS J.W | |||
| Glycoprotein glycosylation and cancer progression | |||
| Biochim Biophys Acta | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| MIROSLAWA FERENS-SIECZKOWSKA et al Haptoglobin glycoforms in a case of carbohydrate-deficient glycoprotein syndrome | |||
| Glycoconjugate Journal | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2013-02-20—Публикация
2008-04-15—Подача