Изобретение относится к медицинской иммунологии, а именно к способам определения функциональной активности компонентов комплемента в сыворотке крови человека при диагностике ряда заболеваний и в биологических препаратах.
С1 ингибитор системы комплемента в качестве ингибитора сериновых протеиназ участвует в регуляции многих ферментов плазмы крови, таких как C1r, C1s - компонентов классического пути комплемента, калликреина калликреин-кининовой системы, а также факторов свертывающей и противосвертывающей систем - XIa, XIIa, XIIf и плазмина (фибринолизина) [1]. Хотя С1 ингибитор и относится к классу серпинов (ингибиторов сериновых протееиназ), известно, что такие ингибиторы не всегда способны осуществлять свое действие в отношении любой сериновой протеиназы, в особенности это относится к высоко специфичным ферментам.
Необходимость определения функциональной активности C1 ингибитора в крови больных диктуется тем обстоятельством, что дефицит этого белка приводит к периодическим отекам, затрагивающим главным образом конечности, лицо, гортань и слизистую оболочку желудочно-кишечного тракта [1, 2].
Наиболее перспективным из современных методов определения белков сыворотки крови является метод иммуноферментного анализа благодаря своей чувствительности, избирательности и возможности автоматизации аналитического процесса. В патенте США [3] использован модифицированный метод определения активности С1 ингибитора, основанный на тест-системе производства Cycotech (Сан Диего, Калифорния, США). Способ предусматривает следующие этапы: 1 - на микропанели сорбируют авидин, 2 - получают высокоочищенный ферментативно активный препарат субкомпонента C1s, 3 - синтезируют биотинилированный препарат C1s, 4 - образцы проб, содержащих определяемый функционально активный С1-ингибитор, инкубируют с биотинилированным препаратом C1s, 5 - образующийся комплекс функционально активного С1-ингибитора с C1s сорбируют в лунках микропанели, покрытых авидином, 6 - количество связавшегося в лунках С1-ингибитора определяют с помощью конъюгата козьих антител против С1-ингибитора с пероксидазой хрена и хромогенного субстрата для пероксидазы. К недостаткам метода можно отнести его многостадийность (использование дополнительной стадии взаимодействия биотин-авидин), а также необходимость получения биотинилированного C1s и трудности в приобретении ферментативно активного C1s (присутствует в сыворотке крови в проферментной форме в количестве 30 мг/л, коммерчески недоступен).
Ранее был разработан способ определения функциональной активности С1 ингибитора [4], который предусматривает: сорбцию в лунках микропанели фибринолизина (аптечный препарат плазмина), образцы проб, содержащих определяемый функционально активный С1 ингибитор, вносят в лунки микропанели и проводят инкубацию, во время которой происходит ковалентное связывание С1 ингибитора с фибринолизином, количество связавшегося в лунках С1 ингибитора определяют с помощью конъюгата антител против С1 ингибитора с пероксидазой хрена и хромогенного субстрата для пероксидазы. Способ основан на способности функционально активного С1 ингибитора ковалентно связываться с фибринолизином. К недостаткам метода можно отнести высокую протеолитическую активность плазмина и его склонность к автолизу, что обусловливает низкую стабильность плазмина при хранении и возможность нежелательного гидролиза ингибитора.
Таких недостатков лишены протеазы, обладающие ограниченной специфичностью. Одним из наиболее специфичных ферментов является IgA1-протеаза микробного происхождения, для которой практически отсутствуют другие субстраты, кроме единственного природного - человеческого иммуноглобулина А1. Однако не было известно подвергается ли этот фермент ингибированию С1 ингибитором, то есть способен ли он ковалентно связывать этот ингибитор. Сама же IgA1-протеаза, продуцируемая Neisseria meningitidis, имеет определенные коммерческие перспективы. Известен метод определения ее активности [5], использования ее для определения иммуноглобулинов А1 и А2 человека [6] и метод ее выделения из культуры Neisseria meningitidis [7].
Задачей заявленного изобретения является повышение надежности определения функциональной активности С1 ингибитора комплемента человека на основе иммуноферментного метода.
Поставленная задача достигается путем разработки способа иммуноферментного определения фунциональной активности С1 ингибитора по способности связываться с IgA1-протеазой, который предусматривает: сорбцию в лунках микропанели высокоспецифичной IgA1-протеазы, внесение в лунки микропанели образцов проб, содержащих определяемый функционально активный С1 ингибитор, проведение инкубации, во время которой происходит ковалентное связывание С1 ингибитора с IgA1-протеазой, определение количества связавшегося в лунках С1 ингибитора с помощью конъюгата антител против С1 ингибитора с ферментом и хромогенного субстрата для этого фермента. Способ основан на способности функционально активного С1 ингибитора ковалентно связываться с IgA1-протеазой.
Техническим результатом заявленного изобретения является разработка надежного способа и набора для иммуноферментного определения функциональной активности С1 ингибитора комплемента человека, использующего высокоспецифичную IgA1-протеазу.
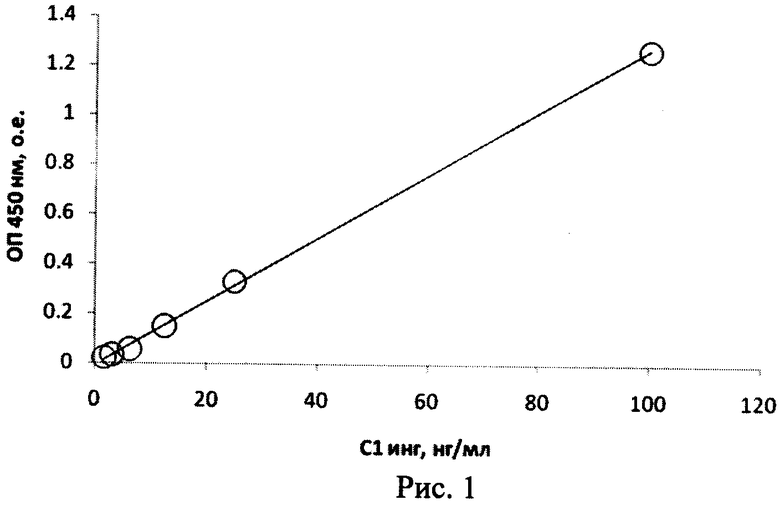
Пример 1. Иммуноферментное определение функциональной активности препарата С1 ингибитора по способности связываться с IgA1-протеазой. Препарат IgA1-протеазы Neisseria meningitidis в 0,05 М натрий-карбонатном буфере, рН 9,5, с конечной концентрацией 15-50 мкг/мл вносят по 100 мкл раствора в каждую лунку плоскодонного полистиролового 96-луночного планшета. Закрывают крышкой и оставляют на ночь при 4°С. Три раза отмывают планшет вероналовым буферным раствором, рН 7,4, содержащим 0,15 М NaCl, 0,15 мМ Са2+ и 0,5 мМ Mg2+(VBS2+), по 200 мкл в каждую лунку, затем планшет осушают путем вытряхивания остатка жидкости. В каждую лунку планшета вносят по 100 мкл VBS2+. В лунки планшета вносят по 100 мкл раствора, содержащего определяемый С1 ингибитор в VBS2+, в подобранном разведении. После инкубации в термостате в течение 1 ч при 37°С, трехкратной отмывки фосфатным буфером, рН 7,4, содержащим 0,15 М NaCl и 0,05% Твин-20, и осушения планшета в каждую лунку вносят по 100 мкл конъюгата пероксидазы с антителами против С1 ингибитора человека в том же буфере в подобранном разведении. После инкубации в термостате в течение 1 ч при 37°С, пятикратной отмывки с детергентом и осушения планшета в каждую лунку вносят по 100 мкл субстратного буфера (3,3',5,5'-тетраметилбензидин в 15 мл цитратно-фосфатного буфера, рН 5,0, и 50 мкл 3% перекиси водорода). После 15-30 мин инкубации в темноте реакцию останавливают внесением в каждую лунку 50 мкл 14% серной кислоты. Результаты реакции учитывают с помощью спектрофотометра с вертикальным лучом измерением светопоглощения при 450 нм. Количество компонента С1 ингибитора рассчитывают по стандартной кривой (рис.1).
На рисунке представлено определение активности С1 ингибитора методом иммуноферментного анализа.
Пример 2. Набор для иммуноферментного определения функциональной активности С1 ингибитора по способности связываться с IgA1-протеазой. Набор содержит плоскодонную микропанель с сорбированным препаратом IgA1-протеазы, конъюгат пероксидазы с антителами к С1 ингибитору человека, субстратный буфер и стандарт с известной активностью С1 ингибитора человека. Данный набор используется в соответствии с примером 1.
Из приведенных на рисунке результатов следует, что измеряемая оптическая плотность линейно зависит от концентрации активного С1 ингибитора с коэффициентом корреляции R2=0,999, что позволяет достоверно определять функциональную активность С1 ингибитора заявленным способом в концентрациях от 1 нг/мл с использованием описанного набора.
ЛИТЕРАТУРА
1. Davis A.E. 3rd. C1 inhibitor and hereditary angioneurotic edema. Ann. Rev. Immunol. 1988. V.66. P.595-628.
2. Андина C.C., Козлов Л.В., Дьяков В.Л. Определение функциональной активности, количества С1 ингибитора и аутоантител к нему как инструмент дифференциальной диагностики отеков. Биомедицинская химия. 2004. Т.50. №1. С.86-91.
3. Pilatte Y.M., Hammer C.H., Frank M.M., Fries L.F. Process for the purification of C1-inhibitor. Patent USA US 5030578. July 9, 1991.
4. Козлов Л.В., Андина C.C., Гузова B.A., Дьяков В.Л., Баталова Т.Н. Способ определения функциональной активности C1 ингибитора комплемента человека. Патент РФ №2195662. Бюл. №36. 27.12.2002.
5. Козлов Л.В., Романов С.В., Дьяков В.Л., Суровцев В.И., Теймуразов М.Г. Способ и набор для иммуноферментного определения активности и ингибирования IgA1-протеазы. Патент РФ №2310853. Бюл. №32. 20.11.2007.
6. Козлов Л.В., Бичучер A.M., Романов С.В., Дьяков В.Л., Панурина Р.Л. Способ и набор для иммуноферментного определения IgA1 и IgA2 на основе поликлональным антител к IgA. Патент РФ №2310854. Бюл. №32. 20.11.2007.
7. Ягудаева Е.Ю., Жигис Л.С., Разгуляева О.А., Зуева B.C., Мельников Э.Э., Зубов В.П., Козлов Л.В., Бичучер A.M., Котельникова О.В., Аллилуев А.П., Аваков А.Э., Румш Л.Д. Выделение и определение активности IgA1-протеиназы из культуры N. meningitidis // Биоорган, химия. 2010. Т.36. №1. С.89-97.
Группа изобретений относится к медицинской иммунологии, а именно к способу определения функциональной активности компонентов комплемента в сыворотке крови человека при диагностике ряда заболеваний и в биологических препаратах и набору для его осуществления. Способ определения предусматривает: сорбцию в лунках микропанели IgA1-протеазы, внесение в лунки микропанели образцов проб, содержащих определяемый функционально активный С1 ингибитор, проведение инкубации, во время которой происходит ковалентное связывание С1 ингибитора с IgA1-протеазой, определение количества связавшегося в лунках С1 ингибитора с помощью конъюгата антител против С1 ингибитора с ферментом и хромогенного субстрата для этого фермента. Способ основан на способности функционально активного С1 ингибитора ковалентно связываться с IgA1-протеазой. Набор содержит плоскодонную микропанель с сорбированным препаратом IgA1-протеазы, конъюгат фермента с антителами к С1 ингибитору человека, субстратный буфер этого фермента и стандарт для активного С1 ингибитора. Группа изобретений обеспечивает разработку простого способа и набора для определения функциональной активности ингибитора С1 и исследования его ингибирования. 2 н.п. ф-лы, 1 ил.
1. Способ иммуноферментного определения функциональной активности С1 ингибитора по способности связываться с IgAl-протеазой, характеризующийся связыванием с сорбированной в лунках микропанели протеиназой С1 ингибитора определяемого образца с неизвестной активностью, определением количества связавшегося С1 ингибитора с помощью конъюгата фермента с антителами против С1 ингибитора и субстрата этого фермента и последующего расчета активности С1 ингибитора по количеству образовавшегося продукта ферментативной реакции, отличающийся тем, что в лунках микропанели для иммуноферментного анализа в качестве лиганда связывания сорбируют IgAl-протеазу.
2. Набор для иммуноферментного определения функциональной активности С1 ингибитора по способности связываться с IgAl-протеазой, характеризующийся тем, что он содержит плоскодонную микропанель с сорбированным препаратом IgAl-протеазой, конъюгат фермента с антителами к С1 ингибитору человека, субстратный буфер и стандарт для расчета активности С1 ингибитора.
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ И ИНГИБИРОВАНИЯ IGA1-ПРОТЕАЗЫ | 2006 |
|
RU2310853C1 |
| US 2006269538 A1, 30.11.2006 | |||
| КОЗЛОВ Л.В | |||
| Исследование функциональной активности компонентов и факторов системы комплемента человека | |||
| - Вопросы Мед | |||
| Химии, 2002, т.48, №6, с.624-631 | |||
| ТЕОДОРОВИЧ О.В | |||
| и др | |||
| Коррекция местных иммуно-метаболитических нарушений при аденоме предстательной железы в сочетании с хроническим простатитом | |||
| - Урология, 2010, №5, с.22-26. | |||
Авторы
Даты
2013-02-20—Публикация
2011-11-09—Подача