Область техники, к которой относится изобретение
Изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента оптически активное производное 4-фенилтиазола, обладающее активностью агониста рецептора тромбопоэтина.
Предшествующий уровень техники
Так как тромбопоэтин является полипептидным цитокином, состоящим из 332 аминокислот, и он промотирует продукцию тромбоцитов путем стимуляции дифференциации и пролиферации мегакариоцитов посредством рецептора, он допустим в качестве агента против заболеваемости болезнью крови, сопровождающейся аномальностью числа тромбоцитов, такой как тромбоцитопения. Нуклеотидная последовательность гена, кодирующего рецептор тромбопоэтина, описана в непатентном документе 1. Из патентного документа 1 и патентного документа 2 также известны низкомолекулярные пептиды, обладающие аффинностью в отношении рецептора тромбопоэтина, но пероральное введение указанных пептидных производных обычно не практикуется.
В качестве низкомолекулярного соединения, имеющего аффинность в отношении рецептора тромбопоэтина, производное 1,4-бензотиазепина описано в патентном документе 3 и патентном документе 4, производное 1-азонафталина описано в патентном документе 5, и производное 1,3-тиазола описано в патентных документах 6-22.
[Патентный документ 1] Японская выложенная патентная заявка (JP-A) № 10-72492.
[Патентный документ 2] Международная публикация WO 96/40750.
[Патентный документ 3] JP-A № 11-1477.
[Патентный документ 4] JP-A № 11-152276.
[Патентный документ 5] Международная публикация WO 00/35446.
[Патентный документ 6] JP-A № 10-287634.
[Патентный документ 7] Международная публикация WO 01/07423.
[Патентный документ 8] Международная публикация WO 01/53267.
[Патентный документ 9] Международная публикация WO 02/059099.
[Патентный документ 10] Международная публикация WO 02/059100.
[Патентный документ 11] Международная публикация WO 02/059100.
[Патентный документ 12] Международная публикация WO 02/062775.
[Патентный документ 13] Международная публикация WO 2003/062233.
[Патентный документ 14] Международная публикация WO 2004/029049.
[Патентный документ 15] Международная публикация WO 2005/007651.
[Патентный документ 16] Международная публикация WO 2005/014561.
[Патентный документ 17] JP-A № 2005-47905.
[Патентный документ 18] JP-A № 2006-219480.
[Патентный документ 19] JP-A № 2006-219481.
[Патентный документ 20] Международная публикация WO 2007/004038.
[Патентный документ 21] Международная публикация WO 2007/036709.
[Патентный документ 22] Международная публикация WO 2007/054783.
[Непатентный документ 1] Proc. Natl. Acad. Sci. USA, 1992, vol. 89, p. 5640-5644.
Описание изобретения
Задачи, которые должны быть решены изобретением
Создана фармацевтическая композиция, содержащая в качестве активного ингредиента оптически активное производное 4-фенилтиазола, обладающее активностью агониста рецептора тромбопоэтина, и предложен агент, регулирующий продукцию тромбоцитов, который может быть введен перорально.
Средства для решения задач
Ввиду указанных задач авторы настоящего изобретения продолжили интенсивное исследование и, как результат, создали фармацевтическую композицию, содержащую в качестве активного ингредиента следующее оптически активное производное 4-фенилтиазола, проявляющее превосходную активность агониста рецептора тромбопоэтина и высокую пероральную абсорбируемость и/или высокую активность in vivo, кристалл, имеющий высокую стабильность и/или высокую чистоту, а также полезное промежуточное соединение и его кристалл.
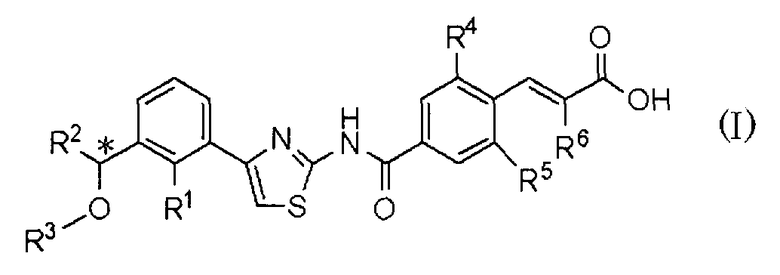
То есть, настоящее изобретение относится к 1) фармацевтической композиции, содержащей в качестве активного ингредиента оптически активное соединение, представленное формулой (I):
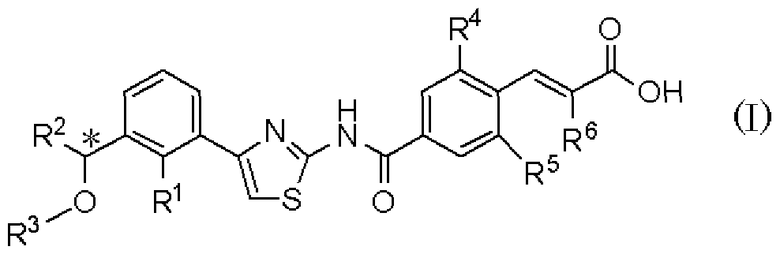
где R1 представляет атом галогена или С1-С3алкилокси; R2 представляет С1-С8алкил; R3 представляет С1-С8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет С1-С3алкил или С1-С3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемую соль или его сольват.
Настоящее изобретение дополнительно относится к следующим пунктам 2)-23).
2) Фармацевтической композиции по пункту 1, где R1 представляет метилокси.
3) Фармацевтической композиции по пункту 1 или 2, где R4 и R5, оба представляют атом хлора.
4) Фармацевтической композиции по любому из пунктов 1-3, где R6 представляет метил.
5) Фармацевтической композиции по пункту 1, где R1 представляет метилокси, R4 и R5, оба представляют атом хлора, и R6 представляет метил.
6) Фармацевтической композиции по любому из пунктов 1-5, которая является агонистом рецептора тромбопоэтина.
7) Фармацевтической композиции по любому из пунктов 1-5, которая является агентом, регулирующим продукцию тромбоцитов.
8) Применению оптически активного соединения, представленного формулой (I):

где R1 представляет атом галогена или С1-С3алкилокси; R2 представляет С1-С8алкил; R3 представляет С1-С8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет С1-С3алкил или С1-С3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемой соли или его сольвата для получения лекарственного средства для регулирования продукции тромбоцитов.
9) Способу регулирования продукции тромбоцитов у млекопитающего, включающему введение проявляющего терапевтический эффект количества оптически активного соединения, представленного формулой (I):

где R1 представляет атом галогена или С1-С3алкилокси; R2 представляет С1-С8алкил; R3 представляет С1-С8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет С1-С3алкил или С1-С3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемой соли или его сольвата млекопитающему, включая человека.
10) Кристаллу (S)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 4,2, 6,4, 12,3, 13,2, 23,6, 23,8 и 24,7 градуса.
11) Кристаллу (S)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 17,8, 21,1, 22,5 23,3, 24,1 и 24,4 градуса.
12) Кристаллу (S)-(E)-3-(2,6-дихлор-4-{4-[3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 13,6, 16,1, 21,2 23,4 и 24,5 градуса.
13) Фармацевтической композиции, содержащей в качестве активного ингредиента кристалл оптически активного соединения по любому из пунктов 10-12, кристалл его фармацевтически приемлемой соли или кристалл его сольвата.
14) Фармацевтической композиции по пункту 13, которая является агонистом рецептора тромбопоэтина.
15) Фармацевтической композиции по пункту 14, которая является агентом, регулирующим продукцию тромбоцитов.
16) Применению кристалла по любому из пунктов 10-12 для получения лекарственного средства для регулирования продукции тромбоцитов.
17) Способу регулирования продукции тромбоцитов у млекопитающего, включающему введение проявляющего терапевтический эффект количества кристалла по любому из пунктуов 10-12 млекопитающему, включая человека.
18) Кристаллу (S)-4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-иламина, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 10,3, 17,7, 18,2, 18,5 и 23,1 градуса.
19) Кристаллу (S)-(-)-4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-иламина, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 12,5, 13,0, 13,6, 16,4, 23,0 и 24,3 градуса.
20) Кристаллу этил 3-(4-карбокси-2,6-дихлорфенил)-2-метилметакрилата, имеющему угол дифракции 2θ главного пика порошковой рентгеновской дифракции 8,1, 16,3, 19,2, 20,0, 24,8 и 39,0 градусов.
21) Оптически активному соединению, представленному формулой (I), его фармацевтически приемлемой соли или его сольвату в качестве агента, регулирующего продукцию тромбоцитов.
22) Оптически активному соединению, представленному формулой (I), его фармацевтически приемлемой соли или сольвату для регулирования продукции тромбоцитов.
23) Оптически активному соединению по пункту 21 или 22, его фармацевтически приемлемой соли или его сольвату, где R1 представляет метилокси.
24) Оптически активному соединению по пункту 21 или 22, его фармацевтически приемлемой соли или его сольвату, где R4 и R5, оба представляют атом хлора.
25) Оптически активному соединению по любому из пунктов 1-3, его фармацевтически приемлемой соли или его сольвату, где R6 представляет метил.
26) Оптически активному соединению по пункту 21, его фармацевтически приемлемой соли или его сольвату, где R1 представляет метилокси, R4 и R5, оба представляют атом хлора, и R6 представляет метил.
Значение каждого термина будет пояснено ниже. Каждый термин используется в данном описании как унифицированное значение и используется в том же значении, когда использован отдельно или когда использован в комбинации с другими терминами.
В данном описании "атом галогена" означает атом фтора, атом хлора, атом брома или атом йода. Атом фтора, атом хлора и атом брома являются предпочтительными.
В данном описании "алкил" включает прямую или разветвленную одновалентную углеводородную группу с числом атомов углерода от 1 до 8. Примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, н-октил или тому подобное. Предпочтительно, примером является С1-С6алкил. Дополнительно, предпочтителен С1-С4алкил. В частности, когда число атомов углерода обозначено, это означает "алкил", имеющий число атомов углерода в указанных пределах.
В данном описании примеры "алкилокси" включают метилокси, этилокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, н-пентилокси, изопентилокси, 2-пентилокси, 3-пентилокси, н-гексилокси, изогексилокси, 2-гексилокси, 3-гексилокси, н-гептилокси, н-октилокси или тому подобное. Предпочтительно, примером является С1-С6алкилокси. Дополнительно, предпочтителен С1-С4алкилокси. В частности, когда число атомов углерода обозначено, это означает "алкилокси", имеющий число атомов углерода в указанных пределах.
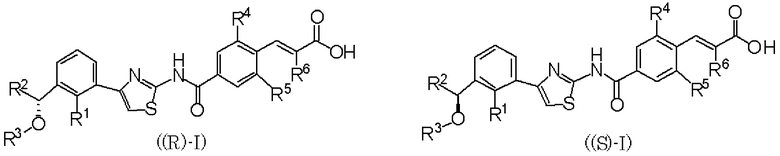
В данном описании в химических формулах атом углерода, отмеченный *, означает асимметричный атом углерода. Соединение, отмеченное *, означает оптический изомер, в котором абсолютная конфигурация атома углерода, отмеченного *, является R конфигурацией или S конфигурацией. Например, оптически активное соединение, представленное формулой (I), включает оптический изомер R конфигурации ((R)-I)) или оптический изомер S конфигурации ((S)-I)).
В данном описании "агент, регулирующий продукцию тромбоцитов", включает агент против заболеваемости болезнью крови, сопровождающейся аномальностью числа тромбоцитов, такой как тромбоцитопения, тромбоцитопения после трансплантации гемопоэтических стволовых клеток (такой как трансплантация костного мозга) и тому подобное, тромбоцитопения после химиотерапии, гипопластическая анемия, синдром миелодисплазии, приобретенная тромбоцитопения, такая как идиопатическая тромбоцитопеническая пурпура и тому подобное, врожденная тромбоцитопения, такая как тромбопоэтиновая недостаточность и тому подобное, вирусная пневмония (такая как гепатит С и тому подобное), другие печеночные заболевания (цирроз печени) и тому подобное. Например, агент может быть применен для лечения и/или профилактики аномальности числа тромбоцитов из-за введения противоракового агента при опухоли гемопоэтического органа, солидной опухоли или тому подобное. Когда число тромбоцитов снижается при введении противоракового агента, агент настоящего изобретения может быть использован в качестве лечебного средства, и, когда снижение числа тромбоцитов в результате введения противоракового агента предполагается, агент может быть использован в качестве профилактического средства. Когда снижение тромбоцитов предполагается при сердечно-сосудистой (такой как на кровеносных сосудах сердца) хирургической операции, агент может быть использован в качестве лечебного и/или профилактического средства.
Используемое в данном описании выражение "продукцию тромбоцитов регулируют" включает 1) увеличение уменьшенного числа тромбоцитов, 2) поддержание числа тромбоцитов, которое должно снижаться, и 3) уменьшение степени снижения числа тромбоцитов.
Предпочтительная группа заместителей R1-R6 соединения, представленного формулой (I), представлена (Ia)-(In). Предпочтительно соединение с возможной их комбинацией.
R1 представляет (Ia), предпочтительно атом галогена или С1-С3алкилокси, (Ib), более предпочтительно атом фтора или метилокси, и (Ic), наиболее предпочтительно метилокси.
R2 представляет (Id), предпочтительно С1-С8алкил, и (Ie), более предпочтительно С1-С6алкил.
R3 представляет (If), предпочтительно С1-С8алкил, и (Ig), более предпочтительно С1-С6алкил.
R4 и R5, оба одинаковые и представляют (Ih), предпочтительно атом фтора или атом хлора, и (Ii), более предпочтительно атом хлора.
R6 представляет (Ij), предпочтительно С1-С3алкил или С1-С3алкилокси, (Ik), более предпочтительно С1-С3алкил, и (Il), наиболее предпочтительно метил.
Оптическое вращение оптического изомера (Im) является предпочтительно (+) или
(-), более предпочтительно (-).
В дополнение, в качестве оптически активного соединения, представленного формулой (I), предпочтительно следующее оптически активное соединение.
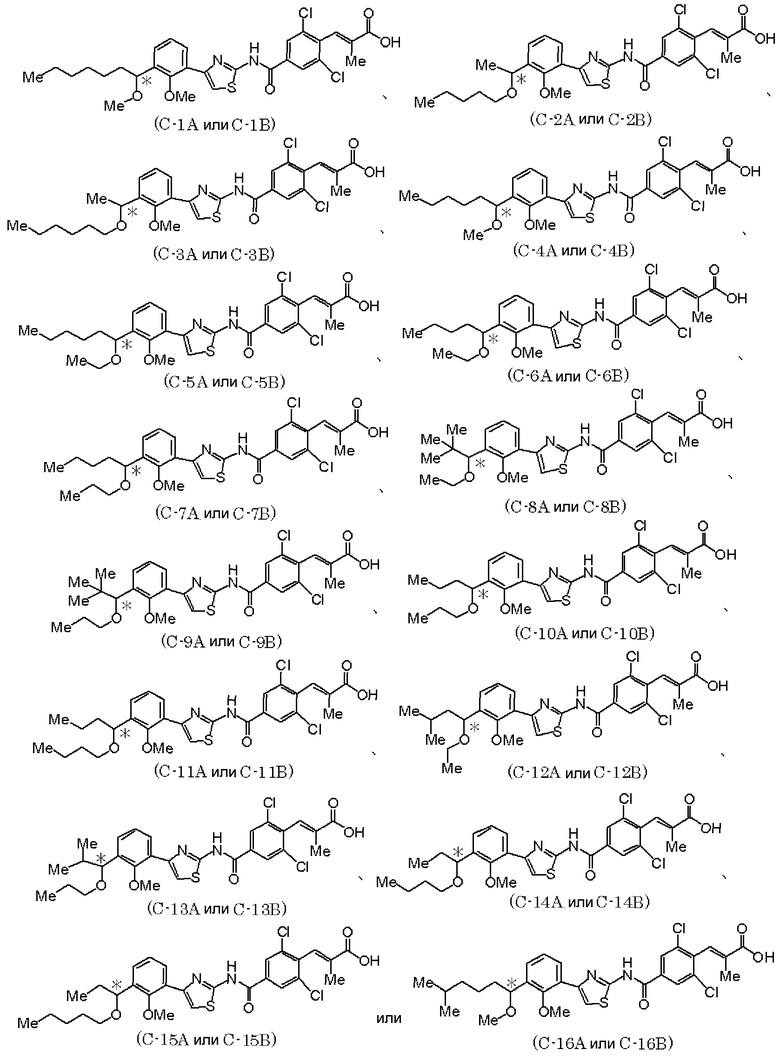
где Ме представляет метил; * означает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода.
Эффект изобретения
Так как оптически активное производное 4-фенилтиазола, обладающее сильной активностью агониста рецептора тромбопоэтина, проявляет высокую пероральную абсорбируемость и/или высокую активность in vivo и имеет высокую безопасность, фармацевтическая композиция, содержащая оптически активное производное 4-фенилтиазола в качестве активного ингредиента, полезна в качестве агента, в частности регулирующего продукцию тромбоцитов. В дополнение, кристалл, имеющий высокую стабильность и/или высокую чистоту, и промежуточное соединение, имеющее высокую стабильность, могут быть использованы при получении производного 4-фенилтиазола и/или получении фармацевтической композиции.
Оптически активное соединение формулы (I) может быть синтезировано путем следующих способов получения А-F и подобных.
Способ получения А
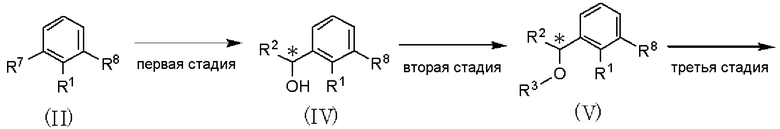
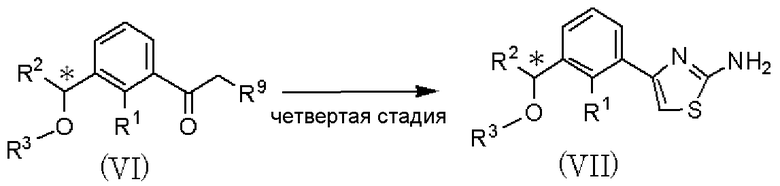
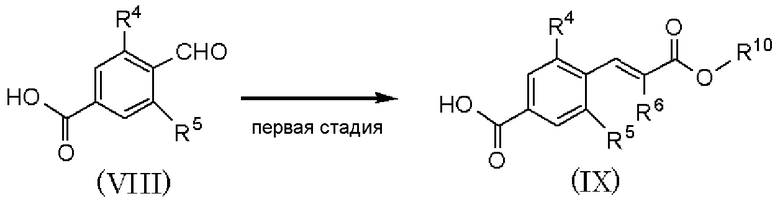
где R1, R2, R3, R4, R5 и R6 имеют значения, указанные в пункте 1); R7 и R8, каждый независимо, представляет атом хлора, атом брома или атом йода; R9 представляет атом фтора, атом хлора или атом брома; R10 представляет С1-С6алкил. В качестве соединения, представленного формулой (II), как исходного соединения, может быть использован коммерчески доступный продукт.
Способ получения А является способом получения оптически активного соединения, представленного формулой (I), из соединения, представленного формулой (II), при проведении от первой до шестой стадий.
Первая стадия является стадией обработки соединения, представленного формулой (II), магнием в растворителе для получения реагента Гриньяра и взаимодействия полученного реагента с соединением, представленным формулой: R2CHO (где R2 имеет значения, указанные в пункте 1), с получением соединения, представленного формулой (IV). По отношению к соединению, представленному формулой (II), магний может быть использован в количестве от 0,5 до 2 мол. эквивалентов, и соединение, представленное формулой R2CHO, может быть использовано в количестве от 0,5 до 3 мол. эквивалентов. В качестве растворителя может быть использован тетрагидрофуран или тому подобное. Температура реакции может составлять от 0°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
Вторая стадия является стадией алкилирования соединения, представленного формулой (IV), при использовании алкилирующего агента в присутствии основания, с получением соединения, представленного формулой (IV). По отношению к соединению, представленному формулой (IV), алкилирующий агент может быть использован в количестве от 0,5 до 2 мол. эквивалентов и основание может быть использовано в количестве от 0,5 до 5 мол. эквивалентов. В качестве растворителя может быть использован N,N-диметилформамид, тетрагидрофуран и тому подобное, отдельно или в виде их смеси.
В качестве основания могут быть использованы гидрид натрия, гидроксид натрия, гидроксид калия, карбонат калия, карбонат цезия и тому подобное, отдельно или в виде их смеси.
Температура реакции может составлять от -10°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
Третья стадия является стадией обработки соединения, представленного формулой (V), изопропилмагнийхлоридом в растворителе для получения реагента Гриньяра и взаимодействия полученного реагента с соединением, представленным формулой: Х-С(=О)-СН2-R9 (где R9 имеет значения, указанные выше, Х представляет атом галогена), с получением соединения, представленного формулой (VI).
По отношению к соединению, представленному формулой (V), изопропилмагнийхлорид может быть использован в количестве от 0,5 до 2 мол. эквивалентов и соединение, представленное формулой: R9-СН2-С(=О)-Х (где R9 и Х имеют значения, указанные выше) или формулой: R9-СН2-С(=О)-N(Me)(OMe) (где R9 имеет значения, указанные выше, Me представляет метил), может быть использовано в количестве от 0,5 до 3 мол. эквивалентов. В качестве растворителя может быть использован тетрагидрофуран или тому подобное. Температура реакции может составлять от 0°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
Четвертая стадия является стадией взаимодействия соединения, представленного формулой (VI), с тиомочевиной в растворителе с получением соединения, представленного формулой (VII). По отношению к соединению, представленному формулой (VI), тиомочевина может быть использована в количестве от 0,5 до 2 мол. эквивалентов. В качестве растворителя может быть использован метанол, этанол, пропанол, изопропанол и тому подобное, отдельно или в виде их смеси. Температура реакции может составлять от 20°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 48 часов.
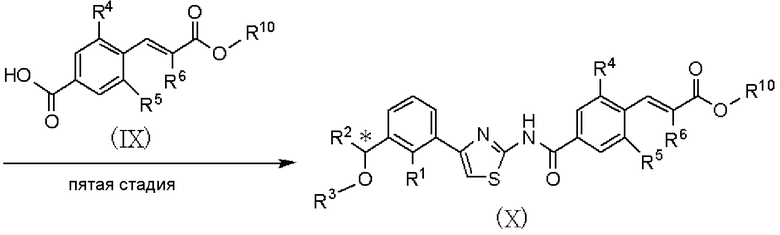
Пятая стадия является стадией взаимодействия соединения, представленного формулой (VII), с соединением, представленным формулой (IX), полученным в способе получения В, с получением соединения, представленного формулой (Х). Данная стадия может быть проведена с применением способа, аналогично описанному на четвертой стадии способа А международной публикации WO 2005/014561.
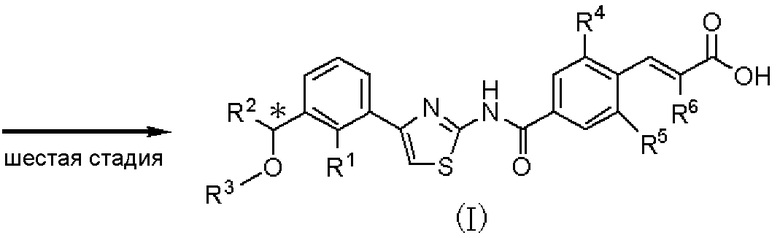
Шестая стадия является стадией получения соединения, представленного формулой (I), путем гидролиза соединения, представленного формулой (Х), в растворителе. Данная стадия может быть проведена с применением способа, аналогично описанному на пятой стадии способа А международной публикации WO 2005/014561.
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть использовано в следующей реакции без очистки. Когда соединение, полученное на каждой стадии, является рацемическим соединением, оптически активное соединение получают колоночной хроматографией с использованием хиральной колонки, и каждая стадия может быть осуществлена с ее использованием.
Способ получения В
где R4, R5 и R6 имеют значения, указанные в пункте 1); R10 имеет значения, указанные в способе получения А. В качестве соединения, представленного формулой (VIII), как исходного соединения, может быть использован коммерчески доступный продукт.
Способ получения В является способом получения соединения, представленного формулой (IX), из соединения, представленного формулой (VIII). Соединение, представленное формулой (IX), подвергают пятой стадии способа получения А и дополнительно подвергают шестой стадии, в результате чего может быть получено соединение, представленное формулой (I). Данная стадия может быть проведена с применением способа, аналогично описанному во второй стадии способа А международной публикации WO 2005/014561.
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть использовано в следующей реакции без очистки.
Способ получения С
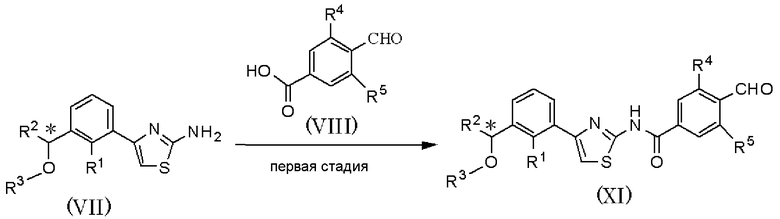
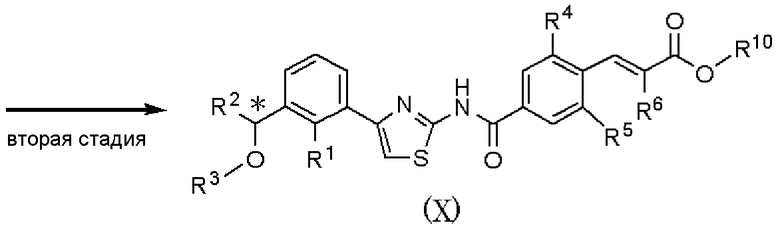
где R1, R2, R3, R4, R5 и R6 имеют значения, указанные в пункте 1); R10 имеет значения, указанные в способе получения А.
В качестве соединения, представленного формулой (VII) как исходного соединения, может быть использовано соединение, полученное способом получения А.
Способ получения С является способом получения соединения, представленного формулой (Х), из соединения, представленного формулой (VII), при проведении первой и второй стадий. Соединение, представленное формулой (Х), может быть подвергнуто шестой стадии способа получения А, с получением соединения, представленного формулой (I).
На первой стадии при использовании способа, аналогично пятой стадии способа получения А, соединение, представленное формулой (XI), может быть получено взаимодействием соединения, представленного формулой (VII), с соединением, представленным формулой (VIII).
На второй стадии при использовании способа, аналогично способу получения В, соединение, представленное формулой (Х), может быть получено из соединения, представленного формулой (XI).
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть также использовано в следующей реакции без очистки. Когда соединение, полученное на каждой стадии, является рацемическим соединением, оптически активное соединение получают колоночной хроматографией с использованием хиральной колонки, и каждая стадия может быть осуществлена с ее использованием.
Способ получения D
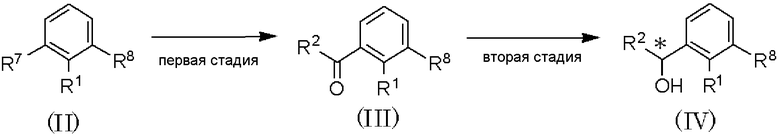
где R1 и R2 имеют значения, указанные в пункте 1); R7 и R8 имеют значения, указанные в способе получения А.
В качестве соединения, представленного формулой (II) как исходного соединения, может быть использован коммерчески доступный продукт.
Способ получения D является способом получения оптически активного соединения, представленного формулой (IV), из соединения, представленного формулой (II), при проведении первой и второй стадий. Подвергая оптически активное соединение, представленное формулой (IV), воздействию от второй до шестой стадиями способа получения А, можно получить оптически активное соединение, представленное формулой (I).
Первая стадия является стадией получения соединения, представленного формулой (IV), путем обработки соединения, представленного формулой (II), магнием в растворителе для получения реагента Гриньяра и взаимодействия полученного реагента с соединением, представленным формулой: R2C(=О)-Х (где R2 имеет значения, указанные в пункте 1); Х имеет указанные выше значения) или формулой R2C(=О)-N(Me)(OMe) (R2 имеет значения, указанные в пункте 1); Me представляет метил).
По отношению к соединению, представленному формулой (II), магний может быть использован в количестве от 0,5 до 2 мол. эквивалентов и соединение, представленное формулой R2C(=О)-Х (где R2 имеет значения, указанные в пункте 1); Х имеет указанные выше значения) или формулой R2C(=О)-N(Me)(OMe), где R2 имеет значения, указанные в пункте 1); Me представляет метил, может быть использовано в количестве от 0,5 до 3 мол. эквивалентов.
В качестве растворителя может быть использован тетрагидрофуран или тому подобное. Температура реакции может составлять от 0°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
Вторая стадия является стадией асимметричного восстановления соединения, представленного формулой (III), асимметричным восстановителем в растворителе, с получением соединения, представленного формулой (IV). Подвергнув соединение, представленное формулой (IV), проведению стадий от третьей по шестую способа получения А, можно получить соединение, представленное формулой (I).
По отношению к соединению, представленному формулой (III), асимметричный восстановитель может быть использован в количестве от 0,5 до 2 мол. эквивалентов. В качестве растворителя может быть использован толуол, тетрагидрофуран и тому подобное отдельно или в виде их смеси. В качестве асимметричного восстановителя может быть использован R-CBS или тому подобное.
R-CBS является оптически активным соединением, представленным формулой:
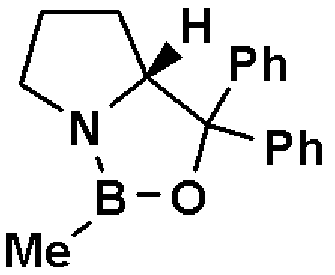
где Ме означает метил, Ph означает фенил.
Температура реакции может составлять от -20°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть также использовано в следующей реакции без очистки.
Способ получения Е
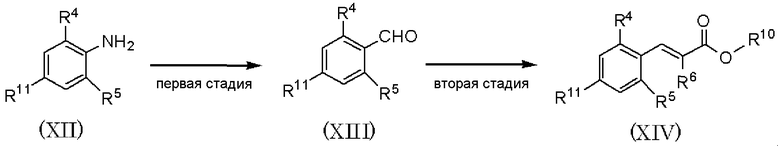
где R4 и R5 имеют значения, указанные в пункте 1); R10 имеет значения, указанные в способе получения А; R11 представляет атом брома или атом йода.
В качестве соединения, представленного формулой (XII), как исходного соединения, может быть использован коммерчески доступный продукт.
Способ получения Е является способом получения соединения, представленного формулой (XIV), из соединения, представленного формулой (XII), путем проведения первой и второй стадий.
Первая стадия является стадией получения соединения, представленного формулой (XIII), диазотированием соединения, представленного формулой (XII), нитритом натрия в растворителе в присутствии кислоты, последующего взаимодействия с алкилакрилатом и озонолизом полученного соединения.
По отношению к соединению, представленному формулой (XII), нитрит натрия может быть использован в количестве от 0,5 до 3 мол. эквивалентов и алкилакрилат может быть использован в количестве от 0,5 до 3 мол. эквивалентов. В качестве растворителя при диазотировании может быть использован ацетон или тому подобное. В качестве растворителя при озонолизе может быть использован дихлорметан или тому подобное. При диазотировании и озонолизе, независимо, температура реакции может составлять от -78°С до температуры кипения растворителя с обратным холодильником, и время реакции может составлять от 0,5 до 12 часов.
На второй стадии при использовании способа, аналогично способу получения В, соединение, представленное формулой (XIV), может быть получено из соединения, представленного формулой (XIII).
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть также использовано в следующей реакции без очистки.
Способ получения F
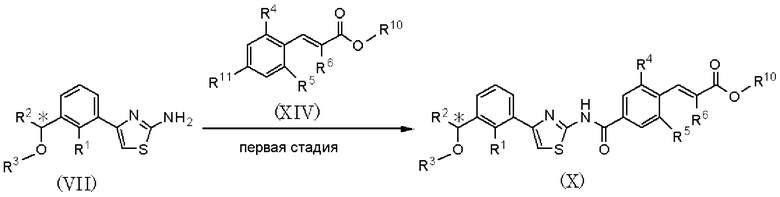
где R1, R2, R3, R4, R5 и R6 имеют значения, указанные в пункте 1); R10 имеет значения, указанные в способе получения А, R11 представляет атом брома или атом йода.
В качестве соединения, представленного формулой (VII), в качестве исходного соединения может быть использовано соединение, полученное способом получения А.
Способ получения F является способом конденсации соединения, представленного формулой (VII), и соединения, представленного формулой (XIV), c образованием соединения, представленного формулой (Х). Подвергнув соединение, представленное формулой (Х), проведению шестой стадии способа получения А, можно получить соединение, представленное формулой (I).
Данная стадия может быть проведена путем использования способа, аналогично способу, описанному на второй стадии способа С международной публикации WO 2005/014561.
Соединение, полученное на каждой стадии, может быть выделено и очищено традиционными методами, такими как колоночная хроматография на силикагеле, перекристаллизация и/или перегонка. Альтернативно, полученное соединение может быть также использовано в следующей реакции без очистки. Альтернативно, оптически активное соединение получают колоночной хроматографией с использованием хиральной колонки, и каждая стадия может быть осуществлена с ее использованием.
Что касается кристалла оптически активного соединения, представленного формулой (I), полученного указанными способами получения, кристалла оптически активного соединения, представленного формулой (VII), и кристалла соединения, представленного формулой (IX), рентгенограмма может быть получена порошковой рентгеновской дифракцией.
Так как кристалл является стабильным, им легко манипулировать для осуществления указанных выше стадий получения или для получения фармацевтической композиции, содержащей в качестве активного ингредиента оптически активное соединение, представленное формулой (I), и он имеет высокую чистоту и может быть использован для получения фармацевтической композиции.
Что касается кристалла оптически активного соединения, представленного формулой (I), кристалла оптически активного соединения, представленного формулой (VII), и кристалла соединения, представленного формулой (IX), рентгенограмма показана в примерах 3-5, описанных ниже (условие измерения рентгеновской дифракции: вакуумная трубка CuK α-излучение, напряжение на трубке 40 кВ, ток трубки 40 мА или 50 мА, dsin θ=nλ (n означает целое число, d означает период кристаллической решетки (единица: ангстрем), θ - угол дифракции (единица: градус)). Такие кристаллы характеризуются величинами каждого угла дифракции или периодом кристаллической решетки.
В данном описании примеры "фармацевтически приемлемой соли" включают соли с щелочными металлами (такими как литий, натрий и калий), щелочноземельными металлами (такими как магний и кальций), аммонием, органическими основаниями и аминокислотами или соли с неорганическими кислотами (такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота) и органическими кислотами (такими как уксусная кислота, лимонная кислота, малеиновая кислота, фумаровая кислота, бензолсульфоновая кислота и п-толуолсульфоновая кислота. Данные соли могут быть образованы общепринятыми способами.
Используемый в данном описании термин "сольват" включает, например, сольват с органическим растворителем, гидрат и тому подобное. Когда образуется сольват, соединение может быть координировано с произвольным числом молекул растворителя.
Данная фармацевтическая композиция проявляет превосходную активность агониста рецептора тромбопоэтина, как описано в примерах испытания, приведенных ниже, и может быть использована в качестве агента (агента, регулирующего продукцию тромбоцитов) против заболеваемости болезнью крови, сопровождающейся аномальностью числа тромбоцитов, такой как тромбоцитопения, тромбоцитопения после трансплантации гемопоэтических стволовых клеток (такой как трансплантация костного мозга) и тому подобное, тромбоцитопения после химиотерапии, гипопластическая анемия, синдром миелодисплазии, приобретенная тромбоцитопения, такая как идиопатическая тромбоцитопеническая пурпура и тому подобное, врожденная тромбоцитопения, такая как тромбопоэтиновая недостаточность и тому подобное, вирусная пневмония (такая как гепатит С и тому подобное), другие печеночные заболевания (цирроз печени) и тому подобное. Композиция может быть использована для лечения и/или профилактики аномальности числа тромбоцитов из-за введения противоракового агента при опухоли гемопоэтического органа, солидной опухоли или тому подобное. Композиция может быть использована для лечения и/или профилактики тромбоцитопении при хирургической операции, такой как на сердечно-сосудистой системе (такой как на кровеносных сосудах сердца) или тому подобное.
Когда настоящую фармацевтическую композицию вводят человеку с целью лечения указанных заболеваний, она может быть введена перорально в виде порошков, гранул, таблеток, капсул, пилюль, растворов или подобного, или может быть введена парентерально в виде препаратов для инъекций, суппозиториев, агентов, абсорбирующихся через кожу, ингаляции, или подобного. В дополнение, эффективное количество данного соединения смешивают, если необходимо, с фармацевтическими добавками, такими как эксципиенты, связующие, смачивающие агенты, дезинтегрирующие агенты, лубриканты или тому подобное, которые являются подходящими для их дозированных форм, тем самым может быть получен фармацевтический препарат. В случае препаратов для инъекций, соединение вместе с подходящим носителем подвергают стерилизационной обработке в препаратах.
Доза является различной в зависимости от стадии болезни, пути введения, возраста или массы пациента и при пероральном введении взрослому обычно составляет от 0,01 до 100 мг/кг/сутки, предпочтительно от 0,02 до 10 мг/кг/сутки, наиболее предпочтительно от 0,05 до 5 мг/кг/сутки.
Настоящее изобретение будет пояснено более подробно ниже на примерах и примерах испытания, но настоящее изобретение не ограничивается ими.
В примерах использованы следующие аббревиатуры.
R-CBS: оптически активное соединение, представленное формулой:

где Ме означает метил, Ph означает фенил.
Ме: метил
ДМФА: N,N-диметилформамид
ТГФ: тетрагидрофуран
ДМСО: диметилсульфоксид
ВЭЖХ: высокоэффективная жидкостная хроматография
[Примеры]
Сравнительный пример 1
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-1)
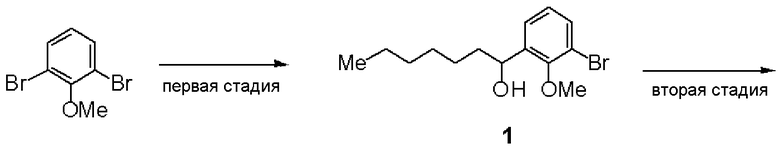

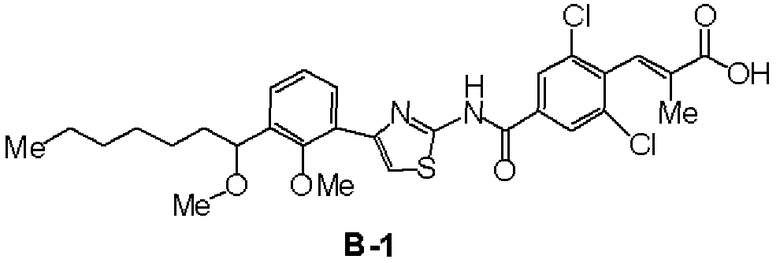
Первая стадия: Синтез (RS)-2-бром-6-(1-гидроксигептил)анизола (1)
К раствору в ТГФ 2,6-диброманизола (10 г, 37,6 ммоль) добавляли Mg (0,90 г, 37,6 ммоль) и смесь нагревали при перемешивании при 40°С. При охлаждении льдом по каплям добавляли гептаналь (47,2 г, 41,3 ммоль). Водный раствор хлористоводородной кислоты добавляли к реакционной смеси, экстрагировали ее этилацетатом и растворитель отгоняли, получая 8,95 г соединения (1).
ЯМР (CDCl3) δ м.д.: 7,45-7,48 (м, 1H), 7,35-7,38 (м, 1H), 7,01 (т, 1H, 8,1 Гц), 4,96-5,00 (м, 1H), 3,88 (с, 3H), 1,70-1,80 (м, 2H), 1,25-1,63 (м, 8H), 0,85-0,90 (м, 3H).
Вторая стадия: Синтез (RS)-1-бром-2-метилокси-3-(1-метилоксигептил)бензола (2)
(RS)-2-бром-6-(1-гидроксигептил)анизол (1, 5,36 г, 17,8 ммоль), полученный на первой стадии, и йодметан (3,0 г, 21,3 ммоль) растворяли в ТГФ и добавляли гидрид натрия (0,78 г, 19,6 ммоль) при охлаждении льдом. При охлаждении льдом добавляли хлористоводородную кислоту, с последующей экстракцией этилацетатом. После отгонки растворителя остаток очищали хроматографией на силикагеле, получая 4,92 г соединения (2).
ЯМР (CDCl3) δ м.д.: 7,46 (д, 1H, J=8,1 Гц), 7,33 (д, 1H, J=4,5 Гц), 7,02 (т, 1H, J=7,5 Гц), 4,52 (дд, 1H, J=7,5 Гц, J=4,8 Гц), 3,85 (с, 3H), 3,21 (с, 3H), 1,27-1,80 (м, 10H), 0,84-0,90 (м, 3H).
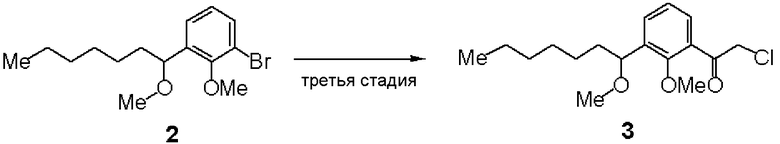
Третья стадия: Синтез (RS)-2-хлор-1-[2-метилокси-3-(1-метилоксигептил)фенил]этанона (3)
К раствору в ТГФ (RS)-1-бром-2-метилокси-3-(1-метилоксигептил)бензола (2, 6,3 г, 20 ммоль), полученного на второй стадии, добавляли по каплям 2М изопропилмагнийхлорид (20 мл). Добавляли 2-Хлор-N-метилокси-N-метилацетамид (5,5 г) и смесь перемешивали при комнатной температуре. К реакционному раствору добавляли водный раствор хлористоводородной кислоты, с последующей экстракцией этилацетатом. После отгонки растворителя остаток очищали хроматографией на силикагеле, получая 2,80 г соединения (3).
ЯМР (CDCl3) δ м.д.: 7,58-7,61 (м, 1H), 7,51-7,54 (м, 1H), 7,22-7,27 (м, 1H), 4,72 (дд, 2H, J=20,8 Гц, 15,9 Гц), 4,54 (дд, 1H, J=8,1 Гц, 4,8 Гц), 3,78 (с, 3H), 3,22 (с, 3H), 1,14-1,77 (м, 10H), 0,84-0,90 (м, 3H).
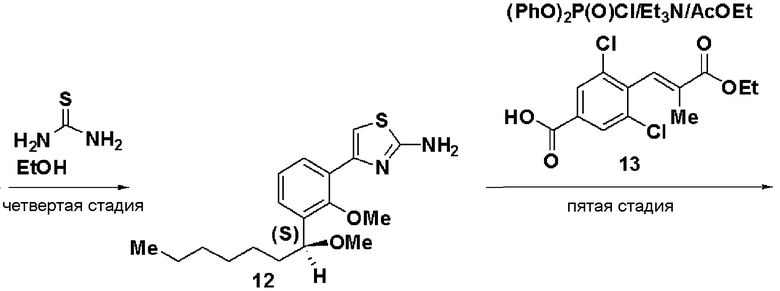
Четвертая стадия: Синтез (RS)-4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-иламина (А-1)
(RS)-2-хлор-1-[2-метилокси-3-(1-метилоксигептил)фенил]этанон (3, 0,28 г, 0,89 ммоль), полученный на третьей стадии, и тиомочевину (0,10 г, 0,89 ммоль) растворяли в этаноле, раствор нагревали и перемешивали. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, с последующей экстракцией этилацетатом. После отгонки растворителя остаток очищали хроматографией на силикагеле, получая 0,23 г соединения (А-1).
ЯМР (CDCl3) δ м.д.: 7,75 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,34 (дд, J=1,8 Гц, 7,5Гц, 1H), 7,19 (т, 1H, J=7,5Гц), 7,08 (с, 1H), 5,41 (ушир.с, 2H), 4,57-4,61 (м, 1H), 3,65 (с, 3H), 3,23 (с, 3H), 1,24-1,77 (м, 10H), 0,84-0,89 (м, 3H).
Пятая стадия: Синтез (RS)-(Е)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-1)
К раствору в ДМФА (6 мл) (RS)-4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-иламина (А-1, 330 мг), полученного на четвертой стадии, этил 3-(4-бром-2,6-дихлорфенил)-2-метилакрилата (4, 338 мг), синтезированного в сравнительном примере 18, описанном ниже, и дихлорбистрифенилфосфинпалладия (42 мг) добавляли триэтиламин (0,56 мл) и смесь перемешивали при 85°С в течение 16 часов в атмосфере монооксида углерода. Реакционный раствор добавляли к воде, с последующей экстракцией этилацетатом. Органический слой промывали водой, промывали насыщенный водным раствором хлорида натрия и сушили над сульфатом магния. После отгонки растворителя очистка колоночной хроматографией (гексан:этилацетат=4:1) давала 540 мг твердого вещества. Полученное твердое вещество растворяли в ТГФ (3 мл), добавляли метанол (3 мл) и водный раствор 2 моль/л гидроксида натрия (3 мл) и смесь перемешивали при комнатной температуре. Реакционный раствор подкисляли хлористоводородной кислотой, с последующей экстракцией этилацетатом. Органический слой промывали водой, промывали насыщенный водным раствором хлорида натрия и сушили над сульфатом магния. После отгонки растворителя перекристаллизация из этилацетата давала 370 мг соединения (В-1).
ЯМР (ДМСО-d6) δ м.д.: 12,99 (ушир.с, 1H), 8,29 (с, 2H), 7,91 (дд, 1H, J=2,1 Гц, 7,2 Гц), 7,72 (с, 1H), 7,41 (д, 1H, J=1,5 Гц), 7,24-7,33 (м, 2H), 4,55-4,60 (м, 1H), 3,62 (с, 3H), 3,16 (с, 3H), 1,69 (с, 3H), 1,25-1,69 (м, 10H), 0,83-0,87 (м, 3H).
Используя способ, аналогично способу синтеза, описанному в сравнительном примере 1, синтезировали соединения (А-2)-(А-16) и соединения (В-2)-(В-16).
Сравнительный пример 2
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-пентилоксиэтил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-2)
(RS)-4-[2-метилокси-3-(1-пентилоксиэтил)фенил]тиазол-2-иламин (А-2)
ЯМР (CDCl3) δ м.д.: 7,74 (дд, 1H, J=2,1 Гц, 7,8 Гц), 7,41 (дд, 1H, J=2,1 Гц, 7,8 Гц,), 7,19 (т, 1H, J=7,8 Гц), 7,07 (с, 1H), 5,49 (ушир.с, 2H), 4,85 (кв, 1H, J=6,3 Гц), 3,65 (с, 3H), 3,28-3,33 (м, 2H), 1,54-1,58 (м, 1H), 1,45 (д, 3H, J=6,6 Гц), 1,24-1,30 (м, 4H), 0,85-0,90 (м, 3H).
Соединение (В-2)
ЯМР (ДМСО-d6) δ м.д.: 8,32 (с, 2H), 7,65 (с, 1H), 7,48-7,60 (м, 2H), 7,43 (с, 1H), 7,23-7,27 (м, 1H), 4,87 (кв, 1H, J=6,3 Гц), 3,55 (с, 3H), 1,87 (с, 3H), 1,55-1,62 (м, 2H), 1,48 (д, 3H, J=6,3 Гц), 1,26-1,38 (м, 4H), 0,86-0,90 (м, 3H).
Сравнительный пример 3
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-3)
(RS)-4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-иламин (А-3)
ЯМР (CDCl3) δ м.д.: 7,75 (дд, 1H, J=1,2 Гц, 7,8 Гц), 7,41 (дд, 1H, J=1,2 Гц, 7,8 Гц,), 7,20 (т, 1H, J=7,8 Гц), 7,08 (с, 1H), 5,48 (ушир.с, 2H), 4,85 (кв, 1H, J=6,0 Гц), 3,66 (с, 3H), 3,28-3,33 (м, 2H), 1,52-1,59 (м, 1H), 1,45 (д, 3H, J=6,3 Гц,), 1,24-1,34 (м, 6H), 0,85-0,89 (м, 3H).
Соединение (В-3)
ЯМР (ДМСО-d6) δ м.д.: 12,97 (ушир.с, 1H), 8,29 (с, 2H), 7,90 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,72 (с, 1H), 7,35-7,40 (м, 2H), 7,26 (т, 1H, J=7,5 Гц), 4,82 (кв, 1H, J=6,3 Гц), 3,62 (с, 3H), 3,16-3,37 (м, 2H), 1,69 (с, 3H), 1,18-1,51 (м, 11H), 0,82-0,87 (м, 3H).
Сравнительный пример 4
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигексил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (А-4)
ЯМР (CDCl3) δ м.д.: 7,75 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,34 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,19 (т, 1H, J=7,8 Гц), 7,08 (с, 1H), 5,48 (ушир.с, 2H), 4,57-4,61 (м, 1H), 3,65 (с, 3H), 3,23 (с, 3H), 1,26-1,77 (м, 8H), 0,85-0,90 (м, 3H).
Соединение (В-4)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 1H), 8,29 (с, 2H), 7,91 (дд, 1H, J=2,4 Гц, 7,5 Гц), 7,72 (с, 1H), 7,40 (с, 1H), 7,24-7,33 (м, 2H), 4,56-4,60 (м, 1H), 3,62 (с, 3H), 3,16 (с, 3H), 1,69 (с, 3H), 1,25-1,69 (м, 8H), 0,83-0,88 (м, 3H).
Сравнительный пример 5
Синтез (RS)-(E)-(2,6-дихлор-4-{4-[3-(1-этилоксигексил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-5)
(RS)-4-[3-(1-метилоксигексил)-2-метилоксифенил]тиазол-2-иламин (А-5)
ЯМР (CDCl3) δ м.д.: 7,73 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,38 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,18 (т, 1H, J=7,5 Гц), 7,07 (с, 1H), 5,48 (ушир.с, 2H), 4,66-4,70 (м, 1H), 3,64 (с, 3H), 3,31-3,42 (м, 2H), 1,16-1,78 (м, 11H), 0,85-0,90 (м, 3H).
Соединение (В-5)
ЯМР (ДМСО-d6) δ м.д.: 12,97 (ушир.с, 1H), 8,29 (с, 2H), 7,89 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,71 (с, 1H), 7,22-7,40 (м, 4H), 4,65-4,69 (м, 1H), 3,58 (с, 3H), 3,17 (д, 2H, J=4,5 Гц), 1,69 (с, 3H), 1,03-1,69 (м, 11H), 0,84-0,88 (м, 3H).
Сравнительный пример 6
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(1-этилоксипентил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-6)
(RS)-4-[3-(1-этилоксипентил)-2-метилоксифенил]тиазол-2-иламин (А-6)
ЯМР (CDCl3) δ м.д.: 7,75 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,34 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,15 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,26 (ушир.с, 2H), 4,67-4,70 (м, 1H), 3,64 (с, 3H), 3,27 (кв, 2H, J=7,0 Гц), 1,56-1,68 (м, 2H), 1,20-1,50 (м, 4H), 1,10 (т, 3H, J=7,0 Гц), 0,85 (т, 3H, J=7,0 Гц).
Соединение (В-6)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 1H), 8,28 (с, 2H), 7,92 (д, 1H, J=7,5 Гц), 7,71 (с, 1H), 7,41 (с, 1H), 7,33 (д, 1H, J=7,6 Гц), 7,25 (т, 1H, J=7,6 Гц), 4,67 (т, 1H, J=6,5 Гц), 3,60 (с, 3H), 3,26 (кв, 2H, J=7,0 Гц), 1,68 (с, 3H), 1,56-1,68 (м, 2H), 1,20-1,50 (м, 4H), 1,10 (т, 3H, J=7,0 Гц), 0,85 (т, 3H, J=7,0 Гц).
Сравнительный пример 7
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-пропилоксипентил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-7)
(RS)-4-[2-метилокси-3-(1-пропилоксипентил)фенил]тиазол-2-иламин (А-7)
ЯМР (CDCl3) δ м.д.: 7,75 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,34 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,15 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,26 (ушир.с, 2H), 4,67-4,70 (м, 1H), 3,64 (с, 3H), 3,27 (кв, 2H, J=7,0 Гц), 1,56-1,68 (м, 2H), 1,50-1,60 (м, 2H), 1,20-1,50 (м, 4H), 0,87 (т, 3H, J=7,0 Гц), 0,85 (т, 3H, J=7,0 Гц).
Соединение (В-7)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 1H), 8,28 (с, 2H), 7,90 (д, 1H, J=7,5 Гц), 7,71 (с, 1H), 7,41 (с, 1H), 7,33 (д, 1H, J=7,6 Гц), 7,25 (т, 1H, J=7,6 Гц), 4,67 (т, 1H, J=6,5 Гц), 3,61 (с, 3H), 3,20 (т, 2H, J=7,0 Гц), 1,68 (с, 3H), 1,56-1,68 (м, 2H), 1,50-1,60 (м, 2H), 1,20-1,50 (м, 4H), 0,90 (т, 3H, J=7,0 Гц), 0,85 (т, 3H, J=7,0 Гц).
Сравнительный пример 8
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(2,2-диметилпропил-1-этилокси)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-8)
(RS)-4-[3-(2,2-диметилпропил-1-этилокси)-2-метилоксифенил]тиазол-2-иламин (А-8)
ЯМР (CDCl3) δ м.д.: 7,73 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,34 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,13 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,26 (ушир.с, 2H), 4,37 (с, 1H), 3,60 (с, 3H), 3,22-3,38 (м, 2H), 1,08 (т, 3H, J=7,0 Гц), 0,90 (с, 9H).
Соединение (В-8)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 1H), 8,28 (с, 2H), 7,90 (д, 1H, J=7,5 Гц), 7,68 (с, 1H), 7,40 (с, 1H), 7,29 (д, 1H, J=7,6 Гц), 7,25 (т, 1H, J=7,6 Гц), 4,40 (с, 1H), 3,61 (с, 3H), 3,30 (кв, 2H, J=7,0 Гц), 1,68 (с, 3H), 1,15 (т, 3H, J=7,0 Гц), 0,89 (с, 9H).
Сравнительный пример 9
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-9)
(RS)-4-[3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил]тиазол-2-иламин (А-9)
ЯМР (CDCl3) δ м.д.: 7,74 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,32 (дд, 1H, J=7,5 Гц, 1,8 Гц), 7,13 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,26 (ушир.с, 2H), 4,37 (с, 1H), 3,60 (с, 3H), 3,22-3,38 (м, 2H), 1,56-1,66 (м, 2H), 0,93 (т, 3H, J=7,0 Гц), 0,90 (с, 9H).
Соединение (В-9)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 1H), 8,28 (с, 2H), 7,92 (д, 1H, J=7,5 Гц), 7,68 (с, 1H), 7,40 (с, 1H), 7,31 (д, 1H, J=7,6 Гц), 7,27 (т, 1H, J=7,6 Гц), 4,40 (с, 1H), 3,61 (с, 3H), 3,20 (т, 2H, J=7,0 Гц), 1,68 (с, 3H), 1,55-1,65 (м, 2H), 0,90 (т, 3H, J=7,0 Гц), 0,87 (с, 9H).
Сравнительный пример 10
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-пропилоксибутил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-10)
(RS)-4-[2-метилокси-3-(1-пропилоксибутил)фенил]тиазол-2-иламин (А-10)
ЯМР (CDCl3) δ м.д.: 7,74 (д, J=7,5 Гц, 1H), 7,36 (д, 1H, J=7,8 Гц,), 7,20 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,15 (ушир.с, 2H), 4,67-4,74 (м, 1H), 3,64 (с, 3H), 3,19-3,36 (м, 2H), 1,50-1,80 (м, 6H), 0,86-0,98 (м, 6H).
Соединение (В-10)
ЯМР (ДМСО-d6) δ м.д.: 13,00 (ушир.с, 2H), 8,29 (с, 2H), 7,90 (д, 1H, J=7,5 Гц), 7,72 (с, 1H), 7,24-7,43 (м, 3H), 4,65-4,72 (м, 1H), 3,61 (с, 3H), 3,23 (т, 2H, J=6,3 Гц), 1,30-1,80 (м, 9H), 0,84-0,98 (м, 6H).
Сравнительный пример 11
Синтез (RS)-(E)-3-(4-{4-[3-(1-бутилоксибутил)-2-метилоксифенил]тиазол-2-илкарбамоил}-2,6-дихлорфенил)-2-метилакриловой кислоты (В-11)
(RS)-4-[3-(1-бутилоксибутил)-2-метилоксифенил]тиазол-2-иламин (А-11)
ЯМР (CDCl3) δ м.д.: 7,74 (д, J=7,5 Гц, 1H), 7,36 (д, 1H, J=7,8 Гц), 7,20 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,15 (ушир.с, 2H), 4,67-4,74 (м, 1H), 3,64 (с, 3H), 3,19-3,36 (м, 2H), 1,50-1,80 (м, 8H), 0,86-0,98 (м, 6H).
Соединение (В-11)
ЯМР (ДМСО-d6) δ м.д.: 13,01 (ушир.с, 2H), 8,29 (с, 2H), 7,90 (д, 1H, J=7,5 Гц), 7,72 (с, 1H), 7,23-7,44 (м, 3H), 4,65-4,72 (м, 1H), 3,61 (с, 3H), 3,27 (т, 2H, J=6,3 Гц), 1,30-1,78 (м, 11H), 0,83-0,98 (м, 6H).
Сравнительный пример 12
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(1-этилокси-3-метилбутил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-12)
(RS)-4-[3-(1-этилокси-3-метилоксибутил)-2-метилоксифенил]тиазол-2-иламин (А-12)
ЯМР (CDCl3) δ м.д.: 7,74 (д, 1H, J=7,5 Гц), 7,36 (д, 1H, J=7,8 Гц), 7,20 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,15 (ушир.с, 2H), 4,76-4,84 (м, 1H), 3,64 (с, 3H), 3,30-3,42 (м, 2H), 1,50-1,80 (м, 6H), 0,92-1,02 (м, 6H).
Соединение (В-12)
ЯМР (ДМСО-d6) δ м.д.: 13,00 (ушир.с, 2H), 8,29 (с, 2H), 7,90 (д, 1H, J=7,5 Гц), 7,72 (с, 1H), 7,23-7,44 (м, 3H), 4,65-4,72 (м, 1H), 3,62 (с, 3H), 3,27 (т, 2H, J=6,3 Гц), 1,78-1,90 (м, 1H), 1,60-74 (м, 4H), 1,30-1,40 (м, 1H), 1,11 (т, 3H, J=6,9 Гц), 0,97 (д, 3H, J=6,3 Гц), 0,93 (д, 3H, J=6,3 Гц).
Сравнительный пример 13
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(2-метил-1-пропилоксипропил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-13)
(RS)-4-[2-метилокси-3-(2-метил-1-пропилоксипропил)фенил]тиазол-2-иламин (А-13)
ЯМР (CDCl3) δ м.д.: 7,74 (д, 1H, J=7,5 Гц), 7,36 (д, 1H, J=7,8 Гц), 7,20 (т, 1H, J=7,5 Гц), 7,08 (с, 1H), 5,20 (ушир.с, 2H), 4,36 (д, 1H, J=6,9 Гц), 3,60 (с, 3H), 3,15-3,34 (м, 2H), 1,90-2,02 (м, 1H), 1,50-1,63 (м, 2H), 1,02 (д, 3H, J=6,6 Гц), 0,91 (т, 3H, J=7,5 Гц), 0,83 (д, 3H, J=6,6 Гц).
Соединение (В-13)
ЯМР (ДМСО-d6) δ м.д.: 13,00 (ушир.с, 2H), 8,29 (с, 2H), 7,88 (д, 1H, J=7,5 Гц), 7,70 (с, 1H), 7,20-7,42 (м, 3H), 4,38 (дз, 1H, J=5,1 Гц), 3,60 (с, 3H), 3,20-3,27 (м, 2H), 1,85-1,95 (м, 1H), 1,69 (с, 2H), 1,44-1,55 (м, 2H), 0,96 (д, 3H, J=4,8 Гц), 0,88 (т, 3H, J=5,7 Гц), 0,81 (д, 3H, J=5,1 Гц).
Сравнительный пример 14
Синтез (RS)-(E)-3-(4-{4-[3-(1-бутилоксипропил)-2-метилоксифенил]тиазол-2-илкарбамоил}-2,6-дихлорфенил)-2-метилакриловой кислоты (В-14)
(RS)-4-[3-(1-бутилоксипропил)-2-метилоксифенил]тиазол-2-иламин (А-14)
ЯМР (CDCl3) δ м.д.: 7,73 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,36 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,17 (т, 1H, J=7,8 Гц), 7,07 (с, 1H), 5,39 (ушир.с, 2H), 4,58-4,62 (м, 1H), 3,64 (с, 3H), 3,24-3,37 (м, 2H), 1,30-1,86 (м, 6H), 0,98 (т, 3H, J=7,5 Гц), 0,89 (т, 3H, J=7,5 Гц).
Соединение (В-14)
ЯМР (ДМСО-d6) δ м.д.: 13,00 (ушир.с, 1H), 8,29 (с, 2H), 7,89-7,92 (м, 1H), 7,72 (с, 1H), 7,40 (с, 1H), 7,23-7,34 (м, 2H), 4,57-4,61 (м, 1H), 3,61 (с, 3H), 3,26-3,30 (м, 3H), 1,69 (с, 3H), 1,26-1,78 (м, 6H), 0,92 (т, 3H, J=7,2 Гц), 0,86 (т, 3H, J=7,2 Гц).
Сравнительный пример 15
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-пентилоксипропил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-15)
(RS)-4-[2-метилокси-3-(1-пентилоксипропил)фенил]тиазол-2-иламин (А-15)
ЯМР (CDCl3) δ м.д.: 7,73 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,36 (дд, 1H, J=1,8 Гц, 7,8 Гц), 7,17 (т, 1H, J=7,8 Гц), 7,07 (с, 1H), 5,33 (ушир.с, 2H), 4,58-4,62 (м, 1H), 3,64 (с, 3H), 3,23-3,37 (м, 2H), 1,22-1,86 (м, 8H), 0,98 (т, 3H, J=7,2), 0,85-0,90 (м, 3H).
Соединение (В-15)
ЯМР (ДМСО-d6) δ м.д.: 13,00 (ушир.с, 1H), 8,29 (с, 2H), 7,89-7,92 (м, 1H), 7,72 (с, 1H), 7,40 (с, 1H), 7,23-7,34 (м, 2H), 4,56-4,61 (м, 1H), 3,61 (с, 3H), 3,25-3,39 (м, 3H), 1,69 (с, 3H), 1,18-1,77 (м, 8H), 0,92 (т, 3H, J=7,2 Гц), 0,85 (т, 3H, J=7,2 Гц).
Сравнительный пример 16
Синтез (RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилокси-5-метилгексил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-16)
Соединение (В-16)
ЯМР (ДМСО-d6) δ м.д.: 12,98 (ушир.с, 2H), 9,29 (с, 1H), 7,89-7,92 (м, 1H), 7,72 (с, 1H), 7,41 (с, 1H), 7,24-7,37 (м, 3H), 4,53-4,57 (м, 1H), 3,61 (с, 3H), 3,16 (с, 3H), 0,87-1,72 (м, 16H).
Сравнительный пример 17
Синтез этил (E)-3-(4-бром-2,6-дихлорфенил)-2-метилакриловой кислоты (4)
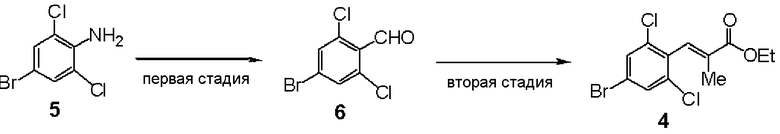
Первая стадия: Синтез 4-бром-2,6-дихлорбензальдегида (6)
4-Бром-2,6-дихлоранилин (5,80 г) растворяли в ацетоне (640 мл) и добавляли 48% водный раствор бромида водорода (120 мл), с последующим перемешиванием при 0°С. Добавляли по каплям водный раствор (160 мл) нитрита натрия (32 г), смесь перемешивали в течение 30 минут и добавляли метилакрилат (200 мл) и воду (200 мл), с последующим перемешиванием в течение 1 часа. При комнатной температуре добавляли оксид меди (I) (2 г), с последующим перемешиванием в течение 2 часов. Реакционный раствор экстрагировали этилацетатом и очищали колоночной хроматографией, получая метил (E)-3-(4-бром-2,6-дихлорфенил)акрилат (48,5 г). Метил (E)-3-(4-бром-2,6-дихлорфенил)акрилат (48,5 г) растворяли в дихлорметане, вводили газообразный озон при -70°С и подвергали окислению озоном. К реакционному раствору добавляли диметилсульфид (40 мл) и экстрагировали этилацетатом, получая 4-бром-2,6-дихлорбензальдегид (6, 37,2 г).
ЯМР (CDCl3) δ м.д.: 10,42 (с, 1H), 7,58 (с, 2H).
Вторая стадия: Синтез этил (Е)-3-(4-бром-2,6-дихлорфенил)-2-метилакрилата (4)
Триэтилфосфонопропионат (26,3 г) растворяли в ТГФ (150 мл), раствор в ТГФ гидрида натрия (6,3 г) и 4-бром-2,6-дихлорбензальдегида (6, 20 г), полученного на первой стадии, добавляли по каплям и смесь перемешивали в течение 2 часов. Реакционный раствор экстрагировали этилацетатом и очищали колоночной хроматографией, получая этил (E)-3-(4-бром-2,6-дихлорфенил)-2-метилакрилат (6, 21,2 г).
Температура плавления 32°С.
ЯМР (CDCl3) δ м.д.: 7,52 (с, 2H), 7,35 (с, 1H), 4,28 (кв, 2H, J=7,0 Гц), 1,76 (с, 3H), 1,33 (т, 3H, J=7,0 Гц).
Пример 1
Синтез (R)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (С-1А) и (S)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (С-1В)
(RS)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловую кислоту (В-1), полученную в сравнительном примере 1, разделяли ВЭЖХ на колонке OJ-RH (зарегистрированный товарный знак), изготовленной DAICEL, (в качестве элюирующего растворителя использовали смешанный растворитель из ацетонитрила, воды и трифторуксусной кислоты), получая оптически активное соединение (С-1А) и оптически активное соединение (С-1В).
Оптически активное соединение (С-1А)
Температура плавления: 162-164°С
ЯМР (ДМСО-d6) δ м.д.: 12,99 (ушир.с, 1H), 8,29 (с, 2H), 7,91 (дд, 1H, J=2,1 Гц, 7,2 Гц), 7,72 (с, 1H), 7,41 (д, 1H, J=1,5 Гц), 7,24-7,33 (м, 2H), 4,55-4,60 (м, 1H), 3,62 (с, 3H), 3,16 (с, 3H), 1,69 (с, 3H), 1,25-1,69 (м, 10H), 0,83-0,87 (м, 3H).
Оптическое вращение: +25,6 градуса (ДМСО, c=1000, 25°С)
Оптически активное соединение (С-1В)
Температура плавления: 161-164°С
ЯМР (ДМСО-d6) δ м.д.: 12,99 (ушир.с, 1H), 8,29 (с, 2H), 7,91 (дд, 1H, J=2,1 Гц, 7,2 Гц), 7,72 (с, 1H), 7,41 (д, 1H, J=1,5 Гц), 7,24-7,33 (м, 2H), 4,55-4,60 (м, 1H), 3,62 (с, 3H), 3,16 (с, 3H), 1,69 (с, 3H), 1,25-1,69 (м, 10H), 0,83-0,87 (м, 3H).
Оптическое вращение: -25,6 градуса (ДМСО, c=1,000, 25°С)
Пример 2
Синтез (R)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (С-3А) и (S)-(-)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (С-3В)
Согласно способу, аналогично описанному в примере 1, оптически активное соединение (С-3А) и оптически активное соединение (С-3В) синтезировали из (RS)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты (В-3), полученной в сравнительном примере 3.
Оптически активное соединение (С-3А)
Температура плавления: 139-141°С
ЯМР (ДМСО-d6) δ м.д.: 12,97 (ушир.с, 1H), 8,29 (с, 2H), 7,90 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,72 (с, 1H), 7,35-7,40 (м, 2H), 7,26 (т, 1H, J=7,5 Гц), 4,82 (кв, 1H, J=6,3 Гц), 3,62 (с, 3H), 3,16-3,37 (м, 2H), 1,69 (с, 3H), 1,18-1,51 (м, 11H), 0,82-0,87 (м, 3H).
Оптическое вращение: +4,5 градуса (ДМСО, c=1,001, 25°С)
Оптически активное соединение (С-3В)
Температура плавления: 142-145°С
ЯМР (ДМСО-d6) δ м.д.: 12,97 (ушир.с, 1H), 8,29 (с, 2H), 7,90 (дд, 1H, J=1,8 Гц, 7,5 Гц), 7,72 (с, 1H), 7,35-7,40 (м, 2H), 7,26 (т, 1H, J=7,5 Гц), 4,82 (кв, 1H, J=6,3 Гц), 3,62 (с, 3H), 3,16-3,37 (м, 2H), 1,69 (с, 3H), 1,18-1,51 (м, 11H), 0,82-0,87 (м, 3H).
Оптическое вращение: -4,5 градуса (ДМСО, c=1,001, 25°С)
Пример 3
Синтез (С-1В)
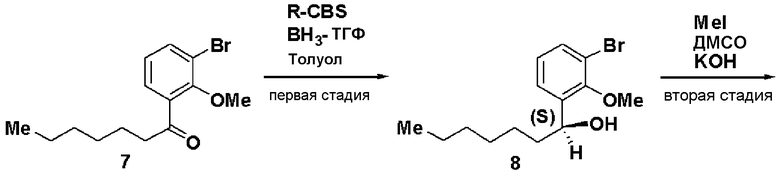
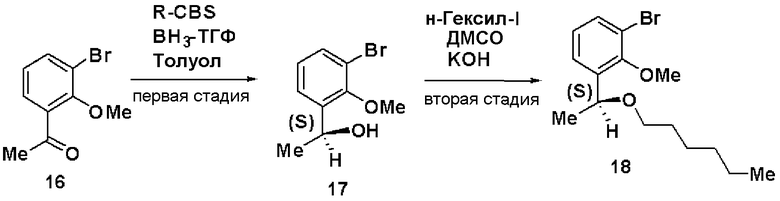
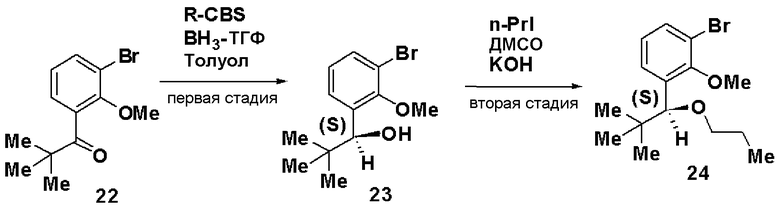
Первая стадия: Синтез (S)-1-(3-бром-2-метилоксифенил)гептан-1-ола (8)
При комнатной температуре 1М раствор борана в ТГФ (48 мл) добавляли к 1М раствору R-CBS в толуоле (120 мл). Добавляли 1-(3-бром-2-метилоксифенил)гептан-1-он (7, 13 г) и смесь перемешивали в течение 1 часа. Добавляли метанол, растворитель отгоняли и остаток очищали хроматографией, получая (S)-1-(3-бром-2-метилоксифенил)гептан-1-ол (8, 12,86 г, выход 75%).
Оптическое вращение: -22,7±0,6 градуса (CHCl3, c=1,008, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,8 Гц), 1,2-1,6 (8H, м), 1,74 (2H, м), 2,09 (1H, ушир.с), 3,88 (3H, с), 4,97 (1H, м), 7,01 (1H, т, J=7,8 Гц), 7,37 (1H, дд, J=7,9 Гц, J=1,3 Гц), 7,46 (1H, дд, J=7,9 Гц, J=1,7 Гц).
Вторая стадия: Синтез (S)-1-бром-2-метилокси-3-(1-метилоксигептил)бензола (9)
(S)-1-(3-бром-2-метилоксифенил)гептан-1-ол (8, 10 г), полученный на первой стадии, растворяли в ДМСО (42,1 мл), добавляли 50% водный раствор КОН (4,21 мл) и йодид метана (3,1 мл) и смесь перемешивали в течение 4 часов. Реакционный раствор экстрагировали простым изопропиловым эфиром и очищали хроматографией на силикагеле, получая (S)-1-бром-2-метилокси-3-(1-метилоксигептил)бензол (9, 8,77 г, 83%).
Оптическое вращение: -70,2±0,9 градуса (CHCl3, c=1,050, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,8 Гц), 1,2-1,5 (8H, м), 1,5-1,8 (2H, м), 3,22 (3H, с), 3,85 (3H, с), 4,51 (1H, м), 7,02 (1H, т, J=7,8 Гц), 7,33 (1H, дд, J=7,8 Гц, J=1,7 Гц), 7,46 (1H, дд, J=7,9 Гц, J=1,7 Гц).
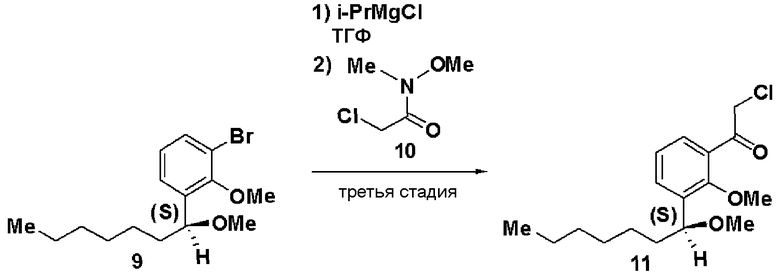
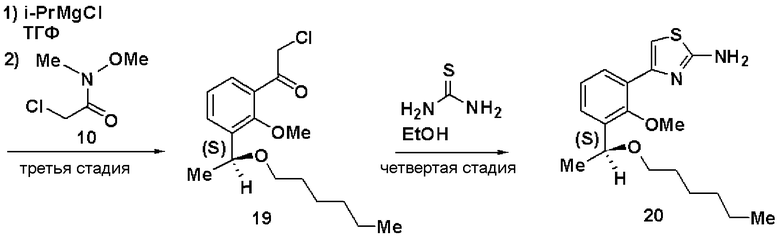
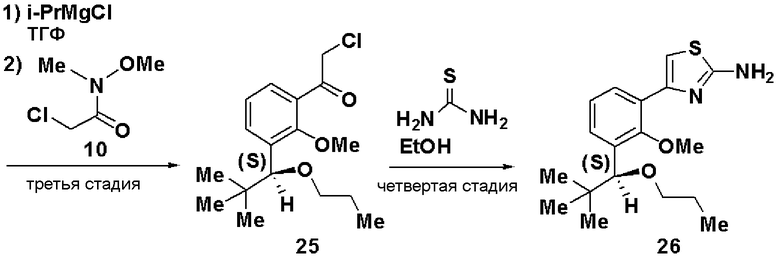
Третья стадия: Синтез (S)-2-хлор-1-(2-метилокси-3-(1-метилоксигептил)фенил)этанона (11)
К раствору в ТГФ (S)-1-бром-2-метилокси-3-(1-метилоксигептил)бензола (9, 12,5 г), полученного на второй стадии, добавляли по каплям 2М раствор изопропилмагнийхлорида в ТГФ (44 мл) при охлаждении льдом. Затем реакционный раствор перемешивали при 45°С в течение 3 часов, добавляли N-метилокси-N-метил-2-хлорацетамид (10, 3,5 г) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор экстрагировали этилацетатом и очищали хроматографией на силикагеле, получая (S)-2-хлор-1-(2-метилокси-3-(1-метилоксигептил)фенил)этанон (11).
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,8 Гц), 1,2-1,82 (10H, м), 3,22 (3H, с), 3,78 (3H, с), 4,53 (1H, м), 4,73 (2H, м), 7,24 (1H, т, J=7,6Гц), 7,52 (1H, дд, J=7,6 Гц, J=1,8 Гц), 7,60 (1H, дд, J=7,7 Гц, J=1,8Гц).
Четвертая стадия: Синтез (S)-4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-амина (12)
(S)-2-хлор-1-(2-метилокси-3-(1-метилоксигептил)фенил)этанон (11), полученный на третьей стадии, растворяли в этаноле (30 мл), добавляли тиомочевину (1,4 г) и смесь перемешивали при 100°С в течение 3 часов. Экстракция толуолом и очистка хроматографией на силикагеле давали (S)-4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-амин (12, 4,22 г, выход 32%).
Оптическое вращение: -54,8±0,9 градуса (ДМСО, c=1,045, 21°С)
ЯМР (ДМСО-d6) δ м.д.: 0,84 (3H, т, J=6,5 Гц), 1,2-1,5 (8H, м), 1,5-1,8 (2H, м), 3,13 (3H, с), 3,62 (3H, с), 4,54 (1H, м), 6,99 (2H, ушир.с), 7,05 (1H, с), 7,16 (1H, т, J=7,6 Гц), 7,22 (1H, дд, J=7,5 Гц, J=2,0 Гц), 7,81 (1H, дд, J=7,4 Гц, J=2,0 Гц).
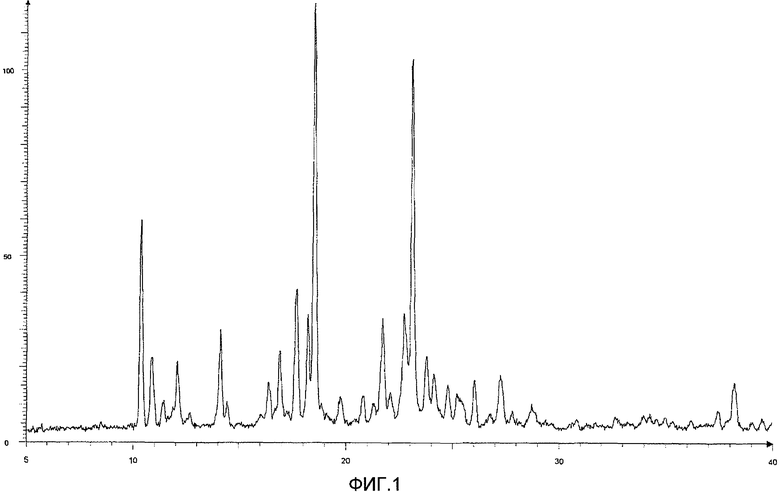
Результаты порошковой рентгеновской дифракции показаны на фиг.1 и в таблице 1.
Угол дифракции главного пика: 2θ=10,33, 17,7, 18,2, 18,5 и 23,1 градуса.
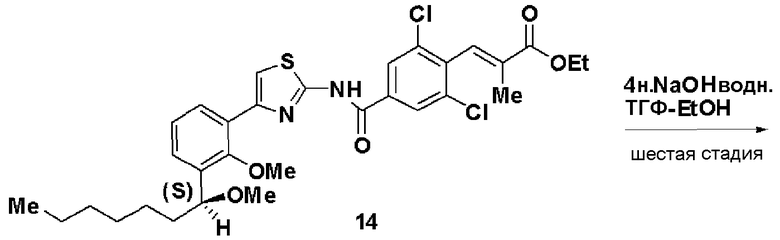
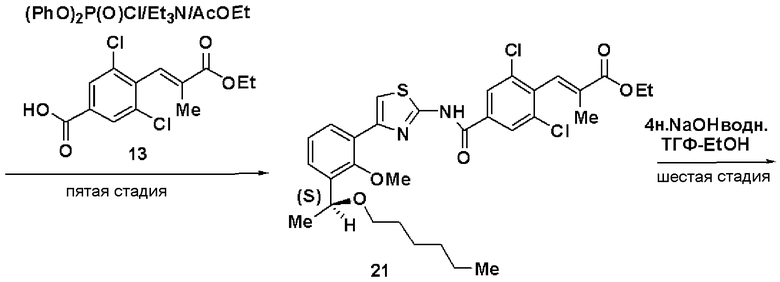
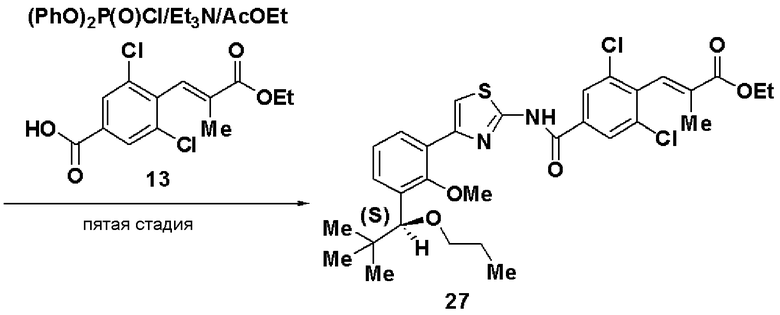
Пятая стадия: Синтез этил (S)-(Е)-3-(2,6-дихлор-4-(4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-илкарбамоил)фенил)-2-метилакрилата (14)
Этил 3-(4-карбокси-2,6-дихлорфенил)-2-метилакрилат (13, 3,82 г), полученный на следующей стадии А, растворяли в этилацетате (40 мл), добавляли хлорангидрид дифеноксифосфорной кислоты (3 г) и триэтиламин (4,2 мл) и добавляли (S)-4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-амин (12,4 г), полученный на четвертой стадии, и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционный раствор экстрагировали этилацетатом и после очистки хроматографией на силикагеле получали этил (S)-(Е)-3-(2,6-дихлор-4-(4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-илкарбамоил)фенил)-2-метилакрилат (14, 7,0 г, выход 95%).
Оптическое вращение: -24,1±0,6 градуса (CHCl3, с=1,040, 21°C)
ЯМР (CDCl3) δ м.д.: 0,88 (3H, т, J=6,5 Гц), 1,2-1,8 (10H, м), 1,37 (3H, т, J=7,1 Гц), 1,77 (3H, д, J=l,4 Гц), 3,23 (3H, с), 3,59 (3H, с), 4,31 (2H, кв, J=7,1 Гц), 4,56 (1H, м), 7,15 (1H, т, J=7,6 Гц), 7,35 (1H, дд, J=7,6 Гц, J=1,7 Гц), 7,41 (1H, д, J=1,2 Гц), 7,52 (1H, с), 7,67 (1H, дд, J=7,6 Гц, J=1,7 Гц), 7,88 (2H, с), 10,42 (1H, ушир.с).
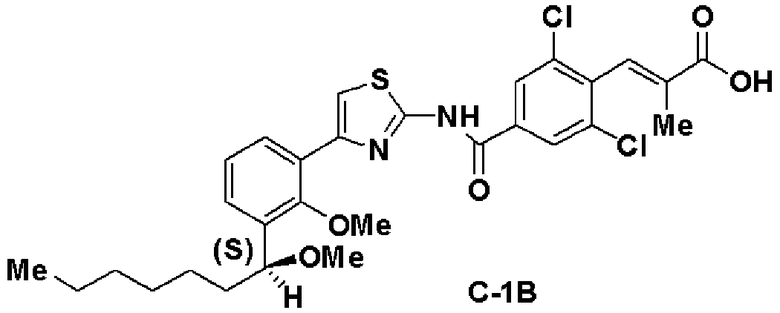
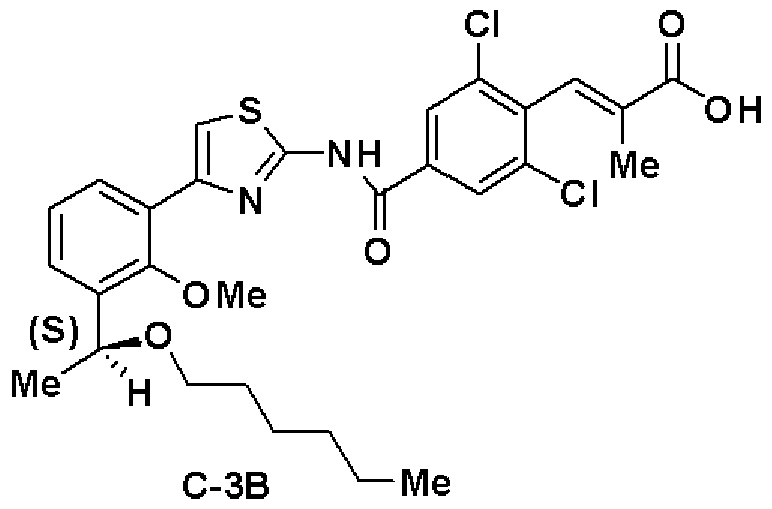
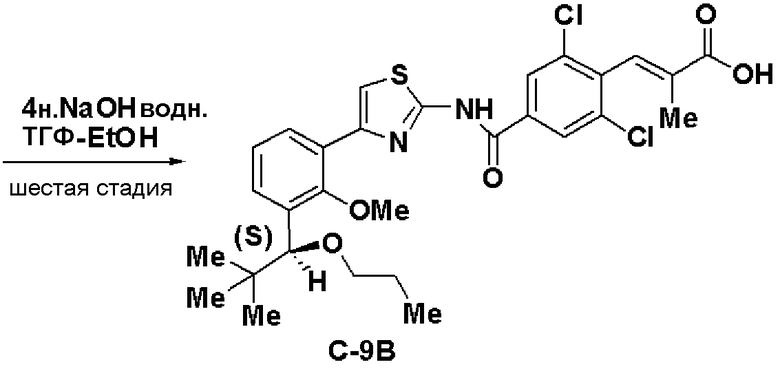
Шестая стадия: Синтез (S)-(Е)-3-(2,6-дихлор-4-(4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-илкарбамоил)фенил)-2-метилакриловой кислоты (С-1В)
Этил (S)-(Е)-3-(2,6-дихлор-4-(4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-илкарбамоил)фенил)-2-метилакрилат (14, 6,76 г), полученный на пятой стадии, растворяли в ТГФ (20 мл) и этаноле (20 мл), добавляли водный раствор (4 моль/л) гидроксида натрия (13,5 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор нейтрализовали хлористоводородной кислотой и экстрагировали этилацетатом. Экстракционный остаток перекристаллизовывали из метанола, получая (S)-(Е)-3-(2,6-дихлор-4-(4-(2-метилокси-3-(1-метилоксигептил)фенил)тиазол-2-илкарбамоил)фенил)-2-метилакриловую кислоту (С-1В, 5,8 г, выход 88%).
Оптическое вращение: -33,3±0,6 градуса (CHCl3, с=1,067, 21°C)
ЯМР (CDCl3) δ м.д.: 0,86 (3H, т, J=6,7 Гц), 1,22-1,82 (10H, м), 1,86 (3H, д, J=1,2 Гц), 3,27 (3H, с), 3,54 (3H, с), 4,61 (1H, м), 7,25 (1Н, т, J=7,8 Гц), 7,41 (1H, с), 7,43 (1H, дд, J=7,9 Гц, J=1,8 Гц), 7,52 (1H, дд, J=7,5 Гц, J=1,7 Гц), 7,41 (1H, д, J=1,4 Гц), 8,32 (2H, с), 13,3 (2H, ушир.с).
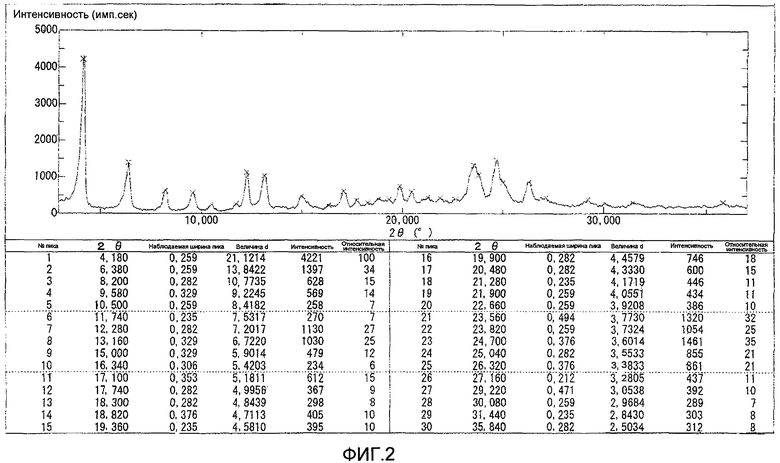
Результаты порошковой рентгеновской дифракции показаны на фиг.2.
Угол дифракции главного пика 2θ=4,2 6,4, 12,3, 13,2, 23,6, 23,8 и 24,7 градуса.
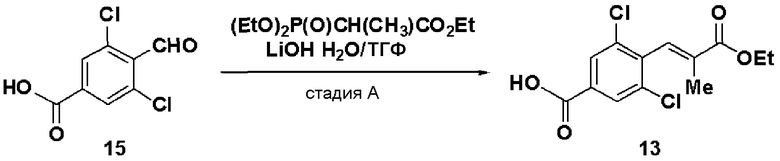
Стадия А: Синтез этил 3-(4-карбокси-2,6-дихлорфенил)-2-метилакрилата (13)
Триэтилфосфонопропионат (4,5 г) растворяли в ТГФ (15 мл), добавляли гидрид натрия (1,59 г) при охлаждении льдом и смесь перемешивали в течение 30 минут. К раствору добавляли раствор, полученный растворением 3,5-дихлор-4-формилбензойной кислоты (3,9 г) в ТГФ (10 мл), и смесь дополнительно перемешивали в течение 1 часа и 20 минут. Реакционный раствор экстрагировали этилацетатом и растворитель отгоняли до достижения массы, включая массу растворителя, 11,7 г. Осажденные кристаллы отфильтровывали и промывали смешанным растворителем из этилацетата и н-гептана (1:2), получая этил 3-(4-карбокси-2,6-дихлорфенил)-2-метилакрилат (13, 3,98 г).
Температура плавления: 145°C
ЯМР (CDCl3) δ м.д.: 8,07 (с, 2H), 7,47 (с, 1H), 4,32 (кв, 2H, J=7,0 Гц), 1,79 (с, 3H), 1,38 (т, 3H, J=7,0 Гц).
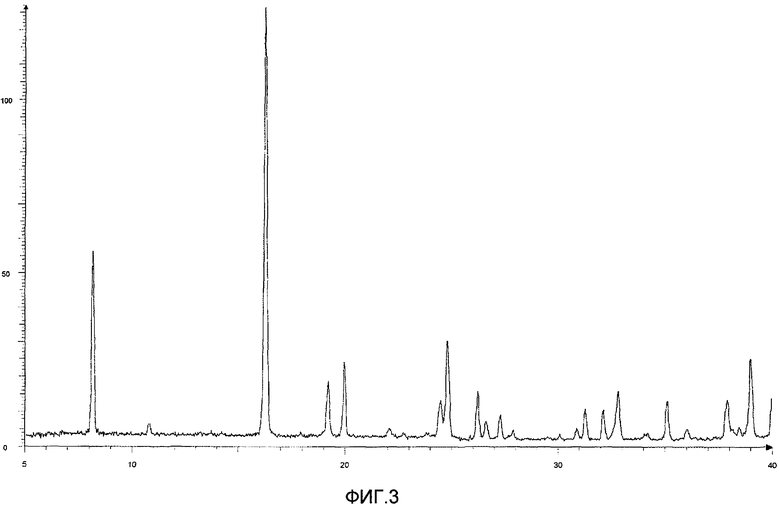
Результаты порошковой рентгеновской дифракции показаны на фиг.3.
Угол дифракции главного пика: 2θ=8,1, 16,3, 19,2, 20,0, 24,8 и 39,0 градусов.
Пример 4
Синтез (С-3В)
Первая стадия: Синтез (S)-1-(3-бром-2-метилоксифенил)этан-1-ола (17)
Используя способ, аналогично первой стадии примера 3, получали соединение (17) из соединения (16) с выходом 77%.
Оптическое вращение: -23,5±0,6 градуса (CHCl3, c=1,050, 21°С)
ЯМР (CDCl3) δ м.д.: 1,49 (3H, д, J=6,6 Гц), 2,33 (1H, ушир.с), 3,88 (3H, с), 5,19 (1H, кв, J=6,4 Гц), 7,01 (1H, т, J=7,9 Гц), 7,40 (1H, дд, J=7,7 Гц, J=1,1 Гц), 7,46 (1H, дд, J=8,0 Гц, J=1,4 Гц).
Вторая стадия: Синтез (S)-1-бром-3-(1-гексилоксиэтил)-2-метилоксибензола (18)
Используя способ, аналогично второй стадии примера 3, получали соединение (18) из соединения (17) с выходом 96%.
Оптическое вращение: -29,8±0,6 градуса (CHCl3, c=1,055, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,8 Гц), 1,2-1,4 (6H, м), 1,42 (3H, д, J=6,5 Гц), 1,54 (2H, м), 3,29 (2H, м), 3,85 (3H, с), 4,78 (1H, кв, J=6,4 Гц), 7,02 (1H, т, J=7,9 Гц), 7,39 (1H, дд, J=7,8 Гц, J=1,7 Гц), 7,45 (1H, дд, J=7,9 Гц, J=1,7 Гц).
Третья стадия и четвертая стадия: Синтез (S)-4-(3-(1-гексилоксиэтил)-2-метилоксифенил)тиазол-2-амина (20)
Используя способ, аналогично четвертой стадии примера 3, получали соединение (19) из соединения (18), затем согласно способу, аналогично четвертой стадии, получали соединение (20).
Соединение (19)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,9 Гц), 1,2-1,4 (6H, м), 1,45 (3H, д, J=6,6 Гц), 1,55 (2H, м), 3,29 (2H, м), 3,78 (3H, с), 4,73 (2H, м), 4,80 (1H, кв, J=6,4 Гц), 7,24 (1H, т, J=7,8 Гц), 7,52 (1H, дд, J=7,7 Гц, J=1,8 Гц), 7,65 (1H, дд, J=7,7 Гц, J=1,8 Гц).
Соединение (20)
Оптическое вращение: -4,2±0,4 градуса (ДМСО, c=1,025, 21°С)
ЯМР (CDCl3) δ м.д.: 0,84 (3H, т, J=7,0 Гц), 1,2-1,3 (6H, м), 1,35 (3H, д, J=6,5 Гц), 1,48 (2H, м), 3,25 (2H, м), 3,61 (3H, с), 4,78 (1H, кв, J=6,4 Гц), 6,99 (2H, ушир.с), 7,05 (1H, с), 7,16 (1H, т, J=7,7 Гц), 7,27 (1H, дд, J=7,5 Гц, J=1,8 Гц), 7,81 (1H, дд, J=7,6 Гц, J=1,9 Гц).
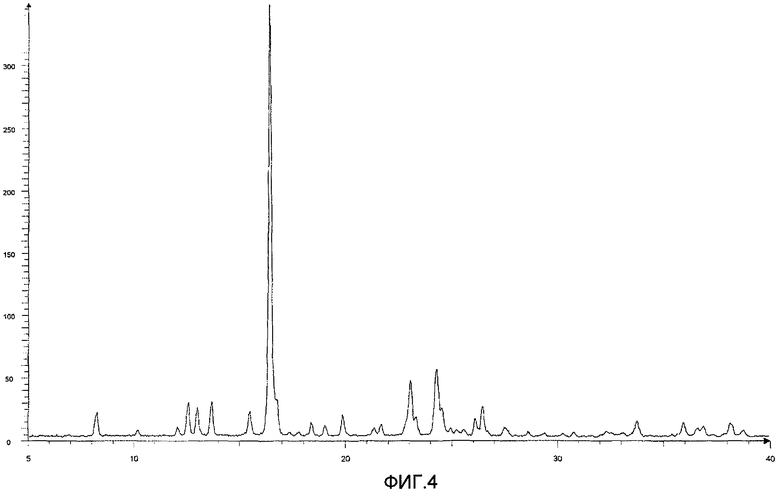
Результаты порошковой рентгеновской дифракции показаны на фиг.4.
Угол дифракции главного пика: 2θ=12,5, 13,0, 13,6, 16,4, 23,0 и 24,3 градуса.
Пятая стадия: Синтез этил (S)-(E)-3-(2,6-дихлор-4-(4-(3-(1-гексилоксиэтил)-2-метилоксифенил)тиазол-2-илкарбамоил)фенил)-2-метилакрилата (21)
Используя способ, аналогично пятой стадии примера 3, получали соединение (21) из соединения (20) с выходом 94%.
Оптическое вращение: +4,7±0,4 градуса (CHCl3, c=1,07, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,9 Гц), 1,2-1,35 (6H, м), 1,38 (3H, т, J=7,1 Гц), 1,44 (3H, д, J=6,4 Гц), 1,57 (2H, м), 1,77 (3H, д, J=1,4 Гц), 3,30 (2H, м), 3,59 (3H, с), 4,31 (2H, кв, J=7,1 Гц), 4,83 (1H, кв, J=6,4 Гц), 7,17 (1H, т, J=7,7 Гц), 7,42 (1H, д, J=1,7 Гц), 7,42 (1H, дд, J=7,7 Гц, J=1,8 Гц), 7,51 (1H, с), 7,67 (1H, дд, J=7,6 Гц, J=1,7 Гц), 7,89 (2H, с), 10,30 (1H, ушир.с).
Шестая стадия: Синтез (S)-(E)-3-(2,6-дихлор-4-(4-(3-(1-гексилоксиэтил)-2-метилоксифенил)тиазол-2-илкарбамоил)фенил)-2-метилакриловой кислоты (С-3В)
Используя способ, аналогично шестой стадии примера 3, получали соединение (С-3В) из соединения (21) с выходом 80%.
Оптическое вращение: -7,0±0,5 градуса (CHCl3, c=1,040, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (3H, т, J=6,8 Гц), 1,2-1,4 (6H, м), 1,48 (3H, д, J=6,4 Гц), 1,52-1,64 (2H, м), 1,86 (3H, д, J=1,4 Гц), 3,35 (2H, т, J=6,7 Гц), 3,55 (3H, с), 4,87 (1H, кв, J=6,3 Гц), 7,25 (1H, т, J=7,7 Гц), 7,41 (1H, с), 7,49 (1H, дд, J=7,9 Гц, J=1,6 Гц), 7,51 (1H, дд, J=7,5 Гц, J=1,8 Гц), 7,65 (1H, д, J=1,4 Гц), 8,33 (2H, с), 13,4 (2H, ушир.с).
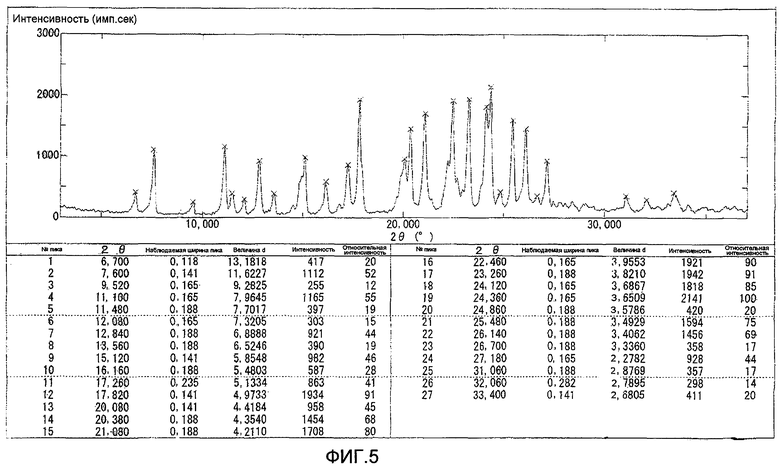
Результаты порошковой рентгеновской дифракции показаны на фиг.5.
Угол дифракции главного пика: 2θ=17,8, 21,1, 22,5, 23,3, 24,1 и 24,4 градуса.
Пример 5
Синтез (С-9В)
Первая стадия: Синтез (S)-1-(3-бром-2-метилоксифенил)-2,2-диметил-пропил-1-ола (23)
Используя способ, аналогично первой стадии примера 3, получали соединение (23) из соединения (22) с выходом 86%.
Оптическое вращение: -6,1±0,4 градуса (CHCl3, c=1,070, 21°С)
ЯМР (CDCl3) δ м.д.: 0,92 (9H, с), 2,06 (1H, ушир.с), 3,83 (3H, с), 4,78 (1H, с), 6,99 (1H, т, J=7,8 Гц), 7,38 (1H, дд, J=7,8 Гц, J=1,6 Гц), 7,46 (1H, дд, J=7,9 Гц, J=1,7 Гц).
Вторая стадия: Синтез (S)-1-бром-3-(2,2-диметил-1-пропилоксипропил)-2-метилоксибензола (24)
Используя способ, аналогично второй стадии примера 3, получали соединение (24) из соединения (23) с выходом 84%.
Оптическое вращение: +3,2±0,4 градуса (CHCl3, c=1,080, 21°С)
ЯМР (CDCl3) δ м.д.: 0,89 (9H, с), 0,92 (3H, т, J=7,2 Гц), 1,56 (2H, м), 3,19 (2H, м), 3,83 (3H, с), 4,30 (1H, с), 6,98 (1H, т, J=7,9 Гц), 7,34 (1H, дд, J=7,9 Гц, J=1,6 Гц), 7,45 (1H, дд, J=7,8 Гц, J=1,6 Гц).
Третья стадия и четвертая стадия: Синтез (S)-4-(3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил)тиазол-2-амина (26)
Используя способ, аналогично третьей стадии примера 3, получали соединение (25) из соединения (24), затем согласно способу, аналогично четвертой стадии, получали соединение (26).
Соединение (25)
ЯМР (CDCl3) δ м.д.: 0,90 (9H, с), 0,92 (3H, т, J=7,2 Гц), 1,57 (2H, м), 3,19 (2H, м), 3,74 (3H, с), 4,32 (1H, с), 4,71 (2H, м), 7,21 (1H, т, J=7,7 Гц), 7,49 (1H, дд, J=7,7 Гц, J=1,8 Гц), 7,61 (1H, дд, J=7,7 Гц, J=1,7 Гц).
Соединение (26)
Оптическое вращение: -93,6±1,2 градуса (ДМСО, c=1,070, 21°С)
ЯМР (CDCl3) δ м.д.: 0,87 (9H, с), 0,89 (3H, т, J=7,4 Гц), 1,52 (2H, м), 3,19 (2H, м), 3,58 (3H, с), 4,37 (1H, с), 6,99 (2H, ушир.с), 7,02 (1H, с), 7,14 (1H, т, J=7,7 Гц), 7,21 (1H, дд, J=7,6 Гц, J=2,1 Гц), 7,80 (1H, дд, J=7,4 Гц, J=2,0 Гц).
Пятая стадия: Синтез этил (S)-(E)-3-(2,6-дихлор-4-(4-(3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил)тиазол-2-илкарбамоил)фенил)-2-метилакрилата (27)
Используя способ, аналогично пятой стадии примера 3, получали соединение (27) из соединения (26) с выходом 94%.
Оптическое вращение: -79,5±1,2 градуса (CHCl3, c=1,010, 21°С)
ЯМР (CDCl3) δ м.д.: 0,89 (9H, с), 0,92 (3H, т, J=7,2 Гц), 1,37 (3H, т, J=7,1 Гц), 1,56 (2H, м), 1,76 (3H, д, J=1,5 Гц), 3,18 (2H, м), 3,53 (3H, с), 4,31 (2H, кв, J=7,1 Гц), 4,32 (1H, с), 7,08 (1H, т, J=7,6 Гц), 7,34 (1H, дд, J=7,7 Гц, J=1,8 Гц), 7,40 (1H, д, J=1,4 Гц), 7,51 (1H, с), 7,62 (1H, дд, J=7,6 Гц, J=1,8 Гц), 7,84 (2H, с), 10,77 (1H, ушир.с).
Шестая стадия: Синтез (S)-(E)-3-(2,6-дихлор-4-(4-(3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил)тиазол-2-илкарбамоил)фенил)-2-метилакриловой кислоты (С-9В)
Используя способ, аналогично шестой стадии примера 3, получали соединение (С-9В) из соединения (27) с выходом 87%.
Оптическое вращение: -61,6±0,9 градуса (CHCl3, c=1,018, 21°С)
ЯМР (CDCl3) δ м.д.: 0,90 (9H, с), 0,90 (3H, т, J=7,4 Гц), 1,53 (2H, м), 1,69 (3H, д, J=1,1 Гц), 3,21 (2H, м), 3,57 (3H, с), 4,40 (1H, с), 7,24 (1H, т, J=7,6Гц), 7,29 (1H, дд, J=7,7 Гц, J=2,1 Гц), 7,40 (1H, д, J=1,4 Гц), 7,68 (1H, с), 7,89 (1H, дд, J=7,4 Гц, J=2,1 Гц), 8,28 (2H, с), 12,98 (2H, ушир.с).
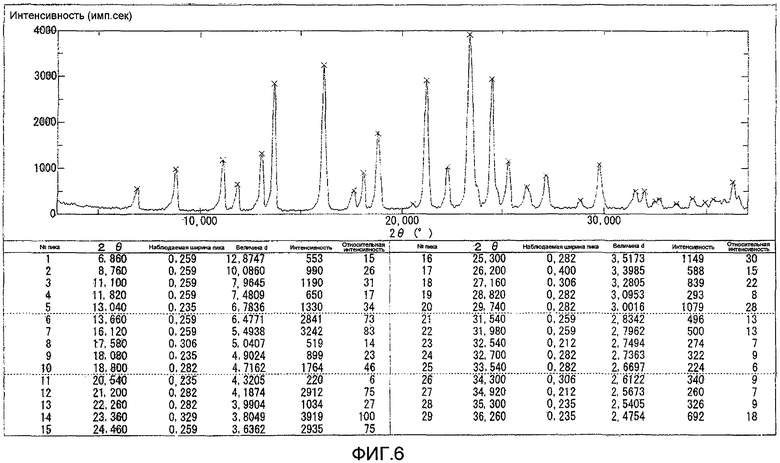
Результаты порошковой рентгеновской дифракции показаны на фиг.6.
Угол дифракции главного пика: 2θ=13,6, 16,1, 21,2, 23,4 и 24,5 градуса.
Используя способы, аналогично примерам 1-5, могут быть синтезированы следующие оптически активные соединения (см. табл. 4).
Примеры испытания
Пример испытания 1
Выделение и очистка тромбопоэтина (ТРО)
ТРО человека и мыши приобретали у R&D Systems.
Пример испытания 2
Реактивность рецептора ТРО
Реактивность рецептора ТРО на соединение, представленное формулой (I), измеряли, используя Тро-зависимый клеточный штамм BaF/hTPOR, полученный введением гена рецептора ТРО человека в клетку BaF-В03 согласно способу, описанному Collins et al., J. Cell. Physiol., 137:293-298 (1988). Нуклеотидная последовательность гена, кодирующего рецептор тромбопоэтина, описана Vigon et al., Proc. Natl. Acad. Sci. 89:5640-5644 (1992). ТРО не реагирует на клетку BaF-В03, которая является родительским штаммом. Клетки BaF/hTPOR, размноженные в среде RPMI с добавленным к ней 10% культуральным раствором WEHI-3, промывали один раз PBS, суспендировали в среде RPMI без добавления культурального раствора WEHI-3 и клетки высевали на 96-луночный микропланшет при 5×104/лунка и добавляли к ним данное соединение или ТРО. После культивирования при 37°С в течение 20 часов в атмосфере 5% СО2 добавляли реагент WST-1 (произведенный Takara Shuzo, Co., Ltd), который является реагентом для определения пролиферации клеток, и измеряли поглощение при 450 нм после 4 часов. Величину ED50 определяли как концентрацию соединения, проявляющую полумаксимальную реактивность ТРО человека, и величина ED50 каждого соединения показана в таблице 5.
Пример испытания 3
Испытание эффективности лекарственного средства in vivo на нокауторованных геном мышах, у которых трансмембранный сайт мышиного гена рецептора ТРО заменен человеческим типом
Наличие или отсутствие эффективности лекарственного средства может быть подтверждено непрерывным пероральным введением соединения (С-1А), соединения (С-1В), соединения (С-3А), соединения (С-3В) или соединения (С-9В) дважды в день в течение 2 недель, сбором крови через три дня, одну неделю, две недели и три недели после первоначального введения и подтверждением того, что число тромбоцитов увеличивается по сравнению с группой введения носителя.
Пример получения
Пример получения 1
Получают гранулу, содержащую следующие компоненты.
Соединение, представленное формулой (I), и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Все смешивают в смесителе V-типа. К смешанному порошку добавляют водный раствор НРС-L (гидроксипропилцеллюлоза низкой вязкости), пластицируют, гранулируют (экструзионное гранулирование, диаметр пор от 0,5 до 1 мм) и сушат. Полученные сухие гранулы пропускают через вибрационное сито (12/60 меш), с получением гранулы.
Пример получения 2
Получают порошок для заполнения капсулы, содержащий следующие компоненты.
Соединение, представленное формулой (I), и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Все компоненты и стеарат магния смешивают в смесителе V-типа. 100 мг 10-кратно измельченного порошка помещают в твердую желатиновую капсулу № 5.
Пример получения 3
Получают гранулы для заполнения капсулы, содержащие следующие компоненты.
Соединение, представленное формулой (I), и лактозу пропускают через сито 60 меш. Кукурузный крахмал пропускают через сито 120 меш. Все смешивают, к смешанному порошку добавляют раствор НРС-L и пластицируют, гранулируют и сушат. Полученные сухие гранулы подгоняют по размерам частиц, 150 мг гранул помещают в твердую желатиновую капсулу № 4.
Пример получения 4
Получают таблетку, содержащую следующие компоненты.
Соединение, представленное формулой (I), лактозу, микрокристаллическую целлюлозу и СМС-Na (натрийкарбоксиметилцеллюлоза) пропускают через сито 60 меш и смешивают. Стерат магния примешивают в смешанный порошок, с получением требуемого смешанного порошка. Данный смешанный порошок непосредственно прессуют, с получением таблетки 150 мг.
Пример получения 5
Препарат для внутривенного введения получают следующим образом:
Раствор указанных компонентов вводят внутривенно пациенту со скоростью 1 мл в минуту.
Промышленная применимость
Как было обнаружено, оптически активное производное 4-фенилтиазола обладает превосходной активностью агониста тромбопоэтина, проявляет высокую абсорбируемость при пероральном введении и/или высокую активность in vivo, и фармацевтическая композиция, содержащая указанное соединение в качестве активного ингредиента, эффективна в качестве терапевтического и/или профилактического средства против заболевания крови, сопровождающегося аномальностью числа тромбоцитов крови, такого как тромбоцитопения и тому подобное. В дополнение, обнаружено, что кристаллы имеют высокую стабильность и/или высокую чистоту, промежуточное соединение имеет высокую стабильность, и они могут быть использованы при получении производного 4-фенилтиазола и/или при получении фармацевтической композиции.
Краткое описание рисунков
[Фиг.1] Порошковая рентгенограмма и величина пиков кристалла соединения (12), полученного на четвертой стадии примера 3. По оси ординат показана интенсивность и по абсциссе показан угол дифракции (2θ, единица: градус).
[Фиг.2] Порошковая рентгенограмма и величина пиков кристалла соединения (С-1В), полученного на шестой стадии примера 3. По оси ординат показана интенсивность (единица: импульс/сек) и по абсциссе показан угол дифракции (2θ, единица: градус).
[Фиг.3] Порошковая рентгенограмма и величина пиков кристалла соединения (13), полученного на седьмой стадии примера 3. По оси ординат показана интенсивность и по абсциссе показан угол дифракции (2θ, единица: градус).
[Фиг.4] Порошковая рентгенограмма и величина пиков кристалла соединения (20), полученного на четвертой стадии примера 4. По оси ординат показана интенсивность и по абсциссе показан угол дифракции (2θ, единица: градус).
[Фиг.5] Порошковая рентгенограмма и величина пиков кристалла соединения (С-3В), полученного на шестой стадии примера 4. По оси ординат показана интенсивность (единица: импульс/сек) и по абсциссе показан угол дифракции (2θ, единица: градус).
[Фиг.6] Порошковая рентгенограмма и величина пиков кристалла соединения (С-9В), полученного на шестой стадии примера 5. По оси ординат показана интенсивность (единица: импульс/сек) и по абсциссе показан угол дифракции (2θ, единица: градус).
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ ДИКАРБОНОВОЙ КИСЛОТЫ | 2014 |
|
RU2662817C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2009 |
|
RU2525116C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПУРИНИЛПИРИДИНИЛАМИНО-2,4-ДИФТОРФЕНИЛСУЛЬФОНАМИДА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ RAF-КИНАЗЫ, СОДЕРЖАЩАЯ ДАННОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2011 |
|
RU2550038C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ПРОФИЛАКТИКЕ ИЛИ ЛЕЧЕНИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2017 |
|
RU2783160C2 |
| ПРОИЗВОДНЫЕ 2-ОКСОХИНАЗОЛИНА КАК ИНГИБИТОРЫ МЕТИОНИН АДЕНОЗИЛТРАНСФЕРАЗЫ 2A | 2019 |
|
RU2830169C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И ХИНАЗОЛИНА СО СРОДСТВОМ К 5HT-РЕЦЕПТОРАМ | 2004 |
|
RU2402533C2 |
| ПРОИЗВОДНЫЕ 5-АМИДИНО-2-ГИДРОКСИБЕНЗОЛСУЛЬФОНАМИДА, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2273633C9 |
| N,N-ЗАМЕЩЕННЫЕ 3-АМИНОПИРРОЛИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОВТОРНОГО ПОГЛОЩЕНИЯ МОНОАМИНОВ | 2006 |
|
RU2574406C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ИЛИ ПРЕДОТВРАЩЕНИИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2016 |
|
RU2741496C2 |
Изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента оптически активное соединение, представленное формулой:
где R1 представляет атом галогена или C1-C3алкилокси; R2 представляет C1-C8алкил; R3 представляет C1-C8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет C1-C3алкил или C1-C3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемую соль или его сольват, которое обладает активностью агониста рецептора тромбопоэтина. 10 н. и 2 з.п. ф-лы., 5 табл., 6 ил., 5 примеров.
1. Фармацевтическая композиция, обладающая активностью агониста рецептора тромбопоэтина, содержащая в качестве активного ингредиента оптически активное соединение, представленное формулой (I)
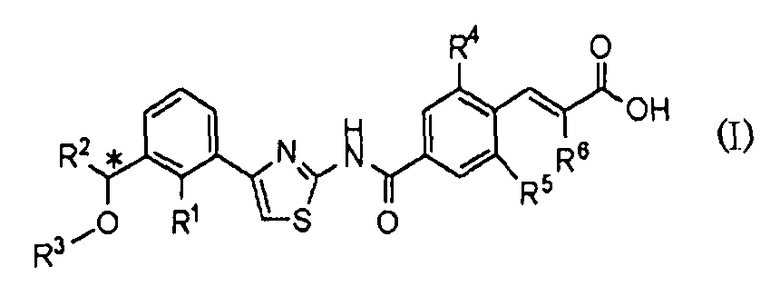
где R1 представляет атом галогена или C1-C3алкилокси; R2 представляет C1-C8алкил; R3 представляет C1-C8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет C1-C3алкил или C1-C3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемую соль или его сольват.
2. Фармацевтическая композиция по п.1, где композиция является агентом, регулирующим продукцию тромбоцитов.
3. Кристалл (S)-(E)-3-(2,6-дихлор-4-{4-[2-метилокси-3-(1-метилоксигептил)фенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющий угол дифракции 2θ главного пика порошковой рентгеновской дифракции 4,2, 6,4, 12,3, 13,2, 23,6, 23,8 и 24,7 градуса.
4. Кристалл (S)-(E)-3-(2,6-дихлор-4-{4-[3-(1-гексилоксиэтил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющий угол дифракции 2θ главного пика порошковой рентгеновской дифракции 17,8, 21,1, 22,5 23,3, 24,1 и 24,4 градуса.
5. Кристалл (S)-(E)-3-(2,6-дихлор-4-{4-[3-(2,2-диметил-1-пропилоксипропил)-2-метилоксифенил]тиазол-2-илкарбамоил}фенил)-2-метилакриловой кислоты, имеющий угол дифракции 2θ главного пика порошковой рентгеновской дифракции 13,6, 16,1, 21,2 23,4 и 24,5 градуса.
6. Фармацевтическая композиция, обладающая активностью агониста рецептора тромбопоэтина, содержащая в качестве активного ингредиента кристалл по любому из пп.3-5.
7. Фармацевтическая композиция по п.6, которая является агентом, регулирующим продукцию тромбоцитов.
8. Кристалл этил 3-(4-карбокси-2,6-дихлорфенил)-2-метилакрилата, имеющий угол дифракции 2θ главного пика порошковой рентгеновской дифракции 8,1, 16,3, 19,2, 20,0, 24,8 и 39,0 градуса.
9. Применение оптически активного соединения, представленного формулой (I)
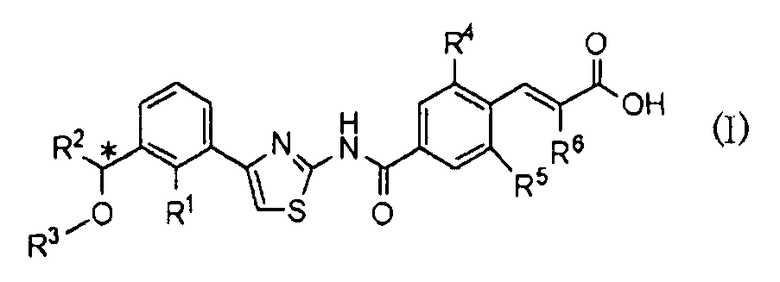
где R1 представляет атом галогена или C1-C3алкилокси; R2 представляет C1-C8алкил; R3 представляет C1-С8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет C1-C3алкил или C1-C3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемой соли или его сольвата для получения лекарственного средства для регулирования продукции тромбоцитов.
10. Способ регулирования продукции тромбоцитов у млекопитающего, включающий введение проявляющего терапевтический эффект количества оптически активного соединения, представленного формулой (I)
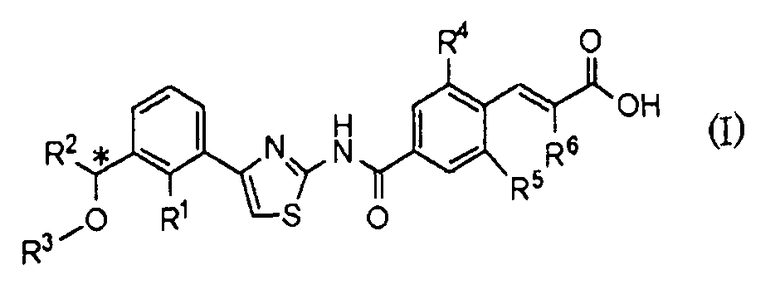
где R1 представляет атом галогена или C1-C3алкилокси; R2 представляет C1-C3алкил; R3 представляет C1-C8алкил; R4 и R5, каждый независимо, представляет атом фтора или атом хлора; R6 представляет C1-C3алкил или C1-C3алкилокси; * указывает, что атом углерода, отмеченный звездочкой, является асимметричным атомом углерода, его фармацевтически приемлемой соли или его сольвата млекопитающему, включая человека.
11. Применение кристалла по любому из пп.3-5 для получения лекарственного средства для регулирования продукции тромбоцитов.
12. Способ регулирования продукции тромбоцитов у млекопитающего, включающий введение проявляющего терапевтический эффект количества кристалла по любому из пп.3-5 млекопитающему, включая человека.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| FR 2854158, A1, 29.10.2004 | |||
| Тепловоз | 1925 |
|
SU5575A1 |
Авторы
Даты
2013-02-27—Публикация
2008-07-29—Подача