Изобретение относится к способу обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце. Изобретение также включает набор, подходящий для применения в данном способе. Этот способ и набор дают возможность более быстро определить количество жизнеспособных микроорганизмов
Бактерии Legionella повсеместно распространены во влажных или сырых средах, таких как почва и неморская водная среда обитания. Также их можно найти в устройствах для теплой и холодной воды, стояках охлаждения в системах кондиционирования воздуха и увлажнителях воздуха.
Legionella, особенно Legionella pneumophila, являются патогенами, которые могут вызывать острую бактериальную пневмонию, известную обычно под названием "болезнь легионеров", которая часто имеет летальный исход для инфицированных индивидуумов.
Традиционно обнаружение и подсчет Legionella pneumophila осуществляется посредством культивирования клеток. Этот способ может осуществляться путем определения количества культивируемых бактерий посевом на чашках Петри или подсчетом микроколоний, используя метод мембранного фильтрования. Этими способами оцениваются жизнеспособные бактерии по их способности образовывать колонию или микроколонию. К сожалению, такие способы обычно требуют от 3 до 10 дней для того, чтобы образовались колонии или микроколонии. Там, где водяные установки при этом находятся в работе, существует недопустимый риск инфицирования человека в течение этого периода времени.
Другие способы определения микроорганизмов Legionella в целом включают метод ПЦР (полимеразную цепную реакцию). В методе ПЦР используется ДНК-полимераза для амплификации участков ДНК путем ферментативной репликации in vitro. В ходе метода генерированная ДНК используется как матрица для репликации, которая приводит к цепной реакции, в которой матрица ДНК амплифицируется в геометрической прогрессии. ПЦР дает возможность одну или несколько копий участка ДНК увеличить до миллиона или более копий данного участка ДНК. В основном такой метод описан Diederen et al., J Med Microbiol. 2007 Jan; 56 (Pt 1): 94-101.
Однако недостатком ПНР является то, что образцы могут содержать ингибиторы реакции полимеризации и поэтому не всегда обеспечивают количественные результаты. Кроме того, в методе используется этап предварительной очистки ДНК, которая может приводить к потере ДНК с последующей недооценкой присутствия Legionella. В некоторой степени эти недостатки преодолеваются с помощью ПЦР в режиме реального времени, которая обеспечивает количественную оценку. Однако этот метод не позволяет отличить жизнеспособные клетки от нежизнеспособных клеток.
Другой способ представляет собой флуоресцентную гибридизацию in situ (FISH), в которой олигонуклеотидный зонд, меченный флуоресцентным веществом, проникает в клетки бактерий. В случае если рибосомные нуклеиновые кислоты (рРНК) имеют подходящую последовательность по отношению к зонду, узнаваемую как мишень, то этот зонд будет присоединяться к своей мишени и не будет удаляться на последующем этапе промывания. Бактерии, в которых зафиксировался зонд, затем будут излучать флуоресцентный сигнал. Этот флуоресцентный сигнал затем можно оценить количественно посредством способов, таких как проточная цитометрия, твердофазная цитометрия, эпифлуоресцентная микроскопия. Типичный FISH способ описывается Dutil S et al J Appl Microbiol., 2006 May; 100(5): 955-63. Однако, применяя только FISH способ, можно было бы определить общее число жизнеспособных Legionella pneumophila, но, к сожалению, этим способом нельзя непосредственно определить только те бактерии Legionella pneumophila, которые способны делиться и создавать впоследствии колонию.
Другой способ численного определения жизнеспособных Legionella pneumophila включает ChemChrome V6 и описан Delgado-Viscogliosi et al Appl Environ Microbiol. 2005 Jul; 71(7): 4086-96. Этот способ позволяет осуществлять количественное определение Legionella pneumophila, а также устанавливать различие между жизнеспособными и нежизнеспособными бактериями. Он объединяет специфическое детектирование клеток Legionella посредством использования антител и маркера бактериальной жизнеспособности (ChemChrome V6), и применение эпифлуоресцентной микроскопии для подсчета. Однако, хотя этот способ устанавливает различия между жизнеспособными и нежизнеспособными клетками, он не способен отдельно идентифицировать те бактерии, которые образуют колонии.
На сегодняшний день единственные способы, которые позволяют обнаружить бактерии Legionella pneumophila, способные делиться, основаны на способе микроколоний (Scan-VIT). Однако для этого способа требуется около 72 часов.
Arana et al. "Detection and enumeration of viable but non-culturable transconjugants of Escherichia coli during the survival of recipient cells in river water" pp 340-346, J. App. Microbiol. Vol 83, 1997 описывают применение прямого подсчета жизнеспособных клеток (DVC) с использованием специфических маркеров.
Piqueres et al. "A combination of direct viable count and fluorescent in situ hybridisation for estimating Helicobacter pylori cell viability" pp 345-349 Res. Macrobiol. Vol 157, 2006 Jjemba et al. "In situ enumeration and probing of pyrene degrading soil bacteria" pp 287-298 FEMS Microbiol. Ecol. Vol.55, 2006 оба ссылаются на DVC-FISH, но для микроорганизмов, не имеющих отношения к Legionella pneumophila.
В Европейской заявке на патент EP-A-1852512 описывается способ идентификации и подсчета нескольких патогенных микроорганизмов, включая Legionella pneumophila. Способ включает прямой подсчет жизнеспособных микроорганизмов (DVC) и флуоресцентную гибридизацию in situ (FISH), но также использует вспомогательный зонд (helper probe) для того, чтобы усилить сигнал. Вспомогательные зонды представляют собой немеченые олигонуклеотиды, которые присоединяются к участкам, являющимися соседними с участками, на которые нацелен меченый специфический зонд. Это увеличивает восприимчивость in situ, и, следовательно, даваемый зондом сигнал.
В способе, описанном в EP-A-1852512, говорится о применении ингибитора ДНК-гиразы, такого как налидиксовая кислота, которая останавливает деление клеток, увеличивает содержание внутриклеточной рРНК и клеточную длину чувствительных клеток. Однако на практике налидиксовая кислота не является достоверно эффективным ингибитором ДНК-гиразы для Legionella pneumophila. Кроме того, этот документ не упоминает о проблеме неточного подсчета, который может встречаться вследствие присутствия естественно флуоресцирующих микроорганизмов.
Было бы желательно обеспечить способ подсчета достоверно жизнеспособных микроорганизмов Legionella pneumophila, способных образовывать колонии в образце более быстро, чем известные способы. В дополнение, было бы предпочтительно осуществлять это более точно.
По настоящему изобретению мы обеспечиваем способ для обнаружения и подсчета жизнеспособных микроорганизмов в образце, предположительно содержащем указанные микроорганизмы, предусматривающий:
(1) контактирование указанного образца с источником питания для клеток и ингибитором клеточной пролиферации,
(2) контактирование указанного образца по меньшей мере с одним флуоресцентно-меченным олигонуклеотидным зондом, способным гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот указанных микроорганизмов,
(3) обнаружение и количественное определение флуоресцентного сигнала, в котором микроорганизмы представляют собой вид Legionella pneumophila и в котором ингибитор клеточной пролиферации выбирается из группы, состоящей из ципрофлоксацина и цефалексина.
Обычно каждый из этапов выполняется последовательно, при этом этап (2) выполняется на образце, обработанном на этапе (1), и затем после этапа (2) проводится этап (3).
Этап (1) способа по изобретению известен как прямой подсчет жизнеспособных микроорганизмов (DVC), основой которого является инкубация бактерий в присутствии антибиотика или ингибитора ДНК-гиразы, который блокирует клеточное деление, не нарушая клеточный метаболизм. Поэтому живые бактерии могут иметь тенденцию к удлинению, но не делиться, и, таким образом, их можно отличить от мертвых бактерий, которые не изменяются в размере. Следовательно, можно идентифицировать живые бактерии под микроскопом. Перед выполнением этапа DVC может быть желательным концентрировать образец и предварительно обработать его, например, кислотой и/или тепловым воздействием согласно стандартному методу Т 90-431 (ISSN 0335-3931), изданному и распространенному French Association of Normalization (AFNOR) 11, Avenue Francis de Pressense-93571 St Denis La Plaine Cedex, France.
Неожиданно мы нашли, что ципрофлоксацин и цефалексин являются очень эффективными ингибиторами ДНК-гиразы. Как ципрофлоксацин, так и цефалексин позволяют клеткам Legionella pneumophila расти в длину в препарате для клеточного деления, но фактически блокируют деление этих удлиненных клеток. В отличие от этого, налидиксовая кислота не обеспечивает достаточного удлинения клеток Legionella pneumophila, чтобы быть эффективной для настоящего способа. Предпочтительно, мы нашли, что способ по настоящему изобретению дает возможность достоверно идентифицировать и подсчитать Legionella pneumophila, и осуществить это в течение периода времени обычно менее чем 24 часа. Это обеспечивает значительные улучшения в санитарном контроле воды.
Ципрофлоксацин или цефалексин могут применяться в любом эффективном количестве. Обычно это составляет концентрацию вплоть до 20 мг/л или выше в среде, содержащейся в источнике питания для клеток. Предпочтительно концентрации составляют между 1 и 10 мг/л. Предпочтительно ингибитор клеточной пролиферации представляет собой ципрофлоксацин. Мы обнаружили, что самая большая элонгация клеток может быть достигнута, когда концентрация ципрофлоксацина составляет между 2 и 6 мг/л, особенно между 3 и 5 мг/л, после периода в 12 часов.
Источник питания для клеток должен содержать любую подходящую композицию питательной среды, применимую для способа DVC и подходящую для Legionella pneumophila. Подходящая композиция среды может содержать среду, селективную добавку, ингибитор клеточной пролиферации (ципрофлоксацин или цефалексин) и ростовую добавку.
Среда обеспечивает минимальное питание, требуемое для того, чтобы позволить расти Legionella pneumophila. Это может быть любая подходящая среда, как описано в литературе, например, согласно рекомендации стандартного метода Т 90-431 (как дано выше) без агара и угля.
Селективная добавка часто требуется для того, чтобы ограничить развитие мешающих микроорганизмов. В качестве антибиотика можно выбрать любую известную добавку, подходящую для DVC метода, например, описанную в стандартном методе Т 90-431 (как дано выше). Тем не менее, концентрация каждого антибиотика, в общем, должна быть адаптирована для конкретной жидкой среды. Однако не обязательно будет причиняться ущерб в случае, когда эти другие микроорганизмы не полностью удаляются, поскольку этап 2 обычно является достаточно специфическим, чтобы преодолеть влияние мешающих бактерий.
Хотя ростовая добавка не является существенной, чтобы позволить расти бактерии Legionella pneumophila, но она может оптимизировать ее рост. Legionella pneumophila характеризуется удвоением в продолжение 120 минут (при оптимальных условиях). Однако мы нашли, что в некоторых случаях жизнеспособные бактерии Legionella pneumophila, которые могут образовывать колонии, не обязательно формируют колонии немедленно, а вместо этого имеют задержку или латентную фазу, перед тем как начнется рост. Эта латентная фаза в виде начального физиологического состояния может находиться в пределах между 8 и более чем 20 часами.
В предпочтительном варианте настоящего изобретения латентная фаза для Legionella pneumophila может быть уменьшена посредством включения таких веществ, как ростовая добавка и антиоксидант, в источник питания для клеток. Антиоксидант может действовать непосредственно на реактивные формы кислорода (РФК) или другим путем, например, воздействуя на метаболизм микроорганизма прямо или косвенно, что приводит к снижению РФК. Подходящие антиоксиданты включают каталазу, аскорбиновую кислоту, метабисульфит натрия, диметилсульфоксид, TDPA (3,3'-тиодипропионовая кислота) и пируват и др. Предпочтительно антиоксидант представляет собой пируват. Предпочтительные дозы антиоксиданта, особенно пирувата, находятся в пределах между 0.5 и 1.5 г/л, особенно около 1 г/л.
Источник питания для клеток может включать, по меньшей мере, одно соединение, которое косвенным образом ингибирует образование и/или разрушает реактивные формы кислорода (РФК), и указанное соединение может приводить к снижению уровней РФК, вмешиваясь в процесс метаболизма микроорганизма. Обычно такие соединения включают аминокислоты или их соли. Особенно предпочтительным соединением является глутаминовая кислота или глутамат.
Еще в одном предпочтительном варианте изобретения источник питания для клеток может включать глутаминовую кислоту или глутамат, особенно натриевую соль. В общем количество глутаминовой кислоты или глутамата находится в пределах между 0.01 и 5% по массе в расчете на натриевую соль.
Особенно предпочтительно, чтобы источник питания для клеток включал пировиноградную кислоту или пируват (особенно натриевую соль) вместе с глутаминовой кислотой или глутаматом (особенно натриевой солью). Эта комбинация пировиноградной кислоты или пирувата с глутаминовой кислотой или глутаматом по-видимому имеет синергетический эффект, который обеспечивает более высокую оценку (и поэтому более точную оценку) культивируемой Legionella, чем соответственно любое из этих соединений, применяемое в отдельности. Кроме того, мы обнаружили, что эта комбинация дополнительно снижает латентную фазу во время развития Legionella pneumophila, в частности в жидкой среде. Такое снижение латентной фазы в жидкой среде приводит к уменьшению времени, которое требуется для получения видимой колонии на агаровой чашке.
Желательно, чтобы количество пирувата и глутамата составляло, как указано ранее. Особенно предпочтительно, чтобы отношение глутамата к пирувату находилось в пределах между 1:1 и 50:1, особенно между 5:1 и 20:1 и более предпочтительно между 7:1 и 15:1.
Неизвестно, является ли глутамат антиоксидантом. Однако представляется, что глутамат может косвенно снижать эндогенное образование РФК, сформированных естественным путем во время культивирования, или их последующее влияние на макромолекулы (окисление).
Не будучи ограниченными теорией, считают, что глутаминовая кислота изменяет метаболизм Legionella, увеличивая эффект пирувата, и это вмешательство в метаболизм Legionella косвенным образом ингибирует образование и/или разрушает внутриклеточные РФК.
Способ по настоящему изобретению может позволить применять более короткий инкубационный период, желательно, не более чем около 24 часов. Предпочтительно он может быть снижен до 12 часов, особенно в случаях, когда имеет место низкое бактериальное вмешательство и/или высокое присутствие бактерий Legionella pneumophila.
Образец может отбираться из любого подходящего места локализации. Это может быть, например, образец рециркуляционной воды в системе охлаждения. Однако желательно, чтобы образец воды был получен в форме аэрозоля. Обычно аэрозоль может локализоваться в стояке охлаждения или воздушном кондиционере. Согласно способу по настоящему изобретению, желательно, чтобы вода конденсировалась из аэрозоля перед испытанием.
Способ инкубации может быть таким, как представлено в литературе при описании процедуры DVC. Такой способ может включать фильтрование образца и последующую инкубацию фильтра на прокладках, пропитанных средой. Предпочтительно по настоящему изобретению образец, или концентрированный образец, непосредственно инкубируется со средой и затем фильтруется. Таким путем мы можем снизить риск потери бактерий во время процесса инкубации и обеспечить лучшие условия во время инкубации, например перенос кислорода или встряхивание образца.
На этапе 2 способа по изобретению может применяться стандартный протокол FISH.
В первой части FISH процедуры клетки могут быть фиксированы посредством обработки наружной мембраны или оболочки клетки, чтобы сделать ее проницаемой для олигонуклеотидных зондов. В целом это достигается при применении фиксирующих растворов, которые представляют собой водные растворы спиртов или альдегидов, которые могут смешиваться с водой при температуре 25°С. Подходящие спирты или альдегиды включают формальдегид, параформальдегид, этанол и/или метанол. Обычно растворы формальдегида или параформальдегида могут иметь концентрацию вплоть до 10% по массе и, предпочтительно, между 1 и 5%. Спирты обычно имеют концентрацию, по меньшей мере, 50% по массе и, в общем, между 60 и 90% по массе. Предпочтительно, эта обработка может быть достигнута последовательной обработкой одним или более из этих растворов Предпочтительно обработка может осуществляться раствором формальдегида или параформальдегида с концентрацией между 1 и 5% и сопровождаться двумя или тремя растворами этанола или метанола с увеличением концентрации от 50 до 90%.
В процедуре FISH затем применяется процедура гибридизации путем применения гибридизационного буфера, содержащего, по меньшей мере, один флуоресцентно-меченый олигонуклеотидный зонд, содержащий олигонуклеотид с прикрепленным флуоресцентным маркером. Этот олигонуклеотид способен нацеливаться на специфическую последовательность в клетке. Олигонуклеотидные зонды проникают в наружную мембрану клетки и присоединяются к последовательности-мишени соответствующего олигонуклеотида. Понятно, что присоединение означает образование водородных связей между комплементарными участками нуклеиновой кислоты. В FISH методике олигонуклеотидные зонды являются комплементарными и способны связываться с определенным участком рибосомной последовательности-мишени в микроорганизме. Обычно зонды содержат от 15 до 30 оснований по длине в виде участков одноцепочечных дезоксирибонуклеиновых кислот и направлены на специфический участок-мишень в микроорганизме.
Олигонуклеотидный зонд, желательно, должен представлять собой специфический рибосомный ARN 16S зонд для Legionella pneumophila. Могут применяться любые олигонуклеотидные зонды, которые специфически нацелены на микроорганизмы вида Legionella pneumophila. Предпочтительно зонды выбираются из группы, состоящей из PNE 1 зонда, описанного Grimm et al 1998, с 5'3'нуклеотидной последовательностью ATCTGACCGTCCCAGGTT, LEGPNE 1 зонда (SEQ ID No 22), описанного Grimm et al 1998 и Declerck et al 2003, имеющего 5'3'нуклеотидную последовательность ATCTGACCGTCCCAGGTT, и LP2 зонда (SEQ ID No 23), описанного Yamamoto et al 1993, имеющего 5'3'нуклеотидную последовательность AGCTTTCATCCAAAGATA.
Также может быть желательным, в качестве альтернативы, применять зонды с последовательностями, имеющими, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80% и более предпочтительно, по меньшей мере, 90% идентичность с любым из трех зондов PNE 1 зондом, LEGPNE 1 зондом или LP2 зондом.
Чтобы избавится от риска ошибочной идентификации микроорганизмов, которые обладают естественной флуоресценцией, в предпочтительном варианте изобретения применяются два нуклеотидных зонда. Один зонд нацелен на все микроорганизмы из рода Legionella, а второй зонд предназначен для специфической гибридизации с микроорганизмами вида Legionella pneumophila. Каждый зонд помечен разными флуоресцентными красителями. Микроорганизмы, которые обладают естественной флуоресценцией, будут флуоресцентными только при специфической длине волны или узкой полосе длин волн, поэтому использование двух зондов с разными красителями, которые флуоресцируют при разных длинах волн, позволяет исключить естественно флуоресцирующие микроорганизмы, которые специфически не являются Legionella pneumophila.
В этом предпочтительном варианте изобретения первый зонд гибридизируется с микроорганизмами, принадлежащими к роду Legionella, который включает, но не ограничивается этим, Legionella longbeachae, Legionella jordanis, Legionella anisa, Legionella pneumophila. Этот первый зонд может содержать нуклеотид, который может связываться с рибосомной последовательностью-мишенью любых бактерий в пределах рода Legionella. Обычно первым зондом может быть любой из зондов, выбранных из группы, состоящей из зонда LEG705 (SEQ ID n°7), описанного Manz et al. (Manz et al. 1995), с 5'3'нуклеотидной последовательностью CTGGTGTTCCTTCCGATC, зонда LEG226 (SEQ ID n°8), описанного Manz et al. (Manz et al. 1995), с 5'3'нуклеотидной последовательностью TCGGACGCAGGCTAATCT, зонда Legall11 (SEQ ID n°9), описанного Leskela et al. (Leskela et al. 2005), с 5'3'нуклеотидной последовательностью CCTCCTCCCCACTGAAAGT, зонда Legall22 (SEQ ID n°10), описанного Leskela et al. (Leskela et al. 2005), с 5'3'нуклеотидной последовательностью CACTGTATGTCAAGGGTAGG, зонда Leg120v (SEQ ID n°11), описанного Buchbinder et al. (Bushbinder et al. 2002), с 5'3'нуклеотидной последовательностью AAGGCATATTCCTACGCG.
В качестве альтернативы может быть желательным применение зондов с последовательностями, имеющими по меньшей мере 70%, предпочтительно по меньшей мере 80% и более предпочтительно по меньшей мере 90% идентичность с любым из трех зондов LEG705 зондом, LEG226 зондом, Legall11 зондом, Legall22 и Leg120v зондом.
Второй зонд может гибридизироваться только со специфическим видом Legionella pneumophila и может быть любым из упомянутых выше нуклеотидных зондов с этой характеристикой, например, любым из трех зондов PNE1 зондом, LEGPNE1 зондом или LP2 зондом.
Может применяться любой из флуоресцентных красителей, про которые известно, что они соответствуют подходящим спектрам эмиссия/возбуждение FITC (флуоресцеин изотиоцианат) (например, Syto9, Alexa 488 и др.) или Cy3 (например, Rhodamine, Alexa 583 и др.)
Этап 3 включает подсчет соответствующих бактерий с помощью микроскопа. Это может осуществляться вручную или автоматически, например, с применением эпифлуоресцентного микроскопа. Предпочтительно для обнаружения и подсчета бактерий, меченых гибридизацией in situ и фиксированных на фильтре, необходимо использовать микроскоп, оборудованный эпифлуоресцентной системой.
Подходящие измерительные приборы включают ChemScan RDI и ScanVIT-Legionella TM (Vernicon AG, Munich, Germany). Можно использовать Chemscan (твердофазная цитометрия, разработанная AESChemunex) для обнаружения и подсчета меченых бактерий. Однако эту систему можно применять только для одной установки зеркала для эмиссии/возбуждения (488 нм), что ограничивает наш протокол использованием только одного меченого зонда.
ScanVIT-Legionella TM является предпочтительным, особенно исходя из упомянутого выше предпочтительного объекта изобретения, использующего по меньшей мере два зонда, поскольку этот способ позволяет использование двух различных флуоресцентных сигналов для исключения естественно флуоресцирующих микроорганизмов, которые не являются Legionella pneumophila.
Способ по настоящему изобретению облегчает точное и быстрое количественное определение существования Legionella pneumophila. Способ подходит для обнаружения Legionella pneumophila в образцах, полученных из любой из групп, выбранных из промышленных охлаждающих вод, питьевой воды, природных водных источников.
Настоящее изобретение также включает набор для более быстрого обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце, предположительно содержащем указанные микроорганизмы, содержащий:
(1) источник питания для клеток,
(2) ингибитор клеточной пролиферации,
(3) по меньшей мере один флуоресцентно-меченый олигонуклеотидный зонд, способный специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот указанных микроорганизмов,
(4) средство для обнаружения и количественной оценки флуоресцентного сигнала,
в котором ингибитор клеточной пролиферации выбирается из группы, состоящей из ципрофлоксацина и цефалексина.
В предпочтительном варианте набор может содержать следующие растворы: композиция среды (как определено выше), которая может быть обезвожена в целях длительного хранения; раствор для фиксации наружной мембраны бактерий, например формальдегида; раствор для гибридизации, например, как описано выше, который должен быть изготовлен незадолго до использования; раствор для промывки, например, как описано выше, который должен быть изготовлен незадолго до использования; флуоресцентный краситель для нуклеиновой кислоты, например DAPI (4,6-диамидино-2-фенилиндол дигидрохлорид), который может быть обезвожен для длительного хранения; поддерживающий антифединговый реагент. Предпочтительно набор может содержать фильтры. Более предпочтительно набор может дополнительно содержать физиологический буфер, растворы этанола различных концентраций между 50 и 90% и стерильную воду. Набор может также содержать пробирку Эппендорф, например, на 2 мл.
Набор может также содержать любой из вариантов выполнения, касающихся первого объекта изобретения.
Набор подходит для применения в способе по настоящему изобретению и дает возможность быстро и надежно подсчитать Legionella pneumophila.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Суспензию Legionella pneumophila с конечной концентрацией 106 бактерий/мл распределили на две суспензии с одинаковым объемом. Только первую суспензию (S1) фиксировали с 3.7% (об/об) формальдегида при температуре окружающей среды (от 20 до 22°С) в течение 30 минут. Обе суспензии затем промывали три раза посредством центрифугирования (6,000 × г, 5 мин при 20°С), в PBS (ФСБ) рН 7.4.
Обе суспензии в конце смешивали в соответствии с таблицей 1.
Каждую смесь обрабатывали согласно протоколу эксперимента, данному ниже.
Результаты
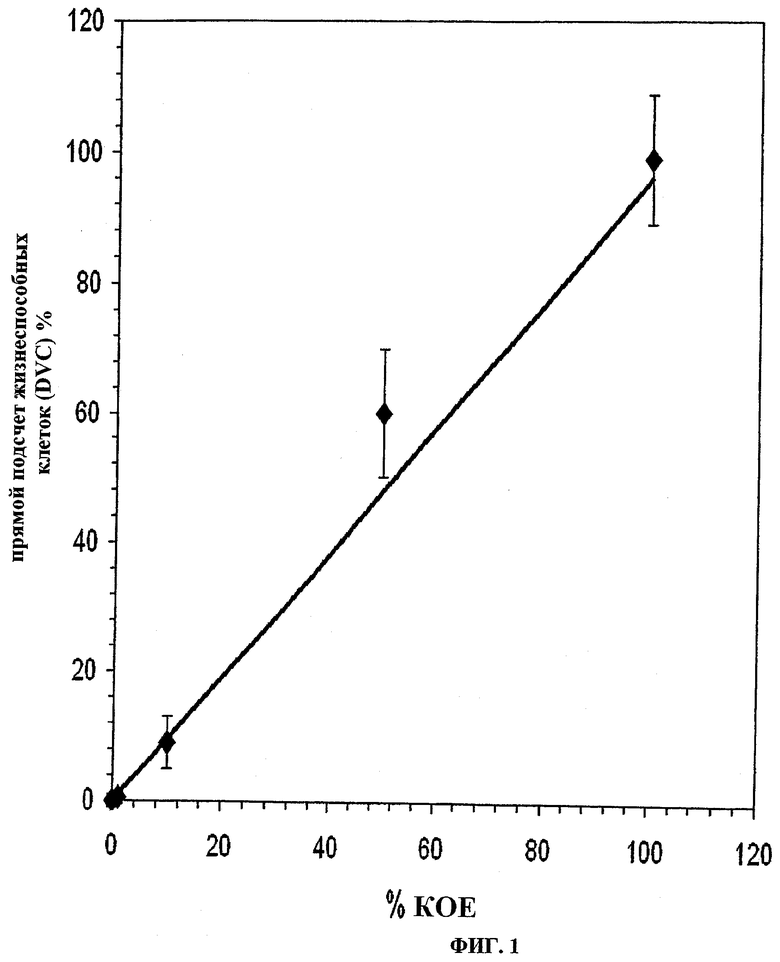
Результаты представлены на Фиг.1. На Фиг.1 показана корреляция между стандартным способом AFNOR (национальные стандарты Франции) (8 дней) и способом по настоящему изобретению, требующим менее чем 24 часа. Результаты показывают хорошую корреляцию между этими двумя способами в показателях точности идентификации Legionella pneumophila.
Протокол эксперимента
Образцы (V1) фильтровали через белую поликарбонатную мембрану диаметром 25 мм и с размером пор 0.2 мкм (Millipore, GTTP02500). Фильтры промывали два раза 10 мл раствора А и помещали в стерильную пробирку (Эппендорф, 2 мл), содержащую 1 мл раствора А. Пробирки встряхивали в течение 1 мин с частотой 30 Hz (4°С). Затем фильтры удаляли и каждую суспензию распределяли следующим образом:
1) 500 мкл суспензии в асептических условиях помещали в стерильную пробирку, содержащую 500 мкл раствора В. Затем пробирки инкубировали в течение 24 часов при температуре 37°С или 45°С со встряхиванием. После инкубации суспензии фильтровали через белую поликарбонатную мембрану диаметром 25 мм и с размером пор 0.2 мкм (Millipore, GTTP02500) и фиксировали раствором С при температуре окружающей среды (от 20 до 22°С) в течение 30 минут. Фильтры промывали два раза забуференным фосфатом физиологическим раствором (рН 7.4) и высушивали на воздухе;
2) 500 мкл суспензии сразу фильтровали через белую поликарбонатную мембрану диаметром 25 мм и с размером пор 0.2 мкм (Millipore, GTTP02500) и фиксировали раствором С при температуре окружающей среды (от 20 до 22°С) в течение 30 минут. Фильтры промывали два раза забуференным фосфатом физиологическим раствором (рН 7.4) и высушивали на воздухе.
Фильтры дегидратировали последовательными промываниями в Растворе D, Растворе E и Растворе F (2 мин в каждом) и затем сушили путем инкубации в течение 30 мин при температуре 37°С. Фильтры помещали на предметное стекло и на фильтры наносили 50 мкл Раствора G. На фильтр помещали покровное стекло, чтобы избежать обезвоживания. Гибридизацию выполняли в течение 2 часов при температуре 46±1°С во влажной камере. Затем фильтры промывали три раза 5 мл раствора Н, предварительно нагретого до 46°С, и далее промывали два раза дистиллированной водой. Фильтры инкубировали 15 мин с 1 мл Раствора I и прополаскивали два раза стерильной водой. После воздушной сушки фильтры окончательно монтировали на предметное стекло с 20 мкл раствора J. Гибридизированные клетки наблюдали с помощью эпифлуоресцентного микроскопа с иммерсионным объективом ×100 и двумя фильтрами эмиссии/возбуждения: фильтром возбуждения от 510 до 550 нм и пороговым фильтром 590 нм.
Растворы
Среда 2Х
Все реактивы стерилизовали посредством фильтрации через нитроцеллюлозную мембрану с размером пор 0.2 мкм (Millipore, SLGS025 OS). Более подробно каждый набор реагентов показан ниже.
Раствор для гибридизации
Все реактивы стерилизовали посредством фильтрации через нитроцеллюлозную мембрану с размером пор 0.2 мкм (Millipore, SLGS025 OS).
Зонды, использованные для обнаружения микроорганизмов методом FISH, представляют собой LEG705 (Eurogentec: 5'-CTGGTGTTCCTTCCGATC-3'), специфический относительно Legionellaceae и меченный красителем FITC (флуоресцеин изотиоцианат), и PNE1 (Eurogentec: 5'-CTGGTGTTCCTTCCGATC-3'), специфический относительно Legionella pneumophila и меченный Cy3.
Зонды добавляли к гибридизационному раствору до конечной концентрации 1 нг/мкл
Раствор для промывания
Все реактивы стерилизовали посредством фильтрации через нитроцеллюлозную мембрану с размером пор 0.2 мкм (Millipore, SLGS025 OS).
Пример 2
Для образца применяли протокол эксперимента из Примера 1, используя первый зонд LEG705, меченный зеленым флуоресцентным красителем, и второй зонд PNE1, меченый красным флуоресцентным красителем.
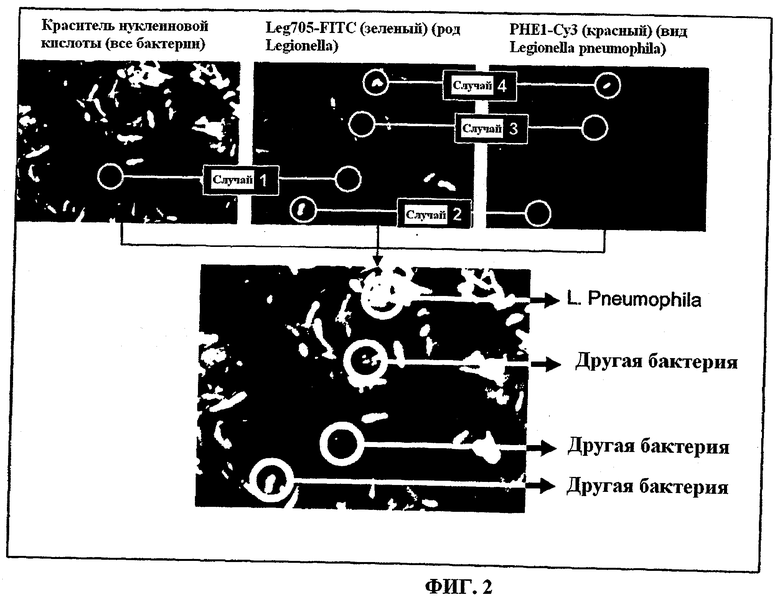
На Фиг.2 показаны четыре случая, которые позволяют различить Legionella pneumophila и естественно флуоресцирующие бактерии. Соответственно на Фиг.2 показано:
Случай 1 - Нет ни бактерий, флуоресцирующих зеленым, ни бактерий, флуоресцирующих красным - бактерия не принадлежит ни к роду Legionella, ни к виду Legionella pneumophila;
Случай 2 - Только бактерия, флуоресцирующая зеленым, - бактерия принадлежит к роду Legionella ИЛИ является естественно флуоресцирующей бактерией;
Случай 3 - Только красная бактерия - несмотря на красную флуоресценцию, бактерия не принадлежит к виду Legionella pneumophila, поскольку нет зеленой флуоресценции, и таким образом бактерия не принадлежит к роду Legionella. Эта бактерия обладает естественной красной флуоресценцией; и
Случай 4 - бактерия, флуоресцирующая и зеленым, и красным, - бактерия принадлежит к роду Legionella И виду Legionella pneumophila.
Применяя это способ, мы можем безошибочно обнаружить Legionella pneumophila, отделяя определение бактерий с естественной флуоресценцией, которые иначе показали бы неверный результат подсчета этих бактерий.
Зонд PNE1 представляет собой первый зонд, описанный Grimm et al. (Grimm et al., 1998). Специфическая последовательность представляет собой: 5'-ATCTGACCGTCCCAGGTT-3'.
Зонд Leg705 представляет собой первый зонд, описанный Manz et al. (Manz et al., 1995). Специфическая последовательность представляет собой: 5'-CTGGTGTTCCTTCCGATC-3.
В этом испытании использовали следующие три красителя:
Первый краситель использовали для окрашивания нуклеиновой кислоты во всех микроорганизмах. DAPI использовали для окрашивания бактерий в синий цвет при УФ-возбуждении. Этот краситель не связывается с олигонуклеотидным зондом.
Два вторых красителя связываются с олигонуклеотидным зондом, позволяя специфическое детектирование. Эти два красителя должны характеризоваться двумя различными спектрами возбуждение/эмиссия. В испытаниях применяются FITC и Cy3, которые представляют собой наиболее обычные красители, используемые для FISH обнаружения, но могут быть использованы и многие другие красители, соответственно, с теми же самыми спектрами.
Представленное изобретение относится к области микробиологии и касается способа обнаружения и подсчета микроорганизмов вида Legionella pneumophila и набора, содержащего необходимые составляющие для осуществления такого способа. Описанный способ включает следующие стадии: контактирование образца с источником питания для клеток, содержащий антиоксидант, представляющий собой пировиноградную кислоту или ее соль, и ингибитором клеточной пролиферации, который выбирается из ципрофлоксацина и цефалексина; контактирование указанного образца с флуоресцентно-меченными олигонуклеотидными зондами, способными специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот, принадлежащими к микроорганизмам рода и вида Legionella pneumophila; и обнаружение и количественное определение флуоресцентного сигнала. Представленные способ и набор позволяют более точно и надежно проводить обнаружение и подсчет жизнеспособных микроорганизмов вида Legionella pneumophila, исключив из подсчета естественную флуоресценцию микроорганизмов. 2 н. и 4 з.п. ф-лы, 2 ил., 6 табл., 2 пр.
1. Способ для обнаружения и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце, предположительно содержащем указанные микроорганизмы, предусматривающий:
(1) контактирование указанного образца с источником питания для клеток и ингибитором клеточной пролиферации, где источник питания для клеток содержит ростовую добавку, которая содержит антиоксидант, предпочтительно пировиноградную кислоту или ее соль,
(2) контактирование указанного образца по меньшей мере с одним флуоресцентно-меченым олигонуклеотидным зондом, способным специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот указанных микроорганизмов, где указанный образец контактирует по меньшей мере с первым зондом и вторым зондом и где первый зонд способен специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот, при этом все кислоты принадлежат роду Legionella, и где второй зонд способен специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот, при этом все кислоты принадлежат к виду Legionella pneumophila,
(3) обнаружение и количественное определение флуоресцентного сигнала, где микроорганизмы представляют собой вид Legionella pneumophila и где ингибитор клеточной пролиферации выбирается из группы, состоящей из ципрофлоксацина и цефалексина.
2. Способ по п.1, отличающийся тем, что олигонуклеотидный зонд представляет собой LP2 зонд.
3. Способ по п.1, отличающийся тем, что первый зонд представляет собой LEG705 зонд.
4. Способ по п.1, отличающийся тем, что этап (3) выполняется автоматически с применением эпифлуоресцентного микроскопа.
5. Способ по любому из пп.1-4, отличающийся тем, что образец отбирается из любой группы, выбранной из промышленных охлаждающих вод, питьевых вод и вод природного происхождения.
6. Набор для детектирования и подсчета жизнеспособных микроорганизмов вида Legionella pneumophila в образце, предположительно содержащем указанные микроорганизмы, содержащий:
(1) источник питания для клеток, содержащий ростовую добавку, которая содержит антиоксидант, предпочтительно пировиноградную кислоту или ее соль,
(2) ингибитор клеточной пролиферации,
(3) флуоресцентно-меченые олигонуклеотидные зонды, способные специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот указанных микроорганизмов, включающие первый зонд и второй зонд, где первый зонд способен специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот, при этом все кислоты принадлежат к роду Legionella, и второй зонд способен специфически гибридизироваться по меньшей мере с одним участком рибосомных нуклеиновых кислот, при этом все кислоты принадлежат к виду Legionella pneumophila,
(4) средство для обнаружения и количественного определения флуоресцентного сигнала, где ингибитор клеточной пролиферации выбирается из группы, состоящей из ципрофлоксацина и цефалексина.
| BARCINA ISABEL et al | |||
| Direct viable count of Gram-positive and Gram-negative bacteria USING ciprofloxacin as inhibitor of cellular division // Journal of Microbiological Mathods | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| GRIMM DOROTHEE et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2013-03-10—Публикация
2009-03-20—Подача