Область техники
Данное изобретение относится к области биотехнологии и, в частности, относится к микробиологии, сфера применения которого находится в области здравоохранения (медицине, ветеринарии, связанных с окружающей средой и фундаментальных исследованиях).
Это изобретение относится к способу определения целостности (интактности) ДНК в микроорганизме, при условии, что гибель клеток означает фрагментацию ДНК, и к набору для оценивания целостности (интактности) ДНК в микроорганизмах.
Уровень техники
Микробы могут погибать вследствие различных причин. В случае бактерий, которые являются организмами, представляющими особый интерес для здоровья, конечный механизм гибели вследствие действия антибиотических агентов фактически неизвестен, наиболее вероятно, вследствие очевидности этой проблемы. Антибиотики влияют на важные процессы клетки, что рано или поздно приведет к гибели этой клетки. Несмотря на знание начального механизма действия конкретного антибиотика, иногда невозможно ясно различить бактериостатическое или бактерицидное действие. Эта картина гибели клеток особенно осложняется вследствие недавнего описания присутствия малой доли стойких (персистирующих) клеток, неуязвимых для бактерицидных антибиотиков, несмотря на то, что они являются мутантными и не растут в присутствии антибиотика. Указанные стойкие (персистирующие) клетки объясняются, по-видимому, высокой устойчивостью биопленок и стационарных культур к гибели под действием химиотерапевтических агентов.
Кроме того, исследования профилей транскрипции всех генов Escherichia coli продемонстрировали существование группы генов, которые индуцируются, и других генов, которые репрессируются обычным образом после действия антибиотиков, причем механизм действия является очень различающимся. Это было подтверждено с использованием ампициллина, ингибитора синтеза клеточных стенок и с использованием офлоксацина, фторхинолона, блокирующего ДНК-гиразу и топоизомеразу IV, с индуцированном прямого повреждения в ДНК (Kaldalu N, Mei R, Lewis K. Killing by ampicillin and ofloxacin induces overlapping changes in Escherichia coli transcription profile. Antimicrob Agents Chemother 2004; 48:890-896).
Эти сведения предполагают, что гибель клеток в бактериях, например, после действия бактерицидного антибиотика может быть программированным процессом, подобным феномену апоптоза, присутствующему в высших организмах. Сходный феномен был описан в одноклеточных дрожжах в качестве реакции на действие фунгицидных агентов. Автолиз бактериальных клеток самоперевариванием клеточной стенки автолизинами после воздействия антибиотиками или неблагоприятными условиями окружающей среды может быть выражением программированной гибели клеток дефектных организмов (Lewis К. Programmed Death in Bacteria. Microbiol Mol Biol Rev 2000; 64:503-514).
Начиная с истоков микробиологии, большинство исследований химиотерапевтического действия оценивали рутинным образом оценкой роста клеток как способности продуцирования колоний в полутвердой культуральной среде или вызывания помутнения в жидкой среде. Кроме того, что эта система является относительно продолжительной, она оценивает поведение не каждой клетки, а группы в целом и применима только для микроорганизмов, способных культивироваться in vitro. Для исследования стадии жизни каждой клетки необходимо использовать микроскопические и цитометрические способы (Lecoeur H. Nuclear apoptosis detection by flow cytometry: influence of endogenous nucleases. Exp CeIl Res 2002; 277:1-14; Steensma DP, Timm M, Witzig ТЕ. Flow cytometric methods for detection and quantification of apoptosis. Methods Mol Med 2003; 85:323-332).
Возможной, хотя и не обычной, оценкой является оценка проницаемости клеточной стенки и клеточной мембраны с использованием витальных красителей. Клетка окрашивается витальным красителем, только если она имеет изменение барьера, изолирующего ее от наружной среды, что обычно связано с лизисом посредством осмотического шока. Независимо от того, является ли это изменение прямым повреждением, через ферментные системы или через потерю целостности мембраны, ДНК хромосомы микроорганизма должна фрагментироваться в процессе гибели клетки. Однако целостность (интактность) хромосомной ДНК не оценивалась в качестве параметра микробной гибели в последовательных исследованиях клетки за клеткой in situ. Это объясняется отсутствием легкого, надежного и воспроизводимого способа для определения целостности хромосомной ДНК с малым размером относительно размера клеток высших организмов.
Имеются различные хорошо установившиеся методологии in situ для оценивания целостности ДНК клеток высших организмов в отношении индуцированного повреждения и гибели клеток посредством апоптоза или некроза. Мечению ДНК-разрывов in situ введением в них меченых нуклеотидов с использованием таких ферментов, как терминальная трансфераза (TUNEL) или ДНК-полимераза (ник-трансляция in situ, ISNT), придается особое значение среди таких методологий (Didenko V, ed. In situ detection of DNA damage. Humana Press, Totowa, New Yersey, 2002).
Эти методологии основаны на применении ферментов к клеткам, фиксированным на предметных стеклах, причем эти ферменты действуют на 3'-ОН-концы этих разрывов, т.е. без химических модификаций. По указанной причине их эффективность является беспорядочной, так как метятся только разрывы, доступные для такого фермента, что означает относительно низкую воспроизводимость этих результатов. Имеется только одна работа, в которой используется способ TUNEL для детектирования разрывов ДНК в Escherichia coli и архебактерии Haloferax volcanii (Rohwer F and Azam F. Detection of DNA Damage in Prokaryotes by Terminal Deoxyribonucleotide Transferase-Mediated dUTP Nick End Labeling Appl Environ Microbiol 2000; 66:1001-1006).
Это исследование демонстрирует возможность детектирования фрагментации бактериальной ДНК после инфицирования фагом. Однако разрывы, вызываемые непосредственно пероксидом водорода, в некоторых условиях не детектировались. Это может быть обусловлено неспособностью этого фермента метить разрывы с модифицированными 3'-ОН-концами, которая является проблемой этого способа. Кроме того, для выполнения этих способов клетки должны быть фиксированы, что влияет на способность мечения. Кроме того, эти реагенты являются дорогими, следовательно, эти способы применяются только в исследовательских испытаниях, и их невозможно применять для рутинной оценки повреждения и деградации ДНК. Эти способы являются относительно продолжительными и сложными, таким образом их обычно не применяют в микробиологии, и не было описано другое исследование в отношении этих способов.
Другим микроскопическим способом для последовательного исследования целостности ДНК клетки за клеткой in situ является кометный анализ (индикации генотипического воздействия) или электрофорез отдельных клеток (Olive PL, Durand RE. Heterogeneity in DNA damage using the comet assay. Cytometry 2005; 66:1-8).
Эукариотические клетки включают в агарозный микрогель на предметном стекле и подвергают действию лизирующих растворов для экстракции мембран и белков. Таким образом получают нуклеоиды, т.е. депротеинизированные ядра, в которых петли ДНК релаксированы вследствие нарушения компактности. Эти нуклеоиды подвергают электрофорезу в резервуаре, заполненном буферным раствором, так что нити ДНК мигрируют в направлении анода, образуя изображение кометы с головой и хвостом в направлении электрофоретической миграции. Эти кометы окрашивают флуоресцентным красителем для наблюдения с использованием флуоресцентной микроскопии. Если ядро имеет фрагментацию ДНК, будет мигрировать большое количество ее фрагментов, концентрирующихся в хвосте кометы. Этот способ является вполне чувствительным, но относительно дорогим и сложным тестом для обычной клинической лаборатории. Действительно, он требует некоторых редких инструментов: источника энергоснабжения и резервуара и системы для улавливания (сбора) и анализа изображений. Ввиду вышеописанного он используется только для исследовательских целей. Имеется только одна опубликованная работа, в которой кометный способ использовали при нейтральном рН в бактерии Escherichia coli (Singh NP, Stephens RE, Singh H, Lai H. Visual quantification of DNA double-strand breaks in bacteria. Mutat Res 1999; 429:159-168).
Этот способ является продолжительным и сложным, требующим множественных инкубирований, и интерпретация этих изображений в отношении разрывов ДНК является неясной. Таким образом, не была описана ни одна другая работа с использованием этого способа в бактериях.
Из приведенного выше описания делается вывод, что все еще существует потребность в надежном способе, который может быть использован рутинным и простым образом для исследования in situ целостности хроматина/ДНК в микроорганизмах. Должна быть разработана и адаптирована некоторая методология, которая является гораздо более быстрой и более эффективной для оценки гибели бактерий с приданием особого значения гибели клеток, которая генерируется деградацией ДНК или претворяется в деградацию ДНК. Таким образом, это является областью, в которой вряд ли были обеспечены какие-либо новшества. Этот способ должен быть надежным, легким в выполнении, дешевым и доступным для базовой лаборатории. Кроме того, он должен давать однородные результаты между различными лабораториями и должен быть пригоден для автоматизации. Анализ диффузии ДНК является в некоторой степени сходным с анализом электрофореза отдельных клеток, позволяющим оценивать ее фрагментацию. Клетки, погруженные в инертный агарозный гель на предметном стекле, подвергают лизису. Если эти клетки имеют фрагментированную ДНК, эти фрагменты диффундируют в агарозный матрикс из исходного ядра, и наблюдаются широкие ореолы периферической диффузии фрагментов ДНК (Vasquez M, Tice RR. Comparative analysis of apoptosis versus necrosis using the single cell gel (SCG) assay. Environ Mol Mutagen 1997; 29:53). Этот способ применяли к эукариотическим клеткам, в основном соматического типа. Клетки, обнаруживающие диффузию фрагментов ДНК, соответствовали клеткам, которые погибали вследствие апоптотического процесса (Singh NP. A simple methodfor accurate estimation of apoptotic cells. Exp Cell Res 2000; 256:328-337).
Некоторые варианты этого анализа были успешно применены к клеткам спермы человека и клеткам спермы других видов животных этой исследовательской группой и были названы Дисперсией Хроматина Спермы (SCD-тестом), (Rodriguez S, Goyanes V, Segrelles E, Blasco M, Gosάlvez J Fernández JL. Critically short telomeres are associated with sperm DNA fragmentation. Fértil Steril 2005; 84:843-845; Enciso M, López-Fernάndez C, Fernández JL, Garcia P, Gosάlbez A, Gosάlvez J. A new method to analyze boar sperm DNA fragmentation under bright-field or fluorescence microscopy. Theriogenology 2006; 65:308-316).
Основные отличия этого варианта способа данного изобретения относительно способа, описанного для клеток спермы, являются следующими:
- Первая инкубация с раствором кислоты не является необходимой, необходимым является только лизис.
- Раствор для лизиса клеток спермы является неактивным в микроорганизмах, подобных бактериям. Тритон Х-100 является неактивным для лизиса этих микроорганизмов. Для этой цели для лизиса рекомендуется содержание более сильного детергента со способностью денатурирования белков, такого как ДСН, и добавление ЭДТА в качестве хелатообразующего (комплексообразующего) агента, способствующего дестабилизации клеточных стенок.
Технически эти отличия означают лизис бактериальной стенки, сохраняющей целостность ДНК. Этот последний момент является важным, так как, поскольку бактериальная ДНК является относительно недостаточной в отношении белков в сравнении с ДНК эукариотических клеток, она могла бы быть более чувствительной к ятрогенному повреждению, вызываемому во время манипулирования и обработки.
Использование высокочувствительных флуоресцентных красителей, таких как красители семейства SYBR, например SIBR Gold, позволяет различать нить ДНК нуклеоидов микроорганизма и, в частности, точно наблюдать малые фрагменты ДНК, диффундируемые в агарозе в случае фрагментации такой ДНК. Это невозможно с использованием классических флуорохромов ДНК, таких как пропидийиодид (PI), этидийбромид, акридиновый оранжевый Hoechst 33258 или 33342 или DAPI.
Другим дополнительным преимуществом является то, что необходимое время инкубации при лизисе является гораздо более коротким, что приводит к гораздо более быстрой методологии в сравнении с методологией, описанной в случае клеток спермы.
В данном изобретении существенной является стабилизация ДНК-нуклеоида микроорганизма для возможности наблюдения с использованием флуоресцентного микроскопа. Этот малый нуклеотид является очень хрупким, отделяющимся и прогрессирующим образом и быстро деградирующим в жидкой среде окрашивания после воздействия на него света флуоресцентного микроскопа. Это является существенной технической проблемой, которая не встречается в случае нуклеоидов клеток спермы или других типов клеток высших организмов с гораздо большей массой. В случае микроорганизмов для стабилизации нуклеоида и прочного прикрепления его к предметному стеклу проводят стадию инкубации при сухом интенсивном нагревании. Таким образом, после высушивания этого предметного стекла с нуклеоидом, перед окрашиванием, его инкубируют в микроволновой печи при высоком напряжении (750-1000 В) в течение 10 минут. Затем оно может быть окрашено и использовано для просмотра. Другой возможностью является инкубирование этого предметного стекла в термостате при высокой температуре, 80-100°С, в течение часов. Однако применение микроволновой печи в сильной степени ускоряет этот процесс, способствуя быстрому проведению этого технического протокола. Эта стадия стабилизации является важной в этом изобретении, так что этот способ имеет высокую дополнительную ценность в приготовлении коммерческого конечного продукта.
Из приведенного выше описания может быть сделан вывод, что способ данного изобретения приводит к изображениям нуклеоида микроорганизма, которые могут ясно различать нуклеоиды, содержащие фрагментированную ДНК. Таким образом, с использованием указанного способа определение уровней фрагментации ДНК пробы является простым и надежным, что делает возможным его применение рутинно и при низкой стоимости. Его применение возможно в различных клинических и базовых микробиологических лабораториях с пробами микроорганизмов.
Однако анализ с этими характеристиками никогда не применялся для определения целостности (интактности) ДНК микроорганизмов. Адаптация и приспособление этой методологии для оценивания геномов с относительно малым размером, после предварительно достигнутого лизиса бактериальных стенок для возможности диффузии ДНК в случае фрагментации этой ДНК представляли бы чрезвычайный потенциальный интерес. После этого был бы доступен относительно простой и быстрый инструмент, который мог бы позволить последовательное оценивание in situ, клетки за клеткой, присутствия разрывов ДНК в бактериях и других микроорганизмах репродуцируемым образом. Просмотр на микроскопическом уровне фрагментированной молекулы ДНК после действия литических агентов может быть использован для быстрого анализа гибели бактериальных клеток. Эти интересные и многочисленные потенциальные приложения указанной методологии в исследовательских, больничных, ветеринарных или защищающих окружающую среду применениях подробно описаны ниже:
- мониторинг агентов с потенциальной способностью прямого или опосредованного повреждения и фрагментирования ДНК, которые являются физическими (ионизирующими излучениями, ультрафиолетовыми излучениями), химическими (антисептическими, антибиотическими, химиотерапевтическими и антимикробными агентами в целом), биологическими и ферментативными (репаративными ферментами, рестрикционными ферментами, кодируемыми дополнительными модулями или фагами);
- мониторинг чувствительности как к известным, так и новым антимикробным лекарственным средствам;
- определение эффективности агентов, способных повреждать и фрагментировать ДНК, в зависимости от различных экспериментальных условий и условий окружающей среды;
- мониторинг стресса на уровне ДНК в природных популяциях микроорганизмов или в различных лабораторных условиях (нутриентов, старения, вариаций физико-химических агентов, таких как температура, рН, осмотическое давление, свет и т.д.);
- анализ чувствительности к индукции повреждения ДНК различных линий дикого типа и мутантных линий, например штаммов, устойчивых к антимикробным агентам, а также их репарации.
Сущность изобретения
Целью данного изобретения является разработка способа простой, быстрой и точной оценки целостности (интактности) ДНК микроорганизмов, который может быть включен в рутинную работу любой микробиологической исследовательской лаборатории.
Таким образом, первая цель этого изобретения состоит в обеспечении способа оценки целостности ДНК микроорганизма, предусматривающего следующие стадии:
a) иммобилизацию микроорганизма на предметном стекле, без фиксации, посредством включения его в инертную среду;
b) обработку лизисным раствором для экстракции клеточных стенок, мембран и белков с сохранением ДНК этого микроорганизма;
c) стабилизацию ДНК-нуклеоида этого микроорганизма на этом предметном стекле; и
d) окрашивание и оценивание целостности ДНК.
Микроорганизмы сначала включают в среду, подобную водной суспензии, предпочтительно в инертном микрогеле, в частности в агарозном микрогеле, который может быть приготовлен на подходящем носителе, например на стеклянном покровном стекле.
Выбор лизисного раствора является решающим для достижения целей этого изобретения. Важно использовать анионогенные или катионогенные денатурирующие белок детергенты, такие как додецилсульфат натрия (ДСН), алкилбензолсульфонат, N-лаурилсаркозин (саркозил), гидратированную соль гликолевой кислоты и их смеси, предпочтительно с использованием ДСН. Они являются детергентами, вызывающими высокую деструкцию мембран с лизисными эффектами, и одновременно они являются активными денатурирующими белок агентами. Их используют в денатурирующем электрофорезе, в котором белки подвергаются миграции, и гарантируют полную денатурацию (потерю трехмерной структуры). Их активность в детергентах является высокой. Применение неионогенного не денатурирующего белок детергента, т.е. детергента, солюбилизирующего эти белки, но не денатурирующего их, обычно не является эффективным для эффективного лизиса во многих микроорганизмах. Включение этилендиаминтетрауксусной кислоты (ЭДТА) является важным, так как она действует как хелатирующий катион Mg++ агент, причем такие катионы стабилизируют наружную мембрану бактерий, в частности, в оболочке грамотрицательных бактерий. Могут быть также включены литические белки, как клеточной стенки, так и белков.
Предпочтительно этот лизисный раствор содержит другие агенты, благоприятствующие дестабилизации клеточных стенок и последующей экстракции. Было подтверждено, что эффективным является раствор, который содержит 0,001-2 М дитиотреитол (ДТТ), 0,001-2 М 2-амино-2-(гидроксиметил)-1,3-пропандиол (Трис), 0,001-2 М ЭДТА и 0,1-3% ДСП, при рН 6,5-10,5. Особенно предпочтительным является раствор, содержащий приблизительно 0,1 М ДТТ, приблизительно 0,01 М Трис, приблизительно 0,05 М ЭДТА и приблизительно 2% ДСН, при рН приблизительно 10.
После лизиса ДНК-нуклеоиды должны быть стабилизированы на предметном стекле таким образом, что они не деградируют и не становятся отделяемыми после подвергания действию света флуоресцентного микроскопа. Наиболее быстрой и наиболее эффективной системой является инкубация этого предметного стекла, после его дегидратации, в банях с увеличивающейся концентрацией спирта и сушка в микроволновой печи. Генерируемое нагревание прочно прикрепляет этот нуклеоид к предметному стеклу. Эта стадия является важной, специфической стадией данного изобретения. Могут быть испытаны различные мощности в течение различных периодов времени. Одной возможностью является использование максимальной мощности в течение 2-15 минут. Другой возможностью, которая является менее рекомендуемой, так как она увеличивает продолжительность этого способа, является инкубирование сухого предметного стекла в печи или сушильном шкафу при высокой температуре, 40-100°С, в течение одного или нескольких часов.
Способ по данному изобретению имеет стадию оценивания целостности ДНК микроорганизмов, после стадий а), b) и с). Хотя имеются несколько альтернатив для этого оценивания, предпочтительно оно должно быть визуальным. Для этой цели этот способ предпочтительно включает в себя стадию окрашивания пробы после стадий а), b) и с). При условии относительно малого размера ДНК микроорганизмов указанное окрашивание должно проводиться с высокочувствительным красителем с использованием микроскопа с линзой высокого увеличения (обычно 100Х). Таким образом, системы на основе флуоресцентной микроскопии, использующие ДНК-специфические флуорохромы, в частности системы, обеспечивающие наилучшую чувствительность и стабильность, являются предпочтительными. Этот перечень является экстенсивным и непрерывно растет. В качестве примеров могут быть упомянуты GelRed, EvaGreen и другие производные цианина, такие как красители семейства SIBR, красители PicoGreen, варианты ТОТО, YOYO, BOBO, POPO, JOJO, LOLO, SYTOX, PO-PRO, BO-PRO, YO-PRO, TO-PRO, JO-PRO, PO-PRO, LO-PRO и т.д.
Оценивание этих результатов может проводиться наблюдателем, относящим каждый наблюдаемый нуклеоид к предварительно установленной шкале повреждений. Может быть также предпочтительным оценивание с использованием системы для сбора данных цифровых изображений, сопряженная с программным обеспечением (программой), количественно определяющим уровень повреждения.
Второй целью данного изобретения является изготовление набора для оценивания целостности ДНК микроорганизмов, в основном содержащей:
a) предобработанные стеклянные предметные стекла для удерживания и сохранения микрогеля с микроорганизмами;
b) раствор для смешивания и включения этих микроорганизмов в микрогели;
c) лизисный раствор для экстракции стенок, мембран и белков и
d) флоурохром для окрашивания ДНК.
Этот набор позволяет проводить описанный выше способ.
Третьей целью данного изобретения является разработка программного обеспечения (программы) для автоматизированного измерения уровней фрагментации ДНК микроорганизма.
Описание чертежей
Фигура 1 показывает нуклеоиды из культуры клеток Escherichia coli, полученные после применения способа, описанного в этом изобретении. Интактные нуклеоиды являются компактными, выравненными на предметном стекле, причем непрерывность растворов, предполагающая фрагментацию ДНК, не наблюдается. Нуклеоид с массивно фрагментированной ДНК (выше) из спонтанно мертвых клеток наблюдается иногда в этой культуре.
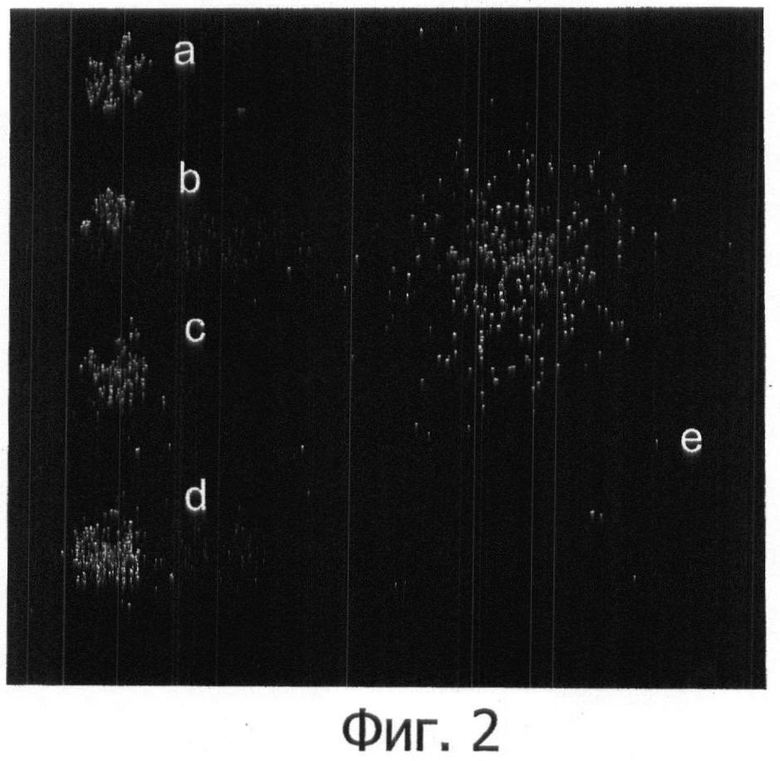
Фигура 2 показывает различные прогрессирующие степени повреждения ДНК Escherichia coli: а: интактный нуклеоид (уровень 0).
b) Нуклеоид с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК (уровень 1, низкая степень повреждения).
c): Более релаксированный нуклеоид, занимающий большую поверхность, с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК (уровень 2, среднее повреждение).
d: Гораздо более релаксированный и обширный нуклеоид, с большим количеством периферических фрагментов, после разрывов ДНК (уровень 3, высокая степень повреждения).
е: Нуклеоид с массивной фрагментацией ДНК, образованный многочисленными малыми фрагментами, которые диффундировали в агарозный матрикс, после лизиса, определяя более широкую поверхность диффузии (уровень 4, массивное повреждение).
Фигура 3 показывает способ DBD-FISH для детектирования разрывов ДНК, гибридизации зонда тотальной геномной ДНК Escherichia coli, меченого Су3 (А). Этот нуклеоид с диффузией фрагментов имеет интенсивное мечение, в то время как остальные нуклеоиды обнаруживают только очень дискретное фоновое мечение. Эту ДНК окрашивали контрастно при помощи DAPI (В).
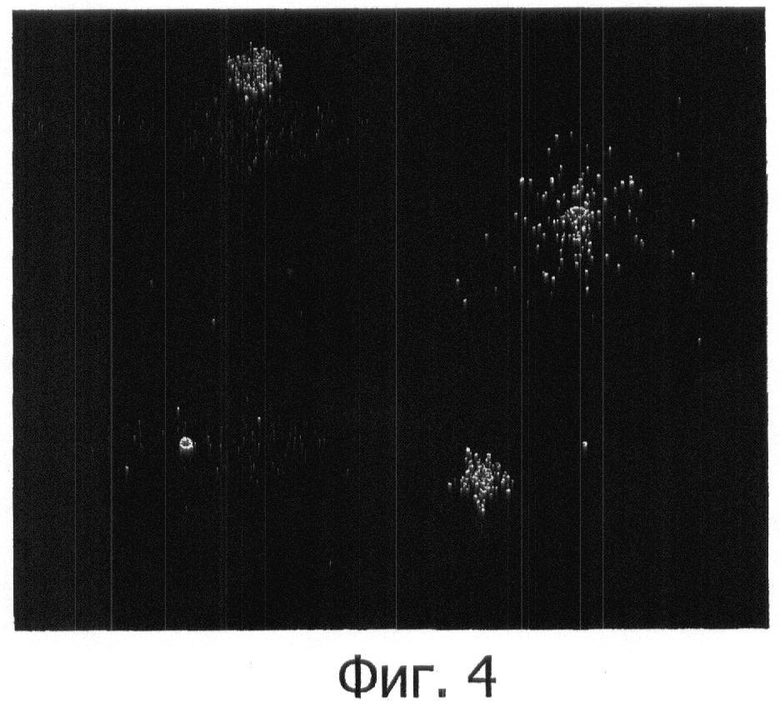
Фигура 4 показывает применение способа этого изобретения к пробе Acinebacter baumannii. Показаны два интактных нуклеоида с ДНК, разрушенной во фрагменты.
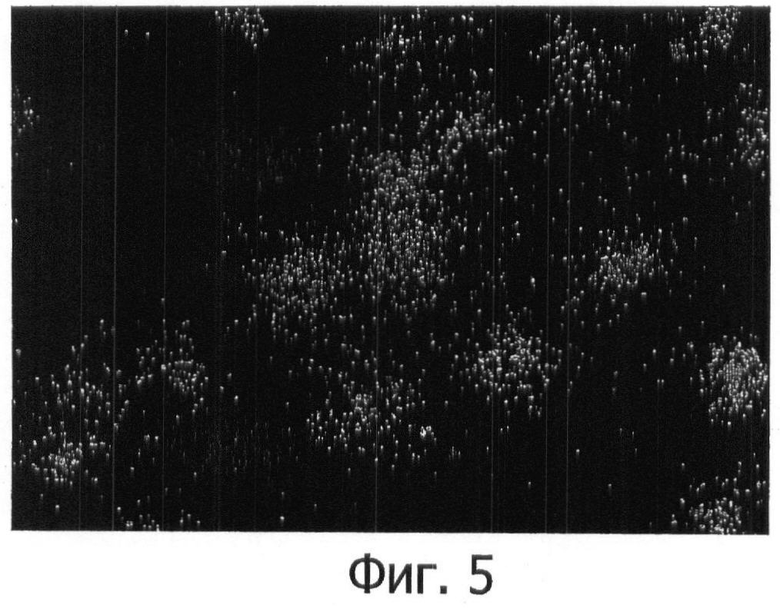
Фигура 5 показывает массивную фрагментацию ДНК Escherichia coli после подвергания этих бактерий действию 10 мМ пероксида водорода в течение 10 минут.
Фигура 6 показывает повреждение ДНК Escherichia coli, наблюдаемое после различных периодов инкубации с ципрофлоксацином (1 мкг/мл). а: 0 минут, b: 2,5 минуты, с: 5 минут, d: 15 минут, е: 40 минут. Начальный уровень повреждения наблюдается уже после 5 минут, увеличиваясь прогрессирующим образом с более продолжительными периодами инкубации.
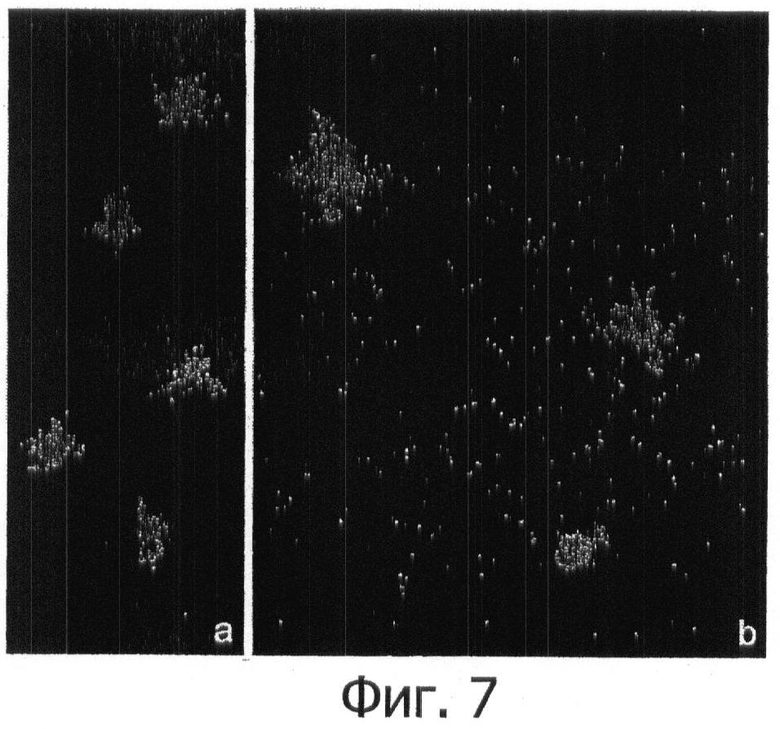
Фигура 7. Нуклеоиды Escherichia coli, наблюдаемые после инкубирования с ампициллином (300 мкг/мл) в течение 20 минут (а) и после 24 часов (b). Фрагменты ДНК не наблюдаются после 20 минут, тогда как после 24 часов фон покрыт фрагментами ДНК.
Фигура 8 показывает графики, изображающие среднее развитие площади (в пикселах, y-ось) ореола диффузии фрагмента или релаксацию петли нуклеоида Escherichia coli (А) и капсулы (В), относительно времени после инкубации с 10 микрограммами на мл ципрофлоксацина, 40 минут (х-ось).
Фигура 9 показывает диаграмму рутины, которой следует придерживаться для постепенного измерения и процесса принятия решения в отношении фрагментации бактериальной ДНК с генерированием конечного сообщения.
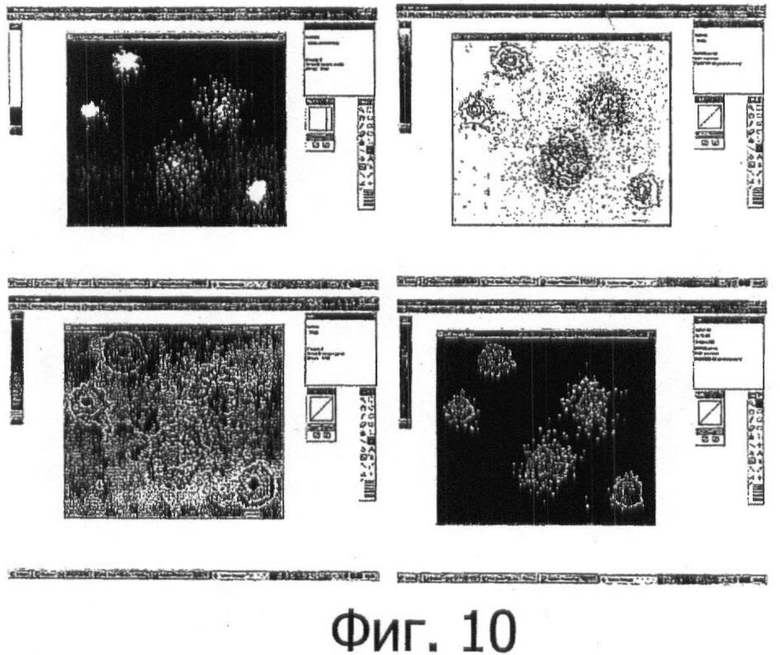
Фигура 10 показывает пробу трех процессов для сегментирования и определения границ ROI, проводимых с использованием цифрового сбора данных, показывающих бактериальную область, включающую в себя 3 бактерии с нормальной ДНК и 2 бактерии с фрагментированной ДНК (верхнее левое изображение). Остальные изображения соответствуют электронным фильтрам исходного изображения, которые могут быть полезны в качестве стратегии, которая должна проводиться для более легкого различения обоих типов клеток.
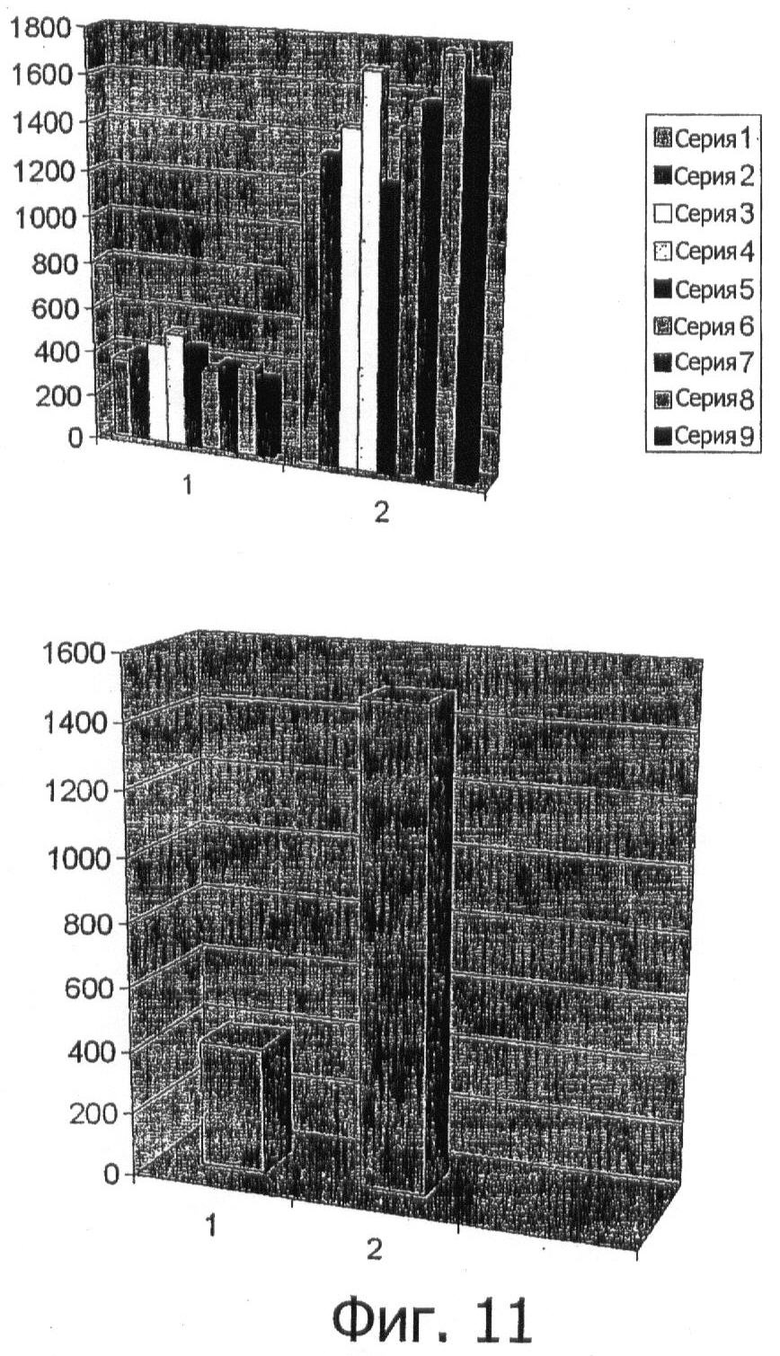
Фигура 11 показывает среднюю интегрированную плотность в 9 разных экспериментальных сериях, в которых выбирали бактерии с нефрагментированной ДНК (1) и бактерии с фрагментированной ДНК (2). Верхняя часть этой фигуры показывает средние величины на эксперимент, в то время как нижняя часть показывает общее среднее на группу в соответствии с нефрагментированной ДНК (1) против фрагментированной ДНК (2) в качестве критерия.
Сведения, подтверждающие возможность осуществления изобретения
Как будет подробно описано ниже, способ и набор данного изобретения являются простой и надежной системой для определения частоты встречаемости микроорганизмов с фрагментированной ДНК.
Способ этого изобретения, который позволяет оценивать целостность (интактность) ДНК микроорганизма, предусматривает стадии:
a) иммобилизации микроорганизма на предметном стекле, без фиксации, посредством заключения его в инертную среду;
b) обработки лизисным раствором для экстракции клеточных стенок, мембран и белков;
c) стабилизации ДНК нуклеоида на предметном стекле и
d) окрашивания и оценивания целостности ДНК.
Способ этого изобретения вместе с некоторыми вариантами и необязательными стадиями подробно описан ниже. Квалифицированному в данной области специалисту будет понятно, что имеются другие варианты осуществления и возможности, при условии сохранения этих описанных важных аспектов.
А) Первой стадией является приготовление пробы. Посредством обычных в данной области способов получают и подтверждают определенную концентрацию микроорганизмов в жидкой пробе. Подходящая концентрация для этого анализа находится в диапазоне 0,1-20 миллионов микроорганизмов на миллилитр. Если эта проба является избыточно концентрированной, ее доводят до этой подходящей концентрации разведением ее культуральной средой или забуференным фосфатом солевым раствором (ЗФР) или т.п., подходящим в соответствии с этим микроорганизмом.
Эту обработку рекомендуется проводить в условиях низкой яркости света для предотвращения фотоиндуцируемого повреждения ДНК во время манипулирования и инкубации. Проба должна быть помещена на носитель для ее обработки в соответствии со способом этого изобретения и облегчения ее оценивания. Этим носителем является предпочтительно стеклянное предметное стекло, которое покрыто стандартной агарозной пленкой. Для этой цели готовят стандартный агарозный раствор 0,2-1% в дистиллированной воде в сосуде Коплина или подобном сосуде. Его покрывают перфорированной пластиковой пластиной и помещают в микроволновую печь. Микроволновую печь доводят до мощности 300-1000 В, предпочтительно 500 В, перемешивая этот контейнер время от времени для лучшего растворения агарозы. Этот способ может также проводиться с использованием термостатической бани. Когда этот раствор агарозы становится полностью прозрачным, он может быть легко помещен в вертикальные сосуды с содержанием 10-250 мл. Эти сосуды должны быть предварительно отрегулированы в бане при 60-100°С, предпочтительно при 70°С, для поддержания раствора агарозы в жидком состоянии.
Предметные стекла должны быть чистыми. Их погружают вертикально, удерживая их пинцетом в зоне дна 1-60 секунд, вынимая их и погружая опять один-десять раз, пока не образуется гомогенная пленка на предметном стекле. Их помещают горизонтально на ровную и холодную поверхность при 1-15°С, предпочтительно при 4°С, изготовленную, например, из стекла или металла. Эту пластину с предметными стеклами вводят в холодильник при 4°С по меньшей мере на 30 минут, пока не будет подтверждено, что раствор агарозы желатинировался на поверхности предметного стекла. Эти лотки удаляют из холодильника и поверхность этих предметных стекол, которая находилась в контакте с этой пластиной, очищают промакательной бумагой. Затем эти предметные стекла вводят горизонтально в сушильный шкаф при диапазоне температур 37-100°С и выдерживают, пока агароза не высохнет полностью и не образует тонкую пленку, прикрепленную к стеклу. Обработанные таким образом предметные стекла могут быть использованы немедленно или могут храниться в хорошо закрытом боксе при комнатной температуре в течение нескольких месяцев.
Для облегчения обработки пробы, содержащей микроорганизмы, ее вводят в среду с признаками, сходными с признаками суспензии, такую как, например, агарозный микрогель. В этом случае раствор агарозы с низкой точкой плавления/низкой точкой желатинирования при концентрации 0,5-2% в дистиллированной воде или забуференном фосфатом солевом растворе (ЗФР). Эту агарозу расплавляют с использованием микроволновой печи или термостатируемой бани и затем поддерживают между 30°С и 37°С в пробирке, введенной в термостатированную баню или сушильный шкаф. В пробирке Эппендорфа или подобной пробирке эту пробу и раствор агарозы осторожно смешивают, так что последний находится при концентрации 0,3-1%; например, 70 микролитров раствора агарозы +30 микролитров этой пробы. Важно, чтобы температура агарозы не была выше 37°С, чтобы микроорганизмы не повреждались.
Наконец, для получения пробы на носителе покрытые предметные стекла помещают на ровной и холодной стеклянной или металлической поверхности с температурой в диапазоне 1-15°С, предотвращающей образование воздушных пузырьков. Рекомендуется помещение микропипеткой капли 5-200 микролитров этой смеси с помещением покровного стекла на верхнюю часть этой капли. В качестве меры предосторожности рекомендуется обработка каждой пробы в двух повторностях и рекомендуется использование контрольной пробы каждый раз при применении этого способа. Пластину с предметными стеклами вводят в холодильник при 4°С на 2-30 минут, пока не произойдет подходящее желатинирование агарозы. После того как произошло желатинирование, покровные стекла осторожно удаляют внутри холодильника, предотвращая повреждение этого микрогеля.
В) После того как эти пробы были подходящим образом приготовлены для их легкого и повторяемого манипулирования, их обрабатывают в соответствии со способом этого изобретения при помощи лизисной стадии обработки для экстракции стенок, мембран и белков. Для этой цели каждое предметное стекло погружают в вертикальном положении в сосуд, содержащий лизирующий раствор.
В предпочтительном варианте осуществления этот раствор образован: 0,001-2 М, предпочтительно 0,01-0,8 М, дитиотреитолом (ДТТ); 0,001-2 М, предпочтительно 0,005-0,4 М, 2-амино-2-(гидроксиметил)-1,3-пропандиолом (Трис); 0,001-2 М, предпочтительно 0,01-1 М, этилендиаминтетрауксусной кислотой (ЭДТА) и 0,1-3%, предпочтительно 0,5-2,5% додецилсульфатом натрия (ДСН). Этот раствор доводят до рН 6,5-10,5, предпочтительно 10, с доведением при помощи, например, NaOH.
Имеются другие альтернативные лизисные растворы с другими дополнительными добавками, или концентрации и периоды инкубации и температуры описанного раствора могут варьироваться при условии сохранения его основных функциональных признаков. Так, в качестве альтернатив ДТТ имеются соединения, такие как бета-меркаптоэтанол и другие восстанавливающие агенты. В качестве альтернативы Трису могут быть использованы другие буферные растворы, такие как HEPES, Mops, Pipes. В качестве альтернативы ЭДТА могут быть использованы другие хелатообразующие агенты, такие как ЭГТА и т.д. В качестве альтернативы ДСН могут быть использованы катионогенные или анионогенные детергенты, как упоминалось выше.
В соответствии с используемыми раствором и типом пробы эти препараты инкубируют в лизисном растворе 1-120 минут, предпочтительно 1-35 минут, особенно предпочтительным является период времени приблизительно 5 минут; и при температуре 1-45°С, предпочтительно 18-40°С, особенно предпочтительной является температура 37°С.
После обработки лизисным раствором эти препараты могут быть промыты для удаления остатков этих растворов. Для этой цели предметные стекла вводят горизонтально в промывной раствор, который является как можно более мягким, свободным от хелатообразующих агентов или детергентов. Например, они могут быть погружены в вертикальном положении в сосуд, содержащий избыточное количество дистиллированной воды, или буферного раствора, или физиологического солевого раствора, на период времени 1 минута-60 минут.
Затем эту пробу дегидратируют. Для этой цели могут быть использованы увеличивающиеся концентрации спирта. Например, предметные стекла снимают и погружают в горизонтальном положении в сосуды с серией увеличивающихся концентраций этанола, между 5 и 100%, на 30 секунд - 60 минут в каждом случае, и затем препаратам дают высыхать на воздухе. Температура спиртов может находиться в диапазоне -20°С - комнатная температура. Может быть предпочтительным использование спиртов при -20°С для улучшения осаждения ДНК в течение 5 минут в каждом случае. В качестве альтернативы этим инкубациям в серии этанола эти препараты могут быть дегидратированы инкубированием в растворах разных спиртов, например метанола, или с использованием сушки на воздухе или сушки в сушильном шкафу. Важно, что это предметное стекло должно быть сухим, так чтобы ДНК прикреплялась к нему, поскольку она обычно становится отделенной после подвергания действию луча света флуоресцентного микроскопа. Для этой цели рекомендуется оставлять его высыхать при высокой температуре в течение продолжительного действия. Например, рекомендуется инкубировать его при 80°С в течение по меньшей мере 60 минут.
После их полного высыхания эти уже обработанные предметные стекла, содержащие пробу, могут храниться в расфасовочных боксах при комнатной температуре, в темноте, в течение месяцев. Это облегчает разделение процесса обработки в соответствии с этим изобретением и последующей стадии оценивания целостности ДНК микроорганизмов. Эта расфасовка позволяет повторяемое оценивание при разных интервалах нескольких проб одного и того же микроорганизма.
С) После сушки решающими являются стабилизация и прочное прикрепление ДНК-нуклеоида к предметному стеклу, так как обычно он становится отделенным после подвергания воздействию луча света флуоресцентного микроскопа. Для этой цели сухие предметные стекла инкубируют в микроволновой печи при мощности 300-1000 В, предпочтительно при 500 В, в течение 5-10 минут. Альтернативно, хотя и менее рекомендуемо вследствие его продолжительности, является инкубирование этих предметных стекол в печи или сушильном шкафу при высокой температуре в течение одного или нескольких часов. После полного высыхания эти уже обработанные предметные стекла, содержащие пробу, могут храниться в расфасовочных боксах при комнатной температуре, в темноте, в течение месяцев. Это облегчает разделение процесса обработки в соответствии с этим изобретением и последующей стадии оценивания целостности ДНК микроорганизмов. Эта расфасовка позволяет повторяемое оценивание при разных интервалах нескольких проб одного и того же микроорганизма.
D. После обработки этих проб в соответствии с описанным процессом проводят стадию окрашивания и оценивания. Имеются несколько возможных процессов для оценивания целостности ДНК микроорганизмов, как указывалось ранее.
В предпочтительном варианте осуществления пробу окрашивают, облегчая визуальное оценивание. Посредством подходящего выбора условий окрашивания могут быть получены высокое качество изображений и высокая согласованность результатов оценки. При относительно малом размере генома этих микроорганизмов для наблюдения ДНК выбрана флуоресцентная микроскопия вследствие ее более высокой чувствительности.
Окрашивание для наблюдения под флуоресцентным микроскопом
В зависимости от доступности флуоресцентных фильтров эти пробы могут быть окрашены флуорохромами типа DAPI, Hoechst 33258, этидийбромида, пропидийбромида и т.д. Однако предпочтительными являются флуорохромы с более высокой чувствительностью, такие как GelRed, EvaGreen и другие производные цианина, такие как красители семейства SIBR, красители PicoGreen, варианты ТОТО, YOYO, ВОВО, РОРО, JOJO, LOLO, SYTOX, PO-PRO, BO-PRO, YO-PRO, TO-PRO, JO-PRO, PO-PRO, LO-PRO и т.д. Количество и качество флуорохромов в настоящее время увеличивается. Для предотвращения потери флуоресценции может быть включена среда против затухания (например, Vectashield-Vector H-1000, DABCO и т.д. Однако эти среды обычно вызывают диффузную флуоресценцию и прозрачный фон, затрудняя контрастирование изображения. Предпочтительно использовать высокочувствительный и относительно фотостабильный флуорохром, заключенный в водный забуференный раствор, и оценивать пробу относительно быстро, до ее высыхания. Если необходимо, предметное стекло может быть промыто и снова окрашено.
Наконец, оценивают целостность ДНК микроорганизмов.
Полученные изображения могут быть исследованы посредством прямого визуального анализа или предпочтительно с использованием программного обеспечения (программы) для анализа оцифрованных изображений, полученных с использованием аналоговых или цифровых камер (фотоаппаратов), сопряженных с платформами (площадками столиков) микроскопов (Пример 9).
Первоначально рекомендуется исследование по меньшей мере 500-1000 микроорганизмов на пробу с использованием следующей шкалы повреждений ДНК (фигура 2):
1. Уровень 0: Микроорганизмы без фрагментированной ДНК: ДНК-нуклеоид сохраняется относительно компактным, без продолжения решений.
2. Уровень 1: Микроорганизмы с низкой степенью повреждения ДНК: нуклеоид кажется компактным, но с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК.
3. Уровень 2: Микроорганизмы со средней степенью повреждения ДНК: нуклеоид является более релаксированным, занимающим большую поверхность, с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК.
4. Уровень 3: Микроорганизмы с высокой степенью повреждения ДНК: нуклеоид является гораздо более релаксированным и обширным, с большим количеством отдельных периферических фрагментов, после разрывов ДНК.
5. Уровень 4: Микроорганизмы с массивно фрагментированной ДНК: они обнаруживают широкий и диффузный ореол более или менее точкообразных фрагментов ДНК, которые диффундировали в соответствии с градиентом в агарозном матриксе.
Критерий для установления корреляции между размером ореолов вследствие диффузии фрагментов и фрагментацией ДНК получают из результатов, полученных с использованием способа DBD-FISH (Femandez JL, Goyanes VJ, Ramiro-Diaz J, Gosalvez J. Application of FISH for in situ detection and quantification of DNA breakage. Cytogenet Cell Genet 1998; 82:251-256; Fernandez JL, Vazquez-Gundin F, Delgado A, Goyanes VJ, Ramiro-Diaz J, de la Torre J Gosalvez J. DNA breakage detection-FISH (DBD-FISH) in human spermatozoa: technical variants evidence different structural features. Mutat Res 2000; 453:77-82; Fernandez JL, Gosalvez J. Application of FISH to detect DNA damage: DNA Breakage Detection-FISH (DBD-FISH). Methods Mol Biol 2002; 203:203-216; Fernandez JL, Goyanes V, Gosalvez J. DNA Breakage Detection-FISH (DBD-FISH). In: Rautenstrauss B, Liehr T, eds. FISH technology-Springer lab manual. Heidelberg: Springer-Verlag; 2002; 282-290).
Этот способ позволяет детектировать и количественно определять разрывы ДНК в депротеинизированных клеточных ядрах, подвергнутых регулируемой денатурации ДНК. Эта денатурация генерирует одноцепочечные участки ДНК из концов разрывов, которые детектируются с использованием гибридизации in situ с использованием зонда общей геномной ДНК, меченного флуорохромом, видимым с использованием флуоресцентного микроскопа. Чем больше уровень разрывов в ДНК клетки, тем больше количество одноцепочечной ДНК, генерируемой денатурирующим раствором, тем больше количество гибридизованного зонда и тем больше наблюдаемая флуоресценция. Пробы, обработанные в соответствии с методологией, описанной в данном изобретении, подвергали после лизиса действию щелочного денатурирующего раствора в течение 2,5 минут при 22°С. Этот раствор генерирует одноцепочечные участки ДНК из концов разрывов, существующих в этой ДНК. Таким образом, интенсивность гибридизации с использованием зонда общей геномной ДНК будет связана с количеством разрывов, присутствующих в этой бактериальной ДНК. Таким образом, было подтверждено, что релаксированные нуклеоиды с фрагментами обнаруживают интенсивное мечение с использованием DVD-FISH, которое демонстрирует интенсивную фрагментацию их ДНК (пример 1 и фигура 3). Остальные нуклеоиды обнаруживают очень низкие уровни мечения с этим зондом, соответствующие фону гибридизации, генерируемому фактической обработкой нуклеоида.
Описанный протокол является эффективным в большинстве грамотрицательных бактерий. В указанных бактериях этот лизисный раствор является достаточным для лизиса клеточной стенки и наблюдения диффузии всей бактериальной хромосомы и фрагментов ДНК в случае фрагментации такой ДНК. Для анализа бактерий с устойчивой стенкой, таких как грамположительные бактерии, необходимо инкубировать их в суспензии с литическими ферментами клеточной стенки перед заключением в микрогель. Например, стафилококки должны быть ресуспендированы с лизостафином (20 микрограмм/мл) в Трис-ЭДТА (ТЭ)-буфере. Энтерококки должны быть инкубированы со смесью лизоцима (2 мг/мл) и мутанолизина (50 микрограмм/мл) в Трис-ЭДТА (ТЭ)-буфере. Дрожжевые клетки инкубируют в буфере, содержащем 1 М сорбит, 0,1 М ЭДТА, 15 мМ бета-меркаптоэтанол, рН 7,5 и Зимолазу (200 Е/мл), Литиказу или Глюколазу (Ligozzi М, Fontana R. Isolation of total DNA from bacteria and yeast. Air J Biotech 2003; 2: 251-253).
Эти инкубации должны проводиться в течение по меньшей мере 5-30 минут при 37°С, и раствор микроорганизма должен быть смешан с агарозой с низкой точкой плавления для включения в микрогель. Имеются другие ферменты, которые не являются обычными в настоящее время, но могут быть эффективными для лизиса грамположительных бактерий, такие как ахромопептидаза и особенно лабиаза (Niwa Т, Kawamura Y, Katagiri Y, Ezaki T. Lytic enzyme, labiase for a broad range of Gram-positive bacteria and its application to analyze functional DNA/RNA. J. Microbiol Methods 2005; 61:251-260).
Другой возможностью является инкубация с лизоцимом (5 мг/мл) и 24% полиэтиленгликолем 20000 в течение 2 часов при 37°С (Maassen CBM. A rapid and safe plasmid isolation method or efficient engineering of recombinant lactobacilli expressing immunogenic or tolerogenic epitopes for oral administration. J Immunol Method 1999; 223: 131-136). Лизис геля может быть щелочным. Применение органических растворителей (ацетона, бутанола, толуола и т.д.) может также способствовать разрыванию бактериальной стенки Harrison STL. Bacterial cell disruption: a key unit operation in the recovery of intracellular products. Biotech Adv 1991; 9:217-240). Применение механических систем для разрывания клеточной стенки обработкой ультразвуком или перемешиванием с разрывающими частицами не рекомендуется, так как они могут повреждать ДНК микроорганизма.
Данное изобретение рассматривает набор для оценивания фрагментации ДНК в микроорганизмах. Этот набор содержит носитель, предварительно обработанный, например, агарозой, а также раствор для приготовления среды с признаками, сходными с признаками суспензии, которая будет содержать пробу, например раствор агарозы с низкой точкой плавления, который позволяет приготовить микрогель.
Содержимое и способ применения набора в соответствии с одним вариантом этого изобретения подробно описаны ниже.
Описание содержимого этого набора
Предобработанные предметные стекла*
Пробирки Эппендорфа, содержащие 140 микролитров 1% агарозы с низкой точкой плавления в дистиллированной воде или ЗФР, желатинированные
Пробирки с лизисным раствором*. Состав: 0,01 М Трис, 0,05 М ЭДТА, 0,1 М ДТТ, 2% ДСН, рН 10 (доведенный с использованием NaOH).
Флуорохром
Сосуд с крышкой для горизонтальной инкубации с лизисным раствором
Ланцет
Поплавки для пробирок Эппендорфа
* Приготовленные, как упомянуто в описании
Требуемые материал и оборудование
Флуоресцентный микроскоп (рекомендованы иммерсионные линзы)
Холодильник при 4°С
Сушильный шкаф при 37°С
Сушильный шкаф или пластина при 80°С (необязательные)
Инкубационная баня при 37°С
Пластиковые перчатки
Стеклянное покровное стекло (18×18 мм или 24×60 мм)
Микропипетки
4 бокса для горизонтальных инкубации
Дистиллированная вода
70%, 90%, 100% этанол
Инструкции для применения
Приготовление пробы на одно предметное стекло:
1) Поместите лизисный раствор в закрытом сосуде для горизонтальной инкубации в сушильный шкаф при 37°С.
2) Разбавьте пробу микроорганизма в культуральной среде или ЗФР при концентрации 5-10 миллионов на миллилитр.
Приготовление агарозного микрогеля
3) Введите пробирку Эппендорфа с желатинированной агарозой в поплавок, оставляя ее на уровне крышки, и оставьте ее плавать в течение 5 минут в воде при 90-100°С, пока агароза не расплавится. Альтернативно, агароза может быть расплавлена в микроволновой печи.
4) Перенесите эту пробирку Эппендорфа с поплавка в термостатическую баню при 37°С и оставьте на 5 минут, пока не уравновесится температура.
7) Добавьте 60 микролитров пробы микроорганизма к содержимому пробирки Эппендорфа и ресуспендируйте с использованием микропипетки.
8) Поместите предобработанное предметное стекло на холодную поверхность при 4°С (например, металлическую или стеклянную пластину).
9) После охлаждения предметного стекла нанесите суспензию микроорганизма с агарозой и поместите стеклянное покровное стекло, предотвращающее образование воздушных пузырьков. Нанесение капли 12, 20 или 50 микролитров рекомендуется для покровного стекла 18×18 мм, 22×22 мм или 24×60 мм соответственно.
10) Введите эту холодную пластину с предметным стеклом в холодильник и дайте пробе желатинироваться в течение 5 минут.
Обработка проб
11) С использованием перчаток снимите покровное стекло мягким скольжением и немедленно введите это предметное стекло горизонтально в сосуд с лизисным раствором с покрыванием его и оставлением для инкубации в течение 5 минут в сушильном шкафу или бане при 37°С.
12) Выньте предметное стекло при помощи ланцета с использованием перчаток. Удерживайте его горизонтально и поместите его горизонтально в бокс, содержащий избыточную дистиллированную воду или буферный раствор для промывки от лизисного раствора. Инкубируйте в течение 5 минут.
13) Введите предметное стекло горизонтально в бокс с 70% этанолом (5 минут), затем в другой бокс с 90% этанолом (5 минут) и наконец в 10% этанол (5 минут), -20°С.
14) Дайте высохнуть на воздухе и инкубируйте в микроволновой печи при 500-1000 В в течение 3-10 минут или, по умолчанию, в сушильном шкафу при 80°С в течение по меньшей мере одного часа или в течение ночи. После высушивания эти обработанные предметные стекла могут храниться в расфасовочных боксах при комнатной температуре, в темноте, в течение месяцев.
Окрашивание проб для наблюдения под флуоресцентным микроскопом
В зависимости от доступности флуоресцентных фильтров пробы могут быть окрашены ДНК-специфическими флуорохромами типа EvaGreen (зеленый) или GelRed (красный). Флуорохромы семейства SYBR, в частности SYBR Gold, делают возможным хорошее разрешение с определенной фотостабильностью.
Хранение и стабильность
Храните при комнатной температуре.
Период хранения: эти реагенты и материалы стабильны в течение периода по меньшей мере 6 месяцев. Рекомендуется поддерживать лизисный раствор в вертикальном положении и хорошо закрытым. Примеры, представленные ниже, описаны в качестве подкрепления конкретных аспектов этого изобретения, и они ни в коем случае не ограничивают объем этого изобретения.
Пример 1: Подтверждение присутствия разрывов ДНК в нуклеоидах, обнаруживающих диффузию фрагментов
Описанную методологию применяли к пробе штамма Escherichia coli TG1 в фазе экспоненциального роста в LB-среде при 37°С для спонтанного получения ореолов диффузии ДНК-сегментов в пробах с фрагментированной ДНК. Для этой цели пробу, разбавленную до концентрации 10-20 миллионов на миллилитр в ЗФР или LB-среде, смешивали с 1% жидкой агарозой с низкой точкой плавления для получения конечной концентрации агарозы 0,7%. После желатинирования микрогеля на предметном стекле эту пробу инкубировали в лизисном растворе, образованном из 0,01 М Триса, 0,05 М ЭДТА, 0,1 М ДТТ, 2% ДСН, рН 10 (доведенном NaOH), в течение 5 минут при 37°С. Эти предметные стекла промывали в физиологическом солевом растворе в течение 5 минут. Затем выполняли последовательно DBD-FISH (DNA Breakage Detection-Fluorescence In Situ Hybridization; Fernandez et al., 1998; 2000; 2002; Fernandez and Gosalvez, 2002) на фактических клетках с использованием зонда общей геномной ДНК Escherichia coli. Этот способ позволяет детектировать и определять количественно разрывы ДНК в ядрах клеток, погруженных в агарозные микрогели, которые депротеинизируют и подвергают регулируемой денатурации ДНК. Эта денатурация генерирует одноцепочечные участки ДНК из концов разрывов, которые детектируются при помощи гибридизации in situ с использованием зонда общей геномной ДНК Escherichia coli, меченного флуорохромом, испускающим красную флуоресценцию (Су3). Чем больше уровень разрывов в ДНК, тем больше количество одноцепочечной ДНК, генерируемой денатурирующим раствором, тем больше количество гибридизованного зонда и тем больше полученная флуоресценция. Согласно способу данного изобретения эти обработанные пробы содержат одноцепочечную ДНК, генерированную денатурирующим раствором из концов возможных разрывов, существующих в этой ДНК. Таким образом, интенсивность гибридизации с использованием зонда общей геномной ДНК будет связана с количеством разрывов, присутствующих в нуклеоиде Escherichia coli.
Считали 250 случайным образом полученных клеток. Изображения окрашивания DAPI ореолов дисперсии хроматина собирали (улавливали) с использованием охлажденной камеры (фотоаппарата) CCD, использующей два фильтра для одновременного наблюдения ореолов дисперсии, видимых в голубом, и сигнала гибридизации, видимого в красном. Целью было подтверждение того, что нуклеоиды с диффузией фрагментов ДНК имеют разрывы этой ДНК. Результаты продемонстрировали, что нуклеоиды с диффузией фрагментов ДНК имеют высокую интенсивность мечения разрывов ДНК с использованием DVD-FISH (фигура 3).
Таким образом, это простое определение диффузии фрагментов ДНК, получаемых при помощи данного способа, предоставляет простое и прямое оценивание фрагментации ДНК.
Пример 2: Оценивание спонтанной фрагментации ДНК и разных бактериальных видах
Брали девять бактериальных видов, растущих в чашке, и определяли частоту встречаемости бактерий с фрагментацией ДНК в указанных пробах. Обрабатывали следующие бактериальные виды: Escherichia coli, Enterobacter cloacae, Pseudomonas aeruginosa, Proteus mirabilis. Salmonella spp., Stenotrophomonas maltophilia, Acinetobacter baumannii, Klebsiella oxytoca, Klebsiella pneumoniae.
Каждую пробу инкубировали в агарозном микрогеле, с тремя микрогелями 18×18 мм, перенесенными из каждого предметного стекла, причем каждый из них соответствовал отличающемуся виду. Один из микрогелей каждого предметного стекла соответствовал той же самой культуре Escherichia coli в качестве контроля результата и обработки. Эти предметные стекла инкубировали в лизисном растворе, промывали, дегидратировали и давали им высыхать при 80°С в течение 3 часов, окрашивали SIBR Gold и обследовали с использованием флуоресцентного микроскопа. Считали одну тысячу клеток на бактериальный вид. Эти результаты показаны в таблице 1. Лизис был эффективен для получения нуклеоидов во всех анализированных видах (фигура 4). Клетки с нуклеоидами, ДНК которых была массивно фрагментирована (уровень 4) и диффундировала в агарозный матрикс, также наблюдали во всех этих видах. Эта фрагментация происходила спонтанным, базовым образом в культуре и не была индуцирована каким-либо агентом, причем ее частота варьировала от одной культуры к другой.
Пример 3: Оценивание фрагментации ДНК после инкубации с различными антимикробными агентами. Повреждение, обусловленное экзогенными агентами.
В качестве иллюстративного примера представлено исследование с попыткой определения возможного повреждения ДНК, индуцированного тремя антибиотиками: ампициллином, гентамицином и ципрофлоксацином, и генерирующим гидроксильный радикал агентом, пероксидом водорода (H2O2), примененными к культурам штамма Escherichia coli TG1, который является чувствительным ко всем из них, растущим в экспоненциальной фазе в LB-среде. Использованные агенты имеют различные механизмы антимикробного действия. Ампициллин является бета-лактамным антибиотиком, действующим на синтез пептидоглюканов клеточной стенки после связывания с РВР (пенициллинсвязывающими белками) и активирующим автолизины. Гентамицин является аминогликозидным антибиотиком, действующим на синтез белка на уровне субъединицы 30S, связывающимся с белком р10 бактериальных рибосом. Ципрофлоксацин является антибиотиком семейства хинолонов, индуцирующим разрывы двухцепочечной ДНК в результате ингибирования ДНК-гиразы и топоизомеразы IV. Эти агенты смешивали в жидкой культальной LB-среде в концентрациях и с периодами инкубации, указанными в таблице 2. После указанных периодов инкубации эти бактерии обрабатывали согласно способу данного изобретения для определения процента бактерий с фрагментированной ДНК.
Одновременно другую аликвоту их инкубировали с витальным красителем. Этот тест является тестом исключения красителя, использующим зеленый флуорохром (SYBR Green II), связывающийся с ДНК и проникающий во все клетки, смешанный с красным флуорохромом пропидийиодидом (PI), который проникает только в клетки с дефектным функционированием мембраны, предположительно «мертвые» клетки. Таким образом, «живые» клетки окрашиваются в зеленый цвет, так как они исключают красный краситель, в то время как «мертвые» клетки не могут исключить красный краситель и окрашиваются PI. Эти результаты показаны в таблице 2. После исследования 5000 бактерий в каждой экспериментальной точке наблюдали, что гентамицин, ципрофлоксацин и пероксид водорода индуцировали только очень дискретное увеличение клеток с мембраной, проницаемой для PI, тогда как указанное увеличение было эффектным с ампициллином. Но ампициллин едва ли увеличивал процент клеток с фрагментированной ДНК подобно гентамицину. Однако ципрофлоксацин и H2O2 при высоких дозах индуцировали массивную фрагментацию ДНК всех испытанных клеток (уровень 4, фигура 5). Этот результат демонстрирует, что оценка проницаемости мембраны не является универсальным параметром в качестве индикатора жизнеспособности и что это исследование ДНК может обеспечивать дополнительную ценную информацию, которая не обеспечивается указанным окрашиванием, и vice versa.
Пример 4: Оценивание чувствительности или устойчивости микроорганизма к определенному агенту
Показано одно исследование действия ципрофлоксацина на уровне ДНК в штамме Escherichia coli, чувствительном (TG1) к этому антибиотику, и в штамме, устойчивом к этому антибиотику, растущими в экспоненциальной фазе.
Средняя ингибирующая концентрация (MIC) роста была равна 0,012 микрограмм/мл. В противоположность этому на рост устойчивого штамма не влияла максимальная концентрация, использованная в коммерческом тесте (MIC >32 микрограмм/мл). Исследовали шесть концентраций ципрофоксацина, примененных к культурам в LB-среде в течение 40 минут, и проводили исследование с витальным красителем подобно тому, что было описано в предыдущем примере (таблица 3), и исследовали уровень повреждения ДНК в соответствии с протоколом этого изобретения. В этом чувствительном штамме было показано очень дискретное увеличение клеток, проницаемых для PI, и клеток с пустой капсулой, когда доза антибиотика увеличивается на уровне самых высоких используемых доз. Витальный краситель не обнаруживал какого-либо действия в устойчивом штамме.
Повреждение на уровне ДНК наблюдали в чувствительном штамме и при самой низкой концентрации, использованной в этом эксперименте (0,5 мкг/мл). Кроме того, с этой концентрацией уровень повреждения соответствовал типу 4, т.е. максимуму в установленной ранее шкале (фигура 2). Все эти микроорганизмы обнаруживали массивно сегментированную ДНК с широким и диффузным ореолом точкообразных фрагментов ДНК, которые диффундировали в агарозном матриксе в соответствии с градиентом из центральной зоны этого нуклеоида. Дозы, большие 0,5 мкг/мл, по-видимому, не модифицировали изображения фрагментации, причем наблюдалась слегка более высокая диффузия, особенно в центральной зоне этого нуклеоида. Это могло указывать на близкое к насыщению действие повреждения ДНК, обусловленное ципрофлоксацином.
Пример 5: Определение возможного действия низких доз ципрофлоксацина, близких к MIC, на целостность ДНК
После определения, что ципрофлоксацин при высоких концентрациях индуцирует массивную фрагментацию ДНК, представляло интерес определить, может ли этот способ различать какое-либо действие на уровне целостности ДНК после подвергания чувствительного штамма Escherichia coli (TG1) действию низких концентраций вышеуказанного антибиотика, ниже уровня МIС и при уровне MIC (0,012 мкг/мл). Использованные дозы показаны в таблице 4, причем время инкубации равно 40 минутам в фазе экспоненциального роста в LB-среде. Таблица 4 показывает результаты витального красителя. Хотя имеется тенденция к увеличению процента клеток, проницаемых для PI, и клеток с пустыми капсулами при увеличении этой дозы, это не было значимым с использованными низкими дозами.
Уровень повреждения ДНК определяли с использованием способа данного изобретения. Наивысшая доза (0,1 микрограмм/мл), выше MIC, обнаруживала повреждение во всех анализированных клетках. Такое повреждение имеет тенденцию быть однородным среди различных клеток, имеющих более низкую величину, чем массивное разрушение, описанное в предыдущем примере, с дозами 0,5 микрограмм/мл и более высокими дозами. Однако степень повреждения была значительной, подобной уровню 3 (фигура 2). Этот уровень квалифицируется как высокая степень повреждения ДНК. Нуклеоид кажется очень релаксированным и обширным, с большим количеством периферических фрагментов после разрывов ДНК.
Доза, сходная с MIC, также вызывала явное и однородное повреждение среди различных нуклеоидов, но с величиной, сходной с уровнем 2 этой шкалы (фигура 2). Это соответствует средней степени повреждения ДНК. Нуклеоид кажется релаксированным, занимающим большую поверхность, чем в контроле без обработки, с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК.
Доза 0,006 микрограмм/мл, половина MIC, также индуцировала явное и однородное повреждение среди различных нуклеоидов, причем его величина является промежуточной между уровнем 1 и 2 в этой произвольной шкале повреждений (фигура 2).
Наконец, доза 0,003 микрограмм/мл, третья часть MIC, также индуцировала очевидное повреждение, но при уровне 1. Это соответствует низкой степени повреждения ДНК, в которой нуклеоид кажется компактным, но с отдельными периферическими фрагментами относительно большого размера, после разрывов ДНК (фигура 2).
Таким образом, способ данного изобретения имеет высокое разрешение, так что может быть детектировано даже повреждение, индуцируемое очень низкими концентрациями ципрофоксацина, ниже MIC, которые не ингибируют значимо бактериальный рост и не влияют на «жизнеспособность», определяемую при помощи витального красителя. Существует возможность, что эти низкие уровни повреждения могут быть репарированы ферментативным аппаратом репарации ДНК с сохранением жизнеспособности клеток.
Пример 6: Определение минимального времени инкубирования с ципрофлоксапином, которое позволяет детектировать повреждение ДНК в чувствительном штамме Escherichia coli
Штамм Escherichia coli TG1 в фазе экспоненциального роста в LB-среде инкубировали в течение уменьшающихся периодов времени: 40 минут, 15 минут, 5 минут, 2,5 минут и 0 минут, с дозой 1 микрограмм/мл ципрофлоксацина. Включали также контроль без циклофлоксацина. Было оценено, что среднее время, необходимое для включения в микрогель и охлаждения в холодильнике, составляло 1,5 минут. Можно предположить, что антибиотик работает на протяжении этого времени, и, следовательно, время 1,5 минут должно быть добавлено к каждому из анализированных периодов времени.
После 40 минут все бактерии обнаруживали массивно разрушенную ДНК (уровень 4, фигура 6). Этот эффект демонстрировали также при времени 15 минут. В этом случае повреждение также имело тенденцию быть однородным среди различных нуклеоидов, но имеющим гораздо более низкую величину средней степени (уровень 2) (фигура 6). Минимальным временем, при котором детектировали явное повреждение ДНК, было равно 5 минутам, что является низкой степенью повреждения (уровень 1), хотя с 2,5 минутами, по-видимому, наблюдалось слабое увеличение релаксации нуклеоида в сравнении с релаксацией при 0 минут и контролем, но его было трудно оценивать.
Таким образом, способ этого изобретения позволяет распознавать, что повреждение ДНК, вызываемое летальной дозой ципрофлоксацина, является накапливающимся на протяжении времени и не является мгновенным или генерируемым в относительно коротком периоде времени. Минимальное время инкубации для детектирования минимального действия на уровне ДНК с использованием дозы 1 микрограмм/мл было равно 5 мин + 1,5 мин = 6,5 мин.
Пример 7: Наблюдение повреждения ДНК после культивирования с антибиотиками, которые не действуют на уровне ДНК, с инкубированием в течение 24 часов.
Целью является наблюдение, означает ли гибель клеток, несмотря на отсутствие наблюдения первоначального повреждения на уровне ДНК, позднюю фрагментацию такой ДНК. Для этой цели штамм Escherichia coli TG1, растущий в экспоненциальной фазе в жидкой LB-среде, инкубировали в течение 24 часов с ампициллином (300 микрограмм/мл). Этот бета-лактамный антибиотик действует на синтез пептидогликанов клеточной стенки после связывания с РВР (пенициллинсвязывающими белками) и активации автолизинов. Для сравнения одну аликвоту этой культуры обрабатывали после 40 минут обработки как для витального красителя, так и для определения повреждения ДНК с использованием способа этого изобретения. Таблица 5 показывает данные, полученные с витальным красителем. После 20 минут инкубирования с бета-лактамным антибиотиком процент клеток с измененной стенкой, проницаемой или имеющей вид пустой капсулы, явно увеличивался. После одного дня инкубирования это увеличение было очень эффектным, особенно клеток с видом пустых капсул, почти все из которых казались мертвыми на основании результатов, полученных с витальным красителем.
Определение повреждения ДНК в соответствии со способом этого изобретения показало, что различия относительно контроля после 20 минут инкубации не наблюдались. Однако после 24 часов имелась низкая плотность нуклеоидов и они обнаруживали релаксированный вид, без хорошо определенной центральной зоны. Наиболее поразительным было массивное присутствие точкообразных деградированных фрагментов ДНК, однородно распределенных в фоне (основе) препарата (фигура 7). Способ этого изобретения демонстрирует, что гибель клеток, хотя она первоначально не обусловлена прямым повреждением ДНК, может со временем опосредованно приводить к массивному повреждению ДНК.
Пример 8: Наблюдение развития повреждения ДНК, генерируемого ципрофлоксацином, в чувствительном штамме Escherichia coli. Применение систем анализа цифровых изображений для оценивания повреждения
Штамм Escherichia coli TG1, в фазе экспоненциального роста в 400 микролитрах LB-среды, инкубировали с 10 микрограмм/мл ципрофлоксацина в течение 40 минут. Затем эти бактерии центрифугировали и ресуспендировали в 400 микролитрах не содержащей ципрофлоксацина среды. Эту операцию снова повторяли для промывки от антибиотика. Бактерии инкубировали 0, 15, 30, 60 и 90 минут, после чего их обрабатывали согласно способу этого изобретения. В каждом случае контроль без обработки антибиотиком одновременно обрабатывали на том же самом предметном стекле.
После окрашивания SYBR Gold изображения собирали высокочувствительной охлажденной камерой (фотоаппаратом) CCD KX32ME (Apogee Instruments, Roseville, CA). Затем эти изображения анализировали с использованием макросконструированной с Visilog 5.1 программы (Noesis, France). Это делало возможными сегментацию и коррекцию различий фона (основы) и яркости в этой области. Результаты общей поверхности бактериального окрашивания, площадь оставшейся капсулы и ореола диспергированных петель или фрагментов ДНК (общая площадь - площадь капсулы), в пикселах, преобразовывали в таблицу Excel. Наконец, статистический анализ указанных данных проводили при помощи программы SPSS 12.5 с использованием непараметрического U-критерия Манна-Уитни и критерия Н Крускала-Уоллиса (р<0,05).
Эти результаты продемонстрировали, что разрывы двухцепочечной ДНК, вызываемые ципрофлоксацином, могут репарироваться, если этот антибиотик исключают из среды. Немедленно после этой обработки можно видеть высокую фрагментацию (уровень 3-4). Уменьшение поверхности ореола фрагментов диффузии начинает детектироваться статистически значимым образом после 15 минут, причем такие фрагменты имеют больший размер. Этот ореол продолжает уменьшаться более медленно во время 30 и 60 минут, обнаруживая увеличивающимся образом все меньше фрагментов, уменьшающихся значимо, более широко, после 90 минут (фигура 8А). В этом случае фрагменты уже не детектируются, а релаксированные петли ДНК не имеют различий относительно контролей без обработки (уровень 0). Таким образом, получали кинетику репарации разрывов ДНК, причем такая ДНК полностью репарировалась по виду после 90 минут инкубации. Однако это не означает, что эта репарация всегда была точной. Достаточно неожиданно, размер бактериальных капсул увеличивается приблизительно вдвое, в среднем, после конечных периодов 60 и 90 минут, относительно остальных анализированных периодов времени (фигура 8 В). Это увеличение является нерегулярным и гетерогенным среди различных бактерий.
Способ данного изобретения демонстрирует факт высокой клинической важности, т.е. важность поддержания точных доз антибиотиков в течение продолжительных периодов времени. Если такой антибиотик отменяют преждевременно, повреждение, первоначально вызванное в бактерии, может возвращаться к прежнему состоянию бактерии.
Пример 9: Развитие программного обеспечения для автоматизированного измерения уровней фрагментации ДНК
С использованием методологии, обсуждаемой в примере 6 данного изобретения, была спланирована базовая методология, закрепляющая основу для морфологической характеристики изображений, генерируемых бактериями, имеющими фрагментированную ДНК и нефрагментированную ДНК, с использованием общепринятых систем анализа изображений. Этот способ делает возможным автоматическое и, следовательно, более быстрое различение между обоими типами бактерий.
Полный способ включает в себя разработку двух стратегий:
1) модели для интерактивного сбора изображений и получения решений на основе количества анализируемых элементов (фигура 9);
2) рутины сегментации (секционирования) для отбора ROI (представляющих интерес районов) (фигура 10).
В этом практическом примере использовали прямой сбор изображений под флуоресцентным микроскопом (×100) при помощи охлажденной монохромной камеры (фотоаппарата) CCD с 12-разрядной глубиной цвета. Эти изображения хранили в виде формата TIFF и обрабатывали при помощи программы Scion Image общего пользования (NIH IMAGE USA). Эта программа содержит минимальные инструменты, необходимые для выполнения операций сегментации, и может измерять интегрированные плотности флуоресценции в изображениях, которые обрабатываются. Эта интегрированная плотность относится к сумме различных уровней серого в AOI с этой зоной выполнением вычитания фона. С использованием этого инструмента обрабатывали 9 серий экспериментов, в которых собирали изображения 100 бактерий, содержащих нефрагментированную ДНК, и 100 бактерий с фрагментированной ДНК. Эти результаты показывают, что очень сходные величины генерируются между каждыми из этих серий, когда критерием группирования и сравнения являются: бактерии, имеющие фрагментированную ДНК, против бактерий, которые не имеют фрагментированной ДНК.
Таким образом, можно различать два типа состояний бактериальной ДНК на основе объективных наблюдений, проводимых на основе операционной среды анализа изображений.
Хотя в этом случае измеряли только площади флуоресценции и интенсивности выбранных площадей, имеются и другие критерии в отношении текстур, генерируемых каждым типом изображения, и, следовательно, могут быть охарактеризованы и различены обе популяции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЛЯ ОПРЕДЕЛЕНИЯ ФРАГМЕНТАЦИИ ДНК В СПЕРМАТОЗОИДАХ ЖИВОТНЫХ | 2005 |
|
RU2373288C2 |
| НАБОР И СПОСОБ ДЛЯ ПРИГОТОВЛЕНИЯ МНОГОСЛОЙНЫХ АГАРОЗНЫХ БЛОКОВ НА ПОВЕРХНОСТИ МИНИ-СТЕКОЛ ДЛЯ МИКРОСКОПИИ | 2013 |
|
RU2558229C2 |
| СПОСОБ ОЦЕНКИ УСТОЙЧИВОСТИ МЯГКОЙ ПШЕНИЦЫ К НАНОЧАСТИЦАМ ТЯЖЕЛЫХ МЕТАЛЛОВ | 2018 |
|
RU2688478C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБРАЗЦА ДЛЯ ДЕТЕКТИРОВАНИЯ МИКРООРГАНИЗМА, СПОСОБ ДЕТЕКТИРОВАНИЯ МИКРООРГАНИЗМА И НАБОР ДЛЯ ДЕТЕКТИРОВАНИЯ МИКРООРГАНИЗМА | 2006 |
|
RU2384624C2 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ МУЖСКОЙ РЕПРОДУКТИВНОЙ ФУНКЦИИ НА БАЗЕ ОЦЕНКИ ДИСПЕРСИИ ДНК-ФРАГМЕНТОВ СПЕРМАТОЗОИДОВ | 2022 |
|
RU2795567C1 |
| Способ для определения целостности хроматина/ДНК в сперматозоидах | 2020 |
|
RU2730947C1 |
| СПОСОБ ДЕТЕКЦИИ МИКРООРГАНИЗМА И НАБОР ДЛЯ ДЕТЕКЦИИ МИКРООРГАНИЗМА | 2006 |
|
RU2395583C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ СИНЕГНОЙНОЙ ПАЛОЧКИ PSEUDOMONAS AERUGINOSA | 2014 |
|
RU2540501C1 |
| СПОСОБ ПОЛУЧЕНИЯ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ | 1997 |
|
RU2143002C1 |
| Способ выявления одноцепочечных и двуцепочечных разрывов ДНК в мужских половых клетках | 2023 |
|
RU2815686C1 |





Изобретение относится к области биотехнологии, конкретно к способу определения целостности ДНК в бактериях, и может быть использовано в микробиологических исследованиях. Иммобилизованные на предметном стекле, без фиксации, бактерии обрабатывают лизисным раствором, содержащим ионогенный денатурирующий белок детергент и ЭДТА. Далее стабилизируют ДНК-нуклеоид сухим нагреванием и инкубированием в микроволновой печи. Окрашивают ДНК с помощью высокочувствительного ДНК специфического флуорохрома, в заключение оценивают целостность ДНК. Предлагают набор для оценивания целостности ДНК-бактерий, который содержит все необходимые для этого компоненты. Изобретение может быть использовано для определения уровней фрагментации ДНК бактерий быстрым и точным образом. 2 н. и 14 з.п. ф-лы, 11 ил., 5 табл.
1. Способ оценивания целостности ДНК бактерий, предусматривающий стадии:
a) иммобилизации бактерий на предметном стекле, без фиксации, посредством включения его в инертную среду;
b) обработки лизисным раствором, содержащим ионогенный денатурирующий белок детергент и ЭДТА, для экстракции клеточных стенок, мембран и белков;
c) стабилизации ДНК-нуклеоида бактерий на предметном стекле сухим нагреванием, инкубированием этого предметного стекла с лизированной пробой в микроволновой печи и
d) окрашивания ДНК с помощью высокочувствительного ДНК- специфического флуорохрома и оценивания целостности ДНК.
2. Способ по п.1, в котором ионогенный детергент является детергентом, выбранным из группы, состоящей из додецилсульфата натрия (ДСН), алкилбензолсульфата, лаурилсаркозина (саркозила), гидратированной соли гликолевой кислоты и их смесей.
3. Способ по п.2, в котором ионогенным детергентом является предпочтительно додецилсульфат натрия (ДСН).
4. Способ по любому из пп.1-3, в котором лизисный раствор содержит 0,001-2 М дитиотреитол (ДТТ); 0,001-2 М 2-амино-2- (гидроксиметил)-1,3-пропандиол (Трис); 0,001-2 М этилендиаминтетрауксусную кислоту (ЭДТА) и 0,1-3% додецилсульфат натрия (ДСН).
5. Способ по п.4, в котором рН лизисного раствора доводят до 6,5-10,5.
6. Способ по п.4, в котором лизисный раствор предпочтительно содержит 0,1 М дитиотреитол (ДТТ); 0,01 М (гидроксиметил)-1,3-пропандиол (Трис); 0,05 М этилендиаминтетрауксусную кислоту (ЭДТА) и 2% додецилсульфат натрия (ДСН).
7. Способ по п.6, в котором рН лизисного раствора доводят до приблизительно 10 с помощью NaOH.
8. Способ по п.1, в котором пробу, содержащую бактерии, включают в инертный микрогель.
9. Способ по п.8, в котором пробу, содержащую бактерии, предпочтительно включают в агарозный микрогель.
10. Способ по п.1, в котором оценивание проводят посредством прямого визуального анализа.
11. Способ по п.1, в котором оценивание проводят автоматизированным образом посредством применения программы для анализа оцифрованных изображений, полученных при помощи камер (фотоаппаратов), сопряженных с платформами микроскопов.
12. Набор для оценивания целостности ДНК бактерий согласно способу по п.1, включающий:
a) предварительно обработанные предметные стекла;
b) раствор агарозы;
c) лизисный раствор, содержащий ионогенный денатурирующий белок детергент и ЭДТА, и
d) высокочувствительный ДНК-специфический флуорохром.
13. Набор по п.12, где лизисный раствор содержит 0,001-2 М дитиотреитол (ДТТ); 0,001-2 М 2-амино-2-(гидроксиметил)-1,3-пропандиол (Трис); 0,001-2 М этилендиаминтетрауксусную кислоту (ЭДТА) и 0,1-3% додецилсульфат натрия (ДСН).
14. Набор по любому из пп.12 или 13, в котором рН лизисного раствора доводят до 6,5-10,5.
15. Набор по п.13, в котором лизисный раствор предпочтительно содержит 0,1 М дитиотреитол (ДТТ); 0,01 М (гидроксиметил)-1,3-пропандиол (Трис); 0,05 М этилендиаминтетрауксусную кислоту (ЭДТА) и 2% додецилсульфат натрия (ДСН).
16. Набор по п.15, в котором рН лизисного раствора доводят до приблизительно 10 с помощью NaOH.
| SINGH N.: «A simple method for accurate estimation of apoptotic cells» Experimental cell research, 2000, v | |||
| Ножевой прибор к валичной кардочесальной машине | 1923 |
|
SU256A1 |
| ERBES М | |||
| ET AL.: «Detection of primary DNA damage in Chlamydomonas reinhardtii by means of modified microgel electrophoresis» Environmental and molecular mutagenesis, 1997, v | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2011-06-10—Публикация
2007-11-08—Подача