ОБЛАСТЬ ТЕХНИКИ
Данное изобретение в общем относится к новым иммуногенным комбинациям, содержащим или кодирующим по меньшей мере два гетероолигомерных микобактериальных антигена или молекулу нуклеиновой кислоты, кодирующую указанные гетероолигомерные микобактериальные антигены, где микобактериальные антигены выбраны из группы антигенов Esx, РЕ и РРЕ видов Mycobacterium, в частности микобактерии туберкулезного комплекса, такой как Mycobacterium tuberculosis (Mtb). В предпочтительном воплощении иммуногенная комбинация находится в форме слитого полипептида, содержащего по меньшей мере два гетероолигомерных микобактериальных антигена. Данное изобретение также относится к векторам, клеткам-хозяевам и композициям, содержащим или кодирующим указанные иммуногенные комбинации, а также к способам их экспрессии и получения. Данное изобретение также относится к способам применения указанной иммуногенной комбинации, слитого полипептида, вектора, клетки-хозяина, композиции, в частности для индукции или стимуляции иммунного ответа с целью обеспечить защитный ответ против микобактериальной инфекции или любого заболевания, вызванного микобактериальной инфекцией или связанного с микобактериальной инфекцией.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Согласно оценкам, одна треть населения земного шара (т.е. более двух миллиардов человек) инфицирована Mycobacterium tuberculosis (Mtb), ежегодно регистрируется от 9 до 10 миллионов новых случаев и 2 миллиона человек в год погибает от туберкулеза, что представляет собой медицинскую проблему мирового масштаба. Как правило, заболевание передается от человека к человеку воздушно-капельным путем, т.е. через аэрозоль, выделяемый больным туберкулезом легких (активной формой заболевания). Активная форма туберкулеза развивается только у 5-10% инфицированных (приблизительно у 30% столкнувшихся с инфекцией индивидуумов) в течение 2 лет после контакта с возбудителем (что обозначают как первичный туберкулез). При этом у большинства инфицированных индивидуумов развивается латентная инфекция (ЛТБ), которая может длиться десятилетиями без клинических проявлений или симптомов заболевания. ЛТБ представляет собой состояние равновесия, при котором инфицированный индивидуум способен контролировать инфекцию, но полная эрадикация бактерии не достигается. Реактивация (активный туберкулез после отдаленного инфицирования) может возникнуть на более поздней стадии, в частности, в пожилом возрасте или у индивидуумов с ослабленным иммунитетом, как в случае ВИЧ-инфекции или лечения ингибиторами фактора некроза опухоли (TNF). Согласно оценкам, риск реактивации туберкулеза в течение жизни составляет 10% и ослабленный иммунитет увеличивает риск до 10% в год.
Геном бациллы Mycobacterium tuberculosis (Mtb), агента, вызывающего туберкулез, представлен кольцевой молекулой ДНК, состоящей из 4411529 пар оснований (пн) и был полностью секвенирован в 1998 (Cole et al, 5 1998, Nature 393: 537-44). Mtb имеет приблизительно 4000 генов, однако функция и роль большинства этих генов в жизненном цикле и в патогенезе до сих пор не известна.
Анализ геномных последовательностей близкородственных микобактерий и сравнительные исследования позволили идентифицировать ряд секретируемых белков, включая представителей семейств генов Esx и РЕ/РРЕ.
Несмотря на то, что структура или точная функция различных представителей семейств РЕ/РРЕ не известна, предполагают, что некоторые из них могут играть роль в ускользании Mycobacterium от механизмов иммунного надзора, вирулентности и специфичности по отношению к хозяину. Анализ генома показал, что гены РЕ и РРЕ часто обнаруживаются в геноме Mtb по соседству и функционально связаны (Riley et al, 2008, PLoS Comput Biol, 4:el000174). Таким образом, предполагают, что данные пары белков РЕ/РРЕ (например, Rv2431c/Rv2430, Rv3477/Rv3478 и т.д.) взаимодействуют между собой с образованием гетеродимеров, которые возможно представляют собой функциональные формы указанных белков.
Как и гены семейства РЕ и РРЕ, большинство генов Esx экспрессируются в виде тандемных пар, которые координированно регулируются. Геном М.tuberculosis содержит 23 гена EsX (обозначаемых от Esx А до Esx W), которые кодируют белки, предположительно связанные с вирулентностью Mtb. Биофизические исследования указывают, что продукты пар генов Esx взаимодействуют друг с другом, образуя функциональные гетеродимеры. Например, структурный анализ комплекса ТВ9.8 (Rv0287)/TB10.4 (Rv0288) выявил, что 19 аминокислотных остатков ТВ9.8 и 21 аминокислотный остаток ТВ10.4 задействованы в межмолекулярных контактах (Ilghari et al, 2011, J. Biol. Chem., 286: 29993-30002).
Предыдущие попытки добиться повышенной экспрессии белков Mtb EsxA (ESAT6) и EsxB (CFP 10) М.tuberculosis по отдельности в Е.coli встретили технические препятствия, в результате чего выход белка оказался низким. Несколько исследований показали, что совместная экспрессия взаимосвязанных пар белков облегчает правильную укладку и димеризацию, что обеспечивает высокий выход продуцируемых рекомбинантных белков и облегчает структурные и биологические исследования данных белковых семейств, связанных с вирулентностью Mtb (Strong et al., 2006, Proc. Natl.
Acad. Sci., 103: 8060-5; Mehra et al, 2013, PLoS, 9: el003734). Однако, нет данных, что такие димеры сохраняют иммуногенную активность.
Гибель миллионов людей вследствие заражения Mtb особенно драматична на фоне существования и широкого применения как вакцины (бациллы Кальметта- Герена (BCG)), так и антибиотиков. Однако, если BCG эффективна для предупреждения заболевания у новорожденных и детей преддошкольного возраста, она не защищает взрослых и не предотвращает реактивацию Mtb у лиц с латентной инфекцией. С другой стороны, лечение активного туберкулеза различными комбинациями антибиотиков эффективно, но требует строгого соблюдения пациентом схемы и режима лечения с ежедневным приемом различных препаратов на протяжении нескольких месяцев. Кроме того, тревожит скорость появления штаммов Mtb с устойчивостью к лекарствам (например, штаммов MDR с множественной лекарственной устойчивостью (от англ. MultiDrug Resistant), штаммов XDR с широкой лекарственной устойчивостью (от англ. extensively Drug-Resistant)
и штаммов TDR с полной лекарственной устойчивостью (от англ. Totally Drug Resistant), главным образом из-за несоблюдения этого продолжительного и дорогостоящего режима лечения.
Существует ряд данных, позволяющих предположить, что стимуляция клеточного иммунитета играет роль в противоборстве туберкулезу (Rook et al, 2007, J Infect Dis, 196: 191-8). Хорошо известно, что ключевую роль в борьбе с патогеном и предупреждении прогрессирования заболевания играют CD4 Т лимфоциты. Например, пациенты с ВИЧ/СПИД с низким уровнем CD4 Т+ клеток более подвержены прогрессированию туберкулеза, тогда как противовирусные препараты, повышающие уровень CD4 Т+ клеток, препятствуют прогрессированию заболевания. Однако, CD4 Т клетки действуют не обособленно, им помогают CD8 Т клетки и другие субпопуляции клеток.
Разработка эффективных противотуберкулезных вакцин имеет приоритетное значение в такой тревожной обстановке, при этом на протяжении последних десяти лет исследования развивались в двух основных направлениях: замена BCG и бустер BCG.
Кандидаты на замену BCG нацелены на улучшение эффективности и безопасности BCG, а их основу, главным образом, составляют живые аттенуированные бактерии, такие как генетически модифицированные штаммы BCG или Mtb, созданные для экспрессии новых групп антигенов, которые отсутствуют у BCG, или для сверхэкспрессии антигенов Mtb, уровень экспрессии которых у BCG, по-видимому, недостаточен, или для устранения генов вирулентности и их регуляторов (например, WO 2009/064825; WO 2012031752).
Бустеры BCG предназначены для индукции клеточного и/или гуморального иммунного ответа и обычно они основаны на рекомбинантных вакцинах, созданных для представления различных туберкулезных антигенов либо в виде белковых композиций, как правило, смешанных с мощными Th1-активирующими адъювантами, либо в вирусных экспрессионных векторах (см. Andersen, 2007, Nature, 5: 484; Ottenhoff and Kaufman, 2012, PLoS 8(5): e1002607; Cayabyab et al, 2012, Frontiers in Cellular and Infection Microbiology 2: 1-16; and Brennan et al., 2012, Int J Tuberc. Lung Dis. 16(12): 1566-1573).
Некоторые из этих вакцин-кандидатов продемонстрировали в доклинических и клинических исследованиях результаты, которые свидетельствовали об их способности индуцировать устойчивый клеточно-опосредованный иммунный ответ против Mtb или обеспечивать защиту от туберкулез-ассоциированных поражений легких. Например, аденовирусный вектор, экспрессирующий Ag85A, ТВ10.4, ТВ9.8 и Acr2 (AdTBF) улучшал эффект BCG, сокращая объем повреждений и бактериальную нагрузку в легких вакцинированных коз (Perez de Val et al, 2013, PLoS, 8: e81317). Однако, данные исследования подчеркнули зависимость Т-клеточного ответа и эффективности защиты от различных факторов, таких как дозы антигенов (например, Aagaard et al, 2009, PLoS One, 4: 1-8) и способ введения (Goonetilleke et al, 2003, J. Immunol, 171: 1602-9).
Также описано применение слитых полипептидов, содержащих различные туберкулезные антигены. Например, слитый белок Hyvac 4 (Н4), состоящий из Ag85B, слитого с TBI 0.4 (Aagaard et al, 2009, PLoS One, 4: 1-8) находится в клинической разработке. Слитый белок GSK М72, построенный из Rv1 196, встроенного в середину сериновой протеазы Rv0125, продемонстрировал благоприятный клинический профиль безопасности и иммуногенности при введении с различными синтетическими адъювантами (Von Eschen et al, 2009, Hum Vaccine, 5: 475-82). Также следует упомянуть так называемые слитые белки "ID" (WO 2008/124647), такие как ID83, построенный из Rv1813, Rv3620 и Rv2608, и ID93, включающий Rv3619, слитый с тремя антигенами ID83, а также антиген Rv0198, слитый с Rv3812 или Rv0111 (см. WO 2011/144951). С другой стороны, WO 2014/009438 описывает крупные гибриды, включающие в себя различные микобактериальные антигены, характерные для всех фаз естественного течения инфекции.
Несмотря на все эти и другие усилия, туберкулез все еще не удается побороть и сохраняется потребность в альтернативных вакцинах-кандидатах для диагностики, предупреждения и лечения туберкулеза, особенно в эндемических регионах.
Данное изобретение удовлетворяет эти и другие потребности, поскольку предлагает иммуногенную комбинацию, которая содержит по меньшей мере гетероолигомерные микобактериальные антигены, предпочтительно слитые, выбранные из группы антигенов Esx, РЕ и РРЕ. Комбинация/слияние пар микобактериальных антигенов, входящих в такие гетероолигомеры (например, гетеродимеры) обусловливает неожиданные свойства, такие как улучшение фолдинга антигенов и растворимости слитых антигенов по сравнению с отдельными антигенами, что может повысить генетическую стабильность вакцин-кандидатов, снизить возможную токсичность при продуцировании в клетках-хозяевах или организмах и/или улучшить качество и/или спектр противомикобактериального гуморального и/или клеточного иммунного ответа. Кроме того, иммуногенная комбинация по изобретению может быть оптимизирована для различных фаз
естественного течения микобактериальной инфекции благодаря дополнительным микобактериальным антигенам. Данное изобретение наиболее целесообразно применять в рамках иммунотерапии как само по себе, так и в качестве бустера BCG в целях профилактики или лечения микобактериальной инфекции, например, для предупреждения инфицирования Mtb и/или предупреждения первичного туберкулеза и/или предупреждения реактивации у индивидуумов латентной инфекции. Также его можно применять в сочетании со стандартной терапией (например, терапией антибиотиками) или любым другим лечением, которое разрабатывается в настоящее время (например, низкомолекулярными прямыми или непрямыми ингибиторами; антителами или иммунотерапией и т.д.). Данное изобретение также может найти применение в области ветеринарии, например, для сокращения или устранения риска микобактериальной инфекции и/или активного заболевания у животных, особенно у молодняка коров и коз.
Техническое решение проиллюстрировано в представленных воплощениях и изложено в формуле изобретения.
Другие аспекты, признаки и преимущества данного изобретения станут очевидны из приведенного ниже описания предпочтительных воплощений изобретения. Данные воплощения приведены в целях описания.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение относится к иммуногенной комбинации, которая содержит или кодирует по меньшей мере два гетероолигомерных микобактериальных антигена, предпочтительно в виде слитого полипептида, выбранные из группы антигенов Esx, РЕ и РРЕ, или молекулу нуклеиновой кислоты, кодирующей указанную комбинацию/слитый полипептид.
Определения
В данной заявке, когда употребляют единственное число, подразумевают "по меньшей мере один", "по меньшей мере первый", "один или более чем один" или "множество" упоминаемых соединений или стадий, если контекстом не продиктовано иное.
Термин «и/или», всякий раз, когда он здесь используется, включает значение "и", "или" и "все или любая другая комбинация элементов, объединенных указанным термином".
Термин "примерно" или "приблизительно", используемый здесь, означает в пределах 10%, предпочтительно в пределах 8% и более предпочтительно в пределах 5% от данного значения или интервала.
Термины "аминокислоты", "остатки" и "аминокислотные остатки" являются синонимами и охватывают как природные аминокислоты, так и аналоги аминокислот (например, не имеющие природного происхождения, синтетические и модифицированные аминокислоты, включая D или L оптические изомеры).
В данном документе при обозначении продуктов, композиций и способов термин "содержащий" (и любая его форма, например «содержать" и "содержит"), "имеющий" (и любая его форма, например "иметь" и "имеет"), "включающий" (и любая его форма, например "включает" и "включать") или "имеющий в своем составе" (и любая его форма, например "имеет в своем составе" и "иметь в своем составе") являются неограничивающими и не исключают дополнительных, не указанных элементов или этапов способа. Так, полипептид "содержит" аминокислотную последовательность, когда аминокислотная последовательность является частью конечной аминокислотной последовательности полипептида. Такой полипептид может иметь до нескольких сотен дополнительных аминокислотных остатков (например, линкер и адресующие пептиды, согласно данному описанию). Под "состоящим по существу из" следует понимать исключающий другие компоненты или стадии, имеющие какое-либо существенное значение. Так, композиция, по существу состоящая из указанных компонентов, не будет исключать следовые примеси и фармацевтически приемлемые носители. Полипептид "по существу состоит из" аминокислотной последовательности, когда в такой аминокислотной последовательности может быть только несколько дополнительных аминокислотных остатков. "Состоящий из" означает исключение более чем следовых элементов других компонентов или стадий. Например, полипептид "состоит из" аминокислотной последовательности, когда полипептид не содержит каких-либо аминокислотных остатков помимо тех, которые указаны в аминокислотной последовательности.
Термин "полипептид" обозначает полимер аминокислотных остатков по меньшей мере из восьми или более аминокислот, соединенных ковалентными пептидными связями. Полипептид может быть линейным или разветвленным и может иметь в своем составе аминокислоты природного происхождения и/или аналоги аминокислот. Термин также охватывает полимеры аминокислот, которые были модифицированы естественным образом или за счет вмешательства, например, образования дисульфидных связей, гликозилирования, липидирования, ацетилирования или фосфорилирования или любых других манипуляций или модификаций, таких как конъюгирование с меткой или добавление функциональных пептидов, таких как таги (гистидиновый, myc, Flag и др.), адресующих пептидов (сигнальных пептидов, трансмембранных доменов и т.д.), а также других известных в области техники модификаций. Следует понимать, что термин «полипептид» охватывает белки (обычно используется для полипептидов, содержащих 50 или более аминокислотных остатков), олигопептиды и пептиды (обычно используется для полипептидов, содержащих менее 50 аминокислотных остатков). Таким образом, каждый полипептид может быть охарактеризован определенными аминокислотами и кодироваться определенными последовательностями нуклеиновых кислот.
Термин «комбинация», используемый в данном документе, относится к любому возможному расположению различных компонентов. Такое расположение включает смесь микобактериальных антигенов (например, смесь отдельных антигенов и/или слитые антигены) или смесь молекул нуклеиновых кислот (например, которые находятся в одном или нескольких векторах), а также смесь олигопептидов и молекул нуклеиновых кислот. Данное изобретение охватывает комбинации, содержащие одинаковые молярные концентрации каждого компонента, а также комбинации с существенно различающимися концентрациями. При этом имеют в виду, что оптимальная концентрация каждого компонента Mycobacterium может быть установлена специалистом в данной области.
Термин «иммуногенная» относится к способности индуцировать или стимулировать значимый клеточный и/или гуморальный иммунный ответ у индивидуума, которому вводят компонент, который квалифицируют как иммуногенный. Например, комбинация по изобретению является иммуногенной, поскольку она способна индуцировать или стимулировать иммунный ответ у индивидуума, который может быть врожденным и/или специфическим (т.е. направленным против по меньшей мере одного микобактериального антигена/эпитопа, содержащегося или экспрессируемого указанной иммуногенной комбинацией), гуморальным и/или клеточным (например, продукция антител и/или цитокинов и/или активация цитотоксических Т клеток, В клеток, Т лимфоцитов, антиген-презентирущих клеток, Т-хелперных клеток, дендритных клеток, NK-клеток и т.д.) и обычно приводит к защитному ответу у индивидуума, которому осуществляют введение. В области техники существует большое разнообразие прямых или непрямых биологических тестов для оценки иммуногенной природы компонента in vivo (у животного или человека) или in vitro (например, в биологическом образце), согласно данному описанию. Например, способность конкретного антигена стимулировать клеточно-опосредованный иммунный ответ можно определить с помощью ряда тестов, таких как лимфопролиферативный тест (активация лимфоцитов), исследование цитотоксических Т лимфоцитов или исследование антиген-специфических Т лимфоцитов сенсибилизированного индивидуума.
Термин «гибрид» или «слитый полипептид» в данном документе обозначает ковалентное связывание в единую полипептидную цепь двух или более полипептидов, которое осуществляют с помощью генетических методов, например, путем слияния в рамке считывания молекул нуклеиновых кислот, кодирующих каждый из указанных полипептидов. Под «слитым в рамке считывания» понимают, что результатом экспрессии слитых кодирующих последовательностей является единый полипептид, при этом между слитыми полипептидами нет никакого терминатора трансляции. Слияние может быть прямым (т.е. без каких-либо дополнительных аминокислотных остатков между ними) или непрямым (например, через линкер между слитыми полипептидами) и может быть на N или С конце полипептида или внутри него. Наличие линкера может способствовать корректному фолдингу и/или функционированию слитых полипептидов. Линкер может также включать сайт расщепления для расщепления слитых полипептидов в ходе (например, пептид 2а) или после трансляции (например, сайт протеазы) в клетке-хозяине или организме. Данное изобретение не ограничивается формой, размером или количеством использованных линкерных последовательностей. Например, типичные линкеры имеют длину от 3 до 30 аминокислотных остатков и состоят из повторов аминокислотных остатков, таких как глицин, серии, треонин, аспарагин, аланин и/или пролин. Линкер также может представлять собой пептидную последовательность из прокариотического организма (например, микобактерии, такой как Mtb), которая особенно подвижна или которая уже присутствует в N-концевой части некоторых антигенов (таких как сигнальный пептид).
В данном документе термин «микобактериальный антиген» обозначает полипептид, присутствующий (например, кодируемый геномом представителей Mycobacterium) или полученный из представителей Mycobacterium. В данном изобретении термин охватывает нативные полипептиды микобактерии, а также фрагменты и их модифицированные версии (варианты), описанные далее. Предпочтительно, микобактериальные антигены, применяемые в данном изобретении, являются иммуногенными при введении индивидууму (способны связываться антителом или Т клеточным рецептором). Как правило, они содержат один или несколько В и/или Т клеточных эпитопов, в частности эпитопов CTL или TR или и тех, и других, которые задействованы в распознавании конкретным антителом или Т-клеточным рецептором в комплексе с молекулами главного комплекса гистосовместимости (ГКГС). Способы идентификации таких эпитопов хорошо известны в области техники. Например, Т-клеточные эпитопы можно идентифицировать с помощью биологических тестов (например, определения интерферона гамма (IFNg) с использованием библиотек синтетических перекрывающихся олигопептидов) или существующих программ для предсказания эпитопов.
«Нативный» микобактериальный антиген можно обнаружить, выделить, получить из естественного источника Mycobacterium. Такие источники включают биологические образцы (например, кровь, плазму, сыворотку, слюну, мокроту, срезы тканей, биопсийные образцы и т.д.), полученные у индивидуума, инфицированного или подвергшегося воздействию Mycobacterium, культивируемые клетки, а также рекомбинантные материалы, находящиеся в депозитариях (например, АТСС или ТВ), библиотеках, или описанные в литературе (например, изоляты Mycobacterium, геномы Mycobacterium, фрагменты геномов, геномная РНК или кДНК, а также любые известные в области техники плазмиды или векторы, включающие такие элементы).
«Фрагмент» или микобактериальный антиген представляет собой полипептид, содержащий по меньшей мере 8 смежных аминокислот микобактериального антигена, более предпочтительно по меньшей мере 15 смежных аминокислот, более предпочтительно по меньшей мере приблизительно 20 смежных аминокислот, еще более предпочтительно по меньшей мере приблизительно 25 смежных аминокислот, еще более предпочтительно по меньшей мере приблизительно 30 смежных аминокислот, еще более предпочтительно по меньшей мере приблизительно 40 смежных аминокислот. Такой фрагмент характеризуется тем, что он сохраняет способность стимулировать иммунный ответ, как и микобактериальный антиген. Подходящий фрагмент может представлять собой иммуногенный домен (как правило, 8-30 аминокислотных остатков), содержащий один или несколько пептидных мотивов, распознаваемых антителом, Т-клеточным рецептором или молекулой HLA.
«Модифицированный», «вариант» или «мутантный» микобактериальный антиген обычно отличается в одной или нескольких позициях от описанного в данном документе или нативного полипептида. Возможны любые модификации, включая замены, вставки, добавления и/или делеции одной или нескольких аминокислотных остатков, не встречающиеся в природе перестройки, а также любые их комбинации. Аминокислотные замены могут быть консервативными или нет. Когда имеют место несколько модификаций, они могут затрагивать остатки, расположенные последовательно и/или не последовательно. Такие модификации могут быть благоприятны для синтеза, процессинга, стабильности, функции и/или растворимости полученного варианта полипептида и/или его иммуногенности. Модификации можно осуществлять посредством ряда методов, известных специалистам, таких как сайт-специфический мутагенез (например, с помощью системы для проведения мутагенеза in vitro SculptorTM производства Amersham, Les Ullis, France), мутагенеза с помощью ПЦР, перестройки ДНК и с помощью методов химического синтеза (например, позволяющих получить синтетическую молекулу нуклеиновой кислоты, кодирующую целевой вариант полипептида).
Термин «гетероолигомерный» в данном документе обозначает способность двух компонентов образовывать комплекс. Ассоциация может быть специфической (требует структурной комплементарности аминокислотных остатков двух партнеров в сайте связывания и одно или несколько из следующих типов взаимодействий: электростатических сил, водородных связей, гидрофобных взаимодействий и/или ван-дер-Ваальсовых сил для поддержания связывания) или неспецифической (взаимодействие за счет одного или нескольких типов перечисленных выше взаимодействий при отсутствии структурной комплементарности). Ряд микобактериальных антигенов семейства генов Esx, РЕ или РРЕ склонны к ассоциации с образованием комплекса (гетероолигомера) в естественных обстоятельствах (например, микобактериальная инфекция), таких как комплекс 1: 1 (гетеродимер) или к любому другому типу ассоциации между двумя партнерами (например, тример, тетрамер и т.д.). Образование такого гетероолигомера можно легко продемонстрировать при помощи кругового дихроизма или вестерн-блоттинга или с использованием метки. В альтернативном случае его также можно установить посредством стандартных методов структурного анализа, таких как рентгеновская кристаллография, ЯМР или генерация второй гармоники (SHG, от англ. second harmonic generation).
В данном описании термины «микобактерия», «виды микобактерий» и «микобактериальный» используются взаимозаменяемо и обозначают любого представителя рода Actinobacteria, принадлежащего семейству Mycobacteriaceae. Термины охватывают лабораторные штаммы, а также клинические изоляты.
«Микобактериальная инфекция» относится к воздействию видов микобактерий на индивидуума с последующим заселением индивидуума или ткани (тканей) индивидуума бактерией. Заселение может стать причиной тяжелых заболеваний (например, туберкулеза, лепры, язвы Бурули и т.д., в зависимости от вида микобактерий) или может не вызвать неблагоприятных проявлений (асимптоматическая или латентная инфекция).
Термин «проведение лечения» (и любые его формы, такие как «лечение», «лечить») в данном документе охватывают профилактику (например, предупреждение заболевания у индивидуума, подвергающегося риску заражения микобактерией) и/или терапию (например, индивидуума, у которого диагностирована микобактериальная инфекция). Лечение требует введения индивидууму активного агента наружно или внутрь (например, иммуногенной комбинации, слитого полипептида, молекулы нуклеиновой кислоты, вектора и/или композиции, описанных в данном документе), возможно в сочетании со стандартной терапией, в частности, используемым в настоящее время лечением активного заболевания, вызванного микобактерией (например, туберкулеза).
Термин «индивидуум» в целом обозначает позвоночного, для которого будет благотворной индукция или стимуляция иммунного ответа против видов микобактерий, и в частности, млекопитающего, выбранного из группы, состоящей из домашних животных, сельскохозяйственных животных, животных для спортивных соревнований и приматов. Предпочтительно, индивидуум представляет собой человека, у которого выявлена микобактериальная инфекция, или который подвергается риску заражения микобактерией, особенно Mtb, и таким образом, подвержен или имеет риск развития заболевания или состояния, вызванного или связанного с микобактериальной инфекцией (например, имеющего активную или латентную форму туберкулеза).
Термин «выделенная», используемый при описании полипептида, молекулы нуклеиновой кислоты, вектора и т.д. в данном документе означает, что такой полипептид, молекула нуклеиновой кислоты, вектор и т.д. извлечены из своего естественного окружения (т.е. отделены по меньшей мере от одного из других компонентов, с которыми они ассоциированы в естественных условиях). Например, выделенный полипептид охватывает рекомбинантный полипептид, обычно продуцируемый рекомбинантными клетками, созданными для его экспрессии, поскольку отсутствует по меньшей мере один компонент естественного окружения полипептида. При этом, выделенный полипептид обычно получают при помощи по меньшей мере одной стадии очистки.
Термины «полученный из», «происходящий из» или «берущий начало из» используют для описания исходного источника компонента (например, полипептида, молекулы нуклеиновой кислоты, вектора и т.д.), но не предполагают ограничения способа, которым получен компонент, который может быть, например, химически синтезирован или получен рекомбинантным способом.
Виды микобактерии
Как указано выше, микобактериальные антигены (такие как гетероолигомерные микобактериальные антигены и возможно, один или несколько дополнительных микобактериальных антигенов, содержащиеся или кодируемые иммуногенной комбинацией по изобретению) могут независимо быть получены из любого представителя видов Mycobacterium, известных в настоящее время.
В области техники известно большое количество микобактерии для применения в данном изобретении. Примеры видов Mycobacterium включают М.phlei, М.smegmatis, М.africanum, М.canetti, М.fortuitum, М.marinum, М.ulcerans, М.tuberculosis (Mtb), М.paratuberculosis, М.bovis, М.microti, М.celatum М.avium, М.leprae, М.lepraemurium, М.intracellulare, М.scrofulaceum, М.xenopi, М.genavense, М.kansasii, М.simiae, М.szulgai, М.haemophilum, М.asiaticum, М.malmoense, М.vaccae, М.caprae, М.pinnipedii и М.shimoidei, но не ограничиваются ими.
В предпочтительном воплощении микобактериальные антигены для применения в данном изобретении получают из видов микобактерии туберкулезного комплекса, куда входят виды, которые традиционно считают возбудителями туберкулеза, а также экзогенные и оппортунистические виды микобактерии, которые вызывают туберкулез и легочные заболевания у индивидуумов с ослабленным иммунитетом (например, у ВИЧ-инфицированных пациентов). Примеры видов, входящих в туберкулезный комплекс, для применения в данном изобретении включают М.tuberculosis (Mtb), М.bovis, М.bovis BCG, М.africanum, М.canetti, М.caprae и М.microti, но не ограничиваются ими. Предпочтительное воплощение относится к Mtb, включая лабораторные штаммы Mtb, такие как H37Rv и H37Ra и клинические изоляты, такие как KZN4207, Т85, CDC1551 (выделенный в США), FI 1 (выделенный в Южной Африке), С, K85 (выделенный в Нидерландах), CPHL-A, а также изоляты MDR или XDR, такие как TN5904, Haarlem, KZN1435, Bejing и KZN605. Другими предпочтительными видами, служащими источником микобактериальных антигенов, являются М.bovis, М.bovis BCG и М.caprae, в особенности для применения в ветеринарии. При этом вследствие высокого процента гомологии между видами микобактерий на аминокислотном и нуклеотидном уровнях возможна выраженная перекрестная реактивность. Следовательно, иммуногенная комбинация по данному изобретению может найти применение в лечении как Mtb-инфицированных индивидуумов (применение у человека), так и М.bovis- и М.caprae-инфицированных индивидуумов (применение в ветеринарии).
Иммуногенная комбинация
В одном воплощении гетероолигомерные микобактериальные партнеры, входящие в состав или кодируемые иммуногенной комбинацией по данному изобретению, выбраны из группы микобактериальных антигенов Esx, РЕ и РРЕ. Такие группы продуктов микобактериальных генов хорошо известны в области техники и могут быть легко идентифицированы специалистом на основе данных, представленных в области техники.
Например, геном М.tuberculosis содержит 23 гена EsX (обозначаемых от Esx А до Esx W), которые кодируют белки, предположительно связанные с вирулентностью Mtb. Продукты гена EsX обычно характеризуются небольшим размером, приблизительно 100 аминокислотных остатков, и наличием центрального мотива WXG. Биофизические исследования указывают, что продукты пар генов Esx взаимодействуют с образованием гетеродимеров, которые по- видимому являются функциональной формой этих белков. Репрезентативные примеры таких гетеродимеров включают, например, EsxA (ESAT6) и EsxB (CFP-10); EsxG (ТВ9.8 или Rv0287) и EsxH (ТВ10.4 или Rv0288); EsxR (Rv3019c) и EsxS (Rv3020c); EsxO (Rv2346c) и EsxP (Rv2347c) и EsxV и EsxW, но не ограничиваются ими.
На мультигенные семейства РЕ и РРЕ Mycobacterium tuberculosis приходится примерно 10% кодирующего потенциала генома и они насчитывают приблизительно 168 представителей (обзор представлен, например, Deng and Xie, J Cell Bioch, 2013, 113: 1087-1095). Представители данного семейства характеризуются наличием консервативного N-конца и вариабельного С-конца. Функция белков, кодируемых данными крупными семействами генов, неизвестны, однако предполагают, что они связаны с антигенной изменчивостью и патогенезом заболевания. Репрезентативные примеры гетеродимеров РЕ/РРЕ включают, например, Rv3478 и Rv3477, но не ограничиваются ими.
Аминокислотные последовательности подходящих микобактериальных антигенов семейств EsX, РЕ и РРЕ и кодирующие нуклеотидные последовательности легко найти в специализированных базах данных и в литературе. Например, последовательности Mtb можно найти у Cole et al. (1998, Nature 393: 537) или на веб-сайтах института Сэнгера (Wellcome Trust Sanger Institute), института Пастера и других (например, в базе данных ТВ (@tbdb.org) и tuberculist (@tuberculist.epfl.ch)). Однако, данное изобретение не ограничено приведенными в качестве примеров видами Mycobacterium. Действительно, нуклеотидные и аминокислотные последовательности могут варьировать у разных изолятов и штаммов и данные естественные генетические варианты входят в объем изобретения, так же как и модификации искусственного происхождения, например, описанные в данном документе. Будучи модифицированными, гетероолигомерные партнеры предпочтительно демонстрируют идентичность по меньшей мере 70% и предпочтительно по меньшей мере 80% (например, 80%, 85%, 90%, 92%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) с аминокислотными последовательностями соответствующих им нативных антигенов EsX, РЕ и РРЕ, применительно как полноразмерному полипептиду, так и его фрагменту (например, по меньшей мере из 40 аминокислотных остатков). Термин «идентичность» относится к соответствию между аминокислотами или нуклеотидами в последовательностях двух полипептидов или нуклеиновых кислот. Процент идентичности между двумя последовательностями зависит от количества идентичных позиций у двух последовательностей, с учетом количества пробелов, которые необходимо добавить для оптимального выравнивания, а также длины каждого пробела. В области техники существуют различные компьютерные программы и математические алгоритмы для определения процента идентичности между двумя аминокислотными последовательностями, например, такие как программа Blast, предоставляемая NCBI, или ALIGN в атласе белковых последовательностей и структур (Dayhoffed, 1981, Suppl, 3: 482-9). Программы для определения идентичности между нуклеотидными последовательностями также предоставляются специализированными базами данных (например, Genbank, Wisconsin Sequence Analysis Package, BESTFIT, FASTA и GAP).
В рамках данного изобретения может быть целесообразным модифицировать один или оба гетероолигомерных партнера. Репрезентативные примеры подходящих модификаций включают (а) делецию внутреннего высоко гидрофобного участка и/или (б) делецию N-концевого сигнального пептида (замену гетерологичными аналогами при необходимости) и/или (в) делецию несвернутого участка, который может отрицательно влиять на растворимость, стабильность, иммуногенность и рекомбинантную экспрессию, и/или (г) делецию или мутацию каталитического домена для устранения по меньшей мере одной биологической активности микобактериального антигена и/или гетероолигомера и/или (д) делецию или мутацию одного или нескольких аминокислотных остатков для уменьшения или устранения его взаимодействия с клеточным белком-мишенью (например, клеточным белком млекопитающего, который в случае инфекции Mtb позволяет бактерии снижать, нарушать или модифицировать нативную функцию или активность указанного клеточного белка-мишени и, таким образом, способствовать развитию инфекции Mtb или заболевания, связанного с инфекцией Mtb) и таким образом, избежать нарушения клеточной активности или клеточной функции, но не ограничиваются ими.
В предпочтительном воплощении гетероолигомерные микобактериальные антигены выбраны из группы, состоящей из ESAT-6 (Rv3875), CFP10 (Rv3874), РРЕ60 (Rv3478), РЕ31 (Rv3477), TBI 0.4 (Rv0288) и TB9.8 (Rv0287).
В другом предпочтительном воплощении такие гетероолигомерные микобактериальные антигены слиты и образуют слитый полипептид. Репрезентативные, но не исчерпывающие примеры гибридов, входящих в состав или кодируемых иммуногенной комбинацией по изобретению, включают (а) гибрид EsxA (также обозначаемого ESAT-6 или Rv3875) и EsxB (также обозначаемого CFPIO или Rv3874); (б) гибрид EsxG (также обозначаемого ТВ10.4 или Rv0288) и EsxH (также обозначаемого ТВ9.8 или Rv0287) и (в) гибрид микобактериального антигена РЕ, Rv3478, с его гетероолигомерным партнером - микобактериальным антигеном РРЕ, Rv3477. В контексте изобретения иммуногенная комбинация может содержать два или более гибридов гетероолигомерных партнеров (например, гибрид CFPIO с ESAT-6 и гибрид ТВ10.4 с ТВ9.8).
Данное изобретение предполагает возможность слияния в обоих направлениях, когда один гетероолигомерный партнер находится на N конце или С конце гибрида. Слияние может быть прямым или между гетероолигомерными партнерами может находиться линкер. Предпочтительный гибрид содержит CFPIO на N-конце и ESAT-6 на С-конце. Другой предпочтительный гибрид содержит TBI 0.4 на N-конце и ТВ9.8 на С-конце.
Желательно, гибрид, содержащийся или кодируемый иммуногенной композицией по изобретению, не включает в себя каких-либо других иммуногенных фрагментов микобактериального антигена (однако он может включать неиммуногенный фрагмент другого микобактериального антигена, например, для применения в качестве линкера или адресующего пептида, и т.д., как описано в данном документе).
Наиболее предпочтительная иммуногенная комбинация по данному изобретению содержит или кодирует слитый полипептид, содержащий аминокислотную последовательность, по меньшей мере на 70% идентичную аминокислотной последовательности, показанной в SEQ ID NO: 1, или любому ее варианту или фрагменту. Более конкретно, SEQ ID NO: 1 представляет гибрид, состоящий из CFPIO и ESAT6, в котором гетероолигомерные партнеры разделены пептидом из 14 аминокислот, соответствующим участку 149-162 белка Mtb Rv1827, использованному в качестве линкера.
Другая особенно предпочтительная иммуногенная комбинация по данному изобретению содержит или кодирует слитый полипептид, содержащий аминокислотную последовательность, по меньшей мере на 70% идентичную аминокислотной последовательности, показанной в SEQ ID NO: 2, или любому ее варианту или фрагменту. Более конкретно, SEQ ID NO: 2 представляет гибрид, состоящий из TBI 0.4 и Rv0287, в котором гетероолигомерные партнеры разделены пептидом из 13 аминокислот, соответствующим участку 149-161 белка Mtb Rv1827, использованному в качестве линкера.
Еще одна особенно предпочтительная иммуногенная комбинация по данному изобретению содержит или кодирует гибрид, содержащий аминокислотную последовательность, по меньшей мере на 70% идентичную аминокислотной последовательности, показанной в SEQ ID NO: 1 или любому ее варианту или фрагменту, и гибрид, содержащий аминокислотную последовательность, по меньшей мере на 70% идентичную аминокислотной последовательности, показанной в SEQ ID NO: 2, или любому ее варианту или фрагменту.
Помимо гетероолигомерных микобактериальных партнеров (например, их гибридов) иммуногенная комбинация по изобретению может также содержать или кодировать один или несколько дополнительных микобактериальных антигенов. Указанные дополнительные микобактериальные антигены предпочтительно выбраны из группы, состоящей из антигенов активной фазы, фазы оживления и латентной фазы. Указанные дополнительные микобактериальные антигены могут содержаться или экспрессироваться иммуногенной комбинацией в форме отдельных полипептидов или в форме одного или нескольких слитых полипептидов (например, дополнительных слитых полипептидов, либо как в форме отдельных антигенов, так и в форме гибридов).
Предпочтительно, гетероолигомерные партнеры и, возможно, один или несколько дополнительных микобактериальных антигенов, содержащихся или кодируемых иммуногенной комбинацией по изобретению, независимо получены из видов микобактерии туберкулезного комплекса, выбранных из группы, состоящей из М.tuberculosis (Mtb), М.bovis, М.bovis BCG, М.africanum, М.canetti, М.caprae и М.microti, наибольшее предпочтение отдается Mtb.
Целесообразно, чтобы иммуногенная комбинация по данному изобретению дополнительно содержала или кодировала по меньшей мере два дополнительных микобактериальных антигена. В данном описании «по меньшей мере два» представляет собой число, находящееся в диапазоне от 2 до 30 (т.е. 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30). Предпочтительно, иммуногенная комбинация по данному изобретению содержит от 2 до 10 дополнительных микобактериальных антигенов или соответствующих молекул нуклеиновых кислот, наиболее предпочтительно от 2 до 6.
Желательно, чтобы «один или несколько микобактериальных антигенов» отличались друг от друга и отличались от (слитых) гетероолигомерных партнеров. В рамках изобретения каждый дополнительный микобактериальный антиген независимо может быть нативным микобактериальным антигеном (например, полноразмерным антигеном) или его модифицированной версией (фрагментом или вариантом), при условии, что он сохраняет иммуногенные свойства (например, способность индуцировать клеточно-опосредованный иммунный ответ CD4+ и/или CD8+ и/или гуморальный ответ).
В предпочтительном воплощении один или несколько дополнительных микобактериальных антигенов независимо выбраны из группы, состоящей из антигенов активной фазы, фазы оживления и латентной фазы.
«Антигены активной фазы» обычно представляют собой ряд белков, которые в основном экспрессируются, когда микобактерия активно растет и реплицируется in vivo. В литературе описано большое количество микобактериальных антигенов активной фазы для применения в данном изобретении (например, Bertholet et al, 2008, J. Immunol. 181: 7948-57; Bertholet and al, 2010, Sci Transl Med 2: 53ra74). Репрезентативные примеры микобактериальных антигенов активной фазы включают Ag85A (Rv3804), Ag85В (Rv1886), Rv3619, Rv3620 и РРЕ белок Rv2608, но не ограничиваются ими.
«Антигены фазы оживления» относятся к любому антигену, который в основном экспрессируется или задействован в переходе между состоянием покоя и/или персистирующим состоянием к активному росту и репликации (активным состоянием микобактериальной инфекции). В литературе описано большое количество антигенов фазы оживления для применения в данном изобретении (например, Yeremeev et al, 2003, Infection and Immunity 71: 4789-94; Kana et al, 2008, Mol Microbiol 67: 672-84; and Commandeur et al, 2011, Clin Vaccine Immunol. 18: 676-83). Репрезентативные примеры микобактериальных антигенов фазы оживления включают RpfA, RpfB, RpfC, RpfD и RpfE, но не ограничиваются ими.
«Антигены латентной фазы» в основном экспрессируются во время фазы покоя (или персистирующей фазы) микобактериальной инфекции, обратимого состояния низкой метаболической активности, в котором микобактерия может персистировать в течение длительного периода времени. В литературе описано большое количество микобактериальных антигенов латентной фазы для применения в данном изобретении. Приведенные в качестве примера антигены латентной фазы Mtb представлены антигенами, которые кодируются DosR регулоном, который опосредует ответ бактерий на гипоксию и антигены голодания, которые активируются при недостатке питательных веществ (Singh et al, 2013, Vaccine, 2013.11.065; WO 03/000721; WO 03/004520; WO 03/035681; WO 2004/006952 and WO 2006/104389). Репрезентативные примеры микобактериальных антигенов латентной фазы включают Rv0081, Rv0111, Rv0198, Rv0569, Rv1733c, Rv1735, Rv1737, Rv1806, Rv1807, Rv1813, Rv2005c, Rv2029c, Rv2032, Rv2626, Rv2627, Rv2628, Rv2660c, Rv3407 и Rv3812, но не ограничиваются ими.
Подходящие иммуногенные комбинации по данному изобретению являются «мультифазными», т.е. содержат или кодируют микобактериальные антигены, и в частности антигены Mtb, по меньшей мере двух фаз инфекции (например, активной фазы и фазы оживления, активной и латентной фаз или фазы оживления и латентной фазы). Наиболее подходящие комбинации содержат или кодируют антигены Mtb трех фаз инфекции, при этом по меньшей мере один антиген относится к фазе активной инфекции, по меньшей мере один антиген относится к фазе латентной инфекции и по меньшей мере один антиген относится к фазе оживления инфекции.
Преимущественно, один или несколько микобактериальных антигенов, содержащихся или кодируемых иммуногенной комбинацией по данному изобретению, выбраны из группы, состоящей из Ag85A (Rv3804), Ag85В (Rv1886), Rv3619, Rv3620, RpfB, RpfD, Rv0081, Rv0111, Rv0198, Rv0569, Rv1733c, Rv1735, Rv1737, Rv1806, Rv1807, Rv1813, Rv2005c, Rv2029c, Rv2032, Rv2626, Rv2627, Rv2628, Rv2660c, Rv3407 и Rv3812. Предпочтительно, указанные дополнительные микобактериальные антигены выбраны из группы, состоящей из Ag85B (Rv1886), RpfB, RpfD, Rv1813, Rv2626 и Rv3407. Что касается гетероолигомерных микобактериальных антигенов, один или несколько дополнительных микобактериальных антигенов, применяемых в иммуногенной комбинации по данному изобретению, могут быть модифицированы по сравнению с соответствующими нативными микобактериальными антигенами. Репрезентативные примеры подходящих микобактериальных антигенов для применения в данном изобретении включают антиген Rv1813 (Rv1813*), представленный в SEQ ID NO: 3, модифицированный по сравнению с нативным аналогом путем делеции N-концевого сигнального пептида (от первого остатка и приблизительно до позиции 31); Ag85B (Ag85B**), представленный в SEQ ID NO: 4, модифицированный по сравнению с нативным аналогом путем делеции N-концевого сигнального пептида (от первого остатка и приблизительно до позиции 32), но не ограничиваются ими.
В более предпочтительном воплощении иммуногенная комбинация содержит или кодирует гибрид гетероолигомерных микобактериальных партнеров CFPIO и ESAT6, а также содержит или кодирует дополнительные микобактериальные антигены Rv2626 и Ag85B. Другая предпочтительная иммуногенная комбинация содержит или кодирует гибрид гетероолигомерных микобактериальных партнеров CFPIO и ESAT6 и гибрид гетероолигомерных партнеров ТВ10.4 и ТВ9.8, а также содержит или кодирует дополнительные микобактериальные антигены Rv2626, Ag85B, RpfB, RpfD, Rv3407 и Rv1813. Другая предпочтительная иммуногенная комбинация содержит или кодирует гетероолигомерные партнеры CFPIO и ESAT6, а также содержит или кодирует дополнительные микобактериальные антигены Rv2626, Ag85B, RpfB и RpfD. Еще одна предпочтительная иммуногенная комбинация содержит или кодирует гетероолигомерные партнеры Rv0287 и TBI 0.4, а также Rv3478 и Rv3477 и еще содержит или кодирует дополнительный микобактериальный антиген Rv3407.
В другом воплощении данное изобретение охватывает любое расположение микобактериальных антигенов, содержащихся или кодируемых иммуногенной комбинацией. При этом, дополнительные микобактериальные антигены могут присутствовать или экспрессироваться в форме отдельных полипептидов (например, смеси рекомбинантных антигенов Mtb) или в форме одного или нескольких слитых полипептидов (по меньшей мере двух ковалентно связанных дополнительных микобактериальных антигенов) или как отдельных антигенов, так гибридов. Другими словами, указанные дополнительные микобактериальные антигены могут экспрессироваться независимо (под контролем отдельных регуляторных элементов) или в виде гибрида по меньшей мере двух антигенов (например, благодаря ковалентному связыванию кодирующих молекул нуклеиновых кислот). Кроме того, кодирующие молекулы нуклеиновых кислот могут содержаться в одном или нескольких векторах. При этом для экспрессии различных микобактериальных антигенов или гибридов, описанных в данном документе, можно использовать векторы одного типа (например, два вектора MVA) или векторы различных типов (например, плазмидную ДНК и MVA).
Слитые полипептиды
В предпочтительном воплощении дополнительные микобактериальные антигены содержатся или кодируются иммуногенной комбинацией по изобретению в виде гибрида двух антигенов.
Примеры слитых полипептидов дополнительных микобактериальных антигенов включают Rv2626 и Ag85B; RpfB и RpfD, а также Rv3407 и Rv1813 (или любые их варианты или фрагменты). Что касается слияния гетероолигомерных партнеров, в рамках данного изобретения возможно любое их расположение. Например, гибрид, содержащий Rv3407 и Rv1813, может иметь Rv3407 на N-конце (Rv3407/1813), внутри или на С-конце (Rv1813/Rv3407).
Слитые полипептиды гетероолигомерных микобактериальных партнеров и/или дополнительных микобактериальных антигенов могут также содержать один или несколько других компонентов, которые могут происходить из видов Mycobacterium (например, дополнительные микобактериальные антигены) или быть гетерологичными (т.е. происходить из других источников, отличных от Mycobacterium). Они могут быть иммуногенными, однако предпочтительно, чтобы они были неиммуногенными. Примеры таких дополнительных компонентов включают линкеры, сайты расщепления, пептиды-таги, адресующие пептиды, трансмембранные домены, олигомеризационные домены, но не ограничиваются ими. В зависимости от микобактериального антигена, присутствие таких пептидов может быть полезным для улучшения экспрессии, фолдинга и/или иммуногенности получаемого антигена или гибрида, по сравнению с антигеном или гибридом, которые экспрессируются без таких пептидов. Улучшение экспрессии можно зарегистрировать при помощи стандартных методов, таких как Вестерн-блоттинг. Улучшение фолдинга можно зарегистрировать при помощи стандартных методов, таких как эксклюзионная хроматография (для различения растворимых и агрегированных белков). Улучшение иммуногенности можно зарегистрировать при помощи стандартных методов, таких как ELISpot (метод иммуноферментных пятен).
Например, может оказаться целесообразным встроить сайт расщепления между расположенными против хода транскрипции и по ходу транскрипции полипептидами, входящими в состав слитого полипептида, описанного в данном документе (гибрида гетероолигомерных партнеров и/или дополнительных микобактериальных антигенов). Такие сайты расщепления для применения в данном изобретении включают пептид 2А вируса ящура (F2A; SEQ ID NO: 5), пептид 2А вируса Thosea asigna (Т2А; SEQ ID NO: 6) и пептид вируса А конского ринита (Е2А; SEQ ID NO: 7), которые обладают саморасщепляющей активностью, но не ограничиваются ими. Такие пептиды 2А опосредуют ко-трансляционное расщепление их С-концевой области и предположительно заставляют рибосому пропускать синтез определенных пептидных связей, что нарушает непрерывность пептидного остова (Luke, 2012. Innovations in Biotechnology, Dr. Eddy C. Agbo (Ed.), ISBN: 978-953-51-0096-6, In Tech, доступно по адресу: http://www.intechopen.com/books/innovation-in-biotechnology/translating-2a-research-into-practice). Таким образом, рассчитывают, что получаемый в результате слитый белок позволит получить расположенный против хода транскрипции микобактериальный антиген, слитый с линкером, содержащим сайт расщепления, и расположенным по ходу транскрипции микобактериальным антигеном.
Дополнительно или альтернативно, любой применяемый здесь микобактериальный антиген или его гибрид может содержать адресующие пептид(ы), такие как сигнальные и/или трансмембранные пептиды. Данные адресующие пептиды хорошо известны в области техники (см., например, WO 99/03885). Вкратце, сигнальные пептиды (SS) обычно присутствуют на N-конце презентируемых на мембране или секретируемых полипептидов и запускают их прохождение в эндоплазматический ретикулум (ЭР). Они содержат 15 или более по существу гидрофобных аминокислот, которые затем удаляются специфической находящейся в ЭР эндопептидазой с образованием зрелого полипептида. Трансмембранные пептиды (ТМ) обычно по природе высоко гидрофобны и служат для закрепления полипептидов в клеточной мембране. Выбор трансмембранных и/или сигнальных пептидов, которые можно применять в рамках данного изобретения, обширен. Они могут быть получены из любых закрепленных в мембране и/или секретируемых полипептидов (например, клеточных или вирусных полипептидов), таких как иммуноглобулины, тканевой активатор плазминогена (тАП), инсулин, гликопротеин вируса бешенства, гликопротеин оболочки ВИЧ или белок F вируса кори или могут быть синтезированы. Предпочтительным сайтом встраивания сигнального пептида является N-конец, после кодона инициации трансляции, а предпочтительным сайтом встраивания трансмембранного пептида является С-конец, например, непосредственно перед стоп-кодоном.
Дополнительно или альтернативно, любой применяемый здесь микобактериальный антиген или его гибрид может содержать пептидную метку (таг) для улучшения его выделения и детекции или для облегчения идентификации клеток-хозяев, экспрессирующих такой антиген или гибрид. В рамках данного изобретения можно применять разнообразные пептидные метки, включая РК метку, FLAG метку, MYC метку, полигистидиновую метку (обычно последовательность из 5-10 остатков гистидина). Пептидные метки можно детектировать при помощи иммунологического анализа с использованием антител, направленных против метки, как описано в приведенных примерах. Пептидные метки могут быть независимо расположены на N-конце микобактериального антигена или гибрида (метка-полипептид) или в альтернативном случае, на его С-конце (полипептид-метка) или в альтернативном случае, когда используют несколько меток, внутри или в любом из указанных положений.
Примеры гибридов дополнительных микобактериальных антигенов для применения в данном изобретении включают полипептиды, содержащие или, в альтернативном случае, по существу состоящие из аминокислотной последовательности, которая идентична по меньшей мере на 70%, преимущественно по меньшей мере на 80%>, желательно по меньшей мере на 90%>, предпочтительно по меньшей мере на 95%, более предпочтительно на 98% и еще более предпочтительно на 100% любой аминокислотной последовательности, приведенной в SEQ ID NO: 8-12, но не ограничиваются ими. Более конкретно, SEQ ID NO: 8 представляет гибрид антигенов фазы оживления RpfB и RpfD, содержащий RpfB, который был модифицирован по отношению к нативному путем делеции сигнального пептида (от первого остатка до остатка, находящегося приблизительно в положении 29, и делеции каталитического домена, таким образом сохраняется RfpB приблизительно от позиции 30 до позиции 283), слитый с так называемым LD (доменом лизоцима, от англ. lysozyme domain) антигена RpfD, имеющим три мутации, внедренные с целью устранения сопутствующей ферментативной активности (например, E292K, Т315А и Q347A). SEQ ID NO: 9 и SEQ ID NO: 10 описывают гибрид Rv2626 с Ag85B**, который имеет (SEQ ID NO: 9: Rv2626/2A/Ag85B**) или не имеет (SEQ ID NO: 10: Rv2626/Ag85B**) сайта расщепления T2A. SEQ ID NO: 11 описывает гибрид Rv3407/E2A/Rv1813*, a SEQ ID NO: 12 - слитый полипептид Rv3407/Rv1813*, не имеющий сайта расщепления Е2А.
Как правило, иммуногенная комбинация по изобретению может быть получена с использованием стандартных методов. Например, микобактериальные антигены можно выделить, например, из бактериальной культуры или получить рекомбинантными способами в клетке-хозяине с помощью любой системы экспрессии, известной в области техники, или можно ввести индивидууму посредством клонирования молекулы кодирующей нуклеиновой кислоты в подходящий вектор экспрессии описанным в данном документе способом.
Кроме того, иммуногенная комбинация по изобретению может также содержать один или несколько иммуноактивирующих пептидов/полипептидов, способных улучшать иммуногенные свойства. В качестве примера можно привести кальретикулин (Cheng et al, 2001, J. Clin. Invest. 108: 669), белок теплового шока 70 (HSP70) Mtb (Chen et al, 2000, Cancer Res. 60: 1035), убиквитин (Rodriguez et al, 1997, J. Virol. 71: 8497), и такие эпитопы T хелперов, как пептид пан-Dr (Sidney et al, 1994, Immunity 1: 751), эпитоп pstSI GCG (Vordermeier et al, 1992, Eur. J. Immunol. 22: 2631), пептиды столбнячного токсина P2TT (Panina-Bordignon et al, 1989, Eur. J. Immunol. 19: 2237), P30TT (Demotz et al, 1993, Eur. J. Immunol. 23: 425), эпитоп гемагглютинина (Rothbard et al, 1989, Int. Immunol. 1: 479) и олигомеризационный домен C4bp (Spencer et al, 2012, PLos One 7:e33555). Такие иммуноактивирующие пептиды/полипептиды могут присутствовать или экспрессироваться независимо или входить в состав гибрида гетероолигомерных партнеров и/или дополнительных микобактериальных антигенов.
Молекулы нуклеиновых кислот и комбинации нуклеиновых кислот
В данном изобретении также предложена комбинация молекул нуклеиновых кислот, входящая в состав иммуногенной комбинации по изобретению, а также выделенные молекулы нуклеиновых кислот, кодирующих указанный гибрид микобактериальных гетероолигомерных партнеров и/или дополнительных микобактериальных антигенов.
В контексте данного изобретения термины «нуклеиновая кислота», «молекула нуклеиновой кислоты», «полинуклеотид» и «нуклеотидная последовательность» используются взаимозаменяемо и описывают полимер любой длины, состоящий либо из полидезоксирибонуклеотидов (ДНК) (например, кДНК, геномная ДНК, плазмиды, векторы, вирусные геномы, выделенная ДНК, зонды, праймеры и любые их смеси) или полирибонуклеотидов (например, мРНК, антисмысловая РНК) или смеси полирибо-полидезоксирибонуклеотидов. Они охватывают одно- или двуцепочечные, линейные или кольцевые нуклеиновые кислоты естественного или искусственного происхождения.
Как описано выше, молекулы нуклеиновых кислот по изобретению могут быть нативными нуклеиновыми кислотами (например, выделенными из генома или фрагмента генома Mycobacterium) или могут быть модифицированы человеком путем замены, делеции, добавления и/или вставки одного или нескольких нуклеотидов. Данное изобретение охватывает любые модификации, направленные на улучшение клонирования и/или экспрессии кодируемого полипептида и гибрида, а также его фолдинга, стабильности и/или иммуногенности. Когда планируют несколько модификаций, они могут затрагивать остатки, расположенные последовательно и/или не последовательно. Модификации, рассматриваемые в данном изобретении, охватывают консервативные модификации, которые не изменяют аминокислотной последовательности кодируемых микобактериальных антигенов и слитых полипептидов, а также модификации, которые транслируются в кодируемый полипептид. Предпочтительно модификации не усиливают иммуногенный потенциал получаемого полипептида по сравнению с немодифицированным. Репрезентативные примеры модификаций включают введение сайтов рестрикции, вырождение последовательности (например, для уменьшения гомологии между последовательностями молекул нуклеиновых кислот, используемых в рамках изобретения, или последовательности клетки-хозяина, способствующей генетической нестабильности) и/или для оптимизации нуклеотидной последовательности (например, для оптимизации трансляции в заданной клетке-хозяине) и/или для подавления потенциально негативных элементов (которые предположительно негативно влияют на уровень экспрессии), но не ограничиваются ими.
Например, может быть целесообразным оптимизировать частоту использования кодона для обеспечения высокого уровня экспрессии кодируемого генного продукта в конкретной клетке-хозяине или у индивидуума. Действительно, как показали наблюдения, если заданная аминокислота кодируется более чем одним кодоном, паттерн использования кодонов у организмов является далеко не случайным и использование кодонов у разных хозяев может существенно различаться. Поскольку нуклеотидные последовательности, используемые в изобретении, преимущественно имеют бактериальное происхождение, они могут иметь паттерн использования кодонов, неподходящий для эффективной экспрессии в таких клетках-хозяевах, как клетки высших эукариот. Обычно, оптимизацию кодонов производят путем замены одного или нескольких «нативных» (микобактериальных) кодонов, соответствующих кодону, редко используемому в интересующей клетке-хозяине, одним или несколькими кодонами, кодирующими ту же самую аминокислоту, которые используются чаще. Не обязательно заменять все нативные кодоны, соответствующие редко используемым кодонам, поскольку повышенная экспрессия может быть достигнута даже при частичной замене. Кроме того, для внедрения сайтов рестрикции в получаемую в результате молекулу нуклеиновой кислоты, допускаются некоторые отклонения от оптимизированного использования кодонов.
Особенно предпочтительное воплощение данного изобретения относится к молекулам нуклеиновых кислот, кодирующих любой из слитых полипептидов, приведенных в SEQ ID NO: 1, 2 и 8, наибольшее предпочтение отдается молекуле нуклеиновой кислоты, содержащей (в альтернативном случае по существу состоящей из или в альтернативном случае состоящей из) нуклеотидной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно на 95% и еще более предпочтительно на 100% любой нуклеотидной последовательности, приведенной в SEQ ID NO: 13-19, или любому ее варианту или фрагменту.
Молекулы нуклеиновых кислот по данному изобретению могут быть созданы с использованием информации о последовательности, доступной в области техники, и информации о последовательности, приведенной в данном документе. Например, они могут быть выделены при помощи общепринятых методов, хорошо известных в области техники, например, выделены при помощи ПЦР и/или клонированы при помощи стандартных методов молекулярной биологии из генома конкретных видов Mycobacterium или фрагментов их генома, кДНК и геномных библиотек или любого известного на уровне техники вектора, известного тем, что содержит их. В альтернативном случае молекулы нуклеиновых кислот по изобретению также могут быть получены путем химического синтеза в автоматизированных процессах (например, собраны из перекрывающихся синтетических олигонуклеотидов).
Другое воплощение изобретения относится к фрагментам молекул нуклеиновых кислот по изобретению, например, фрагментам, полученным с помощью рестрикционных эндонуклеаз и ПЦР. Такие фрагменты можно использовать в качестве зондов, праймеров или фрагментов, кодирующих соответствующие иммуногенные участки.
Векторы
Данное изобретение также относится к векторам, содержащим одну или несколько молекул нуклеиновых кислот по данному изобретению (кодирующим указанный гибрид гетероолигомерных микобактериальных антигенов и/или указанный слитый полипептид дополнительных микобактериальных антигенов) а также к композициям, содержащим такие векторы.
Термин «вектор» в данном документе обозначает носитель, преимущественно молекулу нуклеиновой кислоты или вирусную частицу, которая содержит элементы, необходимые для доставки, воспроизводства и/или экспрессии любой из молекул нуклеиновых кислот, описанных в данном документе, в клетке-хозяине или индивидууме. Данный термин охватывает векторы для поддержания (клонирующие векторы) или векторы для экспрессии в различных клетках-хозяевах или индивидуумах (экспрессирующие векторы), внехромосомные векторы (например, многокопийные плазмиды) или интегрирующие векторы (например, созданные для интеграции в геном клетки-хозяина и образования дополнительных копий молекул нуклеиновых кислот при репликации клетки-хозяина), а также челночные векторы (например, функционирующие как в хозяевах-прокариотах, так и в хозяевах-эукариотах) и переносящие векторы (например, для переноса молекул нуклеиновых кислот в вирусный геном). Для целей изобретения векторы могут иметь естественное происхождение, быть синтезированными или искусственными, или некоей комбинацией генных элементов естественного и искусственного происхождения.
В контексте изобретения термин «вектор» следует понимать широко, включая плазмиды и вирусные векторы. Векторы, подходящие для целей данного изобретения, включают бактериофаги, плазмидные или космидные векторы для экспрессии в прокариотических клетках-хозяевах, таких как бактерии (например, Е.coli, BCG или листерии), векторы для экспрессии в дрожжах (например, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Pichia pastoris), бакуловирусные векторы для экспрессии в системах клеток насекомых (например, клетках Sf 9), а также плазмиды и вирусные векторы для экспрессии в клетках высших эукариот или индивидуумах, но не ограничиваются ими. Обычно такие векторы доступны для приобретения (например, в компаниях Invitrogen, Stratagene, Amersham Biosciences, Promega и т.д.) или могут быть получены в депозитариях, таких как американская коллекция типовых культур (АТСС, Rockville, Md.) или являются предметом многочисленных публикаций, описывающих их последовательность, организацию и способы получения, позволяющих специалисту в данной области применять их. Данное изобретение также охватывает векторы (например, плазмидную ДНК) в комплексе с липидами или полимерами образующие корпускулярные структуры, такие как липосомы, липоплексы или наночастицы.
Термин «плазмидный вектор», используемый в данном документе, обозначает реплицируемую ДНК-конструкцию. Обычно плазмидные векторы содержат селективные маркеры, обеспечивающие позитивную или негативную селекцию клетки-хозяина, несущей плазмидный вектор, в присутствии соответствующего селективного препарата. В области техники известно большое число позитивных и негативных селективных маркеров. В качестве примера можно привести ген устойчивости к антибиотикам, который можно использовать как позитивный селективный маркер, обеспечивающий селекцию клетки-хозяина в присутствии соответствующего антибиотика. Репрезентативные примеры подходящих плазмидных векторов включают pREP4, рСЕР4 (Invitrogen), pCI (Promega), pVAX (Invitrogen) и pGWiz (Gene Therapy System Inc), но не ограничиваются ими.
Термин «вирусный вектор» в данном документе обозначает нуклеиновокислотный вектор, который включает в себя по меньшей мере один элемент вирусного генома и может быть упакован в вирусную частицу. Термины «вирус», «вирион», «вирусная частица», «векторная вирусная частица» используются взаимозаменяемо и обозначают вирусные частицы, которые образуются при трансдукции соответствующей клетки или клеточной линии нуклеиновокислотным вектором в соответствующих условиях, обеспечивая образование вирусных частиц. В контексте данного изобретения термин «вирусный вектор» следует понимать широко, включая нуклеиновокислотные векторы (например, векторы вирусной ДНК), а также образованные из них вирусные частицы. Термин «инфицирующий» обозначает способность вирусного вектора инфицировать и проникать в клетку-хозяина или индивидуума. Вирусные векторы могут быть репликативно-компетентными или селективными (например, созданными для лучшей или селективной репликации в определенных клетках- хозяевах) или могут быть генетически дезактивированы, и быть дефектными по репликации или иметь нарушенную репликацию.
Репрезентативные примеры подходящих вирусных векторов происходят из различных вирусов (например, ретровируса, аденовируса, адено-ассоциированного вируса (AAV), поксвируса, вируса герпеса, вируса кори, пенящего вируса, альфа-вируса, вируса везикулярного стоматита и т.д.). Как указано выше, термин «вирусный вектор» охватывает ДНК вектора, геномную ДНК, а также образованные из них вирусные частицы, и в частности, инфекционные вирусные частицы.
В одном воплощении вирусный вектор, применяемый в данном изобретении, является дефектным по репликации или имеет нарушенную репликацию, что означает, что он не способен реплицироваться в сколько-нибудь значимой степени в нормальных клетках (например, в нормальных человеческих клетках) или у индивидуума, которому его вводят (нарушение или дефект репликативной функции можно определить стандартными методами, например, путем оценки синтеза ДНК и/или вирусного титра в непермиссивных клетках). Для размножения таким дефектным по репликации векторам или векторам с нарушенной репликацией обычно требуются пермиссивные клеточные линии, которые усиливают или дополняют отсутствующие/нарушенные функции.
Примеры вирусных векторов, которые могут найти применение в рамках данного изобретения, включают аденовирусные векторы, которые имеют ряд хорошо задокументированных преимуществ при вакцинации, иммунотерапии, переносе генов или рекомбинантной продукции (обзор представлен в публикации "Adenoviral vectors for gene therapy", 2002, Ed D. Curiel and J. Douglas, Academic Press). Аденовирусные векторы по данному изобретению могут быть получены из разнообразных источников, которыми могут быть человек и животные (например, аденовирус собак, овец, обезьян и т.д.). Можно использовать любой серотип, однако наибольшее предпочтение отдается аденовирусам человека и особенно предпочтительны подрод С, например, Ad2, Ad5, Ad6, и подрод В, например, Adl I, Ad34 и Ad35. Также может быть целесообразно использовать аденовирусы животных, наиболее предпочтительно аденовирусы шимпанзе, такие как Ad3 и Ad63. Перечисленные аденовирусы могут быть получены из АТСС или являются предметом многочисленных публикаций, описывающих их последовательность, организацию и способы получения, позволяющих специалисту в данной области применять их (см., например, US 6,136,594; US 6,133,028; WO 00/50573; WO 00/70071; WO 2004/083418; WO 2004/097016 и WO 2005/071093).
Предпочтительные дефектные по репликации аденовирусные векторы являются дефектными по Е1, при этом делеция Е1 охватывает позиции приблизительно от 459 до 3328 или позиции приблизительно от 459 до 3510 (основываясь на последовательности Ad5, занесенной в базу данных GeneBank под номером доступа М 73260). Клонирующая способность может быть также улучшена путем делеции дополнительных участков аденовирусного генома (всей несущественной области Е3 или ее части (например, делеции приблизительно от позиции 27867 до 30743) или других существенных областей Е2 и/или Е4 согласно описанию WO 94/28152 и Lusky et al, 1998, J. Virol 72: 2022).
Молекулы нуклеиновых кислот по данному изобретению могут быть независимо встроены в любое положение аденовирусного генома, особенно предпочтительной для встраивания является замена областей Е1 и/или Е3. Они могут располагаться в смысловой или антисмысловой ориентации относительно естественного направления транскрипции интересующей области.
Другие примеры вирусных векторов, наиболее подходящих для целей изобретения, включают поксвирусные векторы, такие как векторы fowlpox (например, FP9), векторы сапагурох (например, ALVAC) и векторы вируса vaccinia, последние предпочтительны. Подходящие вирусы vaccinia включают штаммы Copenhagen, Wyeth, NYVAC (US 5,494,807) и модифицированный штамм Ankara (MVA) (Antoine et al, 1998, Virol. 244: 365; WO 02/42480). Общие условия для конструирования и получения рекомбинантных поксвирусов хорошо известны в области техники (см., например, WO 2010/130753; WO 03/008533; US 6,998,252; US 5,972,597 и US 6,440,422). Молекулы нуклеиновых кислот по данному изобретению предпочтительно встраивают в геном поксвируса в несущественный локус. Ген тимидиновой киназы особенно подходит для встраивания в векторы vaccinia Copenhagen, а делеции II или III для встраивания в вектор MVA (WO 97/02355).
Другими вирусными векторами, подходящими для целей данного изобретения, являются morbillivirus, которые относятся к семейству paramyxoviridae, особенное предпочтение относится к вирусу кори. В области техники существуют различные аттенуированные штаммы (Brandler et al, 2008, CIMID, 31: 271; Singh et al, 1999, J. virol. 73(6): 4823), такие как штаммы Edmonston А и В (Griffin et al, 2001, Field's in Virology, 1401-1441), штамм Schwarz (Schwarz A, 1962, Am J Dis Child, 103: 216), штаммы S-191 или C-47 (Zhang et al, 2009, J Med Virol. 81 (8): 1477), данный перечень не является исчерпывающим. Наиболее целесообразным является встраивание между генами Р и М или между генами Н и L.
Подходящие для применения в данном изобретении векторы также включают бактериальные клетки, которые могут быть дикого типа или мутантными (например, авирулентными). Хорошо известные примеры таких бактериальных клеток включают микобактерии (например, Mycobacterium bovis BCG), лактобациллы (например, Lactococcus lactis), листерии (например, Listeria monocytogenes) и другие микроорганизмы, такие как Salmonella и Pseudomona, но не ограничиваются ими. Предпочтительное воплощение относится к вектору BCG, в геном которого встроена молекула (молекулы) нуклеиновой кислоты, кодирующая (кодирующие) один или несколько микобактериальных антигенов или слитых полипептидов, описанных выше, таким образом, что вектор BCG экспрессирует указанные элементы.
В одном воплощении молекулы нуклеиновой кислоты, входящие в состав иммуногенной комбинации по изобретению, находятся в одном векторе. В альтернативном случае, они могут находиться в двух или более векторах, которые можно вводить индивидууму одновременно или последовательно.
Согласно данному изобретению, молекулы нуклеиновой кислоты, содержащиеся в векторе по изобретению, находятся в форме, подходящей для экспрессии в клетке-хозяине или в индивидууме, что означает, что молекулы нуклеиновой кислоты, изложенные в данном документе, функционально связаны с соответствующими регуляторными последовательностями. В данном описании термин «регуляторные элементы» или «регуляторные последовательности» относится к любым элементам, которые обеспечивают, вносят вклад или регулируют экспрессию молекул нуклеиновой кислоты в заданной клетке-хозяине или индивидууме, включая репликацию, удвоение, транскрипцию, сплайсинг, трансляцию, стабильность и/или транспорт нуклеиновых кислот или их производных (т.е. мРНК). Специалист в данной области понимает, что выбор регуляторной последовательности зависит от таких факторов, как сам вектор, клетка-хозяин или индивидуум, уровень желаемой экспрессии и т.д. «Функционально связанный» означает, что связанные элементы расположены таким образом, что они функционируют согласованно для выполнения своего предназначения. Например, промотор функционально связан с молекулой нуклеиновой кислоты, если промотор осуществляет транскрипцию от инициации транскрипции до терминации, обеспечивая экспрессию кодируемой последовательности, присутствующей в молекуле нуклеиновой кислоты, в пермиссивной клетке-хозяине.
В частности, молекулы нуклеиновой кислоты, входящие в состав иммуногенной комбинации по данному изобретению, находятся под транскрипционным контролем промотора, подходящего для обеспечения экспрессии кодируемых полипептидов и/или гибридов, а следовательно, дополнительных микобактериальных антигенов в клетке млекопитающего. В рамках изобретения промотор может быть конститутивным, направляющим экспрессию функционально связанной молекулы нуклеиновой кислоты во многих типах клеток-хозяев или в определенных клетках-хозяевах (например, регуляторные последовательности, специфичные для легких), или регулируемым в ответ на определенные события или экзогенные факторы (например, температуру, питательные добавки, гормоны и т.д.) или согласно фазам вирусного цикла (например, ранний или поздний). Также можно использовать промоторы, которые подвергаются репрессии на этапе продукции в ответ на определенные события или экзогенные факторы, для оптимизации продукции вектора и во избежание потенциальной токсичности экспрессируемых полипептидов.
Промоторы, подходящие для конститутивной экспрессии в клетках млекопитающих включают немедленный ранний промотор цитомегаловируса (CMV) (US 5,168,062), промотор RSV, основной поздний промотор аденовируса, промотор фосфоглицерокиназы (PGK), промотор тимидинкиназы (ТK) вируса простого герпеса (HSV)-I и промотор Т7 полимеразы, но не ограничиваются ими. В хозяевах-прокариотах можно использовать такие промоторы, как промоторы trp, lac, промоторы фагов, тРНК и гликолитических ферментов. Подходящие промоторы дрожжей включают промоторные области металлотионеина, 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза или глицеральдегид-3-фосфатдегидрогеназа, ферментов, отвечающих за утилизацию мальтозы и галактозы. Промоторы вируса Vaccinia наиболее подходят для экспрессии в поксвирусных векторах. Репрезентативные примеры включают промоторы vaccinia 7.5K, H5R, B2R, A35R, 11K7.5 (Erbs et al, 2008, Cancer Gene Ther. 15: 18), промоторы TK, p28, pi 1 и KIL, а также синтетические промоторы, такие как описанные Chakrabarti et al. (1997, Biotechniques 23: 1094-7; Hammond et al, 1997, J. Virol Methods 66: 135-8; и Kumar and Boyle, 1990, Virology 179: 151-8), a также ранние/поздние химерные промоторы (например, pSE/L), но не ограничиваются ими. Промоторы, подходящие для экспрессии, опосредуемой вирусом кори, включают любые промоторы, направляющие экспрессию транскрипционных единиц вируса кори (Brandler and Tangy, 2008, CIMID 31: 271), но не ограничиваются ими.
Специалисту в области техники понятно, что регуляторные элементы, контролирующие экспрессию молекул нуклеиновой кислоты по изобретению, могут также содержать дополнительные элементы для корректной инициации, регуляции и/или терминации транскрипции (например, последовательности терминации транскрипции полиА), транспорта мРНК (например, последовательности сигнала ядерной локализации), процессинга (например, сигналы сплайсинга) и стабильности (например, интроны и некодирующие 5' и 3' последовательности), трансляции (например, инициирующий Met, трехчленную лидерную последовательность, сайты связывания рибосомы IRES, последовательности Шайн-Дальгарно и т.д.) в клетке-хозяине или индивидууме, а также для выделения (например, метки (таги), описанные в данном документе).
Особенно предпочтительные воплощения изобретения относятся к вектору (или его вирусной частице), выбранной из группы, состоящей из:
(i) вектора, содержащего молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные партнеры ESAT-6 и CFP10, молекулу нуклеиновой кислоты, кодирующую Ag85B, и молекулу нуклеиновой кислоты, кодирующую Rv2626;
(ii) вектора, содержащего молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные партнеры ESAT-6 и CFP10, молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные партнеры ТВ10.4 и ТВ9.8, молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены Rv2626 и Ag85B; молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены RpfB и RpfD, и молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены Rv3407 и Rv1813 (как показано на примере MVATG18598 в разделе Примеры) и
(iii) вектора, содержащего комбинацию молекул нуклеиновых кислот, кодирующих гетероолигомерные партнеры ESAT-6 и CFP10 и дополнительные микобактериальные антигены Ag85B, Rv2626, RpfB и RpfD (как показано на примере MVATG18597 в разделе Примеры).
Более предпочтительно, вектор, описанный выше, представляет собой вектор MVA.
Согласно предпочтительному воплощению, вектор по изобретению находится в форме инфекционных вирусных частиц. Обычно такие вирусные частицы получают при помощи процесса, включающего стадии (i) внедрения вирусного вектора по изобретению в клетку-продуцент, (ii) культивирования указанной клетки-продуцента в подходящих условиях, обеспечивающих продукцию указанной инфекционной вирусной частицы, (iii) выделения полученной вирусной частицы из культуры указанной клетки-продуцента и (iv) возможно, очистку указанной выделенной вирусной частицы.
В случаях, когда вирусный вектор является дефектным по репликации или имеет нарушенную репликацию, частицы обычно получают в пермиссивных клетках-продуцентах или с использованием вируса-помощника, который комплементирует отсутствующие/нарушенные функции. Например, подходящие клетки-продуценты для дополнения аденовирусных векторов с делецией Е1 включают клетки 293 (Graham et al, 1997, J. Gen. Virol. 36: 59-72), а также клетки HER-96 и PER-C6 (например, Fallaux et al, 1998, Human Gene Ther. 9: 1909-17; WO 97/00326) или любые производные этих клеточных линий. Для репродукции поксвирусных векторов особенно подходят клетки птиц, включая первичные фибробласты куриных эмбрионов (CEF, от англ. chicken embryo fibroblasts), полученные из куриных эмбрионов, полученных из оплодотворенных яиц, а также линии клеток утки (например, описанные в WO 03/076601, WO 2009/004016, WO 2010/130756 и WO 2012/001075), но не ограничиваясь ими.
Инфекционные вирусные частицы могут быть выделены из культуральной надосадочной жидкости и/или из клеток-продуцентов после лизиса. Их можно в дальнейшем очистить с помощью стандартных методов (хроматографии, ультрацентрифугирования и т.д.).
Данное изобретение также охватывает векторы или вирусные частицы, которые были модифицированы для обеспечения предпочтительной направленной доставки в определенные клетки-хозяева. Характерным признаком векторов для направленной доставки является наличие на их поверхности лиганда, способного распознавать и связываться с клеточным и экспонированным на поверхности компонентом, таким как клеточно-специфичный маркер (например, клетка, инфицированная микобактерией), тканеспецифичный маркер (например, маркер, специфичный для легкого) и т.д. Примеры подходящих лигандов включают антитела или их фрагменты, направленные против домена микобактериального антигена. Направленную доставку можно осуществлять путем генноинженерного встраивания лиганда в полипептид, находящийся на поверхности вируса (например, фибры аденовируса, пентон, pIX или продукт гена р14).
Клетки-хозяева и способы получения
В другом аспекте изобретение также относится к клеткам-хозяевам, которые содержат иммуногенные комбинации, слитые полипептиды, молекулы нуклеиновых кислот или векторы (например, вирусные частицы) по изобретению, а также к композициям, содержащим такие клетки-хозяева.
В данном описании термин «клетка-хозяин» следует понимать в широком смысле, не ограничиваясь клетками, организованными в какие-либо конкретные ткани, органы, или выделенными клетками. Такие клетки могут быть уникальным типом клеток или группой различных типов клеток, такими как культивируемые клеточные линии, первичные клетки и пролиферативные клетки. Изобретение охватывает прокариотические клетки-хозяева, низшие эукариотические клетки- хозяева, такие как дрожжи, и другие эукариотические клетки-хозяева, такие как клетки насекомых, растений и млекопитающих (например, человеческие или не являющиеся человеческими), а также клетки-продуценты, способные продуцировать вектор по изобретению (например, клетки 293, HER96, PERC.6, CEF, линии клеток утки и т.д.). Данный термин также включает клетки, которые могут быть или были реципиентом вектора, описанного в данном документе, а также потомство таких клеток.
Согласно определенному воплощению изобретения, клетка-хозяин также может быть инкапсулирована. Технология инкапсуляции клеток хорошо известна в области техники.
Еще одним аспектом данного изобретения является способ рекомбинантной продукции микобактериальных антигенов (например, гибридов гетероолигомерных партнеров и/или дополнительных микобактериальных антигенов, содержащихся или кодируемых иммуногенной комбинацией, в котором используются векторы (или инфекционные вирусные частицы) и/или клетки-хозяева по изобретению. Как правило, способ включает стадии (i) введения вектора в подходящую клетку- хозяина для получения трансфецированной или инфицированной клетки-хозяина, (ii) культивирования in-vitro указанной трансфецированной или инфицированной клетки-хозяина в условиях, подходящих для роста клетки-хозяина, (iii) выделения культуры клеток и (iv) возможно, очистки микобактериальных антигенов, выделенных из культуры клеток.
Специалисту в данной области техники известны многочисленные системы экспрессии, существующие в области техники для экспрессии полипептидов, а также способы введения вектора в клетку-хозяина. Такие способы включают микроинъекции, CaPO4-опосредованную трансфекцию, ДЭАЭ-декстран-опосредованную трансфекцию, электропорацию, липофекцию/слияние липосом, генную пушку, трансдукцию, инфицирование вирусами, а также непосредственное введение в организм-хозяин различными способами, но не ограничиваются ими. Способ можно также применять в сочетании со стандартными реагентами для трансфекции, которые облегчают введение нуклеиновых кислот в клетки-хозяева, такие как поликатионные полимеры (например, хитозан, полиметакрилат, ПЭИ и т.д.) и катионные липиды (например, DC-Chol/DOPE, трансфектам, липофектин и т.д.).
Клетки-хозяева можно культивировать в стандартных биореакторах для ферментации, флаконах и чашках Петри. Культивирование можно проводить при температуре, рН и содержании кислорода, подходящих для заданной клетки- хозяина. В данном документе не будут подробно описываться различные системы для экспрессии в клетках прокариот и эукариот, существующие в области техники.
В предпочтительном воплощении в способе используют клетку-хозяина Е.coli, и в частности, штамм Е.coli, несущий в своем геноме профаг D13, обеспечивающий индуцибельную экспрессию полимеразы Т7 в присутствии лактозы или аналога лактозы (например, ИПТГ: изопропил-b-D-1-тиогалактопиранозида). Такие штаммы можно приобрести у различных производителей (например, Lucigen, Merck и др.). После введения плазмиды трансформированные клетки Е.coli можно культивировать при температуре, находящейся приблизительно между 18°C и 39°C (особенно предпочтительно при температуре приблизительно 30°C или приблизительно 37°C) в течение периода времени, варьирующего от 6 до 48 часов (особенно предпочтительно от приблизительно 8 до приблизительно 24 ч) в стандартной среде, адаптированной для маркера селекции вектора (например, в присутствии антибиотика) и для штамма-хозяина (например, в присутствии индуктора, такого как ИПТГ). Выделенную культуру клеток можно лизировать (например, применить химический лизис с использованием детергента, соникации и т.д.). После центрифугирования клеточного лизата можно собрать как супернатант, так и осадок для последующего анализа (например, при помощи электрофореза в полиакриламидном геле в присутствии ДСН) для оценки уровня экспрессии, а также растворимости экспрессированного материала (например, растворимое вещество может находиться в супернатанте клеточного лизата, а нерастворимое вещество может захватываться тельцами включения).
Микобактериальные антигены и/или их гибриды можно выделить из культуральной надосадочной жидкости и/или из клетки-хозяина (например, после лизиса клетки). Выделенный материал можно очистить с помощью хорошо известных способов очистки, включая преципитацию сульфатом аммония, экстрагирование кислотами, гель-электрофорез, фильтрацию и хроматографические методы (например, обращенно-фазовую, эксклюзионную, ионообменную, аффинную хроматографию, хроматографию с гидрофобным взаимодействием, гидроксиапатитную, высокоэффективную жидкостную хроматографию и т.д.). Используемые условия и методы будут зависеть от таких факторов, как суммарный заряд, молекулярная масса, гидрофобность, гидрофильность, и будут очевидны для специалиста в данной области. Кроме того, степень очистки будет зависеть от предполагаемого применения. Например, концентрацию белка можно оценить методом Бредфорда (Biorad), уровень эндотоксина можно оценить с использованием таких средств, как портативные тест-системы (Charles River Laboratories), а массу очищенных полипептидов можно определить с помощью методов матрично-активированной лазерной десорбции/ионизации (MALDI, от англ. Matrix-Assisted Laser Desorption/lonisation) или электрораспылительных методов.
Композиции
В другом аспекте изобретения предложена композиция, содержащая по меньшей мере одно из следующего: иммуногенную комбинацию, слитый полипептид, молекулу нуклеиновой кислоты, вектор(ы) (например, инфекционные вирусные частицы) или клетки-хозяева, описанные в данном документе (также обозначаемые здесь «активным агентом») или любую их комбинацию (например, комбинацию различных полипептидов или векторов/вирусных частиц). Предпочтительно, композиция представляет собой фармацевтическую композицию, которая содержит помимо терапевтически эффективного количества активного агента один или несколько фармацевтически приемлемых наполнителей.
В данном описании «фармацевтически приемлемый наполнитель» охватывает любые возможные носители, растворители, разбавители, эксцпиенты, адъюванты, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, замедляющие всасывание агенты и т.п., совместимые с введением индивидууму, и в частности, человеку.
В данном описании «терапевтически эффективное количество» обозначает дозу, достаточную для предполагаемого применения. Когда речь идет о профилактике, данный термин обозначает дозу, необходимую для предупреждения или отсрочки возникновения и/или развития микобактериальной инфекции (например, Mtb инфекции). Для «терапевтического» применения композицию вводят индивидууму уже инфицированному видами Mycobacterium с целью лечения активного заболевания или предупреждения реактивации у индивидуумов с латентной инфекцией, возможно в комбинации с одним или несколькими стандартными терапевтическими средствами. В частности, терапевтически эффективное количество композиции по изобретению может быть таким количеством, которое необходимо для индукции или стимуляции иммунной системы у индивидуума, которому осуществляют введение (например, которое приведет к развитию врожденного и/или специфического иммунного ответа).
Индивидуум, подлежащий лечению, может быть новорожденным, ребенком, подростком или взрослым. Индивидуум может быть ранее иммунизирован бациллой Кальметта-Герена (BCG) или ранее получать лечение от микобактериальной инфекции до начала лечения активными агентами, описанными в данном документе. Он может иметь или не иметь сопутствующей инфекции другим патогенным организмом (например, вирусом иммунодефицита человека (ВИЧ)).
В частности, индивидуум, подлежащий лечению, инфицирован вирулентым видом Mycobacterium (например, Mtb), который может быть устойчивым к лекарствам штаммом (например, MDR, XDR или TDR). Инфицирующая микобактерия может быть таким же штаммом или изолятом, как и любая микобактерия, от которой происходят антигены, содержащиеся или кодируемые активным агентом, используемым в данном изобретении, или она может относиться к другому штамму или изоляту.
Композиция по изобретению соответствующим образом забуферена, чтобы подходить для применения у человека или животного, и имеет физиологическое или слегка щелочное значение рН (например, рН приблизительно от 7 приблизительно до 9). Подходящие буферы включают фосфатный буфер (например, ФСБ), бикарбонатный буфер и/или Трис-буфер, но не ограничиваются ими.
Композиция по изобретению может дополнительно содержать разбавитель, подходящий для применения у человека или животного. Предпочтительно, он является изотоническим, гипотоническим или слабо гипертоническим и имеет относительно слабую ионную силу. Репрезентативные примеры включают стерильную воду, физиологический раствор (например, хлорид натрия), раствор Рингера, растворы глюкозы, трегалозы или сахарозы, раствор Хенкса и другие водные физиологически сбалансированные солевые растворы (см., например, последнее издание Remington: The Science and Practice of Pharmacy, A. Gennaro, Lippincott, Williams&Wilkins).
Дополнительные фармацевтически приемлемые эксципиенты могут применяться для обеспечения желаемых фармацевтических или фармакодинамических свойств, включая например, модификацию или поддержание рН, осмолярности, вязкости, прозрачности, окраски, стерильности, стабильности, скорости растворения состава, модификации или поддержания высвобождения или абсорбции в организме человека или животного, облегчения транспорта через кровяной барьер или проникновения в конкретный орган (например, в легкое).
Кроме того, композиция по изобретению может содержать один или более адъювантов, подходящих для системного введения или введения в слизистую оболочку человека. Предпочтительно, адъювант способен стимулировать иммунный ответ на композицию по изобретению, в частности иммунный ответ, опосредованный Т-клетками, например, через toll-подобные рецепторы (TLR), такие как TLR-7, TLR-8 и TLR-9. Репрезентативные примеры подходящих адъювантов включают алюминиевые квасцы, эмульсию минерального масла, такую как полный и неполный адъювант Фрейнда (IFA, от англ. incomplete Freunds adjuvant), липополисахариды или их производные (Ribi et al., 1986, Immunology and Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, p407-419), сапонины, такие как QS21 (WO 98/56415), соединения имидазо-холина, такие как Imiquimod (WO 2007/147529), цитозинфосфатгуанозиновые олигонуклеотиды, такие как CpG, и катионные пептиды, такие как IC-31 (Kritsch et al., 2005, J. Chromatogr Anal. Technol Biomed Life Sci 822: 263) или любые их производные.
Фармацевтически приемлемые носители, входящие в состав композиции по изобретению, должны также обеспечивать сохранение ее стабильности в условиях изготовления и длительного хранения (т.е. по меньшей мере в течение одного месяца, предпочтительно по меньшей мере в течение одного года) при замораживании (например, -70°C, -20°C), охлаждении (например, 4°C) или при температуре окружающей среды. Такие «рассчитанные на длительное время» композиции известны в области техники (например, WO 98/02522; WO 03/053463). В качестве примера можно привести (а) 1М сахарозу, 150 мМ NaCl, 1 мМ MgCl2, 54 мг/л Tween 80, 10 мМ Трис рН 8,5, (б) 10 мг/мл маннит, 1 мг/мл альбумин сыворотки человека, 20 мМ Трис, рН 7,2 и 150 мМ NaCl и (в) физиологический раствор, которые лучше всего подходят для композиции по изобретению.
Композиция по изобретению может быть в различных формах, например, твердой, жидкой или замороженной. Твердые (например, сухие порошковые или лиофилизированные) композиции могут быть получены с помощью процесса, включающего вакуумную сушку и сублимационную сушку. В конкретном воплощении композиция по изобретению составлена для доставки в респираторный тракт (например, путем ингаляции, интраназальным или внутрилегочным способом) в высушенной распылением форме (см., например, WO 2010/135495) или в форме мелких капель (особенно предпочтительны мелкие капли, имеющие средний диаметр 100-5000 мкм).
Иммуногенная комбинация, слитый полипептид, молекула нуклеиновой кислоты, вектор, клетка-хозяин или композиция по данному изобретению подходят для разных способов введения. В рамках изобретения может использоваться любой общепринятый путь введения, включая системное, местное введение или введение в слизистую оболочку.
Системное введение включает, например, подкожную, внутрикожную, внутримышечную, внутривенную, внутрибрюшинную, внутрисосудистую, внутриартериальную инъекцию, а также скарификацию. Инъекции могут осуществляться с использованием стандартных шприцев и игл, или любых других подходящих средств, известных в области техники (например, электропорации). Введение в слизистую оболочку включает пероральное/алиментарное, интраназальное, интратрахеальное, внутрилегочное, интравагинальное или интраректальное введение, но не ограничивается ими. Введение в респираторный тракт можно осуществлять пульверизацией или распылением капель, аэрозоля или сухой порошковой композиции с использованием соответствующего диспенсера. Местное введение также можно осуществлять с использованием чрескожных средств (например, пластыря и т.п.). Внутримышечное, внутрикожное и подкожное введение, а также интраназальное, интратрахеальное и внутрилегочное введение наиболее предпочтительны в рамках изобретения.
Подходящая дозировка может быть адаптирована в зависимости от различных параметров, в частности активного агента, входящего в состав композиции, способа введения, возраста, состояния здоровья и веса индивидуума, природы и степени выраженности симптомов; сопутствующего лечения; регулярности лечения и/или потребности в профилактике или лечении. Дальнейшее уточнение расчетов, необходимое для определения соответствующей дозировки для лечения, обычно выполняет практикующий врач, с учетом соответствующих обстоятельств.
В качестве базового руководства можно привести следующую информацию: подходящая дозировка для композиции, содержащей вектор, варьирует приблизительно от 104 приблизительно до 1013 ВЧ (вирусных частиц), ИЕ (инфекционных единиц) или БОЕ (бляшкообразующих единиц), в зависимости от вектора и использованного способа количественной оценки. Способы, существующие для оценки количества ВЧ, ИЕ и БОЕ, присутствующих в образце, являются стандартными в области техники. Например, количество аденовирусных частиц (ВЧ) обычно определяют по поглощению А260 или при помощи ВЭЖХ, титр ИЕ определяют путем количественного измерения иммунофлуоресценции ДНК-связывающего белка, а БОЕ определяют путем подсчета количества бляшек после инфицирования пермиссивных клеток. Предпочтительно, соотношение ВЧ/ИЕ составляет менее 100, в соответствии с рекомендациями FDA (Федерального управления по контролю качества пищевых продуктов и лекарственных средств). Предпочтительные дозы содержат приблизительно от 105 до приблизительно 1012 ВЧ аденовирусного вектора (например, приблизительно 5×108, приблизительно 109, приблизительно 5×109, приблизительно 1010, приблизительно 5×1010 ВЧ или приблизительно 1011 ВЧ). Дозы приблизительно от 5×105 приблизительно до 109 БОЕ предпочтительны для композиций на основе вируса Vaccinia (MVA), особенно предпочтительны дозы приблизительно 5×106, приблизительно 107, приблизительно 5×107, приблизительно 108 или приблизительно 5×108 БОЕ. Дозы приблизительно от 5×104 приблизительно до 107 БОЕ предпочтительны для композиций на основе вируса кори, особенно предпочтительны дозы приблизительно 105, 5×105, 106 или 5×106 БОЕ. Композиции на основе плазмидного вектора можно вводить в дозах между 10 мкг и 20 мг, преимущественно между 100 мкг и 2 мг. Белковую композицию можно вводить в одной или более дозах между 10 мкг и 20 мг, особенно предпочтительны дозы приблизительно от 0,1 мг приблизительно до 2 мг каждого микобактериального антигена, входящего в состав композиции, на кг веса тела.
Можно вводить однократную дозу или осуществлять повторное введение через определенный интервал времени. Повторные введения (2, 3, 4, 5, 6, 7, 8, 9, 10 и т.д.) могут разделяться одно от другого соответствующими временными интервалами и выполняться тем же способом или иным способом введения, как в том же участке, так и в различных участках. Кроме того, при каждом введении можно использовать одни и те же или различные активные агенты. Например, два или три подкожных введения, отделенные друг от друга приблизительно недельным промежутком времени (например, от 3 до 10 дней), особенно подходят для композиций на основе MVA, тогда как одно или два внутримышечных введения особенно подходят для композиций на основе аденовируса, вируса кори и плазмид. Также возможно осуществлять несколько последовательных циклов введений (например, цикл введений раз в неделю), которые повторяются после периода отдыха. За первой серией введений может следовать одно или более последующих введений (например, спустя период времени от 4 месяцев до года), чтобы вызвать из памяти анти-микобактериальный иммунный ответ, возникший после первого контакта с антигеном.
В конкретном воплощении введение можно осуществлять согласно режиму прайм-буст, который включает последовательное введение одной или нескольких примирующих композиций и одной или нескольких бустерных композиций. Как правило, в примирующих и бустерных композициях используют различные активные агенты, которые содержат или кодируют по меньшей мере общий микобактериальный антиген, иммуногенный домен или эпитоп. Примирующие и бустерные композиции можно вводить в один и тот же участок или в альтернативные участки одним и тем же или различными способами. Например, композиции на основе полипептида можно вводить через слизистую, в то время как композиции на основе векторов предпочтительно вводить, например, путем подкожных или внутримышечных инъекций. Например, можно рассматривать примирование ответа хозяина с использованием живой аттенуированной бактерии (такой как BCG) и бустерное введение с использованием по меньшей мере одного «активного агента», описанного в данном изобретении (например, иммуногенной комбинации, слитого полипептида, молекулы нуклеиновой кислоты, вектора (например, инфекционной вирусной частицы) или клетки-хозяина по изобретению или любой их комбинации).
Профилактическое и терапевтическое применение
Иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению предпочтительно применяют для предупреждения или лечения микобактериальной инфекции или любого заболевания и патологического состояния, вызванного или ассоциированного с ней. Такое применение направлено на индукцию или стимулирование защитного иммунного ответа против микобактериального антигена/эпитопа.
В одном воплощении иммуногенная комбинация, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению предназначены для применения в способах предупреждения инфекции или откладывания риска микобактериальной инфекции у нуждающегося в этом индивидуума, особенно у индивидуума, который находился в тесном контакте с инфицированным индивидуумом, у которого развилось активное заболевание, и следовательно, имеющего риск развития микобактериальной инфекции (например, передачи путем ингаляции бацилл в каплях влаги, выделившихся при кашле индивидуума, страдающего туберкулезом).
В другом воплощении иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению применяют в способах лечения активного заболевания у индивидуума, инфицированного видом Mycobacterium, и особенно Mtb, способ включает стадию введения инфицированному индивидууму, у которого развилось активное заболевание, терапевтически эффективного количества иммуногенной комбинации, гибрида(ов), молекулы нуклеиновой кислоты, вектора, клетки-хозяина или композиции, описанных в данном документе, для индукции иммунного ответа против инфицирующего вида Mycobacterium, таким образом откладывая или снижая риск развития активного заболевания.
«Активное заболевание» обозначает микобактериальную инфекцию с манифестацией выраженных симптомов заболевания. Например, у человека, туберкулез характеризуется неспецифическими клиническими признаками (такими как потеря веса, астения, лихорадка, ночной пот), клиническими признаками и/или симптомами (такими как кашель, кровохарканье, боль в груди в случае легочной формы туберкулеза) и/или в некоторых случаях, внелегочными признаками, зависящими от локализации инфекции (такими как поражение лимфоузлов, костные формы, менингит, урогенитальные формы).
В другом воплощении иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению применяют в способах предупреждения или лечения реактивации у индивидуума с латентной микобактериальной инфекцией, в частности, инфицированного М.tuberculosis, способ включает стадию введения указанному латентно инфицированному индивидууму терапевтически эффективного количества иммуногенной комбинации, гибрида(ов), молекулы нуклеиновой кислоты, вектора, клетки-хозяина или композиции, описанных в данном документе, для индукции иммунного ответа против инфицирующего вида Mycobacterium, таким образом предупреждая или откладывая реактивацию.
Под «латентно инфицированным индивидуумом» понимают индивидуума, который уже инфицирован вирулентным видом Mycobacterium (например, Mtb), но не имеет манифестных признаков или клинических симптомов заболевания. Как правило, латентно инфицированный индивидуум, в организме которого присутствуют микобактерии, не является больным с клинической точки зрения, но имеет риск последующего прогрессирования в направлении клинического заболевания (реактивации), особенно в случае угнетения иммунитета (например, при ко-инфекции другим патогеном, таким как ВИЧ, или на фоне иммуносупрессивной терапии, например, ингибиторами TNFa). Латентно инфицированный Mtb индивидуум будет ожидаемо иметь положительные результаты анализов при любом исследовании, позволяющем диагностировать инфекцию Mtb (например, в туберкулиновой пробе, реакции Манту и/или анализе высвобождения интерферона гамма).
Термин «реактивация» относится к более поздней манифестации симптомов заболевания, ассоциированного с микобактериями, у индивидуума, у которого результаты анализов на микобактериальную инфекцию оказываются положительными, но отсутствуют явные симптомы заболевания. Например, реактивация может произойти у инфицированного индивидуума, у которого симптомы активного заболевания ранее могли манифестировать или не манифестировать, или который прошел лечение, достаточное для того, чтобы инфекция перешла в латентное состояние. Например, у индивидуума, инфицированного Mtb, который ранее прошел иммунизацию BCG, или ранее получал лечение от инфекции Mtb (например, одним или несколькими химиотерапевтическими препаратами «первой линии».
В конкретном воплощении иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению предпочтительно применяют в качестве бустера для повышения эффективности вакцинации BCG у вакцинированного индивидуума.
Сочетание с химиотерапией
Иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, вектор(ы), клетки-хозяева или композиции по изобретению предпочтительно применяют в сочетании с одним или несколькими стандартными терапевтическими средствами, например, одним или несколькими химиотерапевтическими препаратами, эффективными в отношении микобактериальной инфекции (например, инфекции Mtb).
Химиотерапевтические средства обычно выбирает лечащий врач в соответствии с существующими рекомендациями. Примеры таких химиотерапевтических препаратов включают антибиотики, а также низкомолекулярные прямые и непрямые ингибиторы, антитела и иммунотерапевтические средства, но не ограничиваются ими. Как правило, химиотерапия антибиотиками «первой линии», применяемая в настоящее время для лечения инфекции Mtb, не имеющей лекарственной устойчивости, включает изониазид, рифамицины (т.е. рифампин, рифапентин и рифабутин). Химиотерапевтические средства «второй линии», используемые для лечения инфекции Mtb, продемонстрировавшей лекарственную устойчивость к одному или нескольким средствам «первой линии», включают офлоксацин, ципрофлоксацин, этионамид, аминосалициловую кислоту, циклосерин, амикацин, канамицин и капреомицин. Одно или несколько химиотерапевтических средств обычно вводят в течение соответствующего периода времени, например, одного или нескольких месяцев (например, 1, 2, 3, 4, 5, 6, 9 или 12 месяцев) или более. Надлежащим является суточное введение доз от 200 до 500 мг (например, 300 или 400 мг) в течение периода времени, варьирующего от 6 до 12 месяцев.
В одном воплощении иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению применяют для сокращения продолжительности курса химиотерапии, направленной против микобактериальной (например, Mtb) инфекции. Обычно введение активного агента (агентов) согласно данному описанию позволяет повысить эффективность химиотерапии (например, сократить продолжительность и/или тяжесть клинических признаков, улучшить показатель конверсии мокроты и т.д.), сократить продолжительность химиотерапии и/или количество применяемых химиотерапевтических средств, особенно когда инфицировавшая микобактерия обладает лекарственной устойчивостью.
Согласно данному изобретению, иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, вектор(ы), клетки-хозяева или композиции по изобретению можно вводить перед, одновременно или после введения одного или нескольких химиотерапевтических препаратов. В одном воплощении активные агенты, описанные в данном документе, вводят по меньшей мере через 2 недели после начала введения химиотерапевтических средств.
В предпочтительном воплощении иммуногенную комбинацию, гибрид(ы), молекулы нуклеиновой кислоты, векторы, клетки-хозяева или композиции по изобретению применяют для индукции или усиления иммунного ответа у индивидуума, которому осуществляют введение. Соответственно, данное изобретение также охватывает способы индукции или стимулирования иммунного ответа против микобактериального антигена после введения индивидууму иммуногенной комбинации, гибрида(ов), молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению.
Индуцированный или стимулированный иммунный ответ может быть специфическим (т.е. направленным против микобактериального эпитопа/антигена) и/или неспецифическим (врожденным), гуморальным и/или клеточным. В контексте изобретения иммунный ответ предпочтительно представляет собой CD4+ или СР8+-опосредованный Т-клеточный ответ, или и тот, и другой, направленный против микобактериального антигена/эпитопа.
Способность активных агентов, описанных в данном документе, индуцировать или стимулировать иммунный ответ можно оценить in vitro или in vivo, используя большое разнообразие прямых или непрямых тестов, общепринятых в области техники.
Например, индукцию неспецифического иммунитета можно охарактеризовать, определяя NK/NKT-клетки (например, репрезентативность и уровень активации), а также связанные с IFNy каскады синтеза цитокинов и/или хемокинов и другие маркеры врожденного иммунитета (например, Riano et al, 2012, Tuberculosis 92: 148-59).
Способность стимулировать гуморальный ответ можно определить по повышению титра антитела, специфического по меньшей мере в отношении одного из антигенов, содержащихся или кодируемых иммуногенной комбинацией и гибридами, описанными в данном документе. Примеры методик включают связывание антител, конкурентное связывание, а также ИФА и вестерн-блоттинг, но не ограничиваются ими.
Клеточный иммунитет можно оценить, например, по увеличению встречаемости иммунных клеток, таких как Т-лимфоциты, специфических по меньшей мере в отношении одного из микобактериальных антигенов, содержащихся или кодируемых иммуногенной комбинацией и гибридами, описанными в данном документе. Можно также отслеживать клеточную пролиферацию с использованием радиоактивных меток (например, исследовать пролиферацию Т-клеток по включению [3Н] тимидина). Другим чувствительным способом оценки иммунного ответа является метод ELISpot, позволяющий определять встречаемость продуцирующих IFNy клеток. Цитотоксическую активность антиген-специфических Т-лимфоцитов можно определять у сенсибилизированных индивидуумов или путем иммунизации в соответствующих моделях на животных. Кроме того, можно выполнять количественную оценку высвобождения соответствующих Th1 и/или Th2 цитокинов, произведенных активированными Т-клетками с помощью общепринятых биологических тестов (например, многопараметрической проточной цитометрии (ICS), исследования профиля цитокинов с помощью мультиплексных технологий или ИФА и т.д.). Также можно использовать метод ПЦР для определения присутствия мРНК, кодирующей соответствующие цитокины. Специалисту в данной области понятно, что значимое повышение или снижение количества таких соответствующих цитокинов можно использовать для оценки иммуногенной активности одного или нескольких активных агентов, описанных в данном документе.
Такие иммунологические показатели хорошо коррелируют с защитным иммунным ответом, направленным против микобактериальной инфекции, который обеспечивают активные агенты, описанные в данном документе. «Защитный ответ» имеет свое общепринятое значение, характеризуется тем, что лечение оказывает благотворное действие на получающего лечение индивидуума по сравнению с ответом у нелеченого индивидуума; в качестве примеров можно привести индукцию или стимуляцию иммунного ответа, защиту от заражения микобактериальной инфекцией или пониженную устойчивость в отношении активной формы заболевания или предупреждение реактивации латентной микобактериальной инфекции или даже излечение после развития активного заболевания.
Такой защитный иммунный ответ также можно оценивать in vivo на соответствующих экспериментальных животных, например, мышах, крысах или морских свинках (см. Ashwin et al, 2008, Am J Resp, 39: 503-8; Acosta et al, 2011, Malays J Med, 18: 5-12), например, измеряя уменьшение микобактериальных колониеобразующих единиц (КОЕ) из гомогената селезенки, легких или других тканей, взятых у животных, которые были инфицированы вирулентным штаммом одного из видов Mycobacterium (например, Mtb) после предварительной иммунизации одним или несколькими активными агентами, описанными в данном документе, по сравнению с микобактериальными КОЕ в контрольной группе экспериментальных животных, зараженных тем же вирулентным штаммом микобактерии, но предварительно не иммунизированных. Сравнивать группы, получавшие и не получавшие лечение, также можно по выживаемости животных (увеличение выживаемости в группе, получавшей лечение, будет коррелировать с защитным иммунным ответом).
Защитный ответ, обеспечиваемый иммуногенной комбинацией, гибридом, молекулой нуклеиновой кислоты, вектором, клеткой-хозяином или композицией по изобретению, также можно оценивать при введении человеку в соответствии с описанными здесь схемами, по сравнению с исходным состоянием или по сравнению с ожидаемым состоянием при отсутствии лечения. О наличии защитного ответа могут свидетельствовать любые соответствующие клинические показатели, обычно используемые врачами или другими медицинскими специалистами, включая, например:
- снижение заболеваемости и/или распространенности и/или частоты заболевания в заданной популяции, такой как Китайская популяция или популяция мигрантов в заданной стране (например, более низкая доля индивидов, у которых была впервые диагностирована микобактериальная инфекция, или у кого существует риск развития микобактериальной инфекции или заболевания, ассоциированного с микобактериальной инфекцией в группе, получившей активный агент(ы), описанный(е) в данном документе);
- более высокий показатель конверсии мокроты, выраженный в процентах, в группе индивидуумов, получавших лечение;
- более высокий показатель излечиваемости активного заболевания, выраженный в процентах, в группе индивидуумов, получавших лечение;
- снижение показателя передачи микобактериальной инфекции после близкого контакта с инфицированным индивидуумом (например, снижение или отсрочивание риска инфицирования или риска развития активного заболевания и/или снижение или отсрочивание риска реактивации у латентно инфицированных индивидуумов);
- улучшение течения заболевания (например, снижение бактериальных КОЕ в ткани-мишени или в биологическом образце; сокращение симптомов заболевания или их тяжести (например, числа и/или тяжести поражений в органе- мишени) или стабилизация (отсутствие ухудшения) течения заболевания); и
- улучшение ответа на последующее лечение у получавшего лечение индивидуума (снижение потребности, количества, длительности и/или дозировки стандартных химиотерапевтических препаратов).
В контексте изобретения защитный ответ может быть преходящим (сохраняться пару недель после прекращения введения) или устойчивым (в течение нескольких месяцев или лет). Естественное течение клинического состояния может существенно варьироваться от одного индивидуума к другому, защитный ответ может наблюдаться не у каждого индивидуума, получающего лечение, но у значительного количества индивидуумов (например, статистически значимое различие между двумя группами можно выявить любыми статистическими критериями, известными в области техники, такими как параметрический тест Тьюки, тест Крускала-Уоллиса, U-тест Манна и Уитни, t-тест Стьюдента, тест Вилкоксона и т.д.).
Такие измерения можно выполнять перед введением активного агента, описанного в данном документе (до начала лечения) и в разные временные точки в ходе лечения, а также по меньшей мере через несколько (например, 12) недель после прекращения лечения.
В качестве общего руководства можно отметить, что микобактериальную инфекцию и ассоциированные заболевания можно выявлять различными способами. Например, микобактериальную инфекцию также можно выявить с помощью ряда методов, используемых в настоящее время в клинической практике, таких как туберкулиновая кожная проба Манту, квантифероновый тест, а также оценивая ответ на гепарин-связывающий гемагглютинин in vitro (Hougardy et al, 2007; PLos One 2(10): e926) или определяя IP 10 после стимуляции in vitro с помощью ESAT6, CFP10 и ТВ7.7 (Ruhwald et al, 2008; Microbes Infect 9: 806-12). Существующая практика позволяет выявлять индивидуумов у которых развивается активное заболевание. Например, диагноз туберкулеза основывается на выявлении болезнетворных бактерий в клинических образцах при помощи микроскопии, культуральных методов, полимеразной цепной реакции (ПЦР) и различных производных данного метода. Также можно использовать метод ДНК-дактилоскопии и сполиготипирования. Выявление микобактерий культуральным методом является золотым стандартом выявления изолятов комплекса Mycobacterium tuberculosis и определения чувствительности к лекарственным препаратам. Выявить активную легочную и/или внелегочную форму заболевания также помогают рентгеновские методы и клинические наблюдения. С другой стороны, для диагностирования инфекции Mtb были разработаны многочисленные серологические тесты, в которых используются различные антигены, позволяющие выявлять циркулирующие антитела, в том числе реакция связывания комплемента, реакция гемагглютинации, радиоиммунный и иммуноферментный анализ (ИФА).
Данное изобретение также относится к способу качественного и/или количественного определения антител, направленных против Mycobacterium, в биологическом образце (например, плазме, сыворотке и т.д., взятых у индивидуума, инфицированного или восприимчивого к инфекции Mycobacterium), который включает стадии приведения в контакт указанного биологического образца с реагентом, содержащим любое из: иммуногенной комбинации, гибрида(ов), молекул нуклеиновой кислоты, векторов, инфекционных вирусных частиц, клеток-хозяев по изобретению, в условиях, обеспечивающих формирование комплекса между антителом и микобактериальным антигеном/эпитопом, содержащимся или кодируемым любым из вышеупомянутых реагентов, и количественного и/или качественного определения формирования указанного комплекса любыми подходящими средствами. Определение наличия специфического антитела указывает на микобактериальную инфекцию (например, Mtb).
Специалист в данной области легко определит количество реагента, которое следует применять в способах по изобретению. Способы качественного и/или количественного определения комплекса антиген/антитело являются общепринятыми и хорошо известны специалистам в данной области. Например, можно упомянуть блоттинг, ИФА, т.н. сэндвич-методы, конкурентные методы и методики ПЦР, в частности, т.н. методики «в реальном времени». Применение перечисленных выше реагентов можно усовершенствовать за счет присоединения (т.е. физического связывания) к веществу, которое можно детектировать. Примеры детектируемых веществ включают различные ферменты (например, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу), простетические группы (например, стептавидин/биотин или авидин/биотин), флуоресцентные материалы (например, умбеллиферон, флуоресцеин или производные флуоресцеина), люминесцентные материалы, биолюминесцентные материалы (например, люциферазу, люциферин или экворин) и радиоактивные материалы (например, 125I, 131I, 35S или 3Н).
Данное изобретение также относится к набору реагентов для диагностики микобактериальной инфекции (например, Mtb) для определения антигена, включающему антитело по изобретению, а также для определения антитела, включающему иммуногенную комбинацию, гибрид(ы), молекулу нуклеиновой кислоты, вектор, клетку-хозяина, композицию по изобретению.
Все цитируемые выше описания патентов, публикаций и доступов в базы данных включены сюда посредством ссылки в той же степени, как если бы для каждого патента, публикации или доступа в базы данных отдельно и специально было указано, что они включены сюда во всей своей полноте путем ссылки.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показан клеточный иммунный ответ, индуцированный после иммунизации мышей C57BL/6 (а) пустым MVATGN33.1 или (б) MVATG18379 (Rv2029-Rv2626-Rv1733-Rv0111 + RpfB-Dhyb-Ag85B-TBI 0.4-ESA T6 + Rv0569-Rv1813-Rv3407-Rv3478-Rv1807) или MVATG18598 (Rv2626-2a-Ag85B + CFP10-ESAT6 + TB10.4-Rv0287 + RpfB-Dhyb + Rv1813-2a-Rv3407). Продуцирующие IFNy клетки определяли спустя одну неделю после последней инъекции MVA методом ELISpot для определения IFNy после стимуляции ex vivo специфическими пулами пептидов (Р). Каждый однотонный столбец представляет ответ отдельной мыши (6 мышей в группе), а столбец со штриховкой обозначает медианное значение в каждой группе. Пунктирной линией обозначено пороговое значение в эксперименте. Статистический анализ выполняли с использованием теста Манна-Уитни. *, р<0,05.
На Фиг. 2 показан клеточный иммунный ответ, индуцированный после иммунизации мышей C57BL/6 (а) пустым MVATGN33.1 или (б) MVATG18377 (Rv2029-Rv2626-Rv1 733-Rv0111 + RpfB-Dhyb-Ag85B-TB10.4-ESAT6 + Rv0569-Rv1813-Rv3407-Rv3478-Rv1807) или MVATG18597 (ESAT6 + CFP10 + Rv2626 + Ag85B + RpfB-Dhyb) или MVATG18633 (ESAT6 + Rv1813 + Rv2626 + Ag85B + RpfB-Dhyb). Продуцирующие IFNy клетки определяли спустя одну неделю после последней инъекции MVA методом ELISpot для определения IFNy после стимуляции ex vivo специфическими пулами пептидов (Р). Каждый однотонный столбец представляет ответ отдельной мыши (5 мышей в труппе), а столбец со штриховкой обозначает медианное значение в каждой группе. Пунктирной линией обозначено пороговое значение в эксперименте. Статистический анализ выполняли с использованием теста Манна-Уитни. *, р<0,05; **, р<0,01.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Материалы и методы
Промоторы Vaccinia и синтетические гены, кодирующие различные антигены Mtb и гибриды, синтезировали в компании Geneart (Regensburg, Germany). Последовательности оптимизировали для использования кодонов у человека, а перед стартовым кодоном ATG добавили последовательность Kozak (АСС). Кроме того, исключили некоторые мотивы: Mill NT, GGGGG, ССССС, губительные для экспрессии в поксвирусном векторе, и AAAGGG, AAAAGG, GGGAAA, GGGGAA (и комплементарные последовательности ТТСССС, ТТТССС, ССТТТТ, ССССТТ), которые могут быть губительными для экспрессии в некоторых других векторах.
Конструирование MVATG18598, экспрессирующего гибриды гетероолигомерных антигенов Mtb MVATG18598 содержал 5 экспрессионных кассет, каждая из которых кодировала гибрид двух антигенов Mtb (как показано в Таблице 1). Первый гибрид Rv2626/2a/Ag85B** (SEQ ID NO: 9) включал в себя последовательность Rv2626 от позиции 1 до 143, линкер GSG от позиции 144 до 146, последовательность саморасщепляющегося пептида Т2А от позиции 147 до 164 и последовательность модифицированного Ag85B (Ag85B** модифицирован по отношению к нативному аналогу за счет частичной делеции N-концевого сигнального пептида, от первого остатка приблизительно до позиции 32) от позиции 165 до 457. Нуклеотидную последовательность, кодирующую Rv2626/2a/Ag85B** (SEQ ID NO: 16), поместили под контроль промотора pB2R (SEQ ID NO: 20). Второй гибрид (SEQ ID NO: 1) представлял собой гибрид двух гетероолигомерных партнеров CFP10 и ESAT6. Он включал в себя CFP10 от позиции 1 до 100, линкер из 14 аминокислот (соответствующий аминокислотам от 149 до 162 белка Mtb Rv1827) от позиции 101 до 114 и ESAT6 от позиции 115 до 208. Нуклеотидную последовательность, кодирующую CFP10/ESAT6 (SEQ ID NO: 13), поместили под контроль промотора pH5R (SEQ ID NO: 21). Третий гибрид (SEQ ID NO: 2) представлял собой гибрид двух гетероолигомерных партнеров ТВ10.4 и Rv0287. Он включал в себя TBI 0.4 от позиции 1 до 96, линкер из 13 аминокислот (соответствующий аминокислотам от 149 до 161 белка Mtb Rv1827) от позиции 97 до 109 и Rv0287 от позиции 110 до 205. Нуклеотидную последовательность, кодирующую TB10.4/Rv0287 (SEQ ID NO: 14), поместили под контроль промотора pSE/L (SEQ ID NO: 22). Четвертый гибрид представлял собой гибрид RPFB-Dhyb, описанный последовательностью SEQ ID NO: 8. Он представлял собой гибрид антигена RpfB, модифицированного по отношению к нативному аналогу путем делеции сигнального пептида (от первого остатка до остатка, находящегося приблизительно в положении 29) и делеции каталитического домена, таким образом сохранялся RfpB приблизительно от позиции 30 до позиции 283, и каталитического домена антигена RpfD, имеющего три мутации, внедренные с целью устранения сопутствующей ферментативной активности (Е292К, Т315А и Q347A). Нуклеотидную последовательность, кодирующую RPFB-Dhyb (SEQ ID NO: 15), поместили под контроль промотора р7.5K (SEQ ID NO: 23). Последний гибрид Rv3407/2a/Rv1813* (SEQ ID NO: 11) включал в себя Rv3407 от позиции 1 до 99, линкер GSG от позиции 100 до 102, саморасщепляющийся пептид Е2А от позиции 103 до 122 и модифицированный Rv1813 (Rv1 813*, модифицированный по отношению к нативному аналогу за счет частичной делеции N-концевого сигнального пептида, от первого остатка приблизительно до позиции 31) от позиции 123 до 235. Нуклеотидную последовательность, кодирующую Rv3407/2a/Rv1813* (SEQ ID NO: 18), поместили под контроль промотора pA35R (SEQ ID NO: 24).
Два фрагмента ДНК, соответствующие первым трем экспрессионным кассетам и двум последним экспрессионным кассетам, соответственно, разделенные подходящими сайтами рестрикции, создали синтетическим способом. После рестрикции первого фрагмента Notl и Xhol и второго фрагмента Xhol и Pad оба фрагмента клонировали в pTG18593, обработанный рестриктазами Notl и Xhol с получением pTG 18598.
Переносящую плазмиду на основе MVA, pTG18593, сконструировали так, чтобы обеспечить вставку нуклеотидной последовательности, подлежащей переносу, посредством гомологичной рекомбинации, в делецию III генома MVA. Она являлась производной плазмиды pUC18, в которую клонировали фланкирующие последовательности (BRG3 и BRD3), окружающие делецию III MVA (Sutter and Moss, 1992, Proc. Natl. Acad. Sci. USA 89: 10847).
MVATG18598 сконструировали посредством гомологичной рекомбинации в первичных фибробластах эмбрионов цыпленка (CEF), инфицированных MVA и трансфецированных pTG18598 путем нуклеофекции (согласно технологии Amaxa Nucleofector). Отсутствие контаминации родительским MVA верифицировали с помощью ПЦР.
Конструирование векторов MVA, ко-экспрессирующих гетероолигомерные партнеры Mtb
Конструирование MVATG18597
MVATG18597 содержал 5 экспрессионных кассет, каждая из которых кодировала один антиген Mtb (Таблица 1). Нуклеотидную последовательность, кодирующую ESAT6 (SEQ ID NO: 25), поместили под контроль промотора pB2R (SEQ ID NO: 20). Нуклеотидную последовательность, кодирующую CFP10 (SEQ ID NO: 26), поместили под контроль промотора pH5R (SEQ ID NO: 21). Нуклеотидную последовательность, кодирующую Rv2626 (SEQ ID NO: 27), поместили под контроль промотора pSE/L (SEQ ID NO: 22). Нуклеотидную последовательность, кодирующую модифицированный Ag85B (Ag85B*, модифицированный по отношению к нативному аналогу за счет делеции N-концевого сигнального пептида, от первого остатка до позиции 39 (SEQ ID NO: 28), поместили под контроль промотора р7.5K (SEQ ID NO: 23). Последний антиген представлял собой слитый полипептид, содержащий антигены Mtb RpfB и RpfD (например, как проиллюстрировано на примере т.н. RPFB-Dhyb с SEQ ID NO: 8). Нуклеотидную последовательность, кодирующую RPFB-Dhyb (SEQ ID NO: 15), поместили под контроль промотора pA35R (SEQ ID NO: 24).
Фрагмент ДНК, соответствующий пяти экспрессионным кассетам, разделенным подходящими сайтами рестрикции и окруженный последовательностью приблизительно 30 пн, гомологичной переносящей плазмиде на основе vaccinia, создали синтетическим способом. После рестрикции SnaBI и Fspl фрагмент встроили с помощью клонирования In-Fusion (набор для клонирования In-Fusion HD, Clontech) в переносящую плазмиду на основе vaccinia, pTG18593, обработанную рестриктазами Notl и Pad, с получением pTG18597.
Вирус MVATG18597 получили в CEF путем гомологичной рекомбинации, как описано выше.
Конструирование MVATG 18604
MVATG 18604 содержал 5 экспрессионных кассет, каждая из которых кодировала отдельный антиген Mtb (Таблица 1). Нуклеотидную последовательность, кодирующую Rv0287 (SEQ ID NO: 29), поместили под контроль промотора pB2R (SEQ ID NO: 20). Нуклеотидную последовательность, кодирующую ТВ10.4 (SEQ ID NO: 30), поместили под контроль промотора pH5R (SEQ ID NO: 21). Нуклеотидную последовательность, кодирующую Rv3407 (SEQ ID NO: 31), поместили под контроль промотора pSE/L (SEQ ID NO: 22). Нуклеотидную последовательность, кодирующую Rv3478 (SEQ ID NO: 32), поместили под контроль промотора р7.5K, а нуклеотидную последовательность, кодирующую Rv3477 (SEQ ID NO: 33), поместили под контроль промотора pA35R (SEQ ID NO: 24).
Фрагмент ДНК, соответствующий пяти экспрессионным кассетам, разделенным подходящими сайтами рестрикции и фланкированный последовательностью приблизительно 30 пн, гомологичной переносящей плазмиде на основе vaccinia, создали синтетическим способом. После рестрикции SnaBI и Fspl фрагмент встроили посредством клонирования In-Fusion (набор для клонирования In-Fusion HD, Clontech) в переносящую плазмиду на основе vaccinia, pTG18593, обработанную рестриктазами Notl и Pad, с получением pTG18604.
Вирус MVATG18604 получили в CEF путем гомологичной рекомбинации, как описано выше.
Получение антител, направленных против антигенов Mtb
Антитела, направленные против различных антигенов Mtb, получали после иммунизации кроликов смесью двух различных антиген-специфических пептидов (Eurogentec; Seraing, Belgium). Такие пептиды размером от 15 до 16 аминокислотных остатков выбрали по результатам предсказания В эпитопов. Антисыворотку против антигенов Rv1807, RPFB-Dhyb*, Rv1813* и Rv3407 получили после иммунизации кроликов двумя специфическими пептидами в день 0 и трех бустерных инъекций в день 7, 10 и 18. Образцы крови брали перед инъекцией первого пептида и в день 21. Последний забор крови у кроликов осуществляли в день 29. В случае Rv3478, кролики получали инъекцию двух специфических пептидов-октагексамеров в день 0, 22, 49 и 77. Образцы крови брали перед инъекцией первого пептида и в день 31 и 59. Последний забор крови у кроликов осуществляли в день 87.
Полученные сыворотки анализировали методом ИФА с использованием специфических пептидов и методом Вестерн-блоттинг с использованием плазмид, экспрессирующих индивидуальные гены Mtb.
Вестерн-блоттинг продуктов экспрессии, опосредованной MVA
4×106 клеток CEF инфицировали при множественности заражения (MOI, от англ. multiplicity of infection) 0,2 различными MVA, продуцирующими гибриды антигенов Mtb, в присутствии или в отсутствие ингибитора протеасом MG132 (10 мкМ), добавляемого в питательную среду через 30 мин после инфицирования. В качестве отрицательного контроля использовали пустой вектор MVATGN33.1. Спустя 24 часа среду удаляли и клетки лизировали буфером Трис-глицин-SDS 2 X в количестве 300 мкл на чашку (кат. номер LC2676; Novex) с добавлением β-меркаптоэтанола (5% об:об). Затем проводили соникацию лизата и нагревали в течение 5 мин при 95°C. Двадцать микролитров клеточного лизата использовали для электрофореза в преформированном 4-15% геле Criterion с использованием систем для гель-электрофореза Criterion Precast (Biorad). После электрофореза белки переносили на мембрану PVDF (Trans-blot® Turbo™ Transfer System (# 170-4155, Biorad)).
Иммунодетекцию осуществляли с использованием специфических к Mtb антител (см. ниже). Иммунные комплексы выявляли с помощью набора ImmunStar WesternC (Biorad, ref 170.5070).
Для детекции Rpf-B-D, Rv1813*, Rv3407 и Rv3478 методом вестерн-блоттинга также использовали сыворотку (разведенную 1/1000), полученную после иммунизации кролика, как описано выше, Для детекции ESAT6, Ag85B*, ТВ10.4 и Rv2626, соответственно, использовали приобретенные антитела: мышиное моноклональное антитело HYB076-08 (Santa-Cruz; #sc-57730, разведение 1/500) для ESAT6, кроличью поликлональную антисыворотку NR-13800 (BEI, разведение 1/5000) для Ag85B*, мышиное моноклональное антитело 26А11 (Lifespan- Biosciences; #LS-C91052 разведение 1/1000) для Rv2626 и поликлональное кроличье антитело ABIN361292 (Antibodies-online, разведение 1/1000) для ТВ10.4.
Исследование растворимости
Клетки CEF в количестве 4×106 на лунку культивировали в 6-луночных планшетах, как описано выше, и инфицировали MVA при MOI 0,2 без MG132. Спустя 24 часа после заражения культуральную жидкость удаляли и клетки лизировали в 250 мкл нативного буфера (50 мМ Трис рН 7,5; 150 мМ NaCl; 1% Тритон Х1OO; антипротеазный коктейль Roche) или буфера Novex (Invitrogen) с добавлением 0,7 М бета-меркаптоэтанола (Novex + ВМЕ).
Клеточный лизат центрифугировали при 16000 g в течение 5 мин при комнатной температуре для удаления клеточного дебриса и крупных белковых агрегатов. Осадок ресуспендировали в исходном объеме 250 мкл буфера Novex с бета-меркаптоэтанолом. Для вестерн-блоттинга использовали клетки целиком (в буфере Novex), а также клеточный осадок и супернатант для определения экспрессии антигена в нерастворимой и в растворимой фракциях, соответственно. Отрицательным контролем служил лизат клеток, инфицированных MVA (N33), не несущим какого-либо трансгена. Контрольный MVA служил для определения неспецифического фона при иммунодетекции.
Если антиген или гибрид определялись в основном в растворимой фракции, 0,45 мл лизата затем разделяли путем эксклюзионной хроматографии с использованием колонок S200 10/30 Superdex, уравновешенных ФСБ. Фракции объемом 0,75 мл собирали после прохождения 8-10 мл (мертвый объем) и до 23,6 мл (общий объем колонки).
Для определения профиля элюирования каждого антигена или гибрида эти фракции исследовали методом вестерн-блоттинга с применением специфических антител или антисыворотки. Гибрид или антиген считали агрегированными, если они элюировались в мертвом объеме колонки.
Оценка иммуногенности в модели на мышах
Протокол иммунизации MVA
Иммуногенность кандидатов MVA ТВ оценивали на мышах C57BL/6 Каждый вектор MVA вводили подкожно в основание хвоста, двукратно с 4-недельным интервалом, в дозе 1×107 БОЕ в 100 мкл Трис-HCl буфера и буфера, содержащего сахарозу. Клеточный иммунный ответ оценивали через 7 дней после последней инъекции MVA методом ELISpot IFNy.
Пептидные библиотеки
Для повторной стимуляции ex-vivo спленоцитов иммунизированных мышей использовали пептидную библиотеку. Более конкретно, синтезировали все пептиды (октапентамеры, перекрывающиеся на 11 аминокислот), охватывающие все антигены Mtb, находившиеся в конструкциях, описанных выше (Proteogenix). Пептидный пул готовили в ДМСО в конечной концентрации 1 мкМ/л. Для того, чтобы охватить всю длину каждого антигена Mtb требовалось от одного до четырех пулов.
На RpfB-Dhyb приходилось 4 пула, по 24 пептида в первых 3 пулах и 19 пептидов в четвертом пуле. Пул 1: 22 пептида, охватывающие остатки RpfB с 30 по 127; Пул 2: 22 пептида, охватывающие остатки RpfB со 117 по 215; Пул 3: 22 пептида, охватывающие остатки RpfB с 205 по 284 и остатки RpfD с 53 по 71; Пул 4: 21 пептид, охватывающий остатки RpfD с 61 по 153.
На Rv1813 приходился 1 пул из 25 пептидов, охватывающих остатки Rv1813 с 34 по 143.
На Rv3407 приходился 1 пул из 22 пептидов, охватывающих остатки Rv3407 с 1 по 99. На Rv2626 приходилось 2 пула из 17 и 16 пептидов. Пул 1: 17 пептидов, охватывающих остатки Rv2626 с 1 по 79; Пул 2: 16 пептидов, охватывающих остатки Rv2626 с 69 по 143.
На Ag85B приходилось 3 пула из 23 пептидов. Пул 1: 23 пептида, охватывающие остатки Ag85B с 39 по 141; Пул 2: 23 пептида, охватывающие остатки Ag85B со 131 по 233; Пул 3: 23 пептида, охватывающие остатки Ag85B с 223 по 325.
На ESAT-6 приходился 1 пул из 21 пептида, которые охватывали остатки ESAT-6 с 1 по 95.
На CFP10 приходился 1 пул из 23 пептидов, охватывающих остатки CFP10 с 1 по 100. На ТВ10.4 приходился 1 пул из 21 пептида, которые охватывали остатки ТВ10.4 с1 по 96.
На Rv0287 приходился 1 пул из 22 пептидов, охватывающих остатки Rv0287 с 1 по 97.
Исследование IFNy методом ELISpot
Собирали спленоциты иммунизированных мышей и лизировали эритроциты (Sigma, R7757). 2×105 клеток на лунку культивировали в трипликатах в течение 40 ч в чашках Multiscreen (Millipore, MSHA S4510), покрытых моноклональным антителом к IFNy мыши (BD Biosciences; 10 мкг/мл, 551216) в питательной среде аМЕМ (Gibco, 22571) с добавлением 10% эмбриональной телячьей сыворотки (JRH, 12003-100М), 80 ед/мл пенициллина/ 80 мкг/мл стрептомицина (PAN, Р06-07-100), 2 мМ L-глутамина (Gibco, 25030), 1× заменимых аминокислот (Gibco, 11140), 10 мМ Hepes (Gibco, 15630), 1 мМ пирувата натрия (Gibco, 31350) и 50 мкМ β-меркаптоэтанола (Gibco, 31350) в присутствии 10 ед/мл рекомбинантного IL2 мыши (Peprotech, 212-12), либо отдельно (отрицательный контроль), либо с добавлением:
- описанного выше пула пептидов в конечной концентрации 1 мкмоль/л;
- конканавалина А в концентрации 5 мкг/мл (Sigma, С5275) в качестве положительного контроля;
- нерелевантного пептида.
Количественное определение IFNy-продуцирующих Т-клеток проводили методом ELISpot (цитокин-специфический метод иммуноферментных пятен), как описано ранее (Himoudi et al, 2002, J. Virol. 76: 12735-46). Результаты представлены как среднее значение, полученное для трипликатов. Пороговый уровень, выше которого экспериментальные результаты расценивали как положительные (или порог отсечения) определяли, рассчитывая пороговое значение, соответствующее среднему количеству пятен, наблюдаемых только со средой, плюс 2 стандартных отклонения, приведенному для 106 клеток. Технический порог отсечения для считывающего устройства CTL ELISpot составил 50 пятен/106 клеток (представлял собой значение, выше которого коэффициент вариации считывающего устройства систематически был менее 20%). Максимальные пороговые значения между техническим и экспериментальным порогом отсечения представлены на графиках. Положительными считали только те ответы (медианное значение для каждой группы мышей), которые превышали порог отсечения. Статистический анализ ответов, полученных методом ELISpot, проводили с использованием критерия Крускала-Уоллиса с последующим тестом Манна-Уитни при обнаружении достоверных различий. Значения Р равные или меньшие 0,05 считали значимыми.
Результаты
Пример 1. Создание рекомбинантных MVA, экспрессирующих слитые гетеродимерные партнеры
MVATG18598 MVA создали для экспрессии двух гибридов гетеродимерных партнеров ESAT6 с CFP10 и ТВ10.4 с Rv0287 (также обозначаемым ТВ9.8) вместе с тремя гибридами дополнительных микобактериальных антигенов, включая антигены Mtb латентной (Rv2626, Rv3407 и Rv1813), активной (Ag85B) фаз и фазы оживления (RPFB-Dhyb). Между каждым из партнеров добавляли гибкий линкер из 13-14 аминокислот, что способствовало фолдингу гетеродимеров. В некоторых случаях между двумя элементами гибрида добавляли последовательность, кодирующую саморасщепляемые пептиды 2А, что позволяло синтезировать оба элемента по отдельности. В конструкции использовали два различных пептида 2А: Т2А (из вируса Thosea asigna) и Е2А (из вируса ринита лошадей А). Всего MVATG18598 содержал пять независимых экспрессионных кассет, находящихся под контролем пяти различных промоторов (как показано в Таблице 1).
MVATG18597 и MVATG18604 были созданы как контроли, ко-экспрессирующие (без слияния) гетеродимерные партнеры ESAT6 и CFP10 (MVATG18597) и ТВ10.4 и Rv0287, а также Rv3478 и Rv3477 (MVATG18604) вместе с другими дополнительными антигенами Mtb латентной фазы (Rv2626, Rv3407 и Rv1813), активной фазы (Ag85B) и фазы оживления (RPFB-Dhyb).
Более конкретно,
- MVATG18598 содержал 5 гибридов из 10 антигенов Mtb, соответственно, Rv2626/2a/Ag85B** под контролем промотора pB2R, CFP10/ESAT6 под контролем промотора pH5R, RPFB-Dhyb под контролем промотора p7.5K, ТВ10.4/TB9.8 под контролем промотора pSE/L и Rv3407/2a/Rv1813* под контролем промотора pA35R.
- MVATG18597 содержал ESAT6 под контролем промотора pB2R, CFP10 под контролем промотора pH5R, Rv2626 под контролем промотора pSE/L, Ag85B* под контролем промотора р7.5К и RPFB-Dhyb под контролем промотора pA35R.
- MVAT18604 содержал Rv0287 под контролем промотора pB2R, TBI 0.4 под контролем промотора pH5R, Rv3407 под контролем промотора pSE/L, Rv3478 под контролем промотора р7.5К и Rv3477 под контролем промотора pA35R.
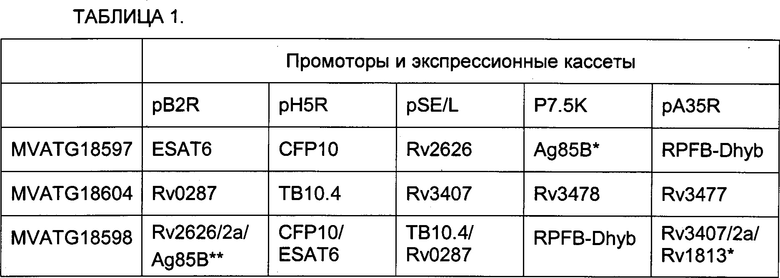
Пример 2. Анализ экспрессированных в MVA антигенов Mtb и гибридов методом вестерн-блоттинга
Клетки CEF инфицировали (MOI 0,2) в присутствии или в отсутствие MG132, различными кандидатами MVA, описанными выше, и продукты экспрессии анализировали методом вестерн-блоттинга в условиях, описанных в разделе Материалы и Методы. Иммунодетекцию выполняли с использованием антител, специфических к различным антигенам Mtb, описанным в данном документе, за исключением CFP-10, Rv0287 и Rv3477. В частности, сыворотку, полученную после иммунизации кроликов (см. Материалы и Методы), использовали для определения Rv1807, RPFB-Dhyb*, Rv1813*, Rv3407 и Rv3478, тогда как приобретенные антитела использовали для определения ESAT6, Ag85B*, ТВ10.4 и Rv2626.
Обобщенные результаты представлены в Таблице 2. Интенсивные полосы, соответствующие гибридам гетеродимеров CFP10/ESAT6 и TB10.4/Rv0287, выявляли в лизате клеток, инфицированных MVATG18598, с помощью антител к ESAT6 и ТВ10.4. Полосы, появившиеся после расщепления пептида 2А, детектировали с использованием антител к Rv2626 и Ag85B* для гибрида Rv2626/2a/Ag85B** и с использованием антител к Rv3407 и Rv1813 для гибрида Rv3407/2a/Rv1813*.
С другой стороны, при экспрессии отдельных антигенов (MVATG18597 и MVATG18604) определялась слабая полоса с антителом к ESAT6, тогда как с антителом к ТВ10.4 экспрессия не детектировалась, несмотря на присутствие в том же самом векторе их соответствующих гетеродимерных партнеров. Однако, в обеих конструкциях дополнительные антигены Mtb определялись соответствующим антителом. Действительно, полоса, соответствующая ожидаемому размеру, определялась с использованием антисыворотки/антител к Ag85B, RPFB-Dhyb, Rv2626, Rv3478 и Rv3407.


Пример 3. Исследование растворимости экспрессированных в MVA антигенов Mtb и гибридов
Клетки CEF, инфицированные MVATG18598, MVATG18597 и MVATG18604, без MG132, анализировали на предмет растворимости антигенов или гибридов. Анализ CFP10, Rv0287 и Rv3477 не проводили. Центрифугирование при 16000 g в течение 5 минут позволяло осадить клеточный дебрис и крупные белковые агрегаты (осадок, содержащий нерастворимую фракцию). Напротив, прошедшие фолдинг белки и мелкие агрегаты оставались в надосадочной жидкости (растворимая фракция). Осадок ресуспендировали в том же объеме, что и супернатант, и от 5 до 15 мкл супернатанта и ресуспендированного осадка загружали в полиакриламидный гель для электрофореза в присутствии ДСН. Таким образом, интенсивность сигналов, соответствующих осадку (Р) и супернатанту (S) можно было сравнивать напрямую. В Таблице 3 приведены обобщенные результаты для каждого антигена или гибрида, экспрессируемого тремя MVA, указанными выше.
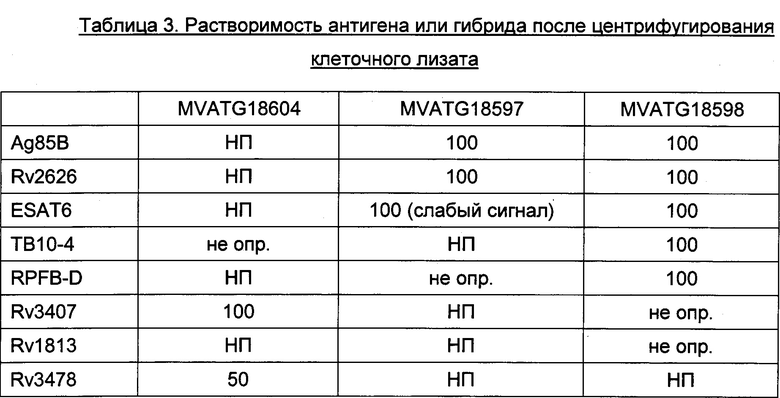

Для некоторых антигенов, которые экспрессировались преимущественно в растворимой фракции, проводили эксклюзионную хроматографию растворимой фракции для оценки состояния агрегации антигенов или гибридов. Использовали колонку (например, Superdex 200 10/30) которая позволяла разделять глобулярные белки размером от 10 до 600 кДа. Любые глобулярные мономерные белки с массой <600 кДа элюировались после мертвого объема колонки. Таким образом, любые гибриды или антигены, которые элюировались после мертвого объема, считали неагрегированными. Результаты представлены в Таблице 4.
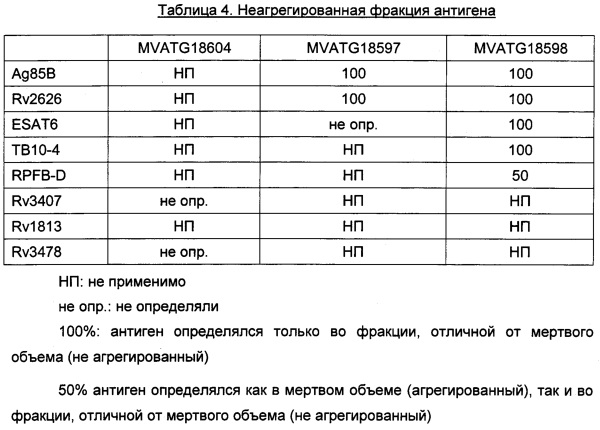
Обобщенные результаты исследования растворимости
- Ag85B определялся с размером, который совпадал с расчетным (не слитый), и в виде растворимого белка в клетках CEF, инфицированных MVATG18597 и MVATG18598. В CEF, инфицированных MVATG18597, также выявлялись слабые полосы, соответствующие размеру нерасщепленных гибридов Ag85B. Эти полосы были слишком слабыми, чтобы провести их анализ с помощью эксклюзионной хроматографии. Анализ методом эксклюзионной хроматографии демонстрировал, что Ag85B, который экспрессировался двумя вирусами, упомянутыми выше, представлял собой белок, прошедший фолдинг.
- Rv2626 определялся с размером, который совпадал с расчетным (не слитый) и в виде растворимого белка в клетках CEF, инфицированных MVATG18597 и MVATG18598.
- ESAT6 едва различался при экспрессии без слияния (MVATG18597) и хорошо детектировался при слиянии с CFP10 (MVATG18598). Любопытно, что только гибрид CFP10-ESAT6, кодируемый MVATG18598, был полностью растворимым и прошедшим фолдинг.
- TBI 0-4 не детектировался, когда его экспрессировали без слияния (MVATG18604) и хорошо детектировался при слиянии с Rv0287 (MVATG18598). Любопытно, что только гибрид ТВ10-4-Rv0287, кодируемый MVATG18598, был полностью растворимым и прошедшим фолдинг.
- RPFB-Dhyb детектировался при экспрессии MVATG18598 в виде мономерного белка. RPFB-Dhyb, экспрессируемый MVATG18598, был растворимым, и анализ с помощью эксклюзионной хроматографии продемонстрировал, что белок RPFB-Dhyb был частично агрегированным.
- Rv3407 не детектировался в отсутствие MG132 в CEF, инфицированных MVATG18598. Rv3407 экспрессировался в виде полностью растворимого белка в CEF, инфицированных MVATG 18604. Растворимые фракции не исследовали аналитической эксклюзионной хроматографией.
- Rv3478 кодировался MVATG 18604 в виде неслитого белка. Rv3478 детектировался только в нерастворимой фракции или как в растворимой, так и в нерастворимой фракциях.
В целом, как показано на примере ESAT6 и ТВ10.4, слияние микобактериального антигена с его естественным гетеродимерным партнером позволяло улучшить экспрессию и растворимость полученного генного продукта.
Пример 4. Оценка иммуногенности потенциальных MVA вакцин, экспрессируюших антигены Mtb
4.1. Оценка иммуногенности потенциальной вакцины MVATG18598, экспрессирующей антигены Mtb, на мышах C57BL/6
Мышей C57BL/6 иммунизировали дважды с 4-недельным интервалом либо MVATG18379 (описание приведено в WO 2014/009438), экспрессирующим гибрид 3 белков «Rv2029-Rv2626-Rv1733-RvOIII + RpfB-Dhyb-Ag85B-TBI 0.4-ESA T6 + Rv0569-Rv1813-Rv3407-Rv3478-Rv1807» или MVATG18598, экспрессирующим гибрид 5 различных белков «Rv2626-2a-Ag85B + CFP10-ESAT6 + TB10.4-Rv0287 + RpfB-Dhyb + Rv1813-2a-Rv3407». Специфический клеточный иммунный ответ оценивали спустя одну неделю после последней инъекции с помощью анализа IFNy ELISpot после стимуляции пулами пептидов, описанных в данном документе. Кроме того, мышей иммунизировали пустым вектором MVA (MVATGN33.1), который служил отрицательным контролем.
Как показано на Фиг. 1б, MVATG18379 и MVATG18598 индуцировали у мышей C57BL/6 положительный ответ в виде продукции IFNy, специфический в отношении Ag85B (Пул 3), ESAT6 и TBI 0.4, который варьировал в пределах от 113 до 1548 пятен/106 клеток. Кроме того, специфический в отношении ESAT6 ответ был значительно более выраженным в случае MVATG18598 (387 пятен/106 клеток), экспрессирующих CFP10, который являлся партнером ESAT6, по сравнению с MVATG18379 (119 пятен/106 клеток), которые не экспрессировали CFP10. Ag85B-специфический ответ был также значительно более выраженным, если мышам делали инъекцию MVATG18598, по сравнению с группой, которую вакцинировали MVATG18379 (1548 и 928 пятен/106 клеток, соответственно). ТВ10.4- специфические ответы были одинаковыми в обеих группах, вакцинированных MVATG18379 либо MVATG18598. RpfB-Dhyb-специфический ответ детектировали только у мышей, вакцинированных MVATG18379. Независимо от вакцины, вводимой мышам C57BL/6, специфического в отношении Rv2626, Rv1813 или Rv3407 сигнала не появлялось. Как и ожидали, при вакцинации мышей пустым вирусом MVATGN33.1, ответ в виде продукции IFNy не детектировали (Фиг. 1а).
4.2. Оценка иммуногенности вакцин-кандидатов MVATG18597 и MVATG18633, экспрессирующих антигены Mtb, на мышах C57BL/6
Мышей C57BL/6 иммунизировали дважды с 4-недельным интервалом либо MVATG18377 (описание приведено в WO 2014/009438), экспрессирующим гибрид 3 белков «Rv2029-Rv2626-Rv1733-RvOIII + RpfB-Dhyb-Ag85B-TBI 0.4-ESA T6 + Rv0569-Rv1813-Rv3407-Rv3478-Rv1807», либо MVATG18597, экспрессирующим 5 отдельных антигенов Mtb «Ag85B + ESAT6 + CFPIO + Rv2626 + RpfB-Dhyb», либо MVATG18633, кодирующим те же отдельные антигены Mtb, за исключением CFPIO, в следующем виде: «Ag85B + ESAT6 + Rv1813 + Rv2626 + RpfB-Dhyb». Специфический клеточный иммунный ответ оценивали спустя одну неделю после последней инъекции с помощью анализа IFNy ELISpot после стимуляции пулами пептидов, описанных в данном документе, или общими антигенами Mtb. Кроме того, мышей иммунизировали пустым вектором MVA (MVATGN33.1), который служил отрицательным контролем.
Как показано на Фиг. 2б, все три вакцины индуцировали у мышей C57BL/6 положительный ответ в виде продукции IFNy, специфический в отношении Ag85B (Пул 3), ESAT6 и RpfB-Dhyb, который варьировал в пределах от 85 до 2113 пятен/106 клеток. Кроме того, специфический в отношении ESAT6 ответ был значительно более выраженным в случае MVATG18597 (375 пятен/106 клеток), экспрессирующих белок CFP10, который являлся партнером ESAT6, по сравнению с MVATG18377 и MVATG18633 (85 и 102 пятен/106 клеток, соответственно), которые не экспрессировали белок CFP10. Ag85B-специфический ответ (Пулы 1 и 3) был также значительно более выраженным, если мышам делали инъекцию MVATG18597 или MVATG18633 (от 262 до 2113 пятен/106 клеток) по сравнению с группой, которую вакцинировали MVATG18377 (от 52 до 468 пятен/106 клеток). Rv1813-специфический ответ детектировали только у мышей, вакцинированных MVATG18377. Независимо от вакцины, вводимой мышам C57BL/6, ни CFPIO- ни Rv2626-специфического сигнала не появлялось. Как и ожидали, при вакцинации мышей пустым вирусом MVATGN33.1, ответ в виде продукции IFNy не детектировали (Фиг. 2а).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ МИКОБАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 2011 |
|
RU2576007C2 |
| Рекомбинантный штамм Mycobacterium bovis rBCG-1 на основе вакцинного штамма Mycobacterium bovis BCG strain Russia 368 | 2022 |
|
RU2807732C1 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АКТИВНОЙ ИНФЕКЦИИ MYCOBACTERIUM TUBERCULOSIS | 2013 |
|
RU2659149C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-CFP10-DBD, РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], СПОСОБ ПОЛУЧЕНИЯ, ИММОБИЛИЗАЦИИ, КОНЦЕНТРИРОВАНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ESAT6-CFP10-DBD НА ДЕКСТРАНЕ, РЕКОМБИНАНТНЫЙ БЕЛОК ESAT6-CFP10-DBD И ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕЛОК ESAT6-CFP10-DBD | 2013 |
|
RU2539026C1 |
| ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2019 |
|
RU2724896C1 |
| Гибридный белок, ДНК, генетическая конструкция, рекомбинантная клетка, вакцина на основе гибридного белка для профилактики и лечения туберкулеза (варианты) | 2015 |
|
RU2615440C2 |
| ПРОФИЛАКТИЧЕСКАЯ ИЛИ ТЕРАПЕВТИЧЕСКАЯ ПОЛИЭПИТОПНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИННАЯ КОНСТРУКЦИЯ, ОБЕСПЕЧИВАЮЩАЯ ИНДУКЦИЮ КЛЕТОЧНОГО ИММУННОГО ОТВЕТА CD4+ ИЛИ CD8+ Т-ЛИМФОЦИТОВ | 2011 |
|
RU2539035C2 |
| ВАКЦИНА РЕКОМБИНАНТНАЯ ПРОТИВОТУБЕРКУЛЕЗНАЯ И АДЪЮВАНТ ДЛЯ НЕЕ | 2017 |
|
RU2665817C1 |
| КОНЪЮГАТЫ И КОМПОЗИЦИИ ДЛЯ ИММУНОТЕРАПИИ И ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ | 2010 |
|
RU2597989C2 |




















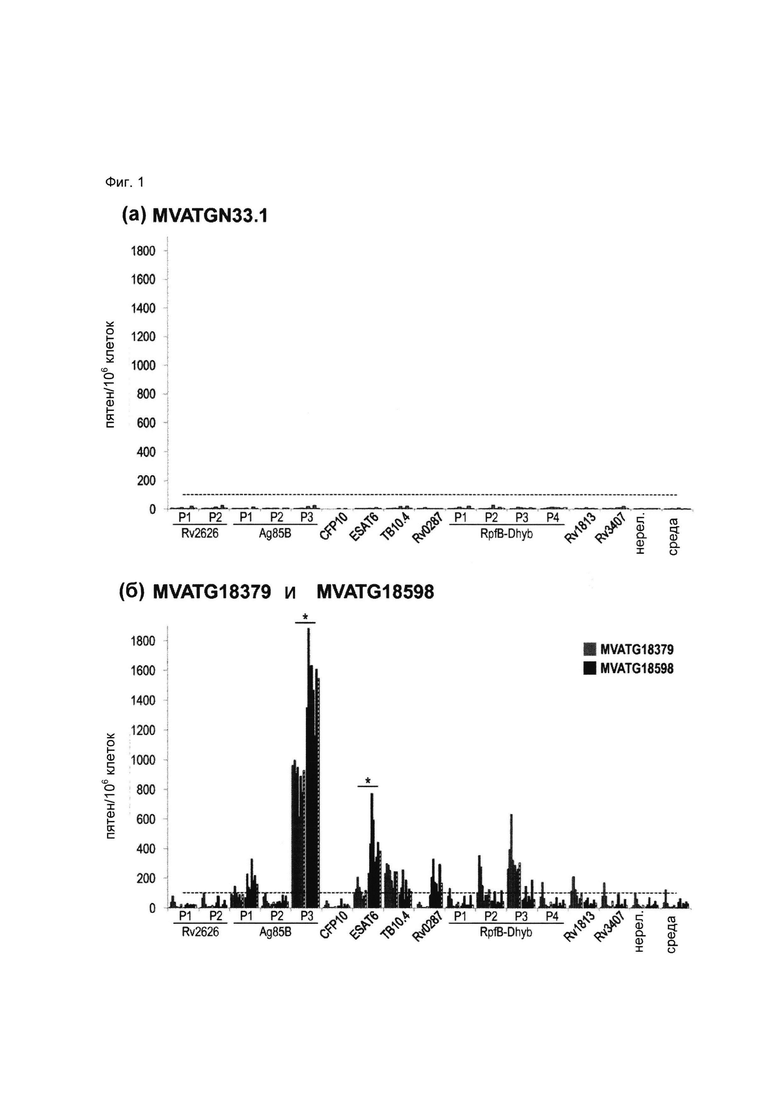
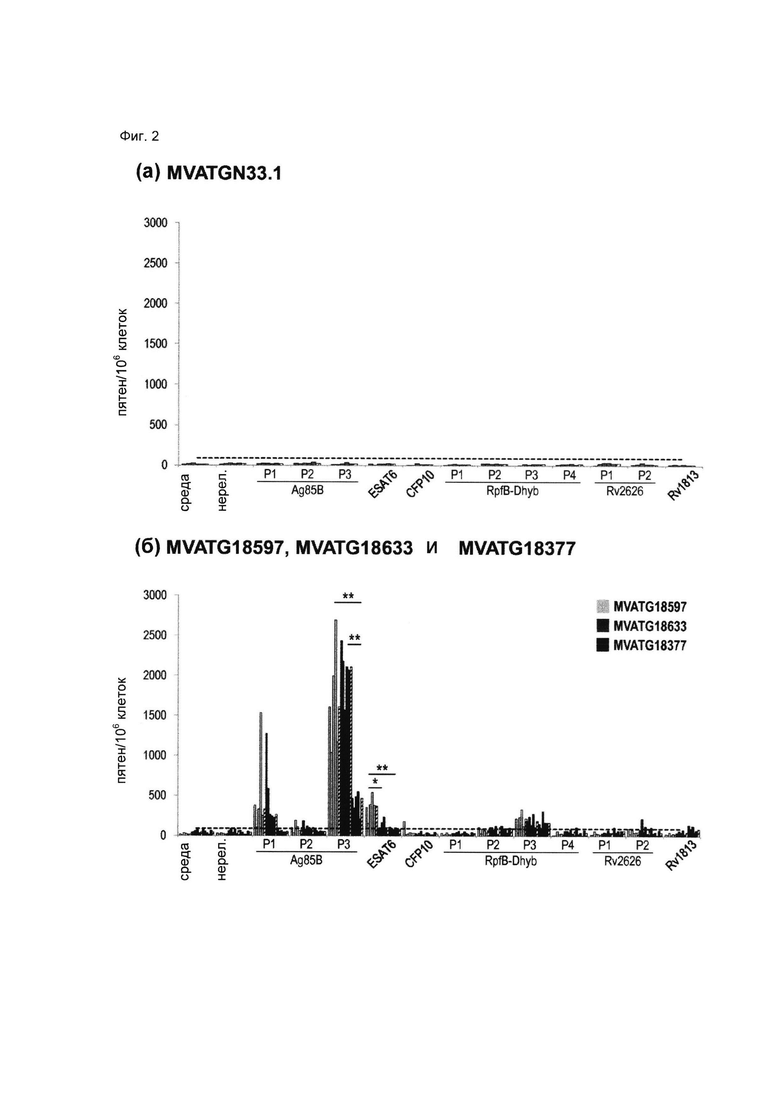
Изобретение относится к биотехнологии. Описан вектор экспрессии на основе поксвируса, который содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) гибрид гетероолигомерных микобактериальных антигенов ESAT6 и CFP10 и предпочтительно гибрид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1. Представлена клетка-хозяин для продуцирования вектора на основе поксвируса по любому из пп. 1-13, содержащая вектор на основе поксвируса по любому из пп. 1-13. Описана композиция для лечения или предупреждения микобактериальной инфекции или любого заболевания и патологического состояния, вызванного или ассоциированного с такой микобактериальной инфекцией, содержащая эффективное количество вектора по любому из пп. 1-13 или клетки-хозяина по п. 14 или любое их сочетание. Данное изобретение служит для индукции или стимулирования иммунного ответа с целью обеспечения защитного ответа против микобактериальной инфекции или любого заболевания, вызванного или связанного с микобактериальной инфекцией. 5 н. и 21 з.п. ф-лы, 2 ил., 4 табл., 4 пр.
1. Вектор экспрессии на основе поксвируса, который содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) гибрид гетероолигомерных микобактериальных антигенов ESAT6 и CFP10 и предпочтительно гибрид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1.
2. Вектор по п. 1, который дополнительно содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) гибрид гетероолигомерных микобактериальных антигенов ТВ10.4 (Rv0288) и ТВ9.8 (Rv0287) и предпочтительно гибрид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 2.
3. Вектор по п. 1, который дополнительно содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) один или несколько дополнительных микобактериальных антигенов, предпочтительно указанный(е) дополнительный(е) микобактериальный(е) антиген(ы) выбран(ы) из группы, состоящей из антигенов активной фазы, фазы оживления и латентной фазы.
4. Вектор по п. 1, где указанные гетероолигомерные микобактериальные антигены и указанные один или несколько дополнительных микобактериальных антигенов независимо получены из видов микобактерий туберкулезного комплекса, выбранных из группы, состоящей из М. tuberculosis (Mtb), М. bovis, М. bovis BCG, М. africanum, М. canetti, М. caprae и М. microti.
5. Вектор по п. 3, где указанные один или несколько дополнительных микобактериальных антигенов выбраны из группы, состоящей из Ag85B (Rv1886), RpfB, RpfD, Rv1813, Rv2626 и Rv3407 и полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 3 или 4.
6. Вектор по п. 5, который содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) гибрид гетероолигомерных микобактериальных антигенов CFP10 и ESAT6, а также экспрессирует дополнительные микобактериальные антигены Rv2626 и Ag85B.
7. Вектор по п. 5, который содержит молекулу(ы) нуклеиновой кислоты, кодирующую(ие) гибрид гетероолигомерных микобактериальных антигенов CFP10 и ESAT6 и гибрид гетероолигомерных микобактериальных антигенов ТВ10.4 и ТВ9.8, а также дополнительно экспрессирует дополнительные микобактериальные антигены Rv2626, Ag85B, RpfB, RpfD, Rv3407 и Rv1813.
8. Вектор по п. 1, где указанные дополнительные микобактериальные антигены кодируются в виде отдельных полипептидов или в виде слитого из двух, предпочтительно указанный слитый полипептид дополнительных микобактериальных антигенов включает (i) Rv2626 и Ag85B или (ii) RpfB и RpfD или (ii) Rv3407 и Rv1813.
9. Вектор по п. 8, где указанный слитый полипептид дополнительных микобактериальных антигенов содержит один или несколько пептидов для обеспечения правильного фолдинга указанных микобактериальных антигенов, таких как сайт расщепления протеазы, встроенный между расположенными против хода транскрипции и по ходу транскрипции полипептидами указанного слитого полипептида.
10. Вектор по п. 9, где указанный слитый полипептид дополнительных микобактериальных антигенов содержит любую из аминокислотных последовательностей, приведенных в SEQ ID NO: 8 - SEQ ID NO: 12.
11. Вектор по любому из пп. 1-10, где указанный вектор на основе поксвируса выбран из группы, состоящей из векторов на основе вирусов fowlpox, canarypox и vaccinia, и предпочтительно вектора на основе вируса vaccinia, выбранного из группы, состоящей из штаммов Copenhagen, Wyeth, NYVAC и модифицированного штамма Ankara (MVA).
12. Вектор по п. 11, который выбран из группы, состоящей из:
(i) вектора на основе поксвируса, содержащего молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные микобактериальные антигены ESAT-6 и CFP10, молекулу нуклеиновой кислоты, кодирующую Ag85B, и молекулу нуклеиновой кислоты, кодирующую Rv2626; и
(ii) вектора на основе поксвируса, содержащего молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные микобактериальные антигены ESAT-6 и CFP10; молекулу нуклеиновой кислоты, кодирующую гибрид, содержащий гетероолигомерные микобактериальные антигены ТВ10.4 и ТВ9.8, молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены Rv2626 и Ag85B; молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены RpfB и RpfD, и молекулу нуклеиновой кислоты, кодирующую слитый полипептид, содержащий дополнительные микобактериальные антигены Rv3407 и Rv1813.
13. Вектор по любому из пп. 1-10, где указанная(ые) молекула(ы) нуклеиновой кислоты помещена(ы) под транскрипционный контроль промотора, подходящего для обеспечения экспрессии кодируемого(ых) гибрида(ов) и дополнительных микобактериальных антигенов в клетке млекопитающего, и в частности под транскрипционный контроль промотора vaccinia, предпочтительно выбранного из группы, состоящей из промоторов р7.5K, pH5R, pB2R, pSE/L и pA35R.
14. Клетка-хозяин для продуцирования вектора на основе поксвируса по любому из пп. 1-13, содержащая вектор на основе поксвируса по любому из пп. 1-13.
15. Композиция для лечения или предупреждения микобактериальной инфекции или любого заболевания и патологического состояния, вызванного или ассоциированного с такой микобактериальной инфекцией, содержащая эффективное количество вектора по любому из пп. 1-13 или клетки-хозяина по п. 14 или любое их сочетание.
16. Композиция по п. 15, которая дополнительно содержит фармацевтически приемлемый носитель.
17. Применение вектора по любому из пп. 1-13 для получения лекарственного средства для предупреждения или лечения микобактериальной инфекции или любого заболевания или патологического состояния, вызванного или ассоциированного с указанной микобактериальной инфекцией.
18. Применение по п. 17, где указанное лекарственное средство предназначено:
а) для предупреждения инфекции или отсрочивания риска микобактериальной инфекции у нуждающегося в этом индивидуума, особенно у индивидуума, который находился в тесном контакте с инфицированным индивидуумом, у которого развилась активная форма заболевания;
б) для лечения активной формы заболевания у индивидуума, инфицированного видом Mycobacterium, и в частности М. tuberculosis;
в) для предупреждения или лечения реактивации у индивидуума, латентно инфицированного видом Mycobacterium, и в частности М. tuberculosis; или
г) для применения в качестве бустера BCG.
19. Применение по п. 17, где указанное лекарственное средство предназначено для применения в сочетании с одним или несколькими химиотерапевтическими препаратами, эффективными в отношении микобактериальной инфекции, и в частности с одним или несколькими химиотерапевтическими антибиотиками.
20. Применение по п. 17 для применения с целью индукции или усиления иммунного ответа у индивидуума, которому осуществили введение.
21. Применение по п. 20, где указанный индуцированный или усиленный иммунный ответ представляет собой CD4+ и/или CD8+-опосредованный Т-клеточный ответ, направленный против микобактериального антигена/эпитопа.
22. Применение композиции по любому из пп. 15, 16 для получения лекарственного средства для предупреждения или лечения микобактериальной инфекции или любого заболевания и патологического состояния, вызванного или ассоциированного с такой микобактериальной инфекцией.
23. Применение по п. 22, где указанное лекарственное средство предназначено:
а) для предупреждения инфекции или отсрочивания риска микобактериальной инфекции у нуждающегося в этом индивидуума, особенно у индивидуума, который находился в тесном контакте с инфицированным индивидуумом, у которого развилась активная форма заболевания;
б) для лечения активной формы заболевания у индивидуума, инфицированного видом Mycobacterium, и в частности М. tuberculosis;
в) для предупреждения или лечения реактивации у индивидуума, латентно инфицированного видом Mycobacterium, и в частности М. tuberculosis; или
г) для применения в качестве бустера BCG.
24. Применение по любому из пп. 22, 23, где указанное лекарственное средство предназначено для применения в сочетании с одним или несколькими химиотерапевтическими препаратами, эффективными в отношении микобактериальной инфекции, и в частности с одним или несколькими химиотерапевтическими антибиотиками.
25. Применение по любому из пп. 22, 23, где указанное лекарственное средство предназначено для применения для индукции или усиления иммунного ответа у индивидуума, которому осуществили введение.
26. Применение по п. 25, где указанный индуцированный или усиленный иммунный ответ представляет собой Т-клеточный ответ, опосредованный CD4+ и/или CD8+, направленный против микобактериального антигена/эпитопа.
| WO 2012057904 A1, 03.05.2012 | |||
| WO 2011144951 A1, 24.11.2011 | |||
| WO 2006136162 A2, 28.12.2006 | |||
| WO 2012129227 A1, 27.09.2012 | |||
| Приспособление для получения на экране кинематографических рельефных изображений | 1928 |
|
SU12436A1 |
Авторы
Даты
2019-07-23—Публикация
2015-01-09—Подача