Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам человека и фрагментам антител, специфичным в отношении CD20 человека, к содержащим их фармацевтическим композициям и к способам лечения.
Уровень техники
CD20 (также известный как антиген ограниченной дифференцировки B-лимфоцитов человека или Bp35; поверхностный антиген B-лимфоцитов B1, Leu-16, BM5, и LF5) представляет собой гидрофобный трансмембранный белок с молекулярной массой ~35 кДа, экспрессирующийся на пре-B и зрелых B-лимфоцитах (Valentine et al. (1989) J Biol Chem 264:11282; Einfield et al. (1988) EMBO J 7:711-717). Аминокислотная последовательность CD20 человека представлена как SEQ ID NO:1 (номер доступа в GenBank NP_690605). Анти-CD20 антитела описаны, например, в US 5736137, WO 2004/056312 и US 2004/0167319.
Способы создания антител, используемых в терапии человека, включают получение химерных антител и гуманизированных антител (см., например, US 6949245). См. также, например, WO 94/02602 и US 6596541, в которых описаны способы получения генетически модифицированных мышей, способных к выработке антител, используемых в терапии человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к антителам человека, предпочтительно, рекомбинантным антителам человека, которые специфически связываются с CD20 человека. Эти антитела характеризуются специфическим связыванием с CD20 человека и опосредуют цитолиз клеток B-клеточной лимфомы, экспрессирующих CD20. Антитела могут быть полноразмерными (например, IgG1 или IgG4 антитела) или могут содержать только антиген-связывающий участок (например, Fab, F(ab')2 или scFv фрагмент), и могут быть модифицированы с эффектом на активность, например, для устранения или усиления остаточных эффекторных функций (Reddy et al. (2000) J. Immunol. 164:1925-1933).
Антитело или его антиген-связывающий фрагмент специфически связываются с CD20 человека и способны индуцировать комплемент-зависимую цитотоксичность (CDC) в отношении клеток, экспрессирующих CD20, в присутствии комплемента, где антитело в концентрации приблизительно 10 нМ или меньше индуцирует 50% лизис клеток Daudi и RL в присутствии 5% нормальной сыворотки человека с комплементом. В предпочтительных вариантах осуществления концентрация антитела, которая индуцирует 50% лизис, составляет приблизительно 5 нМ или менее; приблизительно 2 нМ или менее; или приблизительно 1 нМ или менее. В одном из вариантов осуществления антитело или его фрагмент демонстрируют EC50 0,2 нМ или менее, как измерено на клетках Daudi, или EC50 0,4 нМ или менее, как измерено с помощью клеток RL. В различных вариантах осуществления антитело или фрагмент антитела способны повышать бессимптомное время выживания от приблизительно 2-х до приблизительно 9-ти раз или более, по сравнению с контрольными животными на мышиной модели лимфомы человека.
Антитело или его фрагмент специфически связываются с CD20 человека и способны индуцировать антитело-зависимую клеточную цитотоксичность (ADCC) в отношении клеток, экспрессирующих CD20, в присутствии мононуклеарных клеток периферической крови (PBMC), где антитело демонстрирует EC50 приблизительно 1 нМ или менее, как измерено на клетках Daudi. В предпочтительных вариантах осуществления антитело демонстрирует EC50 приблизительно 50 пМ или менее; приблизительно 20 пМ или менее; приблизительно 10 пМ или менее. В предпочтительном варианте осуществления антитела, демонстрирующие повышенную активность ADCC, могут содержать сниженные уровни фукозилирования, например, приблизительно 5% фукозы.
В одном из вариантов осуществления антитело или антиген-связывающий участок антитела по изобретению содержат последовательность вариабельной области тяжелой цепи (HCVR), выбранную из группы, состоящей из SEQ ID NO:3, 19, 23, 27, 43, 47, 51, 67, 71, 75, 91, 95, 99, 115, 119, 123, 139, 143, 147, 163, 167, 171, 187, 191, 195, 211, 215, 219, 235, 239, 243, 259, 263, 267, 283, 287, 291, 307, 311, 315, 331, 335, 339, 355, 359, 363, 379, 383, 387, 395 и 403, или по существу сходную с ней последовательность. В предпочтительном варианте осуществления антитело или фрагмент содержат последовательность HCVR, выбранную из группы, состоящей из SEQ ID NO:339, 195 и 243.
В конкретном варианте осуществления антитело или его антиген-связывающий фрагмент дополнительно содержат последовательность вариабельной области легкой цепи (LCVR), выбранную из группы, состоящей из SEQ ID NO:11, 21, 25, 35, 45, 49, 59, 69, 73, 83, 93, 97, 107, 117, 121, 131, 141, 145, 155, 165, 169, 179, 189, 193, 203, 213, 217, 227, 237, 241, 251, 261, 265, 275, 285, 289, 299, 309, 313, 323, 333, 337, 347, 357, 361, 371, 381 и 385, или по существу сходную с ней последовательность. В предпочтительном варианте осуществления антитело или фрагмент содержат LCVR, выбранную из группы, состоящей из SEQ ID NO:347, 203 и 251.
В конкретном варианте осуществления антитело или его фрагмент содержат пары последовательностей HCVR/LCVR, выбранные из группы, состоящей из SEQ ID NO:3/11, 19/21, 23/25, 27/35, 43/45, 47/49, 51/59, 67/69, 71/73, 75/83, 91/93, 95/97, 99/107, 115/117, 119/121, 123/131, 139/141, 143/145, 147/155, 163/165, 167/169, 171/179, 187/189, 191/193, 195/203, 211/213, 215/217, 219/227, 235/237, 239/241, 243/251, 259/261, 263/265, 267/275, 283/285, 287/289, 291/299, 307/309, 311/313, 315/323, 331/333, 335/337, 339/347, 355/357, 359/361, 363/371, 379/381 и 383/385. В предпочтительном варианте осуществления антитело или его фрагмент содержат пары последовательностей HCVR/LCVR, выбранные из группы, состоящей из SEQ ID NO:339/347, 195/203 и 243/251.
Во втором аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, которая кодирует антитело или его фрагмент. В конкретных вариантах осуществления молекула нуклеиновой кислоты кодирует HCVR, где нуклеотидная последовательность выбрана из группы, состоящей из SEQ ID NO:2, 18, 22, 26, 42, 46, 50, 66, 70, 74, 90, 94, 98, 114, 118, 122, 138, 142, 146, 162, 166, 170, 186, 190, 194, 210, 214, 218, 234, 238, 242, 258, 262, 266, 282, 286, 290, 306, 310, 314, 330, 334, 338, 354, 358, 362, 378, 382, 386, 394 и 402, или по существу сходную с ней последовательность. В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей LCVR, где нуклеотидная последовательность выбрана из группы, состоящей из SEQ ID NO:10, 20, 24, 34, 44, 48, 58, 68, 72, 82, 92, 96, 106, 116, 120, 130, 140, 144, 154, 164, 168, 178, 188, 192, 202, 212, 216, 226, 236, 240, 250, 260, 264, 274, 284, 288, 298, 308, 312, 322, 332, 336, 346, 356, 360, 370, 380 и 384, или по существу сходную с ней последовательность. В предпочтительном варианте осуществления антитело или фрагмент антитела содержат HCVR, которую кодирует молекула нуклеиновой кислоты, выбранная из группы, состоящей из SEQ ID NO:338, 194 и 242, и LCVR, которую кодирует молекула нуклеиновой кислоты, выбранная из группы, состоящей из SEQ ID NO:346, 202 и 250, соответственно.
В третьем аспекте изобретение относится к антителу или его антиген-связывающему фрагменту, содержащему CDR3 тяжелой цепи (HCDR3), которая, в свою очередь, содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:9, 33, 57, 81, 104, 129, 153, 177, 201, 225, 249, 273, 297, 321, 345, 369, 393, 401 и 409; и CDR3 легкой цепи (LCDR3), которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:17, 41, 65, 89, 113, 137, 161, 185, 209, 233, 257, 281, 305, 329, 353 и 377. В предпочтительном варианте осуществления антитело или его фрагмент содержат последовательности HCDR3 и LCDR3, выбранные из пар последовательностей HCDR3/LCDR3 SEQ ID NO:345/353, 201/209 и 249/257.
В конкретном варианте осуществления антитело или его фрагмент дополнительно содержат доменную последовательность CDR1 тяжелой цепи (HCDR1), выбранную из группы, состоящей из SEQ ID NO:5, 29, 53, 77, 101, 125, 149, 173, 197, 221, 245, 269, 293, 317, 341, 365, 389, 397 и 405; доменную последовательность CDR2 тяжелой цепи (HCDR2), выбранную из группы, состоящей из SEQ ID NO:7, 31, 55, 79, 103, 127, 151, 175, 199, 223, 247, 271, 295, 319, 343, 367, 391, 399 и 407; доменную последовательность CDR1 легкой цепи (LCDR1), выбранную из группы, состоящей из SEQ ID NO:13, 37, 61, 85, 109, 133, 157, 181, 205, 229, 253, 277, 301, 325, 349 и 373; и доменную последовательность CDR2 легкой цепи (LCDR2), выбранную из группы, состоящей из SEQ ID NO:15, 39, 63, 87, 111, 135, 159, 183, 207, 231, 255, 279, 303, 327, 351 и 375. В предпочтительном варианте осуществления антитело или его фрагмент содержат последовательности CDR тяжелой и легкой цепей, выбранные из группы, состоящей из SEQ ID NO:341, 343, 345, 349, 351 и 353; 197, 199, 201, 205, 207 и 209; и 245, 247, 249, 253, 255 и 257, соответственно.
В четвертом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей антитело или антиген-связывающие фрагменты по изобретению, где молекулы нуклеиновой кислоты, кодирующие домен HCDR3 и домен LCDR3, выбраны из группы, состоящей из SEQ ID NO:9 и 16; 33 и 41; 57 и 65; 81 и 89; 104 и 113; 129 и 137; 153 и 161; 177 и 185; 201 и 209; 225 и 233; 249 и 257; 273 и 281; 297 и 305; 321 и 329; 345 и 353; и 369 и 377, соответственно.
В пятом аспекте изобретение относится к антителу или антиген-связывающему фрагменту, содержащему домен HCDR3 и домен LCDR3, где домен HCDR3 содержит аминокислотную последовательность по формуле X1 - X2 - X3 - X4 - X5 - X6 - X7 - X8 -X9 - X10 - X11 - X12 - X13 - X14 - X15 - X16 -X17 - X18 - X19 (SEQ ID NO:412), где X1=A, V или T; X2=K; X3=D; X4=P, F или G; X5=S или H; X6=Y; X7=G; X8=S или H; X9=G или F; X10=S или Y; X11=Y, N или S; X12=Y, G или H; X13=G, L или S; X14=Y, M или D; X15=Y, D или V; X16=G, V или отсутствует; X17=M или отсутствует; X18=D или отсутствует; X19=V или отсутствует; и домен LCDR3 содержит аминокислотную последовательность по формуле X1 - X2 - X3 - X4 - X5 - X6 - X7 - X8 - X9 (SEQ ID NO:415), где X1=Q; X2=Q; X3=R или S; X4=N, Y или F; X5=N, D или Y; X6=W; X7=P; X8=L; X9=T.
В конкретном варианте осуществления антитело или антиген-связывающий фрагмент дополнительно содержат домены тяжелой и легкой цепей CDR1 и CDR2, где домен HCDR1 содержит аминокислотную последовательность по формуле X1 - X2 - X3 - X4 - X5 - X6 - X7 - X8 (SEQ ID NO:410), где X1=G; X2=F или I; X3=T; X4=F; X5=H, R или Y; X6=D; X7=Y; X8=T или A; домен HCDR2 содержит аминокислотную последовательность по формуле X1 - X2 - X3 - X4 - X5 - X6 - X7 - X8 (SEQ ID NO:411), где X1=I; X2=S; X3=W; X4=N; X5=S; X6=G или D; X7=S, Y или T; X8=I или L; домен LCDR1 содержит аминокислотную последовательность по формуле X1 - X2 - X3 - X4 - X5 -X6 (SEQ ID NO:413), где X1=Q; X2=S; X3=V или I; X4=S; X5=S или R; X6=Y или N; и домен LCDR2 содержит аминокислотную последовательность по формуле X1 - X2 - X3 (SEQ ID NO:414), где X1=E, G или V; X2=A; X3=S.
В шестом аспекте изобретение относится к рекомбинантным экспрессионным векторам, несущим молекулы нуклеиновой кислоты по изобретению, и к клеткам-хозяевам, в которые введены такие векторы, а также к способам получения антител или их фрагментов по изобретению путем культивирования клеток-хозяев по изобретению. Клетка-хозяин может быть прокариотической или эукариотической клеткой; предпочтительно, клетка-хозяин представляет собой клетку E. coli или клетку млекопитающего, такую как клетка CHO. В предпочтительном варианте осуществления антитело может быть получено с различными уровнями фукозилирования. Например, клеточная линия CHO может быть выбрана для выработки антитела или фрагмента антитела с уровнем фукозилирования от минимального значения приблизительно 5% до максимального значения приблизительно 95%.
В седьмом аспекте изобретение относится к фармацевтической композиции, которая содержит анти-CD20 антитело человека или его фрагмент и фармацевтически приемлемый носитель.
В восьмом аспекте изобретение относится к полному антителу человека или фрагменту антитела, способному связываться с CD20 человека, где значение EC50 составляет менее приблизительно 10 нМ, как измерено в экспериментах связывания с клетками (описано ниже). В предпочтительном варианте осуществления антитело по изобретению имеет значение EC50, равное приблизительно от 10-8 до приблизительно 10-12 M или выше, например, по меньшей мере 10-8 M, по меньшей мере 10-9 M, по меньшей мере 10-10 M, по меньшей мере 10-11 M или по меньшей мере 10-12 M, при измерении связывания с антигеном, представленным на поверхности клетки.
Настоящее изобретение относится к анти-CD20 антителам с измененной структурой гликозилирования. В некоторых вариантах применения модификация для удаления нежелательных участков гликозилирования может быть эффективна, или отсутствие у антитела фукозной части имеется на олигосахаридной цепи, например, для усиления функции антитело-зависимой клеточной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других вариантах применения модификация гликозилирования может быть проведена для изменения комплемент-зависимой цитотоксичности (CDC).
В девятом аспекте изобретение относится к антителу или антиген-связывающему фрагменту антитела, как описано выше, которые используют для облегчения течения или подавления заболевания или состояния, опосредованного CD20, у человека. В предпочтительном варианте осуществления заболевание или состояние, на которое направлено лечение, представляет собой неходжкинскую лимфому, ревматоидный артрит, системную красную волчанку, болезнь Крона, хронический лимфоцитарный лейкоз и воспалительные заболевания. В другом варианте осуществления изобретение относится к способу облегчения течения или подавления заболевания или состояния, опосредованного CD20, у человека, который включает введение терапевтически эффективного количества антитела или антиген-связывающего фрагмента антитела, как описано выше. Кроме того, изобретение относится к применению антитела или антиген-связывающего фрагмента антитела по изобретению для получения лекарственного средства, которое используют для смягчения или подавления заболевания или состояния, опосредованного CD20, у человека.
Остальные объекты и преимущества изобретения станут очевидны из нижеследующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
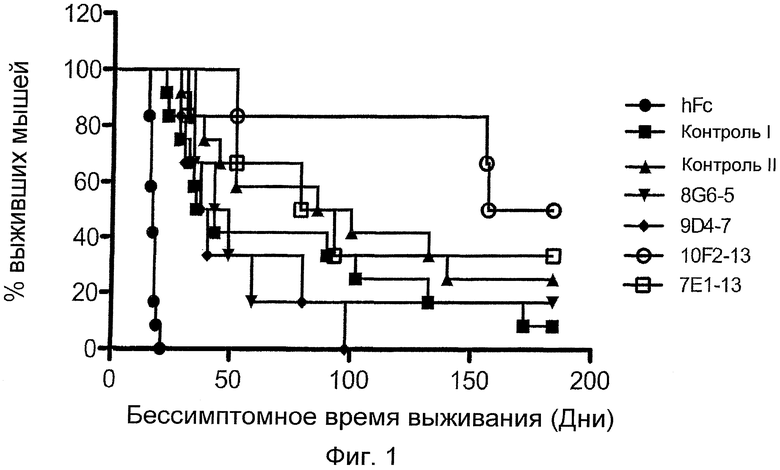
Фиг.1. Кривая бессимптомного выживания. Результаты показаны для контрольного Fc человека, контрольных антител I и II и антител: 8G6-5, 9D4-7, 10F2-13 и 7E1-13.
ПОДРОБНОЕ ОПИСАНИЕ
Перед описанием способов по настоящему изобретению следует иметь в виду, что настоящее изобретение не ограничено отдельными способами и описанными экспериментальными условиями, поскольку такие способы и условия могут изменяться. Также следует иметь в виду, что терминология использована в данном документе только в целях описания частных вариантов осуществления и не является ограничивающей, поскольку объем настоящего изобретения может быть ограничен только формулой изобретения.
Если не определено иначе, все использованные в описании технические и научные термины имеют то же самое значение, в котором они обычно понимаются специалистом в области, к которой относится настоящее изобретение. Хотя любые способы и материалы, сходные или эквивалентные описанным в настоящем описании, можно использовать в практическом осуществлении или тестировании по настоящему изобретению, предпочтительные способы и материалы описаны в данном документе.
Определения
Термин "CD20" включает варианты и изоформы CD20 человека, которые экспрессируются клетками естественным образом. Связывание антитела по изобретению с антигеном CD20 опосредует цитолиз клеток, экспрессирующих CD20 (например, опухолевой клетки). Цитолиз клеток, экспрессирующих CD20, может происходить разными способами, включая комплемент-зависимую цитотоксичность (CDC) по отношению к клеткам, экспрессирующим CD20, апоптоз клеток, экспрессирующих CD20, фагоцитоз эффекторными клетками клеток, экспрессирующих CD20, или опосредованную эффекторными клетками антитело-зависимую клеточную цитотоксичность (ADCC) по отношению к клеткам, экспрессирующим CD20.
Как используется в настоящем описании, термин "антитело" означает молекулу иммуноглобулина, которая содержит четыре полипептидные цепи, две тяжелые (H) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенную в настоящем описании как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенную в настоящем описании как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, названные областями, определяющими комплементарность (CDR), в которые вкраплены более консервативные области, названные каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Как используется в настоящем описании, термин "антиген-связывающий участок" антитела (или просто "участок антитела" или "фрагмент антитела") относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, hCD20). Показано, что эти фрагменты полноразмерного антитела могут выполнять антиген-связывающую функцию антитела. Примеры связывающих фрагментов, охваченных термином "антиген-связывающий участок" антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL1 и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, который содержит два фрагмента F(ab)', связанных дисульфидным мостиком у шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; (v) фрагмент dAb (Ward et al. (1989) Nature 241:544-546), который состоит из домена VH; и (vi) выделенная, определяющая комплементарность область (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются разными генами, они могут быть объединены с помощью рекомбинатных способов синтетическим линкером, что обеспечивает возможность их получения в виде единой смежной цепи, в которой области VL и VH спариваются, образуя моновалентные молекулы (известные как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также охватываются термином "антиген-связывающий участок" антитела. Другие формы одноцепочечных антител, такие как диатела, также включены в термин (см., например, Holliger et al. (1993) Proc. Natl. Acad Sci. USA 90:6444-6448).
"CDR" или область, определяющая комплементарность, представляет собой область гипервариабельности, в которую вкраплены более консервативные области, названные каркасными областями (FR). В различных вариантах осуществления анти-hCD20 антитела или фрагмента по изобретению FR могут быть идентичны зародышевой последовательности человека или могут быть естественно или искусственно модифицированы.
Как используется в настоящем описании, термин "поверхностный плазмонный резонанс", относится к оптическому явлению, которое позволяет анализировать взаимодействия в реальном времени за счет обнаружения изменений в концентрации белков внутри биосенсорной матрицы, например, с использованием системы BIACORE™ (Pharmacia Biosensor AB).
Термин "эпитоп" относится к антигенной детерминанте, которая взаимодействует со специфическим антиген-связывающим участком в вариабельной области молекулы антитела, известной как паратоп. Один антиген может иметь более одного эпитопа. Эпитопы могут быть либо конформационными, либо линейными. Конформационный эпитоп образован путем случайного наложения друг на друга аминокислот из различных сегментов одной (или более) линейной полипептидной цепи(цепей). Линейный эпитоп представляет собой эпитоп, образованный дополнительными аминокислотными остатками в полипептидной цепи. В определенных обстоятельствах эпитоп может включать другие части, такие как сахариды, фосфорильные группы или сульфонильные группы антигена.
Термин "по существу идентичный", используемый по отношению к нуклеиновой кислоте или ее фрагменту, указывает, что при оптимальном выравнивании соответствующими нуклеотидными вставками или делециями с другой нуклеиновой кислотой (или ее комплементарной цепью) существует идентичность нуклеотидной последовательности, по меньшей мере приблизительно 95% и, более предпочтительно, по меньшей мере приблизительно 96%, 97%, 98% или 99% нуклеотидных оснований, как измерено любым хорошо известным алгоритмом идентичности последовательности, таким как FASTA, BLAST или GAP, что обсуждается ниже.
Применительно к полипептидам термин "по существу сходный" означает, что две пептидные последовательности при оптимальном выравнивании, таком как выравнивание с помощью программ GAP или BESTFIT, c использованием пропуска весов по умолчанию, разделяют по меньшей мере 95% идентичности последовательности, даже более предпочтительно, по меньшей мере 98% или 99% идентичности последовательности. Предпочтительно, положения остатков, которые не являются идентичными, различаются консервативными аминокислотными заменами. "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток замещен другим аминокислотным остатком, имеющим боковую цепь (R-группу) со сходными химическими свойствами (например, заряд или гидрофобность). Как правило, консервативная аминокислотная замена по существу не изменяет функциональные свойства белка. В случае, если две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, то процент или степень сходства могут быть увеличены для коррекции консервативной природной замены. Способы проведения такой корректировки хорошо известны специалистам в данной области. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331. Примеры аминокислотных групп, которые имеют боковые цепи со сходными химическими свойствами, включают 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатические гидроксильные боковые цепи: серин и треонин; 3) амидсодержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) основные боковые цепи: лизин, аргинин и гистидин; 6) кислотные боковые цепи: аспартат и глутамат и 7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными консервативными аминокислотными заменами являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. Альтернативно, консервативная замена представляет собой любую замену, которая имеет положительное значение в PAM250 матрице логарифмического правдоподобия, раскрытой в Gonnet et al. (1992) Science 256: 1443 45. "Умеренно консервативная" замена означает любую замену с неотрицательным значением в PAM250 матрице логарифмического правдоподобия.
Сходство последовательности полипептидов обычно измеряют с помощью программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белков подбирает сходные последовательности, используя меры сходства, заданные различным заменам, делециям и другим модификациям, включая консервативные аминокислотные замены. Например, программное обеспечение GCG содержит программы, такие как GAP и BESTFIT, которые можно использовать с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды различных видов организмов, или между белком дикого типа и его мутантом. См., например, GCG Version 6.1. Полипептидные последовательности также можно сравнивать, используя FASTA с параметрами по умолчанию или рекомендованными параметрами; программу в GCG Version 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивание и процент идентичности последовательности областей с наилучшим перекрытием между последовательностью по запросу и последовательностью поиска (Pearson (2000) выше). Другим предпочтительным алгоритмом для сравнения последовательности по изобретению с базой данных, содержащей большое число последовательностей различных организмов, является компьютерная программа BLAST, особенно BLASTP или TBLASTN, с использованием параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403 410 и Altschul et al. (1997) Nucleic Acids Res. 25:3389 402.
Термин "эффективное количество" означает концентрацию или количество антитела или антиген-связывающего фрагмента антитела, которое приводит к достижению конкретной заявленной цели. "Эффективное количество" анти-CD20 антитела или его антиген-связывающего фрагмента антитела может быть определено эмпирически. Кроме того, "терапевтически эффективное количество" означает концентрацию или количество анти-CD20 антитела или его антиген-связывающего фрагмента, которое эффективно для достижения заявленного терапевтического эффекта. Это количество также может быть определено эмпирически.
Получение антител человека
Способы получения антител человека включают, например, VelocImmune™ (Regeneron Farmaceuticals), технологию XenoMouse™ (Green et al. (1994) Nature Genetics 7:13-21; Abgenix), "минилокусный" подход и фаговый дисплей (и см., например, US 5545807, US 6787637). Технология VelocImmune™ (US 6596541) включает способ создания высокоспецифичных полностью человеческих антител к выбранному антигену. Эта технология включает создание трансгенной мыши с геномом, содержащим вариабельные области тяжелой и легкой цепей человека, функционально связанные с эндогенными локусами константной области мыши таким образом, что мышь в ответ на антигенную стимуляцию продуцирует антитело, которое содержит вариабельную область человека и константную область мыши. ДНК, кодирующую вариабельные области тяжелых и легких цепей антитела, выделяли и функционально связывали с ДНК, кодирующей константные области тяжелой и легкой цепей человека. ДНК затем экспрессировалась в клетках, способных к экспрессии полностью человеческого антитела. В конкретном варианте осуществления данные клетки представляют собой клетки CHO.
Антитела могут быть использованы в терапии скорее для блокирования взаимодействия лиганд-рецептор или ингибирования взаимодействия компонентов рецептора, чем для цитолиза клеток путем фиксации комплемента (CDC) и участия в антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Константная область антитела важна для способности антитела фиксировать комплемент и опосредовать клеточно-зависимую цитотоксичность. Таким образом, изотип антитела может быть выбран на основании того, желательно ли для антитела опосредовать цитотоксичность.
Иммуноглобулины человека могут существовать в двух формах, что связано с гетерогенностью шарнирного участка. В одной из форм молекула иммуноглобулина содержит стабильную четырехцепочечную конструкцию приблизительно 150-160 кДа, в которой димеры удерживаются вместе за счет внутрицепочечной дисульфидной связи тяжелой цепи. Во второй форме димеры не связаны посредством внутрицепочечных дисульфидных связей, и молекула приблизительно 75-80 кДа сформирована из ковалентно спаренных легкой и тяжелой цепей (полу-антитело). Эти формы крайне трудно разделить даже после аффинной очистки. Частота появления второй формы в различных интактных изотипах IgG обусловлена, но ими не ограничена, структурными различиями, связанными с шарнирной областью изотипа антитела. Единичная аминокислотная замена в шарнирной области IgG4 человека может значительно снизить появление второй формы (Angal et al. (1993) Molecular Immunology 30: 105) до уровней, обычно наблюдаемых при использовании шарнира IgG1 человека. Настоящее изобретение относится к антителам с одной или несколькими мутациями в шарнире, CH2 или CH3 области, которые могут быть желательны, например, при выработке, для улучшения выхода желаемой формы антитела.
Антитела по изобретению получают предпочтительно с использованием технологии VelocImmune™. Трансгенную мышь, у которой вариабельные области тяжелой и легкой цепей эндогенного иммуноглобулина заменены соответствующими вариабельными областями человека, стимулируют интересующим антигеном, и лимфатические клетки (такие как B-клетки) извлекают из мышей, которые экспрессируют антитела. Эти лимфатические клетки могут быть слиты с клеточной линией миеломы для получения бессмертных гибридомных клеточных линий, и такие гибридомные клеточные линии скринируют и отбирают для того, чтобы определить гибридомные клеточные линии, которые вырабатывают антитела, специфичные к интересующему антигену. ДНК, кодирующая вариабельные области тяжелой цепи и легкой цепи, может быть выделена и связана с желаемыми изотипическими константными областями тяжелой цепи и легкой цепи. Такой антительный белок может быть выработан в клетках, таких как клетки CHO. Альтернативно, ДНК, кодирующая антиген-специфичные химерные антитела или вариабельные домены легкой и тяжелой цепей, может быть выделена непосредственно из антиген-специфических лимфоцитов.
Как правило, антитела по настоящему изобретению обладают очень высокой аффинностью, обычно имея значения KD или EC50 приблизительно от 10-8 до приблизительно 10-12 M или выше, например, по меньшей мере 10-8 M, по меньшей мере 10-9 M, по меньшей мере 10-10 M, по меньшей мере 10-11 M или по меньшей мере 10-12 M, при измерении связывания с антигеном, представленным на клеточной поверхности.
На начальной стадии выделяют высокоаффинные химерные антитела, содержащие вариабельную область человека и константную область мыши. Как описано ниже, антитела характеризуют и выбирают по желаемым характеристикам, включая аффинность, селективность, эпитоп и т.д. Константные области мыши заменяют желаемыми константными областями человека для получения полностью человеческого антитела по изобретению, например, дикого типа или модифицированные IgG1 или IgG4 (например, SEQ ID NO:416, 417, 418). В то время как выбранная константная область может отличаться в соответствии с конкретным применением, вариабельной области присущи высокоаффинная антиген-связывающая и мишень-специфическая характеристики.
Картирование эпитопа и сопутствующие технологии
Для скрининга антител, которые связываются с определенным эпитопом, использовали стандартный анализ перекрестного блокирования, такой как описан в "Antibodies: A Laboratory Manual" 1988 Cold Spring Harbor Laboratory, Harlow and Lane, eds. Другие способы включают аланиновое сканирование мутантов, пептидный блоттинг (Reineke (2004) Methods Mol Biol 248:443-63) или анализ расщепления пептидов, как описано в примерах ниже. Кроме того, могут быть использованы способы, такие как вырезание эпитопа, экстракция эпитопа и химическая модификация антигенов (Tomer (2000) Protein Science: 9: 487-496).
Для анализа связывающих характеристик антитела были сконструированы мутантные белки CD20, содержащие выбранные аминокислотные замены. Мутантные белки CD20 содержали замены определенных аминокислот, встречающихся в белке человека, соответствующими аминокислотами, встречающимися в белке мыши. Такой подход помог убедиться в том, что мутантные белки CD20 сохранили свою третичную структуру и, предположительно, любые конформационные эпитопы. Связывание исследуемых антител с этими мутантными белками CD20 сравнивали со связыванием контрольных (известных) антител к CD20, как измерено с помощью FACS. Ни одно из антител по изобретению не показало профиль связывания, который был идентичен (в отношении всех без исключения мутантов) любому из контрольных антител.
Иммуноконъюгаты
Настоящее изобретение относится к анти-CD20 моноклональному антителу человека, конъюгированному с терапевтической частью ("иммуноконъюгат"), такой как цитотоксин, химиотерапевтическое лекарственное средство, иммуносупрессант или радиоактивный изотоп. Цитотоксичные средства включают любое средство, которое вредно для клеток. Примеры подходящих цитотоксичных средств и химиотерапевтических средств для образования иммуноконъюгатов известны в данной области, см., например, WO 05/103081.
Биспецифичность
Антитела по настоящему изобретению могут быть моноспецифическими, биспецифическими или полиспецифическими. Полиспецифические антитела могут быть специфичны к различным эпитопам одного полипептида-мишени или могут содержать антиген-связывающие домены, специфичные для более чем одного полипептида-мишени. См., например, Tutt et al. (1991) J. Immunol. 147:60-69. Анти-CD20 антитела человека могут быть связаны или ко-экспрессированы с другой функциональной молекулой, например, другим пептидом или белком. Например, антитело или его фрагмент могут быть функционально связаны (например, путем химического спаривания, генетического слияния, нековалентной ассоциации или другим образом) с одной или несколькими другими молекулярными субстанциями, такими как другое антитело или фрагмент антитела, для получения биспецифического или полиспецифического антитела с вторичной специфичностью связывания. Полиспецифическое антитело по изобретению может специфически связываться как с клеткой, экспрессирующей CD20, так и с эффекторной клеткой человека, экспрессирующей полипептид, такой как Fc рецептор человека, и/или компоненты рецепторного комплекса T-клетки. В одном из вариантов осуществления полиспецифическое антитело по изобретению содержит CD20-связывающий участок и цитокин.
Терапевтическое применение
Антитела человека, антиген-связывающие фрагменты антител, иммуноконъюгаты и биспецифические молекулы по изобретению можно использовать в терапевтических способах лечения заболеваний человека, которые сдерживаются или улучшаются за счет ингибирования роста клеток, экспрессирующих CD20, и/или цитолиза клеток, экспрессирующих CD20. Механизм действия, посредством которого успешно осуществляются терапевтические способы по изобретению, включает цитолиз клеток, экспрессирующих CD20, в присутствии эффекторных клеток, например, посредством CDC, апоптоза, ADCC, фагоцитоза или путем комбинации двух или более этих механизмов. Механизм достижения терапевтического эффекта молекул по изобретению может приводить к прямому цитолизу или ингибированию клеток, экспрессирующих CD20, или опосредованно, за счет ингибирования клеток, которые не экспрессируют CD20, например, из-за экспрессии структурно сходных антигенов клеточной поверхности (т.е. без перекрестного реагирования с родственными, но функционально различными антигенами клеточной поверхности). Клетки, экспрессирующие CD20, которые могут быть ингибированы или лизированы с использованием антител человека по изобретению, включают, например, онкогенные B-клетки.
Примеры заболеваний и состояний, на которые может быть направлено лечение или течение которых может быть улучшено с помощью анти-CD20 антител и их фрагментов, включают, но ими не ограничиваются, онкогенные заболевания, такие как B-клеточная лимфома (NHL, лимфобластный лейкоз/лимфома предшественников В-клеток, неоплазии зрелых B-клеток, B-клеточный хронический лимфоцитарный лейкоз/малая лимфоцитарная лимфома, B-клеточный пролимфатический лейкоз, лимфоплазматическая лимфома, лимфома мантийных клеток, фолликулярная лимфома, кожная фолликулярная лимфома, B-клеточная лимфома маргинальной зоны, волосато-клеточный лейкоз, диффузная B-крупноклеточная лимфома, лимфома Беркитта, плазмоцитома, плазмоцитарная миелома, посттрансплантационное лимфопролиферативное нарушение, макроглобулинемия Вальденстрома и анапластическая крупноклеточная лимфома); иммунные заболевания, такие как аутоиммунные заболевания (псориаз, псориатический артрит, дерматит, системная склеродермия и склероз, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, респираторный дистресс-синдром, менингит, энцефалит, увеит, гломерулонефрит, экзема, астма, атеросклероз, дефицит адгезии лейкоцитов, рассеянный склероз, синдром Рейно, синдром Шегрена, юношеский диабет, болезнь Рейтера, болезнь Бехчета, нефрит, вызванный иммунными комплексами, IgA-опосредованная нефропатия, IgM-опосредованные полинейропатии); иммуно-опосредованные тромбоцитопении, острая идиопатическая тромбоцитопеническая пурпура и хроническая идиопатическая тромбоцитопеническая пурпура, гемолитическая анемия, миастения гравис, волчаночный нефрит, системная красная волчанка, ревматоидный артрит, атопический дерматит, пузырчатка, болезнь Грейвса, тиреоидит Хашимото, гранулематоз Вегенера, синдром Оменна, хроническая почечная недостаточность, острый инфекционный мононуклеоз, ВИЧ и заболевания, связанные с вирусом герпеса; тяжелый острый респираторный дистресс-синдром и хореоретинит; заболевания и нарушения, связанные с инфицированием B-клетки вирусом, таким как вирус Эпштейна-Барра.
В конкретном варианте осуществления пациент, которому назначают антитело, дополнительно получает терапию радиацией, принимает химиотерапевтические средства или вещество, которое модулирует (улучшает или ингибирует) экспрессию или активность рецептора Fc, такое как цитокин. Обычно, цитокины для введения в процессе лечения включают гранулоцит-колониестимулирующий фактор (G-CSF), гранулоцит-макрофагальный колониестимулирующий фактор (GM-CSF), интерферон-гамма (IFN-γ) и фактор некроза опухоли (TNF). Обычные терапевтические средства включают, среди прочих, противоопухолевые средства, такие как доксорубицин, цисплатин, блеомицин, кармустин, хлорамбуцил и циклофосфамид.
Терапевтическое введение и составы
Изобретение относится к терапевтическим композициям, которые содержат анти-CD20 антитела человека или их антиген-связывающие фрагменты по настоящему изобретению. Терапевтические композиции в соответствии с изобретением назначают с подходящими носителями, эксципиентами и другими средствами, которые вводят в составы для того, чтобы обеспечить улучшенный перенос, доставку, устойчивость и т.п. Как правило, носители, эксципиенты или другие средства могут включать, например, масла (например, канолы, хлопковых семян, арахиса, сафлора, кунжута, соевых бобов), жирные кислоты и их соли и сложные эфиры (например, олеиновую кислоту, стеариновую кислоту, пальмитиновую кислоту), спирты (например, этанол, бензиловый спирт), полиспирты (например, глицерин, пропиленгликоли и полиэтиленгликоли, например, PEG 3350), полисорбаты (например, полисорбат 20, полисорбат 80), желатин, альбумин (например, сывороточный альбумин человека), соли (например, хлорид натрия), янтарную кислоту и ее соли (например, сукцинат натрия), аминокислоты и их соли (например, аланин, гистидин, глицин, аргинин, лизин), уксусную кислоту или ее соль или сложный эфир (например, ацетат натрия, ацетат аммония), лимонную кислоту и ее соли (например, цитрат натрия), бензойную кислоту и ее соли, фосфорную кислоту и ее соли (например, одноосновный фосфат натрия, двухосновный фосфат натрия), молочную кислоту и ее соли, полимолочную кислоту, глутаминовую кислоту и ее соли (например, глутамат натрия), кальций и его соли (например, хлорид кальция, ацетат кальция), фенол, сахара (например, глюкозу, сахарозу, лактозу, мальтозу, трегалозу), эритрит, арабит, изомальт, лактит, мальтит, маннит, сорбит, ксилит, неионные поверхностно-активные вещества (например, TWEEN® 20, TWEEN® 80), ионные поверхностно-активные вещества (например, додецилсульфат натрия), хлорбутанол, ДМСО, гидроксид натрия, глицерин, м-крезол, имидазол, протамин, цинк и его соли (например, сульфат цинка), тимеросал, метилпарабен, пропилпарабен, карбоксиметилцеллюлозу, хлорбутанол и гепарин. Другие не терапевтические средства описаны в US 7001892, в частности, в таблице A. Большое число соответствующих составов можно найти в справочнике, известном всем фармацевтам: Remington's Pharmaceutical Sciences (Mack Publishing Company, Easton, Pa). Эти составы включают, например, пудры, пасты, мази, желе, воски, масла, липиды, липидсодержащие (катионные или анионные) везикулы (такие как LIPOFECTIN™), ДНК конъюгаты, безводные абсорбирующие пасты, эмульсии масло-в-воде и вода-в-масле, эмульсионные карбовоски (полиэтиленгликоли различной молекулярной массы), полутвердые гели и полутвердые микстуры, которые содержат карбовоск. Любые из указанных составов могут быть подходящими для лечения и терапии в соответствии с настоящим изобретением, при условии, что активный ингредиент в составе не инактивирован составом, и состав физиологически переносим и совместим с путем введения. См. также Powell et al. PDA (1998) J Pharm Sci Technol. 52:238-311 и ссылки в них для дополнительной информации, относящейся к эксципиентам и носителям, которые хорошо известны фармацевтам.
Дозы терапевтических композиций могут изменяться в зависимости от возраста и размера пациента, которому их назначают, заболевания-мишени, условий, пути введения и т.п. Если антитело по настоящему изобретению используют в случае взрослого пациента для лечения различных состояний и заболеваний, связанных с активностью CD20, включая неходжкинскую лимфому, ревматоидный артрит, системную красную волчанку, болезнь Крона, хронический лимфоцитарный лейкоз, воспалительные заболевания и т.п., то преимущественным является внутривенное введение антитела по настоящему изобретению, обычно в разовой дозе приблизительно от 0,01 до приблизительно 20 мг/кг массы тела, предпочтительно, приблизительно от 0,1 до приблизительно 10 мг/кг массы тела и более предпочтительно, приблизительно от 0,1 до приблизительно 5 мг/кг массы тела. В зависимости от тяжести состояния или заболевания частота и длительность лечения могут быть скорректированы. При другом парентеральном и пероральном введении антитело можно вводить в дозе, соответствующей дозе, указанной выше.
Различные системы доставки известны и могут быть использованы для введения фармацевтической композиции по изобретению, например, инкапсулирование в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, рецептор-опосредованный эндоцитоз (см., например, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). Способы введения включают, но ими не ограничиваются, внутрикожный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути введения. Композицию можно вводить любым удобным путем, например инфузией или болюсной инъекцией, абсорбцией через эпителиальную или кожно-слизистую оболочку (например, слизистую оболочку полости рта, ректальную и внутрибрюшинную слизистую и т.д.), и можно вводить совместно с другими биологически активными средствами. Введение может, предпочтительно, быть системным или локальным.
Фармацевтическая композиция может быть также доставлена в везикуле, в частности, в липосоме (см. Langer (1990) Science 249:1527-1533). В определенных ситуациях фармацевтическая композиция может быть доставлена с помощью системы контролируемого высвобождения. В одном из вариантов осуществления может быть использован насос (см. Langer, выше; Sefton (1987) CRC Crit. Ref. Biomed. Eng. 14:201). В другом варианте осуществления могут быть использованы полимерные материалы (см. Medical Applications of Controlled Release, Langer и Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984). В еще одном варианте осуществления система контролируемого высвобождения может быть помещена вблизи от мишени композиции, таким образом, требуя только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138, 1984).
Препараты для инъекций могут включать лекарственные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, капельных вливаний и т.д. Эти препараты для инъекций могут быть получены общеизвестными способами. Например, препараты для инъекций могут быть получены, например, растворением, суспендированием или эмульгированием антитела или его соли, описанных выше, в стерильной водной среде или масляной среде, обычно используемых для инъекций. В качестве водной среды для инъекций имеются, например, физиологический солевой раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные вещества, и т.д., которые можно использовать в сочетании с подходящим солюбилизирующим средством, таким как спирт (например, этанол), полиспирт (например, пропиленгликоль, полиэтиленгликоль), неионное поверхностно-активное вещество [например, полисорбат 80, HCO-50 (аддукт полиоксиэтилена (50 моль) и гидрированного касторового масла)], и т.д. В качестве масляной среды используют, например, кунжутное масло, соевое масло и т.д., которые можно использовать в сочетании солюбилизирующим средством, таким как бензилбензоат, бензиловый спирт и т.д. Инъекцией, полученной таким образом, предпочтительно заполняют соответствующую ампулу.
Фармацевтические композиции для перорального или парентерального применения, описанные выше, преимущественно получают в лекарственной форме в разовой дозе, подходящей для точно соответствующей дозы активных ингредиентов. Такие лекарственные формы в разовой дозе включают, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и т.д. Количество содержащегося вышеуказанного антитела, как правило, составляет приблизительно от 5 до 500 мг на лекарственную форму в разовой дозе; особенно в форме инъекции, предпочтительно, чтобы вышеуказанное антитело содержалось в количестве приблизительно от 5 до 100 мг и приблизительно от 10 до 250 мг в других лекарственных формах.
ПРИМЕРЫ
Следующие примеры предложены для того, чтобы обеспечить специалистов в данной области полным раскрытием и описанием того, как создавать и применять способы и композиции по изобретению, и не ограничены объемом того, что авторы изобретения относят к своему изобретению. Были сделаны попытки обеспечить точность в отношении использованных чисел (например, количества, температура и т.д.), но следует принимать в расчет некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой массовые части, молекулярная масса означает среднюю молекулярную массу, температура представлена в градусах Цельсия и давление является атмосферным или близким атмосферному.
Пример 1. Получение антител человека к CD20 человека.
Иммунизация грызунов может быть проведена любым известным в данной области способом (см., например, Harlow & Lane, eds. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Press, New York; Malik and Lillehoj, Antibody techniques: Academic Press, 1994, San Diego). В одном из вариантов осуществления клетки, экспрессирующие CD20, непосредственно вводят мышам, у которых имеются локусы ДНК, кодирующие как вариабельные области тяжелой цепи иммуноглобулина человека, так и вариабельные области легкой цепи каппа (VelocImmune™, Regeneron Pharmaceuticals Inc.; US 6596541), с адъювантом для стимуляции иммунного ответа. Такие адъюванты могут включать полный и неполный адъювант Фрейнда, систему адъювантов MPL+TDM (Sigma) или RIBI (мурамил-дипептиды) (см. O'Hagan, Vaccine Adjuvant, by Human Press, 2000, Totawa, NJ). Для достижения высоких уровней экспрессии CD20 человека на поверхности клетки клеточные линии мышей, MG87 и/или NS/0 клетки, трансфицируют плазмидой, кодирующей CD20 человека, и клетки, экспрессирующие высокие уровни CD20, обогащают с использованием технологии FACS. В одном из вариантов осуществления CD20 вводят опосредованно в виде ДНК-плазмиды, которая содержит ген CD20, и экспрессируют CD20 с использованием экспрессионной системы белков хозяина для получения антигенного белка in vivo. В обоих подходах, для достижения оптимального антительного иммунного ответа, мыши получают повторные инъекции каждые 3-4 недели. Иммунный ответ проверяют с помощью клеточного иммуноанализа, как описано ниже, при котором образцы сыворотки с серийными разведениями от однократного до трехкратного подвергают иммуноанализу. Титр сыворотки определяют как разведение образца сыворотки, которое давало при анализе сигнал, двукратно превышающий фон. Когда животные достигают максимума своего иммунного ответа, B-клетки, экспрессирующие антитела, собирают и сливают с миеломными клетками мыши для образования гибридом.
Пример 2. Отбор антиген-специфических гибридом
В первичном скрининге NS/0 клетки (ATCC) трансфицировали геном CD20 человека, и высокоэкспрессирующие клетки (NS/0-hCD20) объединяли и культивировали для использования в отборочной кондиционной для гибридомы среде, как правило, приблизительно от 11 до 14 дней после слияния. NS/0-hCD20 клетки в среде RPMI 1640 с 10% эмбриональной телячьей сывороткой помещали с плотностью 50000 клеток на лунку в 96-луночные поли-D-лизиновые планшеты. Кондиционную для гибридомы среду разводили в 5 раз и давали клеткам связываться в течение 30 минут. Клетки затем фиксировали на планшетах в течение 20 мин добавлением равного объема 8% формальдегида, с последующим четырехкратным промыванием в PBST. Планшеты инкубировали с 5% BSA в течение 2 часов при комнатной температуре (RT). После промывания антитела, связанные с планшетом, инкубировали с HRP-конъюгированными козьими Fcγ-специфическими поликлональными антителами против IgG мыши в течение 30 мин и планшеты проявляли, используя 3,3',5,5'-тетраметилбензидиновый (TMB) субстрат (BD Pharmigen), с последующим конечным промыванием. Реакцию HRP останавливали равным объемом 1 M фосфорной кислоты. Сигналы связывания антитела измеряли оптической плотностью при 450 нм. Родительские клетки NS/0, без определяемой экспрессии CD20, использовали в качестве фонового контроля, чтобы исключить гибридомные супернатанты с неспецифическим связыванием с поверхностью клеток. Лунки, позитивные как по родительским клеткам NS/0, так и по клеткам, экспрессирующим CD20, исключали.
Пример 3. Секвенирование антител человека против CD20
Перед секвенированием антиген-специфичные гибридомные клетки субклонировали по одной клетке с использованием проточного цитометра MOFLO™. Секвенирование вариабельных областей легкой и тяжелой цепей производили стандартными способами (см., например, US 2004/0167319A1). Общую РНК получали из каждой гибридомной клеточной линии с помощью набора RNEASY™ (Qiagen). кДНК получали с использованием набора для амплификации кДНК SMART RACE™ (Clonetech). Последовательности ДНК HCVR и LCVR секвенировали и прогнозированные аминокислотные последовательности для HCVR и LCVR предоставляли для выбранных антител (HCVR/LCVR SEQ ID NO): 3B9-10N (3/11); 3B9-10GSP (19/21); 3B9-10FGL (23/25); 9C11-14N (27/35); 9C11-14GSP (43/45); 9C11-14FGL (47/49); 2B7-7N (51/59); 2B7-7GSP (67/69); 2B7-7FGL (71/73); 2C11-4N (75/83); 2C11-4GSP (91/93); 2C11-4FGL (95/97); 3H7-6N (99/107); 3H7-6GSP (115/117); 3H7-6FGL (119/121); 5H2-17N (123/131); 5H2-17GSP (139/141); 5H2-17FGL (143/145); 6B9-4N (147/155); 6B9-4GSP (163/165); 6B9-4FGL (167/169); 6F6-1N (171/179); 6F6-1GSP (187/189); 6F6-1FGL (191/193); 8G6-5N ("8G6-5") (195/203); 8G6-5GSP (211/213); 8G6-5FGL (215/217); 9C3-8N (219/227); 9C3-8GSP (235/237); 9C3-8FGL (239/241); 9D4-7N ("9D4-7") (243/251); 9D4-7GSP (259/261); 9D4-7FGL (263/265); 9E4-20N (267/275); 9E4-20GSP (283/285); 9E4-20FGL (287/289); 9H4-12N (291/299); 9H4-12GSP (307/309); 9H4-12FGL (311/313); 10E3-17N (315/323); 10E3-17GSP (331/333); 10E3-17FGL (335/337); 10F2-13N ("10F2-13") (339/347); 10F2-13GSP (355/357); 10F2-13FGL (359/361); 7E1-13N (363/371); 7E1-13GSP (379/381); 7E1-13FGL (383/385).
Пример 4. Антиген-связывающая специфичность анти-CD20 антител
После того как химерные антитела были преобразованы в полностью человеческий IgG, специфические антиген-связывающие свойства определяли с помощью протокола ELISA, сходного с протоколом, описанным выше, за исключением того, что HRP-конъюгированные козьи анти-hIgG Fcγ-специфические поликлональные антитела использовали в качестве антител детекции, а клеточную линию Daudi (которая экспрессирует эндогенный CD20) использовали в качестве источника антигена. Все исследованные антитела специфически связывались с клетками Daudi с величинами EC50 в диапазоне приблизительно от 0,4 нМ до приблизительно 20 нМ.
Антигенную специфичность связывания с полностью человеческими анти-CD20 антителами подтверждали, используя проточную цитометрию, как описано ниже, с клетками MG87, трансфицированными с помощью CD20 человека. В кратком изложении, родительские клетки MG87 и клетки MG87, трансфицированные с помощью CD20 человека, инкубировали в течение 30 мин при 4°C с каждым из 15 антител человека и двумя контрольными антителами, с последующей инкубацией с PE-конъюгированными антителами против IgG человека. Связывание оценивали с помощью проточной цитометрии. Значения интенсивности флуоресценции сравнивали со связыванием с родительской клеточной линией и контрольным образцом с подходящим изотипом. Результаты суммированы в таблице 1. Все антитела связались с клетками MG87, трансфицированными с помощью CD20 человека, в то время как не наблюдалось никакого связывания с родительскими клетками MG87, указывая на то, что антитела CD20-специфичны. Контроль I: химерное (мышь/человек) анти-CD20 mAb, ритуксимаб, (РИТУКСАН®, IDEC Pharmaceuticals Corp.); контроль II: анти-CD20 mAb человека, 2F2, описанные в WO 2005/103081).
Пример 5. Связывание анти-CD20 антитела человека с мутантным CD20 человека
Мутантные CD20 человека были получены путем замещения аминокислотных последовательностей CD20 человека соответствующими аминокислотами мыши с использованием набора Strategene Mutagenesis (таблица 2). Плазмидный вектор, содержащий мутантный CD20 человека, CMV промотор и маркерный ген устойчивости к гигромицину IRES-GFP, был затем трансфицирован в клетки MG87. Для каждого мутантного CD20 человека собирали совокупность гигромицин-устойчивых клеток, которые демонстрировали высокую экспрессию GFP, и создавали стабильные линии для анализа связывания антитела.
В кратком изложении, приблизительно 1×106 клеток из каждой стабильно трансфицированной клеточной линии, экспрессирующей мутантный CD20 человека, собирали и инкубировали с каждым анти-антителом человека, 10 мкг/мл, на льду в течение 1 ч, с последующей инкубацией с APC-конъюгированными козьими антителами против IgG человека (Jackson Immunolabs), 10 мкг/мл, на льду в течение 45 мин. Для каждого антитела связывание с каждым мутантным CD20 человека определяли с помощью проточной цитометрии. Средние уровни интенсивности флуоресценции оценивали, в то время как пропускали небольшую (приблизительно 20%) популяцию клеток, которые показали средний уровень экспрессии GFP, чтобы минимизировать эффекты, связанные с различными уровнями экспрессии мутантов CD20 внутри каждой клеточной линии. Для каждого мутантного CD20, антитело, которое показало наивысшую среднюю интенсивность флуоресценции, обозначали как 100% связывание. В таблице 3 показан процент связывания каждого анти-CD20 антитела с каждым мутантным CD20 человека.
Пример 6. Эффективность в комплемент-зависимой цитотоксичности (CDC)
Антитела человека против CD20 человека были проверены на их способность стимулировать комплемент-зависимую цитотоксичность (CDC) с использованием клеточных линий лимфомы человека Daudi и RL в качестве клеточных линий-мишеней. Использовали серийные разведения антител в среде (диапазон конечных концентраций от 50 нМ до 0,85 пМ плюс контроль с буфером) и добавляли к клеткам-мишеням, посеянным в формате 96-луночного планшета. Сыворотку человека с компонентами комплемента (Quidel) добавляли в каждую лунку для получения конечной концентрации сыворотки 5%. Клетки инкубировали при 37°C в течение 2 часов с исследуемыми антителами и сывороткой человека с компонентами комплемента, а затем анализировали выживание клеток, что обнаруживали с помощью ALAMARBLUE™. Флуоресценцию измеряли с использованием длины волны возбуждения 560 нм и длины волны эмиссии 590 нм (таблица 4).
Пример 7. Функциональная скорость диссоциации анти-CD20 антител человека
Скорости диссоциации анти-CD20 mAb анализировали в тесте CDC. Эксперименты проводили тремя отдельными сериями. Внутри каждой серии определяли процент лизиса клеток для 5 антител единовременно по сравнению с контролями I и II при 0, 1 и 6 ч. Антитело связывали с клетками путем инкубирования 2 мкг каждого антитела с 106 клеток Daudi в течение 45 мин (RT). Для нулевой временной точки клетки промывали и немедленно ресуспендировали в 100 мкл среды, содержащей 20% нормального сывороточного комплемента человека, затем инкубировали в течение 45 мин при 37°C, 5% C02. Для временных точек 1 ч и 6 ч 106 клеток промывали после связывания антител, ресуспендировали в 12 мл свежей среды в 15-мл пробирках Falcon и инкубировали на механическом инвертере в течение 1 ч и 6 ч, соответственно. При достижении выбранной временной точки и завершении инкубации в среде, содержащей 20% нормального сывороточного комплемента человека, клетки промывали и инкубировали в течение 45 мин. После инкубации с сывороткой к каждому образцу добавляли 7-аминоактиномицин D (7AAD) и инкубировали в течение 15 мин при комнатной температуре для оценки жизнеспособности клеток. Процент цитотоксичности определяли в каждой временной точке. задавая области как прямое рассеивание, в сравнении с двухмерной диаграммой рассеивания 7AAD, которая представляет 7AAD-позитивные и негативные клетки, с дебрисом, исключенным из обеих областей. Процент цитотоксичности был выведен для каждой временной точки как 100 минус процент 7AAD-негативных клеток (таблицы 5-7).
Пример 8. Биохимические скорости диссоциации анти-CD20 антител человека
Биохимические скорости диссоциации выбранных для проверки анти-CD20 антител определяли и сравнивали с контрольными антителами I и II. Два выбранных антител человека, контроль I или II (каждый 2 мкг/мл) инкубировали с CD20-экспрессирующими клетками Raji, 106/мл, в течение 2 часов при комнатной температуре. Затем клетки промывали, удаляли избыток антитела, ресуспендировали в среде, содержащей 1% сыворотки, и инкубировали при 37°C. Во временной точке 0, 15, 30, 45, 60, 90, 120 и 180 мин отбирали аликвоту клеток в 1 мл, промывали, окрашивали с помощью PE-меченного анти-hFc антитела и анализировали с помощью FACS. Среднюю интенсивность флуоресценции (MFI) использовали в качестве индикатора количества антитела, связавшегося с клеточной поверхностью. Биохимические скорости диссоциации рассчитывали, принимая процент связывания в нулевой точке за 100%. Эксперимент повторяли дополнительно 5 раз и биохимические скорости диссоциации для 12 исследуемых антител определяли и сравнивали с контролем I и II (таблицы 8-13).
Пример 9. Анализ антитело-зависимой клеточной цитотоксичности (ADCC)
ADCC, индуцированную выбранными анти-CD20 антителами человека, оценивали с использованием клеток Daudi (клетки из клеточной линии лимфомы человека, которые эндогенно экспрессируют CD20). В кратком изложении, клетки Daudi (10000 клеток/лунку в 50 мкл) сначала смешивали с равным объемом серийных разведений анти-CD20 антитела человека, получая конечную концентрацию антитела в диапазоне от 0,169 пМ до 10 нМ, и инкубировали в течение 10 мин при комнатной температуре в 96-луночном планшете (контроль = лунки без антитела). Раздельно готовили мононуклеарные клетки периферической крови человека (PBMC, эффекторные клетки), следуя обычной методике обогащения с градиентным центрифугированием в среде Ficoll-Hypaque. Обогащенные PBMC собирали, промывали и помещали в среду RPMI 1640, содержащую 10% FBS, инактивированной нагреванием, 2 мМ глутамин и 50 нМ бета-меркаптоэтанол. Клетки затем стимулировали с помощью 5 нг/мл IL-2 человека в течение 3 дней, один раз промывали средой, затем использовали непосредственно для анализа ADCC. Приблизительно 300000 PBMC добавляли к каждой смеси антитела и клетки-мишени для получения конечного отношения эффектора к клеткам-мишеням приблизительно 30:1. 96-Луночные планшеты затем инкубировали в течение 4 ч и центрифугировали при 250 × g. Супернатанты собирали и анализировали на активность лактатдегидрогеназы (LDH) с использованием CYTOTOX 96® Non-Radioactive Cytotoxicity Assay system (Promega) (таблица 14).
Пример 10. Терапевтическая активность анти-CD20 антител с использованием мышиной модели ксенотрансплантата лимфомы человека
In vivo исследования эффективности выбранных анти-CD20 антител проводили с использованием ксенотрансплантата неходжкинской B-клеточной лимфомы человека на модели мыши. Самок мышей с тяжелым комбинированным иммунодефицитом (SCID) приобретали в 6-недельном возрасте. После одной недели акклиматизации 2,5 миллиона свежесобранных клеток Raji (клетки из клеточной линии неходжкинской B-клеточной лимфомы человека) вводили внутривенно каждой мыши. Каждую мышь, привитую клетками Raji, затем подвергали действию FC человека (hFC), контроля I, контроля II, 8G6-5, 9D4-7, 10F2-13 или 7E1-13, каждый в дозе 10 мг/кг, посредством внутривенной инъекции в латеральную часть хвоста на 3, 6 и 9 дни после прививки. Мышей наблюдали в течение периода до 180 дней. Мышей, демонстрирующих признаки заболевания, включая паралич задних конечностей, кахексию и большую локальную опухолевую массу в случайном месте, подвергали эвтаназии путем удушающего действия CO2. Кривые бессимптомного выживания строили с использованием способа Kaplan-Meier (фиг.1). Результаты представлены в виде процента выживания как функции бессимптомного времени выживания. Данные результаты показывают, что антитело 10F2-13 значительно увеличивает время выживания на модели животных, приблизительно от 20 дней (контрольные животные, на которых воздействовали hFc) до приблизительно 180 дней (более чем девятикратное увеличение уровня выживаемости) (50% животных, подвергнутых воздействию, выживали приблизительно 20 дней (hFc контроль), приблизительно 40 дней (контроль I), приблизительно 85 дней (контроль II) и более чем 180 дней (10F2-13). Это увеличенное время выживания по меньшей мере в два раза больше (относительно контроля II), приблизительно в 4,5 раза больше (относительно контроля I) или по меньшей мер, приблизительно в 9 раз или больше относительно животных, на которых воздействовали hFc.















































































































Предложенное изобретение относится к иммунологии. Предложено антитело человека или антиген-связывающий фрагмент антитела, который специфически связывается с CD20 человека и содержит CDR1-3 легкой и CDR1-3 тяжелой цепи. Описан варианта антитела или антиген-связывающий фрагмент антитела, характеризующийся аминокислотными последовательностями легкой и тяжелой цепи. Предложены: кодирующая молекула нуклеиновой кислоты, экспрессионный вектор на ее основе, а также способ получения антитела или антиген-связывающий фрагмент антитела с использованием вектора. Раскрыта фармацевтическая композиция на основе антитела. Описан способ уменьшения тяжести или подавления заболевания или состояния, обусловленного CD20 и применение антитела или антиген-связывающего фрагмента антитела для получения лекарственного средства для уменьшения тяжести или подавления заболевания или состояния, опосредованного CD20 человека. Изобретение обеспечивает антитела, которые увеличивают время бессимптомного выживания приблизительно от 2 до приблизительно 9 раз или более, относительно контроля у животных на мышиной модели лимфомы человека, обладают высокой аффинностью, что может найти применение в медицине. 8 н. и 7 з.п. ф-лы, 1 ил., 14 табл., 10 пр.
1. Антитело человека или антигенсвязывающий фрагмент антитела, который специфически связывается с CD20 человека и способен индуцировать комплемент-зависимую цитотоксичность (CDC) с концентрацией антитела приблизительно 5 нМ или менее и увеличивать время бессимптомного выживания приблизительно от 2 до приблизительно 9 раз или более, относительно контроля у животных на мышиной модели лимфомы человека, где антитело или фрагмент антитела содержит:
- определяющую комплементарность область 1 тяжелой цепи (HCDR1) и CDR1 легкой цепи (LCDR1), где HCDR1 и LCDR1 выбраны из группы, состоящей из SEQ ID NO: 341 и 349;
- определяющую комплементарность область 2 тяжелой цепи (HCDR2) и CDR2 легкой цепи (LCDR2), где HCDR2 и LCDR2 выбраны из группы, состоящей из SEQ ID NO: 343 и 351; и
- определяющую комплементарность область 3 тяжелой цепи (HCDR3) и CDR3 легкой цепи (LCDR3), где HCDR3 и LCDR3 выбраны
из группы, состоящей из SEQ ID NO: 345 и 353.
2. Антитело человека или антигенсвязывающий фрагмент антитела, который специфически связывается с CD20 человека и способен индуцировать комплемент-зависимую цитотоксичность (CDC) с концентрацией антитела приблизительно 5 нМ или менее, где антитело или его фрагмент содержит последовательность вариабельной области тяжелой цепи (HCVR) и последовательность вариабельной области легкой цепи (LCVR), где последовательности HCVR и LCVR выбраны из группы, состоящей из SEQ ID NO: 339 и 347.
3. Антитело человека или антигенсвязывающий фрагмент по п.1, где концентрация антитела, которая требуется для индукции CDC, составляет 1 нМ или менее.
4. Антитело человека или антигенсвязывающий фрагмент по п.3, дополнительно отличающиеся тем, что значение их ЕС50 составляет 0,2 нМ или менее как измерено на клетках Daudi или значение ЕС50 составляет 0,4 нМ или менее как измерено с помощью клеток RL.
5. Антитело человека или антигенсвязывающий фрагмент по любому из пп.1-4, отличающиеся тем, что значение их KD или ЕС50 по меньшей мере составляет 10-11 М при измерении связывания с антигеном, представленным на поверхности клетки.
6. Молекула нуклеиновой кислоты, кодирующая антитело человека или фрагмент антитела по п.5.
7. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п.6.
8. Способ получения антитела против CD20 человека или антигенсвязывающего фрагмента антитела, включающий стадии введения экспрессионного вектора по п.7 в выделенную клетку-хозяина, выращивание клетки в условиях, позволяющих осуществлять выработку антитела или фрагмента антитела, и обратное получение антитела или фрагмента антитела, созданного таким образом.
9. Способ по п.8, где клетка-хозяин представляет собой клетку Е. coli, клетку СНО или клетку COS.
10. Фармацевтическая композиция, которая содержит терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-5, использующаяся для лечения заболевания или состояния, выбранного из группы, состоящей из неходжкинской лимфомы, ревматоидного артрита, системной красной волчанки, болезни Крона, хронического лимфоцитарного лейкоза и воспалительных заболеваний.
11. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-5 для использования для уменьшения тяжести или подавления заболевания или состояния, опосредованного CD20, у человека.
12. Антитело или антигенсвязывающий фрагмент антитела по п.11, где заболевание или состояние, на которое направлено лечение, выбрано из группы, состоящей из неходжкинской лимфомы, ревматоидного артрита, системной красной волчанки, болезни Крона, хронического лимфоцитарного лейкоза и воспалительных заболеваний.
13. Способ уменьшения тяжести или подавления заболевания или состояния, опосредованного CD20, у человека, который включает введение терапевтически эффективного количества антитела или антигенсвязывающего фрагмента антитела по любому из пп.1-5.
14. Применение антитела или антигенсвязывающего фрагмента антитела по любому из пп.1-5 для получения лекарственного средства для уменьшения тяжести или подавления заболевания или состояния, опосредованного CD20, у человека.
15. Применение по п.14, где заболевание или состояние, на которое направлено лечение, представляет собой неходжкинскую лимфому, ревматоидный артрит, системную красную волчанку, болезнь Крона, хронический лимфоцитарный лейкоз и воспалительные заболевания.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| CARTER et al | |||
| "Improving the efficacy of antibody-based cancer therapies", Nature Reviews, 2001, vol.1, с.118-127 | |||
| СЕВЕРИН E.C | |||
| и др | |||
| Биохимия: Учебник | |||
| - М.: Медицина, 2000, с.7 | |||
| Способ получения фотографических эмульсий солей серебра | 1928 |
|
SU18601A1 |
Авторы
Даты
2013-06-27—Публикация
2008-07-31—Подача