ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области микробиологии и технологии вакцин и относится к разработке вакцины, способной формировать иммунитет к стрептококковым инфекциям группы В. Более конкретно, настоящее изобретение относится к новому слитому белку, который формирует иммунитет к инвазивным штаммам стрептококка группы В. Изобретение также относится к выделенной нуклеотидной последовательности, кодирующей указанный слитый белок, к вектору, к клетке-хозяину, к вакцине и к способу предупреждения или лечения стрептококковой инфекции группы В.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Стрептококк группы В (Streptococcus agalactiae) (GBS) является основной причиной инвазивных бактериальных инфекций, в том числе менингита, в неонатальном периоде. Только в Соединенных Штатах в настоящее время насчитывается примерно 5000 случаев в год инвазивного заболевания, вызываемого этой бактерией. Эти инфекции имеют общую смертность примерно 10%, и многие младенцы, которые выживают, имеют постоянные неврологические последствия. В связи с этим, прилагаются большие усилия, чтобы найти способы предупреждения и лечения и выяснить механизмы, по которым GBS вызывает инфекции.
GBS также вызывает мастит у коров, коровье заболевание, которое имеет большое экономическое значение. Поэтому разработка вакцины против GBS инфекций представляет интерес также в ветеринарии.
Примерно 20% всех женщин являются вагинальными носителями GBS, и вертикальный перенос из половых путей матери по всей вероятности является наиболее распространенным источником инфекции при неонатальном заболевании, вызываемом этой бактерией. Тем не менее, только примерно 1% младенцев, у которых GBS колонизируются при рождении, поражаются серьезной инфекцией. Поэтому иные факторы, нежели воздействие бактерии во время рождения, должны вносить вклад в развитие неонатального заболевания.
Стрептококковые штаммы группы В подразделяются на девять серотипов (Ia, Ib и II-VIII) по структуре полисахаридной капсулы (Baker, J.Inf. Dis. 1990, 161: 917). Четыре "классических" серотипа Ia, Ib, II и III встречаются в приблизительно равных пропорциях среди штаммов в нормальной флоре, но тип III является клинически самым важным серотипом, в частности из-за того, что он является причиной большинства случаев менингита.
Поскольку капсула является известным фактором вирулентности, она была исследована очень подробно, в частности в штаммах типа III. Были предприняты попытки разработать вакцину, в которой основным компонентом была бы полисахаридная капсула типа III.
В ЕР 0866133 раскрыта вакцина, способная защищать реципиента от инфекции, вызываемой стрептококком группы В. Это изобретение относится к применению комбинации полисахарида и фрагмента белка эпсилон. В этом документе также раскрыто, что эпидемиологические данные свидетельствуют о том, что типоспецифичная капсула играет важную роль в иммунитете к стрептококковым инфекциям группы В (смотри с.7, строки 2-3). Кроме того, в этом документе приводится целый ряд различных комбинаций разных белков с полисахаридом, упоминаемым в данной заявке, но все пункты формулы изобретения включают в себя полисахарид, что указывает на важность этого конкретного компонента. Однако применение полисахаридной капсулы в качестве вакцины может создавать проблемы из-за перекрестных реакций с тканями человека (Pritchard etal., Infect. Immun. 1992, 60: 1598). Следовательно, было бы очень ценно разработать вакцину на основе белков, а не на основе полисахаридов.
В документе Gravekamp et al., Infection and Immunity, Dec 1997, p 5216-5221, раскрыта оценка иммуногенности, а также защитного действия числа повторов альфа (α) С белка, а также только N-концевой части. Было обнаружено, что иммуногенность понижается с увеличением числа повторов (смотри Фиг.2В). Однако в анализе защиты было также обнаружено, что по сравнению с антителами против N-концевой области за защиту преимущественно ответственны антитела против области повторов (смотри с.5219, левая колонка, строка 6 снизу, и с.5220, правая колонка, строки 26-29).
В WO 9410317 описано применение белка альфа, являющегося поверхностным белком GBS, в разработке конъюгатной вакцины. Недостатком этого белка является то, что он обычно не экспрессируется штаммами типа III, которые являются причиной многих серьезных GBS-инфекций. Следовательно, вакцина на основе белка альфа не будет индуцировать защитный иммунитет против этих штаммов.
В WO 9421685 описано применение белка Rib, являющегося поверхностным белком GBS, в разработке вакцины. Этот белок индуцирует иммунитет при введении с квасцами. Однако белок Rib имеет недостаток, который заключается в том, что он не индуцирует защитный иммунитет против всех штаммов GBS.
Как указано выше, в настоящее время вакцина, пригодная для предупреждения заболевания, вызываемого GBS, еще не доступна, хотя множество работ было посвящено этой проблеме. Ясно, что в настоящее время существует назревшая, но не удовлетворенная потребность в разработке способов предупреждения и лечения GBS-инфекций. Поэтому остается потребность в стратегиях использования вакцин, способных вырабатывать защитный иммунитет против широкого разнообразия штаммов GBS.
Соответственно, основная задача настоящего изобретения заключается в том, чтобы создать вакцину, способную индуцировать защитный иммунитет против GBS-инфекций.
Задача настоящего изобретения заключается также в том, чтобы создать вакцину, которая индуцирует защитный иммунитет против многих клинически важных штаммов GBS.
Задача настоящего изобретения заключается также в том, чтобы создать вакцину, состоящую из одного слитого белка, который индуцирует защитный иммунитет против GBS-инфекций. Один белок имеет несколько преимуществ перед вакциной, состоящей из множества белков, например стоимость производства и безопасность.
Средства для решения каждой из вышеуказанных задач, а также других задач станут ясны из следующего далее описания изобретения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Неожиданно было обнаружено, что слитый белок, содержащий два разных неиммунодоминантных участка, таких как фрагмент N-концевой области белка Rib GBS, слитый с фрагментом N-концевой области белка альфа GBS, т.е. в результате слияния неиммунодоминантных участков двух разных белков, экспрессируемых двумя разными штаммами GBS, образуется слитый белок, который обеспечивает очень эффективную защиту от инфицирования двумя разными бактериальными штаммами при введении этого слитого белка млекопитающему в виде вакцины. Эту защиту осуществляют антитела.
В первом аспекте данное изобретение относится к слитому белку, содержащему по меньшей мере один первый фрагмент N-концевой области поверхностного белка стрептококка группы В или его аналог, гомолог, производное или иммунологически родственную аминокислотную последовательность или фрагменты, который слит с по меньшей мере одним вторым фрагментом N-концевой области поверхностного белка стрептококка группы В или его аналогом, гомологом, производным или иммунологической родственной аминокислотной последовательностью или фрагментами, где указанные по меньшей мере один первый и второй фрагменты N-концевой области поверхностных белков стрептококка группы В получены из разных штаммов стрептококка группы В, и где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Главное преимущество слитого белка по изобретению заключается в том, что он включает в себя области из родственных поверхностных белков Rib и альфа, каждый из которых экспрессируется многими клинически важными штаммами стрептококка группы В, и, что самое важное, было показано, что он индуцирует защитный иммунитет против этих клинически важных штаммов.
Этот слитый белок имеет преимущество в том, что он является иммуногенным даже без адъюванта, индуцируя защитный иммунитет против Rib- и альфа-экспрессирующих штаммов. Более того, вакцину на основе слитого белка по изобретению можно вводить с квасцами в качестве адъюванта, разрешенного для применения у людей. Напротив, о ранее описанной "универсальной вакцине" известно только то, что она работает вместе с адъювантом Фрейнда, сильно раздражающим компонентом, который нельзя применять в медицине человека (Maione, D. et al, Science 2005, 309: 148-150).
Другое преимущество настоящего изобретения заключается в том, что вакцинная композиция по изобретению может состоять из одного слитого белка и все же индуцировать защитный иммунитет против разных GBS инфекций. Это дает несколько преимуществ по сравнению с вакциной, состоящей из множества белков. Например, один белок проще, безопаснее и дешевле в изготовлении, чем смесь, содержащая множество белков.
Более конкретно, настоящее изобретение относится к указанному слитому белку, к выделенной нуклеотидной последовательности, к вектору, к клетке-хозяину, к вакцине и к способу предупреждения или лечения стрептококковой инфекции группы В.
Ниже настоящее изобретение описано более подробно, inter alia, со ссылкой на графические материалы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
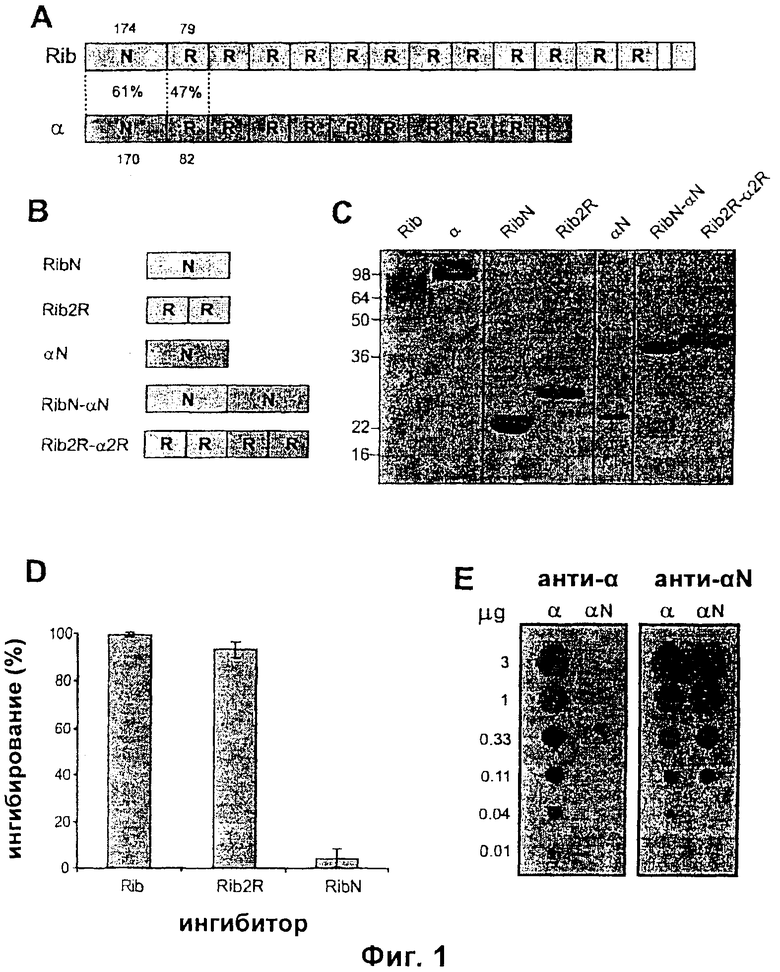
На Фиг.1 представлены белки, использованные в примерах. (А) демонстрирует белки Rib и альфа, включающие их уникальные N-концевые области (N-области) и их области длинных повторов (R-области). Количество аминокислотных остатков в разных областях и идентичность остатков указаны. (В) Рекомбинантные белки из Rib и альфа. (С) Анализ очищенных белков методом SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). (D) Тест на ингибирование с использованием мышиных антител против Rib. (E) Дот-блот анализ.
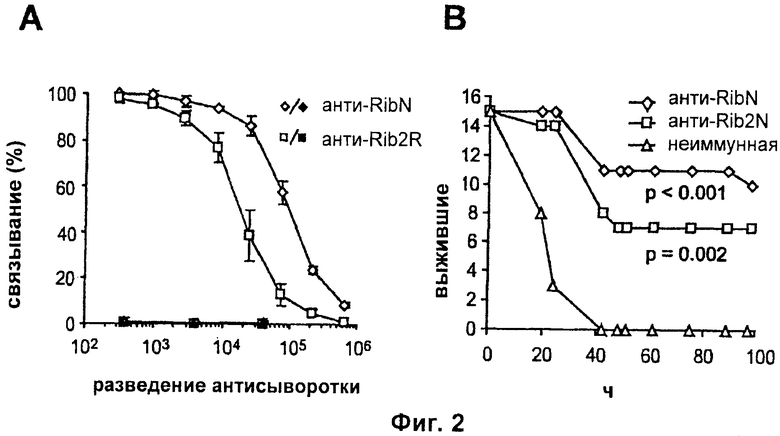
На Фиг.2 представлены данные исследований с пассивной иммунизацией. (А) Реактивность кроличьих антисывороток против RibN или Rib2R с бактериями из Rib-экспрессирующего штамма ВМ110 (незакрашенные символы) или его Rib-негативного мутанта (закрашенные символы). (В) Пассивная вакцинация мышей кроличьим антителом против RibN или против Rib2R.
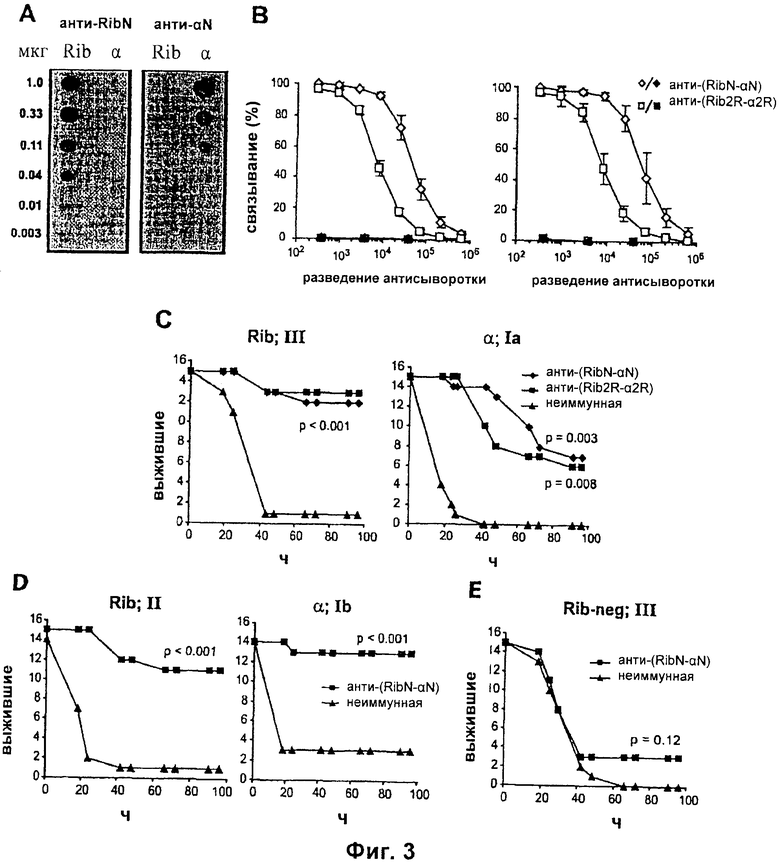
На Фиг.3 представлены: (А) Анализ перекрестной реактивности между N-концевыми областями Rib и альфа; (В) Характеризация кроличьих антител против RibN-альфаN и Rib2R-альфа2R; (С) Пассивная вакцинация мышей антителами к двум слитым белкам с последующей стимуляцией Rib-экспрессирующим штаммом типа III BM110 или альфа-экспрессирующим штаммом типа Ia A909; (D) Пассивная вакцинация слитым белком анти-(RibN-альфаN) с последующей стимуляцией Rib-экспрессирующим штаммом типа II или альфа-экспрессирующим штаммом типа Ib; (E) Пассивная вакцинация слитым белком анти-(RibN-альфаN) с последующей стимуляцией Rib-негативным мутантом BM110.
На Фиг.4 представлены результаты активной иммунизации слитым белком RibN-альфаN. (А) Иммуногенность RibN-альфаN при введении с адъювантом или без адъюванта. (В) Активная вакцинация слитым белком RibN-альфаN.
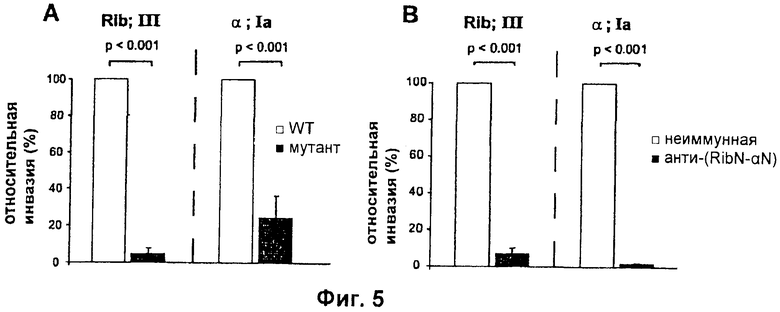
На Фиг.5 представлено сравнение бактерий по (А) способности инвазировать клетки человеческой цервикальной клеточной линии МЕ180. (В) Ингибирование инвазии эпителиальных клеток слитым белком анти-(RibN-альфаN).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "иммуногенный" означает "имеющий способность вызывать иммунный ответ". Новый слитый белок по изобретению является иммуногенным и характеризуется тем, что он обладает способностью вызывать защитный иммунный ответ против по меньшей мере GBS, содержащего Rib- и альфа-белок.
Термин "аналог" означает те белки, родственные Rib- и альфа-белкам, в которых один или более чем один аминокислотный остаток Rib- или альфа-белка (SEQ ID NO: 2 и 4) заменен другим аминокислотным остатком, при условии, что общая функциональность и иммуногенные свойства белка-аналога или слитого белка сохраняются. Такие аналоги могут быть природными или могут быть получены синтетическим путем или методом рекомбинантных ДНК, например посредством мутагенеза одной или обеих последовательностей SEQ ID NO: 1 и 3. Аналоги слитого белка имеют по меньшей мере один эпитоп, способный индуцировать антитела, который взаимодействует с Rib-белком, и по меньшей мере один эпитоп, который реагирует с альфа-белком. Такой аналог может иметь суммарную гомологию или идентичность со слитым белком, представленным в SEQ ID NO: 6, по меньшей мере 80%, например 80-99%-ную гомологию или идентичность, или любой диапазон в ней.
Процент гомологии может быть определен, например, путем сравнения информации о последовательностях с использованием компьютерной программы GAP, версия 6.0, доступной от University of Wisconsin Genetics Computer Group (UWGCG). Программа GAP использует метод выравнивания Нидлмана-Вунша (J.Mol.Biol. 1970, 48: 443), скорректированный Смитом и Уотерманом (Adv.Appl. Math. 1981, 2: 482). Кратко, программа GAP определяет сходство как число выровненных символов (т.е. нуклеотидов или аминокислот), которые сходны, деленное на общее число символов в более короткой из двух последовательностей. Предпочтительные параметры по умолчанию для программы GAP включают: (1) унитарную матрицу сравнения (содержащую числовое значение 1 для идентичностей и 0 для неидентичностей) и взвешенную матрицу сравнения Грибскова и Бургесса (Nucl. Acids Res. 1986, 14: 6745), как описано в Schwartz and Dayhoff, eds. Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington, D.C. 1979, pp.353-358; (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 за каждый символ в каждом гэпе; и (3) без штрафа за концевые гэпы.
Используемый здесь термин "гомологи" относится к указанному слитому белку или Rib- и альфа-белку из вида Streptococcus agalactiae, где один или более чем один аминокислотный остаток в аминокислотной последовательности (SEQ ID NO: 2 или 4) заменен другим аминокислотным остатком, при условии, что общая функциональность и иммуногенные свойства белка-гомолога сохраняются. Такие гомологи могут быть природными или могут быть получены синтетическим путем или методом рекомбинантных ДНК. Гомологи SEQ ID NO: 2 или 4 будут иметь по меньшей мере один эпитоп, способный активировать антитела, который взаимодействуют с Rib- или альфа-белком. Такой гомолог может иметь суммарную гомологию (т.е. подобие) или идентичность с Rib- или альфа-белком по меньшей мере 80%, например 80-99%-ную гомологию (т.е. подобие) или идентичность, или любой диапазон в ней.
Используемое здесь "производное" представляет собой полипептид, в котором изменены одно или более физических, химических или биологических свойств. Такие изменения включают, но ими не ограничиваются: аминокислотные замены, модификации, присоединения или делеции; изменения в паттерне липидилирования, гликозилирования или фосфорилирования; реакции свободных амино, карбоксильных или гидроксильных боковых групп аминокислотных остатков, присутствующих в этом полипептиде, с другими органическими и неорганическими молекулами; и другие изменения, каждое из которых может приводить к изменению первичной, вторичной или третичной структуры.
"Фрагменты" по данному изобретению имеют по меньшей мере один иммуногенный эпитоп. Предпочтительные фрагменты по данному изобретению будут вызывать иммунный ответ, достаточный для предупреждения или ослабления тяжести инфекции.
Термин "фармацевтически приемлемый носитель" означает любой подходящий приемлемый эксципиент, адъювант, носитель, разбавитель, традиционно используемый в фармацевтических препаратах.
Изобретение относится к вакцине, защищающей от инфекций, вызываемых стрептококком группы В (GBS), который является самой важной причиной угрожающих жизни бактериальных инфекций у новорожденных. Настоящее изобретение основывается на знаниях изобретателя и осознании того, что слитый белок из субобластей в двух больших поверхностных белков стрептококка группы В, а именно белков Rib и альфа, индуцирует защитный иммунитет.
С долговременной целью разработать однокомпонентную вакцину на основе стрептококка группы В (GBS) автор изобретения проанализировал, может ли слитый белок из Rib и альфа индуцировать защитный иммунитет. Большой размер Rib и альфа и генетическая нестабильность областей повторов позволили придти к заключению, что слитый белок следует получать из субобластей. Однако выбор субобластей не был очевидным, поскольку защитные эпитопы присутствуют в области повторов белков альфа и Rib. Неожиданно было обнаружено, что слитый белок из N-концевых областей обладает свойствами, превосходящими свойства слитого белка из других областей этих белков, т.е. повторов, и индуцирует хороший защитный иммунитет.
В этом описании, если конкретно не указано иное, употребление существительного в единственном числе означает "один или более".
По всему тексту описания изобретения любой и все конкретные источники информации включены в данное описание посредством ссылки на них.
Слитый белок
В первом аспекте настоящее изобретение относится к слитому белку, содержащему по меньшей мере один первый фрагмент N-концевой области поверхностного белка стрептококка группы В, который слит с по меньшей мере одним вторым фрагментом N-концевой области поверхностного белка стрептококка группы В, где указанные первый и второй фрагменты N-концевой области поверхностного белка стрептококка группы В получены из разных поверхностных белков стрептококка группы В, и где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Разные поверхностные белки стрептококка, которые могут входить в состав слитого белка по настоящему изобретению, включают, но не ограничиваются ими, Rib-белок стрептококка группы В, альфа-белок стрептококка группы В, бета-белок стрептококка группы В, эпсилон-белок стрептококка группы В и/или белок R28 стрептококка группы В.
Согласно одному из воплощений настоящее изобретение относится к слитому белку, содержащему фрагмент N-концевой области Rib-белка стрептококка группы В, который слит с фрагментом N-концевой области альфа-белка стрептококка группы В, где указанный слитый белок способен индуцировать защитный иммунитет против стрептококка группы В.
Согласно другому воплощению настоящее изобретение относится к слиянию, где указанный слитый белок содержит по меньшей мере одну первую аминокислотную последовательность SEQ ID NO: 2 или ее аналог, гомолог, производное или иммунологическую родственную аминокислотную последовательность или фрагменты, слитую с по меньшей мере одной второй аминокислотной последовательностью SEQ ID NO: 4 или ее аналогом, гомологом, производным или иммунологической родственной аминокислотной последовательностью или фрагментами. Указанная по меньшей мере одна первая аминокислотная последовательность содержит аминокислотную последовательность, имеющую по меньшей мере 80, 85, 90, 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 2. Указанная по меньшей мере одна вторая аминокислотная последовательность содержит аминокислотную последовательность, имеющую по меньшей мере 80, 85, 90, 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 4. Один пример слитого белка представлен в SEQ ID NO: 6, и другим примером является слитый белок, который содержит совокупность трех или более аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 2 и SEQ ID NO: 4 или их частей.
Белок Rib стрептококка группы В, который также упоминается в данном описании как Rib и Rib-белок, представляет собой поверхностный белок, известный в данной области и описанный, например, в WO 9421685. Обозначение "Rib" расшифровывается как: устойчивость к протеазам (R), иммунитет (i) и группа В (b). Белок Rib впервые был выделен из стрептококкового штамма группы В серотипа III как отдельный белок с молекулярной массой 95 кДа. Белок Rib экспрессируется почти всеми стрептококковыми штаммами группы В клинически важного серотипа III, которые вызывают большинство случаев менингита, и некоторыми штаммами других серотипов, таких как серотип II. Более того, Rib экспрессируется всеми штаммами гипервирулентного клона типа III. Был разработан способ очистки белка Rib, и было продемонстрировано, что антитела к этому белку защищают от летальной инфекции, вызываемой штаммами, экспрессирующими белок Rib (дополнительные подробности, такие как ДНК и последовательности белка, смотри в WO 9421685).
Белок альфа стрептококка группы В, также упоминаемый в данном описании как альфа, альфа-белок и альфа-антиген, представляет собой поверхностный белок стрептококка группы В, известный в данной области. В WO 9410317 описана конъюгатная вакцинная композиция, содержащая белок альфа. Нативный белок-предшественник альфа стрептококка группы В, как описано в WO 9410317, имеет молекулярную массу 108 кДа. Расщепление предполагаемой сигнальной последовательности из 41 аминокислоты дает зрелый белок с молекулярной массой 104 кДа. (Следует отметить, однако, что впоследствии было показано, что эта сигнальная последовательность имеет длину 56 аминокислотных остатков (Stalhammar-Carlemalm et al., J.Exp.Med. 177, 1593; 1993)). N-концевая область 20 кДа альфа-антигена не демонстрирует гомологию с ранее описанными белковыми последовательностями, и за ней следует серия из девяти тандемных повторяющихся единиц, которые составляют 74% зрелого белка. Каждая повторяющаяся единица (здесь обозначенная как "R") идентична и состоит из 82 аминокислот с молекулярной массой примерно 8500 Дальтон, и кодируется 246 нуклеотидами. С-концевая область альфа-антигена содержит мотив якорного домена клеточной стенки, присутствующий в целом ряде грамположительных поверхностных белков.
Каждый из белков Rib и альфа GBS включает в себя уникальную N-концевую область (N) и область длинного повтора (R). Эти белки, экспрессируемые штаммами GBS BM110 и А909, имеют 12 и 9 повторов соответственно, как указано на Фиг.1А. Области фиксирования в клеточной стенке локализованы на С-концевых концах.
Тандемные повторы в Rib и альфа идентичны в пределах каждого белка, но не между белками, и варьируют по числу между изолятами. Кроме этой вариации, последовательности Rib и альфа стабильны среди штаммов. Несмотря на значительную идентичность аминокислотных остатков (Фиг.1А), эти два белка демонстрируют небольшую перекрестную реактивность или не демонстрируют перекрестную реактивность.
Белок R28 представляет собой поверхностный белок стрептококка группы В, который обеспечивает защитный иммунитет и стимулирует связывание с эпителиальными клетками человека (Stalhammar-Carlemalm et al. Molecular Microbiology 1999, 33, 208-219).
Белок эпсилон представляет собой подобный альфа-белку белок стрептококка группы В (Creti et al. Clin. Microbiol. 2004, 42: 1326-9).
Термин "N-концевая область" применительно к настоящему изобретению относится к области N-конца (N) белка. Примеры аминокислотных последовательностей Rib и альфа N-концевых областей такие, как указано в SEQ ID NO: 2 и SEQ ID NO: 4.
В целях настоящего изобретения термин "слитый белок" относится к ассоциату из двух или более областей белка или их фрагментов, содержащему, например, фрагмент N-концевой области белка Rib стрептококка группы В и фрагмент N-концевой области белка альфа стрептококка группы В. Например, это может быть фрагмент N-концевой области Rib-белка и один фрагмент N-концевой области альфа-белка, или 2, 3, 4 или 5 фрагментов N-концевой области Rib- и альфа-белков, где количества фрагментов из двух белков не равны.
Примеры фрагментов N-концевой области белка Rib стрептококка группы В и фрагментов N-концевой области белка альфа стрептококка группы В включают пептиды, кодирующие нативные аминокислотные последовательности N-концевых областей природных белков альфа и Rib (например SEQ ID NO: 2 и SEQ ID NO: 4), или это могут быть функциональные производные нативных последовательностей этих областей, причем эти функциональные производные сохраняют способность индуцировать защитный иммунитет против стрептококка группы В. Термин "функциональные производные" охватывает части последовательностей и фрагменты N-концевых областей. Он также охватывает варианты природных белков (таких как белки, которые имеют изменения в аминокислотной последовательности, но сохраняют способность проявлять иммуногенное свойство, вирулентность или антигенное свойство, которые проявляет природная молекула), например варианты с измененной фланкирующей последовательностью.
Согласно настоящему изобретению могут быть использованы фрагменты N-концевой области из разных штаммов стрептококка группы В. Это предполагает также легкую вариабельность в последовательности фрагментов N-концевой области, но не изменяет биологические свойства и их функциональную способность индуцировать защитный иммунитет. Например, имеется в виду, что антигены альфа и Rib стрептококка группы В, выделенные из разных штаммов стрептококка группы В, но не те, которые раскрыты в SEQ ID NO: 2 и SEQ ID NO: 4, входят в объем настоящего изобретения.
Объединение полипептидов с получением слитого белка может быть осуществлено несколькими методами, например: химически сочетанием, конъюгированием или поперечным связыванием, либо напрямую, либо через промежуточную структуру; физически сочетанием посредством захвата в или на макромолекулярную структуру; или молекулярным биологическим слиянием посредством объединения молекул рекомбинантных нуклеиновых кислот, которые содержат фрагменты нуклеиновой кислоты, способной кодировать каждую из двух, так что в конце образуется единый непрерывный экпрессионный продукт.
В целях настоящего изобретения термин "белок" относится к молекулярной цепи из аминокислот. Белок не имеет конкретной длины и может, если требуется, модифицироваться in vivo или in vitro, например в результате гликозилирования, амидирования, карбоксилирования или фосфорилирования. Помимо прочего, это определение охватывает пептиды, олигопептиды и полипептиды. Белок или пептид может иметь природное или синтетическое происхождение. В данном контексте под слитым белком подразумеваются два или более полипептидов, ковалентно связанных друг с другом либо напрямую, либо опосредованно несколькими способами, такими как способы, упомянутые выше. Термин "слитый" относится к созданию слитого белка, как упомянуто выше.
Штаммы стрептококка группы В, также упоминаемого здесь как GBS, общеизвестны и могут быть выделены из крови инфицированных живых существ. GBS является наиболее распространенной причиной неонатального сепсиса в Соединенных Штатах и ответственен примерно за 5000 случаев в год.
Обозначение "стрептококк группы В" вытекает из того, что стрептококки разделены на иммунологические группы исходя из присутствия специфических углеводных антигенов на их клеточных поверхностях. В настоящее время известны группы А-O (Davis, B.D. et al., In: Microbiology, 3rd. Edition, page 609, (Harper & Row, 1980)).
Термин "защитный иммунитет" применительно к настоящему изобретению относится к способности сывороточных антител и/или цитотоксического Т-клеточного ответа, вызываемого при иммунизации, защищать (частично или тотально) от заболевания, вызываемого инфекционным агентом, таким как стрептококк группы В. То есть, у позвоночного животного, подвергнутого иммунизации вакцинами по изобретению, рост и распространение стрептококка группы В будут ограничены. Чтобы определить, индуцирован ли защитный иммунитет слитым белком или вакциной, можно использовать методики, известные специалисту в данной области. Например, чтобы определить, индуцирует ли иммунизация слитым белком или вакциной по изобретению защитный иммунитет против инфекции, вызываемой стрептококком группы В, тестируемых иммунизированных животных подвергают воздействию стрептококка группы В и измеряют рост и распространение стрептококка группы В. Например, чтобы определить, индуцирован ли защитный иммунитет, могут быть использованы способы, описанные в примерах ниже.
В одном из воплощений данного изобретения слитый белок дополнительно содержит фрагмент N-концевой области белка R28 стрептококка группы В (Gene bank acc no: AAD39085.1) и/или фрагмент N-концевой области белка эпсилон стрептококка группы В.
В одном из воплощений данного изобретения слитый белок по настоящему изобретению содержит повторяющиеся пептидные последовательности фрагментов N-концевых областей белков стрептококка группы В (т.е. альфа и Rib).
Согласно одному из воплощений данного изобретения слитый белок содержит аминокислотную последовательность, имеющую по меньшей мере 80%-ную, 85%-ную, предпочтительно 90%-ную, более предпочтительно 95%-ную идентичность последовательности с аминокислотной последовательностью, которая представлена в SEQ ID NO: 6.
Термин "идентичность последовательности" указывает количественную меру степени гомологии между двумя аминокислотными последовательностями равной длины или между двумя нуклеотидными последовательностями равной длины. Если две последовательности, которые сравнивают, не равной длины, то они должны быть выровнены до возможного наилучшего соответствия. Идентичность последовательности можно вычислить, например, с помощью программы BLAST, например программы BLASTP или программы BLASTN (Pearson W.R and D.J. Lipman (1988) PNAS USA 85:2444-2448) (www.ncbl.nlm.nlh.gov/BLAST).
Согласно еще одному воплощению данного изобретения слитый белок содержит аминокислотную последовательность, которая представлена в SEQ ID NO: 6.
Выделенная ДНК и системы экспрессии
Во втором аспекте настоящего изобретения предложена выделенная нуклеотидная последовательность/молекула ДНК, содержащая нуклеотидную последовательность/последовательность ДНК, которая кодирует слитый белок по изобретению. Одним из примеров является нуклеотидная последовательность, содержащая по меньшей мере одну первую нуклеотидную последовательность, представленную в SEQ ID NO: 1, или ее фрагменты, слитую с по меньшей мере одной второй нуклеотидной последовательностью, представленной в SEQ ID NO: 3, или ее фрагментами.
Предложена также рекомбинантная система экспрессии, включающая векторы и клетки-хозяева.
В экспрессировании нуклеотидных последовательностей по данному изобретению может быть использовано широкое разнообразие экспрессионных комбинаций хозяин/вектор. Полезные векторы экспрессии для эукариотических хозяев включают, например, векторы, содержащие последовательности, контролирующие экспрессию, из SV40, вируса бычьей папилломы, аденовируса, аденоассоциированного вируса, цитомегаловируса и ретровирусов. Полезные векторы экспрессии для бактериальных хозяев включают бактериальные плазмиды, такие как плазмиды из Е.coli, в том числе pBluescript, pGEX2T, pUC векторы, col El, pCRI, pBR322, pMB9 и их производные, плазмиды для более широкого круга хозяев, такие как RP4, фаговые ДНК, например многочисленные производные фага лямбда, например лямбда GTIO и лямбда GTI 1, NM989 и другие ДНК фаги, такие как М13 и нитчатые фаги одноцепочечной ДНК. Полезные векторы экспрессии для дрожжевых клеток включают плазмиду 2.mu. и ее производные. Полезные векторы для клеток насекомых включают pVL 941.
Кроме того, любая из широкого разнообразия последовательностей, контролирующих экспрессию, может быть использована в этих векторах для экспрессии нуклеотидных последовательностей/последовательностей ДНК по данному изобретению. Полезные последовательности, контролирующие экспрессию, включают последовательности, контролирующие экспрессию, ассоциированные со структурными генами вышеуказанных векторов экспрессии. Примеры полезных последовательностей, контролирующих экспрессию, включают, например, ранние и поздние промоторы SV40 или аденовируса, lac систему, trp систему, ТАС или TRC систему, промоторы Т3 и Т7, основные операторные и промоторные участки фага лямбда, участки контроля fd покровного белка, промотор для 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислотной фосфатазы, например Pho5, промоторы дрожжевой альфа-спаренной системы и другие конститутивные и индуцибельные промоторные последовательности, о которых известно, что они контролируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, и различные их комбинации.
Клетки-хозяева, трансформированные вышеуказанными векторами, составляют еще один аспект данного изобретения. Самые разнообразные одноклеточные хозяева полезны в экспрессировании нуклеотидных последовательностей/последовательностей ДНК по данному изобретению. Эти хозяева могут включать общеизвестные эукариотические и прокариотические хозяева, такие как грамотрицательные и грамположительные штаммы, такие как штаммы E.coli, Pseudomonas, Bacillus, Streptomyces, стрептококка, стафилококка, Lactobacillus, Aspergillus, шигеллы, сальмонеллы, листерии, гриба, дрожжей, клетки насекомых, такие как Spodoptera frugiperda (SF9), клетки животных, такие как СНО (клетки яичника китайского хомячка) и клетки мыши, клетки африканской зеленой мартышки, such как COS 1, COS 7, BSC 1, BSC 40, и ВМТ 10, клетки человека и клетки растений в культуре ткани. Предпочтительные организмы-хозяева включают бактерии, такие как Е.coli и В.subtilis, и клетки млекопитающих в культуре ткани.
Понятно, разумеется, что не у всех векторов и последовательностей, контролирующих экспрессию, функция экспрессирования нуклеотидных последовательностей/последовательностей ДНК по данному изобретению будет в равной степени хорошая. Также не у всех хозяев будет в равной степени хорошая функция с одной и той же системой экспрессии. Однако специалист в данной области может произвести отбор среди этих векторов, последовательностей, контролирующих экспрессию, и хозяев без чрезмерного экспериментирования и не выходя за рамки объема изобретения. Например, при отборе вектора необходимо учитывать хозяина, поскольку вектор должен реплицироваться в нем. Число копий вектора, способность контролировать это число копий и экспрессия любых других белков, кодируемых этим вектором, таких как антибиотические маркеры, также должны быть приняты во внимание. При отборе последовательности, контролирующей экспрессию, следует учитывать различные факторы. Они включают, например, относительную устойчивость последовательности, ее контролируемость и ее совместимость с нуклеотидными последовательностями/ДНК-последовательностями по данному изобретению, особенно в отношении потенциальных вторичных структур. Одноклеточные хозяева следует отбирать с учетом их совместимости с выбранным вектором, токсичности продукта, кодируемого нуклеотидными последовательностями/последовательностями ДНК по данному изобретению, характеристик их секреции, их способности правильно сворачивать белок, требований к их ферментации или культивированию и легкости очистки из них продуктов, кодируемых нуклеотидными последовательностями/ДНК-последовательностями по данному изобретению. В пределах этих параметров специалист в данной области может выбрать различные комбинации вектор/последовательность, контролирующая экспрессию/хозяин, которые будут экспрессировать нуклеотидные последовательности/последовательности ДНК по данному изобретению при культивировании или в животной культуре укрупненного масштаба.
Полипептиды, кодируемые нуклеотидными последовательностями/последовательностями ДНК по данному изобретению, могут быть выделены из микробиологической культуры или клеточной культуры и очищены с использованием различных общепринятых способов, включая жидкостную хроматографию, такую как нормальнофазная или обращеннофазная HPLC (высокоэффективная жидкостная хроматография), FPLC (быстрая жидкостная хроматография белков) и т.п., аффинную хроматографию (такую как с неорганическими лигандами или моноклональными антителами), ионообменную хроматографию, эксклюзионную хроматографию, металлхелатную хроматографию, гель-электрофорез и т.п. Специалист в данной области может выбрать наиболее подходящие методики выделения и очистки, не выходя за рамки объема изобретения.
Кроме того, полипептиды по данному изобретению могут быть получены любым из нескольких химических методов. Например, они могут быть получены с использованием твердофазного синтетического метода, первоначально описанного R.В.Merrifield (J.Am. Chem. Soc. 1963, 83: 2149-54), или они могут быть получены синтезом в растворе. Описание методов пептидного синтеза можно найти в Е.Gross & Н.J.Meinhofer, 4 The Peptides: Analysis Synthesis, Biology; Modern Techniques Of Peptide and Amino Acid Analysis, John Wiley & Sons, (1981); и М.Bodanszky, Principles Of Peptide Synthesis, Springer-Verlag (1984).
Предпочтительные композиции и способы по данному изобретению включают в себя полипептиды, имеющие повышенную иммуногенность. Такие полипептиды могут образовываться в результате модификации нативных форм полипептидов или их фрагментов или в результате обработки, обеспечивающей усиление их иммуногенного характера в предполагаемом реципиенте. Специалисту в данной области доступны и известны многочисленные методики, которые могут быть использованы, без лишнего экспериментирования, чтобы существенно повысить иммуногенность описанных здесь полипептидов. Например, полипептиды могут быть модифицированы связыванием с динитрофенольными группами или арсаниловой кислотой, или денатурацией с использованием нагрева и/или SDS (додецилсульфата натрия). В частности, если полипептиды представляют собой небольшие полипептиды, синтезированные химическим путем, то может быть желательным связывание их с иммуногенным носителем. Разумеется, связывание не должно затрагивать способность либо полипептида, либо носителя функционировать должным образом. Обзор по некоторым общим соображениям касательно стратегий связывания опубликован в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, ed. Е.Harlow and D.Lane (1988). Полезные иммуногенные носители общеизвестны в данной области. Примерами таких носителей являются гемоцианин фиссуреллы (KLH); альбумины, такие как бычий сывороточный альбумин (BSA) и овальбумин, PPD (очищенное белковое производное туберкулина); красные кровяные клетки; столбнячный анатоксин; холерный анатоксин; агарозные шарики; активированный уголь; или бентонит.
Экспрессия может быть осуществлена в так называемых бесклеточных системах экспрессии. Такие системы содержат все необходимые факторы для экспрессии из соответствующей рекомбинантной нуклеиновой кислоты, функционально связанные с промотором, который будет функционировать в этой конкретной системе.
Нуклеотидные последовательности/последовательность ДНК N-концевых областей Rib и альфа такие, как представлено в SEQ ID NO: 1 и SEQ ID NO: 3, и нуклеотидные последовательности/последовательность ДНК слитого белка, использованные в примерах, приведенных ниже, такие как представлено в SEQ ID NO: 5.
В одном из воплощений изобретение относится к способу получения указанного слитого белка, включающему следующие стадии: получение клетки-хозяина, как описано выше, содержащей нуклеотидную последовательность, как описано выше; размножение указанной клетки-хозяина в подходящей среде хозяина, известной специалисту в данной области; очистка указанного слитого белка с использованием одного или более из вышеупомянутых методов; и получение указанного слитого белка, который затем может быть использован для приготовления вакцины, как описано ниже.
Вакцинные композиции
В третьем аспекте настоящего изобретения предложена вакцина, содержащая слитый белок по изобретению и фармацевтически приемлемый носитель.
Вакцинная композиция по настоящему изобретению может содержать, в дополнение к слитому белку, другие фармакологически приемлемые ингредиенты, такие как соли, буферы, иммуноактивные компоненты, адъюванты, смачивающие агенты, эмульгаторы и суспендирующие агенты, или подсластители, корригенты, ароматизаторы, или другие вещества, которые желательны для увеличения эффективности композиции. О композиции говорят, что она "фармакологически приемлемая", если индивидуум-реципиент может переносить ее введение.
Поливалентная вакцина может быть также приготовлена путем объединения слитого белка с другими компонентами, включая, но не ограничиваясь ими, дифтерийный анатоксин или столбнячный анатоксин, или полисахариды, с использованием методик, известных в данной области.
Другие примеры предпочтительных белков поливалентной вакцины по настоящему изобретению включают дополнительные поверхностные белки стрептококка группы В или их эквиваленты, такие как белок R28 и белок эпсилон.
В одном из воплощений вакцинная композиция по настоящему изобретению содержит фрагмент белка R28 стрептококка группы В и/или фрагмент белка эпсилон стрептококка группы В.
Способы приготовления вакцинных композиций и их препаратов общеизвестны специалистам в данной области. Выбор ингредиентов будет варьировать, например, в зависимости от пути введения композиции. Например, композиции для парентерального введения включают стерильные или нестерильные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические эфиры, такие как этилолеат. Носители или окклюзионные повязки могут быть использованы для увеличения проницаемости через кожу и усиления абсорбции антигенов. Жидкие лекарственные формы для перорального введения могут содержать главным образом липосомный раствор, содержащий жидкую лекарственную форму. Подходящие формы для суспендирования липосом включают эмульсии, суспензии, растворы, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области, такие как очищенная вода.
Вакцинная композиция по настоящему изобретению может содержать дополнительный иммуноактивный компонент. Дополнительный иммуноактивный компонент может представлять собой антиген, усиливающее иммунитет вещество и/или вакцину, и все они могут содержать адъювант.
Адъюванты представляют собой вещества, которые могут быть использованы, в частности, для приращения специфического иммунного ответа. Обычно перед презентацией в иммунную систему адъювант и композицию смешивают, или их представляют по отдельности, но в одно и то же место иммунизируемого животного или человека. Адъюванты можно разделить на основе их состава приблизительно на несколько групп. Эти группы включают масляные адъюванты (например полный и неполный адъювант Фрейнда), минеральные соли (например AIK(SO4)2, AINa(SO4)2, AINH4(SO4)), диоксид кремния, каолин и углерод, полинуклеотиды (например кислоты poly IC (полиинозиновая: полицитидиловая кислота) и poly AU (полиадениловая: полиуридидовая кислота) и некоторые природные вещества (например воск D из Mycobacterium tuberculosis, а также вещества, обнаруживаемые в Corynebacterium parvum или Bordetella pertussis и членах рода Brucella). К веществам, особенно полезным в качестве адъювантов, относятся сапонины, такие как, например, Quil А. Примеры веществ, подходящих для использования в вакцинной композиции, приведены в Remington's Pharmaceutical Sciences (Osol, A, Ed, Mack Publishing Co, Easton, PA, pp.1324-1341 (1980). В еще одном воплощении слитый белок по изобретению может быть использован в качестве носителя для полисахарида в конъюгатной вакцине, В этом воплощении вакцина содержит белок, т.е. слитый белок, конъюгированный с полисахаридом (таким как капсульный полисахарид).
Использование полипептида, белка или слитого белка в качестве носителя для полисахарида в конъюгатной вакцине известно в данной области (смотри, например, US 6855321, WO 9410317 и US 4496538).
Под полисахаридом подразумевается любой линейный или разветвленный полимер, состоящий из моносахаридных остатков, обычно связанных гликозидными связями, и, соответственно, включающий олигосахариды. Предпочтительно, полисахарид содержит от 2 до 50 моносахаридных единиц, более предпочтительно от 6 до 30 моносахаридных единиц.
Полисахаридный компонент может быть основан на или получен из полисахаридных компонентов полисахаридной капсулы из многих грамположительных и грамотрицательных бактериальных патогенов, таких как Н.influenzae, N.meningitidis и S.pneumoniae. Другие бактерии, полисахаридные компоненты из которых могут быть конъюгированы с белками-носителями по настоящему изобретению, включают Staphylococcus aureus, Klebsiella, Pseudomonas, Salmonella typhi, Pseudomonas aeruginosa и Shigella dysenteriae. Полисахаридные компоненты, пригодные для использования согласно этому аспекту настоящего изобретения, включают Hib олигосахарид, липополисахарид из Pseudomonas aeruginosa (Seid and Sadoff, 1981), липополисахариды из Salmonella (Konadu et al., 1996) и O-специфичный полисахарид из Shigella dysenteriae (Chu et al, 1991). Другие полисахаридные компоненты, пригодные для использования в соответствии с настоящим изобретением, известны специалистам в данной области.
Фрагменты бактериального капсульного полисахарида могут быть получены любым подходящим способом, таким как кислотный гидролиз или ультразвуковая иррадиация (Szn et al, 1986). Другие способы получения полисахаридных компонентов известны специалистам в данной области.
В одном из воплощений настоящего изобретения полисахарид представляет собой капсульный полисахарид, получаемый из стрептококка группы В, или его эквиваленты.
Полисахаридный компонент конъюгатной вакцины предпочтительно связан с белком-носителем ковалентной связью. Особенно предпочтительным способом связывания полисахарида и белка является восстановительное аминирование. Другие способы включают активацию полисахарида цианбромидом с последующим взаимодействием с дигидразидом адипиновой кислоты (спейсер) и конъюгированием с карбоксильными группами белка-носителя с использованием растворимых карбодиимидов (Shneerson et al, 1986); функционализирование белка-носителя дигидразидом адипиновой кислоты с последующим связыванием с активированными цианбромидом полисахаридами (Dick et al, 1989); химическую модификацию как белка-носителя, так и полисахарида с последующим их связыванием (Marburg et at, 1986; Marburg et al, 1987 и 1989).
Полисахаридная молекула может быть связана с белком-носителем через молекулу-спейсер, такую как адипиновая кислота. Эта молекула-спейсер может быть использована для облегчения связывания белка с полисахаридом. После проведения реакции связывания конъюгат может быть очищен диафильтрацией или другими известными способами для удаления непрореагировавшего белка или непрореагировавших полисахаридных компонентов.
Если полисахарид получен из бактериального патогена, иного чем GBS, то конъюгат может индуцировать иммунитет против двух или более патогенов, например множества типов бактерий. Это является потенциально важным применением слитого белка. Для приготовления конъюгатной вакцины значительным преимуществом может быть то, что белковая часть состоит из единого слитого белка.
Для специалиста в данной области очевидно, что вакцинная композиция по настоящему изобретению может содержать другие вещества или соединения, не упомянутые выше, например другие разбавители, эмульгаторы или стабилизаторы, или другие белки или полисахариды. Такие вещества или соединения должны придавать композиции желаемые свойства.
Способы предупреждения и лечения инфекции, вызываемой стрептококком группы В
В еще одном аспекте настоящего изобретения предложены способы предупреждения или лечения инфекции, вызываемой стрептококком группы В. Эти способы включают введение индивидууму фармацевтически эффективного количества вакцины по изобретению. Согласно изобретению предложено также применение иммуногенной композиции по изобретению для изготовления вакцины для предупреждения или лечения инфекции, вызываемой стрептококком группы В.
Иммунопрофилактика матери вакциной для защиты от инфицирования стрептококком группы В как матери, так и потомства давно была предложена как возможный путь.
Термин "предупреждение или лечение" в его различных грамматических формах в контексте настоящего изобретения относится к предупреждению, излечению, реверсии, ослаблению, облегчению, улучшению состояния, ингибированию, минимизации, подавлению или остановке (1) вредных эффектов расстройства, ассоциированного с инфекцией, вызываемой стрептококком группы В, (2) прогрессирования расстройства или (3) возбудителя расстройства (стрептококка группы В). Термин "предупреждение или лечение" также охватывает формирование у индивидуума общего или частичного иммунитета к инфекции, вызываемой стрептококком группы В.
Согласно одному из воплощений этот способ предупреждения или лечения включает введение особи женского пола эффективного количества вакцины по изобретению, способной выработать иммунитет к инфекции, вызываемой стрептококком группы В, у не рожденного потомства указанной особи женского пола. Согласно этому воплощению вакцину вводят не беременной особи женского пола или беременной особи женского пола во временных и количественных условиях, достаточных для того, чтобы вызвать продуцирование антител, которые служат для защиты как особи женского пола, так и плода или новорожденного (посредством пассивного переноса антител через плаценту).
В еще одном воплощении способ предупреждения или лечения инфекции, вызываемой стрептококком группы В, включает введение индивидууму эффективного количества антисыворотки, индуцированной в результате воздействия вакцины по изобретению на второго индивидуума. Согласно этому воплощению устойчивость к стрептококку группы В формируется у индивидуума пассивной иммунизацией, т.е. вакцину вводят хозяину-добровольцу (т.е. человеку или млекопитающему), и индуцированную антисыворотку выделяют и прямо вводят реципиенту, у которого подозревают инфекцию, вызываемую стрептококком группы В. Предполагается, что такую антисыворотку можно вводить беременной особи женского пола (во время родов или перед родами) во временных и количественных условиях, достаточных для того, чтобы антисыворотка могла служить для защиты и плода, и новорожденного (посредством пассивного инкорпорирования антител через плаценту).
Таким образом, вакцину или антисыворотку можно вводить либо до начала инфицирования (чтобы защитить или ослабить ожидаемое инфицирование), либо после инициации реального инфицирования.
Вакцинную композицию или антисыворотку согласно изобретению можно вводить людям или животным, включая млекопитающих и птиц, таких как грызуны (мышь, крыса, морская свинка или кролик), птицы (индюк, утка или цыпленок), другие сельскохозяйственные животные (корова, лошадь, свинья или поросенок), домашние животные (собака, кошка и другие домашние животные) и люди. Хотя препаратом по изобретению можно лечить многих животных, предпочтительным для лечения индивидуумом является человек или имеющее коммерческое значение животное и скот.
Вакцинную композицию или антисыворотку по изобретению можно вводить индивидууму способами, известными в данной области. Такие способы включают введение, например парентеральное, такое как введение любым путем инъецирования в или через кожу, например внутримышечным, внутривенным, интраперитонеальным, интрадермальным, мукозальным, субмукозальным или подкожным. Их также можно применять местным нанесением в виде капли, спрея, геля или мази на эпителий слизистой оболочки глаза, носа, ротовой полости, ануса или вагины, или на эпидермис наружного кожного покрова в любой части тела. Другими возможными путями применения являются применение спрея, аэрозоля или порошка ингаляцией через дыхательные пути. В этом последнем случае используемый размер частиц будет определять, как глубоко частицы будут проникать в дыхательные пути. Альтернативно, вводить можно через пищеварительный тракт, путем объединения с пиццей, кормом или питьевой водой, например в виде порошка, жидкости или таблетки, или введением непосредственно в ротовую полость в виде жидкости, геля, таблетки или капсулы, или в анус в виде суппозитория. Вакцину также можно вводить в форме ДНК вакцины.
Для распределения иммунизации во времени существует множество разных методик. Композиции по изобретению можно использовать более чем однократно для увеличения уровней и диверсификации экспрессии иммуноглобулинового репертуара, экспрессируемого подвергнутыми иммунизации животными. Обычно, если проводится многократная иммунизация, то ее проводят с перерывом от одного до двух месяцев.
Термин "эффективное количество" в контексте настоящего изобретения относится к такому количеству, которое обеспечивает терапевтический эффект для данного состояния и режима введения. Это количество представляет собой предопределенное количество активного вещества, рассчитанное так, чтобы продуцировать желаемый терапевтический эффект совместно с требуемыми добавками и разбавителями, т.е. носителем или растворителем для введения. Этот термин также означает количество, достаточное для снижения и, наиболее предпочтительно, для предупреждения клинически значимого дефицита активности и ответной реакции хозяина. Альтернативно, терапевтически эффективное количество является достаточным для того, чтобы вызвать улучшение клинически значимого состояния у хозяина. Как известно специалистам в данной области, количество соединения может варьировать в зависимости от его специфической активности. Подходящие дозовые количества могут содержать предопределенное количество активной композиции, рассчитанной для продуцирования желаемого терапевтического эффекта совместно с требуемыми разбавителями, т.е. носителем или добавкой. Кроме того, вводимая дозировка будет варьировать в зависимости от используемого активного начала или начал, возраста, массы и других характеристик индивидуума, которого лечат.
Как правило, дозировка будет состоять из начальной инъекции, наиболее вероятно с адъювантом, примерно от 0,01 до 10 мг и предпочтительно от 0,1 до 1,0 мг слитого белка-антигена на индивидуума с последующими наиболее вероятно одной или, возможно, более инъекциями ревакцинирующих доз. Предпочтительно, ревакцинирующие дозы вводят примерно через 1 и 6 месяцев после первоначальной инъекции.
ПРИМЕРЫ
Чтобы данное изобретение можно было лучше понять, ниже приведены примеры. Следует иметь в виду, однако, что приведенные ниже примеры приведены для иллюстрации настоящего изобретения, и изобретение не ограничивается конкретными условиями и подробностями, описанными в этих примерах.
В приведенных ниже примерах использованы следующие штаммы стрептококка группы В (GBS): А909 (тип Ia), SB35sed1 (тип Ib), 1954/92 (тип II) и ВМ110 (тип III) (Larsson et al. Infect. Immun. 1996, 64:3518-3523; Stalhammar-Carlemalm et al. J.Exp.Med. 1993, 177: 1593-1603). Штамм ВМ110 является членом гипервирулентного клона ST-17. Все штаммы GBS выращивали в бульоне Тодда-Хьюита при 3°С без встряхивания.
Все упомянутые здесь штаммы были получены авторами изобретения из Лундского университета и Лундского университетского госпиталя (доктор Гуннар Линдахл, Отделение медицинской микробиологии [University of Lund and the Lund University Hospital (Doctor Gunnar Lindahl, Department of Medical Microbiology, Solvegatan 23, SE-22362 Lund, Sweden)].
Пример 1: Конструкция Rib- и альфа-негативных бактериальных мутантов
Rib-негативный мутант получали из ВМ110. Фрагмент ~7 т.п.н. (тысяча пар нуклеотидов), несущий ген rib и фланкирующие последовательности, субклонировали в pJRS233 (Perez-Casal et al, Mol. Microbiol. 1993, 8: 809-819).
Ген rib делетировали инверсной PCR (полимеразная цепная реакция) и заменяли канамицин-устойчивой кассетой. После трансформации в ВМ110 Rib-негативный мутант выделяли гомологичной рекомбинацией (Perez-Casal, J. et al, 1993). Целый ген rib отсутствует в этом мутанте в отличие от ранее описанного (Waldemarsson et al. J.Bacteriol. 2006, 188: 378-388). Структуру мутанта подтверждали PCR. У этого мутанта отсутствовала реактивность с анти-Rib сывороткой, но это не сказывалось на экспрессии капсулы. Альфа-негативный мутант А909 конструировали аналогичным способом. У этого мутанта отсутствовала реактивность с анти-альфа сывороткой, но это не сказывалось на экспрессии капсулы или бета-белка.
Пример 2: Конструирование слитых белков и других производных Rib и альфа
В описанных здесь примерах использовали интактные белки и серию рекомбинантных белков (смотри Фиг.1В). Фрагменты гена Rib (SEQ ID NO: 1) в ВМ110 и гена bca, кодирующих альфа-белок (SEQ ID NO: 3) в А909 клонировали в pGEX-6P-2 (Amersham) и использовали для получения GST-слияний (GST-глютатион-S-трансфераза). После удаления GST очищенные производные имели N-концевую последовательность GPLGS. RibN и Rib2R соответствуют аминокислотным остаткам соответственно 1-174 и 175-332 Rib-белка, и aльфaN соответствует остаткам 1-170 альфа-белка (нумерация из Wastfelt et al. J.Biol. Chem. 1996, 271: 18892-18897). RibN-aльфaN содержит аминокислоты 1-174 Rib-белка и аминокислоты 1-170 альфа-белка, а Rib2R-альфа2R 12 содержит аминокислоты 175-332 Rib-белка и аминокислоты 171-334 альфа-белка. В результате проведенных процедур каждый слитый белок включал в себя последовательность EF между двумя областями. Rib и альфа очищали из ВМ110 и А909 соответственно.
Пример 3: Анализ очищенных белков
На Фиг.1C представлен анализ очищенных белков методом SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). На изображении объединены два геля. Числа слева указывают молекулярную массу в кДа. Поскольку Rib и альфа мигрируют в гелях аберрантно, кажущиеся размеры белков не точно соответствуют размерам, выведенным из аминокислотных последовательностей.
Пример 4: Тестирование иммунодоминирования областей повторов Rib-белка и альфа-белка
Кроличью антисыворотку получали подкожной иммунизацией примерно 35 мкг белка в CFA (полный адъювант Фрейнда), а затем двумя ревакцинирующими дозами примерно 18 мкг белка в IFA (неполный адъювант Фрейнда). Мышей иммунизировали подкожно 25 мкг белка с адъювантом или без адъюванта, как указано, повторно иммунизировали через 4 недели 12 мкг белка и две недели спустя отбирали кровь. Для CFA-мышей ревакцинирующую дозу вводили с IFA.
Тесты на связывание и ингибирование антител (Фиг.1D) выполняли по существу так же, как описано в Stalhammar-Carlemalm et al, J.Exp.Med. 1993, 177: 1593-1603; Wastfelt et al. J.Biol. Chem. 1996, 271: 18892-18897, чтобы Проанализировать, были ли мышиные анти-Rib антитела, индуцированные с использованием квасцов в качестве адъюванта, направлены против N-концевой области и/или области повторов. Антитела, индуцированные с использованием квасцов в качестве адъюванта, использовали для обнаружения чистого Rib, иммобилизованного в микротитровальных лунках, и связывание ингибировали путем добавления указанного чистого белка (2 мкг). Связанные кроличьи антитела детектировали с использованием белка G с радиоактивной меткой, а связанные мышиные антитела детектировали путем инкубирования с кроличьим антителом против Ig мыши, затем белком G с радиоактивной меткой. Связывание вычисляли в % белка G, связавшегося при наименьшем разведении антисыворотки. Чувствительность тестов на ингибирование (Фиг.1D) оптимизировали, используя покровный раствор 0,05 мкг/мл и мышиную сыворотку, разведенную 1000-кратно. Все тесты были проведены по меньшей мере три раза, и значения SD (стандартное отклонение) указаны. Для дот-блот анализа мембраны инкубировали с указанной мышиной сывороткой, и связавшиеся антитела детектировали инкубированием с кроличьим антителом против Ig мыши, затем белком G с радиоактивной меткой и ауторадиографией.
Как и ожидалось, Rib полностью ингибировал связывание с Rib, и почти полное ингибирование наблюдалось также с Rib2R, тогда как RibN оказывал очень незначительный эффект. Таким образом, почти все антитела были направлены против повторов. Ингибирование белком Rib2R было неспецифическим, поскольку он не ингибировал связывание антител с неродственным GBS антигеном (данные не показаны).
В альфа системе дот-блот анализ показал, что анти-альфа реагировали с интактным альфа, а не с альфаМ (Фиг.1Е, слева). Отсутствие реактивности альфаN не является свойством, присущим этой конструкции, поскольку анти-альфаN реагировали как с альфа, так и с альфаN (Фиг.1Е, справа).
Причина иммунодоминирования областей повторов в Rib и альфа не известна. Поливалентные взаимодействия между повторами и рецепторами Ig на В-клетках могут вносить определенный вклад, но Rib и альфа не являются Т-клеточно-независимыми антигенами, поскольку они вызывают IgG ответы. Заслуживает внимания то, что слабый иммунный ответ на NH2-концевые области не был следствием маскировки, поскольку эти области доступны для антител (смотри ниже).
Пример 5: Пассивная вакцинация
Казалось бы, что поскольку антитела к Rib и альфа направлены почти исключительно против повторов и обеспечивают защиту, вакцину на основе слитого белка следует получать из этих повторов. Однако доступные данные не исключали того, что выделенные N-концевые области могли бы обеспечивать лучшую защиту, чем повторы, и быть пригодными для конструкции слитого белка. Чтобы проанализировать эту гипотезу, авторы настоящего изобретения использовали Rib систему для прямого сравнения защитной способности антител, направленных против N-концевой области или повторов. В анализе использовали кроличьи антитела, индуцированные RibN или Rib2R, и мышиную модель пассивной вакцинации.
Пассивные вакцинации проводили как описано в Stalhammar-Carlemalm et al, J.Exp.Med. 1993, 177: 1593-1603, с использованием мышей С3Н/HeN, кроличьей антисыворотки и летальной дозы LD90 бактерий в log-фазе (105-106 CFU (колониеобразующая единица), в зависимости от используемого штамма). Выживание регистрировали в течение периода времени 96 ч. Для активных вакцинаций мышей иммунизировали подкожно 10 мкг белка, смешанного с квасцами. 5 мкг ревацинирующей дозы вводили через 4 недели, с квасцами. Контрольные мыши получали PBS (забуференный фосфатом физиологический раствор) и квасцы. Через две недели после повторной иммунизации мышей подвергали воздействию летальной дозы LD90 бактерий и фиксировали выживаемость. Все эксперименты были одобрены местным комитетом по надзору за исследованиями на животных.
Антитела реагировали с Rib-экспрессирующими бактериями, но не с Rib-негативным мутантом, демонстрируя, что они распознали эпитопы, экспонированные на нативной форме Rib (Фиг.2А). Поскольку анти-RibN сыворотка имела примерно в 7 раз более высокий титр, чем анти-Rib2R сыворотка, ее разводили соответственно, чтобы иметь возможность напрямую сравнивать в мышиной модели. В этой модели каждая антисыворотка защищала от летальной инфекции (Фиг.2В), а разведенная анти-RibN защищала по меньшей мере так же, как и неразведенная анти-Rib2R. Значения р относятся к сравнениям с неиммунным контролем на 96 час. Результаты тестов в Rib системе позволили предположить, что слитый белок из N-концевых областей Rib и альфа следует сравнить со слитым белком из повторов. Однако было неочевидно, что слитый белок из N-концевых областей необходим, поскольку эти области проявляют 61%-ную идентичность остатков (Фиг.1А), что указывает на то, что они могут реагировать перекрестие. Перекрестная реактивность могла пройти незамеченной в предшествующих исследованиях, в которых использовали антитела против интактных белков, т.е. антитела, направленные главным образом против повторов.
Эту гипотезу анализировали с использованием анти-RibN и анти-альфаN (Фиг.3А). Каждая антисыворотка реагировала с целыми бактериями из Rib-экспрессирующего штамма ВМ110 (слева, незакрашенные символы), но не с Rib-негативным мутантом (слева, закрашенные символы). Аналогичным образом, каждая антисыворотка реагировала с бактериями альфа-экспрессирующего штамма А909 (справа, незакрашенные символы), но не с альфа-негативным мутантом (справа, закрашенные символы). Аналогичные данные были получены с использованием двух кроличьих сывороток каждого типа. Это указывает на то, что N-концевые области не имеют перекрестной реактивности. Поэтому был сконструирован слитый белок RibN-альфаN, и его сравнивали со слитым белком сходного размера из повторов, Rib2R-альфа2R. Судя по реактивности с Rib- или альфа-экспрессирующими бактериями (Фиг.3В), у кролика слитый белок RibN-альфаN вызывал лучшие ответные реакции антител, чем Rib2R-альфа2R. Для сравнения пассивной защиты в мышиной модели анти-(RibN-альфаN) сыворотку разводили до того же титра, что и анти-(Rib2R-альфа2R) сыворотку. Каждая антисыворотка защищала от Rib-экспрессирующего штамма типа III и альфа-экспрессирующего штамма типа Ia (Фиг.3С). Таким образом, каждый из двух слитых белков индуцировал защитные антитела, направленные против Rib и альфа.
Пример 6: Пассивная вакцинация для множественных серотипов GBS
Чтобы проанализировать, является ли защита, обеспечиваемая анти-(RibN-альфаN) сывороткой, независимой от капсульного серотипа, была использована модель пассивной иммунизации. Хорошая защита наблюдалась в экспериментах с Rib-экспрессирующим штаммом типа II и альфа-экспрессирующим штаммом типа Ib (Фиг.3D). Так, анти-(RibN-альфаN) защищала от Rib- и альфа-экспрессирующих штаммов четырех классических серотипов, Ia, Ib, II и III. Эта защита не была неспецифической, поскольку анти-(RibN-альфаN) не защищала от Rib-негативного мутанта (Фиг.3Е). Примечательно, что для этого анализа можно было использовать Rib-негативный мутант, поскольку он не проявлял пониженную вирулентность в мышиной модели. Антитела к RibN-альфаN также распознавали штаммы, экспрессирующие два белка, родственных белкам Rib и альфа, белки R28 и эпсилон, которые экспрессируются многими штаммами серотипов V и Ia соответственно (Lindahl et al., Clin. Microbiol. Rev. 2005, 18: 102-127; Brimil et al. Int. J.Med. Microbiol. 2006, 296: 39-44). Однако для защиты от штаммов, экспрессирующих R28 или эпсилон, может потребоваться конструкция слитого белка, включающего N-концевые области этих белков.
Пример 7: Активная вакцинация
На Фиг.4 представлены результаты активной иммунизации слитым белком RibN-альфаМ. (А) Иммуногенность RibN-альфаN при введении с адъювантом или без адъюванта. Группы из четырех мышей подвергали иммунизации RibN-альфаN, смешанным с CFA, квасцами или PBS, подвергали повторной иммунизации через 4 недели и отбирали кровь 2 недели спустя. Мышиную сыворотку анализировали на реактивность с использованием чистого антигена, иммобилизованного в микротитровальных лунках. Связавшиеся мышиные антитела детектировали путем инкубирования с кроличьим антителом против lg мыши, затем белком G с радиоактивной меткой. (В) Активная вакцинация слитым белком RibN-альфаN. Мышей (в количестве, указанном по оси у) подвергали иммунизации чистым RibN-альфаN, смешанным с квасцами, подвергали повторной иммунизации через 4 недели и спустя 2 недели вводили им Rib-экспрессирующий штамм ВМ110 типа III (слева) или альфа-экспрессирующий штамм А909 типа Ia (справа). Контрольные мыши получали PBS и квасцы. Данные для альфа-штамма собирали из двух экспериментов. Значения р относятся к сравнениям на 96 час.
При активных иммунизациях чистым RibN-альфаN этот белок был в равной степени иммуногенным для мышей при введении с CFA, квасцами или PBS (Фиг.4А). Более того, активная иммунизация RibN-альфаN и квасцами защищала мышей от Rib- и альфа-экспрессирующих штаммов (Фиг.4В). Таким образом, RibN-альфаN индуцировал защитный иммунитет с адъювантом, пригодным для использования у человека.
Антитела, индуцированные RibN-альфаN, представляли собой почти исключительно антитела IgG класса (данные не показаны). Экстраполированные на людей, эти данные свидетельствуют о том, что плод может быть защищен материнскими анти-(RibN-альфаN) антителами. Это заключение подкрепляется тем, что было обнаружено, что антитела к интактным Rib и альфа переносятся через плаценту человека.
В противовес результатам, полученным с RibN-альфаN, белок Rib2R-альфа2R индуцировал антитела только у одной из четырех CFA мышей и не индуцировал антитела у мышей, которые получали антиген с квасцами или PBS (данные не показаны). Так, Rib2R-альфа2R оказался слабо иммуногенным для мышей, хотя интактные Rib и альфа вызывали хорошие иммунные ответы на повторы. Эти данные подтверждают, что RibN-альфаN представляет особый интерес как компонент вакцины.
Пример 8: Антитела к RibN-альфаN предотвращают инвазию эпителиальных клеток
На Фиг.5 показано, что антитела к RibN-альфаN предотвращают инвазию эпителиальных клеток человека. (А) Роль Rib и альфа в инвазии эпителиальных клеток. Rib-негативный мутант штамма ВМ110 (слева) и альфа-негативный мутант штамма А909 (справа) сравнивали с соответствующими бактериями дикого типа (WT) по способности заражать клетки человеческой цервикальной клеточной линии МЕ180. (В) Ингибирование инвазии эпителиальных клеток белком анти-(RibN-альфаN). Бактерии штамма ВМ110 (слева) или А909 (справа) преинкубировали с кроличьей анти-(RibN-альфаN) или с неиммунной сывороткой и после этого использовали в анализе инвазии. Все данные на диаграммах (А) и В основаны на трех разных экспериментах. Значения SD и р указаны.
В течение ночи бактериальную культуру промывали PBS, ресуспендировали в среде DME (дополненной 10 мМ Hepes и 4 мМ L-глутамина) до 1×107 CFU мл-1, и образец (500 мкл) добавляли к монослою человеческой цервикальной клеточной линии МЕ180 (АТСС НТВЗЗ), выращенному до 100%-ной конфлюентности в лунке 24-луночного планшета. Добавленные бактерии составляли от 6,7×106 CFU до 2,7×107 CFU. Планшет центрифугировали при 800×g в течение 10 минут и инкубировали в течение 1 ч при 37°С. После пяти промывок PBS в каждую лунку добавляли DME (1 мл), содержащую гентамицин (500 мкг.мл-1) и пенициллин G (5 мкг.мл-1), и инкубирование продолжали в течение 2 ч. После 3 промывок PBS клетки отщепляли с использованием трипсин-EDTA (этилендиаминтетрауксусная кислота) и подвергали лизису 0,025%-ным Triton Х-100, и внутриклеточные бактерии определяли культивированием в чашках. Чтобы проанализировать ингибирование инвазии антисывороткой, промытые бактерии (500 мкл) смешивали с антисывороткой (50 мкл) и инкубировали при комнатной температуре в течение 30 минут. Смесь добавляли к монослою МЕ180. Определяли количество CFU до и после инкубации с антисывороткой. Анализ затем выполняли как описано выше. Неиммунную кроличью сыворотку использовали в качестве контроля. Фракция бактерий, заселяющих МЕ180, в отсутствие антисыворотки составляла 0,13-0,37% от инокулята.
Исследования в модели приматов показали, что GBS инвазирует эпителиальные клетки во время инфекции. Поскольку альфа стимулирует инвазию GBS in vitro, авторы настоящего изобретения сравнили роль Rib и альфа в инвазии, используя GBS мутанты (Фиг.5А). Инвазия человеческих клеток МЕ180 снижалась в 20 раз для Rib-мутанта и в 4 раза для альфа-мутанта по сравнению с родительскими штаммами. Таким образом, Rib и альфа имеют общую способность стимулировать инвазию. Эта потенциально важная функция эффективно блокируется слитым белком анти-(RibN-альфаN) (Фиг.5В). Снижение инвазии не было следствием антитело-опосредованной бактериальной агрегации, которая не происходила в использованных условиях (данные не показаны). Этот результат свидетельствует о том, что анти-(RibN-альфаN) блокирует биологически важную функцию.
Статистический анализ
Данные тестов на защиту на мышах анализировали с использованием двухстороннего точного критерия Фишера. Анализ данных, полученных в тестах на инвазию эпителиальных клеток, был основан на стандартной нормальной аппроксимации оценок максимальной вероятности для двух независимых, распределенных по биномиальному закону переменных. Различия считались статистически значимыми при р<0,05.
В заключение, авторы настоящего изобретения продемонстрировали, что N-концевые области Rib и альфа могут быть использованы для получения вакцины на основе слитого белка, которая превосходит вакцину, получаемую из повторов. Что касается GBS вакцин для человека, полученные данные также указывают на то, что слитый белок RibN-альфаN может индуцировать защитный иммунитет против многих клинически важных штаммов, в том числе большинства штаммов, вызывающих менингит.
Несмотря на то, что в примерах подробно описано предпочтительное воплощение настоящего изобретения, специалистам в данной области очевидно, что могут иметь место модификации и адаптации настоящего изобретения. Однако следует четко понимать, что такие модификации и адаптации входят в объем настоящего изобретения, который определяется формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммунногенный слитый белок | 2016 |
|
RU2757426C2 |
| ИММУНОГЕННЫЙ ПЕПТИД ПРОТИВ СТРЕПТОКОККОВ ГРУППЫ А | 2018 |
|
RU2775621C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2636455C2 |
| СЛИТЫЙ БЕЛОК | 2016 |
|
RU2748643C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2583289C2 |
| МОДИФИЦИРОВАННЫЙ БИОТИН-СВЯЗЫВАЮЩИЙ БЕЛОК, СЛИТЫЕ БЕЛКИ НА ЕГО ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2632651C2 |
| ХИМЕРНЫЕ ГЕНЫ OSPA, БЕЛКИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2773402C2 |
| РЕКОМБИНАНТНЫЕ АТТЕНУИРОВАННЫЕ МИКРООРГАНИЗМЫ CLOSTRIDIUM И ВАКЦИНА | 2007 |
|
RU2445364C2 |
| Способ создания рекомбинантного штамма энтерококка L3-SARSN1 на основе биологически активного штамма Enterococcus faecium L3 | 2022 |
|
RU2820058C1 |
| ИММУНОГЕННЫЕ БЕЛКИ STREPTOCOCCUS | 2008 |
|
RU2518315C2 |

Настоящее изобретение относится к области микробиологии и касается слитого белка, способного индуцировать защитный иммунитет против стрептококка группы В, а также вакцины, содержащей такой белок. Описанный слитый белок содержит по меньшей мере две аминокислотные последовательности. Первая аминокислотная последовательность, имеющая 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2, слита со второй аминокислотной последовательностью, имеющей по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 4. Представленное изобретение позволяет обеспечить иммунитет против различных клинически важных штаммов стрептококков группы В (Streptococcus agalactiae). 2 н. и 7 з.п. ф-лы, 5 ил., 8 пр.
1. Слитый белок, способный индуцировать защитный иммунитет против стрептококка группы В, содержащий по меньшей мере две аминокислотные последовательности, где указанные две аминокислотные последовательности состоят из первой аминокислотной последовательности, имеющей по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2, слитой со второй аминокислотной последовательностью, имеющей по меньшей мере 90%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 4.
2. Слитый белок по п.1, где указанная первая аминокислотная последовательность имеет по меньшей мере 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2, или где указанная вторая аминокислотная последовательность имеет по меньшей мере 95, 96, 97, 98 или 99%-ную идентичность последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 4.
3. Слитый белок по п.1, который содержит аминокислотную последовательность, имеющую по меньшей мере 90%-ную идентичность с аминокислотной последовательностью, представленной в SEQ ID NO: 6.
4. Слитый белок по п.3, который содержит аминокислотную последовательность, имеющую по меньшей мере 95%-ную идентичность с аминокислотной последовательностью, представленной в SEQ ID NO: 6.
5. Слитый белок по любому из пп.1, 2, который содержит три или более аминокислотных последовательностей, выбранных из аминокислотных последовательностей, как они определены в п.1 или 2.
6. Слитый белок по п.1, модифицированный посредством гликозилирования, амидирования, карбоксилирования или фосфорилирования.
7. Вакцина, содержащая фармацевтически эффективное количество слитого белка по любому из пп.1-6, способная индуцировать защитный иммунитет против стрептококка группы В, содержащая фармацевтически приемлемый носитель.
8. Вакцина по п.7, которая дополнительно содержит адъювант.
9. Вакцина по любому из пп.7, 8, где указанный слитый белок конъюгирован с полисахаридом с образованием конъюгатной вакцины.
| RU 2005125832 А, 27.04.2006 | |||
| Устройство для откачки газированной жидкости | 1979 |
|
SU866133A1 |
| US 20050136068 A1, 23.06.2005. | |||
Авторы
Даты
2013-07-20—Публикация
2008-04-14—Подача