ПЕРЕКРЕСТНАЯ ССЫЛКА
[1] Данная заявка испрашивает приоритет предварительной заявки США, №60/955,964, поданной 15 августа 2007, которая полностью включена в настоящее описание путем ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
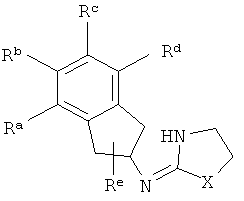
[2] Продолжает существовать потребность в соединениях, обладающих альфа-адренергической активностью, для лечения боли, глаукомы и других состояний.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
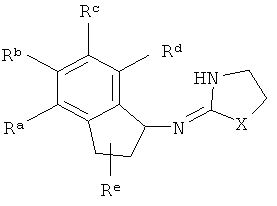
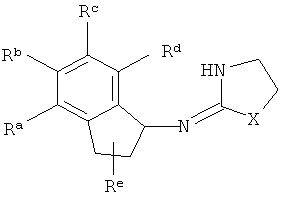
[3] В данной заявке раскрыто соединение, имеющее структуру:
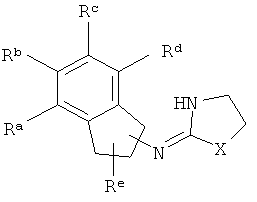
где Х представляет собой O, S или NH;
Ra, Rb, Rc и Rd представляют собой стабильные функциональные группы, независимо состоящие из: от 0 до 4 атомов углерода, от 0 до 10 атомов водорода, от 0 до 2 атомов кислорода, от 0 до 1 атома серы, от 0 до 1 атомов азота, от 0 до 3 атомов фтора, от 0 до 1 атома хлора и от 0 до 1 атома брома; и
Re представляет собой H или C1-4алкил.
[4] Данные соединения пригодны для лечения боли и глаукомы и для снижения внутриглазного давления. Соединение включают в лекарственную форму или в лекарство и вводят млекопитающему, нуждающемуся в этом. Например, жидкую композицию можно вводить в виде глазных капель для лечения глаукомы или снижения внутриглазного давления. Твердую лекарственную форму можно также вводить перорально в случае любого из этих состояний. Другие типы лекарственных форм и лекарств хорошо известны в данной области техники и также могут применяться здесь.
[5] Для целей настоящего описания термины "лечить", "лечащий" или "лечение" относятся к применению соединения, композиции, терапевтически активного агента или лекарственного средства при диагностике, излечении, облегчении, лечении, предупреждении заболевания или другого нежелательного состояния.
[6] Если не указано иное, ссылку на соединение следует истолковывать в широком смысле как включающую фармацевтически приемлемые соли, пролекарства, таутомеры, альтернативные твердые формы и нековалентные комплексы химической структурной единицы, имеющей изображенную структуру или химическое название.
[7] Фармацевтически приемлемая соль представляет собой любую соль исходного соединения, которая пригодна для введения животному или человеку. Фармацевтически приемлемая соль также относится к любой соли, которая может образоваться in vivo в результате введения кислоты, другой соли или пролекарства, которое преобразуется в кислоту или соль. Соль включает одну или более чем одну ионную форму соединения, такую как сопряженная кислота или основание, связанную с одним или более чем одним соответствующим противоионом. Соли могут образовываться из одной или более чем одной депротонированной кислотной функциональной группы (например, из карбоновых кислот), одной или более чем одной протонированной основной функциональной группы (например, из аминов), либо из обеих групп (например, цвиттерионов), либо включать эти группы.
[8] Пролекарство представляет собой соединение, которое преобразуется в терапевтически активное соединение после введения. Хотя это не предназначено для ограничения объема изобретения, такое преобразование может осуществляться посредством гидролиза эфирной функциональной группы или какой-либо другой биологически лабильной функциональной группы. Получение пролекарств хорошо известно в данной области техники. Например, в статье "Prodrugs and Drug Delivery Systems," которая представляет собой главу в книге Richard В. Silverman, Organic Chemistry of Drug Design and Drug Action, 2d Ed., Elsevier Academic Press: Amsterdam, 2004, pp.496-557, приведены дополнительные сведения по данному предмету.
[9] Таутомеры представляют собой изомеры, которые находятся в подвижном равновесии друг с другом. Например, таутомеры могут образовываться вследствие переноса протона, атома водорода или гидридного иона. Примеры таутомеров изображены ниже.
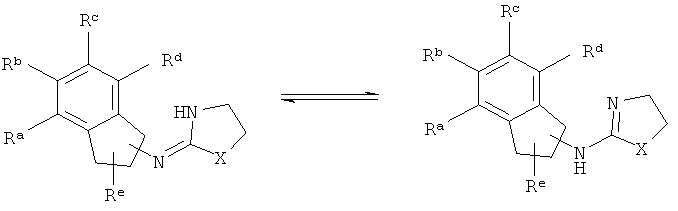
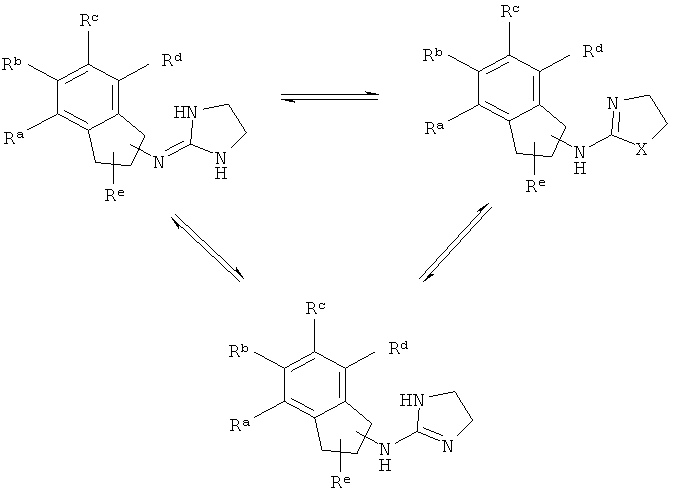
[10] Если стреохимия не обозначена исчерпывающим образом, считается, что структура включает любой возможный стереоизомер, как в чистом виде, так и в виде любой возможной смеси.
[11] Альтернативные твердые формы представляют собой твердые формы, отличные от тех, которые могут являться результатом осуществления на практике методов, описанных здесь. Например, альтернативные твердые формы могут представлять собой полиморфы, различные виды аморфных твердых форм, стекловидную фазу и тому подобное.
[12] Нековалентные комплексы представляют собой комплексы, которые могут образоваться между соединением и одним или более чем одним дополнительным химическим веществом без участия реакции ковалентного связывания между соединением и дополнительным химическим веществом. В них может иметь место или отсутствовать конкретное соотношение между соединением и дополнительным химическим веществом. Примеры могут включать сольваты, гидраты, комплексы с переносом заряда и тому подобное.
[13] X представляет собой O, S или NH. Таким образом, включены соединения, имеющие любую из структур, изображенных ниже.
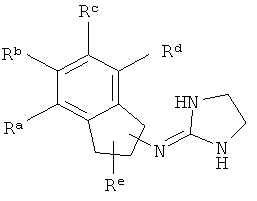
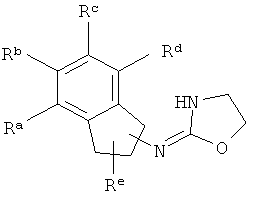
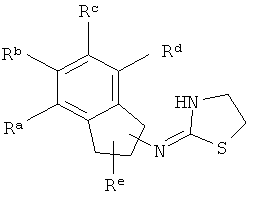
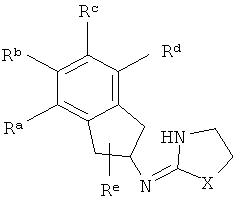
[14] Часть соединения:
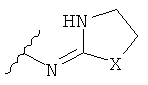
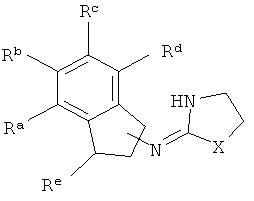
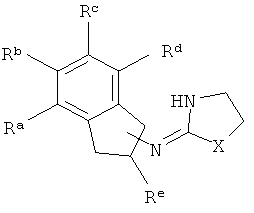
присоединена к одному из неароматических атомов углерода кольцевой системы. Иными словами, включены соединения, имеющие структуры, изображенные ниже.
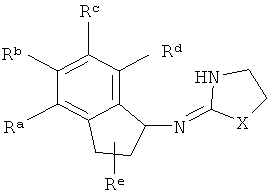
Ra, Rb, Rc и Rd представляют собой стабильные функциональные группы, независимо состоящие из: от 0 до 4 атомов углерода, от 0 до 10 атомов водорода, от 0 до 2 атомов кислорода, от 0 до 1 атома серы, от 0 до 1 атомов азота, от 0 до 3 атомов фтора, от 0 до 1 атома хлора и от 0 до 1 атома брома.
[16] С учетом ограничений, описанных здесь (например, ограничений количества атомов), примеры Ra, Rb, Rc и Rd включают, не ограничиваясь указанным:
[17] Гидрокарбил, обозначающий группу, состоящую только из атомов углерода и водорода, включающую, не ограничиваясь указанным:
а. алкил, означающий гидрокарбил, не имеющий двойных или тройных связей, включающий, не ограничиваясь указанным:
- линейный алкил алкил, например, метил, этил, н-пропил, н-бутил и т.д.,
- разветвленный алкил, например, изопропил, трет-бутил и другие разветвленные изомеры бутила и т.д.,
- циклоалкил, например, циклопропил, циклобутил и т.д.,
- комбинации линейного, разветвленного алкила и/или циклоалкила;
б. алкенил, например, гидрокарбил, имеющий одну или более чем одну двойную связь, включая линейный, разветвленный алкил или циклоалкенил,
в. алкинил, например, гидрокарбил, имеющий одну или более чем одну тройную связь, включая линейный, разветвленный алкил или циклоалкинил;
г. комбинации алкила, алкенила и/или алкинила.
[18] алкил-CN, такой как -CH2-CN, -(CH2)2-CN; -(CH2)3-CN и тому подобное;
[19] гидроксиалкил, то есть алкил-ОН, такой как гидроксиметил, гидроксиэтил и тому подобное;
[20] простые эфирные заместители, включающие -O-алкил, алкил-O-алкил и тому подобное;
[21] тиоэфирные заместители, включающие -S-алкил, алкил-S-алкил, и тому подобное;
[22] аминные заместители, включающие -NH2, -NH-алкил, -N-алкил1алкил2 (то есть алкил1 и алкил2 являются одинаковыми или разными, и оба присоединены к N), алкил-NH2, алкил-NH-алкил, алкил-N-алкил1 алкил2 и тому подобное;
[23] аминоалкил, означающий алкил-амин, такой как аминометил (-CH2-амин), аминоэтил и тому подобное;
[24] сложноэфирные заместители, включающие -CO2-алкил, -CO2-фенил и т.д.;
[25] другие карбонильные заместители, включающие альдегиды, кетоны, такие как ацил (то есть 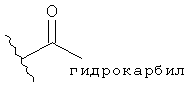 ), и тому подобное; в частности, включены заместители ацетил, пропионил и бензоил;
), и тому подобное; в частности, включены заместители ацетил, пропионил и бензоил;
[26] фторуглероды или гидрофторуглероды, такие как -CF3, -CH2CF3 и т.д.; и
[27] -CN;
[28] также возможны комбинации вышеуказанных групп с учетом определенных ограничений.
[29] В качестве альтернативы заместитель может представлять собой -F, -Cl, -Br или -I.
[30] В частности, включен алкил, имеющий от 1 до 4 атомов углерода;
[31] Ra, Rb, Rc и Rd являются стабильными, то есть они достаточно стабильны для хранения в бутылке при комнатной температуре при обычной атмосфере в течение по меньшей мере 12 часов, или достаточно стабильны, чтобы быть пригодным для любого назначения, указанного здесь.
[32] Если Ra, Rb, Rc или Rd представляет собой соль, например, карбоновой кислоты или амина, противоион указанной соли, то есть ион, который нековалентно связан с остальной частью молекулы, не учитывается при подсчете количества атомов в группе. Так, например, соль -CO2 -Na+ состоит из одного атома углерода и двух атомов кислорода, то есть атом натрия не учитывают. В другом примере соль -NH(Me)2 +Cl- состоит из двух атомов углерода, одного атома азота и семи атомов водорода, то есть атом хлора не учитывают.
[33] В другом воплощении Ra, Rb Rc и Rd независимо представляют собой -H, алкил, содержащий от 1 до 4 атомов углерода, -F, -Cl, -Br, -CH2OH, амин, содержащий от 0 до 4 атомов углерода, -CH2CN, -CF3 или ацил, содержащий от 1 до 4 атомов углерода.
[34] В другом воплощении Ra, Rb Rc и Rd независимо представляют собой -Н, -F, -Cl, -Br, -СН3, -NHCH3 или -CF3.
[35] Re представляет собой Н или С1-4 алкил, то есть метил, этил, н-пропил, изопропил и изомеры бутила. Re присоединен к одному из неароматических атомов углерода кольцевой системы. Таким образом, включены соединения, имеющие любую из структур, изображенных ниже.
[36] В еще одном воплощении X представляет собой O.
[37] В еще одном воплощении X представляет собой S.
[38] В еще одном воплощении X представляет собой NH.
[39] В еще одном воплощении Ra, Rb, Rc и Rd независимо выбраны из Н, метила, этила, C3 алкила и C4 алкила, F, Cl, Br, -CH2OH, -CH2NH2, -CHNH(C1-4алкил), -CN(C1-4алкил)2, -CH2CN и CF3.
[40] В еще одном воплощении Ra, Rb, Rc и Rd независимо выбраны из Н, метила, этила, F, Cl, Br, -CH2CN и CF3.
[41] В еще одном воплощении Re представляет собой H.
[42] В еще одном воплощении Re представляет собой метил.
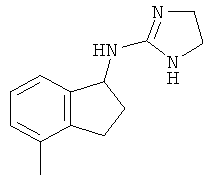
[43] В еще одном воплощении соединение имеет структуру
 .
.
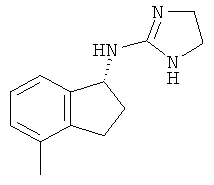
[44] В еще одном воплощении соединение имеет структуру
 .
.
[45] Еще одно воплощение представляет собой способ снижения внутриглазного давления, включающий введение соединения, раскрытого в данной заявке, млекопитающему, нуждающемуся в этом.
[46] Еще одно воплощение представляет собой способ лечения боли, включающий введение соединения, раскрытого в данной заявке, млекопитающему, нуждающемуся в этом.
[47] Другие пригодные соединения включают:
[(1R)-(4,5-Дигидро-1H-имидазол-2-ил)-(4-метилиндан-1-ил)]-амин;
[(1S)-(4,5-Дигидро-1H-имидазол-2-ил)-(4-метилиндан-1-ил)]-амин;
(4,5-Дигидро-1H-имидазол-2-ил)-(6-метилиндан-1-ил)-амин;
(4-Броминдан-1-ил)-(4,5-дигидро-1H-имидазол-2-ил)-амин;
[(1S)-(4,5-Дигидро-1H-имидазол-2-ил)-индан-1-ил]амин;
(4,5-Дигидро-1H-имидазол-2-ил)-индан-1-ил-амин;
(4,5-Дигидро-1H-имидазол-2-ил)-индан-2-ил-амин;
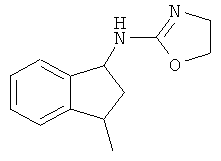
(4,5-Дигидрооксазол-2-ил)-(4-метилиндан-1-ил)-амин;
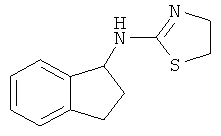
(4,5-Дигидротиазол-2-ил)-(4-метилиндан-1-ил)-амин;
(4,5-Дигидротиазол-2-ил)-(3-метилиндан-1-ил)-амин;
(4,5-Дигидрооксазол-2-ил)-(3-метилиндан-1-ил)-амин; и
(4,5-Дигидротиазол-2-ил)-индан-1-иламин.
[48] Одно воплощение представляет собой соединение, имеющее структуру, выбранную из:
 ,
,  ,
, 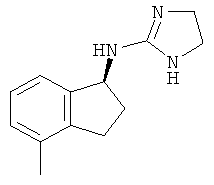 ,
, 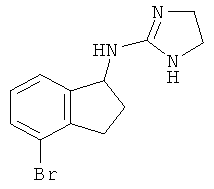 ,
, 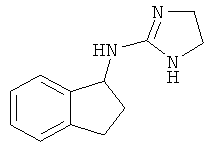 ,
, 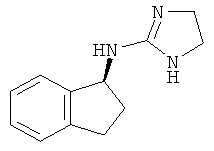 ,
, 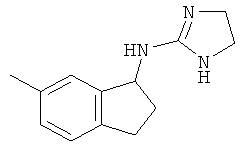 ,
, 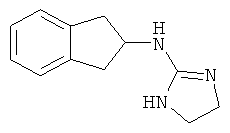 ,
, 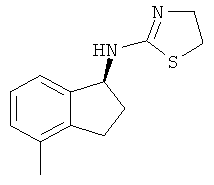 ,
, 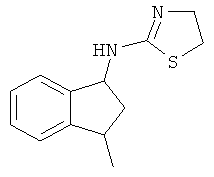 ,
, 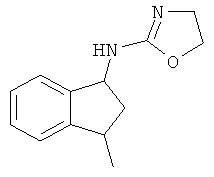 , и
, и 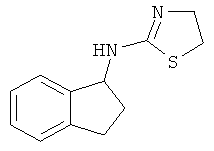 .
.
[49] Еще одно воплощение представляет собой соединение, имеющее формулу
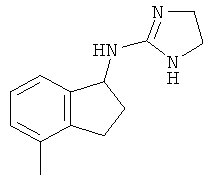 .
.
[50] Еще одно воплощение представляет собой соединение, имеющее формулу
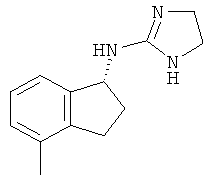 .
.
[51] Еще одно воплощение представляет собой соединение, имеющее формулу
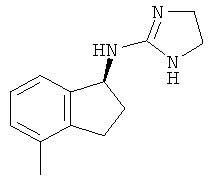 .
.
[52] Еще одно воплощение представляет собой соединение, имеющее формулу
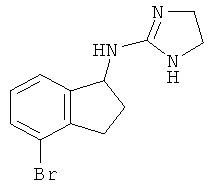 .
.
[53] Еще одно воплощение представляет собой соединение, имеющее формулу
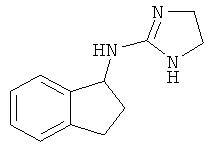 .
.
[54] Еще одно воплощение представляет собой соединение, имеющее формулу
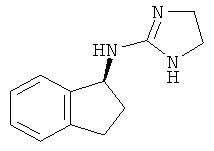 .
.
[55] Еще одно воплощение представляет собой соединение, имеющее формулу
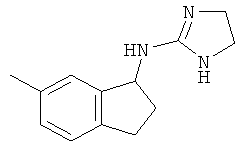 .
.
[56] Еще одно воплощение представляет собой соединение, имеющее формулу
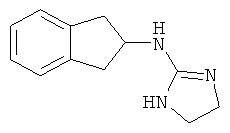 .
.
[57] Еще одно воплощение представляет собой соединение, имеющее формулу
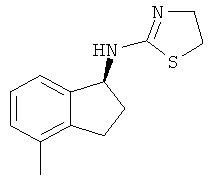 .
.
[58] Еще одно воплощение представляет собой соединение, имеющее формулу
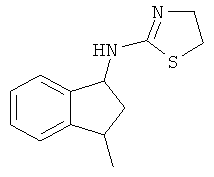 .
.
[59] Еще одно воплощение представляет собой соединение, имеющее формулу
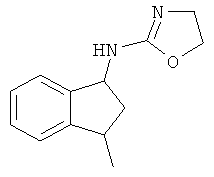 .
.
[60] Еще одно воплощение представляет собой соединение, имеющее формулу
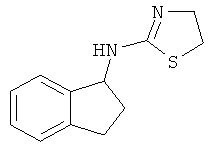 .
.
[61] Способы синтеза
[62] Реакционная схема A, B и C иллюстрирует общие способы получения аминоимидазолинов, аминооксазолинов и аминотиазолинов.
Реакционная схема A
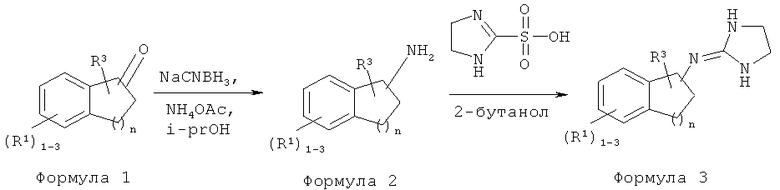
Реакционная схема B
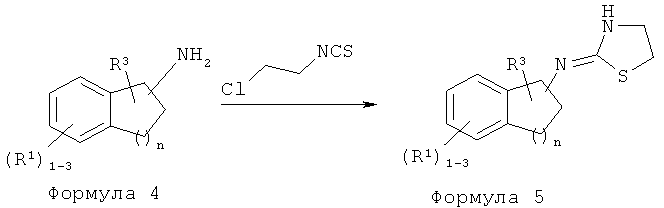
Реакционная схема C
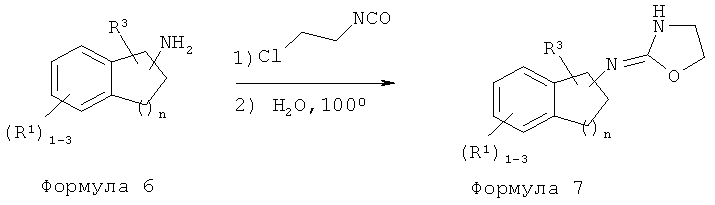
Пример A
Способ А: Методика получения (4.5-дигидро-1H-имидазол-2-ил)-(6-метилиндан-1-ил)-амина (083)
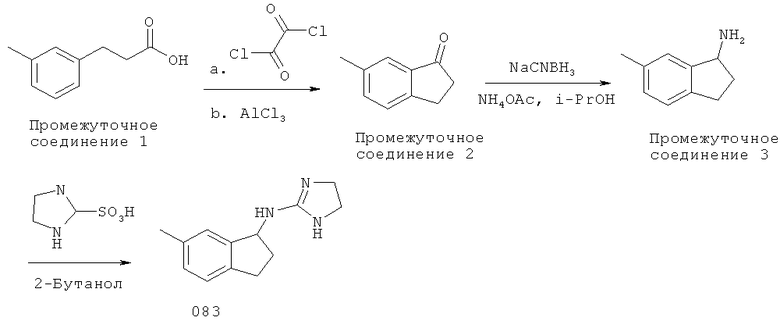
Раствор 3-мета-толуилпропионовой кислоты (Промежуточное соединение 1) (5,0 г, 29,5 ммоль) в дихлорметане обрабатывали оксалилхлоридом (4,5 г, 3,09 мл, 41,09 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали и растворяли в дихлорметане и добавляли порциями хлорид алюминия (6,28 г, 37,62 ммоль). Смесь гасили льдом. Остаток выделяли с помощью обычной водной обработки с получением 6-метилиндан-1-она (Промежуточное соединение 2), (неочищенное).
6-Метилиндан-1-он (Промежуточное соединение 2) (3,0 г, 20,0 ммоль) в изопропаноле (20 мл) обрабатывали цианоборгидридом натрия (9,01 г, 143,5 ммоль) и ацетатом аммония (47,4 г, 615 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 16 часов. Смесь охлаждали до комнатной температуры и подщелачивали гидроксидом натрия (10 мл). Остаток выделяли с помощью обычной водной обработки с получением 6-метилиндан-1-иламина (Промежуточное соединение 3).
Смесь 6-метилиндан-1-иламина (300 мг, 2,05 ммоль) (Промежуточное соединение 3) и 4,5-дигидро-1H-имидазол-2-сульфоновой кислоты (339 мг, 2,2 ммоль) в 2-бутаноле (10 мл) кипятили с обратным холодильником в течение 16 ч. Смесь выпаривали при пониженном давлении. Это вещество очищали хроматографией на силикагеле с 5% NH3-МеОН:CH2Cl2 с получением (4,5-дигидро-1H-имидазол-2-ил)-(6-метилиндан-1-ил)-амина (083) 152 мг(34%).
1HЯМР (CD3OD, 300 МГц):δ=7.32 (s, 1H), 7.24 (dd, J=4.5, 13.2 Hz, 2H), 4.76-4.37 (m, 1H), 3.80 (s, 4H), 3.15-3.16 (m, 1H), 2,65-3.10 (m, 1H), 2.64-2.93 (m, 1H), 2.12-2.05 (m, 1H), 2.39 (s, 3H).
Пример B
Способ В: Методика получения (4.5-дигидро-1H-имидазол-2-ил)-(5.7-диметил-1,2,3,4-тетрагидронафталин-1-ил)-амина (904)
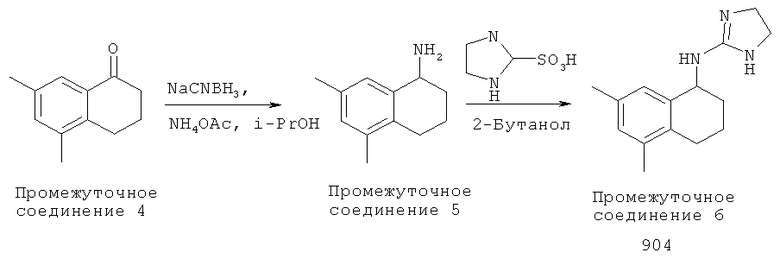
Раствор 5,7-Диметил-3,4-дигидро-2Н-нафталин-1-она (имеется в продаже, 12,3 г, 28,3 ммоль) (Промежуточное соединение 4) в изопропаноле (100 мл) обрабатывали цианоборгидридом натрия (9,01 г, 143,5 ммоль) и ацетатом аммония (47,4 г, 615 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 16 часов. Смесь подщелачивали гидроксидом натрия (10 мл). Остаток выделяли с помощью обычной водной обработки с получением (6,5 г, 37,1 ммоль) (Промежуточное соединение 5). Смесь (500 мг, 5,7 ммоль) (Промежуточное соединение 5) и 4,5-дигидро-1H-имидазол-2-сульфоновой кислоты (940 мг, 6,3 ммоль) в 2-бутаноле (30 мл) кипятили с обратным холодильником в течение 24 ч. Смесь выпаривали при пониженном давлении. Это вещество очищали хроматографией на силикагеле с 5% NH3-МеОН:CH2Cl2 с получением (90 мг, 3,7 ммоль, 36%) (4,5-дигидро-1H-имидазол-2-ил)-(5,7-диметил-1,2,3,4-тетрагидронафталин-1-ил)-амина (904).
Следуя методике, подобной таковой для 904, получили 631, 659, 629, 659,323, 522,380, 523 и 380.
Пример C
Способ C: Методика получения:
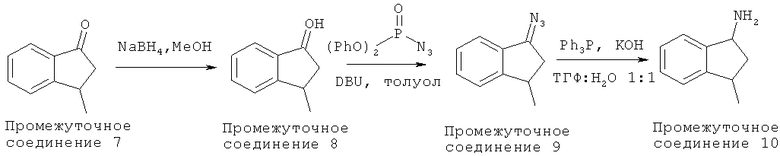
Боргидрид натрия (1,3 г, 34,36 ммоль, 1,0 экв.) добавляли к охлажденному (0°С) раствору 3-метил-2,3-дигидро-1H-инден-1-она (Промежуточное соединение 7) (5,0 г, 34,2 ммоль) в МеОН. Реакционную смесь перемешивали в течение 1 часа, после чего ее гасили насыщенным NH4Cl. Полученную в результате смесь экстрагировали Et2O (3×50 мл), и объединенные органические экстракты промывали H2O (3×50 мл), рассолом (1×50 мл), высушивали над MgSO4 и концентрировали с получением 3-метил-2,3-дигидро-1H-инден-1-ола (Промежуточное соединение 8), который очищали колоночной хроматографией, используя гексан:EtOAc (4:1) в качестве элюента.
Дифенилфосфорилазид (10,40 мл, 48,26 ммоль, 1,5 экв.) добавляли к охлажденному (0°С) раствору 3-метил-2,3-дигидро-1H-инден-1-ола (Промежуточное соединение 8) (4,77 г, 32,2 ммоль) в толуоле. Полученную в результате смесь перемешивали в течение нескольких минут и медленно добавляли 7,22 мл (1,5 экв.) DBU (диазабициклоундецен). После перемешивания реакционной смеси в течение ночи ее разбавляли толуолом и промывали H2O (3×50 мл), рассолом (1×50 мл), высушивали над MgSO4 и концентрировали с получением 1-азидо-3-метил-2,3-дигидро-1H-индена (Промежуточное соединение 9), который очищали колоночной хроматографией, используя гексан:EtOAc (4:1) в качестве элюента.
К раствору 1-азидо-3-метил-2,3-дигидро-1H-индена (Промежуточное соединение 9) (5,53 г, 32,0 ммоль) в ТГФ:H2O (1:1) добавляли трифенилфосфин (8,5 г, 1,01 экв.), а затем КОН (1,8 г, 1,0 экв.), и полученную в результате смесь перемешивали в течение ночи. Затем реакционную смесь разбавляли H2O и медленно подкисляли HCl, и водный слой промывали Et2O (3×50 мл). Затем водный слой подщелачивали NaOH (pH 14), экстрагировали Et2O (3×50 мл), и объединенные экстракты промывали H2O (1×25 мл), рассолом (1×25 мл), высушивали над K2CO3 и концентрировали с получением 3-метил-2,3-дигидро-1H-инден-1-амина (Промежуточное соединение 10) (4,47 г, выход 95%).
Пример D
Способ D: Методика получения (R)- и (8)-4,5-дигидро-1H-имидазол-2-ил)-(4-метил-индан-1-ил)]-амина (348 и 349) - оптически чистых энантиомеров:
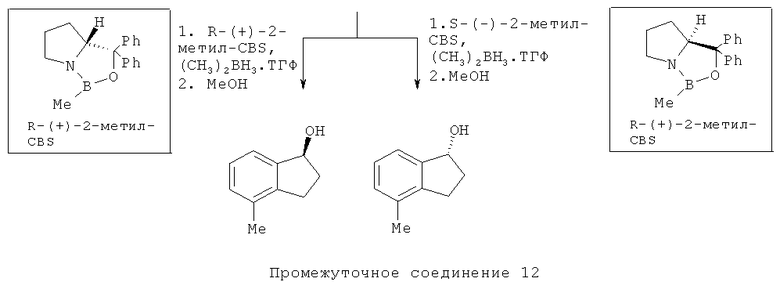
К раствору 4-метилинданона (5,0 г, 34,2 ммоль) (Промежуточное соединение 11) в безводном тетрагидрофуране (100 мл) добавляли катализатор, R-(+)-2-метил CBS (5,1 мл, 5,1 ммоль). Реакционную смесь охлаждали до -18°C и медленно добавляли BH3·SMe (4,78 мл, 23,94 ммоль) с последующим добавлением метанола (40 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 14 часов. Смесь выпаривали при пониженном давлении с получением (5,03 г) Промежуточного соединения 12.
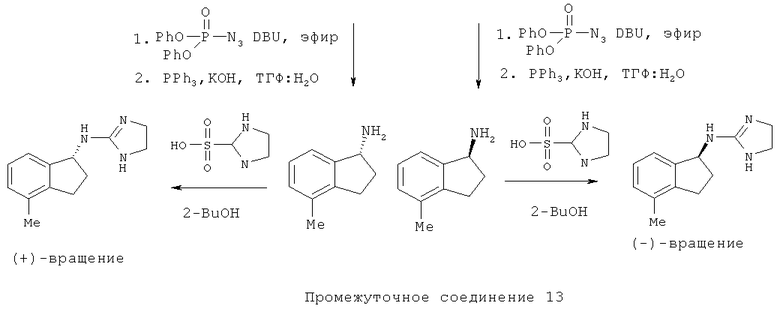
Раствор Промежуточного соединения 13 (2,0 г, 13,6 ммоль) и дифенилфосфорилазида (3,52 мл, 16,32 ммоль) в толуоле (50 мл) охлаждали до 0°С и добавляли DBU (2,44 мл, 16,32 ммоль). Реакционную смесь перемешивали в течение 7 часов. Смесь гасили водой. Остаток выделяли с помощью обычной водной обработки с получением промежуточного азида. Этот азид (1,6 г, 9,3 ммоль) растворяли в тетрагидрофуране (20 мл) и обрабатывали трифенилфосфином (2,46 г, 9,39 ммоль) с последующим добавлением гидроксида калия (526 мг, 9,39 ммоль) и воды (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Водный слой подщелачивали гидроксидом калия до pH 14 с последующей водной обработкой, и концентрировали при пониженном давлении. Продукт дополнительно очищали обработкой кислотой/основанием с получением (1,35 г) Промежуточного соединения 13.
Смесь Промежуточного соединения 13 (250 мг, 1,7 ммоль) и 4,5-дигидро-1H-имидазол-2-сульфоновой кислоты (292 мг, 1,87 ммоль) в 2-бутаноле (30 мл) кипятили с обратным холодильником в течение 24 ч. Смесь выпаривали при пониженном давлении. Это вещество очищали хроматографией на силикагеле с 5% NH3-МеОН:CH2Cl2 с получением 4,5-дигидро-1 Н-имидазол-2-ил)-(5,7-диметил-1,2,3,4-тетрагидронафталин-1 -ил)-амина (348) соответственно.
Пример E
Способ E: Методика получения (4,5-дигидрооксазол-2-ил)-(3-метил-индан-1-ил)-амина 603:
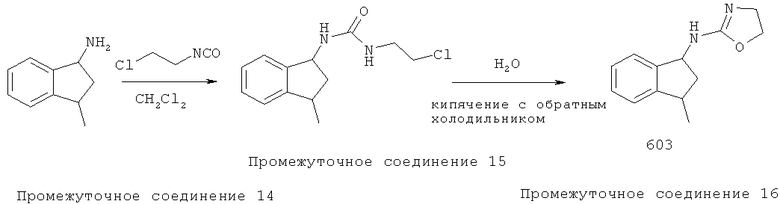
К 3-метилиндан-1-иламину (Промежуточное соединение 14) (0,44 г, 3,0 ммоль) в дихлорметане (10 мл) добавляли хлорэтилизоцианат (0,32 мл, 3,3 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 часа и гасили водой. Водный слой экстрагировали дихлорметаном (3×50). Объединенный органический слой высушивали над сульфатом магния. Смесь фильтровали. К фильтрату добавляли силикагель, и растворители удаляли в вакууме. В результате очистки хроматографией на силикагеле (от 2 до 10% метанола в дихлорметане) получили неочищенное вещество, которое перекристаллизовали в метаноле/воде с получением Промежуточного соединения 15.
Промежуточное соединение 15 кипятили с обратным холодильником в H2O (60 мл) в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь подщелачивали NaOH (pH 14) и экстрагировали в этилацетате (3×50 мл). Объединенные органические слои промывали рассолом и высушивали над сульфатом магния с получением 603.
Пример F
Способ F: Методика получения (4,5-дигидротиазол-2-ил)-(4-метилиндан-1-ил)-амина 770:
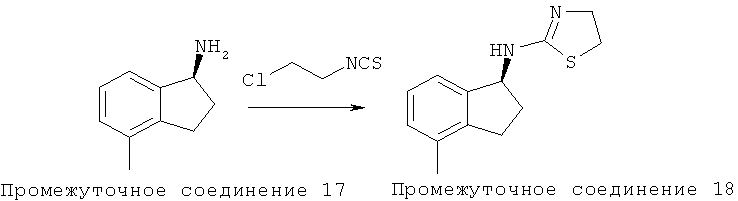
К 1-(2,3-дихлорфенил)-2-(пиридин-4-ил)этанамину (Промежуточное соединение 17) (0,44 г, 3,0 ммоль) в дихлорметане (10 мл) добавляли хлорэтилизоцианат (0,32 мл, 3,3 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 часа и гасили водой. Водный слой экстрагировали дихлорметаном (3×). Объединенный органический слой высушивали над сульфатом магния. Смесь фильтровали. К фильтрату добавляли силикагель, и растворители удаляли в вакууме. В результате очистки хроматографией на силикагеле (от 2 до 10% метанола в дихлорметане) получили неочищенное вещество, которое перекристаллизовали в метаноле/воде с получением (4,5-дигидротиазол-2-ил)-(4-метилиндан-1-ил)-амина 770 в виде твердого вещества (129 мг, 0,55 ммоль, выход 81%).
Приведенные ниже соединения синтезировалия одним из способов, описанных выше:
(4,5-Дигидро-1H-имидазол-2-ил)-(4-метилиндан-1-ил)-амин, 629:
Способ В:
1HЯМР (CD3OD, 500 МГц): δ=7.08-7.15 (m, 3H), 4.99 (t, J=7.5 Гц, 1H), 3.68 (s, 4H), 2.97-3.02 (m, 1H), 2.77-2.81 (m, 1H), 2.55-2.62 (m, 1H).
[(1R)-(4,5-Дигидро-1H-имидазол-2-ил)-(4-метилиндан-1-ил)]-амин, 348:
Способ D:
1HЯМР (CD3OD, 500 МГц): δ=7.08-7.15 (m, 3H), 4.99 (t, J=7.5 Гц, 1H), 3.68 (s, 4H), 2.97-3.02 (m, 1H), 2.77-2.81 (m, 1H), 2.55-2.62 (m, 1H).
[(1S)-(4,5-Дигидро-1H-имидазол-2-ил)-(4-метилиндан-1-ил)]-амин, 349:
Способ D:
1HЯМР (CD3OD, 500 МГц): δ=7.08-7.15 (m, 3H), 4.99 (t, J=7.5 Гц, 1H), 3.68 (s, 4H), 2.97-3.02 (m, 1H), 2.77-2.81 (m, 1H), 2.55-2.62 (m, 1H).
(4-Броминдан-1-ил)-(4,5-дигидро-1H-имидазол-2-ил)-амин, 631:
Способ В:
1HЯМР (ДМСО, 300 МГц): δ=7.6 (d, J=6 Гц, 1H), 7.20-7.40 (m, 2H), 5.05-5.20 (m, 1H), 3.65 (s, 4H), 2.70-3.05 (m, 2H), 2.50-2.60 (m, 1H), 1.6-2.0 (m, 1H).
(4,5-Дигидро-1H-имидазол-2-ил)-индан-1-ил-амин, 523:
Способ В:
1HЯМР (ДМСО, 300 МГц): δ=7.31-7.25 (m, 4 H), 5.02 (t, J=7.08 Гц, 1 Н), 3.66 (m, 4Н), 2.95-2.98 (m, 1H), 2.81-2.85 (m, 1H), 2.48-2.53 (m, 1H), 1.84-1.91 (m, 1H).
[(1S (4,5-Дигидро-1H-имидазол-2-ил)-индан-1-ил]амин, 380:
Способ B:
1HЯМР (CD3OD, 500 МГц): δ=7.22-7.40 (m, 4 H), 5.02 (t, J=7.08 Гц, 1 Н), 3.74 (s, 4Н), 2.83-3.16, (m, 1H), 2.53-2.71 (m, 2H), 1.95-1.99 (m, 1H).
(4,5-Дигидро-1H-имидазол-2-ил)-(6-метилиндан-1-ил)-амин, 083:
Способ A:
1HЯМР (CD3OD, 300 МГц): δ=7.32 (s, 1H), 7.24 (dd, J=4.5, 13.2 Гц, 2H), 4.76-4.37 (m, 1H), 3.80 (s, 4Н), 3.15-3.16 (m, 1H), 2.65-3.10 (m, 1H), 2.64-2.93 (m, 1H), 2.12-2.05 (m, 1H), 2.39 (s, 3Н).
(4,5-Дигидро-1H-имидазол-2-ил)-индан-2-иламин, 522:
Способ B:
1HЯМР (ДМСО, 300 МГц): δ=7.26-7.28 (m, 4H), 4.24-4.30 (m, 1H), 3.62 (s, 4H), 3.34 (dd, J=6 Гц, 15 Гц, 2H,), 3.20 (dd, J=9 Гц, 18 Гц, 2H).
(4,5-Дигидро-1H-имидазол-2-ил)-(1,2,3,4-тетрагидронафталин-1-ил)амин, 639:
Способ B:
1HЯМР (CD3OD, 300 МГц): δ=7.26-7.14 (m, 4H), 4.65 (t, J=6.0 Гц, 1H), 3.74 (s, 4H), 2.65-2.90 (m, 2H), 1.86-2.08 (m, 3H), 1.42-1.47 (m, 1H).
[(1S(4,5-Дигидро-1H-имидазол-2-ил)-(1,2,3,4-тетрагидронафталин-1-ил)]амин, 323:
Способ B:
1HЯМР (CD3OD, 500 МГц): δ=7.06-7.37 (m, 4H), 4.65 (t, J=5.0 Гц, 1H), 3.74 (s, 4H), 2.72-2.98 (m, 2H), 1.77-2.23 (m, 3H), 1.44-1.48 (m, 1H).
(4,5-Дигидро-1H-имидазол-2-ил)-(5,7-диметил-1,2,3,4-тетрагидронафталин-1-ил)-амин, 904:
Способ B:
1HЯМР (CD3OD, 500 МГц): δ=6.94 (d, 2H), 4.61-4.67 (m, 1H), 3.90 (s, 4H), 2.63-2.60 (m, 2H), 1.82-1.98 (m, 4H), 2.28 (s, 3H), 2.28 (s, 3H).
(4,5-Дигидрооксазол-2-ил)-(4-метилиндан-1-ил)-амин, 770:
Способ E:
1HЯМР (CD3OD, 300 МГц): δ=7.13-7.19 (m, 3H), 5.20 (t, J=10 Гц, 1H), 4.06-4.93 (m, 2H), 3.60-3.63 (m, 2H), 3.00-3.06 (m, 1H), 2.83-2.88 (m, 1H), 2.60-2.67 (m, 1H), 2.30 (s, 3H), 1.99-2.05 (m, 1H).
(4,5-Дигидротиазол-2-ил)-(4-метилиндан-1-ил)-амин, 075:
Способ F:
1HЯМР (CDCl3, 500 МГц): δ=6.97-7.19 (m, 3H), 5.50 (t, J=10 Гц, 1H), 3.30-3.41 (m, 2H), 3.19-3.22 (m, 1H), 3.02-3.07 (m, 1H), 2.68-2.74 (m, 1H), 2.81-2.84 (m, 1H), 2.19 (s, 3H), 1.85-1.88 (m, 1H).
(4,5-Дигидротиазол-2-ил)-(3-метилиндан-1-ил)-амин, 604:
Способ F:
1HЯМР (ДМСО, 500 МГц): δ=7.38 (d, J=10 Гц, 1H), 7.12-7.26 (m, 3H), 5.28 (t, J=10 Гц, 1H), 3.90-3.93 (m, 2H), 3.28-3.36 (m, 3H), 2.14-2.16 (m, 1H), 1.97-2.13 (m, 1H), 1.25(d, 3H, J=10 Гц).
(4,5-Дигидрооксазол-2-ил)-(3-метилиндан-1-ил)-амин, 603:
Способ E:
1HЯМР (ДМСО, 500 МГц): δ=7.34 (d, J=10 Гц, 1H), 7.16-7.21 (m, 3H), 5.04 (t, J=10 Гц, 1H), 4.16 (t, J=5 Гц, 1H), 3.59-3.63 (m, 3H), 3.29 (m, 1H), 2.08-2.10 (m, 1H), 1.94-1.90 (m, 1H), 1.17 (d, 3H, J=5 Гц).
(4,5-Дигидротиазол-2-ил)-индан-1-иламин, 524:
Способ F:
1HЯМР (CDCl3, 300 МГц): δ=6.89-7.34 (m, 4H), 5.21 (s, J=4.5 Гц, 1H), 4.01-4.07 (m, 2H), 3.34-3.39 (m, 2H), 2.82-2.96 (m, 2H), 2.59-2.67 (m, 1H), 1.91-1.99 (m, 1H).
(4,5-Дигидрооксазол-2-ил)-(5,6,7,8-тетрагидрохинолин-8-ил)-амин, 747:
Способ E:
1HЯМР (CDCl3, 300 МГц): δ=8.42 (d, J=6 Гц, 1H), 7.42 (d, J=6 Гц, 1H), 7.13 (dd, J=6, 9 Гц, 1H), 4.88-4.69 (m, 3H), 3.99-3.85 (m, 2H), 2.95-2.87 (m, 1H), 2.80-2.71 (m, 1H), 2.30-2.23 (m, 1H), 2.08-2.01 (m, 2H), 1.89-1.77 (m, 1H).
(4,5-Дигидрооксазол-2-ил)-(5,6,7,8-тетрагидрохиноксалин-5-ил)-амин, 772:
Способ E:
1HЯМР (CD3OD, 500 МГц): δ=8.43 (dd, J=5, 15 Гц, 2H), 4.79 (t, J=5 Гц, 1H), 4.39-4.32 (m, 2H), 3.77 (t, J=10 Гц, 2H), 3.06-2.93 (m, 3H), 2.21-2.19 (m, 1H), 2.01-1.96 (m, 2H).
[63] Биологические данные
[64] Анализ с помощью технологии отбора и амплификации рецептора (RSAT - Receptor selection and Amplification Technology)
[65] В анализе RSAT измеряют опосредованную рецептором потерю контактного ингибирования, которая приводит в результате к избирательной пролиферации клеток, содержащих рецептор, в смешанной популяции конфлюэнтных клеток. Увеличение числа клеток оценивают с помощью подходящего трансфецированного маркерного гена, такого как ген β-галактозидазы, активность которого можно легко измерить в 96-луночном формате. Рецепторы, которые активируют белок G, Gq, вызывают данный ответ. Альфа-2 рецепторы, которые в норме связываются с Gi, активируют ответ RSAT при совместной экспрессии с гибридным белком Gq, который имеет домен распознавания рецептора Gi, называемый Gq/i5.
[66] Клетки NIH-3T3 высевают при плотности 2×106 клеток в 15 см чашки и поддерживают в модифицированной Дульбекко среде Игла с добавлением 10% сыворотки теленка. Спустя одни сутки клетки котрансфецируют с помощью кальций-фосфатной преципитации экспрессионными плазмидами млекопитающих, кодирующими p-SV-β-галактозидазу (5-10 мкг), рецептор (1-2 мкг) и белок G (1-2 мкг). В трансфекционную смесь можно также включать 40 мкг ДНК спермы лосося. Свежую среду добавляют на следующие сутки, и, спустя 1-2 суток, клетки собирают и замораживают в 50 аналитических аликвотах. Клетки оттаивают, и 100 мкл добавляют к 100 мкл аликвотам различных концентраций лекарственных средств в трех повторах в 96-луночных планшетах. Инкубацию продолжают в течение 72-96 ч при 37°С. После отмывки фосфатно-солевым буферным раствором ферментативную активность β-галактозидазы определяют путем добавления 200 мкл хромогенного субстрата (состоящего из 3,5 мМ орто-нитрофенил-β-D-галактопиранозида и 0,5% Nonidet Р-40 в фосфатно-солевом буферном растворе), инкубации в течение ночи при 30°C и измерения оптической плотности при 420 нм. Поглощение является мерой ферментативной активности, которая зависит от числа клеток и отражает опосредованную рецептором клеточную пролиферацию. Эффективность собственной активности вычисляют как отношение максимального эффекта лекарственного средства к максимальному эффекту стандартного полного агониста к каждому подтипу рецептора. Бримонидин, также называемый UK14304, химическая структура которого представлена ниже, используют в качестве стандартного агониста к рецепторам альфа2A, альфа2B и альфа2C. EC50 представляет собой концентрацию, при которой эффект лекарственного средства составляет половину от его максимального эффекта.
[67]
[68] Результаты анализа RSAT с несколькими взятыми для примера соединениями по изобретению раскрыты в приведенной ниже таблице 1 вместе с химическими формулами этих примерных соединений. Значения ЕС50 приведены в наномолях. НО обозначает "не определим" при концентрациях менее чем 10 микромоль. CA означает "собственная активность".
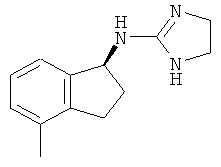
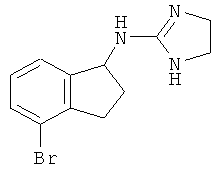
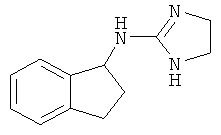
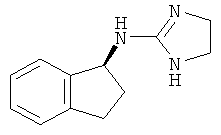
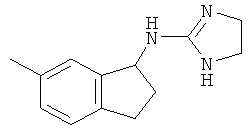
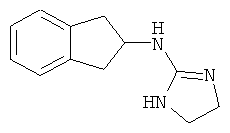
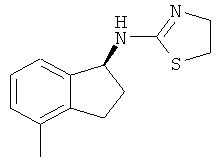
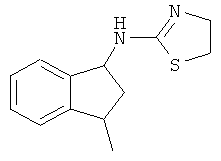
[69] Способы изготовления препаратов этих соединений хорошо известны в данной области техники. Например, в патенте США №7141597 (в частности, колонка 10, строка 27 - колонка 14, строка 47) содержится информация, которую можно использовать в качесвте общих рекомендаций. Подобная релевантная информация также доступна из различных других источников. Биологическую активность соединений, раскрытых в данной заявке (например, таблица 1), можно использовать для дополнительного общего руководства по дозировке в зависимости от конкретного применения соединения.
[70] В приведенном выше описании подробно описаны конкретные способы и композиции, которые можно применять на практике настоящего изобретения, и представлен лучший рассмотренный способ. Однако обычному специалисту в данной области техники очевидно, что другие соединения с желаемыми фармакологическими свойствами могут быть получены аналогичным способом, и что раскрытые соединения могут быть также получены из других исходных соединений посредством других химических реакций. Подобным образом, по существу с тем же результатом можно получать и применять различные фармацевтические композиции. Таким образом, хотя в тексте может встречаться подробное описание всего описанного выше, это не следует истолковывать как ограничение общего объема изобретения; поскольку объем настоящего изобретения должен определяться только правомерным истолкованием формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ДИГИДРОИМИДАЗОЛА, ЗАМЕЩЕННОГО КОНДЕНСИРОВАННЫМ КАРБОЦИКЛОМ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СНЯТИЯ БОЛИ И ЛЕЧЕНИЯ СОСТОЯНИЙ, ПОДОБНЫХ ГЛАУКОМЕ | 2008 |
|
RU2481335C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| СОЕДИНЕНИЯ ((ФЕНИЛ)ИМИДАЗОЛИЛ)МЕТИЛГЕТЕРОАРИЛА, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННЫЕ СОЕДИНЕНИЯ, И НАБОР, ВКЛЮЧАЮЩИЙ ТАКУЮ КОМПОЗИЦИЮ | 2008 |
|
RU2478631C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2648997C2 |
| СОЕДИНЕНИЯ 2,3-ДИГИДРОХИНАЗОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NaV1.8 | 2020 |
|
RU2833870C2 |
| АМИНОИНДАНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ БОЛИ | 2012 |
|
RU2612959C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| АКРИЛСОДЕРЖАЩИЕ МОДУЛЯТОРЫ ЯДЕРНОГО ТРАНСПОРТА И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2838463C2 |
| ДИФЕНИЛЬНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1997 |
|
RU2175319C2 |
Настоящее изобретение относится к способу лечения боли и способу снижения внутриглазного давления, включающим введение соединения формулы  ,
,
где X представляет собой O, S или NH; Ra, Rb, Rc и Rd независимо выбраны из Н, метила, этила, C3 алкила и С4 алкила, F, Cl, Br, -CH2OH, -CH2NH2, -CHNH(C1-4алкила), -CN(C1-4алкила)2, -CH2CN и CF3; и Rе представляет собой H или C1-4алкил. Также изобретение относится к конкретным производным индана. Технический результат: предложены новые способы использования известных соединений, а также получены новые производные индана, полезные при лечении боли и снижении внутриглазного давления. 3 н. и 13 з.п. ф-лы, 1 табл., 6 пр.
1. Способ лечения боли, включающий введение соединения нуждающемуся в этом млекопитающему, где указанное соединение имеет структуру
где X представляет собой O, S или NH;
Ra, Rb, Rc и Rd независимо выбраны из H, метила, этила, C3 алкила и C4 алкила, F, Cl, Br, -CH2OH, -CH2NH2, -CHNH(C1-4алкила), -CN(C1-4алкила)2, -CH2CN и CF3; и
Re представляет собой Н или С1-4 алкил.
2. Способ по п.1, где Х представляет собой О.
3. Способ по п.1, где Х представляет собой S.
4. Способ по п.1, где Х представляет собой NH.
5. Способ по п.1, где Ra, Rb, Rc и Rd независимо выбраны из H, метила, этила, F, Cl, Br, -CH2CN и CF3.
6. Способ по п.1, где Re представляет собой H.
7. Способ по п.1, где Re представляет собой метил.
8. Способ по п.1, где боль представляет собой аллодинию.
9. Способ снижения внутриглазного давления, включающий введение соединения нуждающемуся в этом млекопитающему, где указанное соединение имеет структуру

где X представляет собой O, S или NH;
Ra, Rb, Rc и Rd независимо выбраны из H, метила, этила, C3 алкила и C4 алкила, F, Cl, Br, -СН2ОН, -CH2NH2, -CHNH(C1-4алкила), -CN(C1-4алкила)2, -CH2CN и CF3; и
Re представляет собой H или С1-4алкил.
10. Способ по п.9, где Х представляет собой О.
11. Способ по п.9, где Х представляет собой S.
12. Способ по п.9, где Х представляет собой NH.
13. Способ по п.9, где Ra, Rb, Rc и Rd независимо выбраны из H, метила, этила, F, Cl, Br, -CH2CN и CF3.
14. Способ по п.9, где Re представляет собой H.
15. Способ по п.9, где Re представляет собой метил.
16. Соединение, имеющее структуру, выбранную из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  , и
, и 
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| 0 |
|
SU251453A1 | |
| Wong W.C | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 4256755 A, 17.03.1981 | |||
| ПРОИЗВОДНЫЕ ФЕНИЛАМИНОИМИДАЗОЛИНА ИЛИ ФЕНИЛИМИНОИМИДАЗОЛИДИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ АГОНИСТА α-АДРЕНОРЕЦЕПТОРОВ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2230061C2 |
| Способ получения производных 2-ариламино-2-имидазолина или их солей | 1975 |
|
SU548207A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(ГАЛОИД- ФЕНИЛАМИНО)-ИМИДАЗОЛИНА-2 | 0 |
|
SU333761A1 |
Авторы
Даты
2013-08-27—Публикация
2008-08-14—Подача