Перекрестные ссылки
[1] В настоящей заявке на изобретение испрашивается приоритет предварительной заявки на патент США 60/955960, поданной 15 августа 2007 года, включенной здесь путем ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[2] Существует постоянная необходимость в альфа-адренергических соединениях для лечения боли, глаукомы и других состояний.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
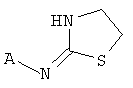
[3] Предложенное здесь соединение имеет структуру
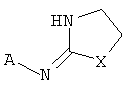
где X представляет собой О, S или NH; и
A представляет собой слитую бициклическую кольцевую систему, содержащую:
С3-5алкильную кольцевую функциональную группу, конденсированную с шестичленным гетероароматическим кольцом, имеющим в составе кольца 1 или 2 гетероатома, независимо выбранные из N, O или S;
где алкильная кольцевая функциональная группа образует связь, обозначенную в структуре как A-N, причем указанная алкильная кольцевая функциональная группа имеет 0 или 1 C1-4алкильный заместитель; и
где гетероароматическое кольцо имеет от 0 до 3 заместителей, независимо состоящих из: от 0 до 4 атомов углерода, от 0 до 10 атомов водорода, от 0 до 2 атомов кислорода, от 0 до 1 атома серы, от 0 до 1 атома азота, от 0 до 3 атомов фтора, от 0 до 1 атома хлора и от 0 до 1 атома брома.
[4] Эти соединения пригодны для лечения боли, глаукомы и снижения внутриглазного давления. Соединение включают в лекарственную форму или в лекарственное средство, и вводят млекопитающему, нуждающемуся в таком введении. Например, жидкую композицию можно вводить в виде глазных капель для лечения глаукомы или снижения внутриглазного давления. Твердую лекарственную форму также можно вводить перорально при любом из этих состояний. В данной области техники хорошо известны и другие типы лекарственных форм и лекарственных средств, и их также можно применять здесь.
[5] Для задач настоящего описания термины "лечить," "лечение" или "процесс лечения" относится к применению соединения, композиции, терапевтически активного ингредиента или лекарства при диагностике, терапии, уменьшении отрицательных последствий, лечении или профилактике заболевания или другого нежелательного состояния.
[6] Если не указано иное, то ссылку на соединение следует трактовать широко, так чтобы включить фармацевтически приемлемые соли, пролекарства, таутомеры, альтернативные твердые формы, и также нековалентные комплексы химических соединений, обладающих приведеной структурой или химическим названием.
[7] Фармацевтически приемлемая соль представляет собой любую соль исходного соединения, которая пригодна для введения животному или человеку. Фармацевтически приемлемая соль также относится к любой соли, которая может образовываться in vivo в результате введения кислоты, другой соли или пролекарства, которое превращается в кислоту или соль. Соль содержит одну или более чем одну ионную форму соединения, такую как конъюгированная кислота или основание, связанные с одним или более чем одним соответствующим противоионом. Соли могут образовываться из или включать одну или более чем одну депротонированную кислотную группу (например, карбоновые кислоты), одну или более чем одну протонированную основную группу (например, амины), или обе (например, цвиттер-ионы).
[8] Пролекарство представляет собой соединение, которое превращается в терапевтически активное соединение после введения. Хотя это не ограничивает объем изоберетния, превращение могут быть осуществлять путем гидролиза эфирной группы или какой-либо другой биологически лабильной функциональной группы. Получение пролекарства хорошо известно в данной области техники. Например "Prodrugs and Drug Delivery Systems," которое представляет собой главу в Richard В. Silverman, Organic Chemistry of Drug Design and Drug Action, 2d Ed., Elsevier Academic Press: Amsterdam, 2004, pp.496-557, представляет дополнительную подробную информацию по теме.
[9] Таутомеры представляют собой изомеры, находящиеся в динамическом равновесии друг с другом. Например, таутомеры могут образовываться при переносе протона, атома водорода или гидридного иона. Примеры таутомеров изображены ниже.

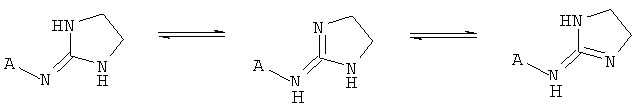
[10] Если стереохимия не обозначена точно, то предполагается, что структура включает любой возможный стереоизомер, чистый или в составе любой возможной смеси.
[11] Альтернативные твердые формы представляют собой твердые формы, отличающиеся о тех, которые могут образовываться в результате проведения процедур, описанных здесь. Например, альтернативные твердые формы могут представлять собой полиморфы, различные виды аморфных твердых форм, стекла и т.п.
[12] Нековалентные комплексы представляют собой комплексы, которые могут образовываться между соединением и одним или более чем одним дополнительным химическим веществом, в которых не возникает ковалентное взаимодействие между соединением и дополнительными химическими соединениями. Они могут иметь или не иметь конкретное соотношение между соединением и дополнительными химическими веществами. Примеры могут включать сольваты, гидраты, комплексы с переносом заряда и т.п.
[13] X представляет собой O, S или NH. Таким образом, включены соединения в соответствии с любой из структурных формул, приведенных ниже.
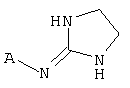
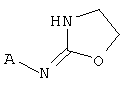
[14] А представляет собой Сз.5алкильную кольцевую функциональную группу, конденсированную с шестичленным гетероароматическим кольцом, имеющим в составе кольца 1 или 2 гетероатома, независимо выбранных из N, O или S. Таким образом, основная кольцевая структура А приведена ниже.
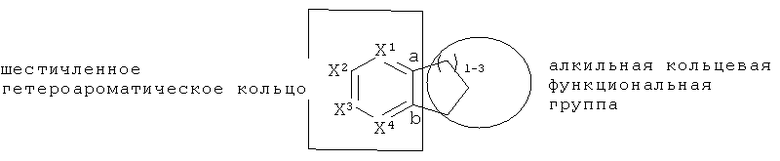
[15] Алкильная кольцевая функциональная группа изображена в круге справа. Она представляет собой часть системы, которая должна формировать циклоалкильное кольцо в случае, если оба атома, которые замыкают кольцо, т.е., углеродные атомы, обозначенные "a" и "b," представляют собой -СН2-. Незамещенная алкильная кольцевая функциональная группа состоит из -(СН2)n-, где n равно от 3 до 5. Шестичленное гетероароматическое кольцо изображено в прямоугольнике слева, где один или два из числа X1, X2, X3 и X4 независимо представляют собой S, N или O, а оставшиеся представляют собой СН или C-Y, где Y представляет собой описанный здесь заместитель.
[16] Примеры пригодных гетероароматических колец включают замещенный или незамещенный пиридин, пиразин, пиримидин и т.п.
[17] Алкильная кольцевая функциональная группа образует связь, изображенную в общей структуре как A-N. Другими словами, образующий мостиковую связь азот прикрепляется непосредственно к одному из неароматических углеродов алкильной кольцевой функциональной группы.
[18] Другими словами, включены структуры, изображенные ниже.
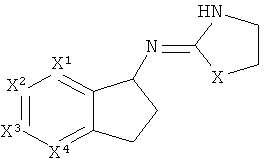
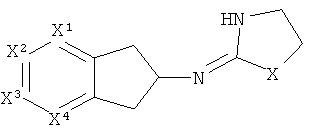
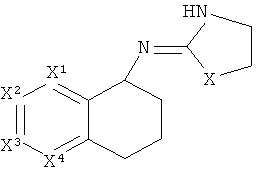
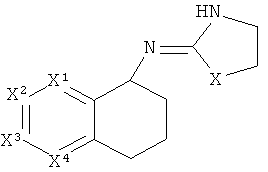
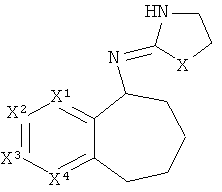
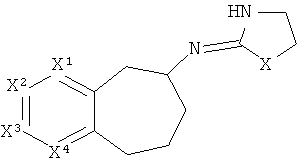
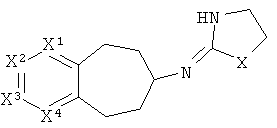
[19] Алкильная кольцевая функциональная группа может быть незамещенной, но также она может иметь 1 C1-4 алкильный заместитель.
[20] Заместители на гетероароматическом кольце представляют собой стабильные функциональные группы, независимо содержащие от 0 до 4 атомов углерода, от 0 до 10 атомов водорода, от 0 до 2 атомов кислорода, от 0 до 1 атома серы, от 0 до 1 атома азота, от 0 до 3 атомов фтора, от 0 до 1 атома хлора, и от 0 до 1 атома брома.
[21] В соответствии с описанными здесь ограничениями (например, ограничениями количества атомов) примеры этих заместителей включают:
[22] Гидрокарбил, обозначающий функциональную группу, состоящую только из углерода и водорода, включая, но не ограничиваясь указанным:
а. алкил, обозначающий гидрокарбил, не имеющий двойных или тройных связей, включая:
- линейный алкил, например, метил, этил, н-пропил, н-бутил и т.д.,
- разветвленный алкил, например, изопропил, трет-бутил и другие разветвленные изомеры бутила, и т.д.,
- циклоалкил, например, циклопропил, циклобутил и т.д.,
- комбинации линейного алкила, разветвленного алкила и/или циклоалкила;
б. алкенил, например, гидрокарбил, имеющий одну или более чем одну двойную связь, включая линейный алкенил, разветвленный алкенил или циклоалкенил,
в. алкинил, например гидрокарбил, имеющий одну или более чем одну тройную связь, включая линейный алкинил, разветвленный алкинил или циклоалкинил;
г. комбинации алкила, алкенила и/или алкинила
[23] алкил-CN, такой как -CH2-CN, -(CH2)2-CN; -(CH2)3-CN, и т.п;
[24] гидроксиалкил, т.е. алкил-OH, такой как гидроксиметил, гидроксиэтил и т.п.;
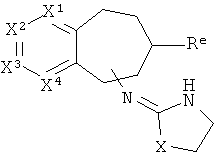
[25] заместители - простые эфиры, включая -O-алкил, алкил-O-алкил и т.п.;
[26] тиоэфирные заместители, включая -S-алкил, алкил-S-алкил и т.п.;
[27] аминные заместители, включающие -NH2, -NH-алкил-N-алкил1алкил2 (т.е. алкил1 и алкил2 являются одинаковыми или разными, и оба связаны с азотом), алкил-NH2, алкил-NH-алкил, алкил-N-алкил1алкил2 и т.п.;
[28] аминоалкил, обозначающий алкиламин, такой как аминометил (-СН2-амин), аминоэтил и т.п.;
[29] заместители - сложные эфиры, включая -CO2-алкил, -CO2-фенил и т.д.;
[30] другие карбонильные заместители, включая альдегиды, кетоны, такие как ацил (т.е. 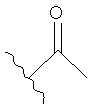 ) и т.п.; в частности, включены ацетиловые, пропиониловые и бензольные заместители;
) и т.п.; в частности, включены ацетиловые, пропиониловые и бензольные заместители;
[31] фторуглероды или гидрофторуглероды, такие как -CF3; CH2CF3, и т.д.; и
[32] -CN;
[33] также возможны комбинации вышеописанных соединений, с учетом обозначенных ограничений;
[34] альтернативно, заместитель может представлять собой -F, -Cl, -Br, или -I.
[35] В частности включен алкил, имеющий от 1 до 4 атомов углерода;
[36] Заместители на гетероароматическом кольце являются стабильными, т.е. они должны быть достаточно стабильными для того, чтобы их можно было хранить во флаконе при комнатной температуре в условиях нормальной атмосферы в течение, по меньшей мере, 12 часов, или достаточно стабильными для того, чтобы их можно было применять по любому из раскрытых здесь назначений.
[37] Если заместитель представляет собой соль, например, карбоновой кислоты или амина, то противоион указанной соли, т.е. ион, который нековалентно связан с остатком молекулы, не учитывается при подсчете количнества атомов функциональной группы. Таким образом, например соль -CC2 -Na+ состоит из одного атома углерода и двух атомов кислорода, т.е. натрий не учитывается. В другом примере, соль -NH(Me)2 +Cl- состоит из двух атомов углерода, одного атома азота и семи атомов водорода, т.е. хлор не учитывается.
[38] В другом воплощении заместители независимо представляют собой -H, алкил, содержащий от 1 до 4 атомов углерода, -F, -Cl, -Br, -СН2ОН, амин, содержащий от 0 до 4 атомов углерода, -CH2CN, -CF3, или ацил, содержащий от 1 до 4 атомов углерода.
[39] В другом воплощении заместители независимо представляют собой -H, -F, -Cl, -Br, -СН3, -NHCH3 или -CF3.
[40] Заместитель алкильной кольцевой функциональной группы представляет собой H или С1-4алкил, т.е. метил, этил, н-пропил, изопропил, а также изомеры бутила. Таким образом, включены соединения, имеющие любую из структур, изображенных ниже, где заместитель алкильного кольца изображен как Re.
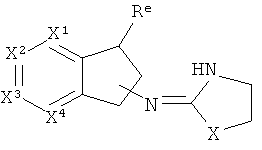
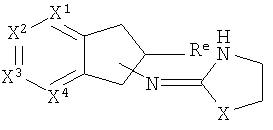
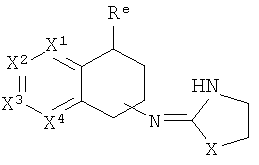
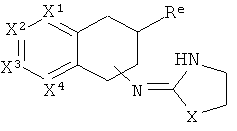
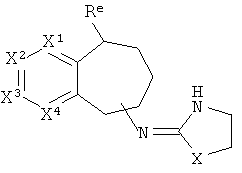
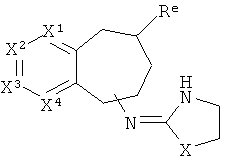
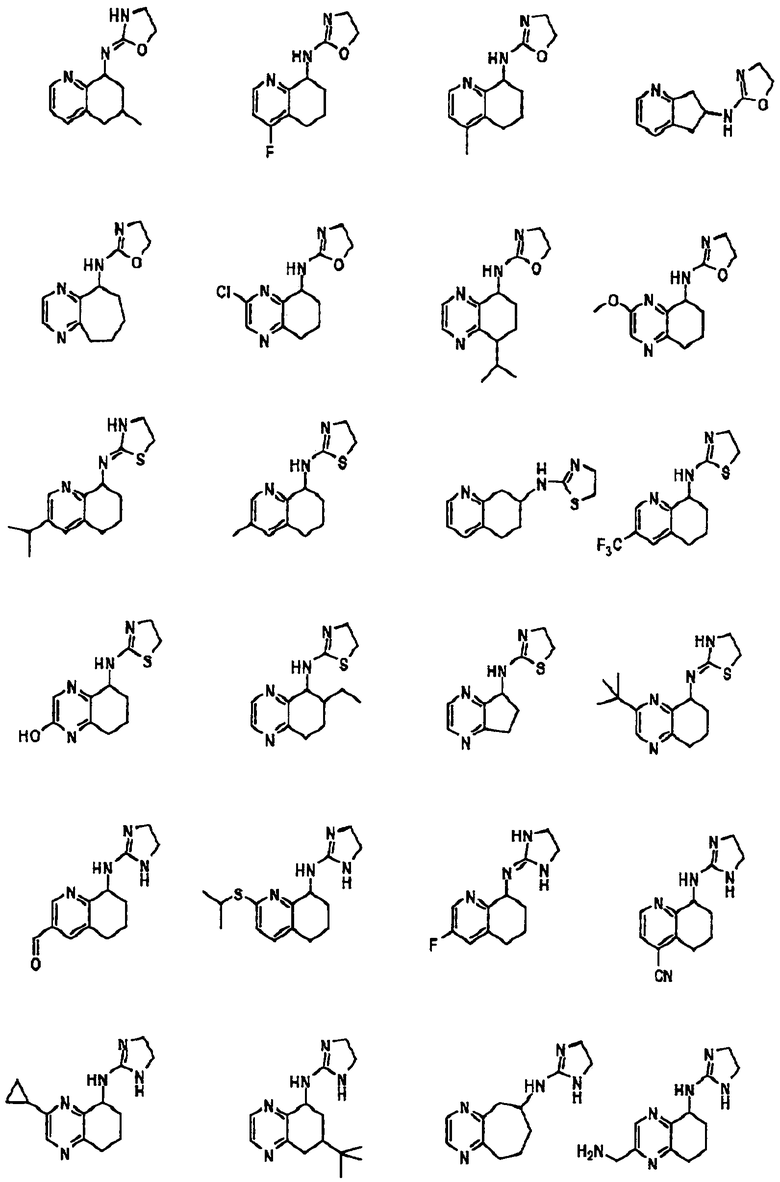
[41] Некоторые гипотетические примеры применяемых соединений
изображены ниже.
Способы синтеза
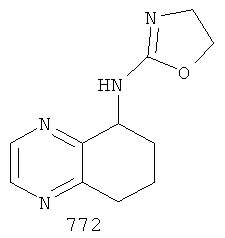
[42] Способ получения (4,5-дигидро-оксазол-2-ил)-5,6,7,8-тетрагидрохиноксилан-5-ил)-амина, 772:
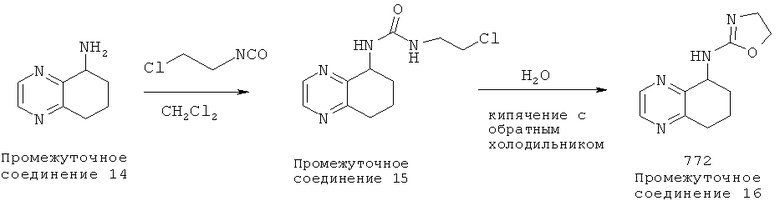
[43] К 5,6,7,8-тетрагидрохиноксалин-5-амину (Промежуточное соединение 14) (3,0 ммоль) в дихлорметане (10 мл) добавляли хлорэтилизоцианат (3,3 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 часов. Растворители удаляли в условиях вакуума с получением неочищенного вещества, промежуточного соединения 15.
[44] Промежуточное соединение 15 кипятили с обратным холодильником в Н2О (60 мл) в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь подщелачивали с помощью NaOH (рН 14), экстрагированном в этилацетате (3×50 мл). Объединенные органические слои промывали рассолом и сушили над сульфатом магния, чтобы получить 772.
1Н NMR (ядерный магнитный резонанс) (CDCl3, 300 Мгц): δ=8.42 (d, J=6 Гц, 1Н), 7.42 (d, J=6 Гц, 1Н), 7.13 (dd, J=6, 9 Гц, 1Н), 4.88-4.69 (m, 3H), 3.99-3.85 (m, 2Н), 2.95-2.87 (т, 1Н), 2.80-2.71 (m, 1Н), 2.30-2.23 (m, 1Н), 2.08-2.01 (m, 2Н), 1.89-1.77 (m, 1Н).
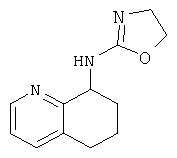
[45] Способ получения (4,5-дигидрооксазол-2-илИ5.6.7.8-тетрагидрохинолин-8-ил)-амина. 747:
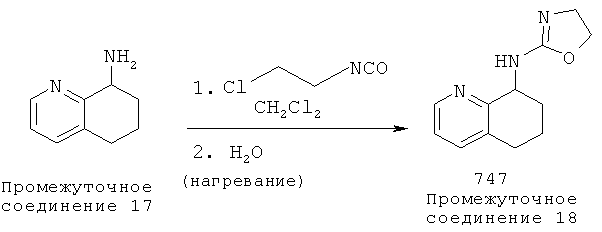
[46] К 5,6,7,8-тетрагидрохинолин-8-амину (Промежуточное соединение 17) (3,0 ммоль) в дихлорметане (10 мл) добавляли хлорэтилизоцианат (3,3 ммоль). Раствор перемешивали при комнатной температуре в течение 1,5 часов. Растворитель удаляли в условиях вакуума для получения сырьевого материала, который кипятили с обратным холодильником в H2O (60 мл) в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь подщелачивали с помощью NaOH (рН 14), экстрагировали в этилацетате (3×50 мл). Объединенные органические слои промывали рассолом и сушили над сульфатом магния с получением 747. (4,5-Дигидрооксазол-2-ил)-(5,6,7,8-тетрагидрохинолин-8-ил)-амин, 747 в виде твердого вещества.
1Н NMR (CDCl3, 300 МГц): δ=6.89-7.34 (m, 4Н), 5.21 (s, J=4.5 Гц, 1Н), 4.01-4.07 (m, 2Н), 3.34-3.39 (m, 2Н), 2.82-2.96 (m, 2Н), 2.59-2.67 (m, 1Н), 1.91-1.99 (m, 1Н).
Синтез аминов 14 и 17.
[47] Способ получения 5,6,7,8-тетрагидрохиноксалин-5-амина, 14:
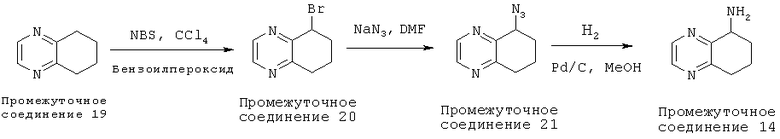
К раствору 5,6,7,8-тетрагидрохиноксалина (Промежуточного соединения 19) (3,08 г, 23,0 ммоль, имеющегося в продаже) в CCl4 (200 мл) добавляли N-бромсукцинимид (4,09 г, 23,0 ммоль) и каталитическое количество (56 мг) перекисибензоила. Реакционную смесь нагревали с обратным холодильником в течение 17 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит, и концентрировали в вакууме с получением 5-бром-5,6,7,8-тетрагидрохиноксалина (Промежуточное соединение 20) (3,8 г, неочищенного).
5-бром-5,6,7,8-тетрагидрохиноксалин (Промежуточное соединение 20) (3,8 г, 17,92 ммоль) и азид натрия (2,3 г, 35,8 ммоль) растворяли в диметилформамиде (DMF) (50 мл) в атмосфере азота, и реакционную смесь нагревали до 60°C в течение 20 часов. Смесь охлаждали до комнатной температуры, заливали водой (200 мл), и экстрагировали CH2Cl2 (3×100 мл). Органические экстракты промывали солевым раствором (2×100 мл), сушили и концентрировали в вакууме. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием 1:1 EtOAc/гексана с получением 5-азид-5,6,7,8-тетрагидрохиноксалина (Промежуточное соединение 21) (3,2 г, 84%).
Смесь 5-азид-5,6,7,8-тетрагидрохиноксалина, (Промежуточное соединение 21) (3,2 г, 15,09 ммоль) в МеОН (40 мл) обрабатывали 10% Pd/C (300 мг) в атмосфере Н2 (баллон) в течение 16 ч при комнатной температуре. Смесь фильтровали через целит и освобождали от растворителя при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле 10% MeOH:CH2Cl2 с получением 5,6,7,8-тетрагидрохиноксалин-5-амина (Промежуточное соединение 21) (1,3 г). 1Н NMR (CD3OD, 500 МГц): δ=8.48 (s, 1H), 8.38 (s, 1H), 4.06 (dd, J=5.5, 9 Гц, 1H), 3.02-2.97, (m, 2H), 2.30-2.24 (т, 1H), 2.15-2.08 (m, 1 Н), 1.96-1.73 (m, 1Н).
[48] Способ получения 5,6,7,8-тетрагидрохинолин-5-амина, 17:
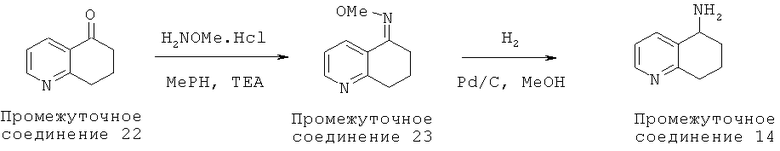
К раствору 7,8-дигидрохинолин-5(6Н)-она (Промежуточного соединения 22) (1,06 г, 7,2 ммоль, имеющегося в продаже) в МеОН (20 мл) добавляли метоксиламин (1,2 г, 14,4 ммоль) с последующим добавлением триэтиламина (2 мл, 14,4 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали в условиях вакуума. Затем остаток разводили в CH2Cl2 и гасили водой (100 мл), и экстрагировали CH2Cl2 (3×100 мл). Органические экстракты высушивали и концентрировали в условиях вакуума. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием MeOH:CH2Cl2 с получением (Z/E)-7,8-дигидрохинолин-5(6Н)-он О-метила оксима, (Промежуточное соединение 23) (1,14 г, 90%).
К смеси (Z/E)-7,8-дигидрохинолин-5(6Н)-она О-метила оксима (Промежуточное соединение 23) (1,14 г, 6,47 ммоль) в TFA (трифторуксусной кислоте) (20 мл) добавляли 10% платину на углероде (10 масс.% Pd/C; 0,15 г) в условиях атмосферы аргона в колбе Парра для шейкера. Смесь гидрировали при 50 футов/кв. дюйм в течение 16 часов. Реакционную смесь промывали азотом и фильтровали через слой Celite® и концентрировали в условиях вакуума. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии на силикагеле с использованием NH3-MeOH:CH2Cl2 с получением 5,6,7,8-тетрагидрохинолин-5-амина (Промежуточного соединения 22), (0,74 г, 78%). 1Н NMR (CD3OD, 300 МГц): δ=8.41 (d, J=4.5 Гц, 1H), 7.43 (d, J=8.1 Гц, 1H), 7.15-7.11 (m, 1H), 4.18 (m, 1Н), 2.85-2.80, (m, 2H), 2.35-2.29 (m, 1H), 2.05-2.01 (m, 1H), 1.99-1.77 (m, 2H).
Биологические данные
[49] Анализ на основе выбора рецептора и амиплификации (RSAT)
[50] С помощью теста RSAT измеряют опосредованную рецептором утрату контактного ингибирования, что приводит к выборочной пролиферации клеток, содержащих рецепторы, в смешанной популяции конфлюэнтных клеток. Повышение числа клеток оценивают с помощью подходящего трансфицированного маркерного гена, такого как p-галактозидаза, активность которого можно легко измерить в 96-луночном планшете. Рецепторы, активирующие G белок, Gq, проявляют этот ответ. Альфа-2 рецепторы, которые в норме сливаются с Gi, активируют RSAT ответ при совместной экспрессии с гибридным Gq белком, который имеет домен распознавания Gi рецептора, названный Gq/i5.
[51] NIH-3T3 клетки высевают при плотности 2×106 клеток в 15 см чашках и поддерживают на модифицированной Дульбекко среде Игла, обогащенной 10% коровьей сывороткой. Через одни сутки клетки трансфицируют с помощью осаждения фосфатом кальция экспрессионными плазмидами млекопитающих, кодирующими p-SV-β-галактозидазу (5-10 мкг), рецептор (1-2 мкг) и G белок (1-2 мкг). В смесь для трансфекции также можно включить 40 мкг ДНК спермы лосося. На следующий день добавляют свежую среду и через 1-2 суток клетки собирают и замораживают аликвотами для 50 тестов. Клетки размораживают, и к 100 мкл аликвоты добавляют 100 мкл лекарства в разных концентрациях в трех параллелях в 96-луночных планшетах. Инкубацию осуществляют в течение 72-96 ч при 37°C. После промывания забуференным фосфатом физиологическим раствором активность фермента β-галактозидазы определяли с помощью добавления 200 мкл хромогенного субстрата (состоящего из 3,5 мМ o-нитрофенил-β-D-галактопиранозида и 0,5% Нонидета P-40 в забуференном фосфатом физиологическом растворе), инкубации в течение ночи при 30°C и измерения оптической плотности при 420 нм. Абсорбция представляла собой меру ферментативной активности, которая зависит от числа клеток и влияет на пролиферацию клеток, опосредованную рецепторами. Эффективность или внутреннюю активность рассчитывали как соотношение максимального эффекта лекарства к максимальному эффекту стандартного полного агониста для каждого подтипа рецепторов. Бримонидин, также называемый UK14304, химическая структура которого показана ниже, применяют в качестве стандартного агониста для альфа2А, альфа2B и альфа2C рецепторов. ЕС50 (средняя эффективная концентрация) представляет собой концентрацию, при которой эффективность лекарства составляет половину от его максимальной эффективности.
[52]
[53] Результаты теста RSAT с несколькими типичными соединениями по изобретению представлены в вышеупомянутой таблице 1 вместе с химическими формулами этих типичных соединений. Значения ЕС50 являются наномолярными.: Н.о. обозначает "не определимый" при концентрациях менее 10 микромолей. IA обозначает "внутреннюю активность."
[54] Способы получения этих соединений хорошо известны в данной области техники. Например патент США No. 7141597 (в частности, с абзаца 10, строка 27 до абзаца 14, строка 47) содержит информацию, которую можно применять в качестве основного руководства. Подобная информация также доступна во множестве других источников. Для получения дополнительного общего руководства по дозировке в зависимости от конкретного применения соединения можно использовать биологическую активность соединений, прведенную здесь (например, в таблице 1).
[55] Предшествующее описание подробно описывает конкретные способы и композиции, которые можно применять, осуществляя настоящее изобретение, и описывает наилучший вариант. Однако, для специалиста в данной области техники очевидно, что другие соединения, обладающие желаемыми фармакологическими свойствами, можно получать аналогичным способом, и что предложенные соединения также можно получать из различных исходных соединений путем различных химических реакций.
Аналогично, по существу с тем же самым результатом можно получать и применять различные фармакологические композиции. Таким образом, сколь детальное описание ни содержалось бы в тексте, его не следует рассматривать как ограничивающее объем изобретения; поскольку объем настоящего изобретения ограничен лишь формулой изобретения.
Изобретение относится к соединениям, представляющим собой (4,5-дигидрооксазол-2-ил)-(5,6,7,8-тетрагидрохиноксилан-5-ил)-амино и (4,5-дигидрооксазол-2-ил(-(5,6,7,8-тетрагидрохинолин-5-ил)-амино, или их фармацевтически приемлемой соли. Указанные соединения используют в способах снижения внутриглазного давления и лечения боли у нуждающегося в этом млекопитающего. Технический результат - соединения, являющиеся альфа-адренергическими агонистами. 3 н.п. ф-лы, 1 табл.
 и
и 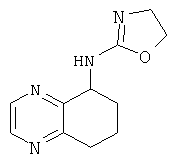
1. Соединение, имеющее структуру, выбранную из
 и
и  , или его фармацевтически приемлемая соль.
, или его фармацевтически приемлемая соль.
2. Способ снижения внутриглазного давления, включающий введение соединения по п.1 нуждающемуся в этом млекопитающему.
3. Способ лечения боли, включающий введение соединения по п.1 нуждающемуся в этом млекопитающему.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| 0 |
|
SU251453A1 | |
| 0 |
|
RU2232154C | |
| Wai C | |||
| Wong et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Bioorganic & Medicinal Chemistry Letters, 1994, v.14, №19, p.2317-2322. | |||
Авторы
Даты
2013-08-27—Публикация
2008-08-14—Подача