Область техники настоящего изобретения
Изобретение относится к области клеточной биологии, молекулярной биологии и биотехнологии, в частности, к получению линии генно-модифицированных клеток хомяка, используемых для получения рекомбинантного биологически активного фактора роста эндотелия сосудов (VEGF) человека, изоформа А165.
Предшествующий уровень техники настоящего изобретения
В настоящее время известно, что одним таким ключевым регулятором ангиогенеза является фактор роста эндотелия сосудов (VEGF, также называемый VEGF-A), и роль семейства генов VEGF в регуляции ангиогенеза интенсивно исследуется уже на протяжении более десятилетия [1]. Семейство VEGF включает в себя прототипный член VEGF-A, плацентарный фактор роста (P1GF) [2], VEGF-B [3], VEGF-C [4] и VEGF-D [5]. Убедительные доказательства свидетельствуют, что тогда как построение и созревание сосудистой стенки представляют собой весьма сложные процессы, требующие согласованных воздействий ангиопоэтинов, тромбоцитарного фактора роста В (PDGF-B) и других факторов [6], действие VEGF-A представляет собой лимитирующую стадию нормального и патологического роста кровеносных сосудов [7]. Важным представляется то, что VEGF-C и VEGF-D регулируют ангиогенез лимфатических сосудов [8]. Это подчеркивает уникальную роль этого семейства генов в контроле роста и дифференцировки некоторых анатомических компонентов сосудистой системы.
В 1983 году Senger et al. сообщили о частичном выделении из кондиционной среды опухолевой клеточной линией морской свинки "фактора проницаемости сосудов" (VPF), белка, который индуцировал увеличение проницаемости сосудов кожи [9]. Однако, поскольку VPF не был выделен и секвенирован, на тот момент молекулярная структура фактора осталась неизвестной. В 1989 году появилось сообщение о выделении из кондиционной среды фолликулярных клеток гипофиза коровы "фактора роста эндотелия сосудов" (VEGF), специфичного в отношении эндотелиоцитов митогена [10]. N-концевая аминокислотная последовательность VEGF не совпадала ни с одной последовательностью известных белков, депонированных на тот момент в доступные базы данных [10]. Затем работа Connolly et al., выполненная на основе работы Senger et al., независимо привела к выделению и секвенированию VPF [11]. Клонирование кДНК VEGF [12] и VPF [13] показало, что VEGF и VPF представляют собой одну и ту же молекулу. Этот результат был неожидан, учитывая, что другие митогены эндотелиоцитов, такие как FGF, не усиливают проницаемость сосудов.
VEGF характеризуется значительной гомологией с цепями А и В PDGF [12]. Ген, кодирующий VEGF-A человека, состоит из восьми экзонов, разделенных семью интронами [14,15]. Альтернативный сплайсинг экзонов приводит к образованию четырех основных изоформ - VEGF-A121, VEGF-A165, VEGF-A189 и VEGF-A206, состоящих после отщепления сигнальной последовательности соответственно из 121, 165, 189 и 206 аминокислот [12]. Альтернативный сплайсинг регулирует биологическую доступность VEGF [16,17]. К настоящему времени скопилась масса доказательств того, что VEGF-A165 является наиболее физиологически компетентной изоформой [18,19]. Также в регуляции биологической доступности VEGF важную роль играет внеклеточный протеолиз. Плазмин способен расщеплять VEGF-A165 и VEGF-A189 и высвобождать биологически активный продукт, состоящий из первых 110 аминоконцевых аминокислот [20]. Учитывая важность активации плазминогена в ходе физиологического и патологического ангиогенеза [21], этот механизм может иметь особое значение для регуляции активности и биологической доступности VEGF при развитии ремоделирования и в ответ на сигналы микроокружения. Кроме того, в некоторых опухолях протеолиз VEGF, опосредованный мактриксной металлопротеиназой-9 (ММР9), может быть ответственным за запуск ангиогенеза [22].
Достоверно установленным действием VEGF является ускорение роста эндотелиоцитов артерий, вен и лимфатических сосудов (обзор приведен в ссылке [23]). VEGF индуцирует мощный ангиогенный ответ во множестве моделей in vivo [12, 24]. Кроме того, как указано выше, VEGF увеличивает проницаемость сосудов, и это свойство лежит в основе важной роли молекулы в воспалении и других патологических процессах [25]. В данном контексте VEGF также индуцирует экспрессию эндотелием некоторых молекул адгезии, регулирующих адгезию лейкоцитов при воспалении [26].
In vitro VEGF предотвращает апоптоз эндотелиоцитов, индуцируемый истощением сыворотки, что опосредуется каскадом фосфатидилинозитол-3-киназы (PI3K)/Akt [27]. VEGF также индуцирует экспрессию в эндотелиоцитах антиапоптотических белков BCL2 и Al [28]. Зависимость от VEGF была показана на эндотелиоцитах вновь образованных, но не до конца сформировавшихся сосудов опухолей [29,30]. Образование выстилки перицитами, предположительно, является одним из ключевых событий, приводящих к утрате эндотелиоцитами зависимости от VEGF [30].
Следует подчеркнуть, что хотя эндотелиоциты являются главными мишенями VEGF, в ходе нескольких исследований были показаны также его эффекты на митотическую активность/выживаемость некоторых неэндотелиальных клеточных типов, включая нейроны [31].
VEGF принципиально важен для нормального эмбрионального васкулогенеза и ангиогенеза. Инактивация аллеля VEGF у мышей приводит к эмбриональной смертности [32, 33]. Ингибирование VEGF в раннем неонатальном периоде приводит к остановке роста, апоптозу эндотелиоцитов и летальному исходу главным образом в результате почечной недостаточности [34, 35]. VEGF также необходим для внутрихрящевого окостенения, фундаментального механизма роста трубчатых костей. Ингибиторы VEGF подавляют эти процессы у грызунов и приматов [36, 37]. Важно заметить, что этот эффект полностью обратим при прекращении анти-VEGF обработки [36, 37]. Ангиогенез является ключевым аспектом нормального овариально-менструального цикла и функционирования эндометрия [38]. Экспрессия мРНК VEGF связана во времени и пространстве с пролиферацией кровеносных сосудов в яичниках различных видов [39,40]. Введение ингибиторов VEGF замедляет развитие фолликулов [41] и подавляет ангиогенез в желтом теле грызунов [42] и приматов [37,43,44].
Очищенные факторы роста человека, в том числе и фактор роста эндотелия сосудов, находят широкое применение в различных практических приложениях. В частности, к областям их применения относятся разработка лекарственных препаратов, принцип действия которых основан на блокировании биологической активности фактора роста, разработка лекарственных препаратов на основе собственно фактора роста, использование факторов роста in vitro для целей клеточной и тканевой инженерии, использование факторов роста в качестве стандартов в различных биологических тест-системах, имеющих прикладное значение. Однако использование факторов роста человеческого происхождения имеет ряд серьезных ограничений, связанных часто с необходимостью использования большого количества исходного биоматериала, сложностью процедур очистки и, самое главное, возможной биологической опасностью конечного продукта из-за содержания в нем известных и неизвестных патогенов. Все эти ограничения отсутствуют при использовании рекомбинантных белков, полученных в контролируемых условиях.
Для получения рекомбинантных белков используют различные системы экспрессии, основанные на использовании в качестве продуцентов клеток E.coli, дрожжей, насекомых, млекопитающих. Выбор системы экспрессии для продукции конкретного белка определяется различными факторами, которые включают в себя стоимость продукции и очистки, характеристики выхода целевого белка, необходимость проведения очистки от продуктов неправильного фолдинга и неполноразмерных молекул, необходимость присутствия пост-трансляционных модификаций в рекомбинантном белке. Одним из широко используемых подходов при продукции рекомбинантных секреторных белков млекопитающих, к которым относится VEGF-A165, является использование в качестве продуцентов клеток хомяка линии СНО. Использование для экспрессии клеток линии СНО позволяет добиться присутствия в рекомбинантных белках, продуцируемых в них, наиболее соответствующего эндогенному паттерну пост-трансляционных модификаций, в частности, гликозилирования, что позволяет получить рекомбинантный белок, максимально схожий с натурально встречающимся белком.
Вне зависимости от используемой для продукции рекомбинантного белка системы экспрессии, продуцированный рекомбинантный белок должен быть подвергнут процедуре очистки, призванной удалить примеси как белковой, так и небелковой природы, которые могут интерферировать со специфической активностью самого рекомбинантного белка и проявлять собственную биологическую активность, включая токсическое действие на клетки-мишени для целевого рекомбинантного белка. Процедура очистки основана на специфических физико-химических свойствах целевого белка и может включать в себя методы ультрафильтрации, дифференциального осаждения и различные виды хроматографии.
Одним из широко используемых подходов при очистке рекомбинантных белков является аффинная хроматография, основанная на специфическом связывании аффинным матриксом (например, за счет иммобилизованных антител) целевого белка. Этот метод позволяет в одну стадию добиться высокой очистки целевого белка от примесей. При использовании антител для получения аффинного матрикса для очистки конкретного рекомбинантного белка предпочтительным является использование антител, способных узнавать антигенные детерминантны белка. Это позволяет проводить аффинную очистку рекомбинантного белка, по своей структуре идентичного натуральному. Однако реализация этого подхода требует получения для каждого белка уникальных препаратов антител, которые в силу необходимости стандартизации процедуры очистки, должны представлять собой моноклональные антитела. Альтернативным подходом является использование стандартных моноклональных антител для очистки различных рекомбинантных белков. Для реализации этого подхода необходимо введение в последовательность рекомбинантного белка специальной последовательности аминокислот (эпитоп), узнаваемой используемыми для аффинной очистки стандартными антителами. Недостатком этого подхода является присутствие в составе рекомбинантного белка экзогенных последовательностей и, соответственно, его неполная идентичность натуральному белку, что может влиять на биологическую активность белка, а также при применении in vitro приводить к возникновению иммунного ответа на эпитоп и сам белок как следствие гаптенации. Однако в ряде случаев присутствие эпитопа не является существенным для практического использования белка при условии сохранения его функциональных свойств. Такими приложениями являются, например, использование рекомбинантных белков в качестве стандартов в иммуноферментном анализе, использование факторов роста in vitro при тканевой и клеточной инженерии, а также в исследовательских целях.
В качестве экзогенных эпитопов для детекции и очистки рекомбинантных белков используются различные последовательности аминокислот. Одной из таких последовательностей является DED-эпитоп («Пептид DED и его применение для идентификации и/или очистки рекомбинантных белков, вектор pDED», патент на изобретение №2380373), позволяющий проводить специфическую детекцию и очистку содержащих его белков с применением антител, специфически узнающих этот эпитоп.
Помимо использования единичного эпитопа одним из хорошо известных способов увеличения эффективности взаимодействия антител с рекомбинантным белком, маркированным эпитопом, является тандемное включение нескольких эпитопов вместо его единичной копии. Это позволяет увеличить чувствительность детекции белка, маркированного эпитопом, а также улучшить параметры его аффинной очистки, как это было продемонстрировано, например, для FLAG-эпитопа [45]. Особенно существенным введение нескольких повторяющихся эпитопов может быть при необходимости очистки маркированного ими белка в нативных условиях, поскольку единичный эпитоп может быть недоступен из-за стерических препятствий, возникающих в результате фолдинга белка, а увеличение числа эпитопов увеличивает вероятность доступности хотя бы одного эпитопа для связывания антителами для белка в нативной конформации [46].
Раскрытие настоящего изобретения
Сущностью настоящего изобретения является создание новой линии клеток хомяка CHO[V3D], продуцирующих рекомбинантный фактор роста эндотелия сосудов - белок VEGF-A165 человека - с тремя тандемно повторяющимися DED-эпитопами (3×DED) на С-конце полипептидной цепи (белок VEGF-A165-3×DED). Способность клеток CHO[V3D] секретировать рекомбинантный VEGF-A165-3×DED достигается при помощи генной модификации клеток хомяка линии СНО генной конструкцией - плазмидой pV3D, содержащей комплементарную ДНК (кДНК) VEGF-A165 человека (SEQ ID NO: 1), в которой удален кодон терминации транскрипции, а вместо него вставлен фрагмент ДНК, кодирующий в одной рамке считывания с кДНК VEGF-A165 три DED-эпитопа, разделенные последовательностями нуклеотидов 5'-GCTAGAGGAGGT-3', кодирующими тетрапептиды Ala-Arg-Gly-Gly, встроенную в вектор, предназначенный для экспрессии в клетках млекопитающих.
Технический результат заключается в получении клеток линии CHO[V3D], стабильно трансфицированных плазмидой pV3D, предназначенной для экспрессии в клетках млекопитающих белка VEGF-A165 человека с С-концевым 3×DED-эпитопом, и секретирующих этот фактор в ростовую среду при культивировании in vitro.
Целью настоящего изобретения является расширение коллекции уникальных клеточных штаммов, которые можно использовать для получения белка VEGF человека, изоформа А 165. Эта задача является особенно актуальной для современной фармакологической биотехнологии. Наработанный указанным штаммом белок VEGF-A165 может применяться во многих сферах биологических и медицинских исследований, в частности, при создании и изучении лекарственных средств и других соединений, являющихся агонистами или антагонистами VEGF, в области клеточной и тканевой инженерии. Помимо этого, в настоящее время уровень VEGF в крови все чаще рассматривается как биомаркер при различных патологических состояниях человека, что делает актуальным создание систем количественной детекции VEGF, для чего необходимо наличие референсного стандарта этого фактора роста [47].
Поставленная задача решается тем, что получена новая линия клеток CHO[V3D], несущая интегрированную в геном генную конструкцию, представляющую собой модифицированную кДНК VEGF-A165 человека (SEQ ID NO: 1), встроенную в вектор, предназначенный для экспрессии в клетках млекопитающих, и продуцирующих биологически активный рекомбинантный белок VEGF-A165 человека с С-концевым ЗхВЕО-эпитопом, позволяющего проводить одностадийную аффинную очистку белка и его высокочувствительную детекцию с использованием антител против DED-эпитопа, с пост-трансляционными модификациями гликозилирования, в количестве не менее 0.2 мг рекомбинатного белка на 1 л культуральной среды за 72 часа. Полученная клеточная линия обладает стабильными культуральными и морфологическими свойствами и в результате генной модификации обладает способностью секретировать рекомбинантный фактор роста эндотелия сосудов. Линия клеток CHO[V3D] депонирована во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-123.
Краткое описание чертежей
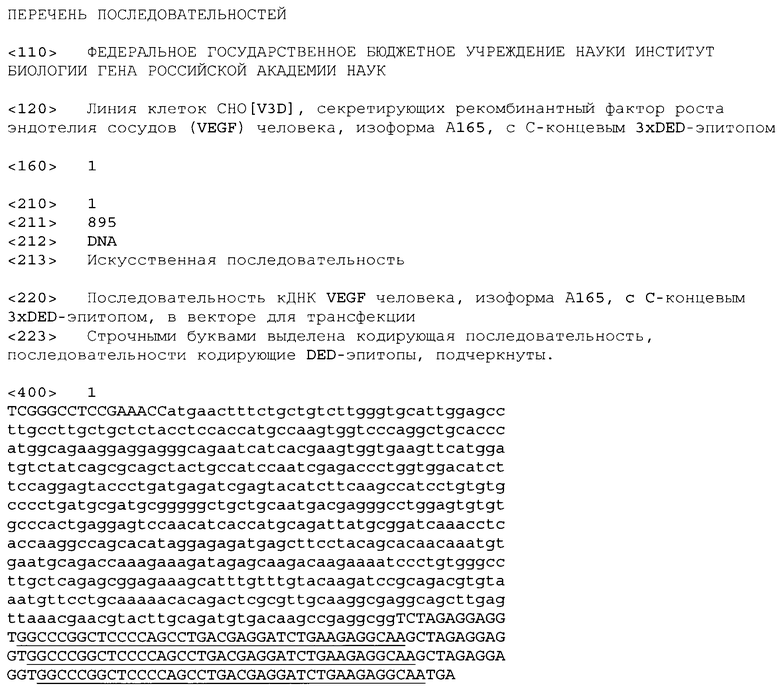
На фиг.1 показан результат анализа культуральных сред немодифицированных клеток линии СНО (-), клеток линии СНО, транзиторно трансфицированных плазмидой pV3D (+), и клеток линий СНО, модифицированных плазмидой pV3D (pV3D), на присутствие в них белка VEGF-A165-3×DED человека. Монослойные культуры клеток инкубировали с бессывороточной культуральной средой в течение 48 часов, после чего аликовоты кондиционной среды разделяли в 12.5% ДСН-ПААГ в редуцирующих условиях. Приведены результаты Вестерн-блот анализа с антителами против DED-эпитопа. Линия клеток CHO[V3D] отмечена звездочкой (*) (А). Аналогичным образом приготовленные образцы культуральной среды клеток линии СНО и CHO[V3D] также разделяли в 12.5% ДСН-ПААГ в нередуцирующих условиях и параллельно проводили детекцию белков с антителами против DED-эпитопа (анти-DED) и с анти-VEGF антителами (Sigma, США, кат. №V-6621) (анти-VEGF). Стрелка указывает на положение в геле рекомбинантного белка VEGF-A165-3×DED человека, мигрирующего в ДСН-ПААГ как гомодимер в нередуцирующих условиях. Слева приведены положения полос маркера молекулярного веса (Bio-Rad, США, Prescision Plus Protein™ Standard) в килодальтонах (кДа) (Б).
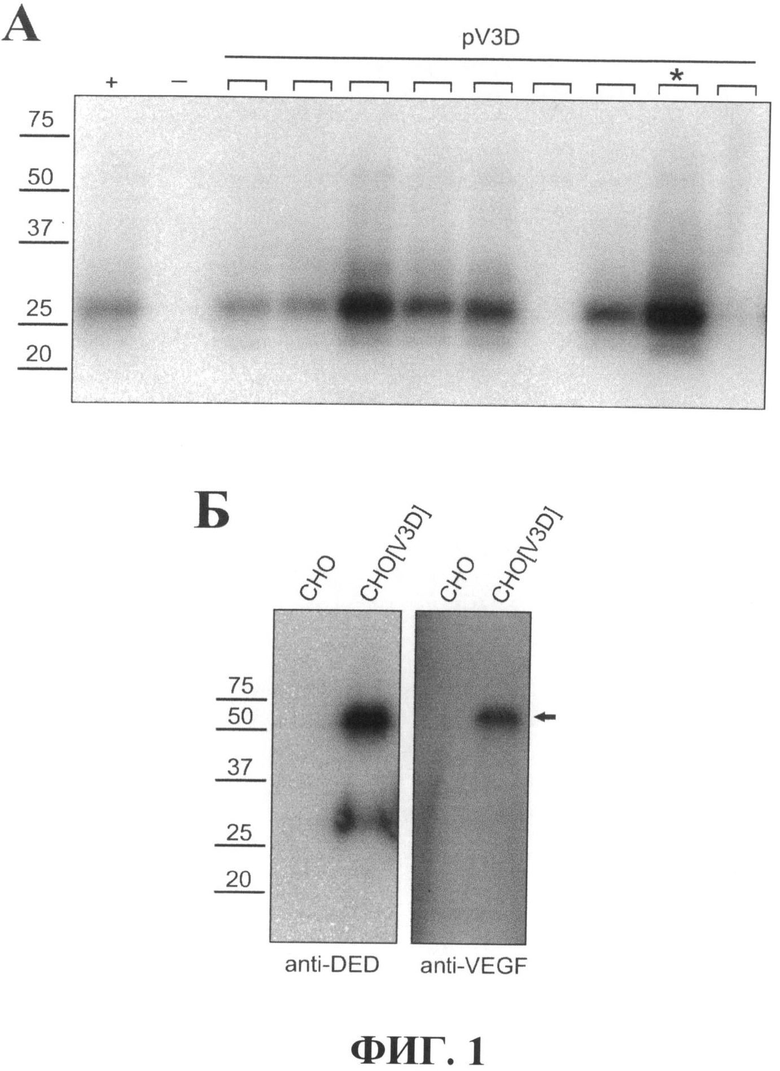
На фиг.2 показан результат оценки количества белка VEGF-A165-3×DED в культуральной среде клеток CHO[V3D]. Белки, очищенные с помощью иммобилизованных на твердом носителе антител против DED-эпитопа из 500 мкл быссывороточной культуральной среды, инкубированной с монослойной культурой клеток CHO[V3D] или СНО в течение 72 часов, разделяли в 12% ДСН-ПААГ в редуцирующих условиях. Приведены результаты окраски геля красителем Кумасси R-250. Стрелка указывает на положение в геле рекомбинантного белка VEGF-A165-3×DED человека. Слева приведены положения полос маркера молекулярного веса (Bio-Rad, США, Prescision Plus Protein™ Standard) в килодальтонах (кДа).
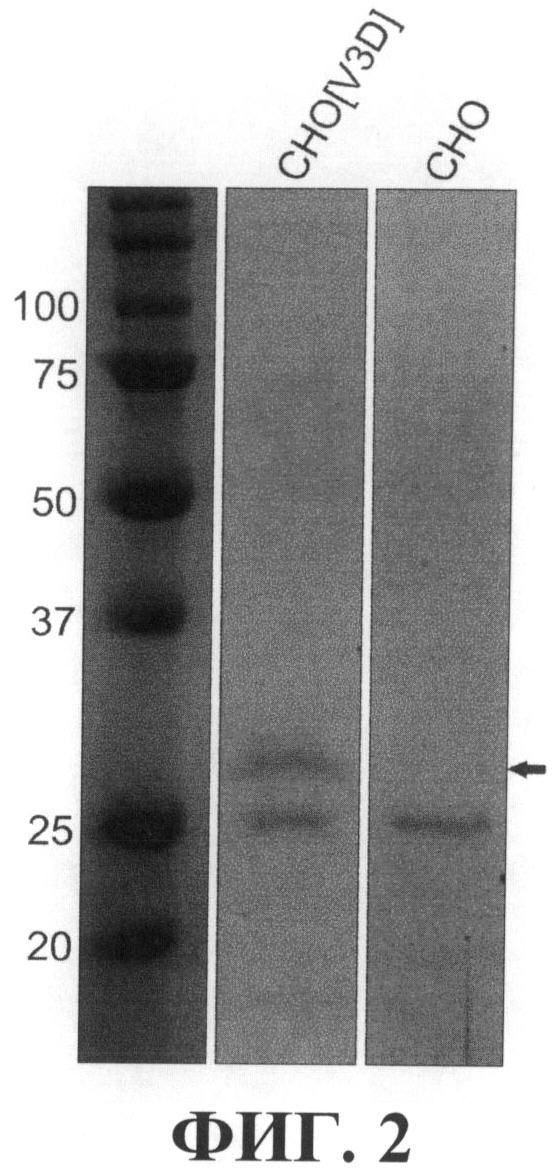
На фиг.3 показан результат очистки рекомбинантного белка VEGF-A165-3×DED из культуральной среды клеток линии CHO[V3D]. Аликвоты очищенного рекомбинантного белка VEGF-A165-3×DED в указанных количествах человека разделяли в 10% ДСН-ПААГ в нередуцирующих условиях с последующим окрашиванием геля красителем Bio-Safe™ Coomassie (Bio-Rad). Для оценки молекулярной массы белков использовали маркер молекулярной массы (MW) Prescision Plus Protein™ Standard (Bio-Rad, США). Размеры полос маркера молекулярного веса приведены справа в килодальтонах. Слева показан денситометрический профиль дорожки геля с разделенными 5 мкг рекомбинантного белка VEGF-A165-3×DED.
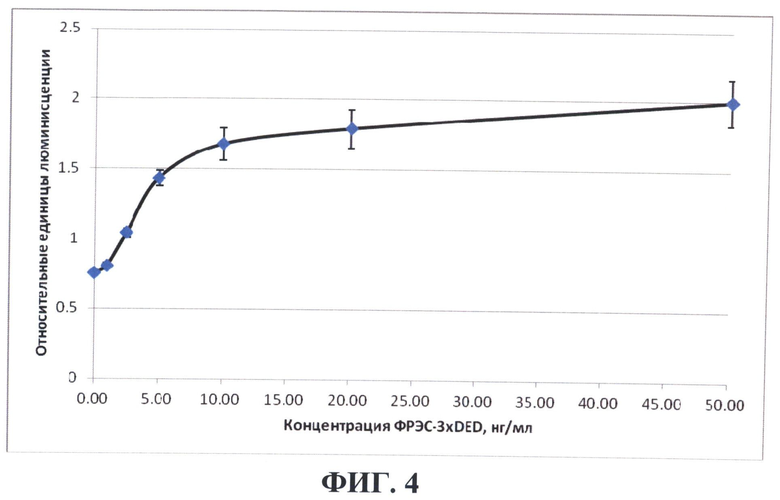
На фиг.4 приведены результаты анализа биологической активности очищенного рекомбинантного белка VEGF-A165-3×DED человека, продуцируемого клетками линии CHO[V3D], основанного на способности VEGF-A165 поддерживать пролиферацию клеток эндотелия HUVEC. Клетки HUVEC рассевали в лунки 96-луночного планшета (2000 клеток на лунку) в базальной среде для роста эндотелиальных клеток ЕВМ-2 (Lonza, США) с 2% фетальной бычьей сывороткой. После прикрепления клеток (через 4 часа) добавляли белок VEGF-A165-3×DED до указанных конечных концентраций. Пролиферацию клеток определяли через 96 часов с помощью набора CellTiter Glo™ Luminescent Cell Viability Assay (Promega, США). Данные представлены в виде графика зависимости люминесценции в относительных единицах, пропорциональной количеству клеток, как среднее значение для трех независимых лунок±стандартное отклонение, от концентрации рекомбинантного белка VEGF-A165-3×DED в среде.
Примеры осуществления настоящего изобретения
Пример 1. Получение кДНК VEGF-A165 человека, встроенной в вектор, предназначенный для экспрессии в клетках млекопитающих (плазмида pVEGF-A165-3×DED)
Для получения фрагмента кДНК VEGF-A165 человека использовали полимеразную цепную реакцию с последующим клонированием амплифицированного фрагмента в плазмидный вектор с использованием методов и подходов, хорошо известных специалистам в этой области. кДНК VEGF человека амплифицировали с использованием в качестве матрицы первых цепей кДНК из плаценты человека. Праймеры подбирали таким образом, чтобы амплифицируемый фрагмент кДНК VEGF-A165 содержал полную открытую рамку считывания, кодирующую сигнальный пептид и зрелый полипептид, и последовательности инициации и терминации трансляции. Продукт амплификации использовался в качестве матрицы в полимеразной цепной реакции с праймерами [5'-AGC TGA АТТ CGG GCC ТСС GAA АСС-3'] и [5'-ТАА ТСТ AGA CCG CCT CGG СТТ GTC АСА Т-3'] для (1) введения сайта узнавания рестрикционной эндонуклеазы EcoRI на 5'-конце фрагмента, (2) замены кодона терминации трансляции TGA на нетерминирующий кодон ТСТ, и (3) введения сайта узнавания рестрикционной эндонуклеазы Xbal на 3'-конце фрагмента. Амплифицированный фрагмент расщепляли с использованием рестрикционных эндонуклеаз EcoRI и XbaI и клонировали в вектор, полностью идентичный описанному ранее вектору pB1-DED («Пептид DED и его применение для идентификации и/или очистки рекомбинантных белков, вектор pDED», патент на изобретение №2380373), но содержащий вместо последовательности, кодирующей один DED-эпитоп, последовательность, кодирующую 3 DED-эпитопа в одной открытой рамке считывания. Полученный в результате клонирования фрагмент ДНК, кодирующий белок VEGF-A165 с 3×DЕD-эпитопом, вырезали с помощью рестрикционных эндонуклеаз EcoRI и NotI и клонировали в вектор, предназначенный для экспрессии в клетках млекопитающих, для получения плазмиды pV3D. Это помещает амплифицированный фрагмент ДНК, кодирующий белок VEGF-A165 человека с 3×DЕD-эпитопом, между конститутивным промотором и сигналом терминации транскрипции и полиаденилирования в использованном векторе для экспрессии в клетках млекопитающих таким образом, что 5'-конец фрагмента следует за промотором, а 3'-конец предшествует сигналу терминации транскрипции и полиаденилирования. Нуклеотидная последовательность фрагмента, кодирующего белок VEGF-A165 человека с 3×DED-эпитопом, клонированная в вектор для экспрессии в клетках млекопитающих, была определена и полностью идентична известной последовательности соответствующего фрагмента кДНК VEGF-A165 человека от 5'-конца фрагмента до последней аминокислоты белка VEGF-A165 человека включительно, доступной в базе данных нуклеотидный последовательностей GeneBank (www.ncbi.nlm.nih.gov) под номером NM_001171626, с находящимся далее за ней в одной открытой рамке считывания последовательности, кодирующей 3×DЕD-эпитоп, предшетвующей кодону терминации трансляции. Помимо вышеописанных структурных элементов, вектор для экспрессии в клетках млекопитающих (а также его производная - плазмида pV3D) также содержит селективный маркер (кДНК неомицин-фосфотрансферазы II), позволяющий проводить селекцию в клетках E.coli в присутствии канамицина при проведении процедуры клонирования, а также в клетках млекопитающих в присутствии генетицина (антибиотик G418) при получении клонов клеток линии СНО, продуцирующих белок VEGF-A165-3×DED человека.
Пример 2. Получение генно-модифицированных клеток линии СНО, секретирующих белок VEGF-A165-3×DED человека
Для получения клонов клеток, продуцирующих рекомбинантный белок VEGF-A165-3×DED, кодируемый плазмидой pV3D, клетки линии СНО трансфицировали плазмидой pV3D и проводили отбор клонов клеток со стабильной интеграцией в геном плазмиды pV3D на основании их устойчивости к антибиотику G418.
Клетки линии СНО трансфицировали плазмидой pV3D с использованием реагента для трансфекции Unifetin-56 (UnifectGroup, Москва). Селекцию клонов проводили в полутвердой ростовой среде (среда DMEM/F12 (1:1) с 10% фетальной бычьей сыворотки, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина), содержащей 600 мкг/мл антибиотика G418, ClonMatrix (Genetix, Великобритания) и флуоресцентно меченные антитела против DED-эпитопа. После формирования резистентными клетками колоний проводился анализ продукции рекомбинантного белка на основании его взаимодействия с меченными антителами против DED-эпитопа с использованием роботизированного комплекса ClonePixFL (Genetix, Великобритания). Колонии клеток с максимальной экспрессией рекомбинантного белка переносили в 96-луночный планшет с помощью функции, реализованной в роботизированном комплексе ClonePixFL. После формирования клетками монослоя их переносили в 24-луночный планшет. После формирования монослоя в нем клетки рассевали в 6-луночный планшет для последующей заморозки и в лунку 24 луночного планшета для проведения анализа секреции белка VEGF-A165-3×DED в культуральную среду.
Пример 3. Анализ продукции рекомбинантного белка VEGF-A165-3×DED человека клонами клеток линии СНО, трансфицированных плазмидой pV3D
После достижения отобранными клонами клеток линии СНО, трансфицированных плазмидой pV3D, конфлюентности в лунках 24-луночного планшета, лунки промывали 1 мл ростовой среды без сыворотки и добавляли 1 мл той же среды. Среду собирали через 48 часов инкубации для анализа содержания рекомбинантного белка VEGF-A165-3×DED в ней. Для проведения анализа аликвоты культуральной среды, смешанные с 6-кратным буфером для нанесения на ДСН-ПААГ, разделяли в 12.5% ДСН-ПААГ и проводили Вестерн-блот анализ с использованием антител против DED-эпитопа. Для детекции иммобилизованных на мембране вторичных антител, конъюгированных с пероксидазой хрена, использовали субстрат ECL+(GE Healthcare). В качестве контролей использовали процессированные кондиционные среды нетрансфицированных клеток лини СНО (отрицательный контроль) и клеток линии СНО, транзиторно трансфицированных плазмидой pV3D с помощью реагента для трансфекции Unifectin-56 (положительный контроль). По результатам Вестерн-блот анализа из полученных клонов клеток линии СНО, модифицированных плазмидой pV3D, был отобран клон, продуцирующий максимальное количество рекомбинантного белка VEGF-A165-3×DED в культуральную среду (линия CHO[V3D]). Рекомбинантный белок VEGF-A165-3×DED, секретируемый клетками линии СНО, модифицированных плазмидой pV3D, детектировался как белок с молекулярным весом немного более 25 кДа (фигура 1А). Это незначительно больше, чем ранее описанная подвижность белка VEGF-A165 человека, что определяется присутствием 3×DED-3nHTona.
Для подтверждения присутствия полипептида VEGF-A165 человека в составе рекомбинантного белка VEGF-A165-3×DED, аналогичный описанному выше эксперимент был проведен с детекцией белков при Вестерн блоттинге с антителами против белка VEGF-A165. Аликвоты культуральной среды разделялись в нередуцирующих условиях, поскольку в этом случае выше чувствиетельность детекции использованных антител против белка VEGF-A165 человека. Поскольку физиологически активная форма белка VEGF-A165-3×DED представляет собой гомодимер, формируемый за счет образования дисульфидных связей, в нередуцирующих условиях физиологически активный белок VEGF-A165 мигрирует в геле в виде димера с подвижностью около 50 кДа. Как видно на фигуре 1Б, антитела против белка VEGF-A165 узнают белок с той же подвижностью, что и детектируемый антителами против DED-эпитопа, в кондиционной среде клеток CHO[V3D], но не в кондиционной среде немодифицированных клеток линии СНО.
Пример 4. Оценка концентрации рекомбинантного белка VEGF-A165-3×DED в культуральной среде клеток линии CHO[pV3D]
Клетки линии CHO[V3D] выращивали в 100 мм культуральных чашках до конфлюентности, после чего культуральную среду заменяли на свежую культуральную среду без добавления сыворотки (10 мл на чашку) и инкубировали в течение 72 часов. Собранную культуральную среду использовали для определения концентрации рекомбинантного белка VEGF-A165-3×DED.
Концентрацию рекомбинатного белка VEGF-A165-3×DED оценивали по интенсивности окрашивания очищенного с помощью аффинной хроматографии за 3×DED эпитоп белка VEGF-A165-3×DED после разделения и окраски белков в геле красителем Кумасси R-250. Два мл культуральной среды с белком VEGF-A165-3×DED, приготовленной как описано в примере 4, инкубировали с 50 мкл носителя (Сефароза 4 В) с ковалентно иммобилизованными антителами, узнающими DED-эпитоп (7 мг на 1 мл носителя) при температуре 4°С в течение 3 часов. Носитель промывали 3 раза фосфатно-солевым буфером, и связавшиеся с носителем белки элюировали путем добавления 40 мкл буфера для нанесения на ДСН-ПААГ с последующим кипячением в течение 7 мин. Параллельно аналогичные манипуляции проводили с приготовленной с использованием немодифицированных клеток линии СНО культуральной средой. Десять мкл элюата (что соответствует очистке белков с DED-эпитопами из 500 мкл культуральной среды) разделяли в 12% ДСН-ПААГ в редуцирующих условиях и белки в геле окрашивали красителем Кумасси R-250. Как видно на фигуре 2, в элюате при очистке из культуральной среды клеток линии CHO[V3D], но не из культуральной среды немодифициорованных клеток линии СНО, детектируется белок с подвижностью около 27 кДа, соответствующей подвижности рекомбинантного белка VEGF-A165-3×DED. Поскольку предел детекции количества белков в геле после окраски красителем Кумасси составляет 100 нг, можно заключить, что в дорожке геля присутствует не менее 100 нг рекомбинантного белка VEGF-A165-3×DED. Поскольку это соответствует белку, находящемуся в 500 мкл культуральной среды, то количество рекомбинантного белка VEGF-A165-3×DED в 1 мл среды составляет не менее 0.2 мкг/мл, или не менее 0.2 мг/л.
Пример 5. Наработка среды культуры клеток линии CHO[V3D]
Клетки линии CHO[V3D] растили в роллерах. В процессе и после достижения культурой клеток линии CHO[V3D] в роллерах монослойного состояния культуральная среда при ее замене собиралась следующим образом. После отбора среды из роллеров среда центрифугировалась в течение 5 мин при 1000 об/мин для осаждения возможно присутствующих в ней открепившихся клеток. Надосадок после центрифугирования переносился в чистую емкость и хранился замороженным при -20°С. В результате последовательной смены среды после достижения культурой монослоя в роллере было получено 2.6 литра культуральной среды клеток линии CHO[V3D] (объем культуральной среды в роллере - 250-300 мл в зависимости от срока инкубации до замены среды; смена среды раз в 2-3 дня) (с учетом собранной среды в процессе наращивания клеток для засева их в роллер и достижения монослойного состояния культурой в роллере).
6. Очистка белка VEGF-A165-3×DED из культуральной среды клеток линии CHO[V3D]
Наработанная культуральная среда клеток линии CHO[V3D], содержащая белок VEGF-A165-3×DED, использовлась для очистки рекомбинантного белка VEGF-A165-3×DED.
Очистку белка VEGF-A165-3×DED из культуральной среды клеток линии CHO[V3D] проводили с помощью аффинной хроматографии. Культуральную среду фильтровали через фильтр с диаметром пор 0.2 мкм. Жидкость обезгаживали 20 мин под вакуумом и наносили на колонку, содержащую твердый носитель с ковалентно иммобилизованным на нем реагентом, аффинно связывающим белок VEGF-A165-3×DED (антитела, узнающие DED-эпитоп), при скорости потока 1 мл/мин. После нанесения среды колонку промывали фосфатно-солевым буфером, фосфатно-солевым буфером, содержащим 1 М хлористого натрия, и опять фосфатно-солевым буфером до достижения базового уровня поглощения при 280 нм. Контроль оптической плотности производили проточным денситометром. Элюцию белка VEGF-A165-3×DED производили 0.1 М раствором лимонной кислоты рН 2.2 до начала падения оптической плотности. После элюции 0.1 М цитратным буфером с рН 2.2 раствор белка был немедленно защелочен с использованием 1 M NaOH до конечного рН 7.5, к раствору белка был добавлен 5М раствор хлорида натрия до его конечной концентрации 150 мМ, а также детергент Твин20 до 0.1%. После этого препарат белка был диализован против буфера с составом 20 мМ фосфат натрия, рН 7.0, ×00 мМ хлорид натрия, 0.02% Твин 20. Полученный белок был стерилизован фильтрацией и хранился при температуре 4°С. Чистоту полученного препарата рекомбинантного белка контролировали по окраске разделенного препарата рекомбинантного белка в ДСН-ПААГ в нередуцирующих условиях. Как видно из фигуры 3, окраска 5 мкг препарата очищенного рекомбинантного белка VEGF-A165-3×DED выявила отсутствие посторонних белковых полос помимо полосы с преимущественной подвижностью около 50 кДа, соответствующей белку VEGF-A165-3×DED. Денситометрический анализ изображения геля с помощью программы Quantity One (BioRad, США) показал, что чистота полученного препарата составляет около 96% (фигура 3). Концентрацию белка VEGF-A165-3×DED определяли спектрофотометрически по поглощению при длине волны 280 нм, принимая расчетный коэффициент экстинкции на основании содержания остатков цистина и тирозина (определен с помощью программы ProtParam, ExPASy Proteomics Server, www.expasy.ch [48]).
Пример 7. Определения биологической активности очищенного белка VEGF-A165-3×DED.
Биологическую активность очищенного белка VEGF-A165-3×DED определяли по его способности поддерживать пролиферацию клеток эндотелия человека HUVEC. Эндотелиальные клетки HUVEC засевались в лунки 96-луночного планшета (2000 клеток/лунка) в базальной среде для роста эндотелиалных клеток ЕВМ-2 (Lonza). После прикрепления клеток (через 4 часа) добавляли белок VEGF-A165-3×DED до концентрации от 1 до 50 нг/мл. Количество клеток определяли через 96 часов. Видно (фигура 4), что полученный препарат белка VEGF-A165-3×DED способен доза-зависимо поддерживать пролиферацию клеток эндотелия.
Основные характеристики клеток линии CHO[V3D]
Родословная клеточной линии:
Линия клеток CHO[V3D] получена из клеток линии CHOtk' путем трансформации их плазмидой pVEGF-A165-3×DED для продукции фактора роста эндотелия сосудов человека, изоформа А165, с 3×DЕD-эпитопом на С-конце полипептиной цепи рекомбинантного белка, и содержащей ген устойчивости к антибиотику G418. Клетки CHOtk' представляют собой клон клеток яичника китайского хомячка (СНО), дефектных по гену тимидинкиназы. Штамм депонирован в Российской коллекции культур клеток позвоночных (ИНЦ РАН) под номером 161Д, депозитор Институт Биомедицинских технологий Научный центр РАМН.
Число пассажей:
К моменту составления паспорта клеточная линия прошла 10 пассажей.
Стандартные условия культивирования:
Питательная среда DMEM/F12 (1:1) (90%), фетальная бычья сыворотка 10%, содержащая антибиотики (пенициллин со стрептомицином в концентрации 100 ед/мл и 100 мкг/мл соответственно и G418 в концентрации 400 мкг/мл). Культивирование при 37оС и 5% СО2. Кратность рассева 1:4-1:15, оптимальная плотность 10000-20000 клеток/см2. Метод снятия: 0.25% раствор трипсина и 0.02% раствор версена в соотношении 1:1.
Культуральные свойства:
Пассаж 1 раз в 3-4 суток. Клетки имеют преимущественно адгезионный, преимущественно монослойный характер роста в стандартных условиях культивации.
Маркерные признаки:
Секреция фактора роста эндотелия сосудов человека, изоформа А165 в количестве не менее 0.2 мг на 1 л среды за 48 часов при 1 мл ростовой среды на 5 см2 монослойной культуры. Устойчивость к антибиотику G418 (минимум до 600 мкг/мл).
Контаминация:
Бактерии и грибы в культуре не обнаружены при длительном наблюдении. Тест на микоплазму отрицателен
Условия криоконсервации:
Среда для замораживания: 80% ростовая среда, 10% эмбриональная телячья сыворотка, 10%DMSO, 1.0-2.0×106 клеток/мл в ампуле.
Хранение в жидком азоте при температуре -196°С.
Размораживание быстрое, при 37°С. Клетки разводят в 5 мл ростовой среды и осаждают центрифугированием, ресуспендируют в 5 мл той же среды, и переносят в культуральный флакон с площадью роста 25 см2. Жизнеспособность клеток оценивают по включению трипанового синего. Жизнеспособность клеток после размораживания составляет не менее 90%.





| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ КЛЕТОК Escherichia coli BL21 (pVEGF-A165), СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ФАКТОР РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF) | 2008 |
|
RU2395568C2 |
| ПЕПТИД DED И ЕГО ПРИМЕНЕНИЕ ДЛЯ ИДЕНТИФИКАЦИИ И/ИЛИ ОЧИСТКИ РЕКОМБИНАНТНЫХ БЕЛКОВ, ВЕКТОР pDED | 2007 |
|
RU2380373C2 |
| НАНОАНТИТЕЛО V93, СВЯЗЫВАЮЩЕЕ VEGF, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩАЯ V93 НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СОДЕРЖАЩИЙ ЕЕ ВЕКТОР, СПОСОБ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК | 2008 |
|
RU2395522C1 |
| НАНОАНТИТЕЛО V9, СВЯЗЫВАЮЩЕЕ VEGF, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, КОДИРУЮЩАЯ V9 НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СОДЕРЖАЩИЙ ЕЕ ВЕКТОР, СПОСОБ ИНГИБИРОВАНИЯ ПРОЛИФЕРАЦИИ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК | 2008 |
|
RU2395521C1 |
| АНТИТЕЛО ДВОЙНОЙ НАПРАВЛЕННОСТИ В НОВОЙ ФОРМЕ И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2520824C2 |
| СПОСОБ ПОЛУЧЕНИЯ АФЛИБЕРЦЕПТА | 2016 |
|
RU2732237C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЕСЯ С ДВУМЯ МИШЕНЯМИ -DLL4 И VEGF-, И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2648154C2 |
| Линия клеток C-HAlb, секретирующих рекомбинантный альбумин человека | 2019 |
|
RU2719152C1 |
| FGF-R-Fc СЛИТЫЙ БЕЛОК И ЕГО ИСПОЛЬЗОВАНИЕ | 2012 |
|
RU2560573C2 |
| СЛИТНЫЙ БЕЛОК АНТИАНГИОГЕННОГО ИНДУЦИРУЮЩЕГО ФАКТОРА И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2560589C2 |
Изобретение относится к области биотехнологии и может быть использовано для продукции фактора роста эндотелия сосудов человека - белка VEGF-A165 с тремя DED-эпитопами (3×DED-эпитопоп) на С-конце белка, которые не влияют на его биологическую активность и позволяют проводить очистку белка. Рекомбинантным путем получают линию клеток CHO[V3D], трансформированных плазмидой pV3D, кодирующей фактор роста эндотелия сосудов человека, изоформа А165, с С-концевым 3×DED-эпитопом (SEQ ID NO: 1), которая способна продуцировать биологически активный рекомбинантный белок VEGF-A165 человека с С-концевым 3×DED-эпитопом в количестве не менее 0.2 мг на 1 л среды за 72 часа при 1 мл ростовой среды на 5 см2 монослойной культуры. Линия клеток депонирована во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-123. 4 ил., 7 пр.
Линия клеток CHO[V3D], трансформированных плазмидой pV3D, кодирующей фактор роста эндотелия сосудов человека, изоформа А165, с С-концевым 3xDED-эпитопом (SEQ ID NO: 1), и продуцирующих рекомбинантный белок VEGF-A165 человека с С-концевым 3xDED-эпитопом, депонированная во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-123.
| LEE S.B | |||
| et al | |||
| Overproduction of recombinant human VEGF (vascular endothelial growth factor) in Chinese hamster ovary cells, J | |||
| Microbiol | |||
| Biotechnol., 2008, v.18, n.1, p.183-187 | |||
| ПЕПТИД DED И ЕГО ПРИМЕНЕНИЕ ДЛЯ ИДЕНТИФИКАЦИИ И/ИЛИ ОЧИСТКИ РЕКОМБИНАНТНЫХ БЕЛКОВ, ВЕКТОР pDED | 2007 |
|
RU2380373C2 |
| ШТАММ КЛЕТОК Escherichia coli BL21 (pVEGF-A165), СЕКРЕТИРУЮЩИХ РЕКОМБИНАНТНЫЙ ФАКТОР РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF) | 2008 |
|
RU2395568C2 |
| ГЕННО-ИНЖЕНЕРНАЯ КОНСТРУКЦИЯ VEGF-ИБМЕД (VEGF-IBMED) | 2005 |
|
RU2297848C2 |
| ГОИГОРЯН А.С | |||
| и др | |||
| Возможные молекулярные механизмы функционирования плазмидных | |||
Авторы
Даты
2013-09-20—Публикация
2012-07-16—Подача