Настоящее изобретение относится к глазным композициям, содержащим мукоадгезивные полисахариды, способные стимулировать восстановление эпителия роговицы. Конкретнее, изобретение относится к глазным растворам, содержащим арабиногалактаны, обладающие защитным действием на эпителий роговицы, которые особенно рекомендуются для применения в качестве искусственной слезы для стимуляции заживления поражений роговицы и особенно применимы для людей, носящих контактные линзы.
Как известно, роговица представляет собой передний отдел фиброзной оболочки глазного яблока, причем роговица составляет только ее шестую часть, а остальное представляет собой склеру; эти две структуры соприкасаются и составляют неразрывное целое. Фактически роговица менее изогнута, чем склера, поэтому создается впечатление, что роговица выступает вперед. Благодаря своим специфическим характеристикам (прозрачности и отсутствию сосудов), а также благодаря форме, которая делает ее прекрасной вогнуто-выпуклой линзой, роговица составляет существенный элемент преломляющей системы глаза.
Передняя поверхность роговицы выпуклая и эллиптическая, есть ее горизонтальный диаметр немного больше вертикального, и следовательно, роговица имеет различную кривизну в этих двух направлениях. Это различие служит причиной физиологического астигматизма. Задняя поверхность роговицы, напротив, вогнутая, имеет одинаковый диаметр и радиус во всех направлениях. Толщина роговицы меняется от приблизительно 0,5 мм в центральной части до приблизительно 0,7 мм на периферии.
Гистологически роговица состоит из пяти слоев, которые располагаются в следующем порядке (снаружи вовнутрь): эпителий, мембрана Боумена, строма, мембрана Десцемета и эндотелий.
Роговица выполняет свою оптическую функцию благодаря высокой прозрачности и ровности поверхности, контактирующей с воздухом. Последняя особенность обусловлена наличием слезной пленки, покрывающей эпителий, который является неровным из-за наличия сети микроскладок во внешнем слое. Слезная пленка делает эпителий гладким, однородным и придает ему высокие оптические свойства.
Слезная пленка, которая также покрывает конъюнктиву глазного яблока и конъюнктиву век, состоит из трех налагающихся друг на друга слоев, которые располагаются в следующем порядке (снаружи вовнутрь): липидный слой, водный слой и слизистый слой. Муцин, вырабатываемый бокаловидными клетками эпителия конъюнктивы, делает всю поверхность эпителия гладкой, что создает возможность для однородного распределения водного компонента пленки на слизистом слое; липидный слой, который секретируют мейбомиевые железы и железы Цейса, имеет функцию предотвращения испарения слезной пленки.
Как уже отмечалось, прозрачность является основным свойством роговицы. Прозрачность возможна благодаря абсолютному отсутствию сосудов в этой ткани, структурным характеристикам стромы и определенным специфическим физиологическим процессам, которые регулируют кругооборот воды и набухание роговицы, а также препятствуют пропитыванию роговицы, приводя уровень гидратации к нормальному значению - около 78%.
Другие физиологические особенности роговицы - ее отражающая способность (отражение света от поверхности), которая связана с целостностью эпителия, и проницаемость - являются неотъемлемой функцией кругооборота воды и/или проникновения чужеродных веществ, таких как лекарственные средства.
Значительная чувствительность к разнообразным стимулам связана, в конечном счете, с обильной иннервацией мембраны, которая уменьшается в старости и в присутствии некоторых воспалительных и дистрофически-дегенеративных изменений.
Самые часто обнаруживаемые изменения роговицы могут представлять собой начальные симптомы процессов воспалительной, дистрофической или дегенеративной природы или явное проявление заболевания. Изменения механически-травматической природы включают: эрозии роговицы, вызванные поверхностным истиранием эпителия роговицы или инородными телами, например, металлическими, стеклянными или пластмассовыми частицами, древесными и растительными остатками; разрывы и перфорации, вызванные объектами, проникающими в глаз с особой силой, которые внедряются на некоторую глубину; рецидивирующие эрозии роговицы, которые состоят из спонтанных эпизодов разрушения или отслаивания слоев эпителия роговицы; ожоги, вызванные слабыми кислотами или слабыми основаниями, высокой температурой или ультрафиолетовым излучением.
Разрушение эпителия роговицы в любом случае увеличивает риск инвазии возбудителей с потенциально разрушительными результатами. Конъюнктива фактически представляет собой одну из тканей организма, колонизированных микроорганизмами с самых первых моментов внеутробной жизни, и нужно отметить, что среди обычных резидентных микроорганизмов, таких как стрептококки (St. viridans), стафилококки (S. epidermidis, S. aureus), гемофильных палочек, Propionibacterium acnes, имеются некоторые, обладающие всеми характеристиками, которые считаются присущими истинно болезнетворным микроорганизмам.
Экосистема конъюнктивы - это система, которая стремится быть уравновешенной и биологически активной и остается таковой, пока не появятся тканевые, микробные или экологические факторы, которые разрушают это равновесие, тем самым делая среду конъюнктивы благоприятной территорией для микроорганизмов или для хозяина. Тканевые факторы зависят от гистологического строения ткани конъюнктивы и от секретов, составляющих слезную пленку: эти факторы могут действовать как cопутствующие причины в патогенезе различных инфекций роговицы, вызванных бактериями, вирусами и грибами. Они могут заселять ткань роговицы, особенно при наличии поражений роговицы и дать начало кератиту, в том числе очень тяжелому, нарушающему функцию глаза, такой кератит может привести к язве роговицы. Бактериальный кератит характеризуется острой болью, образованием язвы эпителия и иногда стромы роговицы, а также наличием отделяемой конъюнктивы. Этиологическими причинами этого поражения глаза служат S. aureus, St. pneumoniae, Ps. aeruginosa, Citrobacter, Klebsiella, Enterobacter. Кроме того, Mycobacterium chelonei и Mycobacterium fortuitum могут вызвать хронические язвы роговицы. Что касается этиологии грибковых поражений, то грибковый кератит вызывают, главным образом, нитевидные сапрофитные грибы и дрожжи, колонизирующие участки поврежденного эпителия роговицы. Наконец, кератит, вызванный Acanthamoeba, представляет собой редкую форму хронического кератита, вызванного этим паразитом, которая может даже угрожать зрению и характеризуется кольцевидным многоочаговым нагноением стромы роговицы, вслед за которым образуются язвы.
Все изменения роговицы (травматического, воспалительного или дегенеративного типа), которые вызывают разрушение ткани или потерю вещества, быстро заживают благодаря физиологическим механизмам, которые частично отличаются от механизмов других тканей из-за отсутствия в роговице сосудов. Процесс заживления, на который влияют характеристики очага поражения, и который, несомненно, является более проблематичным в присутствии гнойных язв, всегда начинается на эпителиальном уровне, не только в случае поверхностного повреждения, ограниченного этим слоем, но также и в случаях, затрагивающих паренхиму. Таким образом, эпителий участвует в заживлении очагов повреждений стромы, иллюстрацией чего служит формирование «эпителиального колпачка», необходимого для того, чтобы регулировать развитие последующих явлений регенерации коллагена.
Простые раны эпителия или эрозии заживают быстро благодаря также высокой митотической активности клеточных элементов в этой области. Фактически в момент травмы происходит временное прерывание физиологического механизма слущивания поверхностных клеток, а также перемещение и миграция интактных смежных клеток к поврежденной области. Прерывание прекращается, когда лишенная эпителия область полностью покрыта, и регенерация эпителиальных элементов обеспечивает восстановление нормальных структурных характеристик.
Если повреждение ограничено эпителием, его полное заживление гарантирует восстановление высоких отражающих свойств и прозрачности мембраны.
Специфической и нередкой причиной эрозий роговицы служат контактные линзы. Причины эрозий могут включать различные факторы физиологической, токсической или механической природы, и эрозии роговицы, вызванные контактными линзами, могут возникать в результате, в частности, их применения, трудностей их введения и удаления, проблем в отношения линзы и роговицы, поврежденных линз или инородных тел, попавших под линзу. Эти эрозии могут возникать при использовании и жестких, и мягких линз, но они чаще встречаются у людей, пользующихся жесткими линзами. Исследование, включившее 500 пользователей мягких контактных линз, показало, что у одной трети из них имелись довольно серьезные проблемы с глазами, причем эти проблемы могли привести к инфекциям, и что почти у 50% из них были симптомы легких поражений по меньшей мере одного глаза (R.J. Derick et al., CLAO J., 1989 Oct-Dec; 15(4):268-70).
Таким образом, эрозии роговицы - проблема, которая может возникнуть у любого, но контактные линзы, несомненно, вызывают истирание роговицы, и это увеличивает риск: пользователи контактных линз страдают от поражений роговицы приблизительно в три раза чаще, чем лица, не пользующиеся линзами.
Применение контактных линз также может порождать ряд других проблем, которые происходят из-за влияния линз на нормальное поступление кислорода к эпителию роговицы или вследствие патологических состояний, таких как конъюнктивит с гиперплазией сосочков или васкуляризация роговицы, или более часто встречающегося синдрома «сухого глаза». Последний, также известный как «сухой глаз» или сухой кератоконъюнктивит, является расстройством, вызванным уменьшением количества и качества слез. Типичными симптомами патологии служат раздражение и чувство жжения в глазах, ощущение песка или инородных тел, фотофобия, боль и «туман перед глазами». В конце концов могут возникнуть язвы, угрожающие зрению.
Для лечения «сухого глаза» или ослабления связанных с ним симптомов предложено много составов искусственных слез для периодической инстилляции на конъюнктиву (или в свод конъюнктивы), чтобы обеспечить замену слезной жидкости и ослабить чувство сухости в глазах. Чтобы увеличить время сохранения на поверхности роговицы, а также обеспечить хорошую переносимость, эти препараты, как правило, делаются вязкими путем добавления высокомолекулярных средств - обычно водорастворимых полимеров синтетического, полусинтетического или природного происхождения. Исходя из того, что необходимо длительное время сохранения на поверхности роговицы, искусственная слеза должна иметь свойства, близкие, насколько это возможно, к свойствам дисперсии муцина, то есть она должна вести себя в максимально возможной степени как мукомиметическое вещество, поэтому предпочтение было отдано композициям на основе макромолекулярных соединений природного происхождения, таким как производные целлюлозы (в частности, сложным эфирам целлюлозы, например, карбоксиметилцеллюлозе, и спиртовым производным эфиров целлюлозы, например, гидроксипропилметилцеллюлозе), гликозаминогликаны (в частности, гиалуроновой кислоте - полисахариду, присутствующему во многих тканях и жидкостях человека и животных, который широко используется в глазных препаратах), полисахариды, имеющие подходящие реологические свойства (например, полисахариду, экстрагированному из камеди тамаринда, TSP).
Кроме того, чтобы обеспечить необходимые смазывающие свойства поверхности роговицы, искусственные слезы всегда имеют определенную вязкость (даже если в предпочтительных растворах эта вязкость резко снижается, когда продукт подвергается напряжению сдвига, такому, которое наблюдается при моргании), что может вызвать нечеткость зрения, а также оставлять остатки на роговице или по краю век.
Учитывая вышеупомянутые проблемы, связанных с применением контактных линз, чрезвычайно важно, чтобы возможный продукт, используемый в качестве добавки к слезной жидкости, имел - помимо хорошей переносимости и отсутствия раздражающего влияния на глаз - низкую вязкость, чтобы не вызывать нечеткости зрения и не оставлять остатков на линзах и краях век. Столь же важна для такого продукта способность обеспечивать целостность эпителия роговицы и предотвращать любые отрицательные взаимодействия и/или реакции с материалом контактной линзы.
По настоящему изобретению было обнаружено, что глазные растворы, содержащие конкретные природные полисахаридные полимеры, арабиногалактаны, из которых получают составы с практически пренебрежимой вязкостью, обладают достаточной мукоадгезивностью, чтобы избежать быстрого высыхания на поверхности роговицы, и помимо хорошей переносимости обладают заметной способностью стимулировать восстановление эпителия. Фактически было продемонстрировано, что в рамках исследований, связанных с настоящим изобретением, эти композиции, введенные в глаз с поврежденным эпителием, ускоряют заживление. В результате предложены композиции, связанные с применением контактной линзы, которые способны стимулировать заживление эрозий роговицы, которые могут возникнуть, предотвращая ухудшение повреждения эпителия и любые осложнения. Как уже упоминалось, другой важной характеристикой продукта, которая делает его инновационным и идеальным для данной цели, является то, что, обладая подходящими мукоадгезивными свойствами, он не изменяет вязкость водных растворов и, следовательно, не влияет на зрение как субъектов, носящих контактные линзы, так и лиц, не использующих их. В то же время мукоадгезивные свойства позволяют продукту устанавливать различные связи со слизистой оболочкой поверхности конъюнктивы и роговицы глаза, и эти связи позволяют продукту дольше сохраняться в преокулярной области, и тем самым позволяют проявиться восстановлению эпителия и гидратирующей активности, характеризующих продукт.
Глазные растворы для использования в качестве искусственной слезы, содержащие в качестве полимера для смазывания роговицы арабиногалактан, уже описаны в патенте США № 4039662 (Hecht et al., передан Alcon Laboratories Inc.). В этом случае, однако, восстанавливающим эпителий свойствам полисахарида не придавалось большого значения, они не использовались, и, что важнее всего, его удобство в использовании было обусловлено необходимостью присутствия в составе хлорида бензалкония. Согласно описанию из этого документа, фактически, введение хлорида бензалкония - вещества, которое уже использовалось в глазных композициях как биоцид - является критически важным элементом для предложенного препарата, поскольку считается, что это соединение, объединенное с полисахаридом или образующее комплексы с полисахаридом, служит причиной стабильности продукта в адсорбированном состоянии на поверхности роговицы, то есть он выполняет функцию стабилизатора прекорнеальной пленки. В соответствии с этим наблюдением, в процитированном документе предлагаются глазные растворы, основанные на арабиногалактане и содержащие как обязательный ингредиент хлорид бензалкония.
С другой стороны, согласно исследованиям, выполненным в рамках настоящего изобретения, восстановление эпителия и защитные свойства поверхности роговицы, которые проявляют арабиногалактаны, а также мукоадгезивные свойства, придающие им длительное время сохранения в прекорнеальной пленке, даже в отсутствии любой существенной вязкости, никак не связаны с одновременным присутствием бензалкония хлорида. Поэтому из восстанавливающих эпителий композиций, содержащих арабиногалактаны по настоящему изобретению, бензалкония хлорид исключен, поскольку, если в состав композиции необходимо включить консерванты, могут использоваться многие другие продукты, пригодные для данной цели.
Как известно, арабиногалактаны представляют собой класс длинноцепочечных, плотно разветвленных полисахаридов с молекулярной массой от 10000 до 120000 дальтон, и эти полисахариды имеют центральную структуру, состоящую из цепи, построенной из единиц галактопиранозы. В природе они обнаружены в различных микробных системах, в частности у микобактерий, у которых они находятся в комплексе с пептидогликаном и микотической кислотой, образуя оболочку клетки. Богатыми источниками арабиногалактанов (главным образом в гликопротеиновой форме) служат многие съедобные и несъедобные растения. Многие растения с подтвержденными иммуностимулирующими свойствами, такие как Echinacea purpurea, Baptisia tintoria и Thuja occidentals, содержат значительные количества арабиногалактанов. Деревянистые ткани растений рода Larex особенно богаты арабиногалактанами, особенно Larex occidentalis, но также и Larex dahurica (происходящий из Средней Азии), например, Larex dicidua (европейский) и Larex leptolepis (японский). Фактически, древесина лиственницы - самый распространенный промышленный источник арабиногалактана, из этого источника данный полисахарид извлекают, чтобы использовать не только для промышленных целей, например, в косметической промышленности, но также и прежде всего в пищевой промышленности, как диетический и пищевой ингредиент, богатый клетчаткой, в напитках, а также как иммуномодулирующее средство.
Таким образом, настоящее изобретение относится к глазной композиции для применения в качестве искусственной слезы с кератопротективной и восстанавливающей эпителий активностью, содержащей от 1 до 10 мас.% арабиногалактана в водном растворе, отличающейся тем, что она не содержит хлорида бензалкония. В особенности, самые подходящие концентрации арабиногалактана для предполагаемого применения по настоящему изобретению являются концентрациями, составляющими от 3 до 5 мас.% полисахарида в водном растворе.
Согласно предпочтительным вариантам осуществления настоящего изобретения арабиногалактан, используемый в предложенных композициях, является арабиногалактаном, полученным из лиственницы и относящимся к фармацевтически приемлемой категории. В частности, арабиногалактан, предпочтительно используемый в препаратах по настоящему изобретению (арабиногалактан CAS# 9036-66-2), имеет коммерческое название FiberAid® AG и производится компанией LAREX® (Cohasset, МС, США) по патенту США № 5756098. Этот арабиногалактан находится в форме тонкого белого порошка (молекулярная масса = 45 килодальтон), диспергируемого, но не полностью растворимого в холодной воде.
Все арабиногалактаны, выделенные из лиственницы, являются полисахаридами, не содержащими азота. Одна треть молекулы построена из главной цепи, относящейся к типу (1→3)-β-D-галактопиранана, в то время как остальные состоят из боковых групп, присоединенных по положению (1→6) к каждой единице галактозы, размер которой изменяется от моносахаридов до олигосахаридов. Распределение боковых групп неоднородно. Часто боковая группа представляет собой дисахарид β-D-Galp-(1→6)-β-D-Galp или β-L-Arap-(1→3)-α-L-Araf. Менее часто присутствует мономер β-D-Galp или мономер α-L-Araf. Единицы галактозы и арабинозы находятся в молярном соотношении приблизительно 6:1.
Морфологические исследования арабиногалактана показали, что этот полимер обладает большой конформационной свободой и может принимать много различных форм, но главная цепь обычно имеет жесткую структуру тройной спирали, в то время как боковые группы образуют гибкие ветви с множеством открытых гидроксильных групп (R. Chandrasekaran, S. Janaswamy, 2002, Carbohydrate Research). Это считается причиной, лежащей в основе мукоадгезивных особенностей полимера, которые делают его способным образовывать водородные связи с молекулами муцина глаза.
В некоторых конкретных вариантах осуществления настоящего изобретения глазная композиция помимо арабиногалактана также содержит одно или более средств, регулирующих тоничность, которое придает раствору желаемое значение осмолярности. Поскольку предложенный глазной раствор может быть изотоническим или слегка гипотоническим по отношению к слезной жидкости, регулирующие тоничность средства будут присутствовать в композиции в таком количестве, чтобы обеспечить осмолярность от 150 до 300 мОсм/л. Предпочтительно упомянутое одно или более средств, регулирующих тоничность, выбрано из группы, состоящей из маннита, хлорида натрия, хлорида калия, декстрозы, борной кислоты и сорбита.
Поскольку арабиногалактан также становится стабильным в забуференных водных растворах с различным значением pH, другие ингредиенты, которые могут быть добавлены, подобно известным в области фармакологии, представляют собой одну или более офтальмологически приемлемую кислоту или основание, в качестве корректоров pH, и/или один или более буферов. В частности, подходящие буферы могут быть выбраны из группы, состоящей из фосфатного буфера, боратного буфера, цитратного буфера, бикарбонатного буфера, трисбуфера (тригидроксиметиламинометан). Кроме того, в композициях по изобретению могут с выгодой использоваться другие буферные системы.
Если продукт не упакован в единицы, содержащие одинаковые дозы, композиция также может содержать консерванты и антимикробные средства, за исключением бензалкония хлорида. Возможными консервантами, совместимыми с продуктом, в частности, являются мертиолят натрия или тимеросал, ртуть-фенил нитрат или ртуть-фенил ацетат, фенилэтиловый спирт, метил-, этил- и пропилпарабен, хлоргексидина ацетат или глюконат и хлобутанол.
Наконец, к композициям, содержащим арабиногалактаны по изобретению, при необходимости могут добавляться даже комплексообразующие средства, такие как эдетаты или ЭДТА.
Другой аспект настоящего изобретения относится к применению глазного раствора, содержащего от 1 до 10 мас.% и предпочтительно от 3 до 5 мас.% арабиногалактана в водном растворе для производства глазной композиции с кератопротективной и восстанавливающей эпителий активностью. Как уже отмечалось, из состава упомянутой глазной композиции может быть исключен бензалкония хлорид, не создавая никаких проблем.
Конкретнее глазная композиция, полученная с применением арабиногалактана согласно настоящему изобретению, является искусственной слезой, показанной людям, пользующимся контактными линзами. В некоторых конкретных вариантах осуществления упомянутая глазная композиция является искусственной слезой, показанной для лечения кератоконъюнктивальных повреждений и воспалений и, в последнем случае, может конкретнее являться глазной композицией, рекомендуемой для лечения эрозий роговицы, вызванных применением контактных линз.
Ниже посредством неограничивающих примеров представлены некоторые примеры композиций, содержащих арабиногалактан, применимых в качестве искусственной слезы с кератопротективной и восстанавливающей эпителий активностью по изобретению.
Для приготовления вышеупомянутых композиций точно взвешенный полимер диспергировали в деионизированной воде или фосфатном буфере и продолжали перемешивать до полного растворения. К полученному таким образом раствору добавляли подходящие количества других наполнителей (маннита, NaCl и/или консерванта), продолжая перемешивать до полного растворения.
Композиции, полученные таким образом, можно стерилизовать путем фильтрования через мембрану с диаметром пор 0,22 мкм.
Конкретные характеристики настоящего изобретения, а также его преимущества станут более очевидными в отношении одного из конкретных вариантов его осуществления, описанных ниже исключительно для иллюстративных целей, вместе с результатами экспериментов, выполненных на них; также приведены данные для сравнения с известным уровнем техники. Некоторые экспериментальные результаты также проиллюстрированы приложенными чертежами, где:
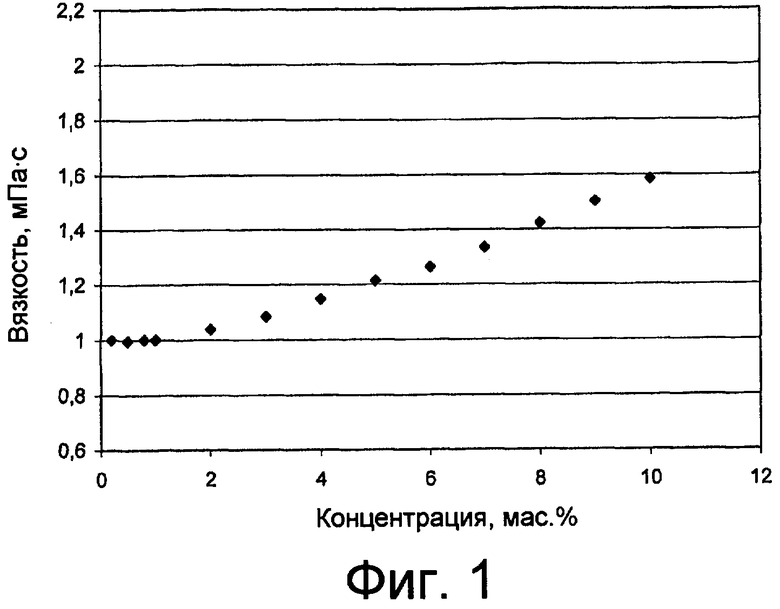
фиг. 1 показывает изменение вязкости композиций, содержащих арабиногалактан в водном растворе по настоящему изобретению, по мере того как меняется концентрация полисахарида;
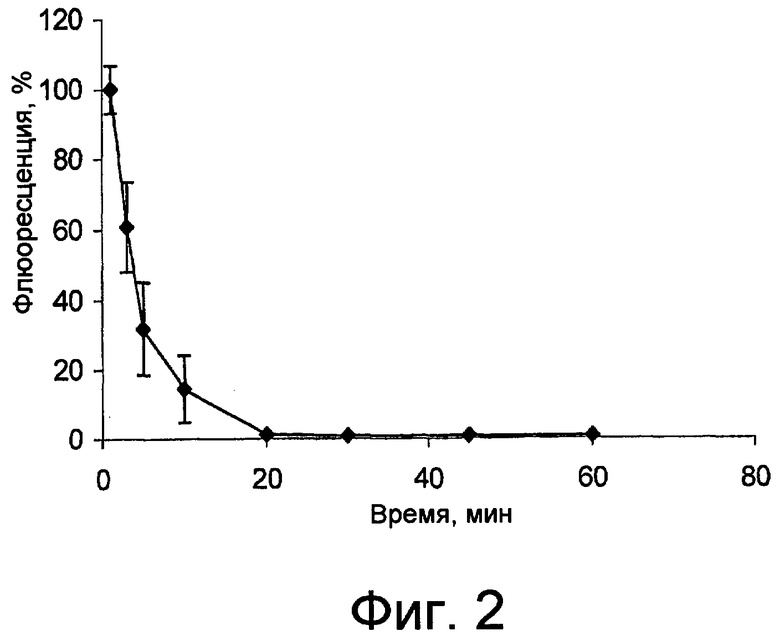
фиг. 2 показывает тенденцию времени сохранения на поверхности роговицы раствора, содержащего арабиногалактан по изобретению, причем время сохранения измерено с помощью определения флюоресцентного производного арабиногалактана;
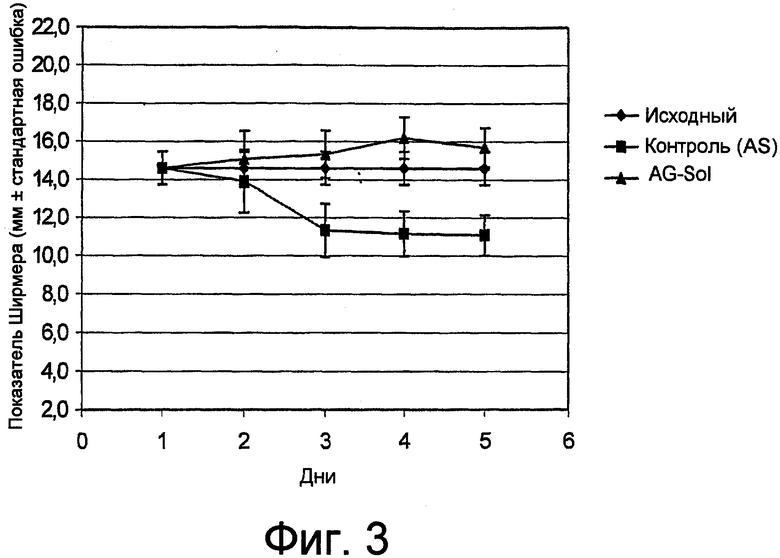
фиг. 3 показывает результаты пробы Ширмера I у кроликов, которым вводили атропина сульфат (AS), чтобы экспериментально вызвать сухость глаз; в один глаз упомянутых кроликов также вводили композицию, содержащую арабиногалактан по изобретению (AG-Sol), в качестве лечения;
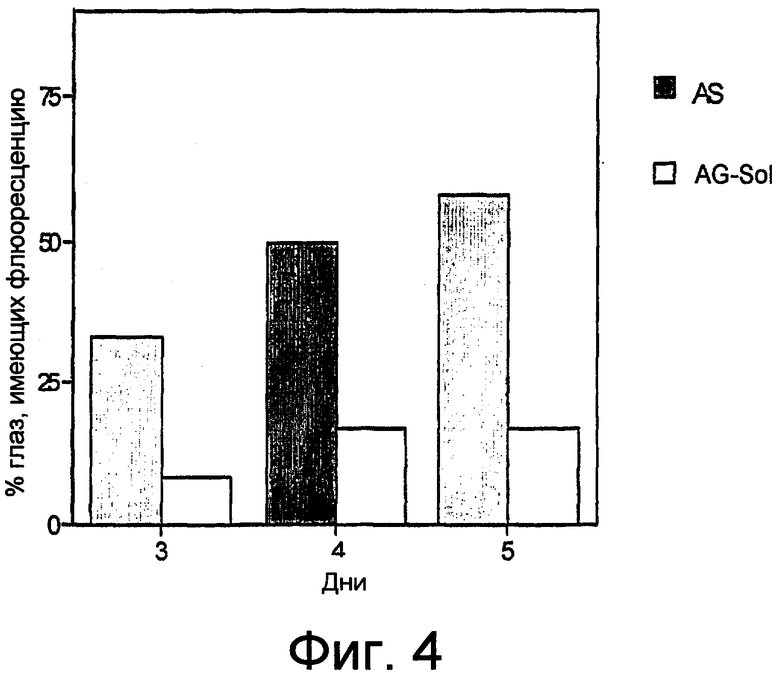
фиг. 4 показывает гистограмму результатов теста на повреждение эпителия роговицы (визуальный осмотр с использованием щелевой лампы после введения флюоресцеина) на тех же самых кроликах, что и на фиг. 3;
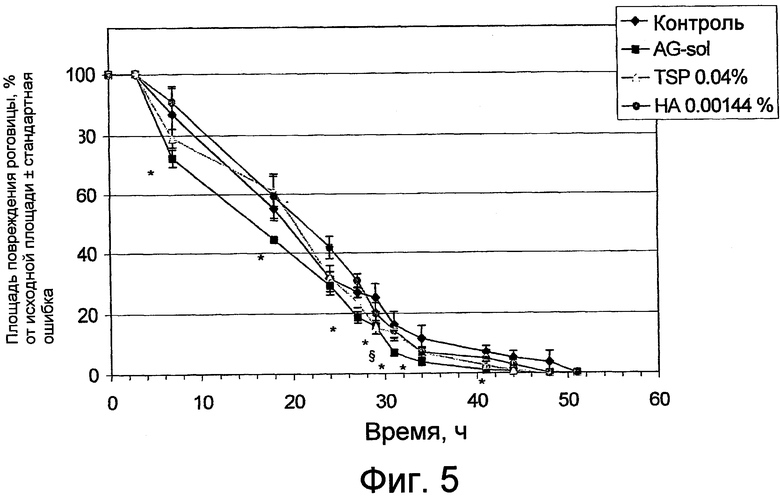
фиг. 5 графически представляет результаты теста на заживление поражения роговицы, экспериментально вызванного у кроликов, которых затем лечили композицией по изобретению (AG) или, для сравнения, сахаридом камеди тамаринда (TSP) или гиалуроновой кислотой (HA);
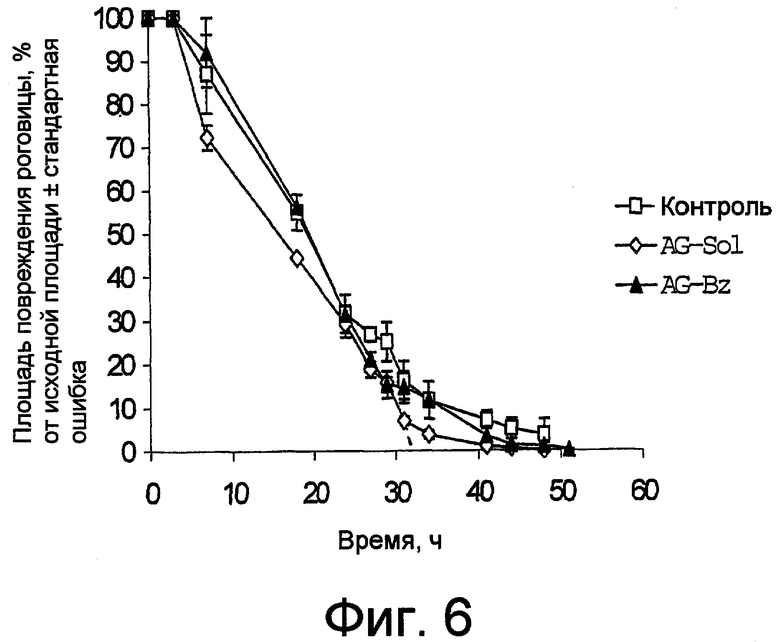
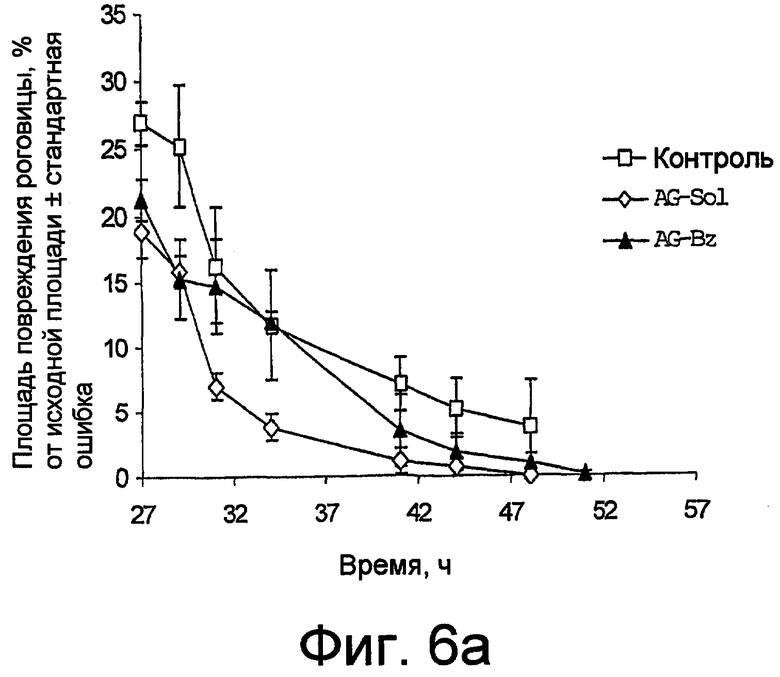
фиг. 6 и 6a графически представляют, с разной детализацией, результаты теста на заживление поражения роговицы, экспериментально вызванного как в тестах на фиг. 5, где композиция по настоящему изобретению (AG-Sol) сравнивается с подобным раствором, содержащим также бензалкония хлорид (AG-Bz); и
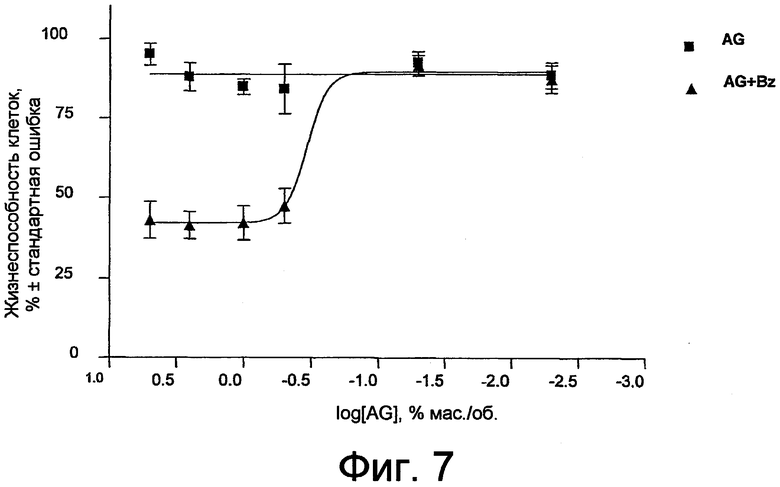
фиг. 7 показывает результаты испытаний на цитотоксичность с точки зрения жизнеспособности клеток после контакта с раствором, содержащим арабиногалактан по изобретению (AG-Sol), или с подобным раствором, содержащим также бензалкония хлорид (AG-Bz).
Испытание на вязкость
Растворы арабиногалактозы (FiberAid® AG LAREX®, Cohasset, шт. Миннесота, США), далее называемой AG, в различных концентрациях (0,2; 0,5; 0,8; 1; 2; 3; 4; 5; 6; 7; 8; 9 и 10 мас.%) подвергали испытанию на вязкость, используя ротационный вискозиметр Rheostress RS 150 (Haake) с коаксиальными цилиндрами (Z40 and Z41) при постоянной температуре 25 °C. Значения вязкости растворов представлены графически на фиг. 1 прилагаемых чертежей.
Реограммы получали для значений градиента скорости от 0 до 200 с-1 и по графикам оценивали корреляцию между усилием сдвига (τ) и градиентом скорости (γ) с помощью математической обработки, используя программное обеспечение Rheowin. Таким образом обнаружили, что растворы продукта AG имеют ньютоново реологическое поведение, и тиксотропия не присутствует.
Ньютоново поведение растворов AG вызвано тем, что они не вязкие - это желаемая особенность в случае растворов, которые вводятся в глаз человека, носящего контактные линзы; в результате жидкость проникает в пространство между линзой и роговицой, не вызывая нечеткости зрения.
Исследования мукоадгезии
1. Исследование мукоадгезии на твердой матрице
Мукоадгезивные свойства арабиногалактана по изобретению (FiberAid® AG, Larex®) оценивали, измеряя усилие, которое требуется, чтобы разделить две слизистые поверхности, между которыми помещен исследуемый образец. Слизистые поверхности состояли из водной дисперсии 25% желудочного муцина свиньи (TCI, Токио), адсорбированного на фильтровальной бумаге (Saettone et al., 1989, Int. J. Pharm., 51:203-212).
Используемое оборудование состояло из микрометрической шкалы, подвижной платформы и компьютеризированной системы, способной регистрировать усилие, необходимое, чтобы отделить две поверхности (исследуемый образец и слизистый слой), как функцию удлинения (программное обеспечение TP 5008, TiePie Engineering, Леуварден, Нидерланды).
Работу адгезии измеряли для твердых матриц, состоящих из изучаемого полисахаридного полимера, диаметром 13 мм и толщиной 1 мм, которые получали прессованием подходящего количества полимерного материала гидравлическим прессом (Perkin-Elmer) при давлении 3000 кг/см2.
Полученные результаты сравнивали с работой адгезии, измеренной с помощью твердых матриц того же размера, состоящих из полисахарида камеди тамаринда (TSP), известного из литературы как мукоадгезив, полученных тем же самым способом. Полученные результаты приведены в следующей таблице.
2. Реологическая оценка прочности адгезии муцин-полимер
Чтобы исследовать мукоадгезивные свойства арабиногалактана (AG) более подробно, применяли метод Saettone et al. (Saettone et al., 1994, Journal of Ocular Pharmacology, 10:83-92) и Hassan и Gallo (Hassan, Gallo, 1990, Pharm. Res., 7:491-495), который состоит из измерения изменений вязкости, возникающих в дисперсии муцина после добавления полимера. По этому методу компонент вязкости, обусловленный биоадгезией (ηb), рассчитывается из уравнения ηb = ηt - ηm - ηp, где ηt, ηm и ηp - коэффициенты вязкости системы, муцина и полимера соответственно. Значение ηb затем нормализовывали согласно следующему уравнению Δη/η=ηb/ηp.
После этого измеряли изменения вязкости из-за взаимодействия муцин-полимер в водных растворах, содержащих: i) 15% муцина (ηm); ii) AG и другие полимеры в соответствующих эффективных концентрациях ηp, которые использовались как стандарт; iii) смеси муцин-полимер в тех же концентрациях, которые были указаны ранее (ηt).
Использовали следующие композиции:
1. Водный раствор желудочного муцина свиньи (MGS; TCI, Токио), 15% мас./мас.;
2. Водный раствор AG, 5% мас./мас. (FiberAid® AG, LAREX®);
3. Водный раствор TSP, 0,5% мас./мас. (Farmigea, Пиза);
4. Водный раствор гиалуроновой кислоты, 0,2% мас./мас. (Chemofin, Милан);
5. Водная дисперсия муцина, 15% мас./мас., и AG, 5% мас./мас.;
6. Водная дисперсия муцина, 15% мас./мас., и TSP 0,5% мас./мас.;
7. Водная дисперсия муцина, 15% мас./мас., и гиалуроновой кислоты, 0,2% мас./мас.
Визкозиметрические измерения выполняли с помощью ротационного вискозиметра Rheo-stress RS 150 (Haake) с коаксиальными измерительными цилиндрами (Z40 и Z41) при постоянной температуре 32°C. Реограммы получали при значениях градиента скорости от 0 до 500 с-1.
Растворы полимеров демонстрировали ньютоново поведение, и полученные графики использовали, чтобы оценить линейную корреляцию между усилием сдвига (τ) и градиентами скорости (обозначенными γ или D) посредством математической обработки, выполненной с помощью программного обеспечения Rheowin.
Гиалуроновая кислота, муцин и дисперсия муцин-полимер демонстрировали псевдопластическое поведение. Математическая корреляция полученных графиков, определенная с помощью программного обеспечения Rheowin, была следующей: τ=aDb. Вязкость в ньютоновых составах и кажущуюся вязкость псевдопластических составов вычисляли, выбирая определенное значение D, и затем получали τ из соответствующих уравнений (D=200 с-1).
Значения вязкости для всех композиций приведены ниже, в таблице 2, а значения параметра Δη/η для использованных полимеров приведены в таблице 3.
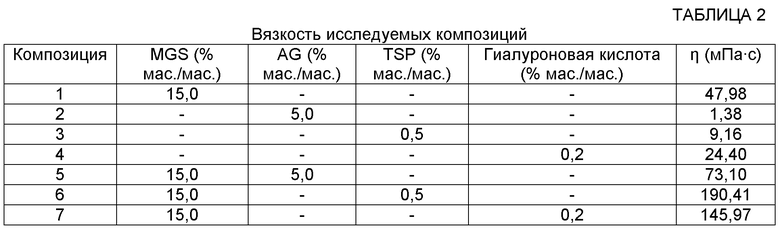
Как показывают результаты, водный раствор 5% мас./мас. AG имеет намного более низкую вязкость (1,38 мПа∙с), чем полимеры, взятые в качестве стандарта (9,16 мПа∙с и 24,40 мПа∙с для TSP и HA соответственно), хотя нормализованное значение Δη/η AG имеет ту же самую величину, что и значение TSP. Это свидетельствует о том, что AG способна к различным видам взаимодействия со слизью, покрывающей поверхность конъюнктивы и роговицы глаза. Поэтому, несмотря на то, что AG - невязкий полимер, который не вызывает нечеткости зрения и не мешает использованию контактных линз, AG устанавливает взаимодействия, позволяющие продукту длительно сохраняться в преокулярной области, и тем самым обеспечивает длительную защиту и гидратацию поверхности роговицы.
Исследования взаимодействия контактных линз с полимером
Чтобы оценить степень взаимодействия контактных линз с исследуемым полимером, получали флюоресцентное производное арабиногалактана (FITC-AG), как описано ниже.
Точно взвешенное количество арабиногалактана (FiberAid® AG, Larex®), равное 1 г, растворяли в 10 мл диметилсульфоксида, содержащего несколько капель пиридина. К этому раствору добавляли 0,1 г флюоресцеина изотиоцианата (Sigma-Aldrich, Германия), затем - 20 мг дибутилтиндилаурата (Sigma-Aldrich, Германия). Полученную таким образом смесь нагревали в течение 2 часов до 95°C. После осаждения и промывки этанолом, чтобы удалить непрореагировавшие продукты, FITC-AG отфильтровывали и сушили при 80°C (A.N. de Belder & K. Granath, 1973, Carbohydrate Research, 30:375-378).
Для исследования готовили следующие растворы в деионизированной воде:
1. 5% мас./мас. FITC-AG;
2. Флюоресцеин натрия (SF) (Sigma-Aldrich, Сент-Луис, США) 0,0223% мас./мас.
Концентрацию SF выбирали такой, чтобы он имел такую же флюоресценцию, что и 5% мас./мас. раствор FITC-AG. Для исследования использовали мягкие контактные линзы ежедневного ношения (Focus Dailies®, Ciba Vision, Германия).
Контактные линзы погружали в 1 мл искусственной слезы без белков, к которой добавляли 50 мкл 5% мас./мас. раствора FITC-AG или 0,0223% мас./мас. SF и оставляли в покое на 30 минут. Затем линзы промывали, погружая их в 100 мл искусственной слезы на 15 минут при медленном перемешивании магнитной мешалкой. После этого обработанные линзы осматривали с помощью лампы Вуда с длиной волны излучения 365 нм и сравнивали с необработанными контактными линзами в качестве стандарта.
Ни у одной линзы не было обнаружено видимых следов флюоресценции - это доказывает то, что полимер AG не удерживается на поверхности линз при использованных условиях.
Искусственная слеза имела следующий состав, выраженный в мг/100 мл деионизированной воды: MgCl2 - 4,75; CaCl2 7,97; KHCO3 - 260,00; NaCl - 754,00 (Burgalassi et al., 1999).
Тест на феномен папоротника
Самый внутренний слой слезной жидкости состоит из слизистых гликопротеинов, которые в нормальных условиях секретируются бокаловидными клетками конъюнктивы. Одной из самых важных физических особенностей этой слизи служит способность образовывать при высыхании при комнатной температуре кристаллы, напоминающие лист папоротника.
Различные аспекты кристаллизации слизи слез могут служить полезными признаками условий стабильности слезной пленки, и эти аспекты разделяют на четыре типа:
Тип I: рисунок «папоротника» однороден, между отдельными «листьями папоротника» нет промежутков. «Листья папоротника» крупные, с плотно расположенными ветвями.
Тип II: «листьев папоротника» все еще много, но отдельные «листья» более мелкие и не так широко ветвятся. Между «листьями» имеются заметные промежутки.
Тип III: феномен папоротника частичный: «листья папоротника» мелкие и слабо ветвятся; между «листьями» есть значительные промежутки.
Тип IV: феномен папоротника отсутствует, имеются нити или конгломераты, представляющие собой дегенеративный слизистый материал, смешанный со слущенными клетками.
Первые два вида феномена папоротника типичны для нормального глаза с хорошими состоянием слизистого слоя и слезной пленки. Тип III представляется переходной формой и указывает на трудность поддержания целостности и функций слизи. Тип IV указывает на выраженные изменения компонентов слезы.
Все глазные растворы, которые кристаллизуют в форме листьев папоротника, сравнимых с типами I и II, структурно подобны слизистым гликопротеинам, продуцируемым бокаловидными клетками конъюнктивы.
Таким образом, тест на феномен папоротника выполняли, чтобы оценить возможную способность AG кристаллизоваться с характеристиками, подобными таковым слизи, присутствующей на поверхности глаза. Тест состоял из высушивания при комнатной температуре (25±1 °C) в течение 24 ч на предметном стекле ранее полученной смеси, которая состояла из 10 мкл 2,5% мас./мас. раствора AG и 2 мкл искусственной слезы.
2,5%-ный раствор AG получали путем диспергирования при перемешивании подходящего количества полимера (FiberAid® AG, Larex®) в деионизированной воде. Остаток после высушивания изучали с помощью поляризационного микроскопа Reichert-Jung Microstar с 10-кратным увеличением.
В результате кристаллизации раствора AG образовывались подобные папоротнику разветвленные структуры, очень схожие со структурами, полученными из слезной жидкости человека. Полученный результат, также подтвержденный тестами на реологические взаимодействия, подкрепляет гипотезу, согласно которой исследуемый полимер совместим с гликопротеиновыми структурами глазной слизи. Следовательно, можно предполагать, что AG может заменить природный слизистый компонент при недостатке последнего из-за патологических причин.
Биологические тесты
1. Оценка времени сохранения на поверхности роговицы
В данном исследовании использовали флюоресцентное производное арабиногалактана (FITC-AG), полученное как описано выше в разделе об исследованиях взаимодействия контактных линз с полимером.
Количественное определение FITC-AG в биологических пробах было выполнено посредством флюориметрического анализа. Оборудование состояло из детектора флюоресценции Shimadzu RF-551 с подходящим программным обеспечением. Детекция происходила при длине волны возбуждения 490 нм и длине волны эмиссии 514 нм.
Тест выполняли на новозеландских кроликах-альбиносах с массой 2-2,5 кг. В нижний конъюнктивальный мешок кроликов вводили 50 мкл водной композиции 5% мас./мас. FITC-AG. Через подходящие временные интервалы после инстилляции (1, 3, 5, 10, 20, 30, 45 и 60 мин) отбирали пробы слезы (1,0 мкл) у крайней части нижнего конъюнктивального мешка посредством микрокапилляра (Microcaps, Drummond Scientific, шт. Нью-Джерси, США), избегая любого контакта с эпителием роговицы. Пробы слезы переносили в пробирки Eppendorf и затем исследовали посредством флюориметрического анализа после разбавления 50 мкл воды.
На прилагающейся фиг. 2 показано процентное ослабление флюоресценции FITC-AG в слезной жидкости с течением времени; за 100% принята флюоресценция продукта через 1 мин. Флюоресценция всегда была высокой через 10 мин после введения, уменьшалась через 20 мин и все еще поддавалась измерению через 60 мин, что указывает на длительное сохранение AG в прекорнеальной области.
2. Индукция и лечение синдрома «сухого глаза»
В данном исследовании использовали раствор арабиногалактана (FiberAid® AG, Larex®) в воде, далее называемый AG-Sol, с концентрацией AG 5% мас./мас., который был сделан путем добавления изотонически подходящего количества маннита (4,41% мас./мас.) и имел pH 6,46.
Для получения композиции AG-Sol точно взвешенный полимер диспергировали в деионизированной воде (Milli-Q, Millipore), и полученный таким образом раствор нагревали до 80 °C в течение 30 минут при перемешивании магнитной мешалкой. После охлаждения добавляли маннит.
Полученный таким образом раствор фильтровали в вытяжном шкафу с ламинарным потоком воздуха через стерильные фильтры (Minisart Sartorius) с размером пор 0,22 мкм и упаковывали в стеклянные флаконы.
Чтобы оценить влияние арабиногалактана на слезотечение, в случаях повреждения эпителия роговицы, вызванного синдромом «сухого глаза», выполняли эксперимент in vivo.
Тесты выполняли, используя новозеландских кроликов-альбиносов с массой 2-2,5 кг.
В оба глаза животных 3 раза в день (в 9:00, 13:00 и 17:00) 5 дней подряд закапывали одну каплю 1,0% водного раствора сульфата атропина (AS), чтобы уменьшить образование слезы и вызвать «сухой глаз» (S. Burgalassi et al., 1999, Ophthalm. Res., 31, 229-235). Через 5 мин после каждого введения AS в правый глаз животных инстиллировали 50 мкл композиции AG-Sol.
Животных подвергали пробе Ширмера I в день 0 (до лечения) и во 2-й, 3-й, 4-й и 5-й день после начала лечения. Тест предусматривал измерение количества секретируемой слезы один раз в день. Определение выполняли перед каждым введением растворов (AS и AG-Sol) посредством полосок фильтровальной бумаги (Alfa Intes), которые помещали в нижний свод конъюнктивы каждого глаза кролика. Степень подъема слезы вдоль полоски фильтровальной бумаги измеряли в мм. Значения, полученные для глаз, обработанных только сульфатом атропина, сравнивали с полученными для глаз, обработанных раствором арабиногалактана по изобретению.
Исходное значение секреции слезы измеряли в группе контрольных животных, которые не получали никакого фармакологического лечения.
Полученные результаты изображены графически на фиг. 3 прилагающихся чертежей. На фигуре показано, что раствор AG-Sol защищает против развития «сухого глаза».
Кроме того, в 3-й, 4-й и 5-й дни после начала лечения степень повреждения эпителия роговицы, вызванного сухим глазом, оценивали с помощью осмотра с щелевой лампой, оборудованной синим светофильтром, после окраски роговицы 10 мкл водного 1% мас./мас. раствора флюоресцеина. В случае повреждения эпителия на поверхности роговицы наблюдались флюоресцирующие области.
Полученные результаты приведены ниже, в таблице 4, как процентная доля глаз, имеющих флюоресценцию, от общего количества обработанных глаз. Те же результаты изображены в виде гистограммы на прилагающейся фиг. 4, на которой графически сравнивается процентная доля глаз, имеющих флюоресценцию после лечения раствором AG-Sol, по отношению к процентной доле глаз, имеющих флюоресценцию, у контрольных животных, которые получали только AS.
По результатам, приведенным в таблице 4 и на фиг. 4, можно заметить, что у нелеченных животных процентная доля глаз, имеющих флюоресценцию, увеличивалась день за днем и к 5-му дню достигла почти 60%, в то время как у животных, леченных раствором AG-Sol, процентная доля глаз, имеющих флюоресценцию, между 4-м и 5-м днем лечения оставалась постоянной, причем намного более низкой - примерно 17%.
3. Оценка способности к востановлению эпителия
Тест, о котором рассказывается ниже, позволяет оценить время устранения повреждения роговицы кролика после введения следующих композиций:
1. Водный раствор AG-Sol (5% AG, 4,41% маннита);
2. Полисахарид TS (TSP), 0,04% водный раствор;
3. Гиалуроновая кислота (HA), 0,00144% водный раствор.
Нужно отметить, что целью продуктов по изобретению является создание заместителей слезной жидкости, не столь вязких, как искусственная слеза из известного уровня техники, основанных на полисахаридах так, чтобы они были наиболее применимыми для людей, пользующихся контактными линзами, поэтому концентрация эталонных растворов 2) и 3), содержащих TSP и HA, была выбрана такой, чтобы создать растворы с тем же самым реологическим поведением (то есть ньютоновским) и той же вязкостью, что и раствор AG-Sol.
Тест проводили на новозеландских кроликах-альбиносах с массой 2-2,5 кг. Кроликов анестезировали внутримышечной инъекцией (0,15 мл/кг) Zoletil 100® (Laboratories Virdac, Франция), и глаз удерживали в открытом состоянии, используя блефаростат, и анестезировали его поверхность, инстиллируя 10 мкл оксибупрокаина гидрохлорида (Novesina®, MiPharm, Италия).
Чтобы вызвать поражение роговицы, бумажный микробиологический диск диаметром 6 мм, пропитанный 10 мкл н-гептанола, помещали в центральную область роговицы на 60 секунд. После удаления диска поверхность глаза тщательно промывали 1 мл физиологического раствора (Burgalassi et al., 2000, Eur. J, Ophthalmol., 10, 71-76).
В моменты времени 0 (немедленно после удаления пропитанной бумаги и промывки) и через 3, 7, 18, 24, 27, 29, 31, 34, 41, 44, 48 и 51 час после создания поражения поверхность глаза окрашивали 10 мкл водного 1% мас./мас. раствора флюоресцеина натрия, и диаметр поражения измеряли с помощью специального микрометра.
Обработанные животные получали 100 мкл исследованных растворов в поврежденный глаз 5 раз в день (в 9:00, 11:00, 13:00, 15:00 и 17:00).
В одной группе животных поражению роговицы позволяли зажить самостоятельно; эту группу использовали в качестве контрольной.
На фиг. 5 прилагающихся чертежей графически изображена тенденция заживления роговицы в группах животных в зависимости от времени. Данные представлены в виде снижения процента площади поражения, где за 100% принята площадь в момент 0. Те же данные приведены в цифровой форме в таблице 5 ниже.
По вышеупомянутой таблице, а также по фиг. 5 можно заметить, что начиная с 27 часов после введения композиций, только композиция по настоящему изобретению, AG-Sol, показывает скорость восстановления, значительно отличающуюся от контрольного значения. Фактически AG-Sol демонстрирует статистически значимые различия через 27, 29, 31, 34 и 41 час после начала лечения, а для других композиций разница становится статистически заметной только для TSP после 29 часов.
4. Оценка восстанавливающей эпителий способности в присутствии бензалкония хлорида
В тесте оценивали время заживления поражения роговицы кролика после введения следующих композиций:
1). Водный раствор AG-Sol (5% AG, 4,41% маннита).
2). Водный раствор AG-Bz (5% AG, 4,00% маннита, 0,01% хлорида бензалкония).
Тест проводили на новозеландских кроликах-альбиносах с массой 2-2,5 кг. Кроликов анестезировали внутримышечной инъекцией (0,15 мл/кг) Zoletil 100® (Laboratories Virdac, Франция), и глаз удерживали в открытом состоянии, используя блефаростат, и анестезировали поверхность, инстиллируя 10 мкл оксибупрокаина гидрохлорида (Novesina®, MiPharm, Италия).
Чтобы вызвать поражение роговицы, бумажный микробиологический диск диаметром 6 мм, пропитанный 10 мкл н-гептанола, помещали в центральную область роговицы на 60 секунд. После удаления диска поверхность глаза тщательно промывали 1 мл физиологического раствора (Burgalassi et al., 2000, Eur. J, Ophthalmol., 10, 71-76).
В момент времени 0 (немедленно после удаления пропитанной бумаги и промывки) и через 3, 7, 18, 24, 27, 29, 31, 34, 41, 44, 48 и 51 час после создания поражения поверхность глаза окрашивали 10 мкл водного 1% мас./мас. раствора флюоресцеина натрия, и диаметр поражения измеряли с помощью специального микрометра.
Обработанным животным вводили в поврежденный глаз 100 мкл исследованных растворов 5 раз в день (в 9:00, 11:00, 13:00, 15:00 и 17:00).
В одной группе животных поражению роговицы позволяли зажить самостоятельно; эту группу использовали в качестве контрольной.
На фиг. 6 и 6a с различной степенью точности графически показана тенденция заживления поражений роговицы в группах животных с течением времени. Данные представлены в виде снижения процента площади поражения, где за 100% принята площадь в момент 0.
Можно заметить, что наличие хлорида бензалкония модифицирует скорость восстановления AG, снижая ее: полное заживление у животных, которых лечили композицией AG-Bz, происходило после 51 часа, в то время как у животных, леченных AG-Sol, заживление происходило уже спустя 44 часа. Именно поэтому применение обоих продуктов в композиции, направленной на защиту роговицы, нецелесообразно.
Гистологическая оценка леченных роговиц
Чтобы оценить, привел ли процесс восстановления эпителия помимо обеспечения полного заживления экспериментально вызванных поражений также к правильному наслоению эпителиальных клеток с воссозданием природного строения роговицы, выполняли гистологическое исследование.
Биоптаты роговицы, взятые через 24 часа после создания поражения роговицы, после полного заживления (когда флюоресцеин переставал обнаруживаться на эпителии) и спустя 1 неделю после заживления, фиксировали в 10% растворе параформальдегида в 0,1 М фосфатном буфере с pH 7,4. Затем пробы подвергали нескольким промывкам буфером в течение 12 часов, обезвоживали в батарее растворов этилового спирта увеличивающейся концентрации и заливали при 4°C в специальную смолу для световой микроскопии (JB-4, Embedding kit, Polysciences Inc.). Залитую в смолу ткань разрезали микротомом и окрашивали по Нисслю, после чего подвергали микроскопии.
Через 24 часа после создания поражения становились очевидными признаки физиологического восстановительного механизма в виде перемещения и миграции прилежащих интегральных эпителиальных клеток в поврежденную область с формированием монослоя. Эпителий восстанавливал природную толщину (55-60 мкм в центральной области роговицы) и слоеное строение только после полного заживления, когда физиологический механизм слущивания клеток восстанавливался и полное покрытие минус-области и регенерация эпителиальных элементов обеспечивали восстановление нормальных структурных характеристик. Состояние оставалось неизменным через неделю после заживления - это указывает на то, что процесс регенерации завершен.
Лечение, произведенное после создания поражения роговицы, выполненное теми же продуктами, о которых сообщалось в предыдущем разделе 3, посвященном биологическим тестам, привело к уменьшению времени заживления поражения в различной степени в зависимости от используемого продукта. Это привело к предположению о различном влиянии используемых полимеров на механизм репарации. Поэтому стало необходимым исследовать фазы восстановления эпителия, чтобы выявить любые различия в морфологическом аспекте ткани.
С этой целью метод оценки восстановления эпителия (раздел 3, биологические тесты) повторили, создавая поражение и производя лечение полимерными композициями, описанными выше. Животных забивали перед полным заживлением поражения роговицы, то есть в момент, когда используемое оборудование не могло более измерять поражение, но задержка флюоресцеина на поверхности глаза все еще определялась визуально.
Биоптаты роговицы, получившей такое лечение, подвергали гистологическому исследованию (процедура была такой же, как описано выше), и в каждом случае измеряли толщину восстановленного эпителия.
Измерение каждый раз выполняли на одном и том же расстоянии от края возобновления роста, и акцент делали на различиях в толщине эпителия, преобразованного после различных воздействий. Фактически были получены следующие результаты:
- нелеченный контроль (самостоятельное заживление) - 6 мкм;
- проба, обработанная AG-Sol (5% AG, 4,41% маннита) - 18 мкм;
- проба, обработанная 0,5% раствором полисахарида TS - 18 мкм;
- проба, обработанная 0,2% раствором гиалуроновой кислоты - 12 мкм.
Эти результаты показывают, что в каждом из наблюдаемых случаев эпителий, готовый воссоздавать дефектную область, еще не имел физиологической толщины, хотя в пробах, обработанных композициями AG-Sol и полисахарида TS, толщина эпителия значительно превышала его толщину в пробах, которые были подвергнуты самостоятельному заживлению.
Наблюдение за соответствующими изображениями (не показаны) также выявило морфологические различия между пробами роговицы. Фактически существуют значительные различия в компоновке нового эпителия в четырех изученных случаях.
- Образец, полученный из контрольного глаза, демонстрирует не очень хорошо организованное строение, наслоение слабое или не выраженное.
- Эпителий, обработанный композицией AG-Sol, продемонстрировал большое сходство с природным эпителием в плане тканевой структуры.
- Проба, обработанная полисахаридом TS, содержала плохо стратифицированную новообразованную ткань, несмотря на то, что толщина этого эпителия была такой же, как толщина эпителия в пробе, обработанной AG-Sol; на деле часто обнаруживали несколько крупных клеток, намного большего размера, чем в норме.
- Наконец, лечение HA привело к дискретному наслоению нового эпителия, даже если окончательная полученная толщина была меньше.
Эти результаты заставляют прийти к заключению, что более высокая скорость заживления поражения роговицы после лечения композицией, содержащей AG, обусловлена стимуляцией регенерации эпителиальных элементов, которую вызывает этот продукт. Более высокая способность эпителиальных клеток к репликации приводит к раннему наслоению ткани, которая, таким образом, позволяет контролировать большее количество клеток, чтобы покрыть дефектную зону.
Исследования цитотоксичности
Оценивали цитотоксичность растворов, содержащих AG в отдельности или вместе с бензалкония хлоридом (Bz). Исходные растворы полимера готовили (1. 5% мас./мас. AG; 2. 5% мас./мас. AG + 0,01% мас./мас. Bz) непосредственно в модифицированной Иглзом среде Дальбекко (DMEM, Sigma Chemical Co., Сент-Луис, Миссури, США). Эти растворы затем разбавляли 1:2, 1:5, 1:10, 1:100 и 1:1000, по-прежнему используя DMEM.
Использовали клеточную линию, состоящую из эпителиальных клеток роговицы кролика (трансформированная RCE SV40, N. 95081046, ECACC, G.B). Линия RCE была создана путем заражения первичных культур эпителиальных клеток роговицы кролика рекомбинантным ретровирусом SV-40. Клетки имели типичную «мощеную» морфологию эпителия и способность к наслоению, а также развитие десмосом и микроворсинок.
Питательной средой для клеток была модифицированная Иглзом среда Дальбекко (DMEM, Sigma Chemical Co., Сент-Луис, Миссури, США) с добавкой питательной смеси Ham F12 (1:1), L-глутамина (1% об./об., 2 мМ), пенициллина (100 МЕ/мл), стептомицина (0,1 мг/мл), амфотерицина B (0,25 мкг/мл), инактивированной высокой температурой сыворотки коровьих эмбрионов (15% об./об.) (Gibco, Великобритания), инсулина (5 мкг/мл), эпидермального фактора роста (10 нг/мл) (Sigma Chemical Co., Сент-Луис, Миссури, США). Клетки росли при 37°C в насыщенной водяными парами атмосфере, содержащей 5% CО2.
Оценку степени токсичности растворов, тестируемых на клетках RCE, выполняли посредством колориметрического способа, используя имеющийся в продаже реактив для оценки пролиферации клеток WST-1 (Roche Diagnostics® S.p.A., Монца). Тест основан на расщеплении из-за активности митохондрий соли тетразолия WST-1 до растворимого окрашенного соединения (формазана). Поскольку эта трансформация может быть произведена только живыми клетками, количество полученного формазана прямо пропорционально количеству живых клеток.
Клетки RCE помещали на 96-луночные планшеты (Coming Costar® Italia, Милан) по 5·103 клеток на лунку. Через 24 часов при 90% слиянии питательную среду удаляли и заменяли исследуемым раствором (100 мкл раствора). Через 60 минут контакта (при 37 °C, в увлажненной атмосфере, содержащей 5% CО2) реакционную среду удаляли, и клетки дважды промывали DMEM F12; затем в каждую лунку добавляли 100 мкл свежей питательной среды и 10 мкл реактива WST-1. Клетки инкубировали еще 2 часа (при 37 °C, в увлажненной атмосфере, содержащей 5% CО2), и планшеты осторожно встряхивали в течение 9 секунд; спектральную поглощательную способность среды измеряли при 450 нм, используя подходящий спектрофотометр (Microtiter reader 550®, Bio-Rad Laboratories, Геркулес, Калифорния). Оптимальное время инкубации с реактивом WST-1 определили в ряде предварительных экспериментов.
Показания спектрофотометра определяли по сравнению с «холостой» лункой, содержащей только смесь питательной среды и WST-1 (100 и 10 мкл, соответственно) без клеток. Результаты выражали в виде процента спектральной поглощательной способности обработанных лунок (Abstr) по отношению к необработанным лункам (контроль, Absс), которые содержали клетки, обработанные только средой без фармацевтического продукта, по следующей формуле:
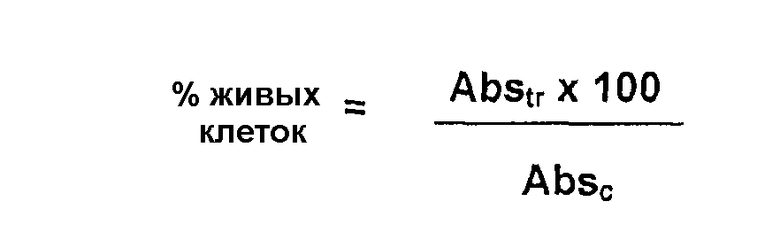
Результаты изображены графически на фиг. 7, в которой жизнеспособность клеток выражена как процент по отношению к логарифму концентрации AG, если клетки были обработаны растворами, содержащими только AG или смесь AG + Bz. Все проверенные концентрации AG не проявляли никакой цитотоксичности. Добавление Bz, прежде всего в более высоких концентрациях, вызвало увеличение токсичности. Таким образом, присутствие бензалкония хлорида приводит к существенной цитотоксичности и, кроме того, как показано в экспериментах in vivo, также снижает восстанавливающую эпителий активность AG.
Настоящее изобретение было раскрыто по отношению к некоторым конкретным вариантам осуществления, но нужно понимать, что специалист в данной области техники может произвести изменения или модификации, не отступая от объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЛАЗНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ МУКОАДГЕЗИВНЫЕ ПОЛИСАХАРИДЫ, СПОСОБНЫЕ СТИМУЛИРОВАТЬ ВОССТАНОВЛЕНИЕ ЭПИТЕЛИЯ РОГОВИЦЫ | 2013 |
|
RU2663449C2 |
| ГЛАЗНЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ПОЛИСАХАРИДА СЕМЯН ТАМАРИНДА И ГИАЛУРОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2493855C2 |
| Гелеобразная искусственная слеза с антисептическим и репаративным действием | 2018 |
|
RU2679319C1 |
| ОФТАЛЬМОЛОГИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЦИКЛОСПОРИН И ТРЕГАЛОЗУ | 2015 |
|
RU2700927C2 |
| ОФТАЛЬМОЛОГИЧЕСКОЕ УВЛАЖНЯЮЩЕЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2024 |
|
RU2839755C1 |
| Раствор для ухода за контактными линзами | 2020 |
|
RU2755298C1 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ | 2017 |
|
RU2756758C2 |
| ГЛАЗНЫЕ КАПЛИ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА СУХОГО ГЛАЗА | 2006 |
|
RU2302231C1 |
| КАПЛИ ГЛАЗНЫЕ | 2010 |
|
RU2431470C1 |
| ОФТАЛЬМОЛОГИЧЕСКИЙ ГЕЛЬ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2007 |
|
RU2340327C1 |
Группа изобретений относится к области медицины, в частности к офтальмологии. Глазная композиция для лечения кератоконъюнктивальных повреждений и воспалений содержит водный раствор, включающий от 1 до 10 мас.% арабиногалактана, один или более консервантов, выбранных из группы, состоящей из мертиолята натрия, тимеросала, ртуть-фенил нитрата или ртуть-фенил ацетата, фенилэтилового спирта, метил-, этил-, пропилпарабена, хлоргексидина ацетата или глюконата или хлорбутанола и не включающего бензалкония хлорид. Глазную композицию применяют как искусственную слезу, рекомендованную для людей, пользующихся контактными линзами. Группа изобретений обеспечивает лечение эрозий роговицы, вызванных применением контактных линз. 2 н. и 14 з.п. ф-лы, 5 табл., 7 ил.
1. Глазная композиция для лечения кератоконъюнктивальных повреждений и воспалений, содержащая:
- водный раствор, включающий от 1 до 10 мас.% арабиногалактана,
- один или более консервантов, выбранных из группы, состоящей из мертиолята натрия, тимеросала, ртуть-фенил нитрата или ртуть-фенил ацетата, фенилэтилового спирта, метил-, этил-, пропилпарабена, хлоргексидина ацетата или глюконата или хлорбутанола и не включающая бензалкония хлорида.
2. Глазная композиция по п.1, содержащая от 3 до 5 мас.% арабиногалактана в водном растворе.
3. Глазная композиция по п.1 или 2, где упомянутый арабиногалактан является арабиногалактаном лиственницы, относящимся к фармацевтически приемлемой категории.
4. Глазная композиция по п.1, дополнительно содержащая одно или более средств, регулирующих тоничность.
5. Глазная композиция по п.4, где упомянутые одно или более средств, регулирующих тоничность, присутствуют в водном растворе в таком количестве, чтобы придать раствору осмолярность от 150 до 300 мосм/л.
6. Глазная композиция по п.5, где упомянутые одно или более средств, регулирующих тоничность, выбирают из группы, состоящей из маннита, хлорида натрия, хлорида калия, декстрозы, борной кислоты и сорбита.
7. Глазная композиция по п.1, дополнительно содержащая одну и более фармацевтически приемлемую кислоту или основание в качестве корректора рН.
8. Глазная композиция по п.1, дополнительно содержащая один или более буферов.
9. Глазная композиция по п.8, где упомянутые буферы выбраны из группы, состоящей из фосфатного буфера, боратного буфера, цитратного буфера, бикарбонатного буфера, трис буфера (тригидроксиметиламинометан).
10. Глазная композиция по п.1, дополнительно содержащая одно или более комплексообразующих средств.
11. Глазная композиция по п.10, где упомянутое комплексообразующее средство представляет собой ЭДТА.
12. Применение глазной композиции для лечения кератоконъюнктивальных повреждений и воспалений, содержащей водный раствор, включающий от 1 до 10 мас.% арабиногалактана, один или более консервантов, выбранных из группы, состоящей из мертиолята натрия, тимеросала, ртуть-фенил нитрата или ртуть-фенил ацетата, фенилэтилового спирта, метил-, этил-, пропилпарабена, хлоргексидина ацетата или глюконата или хлорбутанола и не включающей бензалкония хлорида.
13. Применение по п.12, где упомянутая глазная композиция содержит от 3 до 5 мас.% арабиногалактана.
14. Применение по п.12 или 13, где упомянутая глазная композиция является искусственной слезой, рекомендованной для людей, пользующихся контактными линзами.
15. Применение по п.12, где упомянутая глазная композиция представляет собой искусственную слезу для лечения керато-конъюнктивальных поражений и воспалений.
16. Применение по п.15, где упомянутая искусственная слеза предназначена для лечения эрозий роговицы, вызванных применением контактных линз.
| US 4039662 A, 02.08.1977 | |||
| КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ И ХРАНЕНИЯ МЯГКИХ КОНТАКТНЫХ ЛИНЗ | 2004 |
|
RU2262342C1 |
| US 6552024 А, 22.04.2003 | |||
| ICHIRO ARUMA et al | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Infect Immun | |||
| ЧУЛОК С ПРИРАБОТАННЫМ БЕЗ ШВА ПУСТЫМ ОБОДКОМ (ИЛИ ОБОДКАМИ) | 1925 |
|
SU970A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2013-09-27—Публикация
2006-08-10—Подача