Область техники, к которой относится изобретение
Это изобретение имеет отношение к Tr1-клеткам и мезенхимальным стволовым клеткам. Конкретнее, это изобретение имеет отношение к применениям Tr1-клеток и мезенхимальных стволовых клеток для лечения избыточного, нарушенного или неконтролируемого ответа, опосредуемого аутологичными или неаутологичными Т-клетками, такого как аутоиммунное заболевание или воспалительное заболевание.
Уровень техники
Функция иммунной системы заключается в устранении чужеродных клеток, которые могут содержать патогены, и в то же время в поддержании иммунологической толерантности или резистентности в отношении собственных антигенов. Толерантность выражается в сокращении или анергии аутореактивных Т-клеток, последняя характеризуется тем, что Т-клетки выживают, но становятся гипореактивными. Однако в некоторых условиях иммунная система может атаковать собственные составляющие, вызывает тем самым аутоиммунное заболевание. Считается, что аутоиммунные заболевания возникают в результате нарушенного иммунного ответа на собственные антигены, как в результате изменения в иммуногенной способности собственных антигенов, так и в результате взаимодействия с кросс-реактивными миметическими антигенами.
Желательно усовершенствовать настоящие возможности лечения аутоиммунных заболеваний или других нежелательных иммунных реакций, в которых применяют обычные иммунодепрессивные средства, такие как соединения анти-TNF, кортикостероиды, азатиоприн или циклоспорин А. Эти лечебные подходы не селективны и не различают нормальный и аномальный иммунные ответы. Эти лекарственные препараты часто обладают неблагоприятными побочными эффектами, включая подавление иммунной системы в целом с высоким риском инфицирования и неоплазии, а также развития таких заболеваний, как диабет, остеопороз, лейкопения и повышенное кровяное давление. Альтернативные подходы для лечения этих состояний необходимы пациентам, которые не переносят традиционное лечение с помощью неспецифических лекарственных препаратов или не реагируют на него. Эти альтернативные подходы основаны на индукции подавления иммунного ответа и/или специфической иммунной толерантности, направленных на «заглушение» патогенного ответа на собственный антиген, при сохранении при этом интактными иммунологические защитные механизмы.
Рассмотрим альтернативные подходы с применением клеток MSC.
Мезенхимальные стволовые клетки (клетки MSC) представляют собой мультипотентные стволовые клетки, которые могут легко дифференцировать в клеточные линии, включая остеобласты, миоциты, хондроциты и адипоциты. MSC-клетки на своей поверхности экспрессируют антиген главного комплекса гистосовместимости (МНС) класса I, ограниченно, класса II и не экспрессируют способствующие проявлению эффекта молекулы В7 или CD40, следовательно, предположительно, эти клетки обладают низкой иммуногенной способностью. MSC-клетки также ингибируют пролиферативные ответы Т-клеток в МНС-независимым образом. Эти иммунологические свойства клеток MSC могут усиливать их приживление при трансплантации и ограничивать способность иммунной системы реципиента распознавать и отторгать аллогенные клетки после трансплантации.
Патентная заявка US 2002/044923 раскрывает применение клеток MSC, которые были модифицированы так, чтобы нести антиген, для лечения или ингибирования нежелательного или аномального иммунного ответа, такого как появляется при аутоиммунном заболевании. Взаимодействие антигена с Т-клеткой в отсутствии способствующего проявлению эффекта сигнала индуцирует антиген-специфическое состояние гипореактивности, или даже отсутствие реакции, или анергию, в Т-клетках на последующую стимуляцию Т-клетки антигеном.
Патентная заявка WO 2005/093044 (Pittenger et al.) описывает то, как MSC-клетки могут быть применены для лечения состояний заболеваний и нарушений, в которые вовлечена иммунная система. Pittenger et al. полагают, что 1) MSC-клетки могут стимулировать дендритные клетки (DC) с образованием интерферона-бета (IFN-β), который стимулирует подавление развития опухоли и устойчивость к вирусным инфекциям, и 2) MSC-клетки могут подавлять аутоиммунное заболевание, вызывая высвобождение интерлейкина-10 (IL-10) из регуляторных Т-клеток (Treg-клетки) и/или DC. Однако все эксперименты, приведенные в примерах, были проведены в условиях in vitro и Pittenger et al. не продемонстрировали в этой патентной заявке, что инъекция клеток MSC может эффективно лечить состояния заболевания и нарушения, связанные с иммунной системой.
Патентная заявка US 2002/085996 имеет отношение к применению клеток MSC для предупреждения, ослабления или лечения отторжения трансплантата и/или реакции трансплантата против хозяина, но ничего не сообщает об аутоиммунных состояниях.
Рассматриваются другие альтернативные подходы с применением регуляторных Т-клеток.
Несколько субпопуляций регуляторных Т-клеток (Treg-клеток) с определенными фенотипами и ясными механизмами действия теперь идентифицированы. Эти субпопуляции включают CD4+CD25+Treg-клетки, которые ингибируют иммунные ответы посредством межклеточных контактов, Th3-клетки, которые исходно секретируют TGF-β, и Trl-клетки, которые секретируют IL-10 на высоком уровне и снижают до среднего уровня TGF-β. Эти Tr1-клетки продуцируют IL-10, IL-5 и IFN-γ, вместе с TGF-β, или без него, но с небольшим количеством IL-2 или IL-4 или не продуцируют их, и плохо пролиферируют после поликлональной TCR-опосредуемой активации.
Патентные заявки US 2007/009497 и WO 2006/090291 раскрывают применение Treg-клеток CD4+CD25+ для лечения аутоиммунных и воспалительных состояний.
Патент US 6281012 раскрывает применение Т-супрессоров для снижения или ингибируют отторжения трансплантата хозяином. Эти Т-супрессоры определяют как Т-клетки, которые примируют в реакции смешанной культуры лимфоцитов путем воздействия аллоантигена, и затем культивируют с мезенхимальными стволовыми клетками. Поэтому эти Т-супрессоры включают аллогенные Tr1-клетки.
В патентной заявке WO 2006/018674 заявители раскрывают применение Tr1-клеток для лечения атеросклероза. Заявители также наблюдали на модели болезни Крона у мышей, в которой провоспалительные клетки направлены против симбиотических бактерий флоры пищеварительного тракта, что введение мышам Tr1-клеток, направленных против антигенов, доставляемых с пищей, позволяет предупредить хроническое воспаление толстой кишки.
Заявители намерены теперь обеспечить новое альтернативное лечение для усовершенствования существующих приемов лечения аутоиммунного заболевания или других нежелательных иммунных реакций. Это новое лечение по-прежнему основано на индукции подавления иммунного ответа и/или специфической иммунной толерантности, направленных на «заглушение» патогенного ответа на собственный антиген, сохраняя при этом интактными иммунологические защитные механизмы. Это новое лечение основано на применение композиции, включающей Tr1-клетки и мезенхимальные стволовые клетки. Заявители с удивлением обнаружили, что лечение с помощью композиции, включающей Tr1-клетки и мезенхимальные стволовые клетки, дает лучшие результаты, чем лечение только одними MSC-клетками или одними Tr1-клетками. Не будучи связанными теорией, заявители полагают, что эта композиция может индуцировать антиген-специфическую иммунную толерантность у субъекта для лечения избыточного, нарушенного или неконтролируемого иммунного ответа, опосредуемого аутологичными или неаутологичными Т-клетками через различные пути, такие как:
1) ингибирование пролиферативных ответов Т-клеток MSC-клетками антиген-независимым способом,
2) ингибирование пролиферативных ответов Т-клеток и индукция толерантности Т-клеток с помощью IL-10, секретируемого Tr1-клетками,
3) in vivo индукция Tr1-клеток MSC-клетками.
Раскрытие изобретения
Таким образом, настоящее изобретение имеет отношение к композиции, включающей Tr1-клетки и мезенхимальные стволовые клетки.
В воплощении изобретения указанная композиция дополнительно включает антиген, к которому Tr1-клетки специфичны.
В воплощении изобретения Tr1-клетки представляют собой клетки специфичные к антигену, в норме толерантному у здорового субъекта.
В предпочтительном воплощении изобретения указанный антиген, в норме толерантный у здорового субъекта, представляет собой аллерген, собственный антиген, пищевой антиген или антиген микроорганизмов. Предпочтительно, указанный аллерген выбирают из группы, включающей аллергены пыльцы, клещей домашней пыли, кошек или грызунов, сырость, указанный собственный антиген выбирают из группы, включающей инсулин, миелиновый белок, белки теплового шока, десмоглеины, суставные белки, их фрагменты, варианты и смеси, указанный пищевой антиген выбирают из группы, включающей овальбумин, казеин, белки сои, глиадин, их фрагменты, варианты и смеси, и указанный антиген микроорганизмов выбирают из группы, включающей Escherichia coli, Enterobacter aerogenes, Enterobacter cloacae и белки их симбиотических бактерий.
В другом воплощении изобретения указанные Tr1-клетки и MSC-клетки представляют собой аутологичные клетки.
В другом воплощении изобретения Tr1-клетки и MSC-клетки упаковывают раздельно для последовательного или совместного введения.
Настоящее изобретение также имеет отношение к лекарственному средству, включающему композицию, такую как была описана выше.
Настоящее изобретение также имеет отношение к фармацевтической композиции, включающей композицию, такую как была описана выше, в комбинации с одним или несколькими фармацевтически приемлемыми эксипиентами.
Еще одна цель изобретения представляет собой способ индуцирования антиген-специфической иммунологической толерантности у субъекта, страдающего от заболевания, в которое вовлечен избыточный, нарушенный или неконтролируемый опосредуемый аутологичными или неаутологичными Т-клетками иммунный ответ, включающий введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции, такой как была описана выше
В воплощении изобретения указанное заболевание представляет собой аутоиммунное заболевание, аллергическое заболевание или воспалительное заболевание.
В предпочтительном воплощении указанное аутоиммунное заболевание выбирают из группы, включающей гранулематоз Вегенера, первичный биллиарный цирроз, первичный склерозирующий холангит, болезнь Крона, ревматоидный артрит, множественный склероз и инсулин-резистентный диабет.
В предпочтительном воплощении указанное аллергическое заболевание выбирают из группы, включающей астму, ринит, крапивницу, атопический дерматит; фиброзирующие заболевания и пищевую аллергию.
В предпочтительном воплощении указанное воспалительное заболевание выбирают из группы, включающей ревматоидный артрит, множественный склероз, болезнь Крона.
В воплощении изобретения указанные Tr1-клетки и указанные MSC-клетки вводят совместно или последовательно.
Еще одна цель изобретения заключается в обеспечении способа стимуляции регенерации тканей у нуждающегося в этом субъекта, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения.
Еще одна цель изобретения заключается в обеспечении способа лечения фиброза у нуждающегося в этом субъекта, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения.
Еще одна цель изобретения заключается в обеспечении способа стимуляции ангиогенеза в органе или в ткани нуждающегося в этом субъекта, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции изобретения.
Осуществление изобретения
Определение
Термин «регуляторные Т-клетки» или «Т-супрессор», так как применен в этом документе, имеет отношение к популяции Т-клеток, которые ингибируют или предупреждают активацию, или в другом воплощении, эффекторное действие и пролиферацию, другого Т-лимфоцита.
Термин «Trl-клетки», так как применен в этом документе, имеет отношение к клеткам, которые имеют следующий фенотип в покое CD4+CD25-FoxP3- и способны в результате активации секретировать высокий уровень IL-10 и от низкого до умеренного уровни TGF-β. Trl-клетки частично характеризуются своим уникальным профилем цитокинов: они продуцируют высокий уровень IL-10, значительный уровень TGF-β и промежуточный уровень IFN-γ, но незначительный уровень IL-4 или IL-2, или не продуцируют их. Продукция цитокинов обычно возрастает в культурах клеток после активации поликлональными активаторами Т-лимфоцитов, такими как анти-CB3+ и анти-CD28 антитела или интерлейкин-2, РМА+иономицин. Альтернативно, продукция цитокинов возрастает в культурах клеток после активации специфическим антигеном Т-клеток, которые представлены презентирующими антиген клетками. Высокий уровень IL-10 соответствует, по меньшей мере, примерно 500 пг/мл, обычно выше, чем примерно 1, 2, 4, 6, 8, 10, 12, 14, 16, 18 или 20 тысяч пг/мл или более. Значительный уровень TGF-β соответствует, по меньшей мере, примерно 100 пг/мл, обычно выше, чем примерно 200, 300, 400, 600, 800, или 1000 пг/мл или более. Промежуточный уровень IFN-γ соответствует концентрации, равной от 0 пг/мл до, по меньшей мере, 400 пг/мл, обычно выше, чем примерно 600, 800, 1000, 1200, 1400, 1600, 1800 или 2000 пг/мл или более. Незначительный уровень IL-4 или IL-2, или отсутствие их продукции соответствует менее чем примерно 500 пг/мл, предпочтительно менее чем примерно 250, 100, 75 или 50 пг/мл, или менее.
Термин «антиген», так как применен в этом документе, имеет отношение к белку, или пептиду, связанному с определенным заболеванием, для модуляции которого применяют клетки этого изобретения, или для применения в любом из способов этого изобретения. В одном из воплощений термин "антиген" может иметь отношение к полученной синтетическим способом молекуле, или полученной из природных источников молекуле, которая обладает гомологией в последовательности с антигеном, представляющим интерес, или структурной гомологией с антигеном, представляющим интерес, или их комбинацией. В одном из воплощений антиген может представлять собой мимеотоп.
Термин «антиген специфический», так как применен в этом документе, имеет отношение к такому свойству популяции клеток, что запас определенного антигена, или фрагмента этого антигена, приводит в одном из воплощений к специфической пролиферации регуляторных Т-клеток, если антиген представлен применительно к МНС. В другом воплощении запас антигена, или его фрагмента, приводит к продукции IL-10 регуляторными Т-клетками. В одном из воплощений популяция регуляторных Т-клеток экспрессирует моноклональный рецептор Т-клеток. В другом воплощении популяция регуляторных Т-клеток экспрессирует поликлональные рецепторы Т-клеток.
Термин «собственный антиген», так как применен в этом документе, имеет отношение к антигену, который в норме экспрессируется в организме субъекта. В одном из воплощений собственный антиген имеет отношение к антигену, который при экспрессии в организме, может приводить к коммитированию аутореактивных Т-клеток. В одном из воплощений собственный антиген экспрессируется в органе, который представляет собой мишень аутоиммунного заболевания. В одном из воплощений собственный антиген экспрессируется в поджелудочной железе, щитовидной железе, соединительной ткани, почках, легких, печени, пищеварительной системе или нервной системе. В другом воплощении собственный антиген экспрессируется на β-клетках поджелудочной железы.
Термин «антиген, в норме толерантный у здорового субъекта» имеет отношение ко всем аутологичным или неаутологичным молекулам или составляющим системы, которые не индуцируют провоспалительный ответ у здоровых субъектов. Эти лишенные иммуногенных свойств антигены могут быть аутологичным антигенами, антигенами, полученными с пищей, антигенами, полученными при дыхании, антигенами бактериальной флоры или контактными антигенами.
Термин «субъект», так как применен в этом документе, имеет отношение к млекопитающему, в особенности, к человеку.
Термин «эффективное количество», так как применен в этом документе, имеет отношение к количеству, достаточному для того, чтобы вызвать положительный или желаемый клинический результат (например, улучшение в клинических условиях).
Термин «подвергать лечению» или «лечение», так как применен в этом документе, обычно имеет отношение к клиническому вмешательству с целью изменить природное течение процесса у индивидуума или в клетке, подвергаемых лечению, и может быть проведено как в целях профилактики, так и в процессе развития клинической патологии. Желаемые эффекты включают, но не ограничиваются, предупреждение возникновения или рецидивов заболевания, смягчения симптомов, подавление, снижение или торможение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, снижение скорости прогрессирования заболевания, улучшение или временное ослабление состояния заболевания, и приведение к состоянию ремиссии или улучшенный прогноз.
Термин «аутоиммунное заболевание», так как применен в этом документе, имеет отношение к иммунному ответу, направленному против собственного антигена.
Термин «состояние воспаления» или «воспалительное нарушение», так как применен в этом документе, имеет отношение к любому нарушению, которое, в одном из воплощений, вызывается "воспалительным ответом", также определяют, в другом воплощении, как "воспаление" или, в другом воплощении, симптомы которого включают воспаление. Например, воспалительное нарушение, вызываемое воспалением, может представлять собой септический шок, и воспалительное нарушение, симптомы которого включают воспаление, может быть ревматоидным артритом.
Термин "аллергическое ответ", так как применен в этом документе, имеет отношение к атаке иммунной системы против обычно безопасного, нетоксичного антигена или аллергена. В одном из воплощений аллергии могут включать, но не ограничиваться, аллергию на пыльцу, астму, атопический дерматит, а также аллергии на сумах ядовитый, клещей домашней пыли, пчелиный яд, орехи, моллюсков, пенициллин или другие лекарственные средства, или любое другое соединение или любые другие соединения, которые вызывают аллергический ответ.
Настоящее изобретение
Настоящее изобретение имеет отношение к композиции, включающей Trl-клетки и мезенхимальные стволовые клетки (MSC).
В одном из воплощений изобретения MSC-клетки могут быть получены путем забора ткани, содержащей MSC-клетки, выделения и размножения указанных MSC-клеток.
Полученные MSC-клетки могут представлять собой гомогенную популяцию или могут представлять собой смешанную популяцию клеток, обогащенную MSC-клетками. Гомогенные MSC-клетки могут быть получены путем культивирования костномозговых адгезивных клеток или клеток надкостницы, или стромально-васкулярной фракции жировой ткани, и MSC-клетки могут быть идентифицированы с помощью специфических маркеров клеточной поверхности. Гомогенные композиции MSC получают с помощью положительного отбора костномозговых адгезивных клеток, клеток стромально-васкулярной фракции жировой ткани или клеток надкостницы, которые свободны от маркеров, связанных как с гемопоэтическими клетками, так и с дифференцированными мезенхимальными клетками. Эти изолированные популяции мезенхимальных клеток, проявляющие характеристики эпитопов, связанные только с мезенхимальными стволовыми клетками, обладают способностью к регенерации в культуре без дифференцирования, и обладают способностью дифференцировать в специфические мезенхимальные линии, как при индукции in vitro или при помещении in vivo на участок поврежденной ткани. Для того чтобы получить мезенхимальные стволовые клетки определенного человека, необходимо изолировать редкие плюрипотентные мезенхимальные стволовые клетки от других клеток в костном мозге или в другом источнике MSC. Клетки костного мозга могут быть получены из подвздошного гребня, бедренных костей, болынеберцовой кости, позвоночника, ребра или других пространств, заключающих костный мозг. Другие источники мезенхимальных стволовых клеток человека включают эмбриональный желточный мешок, плаценту, пуповину, кожу эмбрионов и подростков, кровь и жировую ткань.
Включенный в этот документ путем отсылки способ получения популяции клеток, обогащенных MSC-клетками, описан, например, в патенте US 5486359.
В одном из воплощений изобретения, Tr1-клетки могут быть получены путем
a) изолирования из субъекта популяции клеток-предшественников,
b) получения популяции дендритных клеток с помощью культивирования указанной популяции клеток-предшественников в присутствии IL-10,
c) взаимодействие клеток стадии b) с популяцией CD4+Т-лимфоцитов, изолированной из указанного субъекта в присутствии антигена для того, чтобы позволить дифференциацию указанных CD4+Т-клеток в популяцию Tr1-клеток, и
d) извлечение популяции Tr1-клеток со стадии с).
На стадии b), IL-10 присутствует в концентрации, равной от 50 до 250 Ед./мл, предпочтительно, в концентрации, равной 100 Ед./мл в культуральной среде. Указанный способ получения Tr1-клеток описан в работе Wakkach et al (Immunity 2003 May; 18 (5): 605-17), включенной в настоящий документ путем отсылки.
Указанный способ также может быть выполнен с применением дексаметазона, витамина D3 или толерогенированных или незрелых клеток DC вместо клеток DC стадии b).
В другом воплощении настоящего изобретения Tr1-клетки могут быть получены путем:
a) культивирования популяции CD4+Т-клеток, изолированных из субъекта, в среде с подходящим количеством IFN-α, и
b) извлечение популяции Tr1-клеток.
IFN-α предпочтительно присутствует в среде в концентрации, равной 5 нг/мл. На стадии а), среда может дополнительно включать подходящее количество IL-10, предпочтительно в концентрации, равной 100 Ед./мл.
На стадии b), популяцию Tr1-клеток культивируют в среде, включающей IL-15, для того, чтобы позволить пролиферацию, концентрация IL-15 в среде предпочтительно равна 5 нг/мл. Включенный в настоящий документ путем отсылки указанный способ получения Tr1-клеток описан в патенте US 6746670.
В еще одном воплощении изобретения Tr1-клетки могут быть получены путем:
a) in vitro активации популяции CD4+Т-клеток в присутствии антигена, представленного клетками, презентирующими искусственный антиген, и
b) извлечение активированных CD4+Т-клеток, включающих, по меньшей мере, 10% Tr1-клеток.
Предпочтительно, клетки, презентирующие искусственный антиген, экспрессируют молекулу HLA-II системы и LFA-3-молекулу человека и не экспрессируют молекулы для совместной стимуляции В7-1, В7-2, В7-Н1, CD40, CD23 и ICAM-1.
Указанный способ получения Tr1-клеток, включенный в настоящий документ путем отсылки, описан в патентной заявке WO 02/.92793.
В еще одном воплощении изобретения, Tr1-клетки могут быть получены путем:
a) in vitro активации популяции CD4+Т-клеток в присутствии антигена и подходящего количества IL-10; и
b) извлечения популяции Trl-клеток.
Предпочтительно, IL-10 присутствует в среде в концентрации, равной 100 Ед./мл. Указанный способ описан в работе Groux et al. (Nature 1997, 389 (6652): 737-42), включенной в настоящий документ путем отсылки.
В еще одном воплощении изобретения антиген-специфические Trl-клетки могут быть получены путем:
a) стимуляции популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) антигеном,
b) извлечения антиген-специфической популяция Trl-клеток из стимулированной популяции,
c) необязательно, размножения указанной антиген-специфической популяции Tr1-клеток.
Термин лейкоциты охватывает несколько типов клеток, которые характеризуются своей значимостью, своим распределением, своим числом, своим временим жизни и своими потенциальными возможностями. Это следующие типы: многоядерные или гранулярные лейкоциты, среди которых отмечают эозинофильные, нейтрофильные и базофильные лейкоциты, и мононуклеарные клетки, или мононуклеарной клетки периферической крови (РВМС), которые представляют собой крупные белые клетки и состоят из клеток иммунной системы (лимфоцитов и моноцитов). Лейкоциты или клетки РВМС могут быть выделены из периферической крови с помощью любого из способов, известных специалистам в этой области техники. Для отделения клеток РВМС удобно применять центрифугирование, предпочтительно центрифугирование в градиенте плотности, предпочтительно центрифугирование в ступенчатом градиенте плотности. Альтернативно можно применить специфические моноклональные антитела. В некоторых воплощениях РВМС обычно изолируют из цельной крови посредством Ficoll-Hypaque, применяя стандартные процедуры. В других воплощениях клетки РВМС извлекают с помощью лейкафереза.
Указанный способ, включенный в настоящий документ путем отсылки, описан в патентной заявке WO 2007/010406.
В еще одном воплощении Tr1-клетки могут быть получены путем:
a) культивирования популяции лейкоцитов или популяции мононуклеарных клеток периферической крови (РВМС) с мезенхимальными стволовыми клетками в присутствии антигена,
b) извлечения популяции Tr1-клеток.
Указанный способ также может быть осуществлен с необученными Т-клетками или Т-клетками памяти, вместо клеток РВМС или лейкоцитов.
Популяция Tr1-клеток, полученная таким способом, может дополнительно быть увеличена путем культивирования в присутствии цитокинов, таких как интерлейкин-2 и интерлейкин-4. Альтернативно, интерлейкин-15 и интерлейкин-13 также могут быть применены для размножения культур Tr1-клеток.
В еще одном воплощении, Tr1-клетки могут быть получены путем:
a) культивирования Т-клеток CD4+ с дендритными клетками предварительно обработанными дексаметазоном (примерно 10-7 М) и выбранным антигеном,
b) извлечения популяции Tr1-клеток через одну неделю после начала культивирования.
В способах, описанных выше, Tr1-клетки могут быть охарактеризованы с помощью способа идентификации, описанного в патентной заявке WO 2005/000344. Указанный способ идентификации Tr1-клеток основан на определении одновременного присутствия продуктов экспрессии генов, кодирующих молекулу CD4 и молекулы из группы, включающей CD18 и/или CD11a и CD49b. Tr1-клетки могут быть идентифицированы и/или очищены с помощью метода Elisa, способами проточной цитометрии или иммуноаффинной очистки, применяя антитела к указанным маркерам.
Tr1-клетки также могут быть обогащены с помощью положительного отбора или негативного отбора с помощью проточной цитометрии или магнитных микроносителей. Такие способы, включенные в настоящий документ путем отсылки, также описаны в патентной заявке WO 2005/000344.
В другом воплощении изобретения, указанная композиция, включающая Tr1-клетки и MSC-клетки, может быть получена путем совместного культивирования MSC-клетки с аутологичными Т-клетками в течение одной-двух недель.
В предпочтительном воплощении изобретения композиция, включающая указанный Tr1-клетки и указанные MSC-клетки, дополнительно включает антиген, для которого Tr1-клетки представляют собой специфические клетки.
В одном из воплощений изобретения антиген, для которого Tr1-клетки представляют собой специфические клетки, может быть введен отдельно от композиции изобретения, например пищевой антиген может быть введен субъекту с пищей. В другом воплощении, антиген, для которого Tr1-клетки представляют собой специфические клетки, добавляют в композицию изобретения.
В предпочтительном воплощении изобретения указанный антиген, для которого Tr1-клетки представляют собой специфические клетки, представляет собой антиген в норме толерантный у здорового субъекта.
В одном из воплощений изобретения указанный антиген в норме толерантный у здорового субъекта представляет собой аллерген. Список аллергеном может быть найден на сайте http://www.allergen.org/.
В предпочтительном воплощении указанный аллерген выбирают из группы, в которую входят цветочная пыльца, клещи домашней пыли, аллергены кошачьих или грызунов, сырость.
В другом воплощении изобретения указанный антиген в норме толерантный у здорового субъекта представляет собой пищевой антиген.
Термин "пищевой антиген" имеет отношение к иммуногенному пептиду, который получают из пищевых продуктов, таких как пищевые антигены, перечисленные в следующем неограниченном списке: бычьи антигены, такие как липокалин, Са-связывающий SlOO, альфа-лактальбумин, бета-лактоглобулин, бычий сывороточный альбумин, иммуноглобулин или казенны. Пищевыми антигенами также могут быть антигенами атлантического лосося, такими как парвальбумин, куриными антигенами, такими как овомукоид, овальбумин, Ag22, кональбумин, лизоцим или сывороточный альбумин цыплят, земляных орехов, антигенами моллюсков, такими как тропомицин, антигенами пшеницы, такими как агглютинин или омега-5-глиадин, антигенами сельдерея, такими как профилин сельдерея, антигенами моркови, такими как профилин моркови, антигенами яблока, такими как тауматин, липид-переносящий белок яблок, профилин яблок, антигенами груш, такими профилин груш, изофлавон-редуктаза, антигенами авокадо, такими как эндохитиназа, антигенами абрикоса, такими как липид-переносящий белок абрикоса, антигенами персика, такими как липид-переносящий белок персика или профилин персика, антигенами соевых бобов, такими как HPS, профилин соевых бобов или (SAM22) PR-10 prot.
В другом воплощении изобретения указанный антиген, в норме толерантный у здорового субъекта, представляет собой собственный антиген.
Термин "собственный антиген" имеет отношение к иммуногенному пептиду, полученному из белка указанного индивидуума. Он может представлять собой, например, аутоантиген, перечисленный в следующем неограничивающем списке: рецептор ацетилхолина, актин, транслокатор адениновых нуклеотидов, β-адренорецептор, декарбоксилаза ароматических L-аминокислот, рецептор асиалогликопротеина, бактерицидный/увеличивающий проницаемость протеин (BPi), кальций-распознающий рецептор, фермент, расщепляющий боковую цепь холестерина, Оу-цепь коллагена IV-го типа, цитохром Р450 2D6, десмин, десмоглеин-1, десмоглеин-3, F-актин, GM-ганглиозиды, глутаматдекарбоксилаза, глутаматный рецептор, Н/K АТРаза, 17-[альфа]-гидроксилаза, 21-гидроксилаза, IA-2 (ICAS 12), инсулин, инсулиновый рецептор, внутренний фактор типа 1, функциональный антиген 1 лейкоцитов, ассоциированный с миелином гликопротеин, основной белок миелина, белок миелина олигодендроцитов, миозин, Р80-коилин, пируватдегидрогеназный комплекс Е2 (PDC-E2), натрий-йодидный симпортер, SOX-10, общий белок мышц глаза и щитовидной железы, тиреоглобулин, тиреоидная пероксидаза, тиротропиновый рецептор, тканевая трансглютаминаза, коактиватор транскрипции р75, триптофановая гидроксилаза, тирозиназа, тирозингидроксилаза, АСТН, аминоацил-tPvNA-гистидилсинтететаза, кардиолипин, карбоангидраза II, белки, ассоциированные с центромерой, DNA-зависимая стимулируемая нуклеосомами АТРаза, фибрилларин, фибронектин, глюкозо-6-фосфат изомераза, бета-2-гликопротеин I, голджин (95, 97, 160, 180), белки теплового шока, гемидесмосомальный протеин 180, гистон Н2А, Н2В, кератин, IgE-рецептор, Ku-DNA протеинкиназа, Ku-нуклеопротеин, La-фосфопротеин, миелопероксидаза, протеиназа 3, RNA полимераза I-III, белок, распознающий сигнал, топоизомераза I, тубулин, вименсин, ассоциированный с миелином основной белок олигодендроцитов (МОВР), протеолипидный белок, специфический белок олигодендроцитов (OSP/клаудин 11), фосфодиэстераза циклических 3′-нуклеотидов (СNРаза), BP антиген 1 (BPAGl-e), трансальдолаза (TAL), митохондриальные аутоантигены человека PDC-E2 (Novo 1 и 2), OGDC-E2 (Novo 3) и BCOADC-E2 (Novo 4), буллезный пемфигоид (ВР)180, ламинин 5 (LN5), белок DEAD-box 48 (DDX48) или антиген-2, ассоциированный с инсулиномой.
Предпочтительно, пищевой или собственный антиген представляет собой рекомбинантный или синтезированный антиген.
Предпочтительно, антиген представляет собой пищевой антиген, который выбирают из группы, включающей овальбумин, казеин, белки сои, глиадин, белки земляных орехов, их фрагменты, варианты и смеси.
Предпочтительно, антиген представляет собой собственный антиген, который выбирают из группы, включающей инсулин, миелиновый белок, белки теплового шока, десмоглеины, белки суставов, протеиназы 3, их фрагменты, варианты и смеси.
Термин "вариант" пищевого или аутоантигена в этом документе обозначает антиген, который почти полностью идентичен природному антигену и который обладает той же биологической активностью. Минимальное различие между природными антигенами и их вариантом может заключаться, например, в аминокислотной замене, делеции и/или вставке. Такие варианты могут содержать, например, консервативные аминокислотные замены, при которых аминокислотные остатки замещены на такие аминокислотные остатки, которые имеют похожую боковую цепь. Семейства аминокислотных остатков, которые имеют похожие боковые цепи, определены в этой области техники, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
В одном из воплощений изобретения, указанный антиген в норме толерантный у здорового субъекта представляет собой антиген микроорганизмов.
Антиген микроорганизмов включает, но не ограничивается, антигеном, происходящим из микроорганизма, такого как бактерия, архебактерия, гриб, вирус, простейшее, паразит, водоросль, миксомицет или прион.
Примеры указанных микроорганизмов представляют собой Streptococcus pneumoniae, Staphylococcusaureus, Clostridium difficile, Haemophilus influenza, Pseudomonas aeruginosa, Neisseria meningitidis, Escherichia coli, Helicobacter pylori, Moraxella catarrhalis, Mycobacteria, Salmonella, Vibrio, Streptomyces, Helicobacter, Lactococcus и Listeria.
Предпочтительно, антиген представляет собой антиген микроорганизмов, который выбирают из группы, включающей Escherichia coli, Enterobacter aerogenes, Enterobacter cloacae и белки из симбиотических бактерий.
В предпочтительном воплощении изобретения указанные Tr1-клетки и MSC-клетки представляют собой аутологичные клетки.
Это означает, что MSC-клетки и Tr1-клетки или их предшественников получают из того же самого субъекта и предполагают вводить тому же самому субъекту, от которого они были получены.
Клетки MSC и Tr1-клетки, будучи аутологичными, во-первых, позволяют проводить долговременное приживление: не будет ни отторжения клеток и ни аллогенных ответов. Во-вторых, в случае если необходима презентация антигена MSC-клетками, аутологичность делает это возможным.
Настоящее изобретение также имеет отношение к композиции, такой как была описана выше, в которой Tr1-клетки и MSC-клетки упаковывают отдельно последовательного или совместного введения.
Под последовательным введением следует понимать, что MSC-клетки могут быть сначала введены с помощью инъекции, а затем с помощью инъекции буду введены Tr1-клетки, предпочтительно через 24-48 часов после инъекции MSC-клеток.
Настоящее изобретение также имеет отношение к лекарственному средству, включающему описанную выше композицию.
Настоящее изобретение также имеет отношение к фармацевтической композиции, включающей композицию, такую как была описана выше, в комбинации с одним или несколькими фармацевтически приемлемыми эксипиентами.
Еще одна цель настоящего изобретения заключается в обеспечении способа индуцирования антиген-специфической иммунологической толерантности у субъекта, страдающего заболеванием, в которое вовлечен избыточный, нарушенный или неконтролируемый иммунный ответ, опосредуемый аутологичными или неаутологичными Т-клетками, включающий введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции, такой как была описана выше.
Подходящие носители и разбавители включают изотонические солевые растворы, например, солевые растворы на основе фосфатного буфера. Композиция может быть составлена для парентерального, внутримышечного, внутривенного, внутрибрюшинного введения, инъекции, интраназальной ингаляции, легочной ингаляции, внутрикожного, внутрисуставного, интратекального введения или введения через пищеварительный тракт.
Лекарственное средство или фармацевтические композиции изобретения обычно вводят пациенту с помощью внутримышечной, внутрибрюшинной или внутривенной инъекции, или с помощью прямой инъекции в лимфатические узлы пациента, предпочтительно с помощью внутривенной инъекции.
Обычно субъекту вводят от 104/кг до 109/кг клеток, предпочтительно, от 105/кг до 107/кг клетки и более предпочтительно, примерно 106/кг клеток.
Пути введения и описанные дозы предназначены только для общего руководства, поскольку квалифицированный практик легко способен определить оптимальный путь введения и дозировку для любого определенного субъекта, в зависимости, например, от возраста, веса и состояния пациента.
В предпочтительном воплощении, указанное заболевание, в которое вовлечен избыточный, нарушенный или неконтролируемый иммунный ответ, опосредуемый аутологичными или неаутологичными Т-клетками, представляет собой аутоиммунное заболевание, аллергическое заболевание или воспалительное заболевание.
Аутоиммунные заболевания включают, но не ограничиваются, диабет, множественный склероз и ревматоидный артрит.Конкретные состояния, связанные с аутоиммунными заболеваниями, которые могут быть подвергнуты лечению, включают: аутоиммунный тиреоидит (тиреоидит Хошимото), гипертиреоз при сахарном диабете типа I (болезнь Грейвса), инсулин-толерантный диабет, аутоиммунную недостаточность коры надпочечников (болезнь Аддисона), аутоиммунный оофорит, аутоиммунный орхит, аутоиммунный гемолитическая анемия, пароксизмальную холодовую гемоглобинурию, аутоиммунную тромбоцитопению, аутоиммунную нейтропению, злокачественную анемию, истинную эритроцитарную анемию, аутоиммунные коагулопатии, миатению гравис, аутоиммунный полиневрит, множественный склероз, пемфигус и другие буллезные заболевания, ревматический кардит, синдром Гудпасчера, посткардиотомический синдром, системную красную волчанку, ревматоидный артрит, синдром Серджена, полимиозит, дерматомиозит, склеродермию; воспалительные заболевания кишечника: болезнь Крона, язвенный колит; хронические обструктивные заболевания легких; хронические воспалительные заболевания, глютеновую энтеропатию, гранулематоз Вегенера, первичный биллиарный цирроз, первичный склерозирующий холангит, аутоиммунный гепатит, спондилоартрит.
Предпочтительно, указанное аутоиммунное заболевание выбирают в группе, включающей гранулематоз Вегенера, первичный биллиарный цирроз, первичный склерозирующий холангит, болезнь Крона, ревматоидный артрит, множественный склероз и инсулин-толерантный диабет.
Аллергические заболевания включают, но не ограничиваются, астму, ринит, крапивницу, атопический дерматит; фиброзирующие заболевания и пищевую аллергию.
Воспалительные нарушения включают, но не ограничиваются, сердечнососудистые заболевания, ревматоидный артрит, множественный склероз, болезнь Крона, воспалительные заболевания кишечника, красную системную волчанку, полимиозит, септический шок, реакцию «трансплантат против хозяина», реакцию «хозяина против трансплантата», астму, ринит, псориаз, кахексию, связанную с раком, или экзему.
Предпочтительно, указанное воспалительное заболевание выбирают в группе, включающей ревматоидный артрит, множественный склероз, болезнь Крона.
В одном из воплощений способа изобретения, указанный антиген, лишенный иммуногенных свойств, специфической Tr1-клетки и указанные MSC-клетки вводят совместно или последовательно.
Под последовательным введением следует понимать, что сначала с помощью инъекции могут быть введены MSC-клетки, а затем с помощью инъекции могут быть введены Tr1-клетки, предпочтительно через 24-48 часов после инъекции MSC-клеток.
В другом воплощении способа изобретения, лекарственное средство или фармацевтическая композиция этого изобретения может быть введена в комбинации с традиционными терапиями, или в другом воплощении, со сниженными дозами таких традиционных терапий, например, способ этого изобретения может сопровождаться введением иммуносупрессантов, дозировку иммуносупрессанта или число иммуносупрессантов снижают.
Еще одна цель настоящего изобретения заключается в обеспечении способа стимуляции регенерации тканей у субъекта, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиций, такой как была описана выше.
Примеры тканей, подвергаемых лечению, включают, но не ограничиваются, мышцы, кость и восстановление хряща.
Подходящие носители и разбавители включают изотонические солевые растворы, например, солевые растворы на основе фосфатного буфера. Композиция может быть составлена для парентерального, внутримышечного, внутривенного, внутрибрюшинного введения, инъекции, интраназальной ингаляции, легочной ингаляции, внутрикожного, внутрисуставного, интратекального введения или введения через пищеварительный тракт (например, через пейеровы бляшки). Предпочтительно, лекарственное средство или фармацевтическая композиция изобретения могут быть введены непосредственно в дегенерирующую ткань.
Обычно субъекту вводят от 104/кг до 109/кг клеток, предпочтительно, от 105/кг до 107/кг клеток и более предпочтительно, примерно 106/кг клеток.
Пути введения и описанные дозы предназначены только для общего руководства, поскольку квалифицированный практик легко способен определить оптимальный путь введения и дозировку для любого определенного субъекта, в зависимости, например, от возраста, веса и состояния пациента, и размера и тяжести раны, подвергаемой лечению.
Еще одна цель настоящего изобретения заключается в обеспечении способа лечения фиброза у субъекта, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции, такой как была описана выше.
Примеры фиброза, подвергаемого лечению, включают, но не ограничиваются, цирроз печени, фиброз почек, связанный с заболеванием почек на последней стадии, и фиброза легкого.
Подходящие носители и разбавители включают изотонические солевые растворы, например, солевые растворы на основе фосфатного буфера. Композиция может быть составлена для парентерального, внутримышечного, внутривенного, внутрибрюшинного введения, инъекции, интраназальной ингаляции, легочной ингаляции, внутрикожного, внутрисуставного, интратекального введения или введения через пищеварительный тракт.
Лекарственное средство или фармацевтическую композицию изобретения обычно вводят пациенту с помощью внутримышечной, внутрибрюшинной или внутривенной инъекции, или с помощью прямой инъекции в лимфатические узлы пациента, предпочтительно с помощью прямой внутривенной инъекции.
Обычно субъекту вводят от 104/кг до 109/кг клеток, предпочтительно от 105/кг до 107/кг клеток и более предпочтительно примерно 106/кг клеток.
Пути введения и описанные дозы предназначены только для общего руководства, поскольку квалифицированный практик легко способен определить оптимальный путь введения и дозировку для любого определенного субъекта, в зависимости, например, от возраста, веса и состояния субъекта, и размера и тяжести фиброза, подвергаемого лечению.
Еще одна цель настоящего изобретения заключается в обеспечении способа стимуляции ангиогенеза в ткани или в органе у субъекта, у которого такая ткань или орган нуждается в ангиогенезе, включающего введение указанному субъекту эффективного количества лекарственного средства или фармацевтической композиции, такой как была описана выше.
Индукция ангиогенеза может быть применена для лечения недостаточности коронарных и периферических артерий, и, следовательно, может представлять собой неинвазивный и терапевтический подход к лечению заболеваний коронарных артерий, ишемической болезни сердца и заболеваний периферических артерий. Ангиогенез может быть важен при лечении заболеваний и нарушений в тканях и органах, отличных от сердца, а также при развитии и/или поддержании органов, отличных от сердца. Ангиогенез может иметь значение при лечении внутренних и внешних ран, а также кожных язв. Ангиогенез также важен для сопряжения резорбции хряща с образованием кости, и важен для правильного морфогенеза в пластинке роста. Ангиогенез также играет роль в имплантации эмбриона, и росте плаценты, а также в развитии эмбриональной сосудистой системы.
Подходящие носители и разбавители включают изотонические солевые растворы, например, солевые растворы на основе фосфатного буфера. Композиция может быть составлена для парентерального, внутримышечного, внутривенного, внутрибрюшинного введения, инъекции, интраназальной ингаляции, легочной ингаляции, внутрикожного, внутрисуставного, интратекального введения или введения через пищеварительный тракт.
Лекарственное средство или фармацевтическую композицию изобретения обычно вводят пациенту с помощью внутримышечной, внутрибрюшинной или внутривенной инъекции, или с помощью прямой инъекции в лимфатические узлы пациента, предпочтительно с помощью прямой внутривенной инъекции.
Обычно субъекту вводят от 104/кг до 109/кг клеток, предпочтительно, от 105/кг до 107/кг клеток и, более предпочтительно, примерно 106/кг клеток.
Пути введения и описанные дозы предназначены только для общего руководства, поскольку квалифицированный практик легко способен определить оптимальный путь введения и дозировку для любого определенного субъекта, в зависимости, например, от возраста, веса и состояния пациента.
Краткое описание чертежей
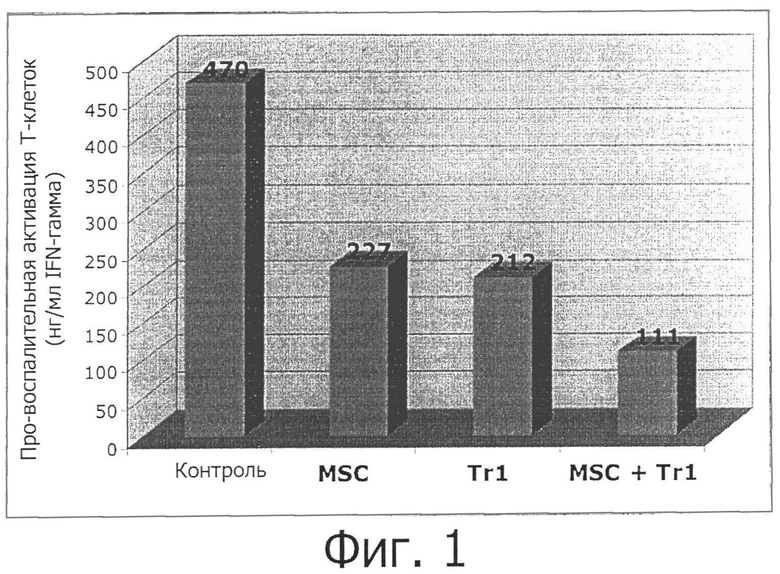
Фигура 1: определение IFN-гамма, продуцируемого Т-клетками, активированными в присутствии или отсутствии MSC-клеток и/или Tr1-клеток.
MLR культивируют в нижней ячейке системы Transwell без добавок или в присутствии MSC-клеток, Tr1 или MSC-клетки, и Tr1 в верхней камере. Супернатант собирают через 4 дня и секрецию IFNγ измеряют методом ELISA.
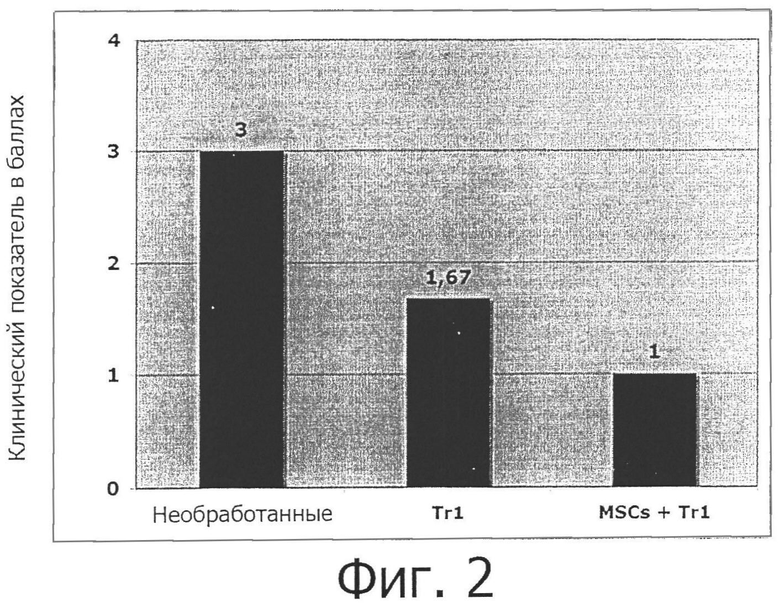
Фигура 2: Совместное введение MSC-клеток улучшает эффективность терапии с помощью Tr1-клеток в модели колита у мышей.
Balb/c мышей обрабатывают DSS в питьевой воде в течение 7-ми дней, Tr1-клетки и MSC-клетки вводят с помощью инъекции внутривенно, первый день. Клинический показатель и массу тела отмечали ежедневно.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1
Получение MSC-клетки
Мезенхимальные стволовые клетки получают из стромально-васкулярной фракции жировой ткани Balb/c мышей. Жировую ткань разрушали в присутствии 0,1%-ной коллагеназы в течение 30 минут и фильтровали через сито с размером пор 70 µ меш. Прикрепившиеся клетки культивировали в среде RPMI, содержавшей 10% FCS и 10% лошадиной сыворотки, дополненной глутамином и пенициллином и стрептомицином. Клетки многократно проверяли на их способность к дифференциации, как в линию адипоцитов, так и в линию остеобластов.
Получение Tr1-клеток
Овальбумин-специфические Tr1-клетки дифференцируют из необученных CD4+Т-лимфоцитов, полученных от DO11-10 овальбумин-специфической TCR трансгенной мыши после активации с помощью пептида 323-339 овальбумина и IL-10 в присутствии облученных изогенных антиген-представляющих клеток. Клетки затем клонируют с помощью ограниченного разведения с целью получить моноклональную популяцию овальбумин-специфических Tr1-клеток. Клетки, примененные в эксперименте 1 и 2, получают из культуры Tr1 клона.
Анализ активации Т-клетки
Способность к супрессии Tr1-клеток и MSC-клеток оценивают по ингибированию MLR. MLR помещают в нижнюю ячейку системы Transwell с 106 иммуноотвечающих клеток (Balb/c мыши) и с 106 облученных спленоцитов из С57 BL6 мышей. MSC-клетки (3×104 клеток) и Tr1-клетки (105 клеток) добавляют в верхнюю камеру. Через 4 дня собирают супернатант от MLR и измеряют секрецию IFN-гамма методом ELISA.
Способ определения продукции IFN-гамма
Продукцию интерферон гамма активированными Т-лимфоцитами оценивают с помощью коммерчески доступного набора ELISA, приобретенного у компании «BD Biosciences ».
Полученные результаты (фигура 1)
Результаты демонстрируют, что как MSC, так и Tr1-клетки независимо ингибируют активацию Т-клеток, измеряемую по снижению высвобождения IFN-гамма про-воспалительными Т-лимфоцитами. Совместное культивирование MSC- и Tr1-клеток приводит к более сильному ингибированию по сравнению с ингибированием только MSC-клетками, или только Tr1-клетками, следовательно, два типа клеток проявляют синергический эффект при своем действии, что приводит к усилению ингибирования активации Т-клеток и высвобождения IFN-гамма.
Пример 2
BALB/c мышей обрабатывают декстраном сульфатом натрия (DSS, 5% в питьевой воде) для индукции острого колита. Группу мышей оставляют необработанной или обрабатывают внутривенно на день 1 106 овальбумин-специфическими Trl-клетками с MSC-клетками, полученными из жировой ткани (0,5×106/мышь), или без них. Через 7 дней клинические показатели мышей оценивают на основании следующего подсчета баллов:
0 - нет клинических признаков
1 - Потеря массы
2 - Потеря массы + слабая диарея
3 - Потеря массы + тяжелая диарея
4 - Потеря массы + тяжелая диарея + кровь в кале
Результаты показывают, что совместное введение MSC-клеток улучшает эффективность терапии с помощью Tr1-клеток в этой модели колита (фигура 2).
Группа изобретений относится к композициям, включающим Tr1-клетки и мезенхимальные стволовые клетки, представляющие собой специфические клетки для антигена, в норме толерантного у здорового субъекта, где указанный антиген представляет собой аллерген, собственный антиген, пищевой антиген или антиген микроорганизмов, и способам лечения аутоиммунного заболевания, аллергического заболевания или воспалительного заболевания. Группа изобретений обеспечивает новое альтернативное лечение с усовершенствованием существующих приемов лечения аутоиммунных заболеваний или других нежелательных иммунных реакций. 5 н. и 9 з.п. ф-лы, 2 ил., 2 пр.
1. Композиция для индукции антиген-специфичной иммунологической толерантности у субъекта, страдающего от заболевания, которое включает избыточный, дисфункциональный или неконтролируемый иммунный ответ, опосредованный аутологичными или неаутологичными Т-клетками, включающая Tr1-клетки и мезенхимальные стволовые клетки, в которой Tr1-клетки представляют собой специфические клетки для антигена, в норме толерантного у здорового субъекта, причем указанный антиген в норме толерантный у здорового субъекта представляет собой аллерген, собственный антиген, пищевой антиген или антиген микроорганизмов.
2. Композиция по п.1, дополнительно включающая антиген, для которого Tr1-клетки представляют собой специфические клетки.
3. Композиция по п.1, в которой указанные Tr1-клетки и MSC-клетки представляет собой аутологичные клетки.
4. Композиция по п.1, в которой Tr1-клетки и MSC-клетки упаковывают отдельно для последовательного или совместного введения.
5. Композиция по п.1 в комбинации с одним или несколькими фармацевтически приемлемыми эксипиентами.
6. Способ индуцирования антиген-иммунной специфической толерантности у субъекта, страдающего заболеванием, в которое вовлечен избыточный, нарушенный или неконтролируемый иммунный ответ, опосредуемый аутологичными или неаутологичными Т-клетками, включающий введение указанному субъекту эффективного количества композиции по п.1.
7. Способ по п.6, в котором указанное заболевание представляет собой аутоиммунное заболевание, аллергическое заболевание или воспалительное заболевание.
8. Способ по п.7, в котором указанное заболевание представляет собой аутоиммунное заболевание, которое выбирают из группы, включающей гранулематоз Вегенера, первичный биллиарный цирроз, первичный склерозирующий холангит, болезнь Крона, ревматоидный артрит, множественный склероз и инсулин-толерантный диабет.
9. Способ по п.7, в котором указанное заболевание представляет собой воспалительное заболевание, которое выбирают из группы, включающей ревматоидный артрит, множественный склероз, Болезнь Крона, реакцию «трансплантат против хозяина», реакцию «хозяина против трансплантата».
10. Способ по п.7, в котором указанное заболевание представляет собой аллергическое заболевание, которое выбирают из группы, включающей астму, ринит, крапивницу, атопический дерматит; фиброзирующие заболевания и пищевую аллергию.
11. Способ по п.6, в котором указанные Tr1-клетки и указанные MSC-клетки вводят совместно или последовательно.
12. Способ стимуляции регенерации тканей у нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества фармацевтической композиции по п.1.
13. Способ лечения фиброза у нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества композиции по п.1.
14. Способ стимуляции ангиогенеза в органе или в ткани нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества композиции по п.1.
| WO2006018674 A1, 23.02.2006 | |||
| УСТРОЙСТВО ДЛЯ ПЕРЕДАЧИ КООРДИНАТ | 1994 |
|
RU2092793C1 |
| NICOLA M.D | |||
| et al., Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli | |||
| Blood, 15.05.2002, Vol.99, №10, pp.3838-3843 | |||
| YAN CHEN et al., Induction of experimental acute ulcerative colitis in rats by administration of | |||
Авторы
Даты
2013-09-27—Публикация
2008-10-17—Подача