Область техники
Настоящее изобретение относится к композиции и способу индуцирования дифференцировки CD4+ Т-клеток в регуляторные Т-клетки посредством лигандов индуцированных Т-клеточных костимуляторов (ICOSL) или посредством мезенхимальных стволовых клеток, гиперэкспрессирующих ICOSL, для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками. Уровень техники
Одной из самых важных характеристик всех здоровых индивидуумов является их способность не реагировать в ущерб собственному организму на антигенные вещества, присутствующие в организме, и в тоже время способность таких индивидуумов распознавать, реагировать и уничтожать многие антигены, не являющиеся собственными (аутоантигенами). Отсутствие ответа организма на аутоантигены называют иммунологической неотвечаемостью или толерантностью. Аутотолерантность возникает при удалении лимфоцитов, которые могут содержать специфичные для аутоантигенов рецепторы, или при инактивации аутореактивной функции после воздействия аутоантигенов. В случае, когда затруднительно индуцировать или поддерживать аутотолерантность, возникает иммунный ответ на аутоантиген, и возникающее в результате заболевание называют аутоиммунным заболеванием. Пример аутоиммунных заболеваний включает аллергическое заболевание, которое относится к расстройству, при котором нарушается работа иммунной системы, и вещества, безвредные для большинства людей, вызывают различные симптомы гиперчувствительности только у конкретного человека. Вещества, вызывающие аллергические заболевания, называют аллергенами или антигенами. Аллергии могут вызывать пыльца, антибиотики, лекарственные средства, пыль, пищевые продукты, холодный воздух или солнечный свет. Симптомы аллергического заболевания включают крапивницу, чихание, зуд, ринорею, кашель, поллиноз (сенную лихорадку), покраснение, экзему, сыпь и им подобные симптомы. Обычные аллергические заболевания включают аллергическую астму с такими симптомами, как респираторный стеноз, повышенная концентрация слизистой в легких, одышка и кашель. Кроме того, наблюдается атопический дерматит, конъюнктивит, ринит и язвенный колит.
Исследования важности регуляторных Т-клеток активно проводились в отношении заболеваний, вызванных нарушениями (аномалиями) различных аутоиммунных систем. В начале 1970-х годов Гершон (Gershon) впервые ввел понятие ингибирующих Т-клеток в качестве возможно присутствующих Т-клеток, которые способны контролировать и ингибировать эффекторную функцию обычных Т-клеток (R.K. Gershon and K. Kondo, Immunology, 1970, 18: 723-37). Затем были проведены исследования для выяснения биологических свойств и функции регуляторных Т-клеток во многих областях иммунологии. В частности, в 1995 году Сакагути (Sakaguchi) сообщил о том, что CD25 может действовать в качестве важного фенотипического маркера встречающихся в природе CD4+ регуляторных Т-клеток (S. Sakaguchi et al., J. Immunol., 1995, 155: 1151-1164). Затем проводимые исследования были сосредоточены на роли и важности регуляторных Т-клеток при индукции периферической толерантности к аутоантигенам.
В последние годы заболевания, опосредуемые Т-клетками, были признаны заболеваниями, представляющими собой множественные заболевания иммунной системы. В частности, считается, что Т-клетки вызывают и поддерживают аутоиммунные заболевания. Непрерывная активация или регулярная активация аутореактивных Т-клеток приводит к иммунным ответам на аутоантигены. Аутореактивные Т-клетки привлекают внимание в качестве причины характерного повреждения ткани и разрушения ткани, которые напрямую или опосредованно выявляются при аутоиммунных заболеваниях.
Соответственно, многие терапевтические агенты были предложены для аутоиммунных заболеваний и других заболеваний, опосредованных Т-клетками. Тем не менее, до сих пор требуются другие терапевтические средства. В частности, точный механизм действия Т-клеток необходим для применения их в качестве терапевтического агента.
Между тем, известно, что мезенхимальные стволовые клетки обладают иммунорегуляторной способностью регулировать активацию и дифференцировку иммунных клеток в дополнение к мультипотентности. Известно, что они регулируют Т-клетки, В-клетки, макрофаги, естественные клетки-киллеры, дендритные клетки и т.д. в различных воспалительных средах и индуцируют регуляторные Т-клетки для ингибирования иммунных ответов. Тем не менее, мало что известно о конкретном механизме регуляции или действия при индукции регуляторных Т-клеток. В этой связи для лечения иммунных заболеваний, таких как аутоиммунные заболевания, необходимы исследования конкретных механизмов и эффективных ингредиентов.
Описание
Техническая задача
Авторы настоящего изобретения исследовали мезенхимальные стволовые клетки и заболевания, опосредованные регуляторными Т-клетками. Авторы настоящего изобретения определили, что лиганд индуцированных Т-клеточных костимуляторов (ICOSL) на поверхности мезенхимальных стволовых клеток может индуцировать дифференцировку CD4+ Т-клеток в регуляторные Т-клетки с образованием множества регуляторных Т-клеток, и эффективно излечивать заболевания, опосредованные Т-клетками, что и позволило получить настоящее изобретение.
Соответственно, целью настоящего изобретения является обеспечение фармацевтической композиции для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками, которая содержит лиганды индуцированных Т-клеточных костимуляторов (ICOSL) или мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, а также обеспечение композиции и способа для индуцирования дифференцировки в регуляторные Т-клетки.
Техническое решение
Для достижения описанных выше целей в настоящем изобретении предложена фармацевтическая композиция для предотвращения или лечения заболевания, опосредованного регуляторными Т-клетками, которая содержит лиганд индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL.
Кроме того, в настоящем изобретении предложена композиция для индуцирования дифференцировки и пролиферации CD4+ Т-клетки в регуляторную Т-клетку, которая содержит лиганд индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL.
Кроме того, в настоящем изобретении предложен способ индуцирования дифференцировки и пролиферации CD4+ Т-клетки в регуляторную Т-клетку, который включает обработку CD4+ Т-клетки in vitro лигандом индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальной стволовой клеткой, гиперэкспрессирующей ICOSL.
Положительные эффекты
В настоящем изобретении указанный лиганд индуцированного Т-клеточного костимулятора (ICOSL) или указанная мезенхимальная стволовая клетка, гиперэкспрессирующая ICOSL, индуцирует экспрессию ICOS в регуляторных Т-клетках, индуцируя таким образом дифференцировку регуляторных Т-клеток через механизм PI3K-Akt, а также и эффективное ингибирование пролиферации мононуклеарных клеток периферической крови (РВМС), так что возможно эффективное предотвращение, лечение или облегчение заболеваний, опосредованных Т-клетками.
Описание чертежей
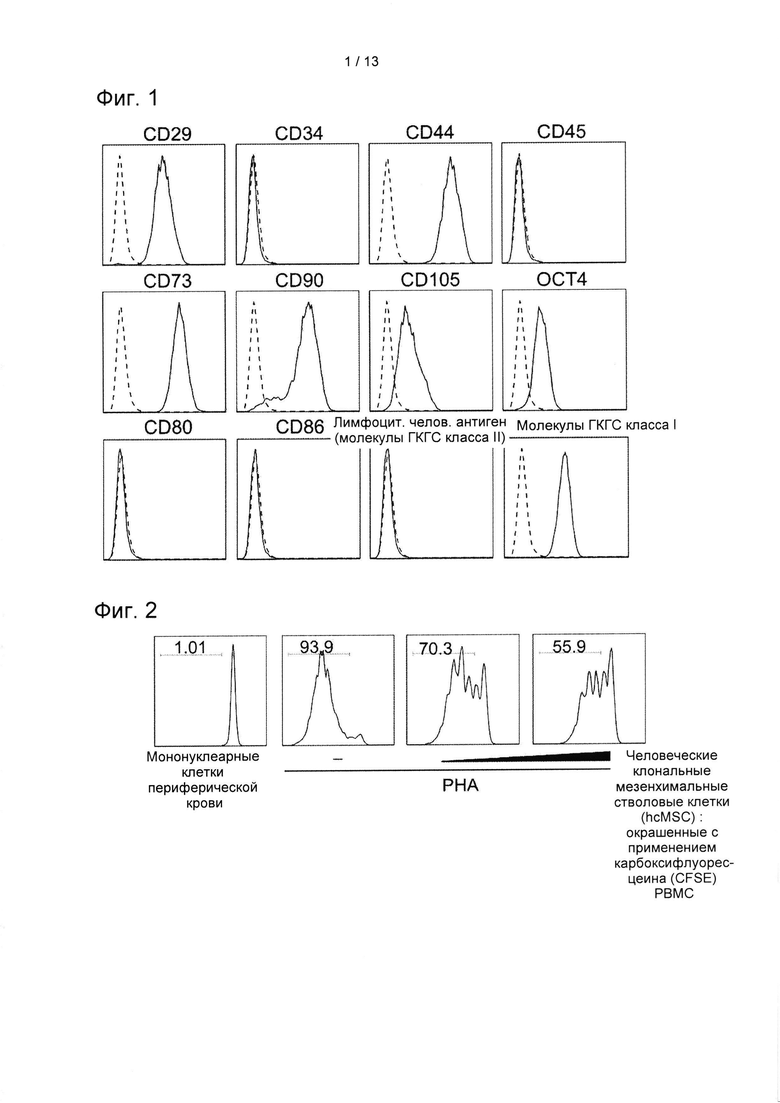
На ФИГ. 1 показаны результаты проточного цитометрического анализа на определение экспрессии маркера hcMSC методом проточной цитометрии, на которой пунктирная линия обозначает окрашивание гомологичным контрольным антителом, а сплошная линия представляет собой специфичную экспрессию каждого маркера.
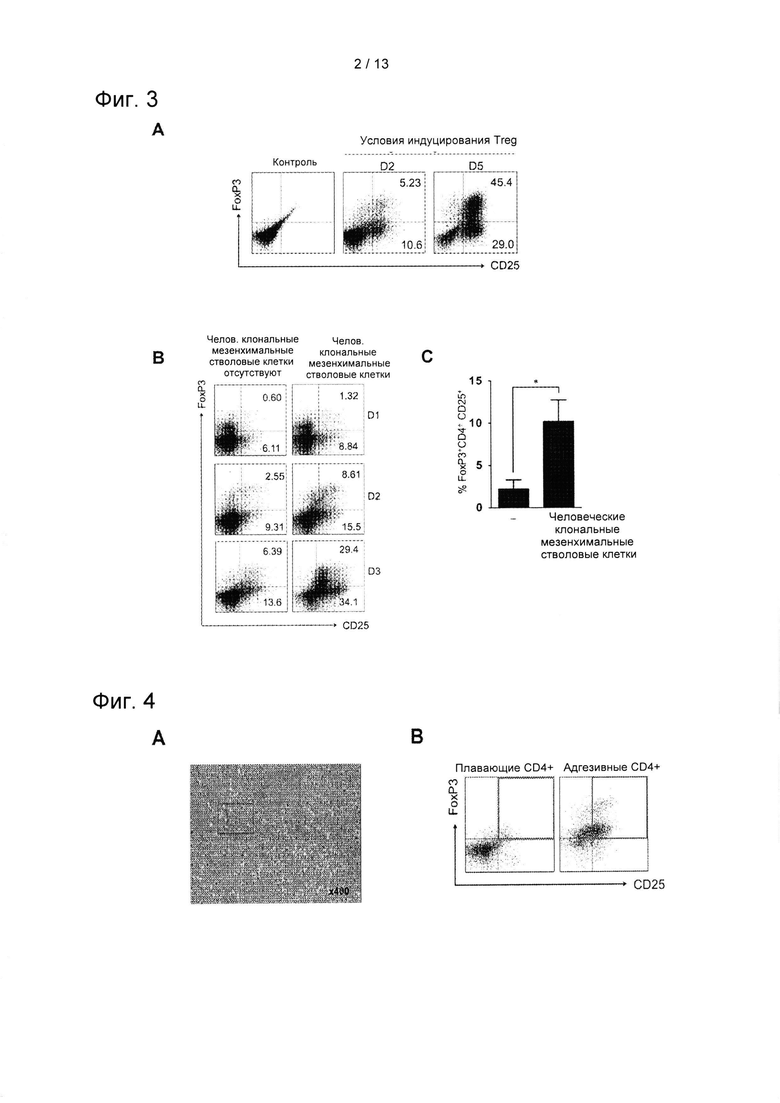
На ФИГ. 2 показаны результаты анализа с применением карбоксифлуоресцеина (CFSE) по определению супрессорной активности hcMSC в отношении Т-клеток in vitro (М: hcMSC и Р: окрашенные CFSE РВМС).
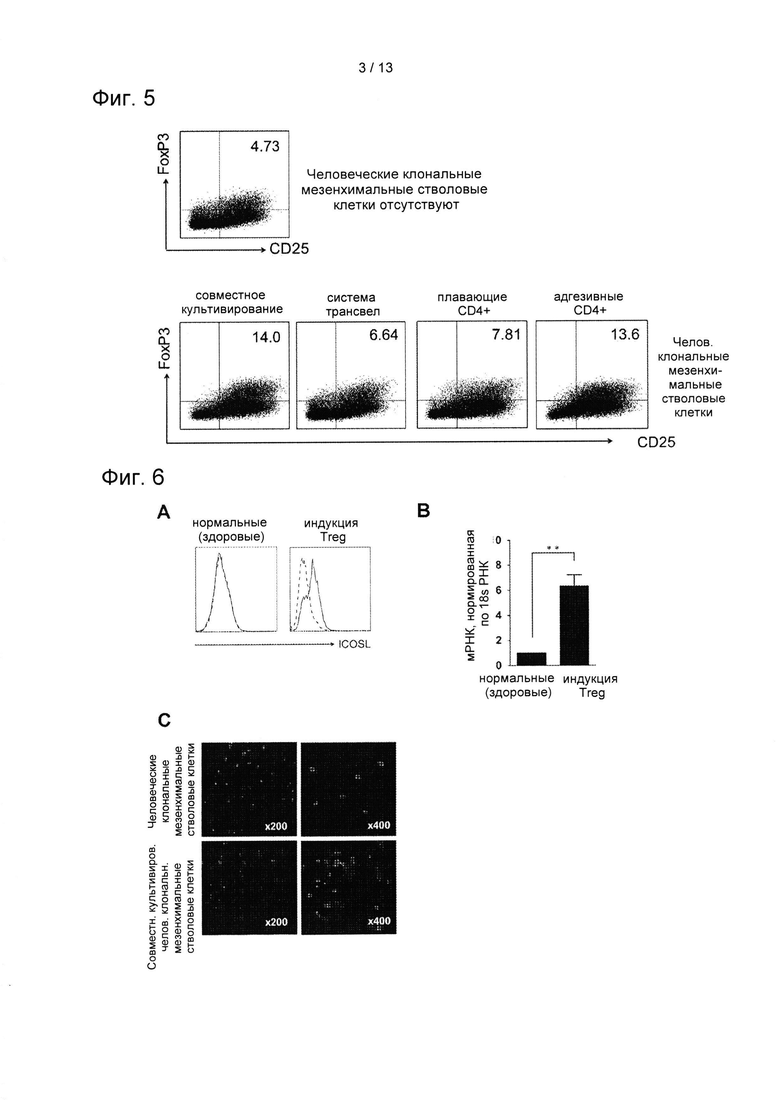
На ФИГ. 3 показаны результаты проточного цитометрического анализа по определению дифференцировки CD4+ Т-клеток в регуляторные Т-клетки (Treg) в условиях индуцирования Treg на 2 и 5 день (А), результаты подтверждения воздействия hcMSC через определение экспрессии FoxP3 и CD25 (В), и результаты подтверждения воздействия hcMSC через увеличение числа клеток FoxP3+CD4+CD25+ (С) (*, Р=0,017).
На ФИГ. 4 показаны результаты подтверждения формы CD4+ Т-клеток, полученных совместным культивированием hcMSC с CD4+ Т-клетками, при помощи микроскопа (А), и результаты сравнения изменений уровней экспрессии CD25+ и FoxP3+ в плавающих CD4+ Т-клетках и адгезивных CD4+ Т-клетках (В) (Синий квадрат: плавающие CD4+ Т-клетки и красный квадрат: адгезивные (прикрепленные к hcMSC) CD4+ Т-клетки).
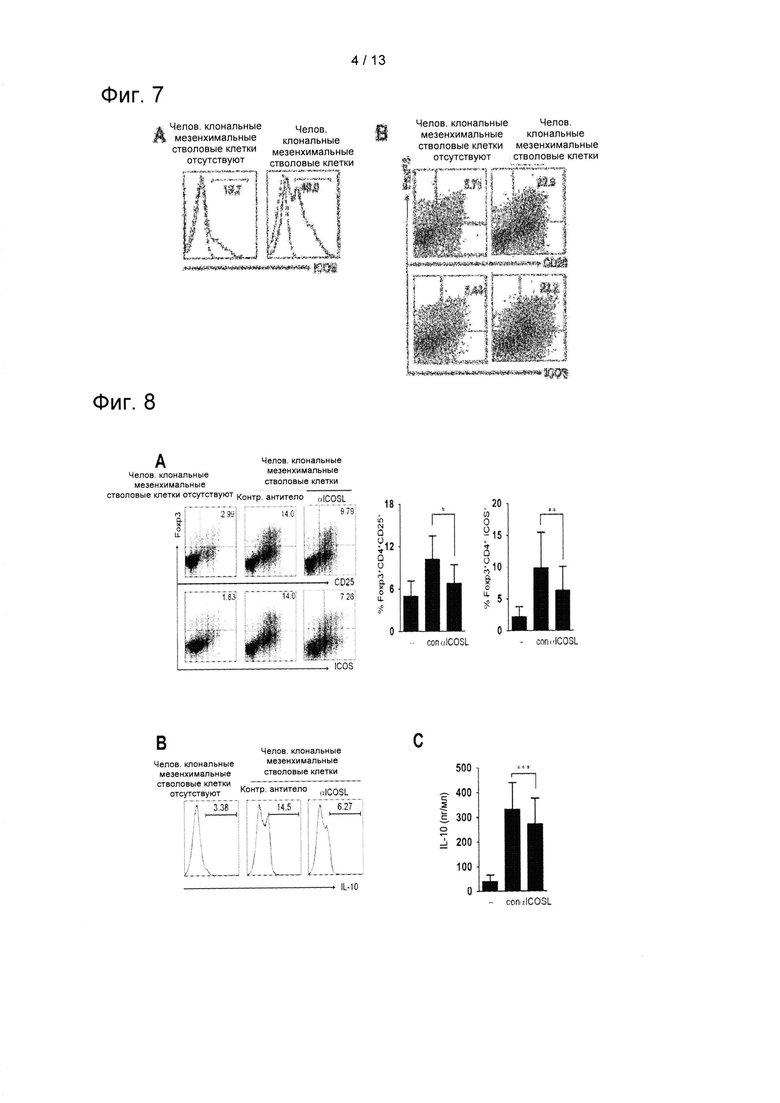
На ФИГ. 5 показаны результаты сравнения изменений уровней экспрессии CD25+ и FoxP3+ в плавающих CD4+ Т-клетках, адгезивных CD4+ Т-клетках, совместно культивированных с hcMSC и культивированных с применением системы трансвел.
На ФИГ. 6 показаны результаты подтверждения изменений экспрессии белка ICOSL путем совместного культивирования hcMSC с CD4+ Т-клетками (А), результаты подтверждения таким образом изменений экспрессии мРНК (В) и результаты подтверждения экспрессии ICOSL при помощи конфокального микроскопа (С) (увеличение: ×200, ×400).
На ФИГ. 7 показаны результаты подтверждения изменений экспрессии белка ICOS в результате совместного культивирования hcMSC с CD4+ Т-клетками (А) и результаты подтверждения таким образом изменений экспрессии FoxP3, CD25 и ICOS в клетках CD4+(В).
На ФИГ. 8А показаны результаты проточного цитометрического анализа по определению изменений экспрессии FoxP3, CD25 и ICOS путем совместного культивирования hcMSC с CD4+ Т-клетками, которые обрабатывают антителом против ICOSL (10 мкг/мл) или контрольным антителом, CD4+ Т-клетками, и подтверждение FoxP3+CD4+CD25+ Т-клеток и FoxP3+CD4+ICOS+ Т-клеток (*Р=0,017 и **Р=0,049).
На ФИГ. 8 В показаны результаты проточного цитометрического анализа по определению образования IL-10 CD4+ Т-клетками путем совместного культивирования hcMSC с CD4+ Т-клетками, которые обрабатывают антителом против ICOSL (10 мкг/мл) или контрольным антителом, CD4+ Т-клетками, и на ФИГ. 8С показаны результаты определения такого образования методом иммуноферментного анализа ELISA (***р=0,03).
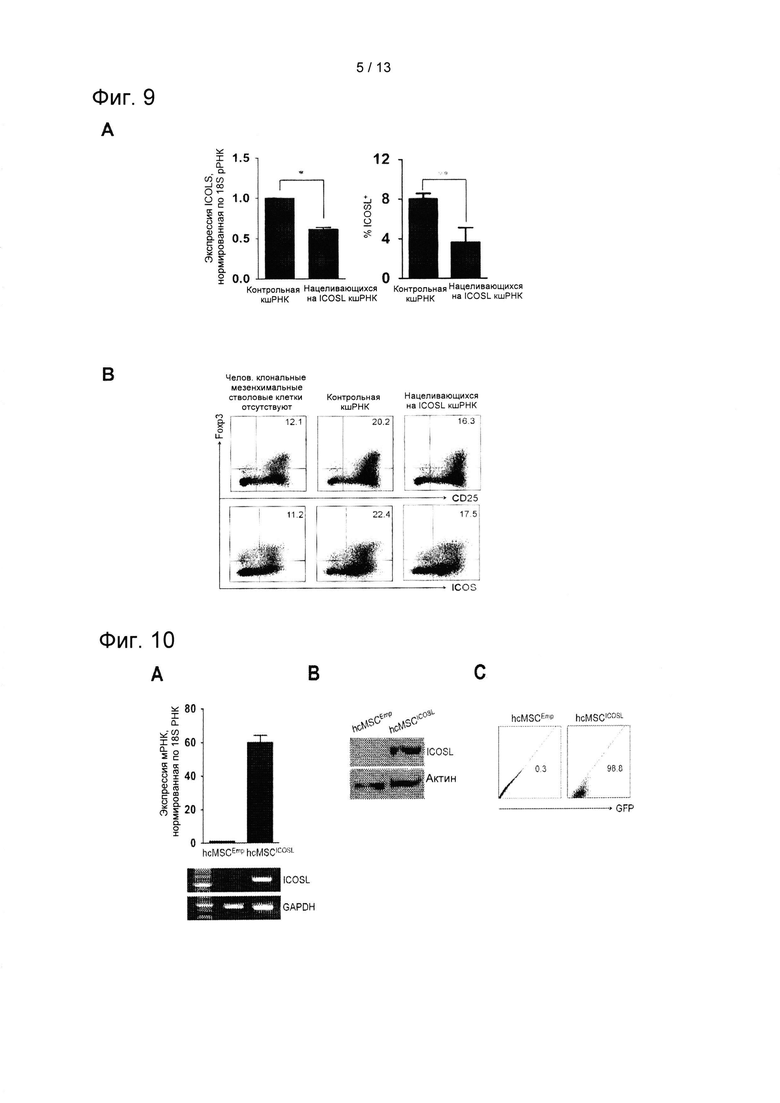
На ФИГ. 9 показаны результаты количественной ПЦР в режиме реального времени и проточного цитометрического анализа результатов нокдауна в зависимости от направленного на ген воздействия с применением нацеливающихся на ICOSL кшРНК (shICOSL), (А), и изменения индуцирующего Treg воздействия в зависимости от нокдауна (В) (*Р=0,008 и **Р=0,013).
На ФИГ. 10 показаны результаты количественной ПЦР в режиме реального времени (qRT-PCR) (А), вестерн-блоттинга (В) и проточного цитометрического анализа (С) по определению повышения экспрессии ICOSL в клетках hcMSC (hcMSCICOSL), в которые трансдуцировали лентивирусы, экспрессирующие полноразмерный человеческий ICOSL, и в клетках MSC, представляющих собой контроль (hcMSCEmp), в которые трансдуцировали пустые векторы.
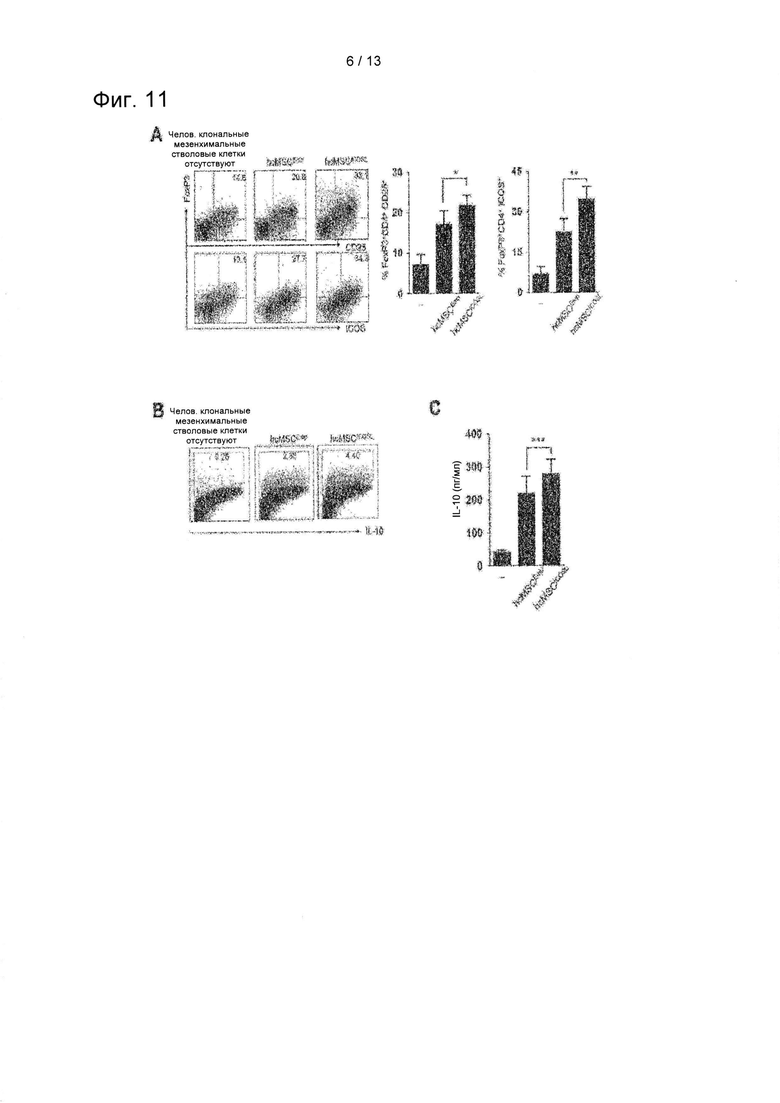
На ФИГ. 11 показаны результаты проточной цитометрии и ELISA по определению эффекта повышения индукции Treg в клетках hcMSCICOSL (А) (*Р=0,045 и **Р=0,049) и результаты проточного цитометрического анализа (В) и ELISA (С) по определению эффекта повышения секреции IL-10 клетками Treg (***Р=0,034).
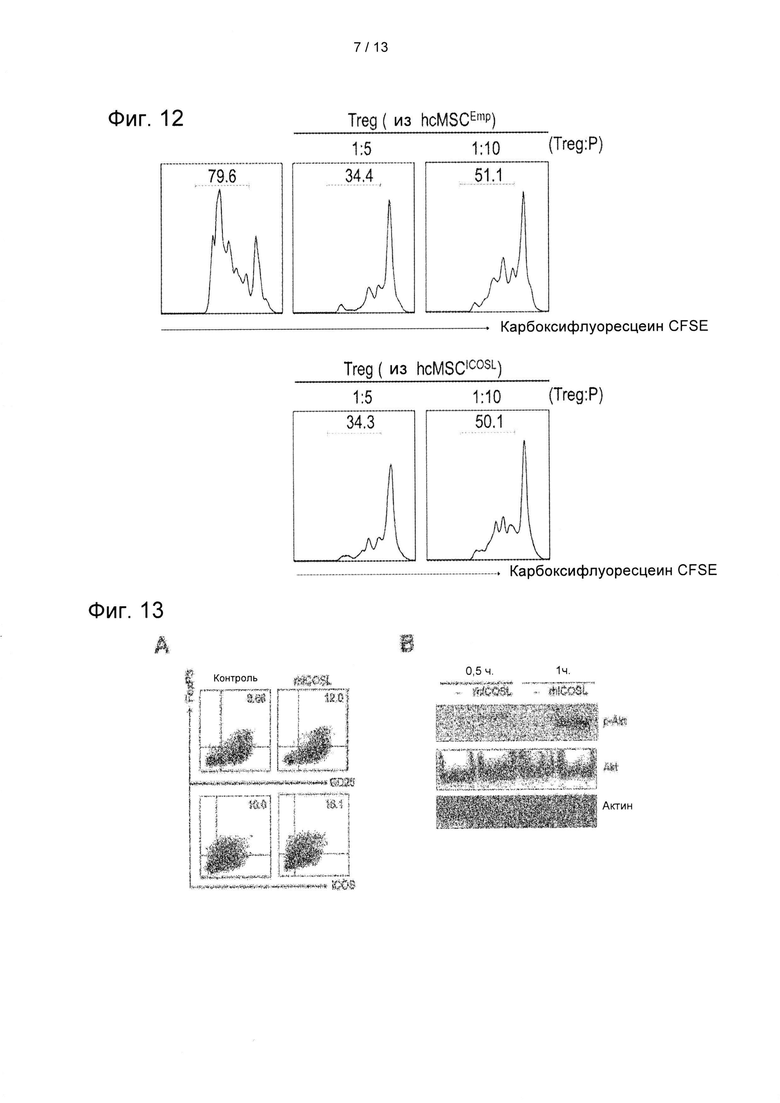
На ФИГ. 12 показаны результаты анализа пролиферации РВМС после того, как популяции CD25+ клеток, выделенные из совместно культивированных hcMSCICOSL или hcMSCEmp, совместно культивировали с CFSE-меченными и активированными РВМС при соотношении 1:5 или 1:10 (Treg:PBMC) в течение 3 дней, которую оценивали по уровню разбавления CFSE в проточном цитометрическом анализаторе.
На ФИГ. 13 показаны результаты проточного цитометрического анализа по определению индуцирующего воздействия обработки rhICOSL на дифференцировку Treg (A), и результаты вестерн-блот-анализа по определению воздействия обработки rhICOSL на фосфорилирование Akt (В).
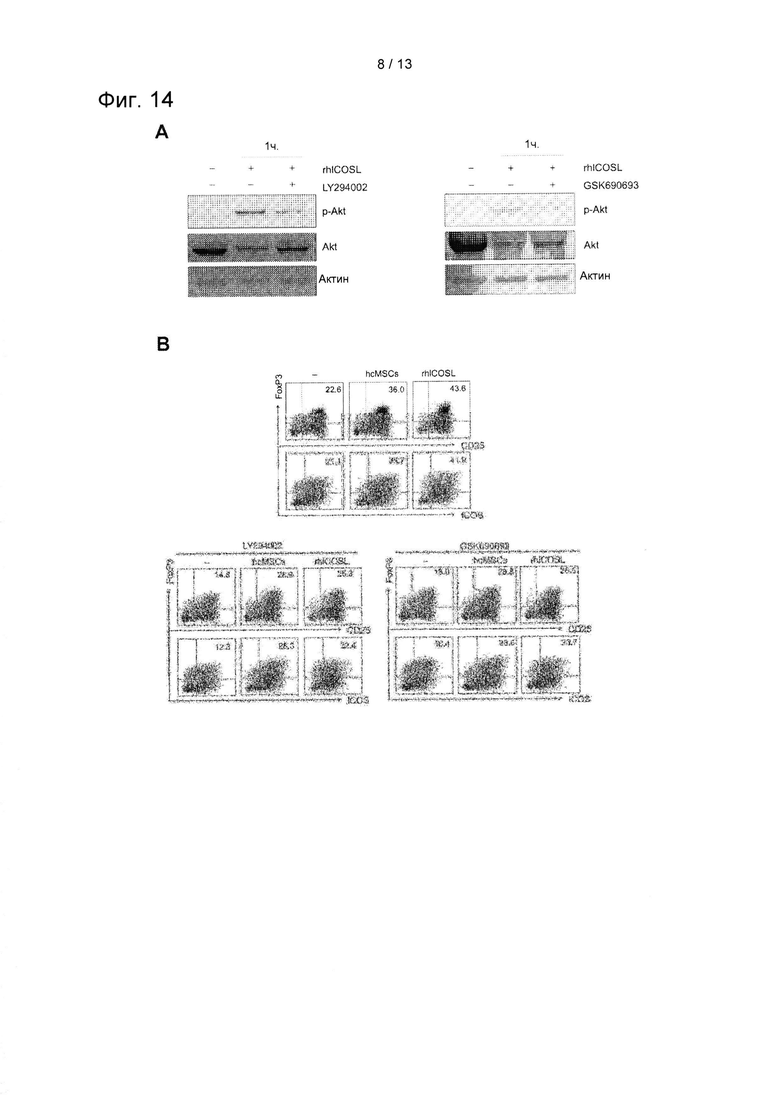
На ФИГ. 14 показаны результаты подтверждения ингибирующего воздействия на фосфорилирование PI3K-Akt (А) и ингибирующего воздействия на дифференцировку Treg
(B) обработки ингибитором PI3K LY294002 (5 мкМ) и ингибитором Akt GSK690693 (1 мкМ) для подтверждения того, участвует ли путь передачи сигнала PI3K-Akt в опосредованной ICOSL дифференцировке Treg.
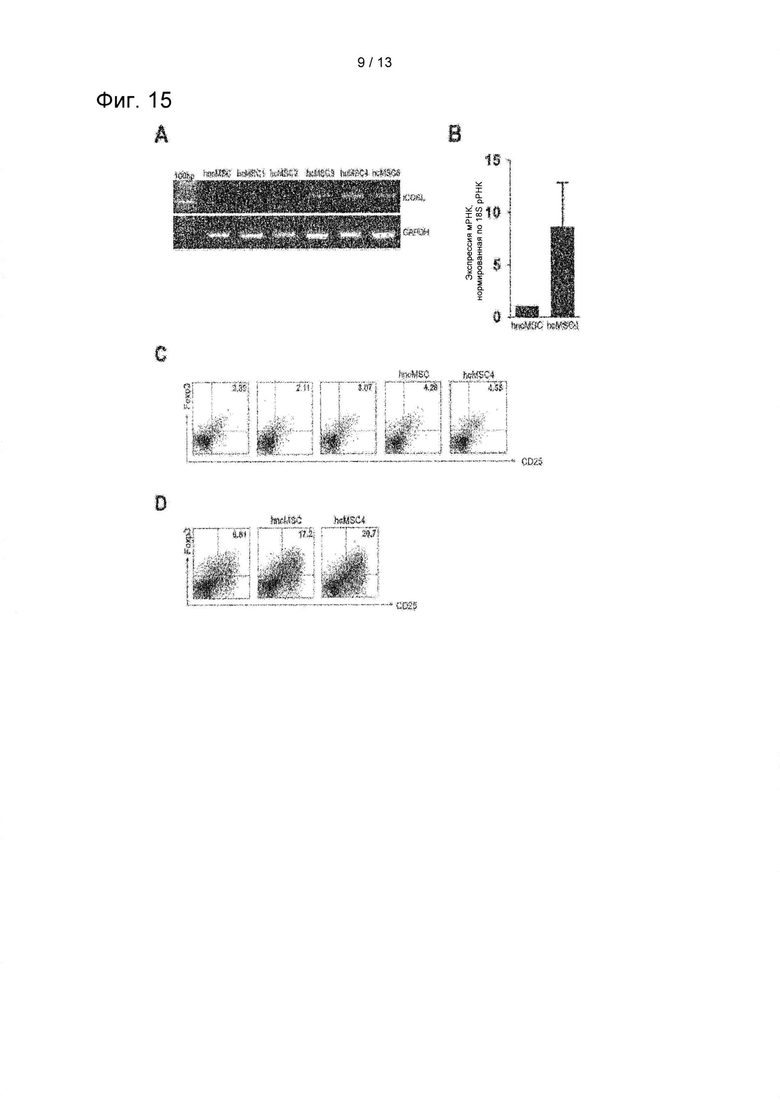
На ФИГ. 15 показаны результаты подтверждения различий в экспрессии ICOSL между неклональными MSC (hncMSC) и hcMSC 1-4 с применением ПЦР с обратной транскрипцией и количественной ПЦР в режиме реального времени (А и В) и сравнения их индуцирующей способности в отношении Treg-клетки путем совместного культивирования с РВМС (С) и в условиях индуцирования Treg (D) в реакции смешанных лимфоцитов (MLR).
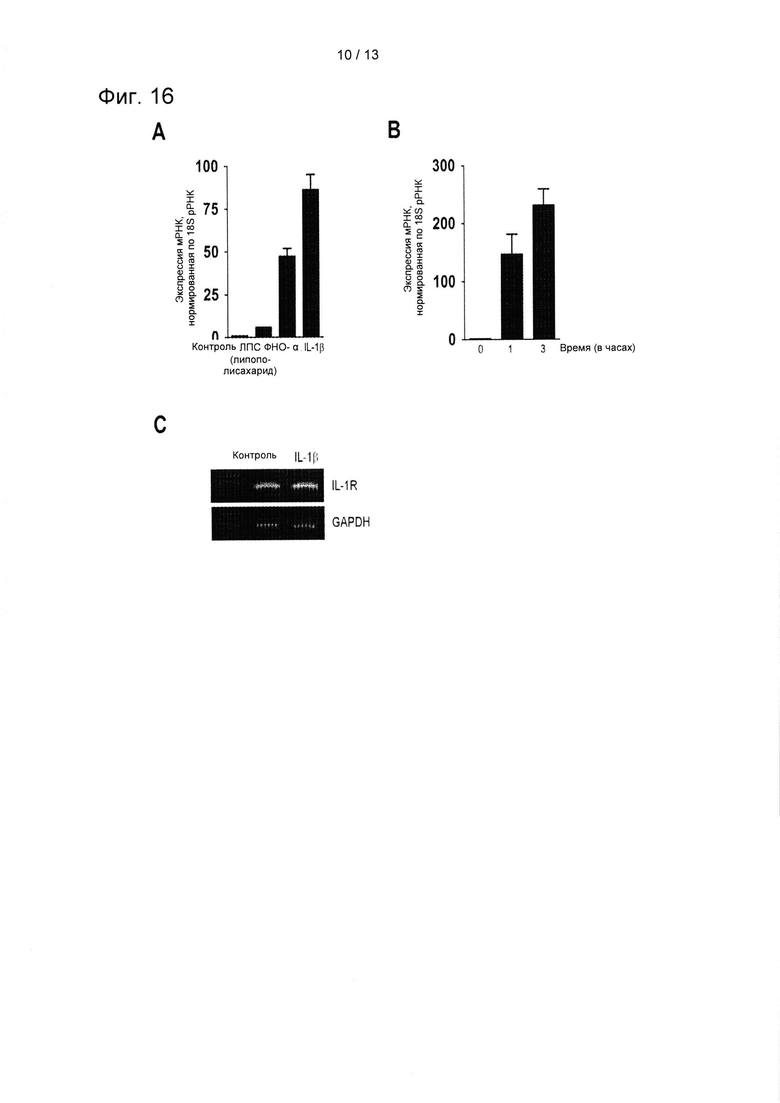
На ФИГ. 16 показаны результаты подтверждения повышения экспрессии мРНК ICOSL в результате обработки IL-1β, ФНО-α и ЛПС (А), повышения экспрессии мРНК ICOSL в результате обработки IL-1β в динамике (В) и изменения экспрессии IL-1R в результате обработки IL-1β (С).
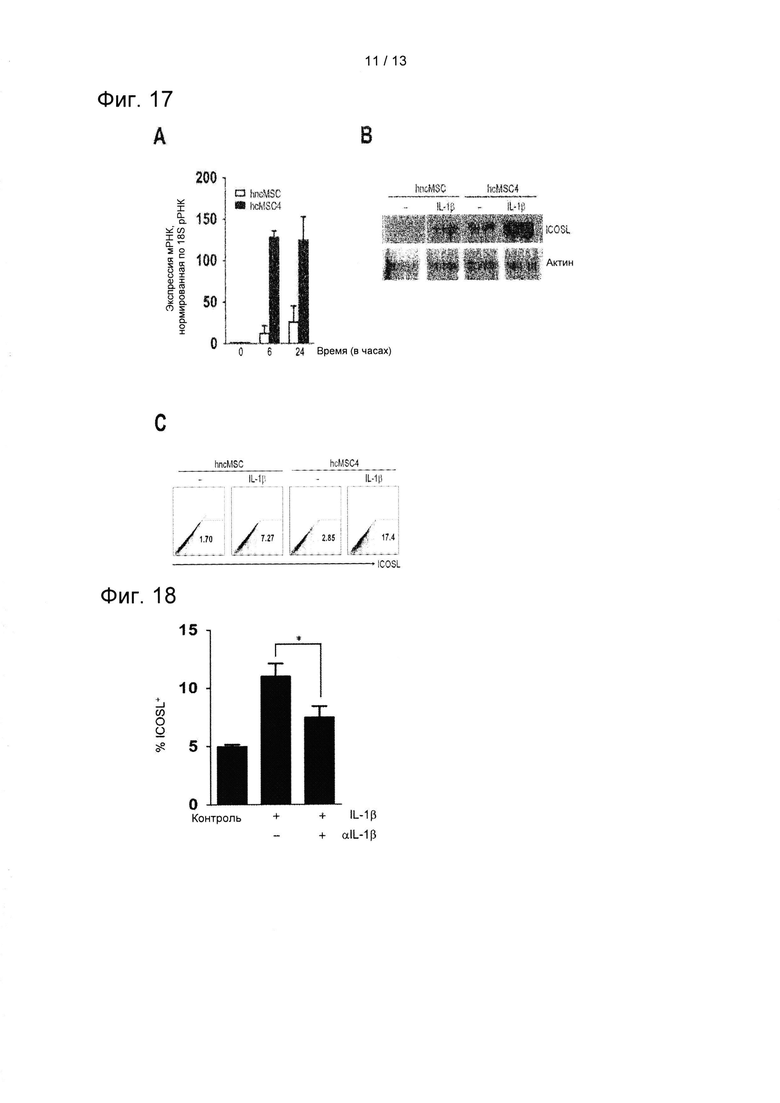
На ФИГ. 17 показаны результаты подтверждения ICOSL-индуцируемых воздействий клональнных (hcMSC) и неклональных MSC (hncMSC) в результате обработки IL-1β посредством количественной ПЦР в режиме реального времени (А), вестерн-блоттинга (В) и проточной цитометрии (С).
На ФИГ. 18 показаны результаты подтверждения изменений индукции экспрессии ICOSL после блокады IL-1β в результате обработки нейтрализующим антителом против IL-1β (*Р=0,003).
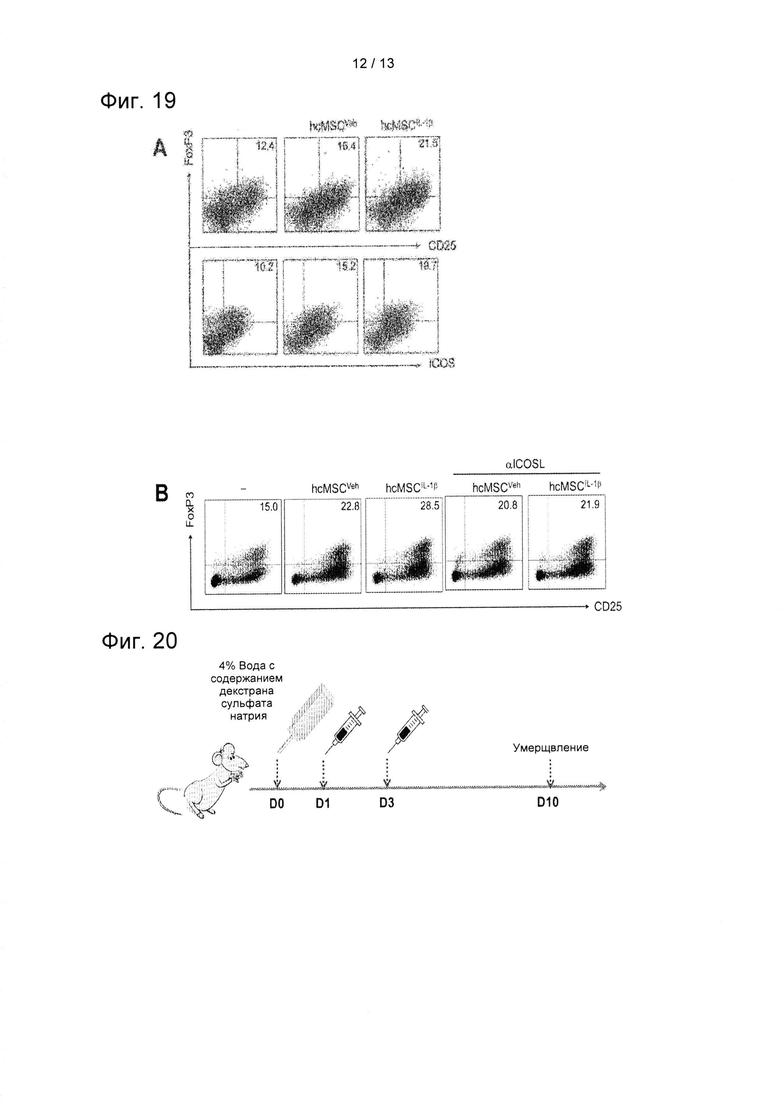
На ФИГ. 19А показан результат проточного цитометрического анализа по определению соотношения популяции CD4+CD25+FoxP3+ или CD4+ICOS+Foxp3+ Т-клеток с применением праймирования IL-1β (hcMSCIL-1β, праймирование IL-1β клеток hcMSC, hcMSCVeh, необработанные IL-1β клетки hcMSC).
На ФИГ. 19В показаны результаты подтверждения восстанавливающего воздействия CD25+FoxP3+ Treg, индуцированных hcMSCIL-1β и нормальными (здоровыми) hcMSC, в результате обработки нейтрализующим антителом против ICOSL (αICOSL).
ФИГ. 20 представляет собой схематическую диаграмму, на которой представлен способ получения при помощи DSS модели колита.
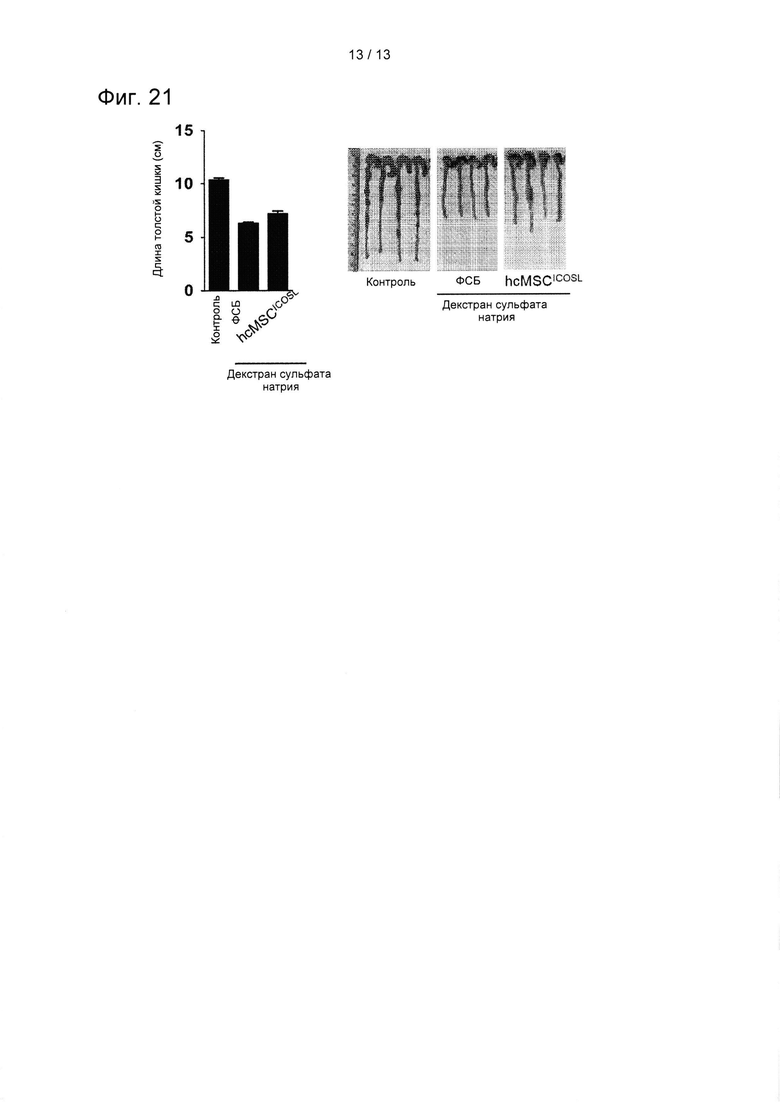
На ФИГ. 21 показаны результаты подтверждения изменения длины толстой кишки в зависимости от обработки клетками hcMSCICOSL в DSS-индуцированной модели мышиного колита.
Предпочтительный вариант реализации изобретения
В настоящем изобретении предложена фармацевтическая композиция для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками, которая содержит лиганд индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL.
Настоящее изобретение свидетельствует о том, что лиганды индуцированных Т-клеточных костимуляторов (ICOSL) или мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, могут способствовать дифференцировке CD4+Т-клеток в регуляторные Т-клетки и пролиферации регуляторных Т-клеток, ингибируя таким образом воспалительный или аутоиммунный ответ, так что их можно применять для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками.
В контексте настоящего описания термином «ICOS» назван Н4 или AILIM, который представляет собой суперсемейство CD28 костимуляторных молекул, и его экспрессия, как известно, увеличивается в активированных Т-клетках. ICOS может связываться с ICOSL, известным как В7-Н2, B7RP-1, B7h, GL50 и LICOS, для опосредования межклеточной передачи сигнала. ICOSL представляет собой костимуляторный белок, который несет сигнал активации для Т-клеток, и который кодируется геном ICOSLG (Gene ID: 23308) у людей. Также известно, что ICOSL обильно экспрессируется в В-лимфоцитах. В частности, экспрессия ICOSL может повышаться на поверхности мезенхимальных стволовых клеток в условиях воспаления.
В настоящем изобретении ICOSL можно получить из мезенхимальной стволовой клетки. Термин «полученный из мезенхимальных стволовых клеток» относится к ICOSL, экспрессированному на поверхности мезенхимальных стволовых клеток, или к выделенному из них типу. Таким образом, ICOSL согласно настоящему изобретению может включать все типы, экспрессированные на поверхности мезенхимальных стволовых клеток, или выделенные типы, синтезированные путем их рекомбинирования (перекомпоновки) без ограничения.
В контексте настоящего описания термин «мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL» относится к стволовым клеткам, у которых экспрессия ICOSL на поверхности мезенхимальных стволовых клеток повышается по сравнению с нормальной (здоровой) контрольной группой. Повышение экспрессии ICOSL на поверхности клеток можно достигнуть без ограничений за счет способа повышения экспрессии гена или белка, известного в данной области, например, в результате введения гена ICOSL и индукции повышения экспрессии. В одном варианте реализации настоящего изобретения лентивирус, экспрессирующий полноразмерный человеческий ген ICOSL, трансдуцируют в человеческие клональные мезенхимальные стволовые клетки (hcMSC) совместно с конструкциями для упаковки вируса для индуцирования повышения экспрессии ICOSL в мезенхимальных стволовых клетках, получая таким образом мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL. Мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, обладают хорошей способностью стимулировать дифференцировку CD4+ Т-клеток в регуляторные Т-клетки (Treg) и пролиферацию регуляторных Т-клеток, и они могут эффективно ингибировать воспалительные или аутоиммунные ответы, такие как колит.
В настоящем изобретении стволовые клетки предпочтительно представляют собой клональные мезенхимальные стволовые клетки (клональные MSC). В настоящем изобретении пример 11 подтверждает, что клональные мезенхимальные стволовые клетки можно применять для индуцирования экспрессии ICOSL, которая значительно превосходит экспрессию в случае человеческих неклональных MSC (hncMSC). Моноклональные стволовые клетки можно получить при помощи способов, известных в данной области техники. Тем не менее, их предпочтительно выделяют при помощи способа культивирования с субфракционированием, описанным у Song S.U. et al. (2008) (Variations of clonal marrow stem cell lines established from the human bone marrow in surface epitopes, differentiation potential, gene expression, and cytokine secretion. Stem cells and development 17(3):451-461.) Данный документ включен в настоящее изобретение посредством ссылки. Моноклональные стволовые клетки обладают более высокой экспрессией ICOSL по сравнению с hncMSC. Они также обладают превосходным индуцирующим воздействием на дифференцировку регуляторных Т-клеток по сравнению с hncMSC. Таким образом, их можно более эффективно применять для лечения воспалительных или аутоиммунных заболеваний.
В настоящем изобретении мезенхимальные стволовые клетки могут представлять собой мезенхимальные стволовые клетки, полученные из одного или более источника, выбранного из группы, состоящей из пуповины, пуповинной крови, костного мозга, жира, мышц, нервов, кожи, амниона и плаценты. В частности, они могут предпочтительно представлять собой мезенхимальные стволовые клетки, полученные из костного мозга. Следует понимать, что мезенхимальные стволовые клетки согласно настоящему изобретению включают не только сами стволовые клетки, но и их культуры без ограничения.
ICOSL согласно настоящему изобретению экспрессируется на поверхности мезенхимальных стволовых клеток, и его можно охарактеризовать по повышению экспрессии индуцированного Т-клеточного костимулятора (ICOS) Т-клеток. ICOS экспрессируется на поверхности Т-клеток во время активации Т-клеток. Настоящее изобретение свидетельствует о том, что клетки CD25+FoxP3+ Treg показали более высокую экспрессию ICOS при совместном культивировании hcMSC и CD4+ Т-клеток.
Кроме того, ICOSL согласно настоящему изобретению можно охарактеризовать по активации пути передачи сигнала PI3K-Akt. ICOSL связывается с ICOS Т-клеток, способствуя таким образом фосфорилированию Akt в Treg и активации пути передачи сигнала PI3K-Akt.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками, в которой мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, обработаны одним или более веществом, выбранным из группы, состоящей из IL-1β, ФНО-α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида).
Мезенхимальные стволовые клетки можно обработать одним или более веществом, выбранным из группы, состоящей из IL-1β, ФНО-1α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида), предпочтительно IL-1β, ФНО-1α и ЛПС, наиболее предпочтительно IL-1β, участвуя таким образом в праймировании стволовых клетках. Более конкретно, мезенхимальные стволовые клетки обрабатывают одним или более веществом, выбранным из группы, состоящей из IL-1β, ФНО-α и ЛПС (липополисахарида) для индуцирования повышения экспрессии ICOSL в мезенхимальных стволовых клетках. Таким образом, можно усилить дифференцировку и пролиферацию регуляторных Т-клеток (Treg), получая мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL. Кроме того, полученные мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, можно применять в качестве терапевтического агента на основе стволовых клеток для предотвращения или лечения заболеваний, опосредованных регуляторными Т-клетками, в результате стимулирования эффектов дифференцировки и пролиферации регуляторных Т-клеток.
Таким образом, настоящее изобретение может быть предложено в виде набора, содержащего мезенхимальные стволовые клетки и одно или более вещество, выбранное из группы, состоящей из IL-1β, ФНО-1α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида), предпочтительно одно или более вещество, выбранное из группы, состоящей из IL-1β, ФНО-1α и ЛПС, наиболее предпочтительно IL-1β, расположенные в отдельных секциях. Мезенхимальные стволовые клетки предварительно обрабатывают одним или более веществом, выбранным из группы, состоящей из IL-1β, ФНО-α и ЛПС (липополисахарида), наиболее предпочтительно IL-1β, для индуцирования гиперэкспрессии ICOSL в мезенхимальных стволовых клетках, получая таким образом композицию для предотвращения или лечения заболевания, опосредованного регуляторными Т-клетками, которая содержит мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL.
В контексте настоящего описания термин «заболевание, опосредованное регуляторными Т-клетками» относится к заболеванию, которое вызвано аномалиями или недостаточностью (дефицитом) регуляторных Т-клеток, и, в частности, такое заболевание может представлять собой воспалительное заболевание или аутоиммунное заболевание.
В одном аспекте настоящего изобретения указанное воспалительное заболевание может включать одно или более заболевание, выбранное из группы, состоящей из волчанки, синдрома Шегрена, ревматоидного артрита, фибромиозита, склеродермии, анкилозирующего спондилита, болезни Бехчета, афтозного стоматита, синдрома Гийена Барре, очаговой алопеции, дерматомиозита, болезни Крона, колита, узелкового полиартериита, рецидивирующего полихондрита и аутоиммунной тромбоцитопении.
Кроме того, в одном аспекте настоящего изобретения аутоиммунное заболевание может включать одно или более заболевание, выбранное из группы, состоящей из ревматоидного артрита, системной склеродермии, инсулинзависимого сахарного диабета у детей вследствие разрушения клеток поджелудочной железы, очаговой алопеции, псориаза, пемфигуса, астмы, афтозного стоматита, хронического тиреоидита, частично приобретенной апластической анемии, первичного гепатоцирроза, язвенного колита, болезни Бехчета, болезни Крона, силикоза, асбестоза, болезни почек IgA-типа, пострептококкового гломерулонефрита, синдрома Шегрена, синдрома Гийена Барре, дерматомиозита, полимиозита, рассеянного склероза, аутоиммунной гемолитической анемии, аутоиммунного энцефаломиелита, миастении гравис, гиперплазии щитовидной железы Грейвса, узелкового полиартериита, анкилозирующего спондилоартрита, фиброзита, височного артериита, болезни Вильсона, синдрома Пакони, множественной миеломы и системной красной волчанки.
Композиция согласно настоящему изобретению может содержать фармацевтически приемлемый носитель и/или добавку и т.п. Например, она может содержать стерильную воду, физиологический раствор, обычный буфер (например, фосфорную кислоту, лимонную кислоту и другую органическую кислоту), стабилизатор, соль, антиоксидант, поверхностно-активное вещество, суспендирующий агент, изотонический агент или консервант. Кроме того, она может, но не ограничиваться ими, содержать органическое вещество, такое как биополимер, и неорганическое вещество, такое как гидроксиапатит, в частности, коллагеновую матрицу, полимер полимолочной кислоты или ее сополимер, полимер полиэтиленгликоля или его сополимер, его химическое производное и его смесь. Примеры указанного стабилизатора могут включать декстран 40, метилцеллюлозу, желатин, сульфит натрия, метасульфат натрия и им подобные. Примеры указанного антиоксиданта могут включать хелатирующий агент, такой как эриторбиновая кислота, дибутилгидрокситолуол, бутилгидроксианизол, α-токоферол, токоферилацетат, L-аскорбиновую кислоту и ее соль, пальмитат L-аскорбиновой кислоты, стеарат L-аскорбиновой кислоты, гидросульфит натрия, сульфит натрия, триамилгаллат, пропилгаллат или этилендиаминтетраацетат натрия (ЭДТА), пирофосфат натрия и метафосфат натрия. Примеры указанного суспендирующего агента могут включать метилцеллюлозу, полисорбат 80, гидроксиэтилцеллюлозу, гуммиарабик, трагакантовую камедь, натрийкарбоксиметилцеллюлозу и полиоксиэтиленсорбитана монолаурат. Примеры указанного изотонического агента могут включать D-маннит и сорбит. Примеры указанного консерванта могут включать метилпарабен, этилпарабен, сорбиновую кислоту, фенол, крезол и хлорокрезол.
Фармацевтический препарат, содержащий полученные таким образом мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, их культуры или ICOSL согласно настоящему изобретению, можно вводить с другими стволовыми клетками, применяемыми для трансплантации и других применений или в форме смеси с такими стволовыми клетками с применением способа введения, обычно применяемого в данной области техники. В частности, такой препарат можно, но не ограничиваться этим, вводить путем непосредственного внедрения (engraft) или трансплантации в очаг поражения у пациента, нуждающегося в таком лечении, или путем непосредственной трансплантации или инъекции в брюшную полость. Кроме того, введение можно осуществить путем нехирургического введения с применением катетера и путем хирургического введения, как, например, инъекции или трансплантации, после разрезания очага поражения. Тем не менее, способ нехирургического введения с применением катетера является более подходящим. Кроме того, введение можно осуществить при помощи парентеральной инъекции согласно обычному способу, например, при помощи прямой инъекцией в очаг поражения, а также путем имплантации при помощи внутрисосудистой инъекции. Единичная доза стволовых клеток составляет от 1,0×104 до 1,0×1010 клеток/кг массы тела, в частности от 1,0×105 до 1,0×109 клеток/кг массы тела, более конкретно от 1,0×106 до 1,0×108 клеток/кг масса тела, и их можно вводить один или несколько раз в разделенных дозах. Тем не менее, следует понимать, что фактическую дозу активного ингредиента определяют в зависимости от различных соответствующих факторов, таких как заболевание, подлежащее лечению, тяжесть заболевания, путь введения и масса тела, возраст и пол пациента. Доза не предназначена для ограничения каким-либо образом объема настоящего изобретения.
Кроме того, в настоящем изобретении предложен способ предотвращения или лечения заболевания, опосредованного регуляторными Т-клетками, который включает введение индивидууму лиганда индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальной стволовой клетки, гиперэкспрессирующей ICOSL.
Предпочтительно указанный индивидуум является млекопитающим, включая человека, который является пациентом, нуждающимся в терапии заболевания, опосредованного регуляторными Т-клетками, включая пациента, получающего лечение от заболевания, опосредованного регуляторными Т-клетками, пациента, который получал лечение от заболевания, опосредованного регуляторными Т-клетками, и пациента с заболеванием, опосредованным регуляторными Т-клетками, который нуждается в таком лечении. Он может также включать пациента, который подвергался хирургической операции для лечения заболевания, опосредованного регуляторными Т-клетками.
Кроме того, в настоящем изобретении можно применять лиганды индуцированных Т-клеточных костимуляторов (ICOSL) или мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, а также с их помощью осуществлять лечение, в комбинации с лекарственными средствами или методами лечения для терапии других обычных заболеваний, опосредованных регуляторными Т-клетками. В случае, когда лиганды индуцированных Т-клеточных костимуляторов (ICOSL) или мезенхимальные стволовые клетки, гиперэкспрессирующие ICOSL, согласно настоящему изобретению применяют в комбинации, лечение с их помощью можно проводить одновременно или последовательно с лечением другими лекарственными средствами или методами лечения для терапии заболеваний, опосредованных регуляторными Т-клетками.
Кроме того, в одном аспекте настоящего изобретения предложена композиция для индуцирования дифференцировки и пролиферации CD4+ Т-клетки в регуляторную Т-клетку, которая содержит лиганд индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL.
Термин «индукция дифференцировки и пролиферации» относится к стимулированию дифференцировки CD4+ Т-клеток в регуляторные Т-клетки в результате прямого контакта между CD4+ Т-клетками и ICOSL на поверхности мезенхимальной стволовой клетки и пролиферации регуляторных Т-клеток, которые были дифференцированы и индуцированы при помощи лигандов индуцированных Т-клеточных костимуляторов (ICOSL) или мезенхимальных стволовых клеток, гиперэкспрессирующих ICOSL.
Для того, чтобы дополнительно способствовать экспрессии ICOSL на поверхности мезенхимальных стволовых клеток, указанная композиция может дополнительно содержать одно или более вещество, выбранное из группы, состоящей из IL-1β, ФНО-α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида), предпочтительно одно или более вещество, выбранное из группы, состоящей из IL-1β, ФНО-1α и ЛПС, и наиболее предпочтительно IL-ip.Одно или более вещество, выбранное из группы, состоящей из IL-1β, ФНО-α и ЛПС, представляет собой вещество, которое праймирует мезенхимальные стволовые клетки, способствуя таким образом гиперэкспрессии ICOSL на поверхности мезенхимальных стволовых клеток.
В другом аспекте настоящего изобретения предложен способ индуцирования дифференцировки и пролиферации CD4+ Т-клетки в регуляторную Т-клетку, который включает обработку CD4+ Т-клеток in vitro лигандом индуцированного Т-клеточного костимулятора (ICOSL) или мезенхимальной стволовой клеткой, гиперэкспрессирующей ICOSL.
В указанном способе мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL, можно предварительно обработать одним или более веществом, выбранным группы, состоящей из IL-1β, ФНО-1α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида), предпочтительно одним или более веществом, выбранным из группы, состоящей из IL-1β, ФНО-1α и ЛПС, и наиболее предпочтительно IL-1β. ICOSL или стволовые клетки с повышенной экспрессией ICOSL могут индуцировать повышенную экспрессию ICOS в CD4+ Т-клетках в результате непосредственного контакта с CD4+ Т-клетками, и могут способствовать дифференцировке в регуляторные Т-клетки и пролиферации дифференцированных регуляторных Т-клеток.
В данном способе обработка может включать как культивирование CD4+ Т-клеток в лунке, покрытой ICOSL, так и совместное культивирование CD4+ Т-клеток с мезенхимальными стволовыми клетками, гиперэкспрессирующими ICOSL.
Следует понимать, что описанные в настоящем документе численные значения включают эквивалентные диапазоны, если не указано иное.
Далее для облегчения понимания настоящего изобретения будут описаны предпочтительные примеры получения примеров, примеры и примеры приготовления. Тем не менее, следующие примеры получения, примеры и примеры приготовления приведены только для более легкого понимания настоящего изобретения, и они не ограничивают содержание настоящего изобретения.
[Принцип настоящего изобретения]
Пример 1: Анализ характеристики человеческих клональных MSC (hcMSC)
Человеческий костный мозг собирали у здорового мужчины-донора. Эксперимент проводили согласно разрешению, полученному экспертным советом организации университетской больницы Инха (IRB №10-51). Клетки hcMSC выделяли при помощи способа культивирования с субфракционированием согласно предшествующему документу (Song S.U. et al. (2008). Вариации линий клональных стволовых клеток мозга определяли по полученным из человеческого костного мозга эпитопам клеточной поверхности, потенциалу дифференцировки, экспрессии генов и секреции цитокинов (Stem cells and development, 17 (3): 451-461.). Все hcMSC инкубировали в среде Игла, модифицированной по способу Дульбекко (DMEM), с низким содержанием глюкозы, дополненной 10% фетальной бычьей сывороткой (FBS) и 1% смесью пенициллин/стрептомицин. Выделенные hcMSC анализировали с применением проточной цитометрии для идентификации различных маркеров клеточной поверхности. Антитела, применяемые для анализа, были следующими: антитело против CD29 (Serotec, Кидлингтон, Великобритания), антитело против CD44 (Serotec), антитело против CD 105 (Serotec), антитело против CD34 (BD Biosciences, Сан-Диего, штат Калифорния, США) антитело против CD45 (BD Biosciences), антитело против CD90 (BD Biosciences), антитело против CD73 (BD Biosciences), антитело против HLA класса I (BD Biosciences), антитело против HLA DR (BD Biosciences), антитело против CD80 (eBiosciences, Сан-Диего, штат Калифорния, США), антитело против CD86 (SouthernBiotech, Бирмингем, штат Алабама, США) и антитело против Oct4 (Cell Signaling Technology, Данверс, штат Массачусетс, США). Клетки анализировали с применением проточного цитометра (FACS Calibur; BD Biosciences). В качестве контролей применяли контрольные антитела с парными изотипами. Результаты идентификации экспрессии поверхностных маркеров hcMSC с применением проточной цитометрии показаны на ФИГ. 1.
Как показано на ФИГ. 1, было обнаружено, что экспрессия была позитивной для CD29, CD44, С73, CD90, CD105, Oct-4 и HLA класса I, но было обнаружено, что она является негативной для CD34, CD45 и HLA-DR. Было также обнаружено, что экспрессия является негативной для костимуляторных факторов CD80 и CD86.
Аактивность hcMSC в отношении РВМС in vitro определяли при помощи анализа с применением карбоксифлуоресцеина (CFSE). hcMSC совместно культивировали с РВМС, обработанными РНА. Более конкретно, РВМС в количестве 1×106 окрашивали 1 мкМ CFSE, окрашенные РВМС стимулировали 1 мкг/мл РНА в присутствии или в отсутствии 1×105 или 1×106 hcMSC. После стимуляции РНА в течение 72 часов РВМС собирали и анализировали методом проточной цитометрии. Результаты показаны на ФИГ. 2.
Как показано на ФИГ. 2, в случае, когда hcMSC совместно культивировали с активированными РВМС, обработанными РНА, они ингибировали пролиферацию РВМС.
Пример 2: Определение индуцирования дифференцировки Treg клетками hcMSC
Мононуклеарные клетки периферической крови (РВМС) собирали от здоровых доноров и разделяли при помощи центрифугирования в градиенте плотности фикол-гипака. CD4+ Т-клетки, полученные из РВМС, получали с применением набора для выделения CD4+ Т-клеток MicroBeads (Miltenyi Biotech, Bisley, Суррей, Великобритания).
Для того, чтобы идентифицировать дифференцировку Treg, выделенные CD4+ Т-клетки инкубировали в полной среде, содержащей RPMI 1640, дополненной 10% ФБС, 2 мМ L-глутамином и 100 ед/мл пенициллина. В 24-луночном планшете лунки покрывали 1 мкг/мл моноклонального антитела против CD3 при 4°С в течение ночи. Кроме того, очищенные CD4+ Т-клетки стимулировали антителом против CD3, антителом против CD28, IL-2, TGF-b1 и atRA, что являлось условием для дифференцировки Treg. Для того, чтобы идентифицировать дифференцировку Treg, подтверждали экспрессию FoxP3 и CD25 на 2 и 5 день.
Для того, чтобы подтвердить взаимосвязь между индукцией Treg и hcMSC, CD4+ Т-клетки совместно культивировали с hcMSC, или инкубировали только CD4+ Т-клетки без hcMSC. Результаты подтверждали при помощи анализа на определение экспрессии FoxP3 и CD25 и через увеличение числа клеток FoxP3+CD4+CD25+ на 1-3 день. Результаты показаны на ФИГ. 3.
Как показано на ФИГ. 3, клетки FoxP3+CD25+ Treg постепенно обнаруживались в условиях индуцирования Treg (А). Кроме того, совместное культивирование с hcMSC значительным образом индуцировало большее число клеток FoxP3+CD25+ Treg (В), а также увеличивало популяцию клеток FoxP3+CD25+, полученную из CD4+ Т-клеток (С).
Результаты свидетельствуют о том, что hcMSC могут на высоком уровне индуцировать Treg.
Пример 3: Определение контакт-зависимого индуцирующего воздействия hcMSC
hcMSC совместно культивировали с CD4+ Т-клетками, и появление таких клеток подтверждали при помощи светового микроскопа (×400). Клетки классифицировали как адгезивные или плавающие в зависимости от формы присутствия. Уровни экспрессии CD25 и FoxP3 сравнивали методом проточной цитометрии.
Как показано на ФИГ. 4, при помощи светового микроскопа было подтверждено, что CD4+ Т-клетки присутствовали в адгезивной или плавающей форме (А). Некоторые CD4+ Т-клетки находились в контакте с hcMSC, а адгезивные CD4+ Т-клетки на высоком уровне экспрессировали CD25+ и FoxP3+. Тем не менее, некоторые CD4+ Т-клетки плавали в среде для культивирования. Эти плавающие клетки экспрессировали более низкий уровень CD25+ и FoxP3+, чем адгезивные клетки (В).
Для того, чтобы дополнительно подтвердить необходимость контакта клеток в опосредованной MSC индукции Treg, в течение 2 дней проводили трансвел-анализ. Для трансвел-анализа CD4+ Т-клетки инкубировали в нижней камере, a hcMSC находились в верхней камере. Подтверждали, можно ли при помощи этого способа культивирования получить эффект индукции Treg клетками hcMSC, и результаты показаны на ФИГ. 5.
Как показано на ФИГ. 5, в случае, когда CD4+ Т-клетки и hcMSC инкубировали отдельно с применением трансвел-анализа, hcMSC не влияли на экспрессию CD25+ и FoxP3+ в CD4+ Т-клетках.
Эти результаты свидетельствуют о том, что для опосредованной hcMSC индукции Treg необходимо наличие контакта клеток, что свидетельствует о том, что непосредственное взаимодействие между hcMSC и Т-клетками может играть ключевую роль в передаче индуцирующих сигналов для дифференцировки Treg в CD4+ Т-клетках.
Пример 4: Определение взаимосвязи между экспрессией ICOSL на поверхности hcMSC и индукцией Treg
Было подтверждено, что непосредственное взаимодействие между hcMSC и Т-клетками индуцирует дифференцировку Treg. Следовательно, ожидалось, что экспрессия ICOSL на поверхности hcMSC будет играть существенную роль в передаче сигнала. Таким образом, для подтверждения этого предположения были проведены эксперименты. Клетки hcMSC и CD4+ Treg совместно культивировали в течение 2 дней в условиях индуцирования Treg. Экспрессию белка ICOSL на поверхности hcMSC подтверждали методом проточной цитометрии. Экспрессию мРНК подтверждали количественной ПЦР в режиме реального времени после 24 часов совместного культивирования. Неадгезивные CD4+ Т-клетки удаляли с последующим иммунофлуоресцентным окрашиванием. Затем экспрессию ICOSL на поверхности hcMSC наблюдали при помощи конфокального микроскопа. Суммарную РНК hcMSC измеряли с применением реагента для выделения РНК EasyBlue (Intron, Biotechnology, Соннам, Корея), а кДНК синтезировали из 2 мкг суммарной РНК с применением набора для синтеза кДНК AccuPower (Bioneer, Тэджон, Корея). Полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР) проводили с применением премикса AccuPower PCR (Bioneer). Амплифицированные продукты ПЦР подвергали электрофорезу на 1% агарозном геле, содержащем SybrSafe, и анализировали при помощи анализатора флуоресцентных изображений. ПЦР проводили с применением следующих праймеров: IL-10 (прямая 5'-ATCCAAGACAACACTACTAA-3' и обратная 5'-TAAATATCCTCAAAGTTCC-3'), IL-1 (прямая 5'-GCTGAGTGCTGCAAAGTACC-3' и обратная 5'-TGAGGAGGGA-CTTGTGACTG-3'), IL-1R (прямая 5'-ATTGATGTTCGTCCCTGTCC-3' и обратная 5'-CCTCCACCTTAGCAGGAACA-3') и GAPDH (прямая 5'-CCACTGGCGTCTTCACCAC-3' и обратная 5'-CCTGCTTCACCACCTTCTTG-3').
Для подтверждения наличия мРНК ICOSL количественную ПЦР в режиме реального времени (qRT-PCR) проводили с примением зондов TaqMan (ID анализа: Hs00323621_m1; Applied Biosystems, Фостер Сити, штат Калифорния, США) и TaqMan Universal PCR Master Mix (Applied Biosystems). Уровень мРНК нормировали no 18S рРНК (Hs03928985_g1). Результаты показаны на ФИГ. 6.
Как показано на ФИГ. 6, при помощи проточной цитометрии было подтверждено, что ICOSL значимым образом повышающе регулируется на поверхности совместно культивированных hcMSC в условиях для дифференцировки Treg (А). Кроме того, методом qRT-PCR установили, что экспрессия мРНК ICOSL на поверхности hcMSC увеличилась во время совместного культивирования (В), что не противоречит результатам проточной цитометрии. Экспрессию ICOSL в совместно культивированных hcMSC дополнительно подтверждали с применением иммунофлюоресцентного окрашивания (С).
Эти результаты свидетельствуют о том, что экспрессия ICOSL на поверхности hcMSC повышается в условиях индуцирования Treg.
Пример 5: Определение повышенной экспрессии ICOS Т-клеткой, совместно культивированной с hcMSC
Было известно, что ICOS повышающим образом регулируется в Т-клетках после активации, и что ICOSL, экспрессированный на поверхности АРС, может ингибировать Т-клеточные ответы, стимулируя индукцию Treg. Для определения того, воздействуют ли hcMSC на экспрессию ICOS Т-клетками, hcMSC и CD4+ Т-клетки совместно культивировали в течение 48 часов в условиях для дифференцировки Treg. Индукцию экспрессии ICOS CD4+ Т-клетками в присутствии hcMSC подтверждали 5 независимыми экспериментами. Результаты показаны на ФИГ. 7.
Как показано на ФИГ. 7, уровень ICOS еще больше увеличивался в условиях совместного культивирования CD4+ Т-клеток и hcMSC (А). Интересно отметить, что клекти CD25+FoxP3+ Treg экспрессировали ICOS на более высоком уровне в присутствии hcMSC (В). Эти результаты свидетельствуют о том, что hcMSC стимулируют CD4+ Т-клетки для представления фенотипов FoxP3+ Treg с более высокой экспрессией ICOS.
Пример 6: Определение пути передачи сигнала ICOS-ICOSL
Для того, чтобы получить непосредственные доказательства взаимодействия между индукцией Treg и ICOSL на поверхности hcMSC, блокировали функцию ICOSL и наблюдали за ее изменением. Для того, чтобы блокировать функцию ICOSL, проводили обработку нейтрализующими антителами против ICOSL и эксперименты по нацеливанию на ген.
В частности для того, чтобы блокировать функцию ICOSL, к совместной культуре hcMSC и CD4+ Т-клеток добавляли 10 мкг/мл нейтрализующего антитела против ICOSL. Поверхность клеток окрашивали CD25, конъюгированным с флуоресцеиноизотиоцианатом (FITC) или аллоцикоцианином (АРС), АРС- и РЕ-коннъюгированным ICOS, FITC-конъюгированным CD4 (eBiosciences) в течение 20 минут при температуре 4°С в темноте. Совместное культивирование проводили в течение 2 дней, а соотношение популяции клеток FoxP3+CD25+ и Foxp3+ICOS+ определяли методом проточной цитометрии.
Между тем, ICOS-ICOSL-взаимодействие играет важную роль в образовании IL-10, а Treg, экспрессирующий ICOS, способствует образованию IL-10. Следовательно, образование IL-10 клетками Treg, индуцированными hcMSC, анализировали с применением проточного цитометрического анализатора и при помощи метода ELISA. Образование IL-10 подтверждали после повторного стимулирования клеток форбол-12-миристат-13-ацетатом (РМА, 40 нг/мл, Sigma) и иономцином (1 мкг/мл, Sigma) в течение 5 часов. Для прекращения стимуляции добавляли монензин (4 мкМ, Sigma).
При опосредованной hcMSC индукции Treg, результаты блокирования функции ICOSL в результате обработки нейтрализующим антителом показаны на ФИГ. 8.
Как показано на ФИГ. 8, обработка нейтрализующими антителами (alCOSL) против ICOSL позволила значительно уменьшить популяцию клеток CD25+FoxP3+ Treg, понизив таким образом экспрессию ICOS в указанной популяции Treg (А). Между тем, hcMSC значительно увеличивали образование IL-10 клетками Treg, тогда как образование IL-10 уменьшалось при обработке нейтрализующим антителом против ICOSL (В и С).
Кроме того, был осуществлен нокдаун ICOSL в клетках hcMSC путем инфицирования их лентивирусами, экспрессирующими нацеливающиеся на ICOSL кшРНК (shICOSL). Затем для популяции клеток Treg наблюдали изменения в экспрессии Foxp3, ICOS и CD25. Для нокдауна лентивирусного гена, опосредованного короткошпилечной РНК (кшРНК), содержащие ICOSL вирусные частицы были приобретены у компании Santa cruz (Santa cruz biotechnology, Санта-Крус, штат Калифорния, США). Для трансфекции кшРНК клетки hcMSC в количестве 1×105 высевали в 24-луночный планшет.На следующий день адгезивные hcMSC инфицировали контрольными лентивирусными частицами (shCon) или лентивирусными частицами, экспрессирующими нацеливающуюся на ICOSL кшРНК (shICOSL), в присутствии или в отсутствие полибрена (5 мкг/мл, Санта-Крус) в течение 24 часов. Нокдаун ICOSL подтверждали при помощи qRT-PCR-анализа. Инфицированные hcMSC дополнительно культивировали с CD4+ Т-клетками в условиях индуцирования Treg. Результаты нокдауна и индуцирующих Treg воздействий в зависимости от нокдауна показаны на ФИГ. 9.
Как показано на ФИГ. 9, был осуществлен эффективный нокдаун ICOSL путем обработки кшРНК (А). Индуцирование Treg клеток hcMSC таким нокдауном понижался в такой группе с нокдауном ICOSL (В).
Эти результаты показывают, что ICOSL играет важную роль в опосредованной hcMSC индукции Treg.
Пример 7: Индукция популяции клеток Treg в результате гиперэкспрессии ICOSL в клетках hcMSC
7.1 Определение индукции гиперэкспрессии ICOSL
При опосредованной MSC индукции Treg, в клетках hcMSC индуцировали гиперэкспрессию ICOSL и исследовали воздействие такой гиперэкспрессии. Для гиперэкспрессии ICOSL в hcMSC, лентивирус, экспрессирующий полноразмерный человеческий ген ICOSL, трансдуцировали в клетки hcMSC вместе с конструкциями для вирусной упаковки. Более конкретно, векторы экспрессии полноразмерного человеческого гена ICOSL субклонировали в pLent векторы с mGFP-меткой (мономерный зеленый флуоресцентный белок) на С-конце. Для количественной оценки кДНК их трансформировали в компетентные клетки E.coli, и полученные клоны секвенировали для подтверждения встраивания ICOSL. Клетки 293FT трансфицировали вектором экспрессии ICOSL с применением набора для упаковки Lenti-vpak (Origene). Клетки 293FT для образования лентивируса в количестве 2,5×106 высевали в 100 мм чашку для культивирования. Через два дня супернатант культуры клеток, содержащий вирус, собирали и применяли для инфицирования hcMSC. После инфицирования hcMSC для проверки уровня гиперэкспрессии ICOSL применяли qRT-PCR, вестерн-блоттинг и проточную цитометрию. Результаты показаны на ФИГ. 10.
Как показано на ФИГ. 10, было подтверждено, что клетки hcMSC (hcMSCICOSL), трансдуцированные лентивирусом, экспрессирующим полноразмерный человеческий ICOSL, повышают экспрессию мРНК и белка ICOSL по сравнению с контрольными MSC, трансдуцированными пустым вектором (hcMSCEmp) (А и В). Кроме того, индуцирование ICOSL дополнительно подтверждали экспрессией ICOSL, слитого с GFP, в лентивирусном векторе экспрессии. Результаты свидетельствовали о том, что количество GFP увеличивалось в клетках hcMSCIC0SL с эффективной индукцией гиперэкспрессии ICOSL.
7.2 Определение повышенной индукции Treg в клетках hcMSCICOSL
Было подтверждено, что в эксперименте по п. 7.1 наблюдалась гиперэкспрессия ICOSL в клетках hcMSC. Таким образом, проточную цитометрию и ELISA применяли для подтверждения того, было ли повышена индукция Treg в клетках hcMSCICOSL. Результаты показаны на ФИГ. 11.
Как показано на ФИГ. 11, hcMSCICOSL индуцировали большее количество клеток CD25+FoxP3+ Treg по сравнению с контрольными клетками, в которые вводили пустой вектор, а клетки Treg, индуцированные hcMSCICOSL, экспрессировали ICOS на более высоком уровне (А). Кроме того, проточный цитометрический анализ и анализ ELISA применяли для подтверждения того, способствовали ли дополнительно клетки Treg, индуцированные hcMSCICOSL, образованию и секреции IL-10, эффекторного противовоспалительного цитокина. Эти результаты свидетельствуют о том, что ICOSL выполняет ключевую роль в опосредованной MSC индукции Treg, которая является результатом того, что ICOSL MSC выполняет роль эффективного индуктора Treg.
Пример 8: Определение ингибирующего воздействия hcMSC-индуцированных клеток Treg на пролиферацию РВМС
Было подтверждено, что клетки hcMSC индуцировали так, чтобы CD4+ Т-клетки проявляли фенотипы Treg, экспрессирующих CD25, FoxP3, ICOS и IL-10 в условиях индуцирования Treg. Между тем, известно, что клетка Treg обладает ингибирующей активностью в отношении лимфоцитов как in vitro, так и in vivo. Таким образом, подтверждали, подавляли (ингибировали) ли клетки Treg пролиферацию активированных лимфоцитов.
CD4+Т-клетки, очищенные от клеток РВМС, совместно культивировали с клетками hcMSCICOSL или hcMSCEmp в условиях индуцирования Treg в течение 2 дней. Затем CD25+ клетки выделяли из CD4+ Т-клеток, содержащих популяцию Treg. РВМС помечали при помощи 10 мкМ CFSE в предварительно нагретом ФСБ при конечной концентрации 107 клеток/мл. РВМС, меченные CFSE, стимулировали в присутствии 1 мкг/мл моноклонального антитела против CD3 (eBiosciences) и 3 мкг/мл моноклонального антитела против CD28 (eBiosciences) в течение 3 дней. Популяцию CD25+ клеток, выделенных из совместной культуры CD4+ Т-клеток и hcMSCICOSL или hcMSCEmp, совместно культивировали с CFSE-мечеными и активированными РВМС при соотношении 1:5 или 1:10 (Treg:PBMC) в течение 3 дней. Пролиферацию РВМС анализировали с применением проточного цитометра, который позволяет оценить разбавление CFSE. Результаты показаны на ФИГ. 12.
Как показано на ФИГ. 12, анализ на определение CFSE показал, что содержание активированных РВМС составляло приблизительно 80% при отсутствии Treg. Когда их совместно культивировали с Treg, деление РВМС уменьшалось в зависимости от числа клеток, так что клетки Treg проявляли иммунный ингибирующий эффект.Между тем, очевидные функциональные отличия между клетками Treg, индуцированными hcMSCICOSL и индуцированными hcMSCEmp, в отношении ингибирования РВМС отсутствовали.
Пример 9: Определение активации пути передачи сигнала PI3K-Akt в результате ICOSL-ICOS-взаимодействия
Известно, что путь передачи сигнала PI3K-Akt играет важную роль в функциях Т-клеток, таких как пролиферация, миграция, дифференцировка и образование цитокинов Т-клетками. Для того, чтобы дополнительно определить физиологическую функцию ICOSL, регуляцию молекулярной передачи сигнала в результате ICOSL-ICOS-взаимодействия при дифференцировке Treg исследовали с точки зрения передачи сигнала.
Для данного Примера CD4+ Т-клетки обрабатывали rhICOSL, рекомбинантным человеческим ICOSL (5 мкг/мл) (R&D research, Миннеаполис, штат Миннесота, США), в течение 2 дней в условиях индуцирования Treg, и экспрессию ими CD25, ICOS и FoxP3 анализировали методом проточной цитометрии. Было проведено пять независимых экспериментов. В частности, для введения rhICOSL (R&D research, Миннеаполис, штат Миннесота, США) лунки покрывали 5 мкг/мл rhICOSL при 37°С в течение 4 часов. Очищенные CD4+ клетки добавляли в каждую из таких лунок при концентрации 1×106 клеток/мл, которые стимулировали при помощи 1 нг/мл IL-2 (eBiosciences), 5 нг/мл TGF-α (R&D research, Миннеаполис, штат Миннесота, США) и 0,1 мкМ полностью транс-ретиноевой кислоты (atRA, PHASigma-Aldrich, Сент-Луис, штат Миссури, США), а также 3 мкг/мл моноклонального антитела против CD28 (eBiosciences) в течение 2-5 дней. Клетки hcMSC совместно культивировали с CD4+ Т-клетками при соотношении 1:10 (hcMSC:T-клетки) в течение 2 дней. Через 2 дня hcMSC промывали три раза холодным фосфатно-солевым буфером (ФСБ), содержащим 0,05 мМ этилендиаминтетрауксусной кислоты (ЭДТА), для отсоединения лимфоцитов от hcMSC. Затем hcMSC трипсинизировали и дважды промывали холодным раствором ФСБ-ЭДТА и окрашивали при помощи конъюгированного с фикоэритрином (РЕ) антитела против ICOSL (BioLegend) для анализа экспрессии ICOSL. Фосфорилирование Akt в результате обработки rhICOSL подтверждали методом вестерн-блоттинга. Результаты показаны на ФИГ. 13.
Как показано на ФИГ. 13, аналогично результатам обработки hcMSC, обработка rhICOSL CD4+ Т-клеток также на достаточном уровне способствовала индукции клеток FoxP3+ICOS+ Treg по сравнению с необработанным контролем (А). Кроме того, обработка rhICOSL значительным образом увеличивала фосфорилирование Akt (В). Эти результаты показывают, что ICOSL активирует путь передачи сигнала PI3K-Akt во время индукции Treg.
Пример 10: Определение регуляции дифференцировки Treg через путь передачи сигнала PI3K-Akt
Для того, чтобы дополнительно продемонстрировать участие пути передачи сигнала PI3K-Akt в опосредуемой ICOSL дифференцировке Treg, их обрабатывали ингибитором фосфатидилинозитид-3-киназ (PI3K) LY294002 или ингибитором Akt GSK690693, и таким образом подтверждали данные результаты. Ингибитор Akt GSK649 (Calbiochem, Сан Диего, штат Калифорния, США) применяли в концентрации 1 мкМ, a LY294002 (Cell Signaling Technology, Данверс, штат Массачусетс, США) применяли в концентрации от 5 до 10 мкМ.
Более конкретно, CD4+ Т-клетки предварительно обрабатывали LY294002 (5 мкМ) и GSK690693 (1 мкМ) в течение 30 мин. Подтверждали то, индуцирует ли экзогенная обработка rhICOSL фосфорилирование Akt, и ингибируют ли ингибиторы PI3K-Akt фосфорилирование Akt, индуцированное rhICOSL, в течение часа в условиях индуцирования Treg. Была определена суммарная Akt. Кроме того, после обработки LY294002 (5 мкМ) или GSK690693 (1 мкМ) в течение 2 дней обработанные rhICOSL CD4+ Т-клетки инкубировали для анализа экспрессии CD25, ICOS и FoxP3, оценивая таким образом воздействие ингибирования PI3K-Akt при rhICOSL-индуцированной индукции Treg. Результаты показаны на ФИГ. 14.
Как показано на ФИГ. 14, обработка как LY294002, так и GSK690693 приводила к значительному уменьшению фосфорилирования Akt (А). В то же время, эти ингибиторы снижали количество индуцированных rhICOSL или hcMSC клеток Treg (В). Эти результаты свидетельствуют о том, что путь передачи сигнала PI3K-Akt участвует в регулируемой ICOSL индукции Treg. С другой стороны, снижение популяции клеток Treg при нормальных состояниях в результате ингибирования пути PI3K-Akt свидетельствует о функциональной важности этого пути передачи сигнала при нормальной индукции Treg (В). Эти результаты свидетельствуют о том, что ось передачи сигнала ICOSL-ICOS-PI3K-Akt может участвовать в регуляции опосредованной hcMSC индукции Treg.
Пример 11. Определение корреляции между экспрессией ICOSL и индукцией Treg среди клонов MSC
Известно, что различные клоны MSC обладают различными функциональными свойствами. Таким образом, подтверждали, отличались ли уровни экспрессии ICOSL для индуцирования человеческих Treg в зависимости от hcMSC. В общей сложности шесть линий hcMSC, включая пять линий клональных hcMSCs (hcMSC1-5) и одну линию неклональных hcMSC (hncMSC), полученных от одного донора, исследовали на определение их основной экспрессии ICOSL методами вестерн-блоттинга и qRT-PCR. Кроме того, для оценки индуцирующей Treg активности hcMSC исследовали потенциал индукции Treg линий hcMSC1 и hcMSC4, при которой экспрессию CD25 и FoxP3 сравнивали между линиями клеток hncMSC, hcMSC1 и hcMSC4 путем совместного культивирования каждой линии клеток с клетками РВМС в реакции смешанных лимфоцитов (MLR) или в условиях индуцирования Treg. Результаты показаны на ФИГ. 15.
Как показано на ФИГ. 15, было подтверждено, что линия клеток hcMSC4 показала наивысший уровень экспрессии мРНК ICOSL, и большинство клеток hcMSC показали более высокий уровень экспрессии ICOSL по сравнению с hncMSC (А и В). В частности, линия клеток hcMSC4 показала наивысшую экспрессию CD25 и FoxP3 как в условиях MLR (С), так и в условиях индуцирования Treg (D). Результаты подтверждают, что линия клеток hcMSC4 является наиболее эффективной линией клеток для индукции Treg. Кроме того, поскольку линии клеток демонстрируют более высокую экспрессию мРНК ICOSL, наблюдаются и более сильные индуцирующие Treg воздействия. Эти результаты показывают, что эффективность экспрессии ICOSL коррелируется с эффективностью hcMSC для индуцирования Treg, и чем сильнее индуцируемая линия клеток ICOSL, тем сильнее Treg-индуцирующая способность.
Пример 12: Идентификация индукции ICOSL в клетках hcMSC IL-1β
Известно, что на иммуноподавляющую активность MSC можно воздействовать при помощи разнообразных праймирующих или соответствующих стимуляций. Было подтверждено, что экспрессия ICOSL в hcMSC коррелируется с индукцией Treg. Таким образом, ожидалось, что экспрессия ICOSL будет улучшена для увеличения числа Treg и для усиления иммуноподавляющей функции hcMSC. Чтобы подтвердить это прндположение, сначала был проведен эксперимент для подтверждения присутствия провоспалительного цитокина, который может индуцировать экспрессию ICOSL. Во-первых, для обнаружения подходящих праймирующих факторов, hcMSC обрабатывали IL-1β (10 нг/мл), ФНО-α (10 нг/мл) и ЛПС (2 мкг/мл) в течение 24 часов. Затем экспрессию ICOSL определяли через 1 час и через 3 часа методом qRT-PCR. Кроме того, для подтверждения того, изменяла ли обработка IL-1β экспрессию IL-1R в hcMSC, экспрессию IL-IR в hcMSC подтверждали после обработки IL-1β в течение 24 часов. Результаты показаны на ФИГ. 16.
Как показано на ФИГ. 16, было подтверждено, что уровни мРНК ICOSL были увеличены во всех группах обработки IL-1β, ФНО-α и ЛПС (А и В), и среди их числа IL-1β them проявлял наибольшее вляние. Известно, что IL-1β связывается со своим рецептором, IL-1R1, для регулирования клеточного ответа, и IL-1R1 экспрессируется в hcMSC. По результата проведенной RT-PCR было обнаружено, что здоровые hcMSC экспрессируют мРНК IL-1R1. Кроме того, обработка IL-1β (10 нг/мл) незамедлительно и значительным образом повышала экспрессию мРНК ICOLS, но не изменяла экспрессию мРНК IL-1R.
Пример 13: Определение IL-ip-индуцируемого воздействия клональных MSC
Было подтверждено, что индуцируемый эффект экспрессии ICOSL был сильнее в линии клеток hcMSC4, чем в hncMSC. Таким образом, эксперименты проводили для того, чтобы подтвердить различие в ICOSL-индуцируемых воздействиях клональных и некланальных MSC в результате обработки IL-1β. Если подробно, то hcMSC4 и hncMSC обрабатывали IL-1β (10 нг/мл) в течение 24 часов и экспрессию мРНК ICOSL анализировали методом qRT-PCR в динамике. Вестерн-блот-анализ и проточный цитометрический анализ обнаружили изменения в экспрессии белка ICOSL. Способ проточной цитометрии показал репрезентативное значение пяти независимых экспериментов. Результаты показаны на ФИГ. 17.
Как показано на ФИГ. 17, результаты qRT-PCR показали, что стимулированная IL-1β индукция ICOSL различалась между hcMSC4 и hncMSC как через 6, так и 24 часа (А). Различие в индукции ICOSL, стимулированной IL-1β, между двумя линиями клеток MSC было одинаково как при ее определении методом вестерн-блоттинга, так и методом проточной цитометрии (В и С).
Антитело против IL-1β (10 мкг/мл), которое представляет собой нейтрализующее антитело против IL-1β, применяли для определения того, было ли связано различие в воздействии на индукцию ICOSL с IL-1β.
Для подтверждения того, связаны ли различия в ICOSL-индуцируемых воздействиях, зависящих от типа клональных и неклональных MSC, с IL-1β, клетки обрабатывают антителом против IL-1β (10 мкг/мл), которое представляет собой нейтрализующее антитело против IL-1β, для блокировки функции IL-1β. Таким образом, определяли изменение ICOSL-индуцируемых воздействий. Результаты показаны на ФИГ. 18.
Как показано на ФИГ. 18, обработка нейтрализующим антителом против IL-1β, блокировала функцию IL-ip, что приводило к понижению экспрессии ICOSL, индуцированной IL-1β.
Эти результаты показывают, что IL-1β является мощным праймирующим фактором для индуцирования ICOSL в hcMSC.
Пример 14: Определение воздействия увеличения индукции Treg в результате обработки IL-1β
Для исследования того, проявляли ли клетки hcMSC, праймированные IL-1β, более сильную Treg-индуцирующую активности, hcMSC обрабатывали IL-1β в течение 24 часов, получая таким образом клетки hcMSCIL-1β. HcMSCIL-1β совместно культивировали с CD4+ Т-клетками в условиях для дифференцировки Treg. Для подтверждения соотношения популяции CD4+CD25+FoxP3+ или CD4+ICOS+Foxp3+ Т-клеток проводили проточную цитометрию. Кроме того, после обработки нейтрализующим антителом против ICOSL (5 мкг/мл) hcMSCIL-1β совместно культивировали с CD4+ Т-клетками для подтверждения того, подавляло ли ингибирование нейтрализации ICOS индукцию Treg, вызванную праймированными IL-1β клетками hcMSC. Результаты показаны на ФИГ. 19.
Как показано на ФИГ. 19, праймированные IL-1β клетки hcMSC (hcMSCIL-1β) образовывали большее количество CD25+FoxP3+ Treg по сравнению с клетками hcMSCVeh, которые представляют собой клетки hcMSC, непраймированные IL-1β (А). Кроме того, обработка нейтрализующим антителом против ICOSL понижало количество CD25+FoxP3+ Treg, индуцированных как hcMSCIL-1β, так и здоровыми hcMSC (В). Эти результаты показывают, что hcMSC, праймированные IL-1β, экспрессируют ICOSL, который дополнительно стимулирует дифференцировку Treg за счет активации пути передачи сигнала PI3K-Akt.
Пример 15: Ослабление колита, индуцированного DSS, при помощи hcMSC
15.1 Получение животной модели DSS-индуцированного колита и способ проведения эксперимента
Вышеприведенные примеры подтвердили функциональную роль человеческого ICOSL для иммуносупрессорной способности hcMSC. Следовательно, для подтверждения того, действительно ли такое лечение может быть подходящим для лечения заболеваний, опосредованных Т-клетками, подтверждали, влияет ли введение MSC на иммуносупрессорное воздействие в модели колита, которое представляет собой одно из заболеваний, опосредованных Т-клетками.
Острый колит индуцировали у самок мышей Balb/c путем введения питьевой воды с разбавленным в ней 4% DSS с 0 по 7 день и с заменой на обычную воду, начиная с 8 дня. Мышей Balb/c делили на четыре группы. Протокол такой индукции колита в животной модели показан на ФИГ. 20. Клетки hcMSC трансдуцировали лентивирусом, экспрессирующим ICOSL, за 24 часа до введения DSS. Трансдуцированные hcMSC промывали ФСБ и повторно суспендировали при плотности 5×105 клеток/мышь/200 мкл ФСБ. На 1 и 3 день, клетки hcMSC (5×105 клеток, 200 мкл ФСБ) внутривенно вводили через хвостовую вену. Мышей умерщвляли на 10 день. Мышей Balb/c поделили на следующие четыре группы: контрольная группа (Con, 4 мыши), группа с колитом, обработанная ФСБ, (ФСБ+DSS, 6 мышей) и группа с колитом с трансдуцированными клетками hcMSCICOSL (hcMSCICOSL+DSS, 6 мышей).
15.2 Воздействие hcMSC на DSS-индуцированный колит
Оценку степени тяжести в DSS-индуцированной мышиной модели колита определяли ежедневно, оценивая консистенцию кала, кровь и потерю массы тела. У мыши полностью удаляли толстую кишку, и ее длину измеряли по косвенным маркерам воспаления. Для анализа определения Treg у мышей в толстой кишке клетки, выделенные из мезентериальных лимфатических узлов, инкубировали с АРС-конъюгированными антителом против CD25, FITC-коньюгированными антителом против CD4 и РЕ-коньюгированным антителом против FoxP3 (eBioscience). Для эксперимента in vitro CD4+ Т-клетки удаляли из селезенки и лимфатических узлов. Чистоту выделенных клеток определяли методом проточного цитометрического анализа. CD4+ Т-клетки активировали при помощи прикрепленного к планшету 1 мкг/мл моноклонального антитела против CD3 и 3 мкг/мл растворимого моноклонального антитела против CD28 и анализировали на 1 и 2 день. Результаты показаны на ФИГ. 21.
Как показано на ФИГ. 21, было подтверждено, что у трансдуцированных hcMSCICOSL мышей наблюдали меньшее ущемление толстой кишки по сравнению с мышами, которые получали лечение ФСБ. Кроме того, у трансдуцированных hcMSCICOSL мышей наблюдали меньшую потерю массы тела. Эти результаты показывают, что все hcMSCICOSL демонстрируют облегчение колита и терапевтическое воздействие на мышей с колитом.
Приведенные выше результаты в сумме свидетельствуют о том, что ICOS-ICOSL-взаимодействие может играть важную роль в индукции человеческих Treg посредством MSC. В условиях воспаления hcMSC могут индуцировать экспрессию ICOSL на своей поверхности, что может способствовать индукции Treg посредством активации пути передачи сигнала PI3K-Akt в результате взаимодействия с ICOS, экспрессированным на поверхности Treg. IL-1β является мощным праймирующим фактором для улучшения человеческих Treg путем повышающей регуляции экспрессии ICOSL в hcMSC. По этим результатам можно легко понять иммуносупрессорный механизм hcMSC и применять его для разработки более эффективного терапевтического средства на основе стволовых клеток для направленного лечения трудноизлечимых иммунных заболеваний.
Пример получения 1: Получение лекарственных средств
1.1 Получение порошка
ICOSL: 100 мг
Лактоза: 100 мг
Тальк: 10 мг
Компоненты смешивают и упаковывают в герметичный мешок для получения порошков.
1.2 Получение таблетки
ICOSL: 100 мг
Кукурузный крахмал: 100 мг
Лактоза: 100 мг
Стеарат магния: 2 мг
Компоненты смешивают и придают им форму таблетки согласно обычному способу получения препарата в таблетках для получения таблеток.
1.3 Получение капсул
ICOSL: 100 мг
Кукурузный крахмал: 100 мг
Лактоза: 100 мг
Стеарат магния: 2 мг
Компоненты смешивают и наполняют ими желатиновые капсулы согласно обычному способу получения препарата в капсулах для получения капсул.
1.4 Получение агента для инъекции
ICOSL: 100 мг
Стерильная дистиллированная вода для инъекций: подходящее количество
Регулятор рН: подходящее количество
Агент для инъекции получают с содержанием вышеуказанных компонентов на 1 ампулу (2 мл) согласно обычному способу получения препарата для инъекций.
1.5 Получение жидкого агента
ICOSL: 100 мг
Сахар: 20 г
Изомеризованный сахар: 20 г
Ароматизатор «Лимон»: подходящее количество
Добавляли очищенную воду для регулирования общего объема до 100 мл. Вышеуказанные компоненты смешивают согласно обычному способу получения препарата в виде жидкого агента, затем ею заполняют емкость из коричневого стекла и стерилизуют для получения жидких агентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ ОХ40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2562874C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CD25 И Fc ГАММА-РЕЦЕПТОРУ ДЛЯ ЭЛИМИНАЦИИ ОПУХОЛЕСПЕЦИФИЧЕСКИХ КЛЕТОК | 2017 |
|
RU2759970C2 |
| СИСТЕМА И СПОСОБ ПОЛУЧЕНИЯ И ХРАНЕНИЯ АКТИВИРОВАННЫХ ЗРЕЛЫХ ДЕНДРИТНЫХ КЛЕТОК | 2011 |
|
RU2575978C2 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| РАСТВОРИМЫЙ МЕДИАТОР | 2012 |
|
RU2660580C2 |
| НОВАЯ СУБПОПУЛЯЦИЯ CD8CD45RC КЛЕТОК TREG И ЕЕ ПРИМЕНЕНИЯ | 2016 |
|
RU2766691C2 |
| Tr1-КЛЕТКИ, МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2493869C2 |
| СРЕДСТВО, ПРЕДНАЗНАЧЕННОЕ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ АУТОИММУННОГО ЗАБОЛЕВАНИЯ И ДЛЯ ОБРАЗОВАНИЯ РЕГУЛЯТОРНЫХ Т-КЛЕТОК | 2009 |
|
RU2531936C2 |
| Способ получения аутологичных регуляторных Т-лимфоцитов путем культивирования ex vivo в присутствии хорионического гонадотропина | 2022 |
|
RU2791738C1 |
| АНТИ-ICOS АНТИТЕЛА | 2017 |
|
RU2764548C2 |
Изобретение относится к области биотехнологии, а именно к индуцированию дифференцировки CD4+ Т-клетки в регуляторную Т-клетку и пролиферации регуляторной Т-клетки, индуцированной дифференцировкой, а также применениям мезенхимальной стволовой клетки, гиперэкспрессирующей ICOSL (лиганд индуцируемого Т-клеточного ко-стимулятора). Способ включает обработку CD4+ Т-клетки in vitro мезенхимальной стволовой клеткой, гиперэкспрессирующей ICOSL. Мезенхимальную стволовую клетку, гиперэкспрессирующую ICOSL, применяют для лечения воспалительного заболевания или аутоиммунного заболевания и индуцирования дифференцировки CD4+ Т-клетки в регуляторную Т-клетку и пролиферации регуляторной Т-клетки, индуцированной дифференцировкой. Изобретение позволяет расширить арсенал технических средств. 3 н. и 10 з.п. ф-лы, 21 ил., 15 пр.
1. Применение мезенхимальной стволовой клетки, гиперэкспрессирующей ICOSL (лиганд индуцируемого Т-клеточного ко-стимулятора) для лечения воспалительного заболевания или аутоиммунного заболевания.
2. Применение по п. 1, отличающееся тем, что указанный ICOSL экспрессируется на поверхности мезенхимальной стволовой клетки.
3. Применение по п. 1, отличающееся тем, что указанная стволовая клетка представляет собой клональную стволовую клетку.
4. Применение по п. 1, отличающееся тем, что указанная стволовая клетка представляет собой мезенхимальную стволовую клетку, полученную из костного мозга.
5. Применение по п. 1, отличающееся тем, что указанный ICOSL повышает экспрессию индуцируемого Т-клеточного ко-стимулятора (ICOS) Т-клетки.
6. Применение по п. 1, отличающееся тем, что указанный ICOSL активирует путь передачи сигнала PI3K (фосфоинозитид-3-киназы)-Akt.
7. Применение по п. 1, отличающееся тем, что указанная мезенхимальная стволовая клетка обработана одним или более веществом, выбранным из группы, состоящей из IL-β, ФНО-α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида).
8. Применение по п. 1, отличающееся тем, что указанное воспалительное заболевание включает одно или более заболевание, выбранное из группы, состоящей из волчанки, синдрома Шегрена, ревматоидного артрита, фибромиозита, склеродермии, анкилозирующего спондилита, болезни Бехчета, афтозного стоматита, синдрома Гийена Барре, очаговой алопеции, дерматомиозита, болезни Крона, колита, узелкового полиартериита, рецидивирующего полихондрита и аутоиммунной тромбоцитопении.
9. Применение по п. 1, отличающееся тем, что указанное аутоиммунное заболевание включает одно или более заболевание, выбранное из группы, состоящей из ревматоидного артрита, системной склеродермии, инсулинзависимого сахарного диабета у детей вследствие разрушения клеток поджелудочной железы, очаговой алопеции, псориаза, пемфигуса, астмы, афтозного стоматита, хронического тиреоидита, частично приобретенной апластической анемии, первичного гепатоцирроза, язвенного колита, болезни Бехчета, болезни Крона, силикоза, асбестоза, болезни почек IgA-типа, пострептококкового гломерулонефрита, синдрома Шегрена, синдрома Гийена Барре, дерматомиозита, полимиозита, рассеянного склероза, аутоиммунной гемолитической анемии, аутоиммунного энцефаломиелита, миастении гравис, гиперплазии щитовидной железы Грейвса, узелкового полиартериита, анкилозирующего спондилоартрита, фиброзита, височного артериита, болезни Вильсона, синдрома Пакони, множественной миеломы и системной красной волчанки.
10. Применение мезенхимальной стволовой клетки, гиперэкспрессирующей ICOSL (лиганд индуцируемого Т-клеточного ко-стимулятора) для индуцирования дифференцировки CD4+ Т-клетки в регуляторную Т-клетку и пролиферации регуляторной Т-клетки, индуцированной дифференцировкой.
11. Применение по п. 10, включающее одно или более вещество, выбранное из группы, состоящей из IL-β, ФНО-α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида).
12. Способ индуцирования дифференцировки CD4+ Т-клетки в регуляторную Т-клетку и пролиферации регуляторной Т-клетки, индуцированной дифференцировкой, причем указанный способ включает:
обработку CD4+ Т-клетки in vitro мезенхимальной стволовой клеткой, гиперэкспрессирующей ICOSL.
13. Способ по п. 12, отличающийся тем, что указанные стволовые клетки с повышенной экспрессией ICOSL предварительно обработаны одним или более веществом, выбранным из группы, состоящей IL-β, ФНО-α, IL-6, IL-2, IL-1 и ЛПС (липополисахарида).
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 2009 |
|
RU2540018C2 |
| Tr1-КЛЕТКИ, МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2493869C2 |
| ФРЕЙДЛИН И.С | |||
| "Регуляторные Т-клетки: происхождение и функции", Медицинская Иммунология, 2005; 7(4):347-354 | |||
| LIU D | |||
| et al | |||
| "T-B-cell entanglement and ICOSL-driven feed-forward regulation of germinal centre reaction", Nature | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| YANG D | |||
| et al | |||
Авторы
Даты
2020-07-24—Публикация
2017-02-24—Подача