Настоящее изобретение относится к применению ингибитора протеинкиназы С (ИКС) при лечении или профилактике отторжения инсулин-продуцирующих клеток или тканей, такого как отторжение островковых клеток после трансплантации, прежде всего, после трансплантации островковых клеток поджелудочной железы, или для профилактики или замедления отторжения инсулин-продуцирующих тканей, таких как трансдифференцированные гепатоциты, например, для лечения диабета.
Трансплантация всей поджелудочной железы является серьезным хирургическим вмешательством, обычно требующим анестезию, длительное пребывание в стационаре, и связано с риском при проведении хирургической операции и анестезии. Трансплантация островковых клеток является менее инвазивной процедурой, требующей только местной анестезии. Островковые клетки выделяют из поджелудочной железы донора и затем вводят тонкой иглой через пупочную вену реципиента в брюшную полость или в печень через трубку, вставленную в вену. После трансплантации новые островковые клетки продуцируют и выделяют инсулин.
Несмотря на множество вариантов лечения или профилактики указанных отторжений трансплантата, все еще существует необходимость расширения спектра доступных иммунодепрессантных лекарственных средств, обеспечивающих долгосрочную эффективность трансплантированных островковых клеток, т.е. предназначенных для лечения, профилактики или замедления отторжения островковых клеток после трансплантации.
В настоящем изобретении предлагается применение ингибитора ПКС, прежде всего, производного индолилмалеинимида, для профилактики, лечения или замедления отторжения островковых клеток после трансплантации, прежде всего, в случае диабета или хронического панкреатита, где производным индолилмалеинимида является соединение формулы (I)
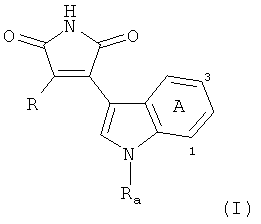 ,
,
где
Ra обозначает Н, С1-С4алкил или С1-С4алкил, замещенный группами ОН, NH2, NHC1-С4алкилом или N(диС1-С4алкилом)2, и
R обозначает радикал формулы (а) или (b)
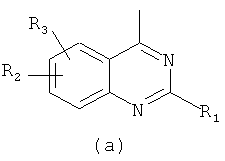
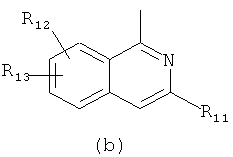 ,
,
где
R1 и R11 каждый обозначает остаток гетероциклила, NR4R5, где R4 и R5 вместе с атомом азота, к которому они присоединены, образуют остаток гетероциклила,
R2, R3, R12 и R13 каждый независимо обозначает Н, галоген, С1-С4алкил, CF3, ОН, SH, NH2, С1-С4алкоксигруппу, С1-С4алкилтиогруппу, NH(С1-С4)алкил, N(диС1-С4алкил)2 или CN, и цикл А необязательно замещен,
или фармацевтически приемлемая соль указанного соединения.
В формуле (I) любой алкил или остаток алкила, например, в составе алкоксигруппы, является линейным или разветвленным. Галоген обозначает F, Cl, Br или I, предпочтительно F или Cl. Любой арил обозначает фенил или нафтил, предпочтительно фенил.
Остаток гетероциклила в качестве R1 или R11, или образованный группой NR4R5, содержит от трех до восьми, предпочтительно от пяти до восьми атомов в насыщенном, ненасыщенном или ароматическом гетероцикле, содержащем 1 или 2 гетероатома, предпочтительно выбранных из N, О и S, и необязательно замещенном.
Пригодные примеры гетероциклического остатка в качестве R1, R11, или образованного группой NR4R5, включают, например, пиридил, например, 3- или 4-пиридил, пиперидил, например, пиперидин-1-ил, 3- или 4-пиперидил, гомопиперидил, пиперазинил, например, 1-пиперазинил, гомопиперазинил, морфолин-4-ил, имидазолил, имидазолидинил, пирролил или пирролидинил, необязательно замещенный, например, моно- или полизамещенный. Если остаток гетероциклила содержит заместители, то указанные заместители присоединены к одному или более атомам углерода в цикле и/или к атому азота, если он присутствует. Примеры заместителей атома углерода в цикле включают, например, С1-С4алкил, например, СН3, С3-С6циклоалкил, например, циклопропил, который, в свою очередь, необязательно замещен С1-С4алкилом, группу 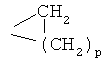 , где р равно 1, 2 или 3, предпочтительно 1, CF3, галоген, ОН, NH2, -CH2-NH2, -СН2-ОН, пиперидин-1-ил, или пирролидинил. Примеры заместителя атома азота в цикле включают, например, C1-С6алкил, ацил, например, R'x-CO, где R'x обозначает Н, С1-С6алкил или фенил, необязательно замещенный С1-С4алкилом, С1-С4алкоксигруппой или аминогруппой, например, формил, С3-С6циклоалкил, С3-С6циклоалкил(С1-С4)алкил, фенил, фенил(С1-С4)алкил, например, бензил, остаток гетероциклила, например, как описано выше, например, ароматический гетероциклический остаток, содержащий 1 или 2 атомов азота, или остаток формулы (а)
, где р равно 1, 2 или 3, предпочтительно 1, CF3, галоген, ОН, NH2, -CH2-NH2, -СН2-ОН, пиперидин-1-ил, или пирролидинил. Примеры заместителя атома азота в цикле включают, например, C1-С6алкил, ацил, например, R'x-CO, где R'x обозначает Н, С1-С6алкил или фенил, необязательно замещенный С1-С4алкилом, С1-С4алкоксигруппой или аминогруппой, например, формил, С3-С6циклоалкил, С3-С6циклоалкил(С1-С4)алкил, фенил, фенил(С1-С4)алкил, например, бензил, остаток гетероциклила, например, как описано выше, например, ароматический гетероциклический остаток, содержащий 1 или 2 атомов азота, или остаток формулы (а)
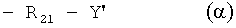
где R21 обозначает С1-С4алкилен или С2-C4алкилен, прерванный О, a Y' обозначает ОН, NH2, (C1-С4алкил) или М(С1-С4алкил)2.
В формуле (I) С2.-С4алкилен, прерванный О, обозначает, например, -СН2-СН2-О-СН2-СН2-.
В формуле (I), если заместитель атома азота в цикле обозначает гетероциклический остаток, он является 5- или 6-членным насыщенным, ненасыщенным или ароматическим гетероциклом, содержащим 1 или 2 гетероатомов, предпочтительно выбранных из N, О и S. Примеры включают, например, 3- или 4-пиридил, пиперидил, например, пиперидин-1-ил, 3- или 4-пиперидил, гомопиперидил, пиперазинил, гомопиперазинил, пиримидинил, морфолин-4-ил, имидазолил, имидазолидинил, пирролил или пирролидинил.
В формуле (I), если Ra обозначает замещенный С1-С4алкил, заместитель предпочтительно расположен у концевого атома углерода.
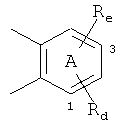
Если цикл А замещен, то он содержит один или более заместителей, предпочтительно один заместитель, причем заместитель(и) выбирают из группы, включающей, например, галоген, ОН, С1-С4алкоксигруппу, например, ОСН3, С1-С4алкил, например, СН3, NO2, CF3, NH2, NH(С1-С4)алкил, N(диС1-С4алкил)2 и CN. Например, цикл А обозначает остаток формулы
 ,
,
где
Rd обозначает Н, С1-С4алкил или галоген, и
Re обозначает ОН, NO2, NH2, NH(С1-С4)алкил, или N(диС1-С4алкил)2.
Предпочтительно Rd расположен в положении 1, a Re предпочтительно расположен в положении 3.
Если в составе Rc группа СН2 заменена на CRxRy, то СН2 предпочтительно содержит Y.
Примеры гетероциклического остатка в качестве R1, R11, или образованного группой NR4R5, включают, например, остаток формулы (γ)
 ,
,
где
цикл D обозначает 5-, 6- или 7-членный насыщенный, ненасыщенный или ароматический цикл,
Xb обозначает -N-, -С= или -СН-,
Хс обозначает -N=, -NRf, -CRf'= или -CHRf'-, где Rf обозначает заместитель атома азота в цикле, как указано выше, a Rf' обозначает заместитель для атома углерода в цикле, как указано выше,
связь между C1 и С2 является насыщенной или ненасыщенной связью,
C1 и С2 каждый независимо обозначает атом углерода, который необязательно содержит один или два заместителя, выбранные из указанных выше заместителей атома углерода в цикле, и
линия между С3 и Xb, а также между С1 и Xb, соответственно обозначает число атомов углерода, которое требуется для образования 5-, 6- или 7-членного цикла D.
Предпочтительный остаток формулы (γ) обозначает остаток, где цикл D образует 1,4-пиперазинил, необязательно С- и/или N-замещенный, как указано выше.
Типичные примеры остатка формулы (γ) включают, например, 3- или 4-пиридил, пиперидин-1-ил, 1-N-(С1-С4алкил)- или -(ω-гидрокси(С1-С4)алкил)-3-пиперидил, морфолин-4-ил, имидазолил, пирролидинил, 1-пиперазинил, 2-(С1-С4)алкил или -С3-С6циклоалкил-1-пиперазинил, 3-(С1-С4)алкил или -С3-С6циклоалкил-1-пиперазинил, 2,2- или 3,5- или 2,5- или 2,6-ди(С1-С4алкил)-1-пиперазинил, 3,4,5-три(С1-С4алкил)-1-пиперазинил, 4-N-(С1-С4алкил)- или
-(ω-гидрокси(С1-С4)алкил)- или -(ω-диметиламино(С1-С4)алкил)-1-пиперазинил, 4-N-пиридин-4-ил-1-пиперазинил, 4-N-фенил- или -С3-С6циклоалкил-1-пиперазинил, 4-N-(С1-С4)алкил)- или -(ω-гидрокси(С1-С4)алкил)-3-(С1-С4)алкил- или -3,3-ди(С1-С4алкил)-1-пиперазинил, 4-N-(1-(С1-С4)алкил(С3-С6)циклоалкил)-1-пиперазинил, 4-N-формил-1-пиперазинил, 4-N-пиримидин-2-ил-1-пиперазинил, 4,7-диазаспиро[2.5]окт-7-ил или 4-N-(C1-С4)алкил-1-гомопиперазинил.
Соединения формулы (I) существуют в свободной форме или в форме соли, например, кислотно-аддитивных солей органических или неорганических кислот, например, соляной кислоты, уксусной кислоты, если R1 или R11 и/или R2, R3, R12 или R13 содержат необязательно замещенную аминогруппу или остаток гетероциклила, которые могут образовывать кислотно-аддитивные соли.
Следует понимать, что соединения формулы (I) могут существовать в форме оптических изомеров, рацематов или диастереоизомеров. Например, атом углерода в цикле, содержащий заместитель в остатке гетероцикла в составе R1, R11 или образованного группой NR4R5, является асимметрическим и характеризуется D- или L-конфигурацией. Следует понимать, что настоящее изобретение включает все энантиомеры и их смеси. Аналогичные рассуждения применимы в отношении исходных соединений, содержащих асимметрические атомы углерода, как указано выше.
В соединениях формулы (I) следующие значения заместителей являются предпочтительными в отдельности или в любой подкомбинации:
1. Ra обозначает Н или СН3,
2. Rb обозначает Н,
3. цикл А является незамещенным или содержит в качестве заместителя метил в положении 7,
4. предпочтительный остаток гетероциклила, образованный группой NR4R5, обозначает, например, пиперазин-1-ил, необязательно N-замещенный, например, С1-С4алкилом, □-гидрокси(С1-С4)алкилом, □-диметиламино(С1-С4)алкилом, С5-С6циклоалкилом, С1-С4алкил(С5-С6)циклоалкилом, ароматический гетероциклический остаток, содержащий 1 или 2 атома азота, например, пиридил или пиримидин-2-ил или 4,7-диазаспиро[2.5]окт-7-ил, или остаток формулы (β), как определено выше, и/или необязательно С-замещенный, например, группой СН3, например, в положениях 2, и/или 3 и/или 5 и/или 6 и/или 2,2 или 3,3, или группой  , например, в положении 2 или 3, пиперидин-1-ил, необязательно С-замещенный, например, в положении 4 группой NH2, -CH2-NH2 или пиперидин-1-илом, или в положении 3, например, группой ОН или NH2, или пирролидинил, необязательно С-замещенный в положении 3 группой ОН или NH2,
, например, в положении 2 или 3, пиперидин-1-ил, необязательно С-замещенный, например, в положении 4 группой NH2, -CH2-NH2 или пиперидин-1-илом, или в положении 3, например, группой ОН или NH2, или пирролидинил, необязательно С-замещенный в положении 3 группой ОН или NH2,
5. R1 и R11 каждый независимо обозначает 1-N-метилпиперидин-4-ил, 4-метилпиперазин-1-ил, 4-метил-1-гомопиперазинил,
4-(2-гидроксиэтил)пиперазин-1-ил, или -Х'-С1, 2 или 3-алкилен-NR7R8, где X' обозначает простую связь, О или NH,
6. R1 обозначает пиперазин-1-ил, необязательно замещенный, например, 1-N-метилпиперидин-4-илом, a R11 обозначает 4,7-диазаспиро[2.5]окт-7-ил,
7. в составе остатка формулы (a) R2 и R3 каждый обозначает Н, или один из R2 и R3 обозначает Н, а другой обозначает F, Cl, СН3, ОСН3 или CF3,
8. в составе остатка формулы (a) R1 и R2 каждый обозначает Н, или один из R1 и R2 обозначает Н, а другой обозначает F, О, СН3, ОСН3 или CF3, предпочтительно R2 обозначает Н, a R1 расположен в положении 5, 6, 7 или 8, предпочтительно в положении 6,
9. в составе остатка формулы (b) R12 и R13 каждый обозначает Н, или один из R12 и R13 обозначает Н, а другой обозначает F, Cl, СН3, ОСН3 или CF3, предпочтительно R13 обозначает Н, a R12 расположен в положении 7,
10. в составе остатка формулы (b), R12 и R13 каждый обозначает Н, R11 обозначает 4,7-диазаспиро[2.5]окт-7-ил, или пиперазин-1-ил, замещенный в положении 3 метилом или этилом и необязательно замещенный в положении 4 метилом.
Соединения формулы (I) являются известными соединениями, и их получают по известной методике, например, как описано в патентах US 6645970, ЕР 1490355 А1, которые включены в настоящее описание в качестве ссылок.
Указанные соединения получают известным способом или по аналогичным методикам, описанным в указанных ссылках.
Предпочтительные соединения формулы (I) включают 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-дион (в данном контексте соединение А), 3-(1.Н.-индол-3-ил)-4-[2-(пиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-дион (в данном контексте соединение В), 3-[3-(4,7-диазаспиро[2.5]окт-7-ил)изохинолин-1-ил]-4-(7-метил-1Н-индол-3-ил)пиррол-2,5-дион (соединение С), в свободной форме или в форме фармацевтически приемлемой соли, например, ацетат 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-диона или ацетат 3-[3-(4,7-диазаспиро[2.5]окт-7-ил)изохинолин-1-ил]-4-(7-метил-1Н-индол-3-ил)пиррол-2,5-диона.
Другие ингибиторы ПКС, используемые в настоящем изобретении, включают соединения формулы (Па)
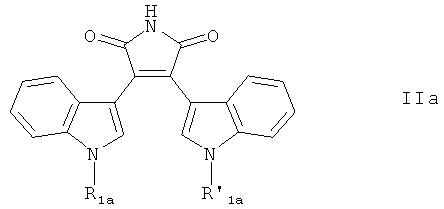
где
R1a обозначает
 ,
,
где s' равно 0, и R'12 обозначает водород или С1-С4алкил, или s' равно 1, и R'12 обозначает пиридил, предпочтительно 2-пиридил, и
R'1a обозначает водород или С1-С4алкил,
или фармацевтически приемлемую соль указанных соединений. Соединения формулы (IIa) могут существовать в форме гидрата или сольвата.
Еще более предпочтительны 3-(1-метил-1Н-индол-3-ил)-4-[1-{(1-пиридин-2-илметил)пиперидин-4-ил}-1Н-индол-3-ил]пиррол-2,5-дион (соединение D), или 3-(1-метил-1Н-индол-3-ил)-4-[1-(пиперидин-4-ил)-1Н-индол-3-ил]пиррол-2,5-дисн (соединение Е), или фармацевтически приемлемая соль, гидрат или сольват указанных соединений.
Соединения формулы (IIa) получают известным способом, например, как описано в патенте US 5545636.
Предлагается также серия следующих специфических или альтернативных вариантов осуществления настоящего изобретения.
1. Способ лечения, профилактики или замедления отторжения инсулин-продуцирующих клеток или тканей, такого как отторжение островковых клеток после трансплантации, или профилактики или замедления отторжения инсулин-продуцирующих тканей, таких как трансдифференцированные гепатоциты, прежде всего, в случае субъекта с диагнозом диабет, например, диабет типа 1, или с диагнозом панкреатит, например, хронический панкреатит, причем указанный способ заключается в том, что субъекту, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество ингибитора ПКС, например, соединения формулы (I) или соединения формулы (IIa), предпочтительно соединения А, В, С, D или Е, или фармацевтически приемлемой соли указанных соединений.
2. Способ лечения, профилактики или замедления развития диабета, например, диабета типа 1, или панкреатита, например, хронического панкреатита, причем указанный способ заключается в том, что субъекту, нуждающемуся в указанном лечении, вводят терапевтически эффективное количество ингибитора ПКС, например, соединения формулы (I) или соединения формулы (IIa), предпочтительно соединения А, В, С, D или Е, или фармацевтически приемлемой соли указанных соединений.
Использованный в данном контексте термин «трансплантация островковых клеток» относится к аутотрансплантации и аллотрансплантации островковых клеток. Инсулин-продуцирующие ткани включают, например, трансдифференцированные гепатоциты. Указанные трансдифференцированные гепатоциты, полученные с использованием способов активации генов и/или переноса генов, можно использовать для аутотрансплантации, аллотрансплантации, или их можно получать in situ в печени.
В другом объекте настоящего изобретения предлагаются следующие варианты.
3. Ингибитор ПКС, например, соединение формулы (I) или (IIa), предпочтительно соединение А, В, С, D или Е, или фармацевтически приемлемая соль указанных соединений, для применения в способе по п.1 и/или по п.2.
4. Ингибитор ПКС, например, соединение формулы (I) или (IIa), предпочтительно соединение А, В, С, D или Е, или фармацевтически приемлемая соль указанных соединений, для применения при получении фармацевтической композиции, предназначенной для применения в способе по п.1 и/или по п.2.
5. Фармацевтическая композиция, предназначенная для применения в способе по п.1 и/или по п.2, включающая ингибитор ПКС, например, соединение формулы (I) или (IIa), предпочтительно соединение А, В, С, D или Е, или фармацевтически приемлемую соль указанных соединений, в смеси с одним или более фармацевтически приемлемых разбавителей или носителей.
Соединения формулы (I) можно вводить в свободной форме или в форме фармацевтически приемлемой соли, например, как указано выше. Указанные соли получают стандартным способом, и они проявляют активность того же порядка, что и соединения в свободной форме.
Соединения формулы (IIa) можно вводить в свободной форме или в форме гидрата, сольвата или соли, например, в форме фармацевтически приемлемой соли. Указанные гидраты, сольваты и соли получают стандартным способом, и они проявляют активность того же порядка, что и соединения в свободной форме.
Пригодность ингибитора ПКС, например, для профилактики или лечения отторжения после трансплантации островковых клеток, как указано в данном контексте, можно оценивать с использованием моделей животных, а также при проведении клинических испытаний, например, в соответствии с описанными ниже способами.
А. Аффинность связывания ингибиторов ПКС с индивидуальной киназой ПКС человека определяют методом анализа аллогенной реакции смешанной культуры лимфоцитов (реакция СКЛ). Анализ реакции СКЛ проводят известными способами, например, с использованием мышей с трансплантированными клетками человека, например, как описано в патенте ЕР 1337527 А1, содержание которого в отношении реакции СКЛ включено в настоящее описание в качестве ссылки.
Б. Анализ in vivo
Эффективность трансплантации островковых клеток определяют, например, как описано в статье Nanji и др., American Journal of Transplantation, 4, cc.526-536 (2004), содержание которой включено в настоящее описание в качестве ссылки.
Трансплантация островковых клеток мышам
Для анализа использовали штамм взрослых самцов мышей линии C57BI/6 (H-2b), BALB/c (H.2d) и CBA/JCr (H-2k).
У мышей линии C57BI/6 (Н-2b) вызывали сахарный химический диабет однократной внутривенной инъекцией стрептозотоцина (200 мг/кг). Островковые клетки доноров линии BALB/c, полностью несовпадающие с главным комплексом несовместимости (МНС), выделяли при обработке коллагеназой (1 мг/мл) с последующей очисткой в градиенте фикола. Приблизительно 500 островков трансплантировали под левую почечную капсулу мышей-реципиентов с диагнозом диабет. Функцию аллотрансплантата контролировали серийными измерениями содержания глюкозы в крови. Эффективность приживления трансплантата определяли по коррекции уровня глюкозы в сыворотке крови до <8 ммоль/л на третий день после трансплантации, а отторжение трансплантата регистрировали по повышению уровня глюкозы в сыворотке крови до >15 ммоль/л в течение 2 последовательных дней.
У животных, которым вводили соединение формулы I перорально в суточной дозе от 1 до 30 мг/кг, наблюдается повышение жизнеспособности островкового трансплантата.
Пригодные клинические испытания включают, например, рандомизированные клинические испытания двойным слепым методом с контролем плацебо с участием пациентов с диагнозом диабет. Благоприятное действие на диабет оценивали напрямую по результатам стандартных клинических испытаний. Указанные испытания пригодны также для сравнения эффективности лечения в режиме монотерапии с использованием соединений формулы (I) или (IIa) в качестве активного ингредиента или комбинации указанных соединений со вторым лекарственным средством.
Например, группе 50 мышей с привитыми островковыми трансплантатами с диагнозом диабет типа 1 вводили исследуемое соединение, например, соединение формулы (I) или (IIa), или фармацевтически приемлемую соль указанных соединений, например, соединение А, В, С, D или Е, в суточной дозе, например, 50, 200 или 400 мг, или плацебо, которое вводили перорально два раза в сут. В случае исследуемых соединений наблюдали благоприятное действие.
Согласно настоящему изобретению соединения формулы (I) и (Па) можно вводить любым стандартным способом, прежде всего, энтерально, например, перорально, например, в форме таблеток или капсул, или парентерально, например, в форме растворов или суспензий для инъекций, местным способом, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме, или в форме суппозиториев. Фармацевтические композиции, включающие соединение формулы (I) и (IIa) в свободной форме или в форме фармацевтически приемлемой соли, в комбинации, по крайней мере, с одним фармацевтически приемлемым носителем или разбавителем, получают стандартным способом при смешивании с фармацевтически приемлемым носителем или разбавителем. Стандартные лекарственные формы для перорального введения содержат, например, от приблизительно 0,1 мг до приблизительно 500 мг активного соединения.
Предпочтительно соединение вводят местным способом, например, наносят на кожу. Еще более предпочтительной формой введения местным способом является введение в глаза.
Суточные дозировки, требующиеся для осуществления на практике способа по настоящему изобретению, изменяются в зависимости, например, от используемого соединения, субъекта, нуждающегося в лечении, способа введения, степени тяжести состояния, подлежащего лечению. Указанная суточная дозировка при пероральном введении крупному млекопитающему, например, человеку, составляет величину в диапазоне от приблизительно 0,5 мг до приблизительно 2000 мг активного ингредиента, например, соединения А, В или С, которую вводят стандартным способом, например, в разделенных дозах вплоть до четырех раз в сут, или в форме с замедленным высвобождением.
Требуемая дозировка изменяется в зависимости от способа введения, конкретного состояния, подлежащего лечению, и требуемого действия; Установлено, что, в основном, удовлетворительные результаты систематически получают при суточных дозировках от приблизительно 0,1 до приблизительно 100 мг/кг массы тела. Указанная суточная дозировка для крупного млекопитающего, например, человека, составляет величину в диапазоне от приблизительно 0,5 мг до приблизительно 2000 мг, которую вводят стандартным способом, например, в разделенных дозах вплоть до четырех раз в сут или в форме с замедленным высвобождением.
Ингибиторы ПКС, например, соединения формулы (I) или (IIa), вводят в виде единственного активного ингредиента или в смеси с другими лекарственными средствами в ходе иммуномодулирующих курсов лечения или с другими противовоспалительными агентами, например, для лечения или профилактики острого или хронического отторжения алло- или ксенотрансплантата или воспалительных или аутоиммунных нарушений, или в смеси с другими антидиабетическими лекарственными средствами.
Например, ингибиторы ПКС, например, соединения формулы (I) или (IIa), можно использовать в комбинации с циклоспоринами, или аскомицинами или с их иммунодепрессантными аналогами или производными, например, с циклоспорином A, ISA Т×247, FK-506, АВТ-281, ASM 981, с ингибитором mTOR, например, с рапамицином, 40-О-(2-гидроксиэтил)рапамицином, CCI779, АВТ578, или с рапалогом, например, АР23573, АР23464, АР23675, АР23841, TAFA-93, с биолимусом 7 или биолимусом 9 и т.п., с кортикостероидами, циклофосфамидом, азатиопреном, метотрексатом, с агонистом рецептора EDG, ускоряющим хоминг лимфоцитов, например, с FTY 720 или с его аналогом, с лефлуномидом или с его аналогами, с мизорибином, с микофеноловой кислотой или с ее солью, например, натриевой солью, с микофенолятом мофетила, 15-дезоксиспергуалином или с его аналогами, с ингибитором киназы JAK3, например, с N-бензил-3,4-дигидроксибензилиденцианоацетамидом, □-циано-(3,4-дигидрокси)-N-бензилциннамамидом (Tyrphostin AG 490), продигиозином 25-С(PNU156804), [4-(4'-гидроксифенид)амино-6,7-диметоксихинозолином] (WHI-P131), [4-(3'-бром-4'-гидроксифенил)амино-6,7-диметоксихиназолином] (WHI-P154), [4-(3',5'-дибром-4'-гидроксилфенил)амино-6,7-диметоксихиназолином] (WHI-P97), KRX-211, 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-(1]пиримидин-4-ил)амин6]пйперидин-1-ил}-3-оксопропионитрилом, в свободной форме или в форме фармацевтически приемлемой соли, например, в форме моноцитрата (названного также СР-690550), или с соединением, описанным в заявке WO 04/052359 или в заявке WO 05/066156, с иммунодепрессантными моноклональными антителами, например, моноклональными антителами против рецепторов лейкоцитов, например, МНС, CD2, CD3, CD4, CD11a/CD18, CD7, CD25, CD27, В7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), OX40, 4-1BB или их лигандов, например, CD154, или с другими иммуномодулирующими соединениями, например, с рекомбинантной связывающей молекулой, содержащей, по крайней мере, часть внутриклеточного домена CTLA4 или его мутированной формы, например, по крайней мере, внутриклеточную часть CTLA4 или его мутированной формы, присоединенную к последовательности, не относящейся к белку CTLA4, например, CTLA4Ig (например, названной АТСС 68629) или ее мутированной форме, например, LEA29Y, или с другими ингибиторами молекулярной адгезии, например, с моноклональными антителами или с нйзкомолекулярными ингибиторами, включая антагонисты LFA-1, антагонисты селектина и антагонисты VLA-4.
Например, указанные соединения можно использовать в комбинации с соединением PPAR-δ, например, с соответствующим гипогликемическим производным тиазолидиндиона, например, глитазоном, с агонистами PPAR□ не-глитазонового типа, прежде всего, с аналогами N-(2-бензоилфенил)-L-тирозина, например, GI-262570 и JTT501, с агентами, повышающими чувствительность к инсулину, или с антагонистами рецептора ATI, например, с продуктом Diovan®, Co-Diovan® или с фармацевтически приемлемой солью указанных соединений.
Структура активных агентов, идентифицированная по общим или торговым названиям, приведена в действующем издании стандартного справочника «ТЪе Merck Index» и в справочнике Physician's Desk Reference, а также в базах данных, например, в базе международных патентов Patents International (например, IMS World Publications) или в базе Current Drugs. Соответствующее содержание указанных источников информации включено в настоящее описание в качестве ссылок. Специалист в данной области может идентифицировать активные агенты на основе указанных ссылок, а также получить и испытывать их фармацевтические свойства с использованием стандартных экспериментальных моделей in vitro и in vivo.
Агенты, повышающие чувствительность к инсулину, восстанавливают поврежденную функцию рецептора инсулина для снижения резистентности к инсулину и, следовательно, повышения чувствительности к инсулину.
При введении ингибиторов ПКС в комбинации с другими лекарственными средствами, дозировки совместно вводимого соединения изменяются в зависимости от типа совместно применяемого лекарственного средства, специфичности применяемого лекарственного средства, состояния, подлежащего лечению и т.п. Использованные в данном контексте термины «совместное введение» или «комбинированное введение» или т.п.означают введение выбранных терапевтических агентов одному пациенту и включают курсы лечения, при которых агенты необязательно вводят одинаковым способом или в одно и тоже время.
В связи с выше сказанным, в следующем объекте настоящего изобретения предлагается:
6. способ, как определено выше, который заключается в том, что совместно вводят, например, одновременно или последовательно, терапевтически эффективное количество ингибитора ПКС, например, соединения формулы (I) или (IIa), предпочтительно соединения А, В, С, D или Е, или фармацевтически приемлемой соли указанных соединений, и второго лекарственного средства, например, как указано выше.
При введении фармацевтической комбинации по настоящему изобретению наблюдается благоприятное действие, прежде всего, синергетическое действие. Например, комбинированное лечение обеспечивает неожиданное пролонгирование эффективности, снижение побочных действий, более низкие дозы индивидуальных лекарственных средств или повышение качества жизни по сравнению с монотерапией. Кроме того, преимущество заключается в возможности применения более низких доз активных ингредиентов в составе комбинации по настоящему изобретению, например, в большинстве случаев дозировки не только снижены, но и вводятся менее часто, или применение более низких доз используется для снижения уровня побочных действий. Указанное соответствует требованиям пациентов, проходящих курс лечения.
Комбинации по настоящему изобретению, как описано в данном контексте, можно использовать для одновременного или последовательного введения в любом порядке, например, для раздельного введения или в составе фиксированной комбинации.
Комбинации по настоящему изобретению включают «набор компонентов», в котором агенты а и b вводят независимо или в составе различных фиксированных комбинаций с различными количествами компонентов в различные моменты времени. Компоненты в составе «набора компонентов» в большинстве случаев можно вводить одновременно или поочередно, т.е. в различные моменты времени и через одинаковые или различные интервалы времени для любого компонента в составе «набора компонентов». Предпочтительно, интервалы времени выбирают таким образом, чтобы действие на заболевание или состояние, подлежащее лечению, при комбинированном применении компонентов превышало действие, которое наблюдается при применении только одного из компонентов.
Эффективная доза каждого из компонентов комбинации, применяемого в комбинации по настоящему изобретению, изменяется в зависимости от конкретного используемого соединения или фармацевтической композиции, способа введения, состояния, подлежащего лечению, степени тяжести состояния, подлежащего лечению. В связи с этим, курсы лечения комбинацией по настоящему изобретению выбирают в соответствии с различными факторами, включая способ введения. Лечащий врач, клиницист или ветеринар, практикующий в данной области медицины, может определить и назначить эффективное количество отдельных активных ингредиентов, требующееся для снижения интенсивности симптомов, лечения или замедления развития состояния. Максимально точные концентрации активных ингредиентов в диапазоне, обеспечивающем эффективность без токсичности, можно определить по данным кинетических исследований уровней активных ингредиентов в участке-мишени.
Настоящая группа изобретений относится к медицине, а именно к терапии и эндокринологии, и касается применения ингибитора протеинкиназы С (ПКС) для профилактики или лечения отторжения инсулин-продуцирующих клеток после трансплантации. Для этого вводят эффективное количество 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-диона или его фармацевтически приемлемой соли. 2 н. и 2 з.п. ф-лы.
1. Применение 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-диона или его фармацевтически приемлемой соли для получения лекарственного средства, предназначенного для профилактики или лечения отторжения инсулин-продуцирующих островковых клеток после трансплантации.
2. Применение по п.1 ацетата 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-диона.
3. Способ лечения, профилактики или замедления отторжения инсулин-продуцирующих островковых клеток после трансплантации, который заключается в том, что субъекту, нуждающемуся в указанном лечении, вводят эффективное количество соединения по любому из пп.1 или 2, включая введение эффективного количества указанного соединения или его фармацевтически приемлемой соли.
4. Способ по п.3, где соединение представляет собой 3-(1.Н.-индол-3-ил)-4-[2-(4-метилпиперазин-1-ил)хиназолин-4-ил]пиррол-2,5-дион и его фармацевтически приемлемую соль.
| СПОСОБ ИДЕНТИФИКАЦИИ ИНГИБИТОРА ЯКОРНОЙ ФУНКЦИИ БЕЛКА И СПОСОБ ОПРЕДЕЛЕНИЯ ПРИСУТСТВИЯ В КЛЕТКЕ КАЛЬЦИНЕЙРИНСВЯЗЫВАЮЩЕГО И ПКА СВЯЗЫВАЮЩЕГО ЯКОРНОГО БЕЛКА | 1995 |
|
RU2185441C2 |
| МЕХАНИЗМ ДЛЯ ПЕРЕКЛЮЧЕНИЯ РЕГИСТРА | 0 |
|
SU238561A1 |
| WO 2005068455 A1, 28.07.2005 | |||
| WO 2005097108 A1, 20.10.2005. | |||
Авторы
Даты
2013-10-10—Публикация
2007-12-05—Подача