Предложенное изобретение относится к энергетике и может быть применено для получения экономичных источников энергии, таких как углеводороды и водород, а также окислителя - кислород. В предлагаемом способе для получения углеводородов, водорода и кислорода использована реакция разложения карбонизированной воды, широко распространенная в природе.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Углеводороды и водород относятся к категории веществ с высокой теплотворной способностью, которые находят применение в качестве топлив в энергетике и других отраслях промышленности.
В настоящее время существует большое разнообразие способов промышленного получения этих веществ. Все эти способы энергоемки и требуют больших капиталовложений.
Современные способы получения углеводородов в промышленных масштабах основаны на следующем.
1) Поиск, разведка и разработка месторождений нефти, природного газа и газогидратов и последующая переработка добываемого углеводородного сырья.
Недостатком этого способа является высокая технологическая сложность и капиталоемкость получения углеводородных топлив, приводящая к большим денежным затратам на единицу продукции.
2) Искусственное получение углеводородов по реакции поликонденсационного синтеза Фишера-Тропша (см. Сторч Г., Голамбик Н., Андерсон Р. Синтез углеводородов из окиси углерода и водорода. М.: Иностранная лит.1954) [1, стр.9]:
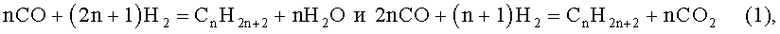
где n - число атомов углерода и водорода в молекулах углеводородов.
Недостатком данного способа является использование синтез-газа, требующего предварительного и весьма затратного получения водорода (Н2) и оксида углерода (СО), а также нежелательное образование в результате реакций диоксида углерода (СО2). Стоимость синтезируемой нефти превышает стоимость природной, что предопределяет сравнительно небольшие объемы ее промышленного производства.
Основные способы промышленного получения водорода следующие.
1) Паровая конверсия метана и природного газа
В настоящее время данным способом (см. патент US 6,682,714) производится примерно половина всего водорода.
Водяной пар при температуре 700-1000°C смешивается с метаном (СН4) под давлением в присутствии катализатора. Пар и тепловая энергия требуются для отделения водорода от углеродной основы в метане, что и происходит в паровых реформерах на каталитических поверхностях. Первая ступень процесса расщепляет метан и водяной пар на водород и оксид углерода. Вторая ступень превращает оксид углерода и воду в диоксид углерода и водород. Эта реакция происходит при температурах 200-250°C. Себестоимость килограмма водорода составляет 2-5 $ США.
2) Газификация угля
Это - старейший способ получения водорода. Уголь в присутствии катализатора нагревают при температуре 800-1300°C без доступа воздуха. К примеру (см. патент US 4,343,624), в процессе газификации в качестве катализатора используют окислы железа Fe3O4. Первый газогенератор был построен в Великобритании в 40-х годах XIX века. По имеющейся информации США предполагают построить электростанцию по проекту FutureGen, которая будет работать на продуктах газификации угля. Электричество будут вырабатывать топливные элементы, используя в качестве горючего водород, получающийся в процессе газификации угля. В декабре 2007 г. была определена площадка для строительства первой пилотной электростанции проекта FutureGen. В Иллинойсе будет построена электростанция мощностью 275 МВт. На электростанции будет улавливаться и храниться до 90% CO2. Себестоимость килограмма водорода составит 2-2,5 $ США.
3) Электролиз воды
Электролиз воды один из наиболее известных и хорошо исследованных методов получения водорода. Он обеспечивает получение чистого продукта (99,6-99,9% Н2) в одну технологическую ступень. При нагревании свыше 2500°C вода разлагается на водород и кислород. Поэтому во всех процессах получения водорода разложением воды в качестве побочного продукта возникают значительные количества кислорода. В производственных затратах получения водорода стоимость электрической энергии составляет примерно 85,5%.
Электролиз воды при добавлении серной кислоты и использовании солнечной энергии (см. патент US 7,241,950) повышает экономическую эффективность метода. Этот метод также применим с использованием соленых вод океана (см. заявку US 2010/0213049), где при электролизе в качестве анода используют гальванизированную сталь, а в качестве катода применяют перфорированные алюминиевые платы.
Метод электролиза воды получил применение в ряде стран, обладающих значительными ресурсами дешевой гидроэнергии. Наиболее крупные электрохимические комплексы находятся в Канаде, Индии, Египте, Норвегии, но созданы и работают тысячи более мелких установок во многих странах мира.
Данный метод является наиболее универсальным в отношении использования следующих первичных источников энергии: энергии ветра; энергии Солнца; атомной энергии; энергии термальных вод; биотехнологии; за счет естественных процессов дегазации.
Известны способы получения водорода в результате реакции металлов и их окислов в водной среде в условиях высоких температур. К примеру, в патентах US 3,821,362 и US 3,979,505 для этой цели используют олово Sn/SnO2.
4) Биотехнологии
Водород из биомассы получают термохимическим или биохимическим способом. При термохимическом методе биомассу нагревают без доступа кислорода до температуры 500-800°C (для отходов древесины), что намного ниже температуры процесса газификации угля. В результате процесса выделяются Н2, СО и СН4. Себестоимость процесса - 5-7 $ за килограмм водорода. В будущем возможно снижение до 1,0-3,0 $.
В биохимическом процессе водород вырабатывают различные бактерии или микроорганизмы и их производные (см. заявку US 2009/0298151). Для ускорения производства водорода из полисахаридов (крахмал, целлюлоза), содержащихся в биомассе, возможно применение различных энзимов. Процесс проходит при температуре 30°C при атмосферном давлении.
Себестоимость водорода около $2 за кг.
5) Естественные процессы дегазации
В работе (см. Ларин В.Н, Ларин Н.В. Способ использования вещества мантии для получения водорода // Химия и жизнь №10. 2000. С.46-51) [2] предложен способ получения водорода с использованием вещества мантии. Для промышленного получения водорода авторы этой работы предлагают использовать явление дегазации недр. По имеющимся данным в продуктах дегазации доминируют метан и водород, а также присутствуют диоксид углерода, азот и некоторые другие газы (см. Войтов Г.И. Химизм и масштабы современного потока природных газов в различных геоструктурных зонах Земли // Ж. Всес. хим. о-ва им. Д.И. Менделеева. 1986. Т.31. №5, стр.538) [3]. Авторы полагают, что поступающие из недр водород и метан возникают в результате реакций с водой интерметаллических соединений (силицидов) и сплавов на основе Si, Mg, Fe и др. химических элементов, содержащихся в мантии Земли. Способ заключается в поиске мест подхода к земной поверхности вещества мантии, бурении в этих местах глубоких скважин, которые, с одной стороны, предлагают использовать для формирования, путем взрыва в породах мантии реакционных полостей, куда закачивают воду, а с другой, для вывода и сбора образующегося водорода на поверхности. Предполагаемый авторами механизм образования водорода в земных недрах проблематичен. В техническом отношении данный способ не разработан и перспективы получения по нему водорода на сегодняшний день не ясны.
Недостатком всех известных способов являются высокие затраты энергии на получение водорода. Количество энергии, содержащееся в водороде, как топливе, составляет только 25% от энергии, затраченной на его производство. В ряде процессов при получении 1 кг водорода образуется нежелательный диоксид углерода в количестве 7-22 кг.
Указанные недостатки заставляют искать энергетически более выгодные и экологически менее вредные для окружающей среды способы получения водорода и углеводородов.
Задачей предлагаемого изобретения является создание способа, позволяющего одновременно получать углеводороды, водород и кислород, уменьшение энергетических затрат и удешевление получения водорода, углеводородов и кислорода при одновременном сокращении экологически вредных продуктов их производства.
Данная задача решается предложенным способом получения углеводородов, водорода и кислорода с использованием диоксида углерода и воды, согласно которому:
- насыщают воду диоксидом углерода с получением карбонизированной воды;
- пропускают карбонизированную воду, по меньшей мере, через один реактор, содержащий катализатор, с получением углеводородов, водорода и кислорода, поступающих далее, по меньшей мере, в один разделитель;
- по меньшей мере, в одном разделителе отделяют продукты реакции от исходной карбонизированной воды путем сепарации газообразной и жидкой фаз, при этом из жидкой и газообразной фаз выделяют углеводороды, а из газообразной фазы дополнительно выделяют водород и кислород.
В качестве катализатора могут быть использованы металлы или сплавы или окислы или минералы, т.е. материалы, присутствующие в природе. Выбор катализатора определяется рядом факторов, рассмотренных подробно ниже.
Предпочтительно, чтобы насыщение воды диоксидом углерода с получением карбонизированной воды осуществлялось, по меньшей мере, в одном смесителе. Использование нескольких смесителей целесообразно для промышленного производства.
Как было отмечено, в жидкой фазе отделяют жидкие углеводороды от воды, из газообразной фазы выделяют водород, кислород, низкомолекулярные гомологи метана и не прореагировавший диоксид углерода. При этом жидкие и газообразные углеводороды, водород и кислород направляют на дальнейшую переработку, а карбонизированную воду и диоксид углерода возвращают в смеситель для повторного использования в цикле.
Могут быть использованы несколько реакторов с различными или одинаковыми катализаторами. Каждый реактор соединен, по меньшей мере, с одним разделителем. Также могут использоваться несколько разделителей, при этом каждый разделитель может служить для выделения, по меньшей мере, одного продукта реакции, включая не прореагировавшие диоксид углерода и воду.
Целесообразно использование фильтров, поэтому дополнительно система может содержать, по меньшей мере, один фильтр, обеспечивающий фильтрацию исходных, промежуточных или конечных продуктов реакции.
Например, смеситель может быть выполнен, по меньшей мере, с одним фильтром, на входе и/или на выходе реактора может быть установлен, по меньшей мере, один фильтр, и разделитель может быть выполнен, по меньшей мере, с одним фильтром.
В реакторе осуществляют реакцию, которая может быть описана следующей химической формулой:
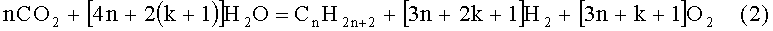
k - целое число, большее или равное О,
n - целое число, большее или равное 1.
Формула (2) приведена в случае образования алканов, но соответствующие формулы, как и при реакции Фишера-Тропша (см. [1, стр.9]), могут быть записаны и для получения других углеводородов газонефтяного ряда.
В настоящее время проблема происхождения нефти и газа не решена. В научной среде существуют различные точки зрения на этот счет. Следуя первой «биогенной» гипотезе нефтегазообразования, углеводороды образуются из органического вещества отмерших организмов, захороненных в осадочных породах. По второй «минеральной» гипотезе источником нефти и газа являются углеводородные флюиды и газы, поступающие из глубоких земных недр.
В соответствии с третьей «биосферной» моделью нефтегазообразования, обобщающей две первые (см. Баренбаум А.А. Механизм формирования скоплений нефти и газа // Доклады Академии наук. 2004. Т.399. №6. С.802-805) [4], нефть и газ являются необходимыми продуктами современного геохимического круговорота углерода, представленного на нашей планете тремя взаимодействующими циклами.
Первый длительностью ~108-109 лет связан с глубоким погружением углеродсодержащих пород в мантию Земли при субдукции литосферных плит. Второй, характеризующийся временем ~106-107 лет, вызван преобразованием захораниваемого органического вещества в процессах осадконакопления. И третий, наиболее короткий - биосферный цикл круговорота - длительностью ~40 лет обусловлен переносом окисленного углерода наземной биосферы в земную кору метеогенными водами при их климатическом круговороте. Последние проникают до кристаллического фундамента (глубины 5-7 км и более), являясь сопутствующими водами почти на всех месторождениях нефти и газа (см. Добрынин В.М., Серебряков В.А. Геологогеофизические методы прогнозирования аномальных пластовых давлений. М.: Недра. 1989) [5].
Участвуя в биосферном цикле, подвижный углерод многократно пересекает поверхность Земли. Входя в состав то живых организмов, то минеральных агрегатов, он меняет химическую форму и изотопный состав. Над земной поверхностью, играющей роль геохимического барьера, углерод циркулирует преимущественно в форме СО2, а под ней восстанавливается до углеводородов.
Поступающий с метеогенными водами диоксид углерода в земной коре испытывает восстановление до углеводородов. Из-за низкой растворимости в воде, последние выделяются в отдельную фазу, которая формирует в геологических структурах-ловушках собственные скопления в виде нефти и газа. Все три цикла круговорота углерода связаны между собой и в той или иной мере участвуют в образовании таких скоплений.
В современную эпоху образование углеводородов в основном обеспечивают два последних цикла, в которых ведущая роль принадлежит региональному климатическому круговороту вод. Вследствие этого месторождения нефти и газа формируются главным образом двумя путями:
1) При экстракции подземными флюидами преобразованного в катагенезе и диагенезе органического вещества осадочных пород; и
2) В результате поликонденсационных реакций синтеза углеводородов из поставляемого в земную кору метеогенными водами диоксида углерода.
Первый механизм отвечает за наличие в нефти сложных углеводородных соединений (биомаркеров), родственных органическому веществу, из которого они возникли, а второй - нормальных и изоалканов, алканолов и других сравнительно просто структурированных молекул углеводородов, составляющих основную массу нефти. В дальнейшем эти углеводороды могут испытывать биодеградацию и изменяться при подземной миграции, как на пути к геологическим ловушкам, так и в пределах месторождений.
По оценкам авторов изобретения доля углеводородов
поликонденсационных синтеза в продукции континентальных нефтяных и газовых месторождений составляет примерно 90% [4, стр.803]. Вследствие участия в нефтегазообразовании метеогенных вод с циклом около 40 лет, на давно эксплуатируемых месторождениях наблюдается восполнение запасов углеводородов в залежах.
Такие эффекты надежно установлены, в частности, на Ромашкинском месторождении нефти (см. Муслимов Р.Х., Глумов Н.Ф., Плотникова И.Н. и др. Нефтегазовые месторождения - саморазвивающиеся и постоянно возобновляемые объекты // Геология нефти и газа. Спец. выпуск. 2004. С.43-49) [6] и на Шебелинском газоконденсатном месторождении (см. Баренбаум А.А., Закиров С.Н. Галактоцентрическая парадигма и ее следствия для теории и практики разработки месторождений // Нефтяное хозяйство. 2003. №3. С.32-34) [7].
Принято думать, что вода - это очень устойчивое химическое соединение, практически не способное к самопроизвольному распаду при температурах и давлениях на поверхности Земли. Константа диссоциации воды при обычной температуре равна 10-14, а константа разложения воды с выделением водорода и кислорода составляет 10-83,1. Поэтому полагают, что разложение воды на водород и кислород без подвода значительной энергии извне в обычных термобарических условиях крайне маловероятно.
Вместе с тем известно, что в земной коре с участием воды активно протекают процессы литогенеза, приводящие к образованию новых минеральных форм. При этом во многих процессах, за счет освобождения внутренней энергии химических связей в минералах, разрушается значительное количество подземных вод (см. Шварцев С.Л. Разложение и синтез воды в процессе литогенеза // Геология и геофизика. 1975. №5. С.60-69) [8]. Важную роль в этих процессах играют свободные электроны, при посредничестве которых из воды и предельно окисленных соединений углерода в осадочных породах могут генерироваться углеводороды газонефтяного ряда (см. Черский Н.В., Царев В.П. Механизмы синтеза углеводородов из неорганических соединений в верхних горизонтах земной коры // Доклады Академии наук. 1984. Т.279. №3. С.730-735) [9].
Разложение в земной коре воды по реакции (2), наряду с образованием нефти и газа, сопровождается выбросом в атмосферу больших количеств водорода и метана. В продуктах дегазации также доминируют диоксид углерода и азот, наличие которых в первую очередь обусловлено предшествующим захватом этих атмосферных газов циркулирующей через поверхность Земли водой.
В последние годы установлено, что разгрузка этих газов идет повсеместно (см. Ларин В.Н, Ларин Н.В., Горбатиков А.В. Кольцевые структуры, обусловленные глубинными потоками водорода // Дегазация Земли: геотектоника, геодинамика, геофлюиды; нефть и газ; углеводороды и жизнь. Материалы Всероссийской конференции. М.: ГЕОС. 2010. С.284-288) [10]. Наиболее интенсивная дегазация происходит через разломы в литосферных плитах, особенно, в зонах срединных океанических хребтов. Метан и другие газы в дальнейшем включаются в геохимический круговорот и остаются на Земле. Легкий же водород достигает стратосферы и частично уходит в космос, образуя вокруг нашей планеты обширную водородную корону и шлейф. Без этого подтока атмосфера Земли полностью лишилась бы водорода за несколько лет.
Факты свидетельствуют, что явление разложения воды с образованием углеводородов чрезвычайно широко распространено в природе.
Известно, что природные процессы экономичны с энергетической точки зрения. Поэтому привлечение реакции (2) для целей промышленного получения углеводородов, водорода и кислорода является более чем оправданным.
ПОЯСНЕНИЕ ЧЕРТЕЖЕЙ
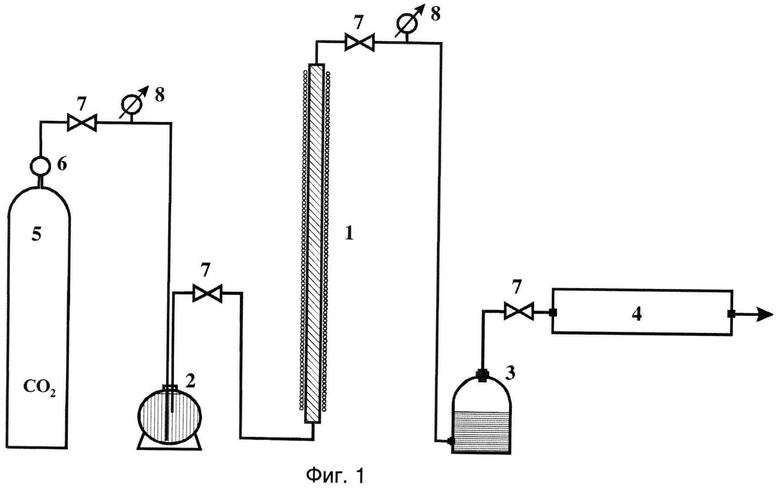
Фиг.1 - Схема экспериментальной установки.
Обозначения: 1 - реакционная колонка с нагревательным элементом, 2 - смеситель, 3 - сепаратор-накопитель, 4 - газовый хроматограф, 5 - баллон с углекислым газом, 6 - редуктор, 7 - регулируемый вентиль, 8 - манометр.
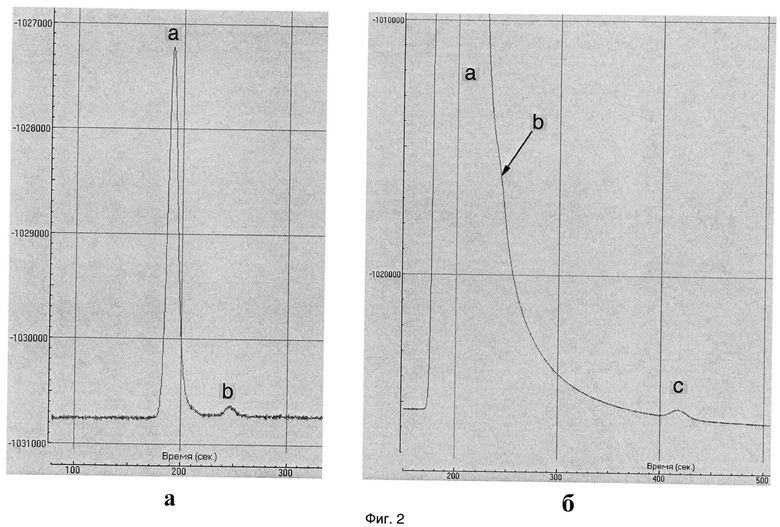
Фиг.2 - Хроматограммы газов, синтезированных в реакции (1) при низком (а) и высоком (б) выходе водорода.
Обозначения: а - водород, b - метан, с - этан. При высоком выходе пик водорода перекрывает пик метана.
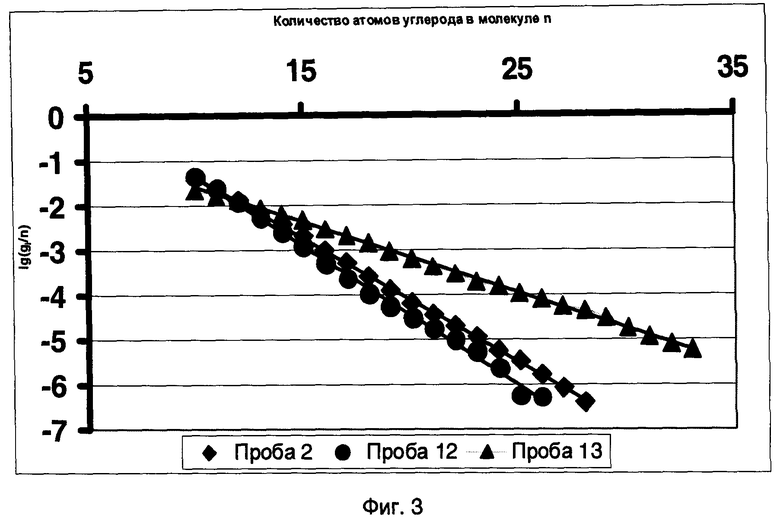
Фиг.3 - Молекулярно-массовое распределение нормальных алканов в системе координат уравнения Андерсона-Шульца-Флори для пробы нефти (проба 13) и двух проб конденсата (пробы 2 и 12).
Результаты анализов проб 2, 12 и 13 взяты из таблицы на стр.75 работы [12].
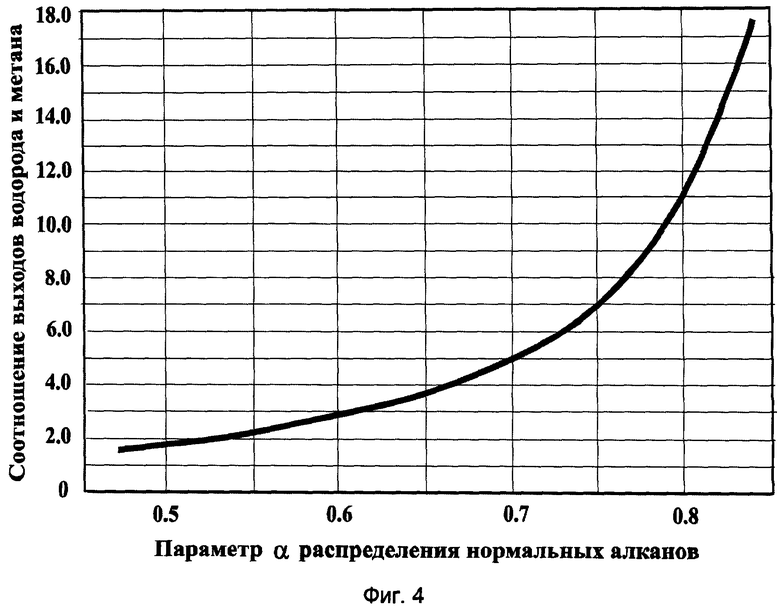
Фиг.4 - Выход водорода по отношению к метану как функция величины параметра α нормальных алканов, синтезированных в реакции (2).
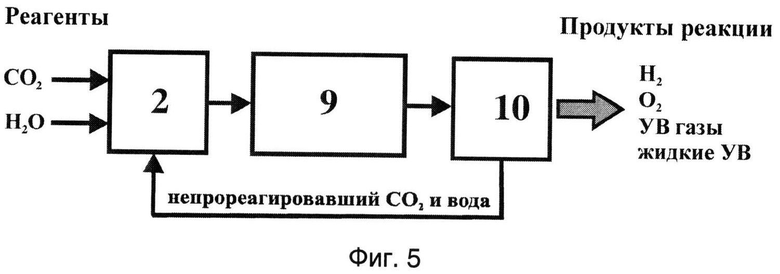
Фиг.5 - Структурная схема промышленной установки для получения углеводородов, водорода и кислорода из диоксида углерода и воды.
Обозначения: 2 - смеситель, 9 - реактор, 10 - разделитель.
ЭКСПЕРИМЕНТАЛЬНОЕ ПОДТВЕРЖДЕНИЕ ИЗОБРЕТЕНИЯ
Авторами изобретения выполнен комплекс экспериментов, воспроизводивших синтез углеводородов в «мягких» термобарических условиях верхних горизонтов земной коры. Результаты этих экспериментов, в совокупности с имеющейся на сегодняшний день научно-технической информацией, привели к выводу, что образование углеводородов, водорода и кислорода из диоксида углерода и воды с большой вероятностью идет в соответствии с экспериментально установленной реакцией поликонденсационного синтеза (2).
Эксперименты заключались в пропускании карбонизированной воды - водный раствор диоксида углерода, имитировавшей метеогенную воду, через насыпную среду, моделировавшую породы земной коры типичного терригенного и карбонатного состава. В модельные среды добавлялась примесь содержащего железо вещества (железная стружка, порошковые окись и двуокись железа и др.), игравшего роль катализатора. Эксперименты проводились при комнатной температуре и атмосферном давлении на выходе из установки.
Разработанная лабораторная установка схематично показана на фиг.1.
Установка состояла из реакционной колонки 1, заполненной насыпным модельным веществом. На вход реакционной колонки из смесителя 2 подавалась карбонизированная вода с заданной концентрацией растворенного диоксида углерода. На выходе из реакционной колонки жидкость поступала в сепаратор-накопитель 3, где происходило отделение от нее газообразных продуктов реакции, которые затем анализировались газоанализатором 4. Смесителем служил бак емкостью 20 л, выдерживавший давление 15 атм. Для приготовления карбонизированной воды использовался баллон с диоксидом углерода 5. Концентрация диоксида углерода в растворе регулировалась давлением и временем насыщения этим газом залитой в смеситель воды.
Использовалась вода как дистиллированная, так и вода из артезианской скважины. Давления диоксида углерода, подававшегося в смеситель, варьировали в диапазоне от 0,5 до 10 атм, что позволяло регулировать скорость течения карбонизированной воды через реакционную колонку. Реакционная колонка представляет собой отрезок пластиковой трубки длиной 1 м и внутренним диаметром 19 мм. С внешней стороны трубки для нагревания в отдельных экспериментах размещалась электрическая спираль. Газоанализатором служил полевой хроматограф «Хромопласт-001», предназначенный для измерения содержания водорода, метана, этана, пропана, изобутана, бутана, изопентана и пентана в газовой смеси. Анализатор имел две хроматографические колонки разной длины, что позволяло определять водород и указанные газы с чувствительностью ~0.01%.
Эксперименты показали, что в результате пропускания карбонизированной воды через модельную среду происходит разложение воды с образованием легких углеводородных газов. Образование водорода и углеводородов, в частности, метана (СН4), этана (С4Н6), бутана и изобутана (С4Н10) инструментально зафиксировано хроматографом в составе накапливавшейся в сепараторе газовой фазы (фиг.2). На значительное выделение в реакции кислорода также указывало быстрое окисление входившего в состав модельной среды железа, игравшего роль катализатора.
На выход водорода и углеводородных газов заметно влияли концентрация CO2 в карбонизированной воде, скорость прокачки этой воды через реакционную колонку, а также тип и количество катализатора.
Обнаруживаемые в экспериментах метан и его гомологи, а также водород служат веским доказательством того, что в осадочных породах земной коры, при фильтрации метеогенных вод в присутствии природных катализаторов, идет процесс разложения воды на водород и кислород, сопровождающийся поликонденсационным синтезом газонефтяных углеводородов.
ПОЯСНЕНИЕ ФОРМУЛЫ РЕАКЦИИ
Известно, что реакции поликонденсационного синтеза углеводородов из окислов углерода и водорода широко распространены в природе. Наиболее изучен синтез углеводородов из оксида углерода и водорода по реакциям Фишера-Тропша (1). В настоящее время данный синтез нашел применение в промышленном производстве углеводородов.
Из других поликонденсационных реакций этого класса известностью пользуется синтез углеводородов из оксида углерода и воды, происходящий в соответствии с химической формулой Кельбеля-Энгельгардта:
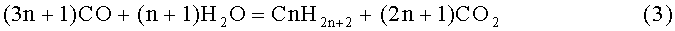
Синтез углеводородов по Фишеру-Тропшу, как известно, носит экзотермический характер. Поэтому реакции (1) имеют заметный выход даже при комнатной температуре и идут с большим тепловыделением (см. [1, стр.10]).
Другая важная особенность реакций (1) и (3), установленная на примере реакции синтеза Фишера-Тропша, состоит в том, что распределение образующихся углеводородов, состоящих в основном из алканов, алкенов, алканолов и алканалей с числом атомов углерода в цепи от 1 до 100 и выше, во многих случаях подчиняются уравнению Андерсона-Шульца-Флори (см. Глебов Л.С., Клигер Г.А. Молекулярно-массовое распределение продуктов синтеза Фишера-Тропша // Успехи химии. 1994. Т.63. №2. С.192-202) [11, стр.193]:

где gn - массовая доля углеводородов с n атомами углерода в молекуле, α - постоянный коэффициент (0<α≤1).
В работе (см. Баренбаум А.А., Абля Э.А. Молекулярно-массовое распределение нормальных алканов нефти как свидетельство их поликонденсационного синтеза // Органическая минералогия: Материалы III Российского совещания с международным участием. Сыктывкар: Геопринт. 2009. С.74-77) [12, стр.75, 76] показано, что формуле (4) хорошо удовлетворяет также распределение углеводородов сырых небиодеградированных нефтей.
На фиг.3 в качестве примера, подтверждающего этот вывод, приведено распределение нормальных алканов (формула CnH2n+2) в системе координат уравнения (4) для одной пробы нефти и двух проб конденсата, начиная с числа углеродных атомов в молекуле n=10. Исследования выполнялись на хроматографе Trace Ultra Thermo Finnigan, на колонке Sol-Gel 1-MS, с нейтральной фазой, длина 60 м, диаметр 0.25 мм, слой 0.25 mn, температура детектора 320°C, испарителя 300°C, температурный режим 3°C/мин. Проверка и идентификация углеводородов выполнялась на спектрометре высокого разрешения Thermo Finnigan MAT 900 (с хроматографом Trace GC) с такой же колонкой и при том же температурным режимом.
Исследовались нефти различных месторождений из отложений преимущественно раннепалеозойского возраста, залегающие на глубинах свыше 2 км. Нефти имеют средний удельный вес около 0.85 г/см3. В групповом составе нефтей содержание полярных фракций мало (менее 10%). Преобладают метановые углеводороды нормального строения (более 80%), и значительна доля ароматических углеводородов. Исследовались также очень легкие нефти, преимущественно состоящие из углеводородов нормального ряда.
Для большой выборки нефтей установлено, что коэффициенты α в распределении алканов нефтей и в продуктах синтеза Фишера-Тропша на железосодержащих катализаторах имеют одну величину.
Данное обстоятельство предопределило выбор железа в качестве катализатора в экспериментах.
Выполненные эксперименты позволили заключить, что наблюдавшийся авторами изобретения процесс деструкции карбонизированной воды с образованием простейших углеводородов наилучшим образом описывается химической формулой (2):
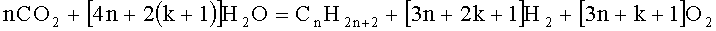
Эта реакция структурно аналогична реакциям синтеза Фишера-Тропша (1) и Кельбеля-Энгельгардта (3). Роднит ее с этими реакциями то, что во всех трех случаях синтезируются углеводороды. А главное отличие ее сводится к тому, что реагентом в ней выступает диоксид углерода CO2, а не окись углерода СО, и на выходе образуются продукты разрушения воды - водород и кислород. Кроме того, реакции (1) и (3) протекают в газовой фазе, а реакция (2) - в водной.
При получении формулы (2) авторами изобретения учтено, что водород и углеводороды - метан (СН4), этан (С2Н6), бутан и изобутан (С4Н10) - инструментально фиксировались хроматографом в составе накапливавшейся в сепараторе газовой фазы, а второй продукт разрушения воды - кислород, не определявшийся напрямую в эксперименте хроматографом, присутствовал в отобранных пробах газа, которые анализировались в химической лаборатории. На образование в реакции кислорода также указывало быстрое окисление железной стружки, служившей в отдельных экспериментах в качестве катализатора.
Таким образом, возникавший кислород присутствовал не только в свободном виде, но и в значительной мере участвовал в окислении катализатора из железа. Последний эффект можно уменьшить, если использовать катализаторы иных типов.
Другое отличие реакции (2) от реакций синтеза Фишера-Тропша и Кельбеля-Энгельгардта состоит в том, что величина энергии Гибса для реагентов этой реакции оказывается выше, чем у ее продуктов. Данное обстоятельство делает эту реакцию термодинамически невыгодной, что исключает ее самопроизвольное протекание без подвода дополнительной энергии. Возможно, что в этом случае определяющая роль в деструкции молекул воды и образовании углеводородов принадлежит электрохимическим процессам с участием свободных электронов, возникающих при контакте минералов горных пород с водой, как это экспериментально установлено другими авторами (см. [9]).
Пользуясь химической формулой (2), сделан ряд теоретических оценок важных для практической реализации настоящего изобретения.
Из формулы (2), в частности, следует, что на образование одной тонны СН4 расходуется 2,75 т CO2 и как минимум 6,75 т воды. В результате получается также 0,5 т водорода и 8,0 т кислорода. С увеличением молекулярного веса синтезируемых углеводородов эти оценки меняются слабо.
Для теоретической оценки полного выхода водорода и углеводородов, необходимо просуммировать правую и левую части формулы (2) по n, задавшись функцией распределения синтезированных углеводородов по массам.
В предположении, что распределение углеводородов подчиняется уравнению Андерсона-Шульца-Флори (4), на фиг.4 приведено рассчитанное соотношение выходов водорода и метана как функция величины параметра α. Из графика видно, что в характерном для нефтей диапазоне изменения параметра α от 0,5 до 0,85 выход Н2 всегда больше выхода СН4. Причем с ростом величины α превышение Н2 над СН4 увеличивается с 2 до 20 раз.
По итогам экспериментов, исходя из измеренных количеств возникавших Н2 и СН4(см. фиг.2-а), по графику (фиг.4) была найдена величина параметра α предполагаемого молекулярно-массового распределения н-алканов.
Значение α оказалось близким 0.7. Данное значение хорошо согласуется с величиной этого параметра в продуктах синтеза Фишера-Тропша на железосодержащих катализаторах, которое составляет 0,65±0,05 (см. [11, стр.199]).
Полученное согласие может дополнительно рассматриваться в качестве подтверждения справедливости установленной химической формулы (2).
Таким образом, выполненные эксперименты подтверждают, что при поступлении карбонизированных поверхностных вод в осадочный чехол земной коры, в ходе фильтрации этих вод через пористо-трещиноватые и проницаемые породы, происходит разрушение молекул Н20 с образованием углеводородов газонефтяного ряда, водорода и кислорода. Причем эти процессы идут даже при невысоких температурах и давлениях без подвода энергии извне.
Полученный вывод естественным образом объясняет ряд наблюдаемых, но пока еще плохо понятных явлений. К ним в первую очередь авторы относят быстрое (заметное за 30-50 лет) восполнение запасов нефти и газа на разрабатываемых месторождениях, существенную изменчивость химического состава добываемых нефтей, а также присутствие в нефти космогенного радиоактивного изотопа 14С природного и техногенного происхождения.
Отметим и другое широко распространенное на нашей планете явление, которое авторы связывают с выявленным процессом. Оно состоит в огромных масштабах современной разгрузки через земную поверхность газов, среди которых доминируют метан, водород, диоксид углерода и азот.
Происхождение этих газов также может быть объяснено поступлением в земную кору метеогенных вод. Так, если возникший в реакции (2) кислород быстро поглощается в породах, то образующиеся метан и водород вместе с захваченным водами азотом воздуха и не прореагировавшим диоксидом углерода в больших количествах выносятся в атмосферу. Наиболее интенсивно они поступают на поверхность через разломы в литосферных плитах в зонах срединных океанических хребтов.
За неимением лучшей идеи дегазацию Земли объясняют поступлением Н2 и СН4 из ядра планеты (см. Маракушев А.А., Маракушев С.А. Водородное дыхание Земли - его происхождение, геологические и биологические следствия // International Scientific Journal for Alternative Ecology №1 (57) 2008. 156-174) [13].
Авторы данной работы полагают, что эти газы сохранились в ядре Земли с момента ее образования. Такое объяснение, однако, противоречит современным представлениям космохимии и физики Земли об условиях формирования нашей планеты и ее внутреннем строении. Разрушение в земной коре молекул H2O с образованием углеводородов позволяет отказаться от наличия водорода и других газов в ядре Земли, как физически неадекватной гипотезы.
Настоящее изобретение обосновывает возможность и целесообразность реализации данного природного процесса для производства водорода, углеводородов и кислорода.
Таким образом, поставленные задачи изобретения - снижение энергоемкости и удешевление промышленного производства углеводородов, водорода и кислорода - достигаются тем, что для их получения используют реакцию (2). Где рабочими агентами являются диоксид углерода и вода, а катализаторами служат вещества, применяемые при промышленном синтезе углеводородов по реакции Фишера-Тропша (см. [1, стр.153]).
На основании известных данных авторы считают, что в качестве эффективных катализаторов при осуществлении реакции (2) может использоваться не только Fe, но и другие металлы, например, Со Cu, Ag, Mn, их окислы: MgO, CaO, SrO, BaO, BeO, Al2O3, La2O3, CeO2, ThO2, UO2, U3O8, SnO2, Bi2O3, CdO, ZnO, а также природные минералы, в частности глины и цеолиты. Причем водорастворимые катализирующие вещества могут добавляться в состав используемой в реакции воды.
Важно, что предлагаемое изобретение совместно решает две актуальные и глобальные проблемы:
1) Дешевое получение углеводородов, водорода и кислорода, необходимых для современного развития промышленности;
2) Утилизацию техногенных избытков диоксида углерода, загрязняющих атмосферу и негативно влияющих на климат планеты.
Наиболее близкими к заявляемому способу по технической реализации являются способы синтеза углеводородов по реакции Фишера-Тропша (1) и получения водорода методом паровой конверсии метана.
Во всех этих способах для производства полезного продукта необходимо присутствие катализаторов.
В предложенном способе, как и в известных способах синтеза углеводородов по реакциям Фишера-Тропша и Кельбеля-Энгельгардта, углеводороды получают из окислов углерода и водорода. Только если при синтезе Фишера-Тропша реагентами выступают оксид углерода и не окисленный водород и на выходе реакции наряду с углеводородами образуются H2O и CO2, а при синтезе Кельбеля-Энгельгардта в реакцию вступают оксид углерода и вода и дополнительно образуется лишь диоксид углерода, то у нас реагентами служат CO2 и H2O, а продуктами являются вместе с углеводородами также Н2 и O2.
При этом отпадает необходимость производства водорода и оксида углерода, что требует значительных энергетических затрат и капиталовложений.
Далекое сходство можно усмотреть между предложенным способом получения водорода и его образованием в методе паровой конверсии метана. Этот метод упрощенно записывается химической формулой:

По данному известному способу один полезный продукт - водород получают из другого не менее полезного продукта - метана (СН4), и при этом возникает экологически вредный CO2. В предложенном способе метан и диоксид углерода меняются местами - CO2 служит реагентом, а СН4 - как и водород, оказывается полезным продуктом реакции.
К этому следует добавить, что методы паровой конверсии метана, также как и другие известные способы получения водорода, являются очень энергоемкими и затратными. Предложенное техническое решение от известных этим выгодно отличается.
Другим важным его отличием является то, что синтез Фишера-Тропша и паровая конвекция метана осуществляются в газовой фазе, тогда как предложенный способ получения углеводородов и водорода реализуется в фазе жидкости.
ПРИМЕР ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В наиболее общем виде установка для промышленного получения углеводородов, водорода и кислорода по заявляемому способу приведена на фиг.5.
В установку функционально входят следующие основные блоки:
- смеситель 2, предназначенный для приготовления карбонизированной воды путем растворения в воде диоксида углерода;
- реактор 9, заполненный веществом катализатора, где при пропускании карбонизированной воды происходит ее разложение на водород и кислород с образованием углеводородов, и
- разделитель 10, в котором осуществляют сепарирование прошедшего через реактор раствора на газовую и жидкую составляющие, выделение из них продуктов реакции: водорода, кислорода, метана и других углеводородов, а также отделение этих полезных компонентов от присутствующего диоксида углерода.
Принцип работы установки состоит в следующем. По отдельным трубопроводам в смеситель поступает вода и под некоторым давлением углекислый газ, например, в режиме эжектирования. Главное назначение смесителя - обеспечить по возможности более полное насыщение воды диоксида углерода. Поэтому в смесителе могут размещаться дополнительные устройства по перемешиванию раствора диоксида углерода в воде.
Во избежание попадания нежелательных механических и химических примесей поступающие в смеситель вода и диоксид углерода предварительно фильтруются.
Приготовленная в смесителе карбонизированная вода под определенным давлением подается в реактор, где в результате каталитического процесса она обогащается газообразными (Н2, О2, СН4 и его гомологи до С5 включительно) и жидкими (углеводороды от С6 и выше) продуктами реакции.
Габариты и конструкция реактора, тип катализатора, температура реакции, а также давление и скорость прокачки раствора через реактор выбирают, исходя из необходимой информации о реализуемом процессе с целью получения максимального выхода водорода и углеводородов при одновременном сокращении на выходе из реактора количества не прореагировавшего диоксида углерода.
Прошедшая через реактор карбонизированная вода, содержащая продукты реакции, поступает в разделитель. Здесь она подвергается сепарации на жидкую и газообразную фазы, из которых отбирают полезные продукты реакции: водород, кислород, метан и его низшие гомологи - из газообразной, и углеводороды (С5+) - из жидкой. Эти компоненты направляются потребителю для дальнейшей переработки и потребления, а оставшиеся вода и не прореагировавший диоксид углерода по специальному трубопроводу подаются в смеситель для повторного использования.
Тем самым предлагаемая установка, принципиальная схема которой приведена на фиг.5, позволяет производить углеводороды, водород и кислород из диоксида углерода и воды в технологически замкнутом цикле, позволяя с малыми энергетическими затратами преобразовывать экологически вредный диоксид углерода в основные виды современных топлив.
Соответствующая промышленная установка должна включать в себя также дополнительное оборудование - насосы, компрессоры, фильтры, запорную и регулирующую арматуру, датчики и счетчики для контроля, регулирования и оптимизации технологического процесса.
При технической реализации настоящего изобретения могут быть использованы технологическое оборудование и катализаторы, обычно применяемые в известных способах синтеза углеводородов и получения водорода.
Исходя из накопленного в промышленности опыта получения углеводородов синтезом Фишера-Тропша и водорода методом конверсии метана, можно ожидать, что процессом производства этих топлив из диоксида углерода и воды удастся управлять. Это может быть обеспечено за счет оптимального выбора катализатора и термобарических условий, которые могут быть экспериментально оптимизированы с учетом получения требуемых продуктов реакции.
Известно, что при изменении состава катализаторов, соотношения оксида углерода и водорода в синтез-газе и условий каталитического процесса возможно получение как преимущественно метана (до 80-90%), так и смеси легких углеводородов С1-С5 и углеводородов C5-C18+ с вариациями содержания нормальных алканов, олефинов, изо-парафинов и ароматических соединений в широких пределах от 5 до 40-50% (см. Ионе К.Г. О роли водорода в техногенной эволюции Земли. Новосибирск. 2003) [13, стр.43].
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВТОРИЧНОГО ИСПОЛЬЗОВАНИЯ ДИОКСИДА УГЛЕРОДА, СОДЕРЖАЩЕГОСЯ В ВЫХЛОПНЫХ ГАЗАХ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО СГОРАНИЯ И УСТРОЙСТВО ДЛЯ НЕГО | 2022 |
|
RU2807459C1 |
| СПОСОБ РАЗЛОЖЕНИЯ ВОДЫ С УТИЛИЗАЦИЕЙ ДИОКСИДА УГЛЕРОДА И ВЫДЕЛЕНИЕМ ВОДОРОДА | 2012 |
|
RU2540313C2 |
| СПОСОБ РАЗРАБОТКИ МЕСТОРОЖДЕНИЙ ПРИРОДНЫХ УГЛЕВОДОРОДОВ В НИЗКОПРОНИЦАЕМЫХ ПЛАСТАХ | 2013 |
|
RU2590916C1 |
| СПОСОБ УТИЛИЗАЦИИ ДИОКСИДА УГЛЕРОДА В ВОДОНОСНОМ ПЛАСТЕ | 2012 |
|
RU2514076C2 |
| СПОСОБ ДОРАЗРАБОТКИ ИСТОЩЕННЫХ ЗАЛЕЖЕЙ ПРИРОДНЫХ УГЛЕВОДОРОДОВ | 2012 |
|
RU2514078C2 |
| СПОСОБ ПРЕОБРАЗОВАНИЯ СОЛНЕЧНОЙ ЭНЕРГИИ В ХИМИЧЕСКУЮ И АККУМУЛИРОВАНИЕ ЕЕ В ВОДОРОДСОДЕРЖАЩИХ ПРОДУКТАХ | 2012 |
|
RU2520475C1 |
| РЕАКТОР КОНВЕРСИИ МЕТАНА | 2014 |
|
RU2571149C1 |
| ПРОЦЕСС ИСПОЛЬЗОВАНИЯ В ПОЛНОМ ОБЪЕМЕ ОСТАТОЧНОГО ГАЗА СИНТЕЗА ФИШЕРА-ТРОПША С НИЗКИМ ВЫДЕЛЕНИЕМ УГЛЕРОДА | 2013 |
|
RU2608406C2 |
| СПОСОБ ПОЛУЧЕНИЯ И КОНВЕРСИИ СИНТЕЗ-ГАЗА (ВАРИАНТЫ) | 2006 |
|
RU2412226C2 |
| ПРИМЕНЕНИЕ ИСКОПАЕМЫХ ТОПЛИВ ДЛЯ УВЕЛИЧЕНИЯ ПРЕИМУЩЕСТВ СИНТЕТИЧЕСКИХ ТОПЛИВ НА ОСНОВЕ БИОМАССЫ | 2011 |
|
RU2598071C2 |
Изобретение относится к способу получения углеводородов, водорода и кислорода с использованием диоксида углерода и воды. Согласно способу насыщают воду диоксидом углерода с получением карбонизированной воды; пропускают карбонизированную воду, по меньшей мере, через один реактор, содержащий катализатор, с осуществлением реакции:
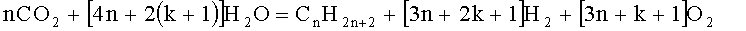
1. Способ получения углеводородов, водорода и кислорода с использованием диоксида углерода и воды, согласно которому насыщают воду диоксидом углерода с получением карбонизированной воды; пропускают карбонизированную воду, по меньшей мере, через один реактор, содержащий катализатор, с осуществлением реакции:
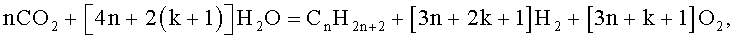
2. Способ по п.1, отличающийся тем, что в качестве катализатора используют металлы или сплавы или окислы или минералы.
3. Способ по п.1, отличающийся тем, что насыщение воды диоксидом углерода с получением карбонизированной воды осуществляют, по меньшей мере, в одном смесителе.
4. Способ по п.1, отличающийся тем, что в жидкой фазе отделяют жидкие углеводороды от воды, из газообразной фазы выделяют водород, кислород, низкомолекулярные гомологи метана и не прореагировавший диоксид углерода; жидкие и газообразные углеводороды, водород и кислород направляют на дальнейшую переработку, а карбонизированную воду и диоксид углерода возвращают в смеситель для повторного использования в цикле.
5. Способ по п.1, отличающийся тем, что используют несколько реакторов с различными или одинаковыми катализаторами.
6. Способ по п.5, отличающийся тем, что каждый реактор соединен, по меньшей мере, с одним разделителем.
7. Способ по п.1 или 4, отличающийся тем, что используют несколько разделителей.
8. Способ по п.7, отличающийся тем, что каждый разделитель служит для выделения, по меньшей мере, одного продукта реакции, включая не прореагировавшие диоксид углерода и воду.
9. Способ по п.1, отличающийся тем, что дополнительно содержит, по меньшей мере, один фильтр, обеспечивающий фильтрацию исходных, промежуточных или конечных продуктов реакции.
10. Способ по п.9, отличающийся тем, что смеситель выполнен, по меньшей мере, с одним фильтром, на входе и/или на выходе реактора установлен, по меньшей мере, один фильтр, и разделитель выполнен, по меньшей мере, с одним фильтром.
| US 5516742 А, 14.05.1996 | |||
| US 2009001316 A1, 01.01.2009 | |||
| JP 9132407 A, 20.05.1997 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКИХ УГЛЕВОДОРОДНЫХ ПРОДУКТОВ ИЗ ДИОКСИДА УГЛЕРОДА | 2000 |
|
RU2181747C1 |
| US 4327239 A, 27.04.1982 | |||
| WO 2010007602 A1, 21.01.2010 | |||
| JP 0005000245 A, 08.01.1993. | |||
Авторы
Даты
2013-10-10—Публикация
2011-12-26—Подача