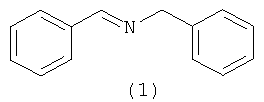
Предлагаемое изобретение относится к области органической химии, в частности к способу получения N-бензилиденбензиламина (1).
N-бензилиденбензиламин (1) применяют как индикатор для количественного определения литийорганических соединений титриметрическим методом [Singn G., Zimmer Н. // J. Org. Chem., 1979, 44(19). 417; Сивова Л.И., Сивов Н.А., Грачева Р.А., Потапов В.М. // ЖОрХ, 1978, 14, 791; Kauffmann Т., Habersaat К., Koppelmann E. // Chem. Ber. 1977, 110, 638].
N-Бензилиденбензиламин (1) является исходным соединением для синтеза замещенных пиперидин-2-онов, обладающих широким спектром физиологической активности, таких как анальгетическая, противоконвульсивная, противосудорожная [Burdzhiev N.T., Stanoeva E.R. // Tetrahedron, 2006, 62, 8318].
Классический метод получения (1) основан на реакции бензальдегида с бензиламином. Выход (1) зависит от многих факторов: природы растворителя, температуры, порядка смешения реагентов и наличия катализатора [Furukawa М., Okawara Т., Terawaki Y. // Chem. Pharm. Bull., 1977, 25(1), 181].
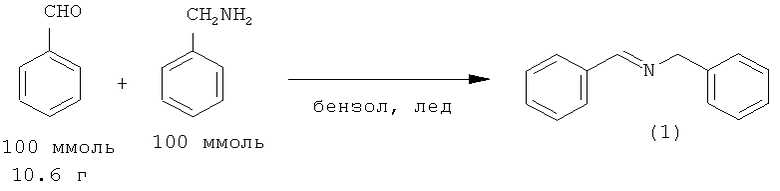
Так, при взаимодействии бензальдегида с бензиламином в растворе кипящего толуола в течение 2 часов выход N-бензилиденбензиламина (1) составил 96% [Juday R., Adkins Н. // J. Am. Chem. Soc., 1955, 77, 4559].
Однако в более поздней работе [Casey C.P., Johnson J.B. // J. Am. Chem. Soc., 2005, 127(6), 1883] выход (1), несмотря на более длительное нагревание в толуоле, был существенно меньше (67%).
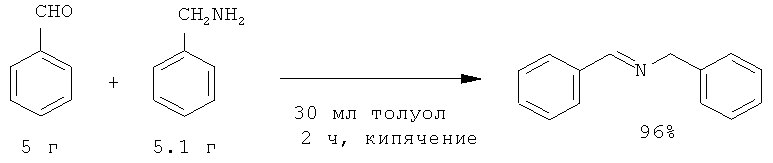
Если реакцию проводить путем медленного добавления бензальдегида к бензиламину, то она проходит при 0°С, завершается за 1 ч. Выход (1) при данных условиях составляет 90% [Wuts P., Jung Y-W, // J. Org. Chem., 1991, 56(1), 365].
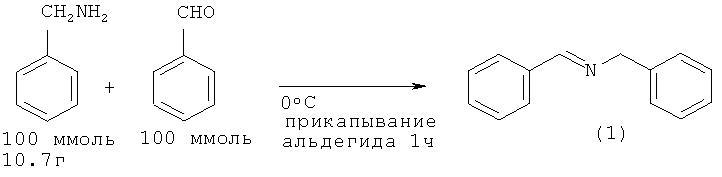
В работах [Zhang Y., Lu Z., Desai A., Wulff W.D., // Org. Letters, 2008, 10(23), 5429; Newman C.A., Antilla J.C., Chen P., Predeus A.V., Fielding L., Wulff W.D. //J. Am. Chem. Soc., 2007, 129(23), 7216]. N-Бензилиденбензиламин (1) получен из бензиламина и бензальдегида в присутствии катализатора MgSO4. Реакция проходит при комнатной температуре, завершается за 24 ч и приводит к получению (1) с выходом 87%.
Китайские исследователи [Law M.C., Cheung T.W., Wong K-Y, Chan Т.Н. // J. Org. Chem., 2007, 72(3), 923] получили N-бензилиденбензиламин (1) с выходом 99% за 3 ч при комнатной температуре из 1 моля бензиламина и 1 моля бензальдегида в среде ионной жидкости ([bpy][BF4]/[bpy]Br (bру=N-бутилпиридин)) (2 мл). Реакцию проводят в атмосфере азота.
Недостатки методов:
1. Использование в качестве исходного реагента, наряду с бензиламином, дорогостоящего и склонного к быстрому окислению бензальдегида.
N-бензилиденбензиламин (1) получен при фотохимическом облучении нитрозоаминов в нейтральной или кислой среде. В присутствии кислорода (воздух) дибензилнитрозоамин в метаноле подвергается фотолизу с образованием N-бензилиденбензиламина (1), дибензиламина (2) и нитрата дибензиламмония. [Axenford Т., Milne G.W.A. // Tetrahedron, 1968, 24, 5775].
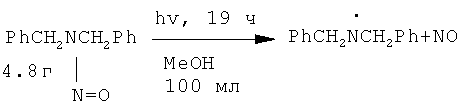


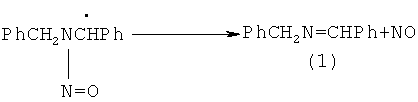
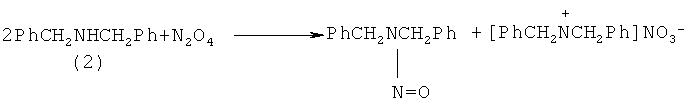
Недостатки методов:
1. Использование труднодоступных нитрозоаминов.
2. Низкая селективность реакции.
3. Оброзование побочного продукта - нитрата дибензиламина.
В работе [Ahn J-S., Сhi K-W., Hwang H.Y., Ryu K-S., Lee C.W. // Bull. Korean Chem. Soc., 2009, 30(10), 2377] N-бензилиденбензиламин (1) (выход 52%) был получен реакцией бензиламина с фенилглицином, в условиях генерирования оксида углерода под действием нанопористого полианилинового катализатора PANI-ES. Одновременно с основной реакцией реализуется побочная, приводящая к образованию N-формилбензиламина.
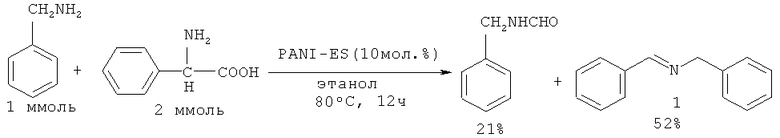
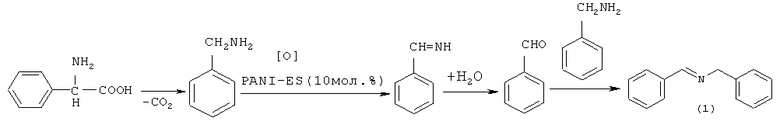
Недостатки метода:
1. Использование дорогостоящей аминокислоты - фенилглицина и катализатора PANI-ES.
2. Образование побочных продуктов.
В работе N-бензилиденбензиламин (1) синтезирован из бензиламина и бутилнитрита [Gillis R.G. // J. Org. Chem., 1956, 21, 805]. Авторы предположили следующий маршрут реакции:
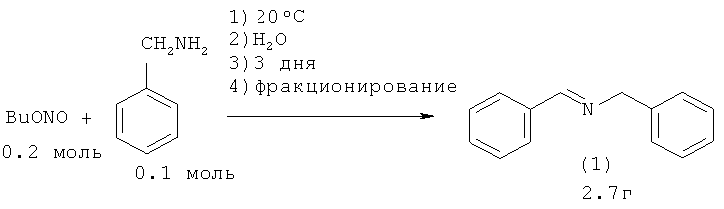
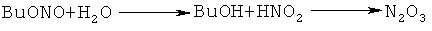
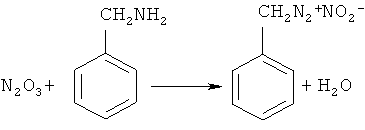
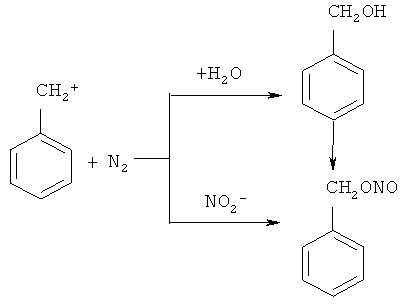

Недостатки метода:
1. Значительна продолжительность реакции - 3 дня.
2. Труднодоступность бутилнитрита.
3. В ходе реакции выделяется ядовитый оксид азота N2O3.
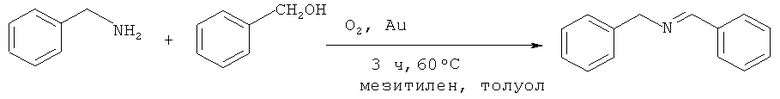
Катализатор, приготовленный нанесением золота на твердую подложку гидроксиапатита является эффективным для синтеза N-бензилиденбензиламина (1) из бензиламина и бензилового спирта в окислительных условиях. Реакция протекает в среде толуола и мезитилена при 60°С за 3 ч [Sun H., Su F-Z., Ni J., Cao Y., He H-Y., Fan K-N. // Angew. Chem., Int. Ed., 2009, 48(24), 4390].
В работе [Gunanathan С., Milstein D. // Angew. Chem., Int. Ed., 2008, 47(45), 8661] осуществлен синтез (1) из бензилового спирта и аммиака под действием рутенийсодержащего катализатора (выход 12%). Основным продуктом реакции является бензиламин, полученный с выходом 87%. Реакцию проводят в среде толуола, при 135°С в течение 13 ч.
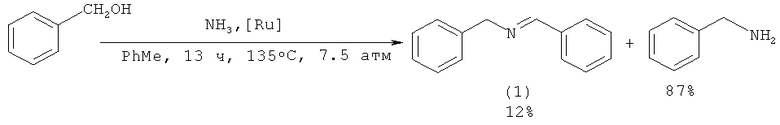
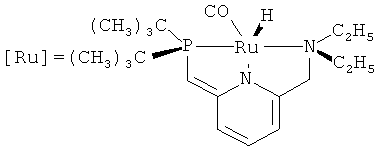
Недостатки методов:
1. Применение дорогостоящего рутенийсодержащего катализатора.
2. Жесткие условия реакции (135°С, 13 ч) и высокое давление (7.5 атм).
3. Низкий выход N-бензилиденбензиламина (1).
В работе [Vanek P, Klan P. // Synt. Commun, 2000, 30(8), 1503] N-бензилиденбензиламин (1) (выход 95%) был получен по Штаудингеру из бензилбромида, бензальдегида, азида натрия (NaN3) под действием РРh3. Реакцию проводили в ацетонитриле.
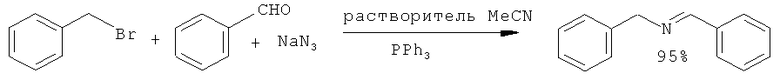
Недостатки метода:
1. Применение бензилбромида - лакриматора.
2. Использование токсичного и взрывоопасного азида натрия.
Авторы работы [Maeda Y., Nishimura Т., Uemura S. // Bull. Chem. Soc. Jpn., 2003, 76(12), 2399] синтезировали (1) окислением дибензиламина (2) кислорода действием медьсодержащего катализатора. Выход имина (1) составил 90% при числе каталитических циклов 45.
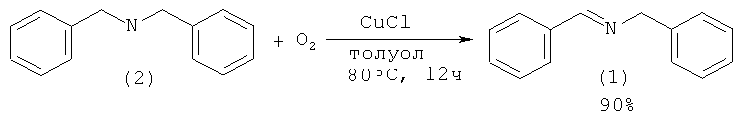
N-бензилиденбензиламин (1) образуется при окислении соответствующего дибензиламина (2) с помощью t-BuOOH в присутствии катализатора RuCl2(PPh3)3. Реакцию проводили в среде бензола. Выход N-бензилиденбензиламина (1) составил 80% [Murahashi S., Naota Т., Taki H. //J. Chem. Soc., 1985, (9), 613].

N-бензилиденбензиламин (1) был получен с выходом 97% при действии на дибензиламин (2) реагента HgO-I2, в среде хлористого метилена при комнатной температуре [Orito K., Hatakeyama Т., Takeo M., Uchiito S., Tokuda M., Suginome H., // Tetrahedron, 1998, 54(29), 8403].
Недостатки методов:
1. Исходным соединением служит дибензиламин, предварительно полученный из бензиламина.
2. Использование окислительных реагентов.
В работе [Kodera Y., Watanabe S., Imada Y., Murahashi S-I., // Bull. Chem. Soc. Jpn., 1994, 67(9), 2542; Murahashi S., Kodera Y. //Tetrahedron Lett., 1985, 26(38), 4633] N-бензилиденбензиламин (1) получен дегидратацией N,N-дибензилгидроксиламина (3) с помощью безводного TiCl3 в растворе ТГФ. Выход (1) по данному синтезу составляет 78%. Реакция проходит при -78°С.
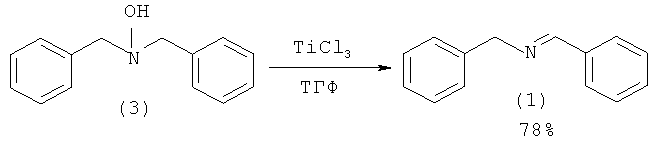
Недостатки методов:
1. Использование в качестве исходного соединения труднодоступного N,N-дибензилгидроксиламина (3).
2. Применение абсолютированного растворителя ТГФ.
3. Необходимость использования безводного ТiСl3.
4. Проведение реакции при -78°С.
В работе [Jiang G., Chen J., Huang J-S., Che C-M. // Org. Lett., 2009, 11(20), 4568] для окисления дибензиламина (2) до имина (1) использовали синглетный кислород, генерируя его из триплетного кислорода в присутствии оптических сенсибилизаторов.
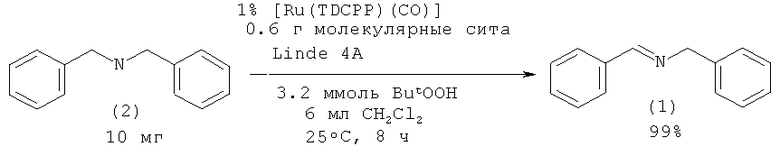
Такие же результаты получены при генерировании синглетного кислорода в присутствии порфириновых фотосенсибилизаторов (реакция Уги) [Jiang G., Chen J., Huang J-S, Che C-M, // Org. Lett., 2009, 11(20), 4568].

В работе [Grirrane A., Corma A., Garcia Н. // J. Catalysis, 2009, 264(2), 138]. N-бензилиденбензиламин (1) синтезирован окислением дибензиламина (2) с помощью кислорода в присутствии металлического золота нанесенного на диоксид титана.
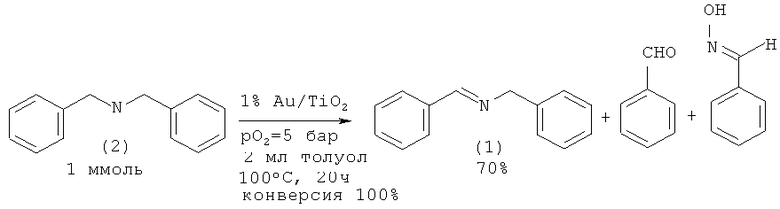
Катализатор 5% Аu/Аl2О3 (порошок Аu (50 µm размер частиц) и подложка из оксида алюминия (50-150 нм размер частиц)) оказался эффективным для аэробного окислительного дегидрирования дибензиламина (2) до имина (1). Реакция проходит при 100°С при давлении O2 1 атм [Zhu В., Lazar M., Trewyn B.G., Angelici R.J. //J. Catalysis (2008), 260(1), 1].
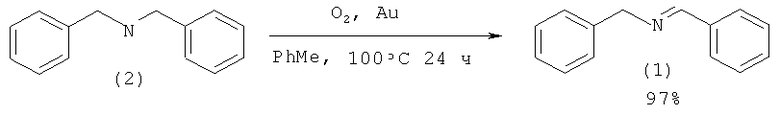
Недостатки методов:
1. Использование в качестве исходного соединения дибензиламина (2), предварительно полученного из бензиламина.
2. Применение дорогостоящего катализатора, содержащего золото.
3. Значительная продолжительность реакции 24 ч.
4. Процесс является пожаро- и взрывоопасным.
Рутениевый комплекс {[(РСу3)(СО)RuН]4(µ4-O)(µ3-ОН)(µ2-ОН)} является эффективным катализатором для синтеза N-бензилиденбензиламина (1) из N,N'-бензилфениламина и трет-бутилэтилена [Yi, Chae S.; Lee, Do W. // Organometallics, 2009, 28(4), 947]. Реакция проходит в жестких условиях при 200°С за 1 ч.

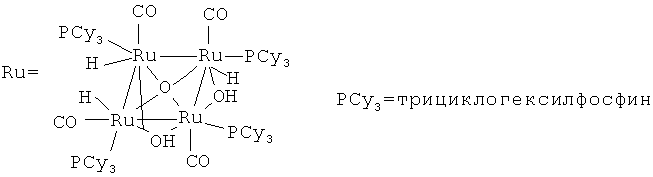
Недостатки методов:
1. Использование труднодоступных исходных реагентов и катализатора.
В работе [Choudary B.M., Narender N., Bhuma V. // Synt. Commun., 1996, 26(4), 631] N-бензилиденбензиламин (1) был получен окислением бензиламина с помощью третбутилгидропероксида t-BuOOH в присутствии цинк-хромового катализатора.
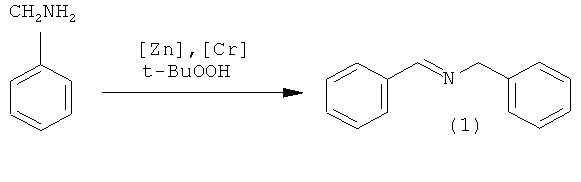
Аналогичная реакция бензиламина с t-BuOOH в присутствии марганецсодержащих катализаторов приводит к образованию N-бензилиденбензиламина (1) с выходом 93%.
Бензиламин реагирует с кислородом с образованием N-бензилиденбензиламина (1) под действием катализатора N,N'-ди(4'-аминофенил)-1,4-фенилендиамина [Hirao Т., Fukuhara S. // J. Org. Chem, 1998, 63(21), 7534].
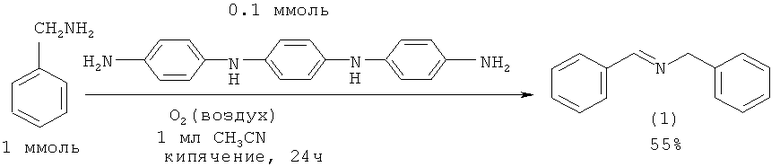
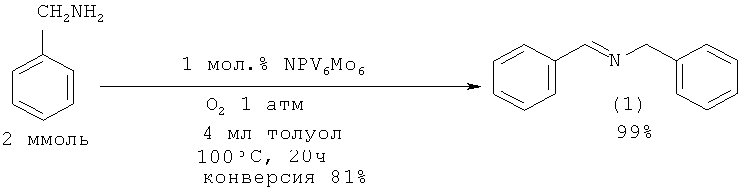
В работе [Nakayama K., Hamamoto M., Nishiyama Y., Ishii Y. // Chem. Lett., 1993, (10), 1699-702.] синтез N-бензилиденбензиламина (1) осуществлен окислением бензиламина кислородом под действием гетерополиоксометаллата NРV6Мо6. Реакцию проводили в различных растворителях: толуол, ацетонитрил, 1,2-дихлорэтан, лучшим из которых является толуол.
N-бензилиденбензиламин (1) был синтезирован при действии на бензиламин кислорода в присутсвии тропилиевых комплексов А или Б. Выход N-бензилиденбензиламин (1) по данному методу составляет 28%. [Naya S., Tokunaka Т., Makoto N. // J. Org. Chem., 2005, 70(24), 9780]
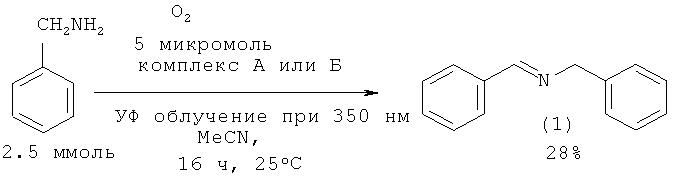
N-бензилиденбензиламин (1) с выходом 89% был получен последовательным диспропорционированием и окислением бензиламина с помощью O2 в присутствии ацетата золота [Aschwanden L., Mallat Т., Krumeich F., Baiker A. // J. Mol. Cat., 2009, 309(1-2), 57].

Недостатки методов, основанных на окислительных реакциях бензиламина:
1. Пожаро- и взрывоопасность процессов из-за использования кислорода, гидропероксида трет-бутила, в качестве окислителя.
2. Необходимость использования труднодоступных катализаторов.
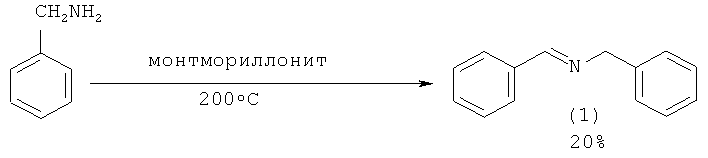
N-бензилиденбензиламин (1) был получен с выходом 20% из бензиламина в присутствии Аl3+- обменного монтмориллонита при температуре 200°С [Ballantine J., Purnell J., Rayanakorn M., Williams K. // J. Mol. Cat., 1985, 30, 373].
Авторами предлагается новый способ получения N-бензилиденбензиламина, не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является упрощение технологии и удешевление себестоимости N-бензилиденбензиламина (1) за счет использования доступного катализатора FеСl3 6Н2О и исходных реагентов - бензиламина и CCl4, a также уменьшение количества исходных реагентов.
Сущность способа заключается во взаимодействии бензиламина с CCl4 в присутствии катализатора FеСl3·6Н2О, при 40-85°С в открытой системе в течение 0,5-8 часов, при мольном соотношении [катализатор]:[бензиламин]:[ССl4]=0,1-1:100:50-200, предпочтительно [катализатор]:[бензиламин]:[ССl4]=1:100:200.
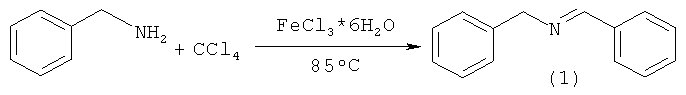
Существенные отличия предлагаемого способа от прототипов.
Исходным сырьем для получения N-бензилиденбензиламина (1) является бензиламин и четыреххлористый углерод, а реакция проходит в присутствии FеСl3·6Н2O.
Преимущества предлагаемого метода.
1. Доступность и дешевизна исходных реагентов - бензиламина, CCl4, и катализатора и удешевление себестоимости и упрощение технологии.
2. Отсутствие побочных продуктов, что облегчает выделение и очистку целевого N-бензилиденбензиламина (1).
3. Выход N-бензилиденбензиламина (1) составляет 96%.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. В стеклянный реактор (V=100 мл) помещали 25 мг (1 ммоль) FеСl3·6Н2O, 1 мл (100 ммоль) бензиламина, 1,8 мл (200 ммоль) CCl4. Реакционную массу нагревали при 85°С в течение 8 часов на магнитной мешалке с обратным холодильником. После окончания реакции реакционную массу охлаждали до ~20°С, нейтрализовали 10% водным раствором Nа2СО3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлороформом и отфильтровывали. Растворители отгоняли, N-бензилиденбензиламин перегоняли под вакуумом. Выход N-бензилиденбензиламина (1) - 96%.
Выделенный N-бензилиденбензиламин (1) имел температуру кипения 124-125/2 мм рт.ст. (200-202°С/ 30 мм рт.ст.) (Gillis R.G. // J. Am. Chem. Soc, 1956, 21. 805), (125-127°С/0,1 мм рт.ст.(Wuts P., Jung Y-W. // J. Org. Chem., 1991. 56(1). 365].
N-Бензилиденбензиламин (1)
Выход 96%. Маслянистая жидкость. Спектр ЯМР 13С (δ, м.д.): 65.05 (PhCH2N), 126.79, 127.98, 128.28, 128.49, 128.60, 130.76, 136.17, 139.29, 162.00(NCHPh). Спектр ЯМР 1H (CDCl3, δ, м.д.): 4.86 с (2Н, PhCH 2N), 6.86-8.20 м (10Н, Аr), 8.43 с (10Н, NCHPh).
Масс-спектр, m/z (Iотн. (%)): 195.25[M]+(35), 194 (33), 165 (5), 152 (3), 117 (15), 91 (100), 65(20), 51(5). Найдено, %: С 86.10; Н 6.73; N 7.17. C14H13N. Вычислено, %: С 86.11; H 6.71; N 7.18.
Другие примеры, подтверждающие способ приведены в таблице 1.
п/п
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-ФЕНИЛ-3-АЛКИЛХИНОЛИНОВ | 2014 |
|
RU2565787C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ БЕНЗОЙНОЙ КИСЛОТЫ | 2011 |
|
RU2481324C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2- И 2,3-ЗАМЕЩЕННЫХ ХИНОЛИНОВ | 2012 |
|
RU2504540C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФЕНИЛПРОПАРГИЛОВОГО СПИРТА | 2012 |
|
RU2515241C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ 1- И 2-НАФТАЛИНКАРБОНОВЫХ КИСЛОТ | 2012 |
|
RU2536591C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,2-ДИОЛОВ И ССl ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ | 2015 |
|
RU2614251C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ ГИДРОКСИБЕНЗОЙНЫХ КИСЛОТ | 2017 |
|
RU2675496C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЛОБЕТУЛИНА | 2009 |
|
RU2402561C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛИЧЕСКИХ ЭФИРОВ ИЗ ДИОЛОВ | 2016 |
|
RU2644163C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ ФЕНАНТРЕН-9-КАРБОНОВОЙ КИСЛОТЫ | 2014 |
|
RU2566086C1 |
Изобретение относится к новому способу получения N-бензилиденбензиламина формулы (1). Способ включает взаимодействие бензиламина с CCl4 в присутствии катализатора FeCl3·6Н2О, при 40-85°С в открытой системе в течение 0,5-8 часов, при мольном соотношении [катализатор]:[бензиламин]:[CCl4]=0,1-1:100:50-200. Способ позволяет упростить технологию, облегчить выделение и очистку целевого продукта и получить продукт с хорошим выходом. 1 табл., 1 пр.
Способ получения N-бензилиденбензиламина (1) формулы
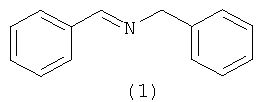
отличающийся тем, что бензиламин взаимодействует с CCl4 в присутствии катализатора FeCl3·6Н2О, при 40-85°С в открытой системе в течение 0,5-8 часов, при мольном соотношении [катализатор]:[бензиламин]:[CCl4]=0,1-1:100:50-200.
| JP 5253489 A, 05.10.1993 | |||
| Способ получения продуктов конденсации галопроизводных углеводородов аммиака и альдегидов | 1972 |
|
SU491618A1 |
| L.ASCHWANDEN et al., «A simple preparation of an efficient heterogeneous gold catalyst for aerobic amine oxidation», Journal of Molecular Catalysis A: Chemical, vol | |||
| Переставная шейка для вала | 1921 |
|
SU309A1 |
Авторы
Даты
2013-10-27—Публикация
2012-01-10—Подача