Изобретение относится к способам получения вторичных ацетиленовых спиртов, конкретно 1-фенилпропаргилового спирта.
Вторичные ацетиленовые спирты - универсальные строительные блоки для синтеза ряда органических соединений (ненасыщенных кетонов, ацетиленов, индолов, пирролов, оксазолов). Особенно ценным из них является 1-фенилпропаргиловый спирт (ФПС). Он находит широкое применение в тонком органическом синтезе, например, для получения ацетиленового и других ненасыщенных кетонов (патент US 4418079, 1983). ФПС используют в качестве сшивающего агента (патент RU 2171264, 2001), как интермедиат в синтезе антиагрегатных агентов тромбоцитов крови (патент US 4418079, 1983), ингибиторов усвоения кальция лейкоцитами и тромбоцитами (патент US 5223518, 1993), аденозиновых рецепторов A3 (R.Volpini, S.Costanzi, С.Lambertucci, S.Taffi, S.Vittori, K.-N.Klotz, G.Cristalli, J. Med. Chem. 2002, v.45, 3271-3279).
ФПС получают несколькими способами. Наиболее распространенный из них основан на нуклеофильном присоединении к бензальдегиду металлированных ацетиленов. В качестве последних используют литий (M.M.Midland, J. Org. Chem. 1975, v.40, 2250-2252) или дилитий ацетилинид (J.Mortier, M.Vaultier, F.Carreaux, J.-M.Douin, J.Org. Chem. 1998, v.63, 3515-3516), ацетиленид натрия (K.N.Campbell, В.К.Campbell, L.T. Eby, J. Am. Chem. Soc. 1938, v. 60, 2882-2884; E.R.H.Jones, J.T.McCombie, J. Chem. Soc. 1942, 733-735; M.W.Leeds, M.Hill, H.L.Komarowski, Pat US 3257465, 1966), ацетиленид цинка (H. Sasaki, D.Boyall, E.M.Carreira, Helv. Chim. Acta 2001, v.84, 964-971), этинилмагний галогениды (реактив Иоцича, A. Kojima, Т. Irie, S.Harada, Y.Kameno, J.Katsube, H.Yamamoto, Pat US 4418079, 1983; U.Kazmaier, S.Lucas, M.Klein, J. Org. Chem., 2006, v. 71, 2429-2433; J.-J.Liu, F.Konzelmann, K.-C.Luk, Tetrahedron Lett. 2003, v.44, 3901-3904), триметилэтинилалюминат натрия (M.J.Joung, J.H.Ahn, N.M.Yoon, J. Org. Chem. 1996, v.61, 4472-4475).
Так, реакция бензальдегида с моноацетиленидом лития в сухом тетрагидрофуране (ТГФ) приводит к ФПС с выходом 93% (M.M.Midland, /. Org. Chem. 1975, v.40, 2250-2252) или 81% (Т.Е.Nielsen, S.Le Quement, D.Tanner, Synthesis 2004, 1381-1390).
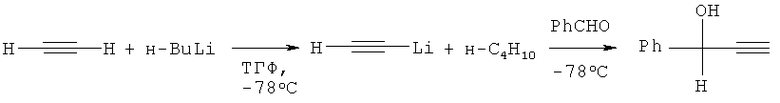
К раствору моноацетиленида лития, получаемого из ацетилена и н-бутиллития в ТГФ (-78°C), добавляют раствор бензальдегида в ТГФ, смесь перемешивают 20 мин и оставляют нагреваться до комнатной температуры. ФПС выделяют из реакционной смеси (после ее разбавления водой и нейтрализации K2CO3) экстракцией диэтиловым эфиром и последующей вакуумной перегонкой (M.M.Midland, J. Org. Chem. 1975 v.40, 2250-2252) или колоночной хроматографией (Т.Е.Nielsen, S.Le Quement, D.Tanner, Synthesis 2004, 1381-1390).
Этот способ получения ФПС реализуется при -78°C; при более высокой температуре образуется более стабильный дилитий ацетиленид, что приводит к снижению выхода целевого спирта.
Позднее было показано (J.Mortier, М.Vaultier, F.Carreaux, J.-M.Douin, J. Org. Chem. 1998, v.63, 3515-3516; Mortier, M. Vaultier, J.-M.Douin, W09929644, 1999), что при 0°C диспропорционирование моноацетиленида лития в дилитий ацетиленид и ацетилен обратимо и при добавлении альдегида образуется ФПС с выходом 90%.
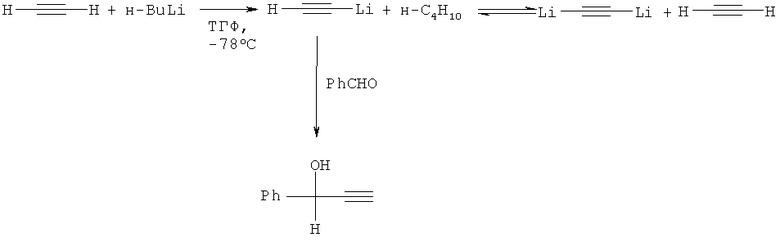
ФПС с выходом 76% синтезирован из бензальдегида и литий бис(диизопропиламино)борацетиленида, получаемого из хлор-
бис(дизопропиламино)борана и литий ацетиленида с последующей обработкой н-бутиллитием (ТГФ, 0°C) (С.Blanchard, М.Vaultier, J. Mortier, Tetrahedron Lett. 1997, v.38, 8863-8866).

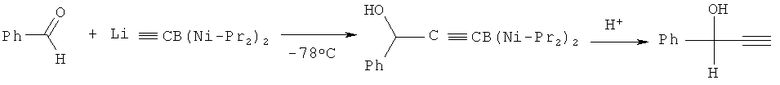
Реакция бензальдегида с литий триметилсилилацетиленидом в присутствии хирального лиганда - (28,2′S)-2-гидроксиметил-1-[(1-метилпирролидин-2-ил)метил]-пирролидина - приводит к ФПС с выходом 87% (Т.Mukaiyama, К.Suzuki, К.Soai, Т.Sato, Chem. Lett. 1979, 447-448; Т.Mukaiyama, Tetrahedron 1981, v.37, 4111-4119).
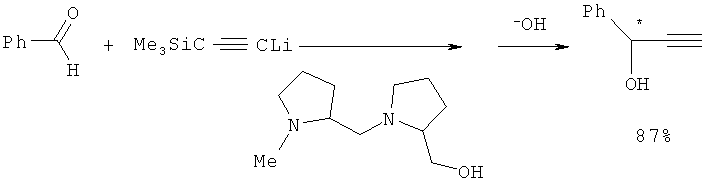
Синтез осуществляется следующим образом: к раствору 2-гидроксиметил-1-[(1-метилпирролидин-2-ил)метил]пирролидина в диэтиловом эфире прибавляют (-35°C) последовательно триметилсилилацетилен в диметоксиэтане (ДМЭ) и н-бутиллитий в гексане. Через 30 мин перемешивания при данной температуре суспензию охлаждают до -123°C и прикапывают раствор бензальдегида в ДМЭ, смесь перемешивают 1 ч. После обработки 2N раствором соляной кислоты, экстракции диэтиловым эфиром, высушивания над Na2SO4 и удаления растворителя тонкослойной хроматографией (SiO2) выделяют ФПС.
ФПС (выход 73-86%) получен взаимодействием бензальдегида с ацетиленидом натрия в диоксане (36-39°C), пиридине (39-41°C) либо дибутиловом эфире диэтиленгликоля (30-33°C) (M.W.Leeds, М.Hill, Н.L.Komarowski, Pat US 3257465,1966). Ацетиленид натрия получают реакцией металлического натрия с ацетиленом при 65-70°C в течение 2 ч в растворителе (диоксан, пиридин, дибутиловый эфир диэтиленгликоля), переносят его в реакционную колбу и при температуре 30-41°C добавляют бензальдегид в течение 1-2 ч, смесь перемешивают еще 3-4 ч. После охлаждения до 10°C смесь гидролизуют водой, отделяют органический слой, который обрабатывают размельченной углекислотой и фильтруют. ФПС выделяют вакуумной перегонкой.
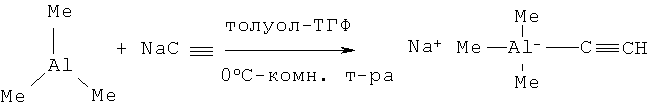
Из бензальдегида и триметилэтинилалюмината натрия (ТГФ-толуол, комнатная температура) ФПС синтезирован с выходом 93% (М.J.Joung, J.Н.Ann, N.М.Yoon, Org. Chem. 1996, v.61, 4472-4475). Триметилэтинилалюминат натрия получают добавлением ацетиленида натрия в виде кашицы в ксилоле к раствору триметилалюминия в смеси ТГФ-толуол (0°C) при интенсивном перемешивании. Затем полученный раствор прибавляют к раствору бензальдегида в толуоле при комнатной температуре, через 1 ч смесь нейтрализуют насыщенным раствором хлорида аммония и экстрагируют этилацетатом, органический слой сушат и концентрируют при пониженном давлении, сырой продукт очищают колоночной хроматографией (SiO2, гексан/этилацетат 9:1).

ФПС получают также из бензальдегида и этинилмагний бромида в ТГФ (A.Kojima, Т.Irie, S.Harada, Y.Kameno, J.Katsube, H.Yamamoto, Pat US 4418079, 1983; U.Kazmaier, S.Lucas, M.Klein, J. Org. Chem. 2006, v.71, 2429-2433; P.C.Chen, R.E.Wharton, P.A.Patel, A.K.Oyelere, Bioorg. Med. Chem. 2007, v.15, 7288-7300). Этот синтез ФПС подробно описан в патенте (A. Kojima, Т. Irie, S. Harada, Y. Kameno, J.Katsube, H.Yamamoto, Pat US 4418079, 1983). Раствор этилмагний бромида в сухом ТГФ прибавляют к раствору ацетилена в ТГФ (-30+-20°C, 50 мин). Реакционную смесь перемешивают 50 мин при температуре ниже 0°C, затем к ней прибавляют раствор бензальдегида в ТГФ в течение 1 ч, поддерживая температуру от 0 до 10°C, после этого смесь перемешивают при комнатной температуре (24 ч), разбавляют при перемешивании и охлаждении водой и отфильтровывают. Из фильтрата удаляют растворитель, остаток перегоняют, получая ФПС. Выход ФПС в патенте не указан. В работе (U.Kazmaier, S.Lucas, М.Klein, J. Org. Chem. 2006, v.71, 2429-2433) приведена схема реакции бензальдегида с этинилмагний бромидом (ТГФ, 0°C) и указан выход ФПС (90%), но конкретная методика его получения не описана.
С количественным выходом ФПС в виде сырого продукта (коричневатое масло без перегонки) получен добавлением раствора этинилмагний бромида в ТГФ к раствору бензальдегида в ТГФ при комнатной температуре (1 ч) в атмосфере аргона (P.C.Chen, R.E.Wharton, P.A.Patel, A.K.Oyelere, Bioorg. Med. Chem. 2007, v.15, 7288-7300).
Реакцией этинилмагний хлорида с бензальдегидом (ТГФ, от -65°C до комнатной температуры, 1.5 ч) ФПС синтезирован с выходом 98% (J.-J.Liu, F.Konzelmann, К.-С.Luk, Tetrahedron Lett. 2003, v.44, 3901-3904).
Взаимодействие бензальдегида и ацетиленида цинка, получаемого in situ из трифлата цинка и ацетилена в присутствии (+)-N-метилэфедрина, приводит к энантиомеру (S)-ФПС высокой степени чистоты (97%) (Н.Sasaki, D.Boyall, Е.М.Carreira, Helv. Chim. Acta 2001, v.84, 964-971). Реакцию проводят следующим образом: к прогретому и отвакуумированному трифлату цинка в атмосфере азота добавляют (+)-N-метилэфедрин, толуол и триэтиламин. Смесь выдерживают под азотом при комнатной температуре в течение 2 ч. К полученной таким образом суспензии добавляют бензальдегид (соотношение бензальдегид:(CF3SO3)2Zn 1:1.1), смесь охлаждают до -40°C и в течение 20 мин насыщают ацетиленом, пропуская его через раствор. После этого реактор герметично закрывают и смесь перемешивают 14 дней при комнатной температуре. Затем реактор вновь охлаждают до -40°C, открывают и к реакционной смеси прикапывают насыщенный водный раствор хлорида аммония, смесь перемешивают при нагревании до комнатной температуры в течение 2 ч. Органический слой отделяют, промывают насыщенным раствором NaCl и сушат сульфатом натрия. После удаления толуола сырой продукт очищают на силикагеле (элюент гексан-этилацетат). Выход ацетиленового спирта 35%, конверсия бензальдегида 68%, выход с учетом конверсии 52%. Недостатки описанного метода: длительность процесса (при этом неполная конверсия бензальдегида и невысокий выход целевого продукта), использование избытка дорогостоящего трифлата цинка и необходимость дополнительного охлаждения до -40°C.
Реакция бисульфитного производного бензальдегида с ацетиленидом натрия в жидком аммиаке приводит к ФПС с выходом 48% (J.Cymerman, K.J.Wilks, J. Chem. Soc. 1950, 1208-1209). К раствору ацетиленида натрия, полученному из металлического натрия и ацетилена в жидком аммиаке, при слабом токе ацетилена прибавляют дробно бисульфитное производное бензальдегида, и смесь перемешивают 5.5 ч. Затем прибавляют хлорид аммония (4.5-кратный избыток) и испаряют аммиак. После испарения аммиака к остатку прибавляют раствор разбавленной серной кислоты (2N) и экстрагируют диэтиловым эфиром.
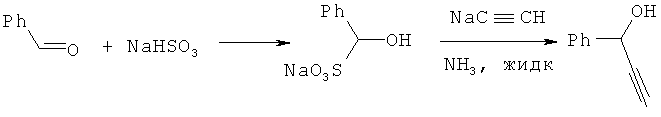
Удаление растворителя из эфирных экстрактов после последовательного промывания последних насыщенными растворами бикарбоната натрия и бисульфита натрия и высушивания (Na2SO4) дает остаток, из которого вакуумной перегонкой получают ФПС. Недостатками этого способа являются необходимость предварительного получения как ацетиленида натрия, так и бисульфитного производного бензальдегида, а также использование жидкого аммиака и металлического натрия.
Триметилсилилацетиленид лития, полученный из триметилсилилацетилена и литий гексаметилдисилазана, реагирует с бензальдегидом, приводя к α-[(триметилсилил)этинил]бензилметанолу, обработка которого (ТГФ, 0°C, 1 ч) тетра-бутиламмоний фторидом дает ФПС с выходом 81% (R.J.Dinerstein, J.S.Sabol, К.А.Diekema, Pat US 5223518, 1993). Триметилсилильную защиту снимают также (метанол, комнатная температура, 3 ч, выход ФПС 95%) обработкой углекислым калием (V. Maraval, С.Duhayon, Y. Coppel, R. Chauvin, Eur. J. Org. Chem. 2008, 5144-5156), либо солями серебра (нитратом или фталатом) в смеси растворителей (ацетон-вода-хлористый метилен, комнатная температура, 2.5-22 ч), выход ФПС 76-86% (A.Orsini, A.Viterrisi, А.Bodlenner, J.-M.Weibel, P.Pale, Tetrahedron Lett. 2005, v.46, 2259-2262).
Вышеописанные способы получения ФПС позволяют получать ацетиленовый спирт с высокими выходами, но они имеют ряд существенных недостатков, основное из которых - использование металлированных ацетиленов, что требует проведения реакции в инертной атмосфере, а также тщательной осушки растворителей и реагентов. В большинстве случаев необходимо охлаждение до низких температур (-78, -123°C), а также использование специального оборудования. В некоторых методах для проведения реакции и выделения целевого ацетиленового спирта применяют несколько растворителей., Целевой продукт чаще всего выделяют с применением пожаро- и взрывоопасного диэтилового эфира. Таким образом, все вышеприведенные методы синтеза ФПС пригодны только для его получения в лабораториях.
Описан трехстадийный способ получения ФПС эпоксидированием 3-фенил-2-пропен-1-ола (8% диизопропилдигидроксисукцината, 5% тетраизопропилтитана, 2 экв. трет-бутилгидропероксида, CH2Cl2, -20-0°C, выход 76%) с последующим хлорированием (трифенилфосфин, 1.2 экв., CCl4, кипячение, 4 ч, выход 87%) и обработкой н-бутиллитием (ТГФ, -35°C, выход 74%), выход ФПС с учетом всех стадий 49-52% (S.Takano, К.Samizu, Т.Sugihara, К.Ogasawara, J. Chem. Soc., Chem. Commun. 1989, 1344-1345; J.S.Yadav, K.Premalatha, S.J.Harshavardhan, B.V.Subba Reddy, Tetrahedron Lett. 2008, v.49, 6765-6767).
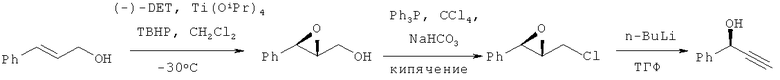
Многостадийность процесса, использование дорогостоящих катализаторов и металлорганических соединений делает этот способ труднореализуемым в промышленности.
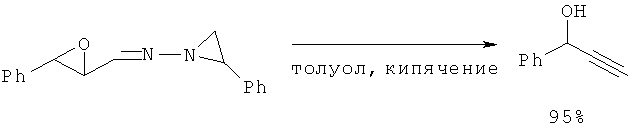
Кипячение в толуоле (3 ч) труднодоступного 2-фенил-N-2-(3-фенил-2-оксиранил)этилиден-1-азиранамина (α,β-эпокси-N-азиридинил имина) приводит к ФПС с выходом 95% (Sunggak Kim, Chang Mook Cho, Tetrahedron Lett. 1994, v.35, 8405-8408).
ФПС с выходом 93% получен декарбоксилированием 4-гидрокси-4-фенил-2-бутиновой кислоты (S.Ceylan, Т.Klande, С.Vogt, С.Friese, A.Kirschning, SynLett, 2010, 2009-2013). Реакцию проводят проточным методом (ацетонитрил, 3 ч) при индукционном нагревании (60°C) микрореактора, содержащего медную проволоку, прокачивая раствор пропаргиловой кислоты насосом через реактор, на выходе из реактора реакционную смесь пропускают через специальный картридж, который улавливает частицы металла.

Недостатком данного метода получения ФПС является использование специального реактора, снабженного индукционным нагревателем, генератором магнитного поля и картриджом для удаления частиц металла. Кроме этого, исходное соединение не является легко доступным. Метод пригоден только для лабораторного применения.
Многостадийным синтезом (6 стадий) ФПС высокой степени энантиомерной чистоты (97%) получен из α,β-ненасыщенных сложных эфиров (J.Chun, H.-S.Byun, R.Bittman, Tetrahedron Lett. 2002, v.43, 8043-8045). Препаративный выход ФПС не указан.
При обработке тетрабутиламмоний фторидом (ТГФ, комнатная температура, 5 мин) или гидридом натрия (ТГФ, 0°C, 30 мин) 1-фенил-2-(п-толилсульфинил)-3-(триметилсилил)-2-пропен-1-ол превращается в ФПС с выходом 28% и 83%) соответственно (S. Nakamura, S.Kusuda, К.Kawamura, Т.Тога, J. Org. Chem. 2002, v.67, 640-647).

Недостатки этого метода - труднодоступность исходного соединения. Его получают в три стадии с использованием большого ряда реагентов и растворителей (диизопропиламин, н-бутиллитий, сухой ТГФ, фенилселенилбромид, м-хлорпербензойная кислота, хлористый метилен), а также низких температур (-78°C, -100°C), что требует специального аппаратурного оформления.
При обработке литий диизопропиламидом (ТГФ, -78°C, 1 ч) 2-хлор-1-фенил-2-пропен-1-ола, синтезируемого из бензальдегида и 1,1,1-трихлорэтана в присутствии избытка (4 экв.) CrCl2, ФПС получают с выходом 89% (J.R.Falck, D.K.Barma, Tetrahedron Lett. 1999, v.40, 2091-2094). Недостатки этого способа - использование большого количества чрезвычайно гигроскопичных и обладающих раздражающим действием дихлорида хрома и триметилсилилхлорида, металлоорганического соединения и низких температур.

Таким образом, очевидно, что несмотря на многочисленность и многообразие способов получения ФПС ни один из них не является достаточно технологичным для реализации в укрупненных масштабах.
Наиболее приемлемыми для практического применения являются способы, основанные на реакции бензальдегида с ацетиленидами лития или натрия, в основе, которых лежит нуклеофильное присоединение ацетиленид-аниона к карбонильной группе. В силу повышенной опасности работы с растворами н-бутиллития в легкокипящих растворителях (обычно н-гексан) и технических неудобств (низкие температуры, инертная атмосфера), а также высокой стоимости литиевых реагентов, наиболее приемлемым для практических целей остается способ, основанный на реакции бензальдегида с ацетиленидом натрия в жидком аммиаке (K.N.Campbell, В.К.Campbell, L.T.Eby, J. Am. Chem. Soc. 1938, v.60, 2882-2884; E.R.H.Jones, J.T.McCombie, J. Chem. Soc. 1942, 733-735), который до настоящего времени чаще всего используется для укрупненной наработки ФПС. Этот способ можно объективно считать прототипом предлагаемого изобретения. В его основу также положена реакция нуклеофильного присоединения ацетиленид-аниона к карбонильной группе. Однако фундаментальным отличием предлагаемого изобретения от прототипа является то, что ацетиленид-анионы генерируются принципиально иным путем - не из ацетиленида натрия, а депротонированием ацетилена под действием NaOH в среде ДМСО, содержащего алифатический спирт.
Известны немногочисленные варианты способов получения ацетиленовых спиртов из ацетилена и только алифатических альдегидов в присутствии гидроксида калия в различных растворителях - реакция Фаворского (И.А.Фаворская, З.А.Шевченко, И.М.Кошкина, ЖОрХ 1967, т.3, 2075; О.А.Тарасова, Б.А.Трофимов, А.В.Афонин, Л.М.Синеговская, Н.А. Калинина, С.В.Амосова, ЖОрХ 1991, т.27, 1172-1180). Однако до сих пор считалось, что гидроксид натрия вообще не способен катализировать реакцию Фаворского.
Таким образом, наиболее близким по технической сущности к предлагаемому изобретению является способ получения ФПС реакцией ацетиленида натрия с бензальдегидом в жидком аммиаке (E.R.H.Jones, J.T.McCombie, J. Chem. Soc. 1942, 733-735). Этот способ-прототип реализуется следующим образом: очищенный ацетилен быстро пропускают через жидкий аммиак (1000 мл) при перемешивании и добавляют металлический натрий (23 г, 1 моль) небольшими кусочками с такой скоростью, чтобы голубой цвет раствора сохранялся не более нескольких мгновений. Затем раствор бензальдегида (106 г, 1 моль) в диэтиловом эфире (100 мл) добавляют в течение 1 ч и смесь перемешивают при охлаждении еще 3 ч, продолжая пропускать ацетилен. Смесь оставляют на ночь для испарения аммиака, после чего к остатку добавляют диэтиловый эфир и разбавленную холодную серную кислоту. Выделение ФПС проводят обычным способом (экстракция эфиром, осушка экстрактов, удаление растворителя, вакуумная перегонка остатка), получая 110 г (83%) ФПС.
Несмотря на высокий выход ФПС данный способ имеет существенные недостатки:
1) использование токсичного аммиака в сжиженном состоянии, что предполагает его тщательную осушку и дополнительное охлаждение для поддержания жидкого состояния растворителя;
2) использование металлического натрия, требующего особых мер предосторожности при работе с ним;
3) предварительное получение ацетиленида натрия.
Также к существенному недостатку способа-прототипа следует отнести и способ выделения целевого продукта, а именно необходимость длительного испарения аммиака и использование пожаро- и взрывоопасного диэтилового эфира в качестве экстрагента.
Перечисленные недостатки препятствуют практическому использованию способа-прототипа для получения ФПС в укрупненных количествах.
Предлагаемый способ получения ФПС, обладая существенной новизной, лишен указанных недостатков способа-прототипа.
По предлагаемому способу реакция бензальдегида с ацетиленом проводится в присутствии NaOH (0.5-1.8 моль на 1 моль бензальдегида, предпочтительно 1 моль на 1,моль бензальдегида) в среде диметилсульфоксида (ДМСО), содержащего алифатический спирт (метанол, этанол или трет-бутанол, предпочтительно этанол) в количестве 10-20% (предпочтительно 10% или 1 моль на 1 моль бензальдегида) от объема взятого ДМСО при температуре 0-10°C. Предлагаемый способ отличается от прототипа также схемой выделения целевого продукта и обеспечивает получение ФПС с выходом 47%.
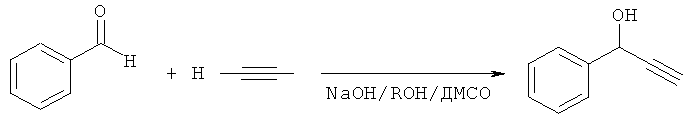
R=Me, Et, трет-Bu
В общем виде предлагаемый способ получения ФПС осуществляется следующим образом. Смесь ДМСО, алифатического спирта и гидроксида натрия при перемешивании нагревают до 125-130°C, при этом происходит формирование растворимой равновесной каталитической системы:
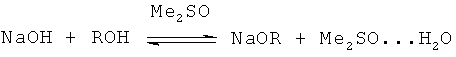


R=Me, Et, трет-Bu
В такой системе повышается основность гидроксид-аниона и образуются еще более основные алкоксид-анионы, способствующие депротонированию ацетилена. Образующиеся при этом комплексные катионы натрия с ДМСО генерируют с ацетиленид-анионами рыхлые (сольватноразделенные) ионные пары, в которых ацетиленовые карбанионы обладают повышенной активностью вследствие ослабления взаимодействия с катионом натрия.
Далее в полученный каталитический раствор, охлажденный до 4-10°C, пропускают ацетилен и медленно (в течение 1.5-3 ч) добавляют раствор бензальдегида в ДМСО, снижая температуру до 0-1°C. После добавления раствора бензальдегида смесь дополнительно перемешивают 15-20 мин. К реакционной смеси добавляют 1.2 экв. (на взятый гидроксид натрия) сухого хлорида аммония, перемешивают 15-20 мин, отфильтровывают образовавшийся хлорид натрия и полимерные продукты, фильтрат перегоняют в вакууме, выделяя алифатический спирт, ДМСО, который после азеотропной осушки снова может быть использован в процессе, и целевой 1-фенилпропаргиловый спирт.
Несмотря на то, что выход ФПС, получаемого по предлагаемому способу, не превышает выход, который обеспечивается способом прототипа, очевидные технологические преимущества, доступность компонентов каталитической системы и безопасность нового способа делают предлагаемый способ привлекательным для реализации в малотоннажной химии и для получения укрупненных партий продукта в лабораторных условиях на стендовых установках.
К технологическим преимуществам предлагаемого способа относятся:
1) проведение процесса при атмосферном давлении;
2) проведение реакции при температуре 0-10°C, легкоконтролируемой технически (не требуется глубокого охлаждения реакционной смеси, как в способе-прототипе или способах-аналогах);
3) использование недорогого и доступного основания - гидроксида натрия;
4) использование в качестве растворителя нетоксичного пожаро-, взрыво- и экологически безопасного растворителя (ДМСО), который может быть далее использован в том же процессе;
5) новая более рациональная и безопасная схема выделения целевого продукта -отгон ДМСО из реакционной смеси в вакууме и последующая вакуумная дистилляция остатка (исключается стадия экстракции с использованием пожаро- и взрывоопасного диэтилового эфира);
6) проведение процесса не требует специальных условий проведения процесса как то: инертной атмосферы, тщательно высушенных растворителей и реагентов;
7) способ прост и удобен в аппаратурном исполнении.
Следующие неограничивающиеся примеры иллюстрируют изобретение.
Пример 1.
В 3-хгорлую кругл о донную колбу емкостью 100 мл, снабженную магнитной мешалкой, обратным холодильником и барботером для подачи ацетилена, помещают 50 мл ДМСО, 3.44 г (0.086 моль) NaOH, 5 мл [10% от объема взятого ДМСО, 4.01 г (0.086 моль)] этилового спирта, смесь нагревают (125-130°C), затем при перемешивании барботируют ацетилен со скоростью 40-45 мл/мин, охлаждая до 4-10°C. По достижении указанной температуры к смеси прикапывают раствор бензальдегида [9.13 г (0.086 моль); мольное соотношение бензальдегид:NaOH:спирт 1:1:1; концентрация бензальдегида 1.72 моль/л] в 10 мл ДМСО в течение 1 ч 30 мин, постепенно снижая температуру реакционной смеси до 0-1°C. После добавления всего раствора бензальдегида реакционную смесь дополнительно перемешивают 15-20 мин, добавляют хлорид аммония (5.52 г, 0.103 моль, 1.2 эквивалента на взятый NaOH), перемешивают 15-20 мин, отфильтровывают хлорид натрия, промывают его ДМСО (10 мл×2). Фильтрат перегоняют в вакууме, первоначально отгоняя этанол и ДМСО (57-68°C/8 мм рт.ст.), а затем ацетиленовый спирт.
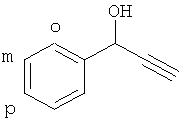
Получают 5.34 г (47%) ФПС, т.кип. 111-112°C/6 мм рт.ст. (лит. 135-136°C/13 мм рт.ст.). 1Н ЯМР (Bruker-400DPX, 400.13 МГц, CDCl3, δ, м.д., внутренний стандарт ГМДС): 7.62 (2Н, м, m-Ph), 7.53 (2Н, м, o-Ph), 7.34 (1Н, м, p-Ph), 5.46 (1Н, с, СН), 2.65 (1Н, с, ≡СН), 2.23 (1Н, уш. с, OH).
Пример 2
В условиях примера 1, при той же температуре (0-10°C), используя те же загрузки, за исключением количества NaOH [6.19 г (0.155 моль) вместо 3.44 г (0.086 моль); мольное соотношение бензальдегид: NaOH:спирт 1:1.8:1; концентрация бензальдегида 1.72 моль/л], после обработки, как описано в примере 1, получают 4.66 г (41%) ФПС.
Пример 3
В условиях примера 2, при той же температуре (0-10°C), используя те же загрузки, за исключением количества ДМСО (100 мл вместо 50 мл) и этанола [10 мл, 10% от объема взятого ДМСО, 8.02 г (0.174 моль) вместо 5 мл, 4.01 г (0.086 моль); мольное соотношение бензальдегид: NaOH:спирт 1:1.8:2; концентрация бензальдегида 0.86 моль/л], после обработки, как описано в примере 1, получают 2.41 г (21%) ФПС.
Пример 4
В условиях примера 1, при той же температуре (0-10°C), используя те же загрузки, за исключением количества NaOH [1.72 г (0.043 моль) вместо 3.44 г (0.086 моль); мольное соотношение бензальдегид:NaOH:спирт 1:0.5:1; концентрация бензальдегида 1.72 моль/л], после обработки, как описано в примере 1, получают 4.10 г (36%) ФПС.
Пример 5
В условиях примера 1, при той же температуре (0-10°C), используя те же загрузки, за исключением количества этилового спирта [7.5 мл, 15% от объема взятого ДМСО, 6.01 г (0.130 моль) вместо 5 мл, 10% от объема взятого ДМСО, 4.01 г (0.086 моль); мольное соотношение бензальдегид:NaOH:спирт 1:1:1.52; концентрация бензальдегида 1.72 моль/л], после обработки, как описано в примере 1, получают 4.79 г (42%) ФПС.
Пример 6
В условиях примера 1, при той же температуре (0-10°C), используя те же загрузки, за исключением количества этилового спирта [10 мл, 20% от объема взятого ДМСО, 8.02 г (0.174 моль) вместо 5 мл, 10% от объема взятого ДМСО, 3.98 г (0.086 моль); мольное соотношение бензальдегид:NaOH:спирт 1:0.5:2; концентрация бензальдегида 1.72 моль/л], после обработки, как описано в примере 1, получают 4.77 г (42%) ФПС.
Пример 7
В условиях примера 2, при той же температуре (0-10°C), используя те же загрузки, вместо этилового спирта берут метиловый спирт [5 мл, 10% от объема взятого ДМСО, 3.96 г (0.124 моль); мольное соотношение бензальдегид:NaOH:спирт 1:1.8:1.44; концентрация бензальдегида 1.72 моль/л], после обработки, как описано в примере 1, получают 4.09 г (36%) ФПС.
Пример 8
В условиях примера 2, при той же температуре (0-10°C), используя те же загрузки, вместо этилового спирта берут трет-бутиловый спирт [5 мл, 10% от объема взятого ДМСО, 4.05 г (0.055 моль); мольное соотношение бензальдегид:NaOH:спирт 1:1.8:0.6; концентрация бензальдегида 1.72 моль/л)], после обработки, как описано в примере 1, получают 3.20 г (28%) ФПС.
Пример 9
В условиях примера 3, при температуре (0-10°C), используя те же загрузки, но раствор бензальдегида прибавляют в течение 3 ч вместо 1 ч 30 мин и после обработки, как описано в примере 1, получают 3.98 г (35%) ФПС.
| название | год | авторы | номер документа |
|---|---|---|---|
| Атом-экономный безотходный способ получения 2-(4-фторфенил)-бут-3-ин-2-ола | 2016 |
|
RU2629024C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛАРИЛ (ГЕТАРИЛ) ЭТИНИЛКАРБИНОЛОВ | 2012 |
|
RU2479565C1 |
| Способ получения органооловоацетиленов | 1979 |
|
SU825533A1 |
| СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ АЦЕТИЛЕНОВЫХ КЕТОНОВ | 2017 |
|
RU2638839C1 |
| Способ получения -ацетиленовых спиртов | 1977 |
|
SU745888A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛЕНОВЫХ АМИНОСПИРТОВ | 1973 |
|
SU396321A1 |
| Способ получения комплексных ацетиленидов галлия | 1978 |
|
SU767111A1 |
| Способ получения водорастворимых пропаргиловых эфиров полисахарида арабиногалактана | 2016 |
|
RU2650544C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКИНИЛАДАМАНТАНОВ | 2012 |
|
RU2507189C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-ЗАМЕЩЕННЫХ СТЕРОИДНЫХ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ ЭПЛЕРЕНОНА, ПРОДУКТ | 2003 |
|
RU2289586C2 |
Изобретение относится к способу получения 1-фенилпропаргилового спирта взаимодействием бензальдегида с ацетиленом в присутствии основного катализатора. При этом реакцию проводят при атмосферном давлении и температуре 0-10°C в присутствии каталитической системы гидроксид натрия/алифатический спирт/ДМСО при мольном соотношении бензальдегид : NaOH : алифатический спирт, равном 1 : 0.5-1.8 : 0.6-2, и концентрации бензальдегида 0.86-1.72 моль/л. Целевой продукт выделяют вакуумной дистилляцией реакционной смеси после ее нейтрализации хлоридом аммония и отделения твердых продуктов фильтрованием. Способ позволяет получать 1-фенилпропаргиловый спирт с выходом до 47%. 2 з.п. ф-лы, 9 пр.
1. Способ получения 1-фенилпропаргилового спирта взаимодействием бензальдегида с ацетиленом в присутствии основного катализатора, отличающийся тем, что реакцию проводят при атмосферном давлении и температуре 0-10°C в присутствии каталитической системы гидроксид натрия/алифатический спирт/ДМСО при мольном соотношении бензальдегид : NaOH : алифатический спирт, равном 1 : 0.5-1.8 : 0.6-2, и концентрации бензальдегида 0.86-1.72 моль/л.
2. Способ по п.1, отличающийся тем, что каталитическую систему получают, предварительно нагревая гидроксид натрия/алифатический спирт в ДМСО при температуре 125-130°C в течение 20-30 мин.
3. Способ по п.1, отличающийся тем, что 1-фенилпропаргиловый спирт выделяют вакуумной дистилляцией реакционной смеси после ее нейтрализации хлоридом аммония и отделения твердых продуктов фильтрованием.
| E.R.H | |||
| JONES et al., Studies in the Polyene Series | |||
| Part VI | |||
| The Preparation of Ethinylcarbinols from ab-Unsaturated Aldehydes, J | |||
| CHEM | |||
| SOC., 1942, 733-735 | |||
| Л | |||
| П | |||
| КИРИЛЛОВА и др., Синтез вторичных ацетиленовых спиртов, ЖУРН | |||
| ОРГАН | |||
| ХИМИИ, 1971, 7(12), 2469-2470 | |||
| Способ получения ацетиленовых спиртов | 1961 |
|
SU141483A1 |
| US 3257465, 21.06.1966 | |||
Авторы
Даты
2014-05-10—Публикация
2012-12-19—Подача