УРОВЕНЬ ТЕХНИКИ
Липосомы используют для доставки широкого разнообразия лекарственных средств. Например, противоопухолевые средства, такие как актиномицин (патент США 3993754), антрациклины (патент США 4863739) и алкалоиды барвинка (патент США 4952408), заключают в капсулу липосом. Позднее были получены термочувствительные липосомы, содержащие активные средства и используемые для доставки активных средств в специфические органы-мишени субъекта (патенты США №№ 6200598 и 6726925 и Yatvin et al., Science 204:188 (1979). При использовании термочувствительные липосомы доставляются субъекту и целевая область субъекта нагревается. Когда термочувствительные липосомы достигают нагретой области, происходит фазовый переход гель-жидкость и высвобождение активного средства. Успех этого метода требует липосом с температурой фазового перехода гель-жидкость, попадающей в диапазон температур, свойственных субъекту.
В данной области техники остается необходимость заключить в капсулу полученной липосомы лекарственное средство, такое как противоопухолевое средство, которое способно претерпевать фазовый переход гель-жидкость при температуре, свойственной субъекту. Это и другие условия соблюдены в настоящем изобретении.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение предусматривает термочувствительные липосомы. Термочувствительные липосомы по изобретению обычно содержат по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин и по меньшей мере один лизолипид. Термочувствительные липосомы по изобретению обычно будут иметь температуру фазового перехода гель-жидкость от около 39°C до около 45°C. Термочувствительные липосомы по изобретению необязательно могут содержать один или более дополнительных липидных компонентов, например, могут содержать ПЭГилированные фосфолипиды. Термочувствительная липосома по изобретению может содержать одно или больше активных средств, например, лекарственных средств, средств для создания изображения, диагностических средств и их комбинации.
В отдельных вариантах осуществления фосфатидилхолин является дипальмитоилфосфатидилхолином (ДПФХ), фосфатидилглицерин является дистеароилфосфатидилглицерином (ДСФГ) и лизолипид является моностеароилфосфатидилхолином (МСФХ) и термочувствительные липосомы содержат ПЭГилированные фосфолипиды, например ПЭГ-2000, модифицированный дистеароилфосфатидилэтаноламином (ДСФЭ-ПЭГ2000) или ПЭГ-5000, модифицированный дистеароилфосфатидилэтаноламином (ДСФЭ-ПЭГ5000). Термочувствительные липосомы по изобретению могут содержать фосфатидилхолин, фосфатидилглицерол, лизолипид и ПЭГилированный фосфолипид в любом соотношении, позволяющем температуре фазового перехода гель-жидкость находиться в диапазоне от около 39°C до около 45°C. Обычно липосомы по изобретению могут содержать следующие соотношения ингредиентов по массе в следующих диапазонах, фосфатидилхолин 60-80: фосфатидилглицерин 6-12: лизолипид 6-12: ПЭГилированный фосфолипид 4-15: активное средство 1-30. Например, термочувствительная липосома по изобретению может содержать соотношение по массе ДПФХ 60-80: ДСФГ 6-12: МСФХ 6-12: ДСФЭ-ПЭГ2000 4-15: активное средство 1-30.
Термочувствительные липосомы по изобретению могут содержать одно или несколько активных средств. Любое активное средство, известное специалистам в данной области техники, можно использовать в комбинации с термочувствительными липосомами по изобретению для доставки активного средства в выбранное место субъекта. При использовании здесь субъектом является любое млекопитающее, в частности люди, кошки или собаки. В одном варианте осуществления термочувствительные липосомы по изобретению содержат одно или более противораковых средств. Примеры подходящих противораковых средств включают, но не ограничиваются ими, алкилирующие средства, антиметаболиты, цитостатические растительные алкалоиды, цитотоксические противоопухолевые антибиотики, антрациклиновые антибиотики, растительные алкалоиды, производные таксола, ингибиторы топоизомеразы, моноклональные антитела или их фрагменты, фотосенсибилизаторы, ингибиторы киназ, противоопухолевые ферменты или ингибиторы ферментов, индукторы апоптоза, модификаторы биологического ответа, антигормоны, ретиноиды и компоненты, содержащие платину. В отдельных вариантах осуществления термочувствительные липосомы по изобретению могут содержать таксан, например доцетаксел. В другом отдельном варианте осуществления термочувствительные липосомы по изобретению могут включать соединение, содержащее платину компонент, такое как карбоплатин или цисплатин.
Настоящее изобретение также предусматривает фармацевтические композиции, содержащие термочувствительные липосомы по изобретению, содержащие активное средство. В таких фармацевтических композициях термочувствительные липосомы по изобретению обычно содержат по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин, по меньшей мере один лизолипид или имеют температуру фазового перехода гель-жидкость от около 39°C до около 45°C. Термочувствительные липосомы для использования в фармацевтической композиции по изобретению могут дополнительно содержать ПЭГилированный фосфолипид.
В одном примере подходящей термочувствительной липосомы для использования в фармацевтической композиции по изобретению фосфатидилхолин является дипальмитоилфосфатидилхолином (ДПФХ), фосфатидилглицерин является дистеароилфосфатидилглицерином (ДСФГ) и лизолипид является моностеароилфосфатидилхолином (МСФХ) и термочувствительная липосома содержит ПЭГилированный фосфолипид, например ПЭГ-2000, модифицированный дистеароилфосфатидилэтаноламином (ДСФЭ-ПЭГ2000). Такие термочувствительные липосомы по изобретению могут содержать фосфатидилхолин, фосфатидилглицерин, лизолипид и ПЭГилированный фосфолипид в любом соотношении, так, чтобы температура фазового перехода гель-жидкость находилась диапазоне от около 39°C до около 45°C. Обычно липосомы для использования в фармацевтических композициях по изобретению могут содержать следующие соотношения ингредиентов по массе в следующих диапазонах, фосфатидилхолин 60-80: фосфатидилглицерин 6-12: лизолипид 6-12: ПЭГилированный фосфолипид 4-15: активное средство 1-30. Например, термочувствительная липосома по изобретению может содержать соотношение по массе ДПФХ 60-80: ДСФГ 6-12: МСФХ 6-12: ДСФЭ-ПЭГ2000 4-15: активное средство 1-30.
В фармацевтические композиции по изобретению можно включить любое активное средство, например лекарственные средства и/или радиоактивные средства. В одном варианте осуществления активное средство может быть противораковым средством. Примеры подходящего противоракового средства включают, но не ограничиваются ими, алкилирующие агенты, антиметаболиты, противораковые антибиотики, антрациклиновые антибиотики, растительные алкалоиды, производные таксола, ингибиторы топоизомеразы, моноклональные антитела, фотосенсибилизаторы, ингибиторы киназ и компоненты, содержащие платину. В отдельном варианте осуществления термочувствительные липосомы по изобретению могут содержать антрациклиновый антибиотик, например доцетаксел. В отдельном варианте осуществления термочувствительные липосомы по изобретению могут включать соединение, содержащее платину, такое как карбоплатин или цисплатин.
Настоящее изобретение также предусматривает способы лечения заболеваний у субъекта с помощью термочувствительных липосом по изобретению. Такие термочувствительные липосомы будут обычно содержать одно или несколько активных средств, которые можно использовать для лечения заболевания. Способ лечения заболевания у субъекта, нуждающегося в этом, согласно изобретению, может предусматривать введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей термочувствительную липосому, содержащую активное средство, где липосома содержит по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин, по меньшей мере один лизолипид и температура фазового перехода гель-жидкость составляет от около 39°C до около 45°C. Часть субъекта, содержащую некоторые или все пораженные ткани, затем нагреваются до температуры, достаточной для перехода липосомы из геля в жидкость, что приводит к высвобождению активного средства непосредственно вблизи от пораженной ткани. Термочувствительные липосомы для использования в способах по изобретению могут также содержать ПЭГилированный фосфолипид, например ДСФЭ-ПЭГ2000 или ДСФЭ-ПЭГ5000.
В одном примере термочувствительных липосом для использования в способах по изобретению фосфатидилхолин является дипальмитоилфосфатидилхолином (ДПФХ), фосфатидилглицерин является дистеароилфосфатидилглицерином (ДСФГ) и лизолипид является моностеароилфосфатидилхолином (МСФХ). Такие термочувствительные липосомы по изобретению могут содержать фосфатидилхолин, фосфатидилглицерин, лизолипид и ПЭГилированный фосфолипид в любом соотношении так, чтобы температура фазового перехода гель-жидкость находилась в диапазоне от около 39°C до около 45°C. Обычно липосомы для использования в фармацевтических композициях по изобретению могут содержать следующие соотношения ингредиентов по массе в следующих диапазонах: фосфатидилхолин 60-80: фосфатидилглицерин 6-12: лизолипид 6-12: ПЭГилированный фосфолипид 4-15: активное средство 1-30. Например, термочувствительная липосома по изобретению может содержать соотношение по массе ДПФХ 60-80: ДСФГ 6-12: МСФХ 6-12: ДСФЭ-ПЭГ2000 4-15: активное средство 1-30.
В одном варианте осуществления настоящее изобретение включает способ лечения рака у субъекта, нуждающегося в этом, предусматривающий введение субъекту терапевтически эффективного количества фармацевтической композиции, содержащей термочувствительную липосому, содержащую противораковое средство, где липосома содержит по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин, по меньшей мере один лизолипид, и температура фазового перехода гель-жидкость составляет от около 39°C до около 45°C. Примеры подходящего противоракового средства включают, но не ограничиваются перечисленными, алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, антрациклиновые антибиотики, растительные алкалоиды, производные таксола, ингибиторы топоизомеразы, моноклональные антитела, фотосенсибилизаторы, ингибиторы киназ и соединения, содержащие платину. В отдельном варианте осуществления термочувствительные липосомы по изобретению могут содержать антрациклиновый антибиотик, например доцетаксел. В отдельном варианте осуществления термочувствительные липосомы по изобретению могут включать соединение, содержащее платину, такой как карбоплатин или цисплатин.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 является кривой дифференциальной сканирующей калориметрии (ДСК), показывающей фазовый переход гель-жидкость типичной термочувствительной липосомы по изобретению.
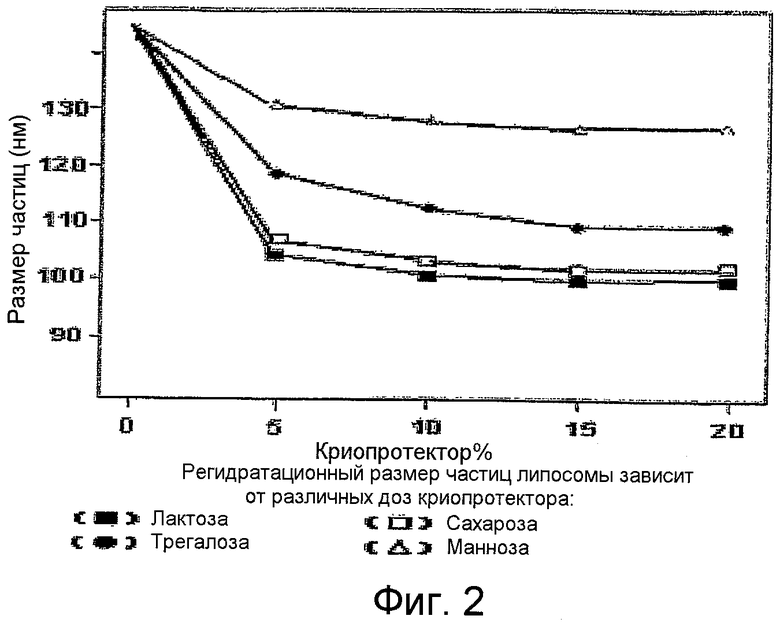
Фиг.2 является графиком размера частиц как функции от количества криопротектора в лиофилизированном препарате липосом.
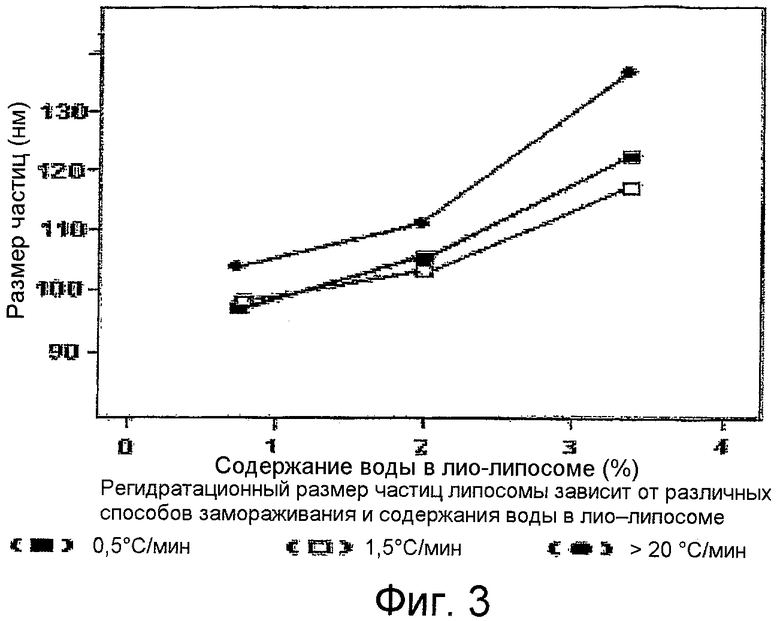
Фиг.3 является графиком размера частиц при регидратации лиофилизированных липосом по изобретению как функции от содержания воды в липосомах при различных скоростях изменения температуры при замерзании.
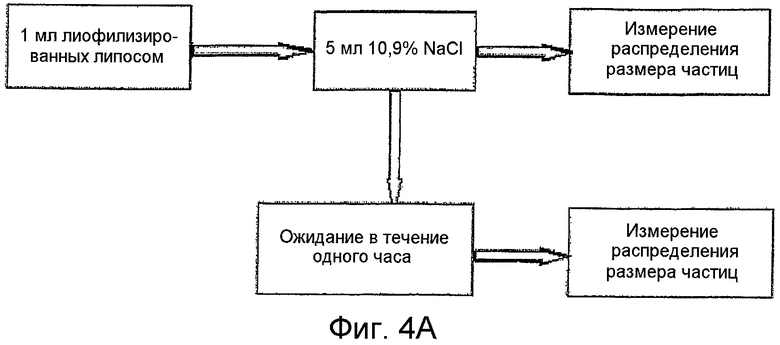
Фиг.4А является схематичным протоколом, используемым при тестировании воздействий на точное соблюдение размера частиц регидратированных липосом по изобретению.
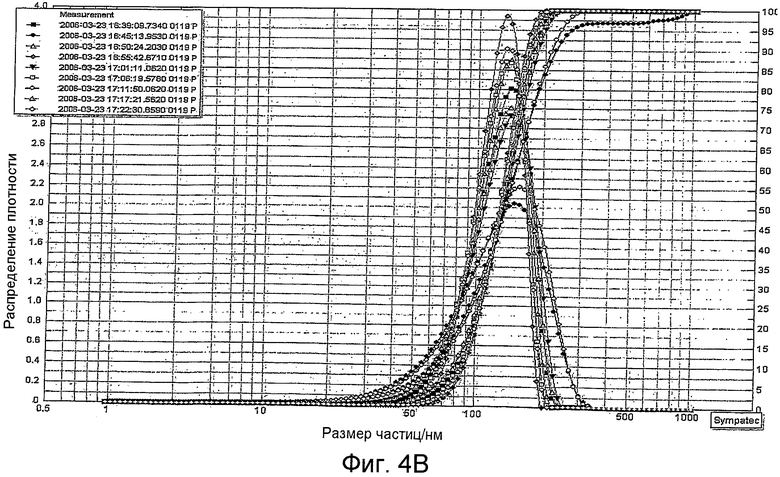
Фиг.4В является графиком, показывающим распределение размера частиц регидратированных липосом по изобретению по истечении одного часа.
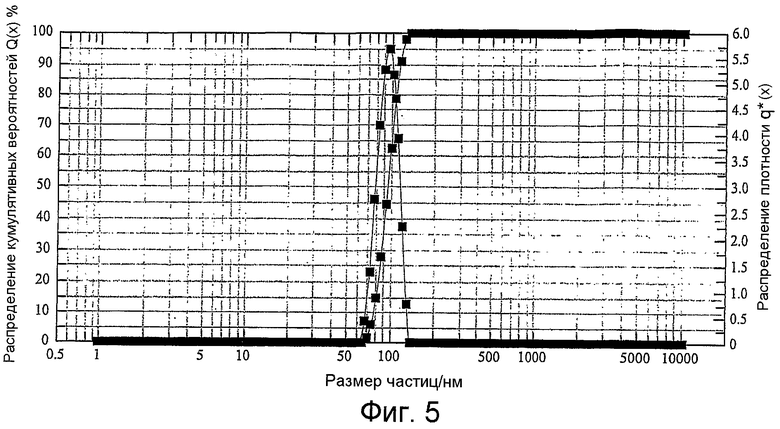
Фиг.5 является линейным графиком распределения размера частиц термочувствительных карбоплатиновых липосом.
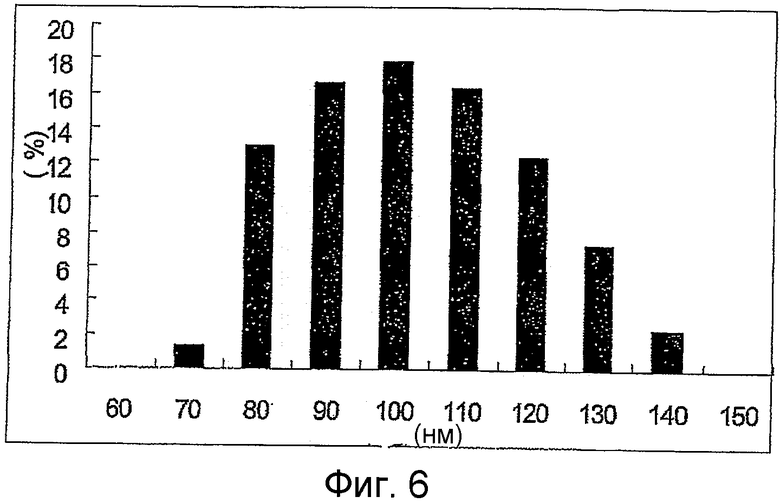
Фиг.6 является гистограммой распределения размера частиц термочувствительных карбоплатиновых липосом.
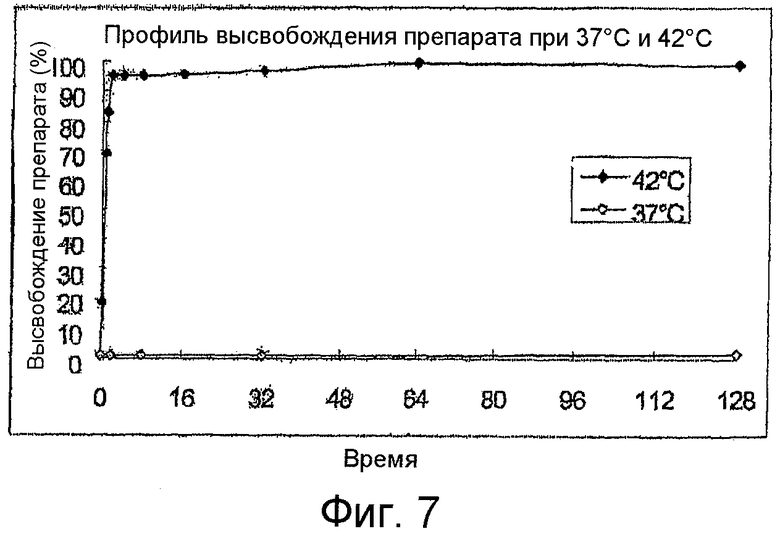
Фиг.7 является линейным графиком высвобождения лекарства при 37°C (светлые ромбики) и при 42°C (черные ромбики) как функция времени.
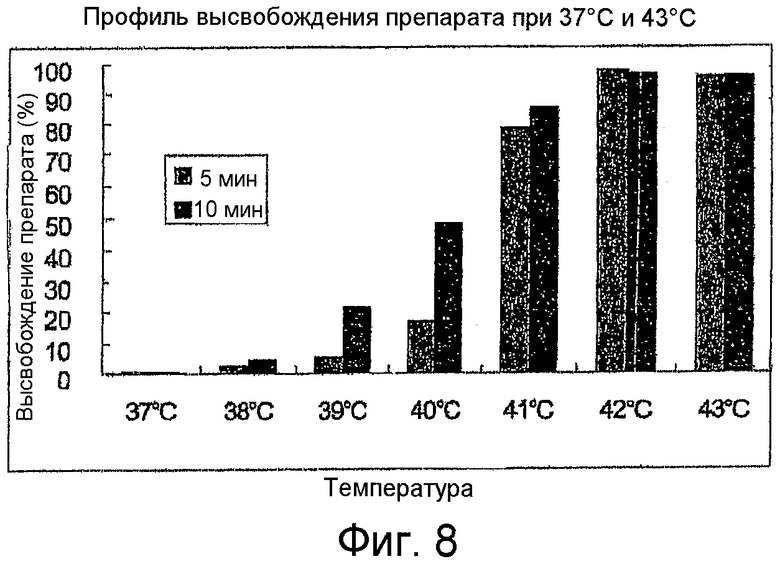
Фиг.8 является гистограммой, показывающей высвобождение цистоплатина при различных температурах в течение 5 минут (голубым) и 10 минут (пурпурный).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термочувствительные липосомы по изобретению обычно содержат один или более фосфатидилхолин. Подходящие примеры фосфатидилхолинов, которые можно использовать в практике изобретения, включают, но не ограничиваются перечисленными, 1,2-дилауроил-sn-глицерин-3-фосфохолин (ДЛФХ), 1,2-димиристоил-sn-глицерин-3-фосфохолин (ДМФХ), 1,2-дипальмитоил-sn-глицерин-3-фосфохолин (ДПФХ), 1,2-дистеароил-sn-глицерин-3-фосфохолин (ДСФХ), 1,2-диолеоил-sn-глицерин-3-фосфохолин (ДОФХ) и 1-пальмитоил-2-олеоил-sn-глицерин-3-фосфохолин (ПОФХ).
Термочувствительные липосомы по изобретению обычно содержат один или более фосфатидилглицеринов. Подходящие примеры фосфатидилглицеринов включают, но не ограничиваются перечисленными, 1,2-димиристоил-sn-глицерин-3-фосфоглицерином (ДМФГ), 1,2-дипальмитоил-sn-глицерин-3-фосфоглицерин (ДПФГ), 1,2-дистеароил-sn-глицерин-3-фосфоглицерин (ДСФХ) и 1-пальмитоил-2-олеоил-sn-глицерин-3-фосфоглицерин (ПОФГ).
Термочувствительные липосомы по изобретению обычно содержат один или более лизолипид. При использовании здесь «лизолипид» относится к любому производному фосфатидной кислоты (1,2-диацил-sn-глицерин-3-фосфат), которое содержит только одну ацильную цепь, ковалентно связанную с глицериновым компонентом. Производные фосфатидиновой кислоты включают, но не ограничиваются перечисленными, фосфатидилхолин, фосфатидилглицерин и фосфатидилэтаноламин. Любой лизолипид, известный специалистам в данной области техники, можно использовать в практике изобретения.
Термочувствительные липосомы по изобретению обычно содержат один или более ПЭГилированный фосфолипид. Подходящие примеры ПЭГилированных фосфолипидов включают, но не ограничиваются перечисленными, 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-350] (мПЭГ 350 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-550] (мПЭГ 550 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-750] (мПЭГ 750 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-1000] (мПЭГ 1000 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (мПЭГ 2000 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-3000] (мПЭГ 3000 ПЭ), 1,2-диацил-sn-глицерин-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-5000] (мПЭГ 5000 ПЭ), модифицированный ПЭГ-2000 дистеароилфосфатидилэтаноламин (ДСФЭ-ПЭГ2000) и модифицированный ПЭГ-5000 дистеароилфосфатидилэтаноламин (ДСФЭ-ПЭГ5000).
Активные средства
Термочувствительные липосомы по изобретению можно изготавливать для составления одного или нескольких активных средств. При использовании здесь «активное средство» включает любое соединение, которое необходимо доставить в специфическое место организма. Любое активное средство можно использовать в практике изобретения.
Как активные средства в термочувствительных липосомах по изобретению можно использовать противораковые средства.
Подходящие примеры противораковых средств включают:
алкилирующие средства, например азотистые иприты (например, хлорамбуцил, хлорметин, циклофосфамид, ифосфамид, мелфалан, нитрозомочевины (например, кармустин, фотемустин, ломустин, стрептозоцин), содержащие платину соединения (например, карбоплатин, цисплатин, оксалиплатин, BBR3464), бусульфан, дакарбазин, хлорметин, прокарбазин, темозоломид, тиотепа и урамустин;
антиметаболиты, направленные, например, на фолиевую кислоту (например, аминоптерин, метотрексат, пеметрексед, ралтитрексед), метаболизм пурина (например, кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин), метаболизм пиримидина (капецитабин, цитарабин, фторурацил, флоксуридин, гемцитабин);
цитостатические растительные алкалоиды, например, таксаны (например, доцетаксел, паклитаксел) и алкалоиды барвинка (например, винбластин, винкристин, виндезин, винорелбин);
цитотоксические/противоопухолевые антибиотики, например, антрациклиновые антибиотики (например, даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон, валрубицин, кариномицин, N-ацетиладриамицин, рубидазон, 5-имидодауномицин, N30 ацетилдауномицин и эпирубицин), блеомицин, митомицин и актиномицин;
ингибиторы топоизомеразы, например, каптотецины (например, камптотецин, топотекан, иринотекан), подофил (например, этопозид, тенипозид);
моноклональные антитела или их фрагменты, например алемтузумаб, бевацизумаб, цетуксимаб, гемтузумаб, панитумумаб, ритуксимаб, тозитумомаб и трастузумаб;
фотосенсибилизаторы, например, аминолевулиновая кислота, метиламинолевулинат, порфимер натрия и вертепорфин;
ингибиторы киназы, например, дазатиниб, эрлотиниб, гефитиниб, иматиниб, лапатиниб, нилотиниб, сорафениб, сунитиниб и вандетаниб;
ферменты, например, аспарагиназа, пегаспаргаза и ингибиторы ферментов, например гидроксимочевина;
индукторы апоптоза, например, триоксид мышьяка, велкад и генасенс;
модификаторы биологического ответа, например денилейкин дифтитокс;
антигормоны, например гозерелина ацетат, леупролида ацетат, трипторелина памоат, мегестрола ацетат, тамоксифен, торемифен, фульвестран, тестолактон, анастрозол, экземестан и летрозол; и
ретиноиды, например 9-цис-ретиноевая кислота и все-транс-ретиноевая кислота.
В дополнительных вариантах осуществления термочувствительные липосомы по изобретению могут содержать более одного противоопухолевого средства или более чем одну термочувствительную липосому можно использовать в способах изобретения, каждая из которых содержит различные активные средства, например, различные противораковые средства.
Дополнительные активные средства, которые можно использовать в практике настоящего изобретения, включают, но ограничиваются перечисленными, антибиотики, противогрибковые, противовоспалительные средства, иммунносупрессивные средства, противоинфекционные средства, противовирусные, противогельминтные и антипаразитарные соединения.
Термочувствительные липосомы по изобретению, содержащие активное средство, могут содержать липиды или активное средство в любом соотношении до тех пор пока липосома остается термически чувствительной и может высвобождать активное средство при подходящей температуре, например между 39°C до 45°C. Подходящими диапазонами соотношений по массе фосфатидилхолин: фосфатидилглицерин: лизолипид: ПЭГилированный фосфолипид: активное средство являются 60-80:6-12:6-12:4-15:1-30. Подходящие диапазоны соотношений по массе фосфатидилхолин: фосфатидилглицерин: лизолипид: ПЭГилированный фосфолипид: активное средство включают, но не ограничиваются 70:8:8:8:4, 71:8:8:8:4, 72:8:8:8:4, 73:8:8:8:4, 74:8:8:8:4, 75:8:8:8:4, 70:8:8:6:4, 71:8:8:6:4, 72:8:8:6:4, 73:8:8:6:4, 74:8:8:6:4, 75:8:8:6:4, 70:8:8:4:4, 71:8:8:4:4, 72:8:8:4:4, 73:8:8:4:4, 74:8:8:4:4, 75:8:8:4:4, 70:9:9:8:4, 71:9:9:8:4, 72:9:9:8:4, 73:9:9:8:4, 74:9:9:8:4, 75:9:9:8:4, 70:9:9:6:4, 71:9:9:6:4, 72:9:9:6:4, 73:9:9:6:4, 74:9:9:6:4, 75:9:9:6:4, 70:9:9:4:4, 71:9:9:4:4, 72:9:9:4:4, 73:9:9:4:4, 74:9:9:4:4 и 75:9:9:4:4.
Способ использования
Термочувствительные липосомы по изобретению можно вводить субъекту любым подходящим способом, например, внутривенным введением, внутриартериальным введением, внутримышечным введением, внутрибрюшным введением, подкожно, внутрикожно, внутрисуставно, интратекально, интрацеребровентрикулярно, назальным спреем, легочной ингаляцией, пероральным введением, а также другими подходящими способами, известными специалистам в данной области техники. Ткани, на которые можно воздействовать, используя способы настоящего изобретения, включают, но не ограничиваются, носовой, легочной, печеночной, почечной, костной, мягкими тканями, мышцами, тканью надпочечников и груди. Ткани, на которые можно воздействовать, включают как раковые ткани, и больные, и находящиеся под угрозой, так и здоровые ткани, при желании. Любую ткань или жидкость тела, которую можно нагреть до температуры выше 39,5°C, можно подвергать воздействию липосом по изобретению.
Количество активного средства, введенного субъекту при помощи термочувствительных липосом по изобретению, легко определяется специалистами в данной области техники, и соответственно вводится внутривенно на протяжении продолжительного периода времени, например, в течение около одной минуты вплоть до нескольких часов, например 2, 3, 4, 6, 24 или более часов. При использовании здесь «около» означает изменчивость в пределах 10% при использовании для модификации числового значения.
Дозу активного средства можно отрегулировать, как известно в данной области техники, в зависимости от активного средства, содержащегося в носителе.
Заданную ткань субъекта можно нагреть перед и/или во время и/или после введения термочувствительных липосом по изобретению. В одном варианте осуществления сначала нагревают заданную ткань (например, в течение 10-30 минут), а липосомы по изобретению доставляются в субъект после нагревания настолько скоро, насколько практически возможно.
Можно использовать любые подходящие средства для нагревания заданной ткани, например радиоизлучение, применение ультразвука, который может быть сфокусированным ультразвуком высокой интенсивности, применение микроволнового излучения, любой источник, который генерирует инфракрасное излучение, такое как теплая водяная баня, свет, как и используемое снаружи или изнутри излучение, такое как генерируется радиоактивными изотопами, электрическими или магнитными полями, и/или комбинация вышеизложенного.
Среднему специалисту в данной области техники будет совершенно очевидно, что другие подходящие модификации и адаптации способов и применений, описанные здесь, можно выполнить, не отклоняясь от цели изобретения или любого варианта его осуществления. Имея детальное описание настоящего изобретения, то же самое будет более понятно с помощью следующих примеров, которые включены сюда исключительно с целью иллюстрации и не имеют своей целью ограничить изобретение.
ПРИМЕРЫ
ПРИМЕР 1
Приготовление и характеристика термочувствительной липосомы с таксотером
Для приготовления липосом по изобретению были использованы следующие материалы:
дипальмитоилфосфатидилхолин (ДПФХ), дистеароилфосфатидилглицерин (ДСФГ) и моностеароилфосфатидилхолин (МСФХ), ПЭГилированный дистеароилфосфатидилэтаноламин (ДСФЭ-мПЭГ2000), NaCl, KCl, Na2HPO4·12H2O, KH2PO4, лактоза, CHCl3, метанол, этанол и дистилированная вода.
Для приготовления липосом по изобретению было использовано следующее оборудование: водяная баня, роторный испаритель, гомогенизатор-экструдер, лиофилизатор, рассеивающий лазерное излучение измеритель частиц (Smypatec Nanophox) и термометр.
Способ для приготовления 20-миллилитровой порции липосом, содержащих доцетаксел.
Отмерьте следующие компоненты в указанных количествах.
Растворите данные материалы в CHCl3/метаноле (3:1) при 55°C. Затем удалите органический растворитель с помощью роторного испарителя. Это можно выполнить путем роторного выпаривания при 55°C в течение 1 часа. После высушивания высушенный материал можно обдувать азотом в течение соответствующего периода времени, например 5 минут.
Затем высушенный материал регидратируют. Соответствующим раствором для регидратации является фосфатный буфер (PBS), в который можно добавить лактозу или другие стабилизующие материалы (например, сахара). Соответствующим протоколом для регидратации является добавление 20 мл PBS-5% раствора лактозы (pH 7,3±0,2) и вращение на роторном испарителе при атмосферном давлении в течение 1 часа при 50°C. После регидратации раствор можно дегазировать под пониженным давлением для удаления пузырьков.
После регидратации размер частиц липосом можно отрегулировать до нужного размера, например 100±15 нм. Соответствующий протокол интрузии состоит в том, чтобы использовать гомогенизатор-экструдер с фильтром 200 нм и выполнить экструзию три раза. Поменяйте фильтр на 100 нм и выполните экструзию три раза. Наконец, поменяйте фильтр на 80 нм и выполните экструзию три раза. Распределение размера частиц липосом можно измерить с использованием любой соответствующей техники, например фотонной кросс-корреляционной спектроскопии (Photon Crosscorrelation Spectroscopy, PCCS) и сенсора Nanophox (Sympatec GmbH). После экструзии липосомальный раствор можно стерилизовать путем фильтрации через мембранный фильтр с размером пор 0,22 мкм (Millipore).
После стерилизации липосомы расфасовывают в ампулы и лиофилизируют. Программа лиофилизации программа является следующей: -50°C 2ч, -45°C 1 ч, -35°C 10 ч, -15°C 5ч, 0°C 2ч, 10°C 2 ч, 20°C 6 ч.
Другим подходящим способом для приготовления липосом по изобретению является следующий:
Растворить те же компоненты как указано выше в CHCl3/метаноле (3:1) при 55°C. Удалить органический растворитель с помощью роторного испарителя как указано выше. Регидратировать 20 мл PBS-5% раствора лактозы при 50°C как указано выше. Поместить регидратированный материал в гомогенизатор и подвергать обработке при 15000 фунт/кв. дюйм в течение 5 минут для уменьшения размера частиц. Взять гомогенизированный материал и использовать экструдер с фильтром 100 нм и провести экструзию шесть раз для уменьшения размера частиц до 100±15 нм (100 нм × 6) и затем стерилизовать путем фильтрации 0,22 мкм. После стерилизации расфасовывают в ампулы и лиофилизируют.
Аналитические способы
Морфологию липосом можно анализировать на электронном микроскопе. Липосомы были негативно окрашены фосфорновольфрамовой кислотой и помещены в медную сетку. Вода могла испаряться и образцы были исследованы с помощью электронного микроскопа. Липосомы, приготовленные способами по изобретению, при анализе под электронным микроскопом были гомогенизированы.
Для липосом, приготовленных как описано выше, измерили процент инкапсулированного препарата (% инкапсуляции). % инкапсуляции = количество инкапсулированного препарата/количество препарата всего × 100%. % инкапсуляции определили следующим образом: 1 мл липосом центрифугировали при 6000 об/мин в течение 5 мин. Доцетаксел в супернатанте измерили высокоэффективной жидкостной хроматографией (ВЭЖХ). Содержание доцетаксела в липосомах определили путем экстракции доцетаксела из липосом и измерением экстрагированного доцетаксела с помощью ВЭЖХ. Для экстракции 0,1 мл липосом растворили в вода:ацетонитрил (45:55) до 0,5 мл. Добавили 4 мл трет-бутилметилового эфира и перемешивали в течение 30 секунд. Смесь центрифугировали при 300 г в течение 15 мин. 3 мл органического слоя убрали и высушили путем роторного испарения. Высушенный материал снова растворили в 200 мл вода:ацетонитрил (45:55) и взяли 5-10 мл для анализа с помощью ВЭЖХ.
Анализ ВЭЖХ был выполнен при следующих условиях: с подвижной фазой воды:ацетонитрила (45:55) использовали колонку Venusil C 18 (колонку с обращенной фазой С 18) при 1 мл/мин. Температура колонки составила 30°C. УФ-обнаружение установили на 230 нм. При этих условиях предел обнаружения препарата находится в пределах 20-800 нг.
Была определена способность вышеизложенного протокола восстанавливать доцетаксел в образце. К 0,1 мл липосом, приготовленных как описано выше, добавили 0,1 мл нормального раствора доцетаксела. Образец растворили в вода:ацетонитрил (45:55) до 0,5 мл. Добавили 4 мл трет-бутилметилового эфира и перемешивали в течение 30 секунд. Затем образец центрифугировали при 300 г в течение 15 мин. 3 мл органического слоя высушили путем роторного испарения. К остатку добавили 200 мл вода:ацетонитрил (45:55) и взяли 5-10 мл для анализа с помощью ВЭЖХ. Следующая таблица показывает степень восстановления при различных концентрациях доцетаксела.
Была определена температура фазового перехода липосом, приготовленных по изобретению. Были проведены измерения дифференциальной сканирующей калориметрией (ДСК) с использованием Q100 (TA Instruments, Inc. New Castle DE) c пустыми герметично запечатанными алюминиевыми тиглями в качестве контроля. Концентрация липидов была приведена к 20 мг/мл и 10 мл липосомной суспензии было осторожно помещено в запечатанные алюминиевые герметичные тигли. Частота сканирования была установлена на 2°C в минуту. Фиг.1 показывает график ДСК, полученный на липосомах по изобретению. Спектр ДСК показывает, что температура фазового перехода для термочувствительные липосомы с таксотером составляет приблизительно 42°C.
Стабильность липосом, приготовленных вышеизложенным методом, оценивали периодическими измерениями размера частиц во время хранения. Результаты в таблице ниже показывают, что липосомы, приготовленные как описано выше, стабильны по меньшей мере 3 месяца.
Также отслеживали содержание препарата. Результаты показывают, что после лиофилизации липосомы стабильны при 2-8°C в течение по меньшей мере 3 месяцев.
Скорость инкапсуляции препарата также отслеживали. Результаты показывают, что после лиофилизации количество препарата, инкапсулированного липосомой, стабильно при 2-8°C в течение по меньшей мере 3 месяцев.
Инкапсуляция препарата
Было протестировано влияние различных криопротекторов на размер частиц во время лиофилизации. Были протестированы лактоза, трегалоза, сахароза и маннитол. Результаты показывают, что лактоза и сахароза более эффективны, чем маннитол и трегалоза. Фиг.2 показывает график размера частиц как функцию от % по массе криопротектора, находящегося в лиофилизированном растворе.
Скорость, при которой липосомы замораживают для лиофилизации, и содержание воды в липосомах влияют на размер частиц. Фиг.3 показывает график размера частиц как функцию содержания воды в липосомах при трех различных скоростях замораживания.
Среда регидратации также имеет значение на размер частиц липосом. Тестировали воду, 5% декстрозу в воде (Д5В) и 0,9% NaCl. 0,9% NaCl и 5% декстроза в воде поддерживает размер частиц липосом. Следующая таблица показывает результаты двух различных формаций липосом с тремя независимыми растворителями. Средний диаметр липосом приведен в нанометрах (нм). Состав F4-1 содержит следующие компоненты ДПФХ:ДСФГ:ДСФЭ-ПЭГ:МСФХ:доцетаксел в следующих масс. % 71,56:8,15:8,24:8,02:4,00 и F4-2 содержит те же компоненты в концентрациях 71,78:8,06:8,10:8,07:3,98 масс.%.
Была изучена стабильность липосом после регидратации. Лиофилизированные липосомы регидратировали с 0,9% NaCl и тестировали как показано схематически на Фиг.4А. Распределение размера частиц отслеживали с помощью аппарата динамического рассеивания света путем повторяющихся сканирований в течение периода 1 час. Результаты показывают, что распределение частиц регидратированных липосом стабильно в течение 1 часа (Фиг.1В).
Лиофилизированные липосомы хранились при различной температуре в течение 9 месяцев. Липосомы тестировали на % инкапсуляции и средний размер частиц после 0, 1, 3, 6 и 9 месяцев. Результаты в следующей таблице показывают, что липосомы были стабильны вплоть до 9 месяцев при 4°C.
ПРИМЕР 2
Сравнили in vivo распределение препарата с липосомами по изобретению и распределение свободного доцетаксела.
Шесть самок мышей линии BALB/с (20±2 г) случайным образом разделили на три группы. Провели обезболивание мышей и поместили их на пенополистироловую панель с отверстием в ней. Одна нога мыши проходила через отверстие на другую сторону панели. Панель плавала в водяной бане, чтобы нагреть ногу до 43,5±0,5°C в течение 15 мин. Затем мышам делали инъекцию в хвостовую вену или липосом в дозе 10 мг/кг или такой же дозы таксотера (контроль: приготовленный по спецификации производителя). Одну ногу у каждой мыши затем нагревали в течение 30 мин после инъекции, после чего умерщвляли животное. Мышцы нагретой и ненагретой ног вырезали. Препарат извлекали из фиксированного веса мышечной ткани, используя метод экстракции, описанный выше. Полученный препарат анализировали с помощью ВЭЖХ. Результаты показаны в следующей таблице.
% (ненагретая нога)
(нагретая нога)
(ненагретая нога)
Данные показывают, что термочувствительная липосома доставляет в нагретую ногу более, чем в два раза больше доксетаксела, чем в ненагретую ногу.
ПРИМЕР 3
Сравнили in vivo распределение препарата, полученное с липосомами по изобретению, и полученное с нетермочувствительными содержащими доцетаксел липосомами.
Термочувствительные липосомы и нетермочувствительные липосомы были получены по формулам, приведенным в следующей таблице:
Шесть самок мышей линии BALB/с (20±2 г) случайным образом разделили на три группы. Провели обезболивание мышей и поместили их на пенополистироловую панель с отверстием в ней. Одна нога мыши проходила через отверстие на другую сторону панели. Панель плавала в водяной бане, чтобы нагреть ногу до 43,5±0,5°C в течение 15 мин. Затем мышам делали инъекцию в хвостовую вену или липосом в дозе 10 мг/кг или такой же дозы таксотера (контроль: приготовленный по спецификации производителя). Одну ногу у каждой мыши затем нагревали в течение 30 мин после инъекции, после чего умерщвляли животное. Мышцы нагретой и ненагретой ног вырезали. Препарат извлекали из фиксированного веса мышечной ткани, используя метод экстракции, описанный выше. Полученный препарат анализировали с помощью ВЭЖХ. Результаты показаны в следующей таблице.
В группе с термочувствительными липосомами концентрация препарата в нагретых тканях оказалась более, чем в два раза выше, чем в ненагретых тканях. В группах с инъекцией доксетаксела (пример 2) и нетермочувствительных липосом концентрация препарата была одинаковой в нагретой и ненагретой тканях. Эти результаты показывают, что термочувствительная липосома высвобождает препарат в ткани в данных экспериментальных условиях.
ПРИМЕР 4
Сравнили in vivo эффективность доставки доксетаксела при использовании липосом по изобретению и свободного доксетаксела у мышей, страдающих карциномой легких Левиса.
Использовали двенадцать самок мышей линии Kunming в возрасте 7-9 недель массой 20±2 г. Клетки карциномы легких Левиса (3×106 клеток в 0,1 мл PBS) имплантировали под кожу в нижнюю часть правой ноги каждой мыши. Перед началом обработки опухоли росли до размера 4-6 мм в диаметре.
Двенадцать мышей разделили по размеру опухоли и случайным образом распределили на 3 экспериментальных группы: соль, свободный доксетаксел и термочувствительные липосомы по изобретению.
Содержащие доксетаксел термочувствительные липосомы по изобретению были получены как описано выше и хранились при 2-8°C вплоть до использования. Экспериментальным животным инъецировали 75 мг/м2 доксетаксела или в термочувствительной липосоме по изобретению или как нелипосомальный таксотер, приготовленный по спецификации изготовителя.
Лечение начали на 8 день после имплантации опухоли и повторили на 12 и 16 дни. Во всех экспериментальных группах провели обезболивание мышей с помощью внутрибрюшной инъекции пентобарбитала (80 мг/кг); препарат вводили в объеме 0,2 мл путем инъекции в хвостовую вену. Эта доза анестезии обеспечила достаточное обездвиживание в течение часового периода воздействия.
За исключением группы, которой вводили соль, все экспериментальные группы получали эквивалентную дозу доксетаксела из расчета 75 мг/м2. Незамедлительно после инъекции мышей поместили в специально разработанные штативы, позволяющие опухоли на изолированной ноге находиться в водяной бане в течение 30 минут. Температура водяной бани составила 43°C. Такая величина температуры водяной бани была получена в результате предварительной калибровки, целью которой было температура опухоли 42°C. Всех мышей умертвили на 18 день. Опухоли вырезали хирургическим путем и зарегистрировали их вес. Угнетение роста опухоли оценивали следующим образом:
коэффициент уменьшения опухоли = (Vs-Vx)/Vs
где: Vs - объем опухоли мышей, получавших соль, Vx - объем опухоли экспериментальной группы.
Результаты показаны в следующей таблице.
Доставка доксетаксела в форме термочувствительной липосомы и местное нагревание опухоли привело к большему подавлению опухоли, чем одна доставка доксетаксела. У двух мышей, у которых была использована термочувствительная липосома, опухоль почти исчезла.
ПРИМЕР 5
Приготовление термочувствительной липосомы, содержащей карбоплатин
Липосомы можно изготавливать любым способом, известным специалистам в данной области техники. Один приемлемый способ состоит в следующем.
Липосомы приготовлены из липидов, перечисленных в следующей таблице.
Растворить липиды в 3 мл хлороформа. Выпарить хлороформ на роторном испарителе при 60°C при пониженном давлении для формирования тонкой пленки. Продолжать нагревание в течение 40 минут для удаления органического растворителя. Добавить 25 мл воды для гидратации высушенной липидной пленки при 60°C в течение 10 минут. Понизить давление при комнатной температуре для удаления пузырьков воздуха в течение 10 минут. Еще раз нагревать в течение 10 минут при 60°C. Провести экструзию липидной суспензии через мембрану с размером пор 200 нм 10 раз. Провести экструзию через мембрану с размером пор 100 нм 4 раз. Липосомы, приготовленные таким образом, могут храниться при 4°C.
Далее липосомы можно наполнять активным средством, например карбоплатином, применяя подходящие методики, известные в данной области техники. Одна из подходящих методик является следующее:
Поместить 800 мг карбоплатина и 1000 мг лактозы в 20 мл пустых липосом с концентрацией 106 мг липосом на мл. Нагреть смесь до 60°C на водяной бане и перемешивать на 300 об/мин в течение 30 минут. Наполненные липосомы могут храниться при 4°C.
Излишек препарата можно удалить из наполненных липосом при помощи любой методики, известной в данной области техники, например, эксклюзионной хроматографии или диализа. Один походящий способ выглядит так:
Раствор наполненных липосом можно поместить в диализный мешок (молекулярный предел: 8000~14000). Раствор позволяет диализ липосом в 200 мл 5%-го раствора лактозы при 4°C в течение 2 часов. Замените диализный раствор свежим 200 мл 5%-го раствора лактозы и проведите диализ а течение еще 2 часов при 4°C. Наполненные липосомы можно удалить из диализного мешка и хранить при 4°C. Наполненные липосомы следует беречь от экспозиции на свету.
ПРИМЕР 6
Физические характеристики содержащих карбоплатин липосом.
После разделения наполненных препаратом липосом и чистого препарата липосомы имеют соотношение препарат/липиды 0,04, как видно из следующей таблицы, и средний размер частиц 95 нм (Фиг.5 и 6). Концентрация липидов составляет 106 мг/мл.
Поскольку карбоплатиновые липосомы для клинического применения необходимо разбавлять, была изучена стабильность содержащих карбоплатин липосом по изобретению в 5% растворе глюкозы и воде в качестве растворителей. Стабильность липосом в этих растворителях была изучена путем растворения 10 мкл липосом в 990 мкл растворителя при комнатной температуре в течение 6 часов. Текучесть препарата после растворения проанализировали путем сравнения инкапсуляции препарата до и после растворения. Следующая таблица содержит полученные результаты. Данные показывают, что карбоплатиновые липосомы совместимы и с водой, и с 5% глюкозой.
ПРИМЕР 7
Характеристика профиля высвобождения препарата содержащих карбоплатин липосом
Профиль высвобождения карбоплатинового препарата анализировали при 37°C и 42°C. Подробный способ состоит в следующем:
Водяные бани были нагреты до 38°C и 43°C соответственно (температура тестового образца была на один градус ниже, чем водяная баня). 1,0 мл аликвот липосом развели в 9,0 мл 5% раствора глюкозы. 5 мл разведенного раствора нагрели при 38°C в водяной бане. Оставшиеся 5 мл разведенного раствора нагрели при 43°C в водяной бане. В различных временных точках после начала нагревания брали 200 мкл образца из образцов обеих температурных групп. Образцы взяли после 0, 0,25, 0,5, 1, 2, 4, 8, 16, 32, 64 и 128 мин из образца с температурой 42°C и после 0, 2, 8, 32 и 128 мин из образца с температурой 37°C. Образцы охладили в ледяной воде немедленно после взятия.
Проанализировали общее содержание препарата и концентрацию чистого препарата в образцах. Высвобождение препарата посчитали по следующему уравнению:
Высвобождение препарата = C чистого/C общая × 100%.
Следующая таблица и Фиг.7 содержат полученные результаты.
(мин)
Эти данные показывают, что липосомы по изобретению высвобождают препарат сразу же после нагревания.
Для дальнейшей характеристики профиля высвобождения препарата из липосом по изобретению были изучены содержащие карбоплатин липосомы при различных температурах от 37°C до 43°C при 5 и 10 минутах нагревания. Следующая таблица и Фиг.8 демонстрирует долю высвобождающегося препарата. При 37°C высвобождения почти не происходит, однако начиная с 40°C препарат высвобождается быстро.
ПРИМЕР 8
Характеристика стабильности содержащих карбоплатин липосом
Оценивали текучесть препарата во время хранения при различных температурах.
Липосомы хранили при -20°C, 4°C и 25°C в течение 5 или 10 дней. Анализировали % инкапсуляции препарата. Результаты, представленные в следующей таблице, показывают, что липосомы по изобретению стабильны при 4°C в течение 10 дней.
Чтобы определить, можно ли стерилизовать липосомы по изобретению путем фильтрации, оценивали их стабильность при фильтрации. 2 мл аликвот липосом отфильтровали через 0,22 мкм фильтр. Процентную долю инкапсулированного препарата оценивали перед и после фильтрации. Данные в следующей таблице показывают, что липосомы могут быть отфильтрованы в небольшом объеме.
Длительная стабильность липосом оценивали как результат хранения липосом при 4°C. Текучесть препарата оценивали в 0, 1 и 2 месяца. Как показано в следующей таблице, липосомы по изобретению стабильны при 4°C по меньшей мере 6 месяцев.
Все публикации, патенты и патентные заявки, упомянутые в этом описании, соответствуют уровню специалиста, владеющего данной областью техники, которому адресовано это изобретение, и приведены здесь в качестве ссылок в той же мере, как если бы каждая отдельная публикация, патент или патентная заявка были специально и отдельно указаны как включенные посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПЕРИТОНЕАЛЬНОМ ДИАЛИЗЕ | 2013 |
|
RU2609860C2 |
| ГИПЕРСТАБИЛИЗИРОВАННЫЕ ЛИПОСОМЫ, ПОВЫШАЮЩИЕ НАПРАВЛЕННОЕ ТАРГЕТИРОВАНИЕ МИТОТИЧЕСКИХ КЛЕТОК | 2018 |
|
RU2765736C2 |
| СТАБИЛИЗИРУЮЩИЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КАМПТОТЕЦИНА | 2016 |
|
RU2833053C2 |
| СТАБИЛИЗИРОВАННЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ КАМПТОТЕЦИНА | 2016 |
|
RU2732567C2 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| СОЗДАНИЕ ПРОФИЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА ПРИ ИСПОЛЬЗОВАНИИ ЛИПОСОМНОЙ КОМПОЗИЦИИ В ВОДНЫХ И БЕЗВОДНЫХ РАСТВОРАХ | 2014 |
|
RU2712157C2 |
| Пероральная система доставки вещества белковой природы (варианты), защитная оболочка системы доставки (варианты) | 2014 |
|
RU2665367C2 |
| ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2792690C2 |
| ПРИМЕНЕНИЕ ЛИПОСОМЫ МИТОКСАНТРОНА ДЛЯ ЛЕЧЕНИЯ НЕХОДЖКИНСКОЙ ЛИМФОМЫ | 2019 |
|
RU2804477C2 |
| ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2017 |
|
RU2756755C2 |

Изобретение относится к фармацевтической промышленности и представляет собой термочувствительную липосому для лечения рака у субъекта, содержащую по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин, моностеароилфосфатидилхолин, пэгилированный фосфолипид и активное средство, выбранное из группы, состоящей из таксотера, доцетаксела и карбоплатина, где липосома имеет температуру фазового перехода гель-жидкость от около 39°C до около 45°C. Изобретение обеспечивает стабильность при хранении в течение длительного периода, составляющего месяц или более, при низких температурах. 6 н. и 6 з.п. ф-лы, 8 пр., 8 ил.
1. Термочувствительная липосома для лечения рака у субъекта, содержащая по меньшей мере один фосфатидилхолин, по меньшей мере один фосфатидилглицерин, моностеароилфосфатидилхолин (МСФХ), ПЭГилированный фосфолипид и активное средство, выбранное из группы, состоящей из таксотера, доцетаксела и карбоплатина, где липосома имеет температуру фазового перехода гель-жидкость от около 39°C до около 45°C.
2. Термочувствительная липосома по п.1, в которой фосфатидилхолин является дипальмитоилфосфатидилхолином (ДПФХ), и фосфатидилглицерин является дистеароилфосфатидилглицерином (ДСФГ).
3. Термочувствительная липосома по п.1, в которой ПЭГилированный фосфолипид является ПЭГ-2000-модифицированным дистеароилфосфатидилэтаноламином (ДСФЭ-ПЭГ2000).
4. Термочувствительная липосома по п.3, содержащая ДПФХ:ДСФГ:МСФХ:ДСФЭ-ПЭГ2000: активное средство в соотношении 60-80:6-12:6-12:4-15:1-30 по массе.
5. Фармацевтическая композиция для лечения рака у субъекта, содержащая термочувствительную липосому по любому из пп.1-4.
6. Композиция по п.5, где активное средство является доцетакселом, причем размер частиц липосом и количество доксетаксела, содержащееся внутри липосомы, остаются, по существу, стабильными при хранении композиции при 2-8°C в течение 1-9 месяцев.
7. Композиция по п.5, где активное средство является карбоплатином, при этом количество карбоплатина, содержащееся внутри липосомы, остается, по существу, стабильным при хранении композиции при 4°C в течение 1-6 месяцев.
8. Композиция по п.5, в которой активное средство является карбоплатином, и по меньшей мере 83,2% карбоплатина высвобождается из липосом при нагревании липосом в течение 1-128 мин до 42°C.
9. Способ лечения рака у субъекта, нуждающегося в этом, предусматривающий:
введение субъекту терапевтически эффективного количества фармацевтической композиции по п.5; и
нагревание области субъекта, содержащее все или часть заболевания.
10. Способ изготовления состава термочувствительных липосом, содержащих противораковое средство, предусматривающий:
растворение ДПФХ, ДСФГ, МСФХ, ДСФЭ-ПЭГ2000 и противоракового средства, выбранного из группы, состоящей из таксотера, доцетаксела и карбоплатина, в органическом растворителе для образования липидного раствора;
удаление органического растворителя из упомянутого липидного раствора для образования высушенного материала;
гидратация высушенного материала в водном растворе PBS и лактозы;
получение дисперсии, содержащей липосомы, и регулирование размера частиц упомянутых липосом в дисперсии; и
стерилизация упомянутой дисперсии липосом.
11. Способ изготовления состава термочувствительных липосом, содержащих противораковое средство, предусматривающий:
растворение ДПФХ, ДСФГ, МСФХ, ДСФЭ-ПЭГ2000 в органическом растворителе;
удаление органического растворителя для образования высушенного материала;
гидратация высушенного материала в водном растворе для образования гидратированного липидного материала;
экструзия упомянутого гидратированного липидного материала для образования дисперсии, содержащей липосомы;
добавление противоракового средства, выбранного из группы, состоящей из таксотера, доцетаксела и карбоплатина, в упомянутую дисперсию во время нагревания и смешивания для образования дисперсии липосом, нагруженных противораковым средством; и
удаление избыточного противоракового средства, которое не вошло в состав упомянутых нагруженных противораковым средством липосом.
12. Продукт, полученный при помощи способа по п.10 или 11.
| US 6726925 B1, 24.04.2004 | |||
| US 2005118249, 02.06.2005 | |||
| RU 96119991 A, 27.12.1998 | |||
| David Needham et al | |||
| "A New Temperature-sensitive Liposome for Use with Mild Hyperthermia: Characterization and Testing in a Human Tumor Xenograft Model", Cancer Res 2000; 60: 1197-1201 | |||
| US 4952408 A, 28.08.1990. |
Авторы
Даты
2013-11-10—Публикация
2008-11-05—Подача