Изобретение относится к области биотехнологии, биоинженерии белка и может быть использовано при получении рекомбинантных белковых препаратов различного назначения, в частности биомедицинских препаратов.
Энтеропептидаза (синоним - энтерокиназа; ЕС 3.4.21.9) - это гетеродимерная сериновая протеиназа из щеточной каемки кишечника, которая активирует трипсиноген благодаря высокоспецифичному разрыву пептидной связи, следующей за распознаваемой ферментом последовательностью (Асп)4Лиз. Благодаря высокой специфичности энтеропептидаза (ЕР) широко используется для расщепления слитных белков для удаления аффинных и других тагов. Использование слитных белков как способ продуцирования рекомбинантных белков хорошо известен в биофармацевтической индустрии. Гибридные таги сильно облегчают очистку целевого белка, улучшив их растворимость. Кроме того, аффинные таги позволяют очистить практически любой белок с заранее неизвестными биохимическими свойствами. Однако часто присутствие тагов в рекомбинантном белке нежелательно или является недостатком планируемого препарата, в частности при его использовании в клинике. В настоящее время для ферментативного удаления тагов используют несколько эндопротеиназ. Среди них широко используются энтеропептидаза, тромбин и фактор Ха. Выбор энтеропептидазы предпочтителен по нескольким причинам. Он специфически расщепляет последовательности (Асп)4Лиз, работает в широком диапазоне pH (6-9) в присутствии различных денатурирующих реагентов. Кроме того, для эффективного расщепления белков ферменту не требуются дополнительные аминокислотные остатки в P' позициях, что позволяет получить целевые белки с природной N-концевой последовательностью. Было показано, что рекомбинантная каталитическая субъединица (легкая цепь) энтеропептидазы активирует трипсиноген значительно хуже, чем природный гетеродимер (состоящий из тяжелой и легкой цепи). Однако легкая цепь существенно эффективнее расщепляет слитные белки, содержащие сайт узнавания (Асп)4Лиз.
Применение энтеропептидазы в биофармацевтической индустрии ограничено по двум причинам. Ферментативное удаление тагов с использованием энтеропептидазы значительно повышает стоимость полученного целевого препарата. Вторая проблема связана с неспецифической протеолитической активностью энтеропептидазы. Это приводить к частичной деградации целевого белка, в результате чего страдают выходы очищенного препарата. Несмотря на высокую гомологию (80-90% среди млекопитающих) каталитическая субъединица энтеропептидазы из разных ресурсов проявляет различную активность для расщепления трипсиногена, специфического субстрата GD4K-na (Gly-Asp-Asp-Asp-Asp-Lys-p-naphthylamide) и различную вторичную активность. Например, каталитическая константа легкой цепи энтеропептидазы человека (L-HEP) в 10 и 17 раз выше для расщепления специфического пептида GD4-na и трипсиногена соответственно, чем у бычьего фермента. (Gasparian ME и др., 2006. Biochemical characterization of human enteropeptidase light chain. Biochemistry (Moscow) 71:149-156. Mikhailova AG и др., 2007. The ways of realization of high specificity and efficiency of enteropeptidase. Prot Pep Lett 14:227-232). Известно, что мутантный вариант трипсиногена, где все аспарагиновые остатки заменены на аланин в сайте расщепления энтеропептидазы (Асп)4Лиз, все еще остается специфическим субстратом для эетеропептидазы человека, но не быка. (Nemoda Z, Sahin-Toth M. 2005 The tetra-aspartate motif in the activation peptide of human cationic trypsinogen is essential for autoactivation control but not for enteropeptidase recognition. J. Biol. Chem. 19:29645-52).
Известен способ повышения скорости расщепления трипсиногена с помощью энтеропептидазы при замене аминокислотного остатка лизина на аргинин в позиции P1 пептида активации катионного трипсиногена человека. (Chen JM, Kukor Z, Le Marechal C, Toth M, Tsakiris L, Raguenes O, Ferec C Sahin-Toth M. 2003. Evolution of trypsinogen activation peptides. Mol. Biol. Evol. 20:1767-1777). В данной работе показано, что природный белок энтеропептидазы быка 2,5 раз быстрее активирует бычий трипсиноген с (Асп)4Арг активируемым пептидом по сравнению с природным сайтом (Асп)4Лиз.
Известен способ повышения эффективности энтеропептидазы быка для расщепления искусственных пептидных субстратов. (Ley AC, Luneau CJ, Lander RC. 2005. Enterokinase cleavge sequences.US patent 6,906,176 B2, from Jun.14 2005). В данной работе с помощью технологии фагового дисплея найдены пептиды Асп-Иле-Асн-Асп-Асп-Арг↓Сер-Лей-Фен и Гли-Асн-Тир-Тре-Асп-Арг↓Мет-Фен-Иле, которые в 3 раза эффективнее расщепляются энтеропептидазой по сравнению с природным субстратом (Асп)4Лиз.
Известен способ повышения эффективности энтеропептидазы быка для искусственного пептидного субстрата Сер-Гли-Асп-Арг↓Мет-Три. (Boulware KT, Daugherty PS. 2006. Protease specificity determination by using cellular libraries of peptide. substrates (CLiPS). Proc Natl Acad Sci USA 103:7583-7588). В этой работе проведен скрининг клеточных библиотек пептидных субстратов для выявления оптимальных субстратов для энтеропептидазы. Показано, что каталитическая константа расщепления искусственного субстрата Сер-Гли-Асп-Арг↓Мет-Три в 6 раз выше по сравнению с природным субстратом (Асп)4Лиз.
Повышение эффективности энтеропептидазы для удаления тагов слитных белков в известных способах доказано только косвенно. Прямые доказательства, что найденные последовательности будут эффективнее расщепляться в составе гибридных белков по отношению природного сайта узнавания энтеропептидазы (Асп)4Лиз в этих работах не приведены. Кроме того, что особенно важно, найденные новые последовательности узнавания энтеропептидазы требуют определенные аминокислотные остатки в P' и P'' позициях, тогда как в различных белках целевого назначения эти остатки варьируют, и любой аминокислотный остаток может оказаться в этих позициях. Эти ограничения не позволяют рассматривать известные работы как универсальные способы улучшения эффективности энтеропептидазы для удаления тагов при расщеплении гибридных белков.
Изобретение решает задачу повышения эффективности выделения рекомбинантных гибридных белков с помощью энтеропептидазы при удалении тагов гибридных рекомбинантных белков.
Поставленная задача решается за счет того, что в способе выделения рекомбинантных гибридных белков, включающем выделение гибридных белков из культуральной жидкости с последующим расщеплением энтеропептидазой, удалением аффинных тагов и очисткой целевого белка, в сайте расщепления энтеропептидазы Асп-Асп-Асп-Асп-Лиз в составе гибридных рекомбинантных белков производят замену аминокислотного остатка лизина (Лиз), на аминокислотный остаток аргинина (Арг).
Данная замена приводит к улучшению эффективности работы фермента в 3-6 раз. В результате повышается выход рекомбинантных белковых препаратов и существенно снижается стоимость их получения.
Изобретение может быть использовано для получения рекомбинантных белковых препаратов различного назначения, в частности используемых в диагностических и терапевтических целях.
Сущность способа состоит в том, что замена остатка лизина на остаток аргинина в сайте расщепления энтеропептидазы (Асп)4Лиз (см. SEQ ID NO 1 и SEQ ID NO 2) в составе гибридных белков, приводит к повышению эффективности расщепления препаратов. В результате значительно снижается количество расходуемого фермента (на рынке стоимость препаратов энтеропептидазы очень высока) и, соответственно, стоимость полученного целевого белка
В качестве целевого белка может быть использован любой полипептид. Для этого в сайте расщепления энтеропептидазы (Асп)4Лиз (см. SEQ ID NO I, SEQ ID NO 2) заменяют аминокислотный остаток лизина на остаток аргинина с помощью метода сайт направленного мутагенеза, используя соответственные олигонуклеотиды. Расщепляют гибридные белки с сайтами расщепления (Асп)4Лиз и (Асп)4Арг с помощью энтеропептидазы в различных условиях и сравнивают эффективность их расщепления. Пробы белков после расщепления анализируют в полиакриламидном геле окрашивая краской Кумасси бриллиантовый синий R250. Эффективность расщепления слитных белков с сайтами расщепления (Асп)4Лиз и (Асп)4Арг энтеропептидазой сравнивают, анализируя интенсивность окрашенных в полиакриламидном геле белковых полос с помощью программу ImageJ с опцией «анализ геля» (http://rsbweb.nih.gov/ij/, NIH, Bethesda, Maryland).
Изобретение иллюстрируют рисунки.
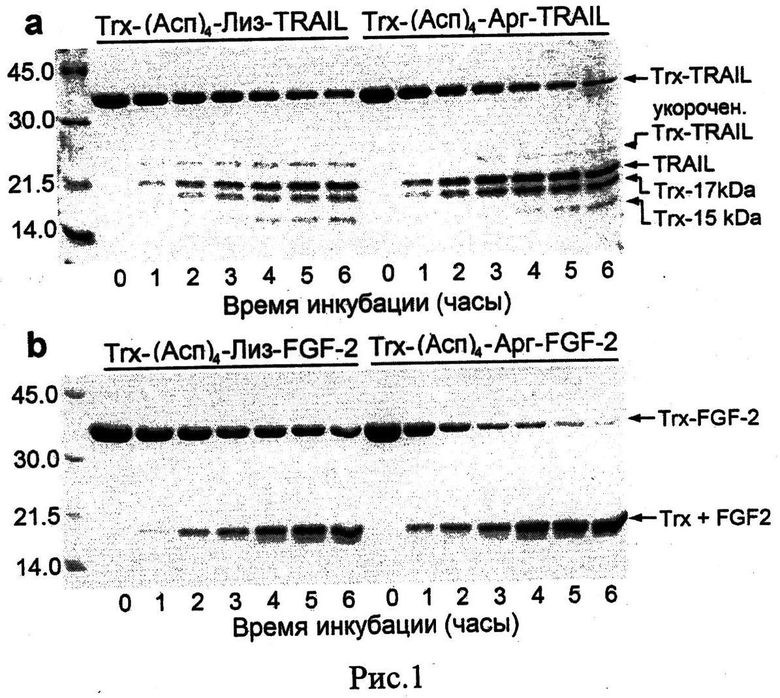
Рис.1. Улучшение эффективности расщепление слитных белков энтеропептидазой после замещения аминокислотного остатка лизина на аргинин в сайте расщепления (Асп)4Лиз. Слитные белки Trx/TRAIL (0.55 мг/мл) и Trx/FGF-2 (0.4 мг/мл) инкубируют с каталитической субъединицей энтеропептидазы человека (L-HEP) в течении 1-6 часов при 25°C. Пробы анализируют на 13% полиакриламидном геле в денатурирующих условиях (Ds-Na-ПААГ).
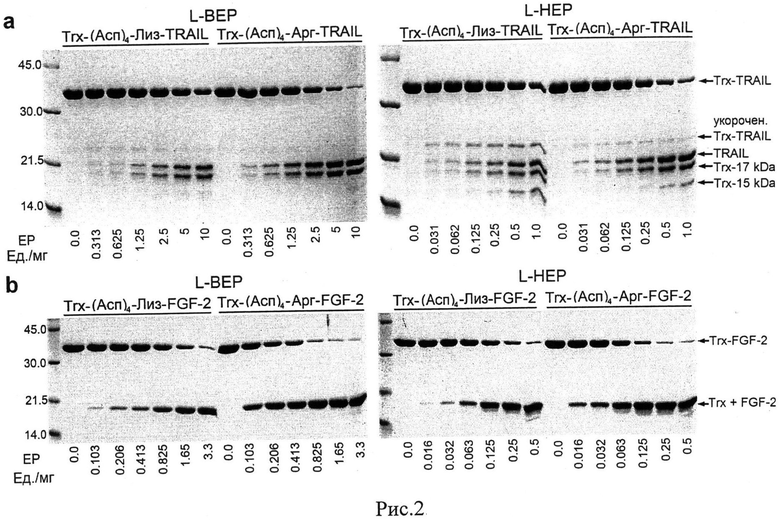
Рис.2. Эффект соотношения фермент-субстрат на гидролиз слитных белков энтеропептидазой. Пробы слитных белков, содержащих разные количества энтеропептидазы человека (L-HEP) или быка (L-BEP) инкубируют со слитными белками в течение 16 часов при 25°C и анализируют на 13% полиакриламидном геле в денатурирующих условиях (Ds-Na-ПААГ).
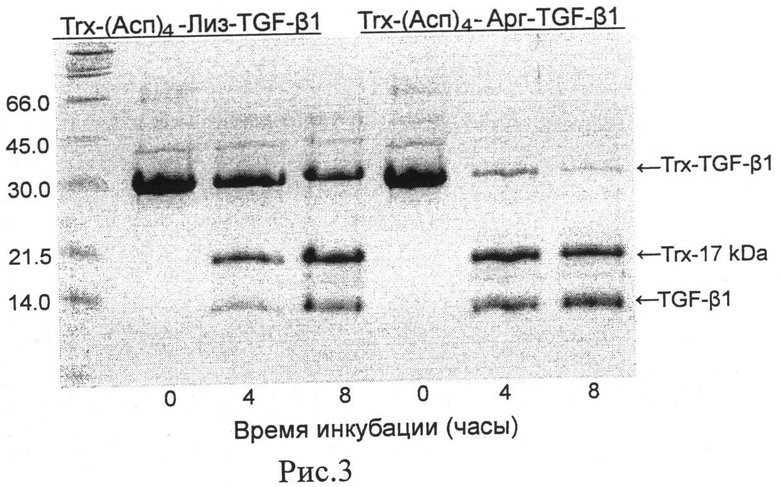
Рис.3. Расщепление слитного белка Trx/TGF-β1 легкой цепью энтеропептидазы человека (L-HEP) после замещения аминокислотного остатка лизина на аргинин в сайте расщепления (Асп)4Лиз. Слитные белки (0.5 мг/мл) Trx-Асп4Лиз/TGF-β1 и Trx-Асп4Арг/TGF-β1 инкубируют с L-HEP в течение 4 и 8 часов при 25°C. Пробы анализируют на 13% полиакриламидном геле в денатурирующих условиях (Ds-Na-ПААГ).
Изобретение иллюстрируют примеры.
Пример 1.
Повышение скорости гидролиза гибридных белков с помощью замены Лиз/Арг в сайте расщепления энтеропептидазы (Асп)4Лиз.
Получают слитные рекомбинантные белки тиоредоксин/TRAIL (Trx/TRAIL) и тиоредоксин/FGF-2 (Trx/FGF-2), содержащих сайт узнавания фермента (Асп)4Лиз или (Асп)4Арг энтеропептидазы, где TRAIL (TNF related apoptosis inducing ligand) и FGF-2 (основной фактор роста фибробластов) являются целевыми белками. В начале получают синтетические гены белков TRAIL и FGF-2. Для этого последовательность ДНК (501 т.п.о., см. SEQ ID NO 5), кодирующая белок TRAIL (114-282 аминокислотных остатков) синтезируют из 20 олигонуклеотидов (длиной 35-42 нуклеотидов каждый) с помощью полимеразной цепной реакции (ПЦР). Последовательность ДНК (465 т.п.о., см. SEQ ID NO 6), кодирующая белок FGF-2 (1-155 аминокислотных остатков) синтезируют из 20 олигонуклеотидов (длиной 35-42 нуклеотидов каждый) с помощью полимеразной цепной реакции (ПЦР). Амплифицированные последовательности ДНК расщепляют с помощью рестриктаз BglII и HindIII и клонируют в плазмидный вектор рЕТ-32а (Novagen США) по сайтам рестрикции BglII/HindIII вслед за геном партнера по слиянию тиоредоксина, непосредственно после последовательности ДНК, кодирующей сайт расщепления энтеропептидазы (Асп)4-Лиз. Далее в последовательностях ДНК, кодирующих белки Trx/TRAIL и Trx/FGF-2 заменяют остаток лизина на аргинин в сайте расщепления энтеропептидазы (см. SEQ ID NO I, SEQ ID NO 2) с помощью метода сайт направленного мутагенеза, используя соответственные олигонуклеотиды (для Trx/TRAIL см. SEQ ID NO 7, SEQ ID NO 8) и (для Trx/FGF-2 см. SEQ ID NO 9, SEQ ID NO 10). В стандартную реакционную смесь полимеразной цепной реакции (ПЦР) объемом 50 мкл, содержащую от 5 нг матричной плазмидной ДНК (pET32a/TRAIL и pET32a/FGF-2), по 62.5 нМ олигонуклеотидных праймеров, по 50 нмоль каждого из четырех дезоксирибонуклеозидфосфатов и 1 ед. Pfu Turbo ДНК-полимеразы. Смесь нагревают до 95°C в течение 1 минуты с последующими 30 циклами нагрева до 95°C в течение 30 сек, 55°C в течение 30 сек, 74°C в течение 14 мин, после чего одноцепочечные концы ДНК достраивают при 74°C в течение 10 минут. После окончания реакций для удаления матричной ДНК в пробы добавляют по 10 ед. рестриктазы DpnI и инкубируют смесь при температуре 37°C в течение 1 часа. Результаты ПЦР оцениваются в 1% агарозном геле. Последовательность генов и сайта расщепления энтеропептидазы подтверждают автоматическим секвенированием с помощью ABI Prism-310 Genetic Analyzer (Applied Biosystems, США).
В результате получают плазмидные ДНК pET-32a/TRAIL и ДНК pET-32a/FGF-2, состоящей из BglII/HindIII - фрагмента ДНК плазмиды рЕТ-32а длиной 5.838 т.п.о., содержащего lacI-промотор E.coli, T7 промотор, последовательность, His'Tag кодирующую последовательность, T7 терминатор, lacI-кодирующую последовательность, bla- (ген β-лактамазы) кодирующую последовательность, последовательность f1 участок ori инициации репликации, кодирующую последовательность сайта узнавания энтеропептидазы (Асп)4Лиз или (Асп)4Арг, а также BglII/HindIII фрагменты кодирующих ДНК целевых белков TRAIL и FGF-2.
Плазмидной ДНК pET-32a/TRAIL и pET-32a/Trx/FGF-2 трансформируют компетентные бактериальные клетки штамма Escherichia coli BL21(DE3) (Invitrogen, США) получают штаммы продуценты BL21(DE3)/pET-32a/TRAIL и BL21(DE3)/pET-32a/FGF-2 - для продукции гибридных белков тиоредоксин/TRAIL (Trx/TRAIL) и тиоредоксин/FGF-2 (Trx/FGF-2). Обозначение DE3 означает, что штамм содержит лизоген фага λ DE3, который несет ген для T7 РНК-полимеразы под контролем lacUV5-пpoмотоpa. Для индукции экспрессии T7 РНК-полимеразы необходим IPTG (изопропил_β-D-1-тиогалактопиранозид).
Для экспрессии гибридных белков 100 мкл компетентные клетки штамма BL21(DE3) трансформируют с 15 нг плазмидной ДНК pET-32a/TRAIL и pET-32a/FGF-2. Трансформированную культуру клеток наносят на чашку со средой LB (Лурия-Бертони) содержащей 1% агарозы и 100 мкг/мл ампицилин и растят при 37°С в течение 16-18 часов. Среда LB (10 мл) инокулируют с одной колонией штаммов продуцентов и растят на ночь при 37°C. Далее ночную культуру разбавляют в 100 раз в бактериальной среде ТВ (Terrific Broth содержащей 100 мкг/мл ампицилин) и клетки растят в течение 23 часа при 28°C. Ночную культуру клеток осаждают центрифугированием и разрушают на френч-прессе. Гибридные белки Trx-(Асп)4Лиз-TRAIL и Trx-(Асп)4Лиз-FGF-2 очищают из растворимой фракции цитоплазматических белков на колонке с носителем Ni-сефарозы. Мутантные варианты белков Trx-(Асп)4Apr-TRAIL и Trx-(Асп)4Apr-FGF-2 экспрессируют и очищают аналогичным образом, как и исходные белки с сайтом расщепления энтеропептидазы (Асп)4Лиз.
Анализируют скорость расщепления очищенных препаратов рекомбинантных гибридных белков Trx/TRAIL (thioredoxin-TNF related apotosis inducing ligand) and Trx/FGF-2 (thioredoxin-basic fibroblast growth factor) с сайтами расщепления (Асп)4-Лиз и (Асп)4-Арг, инкубируя белки с энтеропептидазой человека (L-HEP) при 25°C в течение 1-6 часов. После расщепления пробы белков анализируют на 13% полиакриламидном геле (Рис.1), окрашивая краской Кумасси бриллиантовый синий R250. Интенсивность белковых полос анализируют с помощью программу ImageJ с опцией «анализ геля» (http://rsbweb.nih.gov/ij/, NIH, Bethesda, Maryland) (Табл.1). Показывают, что в течение 6 часов энтеропептидаза расщепляет 3.5 и 4.4 раз больше гибридных белков Trx/TRAIL и Trx/FGF-2 соответственно, когда остаток лизина заменен остатком аргинина в сайте расщепления фермента. При расщеплении белка Trx/TRAIL образуется неспецифически расщепленная полоса пептида с молекулярной массой 21.2 кДа, что соответствует расщеплению сайта в молекуле тиоредоксина после аминокислотного остатка Арг143 (см. SEQ ID NO 11) на сайте Фен-Глу-Арг↓Глн-Гис-Мет. Показывают, что образование неспецифически расщепленного пептида (21.2 кДа) сильно уменьшается после замены остатка лизина на аргинин в сайге расщепления энтеропептидазы, что указывает на улучшение специфичности фермента.
Показывают, что в результате на 25-30% повышается выход целевого белка TRAIL. При наличии несколько скрытых сайтов неспецифического расщепления энтеропептидазы в составе гибридного белка уменьшение количества необходимого фермента для полного расщепления слитных белков приведет к более существенному увеличению выходов целевого белка.
Показывают, что при расщеплении слитного белка Trx/FGF-2 несмотря на то, что на полиакриламидном геле не видны неспецифически расщепленные пептидные полосы (Рис.1), в результате Лиз/Арг замены в сайте расщепления энтеропептидазы на 5-8% повышается выход целевого белка FGF-2.
Пример 2.
Сравнительный анализ каталитической активности энтеропептидаз человека и быка. В настоящее время для удаления тагов гибридных белков широко используют рекомбинантные препараты энтеропептидазы быка и человека. Каталитические свойства рекомбинантных препаратов энтеропептидаз человека (L-HEP см. SEQ ID NO 3) и быка (L-BEP SEQ ID NO 4) исследуется в реакциях с синтетическими пептидными субстратами Z-Lys-SBzl и GD4K-na, а также трипептидов For-Ala-Phe-Lys-pNA и For-Ala-Phe-Arg-pNA (Табл.2). Рекомбинантный препарат энтеропептидазы человека (L-HEP) получают по методике, описанной в работе - Gasparian ME, Ostapchenko VG, Schulga AA, Dolgikh DA, Kirpichnikov MP. (2003) Expression, purification and characterization of human enteropeptidase catalytic subunit in Escherichia coli. Protein Expr. Purif., 31:133-139. Рекомбинантный препарат энтеропептидазы быка (L-BEP) используют фирмы «New England Biolabs, США».
Кинетические параметры расщепления синтетического пептида GD4K-na (Гли-Асп-Асп-Асп-Асп-Лиз-β-нафтиламид) определяют при 37°C в 1.5 мл буфере, содержавшего 25 мМ трис-гидрохлорид (pH 8.4), 10%-ный диметилсульфоксид (ДМСО), 0.2 мМ CaCl2 и 0-0.1 мМ GD4K-na. Реакцию начинают добавлением фермента (L-HEP 0.7 нМ и L-BEP 7 нМ), и скорость образования β-нафтиламида определяют по увеличению флуоресценции (λех=337 нм и λem=420 нм), измеряемому непрерывно в течение 5 мин. Показывают, что каталитическая константа L-HEP 10 раз выше по сравнению с L-BEP.
Скорость гидролиза синтетических трипептидов For-Ala-Phe-Lys-pNA и For-Ala-Phe-Arg-pNA измеряют в 1 мл буфера, содержащего 0.1 мМ Tris-HCl (pH 8.0), 5% ДМСО и 10-300 мкМ пептидов. Реакцию начинают добавлением 4 нмоль ферментов L-HEP или L-BEP и скорость образования p-нитроанилина измеряют при длине волны 405 нМ в течение 5 мин. Показывают, что синтетические трипептид For-Ala-Phe-Lys-pNA гидролизируется энтеропептидазамы человека и быка в 3 раза быстрее, когда остаток лизина заменен на остаток аргинина (Табл.2). Кинетические параметры расщепления субстрата Z-Lys-SBzl (thiobenzyl benzyloxy-carbonyl-L-lysinate) определяют при комнатной температуре в 1.5 мл буфере, содержавшего 0.1 М Трис-HCl (pH 8.0), 260 мкМ дитионитробензойная кислота (ДТНБ) и 20-450 мкМ Z-Lys-SBzl. Реакцию начинают добавлением фермента (0,5 нМ) и скорость образования 3-карбокси-4-нитрофеноксида измеряют по поглощению при 412 нм и рассчитывают исходя из коэффициента экстинкции 13600 М-1 см-1. Кинетические параметры kcat и KM для L-HEP и L-BEP практически одинаковы при расщеплении маленького эфира Z-Lys-SBzl. Одна единица (ЕД) ферментов определяют как значение 0.040 оптических единиц за минуту измеренная при 25°C в буфере содержащего 0.1 М Tris-HCl (pH 8.0), 66 мкМ Z-Lys-SBzl и 260 мкМ ДТНБ в акриловой кювете шириной 10 мМ.
Кинетические параметры расщепления субстрата Z-Lys-SBzl (tmobenzyl benzyloxy-carbonyl-L-lysinate) определяют при комнатной температуре в 1.5 мл буфере, содержавшего 0.1 М Трис-HCl (pH 8.0), 260 мкМ дитионитробензойная кислота (ДТНБ) и 20-450 мкМ Z-Lys-SBzl. Реакцию начинают добавлением фермента (0,5 нМ) и скорость образования 3-карбокси-4-нитрофеноксида измеряют по поглощению при 412 нм и рассчитывают исходя из коэффициента экстинкции 13600 М-1 см-1. Кинетические параметры kcat и KM для L-HEP и L-BEP практически одинаковы при расщеплении маленького эфира Z-Lys-SBzl. Одна единица (ЕД) ферментов определяют как значение 0.040 оптических единиц за минуту измеренная при 25°C в буфере содержащего 0.1 М Tris-HCl (pH 8.0), 66 мкМ Z-Lys-SBzl и 260 мкМ ДТНБ в акриловой кювете шириной 10 мМ.
Пример 3.
Влияние фермент-субстрат соотношения на скорость расщепления слитных белков энтеропептидазой.
Обычно, чтобы избежать неспецифичного расщепления целевого белка в процессе удаления тагов эндопептидазой, пробы белков инкубируют длительное время (16-24 часов) с добавлением малого количества фермента. Для определения рабочих концентрации фермента, гибридные белки Trx/FGF-2 and Trx/TRAIL сайтами расщепления (Асп)4-Лиз и (Асп)4-Арг расщепляют энтеропептидазой человека или быка при различных соотношениях фермент-субстрат в течении 16 часов при 25°C. Пробы анализируют на 13% полиакриламидном геле, окрашивая краской Кумасси бриллиантовый синий R250 (Рис.2). Интенсивность белковых полос анализируют с помощью программу ImageJ с опцией «анализ геля» (Табл.3). Определяют, что скорость расщепления белков зависит от соотношения фермент-субстрат и существенно выше, когда сайт расщепления энтеропептидазы (Асп)4-Лиз заменен на сайт (Асп)4-Арг в гибридных белках.
Расчеты показывают, что для расщепления Trx/TRAIL and Trx/FGF-2 на 95% требуется 3-4 раз меньше энтеропептидазы человека (L-HEP), соответственно, при замене Лиз/Арг в сайте расщепления фермента. Показывают, что эта разница даже больше для бычьего фермента (3.9 и 6.2 раз для Trx/TRAIL и Trx/FGF-2 соответственно). Показывают, что после замены остатка лизина на аргинин в сайте расщепления энтеропептидазы, образование неспецифически расщепленного пептида (21.2 кДа) в молекуле тиоредоксина сильно уменьшается, что указывает на улучшение специфичности фермента (Табл.3).
Пример 4.
Повышение скорости гидролиза гибридного белка тиоредоксин-трансформирующий фактор роста бета1 (Trx/TGF-β1) с помощью замены Лиз/Арг в сайте расщепления энтеропептидазы (Асп)4Лиз.
Получают слитный рекомбинантный белок Trx/TGF-β1 содержащих сайт узнавания фермента (Асп)4Лиз или (Асп)4Арг энтеропептидазы, где TGF-β1 являются целевьш белком. В начале получают синтетический ген белка TGF-β1. Для этого последовательность ДНК (336 т.п.о., см. SEQ ID NO 12), кодирующую белок TGF-β1 (1-112 а.о.), синтезируют из 18 олигонуклеотидов (длиной 30-42 нуклеотидов каждый) с помощью полимеразной цепной реакции (ПЦР). Амплифицированные последовательности ДНК расщепляют с помощью рестриктаз BglII и HindIII и клонируют в плазмидный вектор рЕТ-32а (Novagen США) по сайтам рестрикции BglII/HmdIII вслед за геном партнера по слиянию тиоредоксина, непосредственно после последовательности ДНК, кодирующей сайт расщепления энтеропептидазы (Асп)4-Лиз. В результате получают плазмидные ДНК pET-32a/Trx/TGF-β1 состоящей из BglII/HindIII - фрагмента ДНК плазмиды рЕТ-32а. В белке Trx/TGF-β1 заменяют остаток лизина на аргинин в сайте расщепления энтеропептидазы (см. SEQ ID NO I, SEQ ID NO 2) с помощью метода сайт направленного мутагенеза, используя соответственные олигонуклеотиды (SEQ ID NO 13, SEQ ID NO 14). В стандартную реакционную смесь полимеразной цепной реакции (ПЦР) объемом 50 мкл, содержащую от 15 нг матричной плазмидной ДНК (pET-32a/Trx/TGF-β1) и по 62.5 нМ олигонуклеотидных праймеров, по 50 нмоль каждого из четырех дезоксирибонуклеозидфосфатов и 1 ед. Pfu Turbo ДНК-полимеразы. Смесь нагревают до 95°C в течение 1 минуты с последующими 30 циклами нагрева до 95°C в течение 30 сек, 53°C в течение 45 сек, 74°C в течение 14 мин, после чего одноцепочечные концы ДНК достраивают при 74°C в течение 10 минут. После окончания реакций для удаления матричной ДНК в пробы добавляют по 10 ед. рестриктазы DpnI и инкубируют смесь при температуре 37°C в течение 1 часа. Последовательность генов и сайта расщепления энтеропептидазы подтверждают автоматическим секвенированием с помощью ABI Prism-310 Genetic Analyzer (Applied Biosystems, США).
Плазмидной ДНК pET-32a/Trx/TGF-β1 трансформируют компетентные бактериальные клетки штамма Escherichia coli BL21(DE3) (Invitrogen, США) получают штаммы продуценты BL21(DE3)/pET-32a/Trx/TGF-β1 - для продукции гибридного белка Trx/TGF-β1. Для экспрессии гибридных белков 100 мкл компетентные клетки штамма BL21(DE3) трансформируют с 15 нг плазмидной ДНК Trx/TGF-β1. Трансформированную культуру клеток наносят на чашку со средой LB (Лурия-Бертони), содержащей 1% агарозы и 100 мкг/мл ампицилин, и растят при 37°C в течение 16-18 часов. Среда LB (10 мл) инокулируют с одной колонией штаммов продуцентов и растят на ночь при 37°C. Далее ночную культуру разбавляют в 100 раз в бактериальной среде ТВ (Terrific Broth содержащей 100 мкг/мл ампицилин) и клетки растят в течение 24 часа при 27°C. Ночную культуру клеток осаждают центрифугированием и разрушают на френч-прессе. Гибридный белок Trx-(Асп)4Лиз-TGF-β1 очищают из нерастворимой фракции телец включения после растворения в 8 М мочевине на колонке с носителем N1-NTA агарозы. Мутантный вариант белка Trx-(Асп)4Арг- TGF-β1 экспрессируют и очищают аналогичным образом, как и исходные белки с сайтом расщепления энтеропептидазы (Асп)4Лиз.
Анализируют скорость расщепления очищенных препаратов рекомбинантных гибридных белков Trx/TGF-β1 с сайтами расщепления (Асп)4-Лиз и (Асп)4-Арг, инкубируя белки с энтеропептидазой человека (L-HEP) при 25°C в течение 4-8 часов. После расщепления пробы белков анализируют на 13% полиакриламидном геле (Рис.3), окрашивая краской Кумасси бриллиантовый синий R250. Интенсивность белковых полос анализируют с помощью программу ImageJ с опцией «анализ геля» (http://rsbweb.nih.gov/ij/, NIH, Bethesda, Maryland). Показывают, что в течение 8 часов энтеропептидаза расщепляет 3.5 раза больше гибридного белка Trx/TGF-β1, когда остаток лизина заменен остатком аргинина в сайте расщепления фермента.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET-32a, КОДИРУЮЩАЯ ГЕН ЛИГАНД-СВЯЗЫВАЮЩЕГО ДОМЕНА РЕЦЕПТОРА II ТИПА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА-β ЧЕЛОВЕКА (TβRII), ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ СЛИТНОГО БЕЛКА ТИОРЕДОКСИН/TβRII И СПОСОБ РЕНАТУРАЦИИ И ОЧИСТКИ ЦЕЛЕВОГО БЕЛКА TβRII | 2009 |
|
RU2413769C1 |
| Способ получения рекомбинантного противоопухолевого модифицированного белка DR5-B человека | 2018 |
|
RU2687435C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК L-HEP, ШТАММ ESCHERICHIA COLI ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2019 |
|
RU2716975C1 |
| ПЛАЗМИДА ДЛЯ ЭКСПРЕССИИ В КЛЕТКАХ БАКТЕРИИ РОДА Escherichia НЕАКТИВНОГО ПРЕДШЕСТВЕННИКА МУТЕИНА [C112S] ЛЕГКОЙ ЦЕПИ ЭНТЕРОКИНАЗЫ ЧЕЛОВЕКА, БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ Escherichia, - ПРОДУЦЕНТ ПРЕДШЕСТВЕННИКА РЕКОМБИНАНТНОГО МУТЕИНА [C112S] ЛЕГКОЙ ЦЕПИ ЭНТЕРОКИНАЗЫ ЧЕЛОВЕКА, ПРЕДШЕСТВЕННИК РЕКОМБИНАНТНОГО МУТЕИНА [C112S] ЛЕГКОЙ ЦЕПИ ЭНТЕРОКИНАЗЫ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО МУТЕИНА [C112S] ЛЕГКОЙ ЦЕПИ ЭНТЕРОКИНАЗЫ ЧЕЛОВЕКА, РЕКОМБИНАНТНЫЙ МУТЕИН [C112S] ЛЕГКОЙ ЦЕПИ ЭНТЕРОКИНАЗЫ ЧЕЛОВЕКА | 2011 |
|
RU2495934C2 |
| Способ получения пептида, модулирующего активность пуринергических рецепторов | 2019 |
|
RU2714114C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУТАНТНОГО БЕЛКА TRAIL ЧЕЛОВЕКА | 2009 |
|
RU2405038C1 |
| СЛИТНЫЙ БЕЛОК, СПЕЦИФИЧЕСКИ УЗНАЮЩИЙ МЕЛАНОМНЫЕ КЛЕТКИ | 2012 |
|
RU2535878C2 |
| РЕКОМБИНАНТНАЯ ЭКСПРЕССИЯ БЕЛКОВ В ДВУХЦЕПОЧЕЧНОЙ ФОРМЕ С ДИСУЛЬФИДНЫМ МОСТИКОМ | 2006 |
|
RU2412253C2 |
| Способ очистки рекомбинантного белка, содержащего в своем составе последовательности миелопептидов | 2016 |
|
RU2630302C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTRX-TEVRS-РТН, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К ПРОТЕОЛИТИЧЕСКОМУ РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ ФРАГМЕНТА ЭНДОГЕННОГО ЧЕЛОВЕЧЕСКОГО ПАРАТИРЕОИДНОГО ГОРМОНА (1-34), ШТАММ ESCHERICHIA COLI BL21(DE3)/PTRX-TEVRS-РТН - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО PTH (1-34) | 2019 |
|
RU2700452C1 |





Изобретение относится к области биотехнологии и может быть использовано при получении рекомбинантных форм представляющих практический интерес белков. Предложен способ получения рекомбинантного белка через его гибридный предшественник с природным сайтом расщепления энтеропептидазой, который обеспечивает повышение качества (гомогенности) и выхода целевого продукта в условиях, когда гибридный белок обнаруживает дополнительные (скрытые) сайты расщепления энтеропептидазой. Результат достигается путем замены в природном сайте расщепления энтеропептидазой Асп-Асп-Асп-Асп-Лиз аминокислотного остатка лизина (Лиз) аминокислотным остатком аргинина (Арг) и последующего расщепления гибридного предшественника легкой каталитической субъединицей энтеропептидазы человека или быка. 3 табл., 3 ил., 4 пр.
Способ выделения рекомбинантного белка из гибридного белка с встроенным в него природным сайтом расщепления энтеропептидазой, где указанный гибридный белок содержит скрытые сайты расщепления указанным ферментом, состоящий в том, что в указанном природном сайте Асп-Асп-Асп-Асп-Лиз производят замену аминокислотного остатка лизина на аминокислотный остаток аргинина и расщепляют гибридный белок легкой цепью энтеропептидазы человека или быка.
| GASPARIAN M | |||
| et al | |||
| Biotechnol | |||
| Lett al | |||
| Солесос | 1922 |
|
SU29A1 |
| CHEN J.-M | |||
| et al | |||
| Mol | |||
| Biol | |||
| Evol., 20 (11), 1767-1777, 2003 | |||
| BOULWARE K | |||
| et al | |||
| Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, 103(20), 7583-7588, 2006 | |||
| ГАСПАРЯН М.Э | |||
| и др., Биохимия, 71 (2), 113-119, 2006. | |||
Авторы
Даты
2013-11-20—Публикация
2011-04-14—Подача