Изобретение относится к области клеточной биологии, молекулярной биологии и биотехнологии, конкретно, к получению мутантного белка TRAIL человека, который может быть использован в качестве терапевтического средства для эффективного лечения ОК5-зависимых опухолей, а также в качестве инструмента для научных исследований механизмов TRAIL опосредованно апоптоза.
Белок TRAIL (TNF-related apoptosis-inducing ligand) является одним из членов семейства цитокинов типа TNF (tumor necrosis factor, фактор некроза опухолей). Природный TRAIL играет важную роль в иммунной защите организма от опухолевой трансформации и вирусной инфекции, а также участвует в подавлении аутоиммунных воспалительных реакций, определяющих патогенез ревматоидного артрита, рассеянного склероза и других заболеваний. Экспрессия TRAIL усиливается под действием интерферонов и в значительной степени определяет эффективность этой важнейшей защитной системы организма.
Основной интерес к белку TRAIL связан с его свойством избирательного индуцирования апоптоза в опухолевых клетках, не затрагивая нормальные клетки. Рекомбинантный растворимый белок TRAIL способен вызывать апоптоз в культурах клеток из широкого спектра человеческих опухолей. В связи с этим белок TRAIL рассматривается в качестве многообещающего потенциального терапевтического средства при лечении аутоиммунных и раковых заболеваний. Молекула TRAIL содержит 281 аминокислотных остатков и представляет собой трансмембранный белок II типа с C-концевым экстраклеточным доменом. Показано, что рекомбинантный белок TRAIL 114-281 способен индуцировать апоптоз в концентрациях от 2 до 100 нг/мл на различных раковых клеточных линиях.
TRAIL имеет 5 типов рецепторов: DR4, DR5, DcR1, DcR2 и OPG. Эти рецепторы отличаются способностью индуцировать апоптоз при взаимодействии с лигандом. Причем только рецепторы DR4 и DR5 способны проводить сигнал апоптоза и носят название «рецепторов смерти». Рецепторы DcR1 и DcR2 (так называемые рецепторы ловушки) соревнуются с DR4 and DR5 для связывания с TRAIL и противоборствуют TRAIL опосредованному апоптозу. Остеопротегерин (OPG) является растворимой TRAIL взаимодействующей молекулой, которая, скорее, играет роль в развитии костных и миелоидных клеток, но не в регуляции TRAIL опосредованного апоптоза.
В большинстве видов опухолей рецептор DR5/TRAIL-R2 играет основную роль в проведении сигнала апоптоза при связывании с лигандом. Кроме того, зачастую происходит индукция рецептора DR5 в опухолевых клетках при воздействии различных химиотерапевтических средств. В связи с этим наибольший интерес представляет увеличение специфичности TRAIL по отношению к рецептору DR5.
Известен способ получения DR5 селективного мутантного варианта TRAIL DR5-8 и DR4-8 (Kelley FR., Totpal K., Lindstrom SH., Mathieu M., Billeci K., De Forge L. et al. Receptor-selective mutants of Apo2L/TRAIL reveal a greater contribution of DR5 than DR4 to apoptosis signaling // J.Biol.Chem. 2005. Vol.280, p.2205-2212). Эти мутантные варианты получают с помощью метода фагового дисплея. С помощью рекомбинантных DR4 и DR-5 рецепторов отобрают клоны, в которых мутантные варианты TRAIL хуже связываются к одному или другому рецептору. Гены отобранных мутантных вариантов TRAIL с добавочным метионином на N-конце клонируют в плазмиду pS1346, экспрессируют в штамме Escherichia coli W3110 под контролем промотора trp. После разрушения клеток белок осаждают в буфере 40% аммония сульфата и очищают хроматографическим методом сначала на гидроксиапатите, а затем на Ni-NTA агарозе. Мутантный вариант TRAIL DR5-8 содержит 6 замен аминокислотных остатков (Y189N/R191K/Q193R/H264R/I266L/D267Q) и обладает повышенной специфичностью к DR5 рецептору за счет снижения эффективности связывания с другими рецепторами DR4, DcR1 и OPG. Однако этот мутантный вариант в 2 раза хуже связывается с рецептором DR5, в результате чего менее эффективно вызывает апоптоз.
Мутантный вариант TRAIL DR4-8 содержит 6 замен аминокислотных остатков (Y189A/Q193S/N199V/K201R/Y213W/S215D) и обладает повышенной специфичностью к DR4 рецептору за счет снижения эффективности связывания с рецептором DR5. Однако этот мутантный вариант обладает пониженной биологической активностью по сравнению с диким типом и высокой аффинностью к рецепторам DcR1 и DcR2.
Известен наиболее близкий к заявленному способ получения DR5 селективного мутантного варианта TRAIL D269H (Van der Sloot AM., Tur V., Szegezdi ТЕ., Mullally MM., Cool RH., Samali A. et al. (2006). Designed tumor necrosis factor-related apoptosis-inducing ligand variants initiating apoptosis exclusively via the DR5 receptor // Proc.Natl.Acad.Sci.USA. 2006. V.103, p.8634-8639). D269H мутантный вариант получают с помощью алгоритма автоматического дизайна FOLD-X. ДНК TRAIL клонируют в вектор рЕТ15В и точечную мутацию D269H вводят с помощью метода сайт-направленного мутагенеза. Белок экспрессируют в штамме Escherichia coli BL21 (DE3). После разрушения клеток белок очищают сначала на IMAC сефарозе, заряженной никелем, потом дочищают хроматографическим методом на гидроксиапатите, а затем на Ni-NTA агарозе.
Мутантный вариант TRAIL/ D269H в несколько раз эффективнее связывается с рецептором DR5 и значительно хуже связывается с рецепторами DR4 и DcR1. Недостатком этого мутантного варианта является его невысокая селективность к DR5 рецептору, так как он связывается с DcR2 и OPG рецепторами так же эффективно, как и дикий тип.
Изобретение решает задачу получения препарата с высокой противоопухолевой активностью на основе рекомбинантного белка TRAIL.
Поставленная задача решается за счет способа получения рекомбинантного мутантного белка TRAIL человека с высокой противоопухолевой активностью, включающего введение мутаций Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H или Y189N/R191K/Q193R/H264R/I266L/D269H в ген TRAIL человека, находящийся в составе плазмидной ДНК рЕТ-32а, с последующей трансформацией штамма Escherichia coli BL21(DE3) полученной рекомбинантной плазмидной ДНК, экспрессию и выделение целевого белка.
Предлагаемым способом путем комбинации мутаций получают мутантные варианты DR5-A и DR5-B, содержащие мутации Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H и Y189N/R191K/Q193R/H264R/I266L/D269H соответственно.
Плазмидная ДНК pET-32a/DR5-A, кодирующая мутантный вариант TRAIL DR5-A, содержит мутантный ген белка DR5-A/Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H (SEQ ID NO 9), и плазмидная ДНК pET-32a/DR5-B, кодирующая мутантный вариант TRAIL-DR5-B, содержит мутантный ген TRAIL DR5-B Y189N/R191K/Q193R/H264R/I266L/D269H (SEQ ID NO 10).
Плазмидную ДНК pET-32a/DR5-A или pET-32a/DR5-B трансформируют в компетентные бактериальные клетки штамма Escherichia coli BL21(DE3). Штамм Escherichia coli BL21(DE3)/pET-32a/DR5-A или Escherichia coli BL21(DE3)/pET-32a/DR5-B обеспечивает конститутивный синтез белка теоредоксин/DR5-А или теоредоксин/DR5-В соответственно; уровень экспрессии составляет не менее 1.5 г из 1 литра клеточной культуры. Выделение и очистку целевого белка проводят с помощью хроматографических методов (аффинной хроматографии на никелевой агарозе) после расцепления слитных белков тиоредоксин/DR5-А и тиоредоксин/DR5-В с помощью рекомбинантной каталитической субъединицы энтеропептидазы.
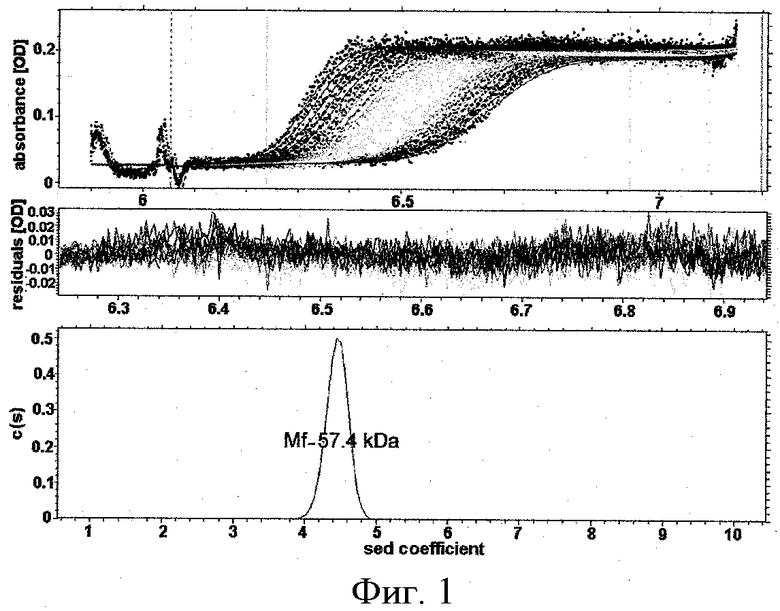
Исследуют тримеризации мутантных вариантов TRAIL с помощью аналитического ультрацентрифугирования (Фиг.1).
Определяют константы связывания мутантных вариантов TRAIL DR5-A и DR5-B с рецепторами DR4, DR5, DcR1, DcR2 и OPG методом поверхностного плазменного резонанса (Фиг.2, Табл.2). Мутантные варианты TRAIL DR5-A и DR5-B не связываются с рецепторами DcR1 и DR4. Кроме того, вариант DR5-B в 280 раз и в 223 раза хуже связывается с DcR2 и OPG рецепторами соответственно по сравнению с диким типом. Введение мутации D269H в аминокислотную последовательность мутантного белка DR5-8, содержащую мутации Y189N/R191K/Q193R/H264R/I266L/D267Q (мутантный белок DR5-A), приводит к увеличению сродства к рецептору DR5 в 3.6 раза, не затрагивая при этом его избирательные свойства к другим рецепторам. Данные поверхностного плазменного резонанса свидетельствуют, что мутантный вариант DR5-B отличается наибольшей избирательностью к DR5 рецептору (Табл.2).
Для сравнительного анализа противоопухолевой активности всех мутантных вариантов TRAIL исследуют биологическую активность этих белков (Фиг.3, Табл.3) на линиях раковых клеток с различными уровнями экспрессии рецепторов: клетки карциномы человека Hela (экспрессирующие DR4 и DR5 в равных количествах); клетки Т лейкемии человека Jurkat (в основном экспрессирующие DR5 рецептор); клетки лейкемии монобластов U937 (экспрессирующие в основном DR5 и DcR2 рецепторы) и клетки лейкемии миелоида К562 (экспрессирующие все 4 рецептора). В клетках HeLa мутантные варианты DR5-A и DR5-B индуцируют апоптоз несколько раз эффективнее по сравнению с диким типом, тогда как DR5-8 вариант уступает дикому типу. В клетках Jurkat DR5-A и DR5-B варианты индуцируют апоптоз более эффективно по сравнению с диким типом и DR4-8, DR5-8 или D269H вариантов. Наоборот, в DR4 ответственных клетках К562 DR4-8 вариант был также эффективен как дикий тип, тогда как DR5-8, DR5-A и DR5-B варианты демонстрируют сниженную активность. В этих клетках D269H вариант так же эффективен, как дикий тип, что указывает на его более низкую селективность по сравнению с DR5-A и DR5-B вариантами. Наконец, в клетках U937 цитотоксичная активность DR5-8, DR5-A и DR5-B вариантов значительно выше, чем у дикого типа, а эффективная доза (ЭД50) индукции апоптоза этими вариантами была уменьшена в 1.8, 3.0 и 3.4 раза соответственно. Данные таблицы 3 наглядно показывают, что противоопухолевая активность в полученных заявленным способом рекомбинантных препаратах в 2-3 раза выше, чем аналогичные свойства у известных ранее препаратов.
Таким образом, техническим результатом заявленного изобретения является получение нового препарата на основе рекомбинантного мутантного белка TRAIL DR5-A и DR5-B с высокой противоопухолевой активностью, значительно превышающей активность известных препаратов. Полученные соединения обладают повышенным сродством связывания с рецептором DR5, сильно пониженной эффективностью связывания с рецепторами DcR2 и OPG и практически не связываются с рецепторами DR4 и DcR1. Кроме того, в DR5 зависимых раковых клеточных линиях варианты TRAIL DR5-А и DR5-B несколько раз эффективнее вызывают апоптоз по сравнению как с диким типом, так и с уже известными DR5 избирательными мутантными вариантами DR5-8 и D269H. Получаемые препараты DR5-A и DR5-B с повышенной избирательностью к DR5 рецептору и высокой противоопухолевой активностью могут быть использованы для лечения DR5-зависимых опухолей, а также в качестве инструмента для исследования TRAIL опосредованных механизмов апоптоза. Получаемые вещества позволяют снизить дозу вводимых препаратов при лечении раковых заболеваний, что приводит к снижению стоимости лечения и негативных последствий для пациентов. Кроме того, благодаря высокой специфичности к рецептору смерти DR5 полученные препараты могут быть применены для лечения таких видов опухолей, которые резистентны к препарату дикого типа.
Изобретение иллюстрируется чертежами:
Фиг.1. Анализ аналитического ультрацентрифугирования мутантных вариантов DR5-A и DR5-B.
Препараты центрифугируют при 60000 rpm в стандартных 0.4 мл ячейках. Профили белков зарегистрированы после 1, 10, 20, 45, 54, 60, 74 и 86 мин при поглощении 280 нм. Посчитанные коэффициенты седиментации s20, w=3.69±0.04 утверждают содержание исключительно глобулярных тримерных молекул в препаратах.
Фиг.2. Сенсограммы связывания мутантных вариантов TRAIL с пятью рецепторами, полученные методом поверхностного плазменного резонанса (SPR). Пять лигандов (дикий тип TRAIL и DR5-8, D269H, DR5-A, DR5-B варианты) при концентрации 250 нМ одновременно наносят через 5 параллельных каналов 6×6 детекторного чипа иммобилизированных с DR4, DR5, DcR1, DcR2 и OPG рецепторами.
Фиг.3. Биологическая активность дикого типа и мутантных вариантов TRAIL на клеточных линиях HeLa, Jurkat, K562 и U937.
Выживаемость клеток определена после 24 часов инкубации с вариантами TRAIL. Для увеличения чувствительности клеток к TRAIL опосредованному апоптозу в культуральную среду для клеток Hela и U937 добавляют эметин 0.05 и 0.25 мкг/мл соответственно.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование мутантного гена белка TRAIL DR5-A
Для введения мутаций Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H в ген белка TRAIL дикого типа в составе плазмидного вектора рЕТ-32а используют метод сайт-направленного мутагенеза, основанный на полимеразной цепной реакции. Введение мутаций осуществляют в 3 этапа.
На первом этапе вводят мутации Y189N/R191K/Q193R в ген белка TRAIL дикого типа, находящийся в составе плазмидного вектора рЕТ-32а. Реакционная смесь для полимеразной цепной реакции содержит буфер с MgSO4 для Pfu ДНК-полимеразы (Fermentas, Литва), Pfu ДНК-полимеразу (Fermentas, Литва), смесь из 4-х дезоксинуклеотидтрифосфатов, плазмидную ДНК pET-32a/TRAIL, прямой (SEQ ID NO 1) и обратный (SEQ ID NO 2) олигонуклеотидные праймеры. Поверх реакционной смеси наслаивают минеральное масло. Проводят 25 циклов амплификации при следующих условиях: 1 минута при 95°C, 30 секунд при 95°C, 1 минута при 55°C, 14.5 минут при 68°C. Образование мутантной ДНК проверяют с помощью электрофореза в 1.5% агарозном геле. Для расщепления исходной метилированной плазмидной ДНК реакционную смесь обрабатывают рестриктазой Dpn I в течение 1 часа при 37°C. Для наработки мутантной ДНК проводят трансформацию бактериального штамма Escherichia coli XL-1 Blue реакционной смесью. Выращивают клетки в среде LB с ампициллином (100 мкг/мл) при 37°C и интенсивном перемешивании 250 об/мин в течение 18 часов, после чего выделяют плазмидную ДНК из клеточной биомассы. Наличие мутаций подтверждают определением нуклеотидной последовательности мутантной ДНК.
На втором этапе вводят мутации H264R/I266L/D267Q в ген TRAIL, содержащий мутации Y189N/R191K/Q193R, по вышеописанной схеме. Используют олигонуклеотидные праймеры SEQ ID NO 3 и SEQ ID NO 4. После второго этапа получают последовательность ДНК кодирующий мутантный вариант TRAIL DR5-8.
На третьем этапе вводят мутацию D269H в ген мутантного варианта DR5-8, содержащий мутации Y189N/R191K/Q193R/H264R/I266L/D267Q, по вышеописанной схеме. Используют олигонуклеотидные праймеры SEQ ID NO 5 и SEQ ID NO 6.
Результатом проделанной работы является рекомбинантная плазмидная ДНК рЕТ-32а, содержащая ген мутантного белка DR5-A с мутациями Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H (SEQ ID NO 9), кодирующая мутантный белок DR5-A (SEQ ID NO 9).
Пример 2.
Конструирование мутантного гена TRAIL DR5-B
Для конструирования мутантного гена белка DR5-B используют метод сайт-направленного мутагенеза, основанный на полимеразной цепной реакции.
Вводят мутации Q267D/D269H в ген мутантного варианта TRAIL DR5-8, содержащий мутации Y189N/R191K/Q193R/H264R/I266L/D267Q, находящийся в составе плазмидного вектора рЕТ-32а. Используют олигонуклеотидные праймеры SEQ ID NO 7 и SEQ ID NO 8. Реакционная смесь для полимеразной цепной реакции содержит буфер с MgSO4 для Pfu ДНК-полимеразы (Fermentas, Литва), Pfu ДНК-полимеразу (Fermentas, Литва), смесь из 4-х дезоксинуклеотидтрифосфатов, плазмидную ДНК, прямой (SEQ ID NO 1) и обратный (SEQ ID NO 2) олигонуклеотидные праймеры. Поверх реакционной смеси наслаивают минеральное масло. Проводят 25 циклов амплификации при следующих условиях: 1 минута при 95°C, 30 секунд при 95°C, 1 минута при 55°C, 14.5 минут при 68°C. Образование мутантной ДНК проверяют с помощью электрофореза в 1.5% агарозном геле. Для расщепления исходной метилированной плазмидной ДНК реакционную смесь обрабатывают рестриктазой Dpn I в течение 1 часа при 37°C. Для наработки мутантной ДНК проводят трансформацию бактериального штамма Escherichia coli XL-1 Blue реакционной смесью. Выращивают клетки в среде LB с ампициллином (100 мкг/мл) при 37°C и интенсивном перемешивании 250 об/мин в течение 18 часов, после чего выделяют плазмидную ДНК из клеточной биомассы. Наличие мутаций подтверждают определением нуклеотидной последовательности мутантной ДНК.
Результатом проделанной работы является рекомбинантная плазмидная ДНК рЕТ-32а, содержащая ген мутантного белка DR5-B с мутациями Y189N/R191K/Q193R/H264R/I266L/D269H (SEQ ID NO 10), кодирующая мутантный белок DR5-B (SEQ ID NO 10). Все известные рецептор-избирательные мутантные варианты представлены в Таблице 1.
Пример 3.
Экспрессия и очистка мутантных белков DR5-A и DR5-B
Экспрессия мутантных вариантов TRAIL DR5-A или DR5-B, находящегося в составе рекомбинантного плазмидного вектора рЕТ-32а, проводится в бактериальном штамме Escherichia coli BL21(DE3). Клетки трансформируют плазмидной ДНК, содержащей мутантный ген, выращивают в жидкой питательной среде LB с ампициллином (100 мкг/мл) при 37°C и интенсивном перемешивании (230 об/мин) в течение 18 часов. После этого клетки инокулируют в жидкую среду ТВ с ампициллином (100 мкг/мл) и индуцируют экспрессию добавлением 0.02 мМ IPTG (изопропил_β-D-1-тиогалактопиранозид). Культуру клеток выращивают при 27°C в течение 21 часа. После этого клетки осаждают центрифугированием при 4000 g и 4°C в течение 15 минут, промывают в буфере, содержащем 500 мМ NaCl и 25 мМ NaH2PO4 (pH 7.4), снова осаждают и замораживают при -80°C для хранения.
Разрушение клеток проводят в буфере, содержащем 25 мМ имидазола, 500 мМ NaCl и 25 мМ NaH2PO4 (pH 7.4), продавливанием под давлением на установке «French press» (Spectronic Instruments, Inc., США). Разрушенную клеточную массу осаждают центрифугированием при 28000 об/мин в течение 40 мин. Растворимую фракцию наносят на хроматографическую колонку Ni-NTA High Performance. Слитные белки Trx-DR5-A или Trx-DR5-B элюируют в буфере, содержащем 25 мМ NaH2PO4, 500 мМ NaCl, 500 мМ имидазола (pH 7.4). Очищенные препараты диализуют против буфера, содержащего 50 мМ Tris/HCl (pH 8.0), 80 мМ NaCl и 1 мМ ДТТ при 4°C в течение 18 часов. После диализа белки Trx-DR5-A или Trx-DR5-B расщепляют рекомбинантной легкой цепью человеческой энтеропептидазы в течение 18 часов при комнатной температуре. После расщепления остаточную активность энтеропептидазы удаляют на колонке с STI (soybean trypsin inhibitor, соевый ингибитор трипсина)-агарозой. Мутантные белки DR5-A или DR5-В отделяют от тиоредоксина на колонке с никелевой агарозой. На последней стадии препараты диализуют против буфера, содержащего 50 мМ фосфата натрия (pH 7.5) и 150 мМ NaCl, после чего стерилизуют через фильтр и хранят при 4°C для дальнейшего использования. На всех этапах очистки белок анализируют спектрофотометрически и с помощью электрофореза в 12% полиакриламидном геле.
В результате получают очищенные рекомбинантные мутантные варианты TRAIL DR5-A (SEQ ID NO 9) или DR5-B (SEQ ID NO 10).
Пример 4.
Определение связывания мутантных вариантов TRAIL DR5-A или DR5-B с рецепторами DR4, DR5, DcR1, DcR2 и OPG методом поверхностного плазменного резонанса
Константы диссоциации (KD) для прямого связывания мутантных белков DR5-A или DR5-B с иммобилизованными рецепторами определяют методом поверхностного плазменного резонанса на установке ProteOn XPR36 Protein Interaction Array System (BioRad). Пять рецепторов DR4, DR5, DcR1, DcR2 и OPG одновременно связывают с поверхностью сенсорного 6×6-канального чипа в количестве 6000-8000 резонансных единиц. Чип активируют в течение 120 сек при помощи смеси гидрохлорида 1-этил-3-(3-диметиламинопропил) карбодиимида (0.13 М) и N-гидроксилсульфосукцинимида (0.03 М). По 2 мкг каждого рецептора в 10 мМ натрий-ацетатном буфере (рН 5.0) наносят на активированные каналы. Реакцию иммобилизации завершают 1 М этаноламином (рН 8.5). В качестве контроля остающийся канал не связывают с белком. Сенсограммы записывают одновременно для 5 концентраций высокоочищенного тримерного белка DR5-A или DR5-B от 15 до 250 нМ. 300 мкл белка DR5-A или DR5-B наносят со скоростью 100 мкл/мин при 25°C, используя фосфатный буфер (рН 7.4) с добавлением 0.005% Tween-20. Связывание лиганда с рецепторами наблюдают в реальном времени. В промежутках между нанесением вариантов TRAIL поверхность рецептора регенерируют с помощью 3 М ацетата натрия (рН 5.2). Для определения значений КD применяют различные концентрации вариантов TRAIL в зависимости от их сродства к различным рецепторам. Сенсограммы анализируют с помощью нелинейного регрессивного анализа согласно модели связывания 1:1 программного обеспечения ProteOn Manager Version 2.0.1 (BioRad) для определения скоростей диссоциации. Константы диссоциации KD вычисляют из скоростей диссоциации KD=koff/kon при пяти различных концентрациях. Для связывания мутантного варианта TRAIL DR5-B с рецепторами DcR2 и OPG значения KD вычисляют согласно 1:1 изотерме связывания Ленгмюра и анализируют в виде нелинейной кривой с помощью того же программного обеспечения.
Анализ сенсограмм показал, что мутантные варианты TRAIL DR5-A и DR5-B не связываются с рецепторами DR4 и DcR1. Константа диссоциации белка DR5-A с рецептором DR5 в 3.5 раза ниже, чем мутантного варианта DR5-8, содержащего мутации Y189N/R191K/Q193R/H264R/I266L/D267Q. Аффинность мутантного белка DR5-B с рецепторами DcR2 и OPG снижено в 280 и 223 раза соответственно по сравнению с TRAIL дикого типа (Таблица 2).
Пример 5.
Исследование действия мутантных вариантов TRAIL DR5-A и DR5-B на линиях раковых клеток HeLa, Jurkat, K562 и U937
Раковые линии клеток Hela, Jurkat, U937 и K562 культивируют в жидкой питательной среде RPMI 1640, содержащей 10% (по объему) бычьей эмбриональной сыворотки, 2 мМ глутамина, 100 ед./мл стрептомицина и 100 ед./мл пенициллина при 37°C и 5% СО2. Разведения мутантных белков DR5-A и DR5-B производят в культуральной среде. Для определения количества живых клеток клетки рассаживают на 96-луночные планшеты (1×105 клеток/лунку) и инкубируют с серийными разведениями мутантных белков DR5-A или DR5-B в течение 24 часов при 37°C и 5% СО2. После этого добавляют реагент МТТ (3-[4,5-диметилтиазол-2]-2,5-дифенил тетразолиумбромид) в окончательной концентрации 0.5 мг/мл. Количество живых клеток определяют спустя 3 часа инкубации путем измерения поглощения при 570 нм на установке Multiscan. Линии клеток цервикальной карциномы HeLa и HeLa Bcl-2 культивируют в жидкой питательной среде DMEM, содержащей 10% (по объему) бычьей эмбриональной сыворотки, 2 мМ глутамина, 100 ед./мл стрептомицина и 100 ед./мл пенициллина при 37°C и 5% СО2. В некоторых экспериментах вместе с мутантными белками DR5-A или DR5-B добавляют ингибитор синтеза белка эметин (0.3 мкг/мл), ингибитор активновых микрофиламентов цитохалазин Д (1 мкг/мл) или ингибитор роста микротрубочек таксол (10 мкМ). Процент апоптоза определяют по количеству клеток с фрагментированными ядрами в препаратах, обработанных красителем Хехст в концентрации 1 мкг/мл в течение 30 минут.
нг/мл
нг/мл
нг/мл
нг/мл
Подсчет конденсированных и фрагментированных ядер (около 500 клеток на 1 образец) осуществляют под флуоресцентным микроскопом. Результаты исследования представлены на Фис.3 и в Таблице 3.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения рекомбинантного противоопухолевого модифицированного белка DR5-B человека | 2018 |
|
RU2687435C1 |
| Способ подавления роста опухолей генно-модифицированным вариантом цитокина TRAIL | 2019 |
|
RU2727059C1 |
| Белковая конструкция на основе рецептор-специфичного мутантного варианта противоопухолевого цитокина TRAIL в виде гибридного белка с пептидом, специфичным к интегрину αvβ3, для терапии солидных опухолей | 2022 |
|
RU2802488C1 |
| СПОСОБ ИНДУКЦИИ ГИБЕЛИ ОПУХОЛЕВЫХ КЛЕТОК | 2015 |
|
RU2620165C2 |
| АПОПТОТИЧЕСКАЯ ЧУВСТВИТЕЛЬНОСТЬ К Apo2L/TRAIL ПУТЕМ ТЕСТИРОВАНИЯ ЭКСПРЕССИИ GalNac-T14 В КЛЕТКАХ/ТКАНЯХ | 2006 |
|
RU2416097C2 |
| Многофункциональные гибридные рекомбинантные белковые препараты для терапии опухолевых заболеваний | 2022 |
|
RU2801367C1 |
| АНАЛИЗЫ И СПОСОБЫ ПРИМЕНЕНИЯ БИОМАРКЕРОВ | 2006 |
|
RU2409817C2 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| АНАЛИЗЫ И СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ БИОМАРКЕРЫ | 2005 |
|
RU2410438C2 |
| АНТИТЕЛО, ОБЛАДАЮЩЕЕ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2298013C2 |


Изобретение относится к области биотехнологии, конкретно, к получению рекомбинантного мутантного TRAIL человека и может быть использовано для исследования TRAIL опосредованных механизмов апоптоза, а также в качестве терапевтического средства для лечения DR5-зависимых опухолей. В ген TRAIL человека, находящийся в составе плазмидной ДНК рЕТ32а, вводят мутации Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H или Y189N/R191K7Q193R/H264R/I266L/D269H с последующей трансформацией штамма Escherichia coli BL21(DE3) полученной рекомбинантной плазмидной ДНК, экспрессией и выделением целевого белка. Изобретение позволяет получить рекомбинантный мутантный TRAIL человека с высокой противоопухолевой активностью. 3 ил., 3 табл.
Способ получения рекомбинантного мутантного белка TRAIL человека с высокой противоопухолевой активностью, включающий введение мутаций Y189N/R191K/Q193R/H264R/I266L/D267Q/D269H или Y189N/R191K/Q193R/H264RA266L/D269H в ген TRAIL человека, находящийся в составе плазмидной ДНК рЕТ-32а, с последующей трансформацией штамма Escherichia coli BL21(DE3) полученной рекомбинантной плазмидной ДНК, экспрессию и выделение целевого белка.
| ЯГОЛОВИЧ А.В | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ЯГОЛОВИЧ А.В | |||
| и др | |||
| Высокий уровень экспрессии и очистка мутантного варианта | |||
Авторы
Даты
2010-11-27—Публикация
2009-07-29—Подача