Область техники, к которой относится изобретение
Настоящее изобретение относится к кристаллическим формам, включая соли и полиморфные модификации соединений, полезных при лечении чувствительных к соединениям тетрациклина состояний. В частности настоящее изобретение относится к кристаллическим формам (4S,4AS,5AR,12AS)-4-7-бис(диметиламино)-9{[(2,2-диметилпропил)амино]метил}-3,10,12,12А-тетрагидрокси-1,11-диокси-1,4,4А,5,5А,6,11,12А-октагидротетрацен-2-карбоксамид(9-(2,2-диметил-пропил-аминометил)-миноциклина).
Уровень техники
Развитие антибиотиков тетрациклина было прямым результатом систематического скрининга анализов почвы, собранных во многих частях мира для доказательства наличия микроорганизмов, способных к производству бактерицидных и/или бактериостатических соединений. Первое из этих новых соединений было представлено в 1948 г с названием хлортетрациклин. Два года спустя, обнаружили окситетрациклин. Установление химической структуры этих соединений подтвердило их похожесть и дало аналитическое основание для получения третьего члена этой группы в 1952 г - тетрациклина. Новое семейство соединений тетрациклина, без присоединенной к кольцу метиловой группы, представленной в более ранних соединениях тетрациклина, было получено в 1957 г и стало общедоступным в 1967 г; к 1972 г начал использоваться миноциклин.
В последнее время усилия исследователей сосредоточились на разработке новых антибиотиков - соединений тетрациклина, эффективных при различных терапевтических условиях и путях введения. Также были исследованы новые аналоги тетрациклина, которые, как могло оказаться, обладали равной или большей эффективностью, чем первоначально представленные соединения тетрациклина. Примеры раскрыты в патентах США с номерами 2,980,584; 2,990,331; 3,062,717; 3,165,531; 3,454,697; 3,557,280; 3,674,859; 3,957,980; 4,018,889; 4,024,272 и 4,126,680. Эти патенты являются репрезентативными для ряда фармацевтически активного тетрациклина и соединений - аналогов тетрациклина.
Исторически, вскоре после их открытия и внедрения, было найдено, что тетрациклины являются очень эффективными фармакологическими средствами против риккетсий; грамположительных и грамотрицательных бактерий и надежным средством против венерической лимфогранулемы, конъюнктивита с включениями и орнитоза. Таким образом, тетрациклины стали известными как антибиотики "широкого спектра". С последующим установлением их in vitro антимикробной активности, эффективности в экспериментальных инфекциях и фармакологических свойств, тетрациклины как класс быстро стали широко используемыми в терапевтических целях. Однако, это широко распространение использования тетрациклинов и для серьезных и для незначительных заболеваний и нарушений непосредственно привело к появлению устойчивости к этим антибиотикам даже среди очень восприимчивых видов бактерий, как симбиотических, так и патогенных (например, пневмококки и сальмонелла). Увеличение количества устойчивых к тетрациклину организмов привело к общему снижению использования тетрациклинов и соединений - аналогов тетрациклина в качестве выбираемых антибиотиков.
У каждого фармацевтического соединения есть оптимальная терапевтическая концентрация в крови и смертельная концентрация. Биодоступность соединения определяет количество дозировки в составе лекарственного средства, необходимом для получения идеального уровня в крови. Если лекарственное средство может кристаллизоваться как две или больше полиморфных модификаций (полиморфов), отличающихся по биодоступности, оптимальная доза будет зависеть от полиморфной модификации, присутствующей в композиции. Некоторые лекарства обладают небольшой разницей между терапевтическими и смертельными концентрациями. Хлорамфеникол-3-пальмитат, например, является антибиотиком широкого спектра действия, который может кристаллизоваться, по крайней мере, в три полиморфные модификации и одну аморфную форму. Наиболее устойчивая модификация, А, доступна в продаже. Различие в биоактивности между этим полиморфом и другой модификацией, В, является смертельным фактором, таким образом, создавая возможность фатальных передозировок соединения если невольно назначается как модификация В из-за изменений во время обработки и/или хранения. Поэтому, регулирующие агентства, такие как Управление по контролю за продуктами и лекарствами Соединенных Штатов, начали помещать трудно контролируемые группы в полиморфное содержание активного компонента в твердых формах дозировки. В общем, для препаратов, которые существуют в полиморфных модификациях, если что-нибудь кроме чистого, термодинамически предпочтительного полиморфа должно быть продано, регулирующее агентство может потребовать контроля каждой партии. Таким образом, становится важным и по медицинским и по коммерческим причинам произвести и продать чистое лекарственное средство в его наиболее термодинамически устойчивой полиморфной модификации, по существу не содержащей других кинетически предпочтительных полиморфов.
Например, формы соли соединений, и полиморфные модификации свободного соединения или соли, как известно в фармацевтической области изменяют, например, растворимость, скорость растворения, биодоступность, химическую и физическую стабильность, текучесть, способность к манипулирвоанию и сжимаемость соединения, так же как и безопасность и эффективность фармацевтических продуктов, основанных на данном соединении (см., например, Knapman, Modern Drug Discovery, 2000, 3(2): 53).
Соответственно, идентификация модификации соли или свободного основания соединения с оптимальными физическими и химическими свойствами улучшат развитие соединений тетрациклина как фармацевтических препаратов. Самые полезные из таких физических и химических свойств включают легкую и воспроизводимую подготовку, кристаллизацию, негигроскопичность, водную растворимость, стабильность к видимому и ультрафиолетовому излучению, низкий процент разложения под ускоренными условиями стабильности температуры и влажности, низкому проценту изомеризации между изомерными формами и безопасность для продолжительного введения людям.
Раскрытие изобретения
В одном воплощении изобретение относится, по крайней мере частично, к устойчивой твердой форме, такой как кристаллическая форма, аминоалкильного соединения тетрациклина, охватываемого формулой 1 (далее Соединение 1):
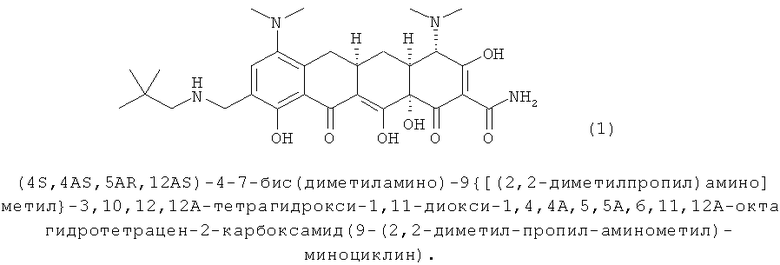
В другом воплощении изобретение относится, по крайней мере частично, к соли Соединения 1 и соляной кислоты. В другом воплощении изобретение относится, по крайней мере частично, к тозилату (р-толуолсульфонату) Соединения 1. В другом воплощении изобретение относится, по крайней мере частично, к мезилату Соединения 1.
В другом воплощении изобретение относится, по крайней мере частично, к устойчивой кристаллической форме Соединения 1.
В другом воплощении изобретение относится, по крайней мере частично, к устойчивой кристаллической форме соли Соединения 1. Например, устойчивая кристаллическая форма соли является устойчивой кристаллической формой тозилата, солянокислой соли или мезилата Соединения 1.
В другом воплощении изобретение относится, по крайней мере частично, к полиморфной модификации Соединения 1.
В другом воплощении изобретение относится, по крайней мере частично, к полиморфной модификации соли Соединения 1.
Например, изобретение относится к полиморфной модификации тозилата Соединения 1. Изобретение относится, в частности к 1-ой полиморфной модификации Соединения 1. Изобретение относится, в частности ко 2-ой полиморфной модификации Соединения 1. Изобретение относится, в частности к 3-ей полиморфной модификации Соединения 1.
Например, 1-ая полиморфная модификация тозилата Соединения 1 обладает пиками дифракции рентгеновских лучей на порошке при приблизительно 8,06, 13,02, и 18,83 °2θ при использовании Cu Кα излучения. В некоторых воплощениях изобретения 1-ая полиморфная модификация тозилата Соединения 1 обладает пиками дифракции рентгеновских лучей на порошке при приблизительно 8,06, 11,41, 13,02, 18,83, 20,54 и 24,53 °2θ при использовании Cu Кα излучения. В некоторых воплощениях изобретения 1-ая полиморфная модификация тозилата Соединения 1 обладает пиками дифракции рентгеновских лучей на порошке при приблизительно 5,60, 8,06, 8,57, 11,41, 13,02, 15,58, 18,83, 20,54 и 24,53 °2θ при использовании Cu Кα излучения.
Например, 1-ая полиморфная модификация тозилата Соединения 1 устойчива при температуре в диапазоне от приблизительно 0°С до приблизительно 70°С. В некоторых воплощениях 1-ая полиморфная модификация тозилата Соединения 1 является устойчивой при температуре в диапазоне от приблизительно 5°С до приблизительно 50°С. В некоторых воплощениях 1-ая полиморфная модификация тозилата Соединения 1 является устойчивой при температуре в диапазоне от приблизительно 20°С до приблизительно 30°С.
1-ая полиморфная модификация тозилата Соединения 1 может быть получена с помощью кристаллизации тозилата указанного Соединения 1 из изопропанола.
Например, 2-ая полиморфная модификация тозилата Соединения 1 обладает пиками дифракции рентгеновских лучей на порошке при приблизительно 7,82, 11,88, 16,12 и 21,46 °2θ при использовании Cu Кα излучения.
Например, 3-я полиморфная модификация тозилата Соединения 1 обладает пиками дифракции рентгеновских лучей на порошке при приблизительно 5,11, 8,89, 10,34, 11,76 и 15,60 °2θ при использовании Cu Кα излучения.
В еще одном воплощении изобретение включает фармацевтические композиции, содержащие кристаллическую форму Соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель.
Например, фармацевтическая композиция соединений по изобретению включает композицию, содержащую полиморфную форму Соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель.
В другом воплощении фармацевтическая композиция соединений по изобретению включает соль Соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель. Например, соль может быть солянокислой солью, тозилатом или мезилатом.
В одном воплощении фармацевтическая композиция соединений по изобретению включает полиморфную форму соли Соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель. Например, полиморфная модификация может быть полиморфной модификацией тозилата, солянокислой соли или мезилата Соединения 1.
В некоторых воплощениях фармацевтическая композиция включает полиморфную модификацию Соединения 1 или его соли в чистом виде.
В другом воплощении фармацевтическая композиция изобретения включает полиморфную модификацию тозилата Соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель. Например, полиморфная модификация может быть 1-ой модификацией, 2-ой модификацией или 3-ей полиморфной модификацией тозилата Соединения 1.
В некоторых воплощениях фармацевтическая композиция включает полиморфы тозилата, солянокислой соли или мезилата Соединения 1 в чистой форме.
В другом аспекте изобретения соль Соединения 1 более устойчива, чем свободное основание Соединения 1.
В другом воплощении изобретение включает способ получения устойчивой кристаллической формы Соединения 1.
В другом воплощении изобретение включает способ получения устойчивой кристаллической формы соли Соединения 1. Например, устойчивой кристаллической формой может быть кристаллический тозилат, солянокислая соль или мезилат Соединения 1.
В другом воплощении изобретение включает способ получения полиморфной модификации соли Соединения 1. Например, полиморфной модификацией может быть полиморфная модификация тозилата, солянокислой соли или мезилата Соединения 1.
В другом воплощении изобретение включает способ получения полиморфной модификации тозилата Соединения 1. Например, полиморфная модификация может быть 1-ой модификацией, 2-ой модификацией или 3-ей полиморфной модификацией тозилата Соединения 1.
В одном воплощении изобретение включает способ для изготовления 1-ой полиморфной модификации тозилата Соединения 1, в котором способ включает: объединение Соединения 1 с растворителем для того, чтобы получить суспензию и добавление р-толуолсульфоновой кислоты. Например, растворитель может быть спиртовым растворителем, таким как изопропанол. Р-толуолсульфоновая кислота добавляется в количестве от 25 до 75 мас.% относительно количества указанного Соединения 1, например, от 25 до 50 мас.%, от 30 до 40 мас.% или 33 мас.% относительно количества указанного Соединения 1. Например, р-толуолсульфоновая кислота используется в форме моногидрата р-толуолсульфоновой кислоты.
Например, суспензия нагревается до добавления р-толуолсульфоновой кислоты.
Например, суспензия перемешивается после добавления р-толуолсульфоновой кислоты. Например, перемешивание проводится при температуре в диапазоне от 20 до 25°С. Например, перемешивание проводится в течение 10-24 часов.
Например, суспензия высушивается. Например, содержание воды в супернатанте указанной суспензии находится в диапазоне от 0,2 до 1,0 мг/мл, или в диапазоне от 0,4 до 0,8 мг/мл.
В еще одном воплощении изобретение включает способ изготовления 1-ой полиморфной модификации тозилата Соединения 1, в котором способ включает: изготовление раствора Соединения 1 в растворителе или комбинации растворителей; и добавление раствора р-толуолсульфоновой кислоты в растворителе или комбинации растворителей.
Например, растворителем может быть спиртовой растворитель, такой как метанол, этанол или изопропанол. Например, комбинация растворителей включает спиртовой растворитель. Например, комбинация растворителей дополнительно включает второй спиртовой растворитель. Например, комбинация растворителей включает этанол и изопропанол. Например, комбинация растворителей дополнительно включает антирастворитель, такой как кетон, эфир или сложный эфир. Например, эфир является, но не ограничен, метил-трет-бутиловым эфиром. Например, комбинация растворителей включает спиртовой растворитель и антирастворитель. Например, комбинация растворителей включает метанол и метил-трет-бутиловый эфир.
Например, р-толуолсульфоновая кислота используется в количестве от 25 до 75 мас.%, от 30 до 50 мас.%, от 35 до 45 мас.%, или 40 мас.% относительно количества указанного Соединения 1. Например, р-толуолсульфоновая кислота используется в форме моногидрата р-толуолсульфоновой кислоты.
Например, раствор получают при температуре в диапазоне от 0 до 60°С, при температуре в диапазоне от 15 до 45°С или при температуре в диапазоне от 20 до 25°С.
Например, раствор нагревается после получения. Например, раствор поддерживают при температуре в диапазоне от 20 до 50°С, или приблизительно при 45°С.
Например, способ дополнительно включает добавление затравочного кристалла монотозилата Соединения 1 для получения суспензии. Суспензия может перемешиваться в течение от 10 до 24 часов или в течение приблизительно 22 часов. Суспензия может перемешиваться при температуре в диапазоне от 15 до 45°С или приблизительно при 20°С. Суспензия может быть высушена. Например, содержание воды в суспензии находится в диапазоне от 1 до 10 мас.%, или в диапазоне от 2 до 6 мас.% или приблизительно 3 мас.%.
В другом воплощении изобретение включает способ получения 1-ой полиморфной модификации тозилата Соединения 1, который включает: растворение свободного основания Соединения 1 в первом растворителе или комбинации растворителей, чтобы сформировать первый раствор, растворение р-толуолсульфоновой кислоты во втором растворителе или комбинации растворителей, чтобы сформировать второй раствор и объединение указанных первого и второго растворов с формированием третьего раствора.
В одном воплощении первый и второй растворитель или комбинация растворителей могут быть одинаковыми или различными. В другом воплощении растворитель может быть спиртовым растворителем, таким как метанол, этанол или изопропанол. В другом воплощении комбинация растворителей представляет собой комбинацию двух спиртовых растворителей, включая, но не ограничиваясь этанолом и изопропанолом. В предпочтительном воплощении объемное соотношение этанола и изопропанола составляет 2 к 1. В еще одном воплощении комбинация растворителей представляет собой комбинацию, которая включает, но не ограничена, спиртовой растворитель и антирастворитель (например, кетон, эфир, сложный эфир, и т.д.). Например, комбинация растворителей представляет собой комбинацию, которая включает, но не ограничена, метанол и метил-трет-бутиловый эфир. В предпочтительном воплощении объемное соотношение метанола и метил-трет-бутилового эфира составляет 1 к 1,2.
В другом воплощении способ дополнительно включает добавление 1-ой полиморфной модификации тозилата Соединения 1 к третьему раствору с формированием четвертого раствора. Например, 1-ая полиморфная модификация тозилата является затравочным кристаллом. В некоторых воплощениях четвертый раствор формирует суспензию после перемешивания. Суспензия может быть отмыта с растворителем или комбинацией растворителей, которые могут быть одинаковыми или отличаться от первого растворителя или комбинации растворителя, или второго растворителя или комбинации растворителей. Суспензия может быть высушена.
В другом воплощении изобретение относится к чистой композиции, включающей Соединение 1, причем композиция является чистой на приблизительно 90÷100 мас.%, предпочтительно 95÷100 мас.%, более предпочтительно 98÷100 мас.% или 99÷100 мас.%; например, примеси присутствуют в количестве менее чем приблизительно 10 мас.%, менее чем приблизительно 5 мас.%, менее чем приблизительно 2 мас.% или менее чем приблизительно 1 мас.%. Такие примеси включают, например, продукты разложения, окисленные продукты, эпимеры, растворители и/или другие нежелательные примеси.
В еще одном воплощении изобретение включает способ лечения тетрациклин чувствительных состояний у субъекта введением субъекту эффективного количества кристаллической формы Соединения 1. Например, субъект является человеком.
В еще одном воплощении изобретение включает способ лечения тетрациклин чувствительного состояния у субъекта введением субъекту эффективного количества устойчивой соли Соединения 1. Например, устойчивая соль представляет собой тозилат, солянокислую соль или мезилат Соединения 1.
В еще одном воплощении изобретение включает способ лечения тетрациклин чувствительного состояния у субъекта введением субъекту эффективного количества полиморфной модификации Соединения 1.
В еще одном воплощении изобретение включает способ лечения тетрациклин чувствительного состояния у субъекта введением субъекту эффективного количества полиморфной модификации соли Соединения 1. Например, полиморфная модификация может быть полиморфной модификацией тозилата, солянокислой соли или мезилата Соединения 1.
В еще одном воплощении изобретение включает способ лечения тетрациклин чувствительного состояние у субъекта введением субъекту эффективного количества полиморфной модификации тозилата Соединения 1. Например, полиморфная модификация тозилата может быть 1-ой модификацией, 2-ой модификацией или 3-ей полиморфной модификацией тозилата Соединения 1.
Например, тетрациклин чувствительное состояние является бактериальной инфекцией. Бактериальная инфекция может быть связана с грамположительными или грамотрицательными бактериями. В некоторых воплощениях бактериальная инфекция связана с Е.coli, S.aureus или Е.faecalis.
В некоторых воплощениях бактериальная инфекция устойчива к другим антибиотикам тетрациклина, включающим, не ограничивая, тетрациклин, миноциклин, доксициклин, санциклин, хлортетрациклин, демеклоциклин, окситетрациклин, хелокардин (антибиотик М319), ролитетрациклин, лимециклин, метациклин, эпициклин, кломоциклин, пипациклин, мепициклин, меглуциклин, гуамциклин, пенимоциклин и этамоциклин.
Соединения-антибиотики тетрациклинового ряда, как известно, обладают низкой стабильностью в твердой фазе в форме свободного основания. Одно из таких некристаллических соединений - аналогов тетрациклина, (4S,4AS,5AR,12AS)-4-7-бис(диметиламино)-9-{[(2,2-диметилпропил)амино]метил}-3,10,12,12А-тетрагидрокси-1,11-диоксо-I,4,4А,5,5А,6,II,12А-октагидротетрацен-2-карбоксамид (Соединение 1; MW=556,66, MF=C29H40N4O7), обладает низкой стабильностью в твердой фазе при воздействии воздуха, света и/или влажности.
В частности, Соединение 1 является желтым аморфным твердым веществом, которое нестабильно при температурах выше 0°С и при воздействии воздуха. Соединение 1 должно храниться при температурах ниже 0°С с минимальным воздействием воздуха, света и влажности на твердую фазу. Вне этих ограничительных условий воздействия Соединение 1 разлагается с выделением продуктов разложения, включающих продукты разложения на воздухе 2, 3 и 4, так же как 4-эпиизомера 5.
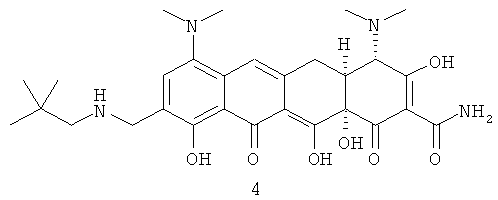
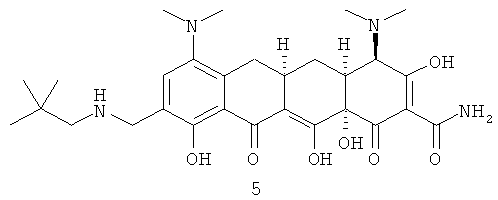
До настоящего изобретения не были известны никакие устойчивые кристаллические формы или устойчивые кислые кристаллические соли Соединения 1.
Настоящее изобретение относится к кристаллической форме Соединения 1, солям Соединения 1, полиморфным модификациям Соединения 1 или полиморфным модификациям солей Соединения 1; фармацевтическим композициям, включающим кристаллические формы, соли, полиморфные модификации или полиморфные модификации солей Соединения 1; способам получения кристаллических форм, солей, полиморфных модификаций или полиморфных модификаций солей Соединения 1; а также к способам их использования для лечения чувствительных к тетрациклину состояний.
1. Твердые Формы Соединений
Соединение 1 является соединением тетрациклина. Термин "соединение тетрациклина" включает множество соединений с подобной тетрациклину кольцевой структурой. Примеры соединений тетрациклина включают: тетрациклин, хлортетрациклин, окситетрациклин, демеклоциклин, метациклин, санциклин, доксициклин и миноциклин.
Свободное основание и определенные фармацевтически приемлемые соли Соединения 1 описаны в американской заявке номер 10/786,881, соответствующей американской публикации номер 2005/0026876 AI. В данных документах нет никакого раскрытия или предположения кристаллических форм Соединения 1, или что любая из описанных форм солей превосходит другие, как определено списком свойств, описанных выше.
Таким образом, настоящее изобретение относится к потребности в улучшенных соединениях тетрациклина и потребности в улучшенных формах твердой фазы соединений тетрациклина для производства и биодоступности.
Форма твердого состояния соединения тетрациклина, Соединения 1, может быть кристаллической формой. Кристаллическая форма соединения может быть свободным основанием. Могут быть получены кристаллические формы различных солей свободного основания. Примеры кислот, которые могут использоваться для преобразования свободного основания в соль включают, но не ограничены, HCl, р-толуолсульфоновая кислота, трифторуксусная кислота, метилсульфоновая кислота, бензолсульфоновая кислота и уксусная кислота.
Нейтральные формы соединений могут быть восстановлены контактированием соли с основанием или кислотой и выделением родительского соединения обычным образом. Родительская форма соединения может отличаться от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях.
Как описано в настоящем изобретении, был разработан способ, которым могут быть получены различные кристаллические формы Соединения 1. Более конкретно, изобретатели показали, что полученная кристаллическая форма главным образом зависит от природы растворителя, используемого в способе. В рамках данного изобретения термин "кристаллическая форма" относится или к полиморфной модификации или к неаморфной форме, без различия. "Полиморфная модификация" относится к упорядоченной структуре, включающей только молекулы растворенного вещества и имеющей характерные кристаллические особенности.
Термины "полиморфы" и "полиморфные модификации" и связанные с ними термины в рамках настоящего изобретения относятся к кристаллическим формам одной и той же молекулы, и у различных полиморфов могут быть различные физические свойства такие как, например, температура плавления, теплота плавления, растворимость, нормы растворения и/или колебательные спектры в результате упаковки или конформации молекул в кристаллической решетке. Различия в физических свойствах, показанные полиморфными модификациями, изменяют фармацевтические параметры, такие как устойчивость при хранении, сжимаемость и плотность (важные в формировании и производстве продукта) и норма растворения (важный фактор для биодоступности). Различия в стабильности могут быть результатом изменений в химической реакционноспособности (например, различном окислении, так, что дозированная форма обесцвечивается более быстро в случае когда состоит из одного полиморфа чем в случае, когда состоит из другого полиморфа) или механических свойствах (например, таблетки разрушаются на хранении, поскольку кинетически предпочтительный полиморф преобразовывается в термодинамически более устойчивый полиморф) или и того и другого (например, таблетки одного полиморфа являются более склонными к распаду при высокой влажности). В результате различий растворимости/растворения, в крайних случаях, некоторые полиморфные превращения могут закончиться нехваткой потенции или, наоборот, наличием токсичности. Кроме того, физические свойства кристаллов могут иметь большое значение в процессе получения, например, один полиморф более склонен к формированию сольватов или может быть более сложным для фильтрования и отмывания от содержащихся примесей (то есть, форма и распределение частиц по размерам могут быть различными у разных полиморфных модификаций).
Полиморфные модификации молекулы могут быть получены многими способами известными в уровне техники. Такие способы включают, но не ограничены, перекристаллизацию расплава, охлаждение расплава, перекристаллизация растворителя, десольватация, быстрое испарение, быстрое охлаждение, медленное охлаждение, диффузия паров и сублимация.
Методики для характеристики полиморфов включают, но не ограничены, дифференциальную сканирующую калориметрию (DSC), дифракцию рентгеновских лучей на порошке (XRPD), рентгеновскую дифрактометрию монокристаллов, вибрационную спектроскопию, например, IR. и рамановская спектроскопия, ЯМР твердой фазы, оптическую микроскопию с нагреванием, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ площади поверхности, исследования растворимости и исследования растворения.
Термин, "сольват", в рамках настоящего изобретения, относится к кристаллической форме вещества, которая содержит растворитель. Термин "гидрат" относится к сольвату в котором растворителем является вода.
Десольватированный сольват это кристаллическая форма вещества, которая может быть получена только удалением растворителя из сольвата.
Термин, "аморфная форма", в рамках настоящего изобретения, относится к некристаллической форме вещества.
В рамках настоящего изобретения, термин "чистый" означает чистоту соединения приблизительно 90÷100 мас.%, предпочтительно 95÷100 мас.%, более предпочтительно 98÷100 мас.% или 99÷100 мас.%; например, примеси присутствуют в количестве меньше чем приблизительно 10 мас.%, меньше чем приблизительно 5 мас.%, меньше чем приблизительно 2 мас.% или меньше чем приблизительно 1 мас.%. Такие примеси включают, например, продукты разложения, продукты окисления, эпимеры, растворители и/или другие нежелательные примеси.
В рамках настоящего изобретения соединение "устойчиво", когда существенное количество продуктов разложения не наблюдается при постоянных условиях влажности, воздействия света и температурах выше чем 0°С в течение четырех недель. Соединение, как полагают, неустойчиво в определенных условиях, когда появляются примеси разложения или процент существующих примесей начинает расти. Увеличение разложения как функция от времени важно в определении стабильности соединения.
Все диапазоны, сформулированные в рамках настоящего изобретения, предназначены для того, чтобы охватить указанные результаты диапазона так же как всех включенных значений и диапазонов, включая не конкретно сформулированные.
Настоящее изобретение относится к кристаллическим формам, солям и полиморфным модификациям Соединения 1, композициям, включающим кристаллические формы, соли и полиморфные модификации по отдельности или в комбинации с другими активными ингредиентами, способам получения кристаллических форм, солей и полиморфных модификаций и способам их использования в модуляции тетрациклин-чувствительных состояний. Не намереваясь быть связанными любой специфической теорией действия, устойчивость при хранении, сжимаемость, плотность или свойства растворения кристаллических форм, солей и полиморфных модификаций являются полезными для производства, технологии изготовления и биодоступности соединений тетрациклина.
Предпочтительные соли и полиморфные модификации изобретения характеризуются физическими свойствами, например, стабильностью, растворимостью, гигроскопичностью и нормой растворения, подходящими для клинических и терапевтических дозированных форм. Предпочтительные полиморфные модификации настоящего изобретения - те, которые характеризуются физическими свойствами, например, морфологией кристаллов, сжимаемостью и твердостью, подходящими для производства твердых дозированных форм. Такие свойства могут быть определены, используя такие методы, как дифракция рентгеновских лучей, микроскопия, IR спектроскопия, термический анализ и анализ гигроскопичности, как описано в настоящем изобретении и известно в уровне техники.
1.1 Соли Соединения 1
В одном воплощении настоящее изобретение обеспечивает кристаллические формы частично фармацевтически приемлемых солей Соединения 1. Данное воплощение настоящего изобретения обеспечивает кристаллические формы солянокислых солей, мезилата и тозилата Соединения 1:
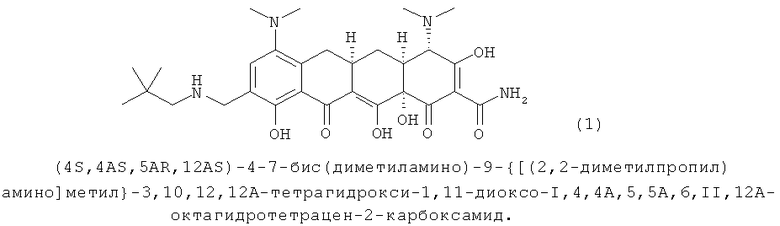
Каждая соль по настоящему изобретению может быть получена обработкой Соединения 1. Соединение 1 может быть синтезировано или получено любым способом, очевидным для специалиста на основании уровня техники. В предпочтительных воплощениях Соединение 1 получено согласно способам, описанным подробно в примерах ниже. См., например, публикацию США номер 2005/0026876 AI, содержание которой включено в настоящее описание ссылкой во всей полноте.
Альтернативно, Соединение 1 может быть получено выделением специфической соли Соединения 1 и преобразованием такой соли Соединения 1 в нейтральную форму посредством обработки подходящим основанием. Например, Соединение 1 может быть получено выделением гидрохлорида Соединения 1, фильтрацией и последующим преобразованием указанной соли в нейтральную форму обработкой одноосновным углекислым натрием в этилацетате или другим подходящим основанием.
Соединение 1, полученное любым способом, может контактировать с подходящей кислотой, как концентрированной (то есть, свободной от примесей или разбавления), так и в подходящем инертном растворителе или растворителях, для получения солей по изобретению. Например, Соединение 1 может вступать в реакцию с р-толуолсульфоновой кислотой для получения модификации тозилата настоящего изобретения.
Исследования стабильности проводились на свободном основании Соединения 1 и аморфной соли дигидрохлорида Соединения 1. Данная соль была получена растворением Соединения 1 в водном растворе, доведением рН раствора до 4,2 и последующей лиофилизацией. Свободное основание разлагалось меньше чем через один месяц при 40°С, и приблизительно через три месяца при 4°С. Напротив, дигидрохлорид Соединения 1 была устойчива в течение 6 месяцев при 40°С, и в течение двух лет при комнатной температуре (25°С).
Как раскрыто подробно в примерах ниже, тозилат Соединения 1 и его полиморфные модификации показывают желательные свойства.
1.2 Полиморфные модификации Соединения 1
Настоящее изобретение раскрывает также полиморфные модификации Соединения 1. В некоторых воплощениях полиморфные модификации изобретения представляют собой полиморфные модификации тозилата Соединения 1.
Каждая полиморфная модификация настоящего изобретения может быть получена превращением Соединения 1. Твердое Соединение 1 может быть растворено и затем кристаллизовано из смесей растворителей, описанных ниже, с целью получения полиморфных модификаций по настоящему изобретению. В определенных воплощениях изобретения тозилат Соединения 1 может быть растворен и затем кристаллизован из смесей растворителей, описанных ниже, с целью получения определенных полиморфных модификаций по настоящему изобретению. В некоторых воплощениях изобретения может быть растворено свободное основание Соединения 1, и затем добавлена кислота с целью получения кристаллической соли Соединения 1.
В одном воплощении настоящее изобретение раскрывает полиморфные модификации тозилата Соединения 1.
В дополнительном воплощении изобретение обеспечивает полиморфную модификацию 1 тозилата Соединения 1, имеющего структуру дифракции рентгеновских лучей, подобную показанной на Фиг.8, характеристики структуры дифракции показаны в Таблице 1. Например, специфическая полиморфная модификация 1 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 5,60, 8,06, 8,57, 11,41, 13,02, 15,58, 18,83, 20,54 и 24,53 °2θ, при использовании Cu Кα излучения. Например, специфическая полиморфная модификация 1 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 8,06, 11,41, 13,02, 18,83, 20,54 и 24,53 °2θ, при использовании Cu Кα излучения. Например, специфическая полиморфная модификация 1 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 8,06, 13,02, 18,83 и 24,53 °2θ. Например, специфическая полиморфная модификация 1 по изобретению обладает основными пиками дифракции рентгеновских лучей на порошке при 8,06 и 18,83 °2θ.
В другом воплощении настоящее изобретение обеспечивает модификацию 2 тозилата Соединения 1. В одном воплощении полиморфная модификация 2 тозилата Соединения 1 имеет структуру дифракции рентгеновских лучей, подобную показанной на Фиг.9, характеристики структуры дифракции показаны в Таблице 2. Например, специфическая полиморфная модификация 2 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 7,82, 11,88, 12,68, 16,12, 18,63, 21,46 и 23,74 °2θ, при использовании Cu Кα излучении. Например, специфическая полиморфная модификация 2 по изобретению обладает основными пиками дифракции рентгеновских лучей на порошке при 7,82, 11,88, 16,12 и 21,46 °2θ. Например, специфическая полиморфная модификация 2 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 11,88 и 16,12 °2θ.
В еще одном воплощении настоящее изобретение обеспечивает модификацию 3 Соединения 1. В дополнительных воплощениях полиморфная модификация 3 тозилата Соединения 1 имеет структуру дифракции рентгеновских лучей, подобную показанной на Фиг.10, характеристики структуры дифракции показаны в Таблице 3. Например, специфическая полиморфная модификация 3 по изобретению обладает пиками дифракции рентгеновских лучей на порошке при 5,11, 8,89, 10,34, 11,76, 13,70, 14,81 и 15.60 °2θ при использовании Cu Kα излучения. Например, специфическая полиморфная модификация 2 по изобретению обладает основными пиками дифракции рентгеновских лучей на порошке в 5,11, 8,89, 10,34, 11,76 и 15,60 °2θ. Например, специфическая полиморфная модификация 2 по изобретению обладает основными пиками дифракции рентгеновских лучей на порошке при 5,11 и 15,60 °2θ.
Тозилат Соединения 1 кристаллизуется в виде очень маленьких нерегулярных частиц, обычно 5-8 микронов в размере. На Фиг.1 показана дифракция рентгеновских лучей на порошке (XRPD) кристаллического твердого тозилата Соединения 1. Это соединение показало температуру плавления, ведущую к разложению при 190°С.
Гравиметрический анализ сорбция пара проводился на Соединении 1 или его тозилате. Было определено, что соотношение молекул воды и молекул Соединения 1 составляло 2,5 к 1 соответственно. XRPD был выполнен для сравнения исходного материала (Е00285) с дегидратированным материалом. Данные не показали изменений формы.
2. Синтез соединения 1
9-(аминометил)-дигидрохлорид миноциклина (200 мг, 1 экв.), диметилформамид и триметилацетальдегид (45 мкл, 1 экв.) были объединены в колбах на 40 мл и перемешаны. Затем был добавлен триэтиламин (150 мкл, 3 экв.). После перемешивания при комнатной температуре в течение нескольких минут, NaBH(ОАс)3 (175 мг, 2 экв.) и InCl3 (9 мг, 0,1 экв.) был добавлен. Через один час реакционная смесь была прозрачной и красной. Жидкостная хроматография показала единственный продукт реакции. Реакция была остановлена метанолом, растворитель был удален, и продукт был очищен, используя хроматографию на колонках.
Очистка
Соединение 1 было очищено хроматографией, впрыскиванием водного раствора соединения с низким рН в ВЭЖХ в градиенте полярного органического растворителя и объединением фракций продукта, таким образом, чтобы получить очищенное соединение. Выбор подходящих кислотных подвижных фаз увеличивал стабильность и селективность способа. Органическая и неорганическая кислотные подвижные фазы были эффективны при отделении побочных продуктов, включая примеси эпимеров и близко элюирующих продуктов посредством контроля рН или выбора кислоты. Кислотные подвижные фазы также защищали от окислительной деструкции соединения.
Например, раствор с низким рН обладал рН приблизительно 2-3. Примеры используемых растворов, включают водные растворы 0,1% метансульфоновой кислоты и водные растворы 0,1% трифторуксусной кислоты. В определенных воплощениях использовался изократический градиент 94% водного раствора и 6%-ого ацетонитрила или другого полярного органического растворителя для того, чтобы очистить соединение от эпимерных и близко элюирующих побочных продуктов.
Полученные водные фракции продукта могут быть объединены, и рН может быть доведен до приблизительно 4,0-4,5 с использованием щелочи (например, NaOH). Гидрофобные примеси и окислительные деграданты соединения могут быть удалены отмыванием водного раствора с неполярным органическим растворителем (например, CH2Cl2). Органические слои удаляются, а водные слои объединяются и сохраняются для дальнейшего использования.
Нужно отметить, что органические растворители, такие как хлористый метилен, могут использоваться для выборочного удаления поздно элюирующих гидрофобных примесей, таких как 4-углеродные сопутствующие продукты и других окислительные деграданты из кислого водного раствора соединения.
рН объединенных водных слоев затем может быть доведен до нейтрального, например, от приблизительно 7,5 до приблизительно 8,5. рН может быть выровнен добавлением основания, такого как NaOH. Нейтральный раствор далее отмывается с неполярным органическим растворителем, таким как хлористый метилен. Нужно отметить, что избирательное регулирование рН до нейтральных диапазонов также позволяет соединению быть извлеченным в органический растворитель, оставляя нежелательный бета-эпимер и сопутствующие продукты в водной фазе.
Кроме того, к водным растворам соединений, описанных здесь, также могут быть добавлены антиоксиданты. Антиоксиданты могут добавляться для того, чтобы предотвратить окислительную деградацию соединений. Могут использоваться такие антиоксиданты, как сульфиты или бисульфиты аммония.
3. Способы получения полиморфных модификаций Соединения 1
Изобретение также относится к способам получения полиморфных модификаций кристаллического Соединения 1.
В одном воплощении, модификация 1 тозилата Соединения 1 может быть получена любым способом создания модификации 1 очевидной для квалифицированного специалиста в уровне техники на основании данного раскрытия. В определенных воплощениях, модификация 1 может быть получена созреванием аморфного тозилата Соединения 1 в изопропаноле, ацетоне, этилацетате, метилпентаноне, толуоле или растворе ацетонитрила. Модификация 1 также может быть получена перекристаллизацией аморфного тозилата, суспендированного в изопропаноле. Модификация 1 также может быть получена, растворением свободного основания в подходящем растворителе или комбинации растворителей, такой как два спирта или спирт и антирастворитель, такой как кетон, эфир, сложный эфир, и т.д. После добавления кислоты, соль может медленно кристаллизоваться в правильную модификацию.
Может быть подобрана система растворения, в которой растворимы примеси и свободное основание Соединения 1, в то время как устойчивая кристаллическая соль Соединения 1 нерастворима, например, осаждением может быть получена суспензия кристаллов.
В другом воплощении, модификация 2 тозилата Соединения 1 может быть получена любым способом создания модификации 2, очевидным для квалифицированного специалиста в уровне техники на основании данного раскрытия. В определенных воплощениях, модификация 2 может быть сформирована созреванием аморфного тозилата Соединения 1 в дихлорметане.
В другом воплощении, модификация 3 тозилата Соединения 1 может быть получена любым способом создания модификации 3, очевидным для квалифицированного специалиста в уровне техники на основании данного раскрытия. В определенных воплощениях, модификация 3 может быть получена созреванием аморфного тозилата Соединения 1 в метилэтилкетоне, этилацетате или метилпентаноне. Модификация 3 также может быть получена созреванием модификации 1 в метилпентаноне.
В дополнительном воплощении полиморфные модификации тозилата Соединения 1, описанные выше, могут быть получены способами, которые включают стадии объединения Соединения 1 с растворителем для того, чтобы получить суспензию и добавления р-толуолсульфоновой кислоты.
Для образования суспензии может использоваться любой подходящий растворитель. Растворители, которые могут использоваться в воплощениях настоящего изобретения, включают спиртовые растворители, такие как изопропанол. Может использоваться любая подходящая комбинация растворителей для создания раствора, из которого кристаллизуется соль. Комбинации растворителей, которые могут использоваться в воплощениях, включают, но не ограничены, метанол и метил-трет-бутиловый эфир или этанол и изопропанол.
Например, суспензия Соединения 1 в растворителе или комбинации растворителей может быть получена при температуре от приблизительно 0°С до приблизительно 60°С, такой как от приблизительно 15°С до приблизительно 45°С, или от приблизительно 20°С до приблизительно 25°С. После получения указанной суспензии, она необязательно может быть нагрета и/или поддерживаться при температуре от приблизительно 15°С до приблизительно 60°С, такой как от приблизительно 20°С до приблизительно 50°С, или при приблизительно 45°С.
Как только суспензия получена, может быть добавлена р-толуолсульфоновая кислота в количестве, достаточном для того, чтобы образовать соль р-толуолсульфоновой кислоты и Соединения 1. В одном воплощении р-толуолсульфоновая кислота добавляется в количестве от приблизительно 25 до приблизительно 75 мас.%, от приблизительно 25 до приблизительно 50 мас.%, от приблизительно 30 до приблизительно 40 мас.% или приблизительно 33 мас.% относительно количества Соединения 1. Р-толуолсульфоновая кислота может быть добавлена в форме моногидрата р-толуолсульфоновой кислоты.
Полиморфные модификации тозилата Соединения 1 могут быть получены растворением. Например, раствор Соединения 1 может быть получен при температуре от приблизительно 0°С до приблизительно 60°С, такой как от приблизительно 15°С до приблизительно 45°С или от приблизительно 20°С до приблизительно 25°С. После того, как получен указанный раствор, он может необязательно быть нагрет и/или поддерживаться при температуре от приблизительно 15°С до приблизительно 60°С, такой как от приблизительно 20°С до приблизительно 50°С или при приблизительно 45°С.
Как только раствор получен, может быть добавлена р-толуолсульфоновая кислота в количестве, достаточном для того, чтобы образовать р-толуолсульфоновую кислую соль Соединения 1. В одном воплощении р-толуолсульфоновая кислота добавляется в количестве от приблизительно 25 до приблизительно 75 мас.%, от приблизительно 25 до приблизительно 50 мас.%, от приблизительно 30 до приблизительно 40 мас.%, или приблизительно 33 мас.% по весу относительно количества Соединения 1. Р-толуолсульфоновая кислота может быть добавлена в форме моногидрата р-толуолсульфоновой кислоты.
В одном воплощении, может быть добавлена полиморфная модификация 1 в качестве затравки раствора. Может использоваться любой подходящий растворитель для того, чтобы сформировать раствор р-толуолсульфоновой кислоты. Подходящие растворители включают спиртовые растворители, такие как изопропанол или комбинации растворителей, такие как метаноловый и метил-трет-бутиловый эфир. В предпочтительном воплощении объемное отношение метанола к метил-трет-бутиловому эфиру составляет 1:1,2. Подходящие растворители включают комбинацию двух или более спиртовых растворителей, таких как комбинация этанола и изопропанола. В предпочтительном воплощении объемное отношение этанола к изопропанолу составляет 2:1. В специфических воплощениях раствор р-толуолсульфоновой кислоты содержит тот же самый растворитель, который используется для получения суспензии или раствора Соединения 1.
После добавления р-толуолсульфоновой кислоты в подходящем растворителе формируется суспензия 1-ой полиморфной модификации тозилата Соединения. Содержание воды в супернатанте суспензии может быть доведено до подходящего уровня после добавления р-толуолсульфоновой кислоты. Как правило, содержание воды в супернатанте суспензии может находиться в диапазоне от приблизительно 0,2 до приблизительно 1,0 мг/мл, таком как от приблизительно 0,4 до приблизительно 0,8 мг/мл, например, приблизительно 0,6 мг/мл, приблизительно 0,54 мг/мл, и т.д.
После добавления р-толуолсульфоновой кислоты суспензия или раствор могут быть перемешаны с целью получить суспензию кристаллов. Перемешивание может проводиться более 48 часов. Однако, перемешивание обычно проводится сроком на от приблизительно 5 до приблизительно 36 часов, таким как от приблизительно 10 до приблизительно 24 часов или приблизительно 18 часов.
Перемешивание может проводиться при любой температуре, подходящей для формирования суспензии кристаллов. Например, суспензия может перемешиваться при температуре от приблизительно 0°С до приблизительно 60°С, такой как от приблизительно 15°С до приблизительно 45°С или от приблизительно 20°С до приблизительно 25°С.
После формирования кристаллов, суспензия может фильтроваться для удаления супернатанта, и кристаллы могут быть отмыты любым подходящим растворителем. В воплощениях настоящего изобретения кристаллы могут быть отмыты от одного до четырех раз, а растворитель может быть любым растворителем, подходящим для получения суспензии кристаллов. В частности, растворитель, используемый для отмывки кристаллов, может быть тем же самым растворителем или растворителями, которые используются для формирования первоначальной суспензии или раствора, или раствора р-толуолсульфоновой кислоты.
Полученные кристаллы затем могут быть высушены для того, чтобы удалить лишний растворитель любым подходящим способом. Например, сушка может быть осуществлена одним или более способами включая, но не ограничиваясь, повышением температуры в диапазоне от приблизительно 0°С до приблизительно 60°С, такой как от приблизительно 15°С до приблизительно 45°С, продувкой сухим азотом кристаллов и продувкой кристаллов влажным азотом.
Исследования созревания были проведены на образце тозилата Соединения 1, суспендированном в различных растворителях и отфильтрованном, влажный порошок был проанализирован XRPD. Были обнаружены три полиморфные модификации тозилата Соединения 1. Фиг.2 изображает спектры XRPD исходного материала (Е00285), модификации 1 тозилата, модификации 2 тозилата, модификации 3 тозилата и аморфной формы Соединения 1.
Таблица 4 отображает список растворителей, использованных для экспериментов созревания.
Перекристаллизация аморфного материала Соединения 1 была выполнена в различных растворителях. Только перекристаллизация в 2-пропаноле (изопропиловый спирт, ИПС) дала модификацию 1 тозилата, как показано в Таблице 5. Фиг.3 показывает сравнение спектров XRPD референсного Соединения 1 (Е00285) и перекристаллизованной из ИПС модификации 1 тозилата.
мент №
Суммарно, полиморфизм тозилата Соединения 1 представлен на Схеме 1:
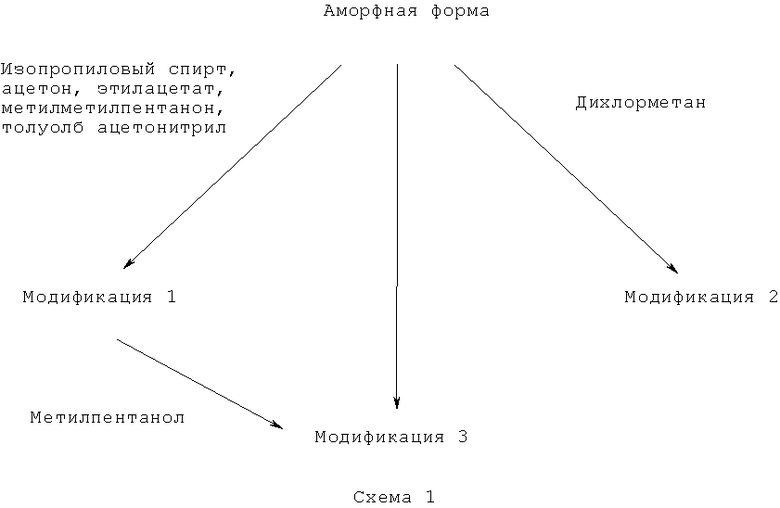
После перекристаллизации, образцы модификации 1, модификации 2 и модификации 3 тозилата были высушены в течение ночи под вакуумом и проанализированы XRPD, что показано на Фиг.4. После высыхания никаких изменений формы соединений не обнаружилось.
XRPD при разной температуре был проведен для модификации 2 и модификации 3 тозилата Соединения 1. См. Фиг.5 и Фиг.6, соответственно.
Была проанализирована относительная устойчивость полиморфных модификаций Соединения 1. Например, модификация 1 тозилата была подвергнута эксперименту созревания в течение 24 часов или в ИПС или в метилпентаноне, с использованием в качестве затравки модификации 2 или модификации 3 тозилата. Во время данного эксперимента не было никакого перехода модификации 1 в модификацию 2 или 3. Суспензия смеси 50:50 модификации 1 и модификации 3 была проанализирована в ИПС в течение 18 часов при 0°С, 25°С, 40°С и 60°С, как показано на Фиг.7. Не наблюдалось никаких переходов модификации 1 в модификацию 3.
Эксперименты перекристаллизации показали, что модификация 1 тозилата может быть получена воспроизводимо из аморфной соли тозилата, суспендированием в ИПС. Модификация 1 Соединения 1 может также быть воспроизводимо получена добавлением р-толуолсульфоновой кислоты. Анализ XRPD с высоким разрешением модификации 1 показан на Фиг.8 и характеристики структуры дифракции показаны в Таблице 1.
4. Фармацевтические композиции, включающие соединения, соли, кристаллические формы или полиморфные модификации настоящего изобретения
В дополнительных воплощениях изобретение относится к фармацевтическим композициям, включающим соединение тетрациклина по настоящему изобретению (например, синтезированное или очищенное способами согласно настоящему изобретению) или его фармацевтически приемлемую соль, пролекарство или сложный эфир. Фармацевтические композиции могут включать фармацевтически приемлемый носитель.
Термин "композиция" как используется в рамках настоящего изобретения включает в себя продукт, включающий указанные ингредиенты (и в указанном количестве, если есть), так же как любой продукт, который получается, прямо или косвенно, комбинацией указанных ингредиентов в указанном количестве. Под термином "фармацевтически приемлемый" имеется в виду, разбавитель, инертный наполнитель или носитель который должен быть совместим с другими ингредиентами фармацевтической композиции и не вредный реципиенту, их принимающему.
Как изложено выше, определенные воплощения настоящих соединений могут содержать основную функциональную группу, такую как амино или алкиламино, и, таким образом, способны к образованию фармацевтически приемлемых солей с фармацевтически приемлемыми кислотами. Термин "фармацевтически приемлемые соли" известен в уровне техники и включает относительно нетоксичные соли неорганических и органических кислот и соединений настоящего изобретения. Данные соли могут быть получены in situ во время заключительного выделения и очистки соединений настоящего изобретения или отдельной реакцией очищенного соединения по изобретению в форме свободного основания с подходящей органической или неорганической кислотой, и выделением полученной таким способом соли. Примеры данных солей включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептанат, лактобионат и лауросульфонат, и т.п.. (См., например, Berge и другие (1977) "Pharmaceutical Salts", J. Farm. SCI. 66: 1-19).
В других вариантах соединения настоящего изобретения могут содержать одну или более кислотных функциональных групп и, таким образом, способны к образованию фармацевтически приемлемых солей с фармацевтически приемлемыми основаниями. Термин "фармацевтически приемлемые соли" в данном понимании включает относительно нетоксичные соли присоединения неорганических и органических оснований соединений настоящего изобретения. Данные соли аналогично могут быть получены in situ во время заключительного выделения и очистки соединений, или отдельной реакцией очищенного соединения в форме свободной кислоты с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, с аммиаком или с фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Примеры щелочных или щелочноземельных солей включают литиевую, натриевую, калиевую, кальциевую, магниевую и алюминиевую соль и т.п. Примеры органических аминов, используемых для получения солей присоединения оснований включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин, и т.п..
Термин "фармацевтически приемлемые сложные эфиры" относится к относительно нетоксичным, эстерифицированным продуктам соединений настоящего изобретения. Эти сложные эфиры могут быть получены in situ во время заключительного выделения и очистки соединений, или отдельной реакцией очищенного соединения в форме свободной кислоты или гидроксида с подходящим агентом этерифицирования. Карбоновые кислоты могут быть преобразованы в сложные эфиры посредством обработки спиртом в присутствии катализатора. Гидроксиды могут быть преобразованы в сложные эфиры посредством обработки агентом этерифицирования, таким как алканоилгалиды. Термин "фармацевтически приемлемые сложные эфиры" также включает низшие углеводородные группы, способные к сольватированию при физиологических условиях, например, алкиловые эфиры, метиловые, этиловые и пропиловые эфиры. (См., например, Berge и другие, как указано выше.).
Изобретение также относится к соединениям тетрациклина, которые синтезированы и/или очищены способами по настоящему изобретению, и их фармацевтически приемлемыми солям.
Фраза "фармацевтически приемлемый носитель" известна в уровне техники и включает фармацевтически приемлемый материал, композицию или наполнитель, подходящие для введения соединений настоящего изобретения млекопитающим. Носители включают жидкий или твердый наполнитель, разбавитель, инертный наполнитель, растворитель или инкапсулирующий материал, вовлеченный в перенос или транспортировку целевого средства от одного органа или части тела, к другому органу или части тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами фармацевтической композиции и не вредным для пациента. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают: углеводы, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетилцеллюлоза; измельченный в порошок трагакант; солод; желатин; тальк; инертные наполнители, такие как масло какао и воск для свечей; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбитол, маннитол и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферы, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и другие нетоксичные совместимые вещества, использующиеся в фармацевтических композициях.
В композициях могут также присутствовать смачивающие вещества, эмульгаторы и смазки, такие как лаурилсульфат натрия и стеарат магния, так же как пигменты, средства контролирующие высвобождение, покрывающие средства, подслащивающие агенты, ароматизаторы и отдушки, консерванты и антиоксиданты.
Примеры фармацевтически приемлемых антиоксидантов включают: растворимые в воде антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, токоферол, и т.п.; а также металлические агенты для образования хелатных соединений, такие как лимонная кислота, этилендиамин тетраацетат, сорбит, винная кислота, фосфорная кислота, и т.п.
Фармацевтические композиции настоящего изобретения включают подходящие для орального, носового, кожного, трансдермального, защечного, подъязычного, ректального, влагалищного и/или парентерального введения композиции. Фармацевтические композиции могут быть представлены в форме дозированной единицы и могут быть получены любыми способами, известными в уровне техники в фармацевтике. Количество активного ингредиента, который может быть комбинирован с материалом - носителем, для производства единичной дозированной формы, будет таким, которое оказывает терапевтический эффект. В общем, из ста процентов, данное количество составит от приблизительно 1 процента до приблизительно девяноста девяти процентов активного ингредиента, предпочтительно от приблизительно 5 процентов до приблизительно 70 процентов, наиболее предпочтительно от приблизительно 10 процентов до приблизительно 30 процентов.
Способы получения указанных лекарственных дозированных форм или композиций включают стадию объединения соединения настоящего изобретения с носителем и, необязательно, одним или более добавочным ингредиентом. В общем, фармацевтические композиции получают постоянным и тесным объединением соединения настоящего изобретения с жидкими носителями, или тонко раздробленными твердыми носителями, или обоими, и затем, в случае необходимости, придавая форму продукту.
Фармацевтические композиции изобретения, подходящие для перорального приема, могут быть в форме капсул, крахмальных капсул, пилюль, таблеток, таблеток (использующих ароматизированное основание, обычно сахарозу и акация или трагакант), порошков, гранул или как раствор или суспензия в водной или неводной жидкости, или как масло в воде или водно-жировой жидкой эмульсии, или как эликсир или сироп, или как пастилки (используя инертную основу, такую как желатин и глицерин, или сахароза и акация) и/или как жидкости для полоскания рта и т.п., при этом каждая форма содержит определенное количество соединения настоящего изобретения в качестве активного ингредиента. Соединение настоящего изобретения может также вводиться как болюс, электуарий или мазь.
В твердых дозированных формах изобретения для перорального приема (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.), активный ингредиент смешан с одним или более фармацевтически приемлемым носителем, таким как лимоннокислый натрий или дикальцийфосфат и/или любое из следующих: наполнители, такие как крахмал, лактоза, сахароза, глюкоза, маннитол и/или кремневая кислота; связывающие вещества, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; увлажнители, такие как глицерин; дезинтегрирующие агенты, такие как агар-агар, углекислый кальций, картофельный или крахмал тапиоки, альгиновая кислота, некоторые силикаты и углекислый натрий; ингибиторы растворения, такие как парафин; усилители абсорбции, такие как четвертичные аммониевые основания; смачивающие вещества, такие как цетиловый спирт и моностеарат глицерина; абсорбенты, такие как каолиновая и бентонитовая глина; смазки, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси и пигменты. В случае капсул, таблеток и пилюль, фармацевтические композиции могут также включить буферные средства. Твердые композиции подобного типа могут также использоваться как наполнители в мягких и твердозаполненных капсулах желатина, используя такие инертные наполнители как лактоза или молочные сахара, так же как и полиэтиленгликоли с высоким молекулярным весом и т.п..
Таблетки могут быть изготовлены прессованием или литьем под давлением, необязательно с одним или более добавочным ингредиентом. Прессованные таблетки могут быть получены с использованием связывающих веществ (например, желатина или гидроксипропилметилцеллюлозы), любрикантов, инертных разбавителей, консервантов, дезинтегрантов (например, натриевой соли гликолята крахмала или натриевой соли сшитой карбоксиметилцеллюлозы), поверхностно-активных или диспергирующих веществ. Литые таблетки могут быть получены литьем под давлением в подходящем приборе смеси измельченного в порошок соединения, увлажненного инертным жидким разбавителем.
Таблетки и другие твердые дозированные формы фармацевтических композиций настоящего изобретения, такие как драже, капсулы, пилюли и гранулы, могут необязательно быть отшлифованы или выполнены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, известные в фармацевтической технологии. Они также могут быть сформулированы таким образом, чтобы обеспечить медленное или контроллируемое высвбождение активного ингредиента, с использованием, например, гидроксипропилцеллюлозы в различных соотношениях, чтобы обеспечить желательный профиль высвобождения, а также другие полимерные матриксы, липосомы и/или микросферы. Они могут стерилизоваться, например, фильтрацией через сдерживающий бактерии фильтр, или инкапсуляцией стерилизующих средств внутрь формы стерильных твердых композиций, которые могут быть растворены в стерилизованной воде, или некоторой другой стерильной вводимой среде непосредственно перед использованием. Эти композиции могут также необязательно содержать рентгеноконтрастные средства и могут быть композициями которые высвобождают активный ингредиент(ы) только, или избирательно, в определенной части желудочно-кишечного тракта, необязательно, с задержанным профилем высвобождения. Примеры охватываемых композиций, которые могут использоваться, включают полимерные вещества и воск. Активный ингредиент также может находиться в микроинкапсулированной форме, если необходимо с одним или более вышеописанных инертных наполнителей.
Жидкие дозированные формы для перорального приема соединений изобретения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активному ингредиенту жидкие дозированные формы могут содержать инертный разбавитель, обычно используемый в технологии, такой как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этиловый эфир угольной кислоты, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3 бутиленгликоль, масла (в частности семян хлопчатника, арахиса, ржи, зародышевое, маслин, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложный эфир сорбитана и их смеси.
Помимо инертных разбавителей, оральные композиции могут также включать вспомогательные вещества, такие как смачивающие вещества, эмульгаторы и суспендирующие агенты, подслащивающие средства, ароматизаторы, пигменты, отдушки и консерванты.
Суспензии, в дополнение к активным соединениям, могут содержать суспендирующие агенты как, например, этоксилированные изостеариновые спирты, сорбит полиэтиленоксидсорбитол и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
Формы фармацевтических композиций изобретения для ректального или влагалищного введения могут быть представлены как свеча, которая может быть получена смешиванием одного или более соединений изобретения с одним или более подходящими нераздражающими инертными наполнителями или включением носителей, например, масла какао, полиэтиленгликоля, воска свечи или салицилата, и которая является твердой при комнатной температуре, но жидкостью при температуре тела и, поэтому, будет плавиться в прямой кишке или влагалище и высвобождать активное соединение.
Фармацевтические композиции настоящего изобретения, которые являются подходящими для влагалищного введения также, включают маточные кольца, тампоны, кремы, гели, пасты, пены или спреи, содержащие носители известные в уровне техники как подходящие.
Дозированные формы для местного или трансдермального назначения соединения настоящего изобретения включают порошки, спреи, мази, пасты, крем, лосьоны, гели, растворы, пластыри и ингаляторы. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем, и с любыми консервантами, буферами или пропеллентами, которые необходимы.
Мази, пасты, кремы и гели могут содержать, в дополнение к активному соединению настоящего изобретения, инертные наполнители, таких как животные жиры и твердые растительные жиры, масла, воск, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, кремнийорганические материалы, бентониты, кремневую кислоту, тальк и окись цинка или их смеси.
Порошки и спреи могут содержать, в дополнение к соединению настоящего изобретения, инертные наполнители, такие как лактоза, тальк, кремневая кислота, гидроксид алюминия, кремнекислый кальций и порошок полиамида или смеси этих веществ. Спреи могут дополнительно содержать общепринятые пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
Трансдермальные пластыри обладают дополнительным преимуществом обеспечивая контроллируемое высвобождение соединения настоящего изобретения к телу. Такие дозированные формы могут быть получены растворением или диспергированием соединение в необходимой среде. Усилители абсорбции также могут использоваться для того, чтобы увеличить прохождение соединения через кожу. Скоростью такого прохождения можно управлять или посредством контролирующей скорость мембраны или диспергированием активного соединения в полимерном матриксе или геле.
Глазные фармацевтические композиции, глазные мази, порошки, растворы и т.п., также рассматриваются как находящиеся в рамках настоящего изобретения.
Фармацевтические композиции настоящего изобретения, подходящие для парентерального введения, включают одно или более соединений изобретения в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водным или неводным раствором, дисперсией, суспензией или эмульсией или стерильными порошками, которые могут быть ресуспендированы в стерильные инъекционные растворы или дисперсию до использования, которые могут содержать антиоксиданты, буферные вещества, антимикробные добавки, растворенные вещества, которые делают фармацевтическую композицию изотонической с кровью выбранного реципиента или суспендирующие вещества или загустители.
Примеры подходящих водных и неводных носителей, которые могут использоваться в фармацевтических композициях изобретения, включают воду, этанол, многоатомные спирты (такие как глицерин, пропиленгликоль, полиэтиленгликоль, и т.п.), и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые сложные эфиры, такие как этилолеат. Необходимая текучесть может быть поддержана, например, при помощи покрывающих материалов, таких как лецитин, сохранением необходимого размера частиц в случае дисперсии и при помощи поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные вещества, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие агенты. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых средств, например, парааминобензойной кислоты, хлорбутанола, сорбиновой кислоты фенола, и т.п. Также может быть желательно включение изотонических средств, таких как сахар, хлористый натрий, и т.п. в композицию. Кроме того, длительное поглощение инъецируемой фармацевтической композиции может быть обеспечено включением средств, которые задерживают всасывание таких как моностеарат алюминия и желатин.
В некоторых случаях, чтобы продлить эффект лекарственного средства, желательно замедлить поглощение лекарственного средства из подкожной или внутримышечной инъекции. Это может быть достигнуто при помощи жидкой суспензии кристаллического или аморфного материала, имеющего слабую водорастворимость. Скорость поглощения лекарственного средства в таком случае зависит от собственной скорости растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, отсроченное поглощение парентерально применяемой формы лекарственного средства может быть достигнуто, растворением или суспендированием лекарственного средства в масляном носителе.
Инъекционные формы пролонгированного действия изготавливаются формированием микроинкапсулированных матриц целевых соединений в биодеградируемых полимерах, таких как мультигликолид полилактида. В зависимости от соотношения лекарственного средства к полимеру, и природы конкретно используемого полимера, можно управлять скоростью высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли-(орто-эфиры) и поли-(ангидриды). Инъекционные фармацевтические композиции также изготавливаются помещением лекарственного средства в липосомы или микроэмульсии, которые являются совместимыми с тканью тела.
Препараты настоящего изобретения могут назначаться перорально, парентерально, местно или ректально. Они изготавливаются в формах, подходящих для каждого пути назначения. Например, они применяются в таблетках. Например, они вводятся инъекцией, настоем, ингаляцией, лосьоном, мазью, свечой и т.д. Пероральный прием предпочтителен.
Фразы "парентеральное введение" и "применяемый парентерально" в настоящем изобретении означает способы введения средств кроме тонкокишечного и местного назначения, обычно инъекционное, и включают, без ограничения, внутривенный, внутримышечный, внутриартериальный, интратекальный, интракапсулярный, внутриорбитальный, внутрисердечный, кожный, интраперитонеальный, транстрахеальный, подкожный, субкутикулярный, внутрисуставный, субкапсулярный, субарахноидальный, интраспинальный и надчревный вид инъекций и инфузии.
Фразы "системное назначение", "применяемый системно", "периферическое назначение" и "применяемый периферически" в рамках настоящего изобретения означают назначение соединения, лекарственного средства или другого материала любое назначение кроме непосредственного в центральную нервную систему, таким образом, что соединение поступает в систему пациента и, таким образом, вступает в целевой метаболизм и другие сходные процессы, например, подкожное назначение.
Эти соединения могут назначаться людям и другим животным для терапии любым подходящим способом введения, включая перорально, через нос (как, например, спрей), ректально, внутривагинально, парентерально, интрацестиниально и местно (как порошками, мазями или каплями, включая буккально и подязычно).
Независимо от пути выбранного назначения соединения настоящего изобретения, которые могут использоваться в подходящей гидратированной форме, и/или фармацевтических композициях настоящего изобретения, сформированы в фармацевтически приемлемые дозированные формы обычными способами, известными из уровня техники.
Термин "терапевтически эффективное количество" относится к количеству целевой соли или полиморфной модификации, которое вызовет биологическую или медицинскую реакцию ткани, системы, животного или человека, которая предполагается исследователем, ветеринаром, медицинским доктором или другим клиническим врачом или является достаточным, чтобы предотвратить развитие или облегчить до некоторой степени один или больше симптомов лечившегося заболевания.
Фактические уровни дозировки активных ингредиентов в фармацевтических композициях настоящего изобретения могут быть различны для того, чтобы получить эффективное количество активного ингредиента для достижения желательной терапевтической реакции для конкретного пациента, композиции, и способа введения, не будучи токсичной для пациента.
Выбранный уровень дозировки будет зависеть от множества факторов, включая активность используемого специфического соединения настоящего изобретения, или его сложного эфира, соли или амида, путь введения, время введения, скорость выведения специфического используемого соединения, продолжительность лечения, другие препараты, соединения и/или материалы, используемые в комбинации со специфическим используемым соединением, возраст, пол, вес, заболевания, общее здоровье и предшествующая история болезни пациента, и аналогичные факторы, известные в медицине.
Врач или ветеринар, квалифицированный в уровне техники, могут с готовностью определить и назначить эффективное требуемое количество фармацевтической композиции. Например, врач или ветеринар могут начать с дозы соединений изобретения, используемой в фармацевтической композиции на уровне ниже, чем это необходимо, чтобы достигнуть желательного терапевтического эффекта и постепенно увеличивать дозировку, пока желательный эффект не будет достигнут.
В общем, подходящая суточная доза соединения настоящего изобретения будет таким количеством соединения, которое является самой низкой дозой, эффективной, чтобы оказать терапевтическое влияние. Такая эффективная доза будет в основном зависеть от факторов, описанных выше. Вообще, внутривенные и подкожные дозы соединений настоящего изобретения для пациента, в случае, когда используются для указанных болеутоляющих эффектов, находятся от приблизительно 0,0001 до приблизительно 100 мг на килограмм массы тела в сутки, более предпочтительно от приблизительно 0,01 до приблизительно 50 мг на кг массы тела в сутки, и наболее предпочтительно от приблизительно 0,1 до приблизительно 10 мг на кг массы тела в сутки. Например, в некоторых воплощениях дозы составляют между 0,5 и 4,0 мг на кг день. Если необходимо, эффективная суточная доза активного соединения может вводиться как один, два, три, четыре, пять, шесть или больше субдоз, вводимых отдельно через подходящие интервалы в течение дня или недели или другого подходящего интервала времени, необязательно, в единичных дозированных формах.
В то время как для соединения настоящего изобретения возможно введение самого по себе, предпочтительно вводить соединение как фармацевтическую композицию.
5. Способы использования соединений тетрациклина по изобретению
Изобретение также относится к способу лечения тетрациклин чувствительных состояний у субъекта, посредством введения субъекту эффективного количества композиции, включающей Соединение 1 согласно изобретению или его фармацевтически приемлемой соли, таким образом, что состояние лечится.
Термины "лечение" или "лечить" в рамках раскрытия настоящего изобретения относятся к способу облегчения или уничтожения болезни или нарушения (например, тетрациклин чувствительного состояния), и/или его сопутствующих симптомов. Термины "предотвращать", "предотвращение" или "профилактика", в рамках раскрытия настоящего изобретения относятся к способу защиты субъекта от приобретения заболевания или нарушения. "Субъект" в рамках раскрытия настоящего изобретения включает млекопитающее. Млекопитающее может быть например, любое млекопитающее, например, человек, примат, мышь, крыса, собака, кошка, корова, лошадь, коза, верблюд, овца или свинья. Предпочтительно, млекопитающее является человеком.
Выражение "состояние, чувствительное к соединениям тетрациклина" или "тетрациклин чувствительное состояние" включает состояния, которые могут лечиться, предотвращаться или улучшаться другим образом посредством введения соединения тетрациклина по изобретению. Состояния чувствительные к соединениям тетрациклина включают бактериальные, вирусные инфекции и микозы (включая устойчивые к другим соединениям тетрациклина), рак (например, рак простаты, рак молочной железы, новообразования толстого кишечника, рак легкого, меланому, рак лимфы и другие нарушения, характеризующиеся нежелательной клеточной пролиферацией, включая, но не ограничиваясь, описанные в патенте США номер 6,100,248), артрит, остеопороз, диабет, и другие состояния, для которых была найдено действие соединений тетрациклина (см., например, патенты США номер 5,789,395; 5,834,450; 6,277,061 и 5,532,227, каждый из которых явно включен в настоящее описание посредством ссылки). Соединения настоящего изобретения могут использоваться для профилактики или контроля таких важных ветеринарных заболеваний и заболеваний млекопитающих, как диарея, инфекции мочевыводящих путей, инфекции кожи и подкожной клетчатки, инфекции уха, горла и носа, раневых инфекций, мастита и т.п. Кроме того в настоящее изобретение включены способы лечения опухолей с использованием соединений тетрациклина настоящего изобретения (van der Bozert et al., Cancer Res., 1998, 48: 6686-6690). В одном воплощении тетрациклин чувствительное состояние не является бактериальной инфекцией. В другом воплощении соединения тетрациклина настоящего изобретения по существу не являются антибактериальными. Например, неантибактериальные соединения тетрациклина по настоящему изобретению могут обладать значениями минимальной концентрации ингибитора большими чем приблизительно 4 мкг/мл как измерено анализами, известными в уровне техники.
Состояния чувствительные к соединениям тетрациклина также включают состояния, связанные с воспалительным процессом (ССВП). Термин "состояния, связанные с воспалительным процессом" включает состояния при которых начинается или представлены на патологическом уровне воспаление или воспалительные факторы (например, матричные металлопротеиназы (ММП), оксид азота (NO), ФНО, интерлейкины, плазменные белки, клеточные системы защиты, цитокины, липидные метаболиты, протеазы, токсические радикалы, молекулы адгезии, и т.д.). Воспалительный процесс представляет собой реакцию живой ткани на повреждения. Воспаление может произойти из-за физического повреждения, химических веществ, микроорганизмов, некроза ткани, рака или других факторов. Острое воспаление является краткосрочным процессом в течение только нескольких дней. Если такое состояние длится дольше, оно может расцениваться как хроническое воспаление.
Состояния ССВП включают воспалительные нарушения. Воспалительные нарушения в общем характеризуются высокой температурой, краснотой, набуханием, болью или потерей функции. Примеры причин воспалительных нарушений включают, но не ограничены, микробными инфекциями (например, бактериальные инфекции и микозы), физическими факторами (например, ожоги, радиация или травмы), химические соединения (например, токсины и едкие вещества), некроз ткани и различные типы иммунологических реакций. В дополнительном воплощении ССВП включает нарушения, описанные в американских патентах номер 5,929,055 и 5,532,227, включенные в данное описание ссылкой в их полноте.
Примеры воспалительных заболеваний включают, не ограничиваясь, остеоартрит, ревматоидный артрит, острые и хронические инфекции (бактериальные и грибковые, включая дифтерию и коклюш), острый и хронический бронхит, синусит, инфекции верхних дыхательных путей (насморк, и т.д.), острый и хронический гастроэнтерит и колит, острый и хронический цистит и уретрит, острый и хронический дерматит, острый и хронический конъюнктивит, острый и хронический серозит (перикардит, перитонит, синовит, плеврит и тендинит), уремический перикардит, острый и хронический холецистит, острый и хронический вагинит, острый и хронический увеит, реакции на лекарственные средства, укусы насекомого, ожоги (тепловой, химический и электрический) и загар.
Термин "состояния, ассоциированные с воспалительным процессом" включает, в одном воплощении, NO ассоциированные состояния. Термин "NO ассоциированное состояние" включает состояния, которые вовлекают или связаны с оксидом азота (NO) или индуцибельной синтазой оксида азота (iNOS). NO ассоциированное состояние включает состояния, которые характеризуются анормальным количеством NO и/или индуцибкльной NO-синтазы (iNOS). Предпочтительно, NO ассоциированное состояние может лечиться введением соединения тетрациклина по настоящему изобретению. Нарушения, заболевания и состояния, описанные в патентах США номер 6,231,894; 6,015,804; 5,919,774 и 5,789,395 также включены как NO ассоциированные состояния. Все содержание каждого из этих патентов включено в настоящее описание посредством ссылки.
Другие примеры NO ассоциированных нарушений включают, не ограничиваясь, малярию, старение, диабет, сосудистый инсульт, нейродегенеративные нарушения (Болезнь Альцгеймера, болезнь Хантингтона и Болезнь Паркинсона), заболевания сердца (связанные с реперфузией повреждения после инфаркта), ювенильный диабет, воспалительные нарушения, остеоартрит, ревматоидный артрит, острые, рецидивные и хронические инфекции (бактериальные, вирусные и грибковые), острый и хронический бронхит, синусит и инфекции дыхательных путей (насморк, и т.д.) Острый и хронический гастроэнтерит и колит, острый и хронический цистит и уретрит, острый и хронический дерматит, острый и хронический конъюнктивит, острый и хронический серозит (перикардит, перитонит, синовит, плеврит и тендонит), уремический перикардит, острый и хронический холецистит, муковисцедоз, острый и хронический вагинит, острый и хронический увеит, реакции на лекарственные средства, укусы насекомого, ожоги (тепловые, химические и электрические) и загар.
Термин "состояния, ассоциированные с воспалительным процессом" также включает, в одном воплощение, состояния, ассоциированные с матричными металлопротеиназами (MMPAS). MMPAS включают состояния, характеризующиеся анормальным количеством ММП или активности ММП. Они также включены в охват настоящего изобретения, как состояния, чувствительные к соединениям тетрациклина, которые могут лечиться с использованием соединений настоящего изобретения.
Примеры состояний, ассоциированных с матричными металлопротеиназами включают, не ограничиваясь, атеросклероз, язву роговицы, эмфизема, остеоартрит, рассеянный склероз (Liedtke et al, Ann. Neurol. 1998, 44: 35-46; Chandler et al, J. Neuroimmunol. 1997', 72: 155-71), остеосаркома, остеомиелит, расширение бронхов, хроническая обструктивная болезнь легких, кожные и глазные болезни, периодонтит, остеопороз, ревматоидный артрит, неспецифический язвенный колит, воспалительные нарушения, рост опухоли и инвазия (Stetler-Stevenson et al, Annu. Rev. Cell Biol. 1993, 9: 541-73; Tryggvason et al, Biochim. Biophys. Acta 1987, 907: 191-217; Li et al, Mol. Carcinog. 1998, 22: 84-89), метастазы, острое повреждение легких, инсульт, ишемию, диабет, аортальные или сосудистые аневризмы, раны кожных тканей, сухость глаз, разрушение костей и хрящей (Greenwald et al., Bone 1998, 22: 33-38; Ryan et al., Curr. Op. Rheumatol. 1996, 8: 238-247). Другие MMPAS включают описанные в патентах США номер 5,459,135; 5,321,017; 5,308,839; 5,258,371; 4,935,412; 4,704,383; 4,666,897 и РЕ 34,656, включенные в настоящее описание ссылкой в их полноте.
В другом воплощении состояние, чувствительное к соединениям тетрациклина представляет собой рак. Примеры рака, для лечения которых могут применяться соединения тетрациклина по изобретению, включают все твердые опухоли, то есть, карциномы, например, аденокарциномы и саркомы. Аденокарциномы - опухоли, происходящие из железистой ткани или в которой опухолевые клетки формируют характерные железистые структуры. Саркомы широко включают опухоли, клетки которых включены в фибриллярное или гомогенное вещество аналогичное зародышевой соединительной ткани. Примеры опухолей, которые могут лечиться с использованием соединений по изобретению, включают, не ограничиваясь, рак простаты, груди, яичников, яичек, легкого, толстого кишечника и груди. Способы настоящего изобретения не ограничены лечением этих типов опухоли, распространясь на любую твердую опухоль, происходящей из любых систем органов. Примеры излечимого рака включают, не ограничиваясь, новообразования толстого кишечника, рак мочевого пузыря, рак молочной железы, меланому, карциному яичника, рак простаты, рак легкого а также множество других опухолей. Способы настоящего изобретения также вызывают замедление роста опухолей при аденокарциномах, таких как, например аденокарциномы простаты, груди, почек, яичников, яичек и толстой кишки.
В одном воплощении изобретение относится к способу лечения субъектов страдающих от или имеющих риск рака, введением эффективного количества замещенного соединения тетрациклина ингибируя таким образом рост раковых клеток, то есть, уменьшается замедляется или останавливается клеточная пролиферация, инвазивность, метастазирование или сфера действия опухоли. Ингибирование может являться результатом ингибирования воспалительного процесса, уменьшение воспалительного процесса, некоторых других механизмов или комбинации механизмов. Альтернативно, соединения тетрациклина могут быть полезными для предотвращения рецидива рака, например, лечения остаточного рака после хирургической резекции или радиационной терапии. Соединения тетрациклина, используемые согласно настоящему изобретению, особенно предпочтительны, поскольку они являются в основном нетоксичными по сравнению с другими способами лечения рака. В дополнительном воплощении соединения настоящего изобретения применяются в комбинации со стандартной терапией рака, такой как, не ограничиваясь, химиотерапия.
Примеры тетрациклин чувствительных состояний также включают неврологические нарушения, которые включают и психоневрологические и нейродегенеративные нарушения, но не ограничиваясь ими, Болезнь Альцгеймера, деменции, связанные с Болезнью Альцгеймера, такие как болезнь Ниммана-Пика, болезнь Паркинсона и другие рассеянные болезни телец Леви, сенильная деменция, болезнь Хантингтона, синдром Жиля де ла Туретта, рассеянный склероз, амилотрофический латеральный склероз, синдром прогрессирующего супрануклеарного паралича, эпилепсия и болезнь Крейтцфельда-Якоба, нарушения вегетативной нервной системы, такие как артериальная гипертензия и нарушения сна, психоневрологические нарушения (депрессия, шизофрения, шизоаффективное расстройство, корсаковский синдром, мании, обеспокоенность, фобии и т.д.), нарушения обучения и памяти (амнезия или возрастная потеря памяти, дефицит внимания, и т.д.) Дистимические нарушения, большое депрессивное расстройство, обсессивно-компульсивное расстройство, нарушения при использовании психотропных веществ, беспокойство, фобии, страх, также как биполярное аффективное расстройство (тяжелое биполярное аффективное (настроение) расстройство (ВР-1), биполярные аффективные неврологические нарушения, например, мигрень и ожирение, и т.д.). Дополнительно неврологические нарушения включают, например, перечисленные в Диагностическом и Статистическом руководстве американской Психиатрической Ассоциации Расстройств психики (DSM), актуальнейшая версия которого включена здесь ссылкой полностью.
В другом воплощении состояние, чувствительное к соединениям тетрациклина представляет собой диабет, например, ювенильный диабет, сахарный диабет, диабет 1 типа или диабет 2 типа. В дополнительном воплощении введение соединений тетрациклина настоящего изобретения не вызывает гликозилирование белка. В другом воплощении соединение тетрациклина изобретения вводится в комбинации со стандартными диабетическими методами лечения, такими как, но не ограничиваясь, инсулинотерапия.
В другом воплощении состояние, чувствительное к соединениям тетрациклина представляет собой костные нарушения. Костные нарушения включают нарушения, где кости субъектов повреждены и/или находятся в состояниях, при которых благоприятны формирование, репарация или ремоделлинг кости. Например, костные нарушения включают остеопороз (например, уменьшение прочности и плотности костей), трещины кости, остеогенез, связанный с хирургическими процедурами (например, лицевая реконструкция), остеопсатироз (болезнь ломкой кости), фосфоэтаноламинурия, болезнь Педжета, фиброзная дисплазия, мраморная болезнь, заболевания костей при миеломе и дефицит кальция в кости, который связан с первичным гиперпаратиреозом. Костные нарушения включают все состояния, при которых формирование, репарация или ремоделлинг кости благоприятны для субъекта так же как и все другие нарушения, связанные с костями или скелетной системой субъекта, которые могут лечиться соединениями тетрациклина настоящего изобретения. В дополнительном воплощении костные нарушения включают описанные в патентах США номер 5,459,135; 5,231,017; 5,998,390; 5,770,588; RE 34,656; 5,308,839; 4,925,833; 3,304,227 и 4,666,897, каждый из которых тем самым включен сюда ссылкой во всей полноте.
В другом воплощении состояние, чувствительное к соединениям тетрациклина представляет собой острое повреждение легких. Острые повреждения легких включают респираторный дистресс-синдром взрослых (РДСВ), патофизиологические расстройства, развивающиеся в ходе применения искусственного кровообращения и травмы. Травма включает любое повреждение живой ткани, вызванное посторонним агентом или случаем. Примеры травмы включают, но не ограничены, повреждением с размозжением тканей, контактирование с твердой поверхностью, или сокращение или другие повреждения легких.
Изобретение также относится к способу лечения острых повреждений легких, введением замещенного соединения тетрациклина по изобретению.
Тетрациклин чувствительные состояния изобретения также включают хронические расстройства легких. Изобретение относится к способам лечения хронических нарушений легких введением соединений тетрациклина, таких как описанные здесь. Способ включает введение субъекту эффективного количества замещенного тетрациклина таким образом, чтобы хроническое нарушение легкого лечилось. Примеры хронических нарушений легкого включают, но не ограничены, астмой, муковисцедозом и эмфиземой. В дополнительном воплощении соединения тетрациклина изобретения используются для лечения острых и/или хронических нарушений легкого, таких как описано в патентах США номер 5,977,091; 6,043,231; 5,523,297 и 5,773,430, каждый из которых тем самым включен сюда ссылкой во всей полноте.
В еще одном воплощении состояние, чувствительное к соединениям тетрациклина представляет собой ишемию, инсульт или ишемический инсульт. Изобретение также относится к способу лечения ишемии, инсульта или ишемического инсульта введением эффективного количества замещенного соединения тетрациклина по изобретению. В дополнительном воплощении соединения тетрациклина настоящего изобретения используются для лечения таких нарушений как описано в патентах США номер 6,231,894; 5,773,430; 5,919,775 и 5,789,395, включенные сюда ссылкой.
В другом воплощении состояние, чувствительное к соединениям тетрациклина представляет собой кожные раны. Изобретение также относится, по крайней мере частично, к способу улучшения заживления эпителизированной ткани (например, кожи, слизистой оболочки и т.д.) острого травматического повреждения (например, рассечения, ожоги, царапины, и т.д.). Способ может включать использование соединения тетрациклина настоящего изобретения (который имеет или, возможно, не имеет антибактериальной активности) для улучшения способности эпителизированной ткани заживлять острые раны. Способ может увеличить скорость накопления коллагена в заживающей ткани. Способ может также уменьшать протеолитическую активность в эпителизированной ткани, уменьшая коллагенолитическую и/или желатинолитическую активность ММП. В дополнительном воплощении соединения тетрациклина настоящего изобретения применяются на поверхности кожи (например, местно). В дополнительном воплощении соединения тетрациклина по изобретению используются для лечения кожных ран и других аналогичных нарушений как описано например в американских патентах номер 5,827,840; 4,704,383; 4,935,412; 5,258,371; 5,308,8391; 5,459,135; 5,532,227 и 6,015,804, каждый из которых включен сюда ссылкой во всей полноте.
В еще одном воплощении состояние, чувствительное к соединениям тетрациклина представляет собой аортальную или сосудистую аневризму в сосудистой ткани субъекта (например, субъекта имеет или имеет риск аортальной или сосудистой аневризмы, и т.д.). Соединение тетрациклина может быть эффективным для уменьшения размера сосудистой аневризмы, или оно может вводиться субъекту до начала развития сосудистой аневризмы таким образом, чтобы было предотвращено развитие аневризмы. В одном воплощении сосудистая ткань представляет собой артерию, например, аорту, например, брюшную аорту. В дополнительном воплощении соединения тетрациклина настоящего изобретения используются для лечения нарушений, описанных в американских патентах номер 6,043,225 and 5,834,449, каждый из которых включен сюда ссылкой во всей полноте.
Бактериальные инфекции могут быть вызваны большим разнообразием грамположительных и грамотрицательных бактерий. Соединения изобретения полезны как антибиотики против организмов, которые устойчивы к другим соединениям тетрациклина. Антибиотическая активность соединений тетрациклина настоящего изобретения может быть определена, с использованием in vitro стандартным методом разведения питательной среды, описанный в Waitz, J.A., National Commission for Clinical Laboratory Standards, Document M7-A2, vol.10, no.8, pp.13-20, 2nd edition, Villanova, PA (1990).
Соединения тетрациклина могут также использоваться для лечения инфекций, традиционно лечимых соединениями тетрациклина таких как, например, риккетсий, некоторых грамположительных и грамотрицательных бактериальных инфекций, венерической лимфогранулемы, конъюнктивита с включениями и орнитоза. Соединения тетрациклина могут использоваться, чтобы лечить инфекции вызванные, например, К.pneumoniae, Salmonella, E.hirae, A.baumanii, В.catarrhalis, H.influenzae, P.aeruginosa, E.faecium, E.coli, S.aureus или E.faecalis. В одном воплощении соединение тетрациклина используется для лечения бактериальной инфекции, которая устойчива к другим соединениям антибиотика тетрациклина. Соединение тетрациклина настоящего изобретения может применяться с фармацевтически приемлемым носителем.
Фраза "в комбинации с" другим терапевтическим средством или лечением включает совместное введение соединения тетрациклина, (например, ингибитора) с другим терапевтическим средством или лечением, введение тетрациклина сначала, сопровождаемое другим терапевтическим средством или лечением и введением другого терапевтического средства или лечением сначала, сопровождаемое соединением тетрациклина. Другое терапевтическое средство может быть любым средством, которое, как известно, в уровне техники лечит, предотвращает или уменьшает симптомы болезни или нарушения, такой же ССВП. Кроме того, другое терапевтическое средство может быть любым средством благоприятным для пациента, когда оно применяется в комбинации с введением соединения тетрациклина. В одном воплощении болезни, такие как рак, которые лечатся способами изобретения, включают описанные в американских патентах номер 6,100,248; 5,843,925; 5,837,696 and 5,668,122, каждый из которых включен сюда ссылкой во всей полноте.
Термин "эффективное количество" соединения представляет собой количество, необходимое или достаточное для того, чтобы лечить или предотвратить состояние, чувствительное к соединениям тетрациклина. Эффективное количество может изменяться в зависимости от таких факторов как размер и вес субъекта, тип болезни, или специфичности соединения тетрациклина. Например, выбор соединения тетрациклина может влиять на то, что составляет "эффективное количество". Квалифицированный специалист в уровне техники в состоянии изучить вышеупомянутые факторы и сделать выбор относительно эффективного количества соединения тетрациклина без неуместного экспериментирования.
В терапевтических способах изобретения одно или более соединений тетрациклина изобретения могут применяться самостоятельно к субъекту, или более обычно соединение изобретения будет применяться как часть фармацевтической композиции в смеси с обычным инертным наполнителем, то есть, фармацевтически приемлемыми органическими или неорганическими соединениями носителя, подходящими для парентерального, орального или другого желательного введения и которые не реагируют антагонистически с активными соединениями и не вредны реципиенту.
Краткое описание чертежей
На Фиг.1 показана структура дифракции рентгеновских лучей на порошке образцов, содержащих кристаллическую форму Соединения 1 при 25°С.
На Фиг.2 показана структура дифракции рентгеновских лучей на порошке при 25°С исходного материала (Е00285), 1-ой модификации тозилата, 2-ой модификации тозилата, 3-ей полиморфной модификации тозилата и аморфной формы тозилата Соединения 1.
На Фиг.3 показано сравнение структур дифракции рентгеновских лучей на порошке при 25°С для кристаллической формы Соединения 1 (Е00285) и образцов содержащих 1-ую полиморфную модификацию тозилата, полученную перекристаллизацией аморфного тозилата Соединения 1 в ИПС.
На Фиг.4 показано сравнение структур дифракции рентгеновских лучей на порошке при 25°С для образцов, содержащих 1-ую модификацию тозилата, 2-ую модификацию тозилата и 3-ью полиморфную модификацию тозилата, которые были высушены в течение ночи под вакуумом.
На Фиг.5 показан анализ дифракции рентгеновских лучей на порошке при различной температуре образцов, содержащих 2-ую полиморфную модификацию тозилата.
На Фиг.6 показан анализ дифракции рентгеновских лучей на порошке при различной температуре образцов, содержащих 3-ью полиморфную модификацию тозилата.
На Фиг.7 показан анализ дифракции рентгеновских лучей на порошке при различной температуре образцов, включающих суспензию 50:50 смеси 1-ой модификации тозилата и 3-ей полиморфной модификации тозилата в ИПС.
На Фиг.8 показана структура дифракции рентгеновских лучей высокого разрешения на порошке образцов, содержащих 1-ую полиморфную модификацию тозилата Соединения 1.
На Фиг.9 показана структура дифракции рентгеновских лучей высокого разрешения на порошке образца, содержащего 2-ую полиморфную модификацию тозилата Соединения 1 (чистота ВЭЖХ - 93,2%).
На Фиг.10 показана структура дифракции рентгеновских лучей высокого разрешения на порошке образца, содержащего 3-ью полиморфную модификацию тозилата Соединения 1 (чистота ВЭЖХ - 96,7%).
Осуществление изобретения
Изобретение дополнительно иллюстрировано следующими примерами, которые не должны быть рассмотрены как дополнительное ограничение.
Пример 1: Синтез 9-алкил аминометилминоциклина
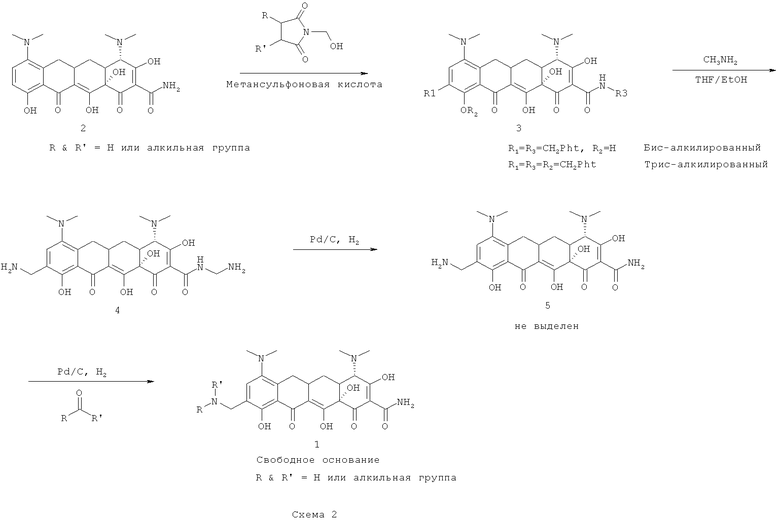
Гидрохлорид миноциклина (соединение 2) был растворен в метилсульфоновой кислоте или фтористоводородной кислоте с метилсульфоновым ангидридом или подобной кислоте - нейтрализаторе воды, такой как трифторметансульфоновая кислота. N-гидроксиметилфталемид был добавлен к реагирующей смеси. Смесь перемешивалась при 20-35°С, пока реакция не была завершена. Раствор кислоты был добавлен к смеси льда/воды, и соль трифторметансульфоноваой кислоты была преципитирована, отфильтрована и собрана. Твердое вещество было повторно растворено в ацетоне и доведено до нейтрального рН основанием. Продукт преципитировался добавлением воды. Если трифторметансульфоновая кислота присутствовала как нейтрализатор, продукт мог преципитироваться без нейтрализации. Продукт был выделен как смесь бис- и трис-алкилированных продуктов. Выделенный материал этой реакции был обогащен вторично в желательном соотношение (90%).
Сухой остаток суспендировался в EtOH или МеОН. Аминолиз был выполнен при использовании метиламина. Побочный продукт диамида фталевой кислоты, преципитируемый в течение реакции был удален фильтрацией. Светло-желтый твердый продукт преципитировался добавлением приблизительно 1,5 объемов мети-трет-бутилового эфира к реагирующей смеси, и собирался простой фильтрацией, которая оставила много малых примесей и метиламиновый реагент в растворе. Дальнейшая очистка соединения была выполнена посредством ресуспендирования с низшим алифатическим спиртом, таким как метанол.
Соединение 4 как свободное основание было перенесено в аппарат для гидрирования, который был заправлен метанолом и альдегидом. Инактивированный катализатор Pd/C был внесен, и сосуд находился под давлением водорода. Реагирующая смесь была гидрирована под водородом при давлении приблизительно 206,8 кПа (30 Psi) в течение приблизительно 24 часов. Когда преобразование соединения 4 в 1 было завершено, раствор был отфильтрован и отмывался через целитовую прокладку. На данной стадии реагирующая смесь содержала очень мало бета С-4 эпимера, приблизительно 3-7%.
Продукт (1) был обработан следующим образом, чтобы очитстить его от примесей. рН раствора был доведен до приблизительно 4,5 концентрированной HCl, и раствор был экстрагирован дихлорметаном. Водный слой был экстрагирован дихлорметаном, чтобы селективно восстановить предпочтительный эпимерный продукт (например, а). Слои дихлорметана были объединены и сконцентрированы, и 2 л n-гептана были добавлены, чтобы преципитировать продукт. Дальнейшая очистка была проведена повторением вышеуказанной процедуры с или без метил-трет-бутилового эфира, чтобы растворить сырой продукт.
Пример 2: Очистка Соединения 1
Сырой продукт 9-(2',2'-диметилпропиламинометил)миноциклин в виде свободного основания (40 г) был растворен в 150 мл буфера (водный раствор 0,1% метансульфоновой кислоты - МСК) и рН был доведен до 2-3 с помощью МСК.
Раствор был отфильтрован и введен на ВЭЖХ, продукт элюировался изократическим градиентом 94%-ого буфера А и 6%-ного ацетонитрила. Накопление фракции продукта было запущено, когда был обнаружен пик продукта. Каждая фракция была проанализирована, и для ранних фракций продукта использовался приемный критерий более чем 80% площадь под кривой главного пика. Во время комбинирования фракций, учитывался уровень примесей и относительная концентрация объединенных фракций в качестве критериев отбора, которые удовлетворяют спецификации конечного продукта. К продукту фракции был добавлен 10%-й водный раствор сульфита натрия, равного 10% первичного объема собранных фракций.
Следующий пример представляет выход единственной инъекции. Выход многократных инъекций может также быть объединен и обработан. Объем фракции продукта 3,5 л (включая сульфит натрия) был собран, и рН был доведен до 4,0-4,5 с использованием раствора гидроксида натрия. Водный раствор был отмыт 2 л дихлорметана, и органический слой был отделен и исключен.
рН водного слоя был отрегулирован до 7,5-8,5 гидроксидом натрия и продукт был экстрагирован четыре раза 2,4 л дихлорметана. рН был доведен до 7,5-8,5 гидроксидом натрия или МСК, до каждой экстракции.
Четыре слоя дихлорметана были комбинированы и сконцентрированы приблизительно до 200 мл, которые затем медленно добавлялись (в течение приблизительно 10 минут) к энергично размешиваемому n-гептану (2,5 л). Суспензия размешивалась в течение приблизительно 10 минут при комнатной температуре и медленно разбавлялась (в течение 5 минут) n-гептаном 1,5 л. Суспензия была охлаждена до 0-5°С и перемешана в течение 1-2 часов. Суспендируемый остаток был отфильтрован и отмыт 3-мя частями по 150 мл n-гептана. Продукт был высушен под вакуумом при 40°С в течение по крайней мере 24 часов, пока не был достигнут постоянный вес, и уровни всех остаточных растворителей были в пределах спецификации. Приблизительно 13,6 г 9-(2',2'-диметипропиламинометил)-миноциклина в виде свободного основания были выделены как желтый порошок.
Пример 3: Подготовка кристаллической солянокислой соли Соединения 1
Соединение 1 (13 г) было растворено в ацетоне (300 мл), отфильтровано, и фильтр был дополнительно отмыт ацетоном. Объединенный фильтрат и смыв были охлаждены до 5°С. К объединенному фильтрату и смыву был медленно добавлен с энергичным перемешиванием раствор концентрированной HCl (3,9 мл) в ацетоне (79 мл). Результирующая суспензия перемешивалась в ванне со льдом в течение 15 минут и фильтровалась.
Первый выход осадка был отмыт с холодным ацетоном и пентаном и высушен в вакууме в течение 48 часов, давая 13,7 г желтого аморфного осадка. Колба с влажным фильтратом была накрыта алюминиевой фольгой и оставлена на 2 недели, в течение которых наблюдался рост монокристаллов. Кристаллы были собраны фильтрацией и отмыты гексаном.
Пример 4: Получение кристаллической соли метансульфоновой кислоты Соединения 1
В колбу с 3 горловинами на 25 мл под инертной атмосферой азота было добавлено 3 мл изопропанола (ИПС). Суспензия была получена добавлением аморфного свободного основания Соединения 1 в колбу в количестве 225 мг. Суспензия была нагрета до температуры 45°С. Затем был добавлен гидрат метансульфоновой кислоты (98,0 мг) к суспензии. Суспензия перемешивалась при 45°С в течение одного часа, затем охлаждалась до 22°С для того, чтобы получить густую кристаллическую суспензию. Суспензия была отфильтрована и отмыта ИПС (2×1 мл). Лишний ИПС был удален от кристаллической фильтрационной корки сушкой при 55°С более двух часов, чтобы достигнуть постоянного веса. Кристаллический мезилат (соль метансульфоновой кислоты) Соединения 1 (180 мг) был выделен. Было установлено, что кристаллический мезилат был нестабилен при 5°С.
Пример 5: Получение кристаллического тозилата Соединения 1 (с использованием суспендирования)
В 5 л колбу с 3 горловинами в инертной атмосфере азота было помещено 2,0 л изопропанола. Суспензия была получена добавлением 289 г аморфного свободного основания Соединения 1 в колбу. Затем к суспензии был добавлен раствор гидрата р-толуолсульфоновой кислоты (97,0 г) в ИПС (400 мл). Содержание воды в супернатанте суспензии было доведено до 0,6 г/л добавлением воды (9 мл), и суспензия перемешивалась при 20-25°С в течение 18 часов для того, чтобы получить густую суспензию кристаллов. Суспензия была отфильтрована и отмыта с ИПС (2×500 мл). Лишний ИПС был удален от фильтрационной корки кристаллов продуванием сухого азота через корку в течение 24 часов. С твердым осадком, содержащим 3 процента (мас.%) ИПС, корка была дополнительно высушена продуванием увлажненного азота через корку при относительной влажности 70-75% в течение 24 часов. Корка сохранила 0,9 мас.% ИПС, который не был дополнительно уменьшен этим способом. Избыток воды затем был удален из корки продуванием сухого азота через корку в течение 24 часов. Тозилат Соединения 1 был выделен как оранжевый порошок (337 г). Выделенный тозилат Соединения 1 была кристаллическим с только одной наблюдаемой формой: нестехиометрический полугидрат, что было определено дифракцией рентгеновских лучей на порошке (XPRD) и термогравиметрическим (TG) анализом.
Пример 6: Получение кристаллического тозилата Соединения 1 (с использованием растворения)
В 5 л колбу с 3 горловинами в инертной атмосфере азота было помещено 1,7 л метанола и 1,7 л метил-трет-бутилового эфира. Затем в колбу был добавлен моногидрат Р-толуолсульфоновой кислоты (209 г) и аморфное свободное основание Соединения 1 (556 г) при перемешивании с получением прозрачного раствора. Затравочное количество (3 g) монотозилата соединения 1 было добавлено, чтобы инициировать кристаллизацию и дополнительное количество метанола (0,1 л) и метил-трет-бутилового эфира (0,5 л). Получившаяся суспензия перемешивалась приблизительно при 20°С в течение 22 часов для того, чтобы получить густую суспензию кристаллов. Суспензия была отфильтрована и отмыта смесью 1,1 л метанола и 1,3 л метил-трет-бутилового эфира, и дальнейшего метил-трет-бутилового эфира (2×2,4 л). Тозилат Соединения 1 был выделен как оранжевый порошок. Лишний растворитель был удален фильтрационной корки кристаллов продуванием сухого азота через корку в течение 24 часов. Затем корка сушилась под вакуумом приблизительно при 30°С, пока осадок не содержал приблизительно 6 процентов (мас.%) растворителя. Корка была дополнительно высушена под вакуумом приблизительно при 45°С, пока твердый осадок не содержал менее чем 3 процента (мас.%) растворителя. Выделенный тозилат Соединения 1 был кристаллическим с наблюдаемой модификацией 1 что было определено дифракцией рентгеновских лучей на порошке (XPRD).
Пример 7: Исследование тозилата Соединения 1
Структура XRPD выделенного тозилата Соединения 1 включала 2θ значения в градусах 5,6, 8,0, 8.6, 11,4, 13,0, 15,5, 18,8, 20,4 и 24,5.
Кристаллический тозилат был проанализирован термогравиметрическим анализом под азотным потоком при скорости нагревания 10°С/мин. Потеря 3,9% массы наблюдалась до 81,3°С, которая происходила из-за потери воды.
После высыхания содержание воды в кристаллическом тозилате Соединения 1 было вычислено как 0,5%. После выдерживания при комнатной температуре в течение 24 часов это значение увеличилось до 5%. В отличие от аморфного Соединения 1, кристаллический тозилат Соединения 1 был устойчив в течение многих недель и месяцев при комнатной температуре, сохраняя содержание воды приблизительно 5%.
Гигроскопичность исследуемого кристаллического тозилата была определена использованием анализатора симметричной сорбции пара, и определена как мас.%, полученный как функция относительной влажности (%ОВ) от 5% до 95% к 1%, в 5%-ных интервалах при 25.0°С. Наблюдался максимальный прирост 12 мас.% в 95%-ном ОВ, с небольшим гистерезисом на десорбцию, и 2% потеря веса из-за ИПС.
Кристаллический тозилат обладал растворимостью, приведенной в Таблице 6 ниже. Растворимость была определена смешиванием избытка сухого остатка с растворителем при температуре окружающей среды в течение двух часов, и дальнейшей фильтрацией супернатанта. Концентрация супернатанта была определена жидкостной хроматографией высокого разрешения (ВЭЖХ). Уравновешивание 56,8 мг исследуемого кристаллического тозилата в 0,5 мл воды и 122,1 мг исследуемого кристаллического тозилата в 1,0 мл воды приводило к прозрачным растворам. рН раствора 122,1 мг исследуемого кристаллического тозилата в 1.0 мл воды был определен как 5,70.
Пример 8: Диффракция рентгеновских лучей на порошке Соединения 1
Структура дифракции рентгеновских лучей на порошке была определена на дифрактометре Siemens D5000, использовались Cu Kα излучение (40 кВ, 40 мА), θ-θ угломер, расхождение V20 с получением срезов, графитовый вторичный монохроматор и сцинтилляционный счетчик. Инструмент был проверен с использованием сертифицированного стандарта корунда (NIST 1976). Программное обеспечение, используемое для сбора данных - Diffrac Plus XRD Commander v2.3.1, и данные были проанализированы и представлены с использованием Diffrac Plus EVA версий 11.0.0.2 или 13.0.0.2.
Образцы порошка были получены как плоские пластины для анализа. Приблизительно 35 мг образца были мягко упакованы в прорез впадины в полированной силиконовой пластинке с нулевым фоном (510). Образец вращался в своей собственной плоскости во время анализа. Детали сбора данных:
Диапазон углов: 2 to 42°2θ
Шаг: 0,05°2θ
Время накопления: 4 с/шаг.
Структуры дифракции рентгеновских лучей высокого разрешения на порошке были собраны на Bruker AXS C2 GADDS дифрактометре, используя Cu Кα излучение (40 кВ, 40 мА), автоматизированную XYZ платформу, лазерный видео микроскоп для типового позиционирования и 2-мерный детектор области HiStar. Оптика рентгеновских лучей состояла из единственного многослойного зеркала Gobel вместе с коллиматором микроканала 0,3 мм.
Расхождение луча, то есть эффективный размер рентгеновского луча на образце, составляло приблизительно 4 мм. θ-θ непрерывное сканирование проводилось с использованием интервала образцов детектора 20 см, который дает эффективные 2θ диапазоны 3,2°-29,7°. Как правило, образец был бы подвергнут воздействию рентгеновских лучей на 120 секунд. Программное обеспечение, используемое для сбора данных, было GADDS для WNT 4.1.16, и данные были проанализированы и представлены с использованием Diffrac Plus EVA версий 9.0.0.2 или 13.0.0.2.
Пример 9: Исследование температурной стабильности и стабильности при влажности
Исследование стабильности проводилось на тозилате и мезилате Соединения 1, контролированием изменения профилей примесей на высокоэффективной жидкостной хроматографии (ВЭЖХ) для каждой соли при воздействии различных температур и/или условий влажности. Каждый образец был помещен в закрытую емкость и подвергнут воздействию трем средам, которыми управляли: холодная (5°С), 20°С и 60%-я относительная влажность, и 40°С и 75%-я относительная влажность. После двух недель кристаллическая соль тозилата была определена как самая устойчивая кристаллическая формой Соединения 1. Исследование стабильности кристаллической соли тозилата было продолжено.
Образцы были проанализированы следующей обратно-фазовой хроматографией с измерением профиля примесей во временные точки 0, 1, 2, 4 недели (Таблица 7) и 3 месяца (Таблица 8) для тозилата; и 0, 1 и 2 недели для мезилата (Таблица 9).
Анализ обратно-фазовой ВЭЖХ проводился, используя колонки SYMMETRY SHIELD RP18 (4,6×250 мм, с размером частиц 5 мкм), хотя ожидалось что анализ с использованием подобных или эквивалентных колонок, даст подобные результаты. Подвижные фазы включали 0,1 М уксуснокислый аммоний в воде при рН 3,3 (А) и ацетонитрил (В). Смесь подвижной фазы была градиентом, который увеличился от 6% до 15% В через пять минут, доведенном до 15% В в течение 15 минут, увеличенном от 15% до 60% В через десять минут, затем от 60% до 90% В через две минуты, и затем система была повторно уравновешена при 6% В в течение четырех минут. Скорость потока составляла 1,0 мл/мин, и объем инъекции был 10,0 мкл. Температура колонки поддерживалась при 30°С. Детекция проводилась ультрафиолетовым излучением при 280 нм. Время удерживания для Соединения 1 составляло приблизительно 15,7 минут. Образец раствора был получен в подвижной фазе А в конечной концентрации 2,0 мг/мл.
0,52 (%)
(%)
(%)
(%)
(%)
(%)
Вышеупомянутые данные демонстрируют, что тозилат Соединения 1 устойчив когда хранится при охлаждении и/или 20°С и 60%-ной ОВ в течение по крайней мере четырех недель. Тозилат Соединения 1 устойчив при температуре в диапазоне от 0°С до 70°С, или в диапазоне от 5°С до 50°С, или в диапазоне от 20°С до 30°С.
Пример 10: Исследование фотостабильности
Исследование фотостабильности проводилось на тозилате Соединения 1. Два образца были помещены в прозрачные стеклянные чашки Петри. Один образец был завернут в алюминиевую фольгу, чтобы служить эталонным образцом. Оба образца были помещены в камеру ES 2000 Environmental Light 10 Chamber и подвергнуты воздействию 12 Клюкс холодной белой люминесцентной лампы в течение в общей сложности 47 часов. Образцы были затем проанализированы ВЭЖХ на профили примесей, и полученные результаты представлены в Таблице 10.
(%)
(%)
Эквиваленты
Квалифицированные в области техники специалисты понимают или будут в состоянии установить, используя не более чем обычное экспериментирование, много эквивалентов определенных воплощений и способов, описанных здесь. Такие эквиваленты охвачены следующей формулой изобретения.
Все патенты, заявки на патент и литературные ссылки, процитированные здесь, тем самым явно включены ссылкой в настоящее описание.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФНЫЕ ФОРМЫ СОЕДИНЕНИЯ ST-246 И СПОСОБЫ ПОЛУЧЕНИЯ | 2011 |
|
RU2578606C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ ДЕФЕРАСИРОКСА (ICL670A) | 2007 |
|
RU2468015C2 |
| НОВАЯ ПОЛИМОРФНАЯ ФОРМА КАЛЬЦИМИМЕТИЧЕСКОГО СОЕДИНЕНИЯ | 2011 |
|
RU2599788C2 |
| ПОЛИМОРФНЫЕ И АМОРФНАЯ ФОРМЫ ФОСФАТНОЙ СОЛИ 8-ФТОР-2-{4-[(МЕТИЛАМИНО)МЕТИЛ]ФЕНИЛ}-1,3,4,5-ТЕТРАГИДРО-6Н-АЗЕПИНО[5.4.3-CD]ИНДОЛ-6-ОНА | 2005 |
|
RU2355691C2 |
| ПОЛИМОРФНАЯ ФОРМА КРИСТАЛЛИЧЕСКОГО ГИДРОХЛОРИДА ИРИНОТЕКАНА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ | 2003 |
|
RU2300535C2 |
| НОВАЯ ПОЛИМОРФНАЯ ФОРМА КРИСТАЛЛИЧЕСКОЙ ГЕМИКАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА | 2006 |
|
RU2409563C2 |
| ПОЛИМОРФНАЯ МОДИФИКАЦИЯ В ИБАНДРОНАТА | 2006 |
|
RU2387661C2 |
| ПОЛИМОРФНАЯ МОДИФИКАЦИЯ А ИБАНДРОНАТА | 2006 |
|
RU2368617C2 |
| НОВАЯ ПОЛИМОРФНАЯ ФОРМА КАЛЬЦИМИМЕТИЧЕСКОГО СОЕДИНЕНИЯ | 2011 |
|
RU2599789C2 |
| МАКРОЦИКЛИЧЕСКИЕ ПОЛИМОРФЫ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ТАКИЕ ПОЛИМОРФЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ПОЛУЧЕНИЯ | 2008 |
|
RU2478643C2 |
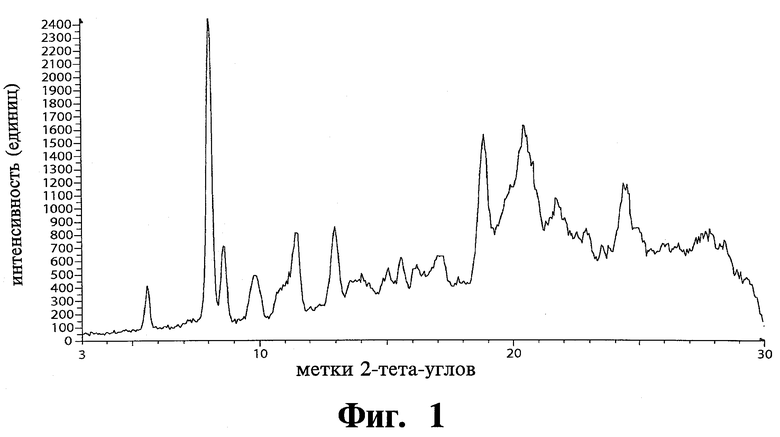
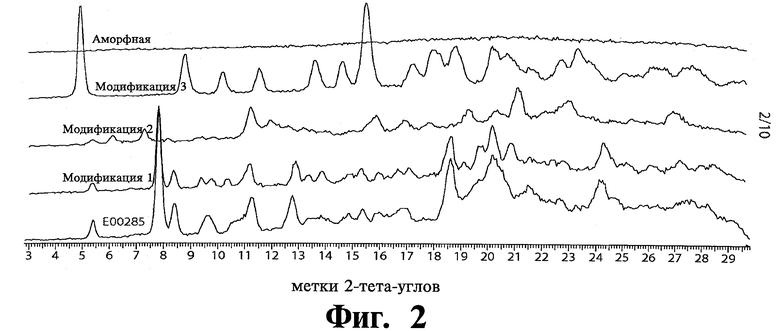
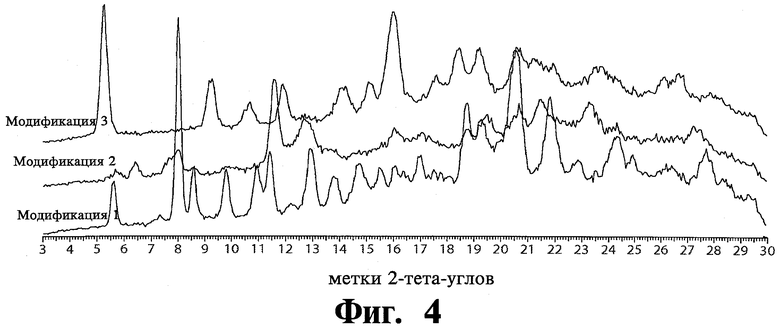
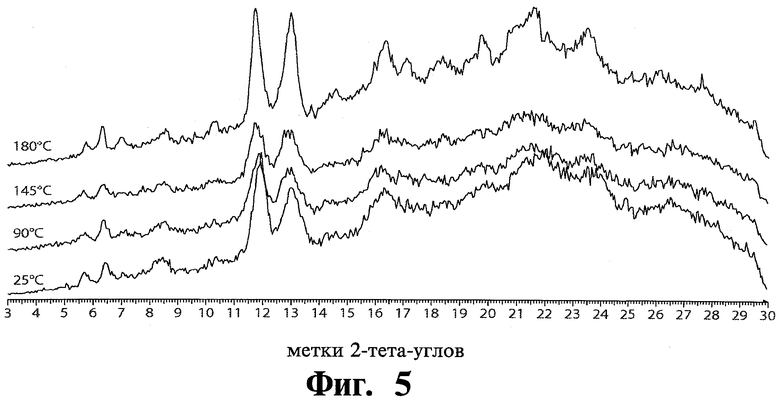
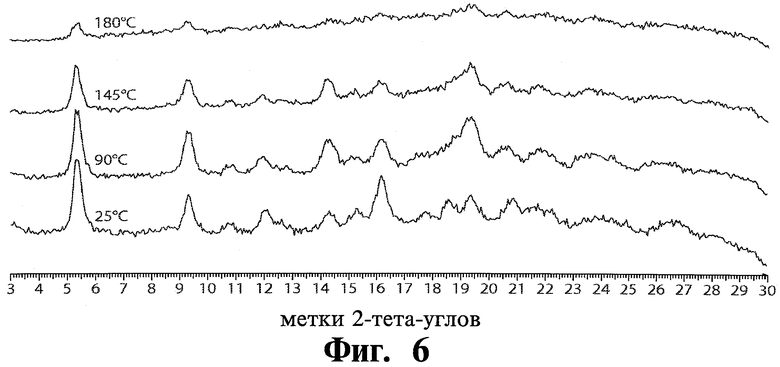
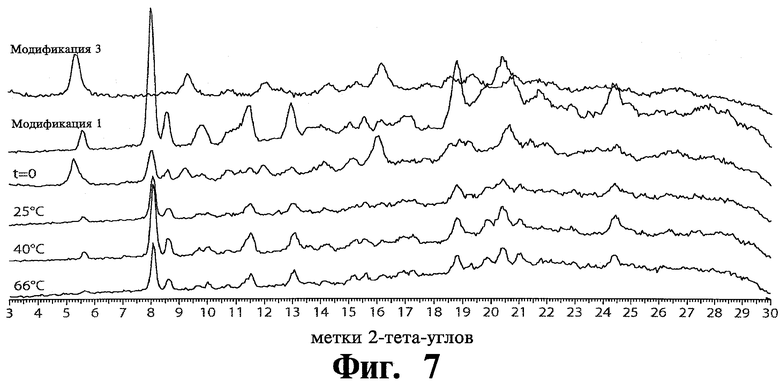
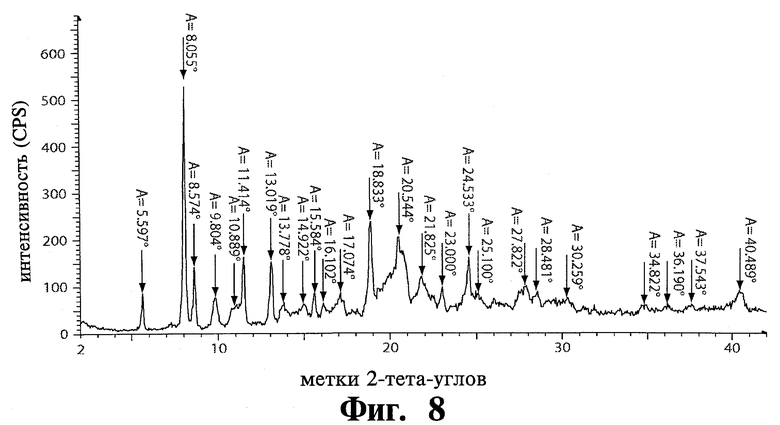
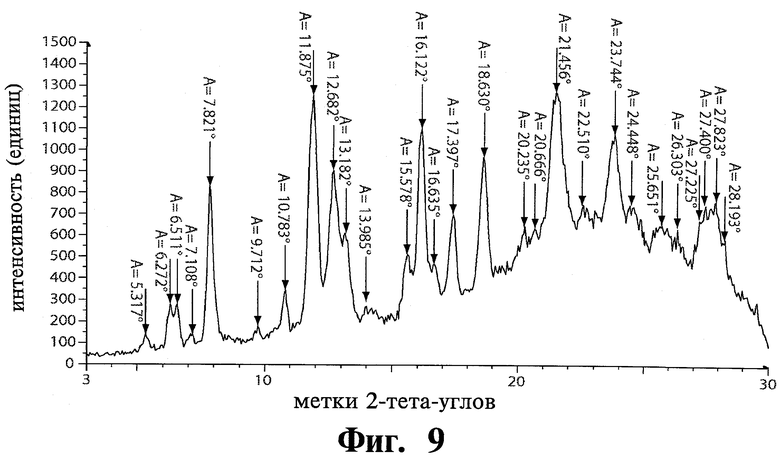
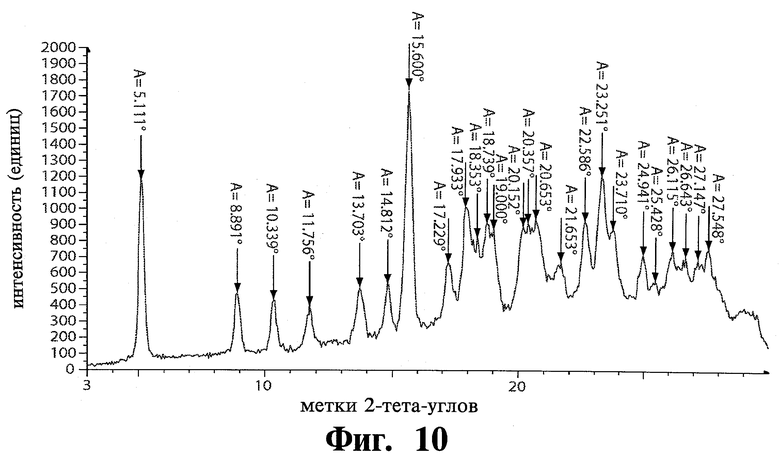
Изобретение относится к тозилату соединения тетрациклина, охватываемого формулой 1, его полиморфным формам, способу их получения и фармацевтическим композициям на их основе.
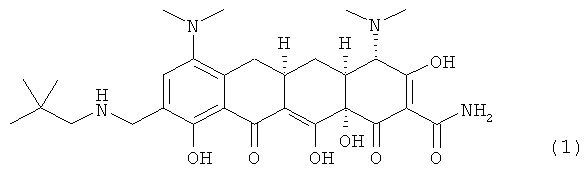
Соединения могут найти применение для лечения состояний, чувствительных к тетрациклину, таких как бактериальные инфекции и т.п. 5 н. и 28 з.п. ф-лы, 10 табл., 10 ил., 10 пр.
1. Тозилат соединения тетрациклина, охватываемого формулой 1:
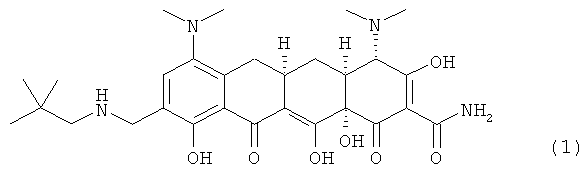
2. Полиморф тозилата по п.1, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 8,06, 13,02 и 18,83 °2θ при использовании CuKα излучения.
3. Полиморф тозилата по п.2, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 8,06, 11,41, 13,02, 18,83, 20,54 и 24,53 °2θ при использовании CuKα излучения.
4. Полиморф тозилата по п.3, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 5,60, 8,06, 8,57, 11,41, 13,02, 15,58, 18,83, 20,54 и 24,53 °2θ при использовании CuKα излучения.
5. Полиморф тозилата по п.1, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 5,11 и 15,60 °2θ при использовании CuKα излучения.
6. Полиморф по п.5, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 5,11, 8,89, 10,34, 11,76, и 15,60 °2θ при использовании CuKα излучения.
7. Полиморф по п.6, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 5,11, 8,89, 10,34, 11,76, 13,70, 14,81 и 15,60 °2θ при использовании CuKα излучения.
8. Полиморф тозилата по п.1, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 11,88 и 16,12 °2θ при использовании CuKα излучения.
9. Полиморф тозилата по п.8, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 7,82, 11,88, 16,12, и 21,46 °2θ при использовании CuKα излучения.
10. Полиморф тозилата по п.9, характеризующийся картиной дифракции рентгеновских лучей на порошке, включающей пики при приблизительно 7,82, 11,88, 12,68, 16,12, 18.63, 21,46 и 23,74 °2θ при использовании CuKα излучения.
11. Полиморф по любому из пп.2-10, полученный кристаллизацией тозилата соединения 1:

из изопропанола, кетона, дихлорметана, или этилацетата.
12. Полиморф по п.11, полученный кристаллизацией тозилата соединения 1:

из изопропанола.
13. Полиморф по п.11, полученный кристаллизацией тозилата соединения 1:

из дихлорметана.
14. Полиморф по п.11, полученный кристаллизацией тозилата соединения 1:

из ацетона, метилэтилкетона, метилпентанона или этилацетата.
15. Способ получения стабильного кристаллического тозилата соединения тетрациклина, охватываемого формулой 1:

включающий
растворение свободного основания соединения, охватываемого формулой 1 в первом растворителе или комбинации растворителей с формированием первого раствора,
растворение п-толуолсульфоновой кислоты во втором растворителе или комбинации растворителей с формированием второго раствора,
объединение указанных первого и второго растворов с формированием третьего раствора, и
добавление кристаллической затравки полиморфа по любому из пп.2-4 к третьему раствору с формированием четвертого раствора, содержащего стабильное кристаллическое соединение.
16. Способ по п.15, в котором первый растворитель или комбинация растворителей и второй растворитель или комбинация растворителей являются одинаковыми или различными.
17. Способ по п.15, в котором первая комбинация растворителей и вторая комбинация растворителей каждая независимо является комбинацией спиртовых растворителей.
18. Способ по п.17, в котором первая комбинация растворителей и вторая комбинация растворителей независимо представляет собой комбинацию двух спиртовых растворителей.
19. Способ по п.18, в котором указанные растворители представляют собой этанол и изопропанол.
20. Способ по п.19, в котором этанол и изопропанол находятся в отношении 2:1 по объему соответственно.
21. Способ по п.15, в котором первая комбинация растворителей и вторая комбинация растворителей включает спиртовой растворитель и антирастворитель.
22. Способ по п.21, в котором спиртовой растворитель представляет собой метанол.
23. Способ по п.21, в котором антирастворитель выбран из группы, включающей кетон, эфир и сложный эфир.
24. Способ по п.23, в котором эфир представляет собой метил-трет-бутиловый эфир.
25. Способ по п.15, в котором каждая комбинация растворителей включает метанол и метил-трет-бутиловый эфир.
26. Способ по п.25, в котором метанол и метил-трет-бутиловый эфир находятся в соотношении 1:1,2 по объему соответственно.
27. Способ по п.15, в котором количество п-толуолсульфоновой кислоты составляет от 25 до 75 мас.% относительно количества указанного соединения 1.
28. Способ по п.15, в котором п-толуолсульфоновая кислота находится в форме моногидрата.
29. Способ по п.15, в котором посредством перемешивания четвертого раствора образуют суспензию.
30. Способ по п.29, в котором суспензию дополнительно сушат.
31. Полиморф тозилата соединения 1:

полученный способом по п.15.
32. Фармацевтическая композиция для лечения состояний, чувствительных к тетрациклину, включающая терапевтически эффективное количество полиморфа по любому из пп.2-10 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель.
33. Фармацевтическая композиция для лечения состояний, чувствительных к тетрациклину, включающая терапевтически эффективное количество тозилата соединения 1 и фармацевтически приемлемый разбавитель, инертный наполнитель или носитель.
| US 7326696 В2, 05.02.2008 | |||
| US 3230254 А, 18.01.1966 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2013-12-10—Публикация
2009-05-26—Подача