Родственные заявки
Данная заявка заявляет приоритет заявки на патент США номер 11/831886, зарегистрированной 31 июля 2007, и предварительной заявки на патент США номер 60/881950, зарегистрированной 22 января 2007, полное описание каждой из которых включено здесь в качестве ссылки.
Область техники, к которой относится изобретение
Изобретение включает в себя новые формы соединений, проявляющих антибиотическую активность широкого спектра, особенно кристаллические полиморфные формы и аморфные формы таких соединений, композиции, содержащие такие кристаллические полиморфные формы и аморфные формы таких соединений, способы их получения и применения. Соединения и композиции изобретения являются применимыми в медицинской и фармацевтической областях, например, при лечении или профилактике заболеваний или нарушений, связанных с применением антибиотиков, химиотерапии или противовирусных терапий, включающих в себя лечение, но без ограничения перечисленным, колита, например псевдомембранозного колита; связанной с антибиотиком диареи и инфекционных заболеваний, вызванных видами Clostridium difficile ("C. difficile"), Clostridium perfringens ("C. perfringens"), Staphylococcus, например, резистентным к метициллину Staphylococcus или Enterococcus, в том числе резистентным к ванкомицину enterococci.
Уровень техники
Антибиотик-ассоциированные диареи ("AAD") вызываются продуцирующими токсин штаммами C. difficile, Staphylococcus aureus ("S. aureus"), включающими в себя резистентные к метициллину Staphylococcus aureus ("MRSA") и C. perfringens. AAD является основным экономическим бременем для системы медико-санитарной помощи, которая по скромным подсчетам оценивается как превышающая 3-6 биллионов $ в год больничных расходов только в Соединенных Штатах.
ADD является значительной проблемой в больницах и учреждениях для длительного лечения. C. Difficile является основной причиной AAD в условиях стационара в больнице, составляющей приблизительно 20% случаев AAD и большинства случаев связанного с антибиотиком колита ("ААС").
Увеличение частоты заболеваний связанной с C. Difficile диареи ("CDAD") относили к частому прописыванию антибиотиков широкого спектра госпитализированным пациентам.
Тиакумицины являются группой 18-членных макролидных антибиотиков, первоначально выделенных из ферментативного бульона Dactylosporangium aurantiacum. Тиакумицины являются эффективными грамположительными антибиотиками. В частности, тиакумицины, особенно тиакумицин В, проявляют активность против различных бактериальных патогенов и в частности против C. difficile, грамположительной бактерии (Antimicrob. Agents Chemother., 1991, 1108-1111). Очистку тиакумицинов проводили в подходящих растворителях, после чего тиакумицин В обладал точкой плавления 143-145°C (см., например, J.E.Hochlowski, et al, J.Antibiotics, vol. XL, no.5, pages 575-588 (1987)).
Полиморфное поведение соединения может иметь решающее значение в фармации и фармакологии. Полиморфы по определению являются кристаллами одной и той же молекулы, имеющими различные физические свойства в результате расположения молекул в кристаллической решетке. Различия в физических свойствах, проявляемых полиморфами, влияют на фармацевтические свойства, такие как стабильность при хранении, прессуемость и плотность (важные при изготовлении препарата и получении продукта) и скорости растворения (важный фактор при определении биологической доступности). Различия в стабильности могут являться результатом изменений в химической реакционной способности (например, различного окисления, так что лекарственное средство изменяет цвет быстрее, когда состоит из одного полиморфа, чем когда состоит из другого полиморфа) или механических изменений (например, таблетки крошатся при хранении, когда кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или тех и других (например, таблетки одного полиморфа являются более восприимчивыми к разрушению при высокой влажности). В результате различий в растворимости/расплавлении в крайнем случае некоторые полиморфные превращения могут привести к потере активности или, при другой крайности, к токсичности. Кроме того, физические свойства кристалла могут быть важными при обработке, например, более вероятно, что один полиморф может образовывать сольваты или может быть трудным его фильтрование и промывание с целью освобождения от примесей (т.е. распределение формы и размера частиц одного полиморфа может отличаться от другого).
Каждое фармацевтическое соединение имеет оптимальную терапевтическую концентрацию в крови и летальную концентрацию. Биологическая доступность соединения определяет эффективность дозы в лекарственном препарате, необходимую для получения идеального уровня в крови. Если лекарственное средство может кристаллизоваться в виде двух или более полиморфов, различающихся по биологической доступности, оптимальная доза может зависеть от полиморфа, присутствующего в препарате. Некоторые лекарственные средства проявляют узкий предел между терапевтической и летальной концентрациями. Поэтому становится важным как по медицинским, так и коммерческим причинам получать и продавать лекарственное средство в его наиболее термодинамически стабильном полиморфе, по существу не содержащем другие кинетически благоприятные или неблагоприятные полиморфы.
Таким образом, существует потребность в разработке безопасных и эффективных полиморфов лекарственных средств, которые являются эффективными при лечении или профилактике нарушений, связанных с бактериальными патогенами. Авторы настоящего изобретения идентифицировали новые кристаллические и аморфные формы 18-членных макролидных соединений, которые проявляют антибиотическую активность широкого спектра.
Раскрытие изобретения
Изобретение включает в себя новые кристаллические и аморфные формы макролидных соединений, которые являются применимыми при лечении или профилактике бактериальных инфекций и протозойных инфекций. В иллюстративном варианте осуществления новые кристаллические и аморфные формы макролидных соединений изобретения проявляют антибиотическую активность широкого спектра. Таким образом, неожиданно были идентифицированы новые кристаллические и аморфные формы макролидных соединений, которые действуют в качестве антибиотиков, обладающих активностью широкого спектра при лечении или профилактике бактериальных инфекций и протозойных инфекций, особенно инфекций, связанных с грамположительными и грамотрицательными бактериями, и в особенности грамположительными бактериями.
В одном варианте осуществления изобретение включает в себя новые кристаллические и аморфные формы макролида формулы I
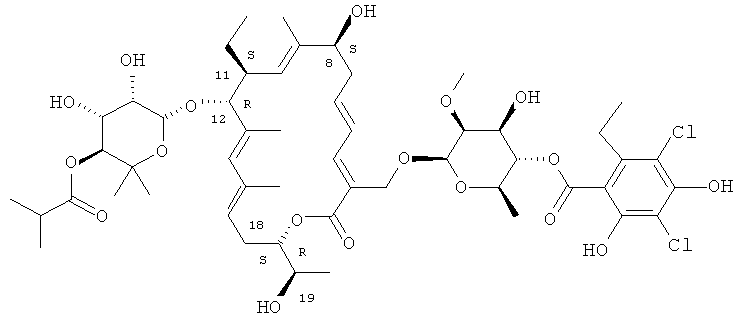
В другом варианте осуществления изобретение включает в себя смесь соединений с различными количествами соединения формулы I, эти формы имеют стабильность, требуемую для применения при получении фармацевтических композиций.
В другом варианте осуществления изобретение включает в себя полиморф, полученный из смеси тиакумицинов и соединения формулы I.
Еще в одном варианте осуществления изобретение включает в себя новые кристаллические и аморфные формы соединения формулы I.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую соединение формулы I.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую соединение формулы I, где соединение формулы I присутствует в количестве больше чем 90 масс.%.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую одну или несколько новых кристаллических и аморфных форм соединения формулы I.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и соединения формулы I.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 75 масс.% или больше соединения формулы I. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 80 масс.% или больше соединения формулы I. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 85 масс.% или больше соединения формулы I. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 90 масс.% или больше соединения формулы I. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 95 масс.% или больше соединения формулы I. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую смесь тиакумицинов и по меньшей мере приблизительно 99 масс.% или больше соединения формулы I.
Изобретение включает в себя также способы лечения или профилактики заболевания или нарушения, включающего в себя, но не ограничивающегося перечисленным, бактериальные инфекции и протозойные инфекции, содержащие введение субъекту, предпочтительно млекопитающему, нуждающемуся в этом, терапевтически или профилактически эффективного количества композиции или препарата, содержащего соединение изобретения.
В одном иллюстративном варианте осуществления композиция или препарат содержит смесь соединений с различными количествами соединения формулы I. В другом варианте осуществления композиция или препарат содержит смесь тиакумицинов и соединения формулы I. Еще в одном варианте осуществления композиция или препарат содержит новые кристаллические и аморфные формы соединения формулы I. Еще в одном варианте осуществления композиция или препарат содержит новые кристаллические и аморфные формы соединения формулы I и смесь тиакумицинов.
В другом конкретном варианте осуществления подвергаемое лечению или профилактике заболевание или нарушение вызывается продуцирующими токсин штаммами C. difficile, Staphylococcus aureus ("S. aureus"), включающими в себя резистентные к метициллину Staphylococcus aureus ("MRSA") and C. perfringens. В другом конкретном варианте осуществления подвергаемым лечению или профилактике заболеванием или нарушением является связанная с антибиотиком диарея.
Краткое описание чертежей
На фигуре 1 показана порошковая рентгенограмма первого полиморфа соединения формулы I, полученного из метанола и воды.
На фигуре 2 показана порошковая рентгенограмма второго полиморфа соединения формулы I, полученного из этилацетата.
На фигуре 3 показано влияние температуры на смесь тиакумицинов, полученных из метанола и воды. На ДСК показана эндотермическая кривая, начинающаяся при 169°C, и потеря массы, начинающаяся при 223°C. Эндотермическая кривая приблизительно при 177°C соответствует плавлению первого полиморфа соединения формулы I.
Осуществление изобретения
Общее описание
Изобретение в общем включает в себя смеси соединений с различными количествами соединения формулы I. Авторы изобретения неожиданно определили, что образование кристаллических полиморфных форм и аморфных форм соединения формулы I и необязательно смесей тиакумицина зависит от выбора растворителя для кристаллизации и способа и условий кристаллизации или осаждения.
В одном варианте осуществления изобретение включает в себя смесь тиакумицинов и соединения формулы I. В другом варианте осуществления изобретение включает в себя новые кристаллические и аморфные формы соединения формулы I и необязательно смесь тиакумицинов. Еще в одном варианте осуществления изобретение включает в себя новые кристаллические и аморфные формы соединения формулы I и смесь тиакумицинов. В другом варианте осуществления изобретение включает в себя смесь, содержащую первый полиморф соединения формулы I, второй полиморф соединения формулы I и другие полиморфные формы, аморфные формы и их смеси.
В другом конкретном варианте осуществления кристаллические полиморфы и аморфные формы получают из смеси тиакумицинов.
В другом варианте осуществления кристаллический полиморф соединения формулы I имеет репрезентативную порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно +0,15, еще более предпочтительно +0,2. В другом варианте осуществления кристаллический полиморф соединения формулы I имеет репрезентативную порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,8°, 15,1° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно +0,15, еще более предпочтительно +0,2.
В другом варианте осуществления полиморф имеет химическую структуру

В другом варианте осуществления полиморф имеет химическую структуру соединения формулы I

В другом варианте осуществления полиморф дополнительно содержит по меньшей мере одно соединение, выбранное из смеси тиакумицинов.
В другом варианте осуществления полиморф формулы I присутствует в количестве от по меньшей мере приблизительно 75% до приблизительно 99,99%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 75%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 80%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 85%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньше мере приблизительно 90%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 93%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 95%.
В другом варианте осуществления полиморф формулы I присутствует в количестве по меньшей мере приблизительно 99%.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет точку плавления от приблизительно 163°C до приблизительно 169°C. В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет точку плавления от приблизительно 160°C до приблизительно 170°C. В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет точку плавления от приблизительно 155°C до приблизительно 175°C.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов и его ДСК имеет эндотермический эффект в диапазоне от приблизительно 174°C до приблизительно 186°C; предпочтительно 175-185°C.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно ±0,15, еще более предпочтительно ±0,2, и имеет точку плавления от приблизительно 163°C до приблизительно 169°C.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно ±0,15, еще более предпочтительно ±0,2, и имеет точку плавления от приблизительно 160°C до приблизительно 170°C.
Другой вариант осуществления включает в себя кристаллический полиморф, полученный из смеси тиакумицинов, которая имеет порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно ±0,15, еще более предпочтительно ±0,2. В конкретном варианте осуществления полиморф имеет химическую структуру соединения формулы I. В другом варианте осуществления кристаллический полиморф дополнительно содержит по меньшей мере одно соединение, выбранное из смеси тиакумицинов.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет точку плавления от приблизительно 150°C до приблизительно 156°C.
В другом варианте осуществления кристаллический полиморф получают из смеси тиакумицинов, которая имеет порошковую рентгенограмму, содержащую по меньшей мере пики при следующих углах дифракции 2θ: 7,4°, 15,5° и 18,8°±0,2, и имеет точку плавления от приблизительно 150°C до приблизительно 156°C.
Другой вариант осуществления изобретения включает в себя фармацевтические композиции, содержащие терапевтически или профилактически эффективное количество кристаллического полиморфа соединения формулы

и фармацевтически приемлемый носитель.
В конкретном варианте осуществления фармацевтическая композиция содержит первый полиморф соединения формулы I, второй полиморф соединения формулы I, другие полиморфные формы соединения формулы I, аморфные формы соединения формулы I и их смеси.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции имеет пики при следующих углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно ±0,15, еще более предпочтительно ±0,2.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции дополнительно содержит по меньшей мере одно соединение, выбранное из смеси тиакумицинов.
В другом варианте осуществления соединение формулы I присутствует в количестве от по меньшей мере приблизительно 75% до приблизительно 99,99%, предпочтительно приблизительно 75%, приблизительно 85%, приблизительно 95% или приблизительно 99%.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции имеет точку плавления от приблизительно 163°C до приблизительно 169°C.
Другой вариант осуществления включает в себя фармацевтическую композицию, содержащую кристаллический полиморф тиакумицина, содержащий пики при следующих углах дифракции 2θ: 7,6°, 15,4° и 18,8°±0,04, предпочтительно ±0,1, более предпочтительно ±0,15, еще более предпочтительно ±0,2. В конкретном варианте осуществления фармацевтическая композиция дополнительно содержит по меньшей мере одно соединение, выбранное из смеси тиакумицинов. В другом конкретном варианте осуществления соединение формулы I присутствует в количестве от приблизительно 75% до приблизительно 99,99%, предпочтительно 75%, 85%, 95% или 99%.
В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 15% смеси тиакумицинов. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 10% смеси тиакумицинов. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 7% смеси тиакумицинов. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 5% смеси тиакумицинов. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 1% смеси тиакумицинов. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 15% смеси S-тиакумицина. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 10% смеси S-тиакумицина. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 7% смеси S-тиакумицина. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 5% смеси S-тиакумицина. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 1% смеси S-тиакумицина. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 15% смеси липиармицина А4. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 10% смеси липиармицина А4. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 7% смеси липиармицина А4. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 5% смеси липиармицина А4. В другом варианте осуществления изобретение включает в себя фармацевтическую композицию, содержащую стереомерно чистый R-тиакумицин и менее 1% смеси липиармицина А4.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции имеет точку плавления от приблизительно 153°C до приблизительно 156°C.
В другом варианте осуществления терапевтически или профилактически эффективное количество составляет от приблизительно 0,01 мг/кг до приблизительно 1000 мг/кг, предпочтительно 0,01, 0,1, 1, 2,5, 5, 10, 20, 50, 100, 250 или 500 мг/кг.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции является подходящим для парентерального введения, предпочтительно внутривенного, внутримышечного или внутриартериального.
В другом варианте осуществления кристаллический полиморф фармацевтической композиции является подходящим для перорального введения.
Другой вариант осуществления изобретения включает в себя способ лечения бактериальной инфекции, содержащий введение фармацевтической композиции, содержащей полиморф изобретения, субъекту, нуждающемуся в этом.
В конкретном варианте осуществления бактериальная инфекция находится в желудочно-кишечном тракте, особенно инфекция ААС или AAD.
Определения
Термин "антибиотик-ассоциированное состояние" относится к состоянию, являющемуся результатом того, что антибиотическая терапия нарушает баланс микробной флоры кишечника, что позволяет обильно размножаться патогенным организмам, таким как продуцирующим энтеротоксин штаммам C. difficile, S. aureus и C. perfringens. Эти организмы могут вызвать диарею, псевдомембранозный колит и колит и проявляются среди других симптомов диареей, острым позывом к мочеиспусканию, судорогами в животе, тенезмами и лихорадкой. Диарея, когда она является тяжелой, вызывает обезвоживание и медицинские осложнения, связанные с обезвоживанием.
Термин "асимметрично замещенный" относится к молекулярной структуре, в которой атом, имеющий четыре тетраэдральные валентности, присоединен к четырем разным атомам или группам. Самые обычные случаи включают в себя атом углерода. В таких случаях результатом является образование двух оптических изомеров (D- и L-энантиомеры или R- и S-энантиомеры) у атома углерода, которые являются неналагаемыми друг на друга зеркальными изображениями. Многие соединения имеют более чем один асимметричный атом углерода. Это приводит к возможности существования многих оптических изомеров, причем число их определяется формулой 2n, где n равно числу асимметричных атомов углерода.
Термин "бульон", применяемый здесь, относится к жидкой культуральной среде, получаемой во время или после ферментации. Бульон содержит смесь воды, требуемого антибиотика(ов), не использованных до сих пор питательных компонентов, живых или погибших организмов, метаболических продуктов и адсорбента с адсорбированным продуктом или без адсорбированного продукта.
Используемые здесь, если не оговорено иначе, термины "бактериальная инфекция(и)" и "протозойная инфекция(и)" применяют взаимозаменяемым образом и эти термины включают в себя бактериальные инфекции и протозойные инфекции, которые встречаются у млекопитающих, рыб и птиц, а также нарушения, связанные с бактериальными инфекциями и протозойными инфекциями, которые можно лечить или предупредить антибиотиками, такими как соединения изобретения. Такие бактериальные инфекции и протозойные инфекции и нарушения, связанные с такими инфекциями, включают в себя нарушения, связанные с применением антибиотиков, химиотерапии или противовирусных терапий, включающие в себя, но не ограничивающиеся перечисленным, колит, например псевдомембранозный колит, связанную с антибиотиком диарею и инфекции, обусловленные видами Clostridium difficile, Clostridium perfringens, Staphylococcus, резистентным к метициллину Staphylococcus или Enterococcus, включая резистентный к ванкомицину enterococci; связанные с антибиотиком диареи, в том числе диареи, вызванные продуцирующими токсин штаммами C. difficile, S. aureus, включая резистентный к метициллину Staphylococcus aureus и C. perfringens; и связанный с антибиотиком колит; пневмонию, воспаление среднего уха, синусит, бронхит, тонзиллит и мастоидит, связанный с инфекцией Staphylococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphlococcus aureus или Peptostreptococcus spp.; фарингит, ревматическую атаку и гломерулонефрит, связанный с инфекцией Streptococcus pyogenes, стрептококками групп С и G, Clostridium diptheriae или Actinobacillus haemolyticum; инфекционные заболевания дыхательных путей, связанные с инфекцией Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; неосложненные инфекционные заболевания кожи и мягких тканей, абсцессы и остеомиелит, и послеродовой сепсис, связанный с инфекцией Staphlococcus aureus, коагулаза-положительными стафилококками (например, S.epidermis и S.hemolyticus), Staphylococcus pyogenes. Streptococcus agalactiae, стрептококковыми группами C-F (крошечной колонией стрептококка), стрептококком viridans, Corynebacterium minutissimum, Clostridium spp. или Bartonella henselae; неосложненные острые инфекционные заболевания мочевых путей, связанные с инфекцией Staphylococcus saprophyticus или Enterococcus spp.; уретрит и цервицит; и переносимые половым путем заболевания, связанные с инфекцией Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrhea; токсинные заболевания, связанные с инфекцией S. aureus (пищевое отравление и синдром токсического шока) или стрептококками групп А, В и С; язвы, связанные с инфекцией Helicobacterpylori, системные лихорадочные синдромы, связанные с инфекцией Borrelia recurrentis; болезнь Лайма, связанная с инфекцией Borrelia burgdorferi, конъюнктивит, кератит и дакроцистит, связанные с инфекцией Chlamydia trachomatis, Neisseria gonorrhoeae, S. aureus, S. pneumoniae, S. pyogenes, H. influenzae или Listeria spp.; диссеминированное заболевание комплекса микобактерий avium (MAC), связанное с инфекцией Mycobacterium avium или Mycobacterium intracellular; гастроэнтерит, связанный с инфекцией Campylobacter jejuni, кишечное протозойное заболевание, связанное с инфекцией Cryptosporidium spp.; одонтогенное инфекционное заболевание, связанное с инфекцией стрептококками viridans; устойчивый кашель, связанный с инфекцией Bordetella pertussis; газовую гангрену, связанную с инфекцией Clostridium perfringens или Bacteroides spp.; и атеросклероз, связанный с инфекцией Helicobacter pylori или Chlamydia pneumoniae. Бактериальные инфекции и протозойные инфекции и нарушения, связанные с такими инфекциями, которые можно лечить или предотвратить у животных, включают следующие заболевания: респираторную болезнь коров, связанную с инфекцией P. haem., P. multocida, Mycoplasma bovis или Bordetella spp.; болезнь кишечника коров, связанную с инфекцией Е. coli или простейшими (например, coccidia, cryptosporidia и т.д.); мастит молочных коров, связанный с инфекцией Staph. aureus, Strep. uberis, Strep. agalactiae, Strep. dysgalactiae, Klebsiella spp., Corynebacterium или Enterococcus spp.; респираторную болезнь свиней, связанную с инфекцией A.pleuro., P. multocida или Mycoplasma spp.; болезнь кишечника свиней, связанную с инфекцией Е. coli Lawsonia intracellulars, сальмонеллой или Serpulina hyodyisinteriae; копытную гниль у коров, связанную с инфекцией Fusobacterium spp.; коровий метрит, связанный с инфекцией Е. coli; коровьи волосатые бородавки, связанные с инфекцией Fusobacterium necrophorum или Bacteroides nodosus; коровий острый эпидемический конъюнктивит, связанный с инфекцией Moraxella bovis; преждевременные роды коров, связанные с инфекцией простейшими (например, neosporium), инфекционную болезнь мочевых путей у собак и кошек, связанную с инфекцией Е. coli; инфекционные болезни кожи и мягких тканей у собак и кошек, связанные с инфекцией Staph. epidermidis, Staph. intermedius, соагулазаотриц. Staph. или Р. multocida; и инфекционные болезни зубов или полости рта у собак и кошек, связанные с инфекцией Alcaligenes spp., Bacteroides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. Другие бактериальные инфекции и протозойные инфекции и нарушения, связанные с такими инфекциями, которые можно лечить или предотвратить согласно способам изобретения, указываются в публикации Sanford, J.P., et al., "The Sanford Guide To Antimicrobial Therapy," 27th Edition (Antimicrobial Therapy, Inc., 1996).
Применяемый здесь, если не оговорено иначе, термин "связывающие вещества" относится к агентам, применяемым для придания связывающих свойств порошкообразному веществу. Связывающие вещества или "грануляторы", как они иногда известны, придают связывающую способность веществу при изготовлении таблетки, обеспечивают способность таблетки оставаться целой после прессования, а также улучшают сыпучие свойства изготовлением гранул требуемой твердости и размера. Вещества, обычно применяемые в качестве связывающих веществ, включают в себя крахмал; желатин; сахара, такие как сахароза, глюкоза, декстроза, меласса и лактоза; природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, экстракт ирландского мха, камедь panwar, камедь ghatti, гуммиарабик Isapol husks, карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон, вигум, микрокристаллическую целлюлозу, микрокристаллическую декстрозу, амилозу, венецианский арабогалактан и тому подобное.
Применяемые здесь, если не оговорено иначе, термины "биогидролизуемый амид", "биогидролизуемый сложный эфир", "биогидролизуемый карбамат", "биогидролизуемый карбонат", "биогидролизуемый уреид", "биогидролизуемый фосфат" означают амид, сложный эфир, карбамат, карбонат, уреид или фосфат, соответственно, соединения, которые либо 1) не препятствуют биологической активности соединения, но могут придавать при этом соединению благоприятные свойства in vivo, такие как поглощение, продолжительность действия или начало действия, или 2) являются биологически неактивными, но превращаются in vivo в биологически активное соединение. Примеры гидролизуемых сложных эфиров включают в себя, но не ограничиваются перечисленным, низшие алкиловые сложные эфиры, низшие ацилоксиалкиловые сложные эфиры (такие как ацетоксиметиловые, ацетоксиэтиловые, аминокарбонилоксиметиловые, пивалоилоксиметиловые и пивалоилоксиэтиловые сложные эфиры), лактониловые сложные эфиры (такие как фталидиловые и тиофталидиловые сложные эфиры), низшие алкоксиацилоксиалкиловые сложные эфиры (такие как метоксикарбонилоксиметиловые, этоксикарбонилоксиэтиловые и изопропоксикарбонилоксиэтиловые сложные эфиры), алкоксиалкиловые сложные эфиры, холиновые сложные эфиры и ациламиноалкиловые сложные эфиры (такие как ацетамидометиловые сложные эфиры). Примеры биогидролизуемых амидов включают в себя, но не ограничиваются перечисленным, низшие алкиламиды, амиды аминокислот, алкоксиациламиды и алкиламиноалкилкарбониламиды. Примеры биогидролизуемых карбаматов включают в себя, но не ограничиваются перечисленным, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и полиэфирамины.
Применяемый здесь, если не оговаривается иначе, термин "носитель" относится к разбавителю, адъюванту, эксципиенту или наполнителю, с которым вводят композицию. Такими фармацевтическими носителями могут быть стерильные жидкости, такие как вода и масла, в том числе масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное.
Применяемый здесь, если не оговорено особо, термин "соединения изобретения" означает сообща соединение формулы I и/или его фармацевтически приемлемые соли и полиморфы. Соединения изобретения идентифицируют здесь по их химической структуре и/или химическому названию. Когда соединение указывают как по химической структуре, так и химическому названию, и когда химическая структура и химическое название противоречат друг другу, химическая структуры является решающим фактором для идентификации соединения. Соединения изобретения могут содержать один или несколько хиральных центров и/или двойных связей и поэтому существуют в виде стереоизомеров, таких как изомеры по двойной связи (т.е. геометрические изомеры), энантиомеры или диастереомеры. Согласно изобретению, химические структуры, изображенные здесь, и, следовательно, соединения изобретения включают в себя все соответствующие энантиомеры и стереоизомеры соединений, то есть как стереомерно чистую (индивидуальную) форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую), так и энантиомерные и стереоизомерные смеси. Энантиомерные и стереоизомерные смеси можно разделить на их компонентные энантиомеры или стереоизомеры хорошо известными способами, такими как газовая хроматография с хиральной фазой, высокоэффективная жидкостная хроматография с хиральной фазой, кристаллизация соединения в виде хирального комплекса соли или кристаллизация соединения в хиральном растворителе. Энантиомеры и стереоизомеры можно также получить из стереомерно или энантиомерно чистых промежуточных продуктов, реагентов и катализаторов хорошо известными способами асимметрического синтеза. Соединения изобретения предпочтительно являются по существу стереомерно чистыми. В конкретном варианте осуществления термин "соединение изобретения" относится к соединению формулы, которое имеет чистоту более 75%, предпочтительно имеет чистоту более 85%, более предпочтительно имеет чистоту более 95% и наиболее предпочтительно имеет чистоту более 99%, и его полиморфной форме (например, полиморфу соединения формулы I) и его аморфным формам.
Применяемые здесь, если не оговорено иначе, "разбавители" являются инертными веществами, добавляемыми для увеличения объема композиции для прессования при изготовлении таблетки практического размера. Обычно применяемые разбавители включают в себя фосфат кальция, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, сухой крахмал, порошкообразный сахар, диоксид кремния и тому подобное.
Применяемые здесь, если не оговорено иначе, "дезинтеграторы" или "дезинтегранты" являются веществами, которые облегчают разрушение или дезинтеграцию таблеток после введения.
Вещества, действующие в качестве дезинтеграторов, химически классифицируют как крахмалы, глины, целлюлозы, альгины или камеди. Другие дезинтеграторы включают в себя вигум HV, метилцеллюлозу, агар, бентонит, целлюлозу и древесные продукты, природную губку, катионообменные смолы, альгиновую кислоту, гуаровую камедь, лимонную пульпу, сшитый поливинилпирролидон, карбоксиметилцеллюлозу и тому подобное.
При введении субъекту (например, животному для ветеринарного применения или человеку для клинического применения) соединения изобретения вводят в выделенной форме. При применении здесь, если не оговорено иначе, "выделенный" означает, что соединения изобретения отделены от других компонентов либо (а) природного источника, такого как растительный или клеточный источник, предпочтительно бактериальной культуры, или (b) синтетической органической химической реакционной смеси, предпочтительно, посредством общепринятых методик, и соединения изобретения являются очищенными. Применяемый здесь термин "очищенный" означает, что при выделении выделенный продукт содержит по меньшей мере приблизительно 70%, предпочтительно по меньшей мере приблизительно 80%, более предпочтительно по меньшей мере приблизительно 90%, еще более предпочтительно по меньшей мере приблизительно 95% и наиболее предпочтительно по меньшей мере приблизительно 99% соединения изобретения в расчете на массу выделенного продукта.
Термин "макролид" или "макроцикл" относится к органическим молекулам со структурой больших колец, обычно содержащих свыше 10 атомов.
Термин "18-членные макроциклы" относится к органическим молекулам со структурами колец, содержащих 18 атомов.
Термин "MIC" или "минимальная ингибирующая концентрация" относится к самой низкой концентрации антибиотика, который требуется для ингибирования роста бактериального изолята in vitro. Общим способом определения MIC антибиотика является приготовление нескольких пробирок, содержащих серийные разведения антибиотика, которые затем инокулируют представляющим интерес бактериальным изолятом. MIC антибиотика можно определить по пробирке с самой низкой концентрацией, которая не обнаруживает помутнения (отсутствует рост).
Термин "MIC50" относится к самой низкой концентрации антибиотика, требуемой для ингибирования роста 50% бактериальных штаммов, испытуемых в данном бактериальном виде.
Термин "MIC90" относится к самой низкой концентрации антибиотика, требуемой для ингибирования роста 90% бактериальных штаммов, испытуемых в данном бактериальном виде.
Применяемый здесь, если не оговорено иначе, термин "смесь тиакумицинов" относится к композиции, содержащей по меньшей мере одно макролидное соединение из семейства известных тиакумицинов. В другом варианте осуществления термин "смесь тиакумицинов" включает в себя смесь, содержащую по меньшей мере один из известных тиакумицинов и соединение формулы I, где соединение формулы I присутствует в количестве приблизительно 50 масс.%, 60 масс.%, 70 масс.%, 80 масс.%, 90 масс.%, 95 масс.%, 99 масс.%, 99,9 масс.% или 99,99 масс.%. В частности, термин "смесь тиакумицинов" относится к композициям, содержащим соединение формулы I, где соединение формулы I имеет отношение относительного времени удерживания ("RTT") 1,0, и дополнительно содержащим по меньшей мере одно из следующих соединений:
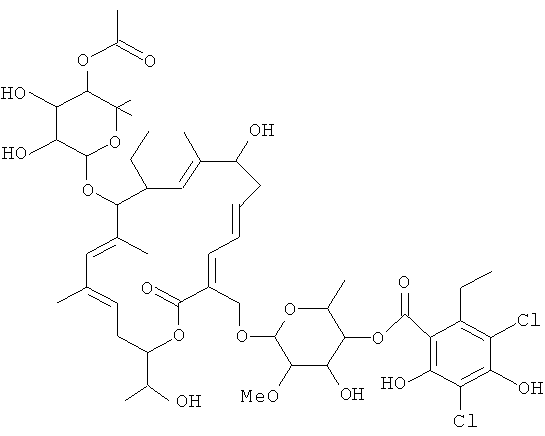
Соединение 101, отношение RRT 0,71

Соединение 102, отношение RRT 0,81
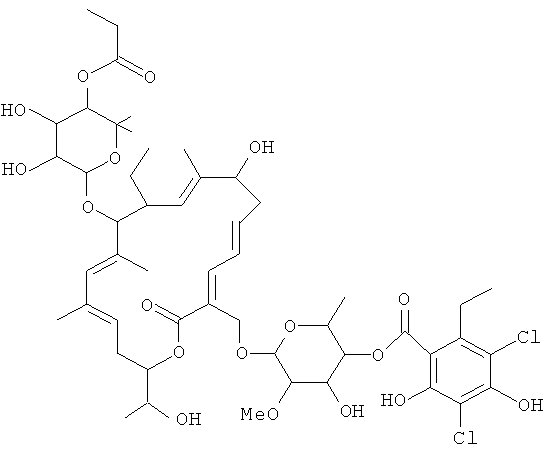
Соединение 103, отношение RRT 0,84
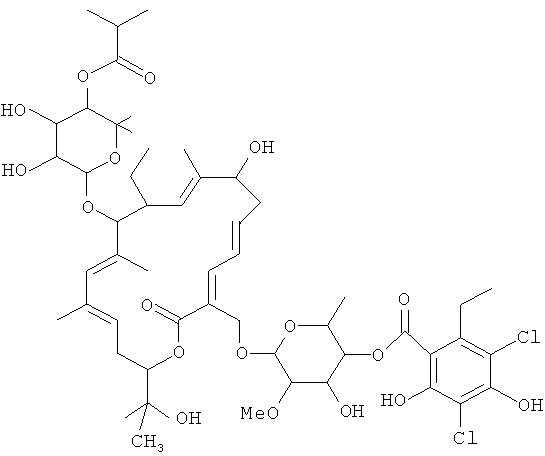
Соединение 104, отношение RRT 1,13
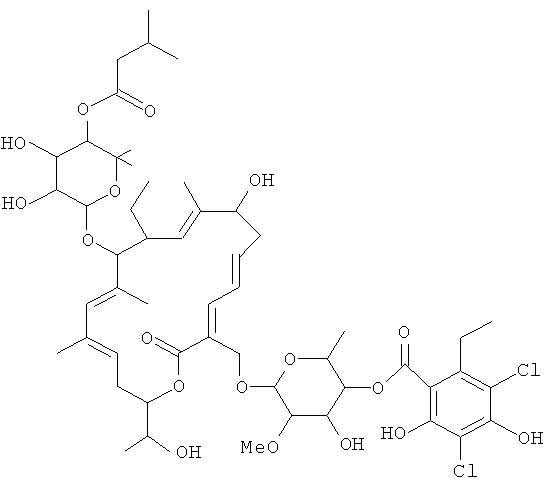
Соединение 105, отношение RRT 1,19
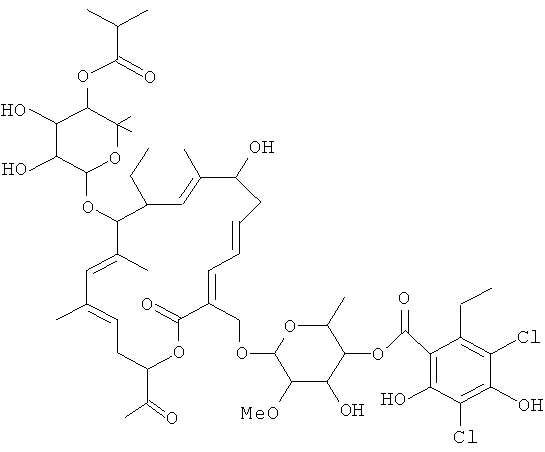
Соединение 106, отношение RRT 1,24
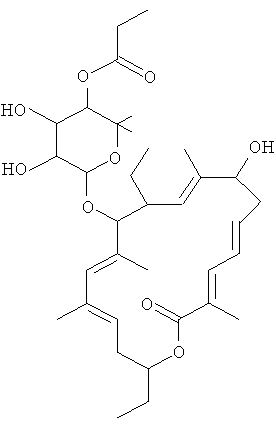
Соединение 107, отношение RRT 1,39
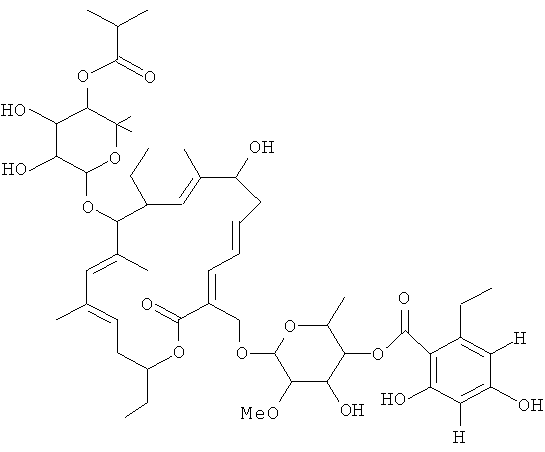
Соединение 108, отношение RRT 1,48
Соединение 109, отношение RRT 0,89

Соединение 110, отношение RRT 0,92
Соединение 111, отношение RRT 0,95

Соединение 112, отношение RRT 1,10
В некоторых иллюстративных вариантах осуществления, когда соединение 109 присутствует в смеси, в смеси необязательно также присутствует одно из соединений 110, 111 и/или 112. Соединение 109 также иногда называют липиармицином А4. Соединение 110 также иногда называют тиакумицином F. Соединение 111 также иногда называют тиакумицином С. Соединение 112 также иногда называют тиакумицином А.
Применяемые здесь, если не оговорено иначе, термины "оптически чистый", "стереомерно чистый" и "по существу стереомерно чистый" применяют взаимозаменяемым образом и они означают один стереоизомер соединения или композицию, которая содержит один стереоизомер соединения и по существу не содержит другой стереоизомер(ы) такого соединения. Например, стереомерно чистое (индивидуальное) соединение или композиция соединения, имеющего один хиральный центр, не будет по существу содержать противоположный энантиомер соединения. Стереомерно чистое (индивидуальное) соединение или композиция соединения, имеющего два хиральных центра, не будет по существу содержать другие диастереомеры соединения. Типичное стереомерно чистое соединение содержит больше чем приблизительно 80 масс.% одного стереоизомера соединения и меньше чем приблизительно 20 масс.% других стереоизомеров соединения, более предпочтительно больше чем приблизительно 90 масс.% одного стереоизомера соединения и меньше чем приблизительно 10 масс.% других стереоизомеров соединения, еще более предпочтительно больше чем приблизительно 95 масс.% одного стереоизомера соединения и меньше чем приблизительно 5 масс.% других стереоизомеров соединения и наиболее предпочтительно больше чем приблизительно 97 масс.% одного стереоизомера соединения и меньше чем приблизительно 3 масс.% других стереоизомеров соединения.
Применяемый здесь, если не оговорено иначе, термин "фармацевтически приемлемый" относится к веществам и композициям, которые являются физиологически переносимыми и обычно не вызывают аллергическую или аналогичную неблагоприятную реакцию, такую как "желудочное расстройство", головокружение и тому подобное, при введении человеку. Применяемый здесь термин "фармацевтически приемлемый" обычно означает одобренный агентством регламентирования Федерального правительства или правительства Штата или перечисленный в фармакопее США или другой обычно признанной фармакопее для применения при лечении животных и, более конкретно, людей.
Применяемый здесь, если не оговорено иначе, термин "фармацевтически приемлемый гидрат" означает соединение изобретения, которое дополнительно включает в себя стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными связями.
Применяемый здесь, если не оговорено иначе, термин "фармацевтически приемлемый полиморф" относится к соединению изобретения, которое существует в нескольких различных формах (например, кристаллических, аморфных), изобретение включает в себя все такие формы.
Применяемый здесь, если не оговорено иначе, термин "фармацевтически приемлемое пролекарство" означает производное модифицированного полиморфа соединения формулы I, которое может гидролизоваться, окисляться или другим образом реагировать в биологических условиях (in vitro или in vivo) с образованием соединения. Примеры пролекарств включают в себя, но не ограничиваются перечисленным, соединения, которые содержат биогидролизуемые части, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают в себя соединения, которые содержат олигонуклеотиды, пептиды, липиды, алифатические и ароматические группы или части NO, NO2, ONO и ONO2. Пролекарства обычно получают с применением хорошо известных способов, таких как способы, описанные в Burger's Medicinal Chemistry and Drug Discovery, 172 178, 949 982 (Manfred E. Wolff ed., 5th ed. 1995) и Design of Prodrugs (H. Bundgaard ed., Elselvier, New York 1985).
Фраза "фармацевтически приемлемая соль(и)", применяемая здесь, включает в себя, но не ограничивается перечисленным, соли кислотных и основных групп, которые могут присутствовать в соединениях, применяемых в настоящих композициях. Соединения, включенные в настоящие композиции, которые являются основными по природе, способны образовывать целый ряд солей с различными неорганическими и органическими кислотами. Кислотами, которые можно применять для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, являются кислоты, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, включающие в себя, но не ограничивающиеся перечисленным, анионы серной, лимонной, малеиновой, уксусной, щавелевой кислот, гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)). Соединения, включенные в настоящие композиции, которые включают в себя аминогруппу, могут образовывать фармацевтически приемлемые соли с различными аминокислотами помимо кислот, указанных выше. Соединения, включенные в настоящие композиции, которые являются кислотными по природе, способны образовывать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочноземельных металлов и особенно соли кальция, магния, натрия, лития, цинка, калия и железа.
Применяемый здесь, если не оговорено иначе, термин "профилактически эффективный" относится к количеству соединения или композиции изобретения, или фармацевтически приемлемой соли, сольвата, полиморфа или пролекарства соединения, вызывающему уменьшение риска появления данного заболевания или нарушения. Согласно этому, соединения изобретения можно применять для профилактики одного заболевания или нарушения и одновременно для лечения другого (например, профилактики ААС при лечении мочевого AAD). В некоторых вариантах осуществления композиции изобретения вводят пациенту, предпочтительно человеку, в качестве профилактической меры против таких заболеваний. Применяемый здесь термин "профилактика" или "предупреждение" относится к уменьшению риска появления данного заболевания или нарушения.
Применяемым здесь термином "субъект" может быть млекопитающее, предпочтительно человек или животное. Подвергаемым лечению субъектом является пациент, нуждающийся в таком лечении.
Применяемая здесь, если не указано иначе, фраза "терапевтически эффективное количество" соединения или композиции изобретения или фармацевтически приемлемой соли, сольвата, полиморфа или пролекарства такого соединения измеряется терапевтической эффективностью соединения изобретения, при которой по меньшей мере одно отрицательное действие нарушения уменьшается или ослабляется. В одном варианте осуществления термин "терапевтически эффективное количество" означает количество лекарственного средства или соединения изобретения, которое является достаточным для обеспечения требуемого локального или системного действия и результата при приемлемом отношении польза/риск, сопровождающим любое консервативное лечение. В одном варианте осуществления фраза "терапевтически эффективное количество" композиции изобретения измеряется терапевтической эффективностью соединения изобретения по ослаблению по меньшей мере одного симптома, связанного с бактериальными или протозойными инфекциями. Авторами изобретения неожиданно было обнаружено, что терапевтически эффективные количества соединений изобретения являются применимыми при лечении или профилактике бактериальных и протозойных инфекционных заболеваний.
Применяемый здесь, если не оговорено особо, термин "лечение" или "терапия" относится к ослаблению заболевания или нарушения или по меньшей мере одного его явного симптома, предпочтительно связанного с бактериальной или протозойной инфекцией. В другом варианте осуществления термин "лечение" или "терапия" относится к улучшению по меньшей мере одного измеряемого физического параметра, не обязательно ощущаемого пациентом. Еще в одном варианте осуществления термин "лечение" или "терапия" относится к ингибированию развития заболевания или нарушения либо физически, например стабилизации явного симптома, либо физиологически, например стабилизации физического параметра, либо обоим. Еще в одном варианте осуществления термин "лечение" или "терапия" относится к задержке начала заболевания или нарушения.
Композиции изобретения для терапевтического/профилактического введения
Изобретение включает в себя композиции, содержащие первый полиморф соединения формулы I, второй полиморф соединения формулы I, другие полиморфные формы, аморфную форму или смеси их или смесь тиакумицинов с различными количествами соединения формулы I.
Изобретение дополнительно включает в себя антибиотическую композицию, которая является смесью тиакумицинов, для применения при лечении CDAD, а также AAD и ААС. Смесь тиакумицинов содержит от приблизительно 76 до приблизительно 100% соединения формулы I, которое принадлежит к семейству 18-членного макролида тиакумицина.
Вследствие активности соединений изобретения, эти соединения являются применимыми подходящим образом в ветеринарии и медицине. Соединения изобретения являются применимыми для лечения или профилактики бактериальных и протозойных заболеваний. В некоторых вариантах осуществления субъект имеет инфекционное заболевание, но у него не проявляются или не обнаруживаются любые физиологические симптомы, связанные с инфекцией.
Изобретение относится к способам лечения и профилактики введением пациенту терапевтически эффективного количества композиции, содержащей кристаллическую полиморфную или аморфную форму соединения изобретения. Пациентом является млекопитающее, включающее в себя, но не ограничивающееся перечисленным, животное, такое как корова, лошадь, овца, свинья, цыпленок, индюк, перепел, кошка, собака, мышь, крыса, кролик, морская свинка и т.д., и более предпочтительно человек.
Настоящие композиции, которые содержат одну или несколько кристаллических полиморфных форм или аморфную форму соединений изобретения или смесь тиакумицинов, можно вводить любым общепринятым путем, например пероральным введением, парентеральным введением, инфузией или инъекцией болюса, абсорбцией через эпителиальные или кожно-слизистые выстилки (например, слизистую оболочку полости рта, ректальную и кишечную слизистые оболочки и т.д.), и можно вводить вместе с другим биологически активным агентом. Введение может быть системным или локальным. Известны различные системы доставки, например капсулирование в липосомах, микрочастицах, микрокапсулах, капсулах и т.д., их можно применять для введения соединения изобретения. В некоторых вариантах осуществления пациенту вводят более чем одно соединение изобретения и смесь тиакумицинов. Способы введения включают в себя, но не ограничиваются перечисленным, внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный, пероральный, сублингвальный, интрацеребральный, интравагинальный, трансдермальный, ректальный способы, ингаляцией или местно, особенно введением в уши, нос, глаза или кожу. Предпочтительный путь введения отдается на усмотрение практикующего врача, и путь введения частично будет зависеть от места лекарственного лечения. В большинстве случаев введение приведет к высвобождению кристаллической полиморфной или аморфной формы соединения изобретения в кровоток.
В определенных вариантах осуществления может быть желательно ввести одну или несколько кристаллических полиморфных форм или аморфную форму соединения изобретения локально на участок, нуждающийся в лечении. Это можно достичь, например, но без ограничения перечисленным, локальной инфузией во время хирургической операции, местным нанесением, например, в сочетании с перевязыванием раны после хирургической операции, инъекцией, при помощи катетера, при помощи суппозитория или при помощи имплантата, причем имплантатом является пористый, непористый или желатинозный материал, в том числе мембраны, такие как силастиковые мембраны, или волокна. В одном варианте осуществления введение можно проводить непосредственной инъекцией в место (или предшествующее место) ткани атеросклеротической бляшки.
Можно также применять легочное введение, например, с применением ингалятора или распылителя и препарата с образующим аэрозоль агентом или посредством перфузии во фторуглероде или синтетическом легочном поверхностно-активном веществе. В некоторых вариантах осуществления соединения изобретения можно изготовить в виде суппозиториев с традиционными связывающими агентами и наполнителями, такими как триглицериды.
В другом варианте осуществления кристаллическую полиморфную или аморфную форму соединения изобретения можно доставить в везикуле, в частности в липосоме (см. Langer, 1990, Science 249:1527-1533; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); Lopez-Berestein, ibid., pp.317-327; see generally ibid.).
Еще в одном варианте осуществления соединения изобретения можно доставить в системе с регулируемым высвобождением. В одном варианте осуществления применяют насос (см. Langer, supra; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201; Buchwald et al., 1980, Surgery 88:507 Saudek et al., 1989, N. Engl. J. Med. 321:574). В другом варианте осуществления можно применять полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol. Chem. 23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71: 105). Еще в одном варианте осуществления систему с регулируемым высвобождением можно поместить вблизи мишени для соединений изобретения, например печени, в результате чего требуется только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, supra, vol.2, pp.115-138 (1984)). Можно применять другие системы с регулируемым высвобождением, обсуждаемые в обзоре Langer, 1990, Science 249:1527-1533).
Настоящие композиции будут содержать терапевтически эффективное количество кристаллической полиморфной или аморфной формы соединения изобретения, необязательно более одной кристаллической полиморфной или аморфной формы соединения изобретения, предпочтительно в очищенной форме, вместе с подходящим количеством фармацевтически приемлемого наполнителя, чтобы получить форму для подходящего введения пациенту.
В определенном варианте осуществления термин "фармацевтически приемлемый" означает одобренный агентством регламентирования Федерального правительства или правительства Штата или перечисленный в Фармакопее США или другой обычно признанной фармакопее для применения при лечении животных и более особенно людей. Термин "наполнитель" относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят соединение изобретения. Такими фармацевтическими наполнителями могут быть жидкости, такие как вода и масла, в том числе масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Фармацевтическими наполнителями могут быть физиологический раствор, аравийская камедь, желатин, крахмальная паста, тальк, кератин, коллоидальный диоксид кремния, мочевина и тому подобное. Кроме того, можно применять вспомогательные, стабилизирующие, загущающие, смазывающие и окрашивающие агенты. При введении пациенту соединения изобретения и фармацевтически приемлемые наполнители предпочтительно являются стерильными. Вода является предпочтительным наполнителем, когда соединение изобретения вводят внутривенно. В качестве жидких наполнителей можно также применять физиологические растворы и водные растворы декстрозы и глицерина, особенно для инъецируемых растворов. Подходящие фармацевтические наполнители включают в себя также эксципиенты, такие как крахмал, глюкоза, лактоза, сахароза, желатин, мальт, рис, мука, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, высушенное сепарированное молоко, глицерин, пропиленгликоль, вода, этанол и тому подобное. Настоящие композиции, если требуется, могут содержать также небольшие количества смачивающих или эмульгирующих агентов или pH-буферных агентов.
Настоящие композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, капсул, содержащих жидкости, порошков, препаратов со стойко поддерживаемым высвобождением, суппозиториев, аэрозолей, спреев или любую другую форму, подходящую для применения. В одном варианте осуществления фармацевтически приемлемым наполнителем является капсула (см., например, патент США №5698155). Другие примеры подходящих фармацевтических наполнителей описаны в "Remington's Pharmaceutical Sciences" by A.R.Gennaro.
В предпочтительном варианте осуществления кристаллическую полиморфную или аморфную форму соединения изобретения изготавливают согласно обычным способам в виде фармацевтической композиции, адаптированной для внутривенного введения людям. Обычно кристаллическая полиморфная или аморфная форма соединения изобретения для внутривенного введения является раствором в стерильном изотоническом водном буфере. Когда необходимо, композиция может также включать в себя солюбилизирующий агент. Композиции для внутривенного введения могут необязательно включать в себя местный анестетик, такой как лидокаин, для успокоения боли в месте инъекции. Ингредиенты обычно подают либо раздельно, либо смешанными в дозированной лекарственной форме, например в виде сухого лиофилизованного порошка или концентрата без воды в герметично запаянном контейнере, таком как ампула или саше, на котором указывается количество активного агента. Когда кристаллическую полиморфную или аморфную форму соединения изобретения нужно ввести инфузией, его можно дозировано подавать, например, сосудом для инфузии, содержащим стерильную воду или физиологический раствор фармацевтического сорта. Когда соединение изобретения вводят инъекцией, могут быть обеспечены ампулы стерильной воды для инъекции или физиологического раствора, так чтобы ингредиенты можно было смешать перед введением.
Предпочтительно, чтобы композиции изобретения вводили перорально. Композиции для пероральной доставки могут быть, например, в форме таблеток, лепешек, водных или масляных суспензий, гранул, порошков, эмульсий, капсул, сиропов или эликсиров. Перорально вводимые композиции могут содержать один или несколько необязательных агентов, например подслащивающие агенты, такие как фруктоза, аспартам или сахарин; корригенты, такие как мята, виноградное масло или вишневое масло; окрашивающие агенты и консерванты, для обеспечения получения фармацевтически приятного на вкус препарата. Кроме того, когда композиции имеют форму таблетки или пилюли, на них можно нанести покрытие для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте, тем самым обеспечивая стойко поддерживаемое действие на протяжении длительного периода времени. Селективно проницаемые мембраны, окружающие осмотически активное движущееся соединение, также являются подходящими для перорально вводимой кристаллической полиморфной или аморфной формы соединения изобретения. В этих последних платформах жидкость из среды, окружающей капсулу, впитывается движущимся соединением, которое набухает с вытеснением агента или композиции агента через отверстие. Эти платформы доставки могут обеспечивать профиль доставки по существу нулевого порядка в противоположность пиковым профилям препаратов с немедленным высвобождением. Можно также применять вещество для временной задержки, такое как моностеарат глицерина или стеарат глицерина. Пероральные композиции могут включать в себя также стандартные наполнители, такие как маннит, лактоза, крахмал, стеарат магния, натриевая соль сахарина, целлюлоза, карбонат магния и т.д. Такие наполнители предпочтительно являются наполнителями фармацевтического сорта.
Количество кристаллической полиморфной или аморфной формы соединения изобретения, которое будет эффективным при лечении конкретного нарушения или состояния, описанного здесь, будет зависеть от природы нарушения или состояния, его можно определить стандартными клиническими методиками. Кроме того, для помощи определения диапазона оптимальных доз можно необязательно применять анализы in vitro или in vivo. Точная доза, которую нужно применять в композициях, будет зависеть также от пути введения и тяжести заболевания или нарушения и должна решаться согласно мнению практикующего врача и каждого из обстоятельств, относящихся к пациенту. Однако подходящие диапазоны доз для перорального введения обычно составляют приблизительно от 0,001 миллиграмма до 1000 миллиграммов соединения изобретения на килограмм массы тела. В определенных предпочтительных вариантах осуществления изобретения пероральная доза составляет от 0,01 миллиграмма до 500 миллиграммов на килограмм массы тела, более предпочтительно от 0,1 миллиграмма до 100 миллиграммов на килограмм массы тела, более предпочтительно от 0,5 миллиграмма до 50 миллиграммов на килограмм массы тела и еще более предпочтительно от 1 миллиграмма до 10 миллиграммов на килограмм массы тела. В наиболее предпочтительном варианте осуществления пероральная доза составляет 1 миллиграмм кристаллической полиморфной или аморфной формы соединения изобретения на килограмм массы тела. Дозированные количества, описанные здесь, относятся к общим вводимым количествам, то есть, если вводят более чем одно соединение изобретения, предпочтительные дозы соответствуют общему количеству вводимых соединений изобретения. Пероральные композиции предпочтительно содержат от 10 масс.% до 95 масс.% активного ингредиента.
Подходящими диапазонами доз для внутривенного (i.v.) введения являются диапазоны от 0,001 миллиграмма до 1000 миллиграммов на килограмм массы тела, от 0,1 миллиграмма до 100 миллиграммов на килограмм массы тела и от 1 миллиграмма до 10 миллиграммов на килограмм массы тела. Подходящими диапазонами доз для интраназального введения являются обычно диапазоны от приблизительно 0,01 пг/кг массы тела до 1 мг/кг массы тела. Суппозитории обычно содержат от 0,01 миллиграмма до 50 миллиграммов соединения изобретения на килограмм массы тела и содержат активный ингредиент в диапазоне от 0,5 масс.% до 10 масс.%. Рекомендованные дозы для внутрикожного, внутримышечного, внутрибрюшинного, подкожного, эпидурального, сублингвального, интрацеребрального, интравагинального, трансдермального введения или введения ингаляцией находятся в диапазоне от 0,001 миллиграмма до 1000 миллиграммов на килограмм массы тела. Подходящие дозы соединений изобретения для местного введения находятся в диапазоне от 0,001 миллиграмма до 1 миллиграмма в зависимости от участка, в который вводят соединение. Эффективные дозы можно экстраполировать из кривых доза-реакция, полученных из систем испытания in vitro или животных моделей. Такие животные модели и системы хорошо известны в данной области.
Изобретение относится также к фармацевтическим упаковкам или наборам, содержащим один или несколько контейнеров, заполненных одной или несколькими кристаллическими полиморфными или аморфными формами соединения изобретения. С таким контейнером(ами) необязательно может быть связано уведомление в форме, предписанной правительственным агентством, регулирующим производство, применение или продажу фармацевтических средств или биологических продуктов, которое отражает одобрение агентством производства, применения или продажу таких продуктов для введения их человеку. В некотором варианте осуществления набор содержит более одной кристаллической полиморфной или аморфной формы соединения изобретения.
Кристаллическую полиморфную или аморфную форму соединения изобретения предпочтительно испытывают in vitro или in vivo на требуемую терапевтическую или профилактическую активность перед применением для людей. Например, испытания in vitro можно применять для определения того, является ли введение определенного соединения изобретения или комбинации соединений изобретения предпочтительным для уменьшения синтеза жирных кислот. Можно также показать, что соединения изобретения являются эффективными и безопасными с применением систем животных моделей.
Другие способы будут известны специалисту в данной области и находятся в пределах объема изобретения.
Общий синтез соединений изобретения
18-Членные макроциклы и их аналоги получают ферментацией. Культивирование подвида hamdenensis AB 718C-41 NRRL 18085 Dactylosporangium aurantiacum для получения тиакумицинов проводят в среде, содержащей источники углерода, неорганические соли и другие органические ингредиенты с одним или несколькими абсорбентами, в подходящих условиях аэрации и смешивания в стерильной окружающей среде.
Микроорганизм, который продуцирует активные антибактериальные агенты, был идентифицирован как принадлежащий к семейству Actinoplanaceae, роду Dactylosporangium (J. Antibiotics, 1987, 40: 567-574 и патент США 4918174). Он был назван подвидом hamdenensis 718C-41 Dactylasporangium aurantiacum. Субкультуру получили из ARS Patent Collection of the Northern Regional Research Center, United States Department of Agriculture, 1815 North University Street, Peoria, IL. 61604, U.S.A., где ей был присвоен номер доступа NRRL 18085. Характеристики штамма AB 718C-41 указаны в the Journal of Antibiotics, 1987, 40: 567-574 и патенте США 4918174.
Данное изобретение включает в себя композицию новых антибиотических агентов, тиакумицинов, полученных глубинной аэробной ферментацией микроорганизма подвида hamdenensis Dactylosporangium aurantiacum. Способ получения описан в заявке WO 2004/014295 А2, которая тем самым включена в качестве ссылки.
ПРИМЕРЫ
1. Получение сырых смесей тиакумицинов и последующая кристаллизация некоторых полиморфов смесей
В иллюстративном варианте осуществления смесь тиакумицинов, содержащую соединение формулы I, получают способом, содержащим
(i) культивирование микроорганизма в питательной среде для аккумуляции смеси в питательной среде и
(ii) выделение смеси из питательной среды, где питательная среда содержит адсорбент для адсорбции смеси.
Питательная среда предпочтительно содержит от приблизительно 0,5 до приблизительно 15 масс.% адсорбента. Адсорбентом предпочтительно является смола-адсорбент. Более предпочтительно, смолой-адсорбентом является амберлит®, XAD16, XAD16HP, XAD2, XAD7HP, XAD1180, XAD1600, IRC50 или дуолит® XAD761. Микроорганизмом предпочтительно является подвид hamdenensis Dactylosporangium aurantiacum. Питательная среда содержит следующую комбинацию в расчете на массу: от приблизительно 0,2% до приблизительно 10% глюкозы, от приблизительно 0,02% до приблизительно 0,5% К2НРO4, от приблизительно 0,02% до приблизительно 0,5% MgSO4·7H2O, от приблизительно 0,01% до приблизительно 0,3% KCl, от приблизительно 0,1% до приблизительно 2% CaCO3, от приблизительно 0,05% до приблизительно 2% казаминокислоты, от приблизительно 0,05% до приблизительно 2% дрожжевого экстракта и от приблизительно 0,5% до приблизительно 15% смолы XAD-16. Стадию культивирования предпочтительно проводят при температуре от приблизительно 25°C до приблизительно 35°C и при pH от приблизительно 6,0 до приблизительно 8,0.
После завершения ферментации твердую массу (в том числе смолу-адсорбент) выделяют из бульона фильтрованием. Твердую массу элюируют органическими растворителями, такими как, например, этилацетат, затем концентрируют при пониженном давлении.
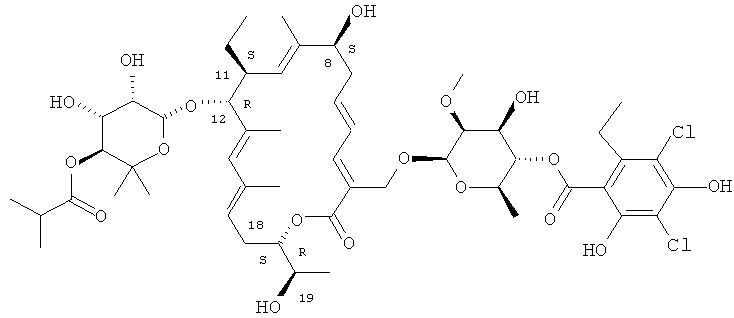
2. Структура R-тиакумицина В
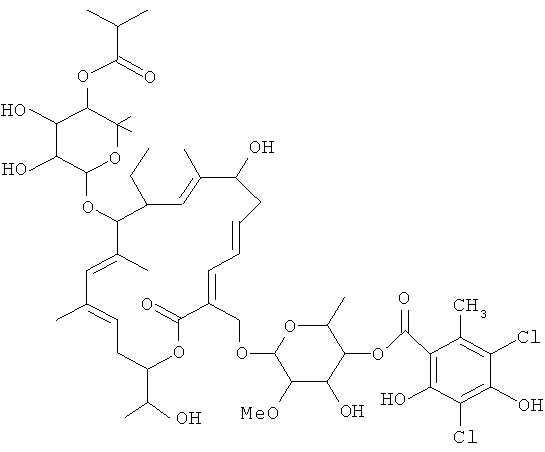
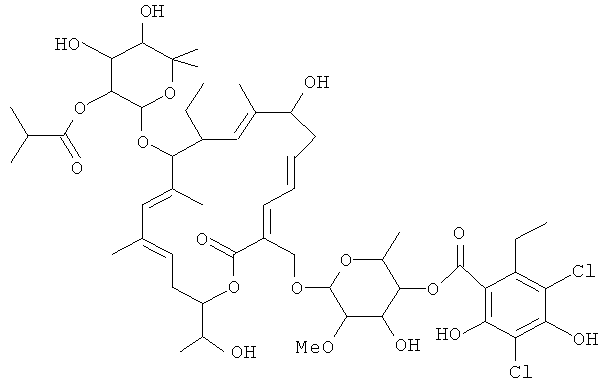
Структура R-тиакумицина В (основной наиболее активный компонент) показана ниже в формуле I. Рентгеновскую кристаллическую структуру R-тиакумицина В получали в виде бесцветного кристалла формы параллелепипеда (0,08×0,14×0,22 мм), выращенного в водном метаноле. Эта рентгеновская структура подтверждает показанную ниже структуру. Официальным химическим названием его является 3-[[[6-деокси-4-O-(3,5-дихлор-2-этил-4,6-дигидроксибензоил)-2-O-метил-β-D-маннопиранозил]окси]метил]-12(R)-[[6-деокси-5-С-метил-4-O-(2-метил-1-оксопропил)-β-D-ликсо-гексопиранозил]окси]-11(S)-этил-8(S)-гидрокси-18(S)-(1(R)-гидроксиэтил)-9,13,15-триметилоксациклооктадека-3,5,9,13,15-пентаен-2-он.
Аналитические данные R-тиакумицина В
Аналитические данные R-тиакумицина В (который почти полностью (т.е. >90%) является R-тиакумицином).
Т.пл. 166-169°C (белые иглы из изопропанола);
[α]D 20 - 6,9 (с 2,0, МеОН);
МС m/z (ESI) 1079,7 (М+Na)+;
1H ЯМР (400 МГц, CD3OD) δ 7,1 (д, 1Н), 6,59 (дд, 1Н), 5,95 (ддд, 1Н), 5,83 (ушир. с, 1Н), 5,57 (т, 1Н), 5,13 (ушир. д, 1Н), 5,09 (т, 1Н), 5,02 (д, 1Н), 4,71 (м, 1Н), 4,71 (ушир. с, 1Н), 4,64 (ушир. с, 1Н), 4,61 (д, 1Н), 4,42 (д, 1Н), 4,23 (м, 1Н), 4,02 (пентет, 1Н), 3,92 (дд, 1Н), 3,73 (м, 2Н), 3,70 (д, 1Н), 3,56 (с, 3H), 3,52-3,56 (м, 2Н), 2,92 (м, 2Н), 2,64-2,76 (м, 3H), 2,59 (гептет, 1Н), 2,49 (ддд, 1Н), 2,42 (ддд, 1Н), 2,01 (дкв, 1Н), 1,81 (с, 3H), 1,76 (с, 3H), 1,65 (с, 3H), 1,35 (д, 3H), 1,29 (м, 1Н), 1,20 (т, 3H), 1,19 (д, 3H), 1,17 (д, 3H), 1,16 (д, 3H), 1,14 (с, 3H), 1,12 (с, 3H), 0,87 (т, 3H);
13С ЯМР (100 МГц, CD3OD) δ 178,4, 169,7, 169,1, 154,6, 153,9, 146,2, 143,7, 141,9, 137,1, 137,0, 136,4, 134,6, 128,5, 126,9, 125,6, 124,6, 114,8, 112,8, 108,8, 102,3, 97,2, 94,3, 82,5, 78,6, 76,9, 75,9, 74,5, 73,5, 73,2, 72,8, 71,6, 70,5, 68,3, 63,9, 62,2, 42,5, 37,3, 35,4, 28,7, 28,3, 26,9, 26,4, 20,3, 19,6, 19,2, 18,7, 18,2, 17,6, 15.5, 14,6, 14,0, 11,4.
3. Получение первого полиморфа R-тиакумицина В
Другой иллюстративный вариант осуществления изобретения содержит способ получения полиморфа соединения формулы I из смеси тиакумицинов, содержащий стадии
a) растворения сырой смеси тиакумицинов, содержащей от приблизительно 76% до приблизительно 100% соединения формулы I, в минимальном количестве растворителя, содержащего метанол, ацетонитрил, уксусную кислоту, изопропиловый спирт или их смеси;
b) предоставления возможности раствору а) упариваться при стоянии при комнатной температуре (например, около 22°C) в течение 3-7 дней для осаждения первого полиморфа соединения формулы I и
c) отделения полиморфа от раствора методиками, известными в данной области.
Иллюстративный пример 1 получения полиморфа R-тиакумицина В
После процесса ферментации, как описано, например, в разделе 1, сырой материал очищали хроматографией с обращенной фазой с применением системы Biotage Flash 75L, содержащей колонку Biotage KR-C18-HS с 1,2 кг диоксида кремния, и с элюированием смесью 70:30:1 МеОН/H2O/АсОН. Собранные фракции, содержащие 75-80% соединения формулы I, объединяли и концентрировали до одной трети первоначального объема с образованием осадка. Осадок отделяют фильтрованием и промывают водой. Твердое вещество сушили в высоком вакууме, получая при этом не совсем белый порошок. Анализ ВЭЖХ показал, что порошок содержит 78% соединения формулы I в качестве основного продукта и смесь тиакумицинов в качестве меньшего компонента.
Смесь тиакумицинов, содержащую приблизительно 78% соединения формулы I (т.е. 50 мг), растворяли в 2 мл метанола с последующим добавлением 1 мл воды. Раствору давали возможность упариваться при стоянии при комнатной температуре в течение 7 дней с образованием кристаллического осадка. Кристаллы выделяют из раствора фильтрованием. После перекристаллизации из смеси метанол/вода кристаллы содержат, на основании данных ВЭЖХ, приблизительно 90% соединения формулы I.
Иллюстративный пример 2 получения полиморфа R-тиакумицина В
После процесса ферментации, как описано, например, в разделе 1, сырой материал очищали хроматографией с обращенной фазой с применением системы Biotage Flash 150, содержащей колонку Biotage KR-C18-HS с 3,75 кг диоксида кремния, и с элюированием смесью 52:48:1 EtOH/H2O/AcOH. Собранные фракции, содержащие приблизительно 80-88% соединения формулы I, объединяли и концентрировали до одной трети первоначального объема с образованием осадка. Осадок отделяли фильтрованием и промывали водой. Твердое вещество сушили в высоком вакууме. Анализ ВЭЖХ показал, что порошок содержит 85,4% соединения формулы I в качестве основного продукта и смесь тиакумицинов в качестве меньшего компонента.
Смесь, содержащую приблизительно 85% соединения формулы I (т.е. 1000 мг), растворяли в 20 мл смеси метанола и воды в отношении 1:1 метанола и воды. Раствору давали возможность упариваться при стоянии при комнатной температуре в течение 3 дней с образованием полиморфного кристаллического осадка. Кристаллы отделяли от раствора фильтрованием.
Полученная композиция является смесью, содержащей, на основании данных ВЭЖХ, первый полиморф соединения формулы I и по меньшей мере одно из тиакумициновых соединений. Композиция имеет точку плавления 165-169°C.
Иллюстративный пример 3 получения полиморфа R-тиакумицина
После процесса ферментации, как описано в разделе 1, сырой материал очищали хроматографией с обращенной фазой с применением системы Biotage Flash 75L, содержащей колонку Biotage KR-C18-HS с 1,2 кг диоксида кремния, и с элюированием смесью от 67:33:4 до 70:30:1 МеОН/H2O/АсОН. Собранные фракции, содержащие >90% соединения формулы I, объединяли и концентрировали до одной трети объема. Осадок отделяли фильтрованием и промывали водой. Твердое вещество сушили в высоком вакууме. Анализ ВЭЖХ показал, что порошок содержит 94,0% соединения формулы I.
Твердое вещество анализировали рентгенографией (XRD) и дифференциальной сканирующей калориметрией (ДСК) (см. фигуру 2). Рентгенография твердого вещества показывает пики у углов 2θ 7,7°, 15,0° и 18,8°±0,1, указывающие, что твердое вещество является формой первого полиморфа соединения формулы I. Диаграмма ДСК показывает эндотермическую кривую, начинающуюся приблизительно при 169°C, и пик при 177°C.
Иллюстративный пример 4 получения полиморфа R-тиакумицина
После процесса ферментации, как описано в разделе 1, сырой материал очищали хроматографией с обращенной фазой с применением системы Biotage Flash 75L, содержащей колонку Biotage KR-C18-HS с 1,2 кг диоксида кремния, и с элюированием смесью 52:48:1 EtOH/H2O/AcOH. Собранные фракции, содержащие >90% соединения формулы I, объединяли, добавляли одну треть объема воды и выдерживали при комнатной температуре на протяжении ночи. Осадок отделяли фильтрованием и промывали водой. Твердое вещество сушили в высоком вакууме. Анализ ВЭЖХ показал, что порошок содержит 94,7% соединения формулы I.
Порошок, содержащий 94,7% соединения формулы I (т.е. 98 мг), растворяли в 3 мл метанола и затем добавляли 1 мл воды. Раствору давали возможность упариваться при стоянии при комнатной температуре в течение 7 дней, получая при этом кристаллический осадок. Кристаллы отделяли от раствора фильтрованием и промывали смесью 3:1 метанол/вода. Кристаллы анализировали рентгенографией.
Осадок по составу является смесью, содержащей на основании данных ВЭЖХ соединение формулы I и имеющей точку плавления 166-169°C.
Иллюстративный пример 5 получения полиморфа R-тиакумицина
После процесса ферментации, как описано в разделе 1, смесь очищали на колонке и 0,06 г смеси тиакумицинов растворяли в 16 мл метанола и 4 мл воды в пузырьке на 20 мл. Пузырек покрывали парафильмом и через парафильм пробивали точечные отверстия. Покрытый пузырек помещали в эксикатор и сохраняли в нем при комнатной температуре в течение десяти дней. Покрытие из парафильма затем удаляли и пузырек возвращали в эксикатор. Кристаллическое вещество образуется через три-пять дней после удаления парафильма. Кристаллическое вещество промывали раствором метанола и воды и выделяли 75,6% соединения формулы I.
Порошковая рентгенограмма кристаллического вещества показана на фигуре 1, имеющей пики при углах 2θ 7,7°, 15,0° и 18,8°.
Иллюстративный пример 6 получения полиморфа R-тиакумицина
Получение полиморфа кристаллизацией из изопропанола
После процесса ферментации, как описано в разделе 1, сырой материал очищали хроматографией с обращенной фазой с применением системы Biotage Flash 150, содержащей колонку Biotage KR-C18-HS с 3,75 кг диоксида кремния, и с элюированием смесью 52:48:1 EtOH/H2O/AcOH. Собранные фракции, содержащие 80-88% соединения формулы I, объединяли и концентрировали до одной трети первоначального объема, получая при этом осадок. Осадок отделяли фильтрованием и промывали водой. Твердое вещество сушили в высоком вакууме. Анализ ВЭЖХ показал, что порошок содержит 85,4% соединения формулы I.
Порошок, содержащий 85,4% соединения формулы I (т.е. 2000 мг), растворяли в 900 мл изопропанола. Раствор нагревали для повышения растворимости и затем фильтровали для удаления нерастворимых веществ. Прозрачному раствору давали возможность упариваться при стоянии при комнатной температуре в течение 14 дней, получая при этом кристаллический осадок. Кристаллы отделяют от раствора фильтрованием.
Осадок по составу является смесью, содержащей на основании данных ВЭЖХ соединение формулы I и по меньшей мере одно из других родственных соединений и имеющей т.пл. 163-165°С.
Рентгенограмма осадка показывает пики у углов 2θ 7,6° и 15,4°.
Иллюстративный пример 7 получения полиморфа R-тиакумицина
После процесса ферментации, как описано в разделе 1, и очистки на колонке смесь соединения формулы I (>90%, 15 г) растворяли в минимальном количестве метанола (от приблизительно 20 мл до приблизительно 30 мл), раствор растирали с изопропанолом (~100 мл), получая при этом полиморф. Твердое вещество отделяли от раствора фильтрованием, вещество имеет точку плавления 165-168°C.
Рентгенограмма (XRD) показывает явную структуру полиморфа, содержащего пики у углов 2 тета 7,5°, 15,2°, 15,7°, 18,6°, 18,7°.
Иллюстративный пример 8 получения полиморфа R-тиакумицина
Получение полиморфа кристаллизацией из ацетонитрила
Смесь тиакумицинов, полученную как описано выше, и (85,44% соединения формулы I, 1000 мг) растворяли в 30 мл ацетонитрила. Раствору давали возможность упариваться при стоянии при комнатной температуре в течение 12 дней, получая при этом кристаллический осадок. Кристаллы отделяют от раствора фильтрованием, они имеют точку плавления 165-169°C.
Рентгенограмма (XRD) этих кристаллов показывает структуру полиморфа, содержащего пики у углов 2 тета 7,8°, 15,1° и 18,8°.
4. Получение других полиморфов R-тиакумицина
Другой иллюстративный вариант осуществления изобретения содержит способ получения полиморфа соединения формулы I, содержащий стадии
a) растворения сырой смеси тиакумицинов, содержащей от приблизительно 78 до приблизительно 100% соединения формулы I, в минимальном количестве этилацетата;
b) предоставления возможности раствору упариваться при стоянии при комнатной температуре в течение 3-7 дней для осаждения полиморфа и
c) отделения полиморфа от раствора.
Иллюстративный пример 1 получения полиморфа R-тиакумицина
Получение полиморфа кристаллизацией из этилацетата
После процесса ферментации, как описано, например, в разделе 1, сырое вещество очищали хроматографией с обращенной фазой с применением системы Biotage Flash 150, содержащей колонку Biotage KR-C18-HS с 3,75 кг диоксида кремния, и с элюированием смесью 52:48:1 EtOH/Н2О/АсОН. Собранные фракции, содержащие 70-88% соединения формулы I, объединяли и концентрировали до одной трети объема, получая при этом осадок. Осадок отделяли фильтрованием и промывали водой. Твердое вещество сушили в высоком вакууме. Анализ ВЭЖХ показал, что порошок содержит 85,4% соединения формулы I.
Эту неочищенную смесь тиакумицинов (1000 мг) затем растворяли в 30 мл этилацетата. Раствору давали возможность упариваться при стоянии при комнатной температуре в течение 12 дней, получая при этом кристаллический осадок полиморфа В соединения формулы I. Кристаллы отделяли от раствора фильтрованием. Кристаллы имеют точку плавления приблизительно 153-156°C, что подтверждает их полиморфную форму, отличную от первого полиморфа.
Иллюстративный пример 2 получения полиморфа R-тиакумицина
Получение полиморфа кристаллизацией из метанола и изопропанола
После процесса ферментации, как описано, например, в разделе 1, шесть разных порций сырого вещества с различными количествами соединения формулы I смешивали так, чтобы смесь имела в среднем 91% соединения формулы I. Смесь растворяли в метаноле и концентрировали роторным испарением. Концентрированный раствор затем смешивают с изопропанолом, фильтруют и сушат в вакууме, получая при этом белый порошок с точкой плавления 156-160°C.
Рентгенограмма белого порошка содержит пики у углов 2 тета 7,5°, 15,4° и 18,7°.
Иллюстративный пример 3 получения полиморфа R-тиакумицина
Получение полиморфа В из хлороформа
После процесса ферментации, как описано, например, в разделе 1, сырое вещество тиакумицинов, содержащих соединение формулы I, растворяли в хлороформе и концентрировали упариванием при комнатной температуре, получая при этом твердое вещество с точкой плавления 156-160°C.
Иллюстративный пример 4 получения полиморфа R-тиакумицина
Получение полиморфной формы кристаллизацией из ацетона
После процесса ферментации, как описано, например, в разделе 1, сырое вещество тиакумицинов, содержащих соединение формулы I, растворяли в ацетоне и концентрировали упариванием при комнатной температуре, получая при этом твердое вещество с точкой плавления 156-160°C.
5. Получение аморфных форм соединения формулы I
Получение аморфной смеси тиакумицинов
Аморфную смесь тиакумицинов получали после очистки на колонке без любых дополнительных стадий обработки. В альтернативном случае, к смеси тиакумицинов можно добавить хлороформ или ацетон и растворитель выпаривать, получая при этом аморфный продукт.
Порошковая рентгенограмма продукта не имеет определенных пиков дифракции.
Экспериментальные данные
1. Экспериментальные данные полиморфов
Первый полиморф соединения формулы I характеризовали дифференциальной сканирующей калориметрией ("DSC") и порошковой рентгенограммой ("XRD").
Диаграмма ДСК полиморфа имеет эндотермическую кривую при 177°С.
Диаграмма XRD (показана на фиг.1) имеет пики при углах дифракции 2θ 7,7°, 15,0° и 18,8°. XDR получали порошковым дифрактометром Филипса сканированием от 20 до 70 градусов два тета при скорости 1,0 градус в минуту с применением излучения Сu K-альфа при 35 кВ и 29 мА. Инструментальная ошибка (вариант) составляет 0,04 (величина 2 тета).
Точки плавления смесей, содержащих различные количества соединения формулы I, суммированы в таблице 1. Оказывается, что все продукты по меньшей мере с 85% соединения формулы I в форме полиморфа имеют точку плавления в диапазоне 163-169°C, измеренную аппаратурой для измерения точки плавления MEL-TEMP 1001.
Состав полиморфного кристалла из смеси, содержащей соединение формулы I и необязательно по меньшей мере одно соединение, которое на основании анализа ВЭЖХ является смесью тиакумицинов с точкой плавления 166-169°C.
Рентгенограмма полиморфного кристалла имеет характеристические пики при углах 2θ 7,8°, 15,0°, 18,8° и 23,9°. В таблице 2 имеется список пиков полученной рентгенограммы для первого полиморфа R-тиакумицина из иллюстративного примера 2.
В таблице 3 приведен список пиков полученной рентгенограммы для полиморфа из иллюстративного примера 6.
2. Экспериментальные данные второго полиморфа R-тиакумицина
Второй полиморф соединения формулы I также характеризовали дифференциальной сканирующей калориметрией (ДСК) и порошковой рентгенограммой (XRD).
Диаграмма ДСК полиморфа В показывает эндотермическую кривую при 158°C. Диаграмма XRD показывает пики, имеющие величины при углах дифракции 2 тета 7,6°, 15,4° и 18,8°. Полиморф В имеет точку плавления в диапазоне 153-156°C, измеренную аппаратурой для измерения точки плавления MEL-TEMP 1001.
Полагают, что существуют и описаны здесь кристаллические полиморфные формы соединений формулы I, другие, чем указанные выше формы А и В. Эти кристаллические полиморфные формы, включающие А и В, и аморфная форма или смеси их, содержащие различные количества соединения формулы I и в некоторых случаях смеси тиакумицинов, можно благоприятно применять при получении лекарственных препаратов, обладающих антибиотической активностью.
Порошковая рентгенограмма кристаллов показана на фигуре 3 с пиками при углах 2θ 7,5°, 15,7° и 18,9°±0,04, указывающими на присутствие полиморфа В.
Диаграмма ДСК полиморфа В показывает эндотермическую кривую, начинающуюся приблизительно при 150°C, и пик при 158°C.
В таблице 4 суммированы различные данные, которые выделены для иллюстративных групп растворителей для кристаллизации.
Настоящее изобретение не должно ограничиваться объемом конкретных вариантов осуществления, описанных в примерах, которые представлены в качестве иллюстраций нескольких аспектов изобретения, и любые варианты осуществления, которые являются функционально эквивалентными, находятся в пределах объема данного изобретения. Действительно, различные модификации изобретения помимо модификаций, показанных и описанных здесь, должны стать очевидными специалисту данной области, и предполагается, что эти модификации находятся в пределах прилагаемой формулы изобретения.
В описании цитирован ряд ссылок, полное описание которых включено здесь в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФ РИФАКСИМИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2593750C2 |
| ПОЛИМОРФЫ | 2017 |
|
RU2840871C2 |
| ПОЛИМОРФЫ ИНГИБИТОРА КИНАЗЫ | 2012 |
|
RU2636588C2 |
| ПОЛИМОРФЫ | 2017 |
|
RU2840872C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ БЕНЗОАТА НАТРИЯ И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2782627C2 |
| НОВЫЕ ПОЛИМОРФЫ И СОЛИ | 2011 |
|
RU2573384C2 |
| СОЛИ И ПОЛИМОРФНЫЕ МОДИФИКАЦИИ ИНГИБИТОРА VEGF-R | 2006 |
|
RU2369607C1 |
| ПОЛИМОРФЫ ПИРРОЛЗАМЕЩЕННЫХ 2-ИНДОЛИНОНОВЫХ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2004 |
|
RU2335502C2 |
| ПОЛИМОРФЫ ДОЦЕТАКСЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2437875C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ МАКРОЦИКЛИЧЕСКОГО ИНГИБИТОРА HCV | 2008 |
|
RU2533830C2 |
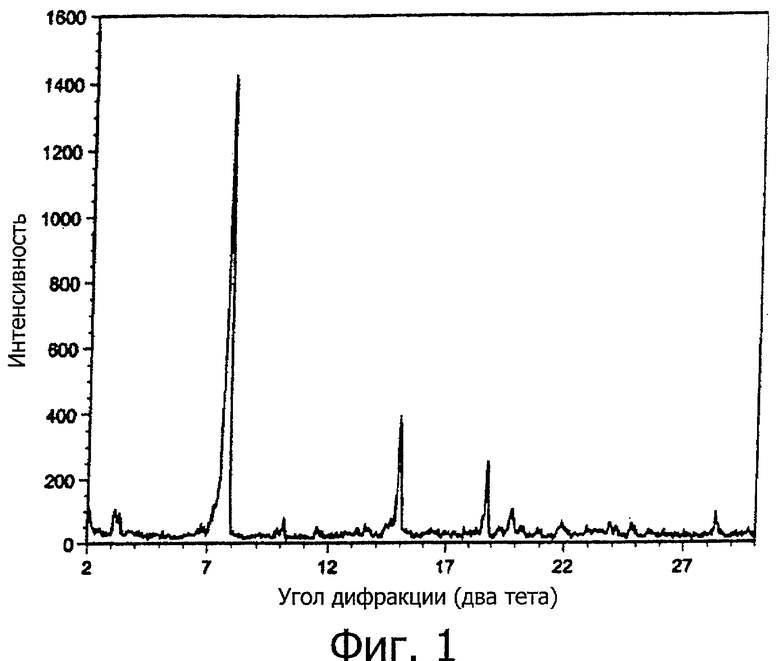

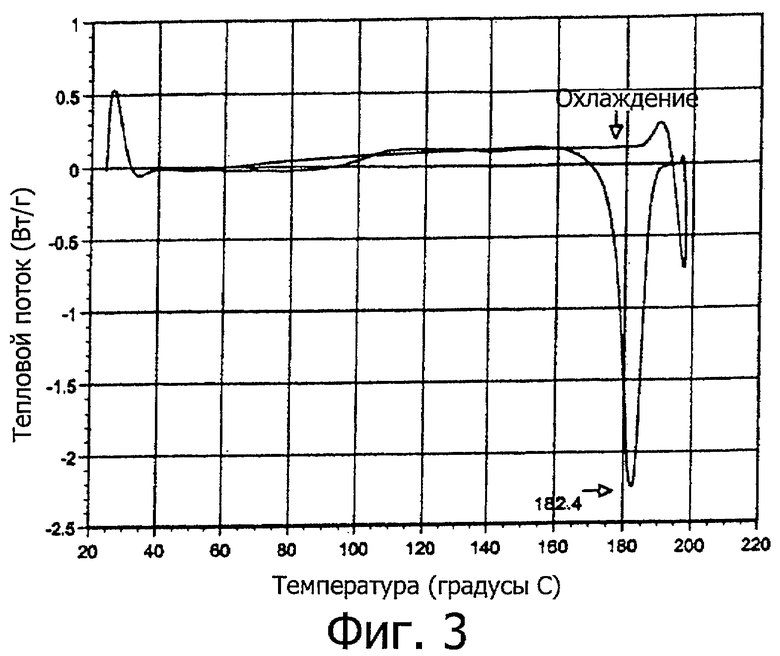
Изобретение относится к новым формам соединений формулы I, проявляющих антибиотическую активность широкого спектра, особенно кристаллическим полиморфным формам таких соединений, также в виде гидрата или сольвата, в частности кристаллическому полиморфу тиакумицина. Изобретение также относится к композициям, содержащим такие кристаллические полиморфные формы соединений, способам их получения и применения. Также в изобретении заявлены фармацевтические композиции, обладающие антибиотической активностью, содержащие кристаллические полиморфы в терапевтически эффективном количестве и фармацевтически приемлемый наполнитель. 10 н. и 16 з.п. ф-лы, 5 пр., 4 табл., 3 ил.

1. Кристаллический полиморф, содержащий соединение формулы I
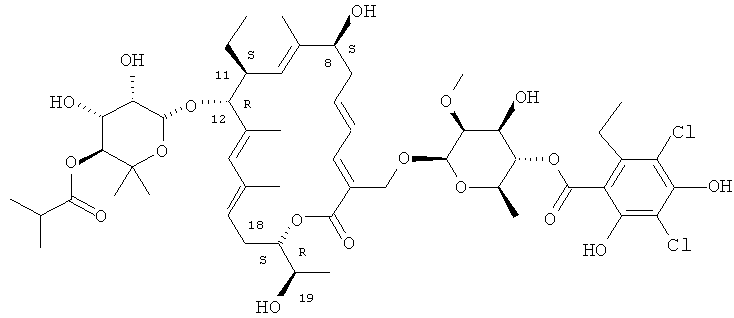
и характеризующийся порошковой рентгенограммой, по меньшей мере, с пиками при углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,2.
2. Кристаллический полиморф, содержащий соединение формулы I,
и характеризующийся порошковой рентгенограммой, по меньшей мере, с пиками при углах дифракции 2θ: 7,6°, 15,4° и 18,8°±0,2.
3. Кристаллический полиморф по п.1 в форме гидрата.
4. Кристаллический полиморф по п.2 в форме сольвата.
5. Композиция, обладающая антибиотической активностью, содержащая кристаллический полиморф по любому из предыдущих пунктов.
6. Композиция по п.5, где полиморф формулы I присутствует в количестве от, по меньшей мере, приблизительно от 75 до приблизительно 99,99 мас.%.
7. Композиция по п.5, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 85 мас.%.
8. Композиция по п.5, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 90 мас.%.
9. Композиция по п.5, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 95 мас.%.
10. Композиция по п.5, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 99 мас.%.
11. Кристаллический полиморф, содержащий соединение формулы I
и характеризующийся эндотермическим эффектом ДСК в диапазоне от приблизительно от 174°C до приблизительно 186°C.
12. Кристаллический полиморф, содержащий соединение формулы I
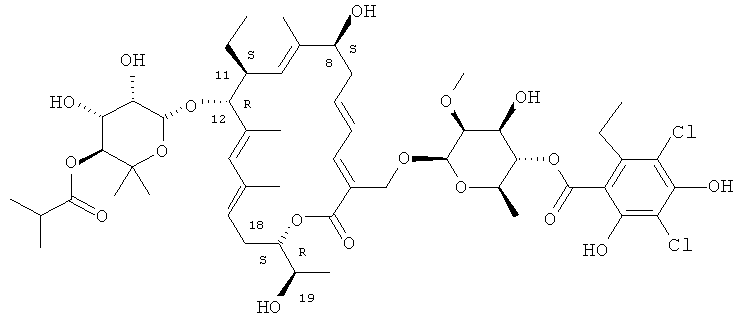
и характеризующийся эндотермическим эффектом ДСК в диапазоне от приблизительно от 153°C до приблизительно 156°C.
13. Кристаллический полиморф по п.11 в форме фармацевтически приемлемого гидрата.
14. Кристаллический полиморф по п.12 в форме сольвата.
15. Композиция, обладающая антибиотической активностью, содержащая кристаллический полиморф по любому из пп.11-14.
16. Композиция по п.15, где полиморф формулы I присутствует в количестве от приблизительно от 75 до приблизительно 99,99 мас.%.
17. Композиция по п.15, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 85 мас.%.
18. Композиция по п.15, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 90 мас.%.
19. Композиция по п.15, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 95 мас.%.
20. Композиция по п.15, где полиморф формулы I присутствует в количестве, по меньшей мере, приблизительно 99 мас.%.
21. Кристаллический полиморф тиакумицина, характеризующийся
(i) порошковой рентгенограммой, по меньшей мере, с пиками при углах дифракции 2θ: 7,7°, 15,0° и 18,8°±0,2;
(ii) эндотермическим эффектом ДСК в диапазоне от приблизительно 174°C до приблизительно 186°С и
(iii) содержащий соединение формулы I

22. Кристаллический полиморф тиакумицина, характеризующийся
(i) порошковой рентгенограммой, по меньшей мере, с пиками при углах дифракции 2θ: 7,6°, 15,4° и 18,8°±0,2;
(ii) эндотермическим эффектом ДСК в диапазоне от приблизительно 153°C до приблизительно 156°C и
(iii) содержащий соединение формулы I
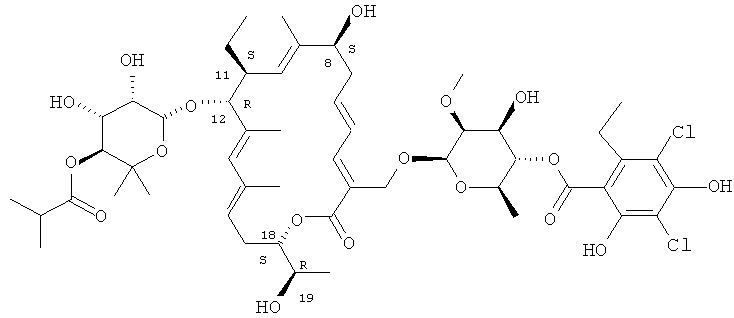
23. Композиция, обладающая антибиотической активностью, содержащая кристаллический полиморф по любому из пп.21 или 22.
24. Композиция по п.23, где соединение формулы I присутствует в количестве от приблизительно от 75 до приблизительно 99,99 мас.%.
25. Композиция по п.23, где соединение формулы I присутствует в количестве приблизительно 90 мас.%.
26. Фармацевтическая композиция, обладающая антибиотической активностью, содержащая композицию по любому из пп.5-10, 15-20 или 23,24 в терапевтически эффективном количестве и фармацевтически приемлемый наполнитель.
| WO 2006085838 A1, 17.08.2006 | |||
| US 3978211 A, 31.08.1976 | |||
| US 5583115 A, 10.12.1996 | |||
| US 4918174 A, 17.04.1990 | |||
| Отбойка погонялки ткацкого станка | 1927 |
|
SU7618A1 |
| Способ получения антибиотика-макролида | 1981 |
|
SU1151218A3 |
Авторы
Даты
2013-04-10—Публикация
2008-01-22—Подача