Область техники
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения рекомбинантного тканевого активатора плазминогена человека (rtPA). Изобретение представляет собой рекомбинантную плазмидную ДНК рВК415, кодирующую полипептид с последовательностью рекомбинантного тканевого активатора плазминогена (rtPA), и продуцент на основе линии клеток Cricetulus griseus CHO 1F8, содержащей указанную плазмидную ДНК, синтезирующий рекомбинантный тканевый активатор плазминогена.
Предшествующий уровень техники
Тканевый активатор плазминогена (tPA) представляет собой белок, состоящий из 527 аминокислот, с весом около 72 кДа. Он обладает способностью вызывать каталитическую деградацию фибрина (основного компонента тромбов), и используется при лечении острых инфарктов миокарда, легочной эмболии, тромбоза вен. Выполняя функции сериновой протеазы, tPA связывается с фибрином, приобретает протеолитическую активность и способствует превращению плазминогена в плазмин, в результате чего происходит лизис тромба и реперфузия кровяного русла (Cell Mol Life Sci. 2011 Mar;68(5):785-801. Epub 2010 Dec 7). Уникальным свойством tPA является его крайне высокая избирательность в отношении связанного с фибрином плазминогена, что обеспечивает его преимущественную активацию на поверхности фибринового тромба, а не в системном кровотоке.
В сравнении с тромболитическими средствами предыдущего поколения, такими как урокиназа и стрептокиназа, тканевые активаторы плазминогена действуют более эффективно. Это выражается в том, что последние напрямую связываются с фибрином и таким образом направленно действуют на основную мишень - тромб, в отличие от стрептокиназы и урокиназы, которые менее специфичны и активируют помимо плазминогена, связанного с фибриновым тромбом, и свободные молекулы плазминогена (Baillieres Clin Haematol. 1995 Jun;8(2):277-90). Кроме того, tPA обладает большим временем жизни в организме пациента.
Природная последовательность тканевого активатора плазминогена была идентифицирована в 1982 году (Nature, 1983, Jan 20; 301(5897):214-21). На его основе был создан лекарственный препарат альтеплаза (торговое название «Актилизе»), содержащий белок, полностью соответствующий человеческому tPA, а также несколько мутантных форм tPA: тенектеплаза (торговое название «Метализе», отличается от природного белка заменой трех аминокислот) и ретеплаза (торговое название «Retavase», характеризуется делецией трех из пяти доменов тканевого активатора плазминогена). Многочисленные исследования («Тромболитическая терапия инфаркта миокарда», РМЖ, Том 6 №3, 1998; Am Heart J. 2004 Jun; 147(6):993-8 и др.) показали, что эффективность перечисленных препаратов довольно сходна. При этом наиболее оптимальным профилем безопасности обладает альтеплаза. Ретеплаза несколько уступает альтеплазе по эффективности (особенно, если задержка с введением препарата составляет более 4 часов с момента появления первых симптомов инфаркта миокарда). В случае тенектеплазы наблюдается повышенный риск внутричерепных кровотечений (Куликов А.Н. Фармакотерапия острых коронарных синдромов (ii), "ФАРМиндекс-Практик" выпуск 9, 2005 г., стр.1-16). Кроме того, два последних препарата содержат мутантные формы белка, что может провоцировать иммунный ответ у пациента, который отсутствует в случае альтеплазы.
В настоящее время инфаркт миокарда является причиной примерно 9% смертей в экономически развитых странах. Только в 1990 г., по данным ВОЗ, из 10912 больных от инфаркта миокарда погибли 1001 человек, что составило 9,2% (Алперт Дж., Френсис Г. Лечение инфаркта миокарда. Практическое руководство. Пер. с англ. М., 1994. С.468). К сожалению, в РФ высокая стоимость рекомбинантных активаторов плазминогена служит сдерживающим фактором в вопросе их широкого применения. Поэтому создание эффективного продуцента tPA, а также разработка метода его получения для производства отечественного препарата является весьма актуальной и важной задачей, решение которой позволит расширить арсенал отечественных лекарственных средств для лечения острых инфарктов миокарда.
Евразийский патент ЕА5163 раскрывает систему экспрессии tPA в прокариотических клетках. Для этой цели ген tPA вставляют в вектор, содержащий также промотор CMV, последовательность сигнального пептида ОтрА и ген протеина III (gp), причем tPA функционально связан с последовательностью ОтрА против хода транскрипции, и по ходу транскрипции с последовательностью гена gpIII. Авторы указывают, что наличие сигнального пептида позволяет белку приобрести правильную конформацию до выхода из клетки, причем эффективность отщепления сигнального пептида очень высока. Однако широко известно, что экспрессия белков млекопитающих (в том числе и человека) сопряжена с гликозилированием, которое невозможно осуществить в бактериальных клетках.
Новые вектора экспрессии для tPA предлагаются в ЕР0260148. Вектор pCIHtPA содержит последовательности tPA и DHFR (дигидрофолатредуктазы) под контролем CMV-промотора, а также последовательность гена SVE. Вектор pCIStPA дополнительно содержит участок полиаденилирования SV40, что позволило повысить уровень экспрессии примерно в три раза по сравнению с вектором pCIHtPA. В публикации также сравниваются уровни экспрессии белка в клетках СНО и клетках 293, трансфицированных соответствующими векторами: для вектора pCIHtPA удалось достичь значений 15 и 1300 нг/мл, для вектора pCIStPA - 55 и 3000 нг/мл соответственно.
Системы экспрессии tPA в клетках млекопитающих (СНО) также достаточно подробно описаны в целом ряде патентов компании Genentech (например, см. ЕР 093619, ЕР 0117059, US 5728565, US 5849574, US 6284247). Все они раскрывают вектор, содержащий последовательность tPA и ген DHFR, что позволяет в дальнейшем, проводя амплификацию гена DHFR, вызывать амплификацию ассоциированной с ним последовательности гена tPA.
Аналогичная система экспрессии природного tPA в клетках СНО, дефицитных по DHFR, являющаяся наиболее близким аналогом настоящего изобретения, описана в патенте RU 2046827. Как и в предыдущих случаях, авторы клонируют последовательность tPA, собранную из трех фрагментов различной длины в плазмиду pBR322, дополнительно содержащую ген DHFR. Затем полученной плазмидой трансформируют клетки СНО и проводят ряд последовательных амплификаций с использованием метотрексата. В результате выход секретируемого продукта достигает значений до 50 пг/клетку/день. Недостатком использованной системы является функционально независимая экспрессия генов DHFR и tPA благодаря использованию двух отдельных SV40-промоторов для каждого из синтезируемых белков. Первоначально высокие выходы трансгена, наблюдаемые при использованных концентрациях метотрексата (до 10 мкМ), обычно связаны со значительным уровнем хромосомной нестабильности штамма-продуцента и при отсутствии селективного агента, являющегося весьма токсичным и потому не использующемся в промышленном фармацевтическом производстве, неизбежно приводит к существенному падению уровня продукции при длительном культивировании клеточной линии. Соответственно, использование данного подхода делает невозможным применение данного метода в процессе производства терапевтических рекомбинантных белков.
В данном контексте очень важно отметить, что ни в одном из приведенных выше патентов не приводятся данные о стабильности системы экспрессии (числе пассажей, генераций), что является одним из важнейших факторов для промышленного производства белка, наряду с высоким уровнем экспрессии.
Раскрытие изобретения
Настоящее изобретение решает задачу конструирования плазмидной ДНК, содержащей последовательность тканевого активатора плазминогена (tPA), и создания линии клеток, позволяющей получать рекомбинантный тканевый активатор плазминогена (rtPA) с высоким выходом на постоянном уровне до 190 мг/л и сохраняющим свою производительность на протяжении большого числа пассажей (не менее 50), что является критическим параметром возможности применения штамма-продуцента для промышленного производства белка.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК рВК415, состоящей из 11383 п.о., и линии клеток Cricetulus griseus CHO 1F8.
Введение различных генетических элементов генома эукариот в состав рекомбинантных конструкций, используемых для последующей трансфекции клеток млекопитающих, может оказывать положительное влияние на стабильность трансгена в геноме клетки-реципиента, существенно улучшая ростовые характеристики культуры (S.C. Makrides Gene Transfer and Expression in Mammalian Cells, (2003) Elsevier Science, chapters 10-12). Подобные элементы, в частности MAR, используются для создания промышленных штаммов-продуцентов, для которых критическим параметром, определяющим возможность его использования в производстве, является стабильность уровня продукции и скорости роста культуры.
Элементы прикрепления к ядерному матриксу MAR (Matrix Attachment Regions) представляют собой фрагменты ДНК эукариот длиной 300-3000 п.о. и играют ключевую роль в организации ядерной и хромосомной архитектуры. В интерфазе они фиксируют хроматин с белками, формирующими ядерный матрикс, разделяя геном эукариот на независимые хроматиновые петли (Mirkovitch, J., Mirault, M.E., and Laemmli, U.K. (1984) Cell 39, 223-232.). Благодаря колокализации MAR-элементов с участками активной транскрипции и регуляторных элементов в геноме, первые положительно влияют на уровень транскрипции трансгена, привлекая активаторы транскрипции и контролируя доступность ДНК в составе хроматина. Помимо указанных свойств MAR-элементы, например MAR гена лизоцима птиц, могут предотвращать постепенное снижение активности трансгенного промотера, что существенно повышает стабильность уровня экспрессии трансгена (Alien, G.C., Spiker, S., and Thompson, W.F. (2000) Plant Mol. Biol. 43, 361-376).
В процессе конструирования плазмиды мы обнаружили, что использование MAR в плазмиде, включающей ген rtPA, позволяет поддерживать уровень экспрессии данного белка с наибольшей стабильностью. Преимущества предлагаемого изобретения также заключаются в использовании химико-ферментативного метода синтеза гена rtPA, что позволяет подобрать оптимальный кодонный состав гена, избежать наличия в последовательности структур ДНК, препятствующих процессу трансляции, криптических сайтов сплайсинга, полиаденилирования. Оптимизация первичной структуры гена и использование энхансера транскрипции цитомегаловируса CMV, а также фрагмента ДНК, обеспечивающего прикрепление к ядерному матриксу MAR, позволяют существенно увеличить уровень секреции rtPA в питательную среду и, соответственно, финальный выход целевого продукта.
Рекомбинантная плазмидная ДНК рВК415 содержит следующие последовательности: MAR - района прикрепления к ядерному матриксу гена лизоцима птиц, промотора вируса CMV, энхансера транскрипции вируса CMV, кДНК гена rtPA, внутреннего сайта инициации трансляции IRES, гена DHFR, сигнала полиаденилирования вируса SV40, кассеты, экспрессирующей ген аминогликозид-3'-фосфотрансферазы, обеспечивающего устойчивость штамма клеток-продуцента к генетицину (Neo), и кассеты для экспрессии в клетках бактерий гена Р-лактамазы, обеспечивающей устойчивость к ампицилину. Плазмида рВК415 (фиг.4), кодирующая полипептид rtPA, характеризуется следующими признаками:
- состоит из 11383 п.о.,
- имеет молекулярную массу 7,4 МДа,
- кодирует полипептид тканевого активатора плазминогена,
- обеспечивает устойчивость бактериальных клеток, трансформированных данной плазмидой, к ампицилину и клеток млекопитающих, трансфицированных указанной плазмидой, к генетицину,
- содержит уникальные участки узнавания следующих эндонуклеаз рестрикции:
AhdI (7352 п.о.), AsiSI (508 п.о.), BglII (2649 п.о.), BipI (2079 п.о.), BmtI (654 п.о.), BssHII (5778 п.о.), BstBI (6062 п.о.), BstEII (2388 п.о.), Bsu36I (2245 п.о.), EcoRI (10035 n.o.), EcoRV (10969 n.o.), FspAI (2020 n.o.), MluI (2433 n.o.), MreI (2220 n.o.), NheI (654 n.o.), NotI (3918 n.o.), PspXI (3342 n.o.), RsrII (5896 n.o.), SfiI (5133 n.o.), SgrAI (2220 n.o.), StuI (5184 n.o.), Tth111I (5496 n.o.), XhoI (3343 n.o.).
Для производства белка была выбрана линия клеток Cricetulus griseus СНО DHFR-. Исходная линия приобретена в Американской коллекции клеточных культур (АТСС), CRL 9096. Выбор линии клеток обусловлен наличием оптимального профиля гликозилирования для синтеза человеческих белков, а также стабильностью и безопасностью данной линии клеток, что является важнейшим параметром для производства терапевтических белков. На основе этой линии клеток была получена линия клеток Cricetulus griseus СНО 1F8 - продуцент рекомбинантного активатора плазминогена человека, являющаяся производным яичников взрослого китайского хомяка.
Линия клеток Cricetulus griseus СНО 1F8 характеризуется следующими признаками.
Морфологические признаки: Клетки имеют типичные морфологические признаки эпителиальной культуры, и, исходно, представляют собой адгерантную культуру. Линия является гиподиплоидной (2n=22), модальное число хромосом 20.
Культуральные признаки: Клетки культивируются в монослое на простых питательных средах, например, на среде ДМЕМ в присутствии 2-10% фетальной сыворотки.
Физиолого-биохимические признаки: Клетки растут при температуре 37°С, pH 6.7-7.3.
Устойчивость к антибиотикам: Клетки обладают устойчивостью к генетицину в концентрации 1 мг/мл.
Штамм клеточной линии Cricetulus griseus СНО 1F8 был депонирован во Всероссийскую Коллекцию промышленных микроорганизмов в ГНИЙ Генетика-ВКПМ под номером Н-127, дата депонирования 20.06. 2012 г.
Заявленное изобретение поясняется на следующих фигурах:
На фиг.1 представлена аминокислотная последовательность белка tPA, SEQ ID NO:1.
На фиг.2. представлена оптимизированная нуклеотидная последовательность гена tPA, SEQ ID NO:2.
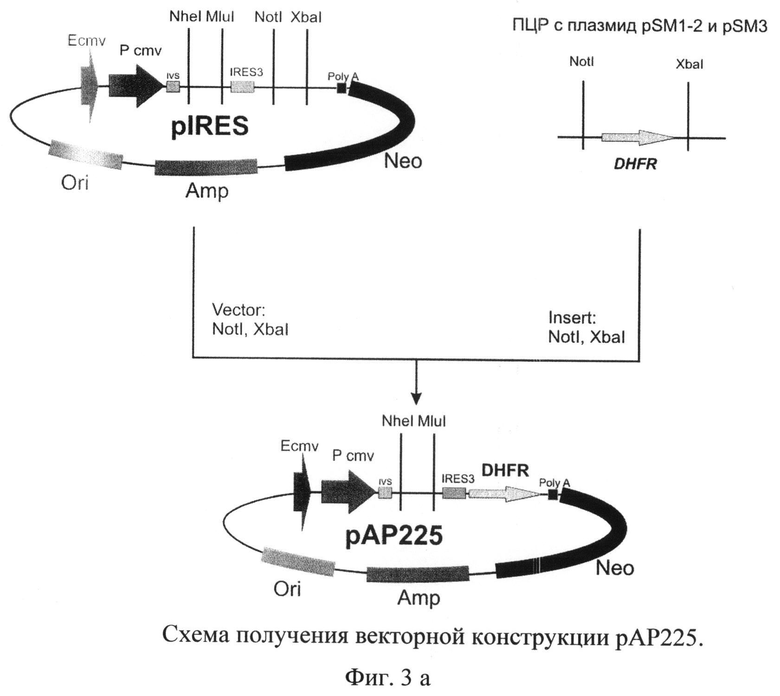
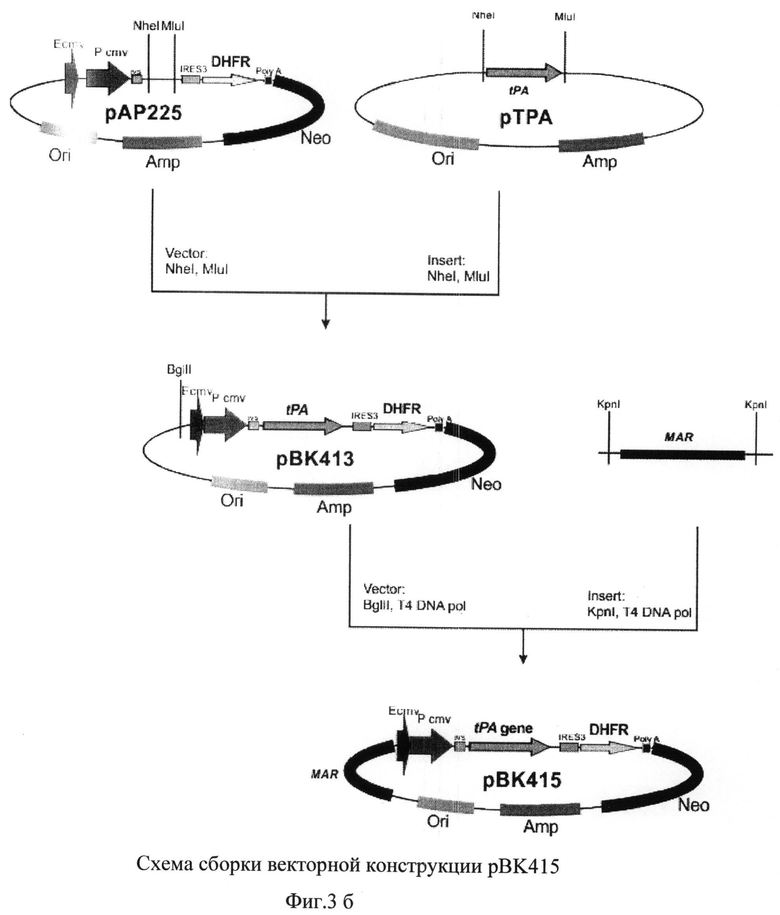
На фиг.3 а) и б) представлена схема получения векторной конструкции pBK415 для экспрессии рекомбинантного tPA
На фиг.4 представлена карта рекомбинантной плазмидной ДНК pBK-415, использованной для создания продуцента рекомбинантного tPA.
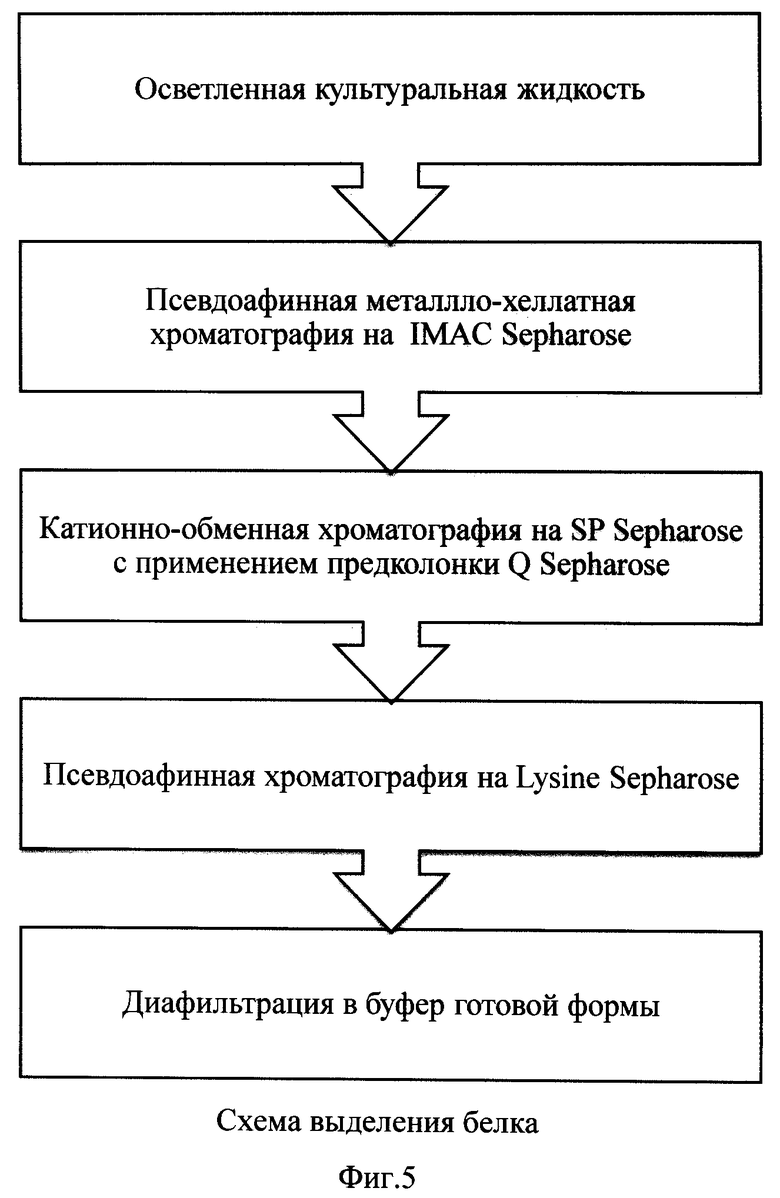
На фиг.5 представлена схема выделения рекомбинантного tPA.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pBK415.
Нуклеотидную последовательность, соответствующую кДНК гена тканевого активатора плазминогена человека, получают химико-ферментативным синтезом. Для этого оптимизированную последовательность гена разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, проводят с помощью твердофазного фосфамидитного метода, например, с использованием синтезатора ASM-102U (БИОССЕТ, Новосибирск). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (NEB, США). Фосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита, прогревают до 65°С, медленно охлаждают до 37°С в течение часа и добавляют Т4-ДНК-лигазу. Реакцию лигирования ДНК проводят 12 ч при 37°С, 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПНР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
F7_fwd
5'-TAGGCTAGCCGCCACCATGGACGCCATGAAGCGCGGCCT-3' и
F7_rev 5'-CGACGCGTTAGGGGCGCATGTTGTCGCGGATCCA-3'.
Синтезированный таким образом фрагмент ДНК содержит последовательность кДНК гена тканевого активатора плазминогена человека, фланкированную сайтами узнавания рестриктаз NheI и MluI - SEQ ID N2 (фиг.2). Продукт амплификации гидролизуют рестриктазами NheI и MluI, очищают электрофорезом в 1% агарозном геле, полосу ДНК величиной около 1700 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для получения векторной ДНК pBK415 использовали серию последовательных этапов клонирования (Фиг.3 а) и б)).
В качестве исходной плазмиды был выбран вектор pIRES (Clontech, США). Используя сайты рестрикции XbaI и NotI, в указанный вектор клонировали ген дигидрофолатредуктазы мыши, полученный методом ПЦР с использованием геномной ДНК, выделенной из клеток миеломы мыши SP2/0, и специфических праймеров
DHFR_fwd
5'-CCTCTAGATGGTTGTGGCCATATTATCATCGTGTTTTTCAAAG-3'
и DHFR_rev
5'- GGAAGCGGCCGCTTAGTCTTTCTTCTCGTAGACTTCA-3'
с последующим проведением сайт-направленного мутагенеза для оптимизации консенсусной последовательности в окружении инициаторного кодона IRES-элемента с помощью набора QuikChange® II XL (Stratagene, США) и следующих олигонуклеотидов:
D3_fwd
5' - CCTTTGAAAAACACGATGATAATATGGCCACAACCATGGTTCGACCATTGAAC
TGCATC-3'
и D3_rev
5' - GATGCAGTTCAATGGTCGAACCATGGTTGTGGCCATATTATCATCGTGTTTTT CAAAGG-3'.
В полученную плазмиду рАР225 по сайтам рестрикции NheI и MluI клонировали синтезированную ранее последовательность кДНК гена тканевого активатора плазминогена. Отбор полученных после трансформации лигазной смеси бактериальных клеток XL-10 Gold проводили таким образом, чтобы выявить плазмидную ДНК pBK413, содержащую последовательность кДНК тканевого активатора плазминогена человека.
Плазмиду pBK413 далее последовательно обрабатывали эндонуклеазой рестрикции Bglil и Т4-ДНК полимеразой, и образовавшийся вектор использовали в реакции лигирования с ПЦР-продуктом, полученным с использованием MAR-специфических праймеров
MAR_fwd 5'-GGGGATCCGTAATACAATTGTACCAGGTTTTGGTTTATTAC-3' и
MAR_rev 5' -GAAAACAATATATTTCCAAATGAAAAAAAAATCTGATAAAAAG-3'.
Отбор полученных после трансформации лигазной смеси бактериальных клеток XL-10 Gold проводили таким образом, чтобы выявить плазмидную ДНК рВК415, содержащую последовательность MAR в геномной ориентации по отношению к промотору.
В дальнейшем первичная последовательность полученной плазмидной ДНК была подтверждена методом сиквенирования по Сэнгеру. По данным секвенирования отобрали плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NheI-MluI фрагмента которой полностью идентичны последовательности кДНК гена тканевого активатора плазминогена человека, которую использовали в дальнейшей работе.
Пример 2. Получение линии клеток Cricetulus griseus CHO 1F8, стабильно продуцирующих рекомбинантный активатор плазминогена человека.
Для получения клеточной линии, стабильно продуцирующей рекомбинантный активатор плазминогена человека (rtPA), клетки линии Cricetulus griseus CHO DHFR-(ATCC CRL 9096), трансфицируют плазмидной ДНК рВК415, линеаризованной по сайту рестрикции BspHI, например методом липофекции при помощи реагента jetPEl™ (Polyplus Transfection Inc., США).
Клетки Cricetulus griseus CHO DHFR высевают в лунки шестилуночного планшета (например Costar) с плотностью 250×103 клеток/лунка в 3 мл среды DMEM/F12 содержащей 10% сыворотки, и инкубируют 24 часа при 37°С в СО2 инкубаторе.
Далее проводят трансфекцию, используя 2 мкг линеаризованной по сайту рестрикции BspHI плазмиды рВК415 и 4 мкл реагента jetPEl™ на лунку согласно рекомендациям производителя (соотношение N/P=5). Через 48 часов после трансфекции начинают селекцию культуры с целью получения стабильных трансфектантов путем смены среды на селективную: среда MEM с добавлением 10% диализованной сыворотки в присутствии антибиотика генетицина в концентрации 1 мг/мл. Смену селективной среды проводят регулярно каждые 3-4 дня. Начиная с 7-го дня, лунки анализируют на наличие клонов активно делящихся клеток. По окончании процедуры селекции (окончание селекции определялось по полной гибели не трансфицированной популяции клеток, также находящихся под давлением антибиотика) и восстановления жизнеспособности пула стабильных трансфектантов была определена его продуктивность.
Продуктивность клонов оценивают методом твердофазного иммуноферментного анализа (ELISA), используя, например, набор Assay Max (AssayPro, США). Для этого в лунках, в которых клетки достигли 80-90% конфлюентности, заменяют среду на свежую, и инкубируют 24, 48 и 72 часа при 37°С в СО2-инкубаторе. Супернатант используют в ELISA тесте. Продуктивность пула стабильных трансфектантов составляла 25 мкг/л.
Для увеличения уровня экспрессии рекомбинантного активатора плазминогена человека пул стабильных трансфектантов был подвергнут процедуре амплификации метотрексатом (МТХ).
Для биотехнологических целей в системе амплификации рекомбинантных генов в качестве селектируемого маркера часто используют ген дигидрофолатредуктазы (DHFR), интегрированный в экспрессирующий вектор. DHFR катализирует превращение фолиевой кислоты в тетрагидрофолат, необходимый для синтеза эукариотическими клетками глицина, тимидинмонофосфата и пуриновых оснований. В этой связи клетки СНО, в которых ген DHFR инактивирован под действием мутации (СНО DHFR-), не растут на средах без нуклеозидов и приобретают эту способность после трансфекции геном DHFR.
Растущие трансфектанты далее отбираются по признаку амплификации гена DHFR на фоне увеличивающихся концентраций метотрексата - ингибитора DHFR, в питательной среде, так как увеличение числа копий гена будет придавать клеткам устойчивость к ингибитору в больших концентрациях. После проведения множественных раундов селекции получают популяцию клеток, содержащих до нескольких сотен копий гена DHFR.
Для данного стабильно трансфицированного пула было проведено 4 последовательных раунда амплификации метотрексатом. Для этой цели клетки культивируются на среде MEM, не содержащей глицин, гипоксантин и тимидин, в присутствии 10% диализованной фетальной сыворотки с добавлением увеличивающихся количеств метотрексата (таблица 1). Продолжительность каждого раунда составляла примерно 10-14 дней.
Далее амплифицированный пул стабильных трансфекантов субклонируют методом предельного разведения. Для субклонирования культура рассевается с плотностью 0,5 клетки/лунку в 96-луночные планшеты. Всего зарегистрировано и проанализировано 130 клонов.
Линия клеток Cricetulus griseus CHO IF 8 - продуцент рекомбинантного активатора плазминогена человека, была успешно адаптирована к суспензионным бессывороточным условиям культивирования.
Для процедуры адаптации был использован протокол постепенного снижения содержания питательной среды с сывороткой в пользу бессывороточной среды. Снижение проводили по следующей схеме:
соотношение среды с сывороткой и бессывороточной среды 50/50, далее, после стабилизации жизнеспособности культуры на уровне не менее 80% снижение содержания сывороточной среды до 25%, культивирование до стабилизации жизнеспособности и, далее, переход к соотношению 10/90 и, наконец, к 100% бессывороточной среде. Культивирование на шейкере в 100% бессывороточной среде проводили до стабилизации жизнеспособности культуры на уровне 90-95% и времени удвоения.
Характеристики данной линии представлены в Таблице 3:
Для данного клона была проанализирована стабильность продуцирующей способности и ростовых характеристик. Для этой цели клетки культивируют на протяжении 50-100 генераций, периодически оценивая как уровень экспрессии rhtPA, так и ростовые характеристики клонов.
Оптимизация состава питательной среды привела к увеличению уровня экспрессии целевого белка примерно до 50 мг/л/24 ч. Так, культивирование данного клона в присутствии специфической питательной добавки СНО Bioreactor supplement (SAFC Biosc.) приводит к увеличению удельной продукции в 1,5 раза, а в сочетании с бутиратом натрия (0,5-1 мМ) или диметиосульфоксидом (1% V/V) увеличение удельной продукции составляет 2-2,5 раза.
Таким образом, был получен один из наиболее производительных и стабильных клонов Cricetulus griseus CHO 1F8, который был далее использован для создания мастер-банка и последующего производства рекомбинантного активатора плазминогена человека.
Пример 3. Культивирование клеток-продуцентов rhtPA в биореакторе с перфузией питательной среды.
Клетки культивируют суспензионным способом в биореакторе с перфузией питательной средой в объеме 0,2-1 объем биореактора/сутки, как правило 0,25-0,5 объема биореактора/сутки, при 37°С, pH 7,0±0,2, с содержанием растворенного кислорода в пределах от 20 до 50% от насыщения, с 5% СО2 в газовой фазе.
Для выращивания клеток-продуцентов в фазе логарифмического роста используют питательную среду SFM4CHO; в продуктивный период в стационарной фазе роста в питательную среду вносят добавки: СНО Bioreactor supplement (SAFC Biose) 5 мл/1 л питательной среды в сутки, диметилсульфоксид 1%V/V, глюкозу до уровня не менее 3 г/л.
При концентрации клеток в стационарной фазе роста в пределах 5-15 млн/мл, как правило 10 млн/мл, экспрессия целевого белка tPA составляет 70-190 мг/л среды в сутки, как правило 150 мг/л/сутки.
Пример 4. Выделение tPA с использованием металло-хелатной хроматографии на IMAC Sepharose.
IMAC-сефароза, насыщенная ионами переходного металла, является псевдоаффинным сорбентом для белков, имеющих специфический центр связывания соответствующего металла. Молекула tPA содержит центр связывания цинка, что позволяет специфически сорбировать белок на Zn-IMAC сефарозе. Поэтому выделение на IMAC-сефарозе использовали для захвата фракции tPA из культуральной жидкости и ее очистки от посторонних белков, не обладающих аффинитетом к переходным металлам и не связывающихся с сорбентом. Этот способ также позволяет сконцентрировать белок перед нанесением на следующую хроматографическую стадию.
Все хроматографические стадии выделения проводили при температуре +4-10°С, буферные растворы предварительно охлаждали. Перед нанесением культуральной жидкости сорбент насыщали ионами цинка путем пропускания через слой сорбента 0.2 М раствора ацетата цинка с последующей промывкой водой и уравновешивали стартовым буфером (20 мМ Трис-HCl, 100 мМ NaCl, 0.05% полисорбат 80, 5% спирт (изопропиловый или этиловый), pH 8.0).
После нанесения культуральной жидкости сорбент промывали от несвязавшихся примесей стартовым буфером, затем последовательно промывали высокосолевым буфером (содержащим 1М NaCl), имидазольным буфером (содержащим 0,1М имидазол) и низкосолевым буфером (включающим 50 мМ ацетат натрия). Указанные промывки позволяют отделить tPA от неспецифически и слабо связанных примесных белков и нуклеиновых кислот штамма-продуцента, а также подготовить продукт к элюции.
Фракцию tPA элюировали кислым буфером, содержащим 50 мМ ЭДТА, и разбавляли в 5 раз кислым низкосолевым буфером, содержащим 50 мМ ацетат натрия (pH 4.5). Полученный раствор использовали для нанесения на следующую стадию выделения.
Пример 5. Выделение tPA с использованием катионо-обменной хроматографии на SP Sepharose с предколонкой Q Sepharose
При выделении tPA на данной стадии использовали последовательно подключенные колонки с Q Sepharose и SP Sepharose (соотношение объемов сорбентов примерно 1:10). Q и SP сефарозы являются, соответственно, сильными анионо- и катионо-обменными сорбентами, позволяющими разделение биомолекул с разными поверхностными зарядами; при этом Q сефароза обладает высокими ДНК-связывающими свойствами. Таким образом, одновременное применение этих сорбентов при низком значении pH в процессе выделения tPA позволяет эффективно удалить остаточную ДНК штамма-продуцента и белки, обладающие отрицательным зарядом при рабочем pH, без потери целевого белка (на Q сефарозе) и количественно сорбировать tPA (на SP сефарозе), дополнительно очищая белок от примесей и переводя его в подходящий буферный раствор для последующей хроматографической стадии.
Колонки с сорбентами предварительно уравновешивали стартовым буфером (50 мМ ацетат натрия, 100 мМ NaCl, 0.05% полисорбат 80, pH 5.0), после чего наносили разбавленный элюат с IMAC сефарозы. Фракцию tPA элюировали щелочным буфером, содержащим 1М изотиоцианат калия, и разбавляли в 10 раз низкосолевым щелочным буфером (содержащим 100 мМ Na-СО3, pH 10.0). Полученный раствор использовали для нанесения на следующую стадию выделения.
Пример 6. Выделение tPA с использованием псевдоаффинной хроматографии на Lysine Sepharose Lysine сефароза является псевдоаффинным сорбентом для белков, имеющих область связывания (биоспецифическую или по локальному заряду) с лизином. Мономерная молекула tPA специфично сорбируется на Lys сефарозу, в то время как олигомерные формы не связываются с носителем, что позволяет эффективно отделить олигомерные формы от мономерной и получить концентрированную фракцию белка в лизин-содержащем буферном растворе, стабилизирующем продукт в мономерной форме.
Колонку с Lysine сефарозой предварительно уравновешивали стартовым буфером (20 мМ Na-СО2, 0.1 М NaCl, 0.05% полисорбат 80, pH 10.0), после чего наносили разбавленный элюат, полученный в предыдущем примере. Фракцию tPA элюировали буфером, содержащим 50 мМ лизин.
Пример 7. Концентрирование и диафильтрация tPA в буфер готовой формы.
Для диафильтрации применяли полиэфирсульфоновый фильтр, непроницаемый для частиц весом более 30 кДа, который предварительно уравновешивали буфером готовой формы следующего состава: 400 мМ аргинин-фосфата, 0.02% полисорбат 80, pH 7.3. В элюат, полученный в Примере 6, вносили сухой L-аргинин гидрохлорид до концентрации 400 мМ. После полного растворения полученный раствор концентрировали на системе для диафильтрации до концентрации 4-5 мг tPA/мл, затем диафильтровали в буфер готовой формы, путем пропускания через систему 8-10 объемов. Полученную субстанцию замораживали в жидком азоте и хранили при -80°С.
Пример 8. Измерение биологической активности субстанции tPA.
Определение активности tPA проводили тремя методами - с использованием прямого хромогенного субстрата tPA; с использованием хромогенного субстрата плазмина (непрямого субстрата) и методом лизиса фибриновых сгустков (ЛФС). В каждом из методов в качестве стандарта использовали международный стандарт активности tPA и составляли калибровочную шкалу для определения активности.
В первом методе к tPA добавляли прямой синтетический пептидный субстрат, соединенный с хромофором, что приводило к расщеплению субстрата. В результате этого реакционная смесь приобретала желтую окраску. Измеряли поглощение реакционной смеси при 405 нм, которое прямо пропорционально активности tPA.
При использовании второго метода в реакционную смесь добавлялись tPA, природный субстрат tPA, плазминоген, и субстрат плазмина (продукта расщепления плазминогена), соединенный с хромофором. В результате активации плазминогена полученный плазмин расщеплял субстрат, и освободившийся хромофор приводил к окрашиванию раствора в желтый цвет, интенсивность которого прямо пропорциональна активности tPA.
При использовании третьего метода в реакционную смесь добавляли компоненты, необходимые для образования фибринового сгустка (нормальная плазма и каолин), и компоненты, необходимые для лизиса (плазминоген и tPA), и измеряли время лизиса, которое пропорционально активности tPA. В данном случае измерение активности tPA основано на способности tPA активировать плазминоген до плазмина в фибриновом сгустке, что приводит к его лизису.
Удельная активность субстанции tPA, определенная при помощи перечисленных методов, составила 580000 МЕ/мг.
Таким образом, настоящее изобретение позволяет получить рекомбинантный активатор плазминогена человека со свойствами, идентичными свойствам природного полипептида. Полученный rtPA в дальнейшем может быть использован для изготовления лекарственных препаратов и в фармацевтической промышленности.







Изобретение относится к области биотехнологии и может быть использовано для получения тканевого активатора плазминогена человека. Рекомбинантной плазмидной ДНК рВК415, кодирующей полипептид с последовательностью тканевого активатора плазминогена человека, включающей также MAR - область прикрепления к ядерному матриксу гена лизоцима птиц, усилитель транскрипции вируса CMV, внутренний сайт инициации трансляции IRES вируса энцефаломиокардита, ген DHFR мыши, сигнал полиаденилирования вируса SV40, ген аминогликозид-3'-фосфотрансферазы, обеспечивающей устойчивость к генетицину (Neo) и кассету для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину, трансформируют клетки линии Cricetulus griseus CHO DHFR(-) с получением линии клеток Cricetulus griseus CHO 1F8, продуцирующей рекомбинантный белок тканевого активатора плазминогена со стабильно высоким выходом на уровне до 190 мг/л. Культивирование клеток-продуцентов проводят в перфузионных условиях в присутствии смеси, состоящей из добавки CHO Bioreactor supplement и бутирата натрия или диметилсульфоксида, с последующим выделением целевого продукта. 3 н. и 2 з.п. ф-лы, 5 ил., 3 табл., 8 пр.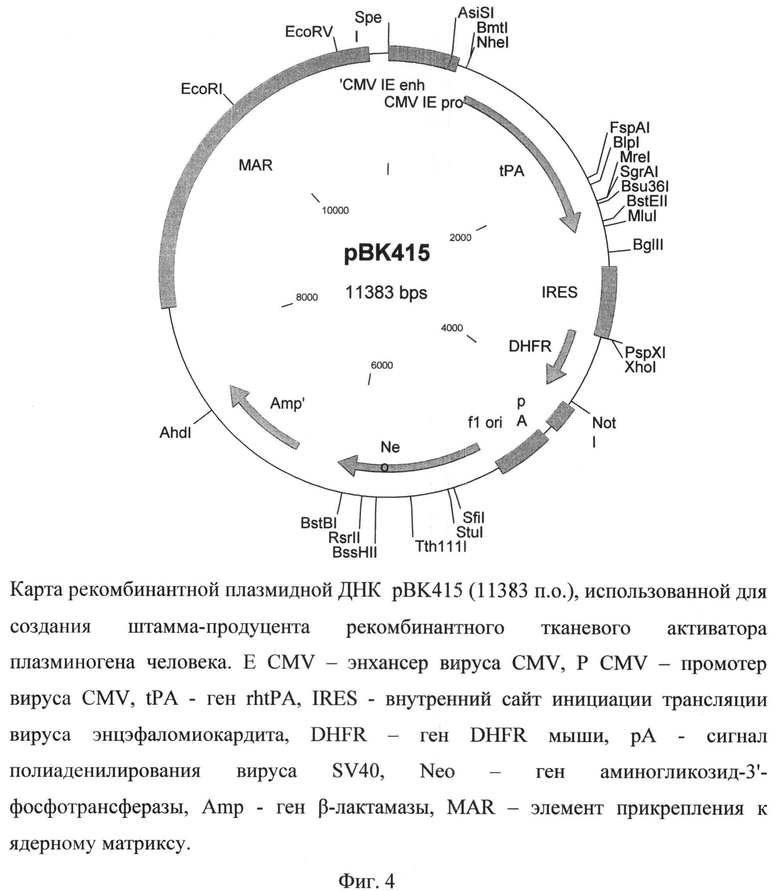
1. Рекомбинантная плазмидная ДНК рВК415, кодирующая полипептид с последовательностью тканевого активатора плазминогена человека, имеющая размер 11383 п.о., с физической картой, представленной на фиг.4, и состоящая из следующих элементов:
- оптимизированной последовательности, кодирующей полипептид тканевого активатора плазминогена человека, SEQ ID NO: 2,
- MAR - области прикрепления к ядерному матриксу гена лизоцима птиц,
- усилителя транскрипции вируса CMV,
- внутреннего сайта инициации трансляции IRES вируса энцефаломиокардита,
- гена DHFR мыши,
- сигнала полиаденилирования вируса SV40,
- аминогликозид-3'-фосфотрансферазы, обеспечивающего устойчивость штамма клеток-продуцента к генетицину (Neo),
- кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину,
- уникальных участков узнавания следующих эндонуклеаз рестрикции: AhdI (7352 п.о.), AsiSI (508 п.о.), BglII (2649 п.о.), BipI (2079 п.о.), BmtI (654 п.о.), BssHII (5778 п.о.), BstBI (6062 п.о.), BstEII (2388 п.о.), Bsu36I (2245 п.о.), EcoRI (10035 п.о.), EcoRV (10969 п.о.), FspAI (2020 п.о.), МluI (2433 п.о.), MreI (2220 п.о.), NheI (654 п.о.), NotI (3918 п.о.), PspXI (3342 п.о.), RsrII (5896 п.o.), SfiI (5133 п.o.), SgrAI (2220 п.o.), StuI (5184 п.о.), Tth111I (5496 п.о.), XhoI (3343 п.о.).
2. Линия клеток Cricetulus griseus CHO 1F8 - продуцент рекомбинантного тканевого активатора плазминогена человека, полученная путем трансформации линии клеток Cricetulus griseus CHO DHFR - рекомбинантной плазмидной ДНК рВК415 по п.1.
3. Способ получения и выделения полипептида, обладающего активностью тканевого активатора плазминогена, включающий культивирование линии клеток по п.2, где для экспрессии указанного полипептида культивирование проводится в перфузионных условиях в присутствии смеси, состоящей из добавки CHO Bioreactor supplement и бутирата натрия или диметилсульфоксида, и выделение полипептида, обладающего активностью тканевого активатора плазминогена.
4. Способ по п.3, где в составе смеси используется 0,5-1,5 мМ бутират натрия или 1% (V/V) диметилсульфоксид.
5. Способ по любому из пп.3 или 4, где линия клеток адаптирована к бессывороточной среде.
| СПОСОБ ПОЛУЧЕНИЯ АКТИВАТОРА ПЛАЗМИНОГЕНА ТКАНЕВОГО ТИПА, ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ СНО-ПРОДУЦЕНТ АКТИВАТОРА ПЛАЗМИНОГЕНА ТКАНЕВОГО ТИПА | 1987 |
|
RU2046827C1 |
| СМЕСИТЕЛЬ ВЯЗКИХ ЖИДКОСТЕЙ | 0 |
|
SU260148A1 |
| Способ определения показателя преломления твердых и жидких тел и рефрактометр для осуществления этого способа | 1957 |
|
SU117059A1 |
Авторы
Даты
2013-12-10—Публикация
2012-07-19—Подача