Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения рекомбинантного активированного фактора свертываемости крови VIIa человека (rhFVIIa). Изобретение представляет собой рекомбинантную плазмидную ДНК рАР271, кодирующую полипептид с последовательностью рекомбинантного фактора свертываемости крови VII человека (rhFVII), и штамм-продуцент на основе линии клеток почек новорожденного хомячка Mesocricetus auratus BHK21 к.13 (2Н7), содержащей указанную плазмидную ДНК и синтезирующий рекомбинантный фактор свертываемости крови VII человека.
Фактор свертываемости крови VII человека представляет собой гликопротеин, молекулярная масса которого составляет около 55 кДа, являющийся компонентом плазмы крови. Белок hFVII циркулирует в кровотоке в неактивной одноцепочечной форме и представляет собой зимоген. Он может подвергаться ограниченному протеолизу при помощи различных протеаз компонентов плазмы, например, фактора Ха, XIIa, IXa или тромбина, или автопротеолизу. При этом происходит расщепление полипептидной цепи между Arg152 и Ile153 и образование двух полипептидных цепей, называемых легкой и тяжелой, удерживаемых в составе единого комплекса с помощью дисульфидной связи. Этот процесс называется активацией фактора VII. Основным физиологичным активатором фактора VII является фактор Ха. Полученный таким образом FVIIa далее участвует в процессе свертывания крови, приводящей к формированию фибринового сгустка.
Подобно некоторым другим белкам плазмы крови, участвующих в процессе гемостаза, активность фактора VII является витамин-K- зависимой. Витамин K необходим для гамма-карбоксилирования 10 глутаминовых остатков, расположенных в виде кластера на N-конце последовательности белка, что обеспечивает необходимое для активации коагуляции металлзависимое взаимодействие FVII с фосфолипидами.
rhFVIIa имеет по два сайта N- и O-гликозилирования. Сайты О-гликозилирования располагаются на остатках серина 52 и 60 и необходимы для взаимодействия с эпидермальным фактором роста (EGF). Сайты N-гликозилирования представлены двумя остатками Asn145 и Asn322. Сайты O-гликозилирования содержат от 1 до 4 моносахаридных остатков, сайты N-гликозилирования имеют более сложную природу и представляют собой биантенные фукозилированные структуры с одним или двумя остатками сиаловой кислоты.
Все перечисленные пост-трансляционные модификации крайне важны для биологической активности фактора VII. В связи с этим рекомбинантный белок получают путем трансформации клеток млекопитающих (СНО, ВНК-21 и других) рекомбинантными плазмидами, несущими ген rhFVII. Полученный штамм клеток секретирует rhFVII в культуральную среду.
Фактор свертываемости крови VIIa способствует быстрому свертыванию крови, действуя в коагуляционном каскаде на более поздних стадиях по сравнению с фактором VIII. Поэтому rhFVIIa в основном используется для лечения пациентов с гемофилией A, имеющих ингибиторы (антитела) к фактору VIII, и пациентов с гемофилией B, имеющих ингибиторы к фактору IX. В более редких случаях rhFVIIa также применяется, когда уровень экспрессии FVIIa недостаточен для обеспечения нормальной скорости коагуляции. Вследствие этого rhFVIIa используют для предотвращения кровопотерь при сильных кровотечениях различной этиологии. В частности, он используется в акушерской и хирургической практике (Gastroenterol. 2002; 123: 118-26); для остановки внутренних кровотечений после хирургических вмешательств (British Journal of Haematology 1999; 107: 677-678); при трансплантации гематопоэтических стемовых клеток (J Thromb Haemost. 2005 Sep; 3(9): 1935-44); различных травмах (Neurol Neurochir Pol. 2004 Nov-Dec; 38(6):527-31), после открытых операций на сердце (Paediatr Anaesth. 2005 Mar; 15(3):235-40) и т.п.
В настоящее время известно несколько биотехнологических систем для получения данного белка. В патенте США 6329176 раскрывается плазмида pLN174, содержащая ген фактора VII, и штамм-продуцент на ее основе. Недостатком данной системы является низкий уровень экспрессии белка, достигаемый при использовании указанной плазмиды (0,18 мкг/мл). В патенте США 5580560 предлагается использовать соэкспрессию с протеазой КЕХ-2, что увеличивает выход белка почти в 5 раз (0,90 мкг/мл), но при этом есть вероятность получения неактивных форм белка, которые за счет протеолитической деградации не обладают коагуляционной активностью.
Существует также ряд продуцентов, позволяющих получать фактор VII, отличающийся от природного заменой одной или нескольких аминокислот (см., например, патенты РФ 2325401, 2338752, патенты США 6960657, 6905683). Однако при использовании таких белков для получения лекарственных препаратов сохраняется опасность возникновения иммунного ответа.
Плазмида, содержащая ген фактора VII, и штамм-продуцент на ее основе, использованный для получения этого белка в клетках млекопитающих, описана также в патенте РФ 2122583. Недостатком указанной плазмиды является трудоемкость сборки из большого количества элементов последовательности ДНК, кодирующей требуемый белок, а также небольшой выход целевого белка (порядка 1 мкг/мл).
Наиболее близким аналогом настоящего изобретения является плазмида pEFZeoF7, содержащая ген фактора VII, и продуцент на ее основе, использованный для получения этого белка, полученные способом, описанным в патенте РФ 2337965. Уровень секреции рекомбинантного фактора VII в этой системе составил 40 мкг/мл, что дало основания для возможности его использования в промышленном производстве белка. Однако проведенные тесты на стабильность продукции и пролиферации описанной клеточной линии показали невозможность ее использования в производственном процессе в силу резкого падения как продуктивности, так и пролиферативной активности линии на протяжении всего нескольких пассажей. Указанные свойства свидетельствуют о недостаточной стабильности клона. Таким образом задача конструирования плазмидной ДНК и создания стабильного штамма-продуцента на ее основе, позволяющего получать белок с хорошим выходом, остается актуальной.
Настоящее изобретение решает задачу конструирования плазмидной ДНК, содержащей последовательность рекомбинантного фактора VII, и создания линии клеток (штамма-продуцента), позволяющей получать рекомбинантный фактор VII с хорошим выходом (на постоянном уровне 2-3 мг/л) и сохраняющим свою производительность на протяжении большого числа пассажей (не менее 30), что является важным и необходимым для промышленного производства белка.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК рАР271, состоящей из 12125 п.о. и линии клеток Mesocricetus auratus BHK-21 к.13 (2Н7), позволяющей получать rhFVII со стабильно высоким выходом, достаточным для промышленного производства.
Введение различных генетических элементов генома эукариот в состав рекомбинантных конструкций, используемых для последующей трансфекции клеток млекопитающих, может оказывать положительное влияние на стабильность трансгена в геноме клетки-реципиента, существенно улучшая ростовые характеристики культуры (S.C.Makrides Gene Transfer and Expression in Mammalian Cells, (2003) Elsevier Science, chapters 10-12). Подобные элементы, в частности MAR, используются для создания промышленных штаммов-продуцентов, для которых критическим параметром, определяющим возможность его использования в производстве, является стабильность уровня продукции и скорости роста культуры.
Элементы прикрепления к ядерному матриксу MAR (Matrix Attachment Regions) представляют собой фрагменты ДНК эукариот длиной 300-3000 п.о. и играют ключевую роль в организации ядерной и хромосомной архитектуры. В интерфазе они фиксируют хроматин с белками, формирующими ядерный матрикс, разделяя геном эукариот на независимые хроматиновые петли (Mirkovitch, J., Mirault, M.E., and Laemmli, U.K. (1984) Cell 39, 223-232.). Благодаря колокализации MAR-элементов с участками активной транскрипции и регуляторных элементов в геноме, первые положительно влияют на уровень транскрипции трансгена, привлекая активаторы транскрипции и контролируя доступность ДНК в составе хроматина. Помимо указанных свойств MAR-элементы, например MAR гена лизоцима птиц, могут предотвращать постепенное снижение активности трансгенного промотера, что существенно повышает стабильность уровня экспрессии трансгена (Allen, G.C., Spiker, S., and Thompson, W.F. (2000) Plant Mol. Biol. 43, 361-376).
В процессе конструирования плазмиды мы обнаружили, что использование MAR в плазмиде, включающей ген hFVII, позволяет поддерживать уровень экспрессии данного белка с наибольшей стабильностью.
Преимущества предлагаемого изобретения заключаются, во-первых, в использовании химико-ферментативного метода синтеза гена hFVII, что позволяет подобрать оптимальный кодонный состав гена, избежать наличия в последовательности структур ДНК, препятствующих процессу трансляции, криптических сайтов сплайсинга, полиаденилирования. Оптимизация первичной структуры гена и использование комбинации промотера фактора элонгации трансляции человека EF-1α и энхансера транскрипции цитомегаловируса CMV, а также фрагмента ДНК, обеспечивающего прикрепление к ядерному матриксу MAR, позволяют существенно увеличить уровень секреции фактора VII в питательную среду, и, соответственно, финальный выход целевого продукта.
Рекомбинантная плазмидная ДНК рАР271 содержит следующие последовательности: MAR-района прикрепления к ядерному матриксу гена лизоцима птиц, энхансера транскрипции вируса CMV, промотера гена трансляционного фактора элонгации EF-1α, кДНК гена hFVII, внутреннего сайта инициации трансляции IRES, гена DHFR, сигнала полиаденилирования вируса SV40, кассеты, содержащей все необходимые элементы для экспрессии гена аминогликозид-3'-фосфотрансферазы (АРН), обеспечивающего устойчивость штамма клеток-продуцента к генетицину, и кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину. Плазмида рАР271 (фиг.1), кодирующая полипептид фактора VII, характеризуется следующими признаками:
- состоит из 12125 п.о.,
- имеет молекулярную массу 7,49 МДа,
- кодирует полипептид фактора VII свертываемости крови человека,
- обеспечивает устойчивость бактериальных клеток, трансформированных данной плазмидой, к ампицилину и клеток млекопитающих, трансфецированных указанной плазмидой, к генетицину,
- содержит уникальные участки узнавания следующих эндонуклеаз рестрикции: AgeI (850 п.о.), BbvCI (1657 п.о.), BmgBI (4202 п.о.), BssHII (6672 п.о.), Eco47III (11269 п.о.), EcoRI (10929 п.о.), EcoRV (11863 п.о.), FseI (1455 п.о.), NotI (4812 п.о.), RsrII (6790 п.о.), SbfI (2330 п.о.), SfiI (6027 п.о.), Tth111I (6390 п.о.), XcmI (2404 п.о.).
Линия клеток Mesocricetus auratus ВНК-21 к.13 (2Н7) - продуцент рекомбинантного фактора VII свертываемости крови человека, являющаяся производным фибробластов почек новорожденного сирийского хомяка Mesocricetus auratus ВПК-21 к.13 характеризуется следующими признаками:
Морфологические признаки. Клетки имеют типичные морфологические признаки фибробластов, представляют собой адгерантную культуру. Это псевдодиплоидная линия (2n=44), пределы изменчивости по числу хромосом 35-45, модальное число хромосом 40, количество полиплоидов составляет не более 14%.
Культуральные признаки. Клетки растут в монослое на простых питательных средах, например, на минимальной среде Игла ЕМЕМ.
Физиолого-биохимические признаки. Клетки растут при температуре 37°С, рН 6.7-7.3.
Устойчивость к антибиотикам. Клетки обладают устойчивостью к генетицину в концентрации 800 мкг/мл.
Штамм клеточной линии Mesocricetus auratus ВНК-21 к.13 (2Н7) был депонирован в Институте Биоорганической Химии им. академиков М.М.Шемякина и Ю.А.Овчинникова Российской Академии Наук 22 марта 2008 г. (коллекционный шифр Э-002).
Заявленное изобретение поясняется на следующих фигурах:
На фиг.1 представлена карта рекомбинантной плазмидной ДНК рАР271, использованной для создания штамма-продуцента рекомбинантного фактора VII свертываемости крови человека.
На фиг.2 представлены:
A. SEQ ID N1 - аминокислотная последовательность коагуляционного Фактора VII человека, 444 а.к.
Б. SEQ ID N2 - оптимизированная последовательность гена коагуляционного фактора VII человека, 1335 п.о.
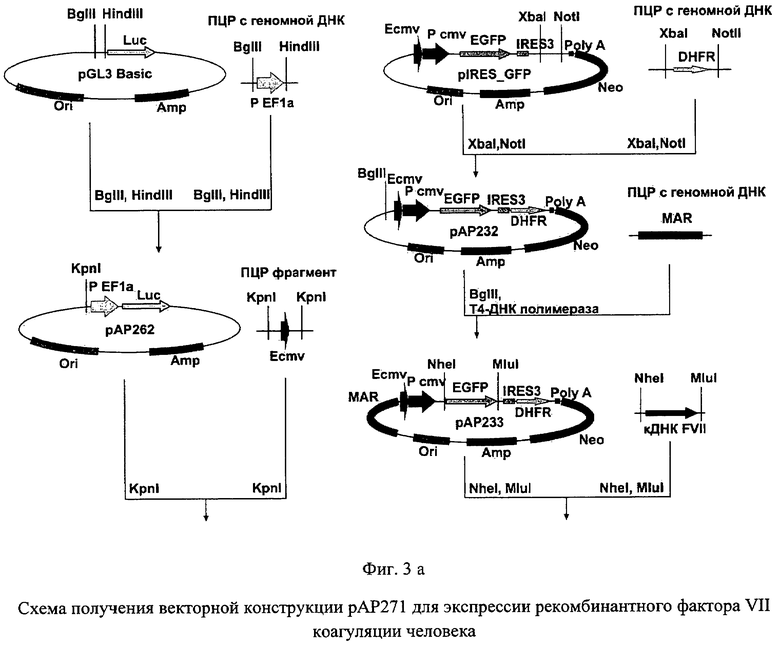
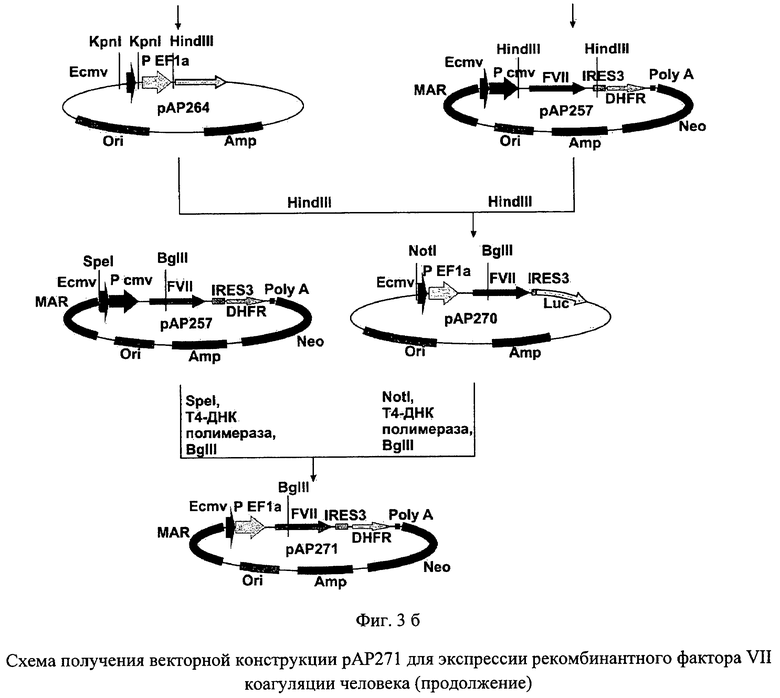
На фиг.3 (а и б) представлена схема получения векторной конструкции рАР271 для экспрессии рекомбинантного фактора VII коагуляции человека.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК рАР271.
Нуклеотидную последовательность, соответствующую кДНК гена коагуляционного фактора VII человека, получают химико-ферментативным синтезом. Для этого оптимизированную последовательность гена разбивают на перекрывающиеся фрагменты размером около 50 п.о. Химический синтез олигонуклеотидов, соответствующих этим фрагментам, проводят с помощью твердофазного фосфамидитного метода с использованием синтезатора ASM-102U (БИОССЕТ, Новосибирск). Полученные олигонуклеотиды подвергают 5'-концевому фосфорилированию с использованием Т4 полинуклеотидкиназы (NEB, США). Фосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении в 50 мкл буфера, содержащего 20 мМ трис-HCl, pH 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреита, прогревают до 65°C, медленно охлаждают до 37°C в течение часа и добавляют Т4-ДНК-лигазу. Реакцию лигирования ДНК проводят 12 ч при 37°C, 0,1 мкл полученного раствора используют в качестве матрицы в полимеразной цепной реакции (ПЦР) в присутствии термостабильной ДНК-полимеразы Pfu и специфических праймеров:
F7_fwd 5'-TAG GCTAGC CGCCACCATGGTGAGCCAGGCACTGAG-3' и
F7_rev 5'-CG ACGCGT TATTAGGGAAAGGGAGCTCTCAGCAG-3'.
Синтезированный таким образом фрагмент ДНК содержит последовательность кДНК гена коагуляционного фактора VII человека, фланкированную сайтами узнавания рестриктаз NheI и MluI - SEQ ID N2 (фиг.2Б). Продукт амплификации гидролизуют рестриктазами NheI и МluI, очищают электрофорезом в 1% агарозном геле, полосу ДНК величиной около 1350 п.о. выделяют из геля методом электроэлюции и осаждают ДНК из раствора этанолом.
Для получения векторной ДНК рАР271 использовали серию последовательных этапов клонирования (фиг.3). Первоначально использовали вектор pIRES (Clontech, США), в который клонировали синтезированную ранее последовательность кДНК гена фактора VII по сайтам рестрикции NheI и MluI. Далее, используя сайты рестрикции XbaI и NotI, в полученный вектор клонировали ген дигидрофолатредуктазы мыши, полученный методом ПЦР с использованием геномной ДНК, выделенной из клеток миеломы мыши SP2/0, и специфических праймеров
DHFR_fwd 5'-CC TCTAGA TGGTTGTGGCCATATTATCATCGTGTTTTTCAAAG-3' и
DHFR_rev 5'-GGAA GCGGCCGC TTAGTCTTTCTTCTCGTAGACTTCA-3'
с последующим проведением сайт-направленного мутагенеза для оптимизации консенсусной последовательности в окружении инициаторного кодона IRES-элемента с помощью набора QuikChange® II XL (Stratagene, США) и следующих олигонуклеотидов:
D3_fwd
5'-CCTTTGAAAAACACGATGATAATATGGCCACAACCATGGTTCGACCATTGAACTGCATC-3' и
D3_rev
5'-GATGCAGTTCAATGGTCGAACCATGGTTGTGGCCATATTATCATCGTGTTTTTCAAAGG-3'.
Первичная структура промежуточной векторной конструкции pAP232 в районе инициаторного кодона IRES-элемента была подтверждена методом секвенирования по Сэнгеру.
Плазмиду pAP232 далее последовательно обрабатывали эндонуклеазой рестрикции BglII и Т4-ДНК полимеразой и образовавшийся вектор использовали в реакции лигирования с ПЦР-продуктом, полученным с использованием MAR-специфических праймеров
MAR_fwd 5'-GGGGATCCGTAATACAATTGTACCAGGTTTTGGTTTATTAC-3' и
MAR_rev 5'-GAAAACAATATATTTCCAAATGAAAAAAAAATCTGATAAAAAG-3'.
Отбор полученных после трансформации лигазной смеси бактериальных клеток XL-10 Gold проводили таким образом, чтобы выявить плазмидную ДНК рАР257, содержащую последовательность MAR в геномной ориентации по отношению к промотеру.
В плазмидную ДНК pGL3Basic (Promega, США) по сайтам BglII и HindIII клонировали ПЦР-фрагмент ДНК, представляющий собой промотер фактора элонгации трансляции EF-1α человека, полученный с использованием праймеров
EF_fwd 5'-GAC AGATCT GGCTCCGGTGCCCGTCAGTGGGCAGAG-3' и
EF_rev 5'-CA AAGCTT GCGACCACGTGTTCACGACACCTGAAATGG-3'
и геномной ДНК клеток человека HEK293. Полученный таким образом вектор рАР262 линеаризовали эндонуклеазой рестрикции KpnI и клонировали эхансер транскрипции цитомегаловируса CMV, полученный методом ПЦР с использованием плазмидной ДНК pIRES и специфических праймеров
CMV_fwd 5'-CGG GGTACC GCGTTACATAACTTACGGTAA-3' и
CMV_rev 5'-CGG GGTACC AAAACAAACTCCCATTGACGTCAA-3'.
В полученную плазмиду рАР264 по сайту HindIII клонировали ДНК-фрагмент размером около 1950 п.н., полученный после обработки векторной ДНК рАР257 рестриктазой HindIII. Селекцию рекомбинантных плазмид проводили таким образом, чтобы идентифицировать векторную ДНК рАР270, содержащую последовательность гена фактора VII в прямой по отношению к промотеру ориентации. Из полученного вектора рАР270 далее выделяли фрагмент ДНК размером около 2350 п.н., образовавшийся в результате последовательной обработки рестриктазой NotI, Т4-ДНК полимеразой и ограниченного гидролиза эндонуклеазы рестрикции BglII в условиях недостатка фермента. В качестве векторной ДНК использовали плазмиду рАР257, обработанную рестриктазой SpeI, Т4-ДНК полимеразой и эндонуклеазой рестрикции BglII. Указанные фрагменты лигировали с помощью Т4-ДНК лигазы, полученный вектор получил название рАР271. В дальнейшем первичная последовательность полученной плазмидной ДНК была подтверждена методом сиквенирования по Сэнгеру. По данным секвенирования отобрали плазмиду, нуклеотидная и соответствующая ей аминокислотная последовательности NheI - MluI фрагмента которой полностью идентичны последовательности кДНК гена коагуляционного фактора VII человека, которую использовали в дальнейшей работе.
Пример 2.
Получение линии клеток Mesocricetus auratus ВНК-21 к.13 (2Н7), стабильно продуцирующих рекомбинантный коагуляционный фактор VII человека.
Для получения клеточной линии, стабильно продуцирующей рекомбинантный фактор VII свертываемости крови человека (rhFVII), клетки линии Mesocricetus auratus BHK-21 к.13 трансфецируют плазмидной ДНК рАР271, линеаризованной по сайту рестрикции BspHI, например, методом липофекции при помощи реагента jetPEI™ (Polyplus Transfection Inc., США).
Клетки Mesocricetus auratus BHK-21 к.13 высевают на чашку Петри (например, диаметром 10 см) с плотностью 2×104 клеток/см2 в 12 мл среды DMEM, содержащей 10% бычьей фетальной сыворотки, и инкубируют 24 часа при 37°С в СО2-инкубаторе. Далее проводят трансфекцию, используя 15 мкг линеаризованной по сайту рестрикции BspHI плазмиды рАР271 и 30 мкл реагента jetPEI™ согласно рекомендациям производителя. Через 48 часов после трансфекции проводят селекцию на антибиотике генетицин в концентрации 800 мкг/мл клонов стабильно трансфецированных клеток. Смену селективной среды, содержащей антибиотик, проводят регулярно каждые 3-4 дня. Начиная с 7-го дня, лунки анализируют на наличие клонов активно делящихся клеток, устойчивых к генетицину. Отдельно растущие клоны, достигшие размера 1-2 мм, последовательно пересаживают в 96-, затем в 24- и 6-луночные планшеты по мере достижения 80-90% конфлюентности.
Продуктивность клонов оценивают методом твердофазного иммуноферментного анализа (ELISA) или иммуноблотинга с использованием моноклональных или поликлональных антител к коагуляционному фактору VII человека. Для этого в лунках, в которых клетки достигли 80-90% конфлюентности, заменяют среду на свежую, содержащую дополнительно 10 мкг/мл витамина К1, и инкубируют 72 часа при 37°С в СО2-инкубаторе. Супернатант используют в ELISA тесте, используя, например, набор Imubind® FactorVII ELISA (American Diagnostica Inc., США).
Лунки с клонами, экспрессирующими rhFVII на уровне 1-2 мг/л/24 часа, дополнительно клонируют методом предельного разведения. Наиболее продуктивные клоны используют в тесте на стабильность продукции фактора VII. Для этой цели клоны культивируют на протяжении 50-100 генераций, периодически оценивая уровень экспрессии rhFVII методом ELISA.
Таким образом, был получен один из наиболее производительных и стабильных клонов Mesocricetus auratus BHК 21 к.13 (2Н7), который был далее использован для создания мастер-банка и последующего производства рекомбинантного фактора VII свертываемости крови человека. Уровень экспрессии белка для данного клона составляет 2-3 мг/л.
Получение рекомбинантного активированного фактора VII свертываемости крови человека основано на длительной культивации линии клеток Mesocricetus auratus BHК 21 к.13 (2Н7), например, в течение 30 суток, с ежедневным отбором культуральной жидкости. Культуральная жидкость используется для дальнейшего выделения rhFVIIa с помощью ряда последовательных стадий: фильтрации, анион-обменной хроматографии в градиенте концентрации соли, аффинной хроматографии, анион-обменной хроматографии в градиенте концентрации кальция, в ходе которой происходит активация фактора VII, гель-фильтрационной хроматографии.
Удельная активность выделенного таким образом rhFVIIa, измеренная стандартным коагулометрическим методом, составляет 44000-64000 МЕ/мг.
Таким образом, настоящее изобретение позволяет получить рекомбинантный активированный фактор свертываемости крови VIIa человека со свойствами, идентичными свойствам природного полипептида. Полученный rhFVIIa в дальнейшем может быть использован для изготовления лекарственных препаратов.

Изобретение относится к области биотехнологии, а именно к рекомбинатной плазмидной ДНК рАР271 и линии клеток Mesocricetus auratus ВНК 21 k.13 (2H7). Конструируют рекомбинантную плазмидную ДНК рАР271, содержащую ген белка rhFVII, MAR-область прикрепления к ядерному матриксу гена лизоцима птиц, усилитель транскрипции вируса CMV, промоутер гена трансляционного фактора элонгации EF-1α человека, внутренний сайт инициации трансляции IRES вируса энцефаломиокардита, ген DHFR мыши, сигнал полиаденилирования вируса SV40, кассету, содержащую все необходимые элементы для экспрессии гена аминогликозид-3'-фосфотрансферазы (АРН), кассету для экспрессии в клетках бактерий гена β-лактамазы, а также уникальные участки узнавания следующих эндонуклеаз рестрикции: AgeI (850 п.о.), BbvCI (1657 п.о.), BmgBI (4202 п.о.), BssHII (6672 п.о.), Eco47III (11269 п.о.), EcoRI (10929 п.о.), EcoRV (11863 п.о.), FseI (1455 п.о.), NotI (4812 п.о.), RsrII (6790 п.о.), SbfI (2330 п.о.), SfiI (6027 п.о.), Tth111I (6390 п.о.), XcmI (2404 п.о.). Предложенное изобретение позволяет получать рекомбинантный белок фактора VII свертываемости крови человека со стабильно высоким выходом. 2 н.п. ф-лы, 4 ил., 2 пр.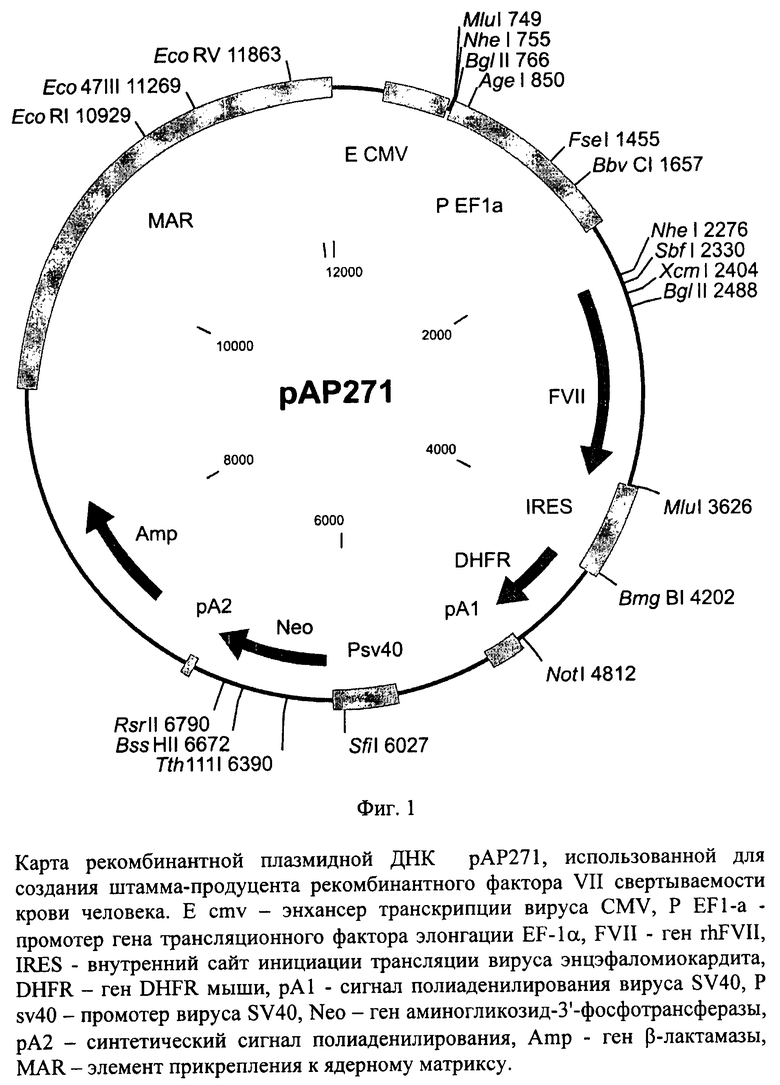
1. Рекомбинантная плазмидная ДНК рАР271, кодирующая полипептид с последовательностью фактора VII свертываемости крови человека, имеющая размер 12125 п.о., с физической картой, представленной на фиг.1, и состоящая из следующих элементов:
оптимизированной последовательности, кодирующей полипептид фактора VII свертываемости крови человека,
MAR - области прикрепления к ядерному матриксу гена лизоцима птиц,
усилителя транскрипции вируса CMV,
промотера гена трансляционного фактора элонгации EF-1α человека,
внутреннего сайта инициации трансляции IRES вируса энцефаломиокардита,
гена DHFR мыши,
сигнала полиаденилирования вируса SV40,
кассеты, содержащей все необходимые элементы для экспрессии гена аминогликозид-3'-фосфотрансферазы (АРН), обеспечивающего устойчивость штамма клеток-продуцента к генетицину,
кассеты для экспрессии в клетках бактерий гена β-лактамазы, обеспечивающей устойчивость к ампицилину,
уникальных участков узнавания следующих эндонуклеаз рестрикции: AgeI (850 п.о.), BbvCI (1657 п.о.), BmgBI (4202 п.о.), BssHII (6672 п.о.), Eco47III (11269 п.о.), EcoRI (10929 п.о.), EcoRV (11863 п.о.), FseI (1455 п.о.), NotI (4812 п.о.), RsrII (6790 п.о.), SbfI (2330 п.о.), SfiI (6027 п.о.), Tth111I (6390 п.о.), XcmI (2404 п.о.).
2. Линия клеток Mesocricetus auratus BHK 21 к.13 (2Н7) - продуцент рекомбинантного фактора VII свертываемости крови человека, полученная путем трансформации линии клеток Mesocricetus auratus BHK 21 к.13 рекомбинантной плазмидной ДНК рАР271 по п.1.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА ФАКТОРА VII ЧЕЛОВЕКА, ЛИНИЯ КЛЕТОК ВНК/F7, ТРАНСФОРМИРОВАННАЯ ПЛАЗМИДНОЙ ДНК | 2006 |
|
RU2337965C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКА, ОБЛАДАЮЩЕГО ОПОСРЕДОВАННОЙ ФАКТОРОМ VII АКТИВНОСТЬЮ В СВЕРТЫВАНИИ КРОВИ | 1986 |
|
RU2122583C1 |
| US 6329176 B1, 11.12.2001 | |||
| US 5580560 A, 03.12.1996. | |||
Авторы
Даты
2012-04-20—Публикация
2010-11-11—Подача