Родственные заявки
Данная заявка испрашивает приоритет предварительной заявки США № 61/021282, поданной 15 января 2008, и предварительной заявки США № 61/104546, поданной 10 октября 2008, содержание которых включено в данное описание ссылкой во всей полноте.
Уровень техники изобретения
Стабильную продукцию белков, включающую получение биопрепаратов, можно осуществлять путем трансфекции клеток-хозяев векторами, которые содержат ДНК, кодирующую белок. Сохранение вектора в клеточной линии можно обеспечить с помощью ряда способов, включающих экстрахромосомальную репликацию с использованием эписомальных ориджинов репликации. Эписомальные векторы содержат ориджин репликации, который инициирует репликацию вектора после связывания последовательности с фактором инициации репликации. Эписомальные векторы имеют несколько преимуществ по сравнению с векторами, которые требуют внедрения в геном хозяина. Например, использование эписомальных векторов позволяет уменьшить фенотипические изменения, возникающие в результате интеграции вектора в геном хозяина. Кроме того, эписомальные векторы можно выделить из трансфицированных клеток с помощью стандартных методов экстракции ДНК.
По мере развития значимости терапевтических белков, т.е. биопрепаратов, нужно предпринимать усилия по оптимизации продукции белков при увеличении общей эффективности процесса продукции. Так, повышение эффективности необходимо соизмерять с производительностью вектора в отношении продукции белка. Существует потребность в усовершенствованных системах экспрессии, которые обеспечивают условия эффективного клонирования, а также высокие уровни целевого белкового продукта. Предпочтительно уменьшить число стадий клонирования в процессе продукции биопрепаратов, в особенности антител, поскольку это позволяет уменьшить затраты времени и минимизировать стоимость. Также предпочтительно использовать векторы, которые обеспечивают удовлетворительную продукцию белка как в мелкомасштабных, так и в крупномасштабных клеточных культурах. Настоящее изобретение направлено на преодоление недостатков, связанных с применением традиционных векторов, путем использования дополнительных преимуществ, которые станут ясны из приведенного ниже подробного описания.
Сущность изобретения
Рекомбинантные белки можно получить путем транзиторной трансфекции клеток млекопитающих, в частности, в процессе разработки фармацевтических средств. Для экспрессии белков можно использовать ряд клеток-хозяев, включая клетки млекопитающих, такие как клетки COS и эмбриональные клетки почек человека (HEK). Активность эписомальных векторов обусловлена присутствием ориджина репликации и действующего извне фактора инициации репликации, который связывается с ориджином репликации. Факторы инициации репликации, такие как ядерный антиген вируса Эпштейна-Барр (EBNA), который связывается с OriP вируса Эпштейна-Барр, можно клонировать в эписомальном векторе или, альтернативно, можно экспрессировать в клетке-хозяине, трансфицированной таким вектором. Таким образом, эписомальные векторы могут быть специфичными для некоторых клеточных линий, которые экспрессируют действующий извне фактор, необходимый для активации репликации через ориджин репликации.
Настоящее изобретение устраняет потребность в разных скелетах эписомальных векторов, используемых для экспрессии рекомбинантных белков. Настоящее изобретение предлагает эписомальные векторы, содержащие, по меньшей мере, два разных эписомальных ориджина репликации, которые позволяют использовать один и тот же вектор для экспрессии белка в разных типах клеток. Разные ориджины репликации позволяют использовать вектор в разных типах клеток млекопитающих, которые предоставляют необходимые действующие извне факторы репликации и обеспечивают репликацию вектора. Путем устранения потребности повторного клонирования представляющих интерес генов при получении белка настоящее изобретение повышает эффективность и уменьшает стоимость путем снижения числа векторов, сохраняя при этом прежний уровень продукции белка. Неожиданный аспект данного изобретения заключается в том, что добавление нуклеотидов к вектору, т.е. второго ориджина репликации, не оказывает негативного влияния на способность вектора продуцировать белок на желательном уровне.
В предпочтительном варианте осуществления векторы данного изобретения содержат константные участки тяжелой или легкой цепи. Следовательно, вариабельный участок тяжелой или легкой цепи можно клонировать в векторе выше константного участка тяжелой или легкой цепи, соответственно, дополнительно улучшая эффективность системы экспрессии. Эписомальные векторы обеспечивают высокоэффективную продукцию белка в клетках млекопитающих, экспрессирующих SV40 T Ag или ядерный антиген вируса Эпштейна-Барр (например, в клетках COS7 или HEK293-6E).
Настоящее изобретение предлагает сочетание элементов, оптимальное для получения высокого выхода белка, высокой эффективности продуцирования и пониженной стоимости, причем указанные элементы играют важную роль в производстве белка, особенно в фармацевтической промышленности и при получении биологических белков, таких как антитела. Другие признаки и преимущества данного изобретения описаны в подробном описании и формуле изобретения, приведенных ниже.
В одном аспекте изобретение предлагает вектор экспрессии, содержащий: a) ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV); (b) ориджин репликации SV40; (c) участок инсерции для вставки представляющего интерес гена; и (d) нуклеотидную последовательность, кодирующую константный участок тяжелой или легкой цепи антитела, функционально связанный с участком инсерции. В одном варианте осуществления представляющий интерес ген кодирует вариабельный участок тяжелой или легкой цепи антитела, например, вариабельный участок тяжелой или легкой цепи мышиного, гуманизированного, химерного или человеческого антитела. В конкретном варианте осуществления вариабельный участок тяжелой цепи антитела представляет собой вариабельный участок тяжелой цепи антитела, выбранного из группы, состоящей из адалимумаба ABT-325 и ABT-874. В другом конкретном варианте осуществления вариабельный участок легкой цепи антитела представляет собой вариабельный участок легкой цепи антитела, выбранного из группы, состоящей из адалимумаба, ABT-325 и ABT-874. Константный участок тяжелой цепи может быть получен, например, из мышиного, гуманизированного, химерного или человеческого антитела, и может представлять собой константный участок тяжелой цепи антитела, выбранный из группы, состоящей из гамма 1, z, a; гамма 1, z, non-a; гамма 2, n+; гамма 2, n-; и гамма 4. Константный участок тяжелой цепи антитела гамма 1, z, non-a может дополнительно содержать аланиновую мутацию в положении 234 константного участка тяжелой цепи. В другом варианте осуществления константный участок тяжелой цепи антитела гамма 1, z, non-a может дополнительно содержать аланиновую мутацию в положении 235 или 237 константного участка тяжелой цепи антитела.
В одном варианте осуществления константный участок легкой цепи антитела относится к каппа-изотипу человеческой цепи или к лямбда-изотипу человеческой цепи. В одном варианте осуществления константный участок тяжелой цепи антитела относится к гамма 1 изотипу мышиной цепи или к гамма 2a изотипу мышиной цепи. В другом варианте осуществления константный участок легкой цепи антитела относится к каппа-изотипу мышиной цепи. В одном варианте осуществления константный участок тяжелой цепи антитела представляет собой домен Fc. В одном варианте осуществления вариабельный участок тяжелой или легкой цепи антитела находится в 5'-направлении по отношению к участку инсерции.
В одном варианте осуществления вектор экспрессии дополнительно содержит промотор, функционально связанный с участком инсерции, где промотор представляет собой либо промотор EF-1α, либо промотор цитомегаловируса (CMV).
В одном варианте осуществления вектор экспрессии дополнительно содержит селектируемый маркер, такой как ген устойчивости к ампициллину.
В одном варианте осуществления промотор CMV содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 1-608 последовательности SEQ ID NO:1. В конкретном варианте осуществления промотор CMV содержит нуклеотиды 1-608 последовательности SEQ ID NO:1.
В одном варианте осуществления промотор EF-1α является человеческим. В одном варианте осуществления промотор EF-1α содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 76-1267 последовательности SEQ ID NO:2. В конкретном варианте осуществления промотор EF-1α содержит нуклеотиды 76-1267 последовательности SEQ ID NO:2.
В одном варианте осуществления ориджин репликации OriP содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 1795-3545 последовательности SEQ ID NO:1.
В одном варианте осуществления ориджин репликации SV40 содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична нуклеотидам 5834-6140 последовательности SEQ ID NO:1. В конкретном варианте осуществления ориджин репликации SV40 содержит нуклеотиды 5834-6140 последовательности SEQ ID NO:1.
Типичный вектор экспрессии данного изобретения содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32. В конкретных вариантах осуществления вектор экспрессии содержит нуклеотидную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32.
Векторы экспрессии данного изобретения также приведены на фиг.1, 2 и 14-25. Другие векторы данного изобретения изображены на фиг.8-13.
В другом аспекте изобретение предлагает клетку-хозяина млекопитающего, содержащую вектор данного изобретения. В качестве клетки-хозяина млекопитающего можно использовать клетку COS, такую как клетка COS 7, или эмбриональную клетку человеческой почки (HEK), такую как клетка HEK-293.
В другом аспекте изобретение предлагает набор, содержащий вектор данного изобретения.
В другом аспекте изобретение предлагает способ получения рекомбинантного белка, включающий введение вектора экспрессии данного изобретения в клетку-хозяина млекопитающего, культивирование клетки-хозяина млекопитающего в подходящих условиях, обеспечивающих экспрессию белка, и выделение белка.
В другом аспекте изобретение предлагает вектор экспрессии, содержащий нуклеотидную последовательность, кодирующую сигнальный пептид. В одном варианте осуществления представляющий интерес ген функционально связан с нуклеиновой кислотой, кодирующей сигнальный пептид.
Краткое описание фигур
Вышеописанные и другие цели, признаки и преимущества настоящего изобретения, а также само изобретение, разъясняются более полно в нижеследующем подробном описании предпочтительных вариантов осуществления в сочетании с прилагаемыми фигурами, на которых:
На фиг.1 изображена карта пустого вектора pHyb-C. Элементы вектора включают эукариотический ориджин репликации SV40, эукариотический экспрессионный промотор цитомегаловируса (pCMV), трехчленную лидерную последовательность (TPL), донорный участок сплайсинга (SD), основной поздний энхансер аденовируса (enh MLP), акцепторный участок сплайсинга (SA), участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли-A (pA), элемент симметрии второго порядка (DS), эукариотический ориджин репликации вируса Эпштейна-Барр (OriP), участок дупликации (FR), маркер устойчивости к ампициллину (AmpR) и бактериальный ориджин репликации (pMB1ori).
На фиг.2 изображена карта пустого вектора pHyb-E. Элементы вектора включают эукариотический ориджин репликации SV40, эукариотический промотор EF-1a, участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли A (pA), элемент симметрии второго порядка (DS), эукариотический ориджин репликации вируса Эпштейна-Барр (OriP), участок дупликации (FR), маркер устойчивости к ампициллину (AmpR) и бактериальный ориджин репликации (pMB1ori).
На фиг.3 показаны титры рекомбинантного гибридного белка Fc, продуцируемого клетками COS, трансфицированными векторами pBOS, pTT3, pHybC и pHybE с использованием метода электропорации.
На фиг.4 показаны титры рекомбинантного гибридного белка Fc, продуцируемого клетками HEK-293-6E, трансфицированными векторами pBOS, pTT3, pHybC и pHybE с использованием метода PEI.
На фиг.5 показаны титры антитела, продуцируемого HEK-293-6E, трансфицированными с использованием метода PEI векторами pBOS, pTT3, pHybC и pHybE, обеспечивающими экспрессию антитела IgG.
На фиг.6 показаны титры антитела, продуцируемого клетками COS, трансфицированными с использованием метода электропорации векторами pBOS, pTT3, pHybC и pHybE, обеспечивающими экспрессию антитела IgG.
На фиг.7 показаны титры антитела, продуцируемого клетками COS, трансфицированными с использованием метода электропорации векторами pHyb-E-SwaI (v1) или pHyb-E (v2), обеспечивающими экспрессию антитела IgG.
На фиг.8 изображена карта вектора pHybC-mBR3-mCg2a (также обозначаемого "pHybC-mBR3-Fc").
На фиг.9 изображена карта вектора pHybE-mBR3-mCg2a (также обозначаемого "pHybE-mBR3-Fc").
На фиг.10 изображена карта вектора pHybC-E7-hCk (также обозначаемого "pHybC-E7").
На фиг.11 изображена карта вектора pHybC-D2-hCg1,z,a (также обозначаемого "pHybC-D2").
На фиг.12 изображена карта вектора pHybE-D2-hCg1,z,a (также обозначаемого "pHybE-D2").
На фиг.13 изображена карта вектора pHybE-E7-hCk (также обозначаемого "pHybE-E7").
На фиг.14 изображена карта pHybE-hCg1,z,a V2 (также обозначаемого "pJP182").
На фиг.15 изображена карта pHybE-hCgl,z,non-a V2 (также обозначаемого "pJP183").
На фиг.16 изображена карта pHybE-hCg1,z,non-a,mut(234,235) V2 (также обозначаемого "pJP184").
На фиг.17 изображена карта pHybE-hCg1,z,non-a,mut (234,237) V2 (также обозначаемого "pJP185").
На фиг.18 изображена карта pHybE-hCg2,n+ V2 (также обозначаемого "pJP186").
На фиг.19 изображена карта pHybE-hCg2,n- V2 (также обозначаемого "pJP187").
На фиг.20 изображена карта pHybE-hCg4 V2 (также обозначаемого "pJP188").
На фиг.21 изображена карта pHybE-mCg1 V2 (также обозначаемого "pJP189").
На фиг.22 изображена карта pHybE-mCg2a V2 (также обозначаемого "pJP190").
На фиг.23 изображена карта pHybE-hCk V2 (также обозначаемого "pJP191").
На фиг.24 изображена карта pHybE-hCl V2 (также обозначаемого "pJP192").
На фиг.25 изображена карта pHybE-mCk V2 (также обозначаемого "pJP193").
Подробное описание изобретения
I. Определения
Чтобы облегчить понимание данного изобретения, в настоящем описании вначале приводятся определения некоторых терминов.
Термин "нуклеиновая кислота" или "молекула нуклеиновой кислоты", используемый в данном описании, обозначает ДНК, РНК, мРНК, кДНК, геномную ДНК и их аналоги. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК. Нуклеиновая кислота может быть выделенной или интегрированной в другую молекулу нуклеиновой кислоты, такую как вектор экспрессии или хромосома эукариотической клетки-хозяина.
"Выделенная" молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновых кислот, присутствующих в природном источнике нуклеиновой кислоты. Например, в отношении геномной ДНК термин "выделенная" включает молекулы нуклеиновых кислот, отделенные от хромосомы, с которой геномная ДНК связана в природе. Предпочтительно, "выделенная" нуклеиновая кислота не содержит последовательностей, которые в природе фланкируют нуклеиновую кислоту (т.е. примыкают к 5'- и 3'-концам нуклеиновой кислоты) в геномной ДНК организма, из которого получена нуклеиновая кислота. Более того, "выделенная" молекула нуклеиновой кислоты, такая как молекула кДНК, по существу не содержит другого клеточного вещества или культуральной среды в случае получения рекомбинантными методами, по существу не содержит химических предшественников или других химических веществ в случае получения химическим синтезом.
Термины "рекомбинантный вектор" или "вектор" в данном описании используются как взаимозаменяемые и относятся к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов векторов является "плазмида", которая представляет собой циклическую двуспиральную петлю ДНК, в которую могут быть лигированы другие сегменты ДНК. Альтернативно, вектор может быть линейным. Другим типом векторов является вирусный вектор, позволяющий лигировать другие сегменты ДНК в вирусный геном. Некоторые векторы могут автономно реплицироваться в клетке-хозяине, в которую они введены (например, бактериальные векторы, содержащие бактериальный ориджин репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина и, следовательно, реплицироваться вместе с геномом хозяина. В предпочтительном варианте осуществления векторы данного изобретения представляют собой эписомальные векторы млекопитающих. Термин "конструкция" в данном описании также относится к вектору.
Некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. "Вектор экспрессии" или "рекомбинантный вектор экспрессии" представляет собой молекулу нуклеиновой кислоты, которая кодирует ген, экспрессирующийся в клетке-хозяине, и, кроме того, содержит элементы, необходимые для управления экспрессией гена. Как правило, вектор экспрессии содержит промотор транскрипции, представляющий интерес ген и терминатор транскрипции. Экспрессия гена обычно находится под контролем промотора, и в таком случае говорят, что ген "функционально связан" с промотором. Подобным образом, регуляторный элемент и основной промотор называют функционально связанными, если регуляторный элемент модулирует активность основного промотора. В одном варианте осуществления вектор экспрессии данного изобретения содержит несколько ориджинов репликации, что позволяет не ограничивать применение вектора одним типом клеток.
Используемый в данном описании термин «эписомально реплицирующийся вектор» или "эписомальный вектор" относится к вектору, который обычно и предпочтительно не интегрируется в геном клетки-хозяина, а существует параллельно. Эписомально реплицирующийся вектор, в соответствии с настоящим описанием, реплицируется в процессе клеточного цикла, и копии вектора, образующиеся в результате данной репликации, распределяются в новых клетках статистически, в зависимости от числа копий, присутствующих до и после деления клетки. Предпочтительно, эписомально реплицирующийся вектор находится в ядре клетки-хозяина и предпочтительно реплицируется в течение S-фазы клеточного цикла. Кроме того, эписомально реплицирующийся вектор реплицируется, по меньшей мере, один раз, т.е. один или несколько раз, в ядре клетки-хозяина в течение S-фазы клеточного цикла. В более предпочтительном варианте осуществления эписомально реплицирующийся вектор реплицируется один раз в ядре клетки-хозяина в течение S-фазы клеточного цикла.
В данном описании термины "последовательности ориджина репликации" или "ориджин репликации" используют как взаимозаменяемые для обозначения последовательностей, которые, в случае присутствия в векторе, инициируют репликацию. Ориджин репликации может распознаваться фактором инициации репликации или, альтернативно, ДНК-геликазой.
Используемый в данном описании термин "рекомбинация" относится к процессу, в результате которого вещество нуклеиновой кислоты, например ДНК, распределяется между двумя молекулами нуклеиновых кислот, например, в микроорганизме. Используемый в данном описании термин "гомологичная рекомбинация" относится к процессу, в результате которого вещество нуклеиновой кислоты распределяется между двумя молекулами нуклеиновых кислот через участки или сегменты гомологии последовательностей или, предпочтительно, идентичности последовательностей (например, имеющих высокую степень идентичности последовательностей). В иллюстративных вариантах осуществления вещество нуклеиновой кислоты находится на хромосоме или эписоме микроорганизма. В других иллюстративных вариантах осуществления вещество нуклеиновой кислоты находится вне хромосомы, например, на плазмиде. Рекомбинация может происходить между линейными и/или циклическими молекулами ДНК.
Используемый в данном описании термин "представляющий интерес ген" относится к экзогенной последовательности ДНК, которую добавляют в вектор данного изобретения. Представляющий интерес ген, например, может содержать кодирующую последовательность, которая может быть или отделена интронами, или которая может представлять собой кДНК, кодирующую открытую рамку считывания. Термин "представляющий интерес ген", используемый в данном описании, относится к последовательности ДНК, которую добавляют в вектор данного изобретения для конечной экспрессии белка. Участок вектора, в котором клонирован представляющий интерес ген, в данном описании называют "участком инсерции". Предпочтительно, представляющий интерес ген содержит последовательность, кодирующую фрагмент антитела или гибридного белка, который экспрессируют с использованием вектора данного изобретения. Например, последовательность, кодирующую вариабельный участок тяжелой цепи антитела адалимумаб, т.е. представляющий интерес ген, клонируют в векторе данного изобретения, который содержит константный участок тяжелой цепи.
В одном варианте осуществления данного изобретения вектор содержит последовательность, кодирующую константный участок легкой или тяжелой цепи антитела, которая находится в 3'-направлении по отношению к участку инсерции представляющего интерес гена и функционально связана с ним. Так, в одном варианте осуществления представляющий интерес ген кодирует вариабельный участок легкой или тяжелой цепи антитела и функционально связан с последовательностью, кодирующей константный участок легкой или тяжелой цепи антитела, которая входит в состав вектора данного изобретения.
Нуклеотидная последовательность считается "функционально связанной" с другой нуклеотидной последовательностью, если она находится в функциональной зависимости от нее. Например, ДНК, кодирующая сигнальный пептид, функционально связана с ДНК, кодирующей белок или полипептид, если в процессе экспрессии последовательности кодируют сигнальный пептид в одной рамке считывания с белком или полипептидом. Подобным образом, промотор или энхансер функционально связан с нуклеотидной последовательностью, кодирующей белок или полипептид, если экспрессия белка или полипептида регулируется указанным промотором или энхансером. В одном варианте осуществления функционально связанные нуклеотидные последовательности примыкают друг к другу (например, в случае сигнальных последовательностей). Альтернативно, функционально связанные нуклеотидные последовательности могут не примыкать друг к другу (например, в случае энхансеров). В одном варианте осуществления нуклеотидная последовательность, кодирующая константный участок легкой или тяжелой цепи антитела, функционально связана с представляющим интерес геном, например, кодирующим вариабельный участок тяжелой или легкой цепи.
Термин "промотор" включает любые нуклеотидные последовательности, достаточные для управления транскрипцией в эукариотической клетке, в том числе индуцируемые промоторы, репрессируемые промоторы и конститутивные промоторы. Как правило, промотор включает элементы, достаточные для обеспечения контроля за экспрессией управляемого промотором гена в клеточно-специфичной, ткане-специфичной или время-зависимой манере, или для индуцирования под действием внешних сигналов или факторов. Такие элементы могут находиться на 5'- или 3'-концах, или в участках последовательности интрона конкретного гена. Обычно используют конститутивную экспрессию гена, хотя при необходимости в настоящем изобретении можно использовать регулируемые промоторы. Экспрессию гена также можно контролировать путем регуляции транскрипции под действием тепла, света или металлов, например, используя гены металлотионина или гены белка теплового шока.
Термины "выше по ходу считывания" и "ниже по ходу считывания" относятся к относительному расположению двух элементов, присутствующих в нуклеотидной последовательности или векторе. Элемент, который находится "выше по ходу считывания", чем другой, расположен ближе к 5'-концу последовательности (т.е. ближе к концу молекулы, который содержит фосфатную группу, присоединенную к 5'-атому углерода рибозного или дезоксирибозного скелета, если молекула является линейной), чем другой элемент. Говорят, что элемент находится "ниже по ходу считывания", если он расположен ближе к 3'-концу последовательности (т.е. ближе к концу молекулы, который содержит гидроксильную группу, присоединенную к 3'-атому углерода рибозного или дезоксирибозного скелета линейной молекулы), чем другой элемент.
В данном описании термин "лишняя последовательность" относится к нуклеотидной последовательности, предпочтительно содержащейся в векторе, которая фланкируется участками ферментативной рестрикции по 5'- и 3'-концам. Лишняя последовательность находится в векторе в участке инсерции нуклеиновой кислоты, кодирующей представляющий интерес ген. В процессе клонирования лишнюю последовательность вырезают из вектора с использованием подходящих ферментов рестрикции, после чего в вектор на место лишней последовательности лигируют или вставляют посредством гомологичной рекомбинации нуклеиновую кислоту, кодирующую представляющий интерес ген. Предпочтительно, лишняя последовательность является достаточно большой, чтобы обеспечить достаточное расстояние между 5'- и 3'-участками ферментативной рестрикции, позволяющее ферментам рестрикции эффективно разрезать вектор. Кроме того, длина лишней последовательности предпочтительно отличается от длины нуклеиновой кислоты, кодирующей представляющий интерес ген, например, лишнюю последовательность, длина которой составляет примерно 300 пар оснований или менее, или примерно 400 пар оснований или более, можно использовать для вставки нуклеиновой кислоты, кодирующей представляющий интерес ген, длина которой составляет примерно 350 пар оснований. В другом варианте осуществления размер лишней последовательности составляет примерно 1 т.о.
Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") в данном описании используется для обозначения клетки, в которую введен рекомбинантный вектор экспрессии. Следует понимать, что такие термины предназначены для обозначения не только конкретной исследуемой клетки, но и к потомству такой клетки. Поскольку в последующих поколениях могут происходить некоторые изменения вследствие мутаций или воздействий окружающей среды, такое потомство в действительности может быть не идентичным родительской клетке, однако оно еще входит в объем термина "клетка-хозяин", используемого в данном описании.
Термин "антитело" в соответствии с данным описанием включает целые антитела, а также любые их антиген-связывающие (т.е. "антиген-связывающий фрагмент") или одноцепочечные фрагменты. "Антитело" представляет собой гликопротеин, содержащий, по меньшей мере, две тяжелые (H) цепи и две легкие (L) цепи, соединенные дисульфидными связями, или его антиген-связывающий фрагмент. Каждая тяжелая цепь состоит из вариабельного участка тяжелой цепи (обозначаемого в данном описании VH) и константного участка тяжелой цепи. Константный участок тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельного участка легкой цепи (обозначаемого в данном описании VL) и константного участка легкой цепи. Константный участок легкой цепи состоит из одного домена, CL. Участки VH и VL можно дополнительно подразделить на участки гипервариабельности, называемые участками, определяющими комплементарность (CDR), которые перемежаются более консервативными участками, которые называются каркасными участками (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных, начиная от амино-конца к карбокси-концу, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные участки тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Сочетание из шести CDR VH и VL образует антиген-связывающий участок. Если антитело состоит из двух H-цепей и двух L-цепей, то оно может содержать два одинаковых антиген-связывающих участка, два разных антиген-связывающих участка, которые связывают один и тот же антиген, или два антиген-связывающих участка, которые связывают разные антигены. Константные участки антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включающими разные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Термин "антиген-связывающий фрагмент" антитела (или просто "фрагмент антитела") в данном описании относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связывать антиген (например, IL-1α, IL-1β). Антиген-связывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, входящих в объем термина "антиген-связывающий фрагмент" антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирном участке; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb (Ward et al, (1989) Nature 341:544-546), который состоит из домена VH или VL; и (vi) выделенный гипервариабельный участок (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются разными генами, их можно объединить рекомбинантными методами с использованием синтетического линкера, который позволяет получить одноцепочечный белок, в котором участки VL и VH соединены с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также входят в объем термина "антиген-связывающий фрагмент" антитела. Указанные фрагменты антител, полученные традиционными методами, известными специалистам в данной области, подвергают скринингу на эффективность таким же способом, как и интактные антитела. В одном варианте осуществления данного изобретения фрагмент антитела выбирают из группы, состоящей из Fab, Fd, Fd', одноцепочечного Fv (scFv), scFva и доменного антитела (dAb).
Кроме того, антитело или его антиген-связывающий фрагмент могут быть частью более крупных молекул иммуноадгезии, образованных в результате ковалентной или нековалентной ассоциации антитела или фрагмента антитела с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают тетрамерные молекулы scFv, полученные с использованием стрептавидинового центрального участка (Kipriyanov et al. (1995) Human Antibodies and Hybridomas 6:93-101), и бивалентные и биотинилированные молекулы scFv, полученные с использованием цистеинового остатка, маркерного пептида и C-концевого полигистидинового маркера (Kipriyanov et al. (1994) Mol. Immunol. 31:1047-1058). Фрагменты антител, такие как фрагменты Fc, Fab и F(ab')2, можно получить из целых антител с помощью традиционных методов, таких как расщепление папаином или пепсином, соответственно. Кроме того, антитела, фрагменты антител и молекулы иммуноадгезии можно получить с помощью стандартных методов рекомбинантных ДНК.
Термин "домен" относится к уложенной структуре белка, которая сохраняет третичную структуру независимо от остальной части белка. Как правило, домены отвечают за отдельные функциональные свойства белков и зачастую могут быть добавлены, удалены или перенесены на другие белки без потери функции остальной части белка и/или домена. Под отдельным вариабельным доменом антитела подразумевается уложенный полипептидный домен, содержащий последовательности, типичные для вариабельных доменов антител. Следовательно, он включает вариабельные домены целых антител и модифицированные вариабельные домены, например, в которых одна или несколько петель заменены последовательностями, которые не являются типичными для вариабельных доменов антител, или вариабельные домены антител, которые были укорочены, или которые содержат N- или C-концевые добавления, а также уложенные фрагменты вариабельных доменов, которые сохраняют, по меньшей мере, отчасти, связывающую активность и специфичность полноразмерного домена.
Вариабельные домены данного изобретения могут быть объединены с получением группы доменов; например, могут быть объединены комплементарные домены, такие как домены VL и домены VH. Также могут быть объединены не комплементарные домены, например, домен VH и второй домен VH. Домены можно объединить с помощью ряда способов, включающих соединение доменов ковалентными или нековалентными связями.
Термин "dAb" или "доменное антитело" относится к полипептиду, представляющему собой один вариабельный домен антитела (VH или VL), который специфически связывает антиген. В одном варианте осуществления вектор данного изобретения используют для экспрессии dAb.
Фраза "рекомбинантное антитело" относится к антителам, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных способов, таким как антитела, экспрессированные с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител, антитела, выделенные у животного (например, мыши), которое является трансгенным, поскольку несет гены человеческих иммуноглобулинов (см., например, Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), или к антителам, которые получают, экспрессируют, создают или выделяют с помощью любых других способов, включающих соединение последовательности гена конкретного иммуноглобулина (например, последовательность гена человеческого иммуноглобулина) с другими последовательностями ДНК. Примеры рекомбинантных антител включают химерные, CDR-привитые и гуманизированные антитела.
Термин "человеческое антитело" относится к антителам, содержащим вариабельные и константные участки, соответствующие последовательностям человеческого эмбрионального иммуноглобулина, как описано, например, Kabat et al. (см. Kabat, et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242), или полученные из них. Однако человеческие антитела данного изобретения могут содержать аминокислотные остатки, которые не кодируются последовательностями человеческого эмбрионального иммуноглобулина (например, мутантные остатки, введенные путем неспецифического или специфического мутагенеза in vitro или путем соматической мутации in vivo), например, в CDR, в частности, в CDR3.
Рекомбинантные человеческие антитела данного изобретения содержат вариабельные участки и, возможно, константные участки, полученные из последовательностей человеческого эмбрионального иммуноглобулина (см. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication № 91-3242). Однако в некоторых вариантах осуществления такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, если используют животное, трансгенное по последовательностям человеческого Ig, соматическому мутагенезу in vivo) с получением аминокислотных последовательностей участков VH и VL рекомбинантных антител, которые, хотя и получены из человеческих эмбриональных последовательностей VH и VL и являются родственными им, могут отсутствовать в природном наборе человеческих эмбриональных антител in vivo. Однако в некоторых вариантах осуществления такие рекомбинантные антитела образуются в результате селективного мутагенеза или обратной мутации, или и того, и другого.
Термин "обратная мутация" относится к процессу, в котором некоторые или все аминокислоты, введенные в человеческое антитело в результате соматической мутации, заменяются на соответствующие остатки из гомологичной последовательности эмбрионального антитела. Последовательности тяжелых и легких цепей человеческого антитела данного изобретения сравнивают по отдельности с эмбриональными последовательностями из базы данных VBASE и выявляют последовательности с наивысшей степенью гомологии. Различия между человеческим антителом данного изобретения и эмбриональной последовательностью устраняют путем мутаций нуклеотидов в определенных положениях, которые кодируют аминокислоты, обуславливающие такие различия. Затем каждую аминокислоту, идентифицированную таким образом как кандидат для обратной мутации, исследуют, чтобы определить, принимает ли она непосредственное или косвенное участие в связывании антигена, и аминокислоты, которые после мутации оказывают влияние на какие-либо желательные характеристики человеческого антитела, не включают в состав конечного человеческого антитела. Чтобы минимизировать число аминокислот, подлежащих обратной мутации, можно оставить аминокислоты, которые отличаются от аминокислот в соответствующих положениях ближайшей эмбриональной последовательности, но идентичны соответствующим аминокислотам второй эмбриональной последовательности, при условии, что вторая эмбриональная последовательность идентична и коллинеарна последовательности человеческого антитела данного изобретения, по меньшей мере, на 10, предпочтительно, на 12 аминокислот, с обеих сторон исследуемой аминокислоты. Обратные мутации можно осуществлять на любой стадии оптимизации антитела.
Термин "химерное антитело" относится к антителам, которые содержат последовательности вариабельных участков тяжелых и легких цепей антитела, полученные от одного вида, а последовательности константных участков от другого вида, таким как антитела, содержащие мышиные вариабельные участки тяжелых и легких цепей, соединенные с человеческими константными участками.
Термин "CDR-привитое антитело" относится к антителам, которые содержат последовательности вариабельных участков тяжелой и легкой цепи из одного вида, но в которых последовательности одного или нескольких участков CDR VH и/или VL заменены на последовательности CDR из других видов, таким как антитела, содержащие вариабельные участки мышиных тяжелых и легких цепей, в которых один или несколько мышиных CDR (например, CDR3) заменены на человеческие последовательности CDR.
Термин "гуманизированное антитело" относится к антителам, которые содержат последовательности вариабельных участков тяжелой и легкой цепи из отличного от человека вида (например, мыши), но в которых, по меньшей мере, часть последовательности VH и/или VL изменена так, чтобы быть в большей степени подобной человеческой последовательности, т.е. более подобной человеческой эмбриональной вариабельной последовательности. Одним из типов гуманизированного антитела является CDR-привитое антитело, в котором человеческие последовательности CDR введены в нечеловеческие последовательности VH и VL вместо соответствующих нечеловеческих последовательностей CDR.
В данном описании термины "соединенный", "гибридизованный" или "гибрид" используются как взаимозаменяемые. Указанные термины относятся к соединению двух или более элементов или компонентов с помощью любых способов, включающих химическую конъюгацию или рекомбинантные методы. Термины "гибридизация в рамке считывания" или "функционально связанный" относятся к соединению двух или более открытых рамок считывания (ORF) с получением сплошной более длинной ORF так, чтобы сохранить правильную рамку считывания из исходных ORF. Таким образом, полученный рекомбинантный гибридный белок представляет собой один белок, который содержит два или более сегментов, соответствующих полипептидам, кодируемым исходными ORF (указанные сегменты в природе обычно не соединены). Хотя полученная таким образом рамка считывания является непрерывной на протяжении гибридизованных сегментов, указанные сегменты можно разделить физически или пространственно, например, с использованием содержащейся в рамке считывания линкерной последовательности.
В данном описании термин "участок Fc" включает аминокислотные последовательности, полученные из константного участка тяжелой цепи антитела. В некоторых вариантах осуществления участок Fc включает полипептид, содержащий константный участок антитела за исключением первого домена константного участка иммуноглобулина.
Участок Fc может представлять собой функционально эквивалентный аналог участка Fc. Функционально эквивалентный аналог участка Fc может представлять собой вариант участка Fc, содержащий одну или несколько аминокислотных модификаций по сравнению с участком Fc дикого типа или природным участком Fc. В некоторых воплощениях вариант участка Fc, по меньшей мере, на 50% гомологичен природному участку Fc, предпочтительно, на 80%-99%, в том числе, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98% или, по меньшей мере, примерно на 99%. Функционально эквивалентные аналоги участка Fc могут содержать один или несколько аминокислотных остатков, добавленных или удаленных на N- или C-конце белка, предпочтительно, не более 30, наиболее предпочтительно, не более 10. Функционально эквивалентные аналоги участка Fc включают участки Fc, функционально связанные с партнером по гибридизации.
Используемые в данном описании термины "гибрид Fc" или "гибридный белок Fc" включают белок, в котором один или несколько белков, полипептидов или малых молекул функционально связаны с участком Fc или его производным. Термин "гибрид Fc" в данном описании используется как синоним таких терминов, как "гибрид Ig", "химера Ig" и "рецепторный глобулин" (иногда с тире), используемых в известном уровне техники (Chamow et al, 1996, Trends Biotechnol. 14:52-60; Ashkenazi et al, 1997, Curr Opin. Immunol. 9:195-200). Гибрид Fc содержит один или несколько участков Fc иммуноглобулина или их вариантов, и партнер по гибридизации, который, как правило, представляет собой любой белок, полипептид, пептид или малую молекулу. В некоторых вариантах осуществления отличная от Fc часть гибрида Fc, т.е. партнер по гибридизации, может служить для опосредования связывания мишени, и, следовательно, он может быть функционально аналогичен вариабельным участкам антитела.
В настоящем изобретении для ковалентного соединения полипептидов Fc с партнером по гибридизации или конъюгации, или для получения гибрида Fc, можно использовать ряд линкеров. В данном описании термины "линкер", "линкерная последовательность", "спейсер", "связывающая последовательность" или их эквиваленты относятся к молекуле или группе молекул (таким как мономер или полимер), которые соединяют две молекулы и могут служить для создания предпочтительной конфигурации двух молекул. Для ковалентного соединения молекул можно использовать ряд способов. Такие способы включают, без ограничения, образование полипептидных связей между N- и C-концами белков или белковых доменов, соединение посредством дисульфидных связей и соединение посредством химических перекрестносвязывающих реагентов.
II. Векторы данного изобретения
Изобретение предлагает эписомальные векторы для экспрессии белков в клетках-хозяевах млекопитающих. Векторы данного изобретения основаны на применении двух эписомальных ориджинов репликации, которые позволяют использовать вектор в любой клеточной линии, содержащей факторы инициации репликации, действующие извне на любой ориджин репликации. Хотя вектор также может содержать фактор инициации репликации, который связывает ориджин репликации, в предпочтительном варианте осуществления действующий извне фактор репликации предоставляется клеткой-хозяином. Кроме того, в одном варианте осуществления векторы данного изобретения являются эффективным средством получения антител и гибридных белков Fc, поскольку векторы содержат константные участки тяжелых или легких цепей, функционально связанные с представляющим интерес геном. Примеры векторов данного изобретения приведены на фиг.1, 2 и 8-25. Кроме того, последовательности типичных векторов представлены в SEQ ID NO:1-32. На фиг.1 и 2 (соответственно SEQ ID NO:1 и 2) показан "открытый" вектор, т.e. вектор данного изобретения, который не содержит константные участки тяжелых или легких цепей и представляющий интерес ген. На фиг.8-25 изображены карты векторов данного изобретения, которые также содержат разные мышиные или человеческие константные участки и участки клонирования представляющего интерес гена.
Вектор данного изобретения содержит, по меньшей мере, два разных ориджина репликации, например, ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV), и ориджин репликации SV40. Ориджин репликации может быть получен из ДНК-вируса, более предпочтительно, из ДНК-вируса, способного к эписомальной репликации, и включает ориджины репликации, полученные, например, из вируса Эпштейна-Барр, вируса простого герпеса, вируса герпеса Saimiri, мышиного Gammaherpesvirus 68, человеческого цитомегаловируса, мышиного цитомегаловируса, вируса псевдобешенства, вируса обезьян 40, вируса полиомы, человеческого вируса BK, вируса папилломы крупного рогатого скота и аденоассоциированного вируса.
В одном варианте осуществления используют ориджин репликации из вируса Эпштейна-Барр, например, oriP, или его функциональные фрагменты (примеры функциональных фрагментов ориджина репликации Эпштейна-Барр описаны в Aiyar et al. (1998) EMBO Journal, 17:6394). Ориджин репликации вируса Эпштейна-Барр (OriP) состоит из 2 основных элементов, нескольких цис-действующих элементов, которые обеспечивают синтез ДНК в клетке, и элемента поддержания вируса. Первый из двух основных элементов содержит семейство повторов (FR), которое содержит участки связывания EBNA (показано на фиг.1 и 2). EBNA представляет собой фактор инициации репликации, который инициирует репликацию вектора через OriP (номер доступа последовательности EBNA в Genbank V01555 (gi:94734074)). Второй элемент, входящий в состав OriP, содержит так называемый элемент симметрии второго порядка (DS), который функционирует, как элемент распознавания ориджина репликации. Как правило, элементы DS и FR разделены в пространстве несколькими парами оснований, обычно 1000 п.о. Относительную ориентацию OriP, в частности, DS и FR, можно изменить, не влияя на функцию OriP. Ориентацию OriP, в частности, DS и FR, относительно других элементов, расположенных на векторах экспрессии данного изобретения, можно изменить, не влияя на функцию OriP. В предпочтительном варианте осуществления данного изобретения, где ориджин репликации представляет собой ориджин репликации вируса Эпштейна-Барр (OriP), и где OriP содержит семейство повторов (FR) и элемент симметрии второго порядка (DS), элемент DS располагается между представляющим интерес геном и элементом FR. В одном варианте осуществления вектор данного изобретения содержит ориджин репликации OriP (вируса Эпштейна-Барр), включающий нуклеотиды 1795-3545 последовательности SEQ ID NO:1, или последовательности, идентичной ей на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%.
В другом варианте осуществления вектор содержит ориджин репликации SV40. Для инициации репликации вектора посредством ориджина репликации SV40 (вируса обезьян 40) (обозначенной, например, на фиг.1 и 2 как "SV40 Ori") требуется присутствие одного вирусного белка, большого T-антигена. Ориджин репликации SV40 можно использовать в эписомальных векторах для репликации и поддержания указанных векторов (см. Calos (1996) Trends Genetics 12:462; Harrison et al (1994) J Virol. 68:1913; Cooper et al (1997) PNAS 94:6450; и Ascenziono et al. (1997) Cancer Lett 118:135). В одном варианте осуществления вектор данного изобретения содержит ориджин репликации SV40, включающий нуклеотиды 5834-6140 последовательности SEQ ID NO:1, или последовательности, идентичной ей на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%.
Функциональные варианты описанного в данном документе ориджина репликации также входят в объем определения ориджина репликации в соответствии с настоящей заявкой.
Помимо эписомального ориджина репликации вектор данного изобретения также может содержать ориджин репликации, обеспечивающий репликацию вектора в бактериях. Пример такого ориджина, показанный на фиг.1 и 2, включает, без ограничения, pMB1 ori, который функционирует в E. coli.
Вектор данного изобретения также может содержать селектируемый маркер. Маркер селекции может облегчать клонирование и амплификацию последовательности вектора в прокариотических и эукариотических организмах. В некоторых вариантах осуществления маркер селекции придает устойчивость к соединению или классу соединений, таких как антибиотик. Примером маркера селекции, который можно использовать в сочетании с молекулами нуклеиновых кислот и системами настоящего изобретения, является маркер, придающий устойчивость к пуромицину. Альтернативно, можно использовать маркеры селекции, которые придают устойчивость к гигромицину, gpt, неомицину, зеоцину, уабаину, бластицидину, канамицину, генетицину, гентамицину, ампициллину, тетрациклину, стрептомицину, спектиномицину, налидиксовой кислоте, рифампицину, хлорамфениколу, зеоцину или блеомицину, или такие маркеры, как DHRF, hisD, trpB или глутаминсинтетаза.
В состав вектора данного изобретения также входят регуляторные элементы, необходимые для транскрипции представляющего интерес гена (а также селектируемого маркера) и трансляции их в белки. Транскрипционные регуляторные элементы обычно включают промотор, присоединенный к 5'-концу последовательности гена, подлежащей экспрессии, участки инициации и терминации транскрипции и последовательность сигнала полиаденилирования. Термин "участок инициации транскрипции" относится к нуклеиновой кислоте, соответствующей в конструкции первой нуклеиновой кислоте, включенной в первичный транскрипт, т.е. к предшественнику мРНК; участок инициации транскрипции может перекрываться с промоторными последовательностями. Термин "участок терминации транскрипции" относится к нуклеотидной последовательности, обычно присутствующей на 3'-конце представляющего интерес гена или на удлиненном участке последовательности, подлежащей транскрипции, которая заставляет РНК-полимеразу завершать транскрипцию. Сигнальная последовательность полиаденилирования, или сигнал добавления поли-A, обеспечивает расщепление по специфическому участку на 3'-конце эукариотической мРНК и посттранскрипционное добавление в ядро последовательности, содержащей примерно 100-200 остатков аденина (хвост поли-A), к расщепленному 3'-концу. Последовательность сигнала полиаденилирования включает последовательность AATAAA, расположенную примерно на 10-30 нуклеотидов выше участка расщепления, и нижележащую последовательность.
Регуляторным элементом, который может быть включен в вектор данного изобретения, является промотор. Промотор может быть конститутивным или индуцируемым. Энхансер (т.е. цис-действующий элемент ДНК, который действует на промотор, повышая транскрипцию), который функционирует в сочетании с промотором, может быть нужен для повышения уровня экспрессии по сравнению с уровнем, обеспечиваемым только промотором, и может быть включен в состав вектора в качестве регуляторного элемента. Во многих случаях полинуклеотидный сегмент, содержащий промотор, также включает энхансерные последовательности (например, CMV IE P/E; SV40 P/E; MPSV P/E). Если требуется получение сплайсированных транскриптов, то в состав вектора могут быть включены сигналы сплайсинга. Чтобы получить секретируемый полипептид, в состав селектируемой последовательности обычно вводят сигнальную последовательность, кодирующую лидерный пептид, который направляет синтезированный полипептид к мембране ER и через нее, после чего полипептид может секретироваться. Лидерный пептид часто, но не всегда, находится на амино-конце секретируемого белка и отщепляется под действием сигнальных пептидаз после пересечения белком мембраны ER. Селектируемая последовательность, как правило, но не всегда, содержит собственную сигнальную последовательность. Если нативная сигнальная последовательность отсутствует, то к селектируемой последовательности можно присоединить гетерологичную сигнальную последовательность. В данной области известно много сигнальных последовательностей, которые можно найти в базах данных по последовательностям, таких как GenBank и EMBL. Трансляционные регуляторные элементы включают участок инициации трансляции (AUG), стоп-кодон и сигнал поли-A, используемые для каждого отдельного экспрессируемого полипептида. В состав некоторых конструкций входит участок внутренней посадки рибосомы (IRES).
Промоторы, используемые в настоящем изобретении, включают вирусные промоторы, промоторы млекопитающих и дрожжевые промоторы, такие как промотор мышиного бета-глобина, промотор убиквитина, промотор полиомы, промотор цитомегаловируса млекопитающих (CMV), промотор дрожжевой алкогольоксидазы, промотор фосфоглицерокиназы, индуцируемые лактозой промоторы, промотор галактозидазы, промотор аденоассоциированного вируса, промотор поксвируса, промоторы ретровирусов, промотор вируса саркомы Рауса, промоторы аденовирусов, промотор SV40, промотор гидроксиметилглутарил-кофермента A, промотор тимидинкиназы, промоторы поксвирусов H5R, поздний промотор аденовируса типа 2MPC, промотор альфа-антитрипсина, промотор фокса IX, промотор иммуноглобулина, промотор поверхностно-активного вещества CFTR, промотор альбумина и промотор трансферрина. Промотор, выбранный для использования в сочетании с нуклеиновыми кислотами и векторами экспрессии данного изобретения, должен обеспечивать (1) высокие уровни экспрессии, например, при управлении экспрессией представляющего интерес гена, или (2) пониженные уровни экспрессии (после снижения эффективности в результате модификации), например, при управлении экспрессией гена селектируемого маркера. Предпочтительно, промотор, управляющий экспрессией представляющего интерес гена, представляет собой сильный промотор, такой как промоторы убиквитина, CMV, EF-1α и SR альфа, обеспечивающий повышение экспрессии и инициацию правильного сплайсинга целевого продукта.
В одном варианте осуществления вектор данного изобретения содержит промотор CMV для управления экспрессией представляющего интерес гена. Применение промотора CMV описано в патентах США №№ 5385839 и 5849522, включенных в данное описание путем ссылки. В одном варианте осуществления промотор CMV, используемый в векторе данного изобретения, функционально связан с представляющим интерес геном и нуклеотидами 1-608 последовательности SEQ ID NO:1. В объем данного изобретения также входят последовательности промотора CMV, которые на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичны нуклеотидам 1-608 последовательности SEQ ID NO:1.
Другим промотором, пригодным для использования в векторе данного изобретения, является промотор фактора элонгации 1α (EF-1α), например, человеческого EF-1α. Последовательность промотора человеческого EF-1α можно найти в GenBank под номером доступа NM_001402 (gi:83367078). В одном варианте осуществления вектор данного изобретения содержит нуклеотиды 76-1267 последовательности SEQ ID NO:2. В объем данного изобретения также входят последовательности промотора EF-1α, которые на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичны нуклеотидам 1-608 последовательности SEQ ID NO:1.
В одном варианте осуществления для проведения клонирования в состав вектора вводят участок рестрикции SwaI.
Как правило, гены (например, селектируемых маркеров и GOI) помещают между промотором и участком полиаденилирования. Можно использовать последовательность поли-A, полученную из представляющего интерес гена (т.e. нативную последовательность поли-A), или гетерологичную последовательность поли-A (т.е. из гена, отличающегося от GOI), например, поли-A BGH и поли-A SV40. мРНК транскрибируется с участием промоторов и стабилизируется под действием сигналов полиаденилирования, расположенных со стороны 3'-концов кодирующих участков. Сигналы поли-A хорошо известны в данной области и могут быть выбраны на основе пригодности для применения в сочетании с векторами и клетками-хозяевами, используемыми в настоящем изобретении. Примеры пригодных сигналов поли-A включают поли-A человеческого BGH, поли-A SV40, поли-A человеческого бета-актина, поли-A кроличьего бета-глобина и поли-A каппа-цепи иммуноглобулина.
Вектор данного изобретения содержит представляющий интерес ген, который посредством вектора экспрессируется в клеточной культуре. Представляющий интерес ген может кодировать функциональную молекулу нуклеиновой кислоты (например, РНК, такую как молекула антисмысловой РНК) или, более предпочтительно, он кодирует пептид, полипептид или белок, который желательно продуцировать на повышенном уровне. Векторы данного изобретения могут содержать представляющий интерес ген, вставленный в участок инсерции так, чтобы представляющий интерес ген был функционально связан с регуляторной нуклеотидной последовательностью, которая обеспечивает экспрессию представляющего интерес гена. В одном варианте осуществления векторы данного изобретения можно использовать для экспрессии практически любого представляющего интерес гена, особенно генов, кодирующих рекомбинантные белки, обладающие терапевтически полезной активностью или имеющие другое коммерчески значимое применение.
Неограничивающие примеры представляющих интерес генов включают гены гормонов, хемокинов, цитокинов, лимфокинов, антител, рецепторов, молекул адгезии и ферментов. Неполный список целевых продуктов включает, например, человеческий гормон роста, бычий гормон роста, паращитовидный гормон, тиреостимулирующий гормон, фолликулостимулирующий гормон, лютеинизирующий гормон; гормональный рилизинг-фактор; липопротеины; альфа-1-антитрипсин; A-цепь инсулина; B-цепь инсулина; проинсулин; кальцитонин; глюкагон; такие молекулы, как ренин; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; антикоагулирующие факторы, такие как белок C, атриальный натрийуретический фактор, легочное поверхностно-активное вещество; активатор плазминогена, такой как урокиназа или человеческий активатор плазминогена мочи или тканевый активатор плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухолей -альфа и -бета; энкефалиназа; RANTES (хемокин, выделяемый T-клетками при активации); человеческий макрофагальный белок воспаления (MIP-I-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; A- или B-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; ДНКаза; ингибин; активин; рецепторы гормонов или факторов роста; интегрин; белок A или D; ревматоидные факторы; нейротрофические факторы, такие как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), факторы роста, включающие фактор роста эндотелия сосудов (VEGF), фактор роста нервов, такой как NGF-бета; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF, bFGF, FGF-4, FGF-5, FGF-6; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, в том числе, TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (IGF-I мозга), белки, связывающие инсулиноподобный фактор роста; белки CD, такие как CD-3, CD-4, CD-8 и CD-19; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, (IL-1)-(IL-33); пероксиддисмутаза; рецепторы T-клеток; поверхностные мембранные белки, например, HER2; комплементзависимый стимулятор гемолиза; вирусный антиген, такой как, например, фрагмент оболочки вируса СПИД; транспортные белки; хоминг-рецепторы; аддрессины; рецепторы факторов роста, цитокины, хемокины и лимфокины; регуляторные белки; антитела; химерные белки, например, содержащие иммуноадгезины и фрагменты любых перечисленных выше полипептидов. Примеры бактериальных полипептидов или белков включают, например, щелочную фосфатазу и бета-лактамазу.
В одном аспекте данного изобретения вектор содержит участок тяжелой или легкой цепи антитела, который функционально связан с участком инсерции. Примеры векторов, содержащих два эписомальных ориджина репликации и константный участок легкой или тяжелой цепи антитела, можно найти в SEQ ID NO:3-32.
Один из вариантов осуществления данного изобретения включает векторы, которые можно использовать для экспрессии целого антитела, т.е. вариабельного участка, связанного с константным участком по тяжелой или легкой цепи. Следовательно, представляющий интерес ген может кодировать вариабельный участок тяжелой или легкой цепи антитела, которое может представлять собой антитело любого типа, например, мышиное, химерное, гуманизированное и человеческое. Представляющий интерес ген, кодирующий вариабельный участок тяжелой цепи или легкой цепи, может включать последовательность, кодирующую полноразмерный вариабельный участок, или, альтернативно, только фрагмент тяжелой цепи или легкой цепи, например, участок антиген-связывающего фрагмента. В одном варианте осуществления представляющий интерес ген кодирует вариабельный участок мышиного или человеческого антитела. В таком случае константный участок может принадлежать к тому же виду, что и вариабельный участок (SEQ ID NO:3-8, 27 и 28 кодируют мышиные константные участки, а SEQ ID NO:9-26 и 29-32 кодируют человеческие константные участки).
В одном варианте осуществления вектор данного изобретения содержит нуклеотидную последовательность, кодирующую константный участок тяжелой цепи антитела, обладающий определенными изотипическими и/или аллотипическими характеристиками. Константный участок тяжелой цепи, например, может относиться к гамма изотипу (IgG), такому как гамма 1, гамма 2, гамма 3 или гамма 4. В одном варианте осуществления константный участок тяжелой цепи гамма 1 относится к определенному аллотипу, включающему, без ограничения, аллотипы z,a и z,non-a. Аллотип z, a, также известный как аллотипы G1m17 и G1m1, в соответствии с IGHG1 содержит Lys в положении 214 (CH1), Asp в положении 356 (CH3) и Leu в положении 358 (CH3) (нумерация по системе EU). Аллотип z,non-a, также известный как аллотипы G1m17 и nG1m1 в соответствии с IGHG1 содержит Lys в положении 214 (CH1), Glu в положении 356 (CH3) и Met в положении 358 (CH3) (нумерация по системе EU).
В другом варианте осуществления константный участок тяжелой цепи гамма 2 (hcG2) относится к определенному аллотипу, включающему, без ограничения, n- или n+. Аллотип hcG2 n+, также известный как G2m (n) или G2m (23), в соответствии с IGHG2 содержит Thr в положении 189 CH1 и Met в положении 282 (нумерация по системе EU). Аллотип hcG2 n-, также известный как G2m (n-), в соответствии с IGHG2 содержит Pro в положении 189 CH1 и Val в положении 282 (нумерация по системе EU). Другие особенности аллотипов n+ и n- описаны в Hougs et al. (2001) Immunogenetics 52:242 и Brusco et al. (1995) Immunogenetics 42:414.
В других вариантах осуществления константный участок тяжелой цепи может относиться к изотипу IgM, IgA (IgA1 или IgA2), IgD или IgE.
В одном варианте осуществления константный участок тяжелой цепи может иметь следующие человеческие изотипические и аллотипические характеристики: гамма 1,z,a; гамма 1,z,non-a; гамма 2,n+; гамма 2,n-; или гамма 4. В одном варианте осуществления изотип/аллотип гамма 1,z,non-a может содержать мутацию в положении 234 константного участка тяжелой цепи. В другом варианте осуществления изотип/аллотип гамма 1,z,non-a может содержать мутации в положениях 234 и 235 или 234 и 237 константного участка тяжелой цепи. Примеры таких векторов приведены на фиг.8-25.
В другом примере константный участок легкой цепи, кодируемый в векторе данного изобретения, может относиться к каппа-изотипу или лямбда-изотипу.
Константные участки, кодируемые вектором данного изобретения, не ограничиваются человеческими, но могут включать константные участки мышей или других видов. В одном варианте осуществления вектор экспрессии данного изобретения содержит нуклеиновую кислоту, кодирующую константный участок тяжелой цепи, который относится либо к мышиному изотипу гамма 1, либо к мышиному изотипу гамма 2a, или константный участок легкой цепи, который относится к мышиному каппа-изотипу.
Два вектора данного изобретения, pHybC и pHybE, представляют собой пустые векторы, поскольку они не содержат константные участки, и могут быть использованы для клонирования представляющих интерес генов. Описание pHybC и pHybE приведено ниже, а карты данных векторов можно найти на фиг.1 и 2.
pHybC
Вектор pHybC (пустой) содержит два вирусных ориджина репликации, позволяющие осуществлять репликацию вектора в разных клеточных линиях. pHybC содержит следующие элементы: ориджин репликации SV40 ("SV40 Ori"), который обеспечивает репликацию векторной плазмиды в клетках, экспрессирующих белок большой T-антиген SV40 (например, в клетках COS7); промотор CMV ("pCMV"), функционально связанный с участком инсерции представляющего интерес гена; трехчленную лидерную последовательность (TPL); донорный участок сплайсинга (SD); основной поздний энхансер аденовируса (enh MLP); акцепторный участок сплайсинга (SA); участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли-A (pA); элемент симметрии второго порядка (DS); эукариотический ориджин репликации вируса Эпштейна-Барр (OriP), который обеспечивает репликацию векторной плазмиды в клетках, экспрессирующих вирусный белок EBNA-I (например, в клетках HEK-293-6E); участок дупликации (FR); маркер устойчивости к ампициллину (AmpR); и бактериальный ориджин репликации (pMB1ori). В векторе pHybC используется промотор pCMV, один из наиболее эффективных доступных промоторных элементов. Карта вектора pHybC (пустого) приведена на фиг.1. Нуклеотидная последовательность вектора pHybC описана в SEQ ID NO:1.
pHybE
Вектор pHybE (пустой) содержит два ориджина репликации, позволяющие осуществлять репликацию вектора в разных клеточных линиях. pHybE содержит следующие элементы: ориджин репликации SV40 ("SV40 Ori"), который обеспечивает репликацию векторной плазмиды в клетках, экспрессирующих белок большой T-антиген SV40 (например, в клетках COS7); эукариотический промотор EF-1a, функционально связанный с участком инсерции представляющего интерес гена; участок открытой рамки считывания (ORF), содержащий представляющий интерес ген с последующим сигналом поли-A (pA); элемент симметрии второго порядка (DS); эукариотический ориджин репликации вируса Эпштейна-Барр (OriP); участок дупликации (FR); маркер устойчивости к ампициллину (AmpR); и бактериальный ориджин репликации (pMB1ori). Карта вектора pHybE (пустого) приведена на фиг.2. pHybE отличается от pHybC тем, что pHybE содержит промотор EF-1а, функционально связанный с участком инсерции представляющего интерес гена, а pHybC содержит промотор CMV. Нуклеотидная последовательность вектора pHybE описана в SEQ ID NO:2.
Описанные ниже векторы, полученные на основе pHybE или pHybC, дополнительно содержат константные участки тяжелых или легких цепей иммуноглобулина. Как и в случае pHybE и pHybC, нижеследующие векторы содержат участки клонирования, которые можно использовать для вставки представляющего интерес гена, такого как последовательность, кодирующая вариабельный участок иммуноглобулина, или его антиген-связывающий фрагмент. Во всех случаях участок клонирования представляющего интерес гена примыкает к последовательности, кодирующей константный участок, которая входит в состав вектора. Таким образом, описанные ниже векторы можно использовать для экспрессии легких или тяжелых цепей антитела, содержащих конкретный константный участок и конкретный вариабельный участок. Как и в случае pHybC и pHybE, каждый из описанных ниже векторов данного изобретения содержит несколько ориджинов репликации, позволяющих экспрессировать легкую или тяжелую цепь антитела в разных клеточных линиях с использованием одного и того же вектора. Описания других векторов данного изобретения приведены ниже (см. также карты векторов, изображенные на фиг.8-25). Следует отметить, что векторы pHyb, обозначенные как версия 1 (V1), содержат дополнительный участок SwaI выше участка рестрикции SrfI, тогда как векторы pHyb, обозначенные как версия 2 (V2), не содержат дополнительный участок SwaI.
Векторы данного изобретения, содержащие мышиные константные участки
pHybC-mCg2a
Вектор pHybC-mCg2a получают на основе вектора pHybC (следовательно, он содержит все описанные выше элементы вектора pHybC). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 2a мышиного иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybC-mCg2a можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина (или его фрагмент) и мышиный константный участок тяжелой цепи гамма 2. Альтернативно, pHybC-mCg2 можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 2, например, гибридного белка Fc. На фиг.8 изображена карта pHybC-mBR3-mCg2a, который содержит последовательность, кодирующую внеклеточный домен (ECD) мышиного белка BR3 в качестве представляющего интерес гена. Нуклеотидная последовательность pHybC-mBR3-mCg2a описана в SEQ ID NO:27.
pHybE-mCk
Вектор pHybE-mCk получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). pHybE-mCk также содержит последовательность, кодирующую константный участок легкой цепи каппа мышиного иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-mCk можно использовать для экспрессии легкой цепи антитела, содержащей вариабельный участок легкой цепи иммуноглобулина и мышиный константный участок легкой цепи каппа. Альтернативно, pHybE-mCk можно использовать для экспрессии представляющего интерес гена, гибридизованного с мышиным константным участком легкой цепи каппа. Карта вектора pHybE-mCk V2 приведена на фиг.25. Нуклеотидная последовательность pHybE-mCk V1 описана в SEQ ID NO:3, а нуклеотидная последовательность pHybE-mCk V2 описана в SEQ ID NO:4.
pHybE-mCg1
pHybE-mCg1 получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1 мышиного иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-mCg1 можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и мышиный константный участок тяжелой цепи гамма 1. Альтернативно, pHybE-mCg1 можно использовать для экспрессии представляющего интерес гена, гибридизованного с мышиным константным участком тяжелой цепи гамма 1, например, гибридного белка Fc. Карта вектора pHybE-mCg1 V2 приведена на фиг.21. Нуклеотидная последовательность pHybE-mCg1 V1 описана в SEQ ID NO:5, а нуклеотидная последовательность pHybE-mCg1 V2 описана в SEQ ID NO:6.
pHybE-mCg2a
pHybE-mCg2a получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 2a мышиного иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-mCg2a можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и мышиный константный участок тяжелой цепи гамма 2. Альтернативно, pHybE-mCg2a можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 2, например, гибридного белка Fc. Карта вектора pHybE-mCg2a V2 приведена на фиг.22. Нуклеотидная последовательность pHybE-mCg2a V1 описана в SEQ ID NO:7, а нуклеотидная последовательность pHybE-mCg2a V2 описана в SEQ ID NO:8. На фиг.9 изображена карта pHybE-mBR3-mCg2a, который в одном варианте осуществления является примером применения pHybE-mCg2a. Вектор, описанный на фиг.9, содержит последовательность, кодирующую внеклеточный домен (ECD) мышиного белка BR3. Нуклеотидная последовательность pHybE-mBR3-mCg2a описана в SEQ ID NO:28.
Векторы данного изобретения, содержащие человеческие константные участки
pHybC-E7-hCk
pHybC-E7-hCk получают на основе вектора pHybC (следовательно, он содержит все описанные выше элементы вектора pHybC). Данный вектор также содержит последовательность, кодирующую константный участок легкой цепи каппа человеческого иммуноглобулина. Кроме того, pHybC-E7-hCk содержит последовательность, кодирующую вариабельный участок легкой цепи адалимумаба (также обозначаемый как "E7"). Карта вектора pHybC-E7-hCk приведена на фиг.10, а нуклеотидная последовательность pHybC-E7-hCk описана в SEQ ID NO:29.
pHybC-D2-hCg1,z,a
pHybC-D2-hCg1,z,a получают на основе вектора pHybC (следовательно, он содержит все описанные выше элементы вектора pHybC). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1,z,a. Кроме того, pHybC-D2-hCg1,z,a содержит последовательность, кодирующую вариабельный участок тяжелой цепи адалимумаба (также обозначаемый как "D2"). Карта вектора pHybC-D2-hCg1,z,a приведена на фиг.11. Нуклеотидная последовательность pHybC-D2-hCg1,z,a описана в SEQ ID NO:30.
pHybE-hCk
pHybE-hCk получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок легкой цепи каппа человеческого иммуноглобулина. Таким образом, например, вектор pHybE-hCk можно использовать для экспрессии легкой цепи антитела, содержащей вариабельный участок легкой цепи иммуноглобулина и человеческий константный участок легкой цепи каппа. Альтернативно, pHybE-hCk можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком легкой цепи каппа. Карта вектора pHybE-hCk V2 приведена на фиг.23. Нуклеотидная последовательность pHybE-hCk V1 описана в SEQ ID NO:9, а нуклеотидная последовательность pHybE-hCk V2 описана в SEQ ID NO:10. Карта вектора pHybE-E7-hCk также изображена на фиг.13. Помимо всех описанных выше элементов вектора pHybE-hCk, pHybE-E7-hCk содержит последовательность, кодирующую вариабельный участок легкой цепи адалимумаба (также обозначаемый как "E7"). Нуклеотидная последовательность pHybE-E7-hCk описана в SEQ ID NO:32.
pHybE-hCl
pHybE-hCl получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок легкой цепи лямбда человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCl можно использовать для экспрессии легкой цепи антитела, содержащей вариабельный участок легкой цепи иммуноглобулина и человеческий константный участок легкой цепи лямбда. Альтернативно, pHybE-hCl можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком легкой цепи лямбда. Карта вектора pHybE-hCl V2 приведена на фиг.24. Нуклеотидная последовательность pHybE-hCl V1 описана в SEQ ID NO:11, а нуклеотидная последовательность pHybE-hCl V2 описана в SEQ ID NO:12.
pHybE-hCg1,z,a
pHybE-hCg1,z,a получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1,z,a человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg1,z,a можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 1,z,a. Альтернативно, pHybE-hCgl,z,a можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 1,z,a, например, гибридного белка Fc. Карта вектора pHybE-hCg1,z,a приведена на фиг.14. Нуклеотидная последовательность pHybE-hCg1,z,a V1 описана в SEQ ID NO:13, а нуклеотидная последовательность pHybE-hCg1,z,a V2 описана в SEQ ID NO:14. Карта вектора pHybE-D2-hCg1,z,a приведена на фиг.12. Помимо описанных выше элементов pHybE-hCg1,z,a, pHybE-D2-hCg1,z,a содержит последовательность, кодирующую вариабельный участок тяжелой цепи адалимумаба (также обозначаемый как "D2"). Нуклеотидная последовательность pHybE-D2-hCg1,z,a описана в SEQ ID NO:31.
pHybE-hCg1,z,non-a
pHybE-hCg1,z,non-a получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1,z,non-a человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCgl,z,non-a можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 1,z,non-a. Альтернативно, pHybE-hCg1,z,non-a можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 1,z,non-a, например, гибридного белка Fc. Карта вектора pHybE-hCg1,z,non-a V2 приведена на фиг.15. Нуклеотидная последовательность pHybE-hCg1,z,non-a V1 описана в SEQ ID NO:15, а нуклеотидная последовательность pHybE-hCg1,z,non-a V2 описана в SEQ ID NO:16.
pHybE-hCg1,z,non-a,mut(234,235)
pHybE-hCg1,z,non-a,mut(234,235) получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1,z,non-a,mut(234,235) человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg1,z,non-a,mut(234,235) можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 1,z,non-a,mut(234,235). Альтернативно, pHybE-hCg1,z,non-a,mut(234,235) можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 1,z,non-a,mut(234,235), например, гибридного белка Fc. Карта вектора pHybE-hCg1,z,non-a,mut(234,235) V2 приведена на фиг.16. Нуклеотидная последовательность pHybE-hCg1,z,non-a,mut(234,235) V1 описана в SEQ ID NO:17, а нуклеотидная последовательность pHybE-hCg1,z,non-a,mut(234,235) V2 описана в SEQ ID NO:18.
pHybE-hCg1,z,non-a,mut(234,237)
pHybE-hCg1,z,non-a,mut(234,237) получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 1,z,non-a,mut(234,237) человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg1,z,non-a,mut(234,237) можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 1,z,non-a,mut(234,237). Альтернативно, pHybE-hCg1,z,non-a,mut(234,237) можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 1,z,non-a,mut(234,237), например, гибридного белка Fc. Карта вектора pHybE-hCg1,z,non-a,mut(234,237) V2 приведена на фиг.17. Нуклеотидная последовательность pHybE-hCg1,z,non-a,mut(234,237) V1 описана в SEQ ID NO:19, а нуклеотидная последовательность pHybE-hCg1,z,non-a,mut(234,237) V2 описана в SEQ ID NO:20.
pHybE-hCg2,n-
pHybE-hCg2,n- получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 2,n- человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg2,n- можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 2,n-. Альтернативно, pHybE-hCg2,n- можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 2,n-, например, гибридного белка Fc. Карта вектора pHybE-hCg2,n- V2 приведена на фиг.19. Нуклеотидная последовательность pHybE-hCg2,n- V1 описана в SEQ ID NO:21, а нуклеотидная последовательность pHybE-hCg2,n- V2 описана в SEQ ID NO:22.
pHybE-hCg2,n+
pHybE-hCg2,n+ получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 2,n+ человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg2,n+ можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 2,n+. Альтернативно? pHybE-hCg2,n+ можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 2,n+, например, гибридного белка Fc. Карта вектора pHybE-hCg2,n+ приведена на фиг.18. Нуклеотидная последовательность pHybE-hCg2,n+ V1 описана в SEQ ID NO:23, а нуклеотидная последовательность pHybE-hCg2,n+ V2 описана в SEQ ID NO:24.
pHybE-hCg4
pHybE-hCg4 получают на основе вектора pHybE (следовательно, он содержит все описанные выше элементы вектора pHybE). Данный вектор также содержит последовательность, кодирующую константный участок тяжелой цепи гамма 4 человеческого иммуноглобулина. Таким образом, в одном варианте осуществления вектор pHybE-hCg4 можно использовать для экспрессии тяжелой цепи антитела, содержащей вариабельный участок тяжелой цепи иммуноглобулина и человеческий константный участок тяжелой цепи гамма 4. Альтернативно, pHybE-hCg4 можно использовать для экспрессии представляющего интерес гена, гибридизованного с константным участком тяжелой цепи гамма 4, например, гибридного белка Fc. Карта вектора pHybE-hCg4 приведена на фиг.20. Нуклеотидная последовательность pHybE-hCg4 V1 описана в SEQ ID NO:25, а нуклеотидная последовательность pHybE-hCg4 V2 описана в SEQ ID NO:26.
Последовательности векторов данного изобретения описаны в SEQ ID NO:1-32. В одном варианте осуществления вектор данного изобретения содержит последовательность, представленную в любой одной из последовательностей SEQ ID NO:1-32 или последовательностей, которые идентичны им, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99%.
Данное изобретение можно использовать для получения человеческих и/или гуманизированных антител, которые иммуноспецифически распознают конкретные клеточные мишени, например, любой из вышеописанных белков, такой как человеческий рецептор EGF, антиген her-2/neu, антиген CEA, простатоспецифический мембранный антиген (PSMA), CD5, CD11a, CD18, NGF, CD20, CD45, CD52, Ep-cam, другие раковые клеточные поверхностные молекулы, TNF-альфа, TGF-b1, VEGF, другие цитокины, альфа 4 бета 7 интегрин, IgE, вирусные белки (например, белки цитомегаловируса). Примеры антител, которые можно получить с использованием композиций и способов данного изобретения, включают, без ограничения, антитело против TNFα, антитело против IL-12, антитело против IL-18 и антитело против рецептора EPO (EPO-R). В одном варианте осуществления антитело против TNFα представляет собой полностью человеческое антитело против TNFα, например, адалимумаб/D2E7 (см. патент США № 6090382, включенный в данное описание путем ссылки; Humira®; Abbott Laboratories). В одном варианте осуществления антитело против IL-12 представляет собой полностью человеческое антитело против IL-12, например, ABT-874 (Abbott Laboratories; см. патент США № 6914128, включенный в данное описание путем ссылки). В одном варианте осуществления антитело против IL-18 представляет собой полностью человеческое антитело против IL-18 (например, ABT-325), а также антитела, описанные в US20050147610 A1, включенном в данное описание путем ссылки. В одном варианте осуществления антитело против EPO/R (также обозначаемое как ABT-007) представляет собой полностью человеческое антитело, такое как описано в публикации патента США № US 20060018902 A1, включенной в данное описание путем ссылки.
Кроме того, константные участки, кодируемые вектором, такие как домен Fc, могут быть функционально связаны с белком с образованием гибридного белка, например, гибридного белка Fc. Таким образом, другой пример типа белков, которые могут продуцироваться с использованием способов и композиций данного изобретения, включает гибридные белки. Примеры таких гибридных белков включают белки, экспрессируемые в виде гибрида с фрагментом молекулы иммуноглобулина, белки, экспрессируемые в виде гибрида с фрагментом-"молнией", и новые полифункциональные белки, такие как гибриды цитокинов и факторов роста (например, GM-CSF и IL-3, MGF и IL-3). В WO 93/08207 и WO 96/40918 описывается получение различных растворимых олигомерных форм молекулы, называемой CD40L, включая гибридный белок иммуноглобулина и гибридный белок-"молния", соответственно; описанные в данном документе способы применимы для получения других белков. Другой гибридный белок представляет собой рекомбинантный TNFR:Fc, также известный как энтанерцепт. Энтанерцепт (или Enbrel®; Amgen/Wyeth) представляет собой димер, состоящий из двух молекул внеклеточного фрагмента рецептора TNF-альфа p75, каждая из которых содержит полученный из TNFR полипептид размером 235 аминокислот, гибридизованный с Fc-фрагментом человеческого IgG1 размером 232 аминокислоты. Фактически, в виде гибридного белка можно экспрессировать любую молекулу, включающую, без ограничения, внеклеточный домен молекулы клеточного рецептора, фермент, гормон, цитокин, фрагмент молекулы иммуноглобулина, домен-"молния" и эпитоп.
Методы определения "идентичности" нуклеотидных и аминокислотных последовательностей известны в данной области. Обычно такие методы включают определение нуклеотидной последовательности мРНК исследуемого гена и/или определение кодируемой ею аминокислотной последовательности, и сравнение указанных последовательностей со второй нуклеотидной или аминокислотной последовательностью. Как правило, термин "идентичность" относится к точному соответствию нуклеотид-нуклеотид или аминокислота-аминокислота двух полинуклеотидных иди полипептидных последовательностей, соответственно. Две или более последовательностей (полинуклеотидных или аминокислотных) можно сравнивать путем определения "процента идентичности." Процент идентичности двух последовательностей, либо нуклеотидных, либо аминокислотных последовательностей, представляет собой число точных совпадений среди двух выравниваемых последовательностей, деленное на длину более короткой последовательности и умноженное на 100. Приблизительное выравнивание нуклеотидных последовательностей осуществляют с помощью алгоритма локальной гомологии, Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981). Данный алгоритм может быть применен к аминокислотным последовательностям с использованием матрицы очков, разработанной Dayhoff, Atlas of Protein Sequences and Structure, M. O. Dayhoff ed., 5 suppl. 3:353-358, National Biomedical Research Foundation, Washington, D. C, USA, и нормализованной Gribskov, Nucl. Acids Res. 14(6):6745-6763 (1986). Типичное применение данного алгоритма для определения процента идентичности последовательностей предоставляется Genetics Computer Group (Madison, Wis.) во вспомогательном приложении "BestFit". Стандартные параметры для данного способа описаны в Wisconsin Sequence Analysis Package Program Manual, Version 8 (1995) (предоставляемой Genetics Computer Group, Madison, Wis.). В предпочтительном способе определения процента идентичности в контексте настоящего изобретения используют комплект программ MPSRCH, охраняемый авторским правом University of Edinburgh, разработанный John F. Collins and Shane S. Sturrok, и распространяемый IntelliGenetics, Inc. (Mountain View, Calif.). Из данного комплекта программ можно использовать алгоритм Смита-Ватермана, где для получения оценочных таблиц используют стандартные параметры (например, штраф за открытие пробела - 12, штраф за продолжение пробела - единица и пробел - шесть). Полученное в результате число "совпадений" отражает "идентичность последовательностей". Другие программы, подходящие для расчета процента идентичности или подобия последовательностей, хорошо известны в данной области.
Условия "селективной гибридизации" двух фрагментов нуклеиновых кислот описаны в данном документе. Степень идентичности последовательностей двух молекул нуклеиновых кислот влияет на эффективность и силу событий гибридизации таких молекул. Частично идентичная нуклеотидная последовательность, по меньшей мере, отчасти ингибирует гибридизацию молекулы-мишени с полностью идентичной ей последовательностью. Ингибирование гибридизации полностью идентичной последовательности можно оценивать с помощью анализов гибридизации, хорошо известных в данной области (таких как саузерн-блоттинг, нозерн-блоттинг, гибридизация в растворе или т.п., см. Sambrook et al., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, New York; или Ausubel et al. (Eds.), Current Protocols In Molecular Biology, John Wiley & Sons, Inc., New York (1997)). Такие анализы можно проводить с разной степенью селективности, например, варьируя условия от низкой до высокой жесткости. Если используются условия низкой жесткости, то отсутствие неспецифического связывания можно определить с помощью вторичного зонда, который не обладает даже частичной идентичностью последовательности (например, зонда, идентичного последовательности молекулы-мишени менее чем на 30%), так что при отсутствии событий неспецифического связывания вторичный зонд не гибридизуется с мишенью.
При использовании системы детекции на основе гибридизации выбирают нуклеотидный зонд, комплементарный целевой нуклеотидной последовательности, после чего в подходящих условиях проводят "селективную гибридизацию" зонда и целевой последовательности, или их связывание друг с другом с получением гибридной молекулы. Молекула нуклеиновой кислоты, способная селективно гибридизоваться с целевой последовательностью в условиях "средней жесткости", обычно гибридизуется в условиях, позволяющих проводить детекцию целевой нуклеотидной последовательности, которая содержит, по меньшей мере, примерно 10-14 нуклеотидов в длину и, по меньшей мере, примерно на 70% идентична последовательности выбранного нуклеотидного зонда. Жесткие условия гибридизации обычно позволяют детектировать целевую нуклеотидную последовательность, которая содержит, по меньшей мере, примерно 10-14 нуклеотидов в длину и, по меньшей мере, примерно на 90-95% идентична последовательности выбранного нуклеотидного зонда. Условия гибридизации зонда и мишени, имеющих определенную степень идентичности последовательностей, можно определить с помощью известных в данной области способов (см., например, Nucleic Acid Hybridization: A Practical Approach, editors B. D. Hames and S. J. Higgins, (1985) Oxford; Washington, D.C.; IRL Press).
Что касается условий жесткости гибридизации, в данной области хорошо известно, что разные эквивалентные условия можно использовать для установления определенной жесткости путем варьирования, например, таких факторов, как длина и природа последовательностей зонда и мишени, состав оснований разных последовательностей, концентрации солей и других компонентов раствора для гибридизации, присутствие или отсутствие блокирующих средств или детергентов в растворах для гибридизации (например, формамида, декстрансульфата, полиэтиленгликоля и додецилсульфата натрия), температурные и временные параметры реакции гибридизации, а также условия промывания. Выбор конкретных условий гибридизации проводят с помощью нижеследующих стандартных способов, известных в данной области (см., например, Sambrook, et al., выше, или Ausubel et al., выше). Считают, что первый полинуклеотид является "производным" второго полинуклеотида, если он имеет такую же или по существу такую же последовательность пар оснований, как и участок второго полинуклеотида, его кДНК или комплементарная цепь, или имеет идентичность последовательности, как описано выше. Считают, что первый полипептид является "производным" второго полипептида, если он (i) кодируется первым полинуклеотидом, производным второго полинуклеотида, или (ii) обладает идентичностью последовательности по отношению ко второму полипептиду, как описано выше.
Данное изобретение также предлагает набор, содержащий один или несколько векторов данного изобретения в подходящем сосуде, таком как флакон. Векторы экспрессии могут содержать, по меньшей мере, один участок клонирования для вставки выбранной представляющей интерес последовательности, или они могут содержать конкретный представляющий интерес ген, уже присутствующий в векторе. Вектор может быть представлен в виде дегидратированной или лиофилизированной формы, или в виде водного раствора. Набор может включать буфер для разбавления дегидратированного полинуклеотида. В состав набора могут входить другие реагенты, например, буферы для реакции, векторы, используемые для сравнения в качестве положительных и отрицательных контролей. Как правило, набор также содержит инструкции по применению входящих в его состав реагентов.
III. Применение векторов данного изобретения
Данное изобретение включает способы экспрессирования белков с использованием описанных в данном документе векторов. Так, данное изобретение предусматривает способ получения рекомбинантного белка, включающий введение вектора экспрессии данного изобретения в клетку-хозяина млекопитающего, культивирование клетки-хозяина млекопитающего в подходящих условиях, обеспечивающих экспрессию белка, и выделение белка. Преимущество вектора данного изобретения заключается в том, что он обеспечивает продукцию белка на высоком уровне в системах культур клеток млекопитающих.
В настоящем изобретении в качестве клетки-хозяина можно использовать любую клетку, способную экспрессировать ген при посредстве нуклеиновой кислоты или вектора экспрессии настоящего изобретения. Термин "клетки-хозяева" относится к клеткам, трансформированным вектором, сконструированным с использованием методов рекомбинантных ДНК.
Рядовые специалисты в данной области могут выбрать конкретную линию клеток-хозяев, которая наилучшим образом подходит для экспрессии GOI и гена селектируемого маркера с использованием вектора настоящего изобретения. Клетки, которые можно использовать в данном изобретении, включают клетки млекопитающих, а также полученные из них клеточные линии и клеточные культуры. Клетки млекопитающих, например, эмбриональные клетки или соматические клетки, можно получить от млекопитающих, таких как мыши, крысы или другие грызуны, или от приматов, таких как люди или обезьяны. Следует понимать, что для осуществления способов данного изобретения можно использовать первичные клеточные культуры или иммортализованные клетки.
В конкретных вариантах осуществления используют типы клеток, относящиеся к клеткам млекопитающих по происхождению, которые включают, без ограничения, клетки яичника китайского хомячка (CHO) (например, DG44 и DUXB11; Urlaub et al., Som. Cell Molec. Genet. 12:555, 1986; Haynes et al., Nuc. Acid. Res. 11:687-706, 1983; Lau et al., Mol. Cell. Biol. 4:1469-1475, 1984; Methods in Enzymology, 1991, vol.185, pp.537-566. Academic Press, Inc., San Diego, Calif.), фибробласты китайского хомячка (например, R1610), клетки цервикальной карциномы человека (например, HELA), линию клеток почки обезьяны (например, CVI и COS), мышиные фибробласты (например, BALBc/3T3), клетки мышиной миеломы (P3.times.63-Ag3.653; NS0; SP2/0), линию клеток почки хомяка (например, HAK), мышиные L-клетки (например, L-929), человеческие лимфоциты (например, RAJI), клетки почки человека (например, 293 и 293T). Линии клеток-хозяев обычно являются коммерчески доступными (например, от BD Biosciences, Lexington, Ky.; Promega, Madison, Wis.; Life Technologies, Gaithersburg, Md.) или их можно получить из американской коллекции типовых культур (ATCC, Manassas, Va.).
В предпочтительном варианте осуществления используемая в данном изобретении клетка-хозяин предоставляет действующий извне фактор инициации репликации, соответствующий, по меньшей мере, одному ориджину репликации, входящему в состав вектора данного изобретения. Например, если вектор содержит два ориджина репликации, соответствующих ориджину репликации SV40 и ориджину репликации OriP, можно использовать линию любых клеток, предпочтительно клеток млекопитающих, которые экспрессируют либо большой T-антиген, либо белок EBNA. В одном варианте осуществления вектор вводят в клетку COS или эмбриональную клетку почки человека (HEK). Например, клетки COS7 получают из клеток обезьян CV-I, трансформированных изначально дефектным мутантом SV40 (Sigma-Aldrich). EBNA можно получить, например, с использованием клеток HEK-293-6E.
Клеточные линии, которые содержат факторы инициации репликации, стабильно интегрированные в геном, обладают преимуществом, заключающимся в стабильной долговременной экспрессии фактора инициации репликации и длительном обеспечении репликации и поддержании плазмид, содержащих ориджин репликации. Примерами коммерчески доступных клеточных линий, экспрессирующих EBNA-1, являются ATCC: 293HEK-EBNA1 и CV1-EBNA1. Конкретные клеточные линии, осуществляющие повышенную экспрессию, по меньшей мере, одного фактора инициации репликации, предпочтительно белка EBNA1 или большого T-антигена SV40, можно получить путем трансфекции и селекции стабильных клеточных клонов.
Нуклеиновые кислоты и векторы экспрессии можно вводить или трансформировать в подходящие клетки-хозяева с помощью различных методов, известных в данной области (см., например, Ridgway, 1973, Vectors: Mammalian Expression Vectors, Chapter 24.2, pp.470-472, Rodriguez and Denhardt eds., Butterworths, Boston, Mass.; Graham et al., 1973, Virology 52:456; Sambrook et al., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, New York; Davis et al., 1986, Basic Methods in Molecular Biology, Elsevier; и Chu et al., 1981, Gene 13:197). Термины "трансформация" и "трансфекция", а также их грамматические вариации используются в данном описании как взаимозаменяемые и относятся к введению чужеродной ДНК в клетку любым подходящим способом. Клетка становится "трансформированной" после того, как экзогенная нуклеиновая кислота попадет внутрь клеточной мембраны. Поглощение нуклеиновой кислоты приводит к образованию стабильного трансфектанта, независимо от способа проведения поглощения, который может включать трансфекцию (в том числе, электропорацию), слияние протопластов, осаждение фосфатом кальция, слияние клетки с покрытой оболочкой ДНК, микроинъекцию и инфицирование интактным вирусом. Даже временная экспрессия на уровне, превышающем нормальный, является полезной для функциональных исследований или для получения и выделения представляющих интерес белков. Трансформированные клетки выращивают в условиях, подходящих для продукции представляющего интерес белка (например, в одном варианте осуществления, тяжелой или легкой цепи антитела), и затем проводят анализы для идентификации кодируемого представляющего интерес полипептида. Примеры аналитических методов, используемых для идентификации и количественного определения генных продуктов, включают иммуноферментный твердофазный анализ (ELISA), радиоиммунологический анализ (RIA) или клеточный сортинг с активацией флуоресценции (FACS), иммуногистохимию и т.п.
Клетки, используемые в настоящем изобретении, можно культивировать с помощью стандартных методов, например, их можно фиксировать на твердой поверхности или выращивать в суспензии в подходящей питательной среде.
Клетки-хозяева млекопитающих, содержащие описанные здесь векторы, также входят в объем данного изобретения.
Если не указано иначе, для осуществления настоящего изобретения используют традиционные методы молекулярной биологии и т.п., известные специалистам в данной области. Такие методы подробно описаны в литературе. См., например, Molecular Cloning: A Laboratory Manual, (J. Sambrook et al., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989); Current Protocols in Molecular Biology (F. Ausubel et al., eds., 1987 updated); Essential Molecular Biology (T. Brown ed., IRL Press 1991); Gene Expression Technology (Goeddel ed., Academic Press 1991); Methods for Cloning and Analysis of Eukaryotic Genes (A. Bothwell et al. eds., Bartlett Publ. 1990); Gene Transfer and Expression (M. Kriegler, Stockton Press 1990); Recombinant DNA Methodology (R. Wu et al. eds., Academic Press 1989); PCR: A Practical Approach (M. McPherson et al., IRL Press at Oxford University Press 1991); Oligonucleotide Synthesis (M. Gait ed., 1984); Cell Culture for Biochemists (R. Adams ed., Elsevier Science Publishers 1990); Gene Transfer Vectors for Mammalian Cells (J. Miller & M. Calos eds., 1987); Mammalian Cell Biotechnology (M. Butler ed., 1991); Animal Cell Culture (J. Pollard et al. eds., Humana Press 1990); Culture of Animal Cells, 2.sup.nd Ed. (R. Freshney et al. eds., Alan R. Liss 1987); Flow Cytometry and Sorting (M. Melamed et al. eds., Wiley-Liss 1990); серии Methods in Enzymology (Academic Press, Inc.); и Animal Cell Culture (R. Freshney ed., IRL Press 1987); и Wirth M. and Hauser H. (1993) Genetic Engineering of Animal Cells, In: Biotechnology Vol.2 Puhler A (ed.) VCH, Weinhcim 663-744.
Примеры
Нижеследующие примеры иллюстрируют инновационный подход к устранению необходимости конструировать отдельные векторы для различных клеток-хозяев млекопитающих, например, клеток COS7 и HEK-293-6E. Нижеследующие примеры также предлагают векторы, содержащие нуклеиновые кислоты, кодирующие константные участки антител, которые можно использовать для экспрессии целых легких или тяжелых цепей антитела, или для экспрессии гибридных белков Fc.
Два новых векторных скелета, называемых pHyb-C и pHyb-E, конструируют путем объединения выборочных элементов других векторов, т.е. векторов pBOS и pTT3 (см. предварительную заявку США № 60/878165, международную заявку № PCT/US2007/26482, поданную 28 декабря 2007, озаглавленную "DUAL-SPECIFIC IL-1A/IL-1b ANTIBODIES" и USSN 12/006068, каждая из которых включена в настоящее описание путем ссылки). Контрольный вектор pBOS содержит промотор EF-1a, функционально связанный с участком инсерции представляющего интерес гена, и ориджин репликации SV40. Контрольный вектор pTT3 содержит промотор CMV, функционально связанный с участком инсерции представляющего интерес гена, и ориджин репликации EBNA (OriP).
Векторы данного изобретения тестируют путем анализа экспрессии белков, таких как мышиный гибрид BR3-Fc и человеческое антитело (адалимумаб) в клетках COS7 и HEK-293-6E. Успешная экспрессия белка в клетках COS7 и HEK-293-6E свидетельствует о том, что векторная система подходит для рекомбинантной экспрессии в клетках обоих типов.
Пример 1
Конструирование векторов pHybC и pHybE
На фиг.1 и 2 приведены карты новых векторов, каждый из которых содержит два ориджина репликации. На фиг.1 и 2 изображены "пустые" версии векторов, т.е. версии, которые не содержат нуклеиновых кислот, кодирующих представляющий интерес ген или константные участки антитела (более подробно они описаны ниже в примере 4). pHybC содержит промотор CMV, функционально связанный с участком инсерции представляющего интерес гена, тогда как pHybE содержит промотор EF-1a.
Чтобы получить pHybC-mBR3-Fc ("mBR3" обозначает мышиный вариант третьего рецептора BlyS и в данном описании конкретно относится к последовательности, кодирующей фрагмент внеклеточного домена (ECD) белка mBR3), участок начала репликации SV40 из вектора pEF-BOS амплифицируют методом ПЦР с использованием праймеров, обеспечивающих введение участков рестрикции PspX I на 5'- и 3'-концах амплифицируемого фрагмента ДНК. Затем этот фрагмент инсерции расщепляют PspX I. Конструкцию pTT3-mBR3-Fc, содержащую участок рестрикции Sal I выше промотора CMV, расщепляют Sal I. Затем фрагмент инсерции, расщепленный PspX I? лигируют в участок Sal I вектора pTT3-mBR3-Fc с получением вектора pHybC-mBR3-Fc.
Чтобы получить конструкцию pHybE-mBR3-Fc, вначале методом ПЦР амплифицируют 5'-конец PspX I-модифицированного фрагмента ДНК, содержащего участок начала репликации SV40, на протяжении внеклеточного домена mBR3. Затем полученный продукт расщепляют по 5'-концу под действием PspX I и по 3'-концу под действием Bsp68 I, специфический участок которого находится в лидерной последовательности выше последовательности внеклеточного домена mBR3. Данный расщепленный фрагмент клонируют в Sal I- и Bsp68 I-расщепленной конструкции pTT3-mBR3-Fc с получением конструкции pHybE-mBR3-Fc.
Карты pHybC-mBR3-Fc и pHybE-mBR3-Fc, каждый из которых экспрессирует гибридный белок рецептор-Fc mBR3-Fc, изображены на фиг.8 и 9.
Вектор pHybC-E7, экспрессирующий такой белок, как легкая цепь антитела D2E7 (адалимумаб), конструируют так же, как и pHybC-mBR3-Fc, т.е. путем лигирования такого же PspX I-расщепленного участка SV40 Ori, который выделяют и расщепляют в процессе получения pHybC-mBR3-Fc (описано выше), в заранее сконструированный вектор pTT3-E7, предварительно расщепленный Sal I.
Чтобы сконструировать вектор pHybE-E7, получают фрагмент вставки путем расщепления уже существующего вектора pBOS-E7 ферментами рестрикции Hind III и BsiW I. Затем полученный фрагмент вставки лигируют в вектор pHybC-E7, предварительно расщепленный такими же ферментами, с получением pHybE-E7, обеспечивающего экспрессию такого белка, как легкая цепь D2E7.
Чтобы сконструировать векторы pHybC-D2 и pHybE-D2, получают фрагмент вставки, содержащий участки, кодирующие вариабельный и константный участки тяжелой цепи антитела D2E7 (адалимумаб) (т.е. последовательность, кодирующую тяжелую цепь D2), путем расщепления уже существующего вектора pTT3-D2 ферментами рестрикции Bsp68 I и Not I. Полученный фрагмент вставки лигируют в векторы pHybC-mBR3-Fc и pHybE-mBR3-Fc, предварительно расщепленные такими же ферментами, с получением pHybC-D2 и pHybE-D2, соответственно, обеспечивающих экспрессию такого белка, как тяжелая цепь антитела D2E7 (адалимумаб).
Пример 2
Сравнение выходов белка
Чтобы определить, влияет ли увеличение размера вектора за счет добавления двух ориджинов репликации на продукцию белка под действием векторов, описанные выше векторы pHyb-E и pHyb-C сравнивают с контрольными векторами pBOS и pTT3, каждый из которых содержит только один ориджин репликации. Чтобы сравнить экспрессию, обусловленную векторами pBOS, pTT3, pHyb-C и pHyb-E, конструкцию, кодирующую гибридный белок мышиный рецептор BAFF-человеческий Fc (mBR3-Fc), субклонируют в четырех векторных скелетах и получают параллельно с использованием набора для получения очищенных и специфичных ДНК.
Четыре вектора, содержащих последовательность mBR3-Fc, вводят методом электропорации в клетки COS или трансфицируют в клетки HEK-293-6E (методики описаны ниже). Клетки инкубируют в течение пяти или семи дней. Берут образцы среды и измеряют концентрацию белка mBR3-Fc, секретируемого в среду. Титры определяют путем анализа IgG методом ELISA и корректируют по разнице в молекулярной массе стандартного белка IgG и белка mBR3-Fc в кондиционированной среде через 5 дней в случае клеток COS7 и через 7 дней в случае клеток HEK-293-6E. Корректировка титра необходима во избежание завышенной оценки титра белка mBR3-Fc вследствие того, что в методе ELISA в качестве стандарта используют гораздо более крупный человеческий белок IgG.
Трансфекция 293
В данном эксперименте в качестве процедуры транзиторной трансфекции 293 используют модифицированные способы, опубликованные в Durocher et al. (2002); Nucleic Acids Research 30(2):E9 и Pham et al. (2005); Biotechnology Bioengineering 90(3):332-44. Для трансфекции используют следующие реагенты:
- клетки HEK 293-6E (линия клеток эмбриональной почки человека, стабильно экспрессирующих EBNA1; получают от Национального научно-исследовательского совета Канады), культивируемые в одноразовых колбах Эрленмейера во влажном инкубаторе при 130 об/мин, 37°C и 5% CO2.
- культуральная среда: среда для экспрессии FreeStyle 293 (Invitrogen 12338-018), дополнительно содержащая 25 мкг/мл генетицина (G418) (Invitrogen 10131-027) и 0,1% Pluronic F-68 (Invitrogen 24040-032).
- среда для трансфекции: среда для экспрессии FreeStyle 293, дополнительно содержащая 10 мМ HEPES (Invitrogen 15630-080).
- исходный раствор полиэтиленимина (PEI): стерильный исходный раствор 1 мг/мл, pH 7,0, полученный с использованием линейного PEI размером 25 kDa (Polysciences), который хранят при температуре ниже -15°C.
- триптоновая питательная среда: 5% масс./об. стерильный исходный раствор триптона N1 (Organotechnie, 19554) в среде для экспрессии FreeStyle 293.
Получение клеток для трансфекции: примерно за 2-4 часа до трансфекции клетки HEK 293-6E собирают центрифугированием и ресуспендируют в культуральной среде до получения плотности примерно 1 миллион жизнеспособных клеток на мл. Для каждой трансфекции 40 мл клеточной суспензии переносят в одноразовую колбу Эрленмейера объемом 250 мл и инкубируют в течение 2-4 часов.
Трансфекция: среду для трансфекции и исходный раствор PEI нагревают заранее до комнатной температуры (КТ). Для каждой трансфекции 25 мкг плазмидной ДНК и 50 мкг полиэтиленимина (PEI) объединяют в 5 мл среды для трансфекции и инкубируют в течение 15-20 минут при КТ, чтобы обеспечить образование комплексов ДНК:PEI. Для трансфекции BR3-Ig используют 25 мкг плазмиды BR3-Ig. Добавляют 5 мл смеси каждого комплекса ДНК:PEI к культуре объемом 40 мл, полученной заранее, и снова инкубируют во влажном инкубаторе при 130 об/мин, 37°C и 5% CO2. Через 20-28 часов к каждой трансфекционной смеси добавляют 5 мл триптоновой питательной среды и культивирование продолжают в течение шести дней.
Трансфекция клеток COS7
Две чашки размером 150 мм, содержащие COS7, трансфицируют конструкцией, используя стандартные условия электропорации, как описано ниже. Для проведения экспериментов по трансфекции COS7 клетки COS культивируют в DMEM + 10%FBS + 1X глутамин. После достижения слияния клетки из одной колбы T-150 используют для электропорации. Клетки трипсинизируют и центрифугируют в среде, содержащей сыворотку до инактивации сыворотки. Клетки промывают 1XPBS.
Для каждой T-150 осадок ресуспендируют в 0,8 мл буфера для электропорации. Буфер для электропорации COS содержит 20 мМ Hepes (или буфер P3), 137 мМ NaCl, 5 мМ KCl, 0,7 мМ Na2HPO4 и 6 мМ декстрозу. Буфер для электропорации доводят до pH 7,0 и стерилизуют фильтрацией. Для каждой электропорации используют шестьдесят микрограммов ДНК (30 мкг каждой плазмидной ДНК тяжелой и легкой цепи или 60 мкг ДНК в случае гибридного белка Fc). В каждую кювету добавляют 0,8 мл смеси клетки/буфер/ДНК (кюветы размером 0,4 см - Biorad). Кроме того, одну кювету заполняют только буфером и используют в качестве контроля. Кюветы помещают на лед. Электропорацию клеток проводят при 250 В и 950 мкФ в течение 15-25 миллисекунд. Затем кюветы возвращают на лед. Содержимое 2 кювет переносят в одну коническую пробирку объемом 50 мл, содержащую 20 мл гибридомы SFM. Пипетку объемом 10 мл используют для разбивки на группы и переноса на две чашки для культивирования тканей размером 150 мм, каждая из которых содержит еще 20 мл среды. Таким образом, общий объем среды в каждой чашке составляет 30 мл. Затем чашки инкубируют при 37°C, 5% CO2 в течение трех дней.
Кондиционированную среду клеток COS (супернатант) собирают в конические пробирки объемом 50 мл и центрифугируют. После центрифугирования супернатант фильтруют, используя фильтр на 2 микрона (мкм). Берут образец для анализа ELISA. Супернатанты собирают через 5 дней и анализируют стандартным методом ELISA для IgG, чтобы определить соответствующий выход белка.
Версии векторов pBOS, pTT3, pHybC и pHybE тестируют по отдельности в mBR3 и адалимумабе (D2E7).
Тестирование белков
Концентрации гибридного белка mBR3-Fc определяют в культуральных супернатантах через 5 дней (в случае клеток COS7) или через 7 дней после трансфекции (в случае клеток 293-6E), используя ELISA и/или Poros A.
Результаты
Данные, демонстрирующие уровни экспрессии белка после контрольной и экспериментальной трансфекции, показаны на фиг.3 (клетки COS) и фиг.4 (клетки HEK-293). Данные, приведенные на фиг.3, показывают, что pHybC и pHybE обеспечивают эффективную продукцию белка в клетках COS, где оба вектора экспрессируются на более высоком уровне, чем контрольный вектор pTT3. Данные, приведенные на фиг.4, показывают, что уровни экспрессии в клетках HEK, трансфицированных pHyb-E, превышают уровни экспрессии, обеспечиваемые остальными тремя векторами, тогда как уровни продукции белка pHyb-C сравнимы с контрольными уровнями. Таким образом, как pHyb-C, так и pHyb-E способны экспрессировать гибридный белок mBr3-Fc так же, как и контрольные векторы pTT3 и pBOS, если не лучше.
Пример 3
Сравнение выхода белка, который требует совместной трансфекции двух конструкций ДНК
Человеческое моноклональное антитело IgG1/κ против TNFα (адалимумаб)/D2E7 субклонируют в четырех векторных скелетах и получают параллельно с использованием набора для получения очищенных и специфичных ДНК.
Четыре вектора, содержащие последовательности, обеспечивающие экспрессию адалимумаба, методом электропорации вводят в клетки COS; клетки HEK-293-6E трансфицируют, используя поли(этиленимин) (PEI).
Используют такую же процедуру транзиторной трансфекции 293, как и в примере 3, за исключением того, что для трансфекции адалимумаба используют плазмиду, содержащую 10 мкг тяжелой цепи D2E7 (обозначаемой "D2"), и плазмиду, содержащую 15 мкг легкой цепи D2E7 (обозначаемой "E7").
Эксперименты по трансфекции COS7 проводят, как описано выше, за исключением того, что в каждую трансфекционную чашку добавляют 30 мкг каждого вектора, содержащего тяжелую и легкую цепи.
Концентрации антитела адалимумаб определяют в культуральных супернатантах через 7 дней после трансфекции, используя ELISA и/или Poros A. Титры определяют путем анализа IgG методом ELISA в кондиционированной среде через 5 дней в случае клеток COS7 и через 7 дней в случае клеток HEK-293-6E.
Данные, демонстрирующие уровни экспрессии белка после контрольной и экспериментальной трансфекции, показаны на фиг.5 (клетки HEK-293) и фиг.6 (клетки COS). Данные, приведенные на фиг.5, показывают, что оба векторных скелета pHybC и pHybE способны обеспечивать продукцию адалимумаба на более высоком уровне, чем контрольный вектор pBOS, и в сравнимых (pHybC) или более высоких (pHybE) количествах, чем контрольный вектор pTT3 (Durocher, Y. et al. Nucleic Acids Res. 30:E9 (2002)). Подобным образом, данные, приведенные на фиг.6, показывают, что оба векторных скелета pHybC и pHybE способны обеспечивать продукцию белка на уровне, превышающем уровень, обеспечиваемый контрольным вектором pTT3, и сравнимом с уровнем, обеспечиваемым контрольным вектором pBOS.
Пример 4
Конструирование вектора pHyb-E, содержащего константный участок антитела
Чтобы облегчить создание векторов, которые можно использовать для продукции антител, с использованием нового векторного скелета pHyb-E, получают набор из двенадцати различных векторов, содержащих тяжелые и легкие цепи (общие сведения представлены в таблицах 2 и 3). Конструируют двенадцать эталонных матриц векторов pHybE, которые обеспечивают экспрессию человеческих и мышиных IgG.
Чтобы получить векторы, описанные на фиг.14-25, фрагмент SrfI/NotI размером 6123 п.о. выделяют из pHybE-stuffer-hCgl,z,a (pJP167) и лигируют с фрагментами рестрикции SrfI/NotI из векторов pBOS, содержащих участок, кодирующий сигнальный пептид, "лишний" фрагмент лямбда, и последовательность, кодирующую константный участок. Чтобы получить фрагменты рестрикции SrfI/NotI, проводят расщепление ферментами рестрикции SrfI/NotI, с получением фрагментов инсерции, содержащих участок, кодирующий сигнальный пептид, "лишний" фрагмент лямбда, и последовательность, кодирующую константный участок (последовательности константных участков приведены в таблице 1). Указанные фрагменты получают из шаблонных матриц pBOS, которые конструируют в плазмидной ДНК pEF-BOS (см. Mizushima, S. and Nagata, S. Nucleic Acids Res. 18:5322 (1990); они также описаны в предварительной заявке США № 60/878165, международной заявке № PCT/US2007/026482, поданной 28 декабря 2007 г. под заголовком "DUAL-SPECIFIC IL-1A/IL-1b ANTIBODIES") и USSN 12/006068, которые включены в данное описание путем ссылки). Фрагмент инсерции для конструкции pHybE-hCl вначале модифицируют методом ПЦР с перекрыванием, чтобы получить участок рестрикции AfeI на 3'-конце J-участка, облегчающий клонирование в данном векторе. Все вставки лигируют в конструкцию pHyBE с проверенной ранее последовательностью, предварительно расщепленную SrfI и NotI с получением нижеследующих векторов.
Затем проверяют последовательности новых векторов, содержащих константные участки, чтобы подтвердить наличие последовательностей, кодирующих константные участки мышиных и человеческих антител (см. SEQ ID NO:3-32).
Все векторы, приведенные в таблицах 2 и 3, содержат "лишнюю" последовательность (ДНК-фага λ) размером ~1 т.о., которая может быть вытеснена последовательностями, кодирующими вариабельные участки. Указанные новые шаблонные векторы также содержат новый участок рестрикции SwaI сразу за участком SrfI выше по ходу считывания. Указанный новый участок SwaI может быть полезен для переноса открытой рамки считывания антитела из pHyb-E в другие векторы экспрессии, которые также содержат участок SwaI для обеспечения клонирования, такие как векторы экспрессии CHO. Помимо универсальности альтернативных участков клонирования, указанные векторы также совместимы с существующими векторами pBOS, pTT3 и CHO.
Как показано на фиг.7, предварительные данные по трансфекции клеток COS7 показывают, что упомянутый дополнительный участок SwaI (векторы v1) не оказывает существенного влияния на уровни экспрессии адалимумаба по сравнению с конструкциями, не содержащими дополнительный участок SwaI (векторы v2).
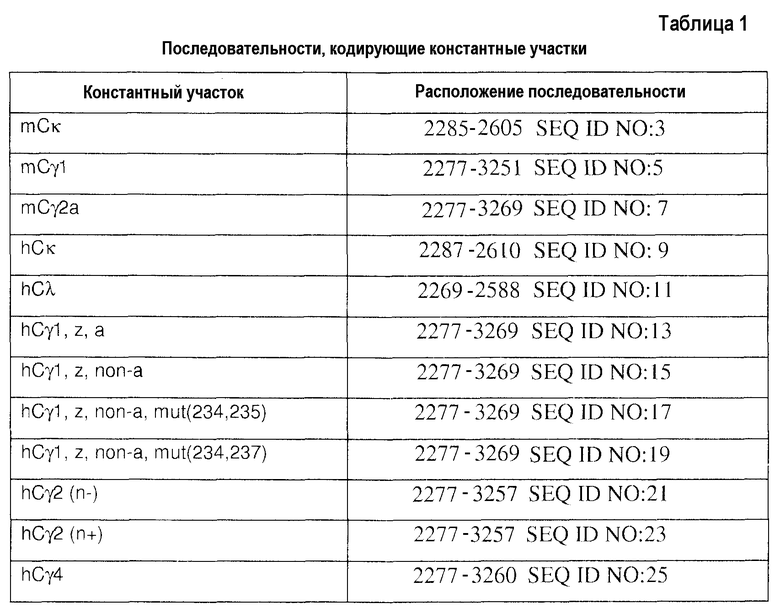

Выводы:
Эксперименты, описанные выше в примерах 1-4, демонстрируют, что векторы pHyb-C и pHyb-E могут функционировать в нескольких клеточных линиях, обеспечивая обильную экспрессию белка, уровень которой часто превышает уровни, обеспечиваемые исходными векторами pBOS и pTT3. Данная повышенная экспрессия является особенно выраженной, когда вектор pHyb-E используют для экспрессии гибридного белка mBR3-Fc, продуцируемого клетками HEK-293-6E с низким выходом. Полученные результаты показывают, что векторы pHyb-C и pHyb-E обладают значительным преимуществом при использовании в векторных технологиях по сравнению с ранее используемыми векторами.
Векторы pHyb, обозначенные как версия 1, содержат дополнительный участок SwaI выше участка рестрикции SrfI.
Векторы pHyb, обозначенные как версия 2, не содержат дополнительный участок SwaI.

Эквиваленты
Специалистам в данной области известно, или они могут установить с помощью не более чем рутинного экспериментирования, что существуют многочисленные эквиваленты описанных здесь конкретных вариантов осуществления данного изобретения. Предполагается, что такие эквиваленты входят в объем нижеследующей формулы изобретения.
Включение путем ссылки
Содержание всех цитируемых ссылок (включая литературные ссылки, патенты, патентные заявки и веб-сайты), которые могут упоминаться на протяжении данной заявки, специально включены в данное описание во всей полноте для любой цели, так же, как и цитируемые в них ссылки. Если не указано иначе, для осуществления настоящего изобретения используют традиционные методы иммунологии, молекулярной биологии, клеточной биологии, а также производства и доставки лекарственных средств, хорошо известные в данной области. Указанные методы включают, без ограничения, методы, описанные в нижеследующих публикациях.









































































































































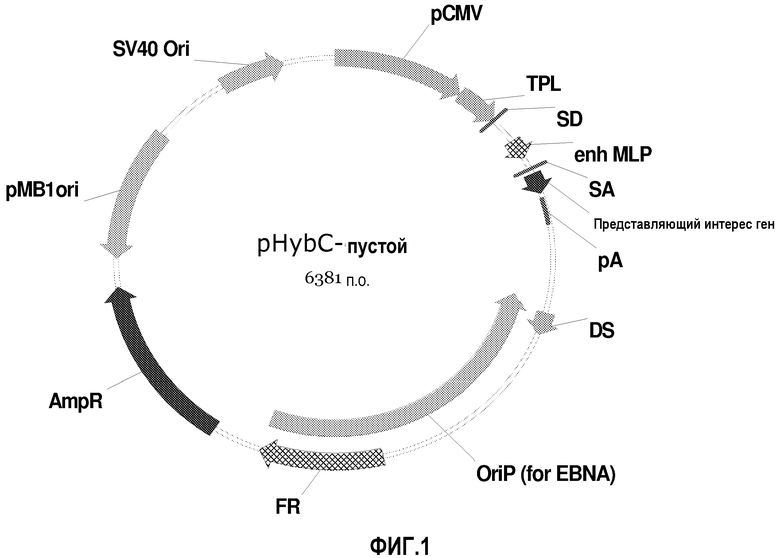
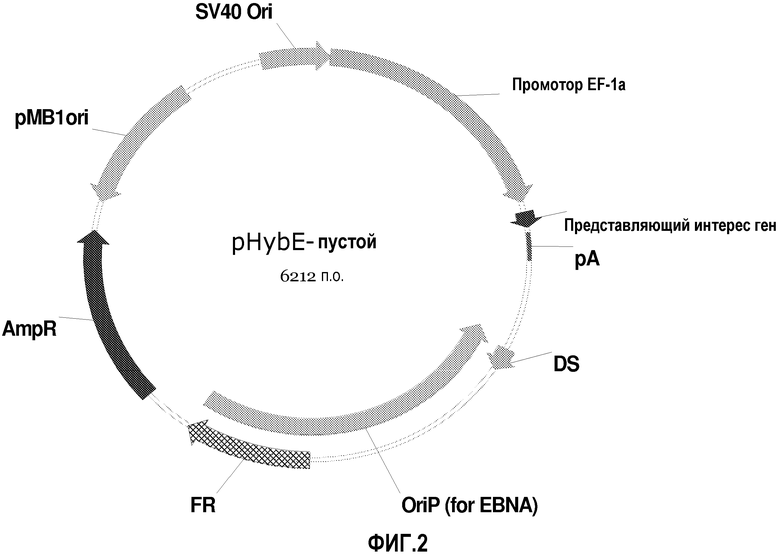
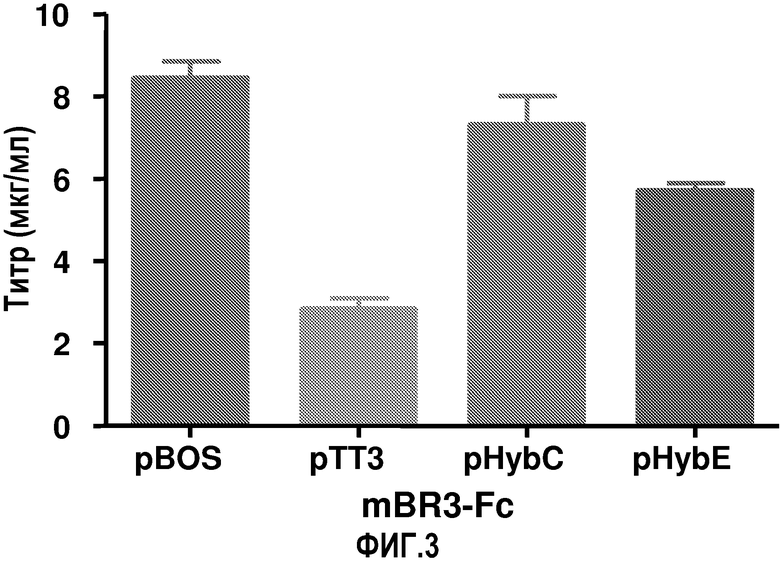
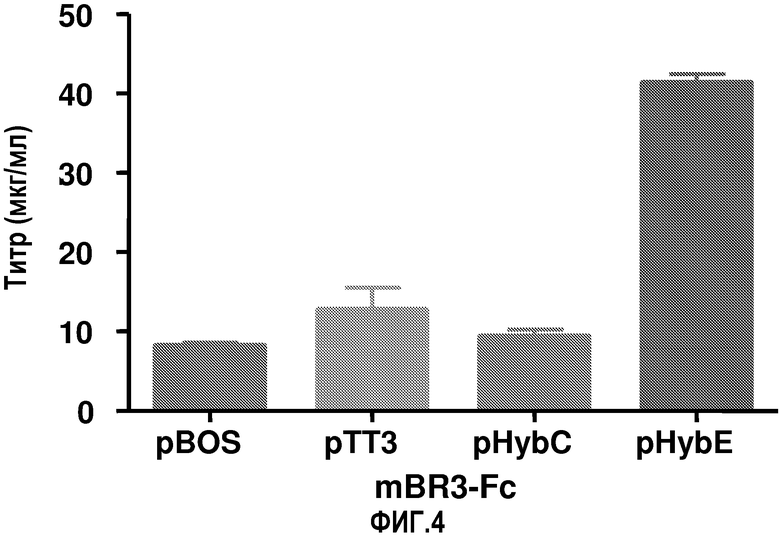
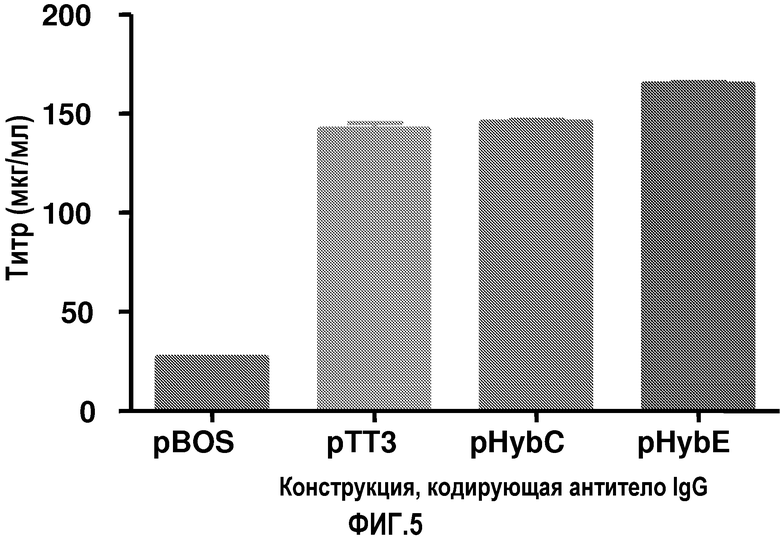
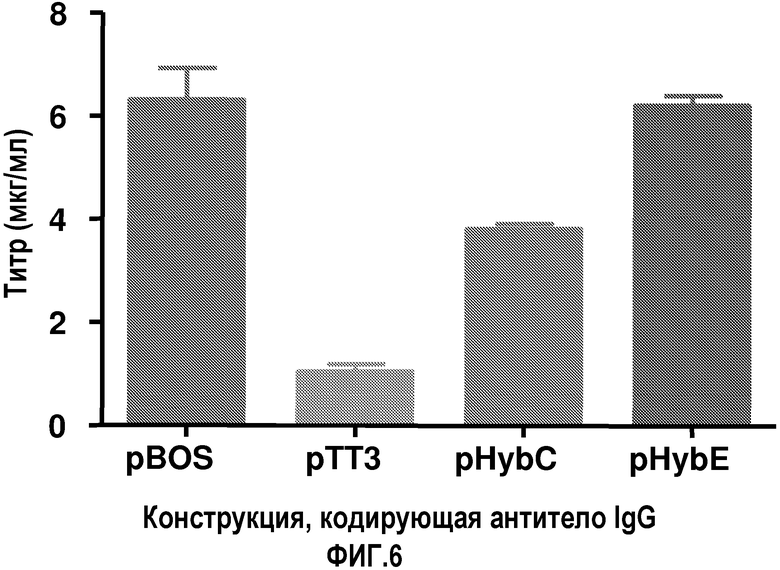
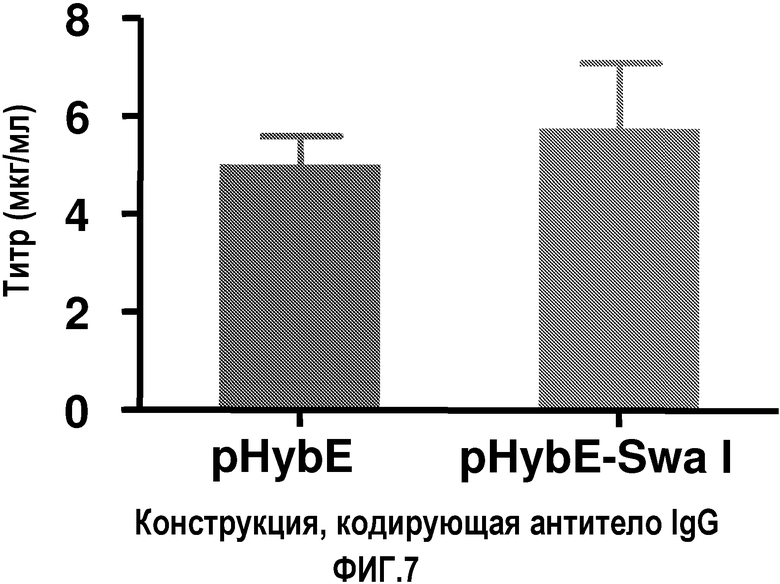
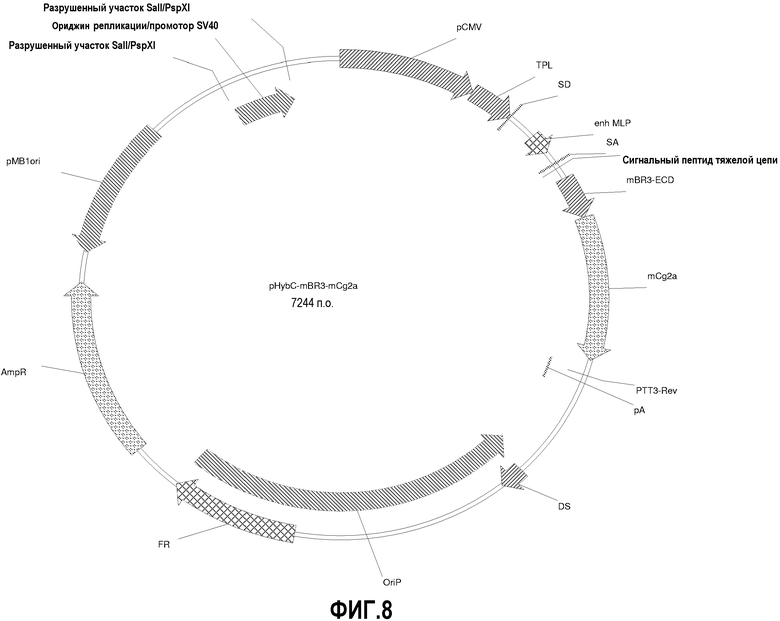
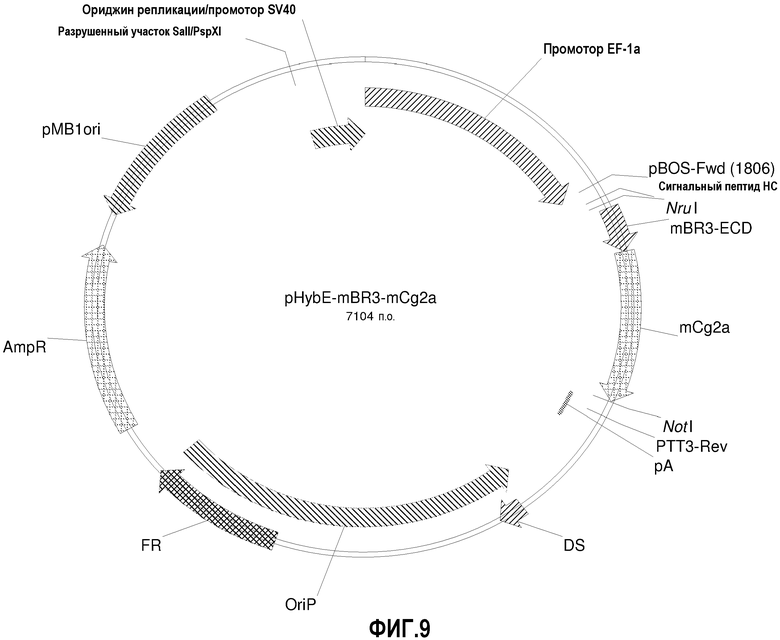
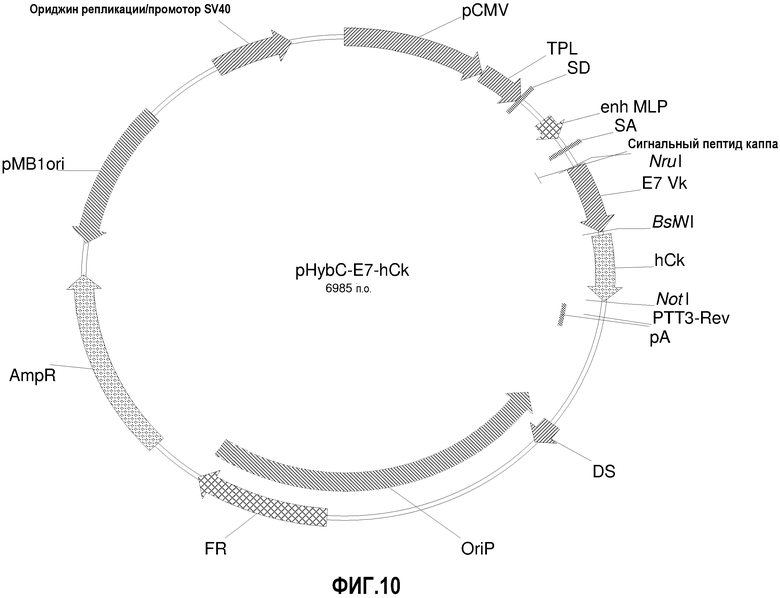
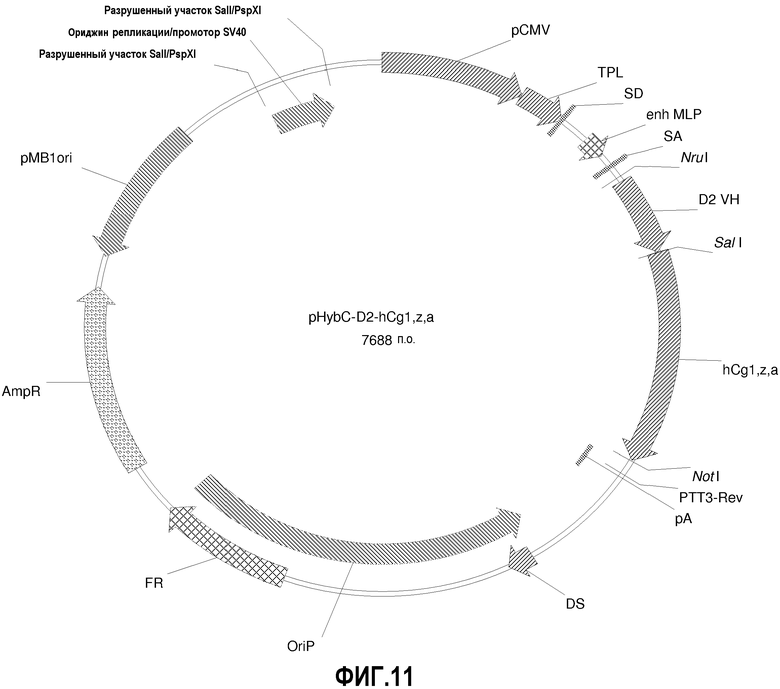
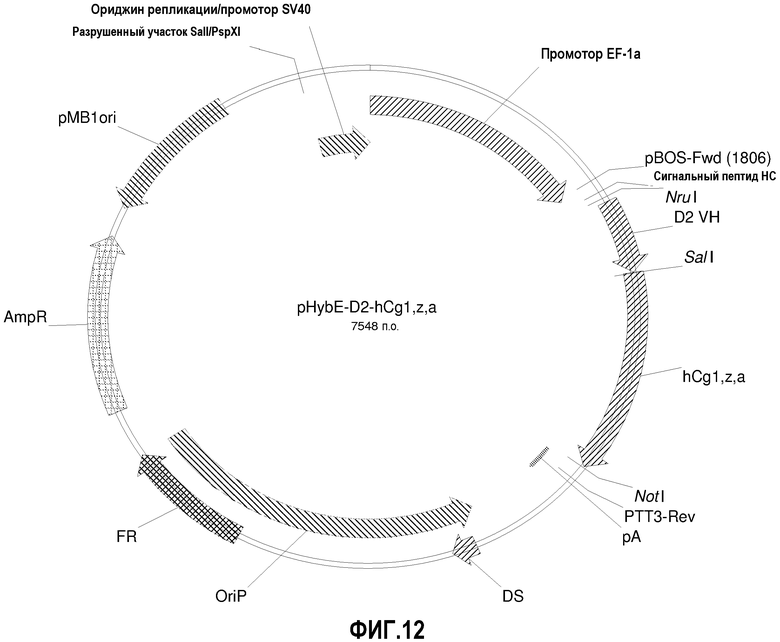
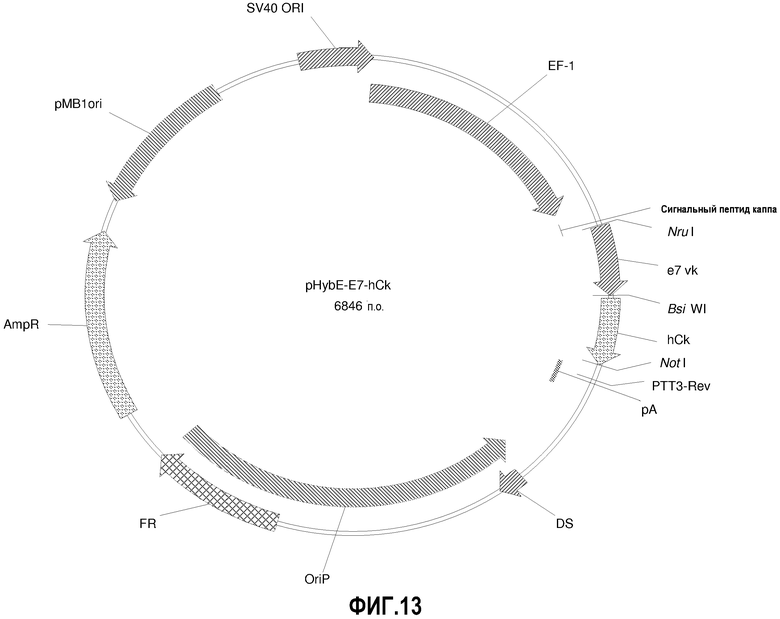
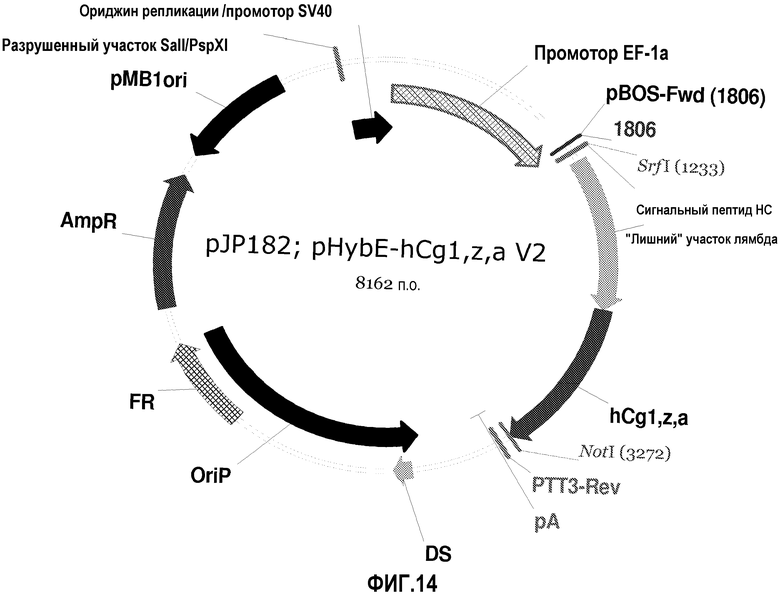
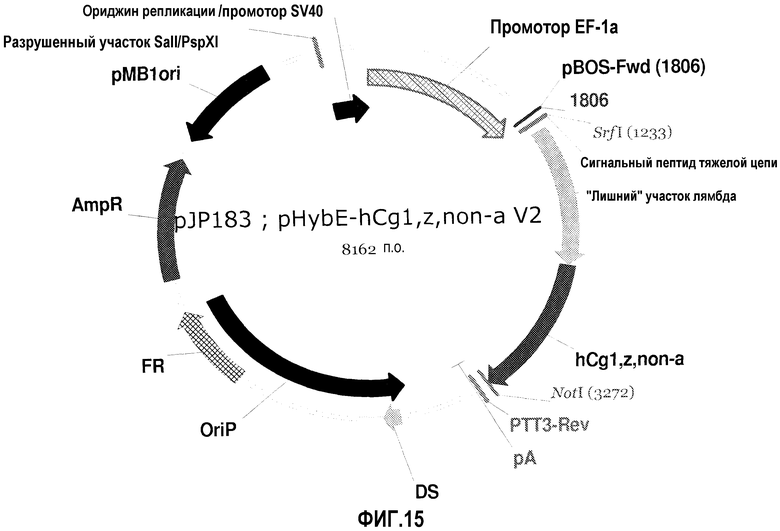
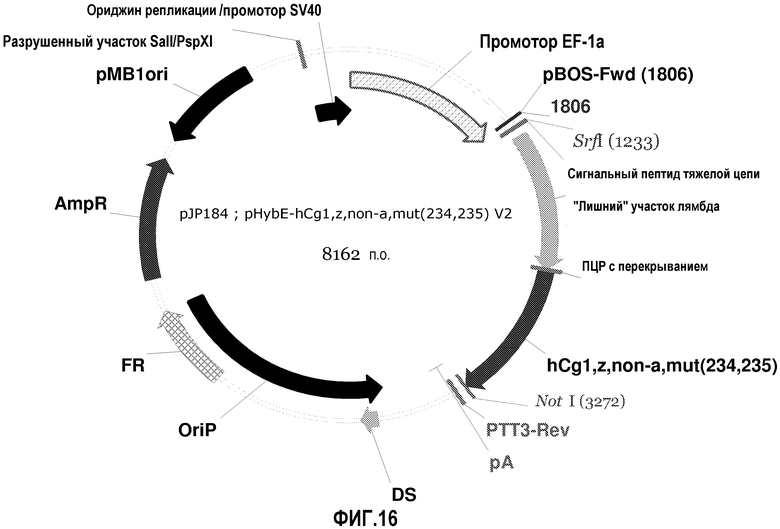
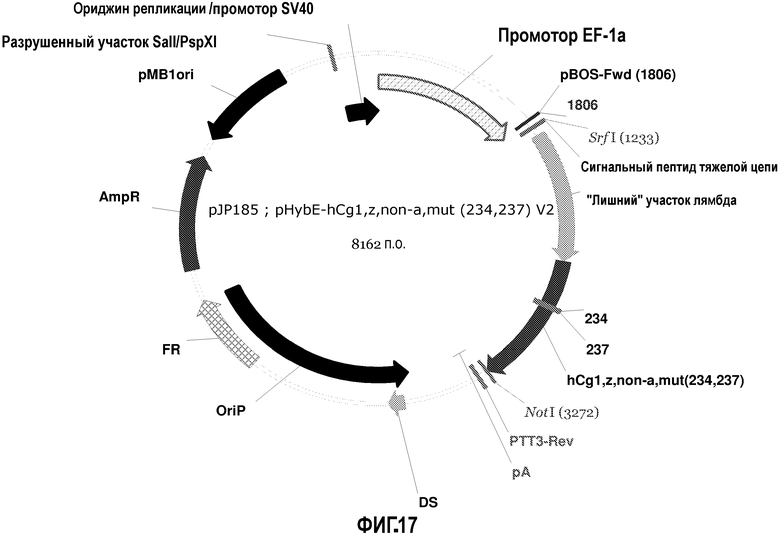
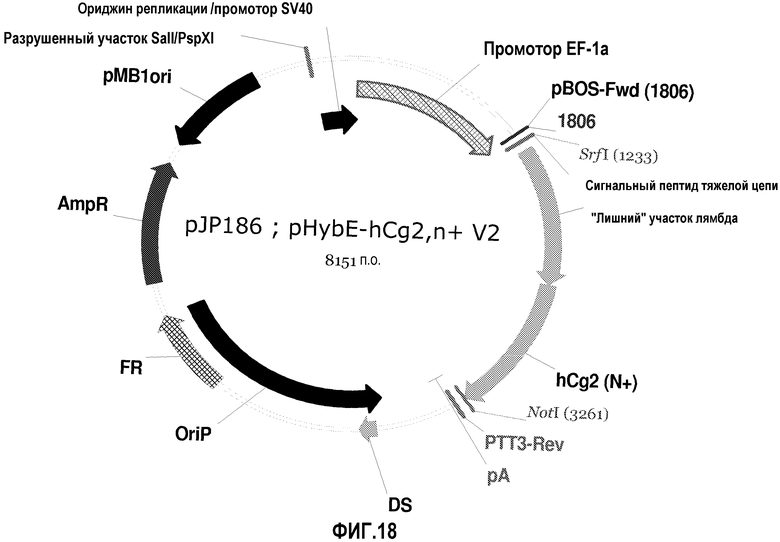
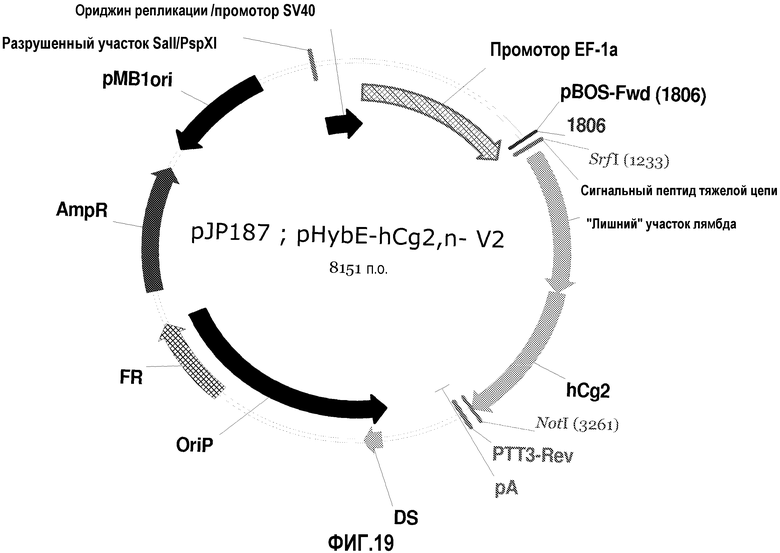
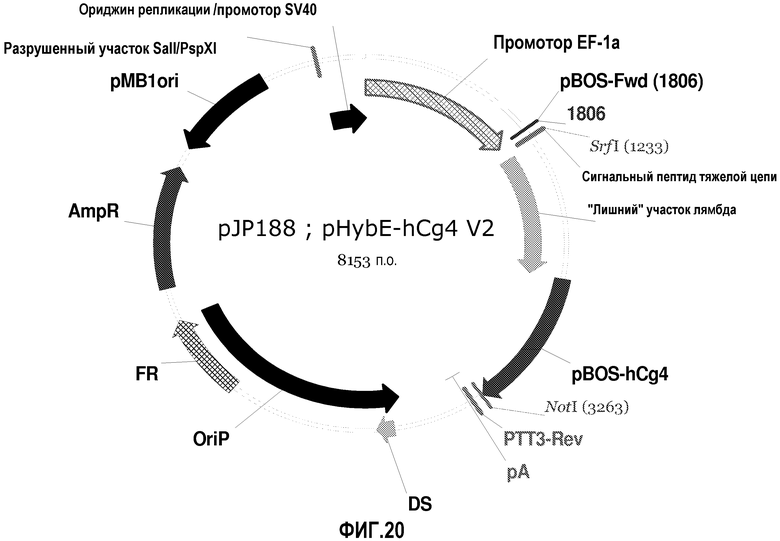
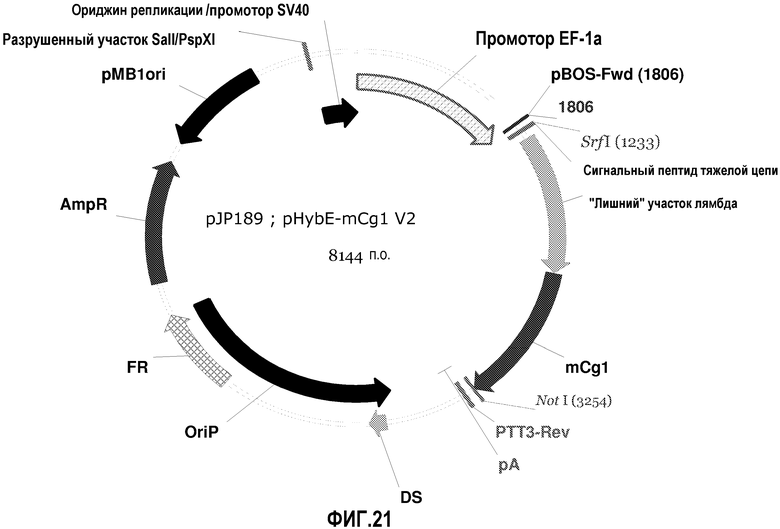
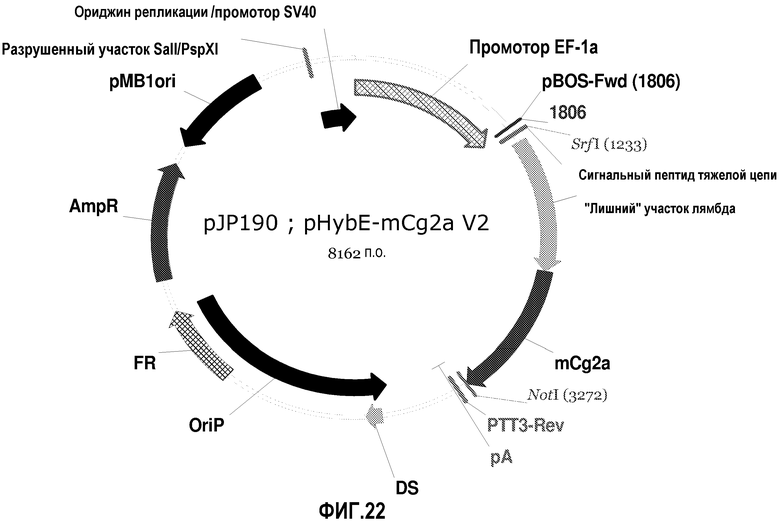
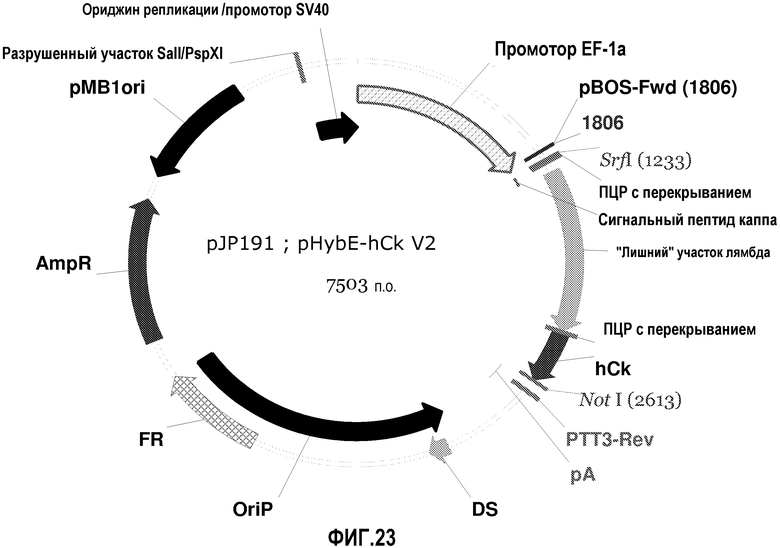
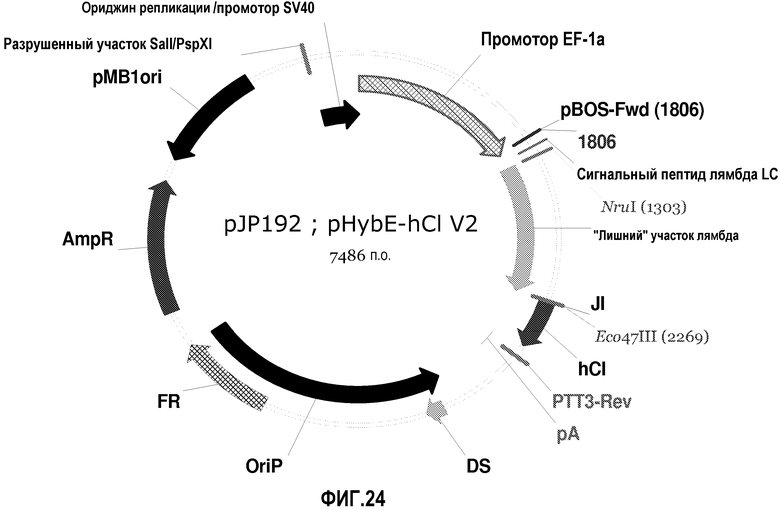
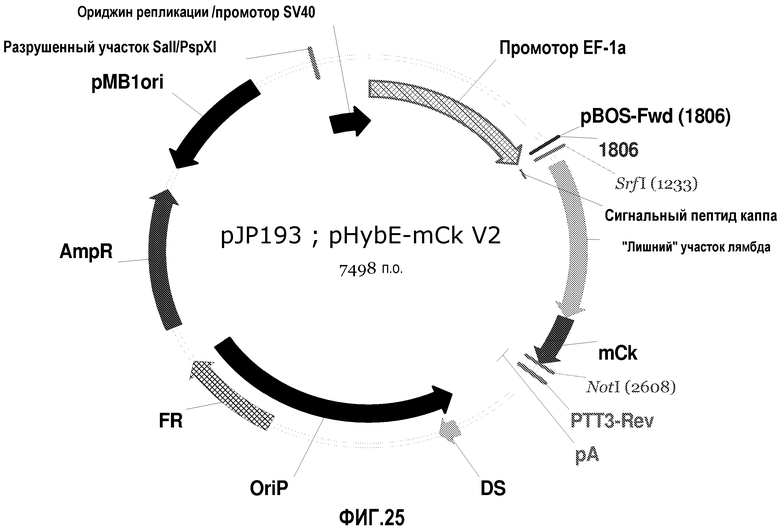
Группа изобретений относится к области биотехнологии. Вектор экспрессии содержит: (a) ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV), где ориджин репликации содержит: 1) элемент симметрии второго порядка (DS); и 2) участок дупликации (FR), который содержит участок связывания EBNA; (b) ориджин репликации SV40; (c) участок инсерции для вставки представляющего интерес гена; (d) промотор EF-1б, функционально связанный с участком инсерции; (e) сигнал поли-A; (f) бактериальный ориджин репликации; (g) селектируемый маркер; и необязательно содержащий (h) последовательность нуклеиновой кислоты, кодирующую константную область тяжелой или легкой цепи антитела, функционально связанную с участком инсерции. Причем ориджин репликации OriP связан с действующим извне фактором инициации репликации EBNA 1, который не кодируется вектором экспрессии. Использование вектора экспрессии в выделенной клетке-хозяине, наборе и способе получения рекомбинантного белка обеспечивает получение обильной экспрессии белка. 4 н. и 22 з.п. ф-лы, 25 ил., 3 табл., 4 пр.
1. Вектор экспрессии, содержащий:
(a) ориджин репликации OriP, полученный из вируса Эпштейна-Барр (EBV), где ориджин репликации содержит: 1) элемент симметрии второго порядка (DS); и 2) участок дупликации (FR), который содержит участок связывания EBNA;
(b) ориджин репликации SV40;
(c) участок инсерции для вставки представляющего интерес гена;
(d) промотор EF-1α, функционально связанный с участком инсерции;
(e) сигнал поли-A;
(f) бактериальный ориджин репликации;
(g) селектируемый маркер; и необязательно содержащий
(h) последовательность нуклеиновой кислоты, кодирующую константную область тяжелой или легкой цепи антитела, функционально связанную с участком инсерции;
где ориджин репликации OriP связан с действующим извне фактором инициации репликации EBNA 1, который не кодируется вектором экспрессии.
2. Вектор экспрессии по п.1, где представляющий интерес ген представляет собой вариабельный участок тяжелой или легкой цепи антитела.
3. Вектор экспрессии по п.2, где вариабельный участок тяжелой или легкой цепи антитела выбран из группы, состоящей из мышиного, гуманизированного, химерного и человеческого участков.
4. Вектор экспрессии по п.2, где вариабельный участок тяжелой цепи антитела представляет собой вариабельный участок тяжелой цепи антитела, выбранного из группы, состоящей из антитела против TNFα, антитела против IL-18 и антитела против IL-12.
5. Вектор экспрессии по п.2, где вариабельный участок легкой цепи антитела представляет собой вариабельный участок легкой цепи антитела, выбранного из группы, состоящей из антитела против TNFα, антитела против IL-18 и антитела против IL-12.
6. Вектор экспрессии по п.1, где константный участок тяжелой цепи антитела является мышиным или человеческим.
7. Вектор экспрессии по п.1, где константный участок тяжелой цепи антитела выбран из группы, состоящей из гамма 1, z, а; гамма 1, z, non-а; гамма 2, n+; гамма 2, n-; и гамма 4.
8. Вектор экспрессии по п.7, где константный участок тяжелой цепи антитела гамма 1, z, non-а дополнительно содержит аланиновую мутацию в положении 234 (нумерация по системе EU) константного участка тяжелой цепи.
9. Вектор экспрессии по п.8, дополнительно содержащий аланиновую мутацию в положении 235 или 237 (нумерация по системе EU) константного участка тяжелой цепи антитела.
10. Вектор экспрессии по п.1, где константный участок легкой цепи антитела представляет собой либо человеческий каппа изотип, либо человеческий лямбда изотип.
11. Вектор экспрессии по п.1, где константный участок тяжелой цепи антитела относится либо к мышиному гамма 1 изотипу, либо к мышиному гамма 2а изотипу.
12. Вектор экспрессии по п.1, где константный участок легкой цепи антитела относится к мышиному каппа изотипу.
13. Вектор экспрессии по п.1, где константный участок тяжелой цепи антитела представляет собой домен Fc.
14. Вектор экспрессии по п.1, где селектируемый маркер представляет собой ген устойчивости к ампициллину.
15. Вектор экспрессии по п.1, где промотор EF-1α является человеческим.
16. Вектор экспрессии по п.1, где промотор EF-1α содержит нуклеотиды 76-1267 последовательности SEQ ID NO: 2 или нуклеотидную последовательность, которая, по меньшей мере, на 80%, 90% или 95% идентична нуклеотидам 76-1267 последовательности SEQ ID NO: 2.
17. Вектор экспрессии по п.1, где ориджин репликации OriP содержит нуклеотидную последовательность, которая, по меньшей мере, на 80%, 90% или 95% идентична нуклеотидам 1795-3545 последовательности SEQ ID NO: 1.
18. Вектор экспрессии по п.1, где ориджин репликации SV40 содержит нуклеотиды 5834-6140 последовательности SEQ ID NO: 1 или нуклеотидную последовательность, которая, по меньшей мере, на 80%, 90% или 95% идентична нуклеотидам 5834-6140 последовательности SEQ ID NO: 1.
19. Вектор экспрессии по п.1, где вектор экспрессии содержит нуклеотидную последовательность, выбранную из группы, включающей последовательности SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32, или нуклеотидную последовательность, которая, по меньшей мере, на 80%, 90% или 95% идентична последовательности, выбранной из группы, включающей последовательности SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32.
20. Вектор экспрессии по п.1, где вектор экспрессии содержит нуклеотидную последовательность SEQ ID NO: 2.
21. Вектор экспрессии по п.1, дополнительно содержащий нуклеотидную последовательность, кодирующую сигнальный пептид.
22. Набор для экспрессии рекомбинантного белка в культуре клеток млекопитающего, содержащий вектор по п.1.
23. Выделенная клетка-хозяин млекопитающего для экспрессии рекомбинантного белка в культуре клеток млекопитающего, содержащая вектор по п.1.
24. Выделенная клетка-хозяин млекопитающего по п.23, которая представляет собой клетку COS или эмбриональную клетку почки человека (HEK).
25. Выделенная клетка-хозяин млекопитающего по п.24, которая представляет собой клетку COS7 или клетку HEK-293-6E.
26. Способ получения рекомбинантного белка, включающий введение вектора экспрессии по п.1 в выделенную клетку-хозяина млекопитающего, культивирование клетки-хозяина млекопитающего в подходящих условиях, обеспечивающих экспрессию белка, и выделение белка.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| DUBRIDGE et al | |||
| Analysis of Mutation in Human Cells by Using an Epstein-Barr Virus Shuttle System | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| WAKABAYASHI-ITO N et al, Characterization of the regulatory elements in the promoter of the human elongation factor-1 alpha gene, J Biol Chem, 1994, abstract. | |||
Авторы
Даты
2013-12-27—Публикация
2009-01-15—Подача