Предпосылки создания изобретения
Область, к которой относится изобретение
Настоящее изобретение относится к соединениям двойного действия и комбинациям блокаторов рецептора ангиотензина и ингибиторов нейтральной эндопептидазы, прежде всего, к молекулам двойного действия, в которых блокатор рецептора ангиотензина и ингибитор нейтральной эндопептидазы связаны нековалентной связью, или к супрамолекулярным комплексам блокаторов рецептора ангиотензина и ингибиторов нейтральной эндопептидазы, изобретение также относится к сшитым пролекарствам, таким как смешанные соли или совместные кристаллы, а также к фармацевтическим комбинациям, содержащим указанное соединение двойного действия или комбинацию, изобретение относится к способам получения указанных соединений двойного действия и способам лечения субъекта, с использованием указанного соединения двойного действия или комбинации. Прежде всего, настоящее изобретение относится к соединению двойного действия или супрамолекулярному комплексу двух активных агентов, которые в составе одной молекулы характеризуются одинаковым или различным механизмом действия.
Предшествующий уровень техники
Ангиотензин II является гормоном, который вызывает сужение кровеносных сосудов, что в свою очередь может приводить к повышению кровяного давления и нагрузке на сердце. Известно, что ангиотензин II взаимодействует со специфическими рецепторами на поверхности клеток-мишеней. В настоящее время идентифицированы два подтипа рецепторов ангиотензина II, подтипы AT1 и АТ2. На современном этапе большое внимание уделялось поиску соединений, связывающихся с рецептором AT1. В настоящее время известно, что блокаторы рецептора ангиотензина (ARB, антагонисты ангиотензина II) препятствуют взаимодействию ангиотензина II с его рецепторами, расположенными па поверхности кровеносных сосудов, и тем самым способствуют снижению кровяного давления. Так как указанные антагонисты ингибируют рецептор AT1, их можно использовать в качестве антигипертензивных средств или для лечения застойной сердечной недостаточности и др. заболеваний.
Нейтральная эндопептидаза (ЕС 3.4.24.11, энкефалиназа, атриопептидаза, NEP) является цинксодержащей металлопротеазой, расщепляющей множество пептидных субстратов по N-концевым гидрофобным остаткам (см. статью Pharmacol Rev, т.45, стр.87 (1993)). Субстратами указанного фермента являются, без ограничения перечисленным, предсердный натрийуретический пептид (ANP, который также называют ANF), мозговой натрийуретический пептид (BNP), метионин- и лейцин-энкефалин, брадикинин, нейрокинин А, эндотелии-1 и вещество Р. ANP является высоко эффективным сосудорасширяющим и натрийуретическим агентом (см. статью J. Hypertens, т.19, стр.1923 (2001)). Вливание ANP нормальным субъектам приводит к воспроизводимому, значительному увеличенному натрийурезу и диурезу, включая увеличение фракционной экскреции натрия, степени мочеотделения и уровня гломерулярной фильтрации (см. статью J. Clin. Pharmacol, т.27, стр.927 (1987)). Однако ANP характеризуется коротким периодом полураспада в кровотоке, и установлено, что NEP в составе мембраны коркового вещества почек является основным ферментом, который расщепляет указанный пептид (см. статью Peptides, т.9, стр.173 (1988)). Таким образом, ингибиторы NEP (ингибиторы нейтральной эндопептидазы, NEPi) должны повышать уровень ANP в плазме крови, и следовательно, проявляют натрийуретическое и диуретическое действие.
В то время как соединения, такие как блокаторы рецептора ангиотензина и ингибиторы нейтральной эндопептидазы, можно использовать для контроля гипертензии, артериальная первичная гипертензия является полигенным заболеванием и не всегда поддается лечению в режиме монотерапии. В 2000 г в экономически развитых странах высокое кровяное давление зарегистрировано у более 333 млн взрослых, а в США у более 65 млн взрослых пациентов (у 1 из 3 взрослых пациентов) (см. Lancet, т.365, стр.217 (2005) и Hypertension, т.44, стр.398 (2004)). Продолжительные и неконтролируемые случаи сосудистой гипертензии, прежде всего, приводят к множеству патологических изменений в органах-мишенях, таких как сердце и почки. Продолжительная гипертенизия может также повысить риск развития инсульта. Следовательно, существует острая необходимость в оценке эффективности антигипертензивной терапии, обследовании дополнительных параметров сердечно-сосудистой системы, кроме снижения кровяного давления, с целью разработки способов более эффективной комбинированной терапии.
Природа сосудистой гипертензии является многофакторной. В некоторых случаях необходимо комбинировать лекарственных средства с различным механизмом действия. Однако, следует учитывать, что любая комбинация лекарственных средств с различным механизмом действия не всегда приводит к благоприятному эффекту. Следовательно, существует необходимость в разработке эффективных способов комбинированной терапии без отрицательных побочных действий.
Краткое описание сущности настоящего изобретения
В первом объекте настоящего изобретения предлагается соединение двойного действия, такое как супрамолекулярный комплекс, включающий:
(a) антагонист рецептора ангиотензина,
(b) ингибитор нейтральной эндопептидазы (NEPi), и необязательно
(c) фармацевтически приемлемый катион.
Настоящее изобретение также относится к соединению двойного действия, такому как супрамолекулярный комплекс, который получают по методике, включающей:
(1) растворение антагониста рецептора ангиотензина и ингибитора нейтральной эндопептидазы (NEPi) в пригодном растворителе;
(2) растворение основания Cat, где Cat означает катион, в пригодном растворителе;
(3) смешивание растворов, полученных на стадиях (1) и (2);
(4) осаждение и высушивание твердого вещества с получением соединения двойного действия;
или альтернативно соединение двойного действия получают при замене растворителя (растворителей), использованных на стадиях (1) и (2), по методике, включающей:
(4a) упаривание полученного раствора досуха;
(5a) повторное растворение твердого вещества в пригодном растворителе;
(6a) осаждение и высушивание твердого вещества с получением соединения двойного действия.
Настоящее изобретение также относится к сшитым пролекарствам, включающим:
(a) антагонист рецептора ангиотензина или его фармацевтически приемлемую соль; и
(b) NEPi или его фармацевтически приемлемую соль, где антагонист рецептора ангиотензина или его фармацевтически приемлемая соль и NEPi или его фармацевтически приемлемая соль сшиты через связующую группу.
Настоящее изобретение также относится к комбинации, включающей:
(a) фармацевтически приемлемую соль антагониста рецептора ангиотензина; и
(b) фармацевтически приемлемую соль ингибитора нейтральной эндопептидазы (NEPi),
где фармацевтически приемлемая соль антагониста рецептора ангиотензина и NEPi относятся к одному типу солей, причем указанные соли выбраны из солей Na, K или NH4.
В предпочтительных вариантах осуществления изобретения, антагонист рецептора ангиотензина и NEPi содержит кислотные группы, позволяющие получить соединение двойного действия, такое как супрамолекулярный комплекс по настоящему изобретению.
Предпочтительный антагонист рецептора ангиотензина выбран из группы, включающей валсартан, лозартан, ирбесартан, телмисартан, эпросартан, кандесартан, олмесартан, саприсартан, тазосартан, элисартан и их комбинации.
В предпочтительных вариантах осуществления изобретения, NEPi выбран из группы, включающей SQ 28603, N-[N-[1S)-карбоксил-3-фенилпропил]-(S)-фенилаланил]-(S)-изосерин, N-[N-[((1S)-карбокси-2-фенил)этил]-(S)-фенилаланил]-β-аланин, N-[2(S)-меркаптометил-3-(2-метилфенил)пропионил]-метионин, (цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]-карбонил]амино]циклогексанкарбоновую кислоту), тиорфан, ретро-тиорфан, фосфорамидон, SQ 29072, этиловый эфир N-(3-карбокси-1-оксопропил)-(4S)-пара-фенилфенилметил)-4-амино-2R-метилмасляной кислоты, (S)-цис-4-[1-[2-(5-инданилоксикарбонил)-3-(2-метоксиэтокси)пропил]-1-циклопентан-карбоксамидо]-1-циклогексанкарбоновую кислоту, 3-(1-[6-эндогидроксиметил-бицикло[2,2,1]гептан-2-эксо-карбамоил]циклопентил)-2-(2-метоксиэтил)пропионовую кислоту, метиловый эфир N-(1-(3-(N-трет-бутоксикарбонил-(S)-пролиламино)-2(S)-трет-бутоксикарбонилпропил)-циклопентанкарбонил)-O-бензил-(S)-серина, 4-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]бензойную кислоту, 3-[1-(цис-4-карбоксикарбонил-цис-3-бутилциклогексилретро-1-карбамоил)циклопентил]-2S-(2-метоксиэтоксиметил)-пропионовую кислоту, N-((2S)-2-(4-бифенилметил)-4-карбокси-5-феноксивалерил)глицин, N-(1-(N-гидроксикарбамоилметил)-1-циклопентан-карбонил)-L-фенилаланин, (S)-(2-бифенил-4-ил)-1-(1Н-тетразол-5-ил)этиламино)метилфосфоновую кислоту, (S)-5-(N-(2-(фосфолометиламино)-3-(4-бифенил)пропионил)-2-аминоэтил)тетразол, β-аланин, 3-[1,1'-бифенил]-4-ил-N-[дифеноксифосфинил)метил]-L-аланил, N-(2-карбокси-4-тиенил)-3-меркапто-2-бензилпропанамид, 2-(2-меркаптометил-3-фенилпропионамидо)тиазол-4-илкарбоновую кислоту, (L)-(1-((2,2-диметил-1,3-диоксолан-4-ил)метокси)-карбонил)-2-фенилэтил)-L-фенилаланил)-β-аланин, N-[N-[(L)-[1-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил]-2-фенилэтил]-L-фенилаланил]-(R)-аланин, N-[N-[(L)-1-карбокси-2-фенилэтил]-L-фенилаланил]-(R)-аланин, этиловый эфир N-[2-ацетилтиометил-3-(2)метилфенил)пропионил]метионина, N-[2-меркаптометил-3-(2-метилфенил)пропионил]метионин, N-[2(S)-меркаптометил-3-(2-метилфенил)пропаноил]-(S)-изосерин, N-(S)-[3-меркапто-2-(2-метилфенил)пропионил]-(S)-2-метокси-(R)-аланин, N-[1-[[1(S)-бензилоксикарбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, N-[1-[[1(S)-карбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)метионин, N-(3-фенил-2-(меркаптометил)пропионил)-(S)-4-(метилмеркапто)метионин, N-[2-ацетилтиометил-3-фенилпропионил]-3-аминобензойную кислоту, N-[2-меркаптометил-3-фенилпропионил]-3-аминобензойную кислоту, N-[1-(2-карбокси-4-фенилбутил)-циклопентанкарбонил]-(S)-изосерин, этиловый эфир N-[1-(ацетилтиометил)циклопентанкарбонил]-(S)метионина, 3(S)-[2-(ацетилтиометил)-3-фенилпропионил]амино-ε-капролактам, этиловый эфир N-(2-ацетилтиометил-3-(2-метилфенил)пропионил)метионина и их комбинации. Предпочтительным соединением двойного действия или комбинацией, прежде всего, супрамолекулярным комплексом, является смешанная соль или совместный кристалл. Предпочтительным сшитым пролекарством также является смешанная соль или совместный кристалл.
Вторым объектом настоящего изобретения является фармацевтическая композиция, которая включает (a) соединение двойного действия или комбинацию, описанные выше, такие как комплекс, описанный выше; и (b) по крайней мере одну фармацевтически приемлемую добавку.
Настоящее изобретение также относится к фармацевтическим композициям, включающим сшитое пролекарство, которые включают (a) антагонист рецептора ангиотензина или его фармацевтически приемлемую соль; (b) NEPi или его фармацевтически приемлемую соль, где антагонист рецептора ангиотензина или его фармацевтически приемлемая соль и NEPi или его фармацевтически приемлемая соль сшиты через связующую группу; и (c) по крайней мере одну фармацевтически приемлемую добавку.
В третьем объекте настоящего изобретения предлагается способ получения соединения двойного действия, прежде всего, супрамолекулярного комплекса, который включает:
(a) антагонист рецептора ангиотензина;
(b) ингибитор нейтральной эндопептидазы (NEPi), и необязательно
(c) фармацевтически приемлемый катион, который выбран из группы, включающей Na, K и NH4; и указанный способ заключается в том, что
(1) антагонист рецептора ангиотензина и ингибитор нейтральной эндопептидазы (NEPi) растворяют в пригодном растворителе,
(2) основание Cat, где Cat означает катион, растворяют в пригодном растворителе,
(3) растворы, полученные на стадии (1) и (2), объединяют,
(4) твердое вещество осаждают и высушивают, при этом получают соединение двойного действия,
или альтернативно соединение двойного действия получают при замене растворителя (растворителей), использованных на стадиях (1) и (2), по методике, включающей:
(4a) упаривание полученного раствора досуха,
(5a) повторное растворение твердого вещества в пригодном растворителе,
(6a) осаждение и высушивание твердого вещества, при этом получают соединение двойного действия.
Настоящее изобретение также относится к способу получения сшитого пролекарства, содержащего
(a) антагонист рецептора ангиотензина или его фармацевтически приемлемую соль;
(b) NEPi или его фармацевтически приемлемую соль, где антагонист рецептора ангиотензина или его фармацевтически приемлемая соль и NEPi или его фармацевтически приемлемая соль сшиты через связующую группу;
включающий добавление сшивающего агента и растворителя в смесь антагониста рецептора ангиотензина и NEPi; и
(d) выделения сшитого пролекарства.
В четвертом объекте настоящего изобретения предлагается способ лечения или профилактики заболевания или состояния, такого как гипертензия, сердечная недостаточность (острая и хроническая), застойная сердечная недостаточность, дисфункция левого желудочка и гипертрофическая кардиомиопатия, диабетическая кардиомиопатия, суправентрикулярная и желудочковая аритмия, мерцательная аритмия, трепетание предсердий, неудачное ремодулирование сосудов, инфаркт миокарда и осложнения после него, атеросклероз, стенокардия (нестабильная или стабильная), почечная недостаточность (диабетическая и не диабетическая), сердечная недостаточность, грудная жаба, диабет, вторичный альдостеронизм, первичная и вторичная легочная гипертензия, состояния, связанные с почечной недостаточностью, такие как диабетическая нефропатия, гломерулонефрит, склеродермия, гломерулосклероз, протепнурия при первичном заболевании почек, а также реноваскулярная гипертензия, диабетическая ретинопатия, другие сосудистые нарушения, такое как мигрень, заболевание периферических сосудов, болезнь Рейно, люминальная гиперплазия, нарушение познавательной способности (например, болезнь Альцгеймера), глаукома и инсульт, и указанный способ заключается в том, что субъекту, нуждающемуся в данном лечении, вводят соединение двойного действия или комбинацию, прежде всего супрамолекулярный комплекс, указанные выше, или сшитое пролекарство, указанное выше, предпочтительно в виде комплекса.
На фиг.1 представлена элементарная ячейка супрамолекулярного комплекса полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], содержащая две асимметрических ячейки, где серым цветом обозначен атом углерода, синим цветом обозначен атом азота, красным цветом обозначен атом кислорода, фиолетовым цветом обозначен атом натрия.
Подробное описание вариантов осуществления настоящего изобретения
Настоящее изобретение относится к соединению двойного действия или комбинации, прежде всего к супрамолекулярному комплексу или сшитому пролекарству, или прежде всего к супрамолекулярному комплексу двух активных агентов, характеризующихся различным механизмом действия, а именно к комплексу антагониста рецептора ангиотензина и ингибитора нейтральной эндопептидазы, которые образуют уникальный молекулярный комплекс, пригодный для лечения пациентов, страдающих различными сердечно-сосудистыми заболеваниями и/или заболеваниями почек.
В одном варианте осуществления изобретения предлагается физическая комбинация, которая включает:
(a) фармацевтически приемлемую соль антагониста рецептора ангиотензина; и
(b) фармацевтически приемлемую соль ингибитора нейтральной эндопептидазы (NEPi),
где фармацевтически приемлемая соль антагониста рецептора ангиотензина и NEPi относятся к одному типу солей, причем указанные соли выбраны из солей Na, K или NH4.
Более подробно, в предпочтительном варианте при комбинировании двух активных агентов образуется одно соединение двойного действия, прежде всего супрамолекулярный комплекс, причем образующиеся новая молекула или супрамолекулярный комплекс характеризуются свойствами, значительно отличающимися от свойств физической комбинации, описанной выше.
Таким образом, настоящее изобретение относится к соединению двойного действия, прежде всего супрамолекулярному комплексу, который включает:
(a) антагонист рецептора ангиотензина;
(b) ингибитор нейтральной эндопептидазы (NEPi); и
(c) фармацевтически приемлемый катион, который предпочтительно выбран из группы, включающей Na, K и NH4.
Настоящее изобретение также относится к соединению двойного действия, прежде всего супрамолекулярному комплексу, который получают по методике, включающей:
(1) растворение антагониста рецептора ангиотензина и ингибитора нейтральной эндопептидазы (NEPi) в пригодном растворителе;
(2) растворение основания Cat, такого как (Cat)OH, (Cat)2CO3, (Cat)HCO3 в пригодном растворителе, где Cat означает катион, который предпочтительно выбирают из группы, включающей Na, K и NH4;
(3) объединение растворов, полученных на стадии (1) и (2);
(4) осаждение и высушивание твердого вещества с получением соединения двойного действия,
или альтернативно соединение двойного действия получают при замене растворителя (растворителей), использованных на стадиях (1) и (2), по методике, включающей:
(4a) упариванне полученного раствора досуха;
(5a) повторное растворение твердого вещества в пригодном растворителе;
(6a) осаждение и высушивание твердого вещества с получением соединения двойного действия.
Настоящее изобретение также относится к сшитым пролекарствам, которые включают:
(a) антагонист рецептора ангиотензина или его фармацевтически приемлемую соль; и
(b) NEPi или его фармацевтически приемлемую соль;
где антагонист рецептора ангиотензина или его фармацевтически приемлемая соль и NEPi или его фармацевтически приемлемая соль сшиты через связующую группу.
Каждый из двух компонентов присоединен к связующей группе, при этом получают сшитое пролекарство. Предпочтительным является сшитое пролекарство, которое характеризуется высокой степенью чистоты, термин, "высокая степень чистоты", использованный в данном контексте, означает что чистота соединения составляет по крайней мере 90%, более предпочтительно по крайней мере 95%, и наиболее предпочтительно по крайней мере 98%.
В одном предпочтительном варианте осуществления настоящего изобретения, сшитое пролекарство получают в виде супрамолекулярного комплекса, в котором два компонента присоединены к связующей группе.
Термин "соединение двойного действия", использованный в данном контексте, означает что два соединения в составе одного соединения характеризуются двумя различными механизмами действия, одно из которых блокирует рецептор агниотензина (фрагмент молекулы ARB), а другое ингибирует нейтральную эндопептидазу (фрагмент молекулы NEPi).
Термин "соединение", использованный в данном контексте, означает химическое соединение, включающее два фармацевтически активных агента, связанных ковалентной связью (фрагмент молекулы ARB и молекулы NEPi) и нековалентной связью между двумя фармацевтически активными агентами (фрагмент молекулы ARB и фрагмент молекулы NEPi). Обычно между двумя фармацевтически активными агентами (молекулярные фрагменты ARB и NEPi) образуются водородные связи. При взаимодействии молекулярных фрагментов ARB и NEPi с катионом могут образовываться ионные связи с одним или обоими фармацевтически активными агентами. В соединении образуются также другие типы связей, такие как вандерваальсовы связи. В качестве примера соединение двойного действия по настоящему изобретению можно представить в виде формулы
(ARB)-(L)m-(NEPi),
где L означает связующую группу, такую как катион или нековалентную связь, a m равно целому числу от 1 или более. Другими словами, между молекулами ARB и NEPi могут образовываться нековалентные связи, такие как водородные связи. В другом варианте или дополнительно, указанные молекулы можно присоединять через связующую группу, такую как катион.
В другом варианте изобретения предлагается соединение двойного действия в форме сшитого пролекарства, где два фармацевтически активных агента. ARB и NEPi, сшиты через связующую группу, такую как катион, с получением пролекарства указанных агентов, из которого после перорального введения и абсорбции высвобождаются указанные агенты.
В предпочтительном варианте осуществления изобретения, соединением двойного действия является комплекс, прежде всего супрамолекулярный комплекс.
Термин "супрамолекулярный комплекс", использованный в данном контексте, означает взаимодействие двух фармацевтически активных агентов, катионов и любого другого компонента, такого как растворитель, прежде всего воды, в результате которого образуются нековалентные межмолекулярные связи. В результате указанного взаимодействия происходит ассоциация указанных компонентов и образуется супрамолекулярный комплекс, отличающийся по свойствам от их физической смеси.
Супрамолекулярные комплексы формируются с образованием любых нековалентных межмолекулярных связей, известных в данной области техники, таких как водородная связь, вандерваальсовы и π-π взаимодействия, могут также образовываться ионные связи. Предпочтительно, комплекс образуется за счет ионной связи, и дополнительно за счет образования водородных связей. Предпочтительно супрамолекулярный комплекс существует в твердом состоянии, но также и в жидкой среде. В предпочтительном варианте осуществления изобретения предлагается комплекс в кристаллической форме, предпочтительно в виде смешанного кристалла или совместного кристалла.
Обычно соединение двойного действия, прежде всего супрамолекулярный комплекс, характеризуется свойствами, такими как tпл., ИК-спектр и т.п., которые отличаются от свойств их физической смеси.
Предпочтительно, в соединении двойного действия, прежде всего в супрамолекулярном комплексе, между двумя фармацевтически активными агентами и любым растворителем (если присутствует), предпочтительно водой, образуется сеть нековалентных связей, прежде всего водородных связей. Кроме того, предпочтительно в соединении двойного действия, прежде всего в супрамолекулярном комплексе, между двумя фармацевтически активными агентами, катионом и любым растворителем (если присутствует), предпочтительно водой, образуется сеть нековалентных связей, прежде всего, ионных и водородных связей. Катион предпочтительно образует координационные связи с несколькими лигандами, содержащими кислород, и тем самым связывает указанные кислород-содержащие лиганды. Кислород-содержащими лигандами являются карбонильные и карбоксильные группы в составе двух фармацевтически активных агентов, а также предпочтительно любой растворитель (если используют), предпочтительно вода.
Соединение двойного действия содержит молекулярный фрагмент антагониста рецептора ангиотензина, то есть при получении соединения двойного действия используют молекулярный фрагмент антагониста рецептора ангиотензина. Антагонист рецептора ангиотензина является частью соединения и присоединен к ингибитору NEP напрямую или косвенно за счет нековалентных связей. Для простоты изложения термин "антагонист рецептора ангиотензина" в данном контексте используют для описания указанного фрагмента соединения. Пригодные антагонисты рецептора ангиотензина (ARB) по настоящему изобретению включают, без ограничения перечисленным, валсартан, лозартан, ирбесартан, телмисартан, эпросартан, кандесартан, олмесартан, саприсартан, тазосартан, элисартан, соединение Е-1477 формулы
соединение SC-52458 формулы
соединение ZD-8731 формулы
Пригодные антагонисты рецептора ангиотензина II также включают, без ограничения перечисленным, ацетат саралазина, кандесартан цилексетил, CGP-63170, EMD-66397, KT3-671, LR-B/081, валсартан, А-81282, BIBR-363, BIBS-222, BMS-184698, кандесартан, CV-11194, EXP-3174, KW-3433, L-161177, L-162154, LR-B/057, LY-235656, PD-150304, U-96849, U-97018, UP-275-22, WAY-126227, WK-1492.2K, YM-31472, калиевую соль лозартана, Е-4177, HMD-73495, эпросартан, HN-65021, ирбесартан, L-159282, ME-3221, SL-91.0102, тазосартан, телмисартан, UP-269-6, YM-358, CGP-49870, GA-0056, L-159689, L-162234, L-162441, L-163007, PD-123177, A-81988, BMS-180560, CGP-38560A, CGP-48369, DA-2079, DE-3489, DuP-167, EXP-063, EXP-6155, EXP-6803, EXP-7711, EXP-9270, FK-739, HR-720, ICI-D6888, ICI-D7155, ICI-D8731, изотеолин, KRI-1177, L-158809, L-158978, L-159874, LR B087, LY-285434, LY-302289, LY-315995, RG-13647, RWJ-38970, RWJ-46458, S-8307, S-8308, саприсартан, саралазин, сармезин, WK-1360, X-6803, ZD-6888, ZD-7155, ZD-8731, BIBS39, CI-996, DMP-811, DuP-532, EXP-929, L-163017, LY-301875, XH-148, XR-510, золасартан и PD-123319.
В объем указанного объекта настоящего изобретения также включены комбинации, содержащие ARB, указанные выше.
Для получения комбинации или комплекса по настоящему изобретению можно использовать коммерческие препараты ARB или их получают по известным методикам. Согласно настоящему изобретению ARB можно использовать в свободной форме, а также в форме любой пригодной соли или эфира.
Предпочтительными солями являются кислотно-аддитивные соли. Соединения, содержащие, по крайней мере, одну кислотную группу (например, COOH или 5-тетразолил) могут образовывать (основно-аддитивные) соли. Пригодные основно-аддитивные соли включают, например, соли металлов, такие как соли щелочных или щелочноземельных металлов, например, соли натрия, калия, кальция или магния или соли аммония или органических аминов, таких как морфолин, тиоморфолин, пиперидин, пирролидин, моно-, ди- или три(низш.)алкиламин, например, этил-, трет-бутил-, диэтил-, диизопропил-, триэтил-, трибутил- или диметилпропиламин, или моно-, ди- или тригидрокси(низш.)алкиламин, например, моно-, ди- или триэтаноламин. Могут также образовываться внутренние соли. Фармацевтически непригодные соли, которые можно использовать, например на стадии выделения или очистки соединений I в свободной форме или в форме фармацевтически приемлемых солей, также включены в объем настоящего изобретения. Наиболее предпочтительными солями являются, например соли, которые выбирают из группы, включающей мононатриевую соль в аморфной форме, динатриевую соль валсартана в аморфной или кристаллической форме, прежде всего в виде их гидратов.
Используют калиевую соль валсартана в аморфной форме, дикалиевую соль валсартана в аморфной или кристаллической форме, прежде всего в виде их гидратов.
Используют калиевую соль валсартана в кристаллической форме, прежде всего в форме гидрата, прежде всего тетрагидрата, магниевую соль валсартана в кристаллической форме, прежде всего в форме гидрата, прежде всего гексагидрата, смешанную кальций/магниевую соль валсартана в кристаллической форме, прежде всего в форме гидрата, бис-диэтиламмонийную соль валсартана в кристаллической форме, прежде всего в форме гидрата, бис-дипропиламмонийную соль валсартана в кристаллической форме, прежде всего в форме гидрата, бис-дибутиламмонийную соль валсартана в кристаллической форме, прежде всего в форме гидрата, прежде всего полугидрата, соль моно-l-аргинина и валсартана в аморфной форме, соль бис-L-аргинина и валсартана в аморфной форме, соль моно-L-лизина и валсартана в аморфной форме, соль бис-L-лизина и валсартана в аморфной форме.
Для получения соединения двойного действия, прежде всего комплекса по настоящему изобретению, предпочтительно используют ARB в свободной форме.
В предпочтительном варианте осуществления изобретения в качестве блокатора рецептора ангиотензина, который используют в комбинации или в составе комплекса по настоящему изобретению, используют валсартан, молекулярная структура которого приведена ниже
Валсартан можно использовать в виде рацемической смеси или в виде одного из двух изомеров, структура которых приводится ниже
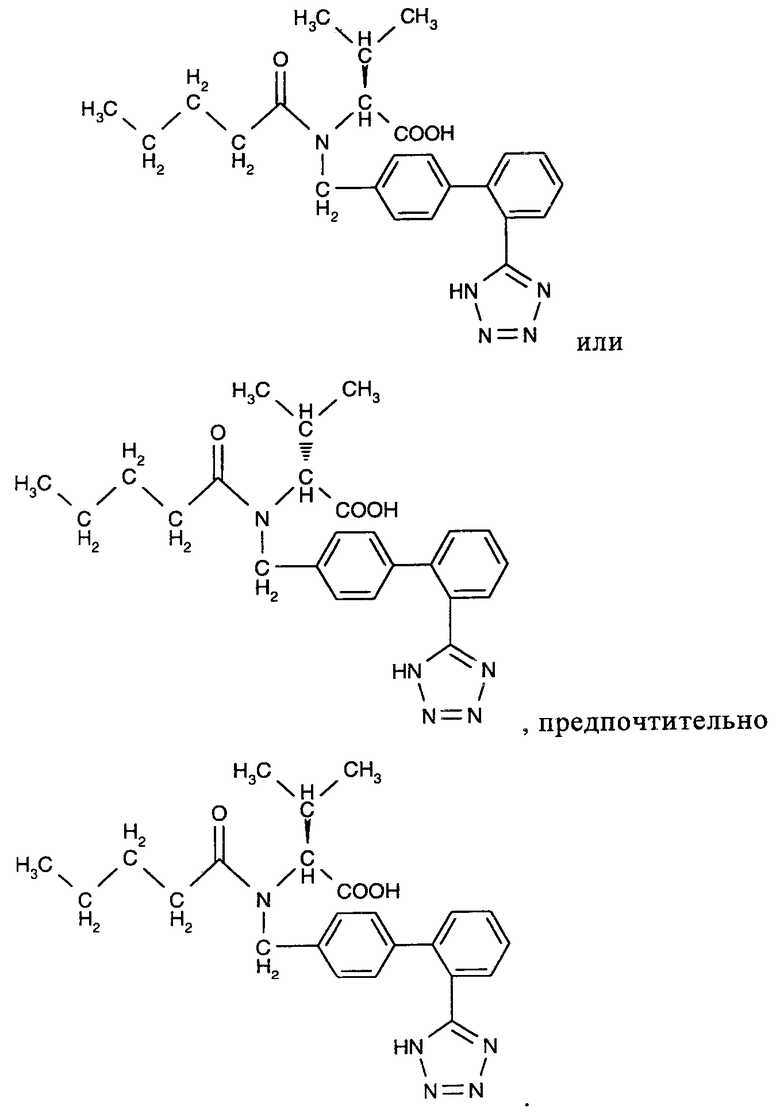
Согласно настоящему изобретению можно использовать коммерческие препараты валсартана, ((S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валин) или препараты, полученные по известным методикам. Например, способ получения валсартана описан в патентах US 5399578 и EP 0443983, которые включены в настоящее изобретение в полном объеме в качестве ссылки. Согласно настоящему изобретению, валсартан можно использовать в форме свободной кислоты, а также в форме любой пригодной соли. Кроме того, для получения сшитых пролекарств, а также солей и производных тетразола, можно использовать сложные эфиры или другие карбоксилсодержащие производные. Ссылки на ARB включают ссылки на их фармацевтически приемлемые соли.
Предпочтительным ARB является двухосновная кислота. Таким образом, в зависимости от pH раствора блокатор рецептора ангиотензина имеет заряд 0, 1 или 2.
В комбинации по настоящему изобретению используют ARB в форме фармацевтически приемлемой соли, которую выбирают из группы, включающей соли Na, K или NH4, предпочтительной является натриевая соль. Указанные соли включают и одно- и двузамещенную соль указанных катионов, предпочтительной является двузамещенная соль, прежде всего в случае использования валсартана, т.е. в образовании соли участвует фрагмент содержащий карбоновую кислоту, и фрагмент содержащий тетразол.
При получении соединения двойного действия, прежде всего супрамолекулярного комплекса по настоящему изобретению, обычно используют ARB в свободной форме, а источником катиона, входящего в состав комплекса, является основание, например, (Cat)OH.
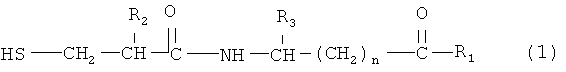
Соединение двойного действия включает молекулярный фрагмент ингибитора нейтральной эндопептидазы, то есть при получении соединения двойного действия используют молекулярный фрагмент ингибитора нейтральной эндопептидазы. Ингибитор нейтральной эндопептидазы является частью соединения и присоединен к ARB напрямую или косвенно за счет нековалентных связей. Для простоты изложения термин "ингибитор нейтральной эндопептидазы" в данном контексте используют для описания указанного фрагмента соединения. Пригодные ингибиторы нейтральной эндопептидазы по настоящему изобретению включают соединения формулы (1)
 ,
,
где R2 означает алкил, содержащий 1-7 атомов углерода, трифторметил, фенил, замещенный фенил, -(СН2)1-4-фенил, или замещенный -(СН2)1-4-фенил,
R3 означает водород, алкил, содержащий 1-7 атомов углерода, фенил, замещенный фенил, -(СН2)1-4-фенил или замещенный -(СН2)1-4-фенил,
R1 означает гидрокси, алкокси, содержащий 1-7 атомов углерода, или NH2,
n равно целому числу 1-15,
и термин "замещенный фенил" включает заместитель, который выбирают из группы, включающей (низш.)алкил, содержащий 1-4 атомов углерода, (низш.)алкокси, содержащий 1-4 атомов углерода, (низш.)алкилтио, содержащий 1-4 атомов углерода, гидрокси, Cl, Br или F.
Предпочтительные ингибиторы нейтральной эндопептидазы формулы (1) включают соединения, где R2 означает бензил, R3 означает водород, n равно целому числу 1-9, и R1 означает гидрокси.
Другим предпочтительным ингибитором нейтральной эндопептидазы является (3S,2'R)-3-{1-[2'-(этоксикарбонил)-4'-фенилбутил]циклопентан-1-карбониламино}-2,3,4,5-тетрагидро-2-оксо-1Н-1-бензазепин-1-уксусная кислота или ее фармацевтически приемлемая соль.
Предпочтительными ингибиторами нейтральной эндопептидазы по настоящему изобретению являются, без ограничения перечисленным, SQ 28603, N-[N-[1(S)-карбоксцл-3-фенилпропил]-(S)-фенилаланил]-(S)-изосерин, N-[N-[((1S)-карбокси-2-фенил)этил]-(S)-фенилаланил]-β-аланин, N-[2(S)-меркаптометил-3-(2-метилфенил)пропионил]метионин, (цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]карбонил]амино]-циклогексанкарбоновая кислота), тиорфан, ретротиорфан, фосфорамидон, SQ 29072, этиловый эфир (2R,4S)-5-бифенил-4-ил-5-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, N-(3-карбокси-1-оксопропил)-(4S)-пара-фенилфенилметил)-4-амино-2R-метилмасляная кислота, (S)-цис-4-[1-[2-(5-инданилоксикарбонил)-3-(2-метоксиэтокси)пропил]-1-циклопентан-карбоксамидо]-1-циклогексанкарбоновая кислота, 3-(1-[6-эндогидроксиметилбицикло[2,2,1]гептан-2-эксокарбамоил]циклопентил)-2-(2-метоксцэтил)пропионовая кислота, метиловый эфир N-(1-(3-(N-трет-бутоксикарбонил-(S)-пролиламино)-2(S)-трет-бутоксикарбонилпропил)-циклопентанкарбонил)-O-бензил-(S)-серина, 4-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]бензойная кислота, 3-[1-(цис-4-карбоксикарбонил-цис-3-бутилциклогексилретро-1-карбамоил)циклопентил]-2S-(2-метоксиэтоксиметил)-пропионовая кислота, N-((2S)-2-(4-бифенилметил)-4-карбокси-5-феноксивалерил)глицин, N-(1-(N-гидроксикарбамоилметил)-1-циклопентанкарбонил)-L-фенилаланин, (S)-(2-бифенил-4-ил)-1-(1Н-тетразол-5-ил)этиламино)метилфосфоновая кислота, (S)-5-(N-(2-(фосфонометиламино)-3-(4-бифенил)пропионил)-2-аминоэтил)тетразол, β-аланин, 3-[1,1'-бифенил]-4-ил-N-[дифеноксифосфинил)метил]-L-аланил, N-(2-карбокси-4-тиенил)-3-меркапто-2-бензилпропанамид, 2-(2-меркаптометил-3-фенилпропионамидо)тиазол-4-илкарбоновая кислота, (L)-(1-((2,2-диметил-1,3-диоксолан-4-ил)метокси)карбонил)-2-фенилэтил)-L-фенилаланил)-β-аланин, N-[N-[(L)-[1-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил]-2-фенилэтил]-L-фенилаланил]-(R)-аланин, N-[N-[(L)-1-карбокси-2-фенилэтил]-L-фенилаланил]-(R)-аланин, этиловый эфир N-[2-ацетилтиометил-3-(2-метилфенил)пропионил]-метионина, N-[2-меркаптометил-3-(2-метилфенил)пропионил]метионин, N-[2(S)-меркаптометил-3-(2-метилфенил)пропаноил]-(S)-изосерин, N-(S)-[3-меркапто-2-(2-метилфенил)пропионил]-(S)-2-метокси-(R)-аланин, N-[1-[[1(S)-бензилоксикарбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, N-[1-[[1(S)-карбонил-3-фенилпропил]амино]циклопентилкарбонил]-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)-изосерин, 1,1'-[дитиобис-[2(S)-(2-метилбензил)-1-оксо-3,1-пропандиил]]-бис-(S)-метионин, N-(3-фенил-2-(меркаптометил)пропионил)-(S)-4-(метилмеркапто)метионин, N-[2-ацетилтиометила-3-фенилпропионил]-3-аминобензойная кислота, N-[2-меркаптометил-3-фенилпропионил]3-аминобензойная кислота, N-[1-(2-карбокси-4-фенилбутил)-циклопентанкарбонил]-(S)-изосерин, этиловый эфир N-[1-ацетилтиометил)циклопентанкарбонил]-(S)-метионина, 3(S)-[2-(ацетилтиометил)-3-фенилпропионил]амино-ε-капролактам, этиловый эфир N-(2-ацетилтиометил-3-(2-метилфенил)пропионил)метионина и их комбинации.
Можно использовать ингибиторы нейтральной эндопептидазы в виде коммерческих препаратов или препаратов, полученных по известным методикам, таким как, описанные в патентах US 4722810, US 5223516, US 4610816, US 4929641, в южноафриканском патенте 84/0670, патентах UK 69578, US 5217996, EP 00342850, GB 02218983, в заявке WO 92/14706, патентах EP 00343911, JP 06234754, EP 00361365, в заявке WO 90/09374, в патенте JP 07157459, заявке WO 94/15908, в патентах US 5273990, US 5294632, US 5250522, EP 00636621, в заявке WO 93/09101, в патенте EP 00590442, в заявке WO93/10773, в патенте US 5217996, каждый из которых включен в настоящее изобретение в качестве ссылки. Согласно настоящему изобретению ингибиторы нейтральной эндопептидазы можно использовать в свободной форме, а также в форме любой пригодной соли. Ссылки на ингибиторы нейтральной эндопептидазы включают ссылки на их фармацевтически приемлемые соли.
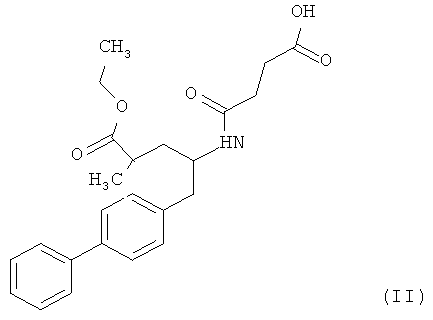
Кроме того, для получения сшитых пролекарств, а также солей и любых других производных, содержащих кислотные группы, можно использовать сложные эфиры или другие карбоксилсодержащие производные. В предпочтительном варианте осуществления настоящего изобретения в качестве NEPi используют этиловый эфир 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты формулы (II) или ее гидролизованную форму - 5-бифенил-4-ил-4-(3-карбоксипропионнламино)-2-метилвалериановую кислоту.
 .
.
Соединение формулы (II) существует в виде (2R,4S), (2R,4S), (2R,4S) или (2R,4S) изомера. Предпочтительным является этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, структурная формула которого представлена ниже:
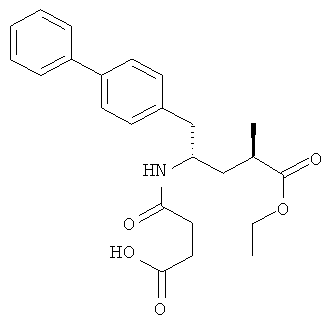
Соединение формулы (II) является специфическим ингибитором NEP и описано в патенте US 5217996. Указанное соединение можно использовать в виде коммерческого препарата или препарата, полученного по известным методикам. Согласно настоящему изобретению соединение формулы (II) можно использовать в свободной форме, а также в форме любой пригодной соли или пригодного эфира.
Предпочтительным NEPi является одноосновная кислота. Таким образом, в зависимости от pH раствора NEPi имеет заряд 0 или 1.
В комбинации по настоящему изобретению используют NEPi в форме фармацевтически приемлемой соли, которую выбирают из группы, включающей соли Na, K или NH4, предпочтительной является натриевая соль.
При получении соединения двойного действия, прежде всего супрамолекулярного комплекса по настоящему изобретению, обычно используют NEPi в свободной форме, а источником катиона, входящего в состав комплекса, является основание, например, (Cat)OH.
Предпочтительным соединением двойного действия является соединение, в котором ARB и NEPi связаны между собой нековалентными связями. В другом варианте (или дополнительно) указанные компоненты необязательно связаны через связующую группу, такую как фармацевтически приемлемый катион.
В качестве связующей группы можно использовать, без ограничения перечисленным, общепризнанные полностью безопасные (GRAS) соединения или другие фармакологически приемлемые соединения. В качестве связующей группы можно использовать ион или нейтральную молекулу. Если в качестве связующей группы используют ион, то сшитое пролекарство получают в виде соли, если в качестве связующей группы используют нейтральную молекулу, то сшитое пролекарство получают в виде совместного кристалла. Без ссылки на какую-либо конкретную теорию следует отметить, что протоны кислотных групп в составе ARB и NEPi присоединяются к основному фрагменту, таким образом все три компонента объединены в одной молекуле. После введения сшитого пролекарства субъекту, нуждающемуся в таком лечении, сшитое лекарство в более кислотной среде организма расщепляется на отдельные компоненты в процессе введения и всасывания и, следовательно, превращается в активные агенты, которые обеспечивают благоприятное биологическое действие при лечении соответствующих заболеваний.
В случае сшитого пролекарства в виде соли или соединения двойного действия, в качестве связующей группы или катиона предпочтительно используют положительно заряженный моно-, ди- или трехвалентный катион, органическое основание или аминокислоту, соответственно. Обычно предпочтительными катионами (Cat) для получения сшитого пролекарства и соединения двойного действия, прежде всего комплекса, являются основные катионы, наиболее предпочтительны катионы металлов. Предпочтительные катионы металлов включают, без ограничения перечисленным, Na, K, Ca, Mg, Zn, Fe или NH4. В качестве сшивающих агентов также можно использовать амины и солеобразующие агенты, такие как бензатин, гидрабамин, этилендиамин, N,N-дибензилэтилендиамин, L-аргинин, гидроксид холина, N-метилглюкамин (меглумин), L-лизин, диметиламиноэтанол (деанол), трет-бутиламин, диэтиламин, 2-(диэтиламино)этанол, 4-(2-гидроксиэтил)морфолин, трометанин (трис), 4-ацетамидофенол, 2-амино-2-метил-1,3-пропандиол, 2-амино-2-метилпропанол, бензиламин, циклогексиламин, диэтаноламин, этаноламин, имидазол, пиперазин и триэтаноламин.
Наиболее предпочтительным катионом является Na, K или NH4, например Na. В одном варианте осуществления изобретения предпочтительным катионом является Ca.
При получении сшитого пролекарства в виде совместного кристалла в качестве сшивающей группы также можно использовать нейтральную молекулу, способную образовывать водородную связь.
В другом варианте осуществления изобретения сшитыми пролекарствами по настоящему изобретению являются соединения, структура которых представлена ниже, на схемах (1) и (2) представлено соединение в виде соли, а на схеме (3) представлено соединение в виде совместного кристалла:
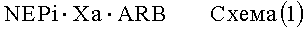
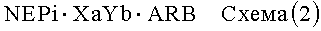

где
X означает Ca, Mg, Zn или Ее,
Y означает Na, K или NH4,
Z означает нейтральную молекулу, и
a, b и c относятся к стехиометрии сшитого пролекарства, предпочтительно, a, b и c означают валентность группы (1,+, 2+ или 3+).
При получении сшитых пролекарств, представленных выше на схемах (1) и (2), предпочтительно используют NEPi в виде одноосновной кислоты, а ARB в виде двухосновной кислоты. В зависимости от pH раствора блокатор рецептора ангиотензина имеет заряд 0, 1 или 2, а NEPi имеет заряд 0 или 1, в то время как молекула, содержащая указанные фрагменты, является нейтральной. ARB и NEPi используют в соотношении 1:1, 1:2, 1:3, 3:1, 2:1, 1:1, предпочтительно 1:1, 1:2 или 1:3, более предпочтительно 1:1.
Многокомпонентные соли, прежде всего, соли цинка и кальция, описаны в литературе, например, в статье Chem Pharm Bull, т.53, с.654 (2005). Указанные ионы образуют координационные комплексы, которые ускоряют кристаллизацию многокомпонентной системы. Пространственная структура координационных комплексов ионов металлов определяется атомными орбиталями данного типа металла.
Валсартан содержит две кислотные группы: карбоновую кислоту и тетразол. В одном варианте осуществления настоящего изобретения молекулярная структура сшитого пролекарства валсартана и NEPi включает связь между карбоксильной группой и связующей группой или связь между остатком тетразола и связующей группой. В еще одном варианте осуществления изобретения сшитое пролекарство содержит трехвалентную связующую группу, которая присоединена к карбоксильной группе, остатку триазола валсартана и фрагменту NEPi.
В варианте указанного объекта настоящего изобретения валсартан присоединен к этиловому эфиру (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропионцламино)-2-метилвалериановой кислоты через ион кальция.
В предпочтительном варианте осуществления настоящего изобретения комбинация, а также супрамолекулярный комплекс содержат антагонист рецептора ангиотензина и ингибитор нейтральной эндопептидазы в молярном соотношении 1:1, 1:2, 1:3, 3:1, 2:1, более предпочтительно в соотношении 1:1. При получении сшитого пролекарства указанные компоненты содержатся в аналогичных соотношениях. Кроме того, комплекс содержит антагонист рецептора ангиотензина, ингибитор нейтральной эндопептидазы и катион в молярном соотношении 1:1:1, 1:1:2, 1:1:3, более предпочтительно в соотношении 1:1:3. При получении сшитого пролекарства указанные компоненты содержатся в аналогичных соотношениях.
Комбинация или соединение двойного действия, прежде всего комплекс по настоящему изобретению, могут содержать растворитель. Присутствие растворителя предпочтительно, прежде всего, в составе соединения двойного действия, прежде всего комплекса, где растворитель может участвовать в образовании межмолекулярной структуры соединения, например, за счет супрамолекулярных взаимодействий. Предпочтительные растворители включают воду, метанол, этанол, 2-пропанол, ацетон, этилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол и хлористый метилен, наиболее предпочтительным растворителем является вода. Если растворитель присутствует, то на одну молекулу активного агента приходится одна или более молекул растворителя. Если растворитель присутствует в стехиометрическом количестве, то в соединении на одну молекулу активного агента приходится предпочтительно 1, 2, 3, 4 или 5, более предпочтительно 3 молекулы растворителя, такого как вода. В другом варианте растворитель может присутствовать в нестехиометрических количествах. В этом случае предпочтительно содержание растворителя составляет часть стехиометрического количества, например, 0,25, 0,5, 0,75, 1,25, 1,5, 1,75, 2,25, 2,5, 2,75, 3,25, 3,5, 3,75, 4,25, 4,5 и 4,75, предпочтительно 2,5, молекулы растворителя, такого как вода, на одну молекулу активного агента. Если соединение двойного действия, прежде всего комплекс, получают в кристаллической форме, то растворитель входит в состав молекулярной упаковки и включен в кристаллическую решетку.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения, соединение двойного действия, прежде всего супрамолекулярный комплекс, характеризуются общей формулой [ARB(NEPi)]Na1-3·xH2O, где x равно 0, 1, 2 или 3, например 3.
Предпочтительно, [ARB(NEPi)]Na3·xH2O, где x равно 0, 1, 2 или 3, например 3.
Более предпочтительно, [валсартан (этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты)]Na3·xH2O, где x равно 0, 1, 2 или 3, например 3.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения, соединение двойного действия, прежде всего супрамолекулярный комплекс, характеризуются общей формулой [ARB(NEPi)]Na1-3·xH2O, где x равно 0-3, например, 2,5.
Предпочтительно, [ARB(NEPi)]Na3·xH2O, где x равно 0-3, например, 2,5.
Более предпочтительно, [(N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валик)(этиловый эфир 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалернановой кислоты)]Na3·xH2O, прежде всего [((S)-N-валерил-N-{(2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валин)(этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты)Na3·xH2O, где x равно 0-3, например, 2,5. В указанном наиболее предпочтительном примере, комплексом является полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты].
Ниже приведена упрощенная структурная формула полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], которую использовали для расчета относительной молекулярной массы указанного соединения.

Валсартан содержит две кислотные группы, карбоновую кислоту и тетразол. В одном варианте указанного объекта настоящего изобретения молекулярная структура соединения двойного действия, прежде всего комплекса валсартана и NEPi, включает взаимодействие между карбоксильной группой и катионом, таким как Na, или растворителем, таким как вода, пли включает связь между остатком тетразола и катионом, таким как Na, или растворителем, таким как вода. В еще одном варианте соединение двойного действия, прежде всего комплекс, включает взаимодействие между карбоксильной группой, остатком триазола валсартана или NEPi и катионом, таким как Na, или растворителем, таким как вода.
Комбинацию или соединение двойного действия, прежде всего, комплекс по настоящему изобретению, предпочтительно получают в твердом состоянии. Твердое состояние включает кристаллическую, полукристаллическую, аморфную или полиморфную форму, предпочтительной является кристаллическая форма.
Свойства соединения двойного действия, прежде всего, комплекса по настоящему изобретению, отличаются от свойств комбинации ARB и NEPi, полученной простым физическим смешиванием двух указанных активных агентов, что упрощает их переработку и применение в качестве лекарственных средств. Например, соединение двойного действия ((S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валина и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, характеризуется свойствами, например спектральными пиками и химическими сдвигами, которые значительно отличаются от аналогичных характеристик их физической смеси.
Прежде всего, указанное соединение двойного действия характеризовали с использованием порошкового рентгеноструктурного метода на порошковом дифрактометре Scintag XDS2000 (Cu-Ka излучение, (λ=1,54056 А), оборудованном кремниевым датчиком, охлаждаемым с использованием эффекта Пелтье, при комнатной температуре (25°C). Величины угла 29 определяли в диапазоне от 1,5°C до 40° при скорости сканирования 3°/мин. Наиболее важные дифракционные пики на рентгенограмме соответствуют следующим межплоскостным расстояниям:
Полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] характеризовали методом рентгеноструктурного анализа, т.е. рассчитывали значения угла 2θ [в градусах] и соответствующие межплоскостные расстояния d на рентгенограмме (стандартное отклонение ±0,2): 4,5, 5,5, 5,6, 9,9, 12,8, 15,7, 17,0, 17,1, 17,2, 18,3, 18,5, 19,8, 21,5, 21,7, 23,2, 23,3, 24,9, 25,3, 27,4, 27,9, 28,0, 30,2,
или при стандартном отклонении ±0,1: 4,45, 5,52, 5,57, 9,94, 12,82, 15,66, 17,01, 17,12, 17,2, 18,32, 18,46, 19,76, 21,53, 21,72, 23,17, 23,27, 24,88, 25,3, 27,4, 27,88, 28,04, 30,2.
Наиболее интенсивные пики на рентгенограмме соответствуют следующим межплоскостным расстояниям: 2θ [в градусах]: 4,5, 5,6, 12,8, 17,0, 17,2, 19,8, 21,5, 27,4, прежде всего, 4,45, 5,57, 17,01, 17,2, 19,76, 21, 27,4.
Предпочтительный метод анализа указанных выше средних величин межплоскостных расстояний и интенсивности пиков, которые получены с использованием рентгенограммы для данного вещества, включает расчет указанных расстояний и интенсивностей по данным более подробного анализа монокристаллической структуры. В результате такого анализа определяют константы элементарной ячейки и положения атомов, которые используют для анализа рентгенограммы, соответствующей твердому веществу с помощью программного обеспечения. В данном случае использовали программу Powder Pattern и программное обеспечение Materials Studio (Accelrys). Сравнительные данные межплоскостных расстояний и интенсивностей наиболее важных пиков полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], найденных на рентгенограмме и рассчитанных пиков по данным анализа монокристаллической структуры, представлены ниже в таблице.
Настоящее изобретение относится к полупентагидрату тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], к кристаллическому твердому веществу, которое характеризуется данными и параметрами, полученными при анализе монокристаллической и порошковой рентгенограмм. Подробное обсуждение теории методов анализа монокристаллической рентгенограммы и определения параметров кристалла можно найти в книге Stout & Jensen, X-Ray Structure Determination, A Practical Guide, Mac Millian Co., New York, N.Y., гл.3 (1968).

Для определения структуры использовали программу SHELXD (Sheldrick, Gottingen).
Трехмерную структуру элементарной ячейку характеризовали, по размеру граней элементарной ячейки a, b и c и по трем углам между оптическими осями α, β и γ. На основании полученных данных рассчитывали объем элементарной ячейки Vc. Подробное описание указанных параметров кристаллов приводится в работе Stout & Jensen, глава 3 (см. выше). На основании данных монокристаллической рентгенограммы, прежде всего, включающих координаты атомов, термические изотропные параметры, координаты атомов водорода, а также соответствующие термические изотропные параметры, полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил {2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] характеризуется моноклинным типом элементарной ячейки, которая включает двенадцать формульных единиц C48H55N6O8Na3·2,5Н2О, и включает два ассиметрических фрагмента в двух участках ячейки.
Ацентрическая пространственная группа P21, полученная по данным монокристаллической рентгенограммы, является стандартной для чистых энантиоморфных молекул. В указанной пространственной группе расположены два структурных элемента, т.е. в элементарной ячейке расположено двенадцать формульных единиц, а в асимметрическом фрагменте расположено 18 ионов натрия и 15 молекул воды.
Изображение элементарной ячейки супрамолекулярного комплекса полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил {2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], включающей два ассиметрических центра, представлено на фиг.1.
По данным монокристаллической рентгенограммы, асимметрический фрагмент супрамолекулы полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] содержит по шесть фрагментов ARB и NEPi, 18 атомов натрия и 15 молекул воды. Полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] является супрамолекулярным комплексом натрия, который образует координационные связи с кислородсодержащими лигандами. В качестве кислородсодержащих лигандов используются двенадцать карбоксильных групп и восемнадцать карбонильных групп в составе молекулярных фрагментов, описанных выше, а также 13-15 молекул воды. Кристалл представляет собой трехмерную сетку указанных комплексов натрия.
Свойства указанного соединения также характеризовали методом ИК-спектроскопии нарушенного полного внутреннего отражения с Фурье-преобразованием (ATR-FTIR). Инфракрасный спектр получали на спектрофотометре Nicolet Magna-IR 560. Соединение характеризуется следующим спектром (волновое число, см-1): 2956 (w), 1711 (st), 1637 (st), 1597 (st), 1488 (w), 1459 (m), 1401 (st), 1357 (w), 1295 (m), 1266 (m), 1176 (w), 1085 (m), 1010 (w), 942(w), 907 (w), 862 (w), 763 (st), 742 (m), 698 (m), 533 (st). Для характеристики комплекса используют, прежде всего, пики 1711 (st), 1637 (st), 1597 (st) и 1401 (st). При анализе данных ИК-ATR, диапазон ошибок для всех полос поглощения составляет ±2 см-1. Для обозначения степени интенсивности полос поглощения используют следующие сокращения: (w) низкая, (m) средняя и (st) высокая интенсивность.
Соединение также характеризовали методом комбинационного рассеяния, спектр получали на раман-спектрометре (на лазерном спектрометре комбинационного рассеяния) (фирмы Kaiser Optical Systems, Inc.), при длине волны излучения 785 нм. Соединение характеризуется следующим спектром (волновое число, см-1): 3061 (m), 2930 (m, ушир.), 1612 (st), 1523 (m), 1461 (w), 1427 (w), 1287 (st), 1195 (w), 1108 (w), 11053 (w), 1041 (w), 1011 (w), 997 (m), 866(w), 850 (w), 822 (w), 808 (w), 735 (w), 715 (w), 669 (w), 643 (w), 631 (w), 618 (w), 602 (w), 557 (w), 522 (w), 453 (w), 410 (w), 328 (w).
При анализе данных комбинационного рассеяния, диапазон ошибок для всех полос поглощения составляет ±2 см-1. Для обозначения степени интенсивности полос поглощения используют следующие сокращения: (w) низкая, (m) средняя и (st) высокая интенсивность.
Указанное соединение также характеризовали методом дифференциальной сканирующей калориметрии (ДСК), определяя специфические характеристики плавления соединения на калориметре Q1000 (фирмы ТА Instruments), температура начала интенсивного плавления и максимальный пик на кривой ДСК для указанного комплекса составляют 139°C и 145°C, соответственно. Анализ проводили при скорости нагрева 10 K/мин.
Во втором варианте осуществления настоящего изобретения предлагаются фармацевтические композиции, которые включают комбинацию, сшитое пролекарство или соединение двойного действия, прежде всего, комплекс, описанные в данном контексте, и, по крайней мере, одну фармацевтически приемлемую добавку. Подробное описание комбинации и комплекса, которые содержат ARB и NEPi, приводится выше в первом варианте осуществления настоящего изобретения.
Фармацевтические композиции по настоящему изобретению, пригодные для перорального или ректального и парентерального введения млекопитающим (теплокровные животные), включая человека, можно получить с использованием способов, известных в данной области техники. Фармацевтические композиции по настоящему изобретению содержат эффективное количество комбинации или соединения двойного действия, прежде всего, комплекса в отдельности, или в комбинации, по крайней мере, с одним фармацевтически приемлемым носителем, прежде всего, пригодным для энтерального или парентерального введения. Стандартные композиции для перорального введения включают таблетки, капсулы, сиропы, эликсиры и суспензии. Стандартные композиции для инъекций включают растворы и суспензии.
Пригодные фармацевтически приемлемые добавки по настоящему изобретению включают, без ограничения перечисленным, химически инертные по отношению к комбинации или соединению двойного действия, прежде всего комплексу по настоящему изобретению или не оказывающие отрицательного действия, добавки, такие как разбавители или наполнители, дезинтегрирующие агенты, глиданты, замасливатели, связующие агенты, красители и их комбинации. Количество каждой добавки в твердой лекарственной форме может изменяться в стандартном диапазоне. Обычно при получении комбинаций, описанных выше, используют стандартные фармацевтически приемлемые носители, такие как сахара, такие как лактоза, сахароза, маннит и сорбит, крахмалы, такие как кукурузный крахмал, маниоковый крахмал и картофельный крахмал, целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и метилцеллюлоза, фосфаты кальция, такие как дикальций фосфат и трикальций фосфат, сульфат натрия, сульфат кальция, поливинилпирролидон, поливиниловый спирт, стеариновая кислота, стеараты щелочно-земельных металлов, такие как стеарат магния и стеарат кальция, стеариновая кислота, растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло и кукурузное масло, неионогенные, катионные и анионные ПАВ, полимеры на основе этиленгликоля, β-циклодекстрин, жирные спирты и гидролизаты злаков, а также другие нетоксичные совместимые наполнители, связующие агенты, дезинтегрирующие агенты, буферные вещества, консерванты, антиоксиданты, замасливатели, ароматизаторы и т.п., используемые при получении фармацевтических комбинаций.
Фармацевтические препараты для энтерального или парентерального введения используют в виде, например, стандартных лекарственных форм, таких как таблетки с покрытием, таблетки, капсулы или суппозитории, а также препаратов в ампулах. Указанные лекарственные формы получают по известным методикам, например, с использованием стандартных методов смешивания, грануляции, нанесения покрытий, солюбилизации или лиофилизации. Таким образом, фармацевтические композиции для перорального введения получают при смешивании сшитого пролекарства, комбинации или соединения двойного действия, прежде всего, комплекса с твердыми эксципиентами, при необходимости полученную смесь гранулируют и перерабатывают в таблетки или таблетки с покрытием, после добавления пригодных вспомогательных веществ.
Доза активных соединений в комбинации или соединения двойного действия, прежде всего, комплекса, зависит от множества факторов, таких как способ введения, вида теплокровного животного, возраст и/или индивидуальное состояние. Предполагаемая эффективная доза при лечении модельных животных с указанным заболеванием находится в диапазоне от приблизительно 0,1 мг/кг/сутки до приблизительно 1000 мг/кг/сутки при пероральном способе введения, а эффективная доза при лечении человека находится в диапазоне от приблизительно 0,1 мг в сутки до приблизительно 2000 мг в сутки. Предпочтительные дозы сшитого пролекарства составляют приблизительно от 40 мг в сутки до приблизительно 960 мг в сутки, предпочтительно от приблизительно 80 мг в сутки до приблизительно 640 мг в сутки. Дозы ARB составляют приблизительно от 40 мг в сутки до приблизительно 320 мг в сутки, а дозы NEPi составляют приблизительно от 40 мг в сутки до приблизительно 320 мг в сутки. Более подробно, дозы ARB/NEPi составляют 40 мг/40 мг, 80 мг/80 мг, 160 мг/160 мг, 320 мг/320 мг, 40 мг/80 мг, 80 мг/160 мг, 160 мг/320 мг, 320 мг/640 мг, 80 мг/40 мг, 160 мг/80 мг и 320 мг/160 мг, соответственно. Указанные дозы являются "терапевтически эффективными количествами" указанных соединений. Предпочтительными дозами сшитого пролекарства, комбинации или соединения двойного действия, прежде всего, комплекса в составе фармацевтической композиции по настоящему изобретению являются терапевтически эффективные дозы.
Фармацевтические композиции могут также содержать другой дополнительный терапевтический агент, например, каждый в терапевтически эффективном количестве, которое известно специалисту в данной области техники. Указанные терапевтические агенты включают:
a) антидиабетические агенты, такие как инсулин, производные и миметики инсулина, соединения, которые вызывают повышение секреции инсулина, такие как сульфонилмочевины, например глипизид, глибурид и амарил, инсулинотропные лиганды рецептора сульфонилмочевины, такие как меглитиниды, например натеглинид и репаглинид, лиганды рецептора, активируемого пролифератором пероксисомы (PPAR), ингибиторы протеинтирозинфосфотазы-1B(РТР-1В), такие как РТР-112, ингибиторы GSK3 (гликогенсинтаза-киназа-3), такие как SB-517955, SB-4195052, SB-216763, NN-57-05441 и NN-57-05445, лиганды RXR, такие как GW-0791 и AGN-194204, ингибиторы натрий-зависимых переносчиков глюкозы, такие как Т-1095, ингибиторы гликогенфосфорилазы А, такие как BAY R3401, бигуаниды, такие как метформин, ингибиторы α-глюкозидазы, такие как акарбоза, GLP-1 (глюкагоноподобный пептид-1), аналоги GLP-1, такой как экседин-4 и миметики GLP-1 и ингибиторы DPPIV (дипептидилпептидаза IV), такие как LAF237,
b) гиполипидемические агенты, такие как ингибиторы 3-гидрокси-3-метилглутарил-КоА-редуктазы (HMG-CoA), например ловастатин, питавастатин, симвастатин, правастатин, церивастатин, мевастатин, велостатин, флувастатин, далвастатин, аторвастатин, розувастатин и ривастатин, ингибиторы скваленсинтазы, FXR (фарнезоидный рецептор X) и лиганды LXR (рецептор Х печени), холестирамин, фибраты, никотиновая кислота и аспирин,
c) агенты против ожирения, такие как орлистат, и
d) антигипертензивные агенты, например, петлевые диуретики, такие как этакриновая кислота, фуросемид и торсемид, ингибиторы ангиотензинконвертирующего фермента (АКФ), такие как беназеприл, каптоприл, эналаприл, фозиноприл, лизиноприл, моэксиприл, перинодоприл, хицаприл, рамиприл и трандолаприл, ингибиторы Na/K-АТ Фазы мембранных насосов, такие как дигоксин, ингибиторы АКФ/NEP, такие как омапатрплат, сампатрилат и фазидотрил, блокаторы β-адренергического рецептора, такие как ацебутолол, атенолол, бетаксолол, бизопролол, метопролол, надолол, пропранолол, соталол и тимолол, ионотропные агенты, такие как дигоксин, добутампн и милринон, блокаторы кальциевых каналов, такие как амлодипин, бепридил, дилтиазем, фелодипин, никардипин, нимодипин, нифедипин, нисолдипин и верапамил, антагонисты рецептора альдостерона и ингибиторы альдостеронсинтазы. Наиболее предпочтительными дополнительными компонентами, входящими в комбинацию, являются диуретики, такие как гидрохлортиазид и/или блокаторы кальциевых каналов, такие как амлодипин или его соль.
Другие специфические антидиабетические соединения описаны в работе Patel Mona, Expert Opin Investig Drugs, 12(4), 623-633 (2003), фиг.1-7, которая включена в настоящее изобретение в качестве ссылки. Соединение по настоящему изобретению можно вводить одновременно, до или после введения другого активного ингредиента, используя один и тот же или различные способы введения или совместно в составе одной фармацевтической композиции.
Структуры активных агентов можно найти, используя кодовые номера, общее или торговое название, указанные в текущем издании справочника "The Merck Index", или в базе данных, например Patents International (например, IMS World Publications). Соответствующие данные включены в настоящее изобретение в качестве ссылки.
Соответственно, настоящее изобретение относится к фармацевтическим композициям, которые содержат другой дополнительный терапевтический агент в терапевтически эффективном количестве, который выбирают из группы, включающей антидиабетические агенты, гиполипидемические агенты, агенты против ожирения или антигипертензивные агенты, наиболее предпочтительными являются антидиабетические агенты, антигипертензивные агенты или гиполипидемические агенты, описанные выше.
Специалист в данной области техники может выбрать подходящую стандартную экспериментальную модель для оценки действия комбинации по настоящему изобретению в отношении указанных в данном контексте терапевтических показаний.
Испытания соединений проводили на примере полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], например согласно методике, описанной ниже.
Антигипертензивную активность и активность ингибитора нейтральной эндопептидазы 24.11 (NEP) для полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] оценивали на моделях крыс, которые находились в сознании. Эффективность снижения кровяного давления оценивали с использованием трансгенных крыс, экспрессирующих два белка (dTGR), то есть у которых наблюдается сверхэкспрессия ренина человека и его субстрата, ангиотензиногена человека (Bohlender и др., High human renin hypertension in transgenic rats, Hypertension, 29 (1 Pt 2), 428-434 (1997)). Следовательно, указанные животные страдают гипертензией, опосредованной ангиотензином II. Эффективность полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] в качестве ингибитора NEP оценивали с использованием крыс Sprague-Dawley, которые находились в сознании, и которым вводили вливанием экзогенный предсердный натрийуретический пептид (ANP). Повышение уровня ANP в плазме крови использовали в качестве показателя ингибирующей активности в отношении NEP in vivo. В двух указанных моделях полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] вводили перорально в виде порошка в желатиновых миникапсулах. Полученные результаты представлены ниже.
- Согласно данным испытаний на крысах dTGR, которые находились в сознании, и которым перорально вводили полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты], указанное соединение оказывает дозозависимое, пролонгированное антигипертензивное действие на модельных крыс, страдающих скоротечной формой гипертензии.
- После перорального введения полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] быстро и дозозависимо ингибирует NEP, и характеризуется пролонгированным действием, о чем свидетельствует потенциироваиие иммунореактивности ANP в плазме крови (ANPir) у крыс Sprague-Dawley, которые находились в сознании, и которым вводили вливанием экзогенный ANP.
Оценка антигипертензивного эффекта in vivo
Трансгенным крысам имплантировали радиотелеметрические датчики для непрерывного измерения артериального кровяного давления и частоты сердечных сокращений. Животных рандомизировали в контрольные группы (пустые капсулы) и группы для введения лекарственного средства (перорально в дозе 2, 6, 20 или 60 мг/кг). Во всех группах исходное среднее артериальное давление в течение 24 ч (MAP) составляло приблизительно 170-180 мм рт. столба. Установлено, что полупентагидрат тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] дозозависимо снижает величину MAP. Величины, полученные в группах, прошедших курс лечения, зависят от дозы, а результаты после лечения тремя самыми высокими дозами значительно отличаются от результатов в контрольной группе.
Ингибирование активности NEP in vivo
Эффективность и продолжительность ингибирования NEP для полупентагидрата тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] in vivo оценивали методом, описанным в работе Trapani, и др., CGS 35601 and its orally active prodrug CGS 37808 as triple inhibitors of endothelin-converting enzyme-1, neutral endopeptidase 24.11, and angiotensin-converting enzyme, J Cardiovasc Pharmacol. 44 (Suppi 1), S211-215 (2004).
ANP крысы (1-28) вводили самцам крыс Sprague-Dawley (находящимся в сознании, с имплаитированной трубкой для продолжительного лечения) внутривенным вливанием при скорости 450 нг/кг/мин. Через 1 ч после вливания крыс рандомизировали в одну из 6 групп: контрольная группа (без лечения), группа для введения носителя (пустые капсулы) и четыре группы для перорального введения дозы лекарственного средства (2, 6, 20 или 60 мг/кг, соответственно). Вливание ANP продолжали в течение еще 8 ч. У животных отбирали образцы крови для измерения уровня ANPir с использованием коммерческого набора для ИФА в момент -60 мин (то есть перед началом вливания ANP), в момент -30 мин (через 30 мин после начала вливания ANP), 0 мин (базовая линия, через 60 мин после начала вливания ANP, но перед введением лекарственного средства пли носителя) и через 0,25, 0,5, 1, 2, 3, 4, 5, 6, 7 и 8 ч после введения дозы.
Перед вливанием ANP, уровень ANPir составляет низкую величину (0,9-1,4 нг/мл) и идентичен для всех шести групп. После начала введения (через 30 мин) ANP уровень ANPir быстро возрастает до ~10 нг/мл. Указанный уровень ANPir сохраняется в течение всего эксперимента в контрольной группе (без лечения) и группе для введения носителя. Напротив, после введения тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] наблюдается быстрое (в течение 15 мин) возрастание ANPir по дозозависимому механизму. Таким образом, после перорального введения LCZ696 наблюдается быстрое и дозозависимое ингибирование NEP, которое характеризуется пролонгированным действием, о чем свидетельствует потенциирование уровня APNir в плазме.
Согласно полученным результатам соединение по настоящему изобретению оказывает неожиданный терапевтический эффект.
Третий объект настоящего изобретение относится к способу получения сшитого пролекарства ARB или его фармацевтически приемлемой соли и NEPi или его фармацевтически приемлемой соли, который заключается в том, что:
(a) в растворитель добавляют неорганический солеобразующий агент, при этом получают раствор для получения соли сшитого пролекарства,
(b) полученный раствор добавляют в смесь ARB и NEPi, и получают сшитое пролекарство, содержащее ARB и NEPi, и
(c) выделяют сшитое пролекарство.
В предпочтительном варианте компоненты добавляют в эквивалентном количестве.
Солеобразующие неорганические агенты включают, без ограничения перечисленным, гидроксид кальция, гидроксид цинка, метилат кальция, ацетат кальция, гидрокарбонат кальция, формиат кальция, гидроксид магния, ацетат магния, формиат магния и гидрокарбонат магния, гидроксид натрия, метилат натрия, ацетат натрия, формиат натрия. Неорганический солеобразующий агент высвобождает в раствор связующий остаток, который в присутствии ARB и NEPi образует сшитое пролекарство.
Растворители по настоящему изобретению включают, без ограничения перечисленным, растворители, в которых ARB, NEPi и неорганический солеобразующий агент, предпочтительно являются плохо растворимыми, что обеспечивает кристаллизацию сшитого пролекарства. Указанные растворители включают, без ограничения перечисленным, воду, метанол, этанол, 2-пропанол, этилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол и хлористый метилен и смеси указанных растворителей.
После добавления неорганического солеобразующего агента в растворитель получают раствор, pH которого способствует образованию сшитого пролекарства. Можно использовать растворы с pH от приблизительно 2 до приблизительно 6, предпочтительно приблизительно от 3 до приблизительно 5, более предпочтительно от 3,9 до 4,7.
Сшитое пролекарство выделяют кристаллизацией и хроматографией. Специфические типы хроматографни включают, например, лигандспецифичную хроматографию, с использованием специфических смол, обращенно-фазовую хроматографию, с использованием обращенно-фазовых смол, ионообменную хроматографию.
Специфический пример включает взаимодействие двухвалентной соли одного компонента с одновалентной солью другого компонента сшитого пролекарства. Специфическую смешанную соль валсартана и NEPi (монооснование) получают при взаимодействии кальциевой соли валсартана с натриевой солью NEPi. Требуемую смешанную соль выделяют селективной кристаллизацией или хроматографией, с использованием смол, содержащих специфические лиганды, или обращенно-фазовых смол или с использованием ионообменных смол. Указанный способ также позволяет получить сшитое пролекарство с использованием одновалентных солей обоих компонентов, например, натриевых солей обоих компонентов.
В другом варианте сшитое пролекарство получают в виде совместного кристалла. Способ получения сшитого пролекарства в виде совместного кристалла заключается в том, что при получении пролекарства неорганический солеобразующий агент заменяют на нейтральную молекулу, способную образовывать водородные связи. Растворитель может входить в состав молекулы, и включен в состав кристаллической решетки.
В предпочтительном варианте осуществления третьего объекта настоящего изобретения предлагается способ получения соединения двойного действия, которое включает:
(a) антагонист рецептора ангиотензина,
(b) ингибитор нейтральной эндопентидазы (NEPi), и необязательно
(c) фармацевтически приемлемый катион, и указанный способ заключается в том, что
(1) антагонист рецептора ангиотензина и ингибитор нейтральной эндопептидазы (NEPi) растворяют в пригодном растворителе,
(2) основание Cat (где Cat означает катион) растворяют в пригодном растворитель,
(3) растворы, полученные на стадии (1) и (2), объединяют,
(4) твердое вещество осаждают и высушивают с получением соединения двойного действия,
или альтернативно соединение двойного действия получают при замене растворителя (растворителей), использованных на стадиях (1) и (2), по методике, включающей:
(4a) упаривание полученного раствора досуха,
(5a) повторное растворение твердого вещества в пригодном растворителе,
(6a) осаждение и высушивание твердого вещества с получением соединения двойного действия.
Подробное описание комплекса, который содержит ARB, NEPi и катион, приводится выше в первом варианте осуществления настоящего изобретения.
На первой стадии (1) ARB и NEPi предпочтительно добавляют в эквимолярном количестве. ARB и NEPi предпочтительно используют в свободной форме. В качестве растворителя на стадии (1) можно использовать любой растворитель, в котором растворяются ARB и NEPi. Предпочтительные растворители включают растворители, описанные выше, такие как вода, метанол, этанол, 2-пропанол, ацетон, этилацетат, изопропилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол, ДМФА, NMF и хлористый метилен и смеси указанных растворителей, такие как этанол/вода, метанол/вода, 2-пропанол/вода, ацетонитрил/вода, ацетон/вода, 2-пропанол/толуол, этилацетат/гептан, изопропилацетат/ацетон, метил-трет-бутиловый эфир/гептан, метил-трет-бутиловый эфир/этанол, этанол/гептан, ацетон/этилацетат, ацетон/циклогексан, толуол/гептан, наиболее предпочтительным является ацетон.
На стадии (2) предпочтительно используют основание Cat, способное образовывать соль при взаимодействии с кислотными группами, входящими в состав ARB и NEPi. Примеры указанных соединений включают соединения, описанные выше, такие как гидроксид кальция, гидроксид цинка, метилат кальция, этилат кальция, ацетат кальция, гидрокарбонат кальция, формиат кальция, гидроксид магния, ацетат магния, формиат магния, гидрокарбонат магния, гидроксид натрия, карбонат натрия, гидрокарбонат натрия, метилат натрия, этилат натрия, ацетат натрия, формиат натрия, гидроксид калия, карбонат калия, гидрокарбонат калия, метилат калия, этилат калия, ацетат калия, формиат калия, гидроксид аммония, метилат аммония, этилат аммония и карбонат аммония, также можно использовать перхлораты. Можно использовать амины или солеобразующие агенты, описанные выше, прежде всего бензатин, L-аргинин, холин, этилендиамин, L-лизин или пиперазин. Обычно используют неорганические основания, содержащие Cat, описанные в данном контексте. Наиболее предпочтительным основанием является (Cat)OH, (CaO2CO3, (СаС)HCO3, еще более предпочтительным является Cat(OH), такой как NaOH. При получении соединения двойного действия, прежде всего, комплекса, который содержит три катиона, основание добавляют в количестве, которое в три раза превышает количество добавленных ARB или NEPi, предпочтительно его добавляют в стехиометрическом количестве. На стадии (2) можно использовать любой растворитель или смеси растворителей, в которых растворяется Cat(OH). Предпочтительные растворители включают воду, метанол, этанол, 2-пропанол, ацетон, этилацетат, изопропилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол и хлористый метилен и смеси указанных растворителей, наиболее предпочтительным растворителем является вода.
На стадии (3) растворы, полученные на стадиях (1) и (2), объединяют. Раствор, полученный на стадии (1), можно добавлять в раствор, полученный на стадии (2), или наоборот, предпочтительно, раствор, полученный на стадии (2), добавляют в раствор, полученный на стадии (1).
Согласно первому варианту после объединения растворов и предпочтительно перемешивания соединение двойного действия, прежде всего, комплекс, осаждают (стадия (4)). Смешивание и осаждение продукта обычно проводят при перемешивании растворов в течение определенного промежутка времени, например, от 20 мин до 6 ч, предпочтительно от 30 мин до 3 ч, более предпочтительно в течение 2 ч, при комнатной температуре, при этом предпочтительно добавить затравочные кристаллы соединения двойного действия, что ускоряет осаждение продукта.
Согласно первому дополнительному варианту на стадии (4) обычно добавляют дополнительный растворитель. В качестве дополнительного растворителя можно использовать растворитель, в котором комплекс ARB и NEPi характеризуется более низкой растворимостью, что обеспечивает его осаждение. В ходе непрерывного пли постадийного упаривания исходный растворитель заменяют на дополнительный растворитель, то есть добавляют указанный дополнительный растворитель, в результате чего получают смесь, которая в основном содержит дополнительный растворитель. Предпочтительные растворители включают этанол, 2-пропанол, ацетон, этилацетат, изопропилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол и хлористый метилен и смеси указанных растворителей, наиболее предпочтительным растворителем является изопропилацетат. Предпочтительно получают смесь, содержащую минимальное количество растворителя, что способствует осаждению продукта. Твердое вещество отделяют, например, фильтрованием и сушат, при этом получают соединение двойного действия, прежде всего, комплекс по настоящему изобретению. Сушку проводят при комнатной температуре или при повышенной температуре, такой как от 30°C до 60°C, предпочтительно при температуре от 30°C до 40°C. Растворитель можно удалять при пониженном давлении, предпочтительно, продукт сушат при нормальном или пониженном давлении, например, при давлении, например, от 10 бар до 30 бар, например, при давлении 20 бар.
Согласно второму варианту при объединении растворов и предпочтительно перемешивании соединение двойного действия, прежде всего, комплекс, образует прозрачный раствор. Перемешивание обычно проводят в течение определенного промежутка времени, например от 20 мин до 6 ч, предпочтительно от 30 мин до 3 ч, более предпочтительно в течение 1 ч, при комнатной температуре. При необходимости для получения прозрачного раствора перемешивание проводят при повышенной температуре.
Затем в полученной смеси заменяют растворитель на дополнительный растворитель, при этом получают соединение двойного действия, прежде всего, комплекс.
Согласно второму дополнительному варианту, на стадии (4а) раствор предпочтительно упаривают досуха при повышенной температуре, такой как от температуры, превышающей комнатную температуру до температуры 50°C, более предпочтительно при температуре от 30°C до 40°C.
Предпочтительно на стадии (5a) используют растворитель или смесь растворителей, в которых комплекс ARB и NEPi характеризуется более низкой растворимостью, что обеспечивает осаждение соединения двойного действия, прежде всего, комплекса. Предпочтительные растворители включают растворители, описанные выше для стадии (1), такие как вода, этанол, 2-пропанол, ацетон, этилацетат, изопропилацетат, метил-трет-бутиловый эфир, ацетонитрил, толуол и хлористый метилен и смеси указанных растворителей, наиболее предпочтительным растворителем является изопропилацетат. Предпочтительно получают смесь, содержащую минимальное количество растворителя или смеси растворителей, что обеспечивает осаждение продукта.
На стадии (6a) осаждение продукта можно проводить при комнатной температуре. Осаждение можно проводить без перемешивания или при перемешивании реакционной смеси, предпочтительно при перемешивании реакционной смеси. Предпочтительно осаждение проводят при перемешивании и/или при обработке смеси ультразвуком. После осаждения твердое вещество отделяют, например, фильтрованием и сушат, при этом получают соединение по настоящему изобретению. Сушку можно проводить при комнатной температуре идя при повышенной температуре, такой как от 30°C до 60°C, предпочтительной является комнатная температура. Удаление растворителя можно проводить при пониженном давлении, предпочтительно, продукт сушат при нормальном давлении.
Четвертым объектом настоящего изобретения является способ лечения или профилактика заболевания или состояния, такого как гипертензия, сердечная недостаточность (острая и хроническая), застойная сердечная недостаточность, дисфункция левого желудочка и гипертрофическая кардиомиопатия, диабетическая кардиомиопатия, суправентрикулярная и желудочковая аритмия, мерцательная аритмия, трепетание предсердий, неудачное ремодулирование сосудов, инфаркт миокарда и осложнения после него, атеросклероз, стенокардия (нестабильная или стабильная), почечная недостаточность (диабетическая и не диабетическая), сердечная недостаточность, грудная жаба, диабет, вторичный альдостеронизм, первичная и вторичная легочная гипертензия, состояния, связанные с почечной недостаточностью, такие как диабетическая нефропатия, гломерулонефрит, склеродермия, гломерулосклероз, протеинурия при первичном заболевании почек, а также реноваскулярная гипертензия, диабетическая ретинопатия, другие сосудистые нарушения, такое как мигрень, заболевание периферических сосудов, болезнь Рейно, люминальная гиперплазия, нарушение познавательной способности (например, болезнь Альцгеймера), глаукома и инсульт, и указанный способ заключается в том, что субъекту, нуждающемуся в данном лечении, вводят комбинацию, сшитое пролекарство или соединение двойного действия, прежде всего, комплекс, описанные выше.
Комбинацию, сшитое пролекарство или соединение двойного действия, прежде всего, комплекс, описанные в первом варианте осуществления изобретения, можно вводить в отдельности или в форме фармацевтической композиции, описанной во втором варианте осуществления изобретения. При введении комбинации, сшитого пролекарства или соединения двойного действия, прежде всего, комплекса, т.е. терапевтически эффективного количества, используют аналогичные дозы независимо от способа введения.
Комбинация, сшитое пролекарство или соединение двойного действия, прежде всего, комплекс являются более эффективными средствами лечения первой линии по сравнению с комбинацией ARB или ингибиторов нейтральной эндопептидазы, которые используют в отдельности, пли по сравнению с другими комбинациями ARB/NEPi, кроме того, их можно комбинировать или перерабатывать более простым способом.
Специфические варианты осуществления настоящего изобретения описаны ниже в примерах. Следует понимать, что указанные примеры приведены только для иллюстрации настоящего изобретения и не ограничивают его объем.
Пример 1
Получение соединения [валсартан (этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты)]Na3·2,5H2O
Для получения соединения двойного действия, содержащего валсартан и этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты (в форме свободной кислоты, 0,42 г. чистота ~95%) и валсартан (в форме свободной кислоты, 0,41 г) растворяли в ацетоне (40 мл). В отдельном сосуде NaOH (0,111 г) растворяли в H2O (7 мл). Два полученных раствора объединяли и перемешивали при комнатной температуре в течение 1 ч, при этом получали прозрачный раствор. Полученный раствор упаривали при 35°C, при этом получали стеклообразное твердое вещество. Затем стеклообразное твердое вещество переносили в ацетон (40 мл), полученную смесь перемешивали и обрабатывали ультразвуком в течение ~5 мин, при этом продукт выпадал в осадок. Полученный осадок отделяли фильтрованием, и твердое вещество сушили при комнатной температуре на открытом воздухе в течение 2 суток до постоянной массы, при этом получали твердое вещество в виде кристаллов.
Данные, полученные с использованием различных аналитических методов, свидетельствуют о том, что продукт содержит валсартан и этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты в виде комплекса в отличие от физической смеси указанных соединений. Согласно данным порошкового рентгеноструктурного анализа, ИК-спектроскопии и спектроскопии комбинационного рассеяния для комплексов наблюдаются пики с высокой интенсивностью, которые отсутствуют в спектрах для физической смеси, подробное описание спектров приводится ниже.
Пример 2
Альтернативный способ получения соединения [валсартан (этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты)]Na3·2,5H2O
Для получения соединения двойного действия - валсартана и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты (в форме свободной кислоты, 22,96 ммоля, чистота ~95%) и валсартан (10,00 г, 22,96 ммоля) растворяли в ацетоне (300 мл). Полученную суспензию перемешивали при комнатной температуре в течение 15 мин, при этом получали прозрачный раствор. Затем в полученный раствор в течение 10 мин добавляли раствор NaOH (2,76 г, 68,90 ммоля) в воде (8 мл), осаждение продукта начиналось через 10 мин. В другом варианте осаждение продукта можно индуцировать добавлением в раствор затравочных кристаллов. Суспензию перемешивали при 20-25°C в течение 2 ч. Полученную суспензию упаривали при 15-30°C при пониженном давлении (180-250 мбар) до объема ~150 мл. Затем добавляли изопропилацетат (150 мл), и суспензию повторно упаривали при 15-30°C при пониженном давлении (180-250 мбар) до объема ~150 мл. Указанную процедуру (добавление изопропилацетата (150 мл) и упаривание) повторяли еще один раз. Суспензию перемешивали при 20-25°C в течение 1 часа. Полученное твердое вещество отделяли фильтрованием на воронке Бюхнера в атмосфере азота, промывали изопропилацетатом (20 мл), и сушили при 35°C при пониженном давлении (20 мбар), при этом получали соединение.
Продукт характеризовали, как описано в примере 1.
Пример 3
Альтернативный способ получения соединения [валсартан (этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты)]Na3·2,5H2 с использованием затравочных кристаллов
В реактор помещали кальциевую соль AHU377 (2,00 кг, 2,323 ммоля) и изопропилацетат (20 л). Суспензию перемешивали при 23±3°C и добавляли 2н. HCl (4,56 л). Смесь перемешивали при 23±3°С в течение 15 мин, при этом получали прозрачный двухфазный раствор. Органический слой отделяли и промывали водой (3×4,00 л). Органический слой упаривали при 22±5°C при пониженном давлении (30-100 мбар) до ~3,5 л (3,47 кг), при этом получали бесцветный раствор свободной кислоты AHU377 в изопропилацетате.
В реактор, описанный выше, содержащий раствор свободной кислоты AHU377 в изопропилацетате (~3,5 л, 3,47 кг), добавляли валсартан (1,984 кг, 4,556 ммоля) и 40 л ацетона. Реакционную смесь перемешивали при 23±3°C, при этом получали прозрачный раствор, который фильтровали в реактор. В реакционную смесь в течение 15-30 мин при 23±3°C добавляли 1 л раствора NaOH (547,6 г, 13,690 ммоля) в воде (раствор предварительно охлаждали до 20±5°C и фильтровали), температуру в реакторе поддерживали при 20-28°С (слабый экзотермический процесс). Колбу промывали водой (190 мл), которую затем добавляли в реакционную смесь. Реакционную смесь перемешивали при 23±3°C в течение 15 мин, затем в качестве затравочных кристаллов добавляли суспензию соединения [валсартан (этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты) Na3·2,5H2O (4,0 г) в изопропилацетате (50 мл). Смесь перемешивали при 23±3°C в течение 2 ч, при этом получали суспензию. Суспензию нагревали при 40±3°C в течение 20 мин, затем в течение 20 мин добавляли изопропилацетат (20 л), температуру внутри реактора поддерживали при 40±3°C. Суспензию перемешивали при указанной температуре в течение еще 30 мин. Смесь концентрировали при 35±5°С (температура в кожухе 45±5°C) при пониженном давлении (200-350 мбар), при этом получали ~35 л суспензии белого цвета (удаляли ~25 л растворителя). Затем добавляли изопропилацетат (30 л), реакционную смесь концентрировали при 35±5°С (температура в кожухе 45±5°С) при пониженном давлении (100-250 мбар), при этом получали ~30 л суспензии белого цвета (удаляли ~40 л растворителя). Затем снова добавляли изопропилацетат (40 л), реакционную смесь концентрировали при 35±5°C (температура в кожухе 45±5°C) при пониженном давлении (100-250 мбар), при этом получали ~30 л суспензии белого цвета (удаляли ~30 л растворителя). Реакционную смесь охлаждали до 23±3°C в течение ~20 мин и перемешивали при указанной температуре в течение еще 3 ч. Твердое вещество отделяли фильтрованием на воронке Бюхнера в атмосфере азота через слой полипропилена. Твердое вещество промывали изопропилацетатом (2×5 л) и сушили при 35°C при пониженном давлении (20 мбар) до остаточного содержания изопропилацетата <0,5%, при этом получали продукт, указанный выше, в виде твердого вещества белого цвета.
Продукт характеризовали, как описано в примере 1.
Порошковый рентгеноструктурный анализ
При расчете межплоскостных расстояний с использованием порошковой рентгенограммы, полученной на порошковом дифрактометре Scintag XDS2000 для наиболее интенсивных пиков получены следующие результаты: d в [Å]: 21,2 (s), 17,0 (w), 7,1 (s), 5,2 (w), 4,7 (w), 4,6 (w), 4,2 (w), 3,5 (w), 3,3(w).
Стандартное отклонение для всех величин межплоскостных расстояний составляет ±0,1 Å. Для обозначения степени интенсивности пиков использовали следующие сокращения: (w) низкая, (m) средняя и (st) высокая интенсивность.
Стандартные отклонения для средних величин 29 в градусах составляет ±0,2, полученные величины приведены ниже: 4,5, 5,5, 5,6, 9,9, 12,8, 15,7, 17,0, 17,1, 17.2, 18,3, 18,5, 19,8, 21,5, 21,7, 23,2, 23,3, 24,9, 25,3, 27,4, 27,9, 28,0, 30,2.
Элементный анализ
Данные элементного анализа приведены ниже. Полученные результаты соответствуют соединению общей формулы (C48H55N6O8Na3)·2,5H2O
Найдено: C 60,05%, H 6,24%, N 8.80%,
Рассчитано: C 60,18%, H: 6,31%, N: 8,77%.
ИК-спектроскопия
Образец характеризовали с использованием метода ИК-спектроскопии с Фурье-преобразованием в комбинации с методом нарушенного полного внутреннего отражения (ATR-FTIR). ИК-спектр получали на спектрометре Nicolet Magna-IR 560. Соединение характеризуется следующим спектром (волновое число, см-1): 2956 (w), 1711 (st), 1637 (st), 1597 (st), 1488 (w), 1459 (m), 1401 (st), 1357 (w), 1295 (m), 1266 (m), 1176 (w), 1085 (m), 1010 (w), 942(w), 907 (w), 862 (w), 763 (st), 742 (m), 698 (m), 533 (st).
При анализе данных ИК-ATR, стандартное отклонение для всех полос поглощения составляет ±2 см-1.
Для обозначения степени интенсивности полос поглощения использовали следующие сокращения: (w) низкая, (m) средняя и (st) высокая интенсивность.
Спектроскопия комбинационного рассеивания (рамановская спектроскопия)
Образец характеризовали методом комбинационного рассеяния, спектр получали на раман-спектрометре (фирмы Kaiser Optical Systems, Inc.), при длине волны излучения 785 нм. Соединение характеризуется следующим спектром (волновое число, см-1): 3061 (m), 2930 (m, ушир.), 1612 (st), 1523 (m), 1461 (w), 1427 (w), 1287 (st), 1195 (w), 1108 (w), 11053 (w), 1041 (w), 1011 (w), 997 (m), 866(w), 850 (w), 822 (w), 808 (w), 735 (w), 715 (w), 669 (w), 643 (w), 631 (w), 618 (w), 602 (w), 557 (w), 522 (w), 453 (w), 410 (w), 328 (w).
При анализе данных спектроскопии комбинационного рассеивания, стандартное отклонение для всех полос поглощения составляет ±2 см-1.
Для обозначения степени интенсивности полос поглощения используют следующие сокращения: (w) низкая, (m) средняя и (st) высокая интенсивность.
13С-ЯМР-спектроскопия высокого разрешения с кросс-поляризацией и вращением под магическим углом (CP-MAS)
Образцы характеризовали методом 13С-ЯМР-спектроскопии высокого разрешения с кросс-поляризацией и вращением под магическим углом (CP-MAS) на ЯМР-спектрометре Bruker-BioSpin AVANCE 500, снабженном высокомощным датчиком 1H (300 Вт), двумя высокомощными Х-усилителями (500 Вт), необходимыми для подавления высокой мощности предусилителями, контроллером MAS и датчиком BioSolids Bruker 4 мм высокого разрешения.
Каждый образец помещали в ротор ZrO2 размером 4 мм. При измерении спектров использовали следующие критические параметры: время контактирования 13С 3 мс, скорость вращения под магическим углом 12 КГц, с линейным изменением времени контактирования и при использовании схемы усиления сигнала 1Н "SPINAL64", при накоплении сигнала с интервалом 10 с, проведено 1024 измерения при температуре 293К. Химические сдвиги определяли при сравнении со сдвигом внешнего стандарта - карбонила глицина 176,04 част./млн.
Результаты анализа 13С-ЯМР-спектроскопии CP-MAS высокого разрешения представлены ниже в виде наиболее значительных пиков (част./млн): 179,0, 177,9, 177,0, 176,7, 162,0, 141,0, 137,2, 129,6, 129,1, 126,7, 125,3, 64,0, 61,5, 60,4, 50,2, 46,4, 40,6, 38,6, 33,5, 32,4, 29,8, 28,7, 22,3, 20,2, 19,1, 17,8, 16,8, 13,1, 12,1, 11,1.
Физическая смесь натриевых солей валсартана и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты характеризуется спектром простой инертной смеси двух солей. Однако спектр для образца комплекса, полученного в примере 1, характеризуется совершенно различными спектральными характеристиками по сравнению со смесью натриевых солей 1:1.
Методы дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (TGA)
Образец характеризовали методом дифференциальной сканирующей калориметрии (ДСК) на калориметре Q1000 (фирмы ТА Instruments). Температуры начала плавления и максимального пика на кривой ДСК для соединения составляют 139°C и 145°C, соответственно.
Согласно данным методов ДСК и TGA при нагревании гидратная вода удаляется в два этапа, первый этап отмечается при температуре менее 100°C, а второй этап выше 120°C.
Анализы ДСК и TGA проводили при скорости нагрева 10 К/мин.
Пример 4
Получение сшитого пролекарства, структура которого приведена на схеме (1)
Для получения сшитого пролекарства кальциевой соли валсартана и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, кальциевую соль валсартана (114 мг) и этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты (в форме свободной кислоты, 86 мг) растворяли в метаноле (2 мл), затем метанол упаривали. Стеклообразный твердый остаток переносили в ацетонитрил (3 мл) и обрабатывали ультразвуком в течение 10 мин, затем перемешивали на магнитной мешалке в течение 20 ч. Твердое вещество белого цвета (приблизительно 120 мг) отделяли фильтрованием. По данным жидкостной хроматографии (ЖХ) и элементного анализа продукт содержит этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты и валсартан в соотношении 1:1. Согласно данным порошкового рентгеноструктурного анализа продукт характеризуется аморфной структурой.
Получение сшитого пролекарства, структура которого приведена на схеме (2)
Для получения сшитого пролекарства кальциевой соли валсартана и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты, кальциевую соль валсартана (57 мг), этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты (в форме свободной кислоты, 43 мг) и трис(гидроксиметил)аминометан (трис, 12,6 мг) растворяли при комнатной температуре в метаноле (2 мл), затем метанол упаривали. Стеклообразный твердый остаток переносили в ацетонитрил (3 мл) и обрабатывали ультразвуком в течение 10 мин, затем перемешивали на магнитной мешалке в течение 20 ч. Твердое вещество белого цвета (приблизительно 83 мг) отделяли фильтрованием. По данным жидкостной хроматографии (ЖХ) и элементного анализа продукт содержит этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты и валсартан в соотношении 1:1. Согласно данным порошкового метода рентгеноструктурного анализа продукт характеризуется аморфной структурой.
В то время как настоящее изобретение описано со ссылкой на специфические варианты осуществления изобретения, представляется очевидным, что возможны многочисленные изменения, модификации и варианты, не выходящие за пределы изобретательской сущности изобретения. Соответственно все такие изменения, модификации и варианты включены в сущность и широкий объем изобретения, как заявлено в формуле изобретения. Все заявки, патенты и другие публикации, перечисленные в данном контексте, включены в полном объеме в настоящее описание.
Изобретение относится к соединению двойного действия, характеризующегося суммарной формулой [((S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валин)этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты]Na1-3·xH2O в твердой форме, где x равен от 0 до 3, которое является антагонистом рецептора ангиотензина и ингибитора NEP, и может быть использовано для лечения гипертензии. 6 н. и 13 з.п. ф-лы, 1 табл., 4 пр.
1. Соединение двойного действия, характеризующееся суммарной формулой [((S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валин)этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты]Na1-3·xH2O, в твердой форме, где x равен от 0 до 3, не являющееся полупентагидратом тринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты].
2. Соединение по п.1 в кристаллической форме.
3. Соединение по п.1 в форме гидрата.
4. Соединение по любому из пп.1-3, характеризующееся суммарной формулой [((S)-N-валерил-N-{[2'-(1H-тетразол-5-ил)бифенил-4-ил]метил}валин)этиловый эфир (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты]Na3·xH2O, где x равен от 0 до 3.
5. Соединение по п.4, в котором x равен 0, 1, 2 или 3.
6. Соединение двойного действия по любому из пп.1-5, получаемое путем:
(1) растворения (S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валина и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты в подходящем растворителе;
(2) растворения натриевого основания в пригодном растворителе;
(3) объединения растворов, полученных на стадиях (1) и (2);
(4) осаждения твердого вещества и его высушивания с получением соединения двойного действия; или альтернативно
получение соединения двойного действия путем замены растворителя (растворителей), использованных на стадиях (1) и (2), посредством
(4a) упаривания полученного раствора досуха;
(5a) повторного растворения твердого вещества в подходящем растворителе;
(6a) осаждения твердого вещества и его высушивания с получением соединения двойного действия.
7. Соединение по п.6, где подходящим растворителем на стадиях (1) и/или (5a) является ацетон.
8. Соединение по п.6, где натриевым основанием является NaOH, Na2CO3, NaHCO3, NaOMe, NaOAc или NaOCHO.
9. Соединение по п.6 в кристаллической форме.
10. Соединение по любому из пп.6-9 в форме гидрата.
11. Фармацевтическая композиция для лечения гипертензии или сердечной недостаточности, включающая (a) соединение по любому из пп.1-10 и (b) по меньшей мере одну фармацевтически приемлемую добавку.
12. Фармацевтическая композиция по п.11, где фармацевтически приемлемая добавка выбрана из группы, включающей разбавители или наполнители, дезинтегрирующие агенты, глиданты, смазывающие агенты, связующие, красители и их комбинации.
13. Способ получения соединения двойного действия по любому из пп.1-10, который включает стадии:
(1) растворения (S)-N-валерил-N-{[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил}валина и этилового эфира (2R,4S)-5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилвалериановой кислоты в подходящем растворителе;
(2) растворения натриевого основания в подходящем растворителе;
(3) объединения растворов, полученных на стадиях (1) и (2);
(4) осаждения твердого вещества и его высушивания с получением соединения двойного действия; или альтернативно
получение соединения двойного действия путем замены растворителя (растворителей), использованных на стадиях (1) и (2), посредством
(4a) упаривания полученного раствора досуха;
(5a) повторного растворения твердого вещества в подходящем растворителе;
(6a) осаждения твердого вещества и его высушивания с получением соединения двойного действия.
14. Способ по п.13, где подходящим растворителем на стадиях (1) и/или (5a) является ацетон.
15. Способ по п.13 или 14, где натриевым основанием является NaOH, Na2CO3, NaHCO3, NaOMe, NaOAc или NaOCHO.
16. Применение соединения по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения или профилактики состояния или заболевания, выбранного из группы, включающей гипертензию и сердечную недостаточность (острую и хроническую).
17. Фармацевтическая композиция для лечения гипертензии и сердечной недостаточности, включающая:
(a) соединение по любому из пп.1-10 или полупентагидраттринатриевой соли [3-((1S,3R)-1-бифенил-4-илметил-3-этоксикарбонил-1-бутилкарбамоил)пропионат-(S)-3'-метил-2'-(пентаноил{2''-(тетразол-5-илат)бифенил-4'-илметил}амино)масляной кислоты] в твердой форме;
(b) терапевтический агент, выбранный из антидиабетического агента, гиполипидемического агента, агента против ожирения и антигипертензивного агента; и
(c) по меньшей мере одну фармацевтически приемлемую добавку.
18. Фармацевтическая композиция по п.17, где терапевтический агент представляет собой безилат амлодипина.
19. Фармацевтическая композиция по п.17, где терапевтический агент представляет собой гидрохлортиазид.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для испытания горных пород | 1973 |
|
SU443983A1 |
| US 5217996 A, 08.06.1993 | |||
| СОЛИ ВАЛСАРТАНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ | 2001 |
|
RU2275363C2 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2014-01-10—Публикация
2006-11-08—Подача