ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к циклическому карбодиимидному соединению.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Полиэфиры, полиамиды, полиимиды, поликарбонаты и полиуретаны применяются для различных целей, поскольку они обладают отличными механическими свойствами. Поскольку эти полимеры содержат гидролизуемую сложноэфирную связь, амидную связь, имидо-связь, карбонатную связь и уретановую связь в молекуле, соответственно, может возникать проблема с надежностью при их использовании в более жестких условиях, и необходимы срочные предупредительные меры.
Поскольку каталитическому гидролизу гидролизуемой связи, такой как сложноэфирная связь, способствует существование полярной группы, такой как карбоксильная группа, в молекуле, предлагается способ подавления этого недостатка с использованием агента замыкания для карбоксильной группы для снижения концентрации карбоксильной группы (патентный документ 1 и патентный документ 2).
В качестве агента замыкания для кислотной группы, такой как карбоксильная группа, используют моно- или поликарбодиимидное соединение, принимая во внимание стабильность и реактивность агента замыкания и цвет получаемого продукта, и получают некоторый эффект. Однако поскольку моно- или поликарбодиимидное соединение представляет собой линейное карбодиимидное соединение, в момент его использования образуется побочное летучее изоцианатное соединение, приводя к такому существенному недостатку как образование неприятного запаха, загрязняя, таким образом, рабочее помещение. Существует необходимость в разработке агента замыкания, имеющего более высокую реакционную способность и не обладающего таким недостатком.
Патентный документ 3 раскрывает макроциклическое карбодиимидное соединение, содержащее уретановую связь и полимерную цепь с молекулярной массой от 100 до 7000. Поскольку макроциклическое карбодиимидное соединение имеет высокую молекулярную массу, оно имеет низкую эффективность в качестве агента замыкания для кислотных групп. В патентном документе 3 не принимается во внимание предотвращение образования неприятного запаха.
(Патентный документ 1) JP-A 2004-332166
(Патентный документ 2) JP-A 2005-350829
(Патентный документ 3) WO2008/081230
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение циклического карбодиимидного соединения, которое является полезным в качестве стабилизатора для полимеров, содержащих гидролизуемую функциональную группу, таких как полиэфиры. Еще одной целью настоящего изобретения является обеспечение способа получения циклического карбодиимидного соединения. Еще одной целью настоящего изобретения является обеспечение агента замыкания конца цепи для полимерных соединений, который включает циклическое карбодиимидное соединение в качестве активного ингредиента. Еще одной целью настоящего изобретения является обеспечение агента захвата для кислотных групп, который включает циклическое карбодиимидное соединение в качестве активного ингредиента.
Авторы настоящего изобретения провели глубокие исследования агента замыкания, который препятствует высвобождению изоцианатного соединения, даже когда он взаимодействует с кислотной группой, такой как карбоксильная группа. Как результат, было обнаружено, что, даже когда карбодиимидное соединение, содержащее циклическую структуру, взаимодействует с кислотной группой, оно не высвобождает изоцианатное соединение и не образует неприятный запах, таким образом, не загрязняя рабочее помещение. Настоящее изобретение было создано на основании этого открытия.
Таким образом, настоящее изобретение включает следующие изобретения.
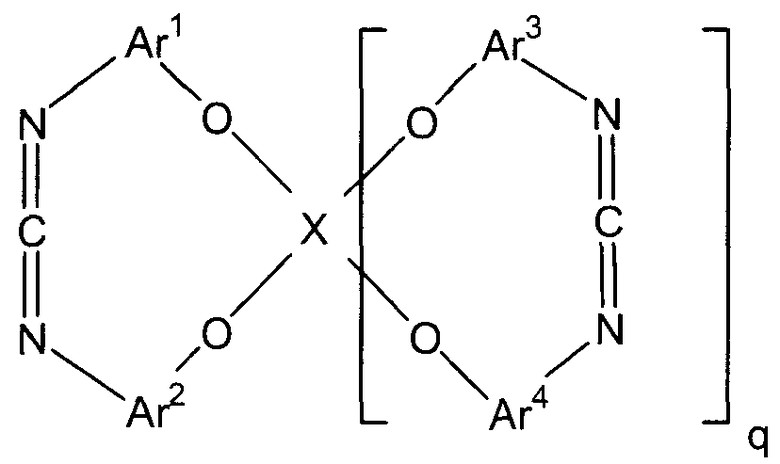
1.Циклическое карбодиимидное соединение, представленное следующей формулой (i):
 (i)
(i)
(в представленной выше формуле X представляет собой любую из двухвалентных групп, представленных следующими формулами (i-1)-(i-3), или четырехвалентную группу, представленную следующей формулой (i-4), когда X является двухвалентным, q имеет значение 0, и когда X является четырехвалентным, q имеет значение 1, и Ar1-Ar4, каждый независимо, представляют собой ароматическую группу и могут быть замещены алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой)
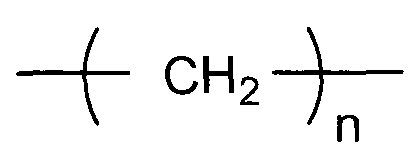 (i-1)
(i-1)
(в представленной выше формуле n представляет собой целое число, имеющее значение от 1 до 6)
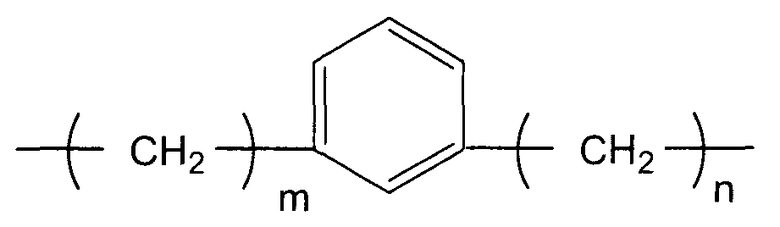 (i-2)
(i-2)
(в представленной выше формуле m и n, каждый независимо, представляют собой целое число, имеющее значение от 0 до 3)
 (i-3)
(i-3)
(в представленной выше формуле R1 и R2, каждый независимо, представляют собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу)
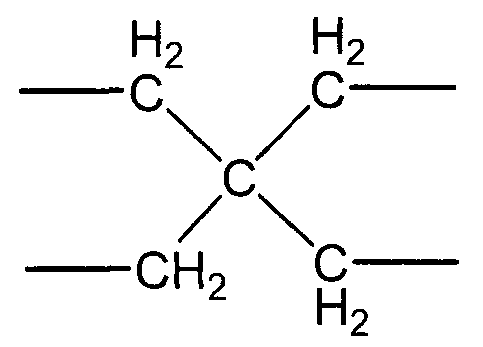 (i-4)
(i-4)
2. Соединение, указанное выше в параграфе 1, где Ar1-Ar4, каждый независимо, представляют собой ортофениленовую группу или 1,2-нафталин-диильную группу, которая может быть замещена алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой.
3. Способ получения циклического карбодиимидного соединения, указанного выше в параграфе 1, включающий следующие стадии:
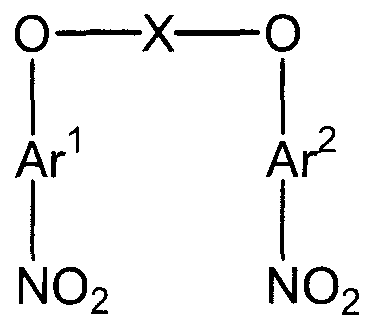
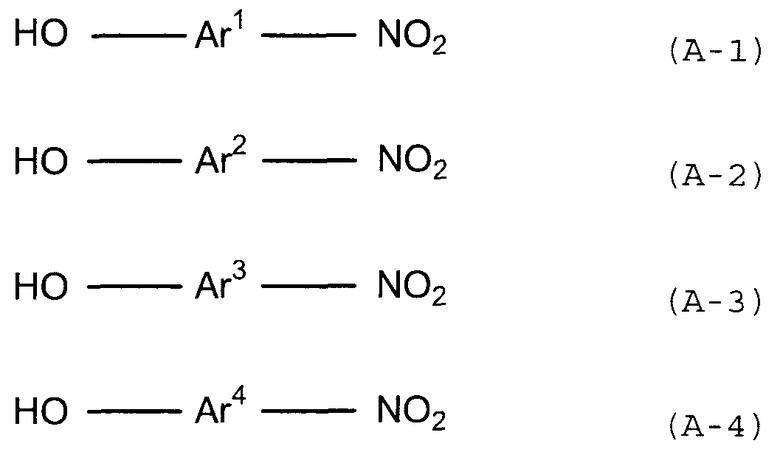
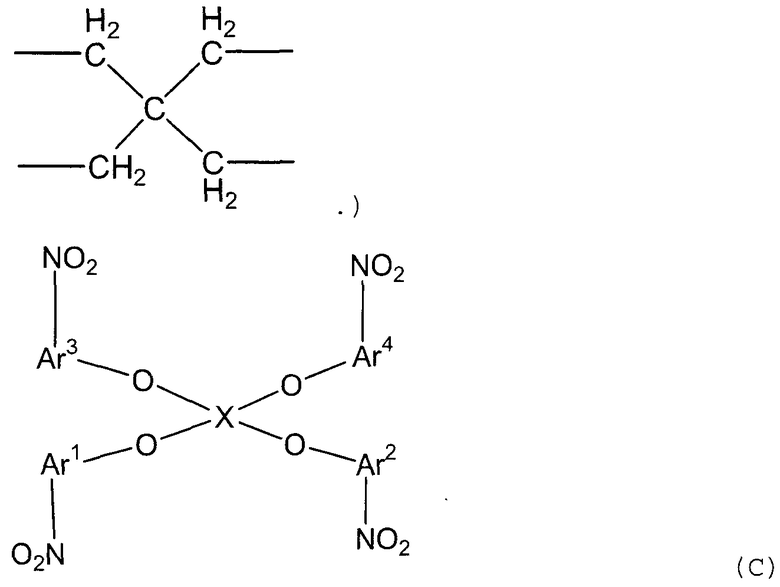
(1) (1a) взаимодействие соединения следующей формулы (a-1), соединения следующей формулы (a-2) и соединения следующей формулы (b-1) с получением нитросоединения, представленного следующей формулой (c):

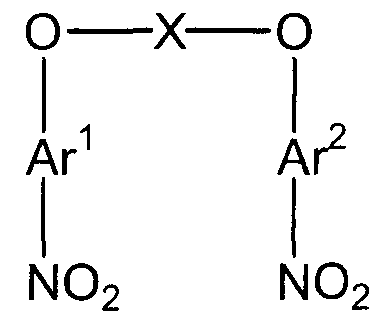 (c)
(c)
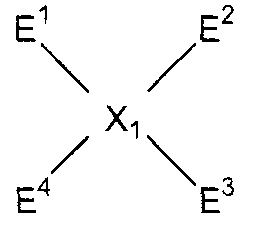
(в представленных выше формулах X, Ar1 и Ar2 имеют значения, определенные выше в формуле (i), и E1 и E2, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу) (примеры атома галогена в настоящем изобретении включают атом хлора, атом брома и атом иода);
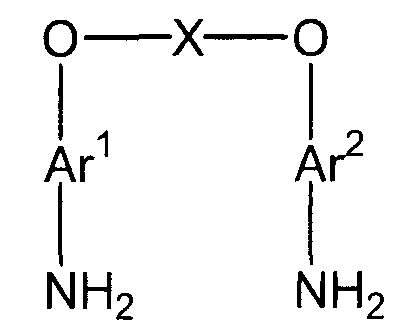
(2) (2a) восстановление полученного нитросоединения с получением соединения амина, представленного следующей формулой (d):
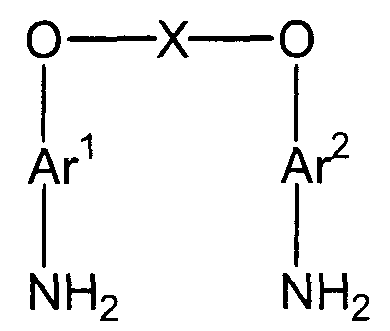 (d)
(d)
(в представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i));
(3) (3a) взаимодействие полученного соединения амина с трифенилфосфиндибромидом с получением трифенилфосфинового соединения, представленного следующей формулой (e-1):
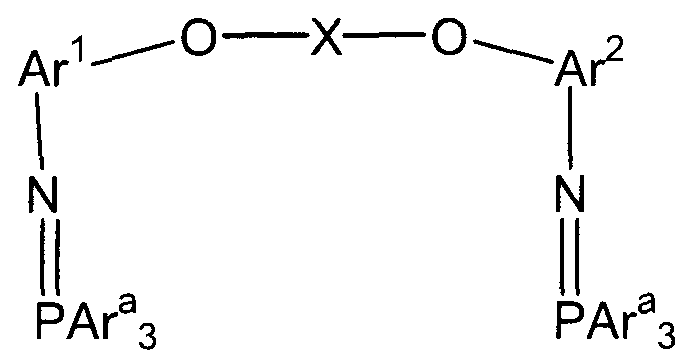 (e-1)
(e-1)
(в представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и Ara представляет собой фенильную группу); и
(4) (4a) изоцианирование полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизация изоцианированного продукта непосредственно с получением соединения следующей формулы (f):
 (f)
(f)
(в представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i)).
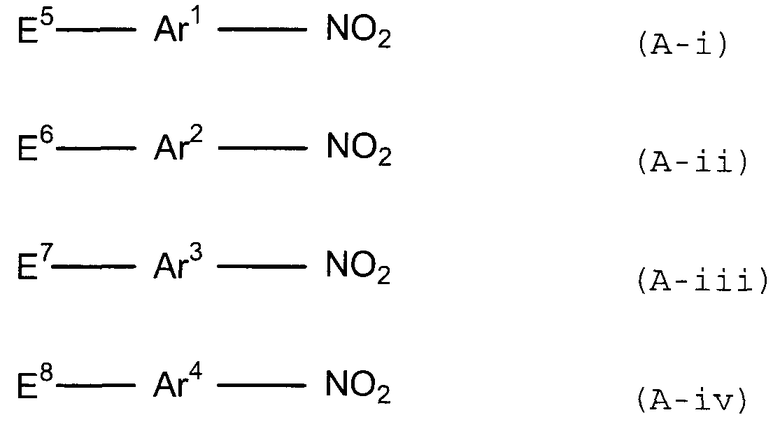
4. Способ, указанный выше в параграфе 3, где стадия (1a) представляет собой стадию (1b) взаимодействия соединения следующей формулы (a-i), соединения следующей формулы (a-ii) и соединения следующей формулы (b-i):

(в представленных выше формулах Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и E3 и E4, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу).
5. Способ, указанный выше в параграфе 3 или 4, где стадия (3a) представляет собой стадию (3b) взаимодействия соединения амина с диоксидом углерода или дисульфидом углерода с получением соединения мочевины или соединения тиомочевины, представленного следующей формулой (e-2):
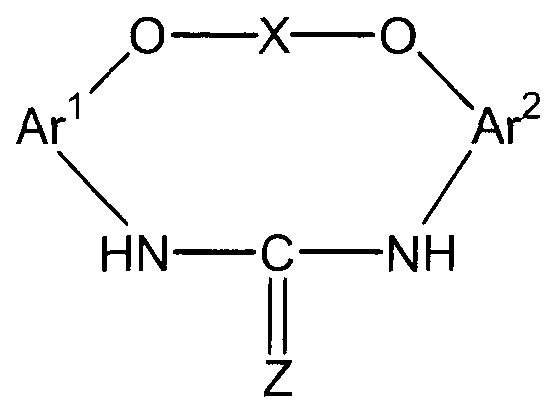 (е-2)
(е-2)
(в представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и Z представляет собой атом кислорода или атом серы); и
стадия (4a) представляет собой стадию (4b) дегидратации полученного соединения мочевины или десульфуризации соединения тиомочевины.
6. Способ получения циклического карбодиимидного соединения, указанного выше в параграфе 1, включающий следующие стадии:
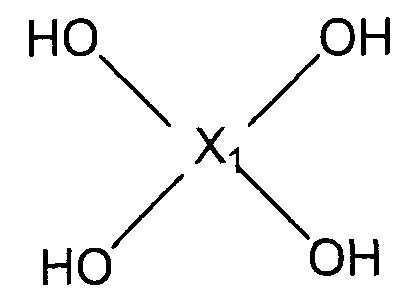
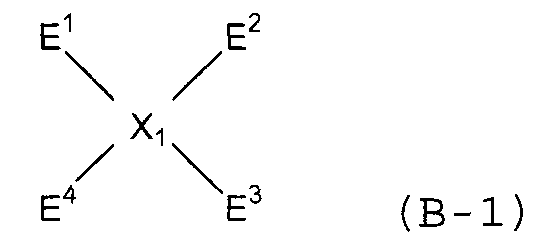
(1) (1A) взаимодействие соединений следующих формул (A-1)-(A-4) и соединения следующей формулы (B-1) с получением нитросоединения следующей формулы (C);

 (В-1)
(В-1)
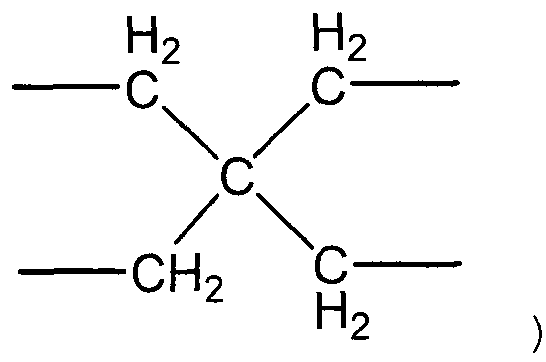
(Х1 представляет собой
 (С)
(С)
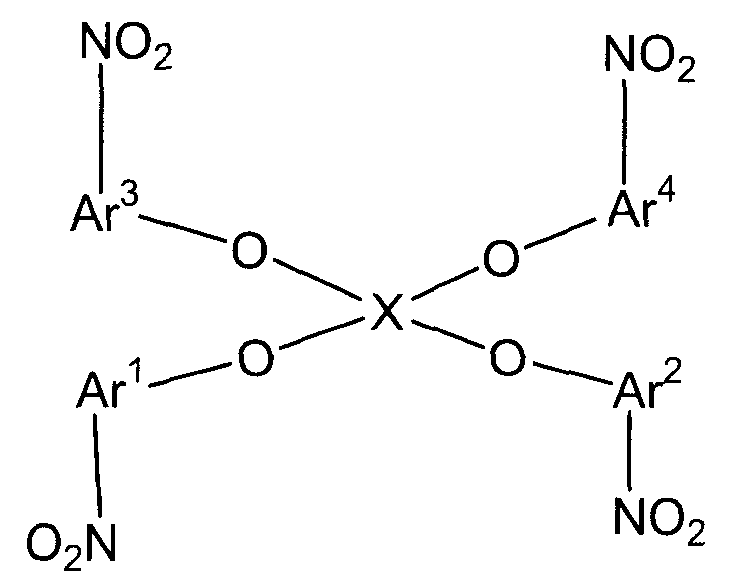
(в представленных выше формулах Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и E1-E4, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу);
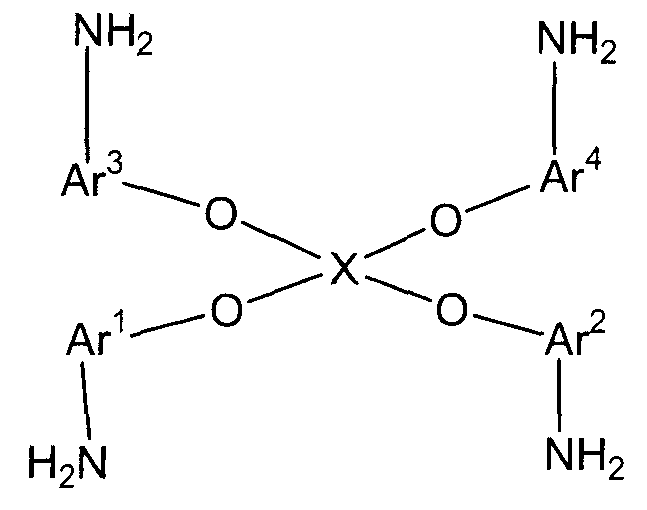
(2) (2A) восстановление полученного нитросоединения с получением соединения амина следующей формулы (D):
 (D)
(D)
(в представленной выше формуле Ar1-Ar4 и X имеют значения, определенные выше в формуле (i));
(3) (3A) взаимодействие полученного соединения амина с трифенилфосфиндибромидом с получением трифенилфосфинового соединения следующей формулы (E-1):
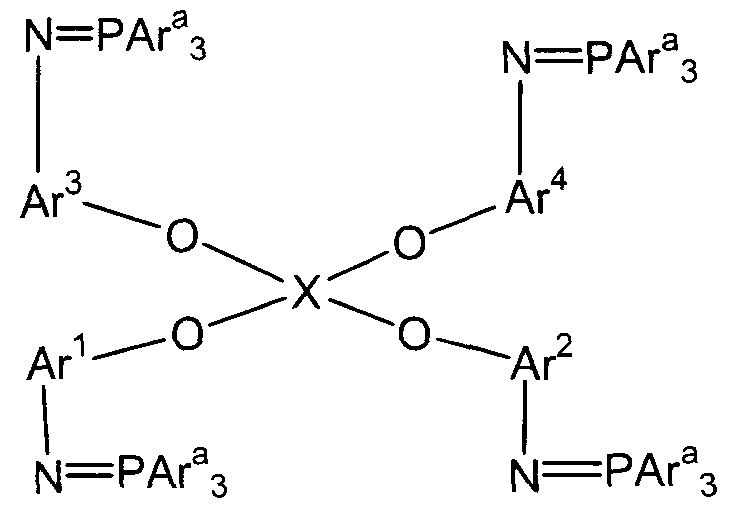 (E-1)
(E-1)
(в представленной выше формуле Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и Ara представляет собой фенильную группу); и
(4) (4A) изоцианирование полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизация изоцианированного продукта непосредственно с получением соединения следующей формулы (F):
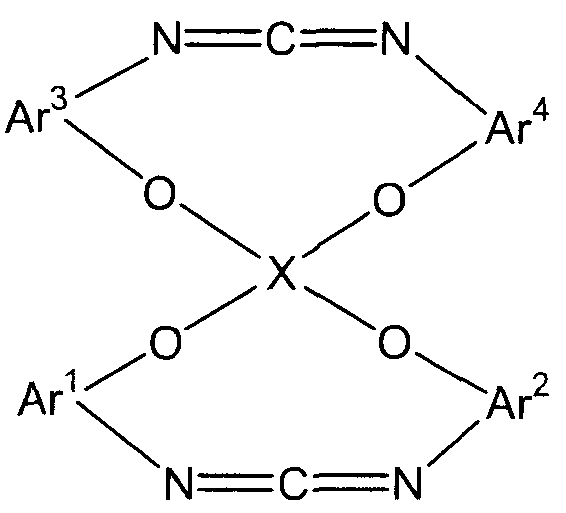 (F)
(F)
(в представленной выше формуле Ar1-Ar4 и X имеют значения, определенные выше в формуле (i)).
7. Способ, указанный выше в параграфе 6, где стадия (1A) представляет собой стадию (1B) взаимодействия соединений следующих формул (A-i)-(A-iv) и соединения следующей формулы (B-i) с получением нитросоединения формулы (C):

 (B-i)
(B-i)
(Х1 представляет собой
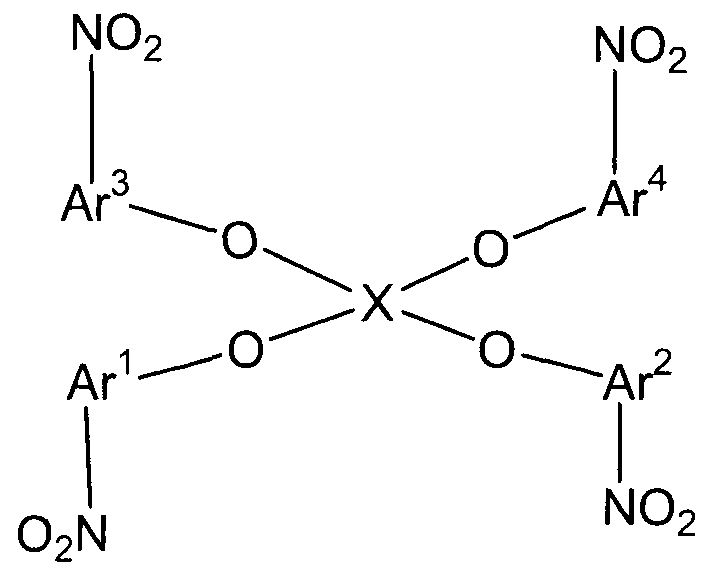 (С)
(С)
(в представленных выше формулах Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и E5-E8, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу).
8. Способ, указанный выше в параграфе 6 или 7, где стадия (3A) представляет собой стадию (3B) взаимодействия соединения амина с диоксидом углерода или дисульфидом углерода с получением соединения мочевины или соединения тиомочевины следующей формулы (E-2):
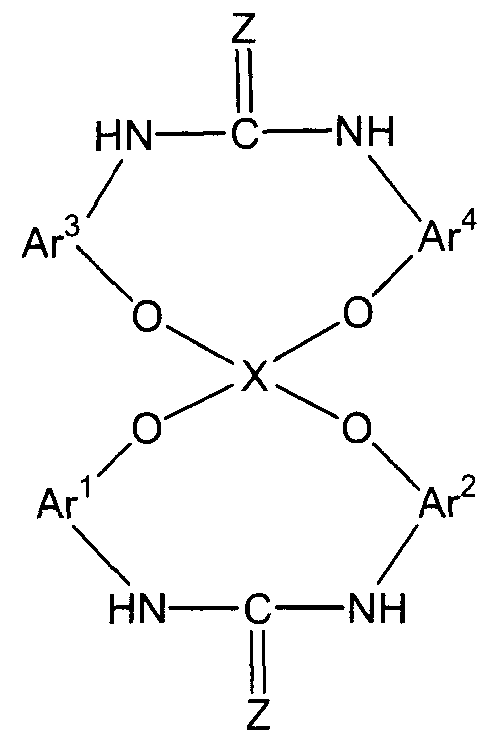 (E-2)
(E-2)
(в представленной выше формуле Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и Z представляет собой атом кислорода или атом серы); и
стадия (4A) представляет собой стадию (4B) дегидратации полученного соединения мочевины или десульфуризации соединения тиомочевины.
9. Агент замыкания конца цепи для полимерных соединений, содержащий циклическое карбодиимидное соединение представленной выше формулы (i) в качестве активного ингредиента.
10. Агент захвата для кислотной группы, содержащий циклическое карбодиимидное соединение представленной выше формулы (i) в качестве активного ингредиента.
ЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
<Циклическое карбодиимидное соединение>
Настоящее изобретение представляет собой циклическое карбодиимидное соединение, представленное следующей формулой (i).
 (i)
(i)
В представленной выше формуле Ar1-Ar4, каждый независимо, представляют собой ароматическую группу. Ароматическая группа может быть замещена алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой. Примеры ароматической группы включают ароматические группы, содержащие от 5 до 15 атомов углерода, такие как фениленовая группа и нафталин-диильная группа.
Примеры алкильной группы, содержащей от 1 до 6 атомов углерода, в качестве заместителя включают метильную группу, этильную группу, н-пропильную группу, втор-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, втор-бутильную группу, изобутильную группу, н-пентильную группу, втор-пентильную группу, изопентильную группу, н-гексильную группу, втор-гексильную группу и изогексильную группу. Присутствие алкильной группы, содержащей от 1 до 6 атомов углерода, или фенильной группы, как ожидается, увеличит совместимость с полимером, таким как полиэфир, и усилит функцию циклического карбодиимидного соединения по настоящему изобретению. Кроме того, можно ожидать эффект подавления летучести циклического карбодиимидного соединения.
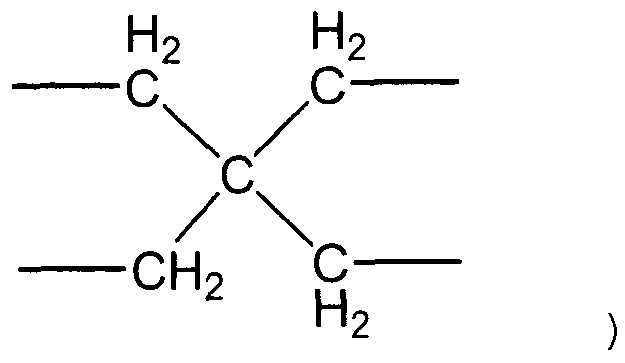
X представляет собой двухвалентную или четырехвалентную группу. Когда X представляет собой двухвалентную группу, q имеет значение 0, а когда X представляет собой четырехвалентную группу, q имеет значение 1. Предпочтительно, X представляет собой двухвалентную группу следующей формулы (i-1).
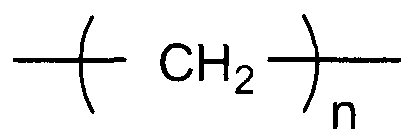 (i-1)
(i-1)
В представленной выше формуле n представляет собой целое число, имеющее значение от 1 до 6. Предпочтительные примеры группы формулы (i-1) включают метиленовую группу, этиленовую группу, 1,3-пропиленовую группу, 1,4-бутиленовую группу, 1,5-пентановую группу и 1,6-гексановую группу. Углерод, который не является непосредственно связанным с кислородом в 1,3-пропиленовой группе, 1,4-бутиленовой группе, 1,5-пентановой группе или 1,6-гексановой группе, может быть замещен по меньшей мере одной группой, выбранной из группы, включающей алкильную группу, содержащую от 1 до 6 атомов углерода, и фенильную группу. Примеры алкильной группы, содержащей от 1 до 6 атомов углерода, включают метильную группу, этильную группу, н-пропильную группу, втор-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, втор-бутильную группу, изобутильную группу, н-пентильную группу, втор-пентильную группу, изопентильную группу, н-гексильную группу, втор-гексильную группу и изогексильную группу.
X предпочтительно представляет собой группу следующей формулы (i-2).
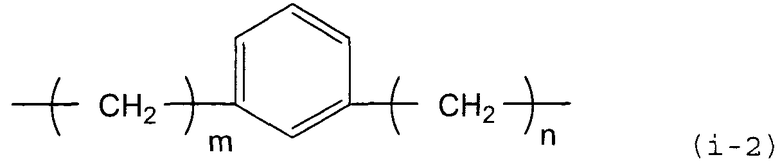
В представленной выше формуле m и n, каждый независимо, представляют собой целое число, имеющее значение от 0 до 3. Метиленовая группа представленной выше формулы, в которой m=0, содержит простую связь. Когда X содержит 1,3-фениленовую группу, стабильность циклического карбодиимидного соединения по настоящему изобретению еще более повышается, и полимерное соединение можно использовать при более высокой температуре процесса, что является выгодным.
X предпочтительно представляет собой группу следующей формулы (i-3).
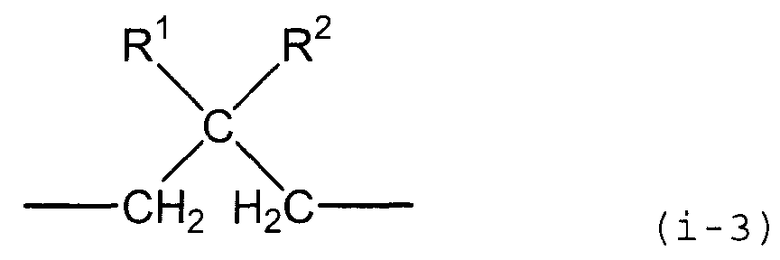
В представленной выше формуле R1 и R2, каждый независимо, представляют собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу. Примеры алкильной группы, содержащей от 1 до 6 атомов углерода, включают метильную группу, этильную группу, н-пропильную группу, втор-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, втор-бутильную группу, изобутильную группу, н-пентильную группу, втор-пентильную группу, изопентильную группу, н-гексильную группу, втор-гексильную группу и изогексильную группу.
X предпочтительно представляет собой четырехвалентную группу следующей формулы (i-4).

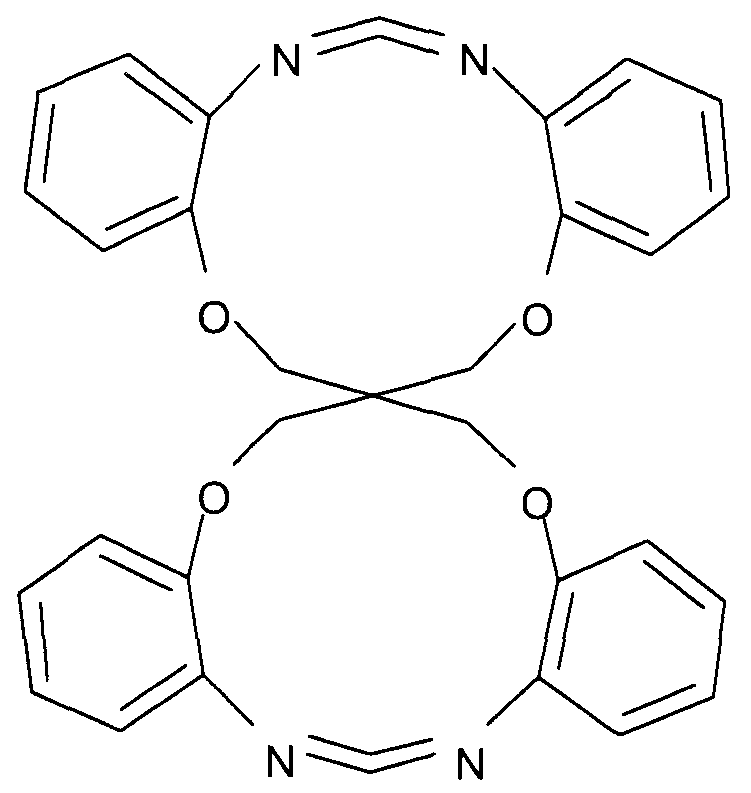
Примеры циклического карбодиимидного соединения по настоящему изобретению включают моноциклическое соединение следующей формулы (f) и бициклическое соединение следующей формулы (F).
 (f)
(f)
В представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i). Ar1 и Ar2, каждый, предпочтительно представляют собой o-фениленовую группу, которая может быть замещена. Заместитель предпочтительно представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу. X представляет собой двухвалентную группу.
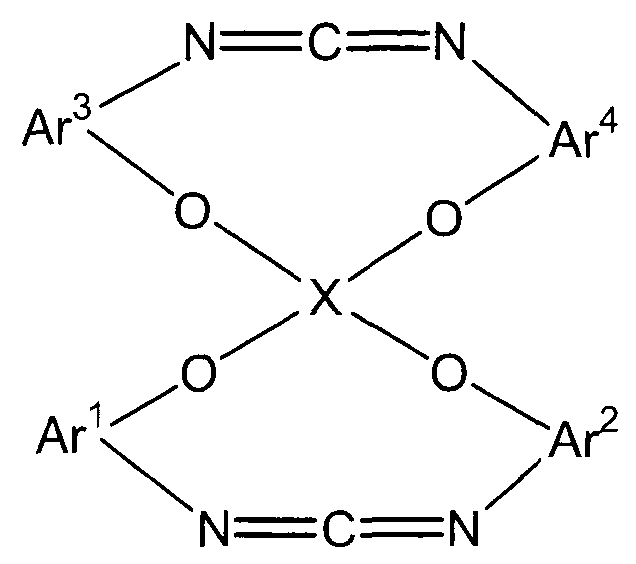 (F)
(F)
В представленной выше формуле Ar1-Ar4 и X имеют значения, определенные в формуле (i). Ar1-Ar4, каждый, предпочтительно представляют собой o-фениленовую группу, которая может быть замещена. Заместитель предпочтительно представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу. X представляет собой четырехвалентную группу.
Предпочтительно, циклическое карбодиимидное соединение по настоящему изобретению содержит две o-фениленовые группы, связанные с 1-положением и 3-положением карбодиимидной группы, кислород эфира в орто-положении карбодиимидной группы в o-фениленовых группах и образует циклическую структуру, в которой атомы кислорода эфира взаимосвязаны посредством X.
Таким образом, соединение, представленное следующей формулой, является предпочтительным.
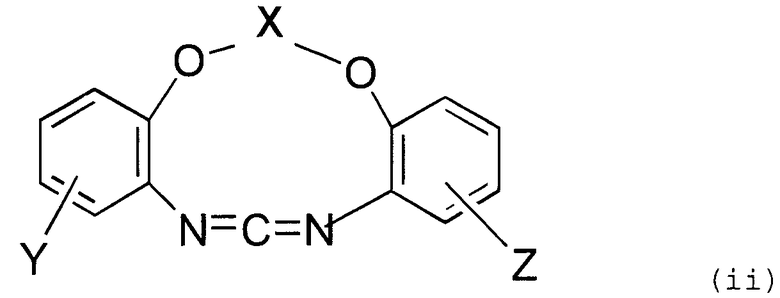
В представленной выше формуле X имеет значение, определенное в формуле (i) выше. Y и Z, каждый независимо, представляют собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу. Примеры алкильной группы, содержащей от 1 до 6 атомов углерода, включают метильную группу, этильную группу, н-пропильную группу, втор-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, втор-бутильную группу, изобутильную группу, н-пентильную группу, втор-пентильную группу, изопентильную группу, н-гексильную группу, втор-гексильную группу и изогексильную группу.
Следующие соединения представлены в качестве примеров циклического карбодиимидного соединения по настоящему изобретению.
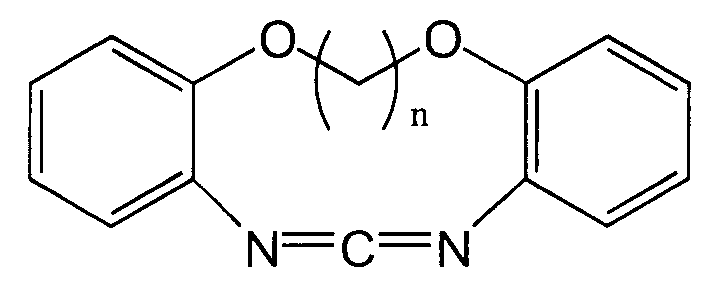
(n представляет собой целое число, имеющее значение от 1 до 6.)
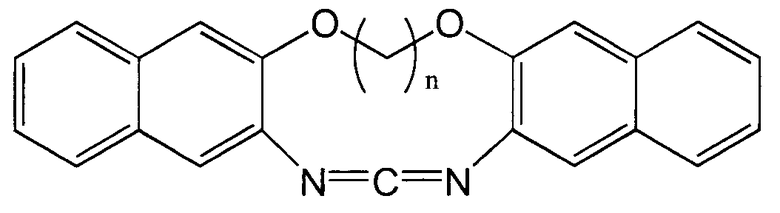
(n представляет собой целое число, имеющее значение от 1 до 6.)
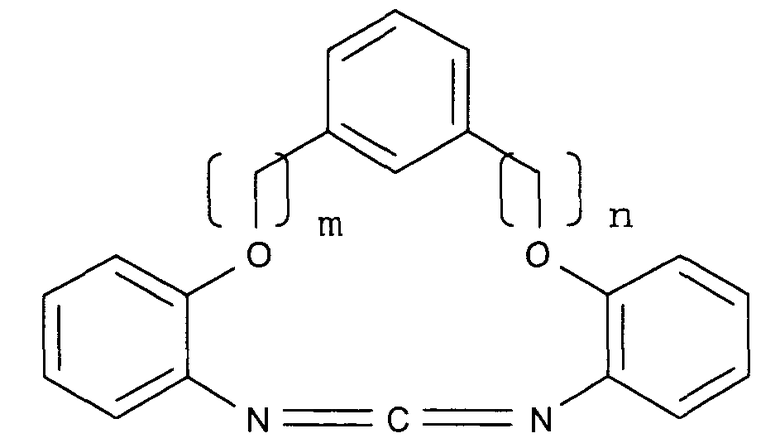
(m представляет собой целое число, имеющее значение от 0 до 3, и n представляет собой целое число, имеющее значение от 0 до 3.)
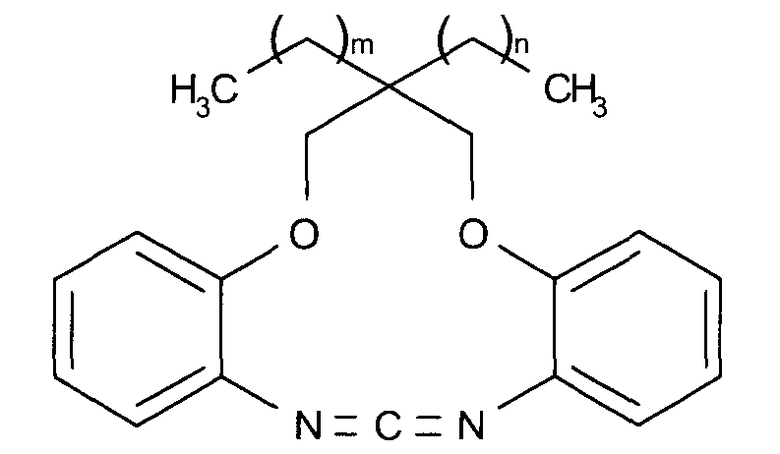
(m представляет собой целое число, имеющее значение от 0 до 5, и n представляет собой целое число, имеющее значение от 0 до 5.)

(n представляет собой целое число, имеющее значение от 0 до 5.)

(m и p, каждый, представляют собой целое число, имеющее значение от 1 до 5, и n представляет собой целое число, имеющее значение от 1 до 6.)

(n представляет собой целое число, имеющее значение от 1 до 6.)
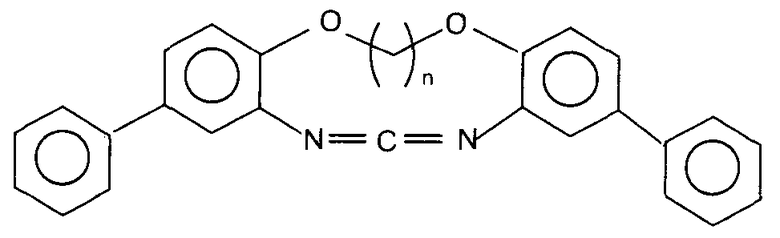
(n представляет собой целое число, имеющее значение от 1 до 6.)
Молекулярная масса циклического карбодиимидного соединения по настоящему изобретению предпочтительно составляет от 100 до 1000. Когда молекулярная масса ниже чем 100, структурная стабильность и летучесть циклического карбодиимидного соединения могут быть проблематичными. Когда молекулярная масса выше чем 1000, необходимо осуществлять синтез в разбавленной системе для получения циклического карбодиимида, или выход снижается, вызывая, таким образом, проблемы себестоимости. С этой точки зрения, более предпочтительно, когда молекулярная масса циклического карбодиимидного соединения составляет от 100 до 750, еще более предпочтительно от 250 до 750. Циклическое карбодиимидное соединение по настоящему изобретению содержит одну карбодиимидную группу в одном кольце. Когда оно содержит две или более карбодиимидные группы в одном кольце, изоцианатное соединение получают посредством реакции замыкания конца цепи, тем самым, вызывая неприятный запах.
<Получение моноциклического карбодиимидного соединения (f)>
Моноциклическое карбодиимидное соединение (f) по настоящему изобретению можно получить через следующие стадии (1)-(4).
Стадия (1) представляет собой стадию получения нитросоединения (c). Стадия (1) включает стадию (1a) и стадию (1b). Стадия (2) представляет собой стадию получения амидного соединения (d) из нитросоединения (c). Стадия (3) и стадия (4) представляют собой стадии получения моноциклического карбодиимидного соединения (f) из амидного соединения (d). Стадии (3)-(4) включают вариант воплощения, который включает стадию (3a) - стадию (4a) и стадию (3b) - стадию (4b).
Более конкретно, карбодиимидное соединение (f) можно получить в соответствии со следующими схемами.
(схема 1) стадия (1a) - стадия (2a) - стадия (3a) - стадия (4a)
(схема 2) стадия (1a) - стадия (2a) - стадия (3b) - стадия (4b)
(схема 3) стадия (1b) - стадия (2a) - стадия (3b) - стадия (4b)
(схема 4) стадия (1b) - стадия (2a) - стадия (3a) - стадия (4a)
(стадия (1a))
Стадия (1a) представляет собой стадию получения нитросоединения (c) следующей формулы путем взаимодействия соединения следующей формулы (a-1), соединения следующей формулы (a-2) и соединения следующей формулы (b-1).

 (с)
(с)
В представленных выше формулах X, Ar1 и Ar2 имеют значения, определенные выше в формуле (i). X представляет собой двухвалентную группу.
E1 и E2, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу. Примеры атома галогена включают атом хлора, атом брома и атом иода.
Для этой реакции можно использовать широко известный способ синтеза простого эфира. Например, можно использовать реакцию Вильямсона, в которой соединение формулы (a-1), соединение формулы (a-2) и соединение формулы (b-1) подвергают взаимодействию в растворителе в присутствии щелочного соединения.
Гидрид натрия, металлический натрий, гидроксид натрия, гидроксид калия или карбонат калия используют в качестве щелочного соединения. N,N-диметилформамид, N-метил-2-пирролидон или тетрагидрофуран используют в качестве растворителя. Температура реакции составляет предпочтительно от 25 до 150°C. Хотя реакция быстро протекает в указанных выше условиях, можно добавить межфазный катализатор для промотирования реакции.
(стадия (1b))
Стадия (1b) представляет собой стадию получения нитросоединения следующей формулы (c) путем взаимодействия соединения следующей формулы (a-i), соединения следующей формулы (a-ii) и соединения следующей формулы (b-i).

 (с)
(с)
В представленных выше формулах Ar1, Ar2 и X имеют значения, определенные выше в формуле (i). X представляет собой двухвалентную группу. E3 и E4, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу.
Для этой реакции можно использовать широко известный способ синтеза простого эфира. Например, можно использовать реакцию Вильямсона, в которой соединение формулы (a-i), соединение формулы (a-ii) и соединение формулы (b-i) подвергают взаимодействию в растворителе в присутствии щелочного соединения.
Гидрид натрия, металлический натрий, гидроксид натрия, гидроксид калия или карбонат калия используют в качестве щелочного соединения. N,N-диметилформамид, N-метил-2-пирролидон или тетрагидрофуран используют в качестве растворителя. Температура реакции составляет предпочтительно от 25 до 150°C. Хотя реакция быстро протекает в указанных выше условиях, для промотирования реакции можно добавить межфазный катализатор. Тетрабутиламмониевую соль, триоктилметиламмониевую соль, бензилдиметилоктадециламмониевую соль или краун-эфир используют в качестве межфазного катализатора.
(стадия (2))
Стадия (2) представляет собой стадию получения соединения амина (d) следующей формулы путем восстановления полученного нитросоединения (c).
 (d)
(d)
Ar1, Ar2 и X имеют значения, определенные выше в формуле (i). X представляет собой двухвалентную группу.
Для этой реакции можно использовать широко известный способ. Например, нитросоединение (c) подвергают каталитическому восстановлению в растворителе в присутствии водорода и катализатора.
Палладий на углероде, композит палладий на углероде-этилендиамин, палладий-фиброин, палладий-полиэтиленимин, никель или медь используют в качестве катализатора. Метанол, этанол, изопропиловый спирт, диоксан, тетрагидрофуран, этилацетат, дихлорметан, хлороформ или N,N-диметилформамид используют в качестве растворителя. Температура реакции составляет предпочтительно от 25 до 100°C. Хотя реакция протекает при нормальном давлении, для промотирования реакции, предпочтительно, прилагают давление.
Что касается реакции для получения соединения амина (d), нитросоединение (c) можно подвергнуть взаимодействию с кислотой и металлом, или нитросоединение (c) можно подвергнуть взаимодействию с гидразином и катализатором.
(стадия (3a))
Стадия (3a) представляет собой стадию получения трифенилфосфинового соединения (e-1) следующей формулы путем взаимодействия полученного соединени амина (d) с трифенилфосфиндибромидом.
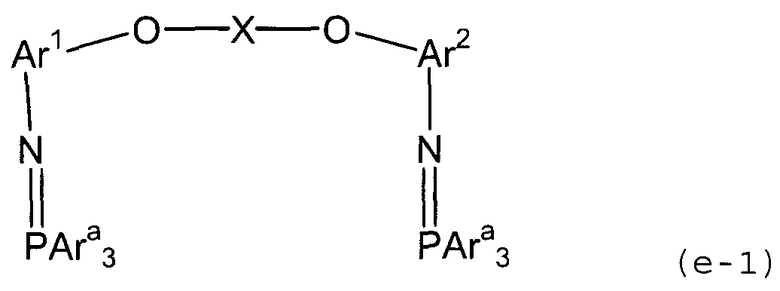
В представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i). Ara представляет собой фенильную группу.
Для этой реакции можно использовать широко известный способ. Например, соединение амина формулы (d) подвергают взаимодействию с трифенилфосфиндибромидом в растворителе в присутствии щелочного соединения. Триэтиламин или пиридин используют в качестве щелочного соединения. Дихлорэтан, хлороформ или бензол используют в качестве растворителя. Температура реакции составляет предпочтительно от 0 до 80°C.
(стадия (4a))
Стадия (4a) представляет собой стадию получения циклического карбодиимидного соединения (f) путем изоцианирования полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизации изоцианированного продукта непосредственно.
Для этой реакции можно использовать широко известный способ. Например, трифенилфосфиновое соединение формулы (e-1) подвергают взаимодействию в растворителе в присутствии ди-трет-бутилдикарбоната и N,N-диметил-4-аминопиридина. Дихлорметан или хлороформ используют в качестве растворителя. Температура реакции составляет предпочтительно от 10 до 40°C.
(стадия (3b))
Стадия (3b) представляет собой стадию получения соединения мочевины или соединения тиомочевины следующей формулы (e-2) путем взаимодействия соединения амина (d) с диоксидом углерода или дисульфидом углерода.
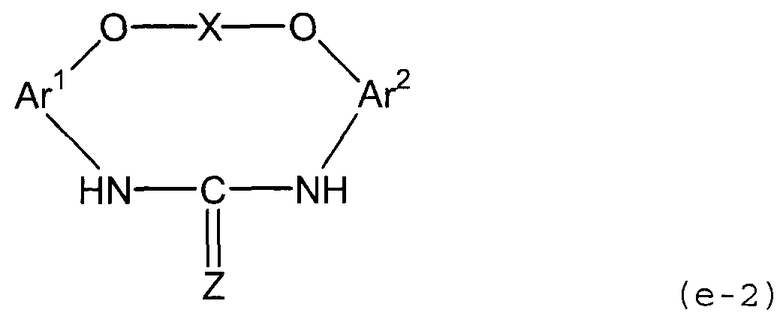
В представленной выше формуле Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и Z представляет собой атом кислорода или атом серы.
Для этой реакции можно использовать широко известный способ получения соединения мочевины (e-2). Например, соединение амина (d) подвергают взаимодействию в растворителе в присутствии диоксида углерода, фосфорного соединения и щелочного соединения.
Эфир фосфористой кислоты или эфир фосфоновой кислоты используют в качестве фосфорного соединения. Триэтиламин, пиридин, имидазол или пиколин используют в качестве щелочного соединения. Пиридин, N,N-диметилформамид, ацетонитрил, хлорбензол или толуол используют в качестве растворителя. Температура реакции составляет предпочтительно от 0 до 80°C.
В качестве другой реакции для получения соединения мочевины (e-2), соединение амина (d) подвергают взаимодействию с оксидом углерода, или соединение амина (d) подвергают взаимодействию с фосгеном.
Для этой реакции можно использовать широко известный способ получения соединения тиомочевины (e-2). Например, соединение амина (d) подвергают взаимодействию в растворителе в присутствии дисульфида углерода и щелочного соединения.
Триэтиламин, пиридин, имидазол или пиколин используют в качестве щелочного соединения. Ацетон, метанол, этанол, изопропиловый спирт, 2-бутанон, пиридин, N,N-диметилформамид или ацетонитрил используют в качестве растворителя. Температура реакции составляет предпочтительно от 25 до 90°C. Хотя реакция быстро протекает в указанных выше условиях, можно использовать тетрабромид углерода для промотирования реакции.
(стадия (4b))
Стадия (4b) представляет собой стадию получения циклического карбодиимидного соединения (f) путем дегидратации полученного соединения мочевины (e-2) или десульфуризации соединения тиомочевины (e-2).
Для этой реакции можно использовать широко известный способ. Например, соединение мочевины или соединение тиомочевины (e-2) подвергают взаимодействию в растворителе в присутствии толуолсульфонилхлорида или метилсульфонилхлорида для дегидратации соединения мочевины (e-2) или десульфуризации соединения тиомочевины (e-2).
Дихлорметан, хлороформ или пиридин используют в качестве растворителя. Температура реакции составляет предпочтительно от 0 до 80°C.
В качестве другой реакции для получения циклического карбодиимидного соединения (f), соединение мочевины (e-2) подвергают взаимодействию с оксидом ртути, или соединение тиомочевины (e-2) подвергают взаимодействию с гипохлоритом натрия.
<Получение бициклического карбодиимидного соединения (F)>
Бициклическое карбодиимидное соединение (F) по настоящему изобретению можно получить через следующие стадии (1)-(4).
Стадия (1) представляет собой стадию получения нитросоединения (C). Стадия (1) включает стадию (1A) и стадию (1B). Стадия (2) представляет собой стадию получения амидного соединения (D) из нитросоединени (C). Стадия (3) и стадия (4) представляют собой стадии получения бициклического карбодиимидного соединения (F) из амидного соединения (D). Стадии (3)-(4) включают вариант воплощения, включающий стадию (3A) - стадию (4A) и стадию (3B) - стадию (4B).
Карбодиимидное соединение (F) можно получить в соответствии со следующими схемами.
(схема 1) стадия (1A) - стадия (2A) - стадия (3A) - стадия (4A)
(схема 2) стадия (1A) - стадия (2A) - стадия (3B) - стадия (4B)
(схема 3) стадия (1B) - стадия (2A) - стадия (3B) - стадия (4B)
(схема 4) стадия (1B) - стадия (2A) - стадия (3A) - стадия (4A)
(стадия (1A))
Стадия (1A) представляет собой стадию получения нитросоединения следующей формулы (C) путем взаимодействия соединений следующих формул (A-1)-(A-4) и соединения следующей формулы (B-1).
(Х1 представляет собой
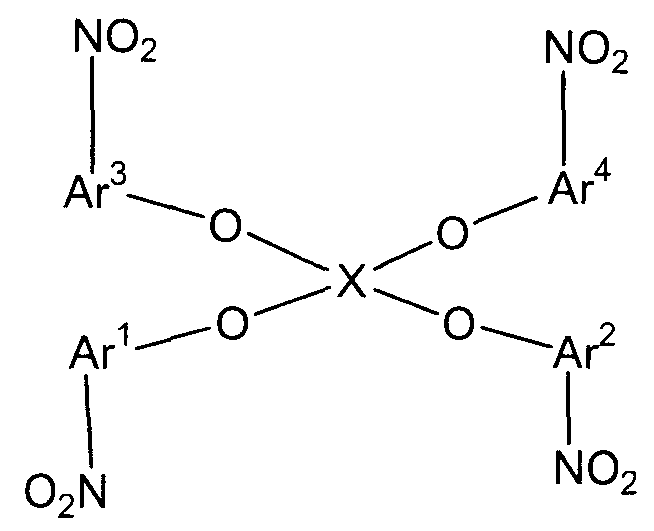 (С)
(С)
В представленных выше формулах Ar1-Ar4 и X имеют значения, определенные в формуле (i). X представляет собой четырехвалентную группу. E1-E4, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу.
Условия реакции аналогичны условиям, описанным выше для стадии (1a).
(стадия (1B))
Стадия (1B) представляет собой стадию получения нитросоединения следующей формулы (C) путем взаимодействия соединений следующих формул (A-i)-(A-iv) и соединения следующей формулы (B-1).

(Х1 представляет собой
В представленных выше формулах Ar1-Ar4 и X имеют значения, определенные в формуле (i). E5-E8, каждый независимо, представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу.
Условия реакции аналогичны условиям, описанным выше для стадии (1b).
(стадия (2A))
Стадия (2A) представляет собой стадию получения соединения амина (D) следующей формулы путем восстановления полученного нитросоединения.

Ar1-Ar4 и X имеют значения, определенные в формуле (i). Условия реакции аналогичны условиям, описанным выше для стадии (2a).
(стадия (3A))
Стадия (3A) представляет собой стадию получения трифенилфосфинового соединения (E-1) следующей формулы путем взаимодействия полученного соединения амина (D) с трифенилфосфиндибромидом.
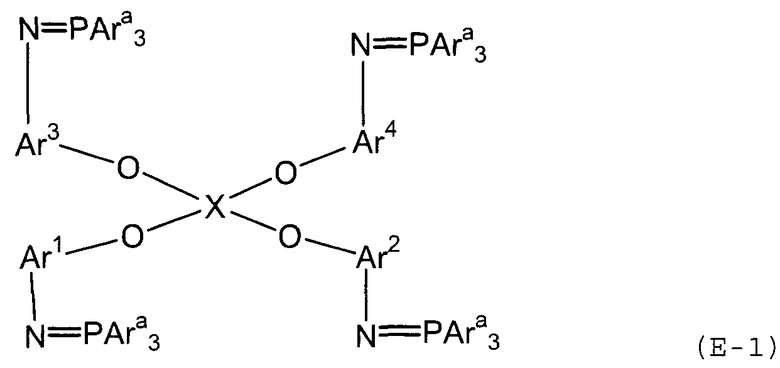
В представленной выше формуле Ar1-Ar4 и X имеют значения, определенные в формуле (i), и Ara представляет собой фенильную группу. Условия реакции аналогичны условиям, описанным выше для стадии (3a).
(стадия (4A))
Стадия (4A) представляет собой стадию получения соединения (F) следующей формулы путем изоцианирования полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизации изоцианированного продукта непосредственно.

В представленной выше формуле Ar1-Ar4 и X имеют значения, определенные в формуле (i). Условия реакции аналогичны условиям, описанным выше для стадии (4a).
(стадия (3B))
Стадия (3B) представляет собой стадию получения соединения мочевины или тиомочевины (E-2) следующей формулы путем взаимодействия соединения амина с диоксидом углерода или дисульфидом углерода.
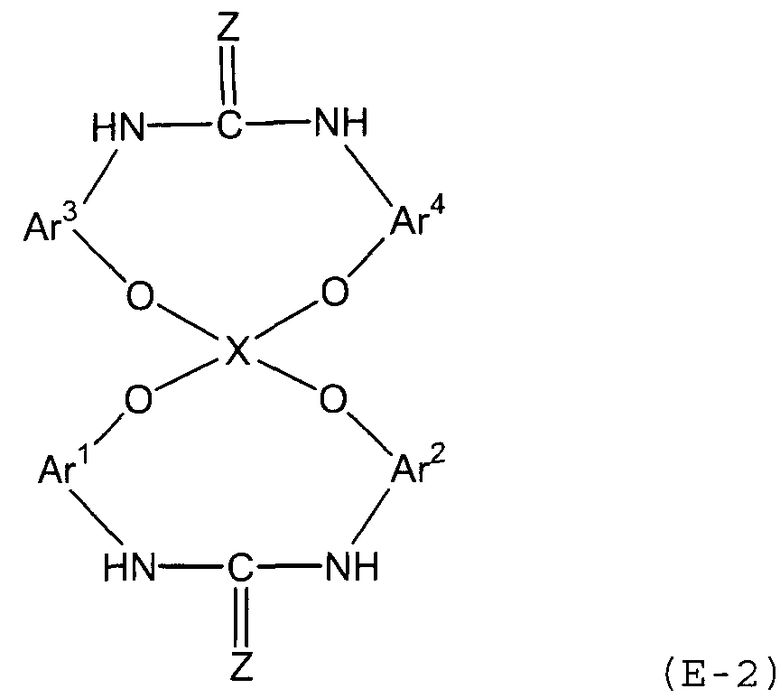
В представленной выше формуле Ar1-Ar4 и X имеют значения, определенные в формуле (i), и Z представляет собой атом кислорода или атом серы.
Условия реакции аналогичны условиям, описанным выше для стадии (3b).
(стадия (4B))
Стадия (4B) представляет собой стадию получения соединения (F) следующей формулы путем дегидратации полученного соединения мочевины или десульфуризации соединения тиомочевины.
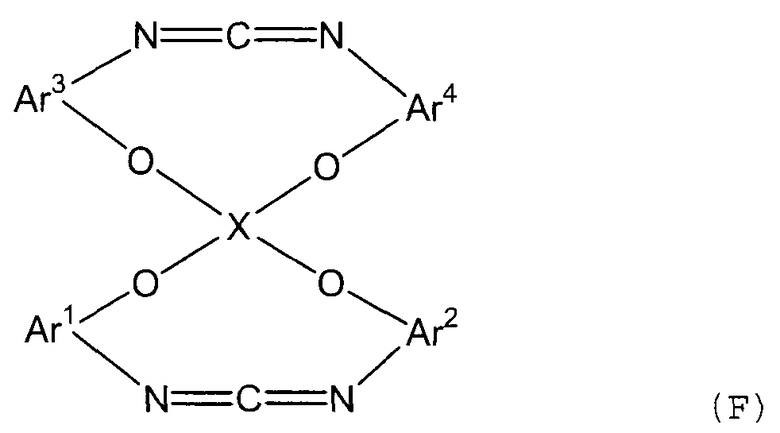
В представленной выше формуле Ar1-Ar4 и X имеют значения, определенные в формуле (i).
Условия реакции аналогичны условиям, описанным выше для стадии (4b).
(Другие способы получения)
Циклическое карбодиимидное соединение по настоящему изобретению можно получить при помощи широко известных способов, помимо описанного выше способа получения. Например, его получают из соединения амина через изоцианатное соединение, из соединения амина через изоцианатное соединение или из карбоновокислотного соединения через изоцианатное соединение.
Циклическое карбодиимидное соединение может эффективно замыкать кислотную группу полимерного соединения. Можно, но необязательно, использовать в сочетании широко известный агент замыкания для карбоксильной группы полимера, при условии, что он не работает против объекта настоящего изобретения. В качестве широко известного агента замыкания карбоксильной группы можно использовать агенты, раскрытые в JP-A 2005-2174, такие как эпоксисоединения, оксазолиновые соединения и оксазиновые соединения.
<Полимерное соединение>
В настоящем изобретении полимерное соединение, для которого используют циклическое карбодиимидное соединение, содержит кислотную группу. Кислотная группа представляет собой по меньшей мере одну группу, выбранную из группы, включающей карбоксильную группу, сульфонатную группу, сульфинатную группу, фосфонатную группу и фосфинатную группу. Полимерное соединение представляет собой по меньшей мере одно соединение, выбранное из группы, включающей полиэфир, полиамид, полиамид-имид, полиимид и полиэфирамид.
Полиэфир представляет собой, например, полимер или сополимер, полученный путем поликонденсации по меньшей мере одного соединения, выбранного из дикарбоновой кислоты или ее эфир-образующего производного, с диолом или его эфир-образующим производным, гидроксикарбоновой кислотой или ее эфир-образующим производным или лактоном, предпочтительно термопластичной полиэфирной смолой. Термопластичная полиэфирная смола может содержать сшитую структуру, обработанную источником образования радикалов, таким как энергетически активная линия или окислитель, для достижения формуемости.
Примеры указанных выше дикарбоновой кислоты или ее эфир-образующего производного включают ароматические дикарбоновые кислоты и их эфир-образующие производные, такие как терефталевая кислота, изофталевая кислота, фталевая кислота, 2,6-нафталиндикарбоновая кислота, 1,5-нафталиндикарбоновая кислота, бис(п-карбоксифенил)метан, антрацендикарбоновая кислота, 4,4'-дифениловый эфир дикарбоновой кислоты, 5-тетрабутилфосфоний-изофталевая кислота и 5-натрий-сульфоизофталевая кислота. Также включены алифатические дикарбоновые кислоты, такие как щавелевая кислота, янтарная кислота, адипиновая кислота, себациновая кислота, азелаиновая кислота, додекандиовая кислота, малоновая кислота, глутаровая кислота и димерная кислота, и их эфир-образующие производные. Кроме того, также включены алициклические дикарбоновые кислоты, такие как 1,3-циклогександикарбоновая кислота и 1,4-циклогександикарбоновая кислота, и их эфир-образующие производные.
Примеры указанного выше диола или его эфир-образующего производного включают алифатические гликоли, содержащие от 2 до 20 атомов углерода, такие как этиленгликоль, пропиленгликоль, 1,3-пропандиол, 1,4-бутандиол, неопентилгликоль, 1,5-пентандиол, 1,6-гександиол, декаметиленгликоль, циклогександиметанол, циклогександиол и димерный диол. Также включены длинноцепочечные гликоли, имеющие молекулярную массу от 200 до 100000, такие как полиэтиленгликоль, политриметиленгликоль, поли-1,2-пропиленгликоль и политетраметиленгликоль. Кроме того, также включены ароматические диоксисоединения, такие как 4,4'-дигидроксибифенил, гидрохинон, трет-бутилгидрохинон, бисфенол A, бисфенол S и бисфенол F, и их эфир-образующие производные.
Примеры указанной выше гидроксикарбоновой кислоты включают гликолевую кислоту, молочную кислоту, гидроксипропионовую кислоту, оксимасляную кислоту, оксивалериановую кислоту, гидроксикапроновую кислоту, гидроксибензойную кислоту, п-гидроксибензойную кислоту, 6-гидрокси-2-нафтойную кислоту и их эфир-образующие производные. Примеры указанного выше лактона включают капролактон, валеролактон, пропиолактон, ундекалактон и 1,5-оксепан-2-он.
Ароматические полиэфиры, полученные путем поликонденсации ароматической дикарбоновой кислоты или ее эфир-образующего производного и алифатического диола или его эфир-образующего производного, в качестве основных ингредиентов включают полимеры, полученные путем поликонденсации ароматической карбоновой кислоты или ее эфир-образующего производного, предпочтительно, терефталевой кислоты или нафталин-2,6-дикарбоновой кислоты или их эфир-образующего производного, и алифатического диола, выбранного из этиленгликоля, 1,3-пропандиола и бутандиола или его эфир-образующего производного, в качестве основных ингредиентов.
Предпочтительные конкретные примеры ароматических полиэфиров включают полиэтилентерефталат, полиэтиленнафталат, политриметилентерефталат, политриметиленнафталат, полибутилентерефталат, полибутиленнафталат, полиэтилен(терефталат/изофталат), политриметилен(терефталат/изофталат), полибутилен(терефталат/изофталат), полиэтилентерефталат·полиэтиленгликоль, политриметилентерефталат·полиэтиленгликоль, полибутилентерефталат·полиэтиленгликоль, полибутиленнафталат·полиэтиленгликоль, полиэтилентерефталат·поли(тетраметиленоксид)гликоль, политриметилентерефталат·поли(тетраметиленоксид)гликоль, полибутилентерефталат·поли(тетраметиленоксид)гликоль, полибутиленнафталат·поли(тетраметиленоксид)гликоль, полиэтилен(терефталат/изофталат)·поли(тетраметиленоксид)гликоль, политриметилен(терефталат/изофталат)·поли(тетраметиленоксид) гликоль, полибутилен(терефталат/изофталат)·поли(тетраметиленоксид) гликоль, полибутилен(терефталат/сукцинат), полиэтилен(терефталат/сукцинат), полибутилен(терефталат/адипат) и полиэтилен(терефталат/адипат).
Алифатические полиэфиры включают полимеры, включающие алифатическую гидроксикарбоновую кислоту в качестве основного составляющего компонента, полимеры, полученные путем поликонденсации алифатической поликарбоновой кислоты или ее эфир-образующего производного и алифатического многоатомного спирта в качестве основных ингредиентов, и их сополимеры.
Полимеры, включающие алифатическую гидроксикарбоновую кислоту в качестве основного составляющего компонента, включают поликонденсаты, такие как гликолевая кислота, молочная кислота, гидроксипропионовая кислота, гидроксимасляная кислота, гидроксивалериановая кислота и гидроксикапроновая кислота, и их сополимеры. Из них особенно предпочтительными для использования являются полигликолевая кислота, полимолочная кислота, поли(3-гидроксикарбономасляная кислота), поли(4-полигидроксимасляная кислота), поли(3-гидроксигексановая кислота), поликапролактон и их сополимеры. Используют поли(L-молочную кислоту), поли(D-молочную кислоту), стереокомплексную полимолочную кислоту и рацемическую полимолочную кислоту.
Полимеры, включающие алифатическую поликарбоновую кислоту и алифатический многоатомный спирт в качестве основных составляющих компонентов, также используют в качестве полиэфира. Примеры поликарбоновой кислоты включают алифатические дикарбоновые кислоты, такие как щавелевая кислота, янтарная кислота, адипиновая кислота, себациновая кислота, азелаиновая кислота, додекандиовая кислота, малоновая кислота, глутаровая кислота и димерная кислота. Также включены алициклические дикарбоновокислотные звенья, такие как 1,3-циклогександикарбоновая кислота и 1,4-циклогександикарбоновая кислота и их эфир-образующие производные.
Примеры диольного компонента включают алифатические гликоли, содержащие от 2 до 20 атомов углерода, такие как этиленгликоль, 1,3-пропандиол, 1,4-бутандиол, неопентилгликоль, 1,5-пентандиол, 1,6-гександиол, декаметиленгликоль, циклогександиметанол, циклогександиол и димерный диол. Также включены длинноцепочечные гликоли, имеющие молекулярную массу от 200 до 100000, например, конденсаты, включающие полиэтиленгликоль, политриметиленгликоль, поли(1,2-пропиленгликоль) или политетраметиленгликоль в качестве основного составляющего компонента. Более конкретно, они включают полиэтиленадипат, полиэтиленсукцинат, полибутиленадипат и полибутиленсукцинат и их сополимеры.
Кроме того, полностью ароматические полиэфиры включают полимеры, полученные путем поликонденсации ароматической карбоновой кислоты или ее эфир-образующего производного, предпочтительно, терефталевой кислоты, нафталин-2,6-дикарбоновой кислоты или их эфир-образующего производного, и ароматического полигидроксисоединения или его эфир-образующего производного в качестве основных ингредиентов.
Более конкретно, примером такого соединения является поли(4-оксифенилен-2,2-пропилиден-4-оксифенилен-терефталоил-ко-изофталоил).
Эти полиэфиры содержат от 1 до 50 экв./т карбоксильной группы и/или гидроксильной группы в качестве карбодиимидного реактивного компонента на конце молекулы. Поскольку эти концевые группы, особенно карбоксильная группа, снижают стабильность полиэфира, их предпочтительно замыкают циклическим карбодиимидным соединением.
Когда карбоксильную концевую группу замыкают карбодиимидным соединением, она может быть замкнута без образования токсичного свободного изоцианата с использованием циклического карбодиимидного соединения по настоящему изобретению.
Кроме того, в качестве дополнительного эффекта, увеличение молекулярной массы или ингибирование уменьшения молекулярной массы полиэфира посредством функции удлинения цепи изоцианатной концевой группы, образованной в полиэфире, которая не высвобождается, когда концевую группу замыкают при помощи циклического карбодиимидного соединения и гидроксильной концевой группы или карбоксильной концевой группы, присутствующей в полиэфире, может более эффективно подавляться по сравнению с традиционным линейным карбодиимидным соединением. Это имеет огромное промышленное значение.
Указанные выше полиэфиры можно получить известными способами (например, способами, описанными в справочнике по насыщенным полиэфирным смолам (автор Kazuo Yuki, опубликован Nikkan Kogyo Shimbun 22 декабря 1989 года).
Кроме того, примеры полиэфира в настоящем изобретении включают ненасыщенные полиэфирные смолы, полученные путем сополимеризации ненасыщенной поликарбоновой кислоты или ее эфир-образующего производного и полиэфирных эластомеров, содержащих низкоплавкий полимерный сегмент, помимо указанных выше полиэфиров.
Примеры ненасыщенной поликарбоновой кислоты включают малеиновый ангидрид, тетрагидромалеиновый ангидрид, фумаровую кислоту и эндометилентетрагидромалеиновый ангидрид. Мономеры добавляют к ненасыщенному полиэфиру для контроля свойств отверждения, и ненасыщенный полиэфир отверждают термоотверждением, радикальным отверждением, под действием света или активной энергетической линии, такой как электронный луч, и подвергают формованию. Для ненасыщенной смолы контроль карбоксильной группы является важной технической задачей, что связано с реологическими характеристиками, такими как тиксотропность и срок службы смолы. Однако такие преимущества, как то, что карбоксильная группа может быть замкнута и контролироваться циклическим карбодиимидным соединением без образования токсичного свободного изоцианата, и что молекулярную массу ненасыщенной смолы можно эффективным образом увеличить при помощи циклического карбодиимидного соединения, имеют огромное промышленное значение.
Кроме того, в настоящем изобретении полиэфир может представлять собой полиэфирный эластомер, полученный путем сополимеризации мягкого компонента. Полиэфирный эластомер представляет собой сополимер, включающий высокоплавкий полиэфирный сегмент и низкоплавкий полимерный сегмент, имеющий молекулярную массу от 400 до 6000, как описано в публично доступных документах, например, JP-A 11-92636.
Температура плавления сополимера, состоящего только из высокоплавкого полиэфирного сегмента, составляет 150°C или выше. Температура плавления или температура размягчения сополимера, состоящего только из низкоплавкого полимерного сегмента составляет 80°C или ниже. Низкоплавкий полимерный сегмент предпочтительно состоит из полиалкиленгликоля или алифатической дикарбоновой кислоты, содержащей от 2 до 12 атомов углерода, и алифатического гликоля, содержащего от 2 до 10 атомов углерода. Хотя такой эластомер имеет проблему с гидролитической стабильностью, очень большое значение имеет то, что можно контролировать его карбоксильную группу при помощи циклического карбодиимидного соединения, и большое промышленное значение имеет то, что можно подавлять снижение его молекулярной массы или увеличение его молекулярной массы без каких-либо проблем, связанных с безопасностью, при помощи циклического карбодиимидного соединения.
Полиамид представляет собой термопластичной полимер, содержащий амидную связь, полученную, в основном, из аминокислоты, лактама или диамина и дикарбоновой кислоты или ее амид-образующего производного.
В настоящем изобретении поликонденсат, полученный путем конденсации диамида и дикарбоновой кислоты или ацильной активной формы, полимер, полученный путем поликонденсации аминокарбоновой кислоты или лактама, или аминокислоты или ее сополимера, можно использовать в качестве полиамида.
Диамин выбирают из алифатического диамина и ароматического диамина. Примеры алифатического диамина включают тетраметилендиамин, гексаметилендиамин, ундекаметилендиамин, додекаметилендиамин, 2,2,4-триметилгексаметилендиамин, 2,4,4-триметилгексаметилендиамин, 5-метилнонаметилендиамин, 2,4-диметилоктаметилендиамин, метаксилилендиамин, параксилилендиамин, 1,3-бис(аминометил)циклогексан, 1-амино-3-аминометил-3,5,5-триметилциклогексан, 3,8-бис(аминометил)трициклодекан, бис(4-аминоциклогексил)метан, бис(3-метил-4-аминоциклогексил)метан, 2,2-бис(4-аминоциклогексил)пропан, бис(аминопропил)пиперазин и аминоэтилпиперазин.
Примеры ароматического диамина включают п-фенилендиамин, м-фенилендиамин, 2,6-нафталиндиамин, 4,4'-дифенилдиамин, 3,4'-дифенилдиамин, 4,4'-диаминодифениловый эфир, 3,4'-диаминодифениловый эфир, 4,4'-диаминодифенилсульфон, 3,4'-диаминодифенилсульфон, 4,4'-диаминодифенилкетон, 3,4'-диаминодифенилкетон и 2,2-бис(4-аминофенил)пропан.
Примеры дикарбоновой кислоты включают адипиновую кислоту, субериновую кислоту, азелаиновую кислоту, себациновую кислоту, додекановую кислоту, терефталевую кислоту, изофталевую кислоту, нафталиндикарбоновую кислоту, 2-хлортерефталевую кислоту, 2-метилтерефталевую кислоту, 5-метилизофталевую кислоту, 5-натрий-сульфоизофталевую кислоту, гексагидротерефталевую кислоту, гексагидроизофталевую кислоту и дигликолевую кислоту. Конкретные примеры полиамида включают алифатические полиамиды, такие как поликапрамид (найлон 6), политетраметиленадипамид (найлон 46), полигексаметиленадипамид (найлон 66), полигексаметиленсебакамид (найлон 610), полигексаметилендодекамид (найлон 612), полиундекаметиленадипамид (найлон 116), полиундеканамид (найлон 11) и полидодеканамид (найлон 12).
Также включены алифатические-ароматические полиамиды, такие как политриметилгексаметилентерефталамид, полигексаметиленизофталамид (найлон 6I), полигексаметилен терефтал/изофталамид (найлон 6T/6I), полибис(4-аминоциклогексил)метан додекамид (найлон PACM12), полибис(3-метил-4-аминоциклогексил)метандодекамид (найлон диметил PACM12), полиметаксилиленадипамид (найлон MXD6), полиундекаметилентерефталамид (найлон 11T), полиундекаметиленгексагидротерефталамид (найлон 11T(H)) и их сополиамиды и сополимеры и их смеси. Кроме того, также включены поли(п-фенилентерефталамид) и поли(п-фенилентерефталамид-ко-изофталамид).
Примеры аминокислоты включают ω-аминокапроновую кислоту, ω-аминоэнантовую кислоту, ω-аминокаприловую кислоту, ω-аминопеларгоновую кислоту, ω-аминокаприновую кислоту, 11-аминоундекановую кислоту, 12-аминододекановую кислоту и парааминометилбензойную кислоту, и примеры лактама включают ω-капролактам, ω-энантолактам, ω-каприллактам и ω-лауролактам.
Молекулярные массы этих полиамидных смол конкретно не ограничены, но относительная вязкость, измеренная при 25°C в растворе 98% концентрированной серной кислоты, содержащем 1% масс. полиамидной смолы, предпочтительно составляет от 2,0 до 4,0.
Эти амидные смолы можно получить хорошо известными способами, например, способами, описанными в справочнике по полиамидным смолам (автор Osamu Fukumoto, опубликован Nikkan Kogyo Shimbun 30 января 1988 года).
Кроме того, полиамид по настоящему изобретению включает полиамид, известный как полиамидный эластомер. Полиамид представляет собой привитой или блок-сополимер, полученный путем взаимодействия полиамид-образующего компонента, содержащего 6 или более атомов углерода, с поли(алкиленоксид)гликолем. Связь между полиамид-образующим компонентом, содержащим 6 или более атомов углерода, и поли(алкиленоксид)гликолевым компонентом обычно представляет собой сложноэфирную связь или амидную связь, но не ограничивается этим, и можно использовать третий компонент, такой как дикарбоновая кислота или диамин, в качестве реакционного компонента для этих компонентов.
Примеры поли(алкиленоксид)гликоля включают полиэтиленоксидгликоль, поли(1,2-пропиленоксид)гликоль, поли(1,3-пропиленоксид)гликоль, поли(тетраметиленоксид)гликоль, поли(гексаметиленоксид)гликоль, блок или статистический сополимер этиленоксида и пропиленоксида, и блок или статистический сополимер этиленоксида и тетрагидрофурана. Среднечисленная молекулярная масса поли(алкиленоксид)гликоля предпочтительно составляет от 200 до 6000, более предпочтительно от 300 до 4000, с точки зрения способности к полимеризации и жесткости. Полиамидный эластомер, используемый в настоящем изобретении, предпочтительно представляет собой полиамидный эластомер, полученный путем полимеризации капролактама, полиэтиленгликоля или терефталевой кислоты.
Хотя полиамидная смола содержит от 30 до 100 экв./т карбоксильной группы и от 30 до 100 экв./т аминогруппы, как можно легко определить на основании ее исходных веществ, известно, что карбоксильная группа оказывает неблагоприятный эффект на стабильность полиамида.
Большое значение имеет композиция, в которой содержание карбоксильной группы снижено до не более 20 экв./т, предпочтительно не более 10 экв./т, более предпочтительно не выше, чем значение, при котором не возникают проблемы безопасности, и в которой снижение молекулярной массы подавляется более эффективно при помощи циклического карбодиимидного соединения по настоящему изобретению.
Полиамид-имидная смола, используемая в настоящем изобретении, содержит основное повторяющееся структурное звено, представленное следующей формулой (I).
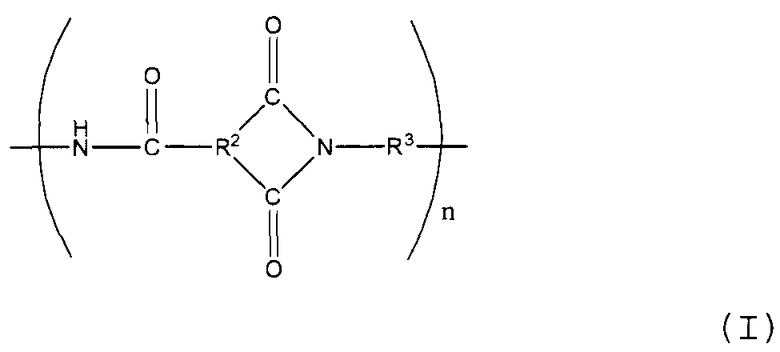
В представленной выше формуле R2 представляет собой трехвалентную органическую группу, R3 представляет собой двухвалентную органическую группу, и n представляет собой положительное целое число.
Типичные способы синтеза этой полиамид-имидной смолы включают (1) способ, в котором диизоцианат и ангидрид трехосновной кислоты подвергают взаимодействию друг с другом, (2) способ, в котором диамин и ангидрид трехосновной кислоты подвергают взаимодействию друг с другом, и (3) способ, в котором диамин и хлорангидрид трехосновной кислоты подвергают взаимодействию друг с другом. Способ синтеза полиамид-имидной смолы, используемый в настоящем изобретении, не ограничивается указанными выше. Типичные соединения, используемые в описанных выше способах синтеза, перечислены ниже.
Предпочтительные примеры диизоцианата включают 4,4'-дифенилметандиизоцианат, ксилилендиизоцианат, 3,3'-дифенилметандиизоцианат, 4,4'-дифениловый эфир диизоцианат, 3,3'-дифениловый эфир диизоцианат и парафенилендиизоцианат.
Предпочтительные примеры диамина включают 4,4'-диаминодифенилсульфон, 3,3'-диаминодифенилсульфон, 4,4'-диаминодифениловый эфир, 3,3'-диаминодифениловый эфир, 4,4'-диаминодифенилметан, 3,3'-диаминодифенилметан, ксилилендиамин и фенилендиамин. Из них 4,4'-дифенилметан диизоцианат, 3,3'-дифенилметандиизоцианат, 4,4'-дифениловый эфир диизоцианат, 3,3'-дифениловый эфир диизоцианат, 4,4'-диаминодифениловый эфир, 3,3'-диаминодифениловый эфир, 4,4'-диаминодифенилметан и 3,3'-диаминодифенилметан являются более предпочтительными.
Ангидрид трехосновной кислоты предпочтительно представляет собой тримеллитовый ангидрид, и хлорангидрид трехосновной кислоты предпочтительно представляет собой хлорангидрид тримеллитовой кислоты.
Для синтеза полиамид-имидной смолы, можно осуществить взаимодействие дикарбоновой кислоты или диангидрида тетракарбоновой кислоты одновременно, при условии, что характерные свойства полиамид-имидной смолы не ухудшаются. Примеры дикарбоновой кислоты включают терефталевую кислоту, изофталевую кислоту и адипиновую кислоту. Примеры диангидрида тетракарбоновой кислоты включают пиромеллитовый диангидрид, диангидрид бензофенонтетракарбоновой кислоты и диангидрид бифенилтетракарбоновой кислоты. Их предпочтительно используют в количестве не более чем 50% по эквиваленту в расчете на общее количество всех кислотных компонентов.
Поскольку срок службы полиамид-имидной смолы может снижаться в зависимости от концентрации карбоксильной группы, содержащейся в полимере, концентрацию карбоксильной группы предпочтительно снижают до 1-10 экв./т или ниже этих пределов. В циклическом карбодиимидном соединении по настоящему изобретению содержание карбоксильной группы может быть выгодным образом снижено до указанных пределов.
Термопластичную полиимидную смолу предпочтительно выбирают в качестве полиимидной смолы. Примером полиимидной смолы является полиимид, включающий следующий диаминовый компонент и тетракарбоновую кислоту.
H2N-R4-NH2
(в представленной выше формуле R4 представляет собой (i) простую связь, (ii) алифатическую углеводородную группу, содержащую от 2 до 12 атомов углерода, (iii) алициклическую группу, содержащую от 4 до 30 атомов углерода, (iv) ароматическую группу, содержащую от 6 до 30 атомов углерода, (v)-Ph-O-R5-O-Ph- (R5 представляет собой фениленовую группу или Ph-W1-Ph-, W1 представляет собой простую связь, алкиленовую группу, содержащую от 1 до 4 атомов углерода, которая может быть замещена атомом галогена, -O-Ph-O, -O-, -CO-, -S-, -SO- или -SO2-), или (vi) -R6-(SiR7 2O)m-SiR7 2-R6- (R6 представляет собой -(CH2)s-, -(CH2)s-Ph-, -(CH2)s-O-Ph- или Ph-, m представляет собой целое число, имеющее значение от 1 до 100, s представляет собой целое число, имеющее значение от 1 до 4, и R7 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, фенильную группу или алкилфенильную группу, содержащую от 1 до 6 атомов углерода.)
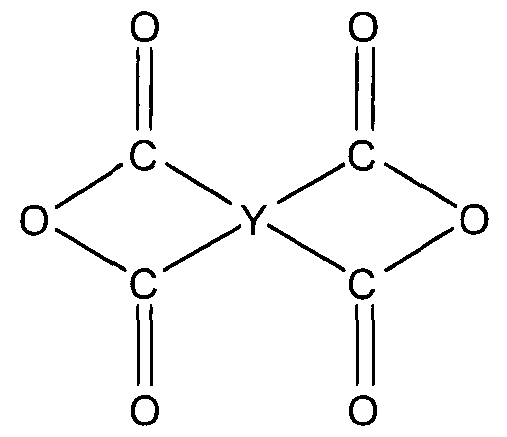
[В представленной выше формуле Y представляет собой четырехвалентную алифатическую группу, содержащую от 2 до 12 атомов углерода, четырехвалентную алициклическую группу, содержащую от 4 до 8 атомов углерода, четырехвалентную ароматическую группу моно- или поликонденсированного кольца, содержащую от 6 до 14 атомов углерода, >Ph-W2-Ph< (W2 представляет собой простую связь, алкиленовую группу, содержащую от 1 до 4 атомов углерода, которая может быть замещена атомом галогена, -O-Ph-O-, -O-, -CO-, -SO- или -SO2-).]
Примеры ангидрида тетракарбоновой кислоты, используемого в получении полиамида кислоты, включают пиромеллитовый ангидрид (PMDA), 4,4'-оксидифталевый ангидрид (ODPA), ангидрид бифенил-3,3',4,4'-тетракарбоновой кислоты (BPDA), ангидрид бензофенон-3,3',4,4'-тетракарбоновой кислоты (BTDA), ангидрид этилентетракарбоновой кислоты, ангидрид бутантетракарбоновой кислоты, ангидрид циклопентантетракарбоновой кислоты, ангидрид бензофенон-2,2',3,3'-тетракарбоновой кислоты, ангидрид бифенил-2,2,3,3'-тетракарбоновой кислоты, безводный 2,2-бис(3,4-дикарбоксифенил)пропан, безводный 2,2-бис(2,3-дикарбоксифенил)пропан, безводный бис(3,4-дикарбоксифенил)овый эфир, безводный бис(3,4-дикарбоксифенил)сульфон, безводный 1,1-бис(2,3-дикарбоксифенил)этан, безводный бис(2,3-дикарбоксифенил)метан, безводный бис(3,4-дикарбоксифенил)метан, 4,4'-(п-фенилендиокси)дифталевый ангидрид, 4,4'-(м-фенилендиокси)дифталевый ангидрид, ангидрид нафталин-2,3,6,7-тетракарбоновой кислоты, ангидрид нафталин-1,4,5,8-тетракарбоновой кислоты, ангидрид нафталин-1,2,5,6-тетракарбоновой кислоты, ангидрид бензол-1,2,3,4-тетракарбоновой кислоты, ангидрид перилен-3,4,9,10-тетракарбоновой кислоты, ангидрид антрацен-2,3,6,7-тетракарбоновой кислоты и ангидрид фенантрен-1,2,7,8-тетракарбоновой кислоты. Настоящее изобретение не ограничивается перечисленными выше. Эти ангидриды дикарбоновых кислот можно использовать отдельно или в сочетании двух или более. Из них предпочтительными для использования являются пиромеллитовый ангидрид (PMDA), 4,4'-оксидифталевый ангидрид (ODPA), бифенил-3,3',4,4'-тетракарбоновый ангидрид (BPDA), ангидрид бензофенон-3,3',4,4'-тетракарбоновой кислоты и ангидрид бифенилсульфон-3,3',4,4'-тетракарбоновой кислоты (DSDA).
Примеры диамина, используемого в получении полиимида, включают 4,4'-диаминодифениловый эфир, 4,4'-диаминодифенилметан, 4,4'-диаминодифенилсульфон, 4,4'-диаминодифениловый тиоэфир, 4,4'-ди(мета-аминофенокси)дифенилсульфон, 4,4'-ди(пара-аминофенокси)дифенилсульфон, o-фенилендиамин, м-фенилендиамин, п-фенилендиамин, бензидин, 2,2'-диаминобензофенон, 4,4'-диаминобензофенон, 4,4'-диаминодифенил-2,2'-пропан, 1,5-диаминонафталин, 1,8-диаминонафталин, триметилендиамин, тетраметилендиамин, гексаметилендиамин, 4,4-диметилгептаметилендиамин, 2,11-додекадиамин, ди(пара-аминофенокси)диметилсилан, 1,4-ди(3-аминопропилдиаминосилан)бензол, 1,4-диаминоциклогексан, орто-толилдиамин, мета-толилдиамин, ацетогуанамин, бензогуанамин, 1,3-бис(3-аминофенокси)бензол (APB), бис[4-(3-аминофенокси)фенил]метан, 1,1-бис[4-(3-аминофенокси)фенил]этан, 1,2-бис[4-(3-аминофенокси)фенил]этан, 2,2-бис[4-(3-аминофенокси)фенил]этан, 2,2-бис[4-(3-аминофенокси)фенил]пропан, 2,2-бис[4-(3-аминофенокси)фенил]бутан, 2,2-бис[4-(3-аминофенокси)фенил]-1,1,1,3,3,3-гексафторпропан, 4,4'-ди(3-аминофенокси)бифенил, ди[4-(3-аминофенокси)фенил]кетон, ди[4-(3-аминофенокси)фенил]сульфид, ди[4-(3-аминофенокси)фенил]сульфоксид, ди[4-(3-аминофенокси)фенил]сульфон и ди(4-(3-аминофенокси)фенил)овый эфир. Настоящее изобретение не ограничивается перечисленными выше. Перечисленные выше диамины можно использовать отдельно или в сочетании.
Примеры термопластичного полиимида включают полиимидные смолы, включающие ангидрид тетракарбоновой кислоты, представленный следующими формулами, и известный диамин, такой как п-фенилендиамин, циклогександиамин или диамин типа гидрированного бисфенола A. Коммерчески доступные продукты термопластичного полиимида включают Ultem1000, Ultem1010, UltemCRS5001 и UltemXH6050 от компании General Electric Co., Ltd. и Auram 250AM от компании Mitsui Chemical Co., Ltd.
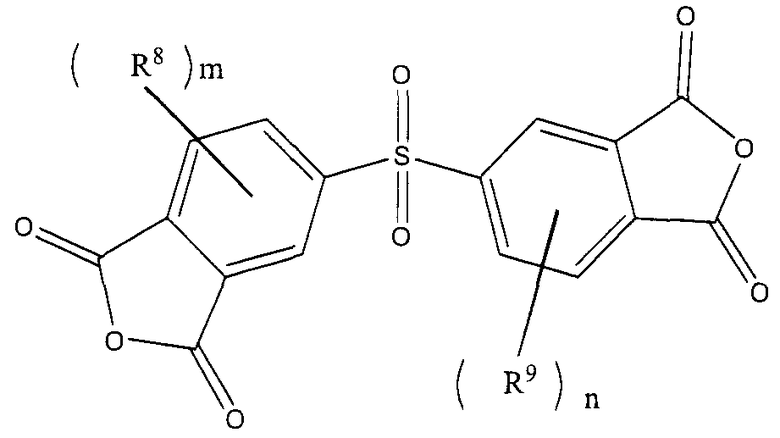
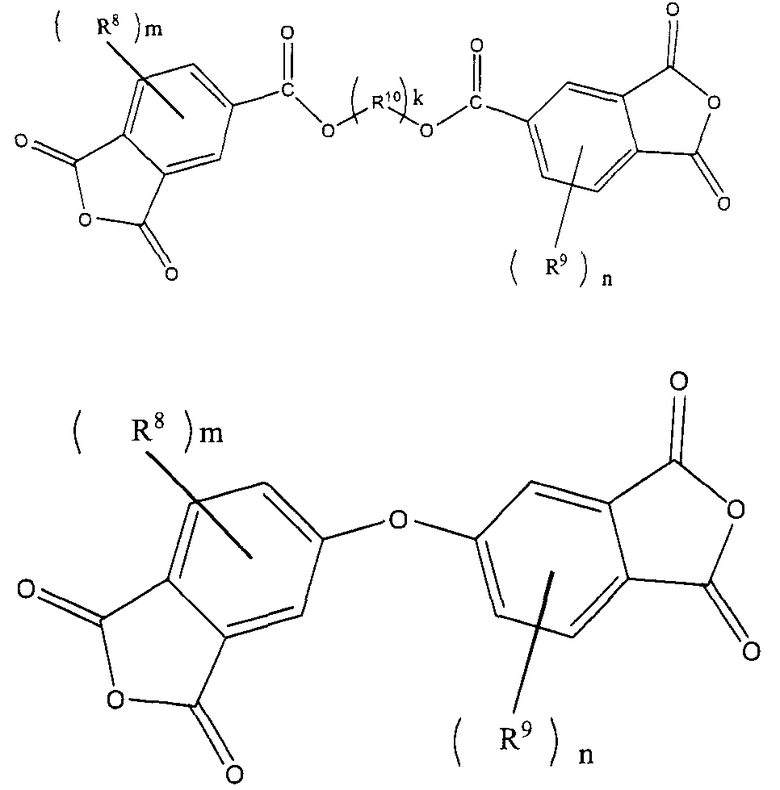
[В представленных выше формулах R8 и R9, каждый независимо, представляют собой атом водорода, линейную или разветвленную алкильную группу, содержащую от 1 до 10 атомов углерода, или арильную группу, R10 представляет собой ариленовую группу, содержащую от 6 до 30 атомов углерода, или алкиленовую группу, содержащую от 2 до 20 атомов углерода, m и n, каждый, представляют собой целое число, имеющее значение от 0 до 5, и k представляет собой целое число, имеющее значение от 1 до 3.]
Примеры полиэфир-амидной смолы включают широко известные полиэфир-амидные смолы, полученные путем сополимеризации полиэфирного составляющего компонента и полиамидного составляющего компонента, из которых термопластичные полиэфир-амидные смолы являются предпочтительными.
Полиэфир-амидную смолу можно синтезировать известными способами. Например, указанный выше полиамидный составляющий компонент сначала подвергают реакции поликонденсации, чтобы синтезировать полиамид, содержащий функциональную группу на конце, и полиэфирный составляющий компонент полимеризуют в присутствии полиамида. Эту реакцию поликонденсации, как правило, осуществляют при помощи реакции амидирования в качестве первой стадии и реакции этерификации в качестве второй стадии. Указанные выше полиэфирные составляющие компоненты предпочтительно выбраны в качестве полиэфирного составляющего компонента. Указанные выше полиамидные составляющие компоненты предпочтительно выбраны в качестве полиамидного составляющего компонента.
<Использование карбодиимида>
В настоящем изобретении циклическое карбодиимидное соединение смешивают с полимерным соединением, содержащим кислотную группу, и подвергают взаимодействию с соединением для замыкания кислотной группы. Способ добавления и смешивания циклического карбодиимидного соединения с полимерным соединением конкретно не ограничен, и можно использовать широко известный способ, в котором циклическое карбодиимидное соединение добавляют в виде раствора, расплава или маточной смеси полимера, или способ, в котором твердое полимерное соединение приводят в контакт с жидкостью, содержащей циклическое карбодиимидное соединение, растворенное в ней, диспергированное в ней или расплавленное в ней, для пропитки циклического карбодиимидного соединения.
В случае способа, в котором циклическое карбодиимидное соединение добавляют в виде раствора, расплава или маточной смеси полимера, используют широко известную месильную машину для добавления циклического карбодиимидного соединения. Для смешивания циклическое карбодиимидное соединение предпочтительно смешивают в растворенном состоянии или расплавленном состоянии, с точки зрения однородности смешивания. Месильная машина конкретно не ограничена, и можно использовать широко известные вертикальные реакторы, смесители, смесительные резервуары, или одношнековые или многошнековые вертикальные смесительные машины, такие как одношнековый или многошнековый экструдер или месильная машина. Время, в течение которого циклическое карбодиимидное соединение смешивают с полимерным соединением, конкретно не ограничено и различается в зависимости от смесительного устройства и температуры смешивания, предпочтительно составляет от 0,1 минуты до 2 часов, более предпочтительно от 0,2 до 60 минут, еще более предпочтительно от 0,2 до 30 минут.
В качестве растворителя можно использовать растворитель, который является инертным в отношении полимерного соединения и циклического карбодиимидного соединения. Растворитель, который обладает сродством к обоим этим соединениям и растворяет по меньшей мере часть каждого из этих соединений, является предпочтительным.
Растворитель выбирают из растворителя на основе углеводорода, растворителя на основе кетона, растворителя на основе сложного эфира, растворителя на основе простого эфира, растворителя на основе галогенового соединения и растворителя на основе амида.
Примеры растворителя на основе углеводорода включают гексан, циклогексан, бензол, толуол, ксилол, гептан и декан. Примеры растворителя на основе кетона включают ацетон, метилэтилкетон, диэтилкетон, циклогексанон и изофорон. Примеры растворителя на основе сложного эфира включают этилацетат, метилацетат, этилсукцинат, метилкарбонат, этилбензоат и диэтиленгликольдиацетат. Примеры растворителя на основе простого эфира включают диэтиловый эфир, дибутиловый эфир, тетрагидрофуран, диоксан, диметиловый эфир диэтиленгликоля, диэтиловый эфир и дифениловый эфир триэтиленгликоля.
Примеры растворителя на основе галогенового соединения включают дихлорметан, хлороформ, тетрахлорметан, дихлорэтан, 1,1',2,2'-тетрахлорэтан, хлорбензол и дихлорбензол. Примеры растворителя на основе амида включают формамид, N,N-диметилформамид, N,N-диметилацетамид и N-метил-2-пирролидон. Эти растворители можно использовать отдельно или в виде смеси.
В настоящем изобретении растворитель используют в количестве от 1 до 1000 частей масс., в расчете на 100 частей масс. объединенного количества полимерного соединения и циклического карбодиимидного соединения. Когда количество растворителя меньше 1 части масс., нет никакого смысла использовать растворитель. Хотя верхний предел количества растворителя конкретно не ограничен, он составляет около 1000 частей масс., с точки зрения простоты манипулирования и эффективности реакции.
В случае способа, в котором твердое полимерное соединение приводят в контакт с жидкостью, содержащей циклическое карбодиимидное соединение, растворенное в ней, диспергированное в ней или расплавленное в ней, для пропитки циклического карбодиимидного соединия, твердое полимерное соединение приводят в контакт с карбодиимидным соединением, растворенным в растворителе, или твердое полимерное соединение приводят в контакт с эмульсией циклического карбодиимидного соединения. Для приведения твердого полимерного соединения в контакт с циклическим карбодиимидным соединением полимерное соединение погружают в циклическое карбодиимидное соединение или наносят на него циклическое карбодиимидное соединение в виде покрытия или спрея.
Реакцию замыкания циклическим карбодиимидным соединением по настоящему изобретению можно осуществить при температуре в пределах от комнатной температуры (25°C) до 300°C. Однако предпочтительной является температура от 50 до 280°C, более предпочтительно от 100 до 280°C, с точки зрения эффективности реакции. Хотя реакция лучше протекает при температуре, при которой полимерное соединение является расплавленным, реакцию предпочтительно осуществляют при температуре ниже чем 300°C для подавления сублимации и разложения циклического карбодиимидного соединения. Для снижения температуры плавления и повышения эффективности смешивания полимера использование растворителя является эффективным.
Хотя реакция протекает полностью и быстро без катализатора, можно использовать катализатор для промотирования реакции. В качестве катализатора можно использовать катализатор, который используют для обычного линейного карбодиимидного соединения (JP-A 2005-2174). Примеры катализатора включают соединения щелочных металлов, соединения щелочноземельных металлов, соединения третичных аминов, имидазольные соединения, четвертичные аммониевые соли, фосфиновые соединения, соли фосфония, эфиры фосфорной кислоты, органические кислоты и кислоту Льюиса. Их можно использовать отдельно или в сочетании два или более таких соединений. Количество катализатора, которое конкретно не ограничено, предпочтительно составляет от 0,001 до 1 части масс., более предпочтительно от 0,01 до 0,1 части масс., еще более предпочтительно от 0,02 до 0,1 части масс., в расчете на 100 частей масс. объединенного количества полимерного соединения и циклического карбодиимидного соединения.
Что касается количества циклического карбодиимидного соединения, содержание карбодиимидной группы, содержащейся в циклическом карбодиимидном соединении, выбирают из диапазона от 0,5 до 100 эквивалентов в расчете на 1 эквивалент кислотной группы. Когда содержание карбодиимидной группы ниже чем 0,5 эквивалента, использование карбодиимида, возможно, не имеет смысла. Когда содержание выше чем 100 эквивалентов, характерные свойства матрицы могут изменяться. С этой точки зрения, предпочтительным является содержание карбодиимидной группы от 0,6 до 75 эквивалентов, более предпочтительно от 0,65 до 50 эквивалентов, еще более предпочтительно от 0,7 до 30 эквивалентов, особенно предпочтительно от 0,7 до 20 эквивалентов, на основании указанного выше стандарта.
ПРИМЕРЫ
Следующие далее примеры представлены для лучшей иллюстрации настоящего изобретения. Физические свойства измеряли следующими способами.
(1) Идентификация циклической карбодиимидной структуры методом ЯМР
Синтезированное циклическое карбодиимидное соединение подтверждали при помощи 1H-ЯМР и 13C-ЯМР. JNR-EX270 от компании JEOL Ltd. использовали для ЯМР. Тяжелый хлороформ использовали в качестве растворителя.
(2) Идентификация карбодиимидного скелета циклического карбодиимида ИК-методом
Существование карбодиимидного скелета синтезированного циклического карбодиимидного соединения при 2100-2200 см-1, что является характеристикой карбодиимида, подтверждали при помощи FT-IR. Magna-750 от компании Thermonicoley Co., Ltd. использовали для FT-IR.
(3) Концентрация карбоксильной группы
Образец растворяли в очищенном o-крезоле в потоке азота и титровали с этанольным раствором 0,05н гидроксида калия с использованием бромкрезолового синего в качестве индикатора.
Пример 1 Синтез циклического карбодиимида CC1 (схема 1)
CC1: MW=252
Стадия (1a)
o-нитрофенол (0,11 моль), 1,2-дибромэтан (0,05 моль), карбонат калия (0,33 моль) и 200 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов, DMF удаляли при пониженном давлении, полученное твердое вещество растворяли в 200 мл дихлорметана, и полученный раствор разделяли при помощи 100 мл воды 3 раза. Органический слой дегидратировали при помощи 5 г сульфата натрия, и дихлорметан удаляли при пониженном давлении с получением промежуточного продукта А (нитросоединение).
Стадия (2a)
Затем промежуточный продукт А (0,1 моль), 5% палладий на углероде (Pd/C) (1 г) и 200 мл смеси этанол/дихлорметан (70/30) вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали и смешанный растворитель удаляли, получали промежуточный продукт B (соединение амина).
Стадия (3a)
Затем трифенилфосфиндибромид (0,11 моль) и 150 мл 1,2-дихлорэтана вводили в реактор, снабженный мешалкой, нагревательным устройством и капельной воронкой, в N2 атмосфере и перемешивали. Раствор, полученный путем растворения промежуточного продукта B (0,05 моль) и триэтиламина (0,25 моль) в 50 мл 1,2-дихлорэтана, постепенно добавляли по каплям к полученной смеси при 25°C. После завершения добавления реакцию осуществляли при 70°C в течение 5 часов. После этого реакционный раствор фильтровали и фильтрат разделяли при помощи 100 мл воды 5 раз. Органический слой дегидратировали при помощи 5 г сульфата натрия, и 1,2-дихлорэтан удаляли при пониженном давлении с получением промежуточного продукта C (трифенилфосфиновое соединение).
Стадия (4a)
Затем ди-трет-бутилдикарбонат (0,11 моль), N,N-диметил-4-аминопиридин (0,055 моль) и 150 мл дихлорметана вводили в реактор, снабженный мешалкой и капельной воронкой, в N2 атмосфере и перемешивали. 100 мл дихлорметана, содержащего промежуточный продукт C (0,05 моль), растворенный в нем, постепенно добавляли по каплям к полученной смеси при 25°C. После завершения добавления реакцию осуществляли в течение 12 часов. После этого твердое вещество, полученное путем удаления дихлорметана, очищали с получением CC1. Структуру CC1 контролировали при помощи ЯМР и ИК.
Пример 2 Синтез циклического карбодиимида CC2 (схема 1)
CC2: MW=516
Стадия (1A)
О-нитрофенол (0,11 моль), пентаэритриттетрабромид (0,025 моль), карбонат калия (0,33 моль) и 200 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов, DMF удаляли при пониженном давлении, полученное твердое вещество растворяли в 200 мл дихлорметана и полученный раствор разделяли при помощи 100 мл воды 3 раза. Органический слой дегидратировали при помощи 5 г сульфата натрия, и дихлорметан удаляли при пониженном давлении с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (2 г) и 400 мл смеси этанол/дихлорметан (70/30) вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали и смешанный растворитель удаляли, получали промежуточный продукт E (соединение амина).
Стадия (3A)
Затем трифенилфосфиндибромид (0,11 моль) и 150 мл 1,2-дихлорэтана вводили в реактор, снабженный мешалкой, нагревательным устройством и капельной воронкой, в N2 атмосфере и перемешивали. Раствор, полученный путем растворения промежуточного продукта E (0,025 моль) и триэтиламина (0,25 моль) в 50 мл 1,2-дихлорэтана, постепенно добавляли по каплям к полученной смеси при 25°C. После завершения добавления реакцию осуществляли при 70°C в течение 5 часов. После этого реакционный раствор фильтровали и фильтрат разделяли при помощи 100 мл воды 5 раз. Органический слой дегидратировали при помощи 5 г сульфата натрия, и 1,2-дихлорэтан удаляли при пониженном давлении с получением промежуточного продукта F (трифенилфосфиновое соединение).
Стадия (4A)
После этого ди-трет-бутилдикарбонат (0,11 моль), N,N-диметил-4-аминопиридин (0,055 моль) и 150 мл дихлорметана вводили в реактор, снабженный мешалкой и капельной воронкой, в N2 атмосфере и перемешивали. 100 мл дихлорметана, содержащего промежуточный продукт F (0,025 моль), растворенный в нем, постепенно добавляли по каплям к полученной смеси при 25°C. После завершения добавления реакцию осуществляли в течение 12 часов. После этого твердое вещество, полученное путем удаления дихлорметана, очищали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 3 Синтез циклического карбодиимида CC2 (схема 2)
Стадия (1A)
О-нитрофенол (0,11 моль), пентаэритриттетрабромид (0,025 моль), карбонат калия (0,33 моль) и 200 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов, N,N-диметилформамид удаляли при пониженном давлении, полученное твердое вещество растворяли в 200 мл дихлорметана и полученный раствор разделяли при помощи 100 мл воды 3 раза. Органический слой дегидратировали при помощи 5 г сульфата натрия, и дихлорметан удаляли при пониженном давлении с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (1,25 г) и 500 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз, и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали фильтрованием и фильтрат добавляли к 3 литрам воды, происходило отделение твердого вещества. Это твердое вещество собирали и сушили с получением промежуточного продукта E (соединение амина).
Стадия (3B)
Затем промежуточный продукт E (0,025 моль), имидазол (0,2 моль), дисульфид углерода (0,2 моль) и 150 мл 2-бутанона вводили в реактор, снабженный мешалкой, нагревательным устройством и промывочным устройством, содержащим водно-щелочной раствор, в N2 атмосфере. Этот реакционный раствор нагревали при 80°C и подвергали взаимодействию в течение 15 часов. После реакции осажденное твердое вещество собирали фильтрованием и промывали с получением промежуточного продукта G (соединение тиомочевины).
Стадия (4B)
После этого промежуточный продукт G (0,025 моль), паратолуолсульфонилхлорид (0,1 моль) и 50 мл пиридина вводили в реактор, снабженный мешалкой, в N2 атмосфере и перемешивали. Реакцию осуществляли при 25°C в течение 3 часов, затем добавляли 150 мл метанола и перемешивали при 25°C в течение 1 часа. Осажденное твердое вещество собирали фильтрованием и промывали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 4 Синтез циклического карбодиимида CC2 (схема 2)
Стадия (1A)
О-нитрофенол (0,11 моль), пентаэритриттетрабромид (0,025 моль), карбонат калия (0,33 моль) и 200 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов, N,N-диметилформамид удаляли при пониженном давлении, полученное твердое вещество растворяли в 200 мл дихлорметана, и полученный раствор разделяли при помощи 100 мл воды 3 раза. Органический слой дегидратировали при помощи 5 г сульфата натрия, и дихлорметан удаляли в вакууме с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (1,25 г) и 500 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз, и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали фильтрованием и фильтрат добавляли к 3 литрам воды, происходило отделение твердого вещества. Это твердое вещество собирали и сушили с получением промежуточного продукта E (соединение амина).
Стадия (3B)
Затем промежуточный продукт E (0,025 моль), имидазол (0,2 моль) и 125 мл ацетонитрила вводили в реактор, снабженный мешалкой, нагревательным устройством и капельной воронкой, в N2 атмосфере и дифенилфосфит (0,1 моль) подавали в капельную воронку. После осуществления замещения диоксидом углерода 5 раз дифенилфосфит постепенно добавляли по каплям при постоянной подаче диоксида углерода при 25°C при перемешивании для осуществления реакции в течение 15 часов. После реакции осажденное твердое вещество собирали фильтрованием и промывали с получением промежуточного продукта H (соединение мочевины).
Стадия (4B)
После этого промежуточный продукт H (0,025 моль), паратолуолсульфонилхлорид (0,1 моль) и 50 мл пиридина вводили в реактор, снабженный мешалкой, в N2 атмосфере и перемешивали. Реакцию осуществляли при 25°C в течение 3 часов, затем добавляли 150 мл метанола и перемешивали при 25°C в течение 1 часа. Осажденное твердое вещество собирали фильтрованием и промывали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 5 Синтез циклического карбодиимида CC2 (схема 3)
Стадия (1B)
О-хлорнитробензол (0,125 моль), пентаэритрит (0,025 моль), карбонат калия (0,25 моль), тетрабутиламмонийбромид (0,018 моль) и 50 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов. После реакции полученный раствор добавляли к 200 мл воды и осажденное твердое вещество собирали фильтрованием. Это твердое вещество промывали и сушили с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (1,25 г) и 500 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз, и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали фильтрованием и фильтрат добавляли к 3 литрам воды, происходило отделение твердого вещества. Это твердое вещество собирали и сушили с получением промежуточного продукта E (соединение амина).
Стадия (3B)
Затем промежуточный продукт E (0,025 моль), имидазол (0,2 моль) и 125 мл ацетонитрила вводили в реактор, снабженный мешалкой, нагревательным устройством и капельной воронкой, в N2 атмосфере и дифенилфосфит (0,1 моль) подавали в капельную воронку. После осуществления замещения диоксидом углерода 5 раз дифенилфосфит постепенно добавляли по каплям при постоянной подаче диоксида углерода при 25°C при перемешивании для осуществления реакции в течение 15 часов. После реакции осажденное твердое вещество собирали фильтрованием и промывали с получением промежуточного продукта H (соединение мочевины).
Стадия (4B)
После этого промежуточный продукт H (0,025 моль), паратолуолсульфонилхлорид (0,1 моль) и 50 мл пиридина вводили в реактор, снабженный мешалкой, в N2 атмосфере и перемешивали. Реакцию осуществляли при 25°C в течение 3 часов, затем добавляли 150 мл метанола и перемешивали при 25°C в течение 1 часа. Осажденное твердое вещество собирали фильтрованием и промывали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 6 Синтез циклического карбодиимида CC2 (схема 3)
Стадия (1B)
o-хлорнитробензол (0,125 моль), пентаэритрит (0,025 моль), карбонат калия (0,25 моль), тетрабутиламмонийбромид (0,018 моль) и 50 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов. После реакции полученный раствор добавляли к 200 мл воды и осажденное твердое вещество собирали фильтрованием. Это твердое вещество очищали и сушили с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (1,25 г) и 500 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз, и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали фильтрованием и фильтрат добавляли к 3 литрам воды, происходило отделение твердого вещества. Это твердое вещество собирали и сушили с получением промежуточного продукта E (соединение амина).
Стадия (3B)
Затем промежуточный продукт E (0,025 моль), имидазол (0,2 моль), дисульфид углерода (0,2 моль) и 150 мл 2-бутанона вводили в реактор, снабженный мешалкой, нагревательным устройством и промывочным устройством, содержащим водно-щелочной раствор, в N2 атмосфере. Этот реакционный раствор нагревали при 80°C для осуществления реакции в течение 15 часов. После реакции осажденное твердое вещество собирали фильтрованием и промывали с получением промежуточного продукта G (соединение тиомочевины).
Стадия (4B)
После этого промежуточный продукт G (0,025 моль), паратолуолсульфонилхлорид (0,1 моль) и 50 мл пиридина вводили в реактор, снабженный мешалкой, в N2 атмосфере и перемешивали. Реакцию осуществляли при 25°C в течение 3 часов, затем добавляли 150 мл метанола и перемешивали при 25°C в течение 1 часа. Осажденное твердое вещество собирали фильтрованием и промывали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 7 Синтез циклического карбодиимида CC2 (схема 4)
Стадия (1B)
О-хлорнитробензол (0,125 моль), пентаэритрит (0,025 моль), карбонат калия (0,25 моль), тетрабутиламмонийбромид (0,018 моль) и 50 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой и нагревательным устройством, в N2 атмосфере и подвергали взаимодействию при 130°C в течение 12 часов. После реакции полученный раствор добавляли к 200 мл воды и осажденное твердое вещество собирали фильтрованием. Это твердое вещество промывали и сушили с получением промежуточного продукта D (нитросоединение).
Стадия (2A)
Затем промежуточный продукт D (0,1 моль), 5% палладий на углероде (Pd/C) (1,25 г) и 500 мл N,N-диметилформамида вводили в реактор, снабженный мешалкой, водородное замещение осуществляли 5 раз, и реакцию осуществляли при постоянной подаче водорода при 25°C и останавливали, когда количество водорода больше не уменьшалось. Когда Pd/C собирали фильтрованием и фильтрат добавляли к 3 литрам воды, происходило отделение твердого вещества. Это твердое вещество собирали и сушили с получением промежуточного продукта E (соединение амина).
Стадия (3A)
Затем трифенилфосфиндибромид (0,11 моль) и 150 мл 1,2-дихлорэтана вводили в реактор, снабженный мешалкой, нагревательным устройством и капельной воронкой, в N2 атмосфере и перемешивали. Раствор, полученный путем растворения промежуточного продукта E (0,025 моль) и триэтиламина (0,25 моль) в 50 мл 1,2-дихлорэтана, постепенно добавляли по каплям к полученной смеси при 25°C. После завершения добавления реакцию осуществляли при 70°C в течение 5 часов. После этого реакционный раствор фильтровали и фильтрат разделяли при помощи 100 мл воды 5 раз. Органический слой дегидратировали при помощи 5 г сульфата натрия и 1,2-дихлорэтан удаляли при пониженном давлении с получением промежуточного продукта F (трифенилфосфиновое соединение).
Стадия (4A)
После этого ди-трет-бутилдикарбонат (0,11 моль), N,N-диметил-4-аминопиридин (0,055 моль) и 150 мл дихлорметана вводили в реактор, снабженный мешалкой и капельной воронкой, в N2 атмосфере и перемешивали. 100 мл дихлорметана, содержащего промежуточный продукт F (0,025 моль), растворенный в нем, постепенно добавляли по каплям к полученной смеси. После добавления реакцию осуществляли в течение 12 часов. Твердое вещество, полученное путем удаления дихлорметана, очищали с получением CC2. Структуру CC2 контролировали при помощи ЯМР и ИК.
Пример 8 Замыкание конца цепи полимолочной кислоты при помощи CC1
0,005 частей масс. октилата олова добавляли к 100 частям масс. L-лактида (изготовитель Musashino Kagaku Kenkyuusho Co., Ltd., оптическая чистота 100%) для осуществления реакции при 180°C в реакторе, снабженном лопастной мешалкой, в атмосфере азота в течение 2 часов, добавляли фосфорную кислоту в качестве дезактиватора катализатора в количестве в 1,2 раза больше эквивалентного количества октилата олова, остаточный лактид удаляли при давлении 13,3 Па и остаток формировали в виде крошек с получением поли(L-молочной кислоты). Концентрация карбоксильной группы полученной поли(L-молочной кислоты) составляла 14 экв./т.
100 частей масс. полученной поли(L-молочной кислоты) и 0,5 частей масс. CC1 смешивали вместе в расплаве с использованием двухшнекового экструдера (температура цилиндра 230°C), с временем пребывания в экструдере 3 минуты. Концентрация карбоксильной группы снижалась до не более чем 0,4 экв./т. Не было никакого запаха изоцианата на выходе из экструдера после смешивания.
Пример 9 Замыкание конца цепи полимолочной кислоты при помощи CC2
Когда реакцию осуществляли таким же способом, как в примере 8, за исключением того, что циклический карбодиимид CC1 заменяли циклическим карбодиимидом CC2, концентрация карбоксильной группы снижалась до не более чем 0,3 экв./т. Не было никакого запаха изоцианата на выходе из экструдера после смешивания.
Сравнительный пример 1 Замыкание конца цепи полимолочной кислоты при помощи линейного карбодиимидного соединения
Когда реакцию осуществляли таким же способом, как в примере 8, за исключением того, что циклический карбодиимид CC1 заменяли линейным карбодиимидом “Stabacsole I” от компании Line Chemie Japan Co., Ltd., концентрация карбоксильной группы составляла 0,4 экв./т, но получали неприятный запах изоцианата на выходе из экструдера.
Пример 10 Замыкание конца цепи полиамида при помощи CC2
Полиметаксиленадипамид (MX Nylon S6001 от компании Mitsubishi Gas Chemical Co., Ltd.) представляет собой полиамид, включающий метаксилилендиамин и адипиновую кислоту, и концентрация карбоксильной группы составляла 70 экв./т. 100 частей масс. этого полиметаксилиленадипамида и 2,0 части CC2 смешивали вместе в расплаве с использованием двухшнекового экструдера (температура цилиндра 260°C), с временем пребывания в экструдере 3 минуты. Концентрация карбоксильной группы снижалась до не более чем 1,2 экв./т. Не было никакого запаха изоцианата на выходе из экструдера после смешивания.
Сравнительный пример 2 Замыкание конца цепи полиамида при помощи линейного карбодиимидного соединения
Когда реакцию осуществляли таким же способом, как в примере 8, за исключением того, что циклический карбодиимид CC2 заменяли линейным карбодиимидом “Stabacsole I” от компании Line Chemie Japan Co., Ltd., концентрация карбоксильной группы составляла 2,2 экв./т, но получали неприятный запах изоцианата на выходе из экструдера.
Эффект настоящего изобретения
Циклическое карбодиимидное соединение по настоящему изобретению может эффективно стабилизировать гидролизуемый компонент полимерного соединения. В этот момент может подавляться побочное образование свободного изоцианатного соединения. Циклическое карбодиимидное соединение по настоящему изобретению может подавлять образование неприятного запаха, источником которого является изоцианатное соединение, даже когда оно замыкает концевую группу полимерного соединения, не загрязняя, таким образом, рабочее помещение. Когда концевую группу полимерного соединения замыкают циклическим карбодиимидным соединением, изоцианатная группа образуется на конце полимерного соединения, и молекулярная масса полимерного соединения может увеличиваться в результате взаимодействия изоцианатной группы.
Циклическое карбодиимидное соединение по настоящему изобретению также имеет функцию улавливания свободного мономера и соединения, содержащего кислотную группу, содержащихся в полимерном соединении.
Кроме того, поскольку циклическое карбодиимидное соединение по настоящему изобретению имеет циклическую структуру, оно может замыкать концевую группу в более мягких условиях по сравнению с теми, которые необходимы для линейного карбодиимидного соединения.
С использованием способа получения по настоящему изобретению можно легко получить циклический карбодиимид. Циклическое карбодиимидное соединение по настоящему изобретению является полезным в качестве агента замыкания конца цепи для полимерных соединений. Циклическое карбодиимидное соединение по настоящему изобретению является полезным в качестве агента захвата для кислотных групп, особенно свободного соединения, содержащегося в полимерном соединении.
Различие между линейным карбодиимидным соединением и циклическим карбодиимидным соединением в механизме реакции замыкания конца цепи описано ниже.
Когда линейное карбодиимидное соединение (R1-N=C=N-R2) используют в качестве агента замыкания конца цепи для полимерного соединения, содержащего концевую карбоксильную группу, имеет место реакция, представленная следующей формулой. В представленной формуле W представляет собой основную цепь полимерного соединения. Амидная группа образуется на конце полимерного соединения в результате реакции между линейным карбодиимидным соединением и карбоксильной группой, и происходит высвобождение изоцианатного соединения (R1NCO).

В то же время, когда циклическое карбодиимидное соединение используют в качестве агента замыкания конца цепи для полимерного соединения, содержащего концевую карбоксильную группу, имеет место реакция, представленная следующей формулой. Должно быть понятно, что изоцианатная группа (-NCO) образуется на конце полимерного соединения через амидную группу в результате реакции между циклическим карбодиимидным соединением и карбоксильной группой, и что изоцианатное соединение не высвобождается.

(в представленной выше формуле Q представляет собой алифатическую, алициклическую или ароматическую группу или двухвалентную-четырехвалентную связывающую группу, которая представляет собой их сочетание, которая может содержать гетероатом или заместитель).
Когда два или более карбодиимидов содержатся в одном кольце, имеет место такой недостаток, как высвобождение изоцианатного соединения в результате взаимодействия карбодиимидной группы.
Промышленная применимость
Циклическое карбодиимидное соединение по настоящему изобретению выгодным образом используют для стабилизации органического полимерного соединения, содержащего гидролизуемую функциональную группу в качестве составляющего компонента.
Изобретение относится к новому циклическому карбодиимидному соединению, представленному следующей формулой (i):
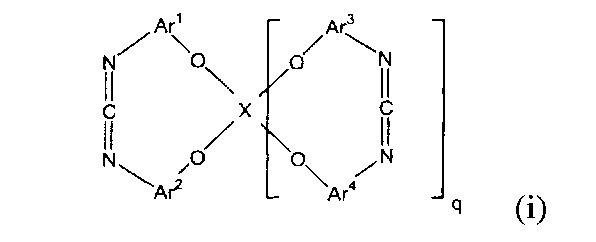
(где X представляет собой любую из двухвалентных групп, представленных следующими формулами (i-1)-(i-3), или четырехвалентную группу, представленную следующей формулой (i-4), когда X является двухвалентным, q имеет значение 0, и когда X является четырехвалентным, q имеет значение 1, и Ar1-Ar4, каждый независимо, представляют собой ароматическую группу и могут быть замещены алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой)
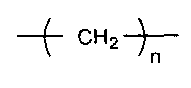 (i-1), где n представляет собой целое число, имеющее значение от 1 до 6,
(i-1), где n представляет собой целое число, имеющее значение от 1 до 6,
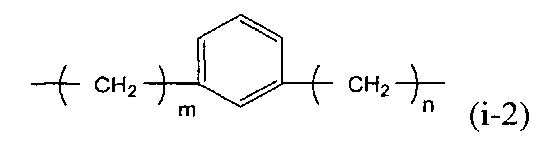
где m и n, каждый независимо, представляют собой целое число, имеющее значение от 0 до 3,
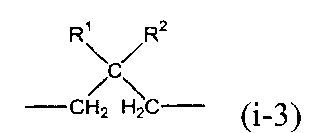
где R1 и R2, каждый независимо, представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу,
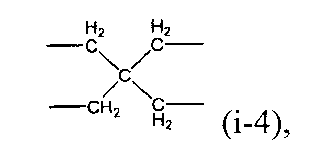
которое является полезным в качестве агента замыкания конца цепи полимерных соединений, а именно агента захвата для кислотной группы. Также описываются способаы получения соединения формулы (i). 5 н. и 5 з.п. ф-лы, 10 пр.
1. Циклическое карбодиимидное соединение, представленное следующей формулой (i):
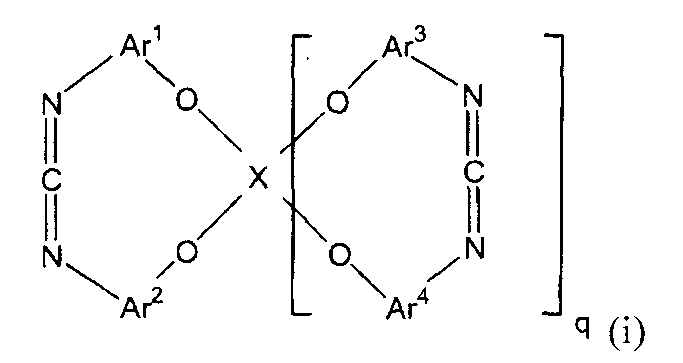
где X представляет собой любую из двухвалентных групп, представленных следующими формулами (i-1)-(i-3), или четырехвалентную группу, представленную следующей формулой (i-4), когда X является двухвалентным, q имеет значение 0, и когда X является четырехвалентным, q имеет значение 1, и Ar1-Ar4 каждый независимо представляют собой ароматическую группу и могут быть замещены алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой

где n представляет собой целое число, имеющее значение от 1 до 6,
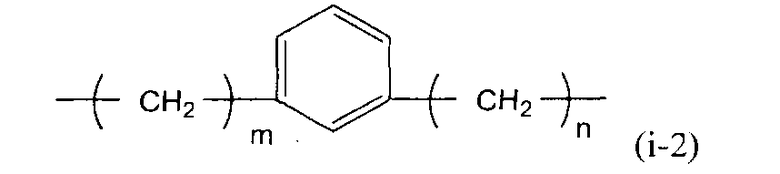
где m и n каждый независимо представляют собой целое число, имеющее значение от 0 до 3,
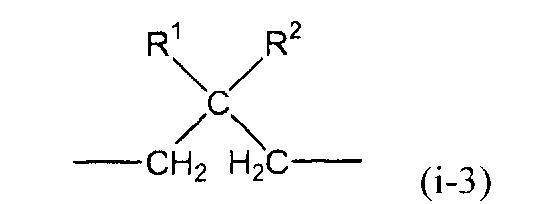
где R1 и R2 каждый независимо представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, или фенильную группу,

2. Соединение по п.1, где Ar1-Ar4 каждый независимо представляют собой ортофениленовую группу или 1,2-нафталин-диильную группу, которая может быть замещена алкильной группой, содержащей от 1 до 6 атомов углерода, или фенильной группой.
3. Способ получения циклического карбодиимидного соединения по п.1, включающий следующие стадии:
(1) (1а) взаимодействие соединения следующей формулы (а-1), соединения следующей формулы (а-2) и соединения следующей формулы (b-1) с получением нитросоединения, представленного следующей формулой (с):

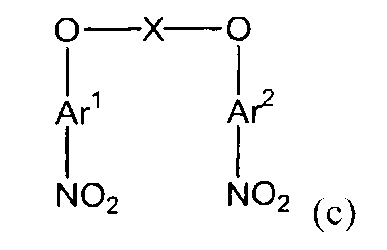
где X, Ar1 и Ar2 имеют значения, определенные выше в формуле (i), и E1 и E2 каждый независимо представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу;
(2) (2а) восстановление полученного нитросоединения с получением соединения амина, представленного следующей формулой (d):
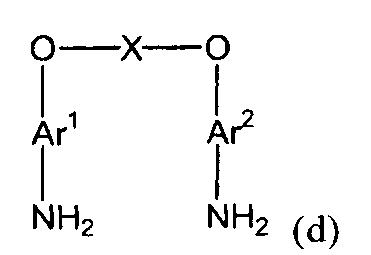
где Ar1, Ar2 и X имеют значения, определенные выше в формуле (i);
(3) (3а) взаимодействие полученного соединения амина с трифенилфосфиндибромидом с получением трифенилфосфинового соединения, представленного следующей формулой (e-1):
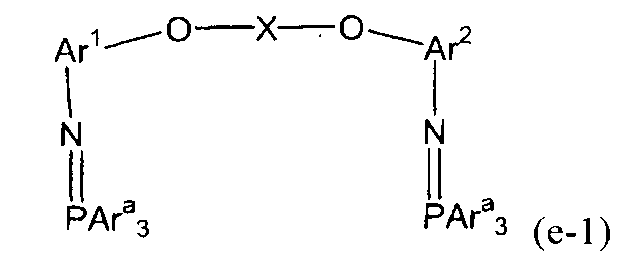
где Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и Ara представляет собой фенильную группу; и
(4) (4a) изоцианирование полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизация изоцианированного продукта непосредственно с получением соединения следующей формулы:

где Ar1, Ar2 и X имеют значения, определенные выше в формуле (i).
4. Способ по п.3, где стадия (1a) представляет собой стадию (1b) взаимодействия соединения следующей формулы (a-i), соединения следующей формулы (a-ii) и соединения следующей формулы (b-i):

где Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и E3 и E4 каждый независимо представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу.
5. Способ по п.3 или 4, где стадия (3а) представляет собой стадию (3b) взаимодействия соединения амина с диоксидом углерода или дисульфидом углерода с получением соединения мочевины или соединения тиомочевины, представленного следующей формулой (е-2):
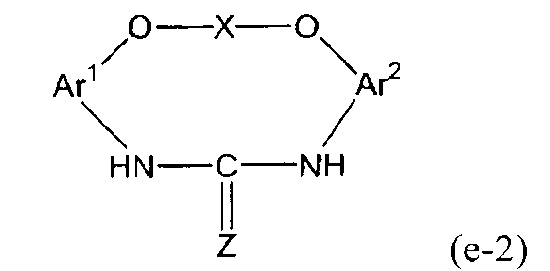
где Ar1, Ar2 и X имеют значения, определенные выше в формуле (i), и Z представляет собой атом кислорода или атом серы; и
стадия (4а) представляет собой стадию (4b) дегидратации полученного соединения мочевины или десульфуризации соединения тиомочевины.
6. Способ получения циклического карбодиимидного соединения по п.1, включающий следующие стадии:
(1) (1A) взаимодействие соединений следующих формул (A-1)-(A-4) и соединения следующей формулы (B-1) с получением нитросоединения следующей формулы (C);

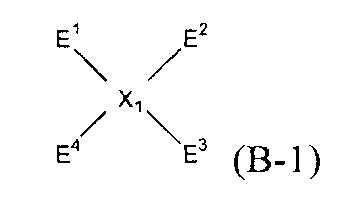
где X1 представляет собой
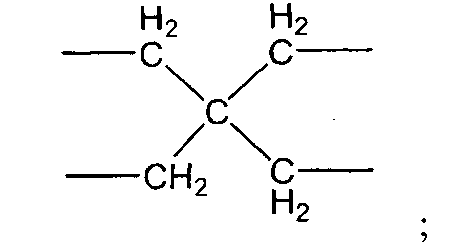
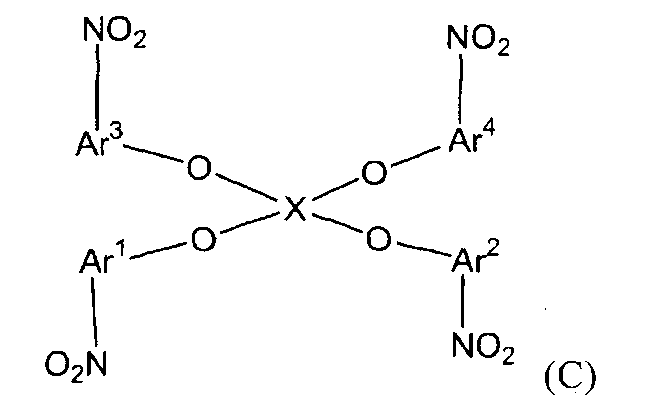
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и E1-E4 каждый независимо представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу;
(2) (2A) восстановление полученного нитросоединения с получением соединения амина следующей формулы (D):
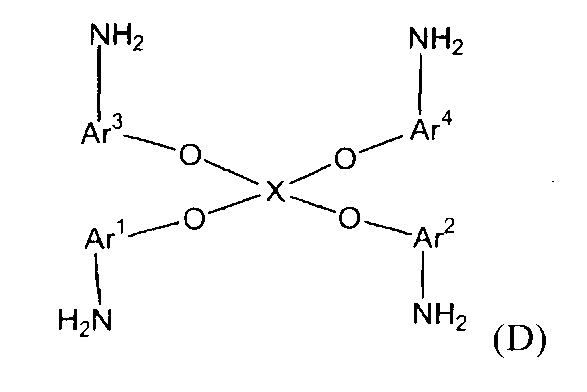
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i);
(3) (3A) взаимодействие полученного соединения амина с трифенилфосфиндибромидом с получением трифенилфосфинового соединения следующей формулы (E-1):
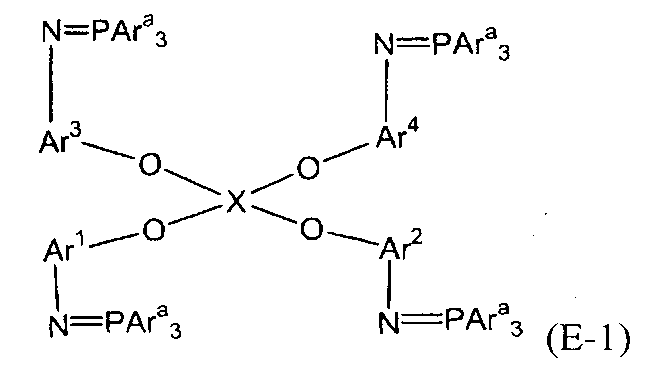
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и Ara представляет собой фенильную группу; и
(4) (4A) изоцианирование полученного трифенилфосфинового соединения в реакционной системе и затем декарбонизация изоцианированного продукта непосредственно с получением соединения следующей формулы (F):
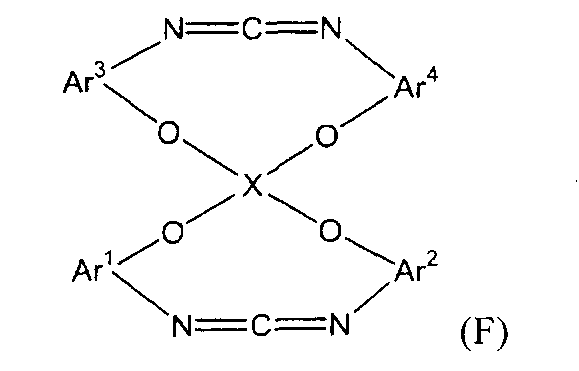
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i).
7. Способ по п.6, где стадия (1A) представляет собой стадию (1B) взаимодействия соединений следующих формул (A-i) - (A-iv) и соединения следующей формулы (B-i) с получением нитросоединения формулы (C):

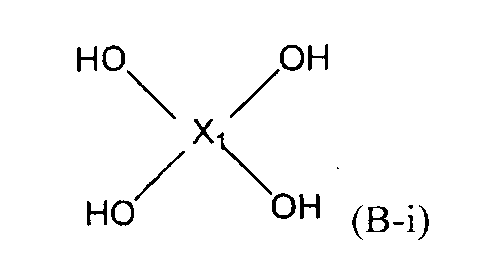
где X1 представляет собой

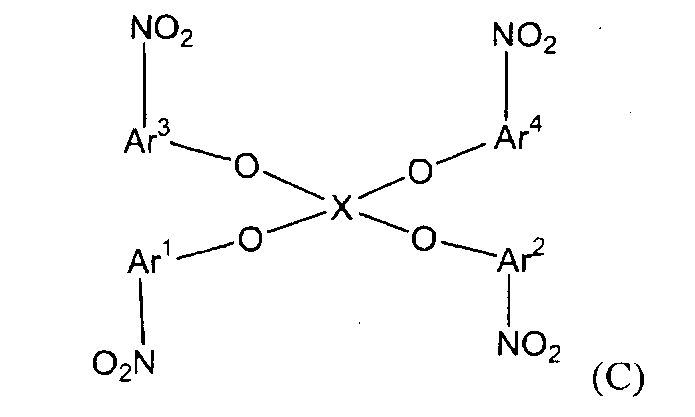
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и E5-E8 каждый независимо представляют собой группу, выбранную из группы, включающей атом галогена, толуолсульфонилоксигруппу, метансульфонилоксигруппу, бензолсульфонилоксигруппу и п-бромбензолсульфонилоксигруппу.
8. Способ по п.6 или 7, где стадия (3A) представляет собой стадию (3B) взаимодействия соединения амина с диоксидом углерода или дисульфидом углерода с получением соединения мочевины или соединения тиомочевины следующей формулы (E-2):
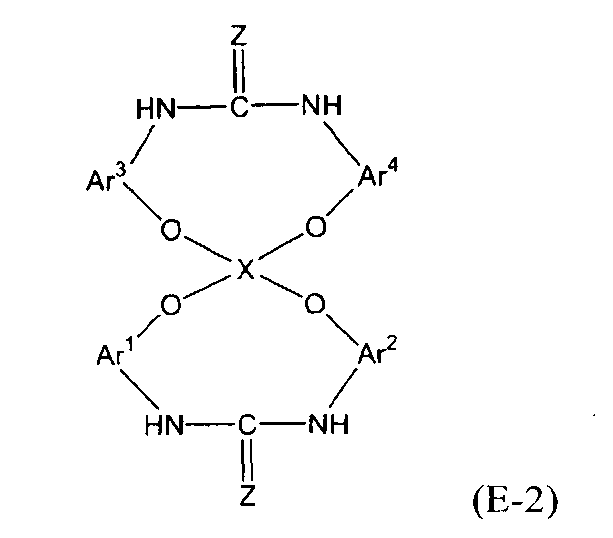
где Ar1-Ar4 и X имеют значения, определенные выше в формуле (i), и Z представляет собой атом кислорода или атом серы; и
стадия (4A) представляет собой стадию (4B) дегидратации полученного соединения мочевины или десульфуризации соединения тиомочевины.
9. Агент замыкания конца цепи для полимерных соединений, содержащий циклическое карбодиимидное соединение представленной выше формулы (i) в качестве активного ингредиента.
10. Агент захвата для кислотной группы, содержащий циклическое карбодиимидное соединение представленной выше формулы (i) в качестве активного ингредиента.
| WO 2008081230 A1, 10.07.2008 | |||
| Pedro Molina et al | |||
| J | |||
| Org | |||
| Chem., 1994, v.59, p.7306-7315. |
Авторы
Даты
2014-01-10—Публикация
2009-12-15—Подача