Область техники
Изобретение относится к получению антибиотиков, в частности оно относится к штамму, продуцирующему антибиотик с высоким выходом, способу его получения и применения.
Уровень техники
В последние несколько десятилетий как количество случаев, так и количество типов грибковых инфекций, причиняющих значительный вред здоровью людей, постепенно повышается, особенно в случае пациентов с ослабленным иммунитетом. В то же время клиническое применение некоторых широко используемых противогрибковых веществ, таких как амфотерицин, имидазолы и триазолы, широко применяемых клинически, ограничено из-за значительной нейротоксичности, устойчивости к лекарственным средствам и т.п. Эхинокандины как тип новых противогрибковых веществ представляют собой группу естественных продуктов, открытых в 1970-х. Структурно эхинокандины имеют сходный циклический полипептидный кор, но различные боковые цепи жирных кислот. Эхинокандины могут конкурентно ингибировать синтез β-D-глюкана в клеточных стенках грибов. Преимуществами эхинокандинов являются низкая токсичность, сильная фунгицидная активность, а также превосходные фармакокинетические свойства.
Семейство эхинокандинов включает следующие эхинокандины: цилофунгин, пневмокандины, акулеацины, мулундокандин и WF 11899A. Эхинокандины и пневмокандины активно исследуются и в настоящее время применяются клинически.
Каспофунгин представляет собой водорастворимое полусинтетическое производное пневмокандина. Merck разработал каспофунгин в качестве противогрибкового/ противопневмоцистного вещества с широким спектром. В фазе II клинического испытания с контрольными экспериментами было обнаружено, что в случае пациентов с ослабленным иммунитетом, страдающих от инвазивного легочного аспергиллеза, применение каспофунгина (внутривенная инъекция, 50-70 мг/д) показало хорошую эффективность, в то время как применение амфотерицина В и азолов, содержащих азот, не оказало какого-либо заметного воздействия. В случае 128 пациентов, инфицированных ВИЧ, эффективность каспофунгина при монилиальном эзофагите достигала 85%, в то время как эффективность амфотерицина В составила только 66,7%. Эти типы лекарственных средств могут быть применены для эффективного уничтожения грибов, устойчивых к азолам, содержащим азот, и амфотерицину В. Более того, эти типы лекарственных средств являются намного лучше, чем традиционные противогрибковые вещества из-за отсутствия гемолитической токсичности и меньшего лекарственного взаимодействия.
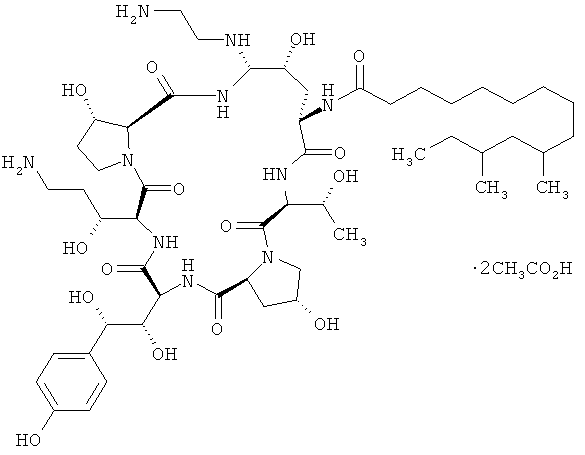
Структура каспофунгина
Таким образом, для удовлетворения требований промышленного производства необходимо найти высокопродуктивный штамм со стабильными генетическими свойствами, который может продуцировать больше В0 и меньше А0.
Краткое описание изобретения
Цель настоящего изобретения - предложить новый мутантный штамм на основе АТСС 20957.
Другая цель настоящего изобретения - предложить способ получения упомянутого нового штамма.
Еще одна цель настоящего изобретения - предложить применение упомянутого мутантного штамма.
Четвертая цель настоящего изобретения - предложить способ получения соединения формулы I при помощи упомянутого нового штамма.
В первом аспекте настоящего изобретения предложен мутированный штамм Glarea lozoyensis, депонированный в Китайском центре коллекции микробиологических культур под номером CGMCC 2933.
Во втором аспекте настоящего изобретения предложен способ получения мутированного штамма, упомянутого ранее, предусматривающий следующие этапы:
(a) смешивание посевной жидкости Glarea lozoyensis №АТСС 20957 с нитрозогуанидином для получения смеси А;
(b) смешивание упомянутой смеси А с ферментом, разрушающим клеточную стенку, для получения протопластов;
(c) регенерация упомянутых протопластов для получения единичных колоний;
(d) культивирование упомянутых единичных колоний для получения мутированного штамма.
В предпочтительном примере концентрация нитрозогуанидина на этапе (а) составляет 10-20 мкг/мл из расчета на общий объем упомянутой смеси А; и концентрация фермента, разрушающего клеточную стенку, на этапе (b) составляет 10-50 мг/мл из расчета на общий объем после смешивания упомянутой смеси А с ферментом, разрушающим клеточную стенку.
В другом предпочтительном воплощении упомянутый фермент, разрушающий стенку, содержит одно или более из следующих соединений: ливалзим, фермент улитки и целлюлозу.
В другом предпочтительном воплощении каждый фермент присутствует в концентрации 10-40 мг/мл.
В другом предпочтительном воплощении мицелий в посевной жидкости на этапе (а) находится в логарифмической фазе роста.
В другом предпочтительном воплощении сухая масса клеток составляет 5-10 г/л из расчета на общий объем упомянутой посевной жидкости на этапе (а).
В третьем аспекте настоящего изобретения предложено применение упомянутого мутированного штамма для получения соединения формулы I:
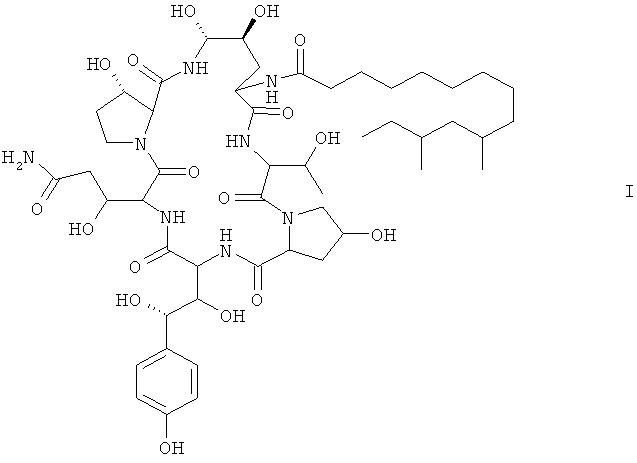
В четвертом аспекте настоящего изобретения предложен способ получения соединения формулы I, предусматривающий следующий этап:
Культивирование упомянутого мутантного штамма в ферментационной среде при температуре 15-35°С для получения соединения формулы I.
В другом предпочтительном воплощении упомянутая ферментационная среда содержит следующие компоненты из расчета на общий объем ферментационной среды: 15-50 г/л L-пролина, 6-20 г/л глутамата натрия, 6-20 г/л дрожжевого экстракта, 4-20 г/л фруктозы, 1,5-7 г/л неорганической соли и 10-50 г/л микроэлементов.
В другом предпочтительном воплощении упомянутая неорганическая соль выбрана из фосфата, или сульфата, или их комбинации.
В другом предпочтительном воплощении упомянутая ферментационная среда также содержит 10-100 г/л маннита в процессе культивирования.
В другом предпочтительном воплощении объем инокулята упомянутого мутантного штамма составляет 4-10 об.% из расчета на общий объем ферментационной среды.
В другом предпочтительном воплощении исходное значение pH упомянутой ферментационной среды составляет 5,3-6,0.
Резюмируя, настоящее изобретение предлагает высокопродуктивный штамм со стабильными генетическими свойствами, который может продуцировать больше В0 и меньше А0, для лучшего соответствия требованиям промышленного производства.
Описание чертежей
Фиг. 1 изображает схему производственного процесса для производства нового штамма CGMCC 2933, предложенного в настоящем изобретении.
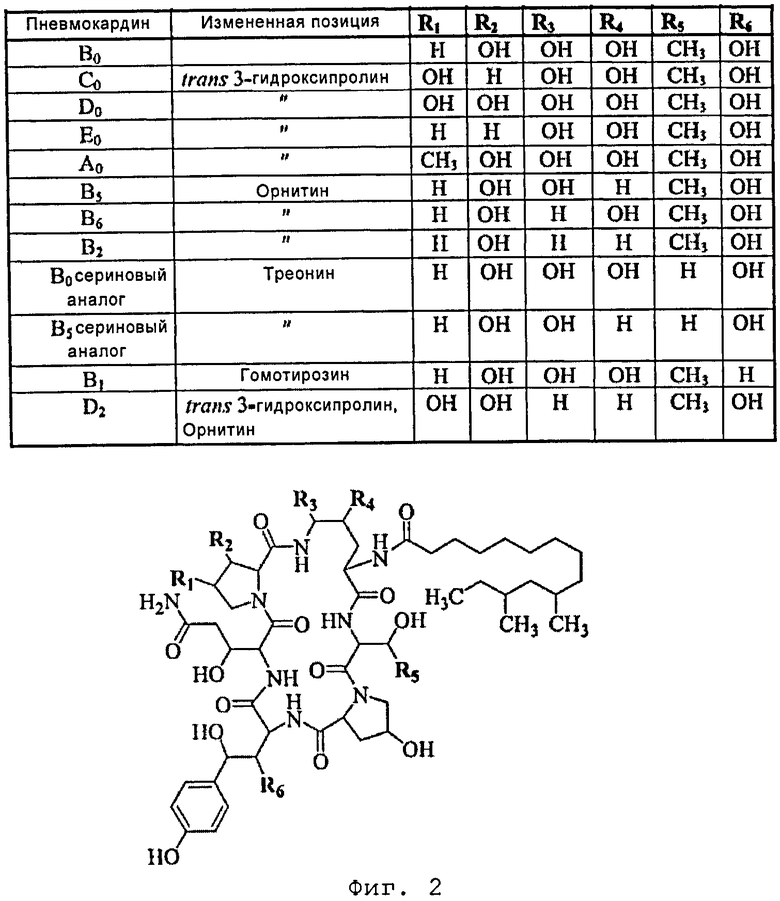
Фиг. 2 изображает структуру пневмокандинов, где пневмокандин В0 представляет собой соединение формулы I по настоящему изобретению.
Способы выполнения изобретения
Авторы настоящего изобретения неожиданно открыли высокопродуктивный мутантный штамм (№ CGMCC 2933), который может быть получен посредством мутирования штамма Glarea lozoyensis АТСС 20957 при помощи нитрозогуанидина (НТГ), при применении ливалзима для получения протопластов и последующего скрининга регенерировавших протопластов. Упомянутый мутантный штамм может продуцировать соединение формулы I с высоким выходом в процессе ферментации. Таким образом, авторы изобретения достигли целей настоящего изобретения.
Новый штамм
Настоящее изобретение предлагает новый штамм, продуцирующий соединение формулы I. Таксономически, упомянутый новый штамм относится к Glarea lozoyensis и депонирован в Китайском центре коллекции микробиологических культур под номером CGMCC 2933.
Способ получения нового штамма
Настоящее изобретение предлагает способ получения нового штамма № CGMCC 2933, и упомянутый способ может быть выполнен согласно следующей последовательности:
Изначальный штамм → посевная жидкость → мутагенез при помощи обработки НТГ → удаление клеточной стенки посредством ливалзима для получения протопластов → разбавление и посев протопластов на чашки → отбор единичной колонии и посев ее на скошенную среду → первичный скрининг во встряхиваемых колбах → селекция высокопродуктивного штамма → посев штамма на скошенную среду → вторичный скрининг во встряхиваемых колбах → селекция высокопродуктивного штамма, верификация в ферментационном чане и выполнение эксперимента по стабильности → консервирование штамма.
В частности, способ, предложенный в настоящем изобретении, предусматривает следующие этапы:
(a) смешивание посевной жидкости Glarea lozoyensis № АТСС 20957 с нитрозогуанидином для получения смеси А;
(b) смешивание упомянутой смеси А с ферментом, разрушающим клеточную стенку, для получения протопластов;
(c) регенерация упомянутых протопластов для получения единичных колоний;
(d) культивирование упомянутых единичных колоний для получения нового штамма.
В одном примере настоящего изобретения новый штамм может быть получен посредством следующей процедуры:
культивирования АТСС 20957 в течение 1-3 дней во встряхиваемых колбах для получения посевной жидкости (сухая клеточная масса, СКМ=5-10 г/л), добавления соответствующего количества НТГ к посевной жидкости, культивирования в течение еще 1-2 дней и последующего центрифугирования посевной жидкости, отмывания и ресуспендирования осадка и разрушения клеточных стенок при помощи ливалзима для получения протопластов; разбавления протопластов и последующего посева разбавленных протопластов на чашки с гипертонической PDA (картофельный агар с декстрозой), культивирования протопластов для получения единичных колоний рекомбинантных клеток для получения нового мутированного штамма.
Кроме того, настоящее изобретение предлагает способ получения соединения формулы I посредством ферментации нового штамма, полученного при помощи мутагенеза.
В примере настоящего изобретения способ для получения нового штамма посредством мутагенеза и ферментации нового штамма для продукции соединения формулы I включает:
(1) Изначальный штамм: Glarea lozoyensis АТСС 20957.
(2) Посевную культуру изначального штамма.
Законсервированный в глицерине штамм АТСС 20957 размораживают, сеют в посевную среду (вносимое количество 50 мл/250 мл), культивируют на шейкере при 200-300 об/мин и температуре 25-30°С в течение от 1 до 3 дней до тех пор, пока сухая масса мицелия не достигнет приблизительно 5-10 г/л.
Композиция посевной среды: 10-20 г/л сахарозы, 4-10 г/л дрожжевого экстракта, 10-20 г/л соевого триптона, 1,5-2 г/л КН2РО4, 0,4-1 г/л MgSO4·7Н2О, 10-50 г/л микроэлементов, исходный pH 5,3-6,0. Среду стерилизуют при 121°С в течение 20 минут. Микроэлементы: 10-20 г/л FeSO4·7H2O, 10-20 г/л MnSO4·H2O, 2-10 г/л ZnSO4·7H2O, 0,7-2,0 г/л СаСl2, 0,56-2,0 г/л Н3ВO3, 0,25-2,0 г/л СuСl2·2Н2O, 0,19-2,0 г/л (NH4)6Мо7O24·7Н2O, концентрированная соляная кислота 500 мл/л.
(3) Отбор единичных колоний
В начале посевную жидкость изначального штамма подвергают мутагенезу при помощи НТГ и затем обрабатывают при помощи ливалзима для разрушения клеточной стенки. Полученные в результате протопласты регенерируют для получения мутантного штамма.
(4) Скрининг мутированного штамма
Протопласты сеют на гипертоническую среду PDA. Единичные колонии, выращенные в течение 10-12 дней, сеют на скошенную среду для дальнейшего культивирования, соответственно. После 8-10 дней посевную среду инокулируют (вносимое количество 25 мл/250 мл) при помощи газона, выращенного на скошенной среде, и культивируют на шейкере при 280 об/мин и температуре 25-30°С в течение 6-10 дней. Посевную среду сеют в ферментационную среду (вносимое количество 25 мл/250 мл) и культивируют на шейкере при 200-300 об/мин и температуре 25-30°С в течение 6-12 дней. После завершения культивирования ферментационную жидкость экстрагируют метанолом и содержание соединения формулы I в ферментационной жидкости измеряют посредством высокоэффективной жидкостной хроматографии.
Композиции соответствующей среды могут быть найдены в «Pneumocandins from Zalerion arboricola», Journal of antibiotics, T.45, H.12, Декабрь 1992, С.1867-1874.
Гипертоническая среда PDA для чашек Петри состоит из 300 г/л картофеля, 20 г/л глюкозы, 15 г/л агара, 273, 6 г/л сахарозы и стерилизована при 121°С в течение 20 мин.
Содержание соединения формулы I в ферментационной жидкости измеряют высокоэффективной жидкостной хроматографией:
хроматографическая колонка: Phenomex С18 (4,6 мм × 250 мм, 5 мкм),
мобильная фаза: ацетонитрил:вода = 50:50,
температура колонки: 35°С,
градиентное элюирование, скорость потока: 1,0 мл/мин,
объем вводимой пробы: 5 мкл, длина волны детектирования: 210 нм.
(5) Ферментация мутированного штамма
Соответствующие технические решения описаны в литературе. Более детально см. Biotechnology and Bioengineering, Т. 78, Н.3, 5 Май, 2002; и Journal of industrial microbiology, 11 (1993), 95-103.
Характеристики настоящего изобретения, упомянутые выше, или характеристики, упомянутые в примерах, при желании, могут быть объединены. Любые характеристики, раскрытые в настоящем описании, могут быть применены в сочетании с любыми другими характеристиками, и каждая характеристика, раскрытая в описании, может быть заменена альтернативной характеристикой, которая может послужить идентичной, эквивалентной или сходной цели. Таким образом, характеристики, раскрытые в данном документе, представляют собой только общие иллюстративные примеры эквивалентных или сходных характеристик, исключая случаи, когда указано иное.
Главные преимущества настоящего изобретения включают следующее.
1. Получение нового высокопродуктивного мутированного штамма со стабильными генетическими свойствами.
2. Высокая генетическая стабильность и низкая контаминация продукции нового штамма, способствующие отделению продукта и его очистке в процессе получения соединения формулы I, а также масштабирование производства, что делает новый штамм приемлемым для промышленного производства.
3. Выход соединения формулы I может достигать 5 г/л в оптимизированных ферментационных условиях.
Настоящее изобретение в дальнейшем будет проиллюстрировано ниже при помощи ссылки на конкретные примеры. Следует понимать, что эти примеры являются только иллюстративными для настоящего изобретения и не огранивают его объем. Экспериментальные способы, описанные в следующих примерах без указания условий, обычно выполняют при общепринятых условиях или согласно инструкции производителя. Если не указано иное, все проценты, отношения, пропорции или части вычислены по массе.
Единица измерения, выраженная в процентном отношении массы к объему, примененная в настоящем изобретении, хорошо известна специалистам в области техники, например, она относится к массе раствора в 100 миллилитрах раствора.
Если не определено иное, все технические и научные термины, примененные в настоящем описании, имеют значения, обыкновенно понимаемые специалистами в области техники. Кроме того, все способы и материалы, которые сходны или эквивалентны содержанию, раскрытому в данном документе, могут быть применены в настоящих способах. Предпочтительные методы и материалы для выполнения настоящих способов, раскрытых в данном документе, приведены только в качестве примеров.
В примерах по настоящему изобретению предложены следующие условия высокоэффективной жидкостной хроматографии, применяемые для измерения содержания соединения формулы I в ферментационной жидкости:
хроматографическая колонка: Phenomex С18 (4,6 мм × 250 мм, 5 мкм),
мобильная фаза: ацетонитрил: вода=50:50,
температура колонки: 35°С,
градиентное элюирование, скорость потока: 1,0 мл/мин,
объем вносимой пробы: 5 мкл, длина волны детектирования: 210 нм.
Пример 1
Мутагенез с целью получения нового штамма CGMCC 2933
1. Мутагенез
Законсервированный в глицероле штамм АТСС 20957 размораживали, сеяли в посевную среду при помощи инокулята в количестве 4% (вносимое количество 50 мл/250 мл), затем культивировали на шейкере при 280 об/мин и температуре 25°С в течение 2 дней до тех пор, пока сухая масса мицелия не составит приблизительно 5-10 г/л. Мутаген НТГ добавляли к посевной жидкости в концентрации 10 мкг/мл, и посевную жидкость культивировали в течение еще одного дня. Затем брали 10 мл посевной жидкости, содержащей НТГ, центрифугировали при 5000 об/мин в течение 10 минут, полученный осадок промывали два раза при помощи двух объемов 0,6 М NaCl для удаления среды и НТГ.
Посевная среда: 10 г/л сахарозы, 5 г/л дрожжевого экстракта, 10 г/л соевого триптона, 1,5 г/л КН2РО4, 0,4 г/л MgSO4·7H2O, 10 г/л микроэлементов, исходный pH 5,3. Посевную среду стерилизовали при 121°С в течение 20 мин.
Микроэлементы: 10 г/л FeSO4·7H2O, 10 г/л MnSO4·H2O, 2 г/л ZnSO4·7H2O, 0,7 г/л СаСl2, 0,56 г/л Н3ВO3, 0,25 г/л СuСl2·2Н2O, 0,19 г/л (NH4)6Мо7O24·7Н2O, концентрированная соляная кислота - 500 мл/л.
2. Приготовление протопластов и отбор единичных колоний
К отмытому мицелию добавляли 10 мл ферментной смеси (в буфере, содержащем двузамещенный фосфат натрия и лимонную кислоту (pH 6,0) с 0,5 М NaCl), которая содержит 20 мг/мл ливалзима (2000 единиц/мг), 10 мг/мл фермента улитки (5 единиц/мг) и 10 мг/мл целлюлозы (15 единиц/мг). Полученную в результате смесь встряхивали при 80 об/мин и 30°С в течение 5 ч для ферментного лизиса. Энзимолитическую реакционную смесь фильтровали при помощи хлопка для удаления мицелия и получения одноклеточной суспензии, содержащей только протопласты. Один миллилитр этого раствора брали и центрифугировали при 14000 об/мин в течение 10 мин. Осадок растворяли в 1 мл буфера (pH 6,0), содержащем двузамещенный фосфат натрия, лимонную кислоту и 0,5 М NaCl. Затем делали серию разведений этого раствора с различными концентрациями, равномерно сеяли на гипертоническую среду PDA с 0,8 М сахарозой и культивировали при 25°С в течение 8-10 дней для получения единичных колоний.
3. Процесс скрининга высокопродуктивного штамма CGMCC 2933
После культивирования в течение 10 дней отбирали единичные колонии и сеяли на скошенную среду для дальнейшего культивирования. После 8 дней собирали газонную культуру площадью 0,5-1 см2, сеяли в посевную среду (вносимый объем 25 мл / 250 мл) и культивировали на шейкере при 280 об/мин и 25°С в течение 8 дней. Посевную жидкость сеяли в ферментационную среду при помощи инокулята объемом 4% (вносимый объем 25 мл / 250 мл), культивировали на шейкере при 280 об/мин и 25°С в течение 14 дней (на 7-й день культивирования добавляли 5% маннит и 0,5% пролин).
Пример 2
Получение соединения формулы I при помощи нового штамма CGMCC 2933
Новый штамм CGMCC 2933, полученный в примере 1 в посевной среде, сеяли в ферментационную среду при помощи инокулята в количестве 4% и культивировали во встряхиваемых колбах при температуре 25°С. После культивирования в течение 14 дней выход соединения формулы I достигал 5 г/л (на 7-й день культивирования добавляли 5% маннит и 0,5% пролин).
Ферментационная среда: 15 г/л L-пролина, 6 г/л глутамата натрия, 6 г/л дрожжевого экстракта (полученного от компании Oxiod), 4 г/л фруктозы, 1,5 г/л КН2РO4, 0,4 г/л MgSO4·7H2O, 50 г/л маннита, 10 мл/л микроэлементов, исходный pH 5,3. Ферментационную среду стерилизовали при 121°С в течение 20 мин.
Микроэлементы: 10 г/л FeSO4·7H2O, 10 г/л MnSO4·H2O, 2 г/л ZnSO4·7H2O, 0,7 г/л СаСl2, 0,56 г/л Н3ВO3, 0,25 г/л СuСl2·2Н2O, 0,19 г/л (NH4)6Мо7O24·7Н2O, концентрированная соляная кислота 500 мл/л.
Сравнительный пример
Способность изначального штамма АТСС 20957 продуцировать соединение формулы I сравнивали с таковой у мутантного штамма CGMCC 2933 при помощи следующих способов: изначальный штамм и мутантный штамм культивировали при помощи способа культивирования, описанного в примере 2, соответственно. После завершения культивирования ферментационную жидкость экстрагировали двумя объемами метанола, и содержание соединения формулы I в ферментационной жидкости измеряли высокоэффективной жидкостной хроматографией. Результаты приведены в таблице 1.
Примененные среды приведены ниже.
Среда для скрининга состоит из 300 г/л картофеля, 20 г/л глюкозы, 15 г/л агара, 273,6 г/л сахарозы и стерилизована при 121°С в течение 20 мин.
Скошенная среда состоит из 300 г/л картофеля, 20 г/л глюкозы, 15 г/л агара и стерилизована при 121°С в течение 20 мин.
Посевная среда состоит из 10 г/л сахарозы, 5 г/л дрожжевого экстракта, 10 г/л соевого триптона, 1,5 г/л КН2РО4, 0,4 г/л MgSO4·7H2O, 10 г/л микроэлементов, исходный pH 5,3 и стерилизована при 121°С в течение 20 мин.
Ферментационная среда состоит из 15 г/л L-пролина, 6 г/л глутамата натрия, 6 г/л дрожжевого экстракта (полученного от компании Oxiod), 4 г/л фруктозы, 1,5 г/л КН2РO4, 0,4 г/л MgSO4·7H2O, 50 г/л маннита, 10 мл/л микроэлементов, исходный pH=5,3, и стерилизована при 121°С в течение 20 мин.
Микроэлементы: 10 г/л FeSO4·7H2O, 10 г/л MnSO4·H2O, 2 г/л ZnSO4·7H2O, 0,7 г/л СаСl2, 0,56 г/л Н3ВO3, 0,25 г/л CuCl2·2H2O, 0,19 г/л (NH4)6Mo7O24·7Н2O, концентрированная соляная кислота 500 мл/л.
Пример 3
Стабильность нового штамма CGMCC 2933
Субкультивирование выполняли при помощи той же питательной среды и условий культивирования, как и в примере 2.
Результаты приведены в таблице 2.
Результаты показывают, что новый штамм обладает превосходной стабильностью.
Вышеприведенное описание представляет собой лишь предпочтительные примеры настоящего изобретения и не предназначено для ограничения объема смыслового технического содержания настоящего изобретения. Смысловое техническое содержание настоящего изобретения широко определено в объеме формулы изобретения, прилагаемой к настоящему изобретению. Любой технический объект или способ, выполненный по-другому, должен считаться относящимся к объему формулы настоящего изобретения, если объект или способ полностью идентичны таковым, определенным в формуле изобретения настоящей заявки, или их эквивалентным изменениям или модификациям.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ, ПРОДУЦИРУЮЩИЙ ПЕПТИДНЫЕ АНТИБИОТИКИ С ВЫСОКИМ ВЫХОДОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2011 |
|
RU2560258C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-СЕРИНА | 1991 |
|
RU2008356C1 |
| ШТАММ БАКТЕРИЙ CORYNEBACTERIUM AMMONIAGENES - ПРОДУЦЕНТ УРИДИН-5'-МОНОФОСФАТА (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ УРИДИН-5'- МОНОФОСФАТА | 1999 |
|
RU2203948C2 |
| СПОСОБ ПОЛУЧЕНИЯ АВЕРМЕКТИНА И ШТАММЫ STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТЫ АВЕРМЕКТИНА | 1988 |
|
RU2096462C1 |
| СПОСОБ ЭФФЕКТИВНОГО ПРОИЗВОДСТВА 7-АДЦК ЧЕРЕЗ 2-(КАРБОКСИЭТИЛТИО) АЦЕТИЛ-7-АДЦК И 3-(КАРБОКСИМЕТИЛТИО)ПРОПИОНИЛ-7-АДЦК | 1994 |
|
RU2139349C1 |
| Способ получения лимонной кислоты | 1977 |
|
SU695230A1 |
| ШТАММ АНАЭРОБНЫХ БАКТЕРИЙ Clostridium tyrobutyricum - ПРОДУЦЕНТ МАСЛЯНОЙ КИСЛОТЫ И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА МАСЛЯНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА | 2015 |
|
RU2605545C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-АМИНОЦЕФАЛОСПОРАНОВОЙ КИСЛОТЫ, ВЕКТОР ЭКСПРЕССИИ, РЕКОМБИНАНТНЫЙ ШТАММ | 1992 |
|
RU2202616C2 |
| Мутантный штамм Corynebacterium glutamicum, продуцирующий L-глутамин (варианты), и способ получения L-глутамина | 2015 |
|
RU2665830C1 |
| ШТАММ STREPTOMYCES HYGROSCOPICUS BKM AC-2737D - ПРОДУЦЕНТ АНТИБИОТИКА РАПАМИЦИНА И СПОСОБ УВЕЛИЧЕНИЯ ЕГО ПРОДУКТИВНОСТИ | 2018 |
|
RU2679051C1 |

Изобретение относится к области биотехнологии и касается мутантного штамма Glarea lozoyensis и его применения. Мутантный штамм получен путем воздействия на штамм Glarea lozoyensis АТСС 20957 нитрозогуанидином и депонирован в CGMCC под №CGMCC 2933. Данный штамм гриба обладает стабильными генетическими и продуктивными свойствами, продуцирует мало примесей при ферментации и приемлем для получения антибиотика в промышленных масштабах. 3 н. и 3 з.п. ф-лы, 2 ил., 2 табл., 3 пр.
1. Мутантный штамм Glarea lozoyensis для получения соединения формулы I
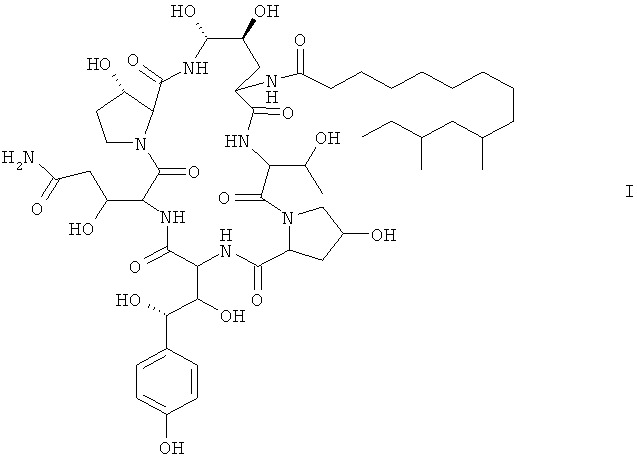
депонированный в Китайском центре коллекции микробиологических культур под № CGMCC 2933.
2. Применение мутантного штамма по п.1 для получения соединения формулы I.
3. Способ получения соединения формулы I, включающий следующий этап:
(1) культивирование мутантного штамма по п.1 в ферментационной среде при температуре 15-35 °С для получения соединения формулы I, где ферментационная среда включает следующие компоненты из расчета на общий объем ферментационной среды: 15-50 г/л L-пролина, 6-20 г/л глутамата натрия, 6-20 г/л дрожжевого экстракта, 4-20 г/л фруктозы, 1,5-7 г/л неорганической соли и 10-50 г/л микроэлементов, и исходное значение рН ферментационной среды составляет 5,3-6,0.
4. Способ получения по п.3, где неорганическая соль выбрана из фосфата или сульфата или их комбинации.
5. Способ получения по п.3, где ферментационная среда дополнительно содержит 10-100 г/л маннита в процессе культивирования.
6. Способ получения по п.3, где объем инокулята мутантного штамма по п.1 составляет 4-10 об.% из расчета на общий объем ферментационной среды.
| US 5426038 A, 20.06.1995 | |||
| WO 2000008197 A1, 17.02.2000 | |||
| GB, 2245271 A, 02.01.1992. |
Авторы
Даты
2014-02-20—Публикация
2009-09-28—Подача