Изобретение относится к области синтетических методов изготовления коммерческих цефалоспориновых антибиотиков в настоящее время имеется значительное количество цефалоспориновых антибиотиков, лечебные средства цефалоспориновой природы сейчас находятся в своем четвертом поколении. У коммерческих цефалоспоринов обнаруживается огромное разнообразие боковых цепей: большая экономическая важность цефалоспоринов определяет повышенную значимость разработок более экономичных и эффективных методов производства ключевых промежуточных продуктов, которые позволяют легко синтезировать различные цефалоспорины.
Одним из ключевых промежуточных продуктов цефалоспоринов является 7-аминоцефалоспорановая кислота (7-АЦК), которая может быть представлена следующей формулой: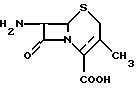
В настоящее время 7-АЦК производится из цефалоспорина С. Цефалоспорин С, сам по себе являющийся ферментационным продуктом, является исходным веществом почти для всех имеющихся в настоящее время торговых препаратов цефалоспоринов. Однако синтетические манипуляции по производству различных коммерческих цефалоспоринов в большинстве случаев начинаются, по существу, с 7-аминоцефалоспорановой кислоты, которая должна быть получена из цефалоспорина С путем отщепления 7-аминоадипоиловой боковой цепи. Обычные коммерческие цефалоспорины получают синтетически из 7-АЦК, в том числе и те, которые имеют 3-ацетилоксиметиленовую боковую цепь, включая цефотаксим, цефалоглицин, цефалотин и цефапирин.
Еще одним из ключевых промежуточных продуктов является 7-аминодеацетилцефалоспорановая кислота (7-АДАЦ), которая может быть представлена следующей формулой: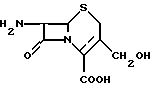
В настоящее время 7-АДАЦ также производится из цефалоспорина С путем удаления 7-D-α-аминоадипоиловой боковой цепи вместе с превращением 3-ацетилоксиметиленовой боковой цепи в 3-гидроксиметил. 7-АДАЦ применяется в качестве промежуточного соединения в синтезе цефалоспоринов, содержащих модифицированные заместители в положении С-3.
В настоящее время в данной области техники предпочтительным способом отщепления 7-аминоадипоиловой боковой цепи является химический способ. Основной иминогалоидный процесс требует защиты амино - и карбоксильной групп 7-аминоадипоиловой боковой цепи; для достижения этого сейчас используется несколько методов. Однако процесс химического отщепления, применяемый в настоящее время, имеет серьезные недостатки. Среди этих недостатков можно отметить необходимость проведения многоэтапного и сложного процесса; чрезвычайно низкие действительные температуры; дорогостоящие реактивы; значительные количества побочных продуктов этого процесса, приводящие к проблемам обработки образующейся реакционной смеси; и очистку сильнозагрязненного сходного материала перед началом химической обработки. Поэтому ведется непрерывный поиск микробиологического или ферментативного процесса, по которому достигалось бы ферментное деацилирование цефалоспорина С с образованием 7-аминоцефалоспорановой кислоты на более экономичной основе, чем та, что имеется у используемого сейчас химического процесса.
Однако этот поиск успешного микробиологического процесса оказывается в значительной степени тщетным. Как становится ясно из литературы, это является результатом особенностей структуры и, в частности, стереохимии аминоадипоиловой боковой цепи молекулы цефалоспорина С, так как пенициллин успешно деацилируется ферментным расщеплением с использованием пенициллинацилазы, образуемой множеством микроорганизмов. С другой стороны, сообщение в литературе об успешном одноэтапном ферментом деацилировании цефалоспорина С часто являются невоспроизводимыми или обеспечивают только очень небольшие выходы конечного продукта.
Поэтому настоящее изобретение главным образом относится к области изготовления ключевого цефалоспоринового промежуточного соединения 7-АЦК, а более конкретно - к области биопроцессов для производства 7-АЦК.
К настоящему времени поиск успешного биопроцесса для изготовлении 7-АЦК остается в значительной степени тщетным, конечно же, и в отношении биопроцесса промышленного масштаба. Например, в то время как возможно прямой ферментацией и/или ферментной обработкой получить 6-аминопенициллановую кислоту (6-АПК), у которой остается необходимым только расширить кольцо, чтобы получить 7-АДЦК, было обнаружено, что, к несчастью, ферменты Cephalosporium или Streptomyces, которые осуществляют расширение кольца в нормальных метаболических путях этих микроорганизмов, не воспринимают 6-АПК в качестве субстрата. Эти ферменты, которые в совокупности обозначаются как ДАОЦС или "фермент экспандаза" в данной области техники, определяются как ферменты, которые катализируют расширение структур пенамовых колец, найденных в молекулах пенициллинового типа, в цеф-3-емовые кольца, найденные у цефалоспоринов. В дальнейшем эти ферменты будут коллективно упоминаться как "фермент экспандаза".
Субстратом, на который действует фермент экспандаза, является пенициллин N, который после расширения кольца и гидроксилирования дает деацетилцефалоспорановую кислоту (ДАЦ). Теперь для получения 7-АДАЦ необходимо только отщепить (Д)-α-аминоадипоиловую боковую цепь, но эта боковая цепь оказалась упорно невосприимчивой к ферментному отщеплению, что приводит только к неприемлемо низким выходам конечного продукта.
В соответствии с настоящим изобретением стало возможным проводить эффективный биопроцесс, по которому пенициллиновое соединение (имеющее адипоиловую боковую цепь) образуется посредством нового ферментационного процесса в высоких титрах; названное пенициллиновое соединение является приемлемым субстратом для экспандазного фермента, который образуется "в месте нахождения" тем же самым организмом, который производит и пенициллиновое соединение, трансформированным для экспрессии названного фермента экспандазы. Фермент экспандаза затем осуществляет расширение кольца пенициллинового соединения с образованием цефалоспоринового соединения с высоким выходом последнего.
Адипоил-7-АДЦК, образуемая действием фермента экспандазы в месте нахождения, имеет 3-метильную боковую цепь (-СН3), тогда как 7-АЦК, конечный продукт, имеет 3-ацетилоксиметильную боковую цепь [-СН2ОС/О/CН3]. Для того чтобы превратить 3-метильную боковую цепь в 3-ацетилоксиметильную боковую цепь, в соответствии с настоящим изобретением также "в месте нахождения" экспрессируются две другие ферментные активности в добавление к экспандазной активности. Для этого имеются гидроксилаза и ацетилтрансфераза; оба фермента являются продуктами экспрессии генов, которыми также был трансформирован микроорганизм, образующий пенициллиновое соединение. Гидроксилазный фермент превращает 3-метильную боковую цепь адипоил-7-АДЦК в 3-гидроксиметильную, а ацетилтрансферазный фермент превращает 3-гидроксиметильную боковую цепь в 3-ацетилоксиметильную боковую цепь 7-АЦК.
И на последнем решающем этапе метода настоящего изобретения важно то, что боковую цепь пенициллинового соединения, теперь уже цефалоспоринового соединения, можно удалить другой ферментной системой с неожиданно высокими выходами конечного продукта. Непредвиденным результатом этого уникального общего биопроцесса, который включает в себя настоящее изобретение, является образование 7-АЦК с удивительно высокими выходами и экономичность, достаточная для того, чтобы представлять приемлемую альтернативу используемым в настоящее время методам, связанным с химическими и биохимическими процессами.
Новый биопроцесс настоящего изобретения представляет уникальный и удивительно эффективный метод производства 7-АЦК как экономически жизнеспособную альтернативу используемому в настоящее время химическому синтезу. Непрерывные попытки изобретения такого биопроцесса в данной области техники приводят к постоянно повторяющимся неудачам. Например, ЕР-А-0422790 описывает ДНК, кодирующую изопенициллин N: ацил-КоА-ацилтрансферазную активность Aspergillus nidulans, и ее использование для получения полезных цефалоспоринов с участием образующих пенициллин грибов, которое не достигалось до этого в данной области техники. Но оно описывается как осуществляемое путем разрушения или перемещения ацетилтрансферазного гена вместе с добавлением генов, кодирующих ферменты эпимеразу и экспандазу, из образующих цефалоспорин организмов; кроме того, по-видимому, не получено действительно полезного результата трансформации и экспрессии. К тому же, если описанная трансформация была бы удачной, она все равно не была бы применима для целей настоящего изобретения, так как по прежнему оставалась бы проблема удаления D-α-аминоадипоиловой боковой цепи. Такая неудачная попытка получить значительные результаты по производству промежуточных продуктов в синтезе коммерческих цефалоспоринов из культур грибов, образующих пенициллин, составляет полную противоположность результатам, полученным при использовании метода настоящего изобретения.
Первый ферментный этап биопроцесса по методу настоящего изобретения представляет собой расширение кольца у адипоил-6-АПК, которое осуществляется ферментом экспандазой, являющимся продуктом экспрессии экспандазного гена, которым был трансформирован хозяйский нерекомбинантный штамм P. сhrysogenum. Использование такого экспандазного фермента уже применялось в данной области техники. Например, Cantwell et al. , Curr. Genet. (1990), 17: 213-221, предложили биопроцесс для получения 7-АДЦК посредством расширения кольца пенициллина V, сопровождаемого ферментным гидролизом полученного деацетоксицефалоспорина V с образованием 7-АДЦК. Это предложение основано на имеющемся в наличии гене экспандазы пенициллина N(cefE), клонированном из S. Clavuligerus, Kovacevic et al., J. Bacteriol. (1989), 171: 754-760 и Ingolia et al. U.S. 5070020. Однако поскольку экспандаза действует на пенициллин N, ее естественный субстрат, а не на пенициллин V, то сделанное предложение требует генно-инженерных работ по формированию модифицированного гена экспандазы, продукт которого может расширить кольцо у пенициллина V. Однако требуемая модификация не выполнена Cantwell et al.; им удалось трансформировать Penicillium chrysogenum геном cefE из Streptomyces clavuligerus и получить экспрессию фермента ДАОЦС (экспандазы) только на низком уровне.
Фермент экспандаза хорошо изучен в данной области техники как в отношении его активности, так и в отношении его генетической последовательности. Например, в работах Wolfe (U.S. 4510246 и 4536476) для предоставления стабильных ферментных препаратов из бесклеточных экстрактов образующих β-лактамы прокариотических организмов, включая Streptomyces clavuligerus были по отдельности выделены циклаза, эпимераза и ферменты, расширяющие кольцо. Detzlaf (U. S. 5082772; EP-A-0366354) описывает выделенный и очищенный фермент экспандазу из S. clavuligerus, который охарактеризован, включая концевые остатки и аминокислотный состав; определено также, что фермент имеет молекулярный вес около 34600 Дальтон. Однако этот результат противоречит молекулярному весу в 29000 Дальтон, определенному для вещества, которое очевидно, является таким же ферментом в U.S. 4536476. ЕР-А-0233715 описывает выделение и характеристику карты, построенной при помощи рестриктирующих эндонуклеаз, гена экспандазы, полученного из S.clavuligerus и экспрессированного рекомбинантной кодирующей экспандазу ДНК (дающей активный экспандазный фермент), в штамме S.clavuligerus дефектного по способности образовывать цефалоспорин.
Ingolia et al., U.S. 5070020 (ЕР-А-0341892) описывают последовательность ДНК, кодирующую фермент экспадазу, которая была получена из P.сhrysogenum; также описывается трансформация штамма P.сhrysogenum экспрессирующим вектором, содержащим названную последовательность ДНК, и получение тем самым экспрессии фермента экспандазы. В то время как предлагается применимость этого фермента для расширения колец у субстратов, отличающихся от пенициллина N, не представлено действительной демонстрации такого расширения колец.
Описанная выше работа сосредоточена на экспандазном ферменте, происходящим из прокариотического штамма S. Clavuligerus. Фермент, по-видимому, имеющий такую же расширяющую кольцо активность, также экспрессируется у эукариотических штаммов Cephalosporium acremonium (также относимым к Acremonium chrysogenum). Однако в таких штаммах экспандазная активность экспрессируется бифункциональным геном (cefEF), который также экспрессирует активность ДАЦС (гидроксилаза), чьей естественной функцией является превращение дезацетоксицефалоспорановой кислоты (ДАОЦ), продукта экспандазного фермента, в деацетилцефалоспорин С (ДАЦ). Результатом такой экспрессии является единственный, но бифункциональный фермент экспандаза/гидроксилаза. Хотя и были приложены усилия по разделению активностей у продукта двойного гена, ни одна из попыток еще не имела успеха. Например, ЕР-А-0281391 описывает выделение и идентификацию последовательности ДНК гена ДАОЦС/ДАЦС, полученного из C.acremonium АТСС 11550, а также соответствующую аминокислотную последовательность фермента. Штамм Penicillium был трансформирован и экспрессировал ферменты, однако попытки превращения пенициллинов G и V в соответствующие цефалоспорины ни разу не были продемонстрированы. Далее, несмотря на то что методы генной инженерии предлагаются в качестве легкого способа разделение генетической информации, кодирующей ДАОЦС и ДАЦС, и их раздельной экспрессии, не представлено действительной демонстрации такого разделения.
Фермент ДАОЦС/ДАЦС/экспандаза/гидроксилаза из C.acremonium также хорошо изучен в данной области техники, как в отношении его активности и ее характеристик, так и в отношении его генетической последовательности. Например, в работах Demain (U. S. 4178210; 4248966 и 4307192) различные исходные материалы пенициллинового типа обрабатываются бесклеточным экстрактом C.acremonium, который эпимеризует и расширяет кольцо с образованием цефалоспоринового антибиотического продукта. Wu-Kuang-Yeh (U.S. 4753881) описывает C.acremonium через посредство его изоэлектрической точки, молекулярного веса, аминокислотных остатков, соотношения гидроксилазной и экспандазной активностей и пептидных фрагментов.
Ацетилтрансферазный фермент C.acremonium также описан в данной области техники в отношении его активности, различных характеристик, рестрикционного картирования и последовательностей нуклеотидов и аминокислот. Смотри, например, ЕР-А-0437378 и ЕР-А-0450758.
Предшествующий уровень техники, обсуждавшийся выше, относится только к одному аспекту настоящего изобретения, а именно к трансформации штамма P. chrysogenum генами, кодирующими ферменты экспандазу и экспандазу/гидроксилазу и обеспечивающими экспрессию этих ферментов. На предшествующем уровне, однако, используются только экспрессированные ферменты для кольца пенициллина N, но не у пенициллинов G и V. И даже в этом случае у пенициллина N остается боковая цепь в положении 7, которую нельзя отщепить при помощи фермента для получения свободной аминогруппы. Настоящее изобретение основано на неожиданном открытии того, что адипоиловая боковая цепь может быть эффективно добавлена штаммом P.chrysogenum; что экспандазный фермент, экспрессируемый "в месте нахождения", может эффективно использовать это соединение в качестве субстрата для расширения кольца с образованием 7-АДЦК; что ферменты гидроксилаза и ацетилтрансфераза, также экспрессируемые "в месте нахождения", могут использовать адипоил-7-АДЦК в качестве субстрата с образованием 3-ацетоксиметиловой боковой цепи 7-АЦК; и что адипоиловая боковая цепь затем может быть эффективно удалена еще одним ферментом с образованием 7-АЦК. Тогда как различные отдельные фрагменты настоящего изобретения могут быть найдены на предшествующем уровне техники, на нем не имеется предложения объединить их для получения неожиданных результатов, предоставляемых методом настоящего изобретения.
Например, образование 6-адипоилпенициллановой кислоты известно в данной области; смотри Ballio et al. Nature (1960), 185, 97-99. Ферментное расширение кольца 6-адипоилпенициллановой кислоты, но только на основе данных in vitro, также известно в данной области; смотри Baldwin et al., Tetrahedron (1987) 43, 3009-3014; и ЕР-А-0268343. И ферментное отщепление адипоиловых боковых цепей также известно в данной области; смотри, например, работу Matsuda et al., J.Bact. (1987) 169, 5815-5820.
Адипоиловая боковая цепь имеет следующую структуру: СООН-(СН2)4-СО-, тогда как две боковые цепи близкородственной структуры являются цепями глутарила, имеющего следующую формулу: СООН-(СН2)3-СО-, и цепями (D)-α-аминоадипоила, имеющего формулу: СООН-СН(NH2)-(СН2)3-СО-. Ферментное отщепление глутариловых боковых цепей известно в данной области техники. Смотри, например, работы Shibuya et al. , Agric. Biol. Chem. (1981) 45, 1561-1567, и U.S. 3960662; Matsuda and Kamatsu, J.Bact. (1985) 163, 1222-1228; Matsuda et al., J.Bact. (1987) 169, 5815-5820; Jap. 53-086084 (1978 - Banyu Pharmaceutical Co., Ltd.); и Jap. 52-128293 (1977 - Banyu Pharmaceutical Co., Ltd.) ЕРА-А-0453048 описывает методы улучшения отцепляющей адипоил активности глутарилацилазы, образуемой Pseudomonas S У-77-1. При замещении различных аминокислот в определенных местах в пределах альфа-субъединицы (фермента) наблюдалась в три-пять раз более высокая скорость отщепления адипоила (от адипоилсерина). Следует отметить, что хотя ЕР-А-0453048, очевидно, демонстрирует ацилазу с улучшенной активностью в отношении адипоиловых боковых цепей, эта работа не описывает какого-либо способа (либо химического, либо при посредстве биопроцесса, каким-либо образом аналогичного тому, что описывается в настоящей спецификации), по которому адипоилцефалоспорин должен образовываться в первую очередь.
В данной области техники известно, что в тех случаях, где присутствует (D)-α-аминоадипоиловая боковая цепь, первой удаляется аминогруппа и происходит укорачивание боковой цепи с участием фермента оксидазы (D)-аминокислот, после чего остается глутариловая (ГЛ-7) боковая цепь; глутариловая боковая цепь удаляется вторым ферментом (глутарилацилазой). Такое двухэтапное отщепление описывание в работах Matsuda, U.S. 3960662; EP-A-0275901; Jap. 61-218057 (1988 - Komatsu, Asahi Chemical Industry Co.); WO 90/12110 (1990 - Wong, Biopure Corp. ); и EP-A-0436355, Isogai et al., также Bio/Technology (1991) 9, 188-191.
В данной области техники также известно, как выполняется одноэтапное отщепление (D)-α-аминоадипоиловой боковой цепи, в частности, с использованием техники рекомбинантной ДНК. Смотри, например: одноэтапное отщепление (D)-α-аминоадипоиловой боковой цепи:
- Jap. 53-94093 (Meiji Pseudomonas sp. BN-188);
- Jap. 52-143289 (= U.S. 4141790, Meiji, Aspergillus sp.);
- U. S. 4774179 (Asahi, 1988, Pseudomonas sp. SE-83 и SE-495), = Jap. 61-21097 и Jap. 61-152286;
- Fr. Pat. 2241557 (Aries 1975, Bacillus cereus var. fluorescens);
- Jap. 52-082791 (Toyo Jozo 1977, Bacillus megaterium NRRL B 5385);
- EP-A-0321849 (Hoechst, Pseudomonas, Bacillus subtilis, γ-glutamyl transpeptidase);
- EP-A-0322032, EP-A-0405846 и U.S. 5104800 (Merck, Bacillus megaterium);
- EP-A-0283218 и U. S. 4981789 (Merck, Arthrobacter viscosus); одноэтапное отщепление (рекомбинантное): цеф С --> 7-АЦК;
- Jap. 60-11029 (Asahi 1985, Comamonas, рекомбинантный штамм E.coli с геном из Comamonas cp. SV-77-1, одноэтапное превращение);
- Jap. 61-152-286 (Asahi 1986, Pseudomonas, рекомбинантный штамм E.coli с геном из Pseudomonas cp. SЕ 83, генетическая последовательность описана и внесена в формулу изобретения; одноэтапный процесс уже сформулирован в U.S. 4774179);
- Jap. 63-74499 (Asahi 1988, Trigonopsis variabibis, Comamonas, экспрессия в рекомбинантном штамме E.coli конструкции оксидазы (D)-аминокислот и ГЛ-7-АЦК-ацилазы);
- ЕР-А-0475652 (Fujisawa, цефалоспорин С-ацилаза и ее продукция посредством техники рекомбинантной ДНК).
В данной области техники известны различные аспекты методов для получения 7-АДАЦ. Смотри, например, U.S. 3304236 и 3972774 (Eli Lilly & Co.) EP-A-0454478 (Shionogi Co. Ltd); и опубликованную Японскую заявку 0453499 (Shionogi Co. Ltd).
Ссылка на заявку, находящуюся в процессе одновременного рассмотрения
Ссылка делается на находящуюся в процессе одновременного рассмотрения заявку с серийным номером 07/933469, выданную 28 августа 1992 года ( 185321 A в проведенном списке), которая описывает биопроцесс для получения 7-АДЦК, основанный на экспрессии активности экспандазного фермента в трансформанте P. chrysogenum тем же способом, что и в биопроцессе для получения 7-АДАЦ и 7-АЦК, описанном здесь. Однако в настоящем биопроцессе дополнительные трансформации используются для экспрессии дополнительных ферментных активностей с целью осуществить полностью отличающийся рекомбинантный метаболический путь для синтеза определенных конечных продуктов, ни один из которых не предлагается в заявке, находящейся в процессе одновременного рассмотрения.
Для того чтобы облегчить лучшее понимание метода настоящего изобретения и освоение ссылок предшествующего уровня техники, обсуждавшихся выше, далее сразу же излагается представление различных этапов метаболического пути, приводящего к адипоил-6-АПК, адипоил-7-АДЦК, адипоил-7-АЦК и 7-АЦК, промежуточных продуктов и ферментов, которые выполняют все вовлеченные в этот процесс превращения.
Краткое содержание изобретения
Настоящее изобретение относится к новому биопроцессу производства 7-аминодеацетилцефалоспорановой кислоты (7-АДАЦ), включающему этапы:
1) выращивание штамма Penicillium chrysogenum, образующего изопенициллин N, в культуральной среде, которая способна поддерживать его рост; добавление к названной культуральной среде источников поступления адипата, включающего что-либо одно или более одного из адипиновой кислоты, ее солей и эфиров, который способен ассимилироваться и использоваться названным штаммом Penicillium chrysogenum для образования адипоил-6-аминопенициллановой кислоты (адипоил-6-АПК), посредством чего и синтезируется адипоил-АПК;
2) осуществление следующих ферментных превращений посредством экспрессии "в месте нахождения" соответствующих генов:
а) кольцо адипоил-6-АПК расширяется "в месте нахождения" с образованием адипоил-7-аминодезатоксицефалоспорановой кислоты (адипоил-7-АДЦК) экспандазным ферментом; названный штамм P.chrysogenum был трансформирован ДНК, кодирующей активность экспандазного фермента, который способен воспринимать названную адипоил-6-АПК в качестве субстрата; в результате экспрессии экспандазы кольцо названной адипоил-6-АПК, образуемой названным штаммом, расширяется "в месте нахождения" с образованием адипоил-7-АДЦК;
б) 3-метиловая боковая цепь адипоил-7-АДЦК гидроксилируется "в месте нахождения" ферментом гидроксилазой с образованием адипоил-7-аминодеацетилцефалоспорановой кислоты (адипоил-7-АДАЦ); названный штамм P.chrysogenum был трансформирован ДНК, кодирующей активность гидроксилазного фермента, который способен воспринимать названную 7-АДЦК в качестве субстрата; в результате экспрессии гидроксилазы названная адипоил-7-АДЦК, образуемая названным штаммом, гидроксилируется "в месте нахождения" с образованием адипоил-7-АДАЦ; и
3) соприкосновение названной адипоил-7-АДАЦ с адипоил-амидазой, посредством чего адипоиловая боковая цепь удаляется с образованием продукта 7-АДАЦ; названный продукт затем выделяется.
Кроме того, настоящее изобретение относится к новому биопроцессу для производства 7-аминоцефалоспорановой кислоты (7-АЦК), включающему этапы:
1) выращивание штамма Penicillium chrysogenum, образующего изопенициллин N, в культуральной среде, которая способна поддерживать его рост; добавление к названной культуральной среде источника поступления адипата, включающего что-то одно или более одного из адипиновой кислоты, ее солей и эфиров, который способен ассимилироваться и использоваться названным штаммом Penicillium chrysogenum для образования адипоил-6-аминопенициллановой кислоты (адипоил-6-АПК), посредством чего и синтезируется названная адипоил-6-АПК;
2) осуществление следующих ферментных превращений посредством экспрессии "в месте нахождения" соответствующих генов:
а) кольцо адипоил-6-АПК расширяется "в месте нахождения" с образованием адипоил-7-аминодезатоксицефалоспорановой кислоты (адипоил-7-АДЦК) экспандазным ферментом; названный штамм P.chrysogenum был трансформирован ДНК, кодирующий активность экспандазного фермента, который способен воспринимать названную адипоил-6-АПК в качестве субстрата; в результате экспрессии экспандазы кольцо названной адипоил-6-АПК, образуемой названным штаммом, расширяется "в месте нахождения" с образованием адипоил-7-АДЦК;
б) 3-метиловая боковая цепь адипоил-7-АДЦК гидроксилируется "в месте нахождения" с образованием адипоил-7-аминодеацетилцефалоспорановой кислоты (адипоил-7-АДАЦ) ферментом гидроксилазой; названных штамм P.chrysogenum был трансформирован ДНК, кодирующей активность гидроксилазного фермента, который способен воспринимать названную адипоил-7-АДЦК в качестве субстрата: в результате экспрессии гидроксилазы названная адипоил-7-АДЦК, образуемая названным штаммом, гидроксилируется также "в месте нахождения" с образованием адипоил-7-АДАЦ; и
с) адипоил-7-АДАЦ ацетилируется "в месте нахождения" с образованием адипоил-7-аминоцефалоспорановой кислоты (адипоил-7-АЦК) ацетилтрансферазным ферментом; названный штамм P.chrysogenum был трансформирован ДНК, кодирующей активность ацетилтрансферазного фермента, который способен воспринимать названную адипоил-7-АДАЦ в качестве субстрата; в результате экспрессии ацетилтрансферазы названная адипоил-7-АДАЦ, образуемая названным штаммом, ацетилируется также "в месте нахождения" с образованием адипоил-7-АЦК; и
3) соприкосновение названной адипоил-7-АЦК и адипоил-амидазы, посредством чего адипоиловая боковая цепь удаляется и образуется продукт 7-АЦК; названный продукт затем выделяется.
Следующие термины при использовании здесь имеют указанные значения:
"7-АЦК" означает 3-[(ацетоилокси)-метил]-7-амино-8-оксо-5-тио-1-азабицикло [4.2.0]окт-2-ен-2-карбоновая кислота;
"адипоил-6-АПК" означает [2S-/2α,5α,6β/]-3,3-диметил-7-оксо-6- [(гексан-1,6-диоил)амино]-4-тио-1-азабицикло [3.2.0] гептан-2-карбоновая кислота;
"адипоил-7-АДЦК" означает 3-метил-7-[(гексан-1,6-диоил)амино]-3-метил-8-оксо-5-тио-1-азабицикло [4.2.0]окт-2-ен-2-карбоновая кислота; и
"адипоил-7-АДЦК" означает 3-гидроксиметил-7-[(гексан-1,6-диоил)амино]-3-метил-8-оксо-5-тио-1-азабицикло [4.2.0]окт-2-ен-карбоновая кислота.
В частности, настоящее изобретение относится к новым биопроцессам для производства 7-аминодеацетилцефалоспорановой кислоты (7-АДАЦ) и 7-аминоцефалспорановой кислоты (7-АЦК), перечисленным выше, в которых: источником поступления адипата является динатрий-адипат; ДНК, кодирующая активность экспандазного фермента, гидроксилазного фермента и ацетилтрансферазного фермента, происходит из Cephalosporium acrеmonium, а адипоил-ацилаза происходит из Рseudomonas species.
Далее, настоящее изобретение относится к векторам экспрессии рекомбинантной ДНК, которая кодирует активность экспандазного, гидроксилазного и ацетилтрансферазного фермента, происходящих из Cephalosporium acrеmonium, и промоторы, которые управляют экспрессией генов, кодирующих названные ферменты; эти векторы включают плазмиды рРЕN/СЕРН-1, рРЕNСАСТ и рТS-8, описанные ниже.
Далее, настоящее изобретение относится к клеткам хозяйского штамма Penicillium chrysogenum, трансформированным векторами экспрессии рекомбинантной ДНК; векторы включают ДНК, кодирующую активность экспандазного, гидроксилазного и ацетилтрансферазного ферментов, которые происходят из Cephalosporium acrеmonium, и промоторы, которые управляют экспрессией, кодирующей названные ферменты ДНК, включающие промотор гена ИПNC Penicillium chrysogenum. В частности, настоящее изобретение относится к клеткам хозяйственного штамма Penicillium chrysogenum трансформированным векторами экспрессии рекомбинантной ДНК, включающими плазмиды pPEN/CEPH-1, рPENCACT и pTS-8, описанные ниже.
Далее, настоящее изобретение относится к методу культивирования рекомбинантных клеток хозяйственного штамма Penicillium chrysogenum в условиях, подходящих для экспрессии генов; рекомбинантные хозяйские клетки включают векторы экспрессии рекомбинантной ДНК, содержащие ДНК, которая кодирует активность экспандазного, гидроксилазного и ацетилтрансферазного ферментов, происходящих из Cephalosporium acremonium, и промоторы, которые управляют экспрессией, кодирующей названные ферменты ДНК, включающие промотор гена ИПNC Penicillium chrysogenum. В частности, настоящее изобретение относится к клеткам культивирования рекомбинантных клеток хозяйского штамма Penicillium chrysogenum в условиях, подходящих для экспрессии генов; названные рекомбинантные хозяйские клетки содержат векторы экспрессии рекомбинантной ДНК, включающие плазмиды pPEN/CEPH-1, рPENCACT и pTS-8, описанные ниже.
Подробное описание изобретения
Главным аспектом настоящего изобретения является новый биопроцесс для производства 7-аминоцефалоспорановой кислоты (7-АЦК) и 7 аминодеацетилцефалоспорановой кислоты (7-АДАЦ), ключевых промежуточных продуктов в производстве синтетических коммерческих цефалоспоринов, которые могут быть представлены следующими структурными формулами: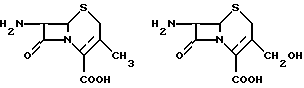
В добавление к цефалоспориновому ядру отличительными признаками 7-АЦК являются 7-аминогруппа и 3-ацетилоксиметильная группа (или 3-ацетоксиметильная группа, как она более часто обозначается). 7-аминогруппа является группой, которая может быть превращена в любое количество производных боковых цепей, и, таким образом, формирует основу для синтеза различных коммерческих цефалоспоринов. 3-ацетилоксиметильная группа часто может быть превращена в некоторое количество других боковых цепей для того, чтобы также синтезировать коммерческие цефалоспорины.
Конечный продукт 7-АЦК и промежуточный продукт адипоил-7-АЦК по методу настоящего изобретения могут составлять противоположность цефалоспорину С, другому ключевому цефалоспориновому промежуточному продукту, который может быть представлен следующей структурной формулой:
У этого промежуточного продукта 7-(D)-α-аминоадипоиловая боковая цепь неприемлема для дальнейшего получения синтетических производных и должна быть отщеплена с образованием приемлемой 7-аминогруппы. К несчастью, часто оказывается, что 7-(D)-α-аминоадипоиловую боковую цепь трудно удалять как химическими, так и биологическими средствами.
Определения
Следующие термины, используемые в настоящем описании и, особенно, в разделе, озаглавленном "Описание предпочтительных осуществлений изобретения", имеют указанные ниже значения:
7-АЦК 7-аминоцефалоспорановая кислота
7-АДАЦ 7-аминодеацетилцефалоспорановая кислота
7-АДЦК 7-аминодезацетоксицефалоспорановая кислота
6-АПК 6-аминопенициллановая кислота
ДАОЦ дезацетоксицефалоспорановая кислота
ДАОЦС ДАОЦ-синтетаза
ДАЦ деацетилцефалоспорин С
ДАЦС ДАЦ-синтаза
ИПNС изопенициллин N-синтетаза
Трис трис[гидроксиметил]аминометан
ЭДТА этилендиаминтетрауксусная кислота
ДЭПК диэтилпирокарбонат
ТЕ буфер Трис/ЭДТА
SS С буфер, содержащий соль (хлористый натрий) и цитрат натрия
SDS додецилсульфат натрия
ПЭГ полиэтиленгликоль.
Культура Penicillium chrysogenum.
Первый этап метода настоящего изобретения включает этап выращивания штамма Penicillium chrysogenum, образующего изопенициллин N, в культуральной среде, которая способна поддерживать его рост, и добавления к названной культуральной среде источника поступления адипата, включающего что-то одно или более одного из адипиновой кислоты, ее солей и эфиров; эти вещества должны ассимилироваться и использоваться названным штаммом Penicillium chrysogenum для образования адипоил-6-АПК. Источник поступления адипата можно добавлять к культуральной среде после посева P.сhrysogenum, но предпочтительно, чтобы он уже присутствовал в культуральной среде в то время, когда производится посев.
Другие роды, отличные от рода Penicillium, например, aspergillus nigulaus, а также другие виды из рода Penicillium, кроме вида chrysogenum, также образуют изопенициллин N. Однако исторически сложилось так, что все штаммы с самым высоким уровнем образования изопенициллина N были разработаны из штаммов вида chrysogenum при помощи хорошо известных методов улучшения штаммов. С практической стороны настоящее изобретение ограничено штаммами Penicillium chrysogenum, хотя очевидна его применимость и к другим видам. Любые заложенные в коллекции штаммы Penicillium chrysogenum или такие штаммы из других источников с открытым доступом являются подходящим исходным материалом для осуществления метода настоящего изобретения.
Культуральная среда, способная поддерживать рост штамма Penicillium chrysogenum, который образует изопенициллин N, относится к типу сред, с которым квалифицированный специалист в данной области мог бы легко познакомиться. Например, культивирование могло бы быть выбрана из ряда подходящих сред, имеющихся в наличии. В обычных средах используются источники углерода, такие как сахароза, глюкоза и крахмал; источники азота, такие как соевые бобы (в виде муки грубого помола или в дробленом виде), масло из семян хлопка, мука грубого помола из земляничных орехов и различные аминокислоты, их смеси и пептоны. Обеспечение потребностей продукции (антибиотика) увеличивает выход и облегчает выделение (антибиотика); предпочтительными средами в таких ситуациях могут быть среды с мелассой в качестве источника углерода и с соевой мукой и аминокислотами в качестве источника азота.
К культуральной среде обычно добавляют пищевые неорганические соли, которые включают соли, способные поставлять следующие ионные компоненты: натрий, калий, аммоний, кальций, фосфат, сульфат, хлорид, бромид, нитрат, карбонат, двухвалентное железо, трехвалентное железо, магний, марганец и другие. Микроэлементы обычно также необходимы для роста, развития и метаболизма Penicillium chrysogenum; их можно добавлять прямо в культуральную среду в том случае, если они уже не доставлены в качестве загрязнений других ингредиентов культуральной среды.
Штаммы Penicillium chrysogenum могут культивироваться в емкостях с малым объемом, такие как качалочные колбы на 1 л, в тех случаях, когда желательно получить только небольшие количества адипоил-7-АЦК и, в конечном счете, 7-АЦК. Когда желательно получить большие количества адипоил-7-АЦК, однако, будут использоваться резервуары для крупномасштабной ферментации в погруженных аэробных условиях.
При осуществлении крупномасштабного производства адипоил-7-АЦК споровую культуру штамма Penicillium chrysogenum выращивают на скошенном агаре. Споры с косяка используются для засева небольшого объема среды для вегетативного роста мицелия. Культивирование на этом этапе проводится для получения обильной, свежей, активно растущей культуры микроорганизма. Этот вегетативный мицелий затем используется в качестве посевного материала на среду для крупномасштабной ферментации. В определенных случаях может быть желательно в качестве посевного материала вносить дополнительный вегетативный мицелий в ферментационную среду. Такое двухэтапное внесение вегетативного мицелия обычно используется, когда объем ферментационной среды значительно больше, чем объем среды для начального вегетативного роста. По этому способу споры микроорганизма культивируют сначала в малом объеме среды для вегетативного роста для получения посевного материала, которым засевают больший объем среды для вегетативного роста. Мицелием со среды большего объема для вегетативного роста затем обеспечивают такую концентрацию микроорганизма, которая достаточна для начала быстрого установления ферментации в резервуаре для крупномасштабной ферментации. Среда для вегетативного роста может иметь такой же состав, как и ферментационная среда, или же может содержать дополнительные ингредиенты для начала роста и развития микроорганизма в малом масштабе.
Штамм Penicillium chrysogenum, применяемые в методе настоящего изобретения, наиболее эффективно растут при температурах между приблизительно 20o и 30oС, но оптимальные выходы получаются, когда температура находится между приблизительно 22o и 28oС, а предпочтительно около 25oС.
Наибольшее образование адипоил-7-АЦК осуществляется при культивировании штамма Penicillium chrysogenum в резервуарах большого масштаба в течение периода между приблизительно 10 и 30 дней, предпочтительно от 15 до 25 дней. Однако при культивировании в емкостях малого масштаба, таких как качалочные колбы на 250 мл, рост микроорганизма является более быстрым, и он образует адипоил-7-АЦК за более короткое время, например за 4-15 дней, чаще за 5-7 дней.
Если в резервуарах для крупномасштабной ферментации конечный рН достигает 8,0 или выше того, то это неблагоприятно отражается на выходе адипоил-7-АЦК. В таких случаях желательно следить за рН культуральной среды на всем протяжении ферментации. Если становится ясно, что рН достигнет таких высоких уровней до того времени, когда осуществляется наибольшее образование адипоил-7-АЦК, то его можно подвести с сторону понижения, добавляя к ферментационной среде подходящую кислоту или буферный агент.
За образованием адипоил-7-АЦК можно следить посредством хроматографической проверки образцов ферментационного бульона.
Как и при большинстве погруженных аэробных ферментаций, стерильный воздух пропускается через культуральную среду для получения более эффективного роста штамма Penicillium chrysogenum и повышенного образования адипоил-7-АЦК. Объем воздуха, пропускаемого через культуральную среду, обычно составляет, по крайней мере, приблизительно 0,2 объема воздуха в минуту на объем культуральной среды. Однако увеличенная скорость пропускания воздуха часто может оказывать благоприятное воздействие на образование адипоил-7-АЦК.
Штамм Penicillium chrysogenum обычно будет образовывать множество побочных продуктов и метаболитов в дополнение к адипоил-7-АЦК. Так как некоторые из этих продуктов являются кислотонеустойчивыми, то желательно при извлечении из ферментационной среды адипоил-7-АЦК в течение короткого времени обработать кислотой весь ферментационный бульон для того, чтобы разрушить некоторые из параллельно образующихся загрязнений. Ферментационный продукт - адипоил-7-АЦК - извлекается из профильтрованного ферментационного бульона, обработанного таким образом, и далее может быть произвольно отделен от других компонентов ферментационной среды посредством хроматографии на ионообменной смоле, и, если необходимо, может быть очищен при помощи хроматографии перед последующим этапом ферментного отщепления адипоиловой боковой цепи. Возможно также проводить такое ионообменное хроматографическое разделение после того, как проведено отщепление боковой цепи. Одним из основных побочных продуктов, который создает проблемы разделения, является адипоил-6-АПК, и для того чтобы сделать разделение более легким, можно разрушить химическим или ферментным способом этот побочный продукт. Сначала профильтрованный ферментационный бульон подвергается процедуре предварительной очистки, которая может включать начальную экстракцию несмешивающимся с водой органическим растворителем, таким как н-бутанол или амил-ацетат, для удаления загрязнений. Экстрагированный бульон затем может быть далее очищен на предварительном уровне посредством хроматографии на активированном угле.
Добавление источника поступления адипата
Предпочтительно, чтобы источник поступления адипата добавлялся к ферментационной среде для Penicillium chrysogenum при ее составлении описанным выше образом (то есть перед засевом) вместе с другими ингредиентами этой ферментационной среды. Источник поступления адипата может добавляться произвольно, через какое-либо время после засева, например через 1, 2 и/или 3 дня после засева. Источник поступления адипата определяется как что-то одно или более одного из адипиновой кислоты, солей и эфиров адипиновой кислоты, что может ассимилироваться и использоваться штаммом Penicillium chrysogenum, культивируемым для образования адипоил-6-АПК. Адипиновая кислота, ее соли и эфиры можно использовать по отдельности или же в любых сочетаниях. Предпочтительна двунатриевая соль, хотя калиевая и смешанная калий-натриевая соли также подошли бы. Можно использовать метиловый эфир, но этиловый эфир нерастворим в воде. Соль или эфир адипиновой кислоты должны быть такими, чтобы они могли ассимилироваться и использоваться штаммом Penicillium chrysogenum для образования адипоил-6-АПК. Например, может подходить сама по себе адипиновая кислота, несмотря на то, что она нерастворима в воде, если при надлежащих условиях рН образуется ассимилируемая соль.
Подходящие экспандазный и/или гидроксилазный ферменты
Штамм Penicillium chrysogenum, который культивировался и снабжался источником поступления адипата, как описано выше, для образования им адипоил-6-АПК, также является штаммом, который был трансформирован ДНК, кодирующей активность экспандазного и гидроксилазного ферментов, после чего в результате экспрессии этих ферментов кольцо названной адипоил-6-АПК "в месте нахождения" расширялось с образованием адипоил-7-АДЦК, 3-метиловая боковая цепь также превращалась в 3-гидроксиметиловую.
Адипоил-6-АПК образуется внутри клеток культуры штамма Penicillium chrysogenum при культивировании его в присутствии источника поступления адипата. Также внутриклеточно, то есть на основании положения " в месте нахождения", трансформированный штамм Penicillium chrysogenum экспрессирует ДНК, кодирующую активность экспандазного и гидроксилазного ферментов, после чего эти ферменты действуют на адипоил-6-АПК как на субстрат, происходит расширение его кольца с образованием адипоил 7-АДЦК, которая затем гидроксилируется в адипоил-7-АДАЦ (адипоил-7-аминодеацетилцефалоспорановую кислоту).
Новые биопроцессы настоящего изобретения включают в свою сферу трансформацию штамма Penicillium chrysogenum того типа, который описан выше, любой ДНК, кодирующей активность экспандазного и гидроксилазного ферментов, после этого в результате экспрессии этих ферментов кольцо адипоил-6-АПК расширяется "в месте нахождения" с образованием адипоил-7-АДЦК, а затем это вещество гидроксилируется с образованием адипоил-7-АДАЦ.
Таким образом, ДНК, которой трансформируется штамм Penicillium chrysogenum, должна экспрессировать ферменты, имеющие не только активность экспандазного фермента, подразумеваемую в данной области техники (то есть способность расширять кольцо изопенициллина N с образованием ДАОЦ), но также способность расширять кольцо адипоил-6-АПК с образованием адипоил-7-АДЦК. Кроме того, гидроксилазный фермент должен быть способен гидроксилировать адипоил-7-АДЦК и образованием адипоил-7-АДАЦ.
В отношении способа, которым обеспечиваются активности ферментов экспандазы и гидроксилазы, в качестве подходящих осуществлений в рамках настоящего изобретения рассматриваются два альтернативных подхода. В одном осуществлении настоящего изобретения, которое является предпочтительным, экспандазная и гидроксилазная функции осуществляются посредством активности, экспрессируемой одним, хотя, по существу, бифункциональным геном Cephalosporium aсremonium, которым трансформируется штамм Р. chrysogenum. Этот ген, который экспрессирует вместе обе активности - экспандазную и гидроксилазную, далее будет обозначаться как ген экспандазы/гидркосилазы, продукт этого гена будет обозначаться фермент экспандаза/гидроксилаза. Когда штамм Р. chrysogenum трансформируется ДНК из С. aсremonium, кодирующей активности экспандазы/гидроксилазы, то обычно экспрессия этой активности будет контролироваться одной промоторной последовательностью, что указывает на присутствие одного гена.
Альтернативное осуществление настоящего изобретения, которое в равной степени является подходящим, включает трансформацию хозяйского штамма Р. chrysogenum ДНК, кодирующей активности экспандазы и гидроксилазы в виде отдельных генов, что составляет противоположность одному гену экспандазы/гидроксилазы. Следовало бы отметить, что отдельные гены экспандазы и гидроксилазы и соответствующие ферментные активности, которые они кодируют, более часто обнаруживаются у прокариотических микроорганизмов, таких как S. clavuligerus, чем у эукаристических микроорганизмов, таких как Р. acremonium, у которых закодирован один ген экспандазы/гидроксилазы и один фермент, как уже рассматривалось выше.
Последовательности прокариотического гидроксилазного фермента и кодирующих его нуклеотидов описываются в работе Kovaceviс et al., J. Bacteriol. 173(1), 398-400 (1991) и в ЕР-А-0465189, где представлены способы выделения названного фермента. Для квалифицированного специалиста понятно, что исходя из последовательности гидроксилазы при помощи хорошо известных ручных методов или с использованием автоматических синтезаторов ДНК возможно синтезировать ДНК, кодирующую гидроксилазный фермент. В свою очередь, соединение ДНК или альтернативные последовательности, кодирующие такую же аминокислотную последовательность гидроксилазы, или их фрагменты и производные, которые имеют равноценную гидроксилазную активность, могут быть использованы в качестве основы для изготовления различных векторов клонирования и экспрессии при комбинировании с промотором или другими регуляторными последовательностями, которыми затем возможно трансформировать хозяйский штамм Р. chrysogenum для того, чтобы экспрессировать гидроксилазный фермент и тем самым осуществить метод настоящего изобретения, Соединение ДНК также возможно использовать в качестве зонда, с помощью которого можно проверить геномную библиотеку штамма-кандидата, потенциально содержащего искомый гидроксилазный фермент, с целью идентифицировать гомологичную последовательность посредством гибридизации. Активность любой предполагаемой гидроксилазы, идентифицированной таким образом, может быть подтверждена путем использования ее действительного субстрата адипоил-7-АДЦК по методу настоящего изобретения и выделения продукта ее гидроксилирования посредством ВЭЖХ.
В этом осуществлении настоящего изобретения, то есть при использовании одного гена, экспрессирующего только гидроксилазную активность, затем будет необходимо также отдельно предоставить ДНК, кодирующую активность экспандазного фермента, штамм Р. chrysogenum можно трансформировать подходящим экспрессионным вектором, который обеспечивает экспрессию "в месте нахождения" экспандазной функции для осуществления этапа расширения
кольца в методе настоящего изобретения. Известно множество экспандазных ферментов, на основании сходства боковых цепей можно считать, что многие экспандазные ферменты смогут участвовать в новом биопроцессе настоящего изобретения.
Другое полезное осуществление настоящего изобретения основано на том факте, что ДНК, кодирующая активность более чем одной экспандазы и/или более чем одной гидроксилазы, может быть использована для трансформации нерекомбинантного штамма Р. chrysogenum. При таком осуществлении настоящего изобретения возможно получить повышенную активность экспандазы и/или гидроксилазы из-за увеличенных количеств ферментного белка, которые будут экспрессироваться.
В разделе, описывающем предшествующий уровень техники, уже отмечалось, что для экспандазного фермента, производящего из Streptomyces clavuligerus АТСС 27064, полностью установлена последовательность нуклеотидов, а также проведена характеристика на ней участков расщепления рестриктирующими эндонуклеазами (картирование). Однако имеется сообщение о том, что вещество, которое, по-видимому, является таким же ферментом, происходящим из штамма S. clavuligerus NRRL 3585, имеет другой молекулярный вес, последовательность нуклеотидов для этого вещества не была определена. Выше - в разделе, касающемся предшествующего уровня техники, - также указывалось, что для фермента ДАОЦС/ДАЦС из Cephalosporium acremonium АТСС 11550 была определена нуклеотидная последовательность (Samcon et al., Bio / Technology (1987) 5: 1207-1214, и ЕР-А-0281391).
Эти экспандазные ферменты, уже идентифицированные на предшествующем уровне техники, применимы в новых биопроцессах настоящего изобретения. Другие экспандазные ферменты, которые еще не охарактеризованы и происходят из различных штаммов S. clavuligerus или С. acremonium или даже из микроорганизмов других родов, также могут оказаться подходящими для осуществления новых биопроцессов настоящего изобретения. Процедуры идентификации таких новых штаммов и родов пригодных микроорганизмов, выделения предполагаемых экспандазных ферментов и установления их применимости для использования в методе настоящего изобретения хорошо известны квалифицированному специалисту в данной области. Проверка бесклеточных экстрактов новых штаммов и родов, являющихся кандидатами в применимые микроорганизмы, может быть выполнена надежным и воспроизводимым способом посредством добавления названных экстрактов к субстрату адипоил-6-АПК в присутствии известных кофакторов ДАОЦС, которые включают двухвалентные ионы железа (Fe2+), аскорбат, α-кетоглютарат и аденозинтрифосфат (АТФ). Адипоил-6-АПК может быть изготовлена в достаточных количествах посредством добавления источника поступления адипата к нетрансформированной культуре Penicillium chrysogenum таким образом, который аналогичен подробно описанному ниже. Присутствие желаемого фермента экспандазы (или экспандазы/гидроксилазы) определяется по образованию адипоил-7-АДЦК и/или и адипоил-7-АДАЦ, наличие которых может быть обнаружено при помощи хроматографии.
Используя хорошо известные рекомбинантные методы, на основании нуклеотидной последовательности экспандазных генов из S. clavuligerus и C.acremonium возможно также получить зонды ДНК, например, для проверки ДНК, содержащейся в микроорганизмах, вероятно, образующих экспандазу, которые применимы в методе настоящего изображения.
Потенциальные источники ферментов экспандазы, гидроксилазы и экспандазы/гидроксилазы
Как уже отмечалось, экспандазные ферменты являются ферментами, которые катализируют расширение структур пенамовых колец (найденных в молекулах пенициллинового типа), с образованием цеф-3-емовых колец (найденных у цефалоспоринов). Любой организм, образующий метаболиты, которые содержат цефемовое кольцо, следовательно, являются потенциальными источниками кодирующей экспандазу ДНК. Подобно этому, любой организм, который образует цефалоспорины, содержащие 3-гидроксиметильную группу, является потенциальным источником кодирующей гидроксилазы (или экспандазу/гидроксилазу) ДНК. Примеры таких микроорганизмов перечислены ниже, но этот перечень является только примерным, его не следует рассматривать как исчерпывающий:
(1) ГРИБЫ:
Cephalosporium acremonium
Cephalosporium sp.
Emericellopsis
Paecilomyces
Scopulariopsis
Diheterospora
Spiroidium
Anoxiopsis
(2) АКТИНОМИЦЕТЫ:
Streptomyces clavuligerus
S. lipmanii
S. wadayamensis
S. todorominensis
S. filipinensis cephamycini
S. heteroma
S. panayensis
S. griseus
S. cattleya
Nocardia lactamdurans
(3) ДРУГИЕ БАКТЕРИИ:
Flavobacterium sp.
Alcaligenes denitrificas
Mycoplana bullata
Provedencia rettgeri
Lysobacter lactamgenus
Экспандазы и гидроксилазы из организмов, перечисленных выше, являются только кандидатами для дальнейших исследований, и возможно, что не все из них окажутся подходящими для нового биопроцесса настоящего изобретения.
Выделение фрагментов ДНК, кодирующих экспандазную активность
Когда присутствие желаемого экспандазного фермента обнаружено тем способом, который описан выше, то способы выделения ДНК, кодирующей активность экспандазного фермента, также хорошо известны в данной области техники. Конструируются зонды ДНК, основанные на известной последовательности или частичной последовательности генов, кодирующих экспандазные ферменты, эти зонды будут гибридизироваться с желаемой кодирующей фермент ДНК, которую нужно выделить. Конструирование таких зондов основано на знании последовательностей аминокислот и азотистых оснований, кодирующих экспандазный фермент, а также на кодоновых предпочтениях конкретного исследуемого микроорганизма. Подобное описание обычных методов такого типа, применимых для геномной ДНК штамма Streptomyces clavuligerus АТСС 27064, излагается ниже.
Выделение ДНК, кодирующей экспандазную ферментную активность, осуществляется с использованием процедур рестрикации и лигирования, хорошо известных в технике рекомбинатной ДНК. Необходимо иметь рестрикционную карту генома исследуемого микроорганизма для того, чтобы можно было получить и выделить нужный рестрикционный фрагмент. Рестрикционные карты для S. clavuligerus и С. acremonium уже имеются; таким образом, для первого из них используются рестриктирующие ферменты BamHI и SalI, а электрофорез представляет фрагменты желаемого размера в 1,8 и 2,2 т.п.н.
Источники ацетилтрансферазного фермента и выделение фрагментов ДНК, кодирующих названную активность
Клонирование ацетилтрансферазного гена ДАЦ из С. acremonium может быть выполнено в соответствии с рекомбинантными методами, хорошо известными в данной области техники, которые в общих чертах описываются тут же ниже.
Для того чтобы клонировать ацетилтрансферазный ген, прежде всего нужно получить мутанты С. acremonium, дефектные по способности превращать деацетилцефалоспорановую кислоту (ДАЦ) в цефалоспорин С. Такой процесс состоит из обработки клеток С. acremonuim мутагенами, такими как N-нитрозогуанидин (НТГ), азотистая кислота или ультрафиолетовый свет, позволяющий обработанным клеткам восстановить рост на подходящей для этого среде, а затем - проверки накопления ДАЦ при помощи, например, хроматографического или биологического способов.
После идентификации подходящего мутанта, следующим этапом в идентификации гена, кодирующего ацетилтрансферазу, является выделение ДНК С. acremonium из штамма, образующего цефалоспорин С. После расщепления (либо посредством переваривания рестрикционными эндонуклеазами, либо механического разрезания) на фрагменты подходящего размера они включаются в плазмидные или космидные трансформационные векторы, которые также содержат подходящий доминантный маркерный ген, такой как ген устойчивости к гигромицину или флеомицину. Вектор также должен содержать последовательности ДНК для облегчения последующего извлечения вставленной ДНК, например, cos-сайты фага лямбда, которые позволяют извлекать клонированную ДНК путем упаковки in vitro, сопровождающейся инфицированием Е. coli, что может быть выполнено посредством хорошо разработанных методов.
Затем протопласты мутантного штамма ацетилтрансфераза-минус трансформируются с использованием векторов, содержащих случайные фрагменты геномной ДНК; трансформанты отбираются на основании устойчивости к антибиотикам. Затем у трансформантов может быть проверено восстановление продукции цефалоспорина С, что является показателем успешной комплементации ацетилтрансферазным геном, содержащимся в векторе. Мутанты, предположительно содержащие клонированные копии гена, затем могут быть выращены, их ДНК выделена, векторная ДНК извлекается методом, в общих чертах описанным выше. Подтверждение того, что вектор действительно содержит ацетилтрансферазный ген, получается посредством субклонирования в Е. coli с использованием стандартных методов и легко доступных векторов, сопровождаемого повторной трансформацией мутанта ацетилтрансфераза-минус. Затем этот ген можно выделить, определить его последовательность и далее использовать так, как описано здесь в рабочих примерах, применяя методы, которые обычно используются квалифицированными специалистами в области молекулярной генетики.
Следующие альтернативные процедуры также хорошо известны в данной области техники: Matsuda et al. выделили ген и определили последовательность этого гена, кодирующего ацетилтрансферазную активность С. acremonium, а также вывели последовательность аминокислот самого фермента, как описывается в EP-А-0450758. Эти альтернативные процедуры состояли из выделения ацетилтрансферазного фермента, определения аминокислотной последовательности N-конца и выведения из этой информации нуклеотидной последовательности, кодирующей этот участок фермента. В свою очередь, на основании этой информации получают зонды, которые гибридизуются с полной кодирующей последовательностью, что позволяет ее выделить.
Трансформация штамма Penicillium chrysogenum
Когда получены фрагменты ДНК, кодирующие эспандазную/гидроксилазную, экспандазную, гидроксилазную и ацетилтрансферазную активности, они могут быть вставлены (лигированы) в плазмиду или другой экспрессионный вектор вместе с фрагментами ДНК, включающими промоторы, трансляционно-активирующиеся последовательности, маркеры устойчивости, регуляторные последовательности, составляющие космид и любые другие последовательности ДНК, которые обеспечивают или способствуют трансформации, управляют экспрессией генных продуктов и облегчают выделение трансформантов. Экспрессионные вектора, которые сконструированы таким образом, затем используются для обеспечения трансформации штамма Penicillium chrysogenum и внутриклеточной экспрессии активности экспандазного/гидроксилазного, экспандазного, гидроксилазного и ацетилтрансферазного ферментов. Методы, используемые для достижения трансформации и экспрессии, хороши известны в данной области техники, подробное описание таких обычных методов изложено ниже.
Как уже подробно обсуждалось выше, трансформированный штамм Penicillium chrysogenum внутриклеточно экспрессирует активности экспандазного/гидроксилазного, экспандазного, гидроксилазного и ацетилтрансферазного ферментов, которые затем действуют "в месте нахождения" на субстрат адипоил-6-АПК, расширяя его кольцо с образованием адипоил-7-АДЦК, гидроксилируют последнюю с образованием адипоил-7-АДАЦ, которая затем ацетилируется с образованием адипоил-7-АДК соответственно.
Новые трансформанты
Специфические трансформанты Penicillium chrysogenum, которые экспрессируют активности, закодированные генами экспандазы/гидроксилазы и экспандазы/гидроксилазы плюс ацетилтрансферазы (которые являются предпочтительными осуществлениями настоящего изобретения), являются новыми по отношению к сходным конструкциям на предшествующем уровне техники, таким как в работе Cantwell et al. (1990) Сurrent Genetics, 17, 213-221, EP-A-0281391 и ЕР-А-0437378. Конструкция Cantrwell содержит экспандазный ген Streptomyces clavuligerus, помещенный под контроль просмотра изопенициллин N-синтетазы (ИПNС) P. chrysogenum, и отличается от конструкций настоящего изобретения отсутствием какой-либо ДНК, кодирующей гидроксилазную или ацетилтранферазную активности.
Ingolia et al. в ЕР-А-0281391 описывают трансформационные вектора P. chrysogenum, которые содержат ДНК, кодирующую бифункциональный фермент экспандазу/гидроксилазу С. acremonium с экспрессией, управляемой промотором ИПNС Penicillium. В одной из этих конструкций (рРS62) ген экспандазы/гидроксилазы после окончания слит и находится в одной рамке считывания с геном гигромицинфосфотрансферазы. Продукт этого гена - слитый белок гигромицинфосфотрансфераза: экспандаза /гидроксилаза - отличается от продукта по настоящему изобретению - фермента экспандазы/гидроксилазы, который, по существу, идентичен ферменту, образуемому С. acremonium. Другой вектор, описанный в ЕР-А-0281391, был сконструирован посредством обширных серий молекулярно-генетических манипуляций, включающий использование синтетических линкеров ДНК. В конечной конструкции (рРS61) используется NcoI-фрагмент промотора ИПNC Penicillium размером 1,2 т.п.н. для экспрессии гена экспандазы/гидроксилазы и ген ацетамидазы Aspergillus nidulaus в качестве селективного маркера для отбора трансформантов Penicillium. Последовательность кодонов девять и десять гена экспандазы/гидроксилазы, которые кодируют соответственно аргинин и лейцин, изменена с ЦГТЦТЦ на ЦГЦЦТА, что не меняет закодированный аминокислотной последовательности.
В конструкции настоящего изобретения NcоI-фрагмент промотора ИПNC размером 1,2 т.п.н. был слит с геном экспандазы/гидроксилазы без изменения естественной последовательности гена экспандазы/гидроксилазы. Промотор ИПNС, используемый в конструкции настоящего изобретения, содержит по отдельности два удвоения по четыре основания, относящихся к естественному промотору - одно при сайте SalI, на 760 п.н. опережающее стартовый кодон АТГ, а другое - при сайте ХbaI, на пять пар оснований опережающее стартовый кодон и находящееся в пределах нетранслируемой лидирующей последовательности на 5'-конце. Эти изменения не затрагивают высокий уровень экспрессии гена экспандазы/гидроксилазы.
Следующее различие векторов относится к используемым селективным маркерам. Те конструкции, которые описаны в ЕР-А-0281391, в качестве селективных маркеров используют ацетамидазу и гигромицин. Это составляет противоположность экспандазно-гидроксилазному трансформационному вектору Penicillium, используемому в настоящем изобретении (рРЕN/СЕРН-1), который содержит маркер устойчивости к флеомицину. Штамм Penicillium chrysogenum, трансформированный вектором рРЕN/СЕРН-1 и способный экспрессировать экспандазно-гидроксилазную активность, был обозначен РС200. Его таксономические признаки обычно включают формирование широко распластанных колоний, имеющих окраску от голубовато-зеленой до зеленой, гладкобархатистых с желтыми каплями, обратная сторона колоний, погруженная в агар, желтая, конидиальные верхушки разветвлены, все их части гладкие, конидии от эллиптических до сферических, 3-4 мкм в длину. В качестве приемлемых культуральных условий для штамма P. chrysogenum используется плотная среда, содержащая моногидратированную лактозу - 1,5% (вес/объем), жидкий кукурузный экстракт - 0,5% (объем/объем), пептон - 0,5% (вес/объем), NaCl - 0,4% (вес/объем), MgSO4-7Н2О - 0,05% (вес/объем), КН2РО4 - 0,06% (вес/объем), FeCl3-6Н2О - 0,0005% (вес/объем), CuSO4-5H2O - 0,0002% (вес/объем), агар - 3,0% (вес/объем) в одном литре дистиллированной воды, рН 4,8. Штамм P. chrysogenum, только что описанный и обозначенный РС200, был заложен в Американскую коллекцию типовых культур (АТСС) 12301, Parklawn Drive, Rockville, Maryland 20852, под присвоенным его номером АТСС 74186 (дата закладки: 23 сентября 1992 года).
Второй новый трансформант Penicillium chrysogenum по настоящему изобретению, способный образовывать адипоил-7-АЦК, экспрессирует обе активности - экспандазно-гидроксилазную и ацетилтрансферазную - благодаря тому, что этот штамм был трансформирован одним вектором (рТS-8), который включает ДНК, кодирующую эти ферменты. Этот вектор, следовательно, отличается от тех трансформационных векторов Penicillium, которые указываются в ЕР-А-0437378, эти вектора включают ДНК, кодирующую либо одну только ацетилтрансферазу С. acremonium, либо в сочетании с последовательностью ДНК, кодирующую мутантный экспандазно-гидроксилазный полипептид. В конструкции рTS-8 экспрессия каждого из генов экспандазы/гидроксилазы и ацетилтрансферазы управляется отдельной копией промотора ИПNС P. chrysogenum, третья копия промотора ИПNC используется для управления транскрипцией гена устойчивости к флеомицину, который используется в качестве селективного маркера.
В альтернативном осуществлении настоящего изобретения гены экспандазы/гидроксилазы и ацетилтрансферазы могут быть включены в отдельные вектора и введены в хозяйский штамм Penicillium последовательным образом.
Порядок, в котором фрагменты ДНК, кодирующие активности ферментов экспандазы/гидроксилазы и ацетилтрансферазы, вводятся в штамм Penicillium важен только с практической точки зрения. Предпочтительно, чтобы трансформация штамма Penicillium геном(ами) экспандазы/гидроксилазы предшествовала введению ацетилтрансферазного гена, так как в таком порядке эти ферменты работают in vivo. Следовательно, за экспрессией экспандазы/гидроксилазы можно следить при помощи проверки образования адипоил-7-АДАЦ. На образование адипоил-7-АДАЦ, являющейся субстратом ацетилтрансферазного фермента, который экспрессируется с введенного впоследствии кодирующего ацетилтрансферазу гена, указывает продукция адипоил-7-АЦК. Используя подходящую in vitro проверку ацетилтрансферазы, можно сначала трансформировать штамм Penicillium геном ацетилтрансферазы, подтвердить его экспрессию при помощи проверки in vitro, затем продолжить введение гена экспандазы/гидроксилазы. Следовательно, любой способ был бы подходящим осуществлением процесса настоящего изобретения для производства 7-АЦК.
Однако предпочтительным осуществлением настоящего изобретения является одновременное введение всех трех ферментных активностей посредством конструирования одного плазмидного вектора, который включает ДНК, кодирующую экспандазно-гидроксилазную и ацетилтрансферазную активности С. acremonium. Штамм Penicillium chrysogenum, трансформированный таким единственным плазмидным вектором, вектором рТS-8, и способный к экспрессии активностей экспандазы/гидроксилазы и ацетилтрансферазы, был обозначен РС300. Его токсономические признаки являются такими же, как те, что выше описаны для РС200. И приемлемые условиям для культивирования штамма РС300 являются такими же, как те, что выше описаны для РС200. Штамм P. chrysogenum, обозначенный РС300, был заложен в Американскую коллекцию типовых культур (АТСС) 12301, Parklawn Drive, Rockville, Maryland 20852, под присвоенным ему номером АТСС 74187 (дата закладки: 23 сентября 1992 года).
Специфический штамм Penicillium chrysogenum трансформированный вектором рРenFTS0 экспрессирует активность экспандазного гена S.clavuligerus и является предпочтительным осуществлением настоящего изобретения, представляется новым по отношению к таким конструкциям на предшествующем уровне техники, как конструкция в работе Cantwell et al. (1990) Current Gonetic, 17, 213-221. В обоих конструкциях для соединения промотора с экспандазным геном использован мутагенез in vitro. В конструкции Сantwell соответствующая манипуляция вводит сайт NdeI при АТГ экспандазного гена, который лигируется в XbaI-сайт на 3'-конце промотора ИПNC при помощи линкера XbaI/NdeI. В конструкции настоящего изобретения NcoI-сайт создается при АТГ экспандазного гена и лигируется в NcoI-сайт на 3'-конце линкера ИПNC. Это создает следующие последовательности в области соединений промотор - ген в этих конструкциях:
В конструкции Cantwell С замещено на Т, тогда как в конструкции настоящего изобретения С сохраняется: таким образом, последовательность промотора ИПNС, непосредственно прилежащая к стартовому кодону АТГ, точно соответствует той последовательности, которая обнаруживается в естественно существующем гене ИПNС. Возможно, что промотор с предшествующего уровня техники, хотя и отличается только одним азотистым основанием, может приводить к более низкой эффективности трансляции и, следовательно, к более низкому уровню экспрессии экспандазного гена.
Имеются и другие различия в участках промотора или гена, включенных в эти конструкции. Конструкция Cantwell содержит участок 5' BamHI-XbaI 3' промотора ИПNC, тогда как вектор настоящего изобретения содержит участок 5' NcoI-NcoI 3' этого промотора (Diez et al. 1990, J. Biol. Chem. 265, 16358-16365). Это приводит к добавлению, приблизительно, 250 п.н. на 5'-конце промотора ИПNC в конструкции Cantwell. Однако этот участок находится внутри открытой рамки считывания гена АЦВ-синтетазы перед геном ИПNC.
Конструкция Cantwell также содержит ген Streptomyces от АТГ до сайта BamHI-3' этого гена, тогда как вектор настоящего изобретения содержит этот ген от АТГ до сайта SalI-3' (Kovacevic et al. (1989), J. Bacteviol., 171, 754-760). Это приводит к добавлению, приблизительно, 1000 п.н. к 3'-концевой последовательности в конструкции Cantwell. Конструкция настоящего изобретения по-прежнему содержит участок перед экспандазным геном вплоть до сайта BamHI-5' АТГ, однако он отделен от рамки считывания экспандазного гена промотором ИПNC.
Другие отличия конструкции рРеn FTSO настоящего изобретения от тех, что описаны на предшествующем уровне техники, относятся к используемому селективному маркеру. Использование слитого гена "промотор ИПNC Penicillium: устойчивость к флеомицину" в конструкции настоящего изобретения ведет к отбору интеграции многочисленных копий или интеграции в локусы, обеспечивающие высокий уровень экспрессии, и, таким образом, может давать высокий процент трансформантов, которые экспрессируют экспандазный ген на высоком уровне.
Отщепление адипоиловой боковой цепи
Последним этапом в новом биопроцессе настоящего изобретения является отщепление адипоиловой боковой цепи от адипоил-7-АДАЦ или адипоил-7-АЦК, которое требует обработки продуктов предшествующих этапов ферментом адипоиламидазой. Как уже отмечалось выше, одним из значительных достижений настоящего изобретения является возможность выполнять все этапы, приводящие к образованию адипоил-7-АДАЦ и адипоил-7-АЦК в одной ферментационной культуре. Это достижение обеспечивает исключительно высокую эффективность за счет того, что отпадает необходимость выделять и частично очищать промежуточные продукты от этапа к этапу этого процесса. На рассматриваемом последнем этапе, однако, адипоиламидазная ферментная система отсутствует, то есть не образуется "в месте нахождения" оригинальной ферментационной культурой посредством либо естественной, либо рекомбинатной экспрессии генов Р. crysogenum.
Если новый биопроцесс настоящего изобретения выполняется периодическим способом, то будет необходимо выделять и частично очищать продукт первого этапа, предварительные процедуры для этого уже были описаны выше.
Несмотря на это, процесс настоящего изобретения можно осуществлять любым способом, по которому адипоиламидаза эффективно приводится в контакт с адипоил-7-АДАЦ или адипоил-7-АЦК для того, чтобы могло иметь место ферментное превращение этих соединений в 7-АДАЦ или 7-АЦК. Тремин "контактирование, соприкосновение" здесь определяется в самом широком контексте. Возможно использовать бесклеточный бульон неочищенных адипоил-7-АДАЦ или адипоил-7-АЦК в качестве источника поступления этих веществ и периодическим способом обрабатывать его неочищенным бульоном с адипоиламидазой. Этот подход обеспечивает некоторую эффективность, так как он требует какой-либо начальной существенной очистки реагирующих веществ. Конечно же, возможны модификации. Например, реагенты могут быть очищены до какой-либо желаемой степени перед тем, как приводить их в контакт друг с другом. Возможно также осуществлять процесс непрерывным способом, в отличие от периодического способа. Само по себе контактирования реагентов может быть модифицировано различными способами в соответствии с перспективными технологическими процессами такого рода. Так, могут быть использованы иммобилизованные ферменты, например, в форме колонки, содержащей адипоиламидазу, и пропускные адипоил-7-АДАЦ или адипоил-7-АЦК через эту колонку. Иммобилизованный фермент также можно добавлять к раствору адипоил-7-АДАЦ иди адипоил-7-АЦК в виде суспензии. Такие системы иммобилизованных ферментов предоставляют преимущества легкого извлечения фермента и многократного его использования. Другим примером технологии такого процесса является процесс, связанный с мембранными реакторами. Предпочтительным способом контактирования реагентов является использование колонки с иммобилизованным ферментом.
Адипоиламидазные ферменты, применимые на этапе отщепления
Имеется ряд ферментов с известной специфичностью в отношении адипоиловых боковых цепей. Результаты, полученные с использованием адипоиламидазы, которая производится корпорацией RAEV, подробно изложены ниже в рабочих примерах. В литературе сообщалось о семи других ферментах, которые удаляют адипоиловые боковые цепи из молекул цефалоспоринового типа. Шесть из этих семи ферментов происходят из видов рода Pseudomonas, а седьмой фермент происходит из вида рода Bacillus. Между некоторыми ферментами псевдомонад существует некоторое сходство, но все семь ферментов до некоторой степени различаются по своим физико-биологическим свойствам. В таблице обобщаются некоторые из характеристик этих ферментов.
Все перечисленные выше адипоиламидазные ферменты применимы в новом биопроцессе настоящего изобретения. Другие адипоиламидазы, применимые в методе настоящего изобретения, могут быть легко обнаружены посредством проверки ферментов-кандидатов по отношению к адипоил-7-АДК и адипоил-7-АДАЦ, действительных субстратов, на которые они должны подействовать. Положительный результат дает надежный и воспроизводимый метод определения того, что фермент-кандидат действительно применим в методе настоящего изобретения. Субстрат может быть получен при помощи реакции адипинового ангидрида с 7-АЦК с использованием модификации того метода, о которой сообщается в работе Szewezuk and Wellman - Bednawska, Clin.Chim. Acta (1978), 84, 19-26. Также возможно приспособить метод, описанный в Agric. Biol. Chem. (1981) 45 (7), 1561-1567, который предназначен для получения глутарил-7-АЦК. Адипиновый ангидрид может быть получен в соответствии с методом Albertson and Lundmark, описанном в J. Macromol. Sci. Chem. (1990), A27, 397-412, 7-АЦК можно приобрести из нескольких торговых источников, включая химическую компанию.
Если желательно провести ориентировочный поиск ферментов-кандидатов с использованием быстрого колориметрического метода, то можно заместить адипоил-7-АЦК колориметрическим субстратом, таким как адипоил-пАБК (пара-аминобензойная кислота) или адипоил-пНА (пара-нитроанилин). Такой метод может быть получен адаптацией метода, описанного для γ-глутарил-пАБК у et al. Clinica Chimica Acta 84 (1978) 19-26. Отщепление боковой цепи дает окрашивающее вещество, присутствие и концентрацию которого легко определить с использованием колориметра. Более подробную информацию, касающуюся этих и других подходящих колориметрических методов, можно получить в работах Merelli, L.P. (1968), J. Pharm. Sci, 57, 2172-2173, Szasz. G. (1969) Clin. Chem. 15: 124-136; Szewezuk et al. (1980), Anal.Biochem. 103:166:169, и Reyes F. et al. (1989) J. Pharma. Pharmacol. 41:136-137.
Было проведено сравнение N-концевых аминокислотных последовательностей фермента RAEV и больших субъединиц ферментов асуII и GK16, представленных выше в таблице. Результаты этого сравнения показаны ниже (скобки указывают не вполне окончательные оценки):
RAEV - Посл-сть IД : 5
/S/ N /S/ /G/ AVA PGK TANG NAL /L/ QN /P/
GK16 - Посл-сть IД : 6
SNS W AVA PGK TANG NAL LL QNP
acyII - Посл-сть IД : 7
SNS W AVA PGR TATG RP I LAG DP
Из представленных последовательностей очевидно, что все эти три пептида родственны друг другу. Однако белок, имеющий N-концевую последовательность, сходную с теми, которые показаны выше, не обязательно обладает активностью адипоиламидазы, как например в случае с ацилазой пенициллина G, которая образуется штаммом Arthrobacter. С другой стороны, имеются адипоиламидазы, применимые в методе настоящего изобретения, которые не обнаруживают значительной гомологии с показанной выше N-концевой последовательностью. Например, было показано, что ацилазы асуI (Asahi) и B. laterosporus J 1 (Fujisawa), представленные выше в таблице, обладают некоторой ацилазной активностью в отношении адипоил-7-АЦК, не имея при этом какой-либо гомологии с последовательностью других ферментов, представленных выше. Поэтому сфера настоящего изобретения в отношении адипоиламидаз, применимых на последнем этапе нового биопроцесса, определяется в зависимости от того, способен ли фермент-кандидат отщеплять адипоиловую боковую цепь от адипоил-7-АЦК эту способность можно легко и надежно определить, как подробно описано выше.
Описание предпочтительных осуществлений изобретения
Далее следует подробное описание конкретных предпочтительных осуществлений настоящего изобретения, которое следует рассматривать только в качестве иллюстрации без какого-либо ограничения настоящего изобретения.
Пример 1. Культуральные условия Penicillium Chrysogenum.
Штамм Penicillium Chrysogenum, использованный в этих процедурах, выращивали на чашках, содержащих среду LCSB, которая содержала моногидратированную лактозу - 1,5% (вес/объем), жидкий кукурузный экстракт - 0,5% (объем/объем), пептон - 0,5% (вес/объем), NaCl - 0,4% (вес/объем), MgSO4-7Н2О -0,05% (вес/объем), КН2РО4 - 0,06% (вес/объем), FeCl3-6Н2О - 0,0005% (вес/объем), СuSO4-5H2O - 0,0002% (вес/объем), агар - 3,0% (вес/объем) в одном литре дистиллированной воды, рН 4,8. По прошествии 12 дней при 25oС и 65% относительной влажности отдельные колонки удаляли со среды LCSB и переносили с 2 мл стерильной воды в пробирку с закручивающейся крышкой, содержащей стеклянные шарики. После мацерации выросшей культуры посредством интенсивного перемешивания, полученную суспензию использовали для засева рисовых колб. Рисовые колбы объемом 250 мл содержали по 25 г отработанного по технологии фирмы Uncle Ben's риса - натуральных длинных зерен, которые были промыты тремя - четырьмя объемами дистиллированной воды в течение семи минут с перемешиванием каждые 30 секунд, и затем высушены так, что вода, поглощенная рисом, составляла, приблизительно 25% его веса. По прошествии 12 дней при 25oС и 65% влажности споры смывали с риса 50 мл стерильной воды. Споровую суспензию использовали для засева жидкой среды, а также для получения лиофильно высушенных культур для хранения при 4 oС. Споры добавляли к равному объему 5% снятого молока и лиофилизировали в стерильных ампулах.
Для продукции пенициллинов или для выращивания мицелия с целью выделения из него РНК или ДНК использовали двухэтапную ферментацию штамма в качалочных колбах. Этап выращивания посевного материала начинался с добавлением 1 х 108 спор к 50 мл питательной среды в 500 мл колбе; среда содержала глюкозу - 3% (вес/объем), pharmamedia - 1,0% (вес/объем), жидкий кукурузный экстракт - 3,0% (объем/объем), сульфат аммония - 0,2% (вес/объем), СаСО3 - 0,5% (вес/объем), безводный монокалийортофосфат - 0,05% (вес/объем), лактозу - 1,0% (вес/объем), предварительно высушенные дрожжи - 1,0% (вес/объем) в одном литре дистиллированной воды. Инкубацию проводили при 25oС и 65% относительной влажности на вращающейся качалке с диаметром амплитуды 70 мм при 220 об/ мин. После 48 часов культивирования начинался этап продукции антибиотика посредством переноса 2 мл вегетативного посевного материала в 500 мл колбу с 35 мл среды следующего состава: КН2РО4 - 0,05% (вес/объем), К2SO4 - 0,5% (вес/объем), (NH4)2SO4 - 1,0% (вес/объем), лактоза - 12,0% (вес/объем), pharmamedia -2,75% (вес/объем), СаСО3 (осажденный) - 1,0% (вес/объем), лярдовое масло - 1,0% (объем/объем), в одном литре дистиллированной воды, рН 6,6. После автоклавирования, но перед засевом добавляли стерильный 25% раствор адипата натрия (рH 6,6) для получения конечной концентрации адипата натрия 2,5%. После засева культивирование было продолжено в течение 5-7 дней в тех же условиях, что и на этапе выращивания посевного материала.
Когда мицелий был нужен для получения протопластов с целью их трансформации или в качестве источника ДНК, то штамм выращивали в 250 мл колбах с 50 мл полноценной среды (ПС), составленной из: 50 мл солей Клаттербука 20 х (120 г Na2O3, 10,4 г КСl, 10,4 г МgSO4-7H2O, 30,4 г КН2РО4), 2,0 мл микроэлементов Вогеля, 0,3 М лимонной кислоты, 0,2 М ZnO4, 25 мМ Fe(NH4)2(SO4)2 -6H2O, 10 мМ CuSO4, 3 мМ MnSO4, 8 мМ борной кислоты, 2 мМ Na2MoO4-2H2O, 5 г триптона, 5 г дрожжевого экстракта, 10 г глюкозы в одном литре дистиллированной воды. Культивирование проводили при 25oС на вращающейся качалке при 220 об/мин.
Пример 2. Культуральные условия Cephalosporium acremonium
Штамм С. acremonium выращивали на косяках, содержащих полноценную среду, составленную из сахарозы - 20 г, агара - 20 г, пептона - 4 г, дрожжевого экстракта - 4 г, NaNO3 - 3 г, КН2РО4 - 0,5 г, К2НРО4 - 0,5 г, КСl - 0,5 г, МgSO4-7H2O - 0,5 г, FeSO4-7Н2О - 0,01 г в 1 литре дистиллированной воды, pH 6,6. По прошествии 10 дней выращивали при 28oС и 66% относительной влажности к косякам добавляли 6 мл стерильной воды и выросшую культуру соскребали с поверхности агара. Полученную суспензию переносили в стерильную пробирку с закручивающейся крышкой, содержащей стеклянные шарики. После мацерации выросшей культуры посредством интенсивного перемешивания в течение нескольких минут 3,5 мл полученной суспензии использовали для засева жидкой среды. Эта суспензии была также использована для получения лиофилизированных культур с целью их хранения при 4oС. Суспензию прошедшей мацерацию культуры центрифугировали, осадок ресуспендировали в 5% снятом молоке, аликвоты лиофилизировали в стерильных ампулах.
Для получения цефалоспоринов или для выращивания мицелия с целью выделения из него РНК и ДНК использовали двухэтапную ферментацию штаммов в качалочных колбах. Этап выращивания посевного материала начинался при добавлении посевного материала в 250 мл колбы, содержащие по 15 мл среды следующего состава: глюкоза - 5 г, сахароза - 40 г, кукурузный крахмал - 30 г, свекольная меласса - 50 г, соевая мука грубого помола - 65 г, СаSO4-2H2O - 15,8 г, ацетат аммония - 8 г, CaCO3 (осажденный ) - 5 г, (NH4)2SO4 - 7,5 г, MgSO4-7H2O - 3,5 г, КН2РО4 - 1 г, соевое масло - 0,45 мл на колбу в 1 литре дистиллированной воды при pH 6,2. Культивирование проводили при 25oС и относительной влажности 65% на вращающейся качалке с диаметром амплитуды 70 мм при 220 об/мин. По прошествии 96 часов инкубации начинался этап продукции антибиотика посредством переноса 2 мл вегетативного посевного мицелия в 250 мл колбу, содержащую 15 мл свежей среды, описанной выше. Инкубацию продолжали еще 96 часов в тех же условиях.
Когда мицелий был нужен в качестве источника ДНК для трансформации штамма выращивали в 500 мл колбе со 100 мл полноценной среды, составленной из: глицерина - 20 г, пептона - 4 г, дрожжевого экстракта - 4 г, КН2РО4 - 0,5 г, К2НРО4 - 0,5 г, КСl - 0,5 г, MgSO4-7H2O - 1 г, NaNO3 - 3 г, FeSO4-7Н2О - 0,01 г в 1 литре дистиллированной воды. Инкубацию проводили при 30oС на вращающейся качалке с 200 об/мин.
Пример 3. Выделение геномной ДНК и тотальной РНК из Penicillium и Cephalosporium
Выросший вегетативный мицелий 48-часовой культуры, полученный описанным выше способом, собирали фильтрованием через марлю, замораживали в жидком азоте и лифоилизировали в течение ночи. Высушенный мицелий растирали с песком при помощи ступки и пестика и ресуспендировали в 25 мл 100 мМ LiCl, 50 мМ ЭДТА, 10 мМ Трис рН 8,0, 4% SDS. После нагревания суспензии до 50-55oС в водяной бане с температурой 60oС смесь экстрагировали сначала 1 М Трис (pH 8,0) - насыщенным фенолом, после этого Трис-насыщенной смесью фенол-хлороформ (1: 1, объем/объем), а затем хлороформом. РНК осаждали из водной фазы добавлением равного объема холодного 6 М раствора LiCl, а затем выдерживанием полученной смеси при -20oС в течение двух-трех часов. После центрифугирования при 12000 х g в течение 20 минут при 4oС содержание этанола в надосадочной жидкости доводили до 66% (объем/объем) и смесь охлаждали до -20oС в течение 15 минут для осаждения ДНК. После центрифугирования описанным выше способом осадок ДНК промывали 70% этанолом, высушивали и ресуспендировали в буфере ТЕ (10 мМ Трис-НСl, рН 7,5, 1 мМ ЭДТА). Концентрацию ДНК оценивали путем сравнения с растворами ДНК известной концентрации (стандарты) после их агарозного гельэлектрофореза и окрашивания бромистым этидием.
Для выделения РНК культуры Penicillium chrysogenum и Cepalosporium acremonium выращивали, как описано выше в примерах 1 и 2, в течение 96 часов в 35 мл ферментационной среды (условия ферментации описаны предварительно) при 25oС на вращающейся качалке при 220 об/мин. Мицелий собирали посредством фильтрования через фильтр Ватман 1 с помощью вакуума и промывали приблизительно 50 мл воды. Мицелий немедленно соскребали с фильтра, ресуспендировали в 5 мл "разрушающего буйера" (50 мМ Трис-НСl, рН 7,4, 150 мМ NaCl, 5 мМ ЭДТА, рН 8,0, 5% SDS), замораживали в жидком азоте и лиофилизировали. После лиофилизации в течение ночи добавляли 5 мл воды, содержащей 0,1% ДЭПК, и 5 мл смеси фенол: хлороформ:изоамиловый спирт (50:50:1), насыщенной 1 М Трис (рН 8), смесь оставляли оттаивать при 37oС в течение 20 минут со встряхиванием. Смесь центрифугировали при 12000 х g в течение 10 минут при температуре 4oС, водный слой удаляли и трижды экстрагировали: сначала смесью фенол:хлороформ: изоамиловый спирт (50:50:1), насыщенной 1 М Трис (рН 8), второй раз фенолом, насыщенным 1 М Трис (рН 8) и третий раз хлороформом. Конечный водный слой объединяли с равным объемом 6 М LiCl; раствор оставляли при -20oС минимум на четыре часа. Тотальную РНК осаждали центрифугированием при 12000 х g в течение 20 минут при 4oС; осадок растворяли в смеси 0,3 мл буфера ТЕ и 0,03 мл 0,3 М ацетата натрия; для повторного осаждения РНК добавляли 2,5 объема этанола. Окончательный осадок растворяли в 0,1 мл буфера ТЕ, концентрацию РНК определяли спектрофотометрически, используя поглощение при 260 нм.
Пример 4. Конструкция генной библиотеки Cephalosporium acremonium и выделение генов экспандазы/гидроксилазы и ацетилтрансферазы С. acremonium
Выделение гена экспандазы/гидроксилазы С. acremonium
Геномную ДНК С. acremonium частично ращепляли Sau 3АI для получения фрагментов со средним размером 10-20 т.п.н.; этот диапазон размеров обогащали центрифугированием смеси фрагментов расщепленной ДНК в градиенте плотности NaCl 5-20%, фракционированную по размеру ДНК использовали для создания библиотеки геномной ДНК С. acremonium посредством лигирования в сайт BamНI вектора λ 2001, упаковывания фаговых частиц с использованием Gigapak ("Strafagene") и инифицирования Е. coli. Полученные бляшки переносили на нитроцеллюлозу и проводили поиск при помощи гибридизации с олигонуклеотидным зондом, комплементарным 3'-концу опубликованной последовательности гена экспандазы/гидроксилазы (Самсон и др., 1987). Зонд метили по концу [τ - 32P] АТФ с использованием полинуклеотидкиназы Т4. Клоны с положительным ответом выделяли, картировали по сайтам рестриктирующих эндонуклеаз; ориентацию гена устанавливали при помощи блот-гибридизации по Саузерну с указанным выше олигонуклеотидным зондом и другим зондом, содержащим последовательность, комплементарную 5'-концу гена.
Выделение гена ацетилтрансферазы С. acremonium
Хотя не было разработанной методики для выделения ацетилтрансферазного гена для последующих векторных конструкций, описанных ниже в Примерах 11 и 12, квалифицированный специалист в данной области техники может воспользоваться следующим методом с применением информации до последовательности ДНК, опубликованной и доступной в настоящее время. Из геномной библиотеки С. acremonium, сконструированной описанным выше способом, на основании результатов гибридизации с синтетическим олигонуклеотидным зондом, комплементарным последовательности ацетилтрансферазы, отбирают клоны, которые кодируют ацетилтрансферазный ген (см. работы Matsuda et al. (1992) Biochem. Biophys. Res. Commun. 182: 995-1001).
Пример 5. Культуральные условия Streptomyces clavuligerus, использованным в этих процедурах, был штамм АТСС 27064
Штамм выращивали на чашках со средой, содержащей дрожжевой экстракт - 4 г; солодовый экстракт - 10 г; глюкозу - 4 г; агар - 20 г в одном литре дистиллированной воды, рН 7,2. По прошествии 5 дней выращивали при 30oС на чашки наносили 2 мл стерильной воды и культуру соскребали с поверхности агара. Полученную суспензию переносили в стерильную пробирку с закручивающейся крышкой, содержащую стеклянные шарики. После мацерации культуры посредством интенсивного перемешивания суспензию использовали для засева жидкой среды. Суспензию также употребляли для постоянного хранения культуры при -70oС после добавления глицерина до 15% от конечного объема.
Когда мицелий был нужен для получения протопластов с целью их дальнейшей трансформации или в качестве источника ДНК, то штамм выращивали в 1 л колбах с 200 мл среды УЕМЕ, состоящей из дрожжевого экстракта - 3 г; пептона - 5 г; солодового экстракта - 3 г; глюкозы - 10 г; сахарозы - 340 г; МgСl2-6Н2О - 1,02 г; глицина - 5 г; агара - 18 г в одном литре дистиллированной воды. Культивирование проводили при 28oС на вращающейся качалке при 220 об/мин.
Пример 6. Выделение геномной ДНК Streptomyces
Вегетативный мицелий 48-часовой культуры, выращенный описанным выше способом, собирали центрифугированием при 22100 х g в течение 10 минут. Клетки ресуспендировали в 10 мл буфере ТЕ, добавляли 10 мг лизоцима, смесь инкубировали при 30oС в течение 15 минут. Затем добавляли один мл 20%-ного раствора SDS, после чего немедленно добавляли 10 мл фенола, насыщенного ТЕ (рН 8) и 1,5 мл 5 М NaCl; емкость со смесью мягко переворачивали в течение 20 минут. Фазы разделяли центрифугированием при 12000 х g в течение 10 минут, после чего водный слой удаляли и переносили в чистую пробирку. Добавляли равный объем хлороформа, емкость со смесью мягко переворачивали в течение 10 минут. Фазы снова разделяли центрифугированием при 12000 х g в течение 10 минут, водный слой удаляли и снова переносили в чистую пробирку. Осторожно добавляли два объема изопропанола, осажденную ДНК "наматывали" из раствора на стеклянную палочку и повторно растворяли в минимальном объеме буфера ТЕ. Добавляли РНКазу А до конечной концентрации 20 мкг/мл, раствор инкубировали при 50oС в течение одного часа. Затем добавляли протеазу К до конечной концентрации 100 мкг/мл вместе со 100 мМ раствором NaCl и 0,4% раствором SDS, смесь инкубировали при 37oС в течение одного часа. Раствор снова экстрагировали равным объемом фенола, насыщенного ТЕ (рН 8), что сопровождалось еще одной экстракцией хлороформом. ДНК из конечного экстракта "наматывали" на стеклянную палочку после добавления к нему двух объемов изопропанола, концентрацию ДНК определяли спектрофотометрически, используя показания поглощения при 260 нм.
Пример 7. Конструкция генной библиотеки Streptomyces clavuligerus и выделение фрагментов ДНК, содержащих гены экспандазы и гидроксилазы S. clavuligerus
Выделение гена экспандазы S. clavuligerus
Геномную ДНК Streptomyces clavuligerus, полученную описанным выше способом, расщепляли рестриктирующими ферментами ВаmНI и SalI. Расщепленную ДНК подвергали электрофорезу в 0,8%-ном агарозном геле; фрагменты размером 1,8 и 2,2 т.п.н. элюировали из геля и лигировали в ДНК рUС18, которая была предварительно расщеплена ВаmНI и SalI. Разведения лигированной смеси использовали для трансформации компетенции клеток М109 с применением электропорации (Gene Pulse, "Bio-Rad", Ричмонд, Калифорния). Получение компетентных клеток и условия электропорации соответствовали рекомендациям производителей. Трансформационную смесь высевали на чашки со средой ЛБ, содержащей 100 мкг/мл ампициллина и 75 мкл 2%-ного раствора Х-Гал. После культивирования при 37oС в течение ночи рекомбинантные колонии идентифицировали по их бесцветному внешнему виду, который являлся следствием инактивации гена бета-галактозидазы плазмидного вектора. Бесцветные колонии перекалывали на чашку со свежей средой ЛБ, содержащей 100 мкг/мл ампициллина. После культивирования при 37oС в течение ночи колонии переносили на нитроцеллюлозу и гибридизовали с зондом, в котором содержались основания 52-918 из опубликованной последовательности гена экспандазы Streptomyces clavuligerus (Kovacevic et al. (1989), J. Bacteriol, 171: 754-760 и Ingolia et al., U.S. 5070020); этот зонд был получен при помощи полимеразной цепной реакции. Мечение продукта полимеразной цепной реакции осуществляли посредством процесса удлинения случайной затравки в присутствии (32Р) дЦТФ, используя набор для олигонуклеотидного мечения в соответствии с рекомендациями производителя ("Pharmacia", Piscataway, New Jersey). Реакцию гибридизации выполняли в присутствии 106 СРМ радиоактивного меченого зонда, 30% формамида, 5 х SSO (0,15 М NaCl, 0,015 М цитрат натрия, рН 7). 0,1% раствора SDS, 5х раствора Денхарта (5 г фикола, 5 г поливинилпиролидона и 5 г БСА на 500 мл 50х исходного раствора) и 100 мкг/мл ДНК тимуса теленка при 37oС в течение ночи. Несколько трансформантов сильно гибридизовались с зондом. Анализом рестриктирующими ферментами было подтверждено, что одна колония содержит вектор, несущий экспандазный ген; эта плазмида была обозначена рFTSO-1.
Выделение гена гидроксилазы S. clavuligerus
Геномную ДНК Streptomyces clavuligerus частично расщепляли ВаmНI и лигировали в вектор лямбда Dash II фирмы "Stratagene". В полученной геномной библиотеке проводили поиск посредством гибридизации с олигонуклеотидом из 30 оснований, который содержал последовательность, идентичную первым 30 основаниям опубликованной последовательности гидроксилазного гена (Kovacevic and Miller, 1991, J. Bact., 173:398). Гибридизацией по Саузерну с ДНК из двух положительных фаговых клонов, расщепленной ВаmНI, был обнаружен искомый фрагмент 6 т.п.н., который был субклонирован. Этот субклон после расщепления КрnI дал набор фрагментов, который соответствовал опубликованной рестрикционной карте для области вокруг гидроксилазного гена (Kovacevic and Miller, 1991).
Пример 8. Выделение плазмидной ДНК
Культуры Е.coli, содержащие представляющую интерес плазмиду, выращивали в 500 мл бульона ЛБ (20 г/л концентрата бульона ЛБ "Gibco" Пайсли, Шотландия), содержащего 15 мкг/мл тетрациклина, на вращающейся качалке с 220 об/мин в течение 12-16 часов при 37oС. Клетки осаждали центрифугированием при 4000 х g в течение 10 минут при 4oС. Осадок клеток ресуспендировали в 18 мл глюкозного буфера (50 мМ глюкозы, 25 мМ Трис рН 8,0, 10 мМ ЭДТА), добавляли 2 мл 40 мг/мл раствора лизоцима ("Sigma", Сент-Луис, Миссури) в глюкозном буфере, смешивали и полученную смесь инкубировали при комнатной температуре в течение 15 минут. Добавляли сорок мл свежеприготовленного раствора 0,2 н. NaOH, 1% SDS; мягко центрифугировали и помещали на лед на десять минут. Затем добавляли 30 мл 5 М раствора ацетата калия, рН 4,8, хорошо перемешивали, полученную смесь помещали на лед еще на десять минут. Клеточные обломки осаждали центрифугированием при 4000 х g в течение десяти минут при 4oС, полученную надосадочную жидкость фильтровали через марлевый фильтр. К прозрачной надосадочной жидкости добавляли изопропанол (0,6 объема) для осаждения плазмидной ДНК; осадок формировался при инкубировании при комнатной температуре в течение 20 минут. Плазмидную ДНК осаждали центрифугированием при 4000 х g в течение 20 минут при 4oС, затем промывали 70% этанолом и быстро высушивали. Осадок ресуспендировали в 9 мл буфера ТЕ, затем добавляли 10 грамм СsСl и 0,387 мл 10 мг/мл раствора бромистого этидия. Этот раствор центрифугировали при 313100 х g в течение 24 часов. Полученную плазмидную полосу в градиенте хлористого цезия наблюдали в ультрафиолетовом свете; выделяли бромистый этидий, затем удаляли, используя для экстракции бутанол, насыщенный водой. Затем из плазмидного препарата СsCl посредством диализа против буфера ТЕ; для окончательной концентрации применяли ПЭГ (м.в. 8000). Концентрацию ДНК определяли спектрофотометрически, используя показания поглощения при 260 нм.
Пример 9. Конструкция вектора рРеnFTSO для трансформации Penicillium
Включение гена устойчивости к флеомицину
Вектор для трансформации Penicillium был сконструирован с геном устойчивости к флеомицину в качестве селективного доминантного маркера. Конструирование выполнялось, начиная с выделения фрагмента из 660 п.о., который содержал ген устойчивости к флеомицину (ген флеомицинсвязывающего белка из Streptoalloteichus hindustanus), сопряженный также с терминатором дрожжевого цитохрома СI, из плазмиды рuТ713 ("САYLA", Toulouse Cedex, Франция) посредством ее расщепления BamHI/BglII, электрофореза в агарозном геле и элюции из геля. Выделенный фрагмент лигировали в сайт BamHI вектора pSELECT® I (корпорация "Promega"); ориентацию гена определяли при помощи анализа рестриктирующими ферментами. Уникальный сайт NindIII в полученной плазмиде удаляли посредством рестрикции NindIII, заполнения концов с помощью полимеразы Кленова и повторного лигирования. Затем вставляли РstI-фрагмент из 550 п.о., содержащий cos-сайт фага лямбда, который позволяет использовать этот вектор для формирования космид при включении вставок подходящего размера. Этот вектор обозначили рSСР4.
Геномную ДНК Р.chrysogenum частично расщепляли Sau3А и использовали для получения библиотеки в фаговом векторе лямбда ЕМВL3. Клоны, содержащие ген изопенициллин N-синтетазы /ИПNС/, выделяли из этой библиотеки и использовали для получения серий субклонов; один субклон содержал фрагмент из 3,6 т.п.н. от первого сайта BamHI перед геном ИПNC до первого сайта HindIII после этого гена. Уникальный сайт SalI был удален из этого субклона при помощи рестрикции SalI, заполнения концов с уступом с помощью полимеразы Кленова и повторного лигирования. Затем аналогичным образом был удален уникальный сайт XbaI посредством рестрикции XbaI, заполнения концов и повторного лигирования. Полученную плазмиду обозначили рSXF-1. Инженерный промотор ИПNC был выделен
из геля с ДНК рSXF-1 как NcoI-фрагмент из 1.2 т.п.н. и лигирован в NcoI-сайт рSСР4, описанный выше. Ориентация, определенная при помощи рестрикционного расщепления, была выбрана так, чтобы промотор был слит с геном устойчивости к флеомицину при стартовом кодоне АТГ. Эту плазмиду обозначили рUTZ-2.
Включение гена экспандазы S.clavuligerus
Фрагмент из 1,645 т.п.н., содержащий ген экспандазы S.clavuligerus был выделен из рFTSO-1 (предварительно описанного вектора) посредством расщепления его BamHI и SalI, электрофореза полученных фрагментов в 0,8% агарозном геле и элюции из этого геля. Выделенный фрагмент лигировали в вектор рSELECT (корпорация "Promega"), также расщепленный BamHI и SalI. Этот вектор был обозначен рFTSO-8. Новый NcoI-сайт был создан при стартовом кодоне АТГ экспандазного гена путем сайт-направленного мутагенеза рFTSO-8, используя систему мутагенеза in vito "Измененные Сайты®" (корпорация "Promega"). Мутагенез выполняли в соответствии с инструкциями производителей. Олигнонуклеотиды конструировали на основании комплементарности с кодирующей последовательностью участка ДНК при стартовом кодоне АТГ из опубликованной последовательности гена экспандазы Streptomyces (Kovacevic et al. (1990), J. Bacteriol. 171, стр.3952-3958). Олигонуклеотиды синтезировали при помощи цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"); олигонуклеотидная последовательность была следующей:
Посл-сть IД : 8
3' ЦГАГАГГАТЦАГТГАГАГТЦЦАТГГАЦАЦГАЦГГ 5'
Мутагенез был подтвержден анализом рестриктирующими ферментами. Затем рестрикцией NcoI или рUTZ-2 был выделен NcoI-фрагмент из 1,2 т.п.н., содержащий инженерный промоторный участок ИПNC Р.chrysogenum; рестрикция сопровождалась агарозным гель-электрофорезом. Промоторный участок лигировали в вектор рFTSO-8 по новому NcoI-сайту, созданному при помощи мутагенеза при стартовом кодоне АТГ экспандазного гена. Ориентация промотора по отношению к экспандазному гену была установлена анализом рестриктирующими ферментами. Кассета промотор ИПNC: экспандазный ген затем была извлечена как BamHI/SalI-фрагмент и помещена в расщепленный BamHI/SalI вектор рUTZ-2 для трансформации Penicillium, описанный выше. Конечная конструкция была обозначена рPenFTSO.
Пример 10. Конструкция вектора рРЕN/СЕРН-1 для трансформации Penicillium
Включение промоторного участка ИПNC
Промоторный участок ИПNC был выделен из рUTZ-2, подробно описанной выше в Примере 9, путем расщепления ее ХhoI/SmaI. Вектор рUTZ-2 был расщеплен BamHI; выступающие концы заполняли с использованием дНТФ и фрагмента Кленова, получая тупые концы; затем проводили расщепление XhoI; выделенный ХhoI/SmaI- фрагмент с промотором ИПNC лигировали в этот расщепленный вектор, получая конструкцию, которая содержала два участка промотора ИПNС. Это вектор был обозначен рUTZ-7.
Включение гена экспандазы/гидроксилазы С. acremonium
Один из участков промотора ИПNС был затем выделен (посредством электрофореза в агарозном геле и элюции из геля) из рUTZ-7 в виде ХhoI/ХbаI-фрагмента и лигирован в расщепленный ХhoI/ХbаI вектор рBIuescript pt IISK ("Stratagene" Ла Джолла, Калифорния). Этот вектор был обозначен рIPNSр/blue.
Экспандазно-гидроксилазный ген Cephalosporium был выделен (посредством электрофореза в агарозном геле и элюции из геля) в виде HindIII/ХbaI-фрагмента из 1,6 т. п. н. одного из тех геномных клонов, что идентифицированы выше, и лигирован в вектор рSELECT, расщепленный HindIII/ХbaI. Новый BSрНI-сайт был создан при стартовом кодоне АТГ экспандазно-гидроксилазного гена путем сайт-направленного мутагенеза, используя систему мутагенеза in vitro "Измененные сайтыТМ" (корпорация "Promega"). Мутагенез был выполнен в соответствии с инструкциями производителей. Олигонуклеотид был сконструирован на основании комплементарности с кодирующей последовательностью участка ДНК при стартовом кодоне АТГ из опубликованной последовательности экспандазно-гидроксилазного гена Cephalosporium acremonium (Samson et al., Bio/Fechnology, vol.5, November, 1987). Олигонуклеотид был синтезирован при использовании цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"), олигонуклеотидная последовательность была следующей:
Посл-сть IД : 9
3' ГТТТТГГТГТЦГТАГТАГТАЦТГААГГТТЦЦАГ 5'
Мутагенез был подтвержден анализом ресктриктирующими ферментами. Ген экспандазы/гидроксилазы Cephalosporium acremonium затем был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) как BSрНI/ХbaI-фрагмент и лигирован в расщепленный NcoI/ХbaI вектор рIPNSр/blue, описанный в предыдущем Примере. Этот вектор теперь содержал промотор ИПNC Penicillium при АТГ экспандазно-гидроксилазного гена Cephalosporium acremonium. Этот вектор был обозначен рIPNSp/ЕХР/blue. Кассета промотор ИПNC:экспандаза/гидроксилаза была частично расщеплена ХhoI и полностью расщеплена ХbаI, фрагмент выделен (посредством электрофореза в агарозных гелях и элюции из гелей) и лигирован в расщепленный ХhoI/ХbаI вектор рUTZ-2, описанный в Примере выше, с образованием конечного трансформационного вектора рРЕN/СЕРН-1.
Пример 11. Конструирование трансформационного вектора Penicillium для экспрессии экспандазного и гидроксилазного генов S. clavuligerus
Ген β-тубулина Р.chrysogenum был клонирован из геномной библиотеки в фаге лямбда с использованием β-тубулина Aspergillus niger в качестве гибридизационного зонда. Фрагмент ХbaI/HindIII из 2,0 т.п.н., содержащий промотор β-тубулина Penicillium, был лигирован в ХbaI/HindIII-сайты рSELECT ("Promega"). NcoI-сайт был введен при стартовом кодоне АТГ при помощи сайт-направленного мутагенеза последовательности АААА-ТГЦГТ в последовательность АЦЦАТГГТ. Из полученного вектора с помощью геля был выделен BamHI/NcoI-фрагмент из 1,4 т.п.н. и лигирован между сайтами BamHI и NcoI pUTZ-2 (описанного предварительно) с образованием вектора рСI-6. Из геномного клона Р.chrysogenum с помощью геля был выделен SalI-фрагмент из 5,1 т.п.н., содержащий гены ИПNC и ацилтрансферазы, и лигирован в SalI-сайт вектора рUTZ-2 с образованием вектора рUTZ-5. 3'-терминаторная последовательность гена ИПNC была выделена из вектора рUTZ-5 при помощи рестрикции BamHI и HindIII, сопровождающейся выделением из геля фрагмента из 1,3 т.п.н., который был лигирован между сайтами BamHI и HindIII вектора рСI-6 (описанного выше) с образованием вектора рСI-13. Уникальный SalI-сайт неподалеку от BamHI-сайта в векторе рСI-13 был удален посредством рестрикции, заполнения с использованием полимеразы Кленова и повторного лигирования. Новый SalI-сайт был введен с другой стороны от BamНI-сайта при помощи сайт-направленного мутагенеза последовательности ГГААГАЦГ в последовательность ГГТЦГАЦГ. Затем ген устойчивости к ампициллину был удален из плазмиды при помощи рестрикции РvuI, выделения из геля, большего фрагмента и повторного лигирования с образованием рСI-15. Наконец, кассета промотор ИПNC:ген экспандазы была выделена с помощью геля из рРЕNFTSO в виде BamHI/SalI-фрагмента размером 2,4 т.п.н. и лигирована в рСI-15 с образованием рЕХР-1.
Конструирование вектора для экспрессии обоих генов гидроксилазы и экспандазы S. clavuligerus состоит из следующих этапов. КрnI-фрагмент из 2,9 т.п. н. , содержащий гидроксилазный ген, субклонируется в рSELECT так, что ЕсоRI-сайт в полилинкере является соседним с 5'-концом гена. Уникальный NcoI-сайт удаляется из плазмиды путем сайт-направленного мутагенеза последовательности ТЦЦАТГГГЦ в последовательность ТЦГАТГГГЦ; одновременно новый NcoI-сайт вводится в область стартового кодона путем изменения последовательности ААЦАТГГЦ и АЦЦАТГГЦ. Оба изменения предохраняют закодированную аминокислотную последовательность. ЕсоRI/NcoI-фрагмент из 1.0 т.п.н., содержащий инженерный промотор ИПNC, с помощью геля выделяется из pUTZ-2 и лигируется между сайтами ЕсоRI и NcoI вышеописанного вектора, содержащего измененный гидркосилазный ген. Затем уникальный сайт ЕсоRI в полученном векторе HindIII-сайтом при помощи сайт-направленного мутагенеза. Слитая конструкция 5'ИПNC:гидроксилаза выделяется из полученного вектора в виде Hind III-фрагмента, который затем лигируется в уникальный HindIII-сайт вектора рЕХР-1, описанного выше. Конечный вектор содержит гены экспандазы и гидркосилазы, причем каждый ген управляется промотором ИПNC; и маркер устойчивости к флеомицину, управляемый промотором β-тубулина.
Пример 12. Конструирование вектора рРеnСАСТ для трансформации Penicillium
Включение гена устойчивости к гигромицину
Трансформационный вектор Penicillium был сконструирован с геном устойчивости к гигромицину в качестве доминантного селективного маркера. Ген гигромицин В-фосфотрансферазы Е.coli был выделен (при помощи электрофореза в агарозном геле и элюции из геля) в виде BamHI-фрагмента из 1,15 т.п.н. из вектора рНрh-1 ("Bochringer Mannheim", Индианополис, Индиана) и лигирован в расщепленный BamHI вектор mp19. Ориентация гена устойчивости к гигромицину в mp19 была определена анализом рамки считывания ДНК рестрикционными ферментами. 5'BamHI-сайт находится неподалеку от стартового кодона АТГ гена устойчивости к гигромицину. Для облегчения расположения альтернативного промотора при 5'BamHI-сайте 3'BamHI-сайт был удален сайт-направленным мутагенезом при помощи набора для сайт-направленного мутагенеза "МутаторТМ" ("Stratagene", Ла Джолла, Калифорния). Мутагенез был выполнен в соответствии с инструкциями производителей. Олигонуклеотид был сконструирован на основании комплементарности с участком ДНК при 5'BamHI-сайте из опубликованной последовательности гена гигромицин В-фосфотрансферазы Е.coli (Gritz, L. and Davies. J., 1983, Gene, 25, 179). Олигонуклеотид был синтезирован при использовании цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"); олигонуклеотидная последовательность была следующей:
Посл-сть IД :10
5' ТАЦЦЦГГГГТТЦЦЦГЦГААЦТ 3'
Мутагенез был подтвержден анализом рестрикционными ферментами. Мутагенизированный ген устойчивости к гигромицину затем был выделен в виде SmaI/ХbaI-фрагмента (посредством электрофореза в агарозных гелях и элюции из гелей) и лигирован в расщепленный SmaI/ХbaI вектор рUC 18.
Промотор ИПNC Penicillium был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) в виде NcoI-фрагмента размером 1.2 т.п.н. из расщепленного NcoI вектора рUTZ-2 /предварительно описанный вектор/. Синтетические олигонуклеотидные линкеры были синтезированы для создания BamHI-сайтов из NcoI-сайтов на концах промоторного фрагмента ИПNC так, чтобы расположить промотор ИПNC в 5' BamHI-сайте неподалеку от АТГ гена устойчивости к гигромицину. Олигонуклеотиды были синтезированы при использовании цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"); были получены следующие олигонуклеотидные последовательности:
Пос-сть IД : 11
5' ЦАТГААГААГ 3'
Пос-сть IД : 12
3' ТТЦТТЦЦТАГ 5'
В этой последовательности сохраняется естественная последовательность промотора ИПNC, но вставлены две аминокислоты в ген устойчивости к гигромицину. Олигонуклеотиды были отожжены, фосфорилированы и лигированы в расщепленный NcoI промоторный фрагмент ИПNC, что привело к появлению BamHI-сайтов на обоих - 5'- и 3'-концах промоторного фрагмента ИПNС. Этот промотор с линкерами на концах был лигирован в расщепленный BamHI ген устойчивости к гидромицину в pUC 18; его ориентация была подтверждена анализом рескриктирующими ферментами. Эта кассета промотор ИПNC:ген устойчивости к гигромицину затем была выделена (посредством электрофореза в агарозных гелях и элюции из гелей) в виде ХhoI/SalI-фрагмента размером 2,1 т.п.н. (сайт ХhoI расположен на 5'-конце промотора ИПNC, а сайт SalI происходит из полилинкера pUC) и лигирована в расщепленный SalI вектор pSELECТ. Ориентация кассеты была определена анализом рестриктирующими ферментами. Этот вектор был обозначен рIРNS/HYG. Включение ацетилтрансферазного гена Cephalosporium acremonium.
Ацетилтрансферазный ген Cephalosporium был выделен из геномного клона (описанного выше) посредством электрофореза в агарозных гелях и элюции из гелей в виде BglII/SalI-фрагмента размером 1,8 т.п.н. Ацетилтрансферазный ген был лигирован в расщепленный BamHI/SalI вектор рSELECT. Для облегчения расположения промотора ИПNC Penicillium при АТГ ацетилтрансферазного гена Cephalosporium был создан новый NcoI-сайт при АТГаацетилтрансферазного гена, а внутренний NcoI-сайт был удален из структурного гена сайт-направленным мутагенезом с использованием системы мутагеназа in vitro "Измененные сайты ТМ" (корпорация "Promega"). Мутагенез был выполнен в соответствии с инструкциями производителей. Олигонуклеотиды были сконструированы на основании комплементарности с кодирующими последовательностями участков ДНК, представляющих интерес, из последовательности ацетилтрасферазного гена Cephalosporium, представленной выше в Посл-стях IД : 1 и 2. Олигонуклеотидная последовательность, использованная для удаления col-сайта из структурного гена, была следующей:
Пос-сть IД : 13
3' ГТЦГГЦГЦАТЦГАТГГГТГГААТ 5'
Олигонуклеотидная последовательность, использованная для создания нового NcoI-сайта при стартовом кодоне АТГ, была следующей:
Посл-сть IД : 14
3' ЦГЦЦЦАЦЦАТГГЦГЦЦТЦАГАТ 5'
Эти олигонуклеотиды были синтезированы при использовании цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"). Мутагенез был подтвержден анализом рестриктирующими ферментами. Этот вектор был обозначен рМUТАСТ.
Промотор ИМNC Penicillium был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) в виде NcoI-фрагмента размером 1,2 т.п.н. из вектора рUTZ-2, подробно описанного в Примере выше. Этот промоторный фрагмент был лигирован в расщепленный NcoI вектор рМUТАСТ, в котором промотор ИПNC теперь расположен прямо при АТГ ацетилтрансферазного гена Cephalosporium acremomium.
Ориентация промотора была подтверждена анализом рекстриктирующими ферментами. Эта кассета промотор ИПNC: ацетилтрансферазный ген была расщеплена ХhoI/SalI (сайт ХhoI расположен на 5'-конце промотора ИПNC, а сайт SalI находится на 3'-конце ацетилтрансферазного гена) и лигирована в расщепленный SalI вектор рSELECT. Ориентация фрагмента была определена анализом рестриктирующими ферментами. Этот вектор был обозначен рМUТАСТ/IPNS.
Мутагенез, использованный для создания нового сайта NcoI при АТГ ацетилтрансферазного гена, привел к замене второй аминокислоты серина на аланин. Для того чтобы сохранить кодирующую последовательность идентичной последовательности нативного гена, был проведен сайт-направленный мутагенез с использованием системы мутагенеза in vitro "Измененные Сайты ТМ". Олигонуклеотид был сконструирован на основании комплементарности с кодирующей последовательностью участка ДНК, представляющего интерес, из последовательности ацетилтрансферазного гена, представленной выше как Посл-сти IД : 1 и 2. Олигонуклеотидная последовательность, использованная для замены второй аминокислоты с аланина на серин, была следующей:
Посл-сть IД : 15
3' ТЦТАГЦТАГАЦАЦЦАТГТЦГЦЦТЦАГАТ 5'
Олигонуклеотид был синтезирован с использованием цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"). Мутагенез был подтвержден определением последовательности ДНК при помощи набора определения последовательности ДНК "Секвеназа Версия 2.0" фирмы "USB" ("USB", Кливленд, Огайо). Затравки для определения последовательности ДНК были синтезированы с использованием цианоэтил фосфорамидитовой химии (оборудование для сборки генов фирмы "Pharmacia"). Этот вектор был обозначен рМUТАСТ/IPNS-2.
Кассета промотор ИПNC: ген устойчивости к гигромицину была удалена из вектора рIPNS/HYG в виде ХbaI-фрагмента и лигирована в расщепленный ХbaI вектор рМUТАСТ/IPNS-2 с образованием конечного трансформационного вектора рРеnСАСТ. Ориентация гигромициновой кассеты была определена анализом рестриктирующими ферментами.
Пример 13. Конструирование трансформационного вектора рТS-8 Penicillium для экспрессии генов экспандазы/гидроксилазы и ацетилтрансферазы Cephalosporium acremonium
Ген ацетилтрансферазы Cephalosporium был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) в виде BglII/SalI-фрагмента размером 1,8 т.п.н. из геномного клона и лигирован в расщепленный BamHI/SalI вектор рSELECT (корпорация "Promega"). Для облегчения расположения промотора ИПNC Penicillium при АТГ ацетилтрансферазного гена Cephalosporium при кодоне АТГ был создан новый NcoI-сайт, расположенный при основании-42 (Mathison et al., Current Genetics, в печати), а внутренний соl-сайт был удален из структурного гена сайт-направленным мутагенезом с использованием системы мутагенеза in vitro "Измененные сайты" (корпорация "Promega"). Мутагенез был выполнен в соответствии с инструкциями производителей. Олигонуклеотиды были сконструированы на основании комплементарности с кодирующей последовательностью участков ДНК, представляющих интерес, которые, однако, включают несколько изменений для создания или удаления NcoI-сайта. Олигонуклеотидная последовательность, использованная для удаления из структурного гена внутреннего NcoI-сайта, была следующей:
Посл-сть IД : 16
3' ГТЦГГЦГЦАТЦГАТГГГТГГААТ 5'
Олигонуклеотидная последовательность, использованная для создания нового NcoI-сайта при АТГ на расстоянии - 42 основания, была следующей:
Посл-сть IД : 17
5' ЦТЦЦГАТАГГГЦГТГГТАЦЦЦГГЦЦЦТАЦТЦТТАТ 3'
Олигонуклеотиды были синтезированы при использовании цианоэтил фосфорамидитовой химии (оборудование для сборки генов "Pharmacia"). Мутагенез в обоих случаях был подтвержден анализом рестрикционными ферментами. Этот вектор был обозначен рМUTACT. Промотор ИПNC Penicillium был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) в виде NcoI-фрагмента размером 1,2 т.п.н. из вектора рUTZ-2, предварительно описанного выше. Этот промоторный фрагмент был лигирован в расщепленный NcoI вектор рМUТАСТ, в котором промотор ИПNC теперь располагался прямо при -42 основания от АТГ гена ацетилтрансферазы Cephalosporium. Ориентация промотора была подтверждена анализом рестриктирующими ферментами. Этот вектор был обозначен рМUТАСТ/IPNS. ХhoI/SalI-фрагмент размером 2,5 т.п.н. был выделен (посредством электрофореза в агарозных гелях и элюции из гелей) из вектора рМUТАСТ/IPNS, который содержал кассету промотор ИПNC:ацетилтрансфераза, и лигирован в расщепленный SalI вектор рUTZ-2 (описанный предварительно). Этот промежуточный вектор затем был расщеплен ХbaI и лигирован с ХbaI-фрагментом размером 2,1 т. п. н. из вектора рРЕN/СЕРН-1 (описанного предварительно), содержащим кассету промотор ИПNC: экспандаза/гидроксилаза, с образованием конечного трансформационного вектора рTS-8.
Пример 14. Трансформация Penicillium chrysogenum
Протопласты штамма Penicillium chrysogenum, описанного выше, получали посредством засева 50 мл бульона ПС 1 х 107 спор и культивирования в течение 67 часов при 25oС на вращающейся качалке с 220 об/мин. Мицелий собирали фильтрованием через марлевые фильтры, переносили в 500 мл колбы и ресуспендировали в 25 мл КМФ (0,7 М КСl, 0,8 М маннита, 0,02 М КРО4, рН 6,3), содержащего 100 мг Novozyme 234 ("Novo Biolabs", Багсваерд, Дания); смесь инкубирвоали при температуре 30oС при 100 об/мин. Сферопласты отделяли фильтрованием через фильтры, состоящие из марли и стекловаты, и осаждали центрифугированием при 350 х g в течение 10 минут. Затем сферопласты промывали три раза по 10 мл буфера КМФ, ресуспендировали в буфере КМФК (КМФ с 50 мМ СаСl2) до концентрации 5 х 107 клеток/мл и оставляли при комнатной температуре на 20 минут. Для трансформации Penicillium к 200 мкл суспензии сферопластов добавляли ДНК (5 мкг векторной ДНК в 6,2 мкл КМФК с 5 мг/мл гепарина) вместе с 50 мкл ПФК (40% ПЭГ, м.в. 3500; 20 мМ КРО4, рН 6,3; 5% СаСl2 добавляли непосредственно перед использованием); трансформационную смесь инкубировали на льду в течение 30 минут. Затем добавляли 1 мл свежеприготовленного ПФК и смесь переносили в 50 мл расплавленной (50oС) регенерационной среды (ПС плюс 1,3% маннита и 3% агара). Затем трансформационную смесь распределяли между 5 чашками Петри. После регенерации в течение 24 часов при 25oС чашки покрывали слоем среды OL(1% пептона в 1% агара), содержащий 100 мкг флеомицина /50 мл OL. Объем верхнего слоя был равен объему регенерационной среды. Чашки инкубировали при 25oС в течение 7-14 дней и наблюдали за образованием колоний трансформантов.
Пример 15. Исследование биологической активности
Для определения антибиотической активности ферментационных продуктов адипоил-6-АПК и адипоил-7-АДЦК, выделенных с помощью ВЭЖХ, использовали их биологическое испытание путем диффузии в агар. Двадцать мкл выделенного продукта наносили на 5 мм диски, которые накладывали на чашки с агаризованной средой ЛБ (20 г/л концентрата бульона ЛБ с 3% агара, "Gibco" Пайсли, Шотландия), засеянной Bacillus subtilis АТСС 33877 из сверхчувствительным штаммом Е.coli (предоставленным проф. Arnold L. Demain, MIT). Bacillus subtilis использовали в качестве индикаторного штамма для испытания продукта адипоил-6-АПК, а сверхчувствительный штамм Е.соli использовали в качестве индикаторного штамма для испытания продукта адипоил-7-АДЦК. Через 15 часов инкубации при 37oС ободки подавления роста индикаторных бактерий вокруг дисков указывали на то, что продукты обладают биологической активностью. Контроли в этом эксперименте включали деацетоксицефалоспорин С, цефалоспорин С, пенициллин V и агаризованную среду, содержащую или не содержащую пенициллиназу, которая служила контролем для подтверждения β-лактамазных структур.
Пример 16. Метод ВЭЖХ для одновременного анализа адипоилсодержащих 6-АПК, 7-АДЦК, 7-АДАЦ и 7-АЦК
Ферментационные продукты трансформированных штаммов Penicillium (адипоил-6-АПК, адипоил-7-АДЦК, адипоил-7-АДАЦ и адипоил-7-АЦК) одновременно анализировали при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ). Система ВЭЖХ состояла из следующих компонентов Waters: системы подачи растворителя 625, индикатора различных длин волн 409Е (установленного на 220 нм и 260 нм) и системы данных Maxima 825. Для стационарной фазы пользовались патроном радиального давления 5 х 100 мм Nova-Pak С18 со вставкой Novo-Pac С18 Guard-Pak. Подвижная фаза состояла из 10-минутного линейного градиента от начальных условий: 5% метанол и 95% 10 мМ КРО4, рН 5; до конечных условий: 40% метанол и 60% КРО4, рН 5 (при скорости потока 1 мл/мин). Адипоил-6-АПК определяли количественно путем сравнения со стандартной кривой пенициллина N при 220 нм. Продукты с расширенным кольцом определяли количественно путем сравнения со стандартными кривыми синтетических адипоил-7-АДЦК и адипоил-7-АЦК при 260 нм.
Пример 17. Исследование фермента RAEV
Для определения специфической активности фермента RAEV (его можно приобрети у производящей корпорации RAEV) в качестве субстрата использовали химически синтезированные адипоил-7-АДЦК и адипоил-7-АЦК. Реакционная смесь содержала 10 мМ субстрата, 1 мкг фермента RAEV и 5% глицерина, растворенных в 0,16 М КН2РО4 (общий объем смеси 50 мкл); смесь инкубировали при 37oС. (Более оптимальные условия реакции включают использование 20 мМ или более концентрированого раствора субстрата в 20-50 мМ калий-фосфатном буфере). Аликвоты по 5 мкл отбирали через 0, 1, 3, 5, 10, 20 и 30 минут после начала реакции, разводили в 35 мкл 0,010 М КН2РО4, рН 3,5, и замораживали при -70oС перед анализом ВЭЖХ в условиях, описанных предварительно.
Активность фермента RAEV испытывали по отношению к колориметрическому субстрату адипоил-п-аминобензойной кислоте, используя 5 мМ субстрата, 8,25 мкг фермента RAEV и 10% глицерина, растворенных в 0,065 М КН2РО4, рН 7,0 (общий объем смеси составлял 50 мкл), и инкубацию при 37oС в течение 30 минут. Реакцию проводили в чашках для микротитрования с 96 лунками. Для остановки реакции добавляли 50 мкл разведения 1/100 1 М NaNO2 в 0,25 М уксусной кислоте; реакционную смесь оставляли при комнатной температуре на 3 минуты. Затем добавляли 100 мкл разведения 1/100 раствора гидрата мононатриевой соли 4-амино-5-гидрокси-2,7-нафталин-дисульфокислоты в воде с концентрацией 10 мг/мл в 0,5 М NaCO3; немедленно определяли появление окрашивания при 515 нм, используя прибор Е 312 для считывания биокинетических результатов с чашек (оборудование "Biotek").
Пример 18. Оценка альтернативный адипоилацилаз
Помимо исследований с применением фермента RAEV, удаление адипоиловой боковой цепи из адипоил-7-АДЦК (и других адипоилсодержащих соединений) было продемонстрировано на ферментах, образуемых множеством микробных источников. В начале исследования штаммы Pseudomonas sp.SE-83 и SE-495, принадлежащие Asahi (заложены в коллекцию Института Ферментационных исследований под присвоенными им номерами FERM ВР-817 и FERM ВР-818 соответственно), и штамм Pseudomonas SY-77-1, принадлежащий Тоуо Jozo (заложен в коллекцию Северной Региональной Исследовательской Лаборатории под присвоенным ему номером NRRL B-8070), выращивали в течение 72 часов на среде, содержащей HyCase SF - 2,0% (вес/объем); мононатрий глутамат - 0,5% (вес/объем); дрожжевой экстракт - 0,5% (вес/объем); порошкообразный кукурузный экстракт - 0,2% (вес/объем); масло из семян хлопка - 0,5% (вес/объем) и глутаровую кислоту - 0,1% (вес/объем). Клетки собирали центрифугированием и промывали 50 мМ фосфатным буфером, рН 8,0; затем клетки ресуспендировали в буфере; их внешнюю мембрану делали проницаемой путем добавления небольшого количества хлороформа. Аликвоты клеточной суспензии затем смешивали с адипоил-пара-нитроанилином (ад-пНА) и инкубировали при 30oС в течение 2-18 часов. После инкубации реакционные смеси подкисляли добавлением 10% (объем/объем) уксусной кислоты. Освободившийся п-нитроанилин затем определяли колориметрическим способом при его превращении в диазосоединение, используя реактивы, предоставляемые в виде набора химической компанией "Sigma" для исследования гамма-глутамил-трансферазы (продукт фирмы "Sigma" номер 545-А). Относительные активности трех штаммов составляли 100%, 85,5% и 48% для штаммов SE-495, SE-83 и SY-77-1 соответственно. С использованием методов, сходных с теми, что описаны выше для фермента RAEV, было также продемонстрировано действие ферментов SE-83 и SE-495 на адипоил-7-АДЦК. Образование β-лактамаз у штамма SY-77-1 препятствует демонстрации деацилирующего действия этого штамма на адипоил-7-АДЦК.
Сходным образом образование адипоилацилазы было также продемонстрировано у двух грибных штаммов Alternaria sp. МА-133, АТСС 20492 и Aspergillus sp. МА-13, АТСС 20491; ссылка на U.S. 414179, выданный Meiji Seika Kaisha Ltd. и трех дополнительных бактериальных штаммов (Brevibacterium, АТСС 14649; Achromobacterium, АТСС 14648; и Flavobacterium, АТСС 14650, которые были описаны как продуценты цефалоспорин С-ацилазы в U.S. 3239394, выданном Меrck & Со., Инк.).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭФФЕКТИВНОГО ПРОИЗВОДСТВА 7-АДЦК ЧЕРЕЗ 2-(КАРБОКСИЭТИЛТИО) АЦЕТИЛ-7-АДЦК И 3-(КАРБОКСИМЕТИЛТИО)ПРОПИОНИЛ-7-АДЦК | 1994 |
|
RU2139349C1 |
| СПОСОБ ЭФФЕКТИВНОГО ПРОИЗВОДСТВА 7-АДЦК ЧЕРЕЗ 3-(КАРБОКСИЭТИЛТИО)ПРОПИОНИЛ-7-АДЦК | 1994 |
|
RU2139350C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-АДЦК ПУТЕМ ВОЗДЕЙСТВИЯ АКТИВНОСТИ ЭКСПАНДАЗЫ НА ПЕНИЦИЛЛИН G | 1996 |
|
RU2192471C2 |
| СПОСОБ ПОЛУЧЕНИЯ 7-АМИНОДЕЗАЦЕТОКСИЦЕФАЛОСПОРАНОВОЙ КИСЛОТЫ (7-ADCA) | 1992 |
|
RU2178808C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ДЕАЦИЛИРОВАННОГО ЦЕФАЛОСПОРИНА | 1998 |
|
RU2208643C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ДЕАЦИЛИРОВАННОГО ЦЕФАЛОСПОРИНА | 1998 |
|
RU2208644C2 |
| СПОСОБ РАСШИРЕНИЯ 5-ЧЛЕННОГО КОЛЬЦА СОЕДИНЕНИЯ БЕТА-ЛАКТАМА ДО 6-ЧЛЕННОГО ЦЕФЕМА | 1999 |
|
RU2230790C2 |
| Способ конструирования рекомбинантной плазмидной ДНК, кодирующей фермент деацетоксицефалоспорин С синтетазу/деацетилцефалоспорин С синтетазу | 1988 |
|
SU1739856A3 |
| СПОСОБ КАТАЛИЗА РЕАКЦИИ ФЕРМЕНТАЦИИ СУБСТРАТА, СПОСОБ УЛУЧШЕНИЯ ПОТРЕБЛЕНИЯ ПИЩЕВОГО РАЦИОНА ЖИВОТНЫМ, ПЛАЗМИДА pMOG413, ПЛАЗМИДА pMOG429 И ПЛАЗМИДА pMOG227 | 1991 |
|
RU2129609C1 |
| ДНК, КОДИРУЮЩАЯ ФИТАЗУ ASPERGILLUS NIGER, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК ДЛЯ ЭКСПРЕССИИ ФИТАЗЫ (ВАРИАНТЫ), ШТАММЫ-ПРОДУЦЕНТЫ ФИТАЗЫ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ФИТАЗЫ И РЕКОМБИНАНТНАЯ ФИТАЗА ASPERGILLUS NIGER | 1990 |
|
RU2113468C1 |
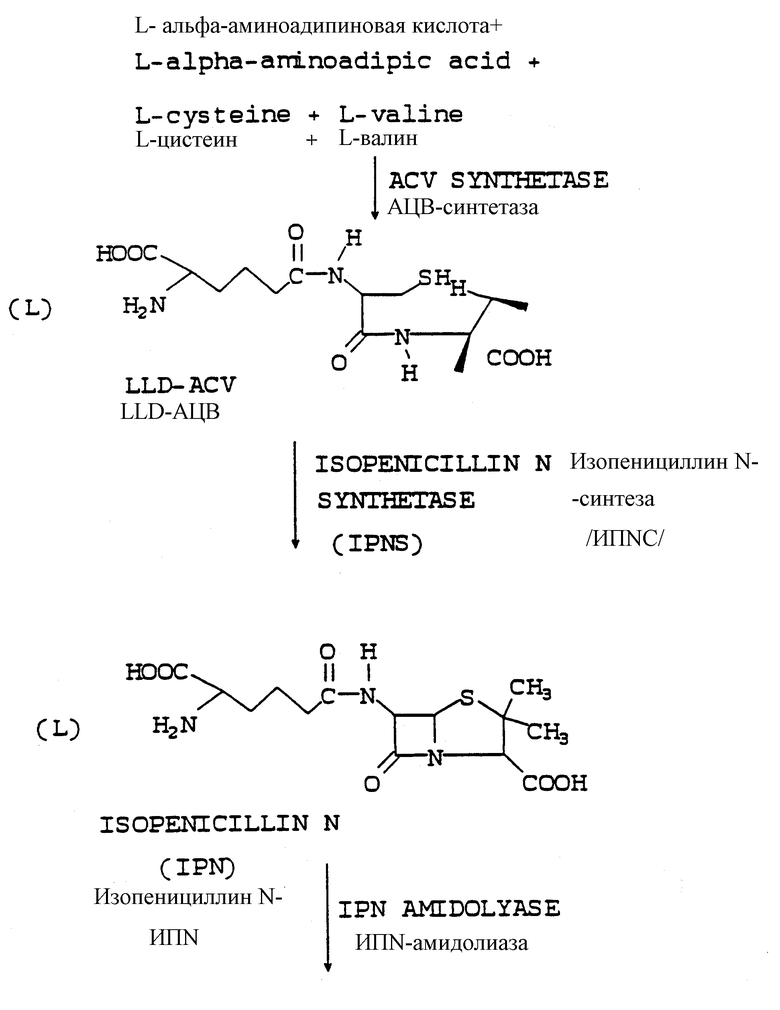
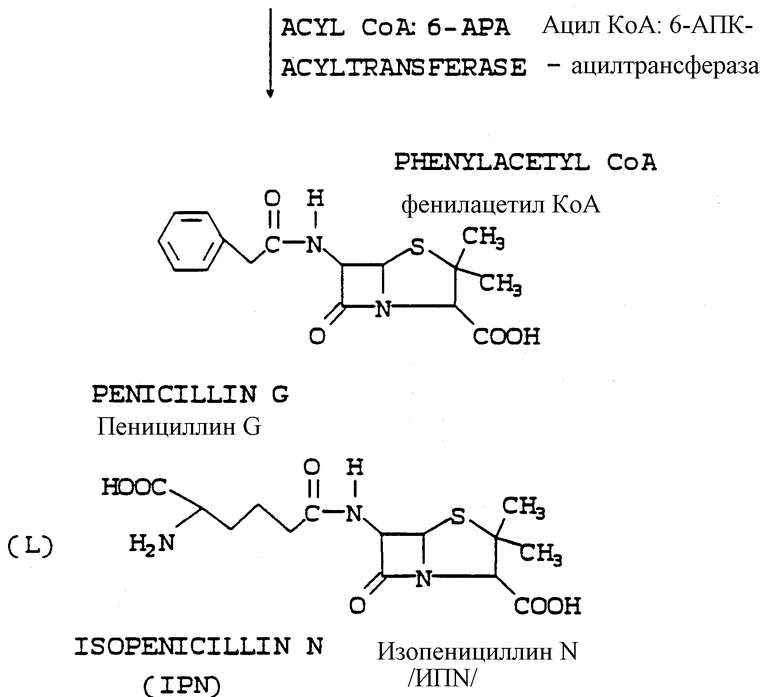
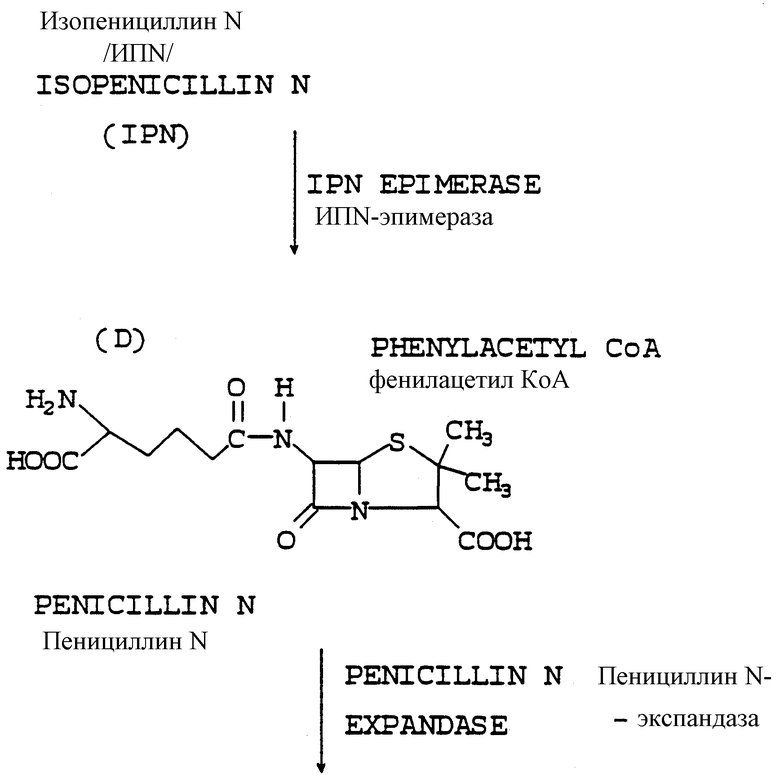
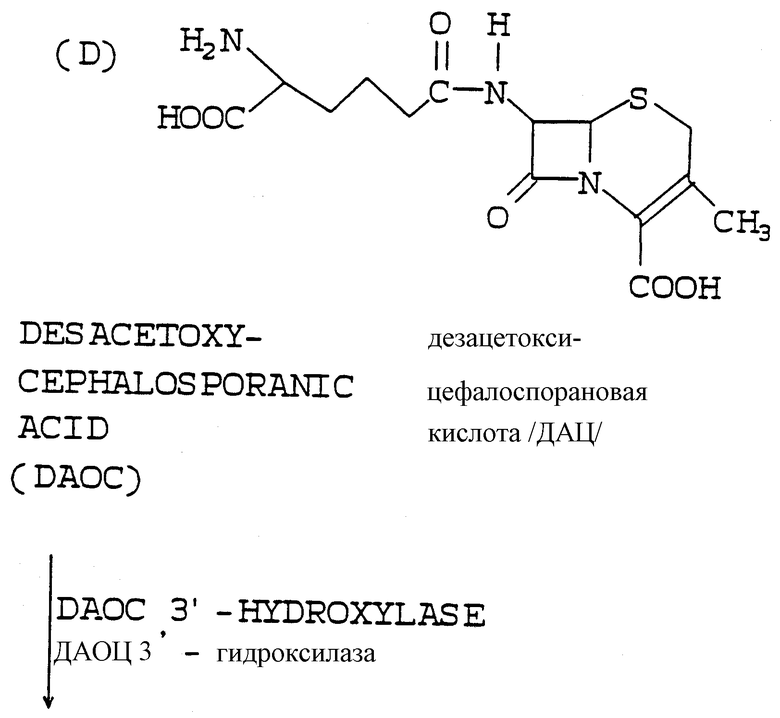
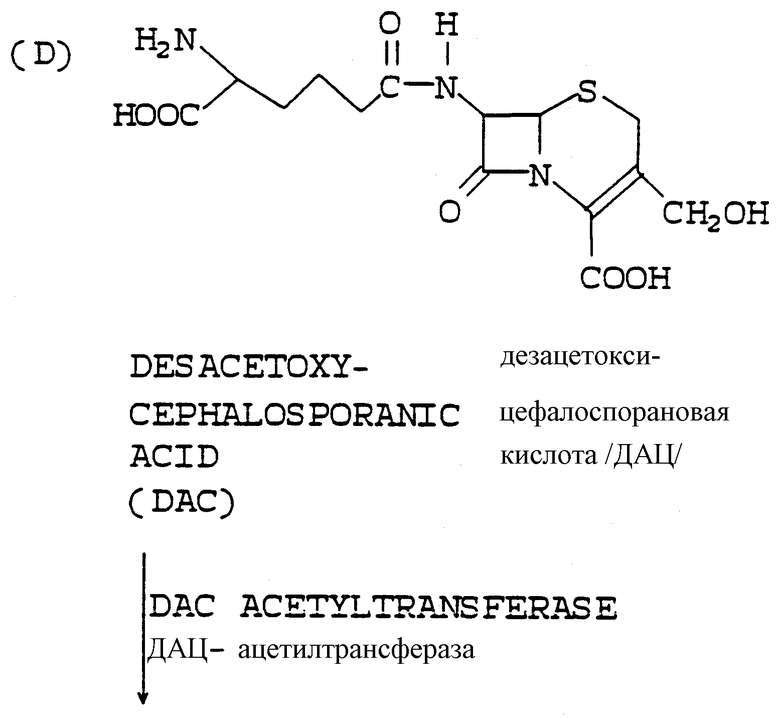
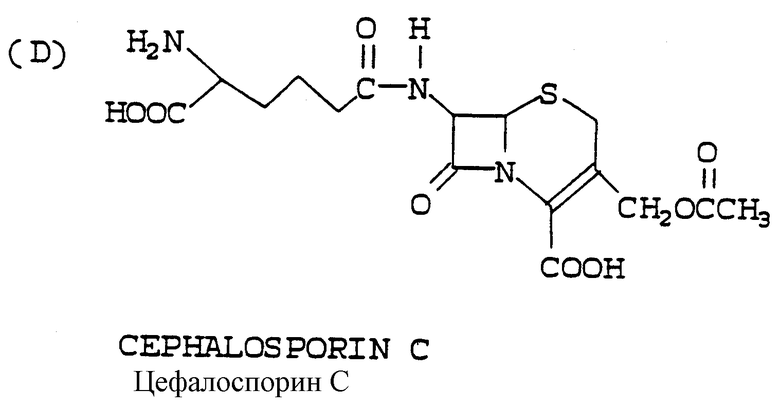




Изобретение относится к области биотехнологии и может быть использовано при промышленном получении промежуточных продуктов для синтеза цефалоспориновых антибиотиков. С помощью технологии рекомбинантных ДНК получают вектор, способный встраиваться в хромосомную ДНК штамма Penicillium chrysogenum и обеспечивать экспрессию содержащихся в нем под контролем промотора IPNS Penicillium последовательностей ДНК из Cephalosporium acremonium, кодирующих ферменты экспандазу/гидролазу и ацетилтрансферазу. В результате трансформации указанным вектором штамма Penicillium chrysogenum, способного продуцировать изопенициллин N, получают рекомбинантный штамм, в котором осуществляется биосинтез всех ферментов, необходимых для превращения адипата в адипоил-7-аминоцефалоспорановую кислоту (ад-7-АЦК). Примером такого штамма является Penicillium chrysogenum/рТS-8 (АТСС 74187). Получаемую путем культивирования рекомбинантного штамма в присутствии источника адипата ад-7-АЦК затем подвергают обработке адипоиламидазой с образованием 7-аминоцефалоспорановой кислоты (7-АЦК). Изобретение обеспечивает возможность получения 7-АЦК в промышленном масштабе эффективным и экономичным способом. 3 с. и 1 з.п.ф-лы, 1 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СТИРАЛЬНОЙ МАШИНЫ | 0 |
|
SU341892A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Двухходовой пробковый переключатель направления потока сыпучих материалов при пневматическом транспортировании | 1972 |
|
SU450758A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 4510246, 09.04.1985. | |||
Авторы
Даты
2003-04-20—Публикация
1992-10-08—Подача