Область техники
Настоящее изобретение относится к области производства антибиотиков. В частности, настоящее изобретение относится к штамму, продуцирующему пептидный антибиотик с высоким выходом, к способу получения и к его применению.
Предшествующий уровень техники
В последние несколько десятилетий постоянно растут и заболеваемость, и типы грибковой инфекции, вредной для здоровья человека, особенно для пациентов с иммуносупрессией. В течение этого периода клиническое применение некоторых часто используемых противогрибковых средств, таких как амфотерицин, имидазолы и триазолы, ограничено из-за значительной нейротоксичности, лекарственной устойчивости и тому подобного. Эхинокандины, как род новых противогрибковых средств, относятся к группе натуральных продуктов, обнаруженных в 1970-х годах. Структурно эхинокандины имеют аналогичную циклическим полипептидам основу, но имеют отличающиеся боковые цепи жирных кислот. Эхинокандины могут конкурентно ингибировать синтез β-D-глюкана в клеточных стенках грибков. Преимуществами эхинокандинов являются низкая токсичность, сильная фунгицидная активность, а также отличные фармакокинетические свойства.
Семейство эхинокандинов включает следующие элементы: WF 11899 A, эхинокандины, цилофунгин, пневмокандины, акулеацины и мулундокандин, с микафунгином, эхинокандины и пневмокандины, которые активно исследуют и в настоящее время применяют в клинике.
Микафунгин является водорастворимым липопептидным противогрибковым агентом из эхинокандинов, который получают путем химической модификации продукта ферментации из Colephoma empetri. Микафунгин был разработан Fujisawa как антигрибковый препарат широкого спектра действия. В открытом исследовании у пациентов с глубокой грибковой инфекцией (Candida или Aspergillus), проведенном в Японии, средняя эффективность 92% может быть достигнута после обработки в течение приблизительно 22 дней для каждой дозовой группы. В моноцентровом исследовании, проведенном в США для 14 случаев рака у пациентов с кандидемией, использовали 50~150 мг Микафунгина в комбинации с другими противогрибковыми агентами или без каких-либо других антигрибковых агентов и обнаружили, что в 11 из 12 случаев он был эффективен (92%). Такие виды препаратов превосходят традиционные противогрибковые агенты благодаря негемолитической токсичности и меньшим взаимодействием с другими препаратами.
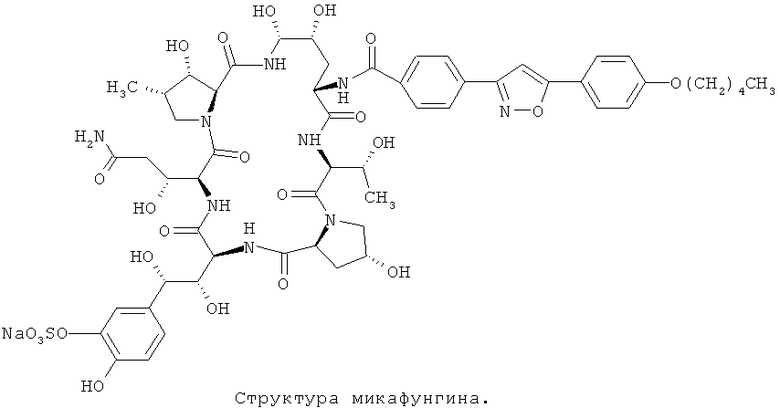
Colephoma empetri может производить класс природных антигрибковых агентов, таких как соединения формулы I, II и III.
Производительность Colephoma empetri (каталожный № FERM ВР-2635) для соединения формулы I очень низка (только 700 мг/л), таким образом, затраты на индустриализацию будут очень высоки.
Общая формула I, II, III
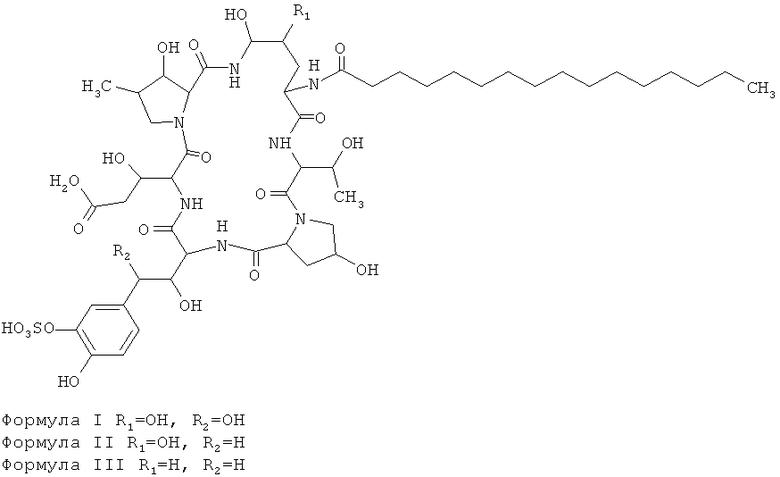
Соответственно, необходимо срочно найти штамм со стабильными генетическими свойствами и высоким выходом, который может производить больше соединения формулы I для выполнения требований промышленного производства.
Краткое описание изобретение
Целью настоящего изобретения является создание мутантного штамма Colephoma empetri.
Другой целью настоящего изобретения является обеспечение способа получения указанного мутантного штамма.
Еще одной целью настоящего изобретения является описание применения указанных мутантного штамма.
В первом аспекте настоящего изобретения предусмотрен мутантный штамм Colephoma empetri, который был депонирован в Китайском Главном Центре Коллекционирования Микробиологических Культур (China General Microbiological Culture Collection Center) с регистрационным номером CGMCC 4129.
Во втором аспекте настоящего изобретения предлагается способ получения мутантного штамма, указанного выше, включающий следующие стадии:
(а) смешивание посевной жидкости Colephoma empetri учетный номер FERM ВР-2635 с нитрозогуанидином для получения смеси A;
(б) смешивание указанной смеси A с ферментом, разрушающим клеточную стенку, для получения протопластов;
(в) регенерацию указанных протопластов для получения отдельных колоний и
(г) культивирование указанных отдельных колоний для получения мутантного штамма, указанного выше.
В третьем аспекте настоящего изобретения, предусматривают применение указанного мутантного штамма для получения соединения формулы I:
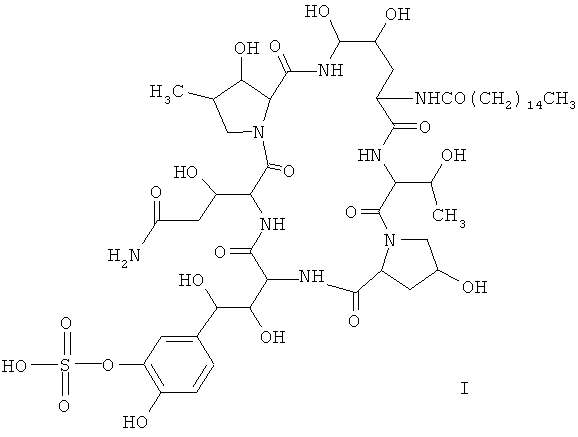
В четвертом аспекте настоящего изобретения предложен способ получения соединения формулы I, содержащий следующую стадию: культивирование указанного мутантного штамма, осуществляемое согласно настоящему методу, в ферментационной среде при температуре от 15 до 35°C с получением соединения формулы I.
В способе получения, указанном выше, указанная ферментационная среда содержит следующие компоненты, в расчете на общий объем ферментационной среды: жидкий кукурузный экстракт 5-20 г/л, мука из жмыха семян хлопчатника 5-30 г/л, дрожжевой экстракт 6-15 г/л, крахмал 10-80 г/л, глюкоза 5-20 г/л, неорганическая соль 1,5-15 г/л, микроэлементы 10-50 г/л, указанная неорганическая соль выбрана из фосфата или сульфата, или их комбинации.
В способе получения, указанном выше, объем инокуляции указанного мутантного штамма, предусмотренного по изобретению, составляет 4-10 об./об.%, в расчете на общий объем ферментационной среды.
В способе получения, указанном выше, исходное значение рН указанной ферментационной среды составляет 5,5-6,5.
Таким образом, настоящее изобретение предусматривает штамм со стабильными генетическими свойствами и высоким выходом, который может производить больше соединения формулы I для лучшего выполнения требований промышленного производства.
Способы осуществления изобретения
Авторы настоящего изобретения неожиданно обнаружили, что мутантный штамм с высоким выходом (учетный номер CGMCC 4129) может быть получен путем мутагенеза штамма Colephoma empetri FERM ВР-2635 с нитрозогуанидином (НТГ) с использованием фермента, лизирующего клеточную стенку, lywallzyme, для получения протопластов, а затем скрининга регенерированных протопластов. Указанный мутантный штамм может продуцировать соединение формулы I с высоким выходом путем ферментации. Таким образом, авторы осуществили настоящее изобретение.
Новый штамм
Настоящее изобретение обеспечивает новый штамм, продуцирующий соединение формулы I. Таксономически указанный новый штамм принадлежит к Colephoma empetri и депонирован в Китайском Главном Центре Коллекционирования Микробиологических Культур (China General Microbiological Culture Collection Center) с учетным номером CGMCC 4129 31 августа 2010 г.
Способ получения нового штамма
Настоящее изобретение относится к способу получения нового штамма с учетным номером CGMCC 4129, и указанный способ может быть осуществлен в соответствии со следующим процессом:
Исходный штамм → посевная жидкость → мутагенная обработка НТГ → удаление клеточной стенки с помощью фермента, лизирующего клеточную стенку (lywallzyme) для получения протопластов → разведение и посев протопластов на чашки→выбор одной колонии и посев ее на скошенный агар → первичный скрининг во встряхиваемых колбах → выбор штамма с большим выходом → посев штамма на скошенный агар → вторичный скрининг во встряхиваемых колбах → выбор штамма с большим выходом, проверка в ферментационном чане, и выполнение эксперимента по определению стабильности → депонирование штамма.
В частности, метод, описанный в настоящем изобретении, включает следующие стадии:
(а) смешивание посевной жидкости Colephoma empetri регистрационный номер FERM ВР-2635 с нитрозогуанидином с получением смеси А;
(б) перемешивание указанной смеси А с разрушающим клеточную стенку ферментом для получения протопластов;
(в) регенерация указанных протопластов для получения отдельных колоний; и
(г) культивирование указанных отдельных колоний для получения нового штамма.
В примере по настоящему изобретению новый штамм может быть получен с помощью следующей процедуры: культивирование посевной жидкости от FERM ВР-2635 (сухая масса клеток, СВК 5-30 г/л) в течение от 1 до 3 суток во встряхиваемых колбах, добавление соответствующего количества НТГ в посевную жидкость, культивирование еще от 1 до 2 суток, а затем центрифугирование посевной жидкости, промывание и ресуспендирование осадка и разрушение клеточных стенок с помощью lywallzyme (коммерчески доступен в Гуандунском Институте Микроорганизмов - Guangdong Microorganism institute), для получения протопластов. Разбавленные протопласты высевали на чашки с гипертоническим КАД (картофельный агар с декстрозой) и культивировали для получения отдельных колоний рекомбинантных клеток. Отдельные колонии, указанные выше, проверяют для получения мутантного нового штамма.
Далее, настоящее изобретение относится к способу получения соединения формулы 1 путем ферментации нового штамма, полученного с помощью мутагенеза.
В примере по настоящему изобретению способ получения нового штамма с помощью мутагенеза и ферментирования нового штамма для получения соединения формулы I является следующим:
(1) исходный штамм: Colephoma empetri FERM ВР-2635
(2) посевная культура исходного штамма.
Депонированный штамм FERM ВР-2635 в глицерине размораживают, высевают в посевной среде (с нагрузкой 50 мл/250 мл), культивируют на шейкере при 200-300 об/мин при температуре 25-30°C в течение от 1 до 3 суток до тех пор, пока масса в расчете на сухой мицелий не достигает приблизительно 5-30 г/л.
Состав посевной среды: сахароза 10-20 г/л, дрожжевой экстракт 4-10 г/л, соевый триптон 10-20 г/л, KH2PO4 1,5-2 г/л, MgSO4·7H2O 0,4-1 г/л, микроэлементы 10-50 г/л, начальный pH 5,3-6,0. Среду стерилизуют при 121°C в течение 20 мин. Микроэлементы: FeSO4·7H2O 10-20 г/л, MnSO4 H2O 10-20 г/л, ZnSO4·7H2O 2-10 г/л, CaCl2 0,7-2,0 г/л, H3BO3 0,56-2,0 г/л, CuCl2·2H2O 0,25-2,0 г/л, (NH4) 6Mo7O24·7H2O 0,19-2,0 г/л, концентрированная соляная кислота 500 мл/л.
(3) разделение отдельных колоний.
Прежде всего посевную жидкость из исходного штамма подвергают мутагенной обработке НТГ, а затем обрабатывают lywallzyme для разрушения клеточной стенки. Полученные протопласты регенерируют для получения мутантного штамма.
(4) скринирование мутантного штамма.
Протопласты высевают на гипертоническую среду КАД. Единичные колонии, растущие в течение от 10 до 12 суток, высевают на среду для культивирования на скошенном агаре для дальнейшего культивирования. Через 8-10 суток посевную среду инокулируют (нагрузка на 25 мл/250 мл) с газоном, выращенным на среде культивирования на скошенном агаре, и культивируют на шейкере при 280 об/мин при температуре 25-30°C в течение 6-10 суток. Посевную жидкость высевают в среду ферментации (нагрузка 25 мл/250 мл) и культивируют на шейкере при 200-300 об/мин при температуре 25-30°C в течение 6-12 суток. После завершения культивирования ферментационную жидкость экстрагируют метанолом и содержание соединения формулы I в ферментационной жидкости измеряют с помощью высокоэффективной жидкостной хроматографии.
Составы используемой среды можно найти в Improvement of FR 901379 production by mutant selection and medium optimization, Journal of Bioscience and Bioengineering VOL 107 No.5, 530-534, 2009, Journal of antibiotics, Vol 45, No.12, Dec 1992, 1867-1874.
Гипертоническая среда КАД: картофель 300 г/л, глюкоза 20 г/л, агар 15 г/л, сахароза 273,6 г/л, стерилизация при 121°C в течение 20 мин.
(5) ферментирование мутантного штамма.
Соответствующие технические решения были описаны в литературе. Для получения подробной информации, пожалуйста, обратитесь к Improvement of FR901379 production by mutant selection and medium optimization, Journal of Bioscience and Bioengineering VOL 107 No.5, 530-534, 2009, Journal of antibiotics, Vol 45, No.12, Dec 1992, 1867-1874.
Отличительные признаки настоящего изобретения, упомянутые выше, или особенности, упомянутые в примерах, могут быть дополнительно объединены. Любой признак, раскрытый в настоящем описании, может быть использован в сочетании с любыми другими признаками, и каждый признак, раскрытый в описании, может быть заменен альтернативным признаком, который может служить идентичной, эквивалентной или аналогичной цели. Таким образом, признаки, раскрытые здесь, являются только общими примерными примерами эквивалентных или сходных признаков, если специально не указано иначе.
Основные преимущества настоящего изобретения включают:
1. Мутантный новый штамм получают со стабильным высоким выходом и стабильными генетическими свойствами.
2. Высокая генетическая стабильность и меньшее продуцирование примесей для нового штамма облегчают разделение и очистку при продуцировании соединения формулы I, а также при масштабировании, и тем самым пригодны для промышленного производства.
3. Выход соединения формулы I может достигать 1,5 г/л при оптимальных условиях ферментации.
Настоящее изобретение будет ниже дополнительно проиллюстрировано со ссылкой на конкретные примеры. Следует понимать, что эти примеры приведены только для иллюстрации настоящего изобретения, но не ограничивают объем настоящего изобретения. Экспериментальные способы без каких-либо конкретных условий, описанных в следующих примерах, как правило, выполняются при обычных условиях или в соответствии с инструкциями производителя. Если не указано иное, то все проценты, соотношения, пропорции или части рассчитываются по массе.
Единица "отношение массы к объему в процентах", используемая в настоящем изобретении, хорошо известна специалистам в данной области техники, например, сказанное относится к массе вещества, растворенного в 100 мл раствора.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют значения, общепринятые специалистами в данной области. Кроме того, все методы и материалы, которые аналогичны или эквивалентны раскрытым в данном документе, могут быть применены в способах по настоящему изобретению. Предпочтительные способы и материалы для осуществления настоящего способы, описанные здесь, даны только в качестве примеров.
В примерах по настоящему изобретению, условия высокоэффективной жидкостной хроматографии, используемой для измерения содержания соединения формулы I в ферментационной жидкости, являются следующими:
содержание соединения формулы I в ферментационной жидкости измеряют с помощью высокоэффективной жидкостной хроматографии:
хроматографическая колонка: Calesil DOS-100 (4,6 мм × 250 мм, 5 мкм) подвижная фаза:ацетонитрил:вода = 50:50 с 0.05N из NH4H2PO4,
температура колонки: 35°C,
градиент элюирования, скорость потока: 1,0 мл/мин,
объем впрыска: 5 мкл, длина волны детектирования: 210 нм.
Пример 1
Получение нового штамма CGMCC 2933 путем мутагенеза.
1. мутагенез
Депонированный штамм FERM ВР-2635 в глицерине размораживают, высевают в посевную среду с инокуляцией в количестве 4% (нагрузка 50 мл/250 мл), затем культивируют на шейкере при скорости 280 об/мин при 25°C в течение 2 суток до получения сухой массы мицелия около 5-30 г/л. Мутаген НТГ добавляют в посевную жидкость при концентрации 10 мкг/мл, а посевную жидкость культивируют еще сутки. Затем берут 10 мл посевной жидкости, содержащей НТГ, центрифугируют при 5000 об/мин в течение 10 минут и полученный осадок промывают два раза двумя объемами 0,6 М NaCl для удаления среды и НТГ. Степень гибели микроорганизмов для этого процесса составляет 85-90%.
Посевная среда: сахароза 10 г/л, дрожжевой экстракт 5 г/л, соевый триптон 10 г/л, КН2РО4 1,5 г/л, MgSO4·7H2O 0,4 г/л, микроэлементы 10 г/л, исходный pH 5,3. Посевную среду стерилизуют при 121°C в течение 20 минут.
Микроэлементы: FeSO4·7H2O 10 г/л, MnSO4·H2O 10 г/л ZnSO4·7H2O, 2 г/л CaCl2, 0,7 г/л H3BO3 0,56 г/л, CuCl2·2H2O 0,25 г/л (NH4)6Mo7O24·7H2O 0,19 г/л, концентрированная соляная кислота 500 мл/л
2. Подготовка протопластов и разделение единичных колоний
К промытым мицелиям добавляют 10 мл смеси ферментов (в буфере двузамещенный фосфорнокислый натрий - лимонная кислота (pH 6,0) с 0,5 М NaCl), смесь ферментов содержит 20 мг/мл lywallzyme (2000 ед./мг), 10 мг/мл фермента улитки (5 ед./мг) и 10 мг/мл целлюлозы (15 ед./мг). Полученную смесь встряхивают при 80 об/мин при 30°C в течение 5 ч для ферментативного разрушения. Реакционную смесь ферментативного разрушения фильтруют через вату для удаления мицелия и получают одноклеточную суспензию, содержащую только протопласты. Один миллилитр этого раствора отбирают и центрифугируют при 14000 об/мин в течение 10 минут. Осадок растворяют в 1 мл буфера двузамещенный фосфорнокислый натрий - лимонная кислота (pH 6,0), содержащего 0,5 М NaCl. Этот раствор затем последовательно разбавляют в различных концентрациях, равномерно наносят на гипертоническую КАД среду с 0,8 М сахарозой и культивируют при 25°C в течение от 6 до 8 суток для получения примерно 6000 отдельных колоний.
3. Процесс скрининга штамма, обеспечивающего высокий выход CGMCC 4129
После культивирования в течение 8 суток отдельные колонии отбирали и высевали на среду для культивирования на скошенном агаре для дальнейшего культивирования. После 8 суток газон площадью от 0,5 до 1,0 см2 отбирали и высевали в посевную среду (объем загрузки 25 мл/250 мл) (всего 4000 отдельных колоний), культивировали на шейкере при 280 об/мин и 25°C в течение 5 суток. Посевную жидкость высевали в ферментационную среду с инокуляционным объемом 4% (объем загрузки 25 мл/250 мл), культивировали на шейкере при 280 об/мин и температуре 25°C в течение 10 суток (на 6-й день культивирования добавляли 5% крахмала).
После окончания культивирования ферментационную жидкость экстрагировали 50 мл метанола и содержание соединения формулы I в ферментационной жидкости измеряли с помощью высокоэффективной жидкостной хроматографии. Всего было получено 5 штаммов с высоким выходом, и штамм с высоким выходом CGMCC 4129 был скринировали еще раз для подтверждения того, что выход соединения формулы I составлял 1,4 г/л.
Пример 2
Продуцирование соединения формулы I новым штаммом CGMCC 4129 Новый штамм CGMCC 4129, полученный в примере 1, в посевной среде засевают в ферментационную среду в инокуляционном количестве 4%, культивируют в 50-литровом ферментере при температуре 25°C. pH ферментационной жидкости поддерживают равной 6,5. После культивирования в течение 10 суток выход соединения формулы I составил 1,5 г/л (на 6-й день культуры добавляют 5% крахмала).
Ферментационная среда: жидкий кукурузный экстракт 20 г/л, мука из жмыха семян хлопчатника 10 г/л, дрожжевой экстракт (коммерчески доступная форма Oxiod) 8 г/л, крахмал 40 г/л, глюкоза 5-10 г/л, КН2РО4 1,5 г/л, MgSO4·7H2O 0,4 г/л, микроэлементы 10 мл/л, исходный pH 5,3. Глюкозу стерилизуют отдельно при 115°C в течение 20 минут.
Микроэлементы: FeSO4·7H2O 10 г/л, MnSO4·H2O 10 г/л ZnSO4·7H2O, 2 г/л CaCl2, 0,7 г/л H3BO3 0,56 г/л, CuCl2·2H2O 0,25 г/л, (NH4)6Mo7O24·7H2O 0,19 г/л, концентрированная соляная кислота 500 мл/л.
Пример для сравнения
Мощность исходного штамма FERM ВР-2635 для продуцирования соединения формулы I сравнивают с мощностью мутантного штамма CGMCC 4129, используя следующие методы:
Исходный штамм и мутантный штамм культивировали, используя способ культивирования, описанный в Примере 2 соответственно. После окончания культивирования ферментационную жидкость экстрагировали с использованием двух объемов метанола и содержание соединения формулы I в ферментационной жидкости измеряли с помощью высокоэффективной жидкостной хроматографии. Результаты показаны в Таблице 1.
Используемые среды перечислены ниже:
Среда скринирования: картофель 300 г/л, глюкоза 20 г/л, агар 15 г/л, сахароза 273,6 г/л, стерилизуют при 121°C в течение 20 минут.
Среда культивирования на скошенном агаре: картофель 300 г/л, глюкоза 20 г/л, агар 15 г/л, стерилизуют при 121°C в течение 20 минут.
Посевная среда: сахароза 10 г/л, дрожжевой экстракт 5 г/л, соевый триптон 10 г/л, KH2PO4 1,5 г/л, MgSO4·7H2O 0,4 г/л, микроэлементы 10 г/л, исходный pH 5,3, стерилизуют при 121°C в течение 20 минут.
Ферментационная среда: жидкий кукурузный экстракт 20 г/л, мука из жмыха семян хлопчатника 10 г/л, дрожжевой экстракт (коммерчески доступная форма (Oxiod) 8 г/л, крахмал 40 г/л, глюкоза 5-10 г/л KH2PO4 1,5 г/л, MgSO4·7H2O 0,4 г/л, микроэлементы 10 мл/л, исходный pH 5,3. Глюкозу стерилизуют отдельно при 115°C в течение 20 минут.
Микроэлементы: FeSO4·7H2O 10 г/л, MnSO4·H2O 10 г/л ZnSO4·7H2O, 2 г/л CaCl2, 0,7 г/л H3BO3 0,56 г/л, CuCl2·2H2O 0,25 г/л (NH4)6Mo7O24·7H2O 0,19 г/л, концентрированная соляная кислота 500 мл/л.
Пример 3
Стабильность нового штамма 4129 CGMCC
Субкультивирование проводят с использованием такой же среды и условий культивирования, как описаны в Примере 2. Результат показан в таблице 2.
Результаты показывают, что новый штамм обладает превосходной стабильностью.
Приведенное выше описание является лишь предпочтительными примерами по настоящему изобретению и не предназначено для ограничения объема существенного технического содержания настоящего изобретения. Существенное техническое содержание настоящего изобретения широко определено в рамках формулы изобретения, прилагаемой к настоящей заявке. Любой технический объект или способ, осуществленный другими лицами, должен считаться попадающим в объем формулы изобретения настоящей заявки, если объект или способ полностью идентичен с тем, что определено в формуле изобретения настоящей заявки или является эквивалентной заменой или модификацией.
Изобретение относится к биохимии и биотехнологии и представляет собой штамм Colephoma empetri, депонированный в CGMCC с учетным номером CGMCC 4129, продуцирующий антибиотики с высоким выходом. Полученный штамм имеет стабильные генетические и продуцирующие свойства, производит мало примесей при ферментации и подходит для применения в промышленном производстве. Изобретение позволяет расширить ассортимент штаммов для продукции антибиотиков. 3 н. и 4 з.п. ф-лы, 2 табл., 2 пр.
1. Мутантный штамм Colephoma empetri для получения соединения формулы I, депонированный в Китайском Главном Центре Коллекционирования Микробиологических Культур (China General Microbiological Culture Collection Center) под учетным номером CGMCC 4129
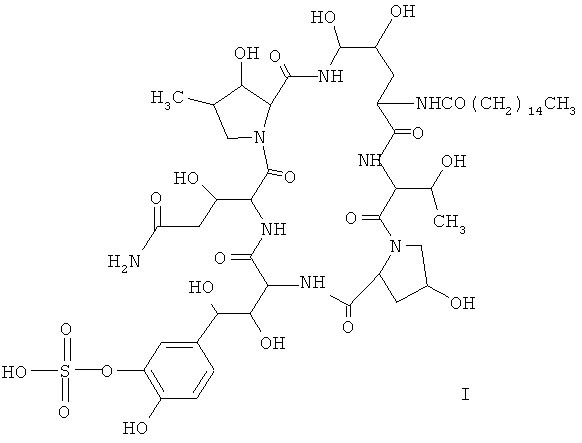
2. Применение мутантного штамма по п.1 для получения соединения формулы I.
3. Способ получения соединения формулы I, включающий следующую стадию: культивирование мутантного штамма по п.1 в ферментационной среде при температуре от 15 до 35°C с получением соединения формулы I.
4. Способ получения по п.3, где указанная ферментационная среда содержит следующие компоненты в расчете на общий объем ферментационной среды: жидкий кукурузный экстракт 5-20 г/л, мука из жмыха семян хлопчатника 5-30 г/л, дрожжевой экстракт 6-15 г/л, крахмал 10-80 г/л, глюкоза 5-20 г/л, неорганические соли 1,5-15 г/л, микроэлементы 10-50 г/л.
5. Способ получения по п.3, где указанная неорганическая соль выбрана из фосфата или сульфата или их комбинации.
6. Способ получения по п.3, где инокуляционный объем указанного мутантного штамма по п.1 составляет от 4 до 10 об.%, в расчете на общий объем ферментационной среды.
7. Способ получения по п.3, где исходное значение pH указанной ферментационной среды составляет от 5,5 до 6,5.
| US 6730776 B1, 04.05.2004 | |||
| KANDA M | |||
| et.al | |||
| Устройство для смены шпал | 1979 |
|
SU901379A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ШТАММ AMYCOLATOPSIS ORIENTALIS SUBSP. EREMOMYCINI ВКПМ-S892 - ПРОДУЦЕНТ АНТИБИОТИКА ЭРЕМОМИЦИНА И СПОСОБ ПОЛУЧЕНИЯ АНТИБИОТИКА ЭРЕМОМИЦИНА | 1997 |
|
RU2110578C1 |
Авторы
Даты
2015-08-20—Публикация
2011-12-15—Подача