Изобретение относится к активной (иммуностимулирующей) композиции, включающей по крайней мере одну РНК, предпочтительно мРНК, кодирующую по крайней мере два (предпочтительно различных) антигена, способных индуцировать (приобретенный) иммунный ответ у млекопитающего, причем антигены выбирают из группы, включающей простат-специфический антиген (ПСА), простат-специфический мембранный антиген (ПСМА), антиген стволовых клеток предстательной железы (АСКП) и шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП). Настоящее изобретение, кроме того, относится к вакцине, включающей указанную активную (иммуностимулирующую) композицию, а также к применению указанной активной (иммуностимулирующей) композиции (для получения вакцины) и/или вакцины для индуцирования (приобретенного) иммунного ответа для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. Наконец, настоящее изобретение относится к наборам, прежде всего, к наборам компонентов, включающим активную (иммуностимулирующую) композицию и/или вакцину.
В настоящее время рак предстательной железы является вторым из наиболее часто диагностированных типов рака и четвертой из наиболее распространенных причин связанного с раком летального исхода у мужчин в развитых странах всего мира. Способы терапевтического лечения недостаточно эффективны, и в настоящее время лечению поддается только локализованное заболевание. Установлено, что при гормонорезистентном раке предстательной железы существующие агенты продлевают жизнь на период не более приблизительно 1 год (см., например, Pavlenko M., Roos А.K. и др., «A phase I trial of DNA vaccination with a plasmid expressing prostate-specific antigen in patients with hormone-refractory prostate cancer», Br. J. Cancer, 91 (4), cc.688-694 (2004)). В некоторых высоко развитых западных странах, таких как Соединенные Штаты Америки, в настоящее время рак предстательной железы является даже наиболее часто диагностированной злокачественной опухолью и третьей из самых распространенных причин связанного с раком летального исхода среди мужчин в Соединенных Штатах (см., например, Jemal A., Siegel R. и др., «Cancer statistics, 2006», СА Cancer J. Clin., 56 (2), cc.106-130 (2006)) и в Европе, соответственно (см., например, Thomas-Kaskel А.K., Waller С.F. и др., «Immunotherapy with dendritic cells for prostate cancer». Int. J. Cancer, 121 (3), cc.467-473 (2007)). Большинство диагностированных опухолей представляют собой аденокарциномы, которые сначала пролиферируют гормонозависимым способом.
Рак предстательной железы развивается в предстательной железе, железе мужской репродуктивной системы. Он развивается, когда клетки предстательной железы подвергаются мутациям и начинают бесконтрольно размножаться. Было установлено, что типичные антигены, сверхэкспрессируемые клетками рака предстательной железы по сравнению с нормальными аналогами, представляют собой, в том числе антигены, такие как ПСА, ПСМА, РАР, АСКП, HER-2 и Ер-САМ. Указанные клетки рака предстательной железы распространяются (метастазируют) из предстательной железы в другие отделы организма, прежде всего, в костную ткань и лимфатические узлы. Рак предстательной железы вызывает боль, затруднение при мочеиспускании, эректильную дисфункцию и другие симптомы. Обычно рак предстательной железы развивается в большинстве случаев у мужчин старше пятидесяти лет, которые представляют собой наиболее распространенную группу пациентов. Однако наиболее часто рак предстательной железы не диагностируется, даже если его выявление возможно. Диагностику рака предстательной железы обычно проводят при физическом осмотре или по результатам анализов крови, таких как анализ на простат-специфический антиген (ПСА). При подозрении на рак предстательной железы диагноз рака обычно подтверждают при удалении кусочка предстательной железы (биопсии) и проведении его анализа под микроскопом. Для определения распространения рака предстательной железы можно проводить другие исследования, такие как рентгенография и остеосцинтиграфия.
Лечение рака предстательной железы все еще остается нерешенной проблемой. Для лечения рака предстательной железы можно использовать стандартные методы лечения, такие как хирургия, лучевая терапия, гормональная терапия, периодически проводимая химиотерапия, протонная терапия или некоторые комбинации указанных способов лечения. Однако при определении исхода заболевания важную роль играют возраст и общее состояние здоровья мужчины, а также степень распространения, внешние признаки, наблюдаемые под микроскопом, а также ответная реакция рака на начальное лечение. В связи с тем, что рак предстательной железы является заболеванием, которое обычно диагностируют у мужчин пожилого возраста, многие умирают вследствие других причин до распространения медленно прогрессирующего рака предстательной железы или проявления симптомов, что приводит к трудностям при выборе лечения. Решение о лечении локализованного рака предстательной железы (опухоли, которая присутствует в предстательной железе) с направленным на излечение вмешательством или об отказе от него принимают пациенты, выбирая между ожидаемыми пользой и отрицательными действиями, которые могут снизить продолжительность жизни и качество жизни.
Однако все указанные выше способы лечения, такие как хирургия, лучевая терапия, гормональная терапия и химиотерапия и т.п., характеризуются серьезными ограничениями. Например, хирургическое удаление предстательной железы, или простатэктомия, является распространенным способом лечения первичного рака предстательной железы, а также рака, который не поддается лечению лучевой терапией. Хирургическое удаление может вызвать повреждение нерва, что значительно ухудшает качество жизни. Наиболее распространенными серьезными осложнениями являются потеря контроля над мочеиспусканием и импотенция. Однако, даже при удачном удалении опухоли предстательной железы, распространение рака предстательной железы в организме остается нерешенной проблемой.
При лечении рака предстательной железы обычно применяют лучевую терапию. Ее можно использовать вместо хирургии на ранних стадиях рака, а также на более поздних стадиях прогрессирования рака предстательной железы для лечения метастазирования, вызывающего боль в костной ткани. Лучевое лечение можно также комбинировать с гормональной терапией при заболевании средней степени тяжести, когда при применении лучевой терапии в отдельности существует меньшая вероятность излечения рака. Однако лучевая терапия также характеризуется высоким риском и в большинстве случаев приводит к полной потере иммунной защиты вследствие разрушения иммунной системы пациента. Кроме того, лучевую терапию обычно применяют локально на участке роста опухоли и, таким образом, нельзя исключить вероятность распространения рака предстательной железы в организме. При систематическом применении лучевая терапия может привести к тяжелым повреждениям клеток и иммунной системы.
Химиотерапию в течение длительного времени рассматривали в качестве менее эффективного способа лечения рака предстательной железы, так как только малая часть пациентов чувствительна к такому способу лечения. Однако на некоторых пациентов (с ответной реакцией) с диагнозом метастазирующей карциномы предстательной железы химиотерапия оказывает благоприятное действие. Доля пациентов, чувствительных к такому лечению, составляет приблизительно 20%, и, в связи с этим, химиотерапия целесообразна при лечении рецидива опухоли, а также в случае неудачного применения гормональной терапии. Однако химиотерапия обычно только временно ослабляет заболевание и не приводит к полному устранению рака предстательной железы у пациента. Типичные химиотерапевтические агенты включают циклофосфамид, доксорубицин, 5-фторурацил, адриамицин, сурамин и другие агенты, однако ни один из указанных агентов не обеспечивает значительного продления жизни пациентов. Недавно в 2004 г. были опубликованы данные в New England Journal of Medicine, и было установлено, что продолжительность жизни пациентов, принимающих дозы доцетаксела каждые три недели, увеличивается в среднем на 2,5 месяца.
При гормональной терапии обычно используют лекарственные средства или комбинацию гормональной терапии и хирургии для блокирования доступа дигидротестостерона (ДГТ) в опухолевые клетки предстательной железы, гормона, продуцируемого в предстательной железе, который требуется для роста и распространения большинства опухолевых клеток предстательной железы. Блокирование ДГТ в большинстве случаев вызывает остановку роста опухоли предстательной железы, и даже уменьшение размера опухоли. Однако гормональная терапия в редких случаях излечивает рак предстательной железы, так как рак, который сначала чувствителен к действию гормональных лекарственных средств, обычно через один-два года становится резистентным. Например, паллиативное антиандрогенное лечение может вызвать ремиссию у 80% пациентов, но через 15-20 месяцев клетки опухоли становятся гормон-нечувствительными, и развивается андроген-независимый рак предстательной железы. В этом случае существует слишком мало способов лечения, например, эффективность химиотерапии ограничена (см. выше). В связи с этим, гормональную терапию обычно применяют, если рак распространяется за пределы предстательной железы. Ее также назначают некоторым мужчинам, прошедшим курс лучевой терапии или после хирургического вмешательства с целью исключить рецидив рака.
В связи с этим существует острая необходимость в альтернативных способах лечения пациентов с обычным, а также рецидивирующим раком предстательной железы или прогрессирующим раком предстательной железы. В качестве одного подхода описанные выше стандартные способы лечения рака предстательной железы, локализованного в одном органе, включая радикальную простатэктомию или лучевую терапию, такую как внешнее излучение и близкофокусная лучевая терапия, в некоторых случаях включают также неоадъювантно- или адъювантно-гормональную терапию (см., например, Totterman Т.Н., Loskog А. и др., «The immunotherapy of prostate and bladder cancer», BJU Int., 96 (5), cc.728-735 (2005)). Хотя указанные способы лечения являются относительно эффективными в течение короткого периода времени, у значительной части пациентов (30-40%) с исходно локализованным заболеванием в итоге наблюдается рецидив. В случае метастазирующего рака предстательной железы основным лечением является подавление андрогенов. Хотя указанное лечение обычно обеспечивает клеточную редукцию и временное ослабление заболевания, прогрессирование гормонорезистентного заболевания обычно происходит в течение 14-20 месяцев. В данной области химиотерапии проведено множество клинических испытаний лечения прогрессирующего андроген-независимого рака предстательной железы. Только недавно в ходе двух испытаний было установлено, что химиотерапия в минимальной степени продлевает жизнь пациентов с гормонорезистентным заболеванием.
В основном, описанные выше стандартные методы лечения, такие как упомянутая выше хирургия, лучевая терапия, гормональная терапия, периодически проводимая химиотерапия, протонная терапия и т.п., при использовании в отдельности, по-видимому, не пригодны для эффективного лечения рака предстательной железы (РПЖ). В связи с этим усовершенствованный способ лечения может включать указанные способы лечения или другие способы лечения, которые могут повысить эффективность указанных стандартных методик. Таким образом, в данном контексте предполагается использовать приобретенный иммунитет в ходе основного лечения или поддерживающего лечения рака предстательной железы (РПЖ).
Как известно в данной области, иммунная система играет важную роль в лечении и профилактике многочисленных заболеваний. В настоящем уровне техники известны различные механизмы защиты организма млекопитающих за счет идентификации и уничтожения, например, опухолевых клеток. Согласно настоящему изобретению указанные опухолевые клетки необходимо детектировать и отличать от нормальных (здоровых) клеток и тканей организма.
Иммунная система позвоночных, таких как человек, включает множество типов белков, клеток, органов и тканей, которые взаимодействуют в чрезвычайно сложной динамической системе. В качестве части указанного комплексного иммунного ответа система позвоночных со временем приспосабливается более эффективно распознавать конкретные патогены или опухолевые клетки. В процессе адаптации формируется иммунологическая память и обеспечивается даже более эффективная защита в ходе следующих столкновений. Указанный адаптационный или приобретенный иммунитет создает основу для разработки стратегии вакцинации.
Приобретенный иммунитет является антиген-специфическим, т.е. специфически распознает «собственные» или «чужие» антигены в ходе процесса, называемого презентацией антигена. Антигенная специфичность обеспечивает выработку ответных реакций, которые предназначены для идентификации специфических патогенов или инфицированных патогенами клеток, или опухолевых клеток. Способность усиливать указанные специфические ответные реакции поддерживается в организме так называемыми «клетками памяти». При повторном инфицировании организма патогеном указанные специфические клетки памяти используются для быстрого уничтожения патогена. В связи с этим, приобретенный иммунитет обеспечивает более сильный иммунный ответ, а также иммунологическую память, в которой каждый патоген или опухолевая клетка «запоминается» по одному или более характерных антигенов.
Главные компоненты приобретенного иммунитета у позвоночных предпочтительно включают на клеточном уровне лимфоциты, а на молекулярном уровне - антитела. Лимфоциты в качестве клеточных компонентов приобретенного иммунитета включают В-клетки и Т-клетки, которые образуются из кроветворных стволовых клеток костного мозга. В-клетки принимают участие в гуморальном ответе, в то время как Т-клетки вовлечены в опосредованный клетками иммунный ответ. В-клетки и Т-клетки включают рецепторные молекулы, которые распознают специфические мишени. Т-клетки распознают «чужую» мишень, такую как патогенная структура-мишень, только после процессинга и презентации антигенов (например, небольших фрагментов патогена) в комбинации с «собственным» рецептором, называемым молекулой главного комплекса гистосовместимости (ГКГ). И наоборот, антиген-специфический рецептор В-клеток представляет собой молекулу антитела на поверхности В-клеток и распознает патогены как таковые, когда антитела на поверхности В-клеток связываются со специфическим чужеродным антигеном. Указанный комплекс антиген/антитело поглощается В-клеткой и подвергается протеолизу (процессингу), при этом образуются пептиды. Затем В-клетка презентирует указанные антигенные пептиды на поверхности молекулы ГКГ класса II. Указанная комбинация ГКГ и антигена притягивает соответствующую Т-клетку-хелпер, которая высвобождает лимфокины и активирует В-клетку. Затем активированная В-клетка начинает делиться, ее потомок секретирует миллионы копий антитела, которое распознает указанный антиген. Указанные антитела циркулируют в плазме крови и лимфе, связываются с патогенами или опухолевыми клетками, экспрессирующими антиген, и маркируют их для деструкции при активации комплемента или для поглощения и деструкции фагоцитами. Цитотоксические Т-клетки (CD8+) в качестве клеточного компонента приобретенного иммунитета также индуцируют ответ цитотоксических Т-лимфоцитов (ЦТЛ). Цитотоксические Т-клетки (CD8+) распознают пептиды из эндогенных патогенов и собственные антигены, связанные с молекулами ГКГ типа I. CD8+ Т-клетки выполняют киллерную функцию за счет высвобождения цитотоксических белков в клетку.
Таким образом, механизмы иммунной системы могут формировать мишени для эффективного лечения различных заболеваний. Соответствующие способы обычно основаны на введении адъювантов для индуцирования врожденного иммунитета или на введении антигенов или иммуногенов для индуцирования приобретенного иммунного ответа. Поскольку антигенами обычно являются специфические компоненты патогенов (например, поверхностные белки) или их фрагменты, можно также вводить пациенту нуклеиновые кислоты с последующей экспрессией требуемых полипептидов, белков или антигенов.
Например, результаты клинических испытаний вакцинации, основанной на известных антигенах, связанных с предстательной железой, проведенных группой Noguchi и др. в 2003 г. и 2004 г. (см., например, статьи Noguchi M., Itoh K. и др., «Phase I trial of patient-oriented vaccination in HLA-A2-positive patients with metastatic hormone-refractory prostate cancer», Cancer Sci., 95 (1), cc.77-84 (2004) и Noguchi M., Kobayashi K. и др., «Induction of cellular and humoral immune responses to tumor cells and peptides in HLA-A24 positive hormone-refractory prostate cancer patients by peptide vaccination», Prostate, 57 (1), cc.80-92 (2003)), которые проводили в две фазы I с использованием мультипептидной вакцины с участием пациентов с метастазирующим гормонорезистентным раком предстательной железы, показали, что в ходе лечения наблюдается как повышенный клеточный, так и гуморальный иммунный ответ на выбранные мишени. Вакцинация безопасна, характеризуется достаточно высокой переносимостью и отсутствием значительного токсического действия. Однако при этом наблюдается также стабилизация или снижение концентраций простат-специфического антигена (ПСА) и только у одного пациента наблюдалось исчезновение метастаз в костной ткани. Главное ограничение указанного подхода, которое вызывает проблемы при его применении в клинике, заключается в необходимости получения предварительной информации о гаплотипе антиген-лейкоцитов человека (АЛЧ), а также об экспрессии пептидов опухолевыми клетками предстательной железы.
В некоторых других недавно разработанных подходах используют вакцинацию на основе клеток, например, для вакцинации используют различные антигены или используют дендритные клетки, нагруженные различными антигенами или их фрагментами. Например, описаны клинические испытания вакцинации пациентов с диагнозом рака предстательной железы аутологическими дендритными клетками, нагруженными импульсным рекомбинантным ПСА человека (см., например, Barrou В., Benoit G. и др., «Vaccination of prostatectomized prostate cancer patients in biochemical relapse, with autologous dendritic cells pulsed with recombinant human PSA», Cancer Immunol. Immunother., 53 (5), cc.453-460 (2004)). При вакцинации пациентов с диагнозом прогрессирующего рака предстательной железы дендритными клетками, нагруженными пептидами АСКП и ПСА, у 5-10 пациентов вырабатывается иммунный ответ по крайней мере на один антиген (см., например, Thomas-Kaskel А.K., Zeiser R. и др., «Vaccination of advanced prostate cancer patients with PSCA and PSA peptide-loaded dendritic cells induces DTH responses that correlate with superior overall survival». Int. J. Cancer, 119(10), cc.2428-2434 (2006)).
Другим примером является вакцинация пациентов с диагнозом рака предстательной железы, проведенная группой Murphy и др. (1996), в соответствующей клинической фазе I с использованием двух эпитопов ПСМА HLA-A*0201S по сравнению с вакцинацией пептидом в отдельности или с использованием импульсных ДК. Результаты свидетельствуют о том, что в случае вакцинации импульсными ДК ответ наблюдается у большинства пациентов. В результате указанных испытаний было установлено, что вакцинация ДК, нагруженными пептидами или белками, вызывает по крайней мере частично, детектируемый иммунный ответ, а также временное снижение или стабилизацию АСКП (см., например, Murphy G., Tjoa В. и др., «Phase I clinical trial: T-cell therapy for prostate cancer using autologous dendritic cells pulsed with HLA-A0201-specific peptides from prostate-specific membrane antigen», Prostate, 29 (6), cc.371-380 (1996)).
Вакцинацию пациентов с диагнозом рака предстательной железы можно также проводить с использованием комбинаций пептидов, которыми нагружают дендритные клетки, например, с использованием дендритных клеток, нагруженных смесью пептидов (см., например, Fuessel S., Меуе А. и др., «Vaccination of hormone-refractory prostate cancer patients with peptide cocktail-loaded dendritic cells: results of a phase I clinical trial», Prostate, 66 (8), cc.811-821 (2006)). Смесь включает пептиды ПСА, ПСМА, сурвивина, простеина и Trp-р8 (транзиторный рецепторный потенциал р8). Клинические испытания проводили также с использованием основанной на дендритных клетках мультиэпитопной иммунотерапии гормонорезистентной карциномы предстательной железы (см., например, Waeckerle-Men Y., Uetz-von Allmen E. и др., «Dendritic cell-based multi-epitope immunotherapy of hormone-refractory prostate carcinoma», Cancer Immunol. Immunother., 55 (12), cc.1524-1533 (2006)), а также проводили испытания вакцинации против гормонорезистентной карциномы предстательной железы пептидами АСКП, простатической кислой фосфатазой (ПКФ), ПСМА и ПСА.
Хотя вакцинация антигенными белками или пептидами, например, которыми нагружены дендритные клетки, является стандартным способом индуцирования иммунного ответа, для включения требуемой генетической информации в клетку в основе иммунизации или вакцинация можно также использовать нуклеиновые кислоты. В основном, для введения нуклеиновых кислот разработаны различные способы, такие как кальций-фосфатная трансфекция, полипреновая трансфекция, слияние протопластов, электропорация, микроинъекция и липофекция, причем было установлено, что пригодным способом, прежде всего, является липофекция.
В качестве одного примера можно привести способ лечения рака предстательной железы при вакцинации, основанной на трансфекции дендритных клеток общей РНК, полученной из аутологической опухоли (см., например, Heiser A., Coleman D. и др., «Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors», J. Clin. Invest., 109 (3), cc.409-417 (2002)). Преимущество указанной стратегии заключается в использовании в качестве мишени многочисленных специфических опухоль-ассоциированных антигенов (ОАА) АЛЧ класса I и класса II у пациентов без проведения предварительного типирования АЛЧ. Кроме того, в качестве мишеней в данной стратегии можно использовать даже стромальные антигены, так как мРНК получают из хирургических образцов, а не из опухолевых клеточных линий. Например, группой Heiser и др. разработана методика иммунотерапии на основе ДК, которые трансфектируют мРНК, кодирующей ПСА. Вакцинация характеризуется достаточно высокой переносимостью и индуцирует повышенный Т-клеточный ответ на ПСА. Однако указанные вакцины на основе ДК против рака предстательной железы, по-видимому, генерируют значительный Т-клеточный ответ, который может сопровождаться клинической ответной реакцией, хотя частота регистрации таких симптомов все еще остается неудовлетворительной.
В стратегии вакцинации для включения требуемой генетической информации в клетку в качестве нуклеиновой кислоты можно также использовать ДНК. В конкретном примере в качестве носителя ДНК используют вирусную ДНК. Благодаря своим инфекционным свойствам указанные вирусы характеризуются чрезвычайно высокой скоростью трансфекции. Используемые вирусы обычно генетически модифицируют таким образом, чтобы в трансфектированной клетке не образовались функциональные инфекционные частицы. Например, клинические испытания в фазе I проводили с использованием рекомбинантного вируса коровьей оспы, экспрессирующего ПСА. Авторами было установлено, что наблюдается Т-клеточный иммунный ответ на ПСА, а также стабилизация сывороточного ПСА у выбранных пациентов (см., например, Eder J.P., Kantoff P.W. и др., «A phase I trial of a recombinant vaccinia virus expressing prostate-specific antigen in advanced prostate cancer», Clin. Cancer Res., 6 (5), cc.1632-1638 (2000)). Воспалительная ответная реакция, индуцируемая высоко иммуногенными пептидами рекомбинантного вируса, может усиливать иммуногенность чужеродного белка, но было установлено, что иммунная система снижает репликацию рекомбинантного вируса и таким образом ограничивает эффективность применения в клинике. Хотя в ходе нескольких испытаний установлена иммуногенность рекомбинантных вакцин и доказана ответная реакция опухоли, указанные результаты тем не менее нуждаются в подтверждении.
Согласно другому подходу вакцинацию пациентов с диагнозом гормонорезистентного рака предстательной железы проводят плазмидными ДНК, экспрессирующими ПСА (см., например, статью Pavlenko M., Roos А.K. и др., «A phase I trial of DNA vaccination with a plasmid expressing prostate-specific antigen in patients with hormone-refractory prostate cancer», Br. J. Cancer, 91 (4), cc.688-694 (2004)). Было также установлено, что терапевтическая и профилактическая вакцинация плазмидой или вирусоподобным репликоном, кодирующим шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП), увеличивает продолжительность жизни мышей с привитыми опухолями (см., например, Garcia-Hernandez Mde L., Gray А. и др., «In vivo effects of vaccination with six-transmembrane epithelial antigen of the prostate: a candidate antigen for treating prostate cancer», Cancer Res., 67 (3), cc.1344-1351 (2007)). Недавно было установлено, что ШТЭАП является белком-индикатором прогрессирующего рака предстательной железы человека и характеризуется значительной сверхэкспрессией при раке предстательной железы человека. Его функция в настоящее время еще не определена.
Хотя ДНК используют в качестве носителя генетической информации, тем не менее нельзя исключить риск неконтролируемой репродукции введенного гена или вирусных генов, например, за счет возможной рекомбинации. В связи с этим, существует также риск, связанный с включением ДНК в интактный ген генома клетки-хозяина, например, рекомбинацией, при этом возможна мутация указанного гена, который в связи с этим полностью или частично инактивируется или содержит искаженную информацию. Другими словами, синтез генного продукта, который жизненно необходим клетке, полностью подавляется, или, в другом варианте, экспрессируется модифицированный генный продукт или генный продукт с неправильной информацией. Особый риск возникает, если ДНК внедряют в ген, который принимает участие в регуляции роста клеток. В этом случае клетка-хозяин дегенерирует, что приводит к развитию рака или образованию опухоли. Кроме того, если ДНК вводят в клетку с целью ее экспрессии, необходимо, чтобы соответствующий носитель ДНК содержал сильный промотер, такой как вирусный промотер ЦМВ. Интеграция указанных промотеров в геном обрабатываемой клетки приводит к нежелательным изменениям регуляции генной экспрессии в клетке. Другой риск использования ДНК в качестве агента для индуцирования иммунного ответа (например, в качестве вакцины) заключается в индуцировании патогенных антител против ДНК у пациента, которому введена чужеродная ДНК, что может вызвать иммунный ответ (возможно летальный).
Подводя итог, результаты описанных выше подходов, несомненно, свидетельствуют о достижении определенного прогресса в лечении рака предстательной железы (РПЖ), тем не менее, при данном высоком уровне смертности, существует острая необходимость в других, альтернативных или усовершенствованных способах лечения.
В связи с этим в настоящее время существует возможность и необходимость создания эффективной системы, которую можно использовать, чтобы обеспечить эффективную стимуляцию иммунной системы для лечения рака предстательной железы (РПЖ) и при этом исключить проблемы неконтролируемой репродукции введенного гена, вызванной ДНК в составе композиций.
В связи с этим в объекте настоящего изобретения предлагается композиция, которая а) обеспечивает лечение РПЖ за счет стимуляции иммунной системы, в то время как б) исключаются упомянутые выше недостатки.
Объектом настоящего изобретения является прежде всего активная (иммуностимулирующая) композиция, включающая по крайней мере одну РНК, кодирующую по крайней мере два, три или даже четыре (предпочтительно различных) антигена, выбранных из группы, включающей следующие антигены:
- простат-специфический антиген ((ПСА), калликреин-3 (КЛК3)),
- простат-специфический мембранный антиген (ПСМА),
- антиген стволовых клеток предстательной железы (АСКП),
- шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП).
Неожиданно было установлено, что специфическая комбинация по крайней мере двух антигенов, антигенных белков или антигенных пептидов из упомянутой выше группы, предпочтительно двух, трех или четырех указанных антигенов, антигенных белков или антигенных пептидов, в составе активной (иммуностимулирующей) композиции по настоящему изобретению, эффективно стимулирует (приобретенный) иммунитет, что позволяет лечить РПЖ, предпочтительно неоадъювантно- и/или гормонорезистентный рак предстательной железы, а также родственные заболевания или нарушения. В данном контексте термины антигены, антигенные белки или антигенные пептиды являются синонимами. В контексте настоящего изобретения активная (иммуностимулирующая) композиция по настоящему изобретению, кроме того, включает композицию, которая индуцирует иммунный ответ, предпочтительно приобретенный иммунный ответ, как определено выше, за счет действия одного компонента (ов), который содержится в активной (иммуностимулирующей) композиции или кодируется компонентами активной (иммуностимулирующей) композиции, предпочтительно по крайней мере одной РНК, предпочтительно мРНК, кодирующей по крайней мере два (предпочтительно различных) антигена.
Было установлено, что антигены, такие как ПСА, ПСМА и АСКП, сверхэкспрессируются опухолевыми клетками предстательной железы по сравнению с нормальными аналогами. В связи с этим, указанные антигены представляют собой возможные мишени для иммунотерапии (см., например, статью Marrari A., Iero M. и др., «Vaccination therapy in prostate cancer», Cancer Immunol. Immunother., 56 (4), cc.429-445 (2007)).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции кодирует ПСА. В контексте настоящего изобретения термин «ПСА» обозначает «простат-специфический антиген», известный в литературе также как калликреин-3 (КЛКЗ). ПСА является белком с молекулярной массой 33 кДа и представляет собой калликреин-подобную регулируемую андрогенами сериновую протеазу, которая продуцируется исключительно эпителиальными клетками ткани предстательной железы всех типов, доброкачественными и злокачественными. Прежде всего, ПСА экспрессируется на высоком уровне нормальными эпителиальными клетками предстательной железы и представляет собой один из наиболее характерных опухоль-ассоциированных антигенов рака предстательной железы. На физиологическом уровне ПСА присутствует в семенной жидкости при высокой концентрации и расщепляет высокомолекулярный белок, ответственный за коагуляцию семенной жидкости, с образованием более мелких полипептидов. Указанное действие приводит к разжижению коагулята. ПСА присутствует также в сыворотке и его можно определять методом моноклонального иммунорадиометрического анализа или поликлонального радиоиммуноанализа. В настоящее время ПСА является наиболее широко распространенным опухолевым маркером, используемым для анализа, диагностики и мониторинга рака предстательной железы. Прежде всего, для определения ПСА в сыворотке широкое клиническое применение находят некоторые типы иммуноанализа. Недавно разработан анализ цепной реакции полимеризации с использованием обратной транскриптазы (ОТ-ПЦР) для определения мРНК ПСА в сыворотке. Однако ПСА нельзя использовать в качестве специфического маркера заболевания, так как повышенные концентрации ПСА регистрируются у значительного процента пациентов с диагнозом гиперплазии предстательной железы (ГПЖ) и простатита (25-86%) (Gao и др., Prostate, 31, cc.264-281 (1997)), а также при других доброкачественных нарушениях и у некоторых здоровых мужчин, что является фактором, который значительно ограничивает диагностическую специфичность указанного маркера. В контексте настоящего изобретения предпочтительная последовательность по крайней мере одной РНК, предпочтительно мРНК, кодирующей ПСА, при использовании в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит или включает последовательность, депонированную с кодом NM_001648, более предпочтительно, содержит или включает последовательность, представленную на фиг.1 (SEQ ID NO:1), и наиболее предпочтительно по крайней мере одна РНК, кодирующая ПСА, содержит или включает кодирующую последовательность, представленную на фиг.2 или на фиг.3 (SEQ ID NO:2 или 3). Согласно другому предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции в альтернативном или в дополнительном варианте кодирует антигенную последовательность ПСА, выбранную из фрагмента, варианта или эпитопа последовательности ПСА, депонированной с кодом NM_001648, или представленной на фиг.1, фиг.2 или фиг.3 (SEQ ID NO:1, 2 или 3).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции кодирует ПСМА. В контексте настоящего изобретения термин «ПСМА» обозначает простат-специфический мембранный антиген или так называемую фолатгидролазу 1 (ФОЛГ-1) или «ПСМ». ПСМА представляет собой трансмембранный гликопротеин типа II с молекулярной массой 100 кДа, при этом экспрессия ПСМА в значительной степени ограничена тканями предстательной железы, но регистрируемые концентрации мРНК ПСМА наблюдаются в головном мозге, слюнной железе, тонкой кишке, а также в почечно-клеточной карциноме (Israeli и др., Cancer Res., 53, cc.227-230 (1993)). ПСМА на высоком уровне экспрессируется в большинстве случаев первичного и метастазирующего рака предстательной железы, но также экспрессируется в большинстве нормальных внутриэпителиальных неопластических образований (Gao и др. (1997), см. выше). Прежде всего, ПСМА на высоком уровне экспрессируется в опухолевых клетках предстательной железы и в не относящейся к предстательной железе сосудистой системе солидных опухолей, а также представляет собой мишень для визуализации рака и противораковых терапевтических агентов. ПСМА выполняет функцию глутаматкарбоксипептидазы (GCPII) при действии на низкомолекулярные субстраты, включая фолат, противораковое лекарственное средство метотрексат, а также на нейропептид N-ацетил-L-аспартил-L-глутамат. Было установлено, что при раке предстательной железы экспрессия ПСМА коррелирует с прогрессированием заболевания, при этом наиболее высокие уровни экспрессии наблюдаются при гормонорезистентном и метастазирующем заболевании. В клетках ПСМА находится в цитоплазме и/или мембранах. ПСМА считается биомаркером рака предстательной железы (РПЖ) и в настоящее время его интенсивно исследуют для применения в качестве мишени для визуализации и лечения. В контексте настоящего изобретения предпочтительная последовательность по крайней мере одной РНК, предпочтительно мРНК, кодирующей ПСМА, при использовании в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит или включает последовательность, депонированную с кодом NM_004476, более предпочтительно, содержит или включает последовательность, представленную на фиг.4 (SEQ ID NO:4), и наиболее предпочтительно по крайней мере одна РНК, кодирующая ПСМА, содержит или включает кодирующую последовательность, представленную на фиг.5 или фиг.6 (SEQ ID NO:5 или 6). Согласно другому предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции в альтернативном или в дополнительном варианте кодирует антигенную последовательность ПСМА, выбранную из фрагмента, варианта или эпитопа последовательности ПСМА, депонированной с кодом NM_004476, или представленной на фиг.5 или фиг.6 (SEQ ID NO:5 или 6).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции кодирует АСКП. В контексте настоящего изобретения «АСКП» обозначает «антиген стволовых клеток предстательной железы». АСКП сверхэкспрессируется на всех стадиях развития рака предстательной железы, включая низкодифференцированную внутриэпителиальную неоплазию предстательной железы (PIN), андроген-зависимые и андроген-независимые опухоли предстательной железы. Ген АСКП характеризуется 30% гомологией по сравнению с антигеном-2 стволовых клеток, членом семейства Thy-I/Ly-6 антигенов, присоединенных к клеточной поверхности через гликозилфосфатидилинозит (ГФИ), и кодирует белок, содержащий 123 аминокислотных остатка, N-концевую сигнальную последовательность, C-концевую последовательность, связанную с ГФИ, а также многочисленные участки N-гликозилирования. Экспрессия мРНК АСКП в значительной степени активируется с повышением активности в андроген-зависимом и андроген-независимом ксенотрансплантатах рака предстательной железы. При проведении анализа мРНК in situ установлено, что экспрессия АСКП локализована в базальных клетках эпителия, предполагаемом компартменте стволовых клеток в предстательной железе. Методом проточной цитометрии установлено, что АСКП предпочтительно экспрессируется на клеточной поверхности и присоединяется к ней через ГФИ. Методом анализа флуоресцентной гибридизации in situ установлено, что ген АСКП расположен в хромосоме 8q24. 2, области аллельного усиления, характерной для более 80% случаев рака предстательной железы. АСКП можно использовать в качестве маркера рака предстательной железы для распознавания злокачественного рака предстательной железы, нормальной предстательной железы и доброкачественной неоплазии. Например, при раке предстательной железы АСКП экспрессируется в чрезвычайно высоких концентрациях по сравнению с доброкачественной гиперплазией предстательной железы (ГПЖ). В контексте настоящего изобретения предпочтительная последовательность по крайней мере одной РНК, предпочтительно мРНК, кодирующей АСКП, при использовании в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит или включает последовательность, депонированную с кодом NM_005672, более предпочтительно, содержит или включает последовательность, представленную на фиг.7 (SEQ ID NO:7), и наиболее предпочтительно по крайней мере одна РНК, кодирующая АСКП, содержит или включает кодирующую последовательность, представленную на фиг.8 или на фиг.9 (SEQ ID NO:8 или 9). Согласно другому предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции в альтернативном или в дополнительном варианте кодирует антигенную последовательность АСКП, выбранную из фрагмента, варианта или эпитопа последовательности АСКП, депонированной с кодом NM_005672 или представленной на фиг.8 или фиг.9 (SEQ ID NO:8 или 9).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции кодирует ШТЭАП. В контексте настоящего изобретения «ШТЭАП» обозначает шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП), так называемый ШТЭАП-1. ШТЭАП или ШТЭАП-1 является новым белком клеточной поверхности и экспрессируется предпочтительно в ткани предстательной железы человека и в других распространенных злокачественных образованиях, включая карциному предстательной железы, мочевого пузыря, ободочной кишки и яичников, а также при саркоме Юинга, что указывает на функцию указанного белка в качестве практически универсального опухолевого антигена. Прежде всего, ШТЭАП в значительной степени экспрессируется при первичном раке предстательной железы, причем экспрессия в нормальных тканях снижена. Положительный результат при проведении анализа на ШТЭАП методом Карла Мейера (p равно 0,001) в образцах костного мозга с высокой точностью коррелирует с продолжительностью жизни при образовании новых метастаз. В контексте настоящего изобретения предпочтительная последовательность по крайней мере одной РНК, предпочтительно мРНК, кодирующей ШТЭАП (или ШТЭАП-1), при использовании в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит или включает последовательность, депонированную с кодом NM_012449, более предпочтительно, содержит или включает последовательность, представленную на фиг.10 (SEQ ID NO:10), и наиболее предпочтительно по крайней мере одна РНК, кодирующая ШТЭАП, содержит или включает кодирующую последовательность, представленную на фиг.11 или на фиг.12 (SEQ ID NO:11 или 12). Согласно другому предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции в альтернативном или в дополнительном варианте кодирует антигенную последовательность ШТЭАП, выбранную из фрагмента, варианта или эпитопа последовательности ШТЭАП, депонированной с кодом NM_012449, или представленной на фиг.11 или на фиг.12 (SEQ ID NO:11 или 12).
Антигены, антигенные белки или антигенные пептиды, как определено выше, которые кодируются по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, включают фрагменты или варианты указанных последовательностей. Указанные фрагменты или варианты обычно включают последовательность, гомология которой по сравнению с одним из упомянутых выше антигенов, антигенных белков или антигенных пептидов или по сравнению с одной из упомянутых выше последовательностей или по сравнению с последовательностями кодирующих их нуклеиновых кислот, составляет по крайней мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, предпочтительно по крайней мере 70%, более предпочтительно по крайней мере 80%, также более предпочтительно по крайней мере 85%, еще более предпочтительно по крайней мере 90% и наиболее предпочтительно по крайней мере 95% или даже 97% по сравнению с полноразмерной последовательностью дикого типа в отношении нуклеотидной или аминокислотной последовательности.
«Фрагменты» антигенов, антигенных белков или антигенных пептидов в контексте настоящего изобретения включают последовательность антигена, антигенного белка или антигенного пептида, как определено выше, которая по сравнению с аминокислотной последовательностью (или последовательностью кодирующей ее нуклеиновой кислоты) является укороченной по N-концевому фрагменту, C-концевому фрагменту и/или в середине последовательности по сравнению с аминокислотной последовательностью исходного (природного) белка (или последовательностью нуклеиновой кислоты, кодирующей указанный белок). Таким образом, указанное укорочение проводят в отношении аминокислотной или, соответственно, нуклеотидной последовательности. В связи с этим в отношении указанного фрагмента, как определено выше, гомология последовательности предпочтительно относится к полноразмерному антигену, антигенному белку или антигенному пептиду, как определено выше, или к полноразмерной последовательности нуклеиновой кислоты, кодирующей указанный антиген, антигенный белок или антигенный пептид.
Фрагменты антигенов, антигенных белков или антигенных пептидов в контексте настоящего изобретения, кроме того, включают последовательность антигена, антигенного белка или антигенного пептида, как определено выше, длина цепи которой составляет приблизительно от 6 до приблизительно 20 или более аминокислот, например, длина цепи фрагментов, которые подвергаются процессингу и презентации молекулами ГКГ класса I, предпочтительно составляет от приблизительно 8 до приблизительно 10 аминокислот, например, 8, 9 или 10 (или даже 6, 7, 11 или 12 аминокислот), или длина цепи фрагментов, которые подвергаются процессингу и презентации молекулами ГКГ класса II, предпочтительно составляет от приблизительно от 13 или более аминокислот, например 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислот, причем указанные фрагменты выбирают из любого участка аминокислотной последовательности. Указанные фрагменты обычно распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГ, т.е. фрагменты в природной форме обычно не распознаются.
Фрагменты антигенов, антигенных белков или антигенных пептидов, как определено выше, включают также эпитопы указанных антигенов, антигенных белков или антигенных пептидов. Эпитопы (также называемые «антигенные детерминанты») в контексте настоящего изобретения обычно обозначают фрагменты, расположенные на внешней поверхности (природных) антигенов, антигенных белков или антигенных пептидов, как определено в данном контексте, предпочтительно содержащие 5-15 аминокислот, более предпочтительно содержащие 5-12 аминокислот, еще более предпочтительно содержащие 6-9 аминокислот, которые распознаются антителами или рецепторами В-клеток, т.е. в природной форме. Указанные эпитопы антигенов, антигенных белков или антигенных пептидов, кроме того, выбирают из любых упомянутых в данном контексте вариантов указанных антигенов, антигенных белков или антигенных пептидов. В данном контексте антигенные детерминанты представляют собой конформационные или прерванные эпитопы, которые состоят из сегментов антигенов, антигенных белков или антигенных пептидов, как определено в данном контексте, которые включают прерванную аминокислотную последовательность антигенов, антигенных белков или антигенных пептидов, как определено в данном контексте, но объединены с образованием трехмерной структуры или непрерывных или линейных эпитопов, которые состоят из одной полипептидной цепи.
«Варианты» антигенов, антигенных белков или антигенных пептидов, как определено выше, кодируются по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, при этом нуклеиновые кислоты, кодирующие антиген, антигенный белок или антигенный пептид, как определено выше по крайней мере одна (м) РНК заменены. Таким образом, образуется антиген, антигенный белок или антигенный пептид, содержащий аминокислотную последовательность, которая отличается от исходной последовательности одной или более мутацией (ями), например, включает одну или более замен, вставок и/или делеций аминокислот. Предпочтительно, указанные фрагменты и/или варианты характеризуются одинаковой биологической функцией или специфической активностью по сравнению с полноразмерным природным антигеном или антигенным белком, например, специфическим антигенным свойством.
По крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению кодирует также антиген или антигенный белок, как определено выше, при этом кодируемая аминокислотная последовательность включает консервативные аминокислотные замены по сравнению с физиологической последовательностью. Термин «варианты», как определено выше, прежде всего, включает указанные кодируемые аминокислотные последовательности, а также кодирующие их нуклеотидные последовательности. Если аминокислоту одного класса заменяют на другую аминокислоту того же класса, то такие замены называют консервативными. Прежде всего указанными аминокислотами являются аминокислоты, включающие боковые алифатические цепи, положительно или отрицательно заряженные боковые цепи, ароматические группы в боковых цепях, или аминокислоты, боковые цепи которых образуют водородные связи, например, боковые цепи которых содержат гидроксильную функциональную группу. Указанное обозначает, например, что аминокислоту, содержащую боковую полярную цепь, заменяют на другую аминокислоту, также содержащую полярную боковую цепь, или, например, аминокислоту с гидрофобной боковой цепью, заменяют на другую аминокислоту, также содержащую гидрофобную боковую цепь (например, серин (треонин) заменяют на треонин (серии) или лейцин (изолейцин) заменяют на изолейцин (лейцин)). Вставки и замены, прежде всего, можно использовать в таких участках последовательности, которые не изменяют трехмерную структуру или не влияют на область связывания. Модификации трехмерной структуры за счет вставки (ок) или делеции (й) регистрируют, например, с использованием спектров кругового дихроизма (КД) (Urry, Absorption, Circular Dichroism and ORD of Polypeptides, в сборнике Modern Physical Methods in Biochemistry, ред. Neuberger и др., Elsevier, Амстердам (1985)).
Кроме того, варианты антигенов, антигенных белков или антигенных пептидов, как определено выше, которые кодирует по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, включают также последовательности, в которых нуклеиновые кислоты по крайней мере одна (м) РНК заменены в соответствии с вырожденным генетическим кодом, чтобы не изменить характерную аминокислотную последовательность антигена, антигенного белка или антигенного пептида, т.е. аминокислотная последовательность или по крайней мере ее часть не должна отличаться от исходной последовательности одной или более мутацией (ями), как определено выше.
Для определения процента гомологии (идентичности) двух последовательностей (нуклеотидных последовательностей, например, последовательностей РНК или мРНК, как определено в данном контексте, или аминокислотных последовательностей, предпочтительно кодируемых аминокислотных последовательностей, например аминокислотных последовательностей антигенов, антигенных белков или антигенных пептидов, как определено выше), последовательности совмещают, а затем выравнивают их между собой. Таким образом, в первую последовательность можно включать пробелы и сравнивать компонент в первой последовательности с компонентом в соответствующем положении второй последовательности. Если в одном и том же положении первой и второй последовательности присутствует один и тот же компонент, две последовательности идентичны в указанном положении. Процент гомологии двух последовательностей равен числу идентичных положений, деленному на общее число положений. Процент гомологии двух последовательностей определяют с использованием математического алгоритма. Предпочтительным, не ограничиваясь только им, примером математического алгоритма, который можно использовать, является алгоритм, описанный в статье Karlin и др., PNAS USA, 90, cc.5873-5877 (1993), или в статье Altschul и др., Nucleic Acids Res., 25, cc.3389-3402 (1997). Указанный алгоритм интегрирован в программу BLAST. Указанная программа позволяет идентифицировать последовательности, которые идентичны последовательностями по настоящему изобретению.
Активная (иммуностимулирующая) композиция по настоящему изобретению включает, как определено выше по крайней мере одну РНК, кодирующую по крайней мере два (предпочтительно различных) антигена, выбранных из антигенов указанной выше группы, так как специфическая комбинация по настоящему изобретению по крайней мере двух (предпочтительно различных) антигенов из упомянутой выше группы способна эффективно стимулировать иммунитет (приобретенный), что можно использовать для лечения рака предстательной железы (РПЖ). Однако в настоящем изобретении предлагаются также такие активные (иммуностимулирующие) композиции, которые включают по крайней мере одну РНК, кодирующую три или четыре (предпочтительно различных) антигена, выбранных из антигенов указанной выше группы, причем возможна любая комбинация указанных антигенов, и все возможные комбинации включены в объем настоящего изобретения.
Более предпочтительно, в настоящем изобретении предлагается также активная (иммуностимулирующая) композиция, включающая по крайней мере одну РНК, кодирующую по крайней мере три или четыре (предпочтительно различных) антигена, выбранных из антигенов указанной выше группы, причем возможна любая комбинация указанных антигенов.
Соответственно, в другом предпочтительном варианте по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению кодирует по крайней мере два (предпочтительно различных) антигена, выбранных из антигенов указанной выше группы, включающей (по крайней мере) одну следующую комбинацию антигенов:
- ПСА и ПСМА, или
- ПСА и АСКП, или
- ПСА и ШТЭАП, или
- ПСМА и АСКП, или
- ПСМА и ШТЭАП, или
- АСКП и ШТЭАП,
или
- ПСА, ПСМА и АСКП, или
- ПСА, ПСМА и ШТЭАП, или
- ПСМА, АСКП и ШТЭАП, или
- ПСА, АСКП и ШТЭАП, или
или
- ПСА, ПСМА, АСКП и ШТЭАП.
Согласно следующему предпочтительному варианту в настоящем изобретении предлагается активная (иммуностимулирующая) композиция, включающая по крайней мере одну РНК, кодирующую по крайней мере два, три или четыре (предпочтительно различных) антигена,
а) в которой по крайней мере один антиген выбран из:
- шестого трансмембранного эпителиального антигена предстательной железы (ШТЭАП), и
б) в которой другой антиген (ы) выбран (ы) по крайней мере из одного антигена из следующих специфических антигенов или их комбинаций:
- простат-специфического антигена (ПСА), или
- простат-специфического мембранного антигена (ПСМА), или
- антигена стволовых клеток предстательной железы (АСКП),
или
- ПСА и ПСМА, или
- ПСА и АСКП, или
- ПСМА и АСКП,
или
- ПСА, ПСМА и АСКП.
Согласно еще более предпочтительному варианту в настоящем изобретении предлагается активная (иммуностимулирующая) композиция, включающая по крайней мере одну РНК, кодирующую четыре (предпочтительно различных) антигена, выбранных из ПСА, ПСМА, АСКП и ШТЭАП.
По крайней мере, одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению обычно является любая РНК, предпочтительно, но, не ограничиваясь только ими, кодирующая РНК, циклическая или линейная РНК, одноцепочечная или двухцепочечная РНК (которая представляет собой РНК, образованную при нековалентном связывании двух одноцепочечных РНК), или частично двухцепочечная или частично одноцепочечная РНК, которые по крайней мере частично комплементарны (указанные частично двухцепочечная или частично одноцепочечная РНК включают более длинную и более короткую одноцепочечную РНК или две одноцепочечные РНК, длина которых приблизительно одинакова, при этом одна одноцепочечная молекула РНК частично комплементарна с другой одноцепочечной молекулой РНК, и, в связи с этим, в указанной области обе молекулы образуют двухцепочечную РНК, т.е. частично двухцепочечную или частично одноцепочечную РНК относительно полноразмерной последовательности РНК). Более предпочтительно по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению является одноцепочечная РНК, более предпочтительно линейная РНК. Наиболее предпочтительно по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению является матричная РНК (мРНК). В данном контексте матричная РНК (мРНК) обычно обозначает РНК, которая включает (по крайней мере) несколько структурных элементов, например, необязательную область 5'-UTR, расположенный слева участок связывания с рибосомой, за которым следует кодирующая область, необязательную область 3'-UTR, за которой следует полиА-концевой фрагмент (и/или полиС-концевой фрагмент).
В одном, прежде всего, предпочтительном варианте каждый по крайней мере один из двух (предпочтительно различных) антигенов в составе активной (иммуностимулирующей) композиции по настоящему изобретению кодируется одной (моноцистронной) РНК, предпочтительно одной (моноцистронной) мРНК. Другими словами, активная (иммуностимулирующая) композиция по настоящему изобретению включает по крайней мере две (моноцистронные) РНК, предпочтительно мРНК, причем каждая из двух указанных (моноцистронных) РНК, предпочтительно мРНК, кодирует только один (предпочтительно различный) антиген, выбранный из упомянутых выше групп или подгрупп, предпочтительно в одной из упомянутых выше комбинаций.
Согласно другому, прежде всего, предпочтительному варианту активная (иммуностимулирующая) композиция по настоящему изобретению включает (по крайней мере) одну би- или полицистронную РНК, предпочтительно мРНК, т.е. (по крайней мере) одну РНК, которая содержит две или более последовательности, кодирующие по крайней мере два (предпочтительно различных) антигена, выбранные из упомянутых выше групп или подгрупп, предпочтительно в одной из упомянутых выше комбинаций. Указанные последовательности (по крайней мере) одной би- или полицистронной РНК, кодирующие по крайней мере два (предпочтительно различных) антигена, разделены по крайней мере одной последовательностью участка внутренней посадки рибосомы (IRES), как определено ниже. Таким образом, термин «кодирующая по крайней мере два (предпочтительно различных) антигена» обозначает, но, не ограничиваясь только ими, что (по крайней мере) одна (би- или полицистронная) РНК, предпочтительно мРНК, кодирует, например по крайней мере два, три или четыре (предпочтительно различных) антигена упомянутых выше групп (ы) антигенов или их фрагментов или вариантов, определенных выше. Более предпочтительно, но, не ограничиваясь только ими, (по крайней мере) одна (би- или полицистронная) РНК, предпочтительно мРНК, кодирует, например по крайней мере два, три или четыре (предпочтительно различных) антигена упомянутых выше подгрупп (ы) антигенов или их фрагментов или вариантов, определенных выше. В данном контексте так называемая последовательность участка внутренней посадки рибосомы (IRES), как определено выше, может осуществлять функцию единственного участка связывания с рибосомой, но также может обеспечивать образование би- или полицистронной РНК, как определено выше, которая кодирует некоторые белки, которые транслируются рибосомами независимо друг от друга. Примеры последовательностей IRES, которые можно использовать согласно настоящему изобретению, включают последовательности РНК пикорнавирусов (например, вирус ящера), пестивирусов (CFFV), вирусов полиомиелита (ВП), вирусов энцефаломиокардита (ВЭМК), вирусов гепатита С (ВГС), вирусов классической чумы свиней (ВКЧС), вируса мышиного лейкоза (ВМЛ), вирусов иммунодефицита обезьян (ВИО) или вирусов паралича сверчка (ВПС).
Согласно следующему, прежде всего, предпочтительному варианту активная (иммуностимулирующая) композиция по настоящему изобретению включает смесь по крайней мере одной моноцистронной РНК, предпочтительно мРНК, как определено выше, и по крайней мере одной би- или полицистронной РНК, предпочтительно мРНК, как определено выше. По крайней мере, одна моноцистронная РНК и/или по крайней мере причем одна би- или полицистронная РНК предпочтительно кодируют различные антигены или их фрагменты или варианты, определенные выше, где антигены предпочтительно выбирают из упомянутых выше групп или подгрупп антигенов, более предпочтительно в одной из упомянутых выше комбинаций. Однако по крайней мере одна моноцистронная РНК и по крайней мере одна би- или полицистронная РНК предпочтительно также кодируют (частично) идентичные антигены, выбранные из упомянутых выше групп или подгрупп антигенов, предпочтительно в одной из упомянутых выше комбинаций, при условии, что активная (иммуностимулирующая) композиция по настоящему изобретению включает в целом по крайней мере два (предпочтительно различных) антигена, как определено выше. Указанный вариант является предпочтительным, например, для поочередного введения, например, при введении активной (иммуностимулирующей) композиции по настоящему изобретению пациенту, нуждающемуся в указанном лечении, через определенные интервалы времени. Компоненты указанной активной (иммуностимулирующей) композиции по настоящему изобретению, прежде всего, различные РНК, кодирующие по крайней мере два (предпочтительно различных) антигена, содержатся, например, в наборе (различных компонентов) композиции, или, например, их вводят в отдельности в виде компонентов различных активных (иммуностимулирующих) композиций по настоящему изобретению.
Предпочтительно длина по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции, кодирующей по крайней мере два (предпочтительно различных) антигена, выбранных из определенной выше группы антигенов, более предпочтительно в указанных выше комбинациях, обычно составляет от приблизительно 50 до приблизительно 20000, или от 100 до приблизительно 20000 нуклеотидов, предпочтительно от приблизительно 250 до приблизительно 20000 нуклеотидов, более предпочтительно от приблизительно 500 до приблизительно 10000, наиболее предпочтительно от приблизительно 500 до приблизительно 5000.
Согласно одному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции, кодирующая по крайней мере два (предпочтительно различных) антигена, выбранных из определенных выше групп (ы) или подгрупп (ы) антигенов, более предпочтительно в указанных выше комбинациях, представлена в форме модифицированной РНК, при этом по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции включает любую модификацию, как определено в данном контексте. Модификации, как определено в данном контексте, предпочтительно приводят к стабилизации по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению.
В связи с этим согласно первому варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению представлена в виде «стабилизированной РНК», предпочтительно стабилизированной мРНК, т.е. в виде (м) РНК, которая в значительной степени устойчива в отношении деградации in vivo (например, под действием экзо- или эндонуклеаз). Указанную стабилизацию проводят, например, при модификации фосфатов в основной цепи по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению. Модификация основной цепи согласно настоящему изобретению обозначает модификацию, при которой фосфаты в основной цепи нуклеотидов РНК модифицируют химически. Нуклеотиды, которые предпочтительно можно использовать для такой модификации, включают, например, фосфаты в основной цепи, модифицированные фосфоротиоатным методом, при этом предпочтительно по крайней мере один из атомов кислорода в фосфатной группе в основной цепи заменен на атом серы. Стабилизированные (м) РНК, кроме того, включают, например: неионогенные фосфатные аналоги, такие как, например, алкил- или арилфосфонаты, в которых заряженный атом кислорода в фосфонатной группе заменен на алкильную группу или арильную группу, или на фосфодиэфиры и алкилфосфотриэфиры, в которых фрагмент, содержащий заряженный атом кислорода, присутствует в алкилированной форме. Указанные модификации основной цепи обычно включают, но, не ограничиваясь только ими, модификации, выбранные из группы, включающей метилфосфонаты, фосфорамидаты и фосфоротиоаты (например, цитидин-5'-O-(1-тиофосфат)).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению может в дополнительном или в альтернативном варианте также включать модификации сахаридных остатков. В контексте настоящего изобретения модификация сахаридного остатка обозначает химическую модификацию сахаридного остатка в составе нуклеотида по крайней мере в одной РНК и обычно включает, но, не ограничиваясь только ими, модифицированные сахаридные остатки, выбранные из группы, включающей 2'-дезокси-2'-фторолигорибонуклеотид (2'-фтор-2'-дезоксицитидин-5'-трифосфат, 2'-фтор-2'-дезоксиуридин-5'-трифосфат), 2'-дезокси-2'-деаминолигорибонуклеотид (2'-амино-2'-дезоксицитидин-5'-трифосфат, 2'-амино-2'-дезоксиуридин-5'-трифосфат), 2'-O-алкилолигорибонуклеотид, 2'-дезокси-2'-С-алкилолигорибонуклеотид (2'-O-метилцитидин-5'-трифосфат, 2'-метилуридин-5'-трифосфат), 2'-С-алкилолигорибонуклеотид и изомеры указанных соединений (2'-арацитидин-5'-трифосфат, 2'-арауридин-5'-трифосфат), или азидотрифосфат (2'-азидо-2'-дезкосицитидин-5'-трифосфат, 2'-азидо-2'-дезоксиуридин-5'-трифосфат).
По крайней мере, одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению может в дополнительном или в альтернативном варианте также включать по крайней мере одну модификацию основания, которая предпочтительно пригодна для значительного повышения экспрессии белка, кодируемого по крайней мере одной последовательностью РНК, по сравнению с не-модифицированной, т.е. природной последовательностью РНК. Значительное повышение в данном случае обозначает повышение экспрессии белка по сравнению с экспрессией природной последовательности РНК, по крайней мере на 20%, предпочтительно, по крайней мере на 30%, 40%, 50% или 60%, более предпочтительно по крайней мере на 70%, 80%, 90% или даже на 100% и наиболее предпочтительно по крайней мере на 150%, 200% или даже 300% или более. Согласно настоящему изобретению нуклеотид, включающий указанную модификацию основания, предпочтительно выбирают из группы нуклеотидов с модифицированными основаниями, включающей 2-амино-6-хлорпуринрибозид-5'-трифосфат, 2-аминоаденозин-5'-трифосфат, 2-тиоцитидин-5'-трифосфат, 2-тиоуридин-5'-трифосфат, 4-тиоуридин-5'-трифосфат, 5-аминоаллилцитидин-5'-трифосфат, 5-аминоаллилуридин-5'-трифосфат, 5-бромцитидин-5'-трифосфат, 5-бромуридин-5'-трифосфат, 5-иодцитидин-5'-трифосфат, 5-иодуридин-5'-трифосфат, 5-метилцитидин-5'-трифосфат, 5-метилуридин-5'-трифосфат, 6-азацитидин-5'-трифосфат, 6-азауридин-5'-трифосфат, 6-хлорпуринрибозид-5'-трифосфат, 7-деазааденозин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 8-азааденозин-5'-трифосфат, 8-азидоаденозин-5'-трифосфат, бензимидазолрибозид-5'-трифосфат, N1-метиладенозин-5'-трифосфат, N1-метилгуанозин-5'-трифосфат, N6-метиладенозин-5'-трифосфат, O6-метилгуанозин-5'-трифосфат, псевдоуридин-5'-трифосфат или пуромицин-5'-трифосфат, ксантозин-5'-трифосфат. Прежде всего, предпочтительными для модификаций оснований являются нуклеотиды, выбранные из группы нуклеотидов с модифицированными основаниями, включающей 5-метилцитидин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 5-бромцитидин-5'-трифосфат и псевдоуридин-5'-трифосфат.
Согласно другому варианту по крайней мере одну РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению аналогичным образом можно модифицировать (и предпочтительно стабилизировать) при включении других модифицированных нуклеотидов, содержащих модифицированные остатки рибозы или основания. В основном по крайней мере одна (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению включает любой природный нуклеотид, например, гуанозин, урацил, аденозин и/или цитозин или аналог указанных нуклеотидов. В связи с этим аналоги нуклеотидов определяют как неприродные варианты распространенных в природе нуклеотидов. Соответственно, аналоги являются химическими производными нуклеотидов, содержащими неприродные функциональные группы, которые предпочтительно включают в природный нуклеотид или удаляют из него или на которые заменяют природные группы в нуклеотиде. Соответственно, каждый компонент природного нуклеотида можно модифицировать, а именно, компонент основания, компонент сахаридного остатка (рибозы) и/или компонент фосфата, образующих основную цепь (см. выше) последовательности РНК. Аналоги гуанозина, урацила, аденозина и цитидина включают, но, не ограничиваясь только ими, любые природные или не-природные остатки гуанозина, урацила, аденозина, тимидина или цитозина, которые модифицированы химическим методом, например, ацетилированием, метилированием, гидроксилированием и т.п., включая 1-метиладенозин, 1-метилгуанозин, 1-метилинозин, 2,2-диметилгуанозин, 2,6-диаминопурин, 2'-амино-2'-дезоксиаденозин, 2'-амино-2'-дезоксицитидин, 2'-амино-2'-дезоксигуанозин, 2'-амино-2'-дезоксиуридин, 2-амино-6-хлорпуринрибозид, 2-аминопуринрибозид, 2'-арааденозин, 2'-арацитидин, 2'-арауридин, 2'-азидо-2'-дезоксиаденозин, 2'-азидо-2'-дезоксицитидин, 2'-азидо-2'-дезоксигуанозин, 2'-азидо-2'-дезоксиуридин, 2-хлораденозин, 2'-фтор-2'-дезоксиаденозин, 2'-фтор-2'-дезоксицитидин, 2'-фтор-2'-дезоксигуанозин, 2'-фтор-2'-дезоксиуридин, 2'-фтортимидин, 2-метиладенозин, 2-метилгуанозин, 2-метилтио-N6-изопентениладенозин, 2'-O-метил-2-аминоаденозин, 2'-O-метил-2'-дезоксиаденозин, 2'-O-метил-2'-дезоксицитидин, 2'-O-метил-2'-дезоксигуанозин, 2'-O-метил-2'-дезоксиуридин, 2'-O-метил-5-метилуридин, 2'-O-метилинозин, 2'-O-метилпсевдоуридин, 2-тиоцитидин, 2-тиоцитозин, 3-метилцитозин, 4-ацетилцитозин, 4-тиоуридин, 5-(карбоксигидроксиметил)урацил, 5,6-дигидроуридин, 5-аминоаллилцитидин, 5-аминоаллилдезоксиуридин, 5-бромуридин, 5-карбоксиметиламинометил-2-тиоурадил, 5-карбоксиметиламинометилурацил, 5-хлорарацитозин, 5-фторуридин, 5-иодуридин, 5-метоксикарбонилметилуридин, 5-метоксиуридин, 5-метил-2-тиоуридин, 6-азацитидин, 6-азауридин, 6-хлор-7-деазагуанозин, 6-хлорпуринрибозид, 6-меркаптогуанозин, 6-метилмеркаптопуринрибозид, 7-деаза-2'-дезоксигуанозин, 7-деазааденозин, 7-метилгуанозин, 8-азааденозин, 8-бромаденозин, 8-бромгуанозин, 8-меркаптогуанозин, 8-оксогуанозин, бензимидазолрибозу, β-D-маннозилквеозин, дигидроурацил, инозин, N1-метиладенозин, N6-([6-аминогексил]карбамоилметил)аденозин, N6-изопентениладенозин, N6-метиладенозин, N7-метилксантозин, метиловый эфир N-урацил-5-оксиуксусной кислоты, пуромицин, квеозин, урацил-5-оксиксусную кислоту, метиловый эфир урацил-5-оксиуксусной кислоты, вибутоксозин, ксантозин и ксилоаденозин. Получение указанных аналогов известно специалисту в данной области, например, описано в патентах US 4373071, US 4401796, US 4415732, US 4458066, US 4500707, US 4668777, US 4973679, US 5047524, US 5132418, US 5153319, US 5262530 и US 5700642. В случае описанного выше аналога согласно настоящему изобретению, прежде всего, предпочтительны аналоги, которые повышают иммуногенность РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению и/или не препятствуют проведению другой модификации РНК.
Согласно конкретному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению включает липидную модификацию. Указанная липидно-модифицированная РНК обычно обозначает РНК, как определено в данном контексте, кодирующую по крайней мере два антигена, выбранные из группы антигенов, как определено выше, предпочтительно в указанных выше комбинациях. Указанная липидно-модифицированная РНК обычно, кроме того, содержит по крайней мере один линкер, ковалентно присоединенный к указанной РНК, а также по крайней мере один липид, ковалентно присоединенный к соответствующему линкеру. В другом варианте, липидно-модифицированная РНК включает (по крайней мере, одну) РНК, как определено в данном контексте, и по крайней мере один (бифункциональный) липид, ковалентно присоединенный (в отсутствии линкера) к указанной РНК. Согласно третьему варианту, липидно-модифицированная РНК включает РНК, как определено в данном контексте, и по крайней мере один линкер, ковалентно присоединенный к указанной РНК, а также по крайней мере один липид, ковалентно присоединенный к соответствующему линкеру, и по крайней мере один (бифункциональный) липид, ковалентно присоединенный (в отсутствии линкера) к указанной РНК.
Липид, содержащийся по крайней мере в одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению (в составе комплекса или за счет ковалентного присоединения к указанной РНК), обычно обозначает липид или липофильный остаток, который предпочтительно сам по себе характеризуется биологической активностью. Указанные липиды предпочтительно включают природные вещества или соединения, такие как, например, витамины, например, α-токоферол (витамин Е), включая RRR-α-токоферол (ранее D-α-токоферол), L-α-токоферол, рацемат D,L-α-токоферола, сукцинат витамина Е (СВЕ), или витамин А и его производные, например, ретиноевую кислоту, ретинол, витамин D и его производные, например, витамин D, а также предшественники эргостерола, витамин Е и его производные, витамин K и его производные, например, витамин K и родственные соединения хинона или фитола, или стероиды, такие как желчные кислоты, например, холиевую кислоту, дезоксихолевую кислоту, дегидрохолиевую кислоту, кортизон, дигоксигенин, тестостерон, холестерин или тиохолестерин. Другие липиды или липофильные остатки согласно настоящему изобретению включают, но, не ограничиваясь только ими, полиалкиленгликоли (Oberhauser и др., Nucl. Acids Res., 20, с.533 (1992)), алифатические группы, такие как, например, С1-С20алканы, С1-С20алкены или С1-С20алканолы и т.п., такие как, например, додекандиол, остатки гексадеканола или ундецила (Saison-Behmoaras и др., EMBO J., 10, с.111 (1991), Kabanov и др., FEBS Lett., 259, с.327 (1990), Svinarchuk и др., Biochimie, 75, с.49 (1993)), фосфолипиды, такие как, например, фосфатидилглицерин, диацилфосфатидилглицерин, фосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, дигексадецил-рац-глицерин, сфинголипиды, цереброзиды, ганглиозиды, или 1,2-ди-О-гексадецил-рац-глицеро-3-Н-фосфонат триэтиламмония (Manoharan и др., Tetrahedron Lett., 36, с.3651 (1995), Shea и др., Nucl. Acids Res., 18, с.3777 (1990)), полиамины или полиалкиленгликоли, такие как, например, полиэтиленгликоль (ПЭГ) (Manoharan и др., Nucleosides & Nucleotides, 14, с.969 (1995)), гексаэтиленгликоль (ГЭК), пальмитин или остатки пальмитиновой кислоты (Mishra и др., Biochim. Biophys. Acta, 1264, с.229 (1995)), октадециламины или остатки гексиламинокарбонилоксихолестерина (Crooke и др., J. Pharmacol. Exp. Ther., 277, с.923 (1996)), а также воски, терпены, алициклические углеводороды, остатки насыщенных и моно- или полиненасыщенных жирных кислот и т.п.
По крайней мере, одну РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению аналогичным образом можно стабилизировать различными способами для предотвращения деградации РНК in vivo. В данной области известно, что нестабильность и (быстрая) деградация мРНК или РНК in vivo, в основном, представляет серьезную проблему при использовании композиций на основе РНК. Указанная нестабильность РНК обычно обусловлена деградацией РНК под действием ферментов, «РНКаз» (рибонуклеаз), при этом присутствие указанных рибонуклеаз в некоторых случаях приводит к полной деградации РНК в растворе. Соответственно, природная деградация мРНК в цитоплазме клеток чрезвычайно тонко регулируется, и перед использованием указанных композиций примеси РНКаз обычно удаляют стандартной обработкой, прежде всего, в присутствии диэтилпирокарбоната (DEPC). В связи с этим, в предшествующем уровне техники известен ряд механизмов природной деградации, которые можно также использовать. Например, структура концевого фрагмента играет важную роль для мРНК in vivo. Например, в концевом 5'-фрагменте природной мРНК присутствует так называемая «кэп-структура» (модифицированный гуанозин), а в концевом 3'-фрагменте обычно содержится последовательность, включающая вплоть до 200 остатков аденозина (так называемый полиА-концевой фрагмент).
Таким образом, по крайней мере одну РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, прежде всего, если она представлена в виде мРНК, можно стабилизировать с целью исключить деградацию под действием РНКаз за счет включения так называемой 5'-кэппированной структуры «5'-кэп». В этой связи, прежде всего, предпочтительной структурой «5'-кэп» является структура 7G(5')ppp (5'(A,G(5')ppp(5')A или G(5')ppp(5')G. Однако указанную модификацию осуществляют, только если предварительно не проведена модификация, например, липидо-модификация, по концевому 5'-фрагменту (м)РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, или если указанная модификация не снижает иммуногенные свойства (не-модифицированной или химически модифицированной) (м)РНК.
Согласно другому предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит, прежде всего, если РНК представлена в форме мРНК, в концевом 3'-фрагменте полиА-концевой фрагмент, включающий обычно приблизительно 10-200 остатков аденозина, предпочтительно приблизительно 10-100 остатков аденозина, более предпочтительно приблизительно 20-100 остатков аденозина или наиболее предпочтительно приблизительно 40-80 остатков аденозина.
Согласно следующему предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению содержит, прежде всего, если РНК представлена в форме мРНК, в концевом 3'-фрагменте полиС-концевой фрагмент, включающий обычно приблизительно 10-200 остатков цитозина, предпочтительно приблизительно 10-100 остатков цитозина, более предпочтительно приблизительно 20-70 остатков цитозина или наиболее предпочтительно приблизительно 20-60 или даже 10-40 остатков цитозина.
Согласно еще одному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению модифицирована и, таким образом, стабилизирована, прежде всего, если РНК представлена в форме мРНК, за счет изменения содержания G/C в РНК, предпочтительно в кодирующей области по крайней мере одной РНК.
Согласно, прежде всего, предпочтительному варианту осуществления настоящего изобретения, содержание G/C в кодирующей области по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению изменяют, прежде всего, повышают по сравнению с содержанием G/C в кодирующей области соответствующей (м) РНК дикого типа, т.е. в не-модифицированной (м) РНК. Кодируемую аминокислотную последовательность по крайней мере одной (м) РНК, предпочтительно не модифицируют по сравнению с кодирующей аминокислотной последовательностью конкретной (м) РНК дикого типа.
Указанную модификацию по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению выбирают с учетом того факта, что последовательность любой транслируемой области (м) РНК имеет важное значение для эффективной трансляции указанной (м) РНК. В связи с этим, композиция и последовательность различных нуклеотидов играют важную роль. Прежде всего, последовательности с повышенным содержанием G (гуанозин)/С (цитозин) более стабильны по сравнению с последовательностями с повышенным содержанием А (аденозин)/и (урацил). В связи с этим, согласно настоящему изобретению кодоны (м) РНК изменяют по сравнению с соответствующей (м) РНК дикого типа, при этом, сохраняя транслируемую аминокислотную последовательность таким образом, чтобы она включала повышенное количество нуклеотидов G/C. Так как несколько кодонов кодируют одну и ту же аминокислоту (так называемое вырождение генетического кода), следует выявить наиболее пригодные кодоны, которые определяют стабильность (так называемое альтернативное использование кодонов).
В зависимости от аминокислоты, кодируемой по крайней мере одной (м) РНК, существуют различные возможности модификации последовательности (м) РНК по сравнению с соответствующей последовательностью дикого типа. В случае аминокислот, которые кодируются кодонами, которые содержат исключительно нуклеотиды G или С, модификации кодона не требуется. В связи с этим, модификации кодонов, кодирующих Pro (CCC или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG), не требуется, так как они не содержат нуклеотиды А или U.
И наоборот, кодоны, которые содержат нуклеотиды А и/или U, заменяют на другие кодоны, которые кодируют те же аминокислоты, но не содержат нуклеотидов А и/или U. Примеры включают:
кодоны CCU или ССА, кодирующие Pro, заменяют на ССС или CCG,
кодоны CGU или CGA или AGA или AGG, кодирующие Arg, заменяют на CGC или CGG,
кодоны GCU или GCA, кодирующие Ala, заменяют на GCC или GCG,
кодоны GGU или GGA, кодирующие Gly, заменяют на GGC или GGG.
В других случаях, хотя удаление нуклеотидов А или U из кодонов является невозможным, тем не менее содержание нуклеотидов А и U можно снизить за счет использования кодонов, которые характеризуются более низким содержанием нуклеотидов А и/или U. Примеры включают:
кодон UUU, кодирующий Phe, заменяют на UUC,
кодоны UUA, UUG, CUU или CUA, кодирующие Leu, заменяют на CUC или CUG,
кодоны UCU или UCA или AGU, кодирующие Ser, заменяют на UCC, UCG или AGC,
кодон UAU, кодирующий Tyr, заменяют на UAC,
кодон UGU, кодирующий Cys, заменяют на UGC,
кодон CAU, кодирующий His, заменяют на САС,
кодон САА, кодирующий Gln, заменяют на CAG,
кодоны AUU или AUA, кодирующие Ile, заменяют на AUC,
кодоны ACU или АСА, кодирующие Thr, заменяют на АСС или ACG,
кодон AAU, кодирующий Asn, заменяют на ААС,
кодон ААА, кодирующий Lys, заменяют на AAG,
кодоны GUU или GUA, кодирующие Val, заменяют на GUC или GUG,
кодон GAU, кодирующий Asp, заменяют на GAC,
кодон GAA, кодирующий Glu, заменяют на GAG,
кодон UAA (стоп-кодон) заменяют на UAG или UGA.
С другой стороны, в случае кодонов, кодирующих Met (AUG) и Trp (UGG), модификация последовательности является невозможной.
Перечисленные выше замены можно использовать в отдельности или во всех возможных комбинациях для повышения содержания G/C по крайней мере в одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению по сравнению с соответствующей конкретной (м) РНК дикого типа (т.е. исходной последовательностью). Таким образом, например, все присутствующие в последовательности дикого типа кодоны, кодирующие Thr, заменяют на кодон АСС (или ACG). Однако предпочтительно используют, например, комбинации указанных выше замен:
замену в исходной последовательности ((м) РНК дикого типа) всех кодонов, кодирующих Thr, на АСС (или ACG) и
замену в исходной последовательности всех кодонов, кодирующих Ser, на UCC (или UCG или AGC),
замену в исходной последовательности всех кодонов, кодирующих Ile, на AUC и
замену всех кодонов, кодирующих Lys, на AAG и
замену всех кодонов, кодирующих Tyr, на UAC,
замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и
замену всех кодонов, кодирующих Glu, на GAG и
замену всех кодонов, кодирующих Ala, на GCC (или GCG) и
замену всех кодонов, кодирующих Arg, на CGC (или CGG),
замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и
замену всех кодонов, кодирующих Glu, на GAG и
замену всех кодонов, кодирующих Ala, на GCC (или GCG) и
замену всех кодонов, кодирующих Gly, на GGC (или GGG) и
замену всех кодонов, кодирующих Asn, на ААС,
замену в исходной последовательности всех кодонов, кодирующих Val, на GUC (или GUG) и
замену всех кодонов, кодирующих Phe, на UUC и
замену всех кодонов, кодирующих Cys, на UGC и
замену всех кодонов, кодирующих Leu, на CUG (или CUC) и
замену всех кодонов, кодирующих Gln, на CAG и
замену всех кодонов, кодирующих Pro, на ССС (или CCG) и т.п.
Предпочтительно, содержание G/C в кодирующей области по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению повышают по крайней мере на 7%, более предпочтительно, по крайней мере на 15%, прежде всего, предпочтительно, по крайней мере на 20% по сравнению с содержанием G/C в кодирующей области (м) РНК дикого типа, которая кодирует антиген, антигенный белок или антигенный пептид, как определено в данном контексте, или их фрагмент или вариант. Согласно конкретному варианту заменяют по крайней мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по крайней мере 70%, еще более предпочтительно по крайней мере 80% и наиболее предпочтительно по крайней мере 90%, 95% или даже 100% заменяемых кодонов в области, которая кодирует антиген, антигенный белок или антигенный пептид, как определено в данном контексте, или их фрагмент или вариант, или полноразмерную последовательность (м) РНК дикого типа, таким образом повышая содержание G/C в указанной последовательности.
В данном контексте, прежде всего, содержание G/C по крайней мере в одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, прежде всего, в области, кодирующей белок, предпочтительно повышено до максимального уровня (т.е. 100% кодонов заменены) по сравнению с последовательностью дикого типа.
Согласно настоящему изобретению, следующую предпочтительную модификацию по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению выбирают с учетом того, что эффективность трансляции определяется также различной частотой присутствия тРНК в клетках. Таким образом, если по крайней мере в одной (м) РНК активной (иммуностимулирующей) композиции по настоящему изобретению повышено содержание так называемых «редких кодонов», то уровень трансляции по крайней мере одной соответствующей модифицированной последовательности (м) РНК значительно снижается по сравнению с вариантом, когда присутствуют кодоны, кодирующие относительно «часто встречаемые» молекулы тРНК.
Согласно настоящему изобретению область по крайней мере в одной модифицированной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, которая кодирует адъювантный белок, модифицирована по сравнению с соответствующей областью (м) РНК дикого типа и при этом по крайней мере один кодон последовательности дикого типа, который кодирует тРНК, которая относительно редко встречается в клетке, заменен на кодон, который использует тРНК, которая относительно часто встречается в клетке и переносит ту же аминокислоту, что и относительно мало встречаемая тРНК. За счет указанной модификации, последовательность по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению модифицируют и включают в последовательность кодоны, доступные для относительно часто встречающейся тРНК. Другими словами, согласно настоящему изобретению, за счет указанной модификации все кодоны последовательности дикого типа, которые кодируют тРНК, которая относительно редко встречается в клетке, в каждом случае заменяют на кодон, который использует тРНК, которая относительно часто встречается в клетке, и которая, в каждом случае, переносит ту же аминокислоту, что и относительно редкая тРНК.
Специалисту в данной области известны тРНК, которые относительно часто встречаются в клетке и которые наоборот относительно редко встречаются в клетке, см., например, статью Akashi, Curr. Opin. Genet. Dev., 11 (6) 660-666 (2001). Прежде всего, предпочтительны кодоны, которые используют тРНК (конкретной аминокислоты), которая встречается наиболее часто, например, кодон, кодирующий Gly, который использует тРНК, которая наиболее часто встречается в клетке (человека).
Согласно настоящему изобретению, прежде всего, предпочтительно комбинировать повышенное, прежде всего повышенное до максимального уровня содержание нуклеотидов G/C в последовательности по крайней мере одной модифицированной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению и «часто встречающие» кодоны без модификации аминокислотной последовательности белка, кодируемого кодирующей областью (м) РНК. Указанный предпочтительный вариант обеспечивает получение, прежде всего, эффективно транслируемой и стабилизированной (модифицированной) по крайней мере одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению.
Идентификацию по крайней мере одной модифицированной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, как описано выше (повышенное содержание G/C, замена тРНК), проводят с использованием компьютерной программы, описанной в заявке WO 02/098443, содержание которой в полном объеме включено в настоящее описание в качестве ссылки. Используя указанную компьютерную программу, можно модифицировать нуклеотидную последовательность любой требуемой (м) РНК с использованием генетического кода или его вырожденности таким образом, чтобы получить в результате максимальное содержание G/C в комбинации с использованием кодонов, которые используют молекулы тРНК, наиболее часто встречающиеся в клетке, при этом аминокислотная последовательность, кодируемая по крайней мере одной модифицированной (м) РНК, предпочтительно сохраняется в не модифицированном виде по сравнению с не-модифицированной последовательностью. В другом варианте, также можно изменять только содержание G/C или только более эффективно использовать кодоны по сравнению с исходной последовательностью. Исходная программа Visual Basic 6.0 (используемая среда разработки Microsoft Visual Studio Enterprise 6.0, Servicepack 3) также описана в заявке WO 02/098443.
В другом предпочтительном варианте осуществления настоящего изобретения содержание A/U вблизи с участком связывания с рибосомой по крайней мере в одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению повышено по сравнению с содержанием A/U вблизи с участком связывания с рибосомой в соответствующей (м) РНК дикого типа. Указанная модификация (повышенное содержание A/U вблизи с участком связывания с рибосомой) повышает эффективность связывания с рибосомой по крайней мере в одной (м) РНК. Эффективное связывание рибосом с участком связывания с рибосомой (последовательность Козака: GCCGCCACCAUGG (SEQ ID NO:27), AUG образует старт-кодон) в свою очередь влияет на эффективность трансляции по крайней мере одной (м) РНК.
Согласно следующему варианту осуществления настоящего изобретения по крайней мере одна (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению модифицирована с учетом потенциально дестабилизирующих элементов последовательности. Прежде всего, кодирующую область и/или не транслируемую 5'- и/или 3'-область по крайней мере одной указанной (м) РНК модифицируют по сравнению с соответствующей (м) РНК дикого типа таким образом, чтобы удалить дестабилизирующие элементы последовательности, при этом кодируемую аминокислотную последовательность по крайней мере одной модифицированной (м) РНК предпочтительно не изменяют по сравнению с соответствующей (м) РНК дикого типа. Например, известно, что в последовательностях РНК эукариотов присутствуют дестабилизирующие элементы последовательности (ДЭН), с которыми связываются сигнальные белки и регулируют ферментативную деградацию РНК vivo. Следовательно, для дополнительной стабилизации по крайней мере одной модифицированной (м)РНК, можно проводить одну или более указанных модификаций, необязательно в области, которая кодирует антиген, антигенный белок или антигенный пептид, как определено в данном контексте, по сравнению с соответствующей областью (м) РНК дикого типа таким образом, чтобы полностью или в значительной степени удалить дестабилизирующие элементы последовательности. Согласно настоящему изобретению с использованием указанных модификаций по крайней мере из одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению можно также удалить ДЭП, присутствующие в не транслируемых областях (3'- и/или 5'-UTR).
Указанные дестабилизирующие последовательности представляют собой, например, обогащенные AU последовательности, которые присутствуют в областях 3'-UTR множества нестабильных РНК (Caput и др., Proc. Natl. Acad. Sci. USA, 83, cc.1670-1674 (1986)). В связи с этим по крайней мере одну (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению предпочтительно модифицируют по сравнению с (м) РНК дикого типа, и таким образом по крайней мере одна (м) РНК не содержит указанных дестабилизирующих последовательностей. Указанное также относится к мотивам последовательностей, которые распознаются возможными эндонуклеазами, например, к последовательности GAACAAG, которая присутствует в сегменте 3'-UTR гена, который кодирует рецептор трансферина (Binder и др., EMBO J., 13, cc. 1969-1980 (1994)). Указанные мотивы последовательности также предпочтительно удалять по крайней мере из одной (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению.
Согласно настоящему изобретению также предпочтительно, чтобы по крайней мере одна (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению включала по крайней мере одну модифицированную IRES, как определено выше, и/или включала по крайней мере одну модифицированную стабилизирующую 5'- и/или 3'-последовательность, например, для повышения эффективности связывания с рибосомой или для обеспечения экспрессии различных кодируемых антигенов, локализованных по крайней мере в одной (би- или полицистронной) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению.
Согласно настоящему изобретению по крайней мере одна (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, кроме того, предпочтительно включает по крайней мере одну стабилизирующую 5'- и/или 3'-последовательность. Указанные стабилизирующие последовательности в не транслируемых 5'- и/или 3'-областях увеличивают период полураспада по крайней мере одной (м) РНК в цитозоле. Указанные стабилизирующие последовательности характеризуются 100% гомологией последовательности по сравнению с природными последовательностями, т.е. с РНК вирусов, бактерий и эукариотов, а также указанные последовательности можно использовать в виде частично или полностью синтетических последовательностей. Примером стабилизирующих последовательностей, которые можно использовать в настоящем изобретении для стабилизации РНК, являются не транслируемые последовательности (UTR) гена β-глобина, например, вида Homo sapiens или Xenopus laevis. Другой пример стабилизирующей последовательности характеризуется общей формулой (C/U)CCANxCCC(U/A)PyxUC(C/U)CC (SEQ ID NO:28), которая присутствует в 3'-UTR чрезвычайно стабильной РНК, которая кодирует α-глобин, α-коллаген-(I), 15-липоксигеназу или тирозингидроксилазу (см. Holcik и др., Proc. Natl. Acad. Sci. USA, 94, cc.2410-2414 (1997)). Указанные стабилизирующие последовательности можно использовать в отдельности или в комбинации друг с другом, а также в комбинации с другими известными стабилизирующими последовательностями. В связи с этим по крайней мере одна (м) РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению предпочтительно присутствует в виде РНК, стабилизированной не транслируемыми областями (UTR) глобина, прежде всего, в виде РНК, стабилизированной UTR глобина.
Тем не менее можно осуществить замены, вставки или делеции оснований по крайней мере в одной (м)РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, предпочтительно с использованием матрицы ДНК для получения по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению по известным методикам сайт-направленного мутагенеза или с использованием методики лигирования олигонуклеотидных зондов (см., например, Maniatis и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3е изд., Cold Spring Harbor, NY (2001)). В указанном процессе для получения по крайней мере одной (м) РНК проводят транскрипцию in vitro соответствующей молекулы ДНК. Указанная матрица ДНК предпочтительно включает пригодный промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым расположена требуемая нуклеотидная последовательность по крайней мере одной РНК и сигнал терминации транскрипции in vitro. Молекулу ДНК, которая образует матрицу по крайней мере одной требуемой РНК, получают ферментативной пролиферацией с последующим выделением в качестве части плазмиды, которую можно реплицировать в бактериях. Плазмиды, которые пригодны по настоящему изобретению, включают, например, плазмиды рТ7Т (код доступа GenBank U26404, Lai и др., Development, 121, cc.2349-2360 (1995)), плазмиды серий pGEM®, например, pGEM®-1 (код доступа GenBank X65300, фирмы Promega) и pSP64 (код доступа GenBank X65327), см. также Mezei и Storts, Purification of PCR Products, ред. Griffin and Griffin, PCR Technology, Current Innovation, CRC Press, Boca Raton, FL (2001).
По крайней мере, одну РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению аналогичным образом можно стабилизировать за счет ассоциации или образования комплексов или связывания по крайней мере одной РНК с катионным соединением, прежде всего, с поликатионным соединением, например, с поликатионным пептидом или белком. Прежде всего, эффективным является применение протамина, нуклеолина, спермина или спермидина в качестве связывающегося с нуклеиновой кислотой (РНК) поликатионного белка. Кроме того, аналогичным образом можно использовать другие катионные пептиды или белки, такие как поли-L-лизин или гистоны. Указанная методика стабилизации РНК описана в патенте ЕР-А-1083232, содержание которого в полном объеме включено в настоящее описание в качестве ссылки. Другие предпочтительные катионные соединения, которые можно использовать для стабилизации РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, включают катионные полисахариды, например, хитозан, полибрен, полиэтиленимин (ПЭИ) или поли-L-лизин (ПLЛ) и т.п. Ассоциация или образование комплексов по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению с катионными соединениями, например, с катионными белками или катионными липидами, например, с олигофектамином (в качестве комплексообразователя на основе липида) предпочтительно повышает перенос по крайней мере одной РНК, присутствующей в виде фармацевтического активного компонента, в клетки, подлежащие обработке, или в организм, нуждающийся в лечении. В данном контексте указанное также относится к стабилизирующему действию по крайней мере на одну РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению за счет образования комплексов, а также справедливо для стабилизации РНК.
Согласно другому, прежде всего, предпочтительному варианту по крайней мере одна РНК в составе активной (иммуностимулирующей) композиции в дополнительном или в альтернативном варианте кодирует секреторный сигнальный пептид. Указанные сигнальные пептиды представляют собой, но, не ограничиваясь только ими, последовательности, длина которых обычно составляет приблизительно 15-30 аминокислот, и которые предпочтительно расположены в N-концевом фрагменте кодируемого пептида. Сигнальные пептиды, как определено в данном контексте, предпочтительно обеспечивают перенос антигена, антигенного белка или антигенного пептида, кодируемых по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции, в определенный компартмент клетки, предпочтительно на клеточную поверхность, в эндоплазматический ретикулум (ЭР) или в эндосомальный-липосомальный компартмент. Примеры последовательностей секреторных сигнальных пептидов, как определено в данном контексте, включают, но, не ограничиваясь только ими, сигнальные последовательности классических или не классических молекул ГКГ (например, сигнальные последовательности ГКГ I и ГКГ II, например, HLA-A*0201 ГКГ класса I), сигнальные последовательности цитокинов или иммуноглобулинов, как определено в данном контексте, сигнальные последовательности консервативной цепи иммуноглобулинов или антител, как определено в данном контексте, сигнальные последовательности Lamp1, тапазина, Erp57, калретикулина, калнексина и других мембранно-ассоциированных белков или белков, ассоциированных с эндоплазматическим ретикулумом (ЭР) или с эндосомальным-липосомальным компартментом. Прежде всего, в настоящем изобретении предпочтительно можно использовать сигнальные последовательности HLA-A*0201 ГКГ класса I.
Любую из указанных выше модификаций можно применять в отношении по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению и, кроме того, в отношении любой (м) РНК, используемой в настоящем изобретении, а также при необходимости модификации можно осуществлять любые комбинации, при условии, что указанные комбинации модификаций не оказывают отрицательного действия на структуру по крайней мере одной РНК. Соответствующий выбор может сделать специалист в данной области.
Согласно другому варианту активная (иммуностимулирующая) композиция по настоящему изобретению включает адъювант. В данном контексте адъювант обозначает любое соединение, которое можно использовать для ускорения введения и доставки активной (иммуностимулирующей) композиции по настоящему изобретению. Кроме того, указанный адъювант может но не ограничиваясь только ими, инициировать или усиливать иммунный ответ (врожденного иммунитета), т.е. неспецифический иммунный ответ. Другими словами, после введения активная (иммуностимулирующая) композиция по настоящему изобретению обычно инициирует приобретенный иммунный ответ за счет действия по крайней мере двух антигенов, кодируемых по крайней мере одной РНК, содержащейся в составе активной (иммуностимулирующей) композиции по настоящему изобретению. Кроме того, активная (иммуностимулирующая) композиция по настоящему изобретению может индуцировать (поддерживающий) врожденный иммунный ответ за счет добавления адъюванта, как определено в данном контексте, в активную (иммуностимулирующую) композицию по настоящему изобретению. Указанный адъювант выбирают из любого известного пригодного в данном случае адъюванта, т.е. ускоряет индуцирование иммунного ответа у млекопитающего. Предпочтительно адъювант выбирают из группы, включающей, но, не ограничиваясь только ими, TDM, MDP, мурамилдипептид, плюроники, раствор алюмокалиевых квасцов, гидроксид алюминия, ADJUMER (полифосфазен), алюмофосфатный гель, глюканы из водорослей, альгамулин, гель гидроксида алюминия (квасцы), гель гидроксида алюминия с высокой степенью адсорбции белка, гель гидроксида алюминия с низкой вязкостью, AF или SPT (эмульсия, включающая 5% сквалан, 0,2% твин 80, 1,25% плюроник L121, фосфатно-солевой буферный раствор, рН 7,4), AVRIDINE™ (пропандиамин), BAY R1005™ (гидроацетат (N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканоиламида), CALCITRIOL™ (1α,25-дигидроксивитамин D3), кальцийфосфатный гель, САРТМ (кальцийфосфатные наночастицы), холерный голотоксин, гибридный белок холерный токсин-А1-белок-А-D-фрагмент, субъединицу В холерного токсина, CRL 1005 (блоксополимер Р1205), цитокин-содержащие липосомы, DDA (бромид диметилдиоктадециламмония), DHEA (дегидроэпиандростерон), DMPC (димиристоилфосфатидилхолин), DMPG (димиристоилфосфатидилглицерин), комплекс DOC/алюм (натриевая соль дезоксихолевой кислоты), полный адъювант Фрейнда, неполный адъювант Фрейнда, γ-инулин, адъювант Gerbu (смесь, включающая 1) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамил-L-аланил-D-глютамин (GMDP), 2) хлорид диметилдиоктадециламмония (DDA), 3) комплекс цинковая соль L-пролина (ZnPro-8), ГМ-КСФ), GMDP (N-ацетилглюкозаминил-(β1-4)-N-ацетилмурамил-L-аланил-D-изоглютамин), имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин), ImmTher™ (дипальмитат N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-глицерина), DRV (иммунолипосомы из везикул, полученных методом дегидратации-регидратации), интерферон-γ, интерлейкин-1β, интерлейкин-2, интерлейкин-7, интерлейкин-12, ISCOMS™, ISCOPREP 7.0.3.™, липосомы, LOXORIBINE™ (7-аллил-8-оксогуанозин), пероральный адъювант LT (лабильный энтеротоксин-протоксин из E.coli), микросферы и микрочастицы любого состава, MF59™ (сквален-водная эмульсия), MONTANIDE ISA 51™ (очищенный неполный адъювант Фрейнда), MONTANIDE ISA 720™ (метаболизируемый масляный адъювант), MPL™ (3-Q-дезацил-4'-монофосфориллипид А), МТР-РЕ и липосомы МТР-РЕ (мононатриевая соль (N-ацетил-L-аланил-D-изоглютаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))этиламида), MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-ОСН3), мурамилпальмитин (MURAPALMITINE™) и D-мурамилпальмитин (D-MURAPALMITINE™) (Nac-Mur-L-Thr-D-изоGln-sn-глицериндипальмитоил), NAGO (галактозоксидаза-нейраминидаза), наносферы или наночастицы любого состава, NISV (везикулы неионогенного ПАВ), PLEURAN™ (β-глюкан), PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты, микро/наносферы), плюроник L121™, ПММА (полиметилметакрилат), PODDS™ (протеиноидные микросферы), производные полиэтиленкарбамата, поли-rA/поли-rU (комплекс полиадениловая кислота/полиуридиловая кислота), полисорбат 80 (твин 80), белковые кохлеаты (фирмы Avanti Polar Lipids, Inc., Alabaster, AL), STIMULON™ (OS-21), Quil-A (сапонин Quil-A), S-28463 (4-амино-отек-диметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол), SAF-1™ (состав адъюванта «Syntex»), протеолипосомы вируса Сендай и липидные матрицы, содержащие белки вируса Сендай, Span-85 (триолеат сорбита), Specol (эмульсия, содержащая Marcol 52, Span 85 и твин 85), сквален или Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан), стеарилтирозин (гидрохлорид октадецилтирозина), Theramid® (Н-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-дипальмитоксипропиламид), Theronyl-MDP (Termurtide™ или [thr 1]-MDP, N-ацетилмурамил-L-треонил-D-изоглютамин), частицы Ту (частицы Ту-VLP или вирусоподобные частицы), липосомы Уолтера-Рида (липосомы, содержащие липид А, абсорбированный на гидроксиде алюминия) и липопептиды, включая Pam3Cys, прежде всего, соли алюминия, такие как Adju-phos, Alhydrogel, Rehydragel, эмульсии, включая CFA, SAF, IFA, MF59, провакс (Provax), титермакс (TiterMax), монтанид (Montanide), ваксфектин (Vaxfectin), сополимеры, включая Optivax (CRL1005), L121, полоксамер 4010 и т.п., липосомы, включая Stealth, кохлеаты, включая BIORAL, адъюванты растительного происхождения, включая QS21, Quil A, Iscomatrix, ISCOM, адъюванты, пригодные для совместной стимуляции, включая томатин (Tomatine), биополимеры, включая PLG, РММ, инулин, микробные адъюванты, включая ромуртид (Romurtide), детокс (DETOX), MPL, CWS, маннозу, нуклеотидные последовательности CpG, CpG7909, лиганды TLR 1-10 человека, лиганды TLR 1-13 мыши, ISS-1018, IC31, имидазохинолины, амплиген (Ampligen), Ribi529, имоксин (IMOxine), IRIV, VLP, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин (Flagellin), ГФИ, LNFPIII/Льюис X, противомикробные пептиды, UC-1V150, гибридный белок RSV, cdiGMP, a также адъюванты, пригодные в качестве антагонистов, включая нейропептид CGRP.
Пригодные адъюванты также выбирают из катионных или поликатионных соединений, при этом адъювант предпочтительно получают при образовании комплексов по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению с катионным или поликатионным соединением. Ассоциация или образование комплексов по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции с катионными или поликатионными соединениями, как определено в данном контексте, предпочтительно придает по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции свойства адъюванта и оказывает стабилизирующее действие на РНК. Прежде всего, предпочтительные катионные или поликатионные соединения выбирают из катионных или поликатионных пептидов или белков, включая протамин, нуклеолин, спермин или спермидин, или других катионных пептидов или белков, таких как поли-L-лизин (ПLЛ), полиаргинин, основные полипетиды, проникающие в клетки пептиды (ПКП), включая ВИЧ-связывающие пептиды, Tat, ВИЧ-1 Tat (ВИЧ), Tat-пептиды, пенетратин (Penetratin), VP22-пептиды или аналогичные пептиды, HSV VP22 (простой герпес), MAP, KALA или домены белковой трансдукции (ДБТ), РрТ620, обогащенные пролином пептиды, обогащенные аргинином пептиды, обогащенные лизином пептиды, MPG-пептид (ы), Рер-1, L-олигомеры, пептид (ы) кальцитонина, пептиды сложного локуса Antennapedia (прежде всего, из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, hCT-пептиды, SAP, протамин, спермин, спермидин или гистоны. Кроме того, предпочтительные катионные или поликатионные соединения включают катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (ПЭИ), катионные липиды, например, DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмоний)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмонийацетил)диэтаноламина, CLIP1: хлорид рац[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры β-аминокислот или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как ПВП (поли(N-этил-4-винилпириднийбромид)) и т.п., модифицированные акрилаты, такие как пДМАЭМА (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как пАМАМ (поли(амидоамин)) и т.п., модифицированные сложные поли-β-аминоэфиры (ПБАЭ), такие как модифицированные в диаминоконцевом фрагменте сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как дендримеры полипропиламина или дендримеры на основе пАМАМ и т.п., полиимин (ы), такие как полиэтиленимин (ПЭИ), полипропиленимин и т.п., полиаллиламин, полимеры на основе сахаридов, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., силановые полимеры, такие как сополимеры PMOXA-PDMS и т.п., блокполимеры, включающие комбинацию одного или более катионных блоков (например, выбранных из катионного полимера, как описано выше) и одного или более гидрофильных или гидрофобных блоков (например, полиэтиленгликоль) и т.п.
Кроме того, предпочтительные катионные или поликатионные белки или пептиды, которые можно использовать в качестве адъюванта за счет образования комплексов по крайней мере с одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, выбирают из следующих белков или пептидов общей формулы (I):
(Arg)l,(Lys)m,(His)n,(Orn)o,(Xaa)x, где l+m+n+o+x=8-15, a l, m, n или о независимо равны любому числу, выбранному из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по крайней мере 50% в расчете на все аминокислоты в составе олигопептида, а Хаа обозначает любую аминокислоту, выбранную из природных или неприродных аминокислот, за исключением Arg, Lys, His или Orn, и x равен любому числу, выбранному из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% в расчете на все аминокислоты в составе олигопептида. В данном контексте, прежде всего, предпочтительными олигопептидами аргинина являются, например, Arg7, Arg8, Arg9, Arg7, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.п.
Пригодные адъюванты, кроме того, выбирают из нуклеиновых кислот формулы (II): GlXmGn, где: G обозначает гуанозин, урацил или аналог гуанозина или урацила, Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомянутых выше нуклеотидов, индекс l равен целому числу от 1 до 40, причем, если l равен 1, G обозначает гуанозин или его аналог, если l>1 по крайней мере 50% нуклеотидов обозначают гуанозин или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает урацил или его аналог, если m>3, то присутствуют по крайней мере 3 последовательных остатка урацила или аналога урацила, n равен целому числу от 1 до 40, при этом, если n равен 1, G обозначает гуанозин или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают гуанозин или его аналог.
Другие пригодные адъюванты, кроме того, выбирают из нуклеиновых кислот формулы (III): ClXmCn, где: С обозначает цитозин, урацил или аналог цитозина или урацила, Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомянутых выше нуклеотидов, l равен целому числу от 1 до 40, причем, если l равен 1, С обозначает цитозин или его аналог, если l>1 по крайней мере 50% нуклеотидов обозначают цитозин или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает урацил или его аналог, если m>3, присутствуют по крайней мере 3 последовательных остатка урацила или аналога урацила, n равен целому числу от 1 до 40, причем, если n равен 1, С обозначает цитозин или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают цитозин или его аналог.
Согласно одному предпочтительному варианту в настоящем изобретении, кроме того, предлагается вакцина, содержащая активную (иммуностимулирующую) композицию по настоящему изобретению. Вакцина по настоящему изобретению дополнительно включает фармацевтически приемлемый носитель и/или другие вспомогательные вещества и добавки и/или адъюванты. Согласно, прежде всего, предпочтительному варианту антигены, кодируемые по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, включенной в вакцину по настоящему изобретению, выбирают из упомянутой выше группы.
Вакцина по настоящему изобретению обычно включает безопасное и эффективное количество по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции, как определено выше, кодирующей по крайней мере два антигена, как определено выше, более предпочтительно кодирующей по крайней мере два антигена, выбранных из упомянутых выше групп, предпочтительно в любой из указанных комбинаций. Используемый в данном контексте термин «безопасное и эффективное количество» обозначает количество по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции в вакцине, как определено выше, которое является достаточным для значительного и благоприятного действия на рак предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентный рак предстательной железы, а также родственные заболевания или нарушения. Однако, в то же время, «безопасное и эффективное количество» является достаточно малым, чтобы исключить серьезные побочные действия, т.е. чтобы обеспечить целесообразное соотношение польза/риск. Указанные пределы обычно определяет квалифицированный специалист в области медицины. В отношении вакцины по настоящему изобретению термин «безопасное и эффективное количество» предпочтительно обозначает количество РНК (и, в связи с этим по крайней мере двух кодируемых антигенов), достаточное для стимуляции приобретенного иммунного ответа, но при этом не наблюдается избыточная или приносящая вред иммунная реакция, а также предпочтительно не наблюдаются иммунные реакции ниже детектируемого предела измерения. Указанное «безопасное и эффективное количество» по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции в вакцине, как определено выше, кроме того, выбирают в зависимости от типа РНК, например, моноцистронная, би- или полицистронная РНК, так как би- или полицистронная РНК индуцирует экспрессию кодируемого антигена (ов) на значительно более высоком уровне по сравнению с равным количеством моноцистронной РНК. «Безопасное и эффективное количество» по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции, как определено выше, которая содержится в вакцине по настоящему изобретению, кроме того, изменяется в зависимости от конкретного состояния, подлежащего лечению, а также возраста и физического состояния пациента, нуждающегося в указанном лечении, степени тяжести состоянии, продолжительности лечения, типа сопутствующего курса лечения, конкретного используемого фармацевтически приемлемого носителя и аналогичных факторов, известных лечащему врачу. Вакцину по настоящему изобретению можно использовать в качестве фармацевтической композиции или в качестве вакцины по настоящему изобретению в медицине, а также в ветеринарии.
Вакцина по настоящему изобретению обычно включает фармацевтически приемлемый носитель. Используемый в данном контексте термин «фармацевтически приемлемый носитель» предпочтительно включает жидкую или не жидкую основу вакцины по настоящему изобретению. Если вакцина по настоящему изобретению представлена в жидкой форме, носителем обычно является апирогенная вода, изотонические солевые или буферные растворы (водные), например, фосфатный, нитратный буферные растворы и т.п. Для инъекции вакцины по настоящему изобретению, прежде всего, можно использовать воду или, предпочтительно, буферный раствор, более предпочтительно водный буферный раствор, содержащий натриевую соль, предпочтительно по крайней мере 50 мМ раствор натриевой соли, кальциевую соль, предпочтительно по крайней мере 0,01 мМ раствор кальциевой соли, и необязательно калиевую соль, предпочтительно по крайней мере 3 мМ раствор калиевой соли. Согласно предпочтительному варианту натриевая, кальциевая и необязательно калиевая соли представлены в форме галогенидов, например, хлоридов, иодидов или бромидов, или в форме гидроксидов, карбонатов, гидрокарбонатов или сульфатов и т.п. Не ограничиваясь только ими, примеры натриевых солей включают, например, NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, примеры необязательных калиевых солей включают, например, KCl, KI, KBr, K2CO3, KHCO3, K2SO4, а примеры кальциевых солей включают, например, CaCl2, CaI2, CaBr2, СаСО3, CaSO4, Ca(OH)2. Кроме того, в буферном растворе могут содержаться органические анионы упомянутых выше катионов. Согласно более предпочтительному варианту буферный раствор, пригодный для инъекции, как определено выше, может содержать соли, выбранные из хлорида натрия (NaCl), хлорида кальция (CaCl2) и необязательно хлорида калия (KCl), при этом кроме хлоридов могут присутствовать другие анионы. CaCl2 можно заменить на другую соль, подобную KCl. Обычно соли в буферном растворе для инъекции присутствуют при концентрация по крайней мере 50 мМ в случае хлорида натрия (NaCl) по крайней мере 3 мМ в случае хлорида калия (KCl) и по крайней мере 0,01 мМ в случае хлорида кальция (CaCl2). В качестве буферного раствора для инъекции можно использовать гипертонический, изотонический или гипотонический раствор по сравнению со специфической средой для сравнения, т.е. буферный раствор характеризуется более высоким, равным или более низким содержанием соли по сравнению со специфической средой для сравнения, причем предпочтительно использовать такие концентрации упомянутых выше солей, которые не приводят к повреждению клеток за счет осмоса или концентрационных эффектов. Среды для сравнения включают, например, среды, присутствующие «in vivo», т.е. биологические жидкости, такие как кровь, лимфа, цитозоль, или другие биологические жидкости, или, например, жидкости, которые можно использовать в качестве сред для сравнения «in vitro», такие как стандартные буферные растворы или жидкости. Указанные стандартные буферные растворы или жидкости известны специалисту в данной области. В качестве жидкой основы, прежде всего, предпочтителен лактатный раствор Рингера.
Однако также можно использовать один или более совместимых твердых или жидких наполнителей или разбавителей или инкапсулирующих соединений, которые пригодны для введения пациенту. Используемый в данном контексте термин «совместимый» обозначает, что компоненты вакцины по настоящему изобретению можно смешивать по крайней мере с одной РНК в составе активной (иммуностимулирующей) композиции, кодирующей по крайней мере два антигена, как определено выше, и при этом в обычных условиях не происходит никаких взаимодействий, которое в значительной степени снижают фармацевтическую эффективность вакцины по настоящему изобретению. Безусловно, фармацевтически приемлемые носители, наполнители и разбавители должны характеризоваться достаточно высокой степенью чистоты и достаточно низкой токсичностью, то есть их можно использовать для введения субъекту, нуждающемуся в лечении. Некоторые примеры соединений, которые можно использовать в качестве фармацевтически приемлемых носителей, наполнителей или их компонентов включают сахара, такие как, например, лактоза, глюкоза и сахароза, крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал, целлюлозу и ее производные, такие как, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы, порошкообразный трагакант, солод, желатин, жир, твердые скользящие вещества, такие как, например, стеариновая кислота, стеарат магния, сульфат кальция, растительные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао, полиолы, такие как, например, полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль,альгиновую кислоту.
Выбор фармацевтически приемлемого носителя в принципе определяется способом введения вакцины по настоящему изобретению. Вакцину по настоящему изобретению можно вводить, например, системным или местным способом. Способы системного введения в основном включают, например, чрескожный, пероральный, парентеральный способы, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции/или интраназальные способы введения. Способы местного введения в основном включают, например, способы местного применения, а также внутрикожные, чрескожные, подкожные или внутримышечные инъекции или введение внутрь пораженных тканей, внутричерепные, внутрилегочные, внутрисердечные и подъязычные инъекции. Более предпочтительно, вакцины можно вводить внутрикожным, подкожным или внутримышечным способом. В связи с этим, композиции/вакцины предпочтительно получают в виде состава в жидкой или твердой форме. Пригодное количество вакцины по настоящему изобретению, предназначенной для введения, определяют по данным стандартных экспериментов на моделях животных. Указанные модели включают, но, не ограничиваясь только ими, модели кролика, овцы, мыши, крысы, собаки и нечеловекообразных приматов. Предпочтительные стандартные лекарственные формы для инъекции включают стерильные водные растворы, стерильные физиологические растворы или их смеси. рН указанных растворов доводят приблизительно до 7,4. Пригодные носители для инъекции включают гидрогели, устройства с контролируемым или замедленным высвобождением, полимолочную кислоту и коллагеновые матрицы. Пригодные фармацевтически приемлемые носители для местного применения включают носители, которые пригодны для применения в лосьонах, кремах, гелях и т.п. Если вакцина по настоящему изобретению предназначена для перорального введения, предпочтительной стандартной лекарственной формой являются таблетки, капсулы и т.п. Фармацевтически приемлемые носители для получения стандартных лекарственных форм, которые можно использовать для перорального введения, известны в предшествующем уровне данной области техники. В связи с этим, их выбор зависит от вторичных факторов, таких как вкус, стоимость и стабильность при хранении, которые не учитывались при создании настоящего изобретения, и такие носители может выбрать специалист в данной области техники.
Для дальнейшего повышения иммуногенности вакцина по настоящему изобретению может дополнительно включать одно или более вспомогательных веществ. Таким образом, предпочтительно достигается синергетическое действие по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции, как определено выше, и вспомогательного вещества, которое необязательно присутствует в вакцине по настоящему изобретению, как описано выше. В этом отношении в зависимости от различных типов вспомогательных веществ можно обсуждать различные механизмы действия. Например, в первый класс пригодных вспомогательных веществ включены соединения, которые обеспечивают созревание дендритных клеток (ДК), например, липополисахариды, ФНО-α или лиганд CD40. В основном, в качестве вспомогательного вещества можно использовать любой агент, который действует на иммунную систему по механизму «сигнал об опасности» (ЛПС, GP96 и т.п.), или цитокины, такие как гранулоцитарно-макрофагоцитарный колониестимулирующий фактор (ГМ-КСФ), которые влияют на иммунный ответ, индуцированный иммуностимулирующим адъювантом по настоящему изобретению, или усиливают его по механизму лиганд-мишень. Прежде всего, предпочтительными вспомогательными веществами являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые в дополнение к индуцированию приобретенного иммунного ответа за счет кодирования по крайней мере двух антигенов повышают врожденный иммунитет, такие как ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-12, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18, ИЛ-19, ИЛ-20, ИЛ-21, ИЛ-22, ИЛ-23, ИЛ-24, ИЛ-25, ИЛ-26, ИЛ-27, ИЛ-28, ИЛ-29, ИЛ-30, ИЛ-31, ИЛ-32, ИЛ-33, интерфероны: ИФ-α, ИФ-β, ИФ-γ, ГМ-КСФ, Г-КСФ, М-КСФ, LT-β или ФНО-α, факторы роста, такие как гормоны роста человека.
Другие добавки, которые можно включать в вакцину по настоящему изобретению, включают эмульгаторы, такие как, например, твин®, смачивающие агенты, такие как, например, лаурилсульфат натрия, красители, агенты для улучшения вкуса, фармацевтические носители, агенты для получения таблеток, стабилизаторы, антиоксиданты, консерванты.
Вакцина по настоящему изобретению, кроме того, включает также любое другое соединение, которое известно в качестве иммуностимулирующего в связи с его связывающей аффинностью (в качестве лигандов) в отношении Toll-подобных рецепторов человека TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, или в связи со связывающей аффинностью (в качестве лигандов) в отношении Toll-подобных рецепторов мыши TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
Другим классом соединений, которые можно добавлять в вакцину по настоящему изобретению в данном контексте, являются нуклеиновые кислоты CpG, прежде всего, CpG-PHK или CpG-ДНК. CpG-PHK или CpG-ДНК включают одноцепочечную CpG-ДНК (оцСрО-ДНК), двухцепочечную CpG-ДНК (дцДНК), одноцепочечную CpG-PHK (оцСрО-РНК) или двухцепочечную CpG-PHK (дцСрС-РНК). Нуклеиновая кислота CpG предпочтительно присутствует в форме CpG-PHK, более предпочтительно в форме одноцепочечной CpG-PHK (оцСрО-РНК). Нуклеиновая кислота CpG предпочтительно содержит по крайней мере одну или более одну или более (митогенную) динуклеотидную последовательностей) цитозин/гуанин (мотив (ы) CpG). Согласно первому предпочтительному варианту по крайней мере один мотив CpG, присутствующий в указанных последовательностях, т.е. С (цитозин) и G (гуанин) в мотиве CpG, является неметилированным. Все остальные остатки цитозина или гуанина, необязательно содержащиеся в указанных последовательностях, являются метилированными или неметилированными. Однако в другом предпочтительном варианте С (цитозин) и G (гуанин) в мотиве CpG также могут присутствовать в метилированной форме.
Согласно другому предпочтительному варианту осуществления настоящего изобретения активную (иммуностимулирующую) композицию по настоящему изобретению можно использовать (для получения вакцины по настоящему изобретению) для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
Согласно следующему предпочтительному варианту осуществления настоящего изобретения вакцину по настоящему изобретению или по крайней мере одну РНК, кодирующую по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, можно использовать для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
В данном контексте настоящее изобретение включает также способы лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений при введении пациенту, нуждающемуся в указанном лечении, фармацевтически эффективного количества вакцины по настоящему изобретению, или фармацевтически эффективного количества активной (иммуностимулирующей) композиции по настоящему изобретению. Указанный способ обычно включает необязательную первую стадию получения активной (иммуностимулирующей) композиции по настоящему изобретению, или вакцины по настоящему изобретению, и вторую стадию, включающую введение (фармацевтически эффективного количества) указанной активной (иммуностимулирующей) композиции по настоящему изобретению или указанной вакцины по настоящему изобретению пациенту, нуждающемуся в указанном лечении. Пациентом, нуждающимся в указанном лечении, обычно является любое млекопитающее. В контексте настоящего изобретения млекопитающее предпочтительно обозначает млекопитающее, выбранное из группы, включающей, но, не ограничиваясь только ими, например, козу, крупный рогатый скот, свинью, собаку, кошку, осла, обезьяну, человекообразную обезьяну, грызуна, такого как мышь, хомяк, кролик и, прежде всего, человека, при этом млекопитающее обычно страдает от рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
Настоящее изобретение относится также к применению (для получения вакцины по настоящему изобретению) активной (иммуностимулирующей) композиции по настоящему изобретению или по крайней мере одной РНК, кодирующей по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, предпочтительно для индуцирования иммунного ответа у млекопитающего, предпочтительно для лечения рака предстательной железы (РПЖ), более предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
Аналогичным образом настоящее изобретение относится также к применению вакцины по настоящему изобретению как таковой или по крайней мере одной РНК, кодирующей по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, для индуцирования приобретенного иммунного ответа у млекопитающего, предпочтительно для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
Профилактику или лечение рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, проводят при введении активной (иммуностимулирующей) композиции по настоящему изобретению и/или вакцины по настоящему изобретению однократно или поочередно, например, в виде набора компонентов, где каждый компонент содержит по крайней мере один предпочтительно различный антиген. Для введения предпочтительно используют любой способ введения, как определено выше. Например, лечение рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, проводят при индуцировании или усилении приобретенного иммунного ответа за счет действия по крайней мере двух (специально выбранных) антигенов, кодируемых по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению. Активную (иммуностимулирующую) композицию по настоящему изобретению и/или вакцину по настоящему изобретению вводят до и/или после введения или одновременно с введением другой активной (иммуностимулирующей) композиции по настоящему изобретению и/или вакцины по настоящему изобретению, как определено в данном контексте, которая включает другую комбинацию РНК, кодирующих другие антигены, при этом каждый антиген, кодируемый по крайней мере одной РНК в составе активной (иммуностимулирующей) композиции по настоящему изобретению, предпочтительно можно использовать для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. В данном контексте лечение, как определено в настоящем описании, включает также модуляцию заболевания, связанного с раком предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентным раком предстательной железы, а также родственными заболеваниями или нарушениями.
Согласно еще одному варианту настоящее изобретение, кроме того, относится к применению (для получения вакцины (по настоящему изобретению)) активной (иммуностимулирующей) композиции по настоящему изобретению или по крайней мере одной РНК, кодирующей по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, для модуляции, предпочтительно для индуцирования или усиления иммунного ответа у млекопитающего, как определено выше, более предпочтительно для лечения и/или поддерживающего лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, или родственных заболеваний или нарушений. В данном контексте поддерживающее лечение рака предстательной железы (РПЖ) включает любую комбинацию стандартных способов лечения рака предстательной железы, таких как хирургия, лучевая терапия, гормональная терапия, периодически проводимая химиотерапия, протонная терапия, или некоторая комбинация указанных способов, а также лечение с использованием активной (иммуностимулирующей) композиции по настоящему изобретению, как определено в данном контексте. Поддерживающее лечение рака предстательной железы (РПЖ) также предусмотрено в любых других вариантах, определенных в данном контексте.
Активную (иммуностимулирующую) композицию по настоящему изобретению или по крайней мере одну РНК, кодирующую по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, или вакцину по настоящему изобретению вводят поочередно. Поочередный курс лечения обозначает, например, что активную (иммуностимулирующую) композицию по настоящему изобретению или по крайней мере одну РНК, кодирующую по крайней мере два (предпочтительно) различных антигена, как определено в данном контексте, или вакцину по настоящему изобретению вводят до и/или после проведения или одновременно с проведением стандартного курса лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, например, лекарственное средство по настоящему изобретению или активную (иммуностимулирующую) композицию по настоящему изобретению или вакцину вводят до и/или после проведения или одновременно с проведением курса лечения или введения терапевтического агента, пригодного для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. Указанный поочередный курс лечения проводят, например, с использованием набора, предпочтительно набора компонентов, как определено ниже.
Поочередный курс лечения в дополнительном или в альтернативном варианте включает также введение активной (иммуностимулирующей) композиции по настоящему изобретению или вакцины, предпочтительно по крайней мере одной РНК, кодирующей по крайней мере два (предпочтительно различных) антигена, как определено выше, в форме, в которой по крайней мере одну РНК, кодирующую по крайней мере два (предпочтительно различных) антигена, как определено выше, предпочтительно являющуюся частью активной (иммуностимулирующей) композиции по настоящему изобретению или вакцины, вводят до или после введения или одновременно с введением другой по крайней мере одной РНК, кодирующей по крайней мере два (предпочтительно различных) антигена, как определено выше, предпочтительно являющейся частью той же самой активной (иммуностимулирующей) композиции по настоящему изобретению или вакцины. Предпочтительно введение (всех указанных РНК) осуществляют в течение 1 ч, более предпочтительно в течение 30 мин, наиболее предпочтительно в течение 15, 10, 5, 4, 3 или 2 мин или даже в течение 1 мин. Указанный поочередный курс лечения проводят, например, с использованием набора, предпочтительно набора компонентов, как определено ниже.
Согласно последнему варианту в настоящем изобретении предлагаются также наборы, прежде всего наборы компонентов, включающие активную (иммуностимулирующую) композицию по настоящему изобретению, и/или вакцину по настоящему изобретению, а также необязательно инструкции по введению и дозировке активной (иммуностимулирующей) композиции по настоящему изобретению и/или вакцины по настоящему изобретению. Инструкции содержат информацию по введению и дозировке активной (иммуностимулирующей) композиции по настоящему изобретению, и/или вакцины по настоящему изобретению. Указанные наборы, предпочтительно наборы компонентов, можно использовать, например, для любого упомянутого выше назначения или применения, предпочтительно для применения по крайней мере одной активной (иммуностимулирующей) композиции по настоящему изобретению (для получения лекарственного средства по настоящему изобретению, предпочтительно вакцины) для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. Наборы можно также использовать для применения по крайней мере одной активной (иммуностимулирующей) композиции по настоящему изобретению (для получения вакцины по настоящему изобретению) для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, при этом активная (иммуностимулирующая) композиция по настоящему изобретению и/или вакцина благодаря кодированию по крайней мере двух антигенов, может индуцировать или усиливать иммунный ответ у млекопитающего, как определено выше. Указанные наборы, кроме того, можно использовать для применения по крайней мере одной активной (иммуностимулирующей) композиции по настоящему изобретению (для получения лекарственного средства по настоящему изобретению, предпочтительно вакцины) для модуляции, предпочтительно для выработки, например, для индуцирования или усиления иммунного ответа у млекопитающего, как определено выше, и предпочтительно для поддерживающего лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. Наборы компонентов в качестве специальной формы наборов может содержать одну или более идентичных или различных активных (иммуностимулирующих) композиций по настоящему изобретению и/или одну или более идентичных или различных вакцин по настоящему изобретению в различных компонентах набора. Наборы могут также включать в качестве различных компонентов активную (иммуностимулирующую) композицию по настоящему изобретению (например, одну), вакцину по настоящему изобретению (например, одну) и/или по крайней мере одну РНК, кодирующую по крайней мере один антиген, как определено выше, например, каждый компонент набора содержит по крайней мере одну РНК, кодирующую предпочтительно различный антиген. Кроме того, возможна комбинация двух типов наборов компонентов. Наборы компонентов можно использовать, например, если предполагается поочередный курс лечения, например, при использовании различных составов и/или повышенных концентраций активной (иммуностимулирующей) композиции по настоящему изобретению, вакцины по настоящему изобретению и/или по крайней мере одной РНК, кодирующей по крайней мере один антиген, как определено выше, в ходе одного курса лечения in vivo. Наборы компонентов можно использовать, если предполагается или назначен (например, по техническим причинам) отдельный состав или отдельное введение различных антигенов активной (иммуностимулирующей) композиции по настоящему изобретению (т.е. в виде отдельных компонентов), но, тем не менее, например, требуется обеспечить совместное присутствие различных антигенов in vivo. Прежде всего, наборы компонентов используют в виде специальной формы наборов, в которой каждый компонент содержит по крайней мере один предпочтительно различный антиген, как определено выше, при этом все компоненты набора предпочтительно входят в состав активной (иммуностимулирующей) композиции по настоящему изобретению или вакцины по настоящему изобретению, как определено в данном контексте. Указанные специфические наборы компонентов, прежде всего, можно использовать, если, например, различные антигены включены в различные компоненты набора в отдельности, но затем их вводят млекопитающему, нуждающемуся в указанном лечении, одновременно друг с другом или поочередно. В последнем случае все различные компоненты указанного набора обычно вводят в течение короткого периода времени, и таким образом сразу после введения последнего компонента набора в организме млекопитающего присутствуют все антигены. Любой описанный выше набор можно использовать для лечения, как определено выше.
Преимущества настоящего изобретения
В настоящем изобретении предлагается активная (иммуностимулирующая) композиция для лечения рака предстательной железы (РПЖ), которая включает по крайней мере одну РНК, предпочтительно мРНК, кодирующую по крайней мере два (предпочтительно различных) антигена, способных индуцировать (приобретенный) иммунный ответ у млекопитающего, при этом антигены выбирают из группы, включающей простат-специфический антиген (ПСА), простат-специфический мембранный антиген (ПСМА), антиген стволовых клеток предстательной железы (АСКП) и шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП). Указанная активная (иммуностимулирующая) композиция обеспечивает эффективное лечение рака предстательной железы (РПЖ) или поддерживающее лечение при использовании стандартных способов лечения. Кроме того, при применении РНК в качестве подхода для лечения исключается проблема неконтролируемого размножения введенных последовательностей ДНК. РНК, используемая в активной (иммуностимулирующей) композиции, характеризуется значительными дополнительными преимуществами по сравнению с системами на основе экспрессии ДНК, например, в отношении иммунного ответа, иммунизации или вакцинации. Указанные преимущества включают, среди прочего, невозможность интегрирования введенной в клетку РНК в геном. При этом исключается риск мутации указанного гена, который в противном случае полностью или частично инактивируется или приводит к передаче ложной информации. Кроме того, при этом исключаются другие виды риска применения ДНК в качестве агента для индуцирования иммунного ответа (например, в качестве вакцины), такие как индуцирование патогенных антител против ДНК у пациента, которому вводят чужеродную ДНК, которая индуцирует иммунный ответ (возможно летальный). И наоборот, до настоящего времени антител против РНК не обнаружено.
Чертежи
Следующие чертежи представлены для иллюстрации настоящего изобретения и не ограничивают его объем.
На фиг.1 представлен плазмидный конструкт RNActive САР-КЛК3(GC)-muag-A70-C30 (SEQ ID NO:1), кодирующий простат-специфический антиген (ПСА, известный также как КЛК3). Указанный конструкт включает следующие элементы последовательности:
оптимизированную по содержанию GC последовательность для стабилизации и усовершенствования использования кодонов,
~ 70 остатков аденозина в концевом 3'-фрагменте (полиА-концевой фрагмент),
~ 30 остатков цитозина в концевом 3'-фрагменте (полиС-концевой фрагмент).
Указанный конструкт ДНК соответствует кодирующей мРНК и служит в качестве основы для получения соответствующего конструкта РНК при проведении экспериментов по транскрипции in vitro.
На фиг.2 представлена кодирующая последовательность дикого типа, соответствующая последовательности конструкта РНК RNActive CAP-КЛК3(GC)-muag-A70-C30 (SEQ ID NO:2), кодирующая простат-специфический антиген (ПСА, известный также как КЛК3), т.е. кодирующая последовательность (КД) простат-специфического антигена (ПСА) в отсутствии оптимизированной по содержанию GC последовательности.
На фиг.3 представлена оптимизированная по содержанию GC кодирующая последовательность конструкта РНК RNActive CAP-КЛК3(GC)-muag-A70-C30 (SEQ ID NO:3), кодирующая простат-специфический антиген (ПСА, известный также как КЛК3), т.е. кодирующая последовательность (КД) простат-специфического антигена (ПСА), содержащая оптимизированную по содержанию GC последовательность.
На фиг.4 представлена последовательность плазмидного конструкта RNActive CAP-ФОЛГ-1(GC)-muag-A70-C30 (SEQ ID NO:4), кодирующая простат-специфический мембранный антиген (ПСМА, известный также как ФОЛГ-1). Указанный конструкт включает следующие элементы последовательности:
оптимизированную по GC последовательность для стабилизации и усовершенствования использования кодонов,
~ 70 остатков аденозина в концевом 3'-фрагменте (полиА-концевой фрагмент),
~ 30 остатков цитозина в концевом 3'-фрагменте (полиС-концевой фрагмент).
Указанный конструкт ДНК соответствует кодирующей мРНК и служит в качестве основы для образования соответствующего конструкта РНК при проведении экспериментов по транскрипции in vitro.
На фиг.5 представлена кодирующая последовательность дикого типа, соответствующая последовательности конструкта РНК RNActive САР-ФОЛГ-1(GC)-muag-A70-C30 (SEQ ID NO:5), кодирующая простат-специфический мембранный антиген (ПСМА, известный также как ФОЛГ-1), т.е. кодирующая последовательность (КД) простат-специфического мембранного антигена (ПСМА, известный также как ФОЛГ-1) в отсутствии оптимизированной по содержанию GC последовательности.
На фиг.6 представлена оптимизированная по содержанию GC кодирующая последовательность конструкта РНК RNActive CAP-ФОЛГ-1(GC)-muag-A70-C30 (SEQ ID NO:6), кодирующая простат-специфический мембранный антиген (ПСМА, известный также как ФОЛГ-1), т.е. кодирующая последовательность (КД) простат-специфического мембранного антигена (ПСМА, известный также как ФОЛГ-1) в присутствии оптимизированной по содержанию GC последовательности.
На фиг.7 представлена последовательность плазмидного конструкта RNActive CAP-АСКП(GC)-muag-A70-C30 (SEQ ID NO:7), кодирующая антиген стволовых клеток предстательной железы (АСКП). Указанный конструкт включает следующие элементы последовательности:
оптимизированную по содержанию GC последовательность для стабилизации и усовершенствования использования кодонов,
~ 70 остатков аденозина в концевом 3'-фрагменте (полиА-концевой фрагмент),
~ 30 остатков цитозина в концевом 3'-фрагменте (полиС-концевой фрагмент).
Указанный конструкт ДНК соответствует кодирующей мРНК и служит в качестве основы для образования соответствующего конструкта РНК при проведении экспериментов по транскрипции in vitro.
На фиг.8 представлена кодирующая последовательность дикого типа, соответствующая конструкту РНК RNActive CAP-АСКП(GC)-muag-A70-C30 (SEQ ID NO:8), кодирующая антиген стволовых клеток предстательной железы (АСКП), т.е. кодирующая последовательность (КД) антигена стволовых клеток предстательной железы (АСКП) в отсутствии оптимизированной по содержанию GC последовательности.
На фиг.9 представлена оптимизированная по содержанию GC кодирующая последовательность конструкта РНК RNActive CAP-АСКП(GC)-muag-A70-C30 (SEQ ID NO:9), кодирующая антиген стволовых клеток предстательной железы (АСКП), т.е. кодирующая последовательность (КД) антигена стволовых клеток предстательной железы (АСКП), содержащая оптимизированную по содержанию GC последовательность.
На фиг.10 представлена последовательность плазмидного конструкта RNActive CAP-ШТЕАП(GC)-muag-A70-C30 (SEQ ID NO:10), кодирующая шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП). Указанный конструкт включает следующие элементы последовательности:
оптимизированную по содержанию GC последовательность для стабилизации и усовершенствования использования кодонов,
~ 70 остатков аденозина в концевом 3'-фрагменте (полиА-концевой фрагмент),
~ 30 остатков цитозина в концевом 3'-фрагменте (полиС-концевой фрагмент).
Указанный конструкт ДНК соответствует кодирующей мРНК и служит в качестве основы для образования соответствующего конструкта РНК при проведении экспериментов по транскрипции in vitro.
На фиг.11 представлена кодирующая последовательность дикого типа, соответствующая конструкту РНК RNActive CAP-ШТЕАП(GC)-muag-A70-C30 (SEQ ID NO:11), кодирующая шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП), т.е. кодирующая последовательность (КД) шестого трансмембранного эпителиального антигена предстательной железы (ШТЭАП) в отсутствии оптимизированной по содержанию GC последовательности.
На фиг.12 представлена обогащенная по содержанию GC кодирующая последовательность, соответствующая конструкту РНК RNActive CAP-ШТЕАП(GC)-muag-A70-C30 (SEQ ID NO:12), кодирующая шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП), т.е. кодирующая последовательность (КД) шестого трансмембранного эпителиального антигена предстательной железы (ШТЭАП), содержащая оптимизированную по содержанию GC последовательность.
На фиг.13 показана детекция антиген-специфического иммунного ответа (иммунного ответа В-клеток) при определении антиген-специфических антител. Как видно на фиг.13, при введении смеси РНК, т.е. смеси РПЖ-РНК, включающей мРНК, кодирующую ПСА, ПСМА, АСКП или ШТЕАП, соответственно, наблюдается значительная индукция антиген-специфического иммунного ответа (иммунного ответа В-клеток) за счет образования значительного количества антител IgG2a против ПСА по сравнению с образцами, содержащими буферный раствор, или с контролем.
На фиг.14 показана детекция антиген-специфического клеточного иммунного ответа методом иммуноферментного анализа ELISPOT. Как видно на фиг.14, вакцинация мышей смесью РНК, т.е. смесью РПЖ-РНК, включающей мРНК, кодирующую ПСА, ПСМА, АСКП или ШТЕАП, соответственно, или вакцинация мРНК, кодирующей ПСА, ПСМА, АСКП или ШТЕАП, соответственно, приводит к значительной индукции антиген-специфического иммунного ответа (ЦТЛ) за счет образования значительного количества ИФ-γ по сравнению с наивными мышами и мышами, которым вводили буферный раствор.
На фиг.15 показана иммунизация и оценка размера привитой опухоли при введении смеси РПЖ-РНК по настоящему изобретению, включающей мРНК (5 мкг), кодирующую ПСА, ПСМА, АСКП и ШТЕАП, соответственно. Как показано на фиг.15, размер опухоли значительно снижается при иммунизации смесью РПЖ-РНК по п. а), включающей мРНК, кодирующую ПСА, ПСМА, АСКП и ШТЕАП, соответственно, которую вводят 2 раза внутримышечно. Размер опухоли снижается в еще более значительной степени, если смесь РПЖ-РНК по п. а) вводят внутримышечно 4 раза.
На фиг.16 представлена индукция ПСА-специфических антител IgG1. На фиг.16, прежде всего, показано присутствие антител IgG1, специфических к опухолевому антигену ПСА, у мышей, которым вводили вакцину мРНК, состоящую из 4 компонентов, содержащую оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Каждую мРНК получали в комбинации с катионным пептидом, протамином. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера), или РНК другого типа (Рр Luc), полученную в комбинации с протамином аналогично вакцине мРНК. Для анализа объединяли сыворотку 5 мышей в каждой группе и титровали. Величина ошибки (отрезок прямой) представляет среднее отклонение двух величин от среднего значения в двух повторах.
На фиг.17 представлена индукция ПСА-специфических антител IgG2a. На фиг.17, прежде всего, показано присутствие антител IgG2a, специфических к опухолевому антигену ПСА, у мышей, которым вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Каждую мРНК получали в комбинации с катионным пептидом, протамином. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера), или РНК другого типа (Рр Luc), полученную в комбинации с протамином аналогично вакцине мРНК. Для анализа объединяли сыворотку 5 мышей в каждой группе и титровали. Величина ошибки (отрезок прямой) представляет среднее отклонение двух величин от среднего значения в двух повторах.
На фиг.18 показаны результаты индукции АСКП-специфических антител IgG1. Прежде всего, на фиг 18 показано присутствие антител IgG1, специфических к опухолевому антигену АСКП, у мышей, которым вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Каждую мРНК получали в комбинации с катионным пептидом, протамином. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера). Для анализа объединяли сыворотку 5 мышей в каждой группе и титровали. Величина ошибки (отрезок прямой) представляет среднее отклонение двух величин от среднего значения в двух повторах.
На фиг.19 показана индукция ПСМА-специфических цитотоксических Т-клеток. 5 мышам в каждой группе вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека, или вводили мРНК другого типа (Рр Luc), полученную в комбинации с протамином аналогично вакцине мРНК. Спленоциты вакцинированных и контрольных мышей выделяли в день 6 после последней вакцинации и стимулировали библиотекой ПСМА или контрольной библиотекой пептидов. Секрецию ИФ-γ регистрировали ex vivo методом анализа ELISPOT. Линии представляют средние значения, и ряд из 5 мышей анализировали в каждой группе отдельно. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism, значение p рассчитывали с использованием одностороннего критерия Манна-Уитни.
На фиг.20 показана индукция ПСМА-специфических цитотоксических Т-клеток in vivo. Мышам C57BL/6 в ходе трех циклов вакцинации вводили внутрикожно вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Контрольным мышам вводили контрольную мРНК Рр Luc или буферный раствор (лактатный раствор Рингера). В день 6 после последней вакцинации селективно меченые спленоциты (30×106, популяции с низкой и высокой интенсивностью флуоресценции, нагруженные библиотекой ПСМА или контрольной библиотекой пептидов, смешанные при соотношении 1:1) вливали внутривенно. Через 16 ч спленоциты мышей-реципиентов выделяли и анализировали проточной цитометрией. Отдельные точки на графике представляют данные для отдельных мышей. Линии обозначают средние значения и диапазон значений. В каждой группе анализировали 5 мышей. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism, значение p рассчитывали с использованием одностороннего критерия Манна-Уитни.
На фиг.21 показана индукция ПСА-специфических цитотоксических Т-клеток памяти через 10 недель после последней вакцинации. Мышам C57BL/6 в ходе двух циклов вакцинации вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера). Через 10 недель после последней вакцинации селективно меченые спленоциты (30×106, популяции с низкой и высокой интенсивностью флуоресценции, нагруженные библиотекой ПСА или контрольной библиотекой пептидов, смешанные при соотношении 1:1) трансплантировали внутривенно. Через 16 ч спленоциты мышей-реципиентов выделяли и анализировали проточной цитометрией. Отдельные точки на графике соответствуют отдельным данным, а линии представляют средние значения для 6 мышей в каждой группе, которых анализировали в отдельности. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism, значение p рассчитывали с использованием одностороннего критерия Манна-Уитни.
На фиг.22 показана индукция АСКП-специфических цитотоксических Т-клеток памяти через 10 недель после последней вакцинации. Мышам C57BL/6 в ходе двух циклов вакцинации вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера). Через 10 недель после последней вакцинации селективно меченые спленоциты (30×106, популяции с низкой и высокой интенсивностью флуоресценции, нагруженные библиотекой АСКП или контрольной библиотекой пептидов, смешанные при соотношении 1:1) трансплантировали внутривенно. Через 16 ч спленоциты мышей-реципиентов выделяли и анализировали проточной цитометрией. Отдельные точки на графике соответствуют отдельным данным, а линии представляют средние значения для 6 мышей в каждой группе, которые анализировали в отдельности. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism, значение p рассчитывали с использованием одностороннего критерия Манна-Уитни.
На фиг.23 показано подавление роста опухоли у мышей, которым вводили вакцину мРНК, включающую 4 компонента, каждый из которых содержал оптимизированные по GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека. Мышам C57 BL/6 вводили внутрикожно в ходе двух циклов вакцинации вакцину мРНК. Контрольным мышам вводили буферный раствор. В день 15 после последней вакцинации мышам прививали опухоль при подкожном введении сингенных опухолевых клеток TRAMP-C1 (1×106). Регистрировали рост опухоли. На графике показан логарифм объема опухоли, определенный в день 52 после прививки опухоли. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism, значение p рассчитывали с использованием одностороннего критерия Манна-Уитни.
Примеры
Следующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем.
1. Получение кодирующих плазмид
В следующем эксперименте последовательности ДНК, соответствующие последовательностям мРНК, кодирующим антигены
- простат-специфический антиген (ПСА),
- простат-специфический мембранный антиген (ПСМА),
- антиген стволовых клеток предстательной железы (АСКП) и
- шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП),
соответственно, получали и использовали в экспериментах по транскрипции и трансфекции in vitro. В связи с этим последовательность ДНК, соответствующую мРНК, кодирующей природный антиген (последовательности, включающие кодирующие последовательности, указанные на фиг.2, 5, 8 и фиг.11. т.е. SEQ ID NO:2, 5, 8 и 11), оптимизировали по содержанию GC для усовершенствованного использования кодонов и получали последовательность, включающую кодирующие последовательности, указанные на фиг.3, 6, 9 и фиг.12. т.е. SEQ ID NO: 3, 6, 9 и 12. Затем кодирующие последовательности переносили в оптимизированный по содержанию GC конструкт (фирмы CureVac GmbH, Tubingen, Германия), модифицированный за счет включения полиА-концевого фрагмента и полиС-концевого фрагмента (А70-С30). Получали конечные конструкты следующей структуры:
RNActive CAP-КЛК3(GC)-muag-A70-C30 (SEQ ID NO: 1),
RNActive CAP-ФОЛГ-1(GC)-muag-A70-C30 (SEQ ID NO: 4),
RNActive CAP-АСКП(GC)-muag-A70-C30 (SEQ ID NO: 7) и
RNActive CAP-ШТЕАП(GC)-muag-A70-C30 (SEQ ID NO: 10),
соответственно.
Конечные конструкты включали последовательность, соответствующую последовательностям, указанным на фиг.1, 4, 7 и фиг.10 (SEQ ID NO: 1, 4, 7 и 10), соответственно, которые включали следующие элементы последовательности:
- оптимизированную по содержанию GC последовательность для стабилизации и усовершенствованного использования кодонов,
~ 70 остатков аденозина в концевом 3'-фрагменте (полиА-концевой фрагмент),
30 остатков цитозина в концевом 3'-фрагменте (полиС-концевой фрагмент).
2. Транскрипция in vitro
Последовательности РНК получали транскрипцией in vitro на основе рекомбинантной плазмидной ДНК, полученной в примере 1. Для этого рекомбинантную плазмидную ДНК линеаризовали и затем проводили транскрипцию in vitro с использованием Т7 РНК-полимеразы. Затем матрицу ДНК разрушали расщеплением ДНКазой I и выделяли РНК осаждением в присутствии LiCl и затем очищали ЖХВР-экстракцией (PUREMessenger®, CureVac GmbH, Tübingen, Германия).
3. Образование комплексов с протамином
Для трансфекции РНК в клетки и организмы, предпочтительно получали комплекс РНК, полученной транскрипцией in vitro, более предпочтительно с протамином при смешивании РНК с протамином.
4. Эксперименты по иммунизации
Для иммунизации РНК, полученную в эксперименте транскрипции in vitro, как описано выше (см. эксперимент 2), предпочтительно полученную в комплексе с протамином, трансфектировали мышам (мышам С57 BL/6). Вакцинацию проводили в различных группах, при этом мышам одной группы (контрольной группы) вводили инъекцией буферный раствор в качестве контроля. В каждой группе 4 мышей иммунизировали при четырехкратном внутрикожном введении 20 мкг РНК (5 мкг на один ген), полученной в комплексе с протамином, при этом РНК кодировала ПСА, ПСМА, АСКП и ШТЕАП.
5. Оценка антиген-специфического иммунного ответа (иммунного ответа В-клеток)
Антиген-специфический иммунный ответ (иммунный ответ В-клеток) оценивали при детектировании антиген-специфических антител. Для этого через одну неделю после последней вакцинации у вакцинированных мышей отбирали образцы крови и получали сыворотку. Планшеты MaxiSorb (фирмы Nalgene Nunc International) покрывали белком ПСА человека (0,5 мкг/лунка). После блокирования ФСБ 1×, содержащим 0,05% твин-20 и 1% БСА, планшеты инкубировали в присутствии разбавленной мышиной сыворотки (1:30, 1:90, 1:270, 1:810). Затем добавляли конъюгат биотина и вторичных антител (антимышиный IgG2a фирмы Pharmingen). После промывки планшет инкубировали в присутствии конъюгата стрептавидина и пероксидазы хрена и затем определяли степень превращения субстрата ABTS (2,2'-азино-бис-(3-этилбензотиазолин-6-сульфоной кислоты).
Как показано на фиг.13, при введении смеси РНК, т.е. смеси РПЖ-РНК, включающей мРНК, кодирующую ПСА, ПСМА, АСКП или ШТЕАП, соответственно (последовательности, указанные на фиг.1, 4, 7 и фиг.10 (SEQ ID NO: 1, 4, 7 и 10), соответственно), наблюдается значительная индукция антиген-специфического иммунного ответа (иммунного ответа В-клеток) при образовании значительного количества антител IgG2a против ПСА по сравнению с образцами, полученными от контрольных мышей.
6. Оценка антиген-специфического клеточного иммунного ответа методом ELISPOT
Через 2 месяца после последней вакцинации мышей забивали, удаляли селезенку и выделяли спленоциты. Спленоциты инкубировали в течение 7 сут в присутствии ИЛ-4 для селекции дендритных клеток. Для оценки антиген-специфического клеточного иммунного ответа после повторной стимуляции определяли уровень секреции ИФ-γ. В качестве клеток-мишеней использовали спленоциты наивной мыши, которые электропорировали в присутствии смеси РПЖ-мРНК (смесь) или мРНК, кодирующей ПСА, ПСМА, АСКП или ШТЕАП (последовательности, указанные на фиг.1, 4, 7 и фиг.10 (SEQ ID NO: 1, 4, 7 и 10), соответственно).
Для определения ИФ-γ многолуночный планшет с нанесенным покрытием (фирмы Millipore) инкубировали в течение ночи в присутствии 0,1 М карбонат-бикарбонатного буферного раствора для нанесения покрытия (рН 9,6, 10,59 г/л Na2CO3, 8,4 г/л NaHCO3), содержащего антитела против ИФ-γ (фирмы BD Pharmingen, Heidelberg, Германия). Клетки-мишени инкубировали в смеси с клетками-эффекторами в планшете при соотношении 1:20 в течение 24 ч. Планшет промывали ФСБ 1× и инкубировали в присутствии конъюгата биотина с вторичными антителами. После промывки смесью ФСБ 1×/0,05% твин-20 в планшет добавляли субстрат (жидкая субстратная система 5-бром-4-хлор-3-индолилфосфат/нитросиний тетразолий фирмы Sigma Aldrich, Taufkirchen, Германия) и оценивали степень превращения субстрата визуально.
Как показано на фиг.14, вакцинация мышей смесью РПЖ-мРНК, кодирующей ПСА, ПСМА, АСКП или ШТЕАП (последовательности, представленные на фиг.1, 4, 7 и 10 (SEQ ID NO:1, 4, 7 и 10), соответственно) приводит к значительной индукции антиген-специфического иммунного ответа (ЦТЛ) в ответ на все четыре антигена при образовании значительного количества ИФ-γ по сравнению с наивными мышами и мышами, которым вводили буферный раствор.
7. Привитые опухоли
а) Иммунизация
мРНК (20 мкг, смесь РПЖ-РНК, включающую мРНК (5 мкг), кодирующую ПСА, ПСМА, АСКП и ШТЕАП, соответственно, например, конструкты RNActive CAP-КЛК3(GC)-muag-A70-C30, RNActive CAP-ФОЛГ-1(GC)-muag-A70-C30, RNActive CAP-АСКП(GC)-muag-A70-C30 и RNActive CAP-ШТЕАП(GC)-muag-A70-C30, соответственно (последовательности, указанные на фиг.1, 4, 7 и фиг.10, т.е. SEQ ID NO: 1, 4, 7 и 10)) вводили мышам внутримышечной инъекцией. Иммунизацию повторяли 1 или 3 раза в течение 7 недель. Через 40 дней после последней иммунизации мышам прививали подкожной инъекцией опухолевые клетки 1 Mio Tramp-C1. В течение 50 сут регистрировали объем опухоли.
б) Результаты
Как показано на фиг.15, объем опухоли значительно снижается при иммунизации смесью РПЖ-РНК по п. а), включающей мРНК, кодирующую ПСА, ПСМА, АСКП и ШТЕАП, соответственно, которую вводят внутримышечно 2 раза. Более значительное снижение объема опухоли наблюдается при введении смеси РПЖ-РНК по п. а) внутримышечно 4 раза.
8. Получение вакцины мРНК и индукция антиген-специфических цитотоксических антител и антиген-специфических цитотоксических Т-клеток
8.1 Получение вакцины мРНК
Вакцина мРНК включает оптимизированные по содержанию GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека (согласно SEQ ID NO:3, 6, 9 и 12), при этом каждую мРНК получают в комбинации с катионным пептидом, протамином, при массовом соотношении 4:1 (РНК/протамин), растворенным в лактатном растворе Рингера (80 об.%).
8.2 Вакцинация
Мышам C57 BL/6 вводили внутрикожно вакцину мРНК (64 мкг, 16 мкг на антиген), как описано выше в п.8.1. Контрольным мышам вводили буферный раствор (лактатный буферный раствор Рингера) или РНК другого типа (обогащенную по содержанию GC мРНК, кодирующую люциферазу светлячка Photinus pyralis (Pp Luc)), полученную в комбинации с протамином аналогично вакцине мРНК. Вакцинация включала два или три цикла иммунизации в неделю 1, 3 (и 7). Каждый цикл включал 4 инъекции в день 1, 2, 3 и 4 недели.
8.3 Прививка опухоли
В день 15 после завершения вакцинации каждой мыши подкожно трансплантировали клетки TRAMP-C1 (1×106, клеточная линия 1 трансгенной аденокарциномы предстательной железы мыши, экспрессирующая мышиные гомологи ПСМА, АСКП и ШТЕАП человека). Опухоли пальпировались через 4 недели после прививки опухолевых клеток. Рост опухоли регистрировали при измерении размера опухоли штангенциркулем.
8.4 Детектирование антиген-специфических антител
В день 14 после последней вакцинации образцы крови (200 мкл) отбирали из ретроорбитального сплетения и определяли в сыворотке подтипы антиген-специфических антител IgG1 и IgG2a с использованием следующей методики ИФА. 96-Луночные планшеты ИФА покрывали рекомбинантным белком АСКП или очищенным ПСА человека (в обоих случаях концентрация составляла 10 мкг/мл в буферном растворе для покрытия поверхности) и (после блокирования и промывки) инкубировали в присутствии сыворотки при 37°С в течение 4 ч. После инкубации в присутствии биотинилированных антител против IgG1 или IgG2a мыши и последующей инкубации в присутствии конъюгата стрептавидина и пероксидазы хрена добавляли субстрат ТМВ. Колориметрическую реакцию регистрировали при 450 нм с использованием ИФА ридера фирмы Tecan.
8.5 Анализ ELISPOT - оценка ответа цитотоксических Т-клеток (ЦТЛ)
Оценку ответа цитотоксических Т-лимфоцитов (ЦТЛ) проводили по уровню секреции ИФ-γ в ответ на специфический стимул, реакцию оценивали визуально на уровне одной клетки с использованием анализа ELISPOT.
Спленоциты мышей, которым вводили вакцину мРНК, как описано выше в п.8.1, и спленоциты контрольных мышей выделяли в день 6 после последней вакцинации (третьего цикла вакцинации) и затем переносили в 96-луночные ИФА планшеты, предварительно покрытые антителами к α-ИФ-γ. Затем клетки стимулировали при 37°С в течение 24 ч библиотекой пептидов ПСМА или библиотекой пептидов ВИЧ. Обе библиотеки использовали при концентрации 1 мкг/пептид/мл. После инкубационного периода клетки вымывали из планшета и регистрировали секретируемый клетками ИФ-γ с использованием биотинилированного вторичного антитела против ИФ-γ мыши, затем в присутствии конъюгата стрептавидин-AKP. Пятна визуализировали с использованием субстрата BCIP/NBT и подсчитывали с использованием автоматического ридера ELISPOT (Immunospot Analyzer, CTL Analyzers LLC).
8.6 Цитотоксичность in vivo
Для оценки активности цитотоксических Т-клеток in vivo проводили лизис специфических клеток-мишеней вакцинированных и контрольных мышей.
Анализ проводили через одну неделю, а также через 10 недель после последней иммунизации для оценки индукции цитотоксических Т-лимфоцитов памяти.
Спленоциты наивных мышей-доноров выделяли и включали метку с использованием флуоресцентного красителя CFSE при двух различных концентрациях красителя. Таким образом, получали две популяции с высокой и низкой интенсивностью флуоресценции. Клетки с низкой флуоресценцией нагружали укороченными пептидами из библиотеки ПСМА, ПСА или АСКП (1 мкг/мл/пептид) при 37°С в течение 3 ч. Контрольные клетки с высокой флуоресценцией нагружали библиотекой пептидов ВИЧ Pol (1 мкг/мл/пептид), соответственно. Обе популяции смешивали при соотношении клетка/клетка 1:1 и трансплантировали внутривенно наивным или вакцинированным мышам-реципиентам. Через 16 ч спленоциты мышей-реципиентов выделяли и подсчитывали число флуоресцентных клеток проточной цитометрией. Сдвиг соотношения число клеток с низкой флуоресценцией/число клеток с высокой флуоресценцией у вакцинированных мышей отражает специфическую гибель клеток-мишеней in vivo. Точное соотношение число наблюдаемых специфических клеток-мишеней/число наблюдаемых контрольных клеток оценивали в виде средней величины, усредненной по данным для всех контрольных мышей. Указанное соотношение позволяет предсказать ожидаемое число специфических мишеней у вакцинированных мышей с учетом наблюдаемого числа контрольных клеток. Соотношение, наблюдаемое число специфических мишеней/предсказанное число специфических мишеней отражает долю выживших (не уничтоженных) специфических мишеней.
Для расчета использовали следующие формулы:
соотношение = число специфических мишеней (наблюдаемых) у контрольных мышей/число контрольных мишеней (наблюдаемых) у контрольных мышей,
соотношение × число наблюдаемых контрольных мишеней у вакцинированных мышей = предсказанное число специфических мишеней у вакцинированных мышей,
% гибели = (1-(число наблюдаемых специфических мишеней/рассчитанное число специфических мишеней).
8.7 Статистический анализ
Статистический анализ проводили с использованием программного обеспечения GraphPad Prism Software, версия 5.01. В связи с отсутствием нормального распределения популяций образцов и малым объемом выборки для анализа различий между исследуемыми группами с уровнем достоверности 5% использовали непараметрические критерии Манна-Уитни.
8.9 Результаты и обсуждение
Мышам вводили вакцину мРНК, включающую оптимизированные по содержанию GC мРНК, кодирующие дифференцировочные антигены ПСМА, ШТЕАП, ПСА и АСКП предстательной железы человека, полученные каждая в отдельности в комбинации с катионным пептидом, протамином, при массовом соотношении РНК/протамин 4:1. Контрольным мышам вводили буферный раствор (лактатный раствор Рингера) или РНК другого типа (Рр Luc), полученную в комбинации с протамином аналогично вакцине мРНК.
а) Индукция антиген-специфических антител в ответ на введение вакцины мРНК
Индукцию специфических антител оценивали для двух или четырех антигенов в зависимости от количества доступного рекомбинантного белка, требующегося для детекции антител. Для двух анализируемых белков, ПСА и АСКП, детектировали антиген-специфические антитела в сыворотке мышей, которым вводили вакцину мРНК. Полученные результаты свидетельствуют о том, что обе РНК являются функциональными и иммуногенными in vivo (см. фиг.16-18).
б) Индукция антиген-специфических цитотоксических Т-клеток в ответ на введение вакцины мРНК
Кроме того, активацию цитотоксических Т-клеток в ответ на введение вакцины мРНК оценивали двумя независимыми функциональными методами анализа: анализом секреции ИФ-γ и анализом цитотоксичности in vivo. ИФ-γ является главным медиатором ответа Th1 и секретируется активированными ЦТЛ. В связи с этим, антиген-специфические цитотоксические Т-клетки в спленоцитах вакцинированных мышей детектировали методом анализа ELISPOT. В качестве антигенного стимула для спленоцитов использовали библиотеку укороченных пептидов ПСМА. Стимуляция указанной библиотекой вызывает значительную секрецию ИФ-γ только в спленоцитах мышей, которым вводили вакцину мРНК, но не у контрольных мышей, которым вводили мРНК, кодирующую белок другого типа, люциферазу (Рр Luc). Все спленоциты не взаимодействуют с контрольной библиотекой пептидов ВИЧ (фиг.19).
Антиген-специфический клеточный иммунитет в ответ на ПСМА можно подтвердить анализом цитотоксичности in vivo. Специфическая гибель клеток-мишеней, нагруженных библиотекой укороченных пептидов ПСМА, наблюдается у всех пяти мышей, которым вводили вакцину мРНК, однако цитотоксическое действие изменяется в диапазоне от 12% до 90%. У мышей, которым вводили контрольную РНК (Рр Luc) или раствор для инъекции (лактатный буферный раствор Рингера), гибель слитых клеток-мишеней не наблюдается (см. фиг.20).
В другом эксперименте исследовали возможность индукции устойчивых эффектов памяти in vivo после введения вакцины мРНК. С этой целью детектировали антиген-специфические цитотоксические Т-клетки памяти через 10 недель после завершения вакцинации методом анализа цитотоксичности in vivo. Специфическая гибель клеток-мишеней наблюдается после вакцинации ПСА, а также АСКП (фиг.21-22). Объединенная вакцина мРНК индуцирует устойчивый продолжительный (по крайней мере, в течение 10 недель) клеточный иммунитет у мышей.
Наконец, исследовали способность вакцины мРНК индуцировать противоопухолевые ответы у мышей. Для этого использовали линию опухолевых клеток TRAMP-C1. Клетки TRAMP-C1 экспрессируют мышиные гомологи антигенов ПСМА, АСКП и ШТЕАП человека, которые включены в вакцину мРНК в качестве антигенов, кодируемых мРНК. Гомология антигенов мыши и человека изменяется в пределах 50-80% для различных антигенов. В связи с тем, что мышей вакцинировали мРНК, кодирующими белки человека, защита в отношении опухолевых клеток TRAMP-C1 опосредована только перекрестной реактивностью. Как показано на фиг.23, введение мышам вакцины мРНК опосредует защиту против роста трансплантированных опухолевых клеток TRAMP-C1. Полученные результаты указывают на способность вакцины мРНК индуцировать перекрестную реактивность у мышей.





















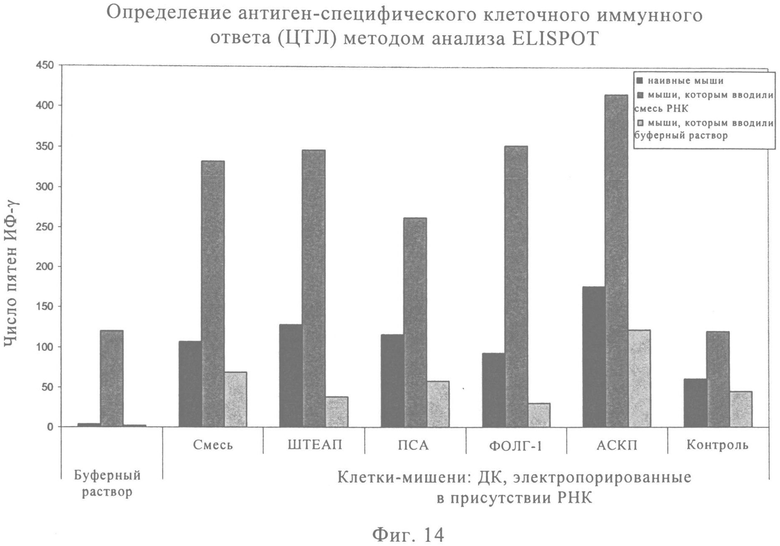
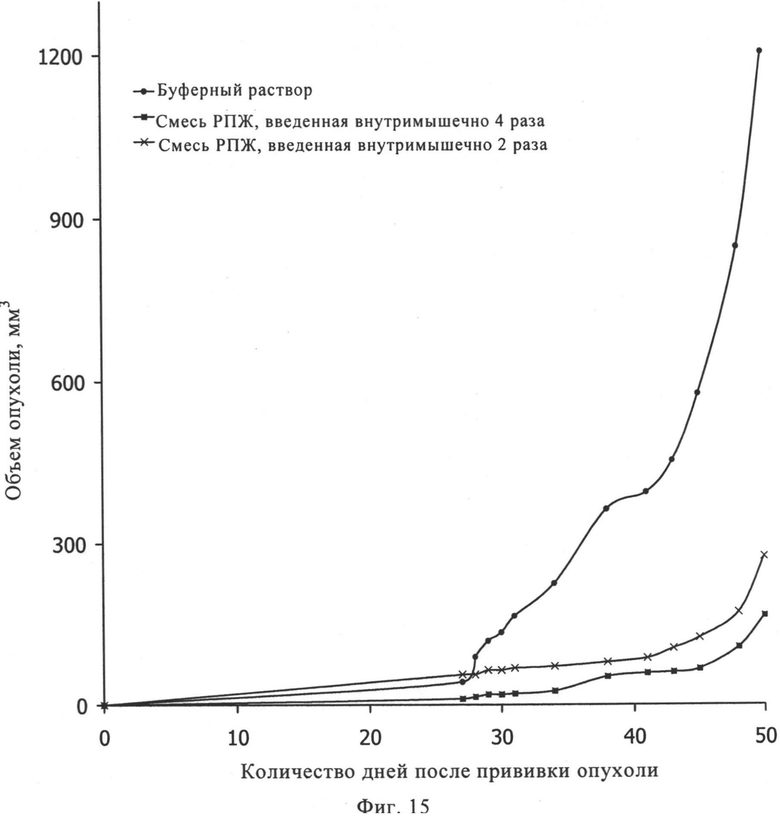
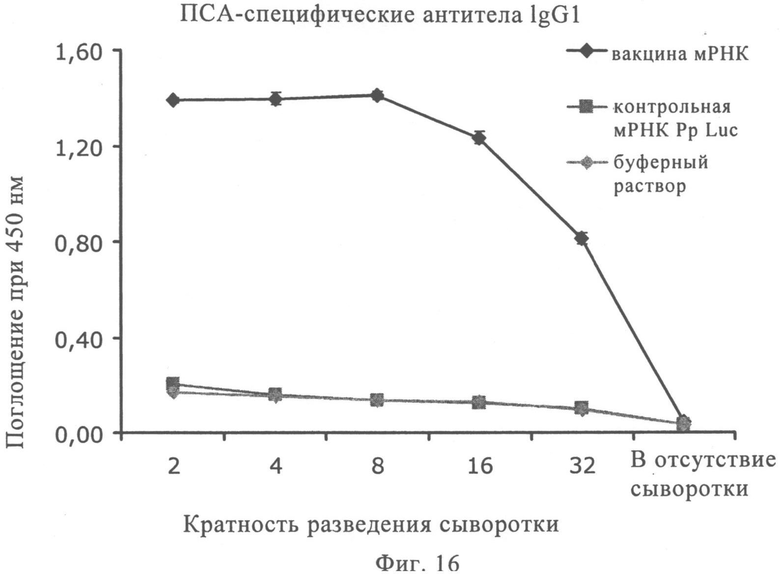
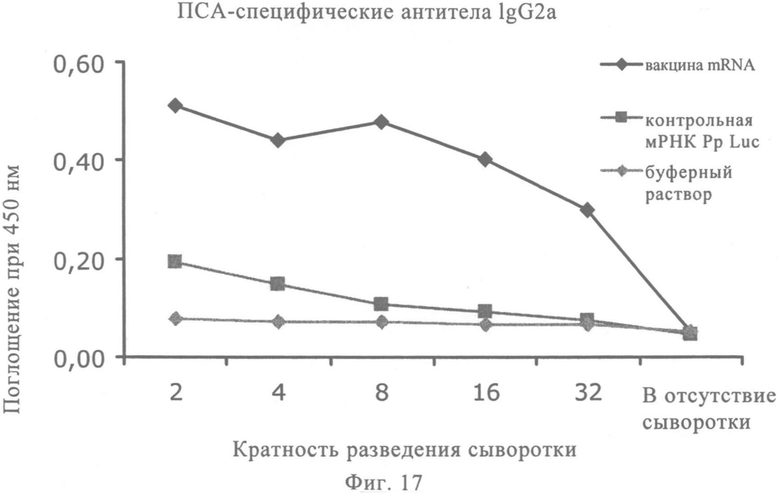
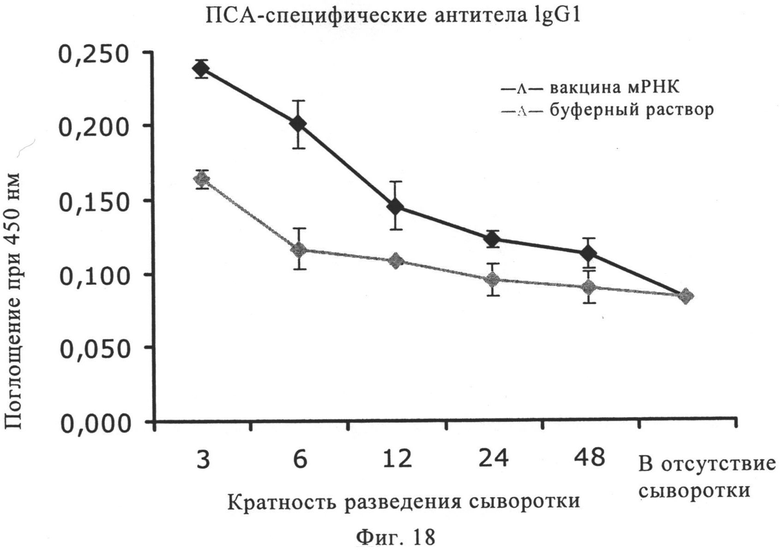
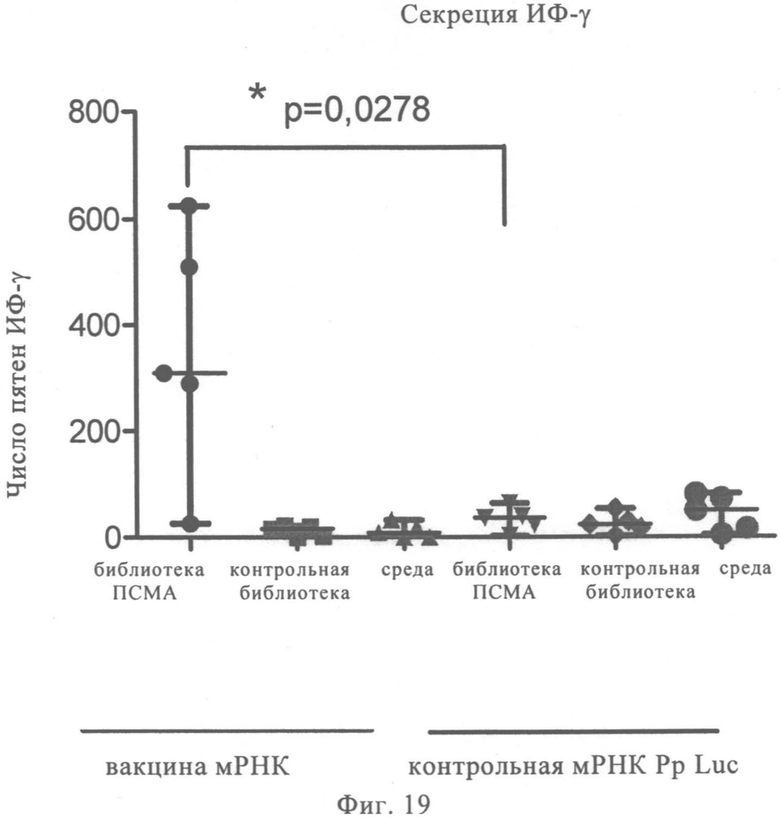
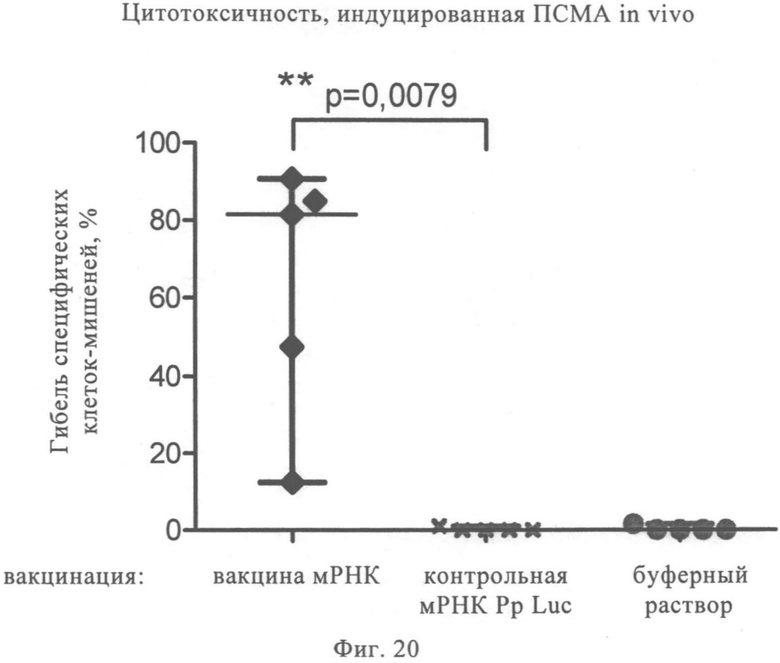

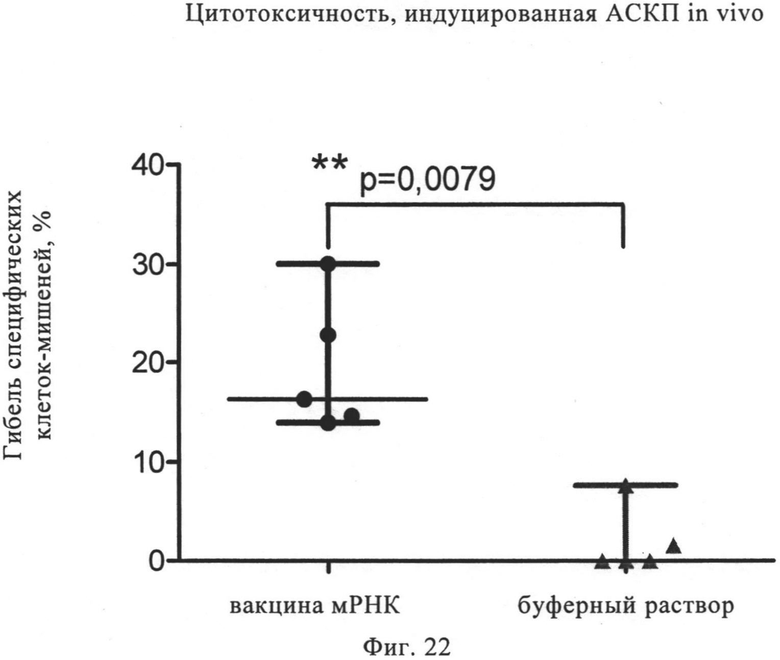
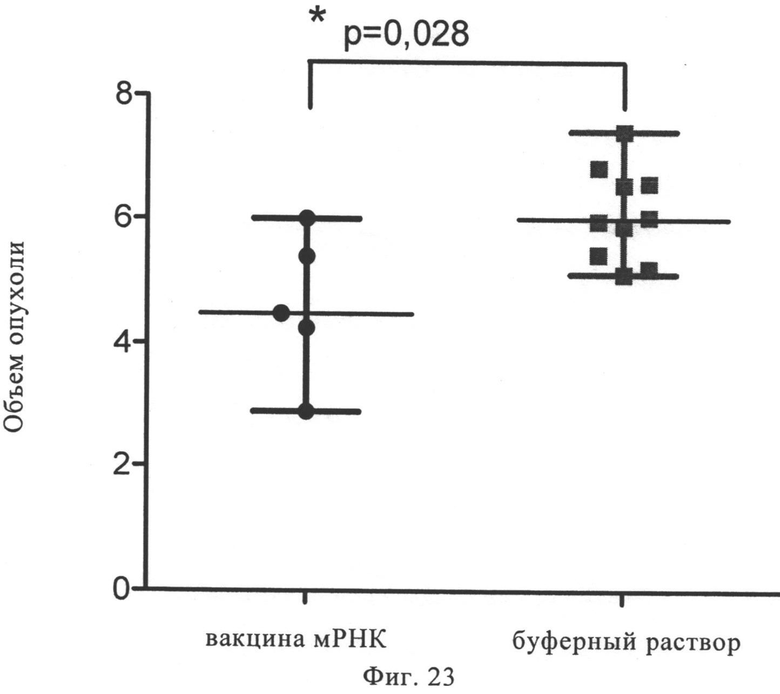
Изобретение относится к биотехнологии. Раскрыта вакцина, включающая четыре РНК, кодирующих простат-специфический антиген (ПСА), простат-специфический мембранный антиген (ПСМА), антиген стволовых клеток предстательной железы (АСКП) и шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП). Вакцина предназначена для лечения рака предстательной железы, предпочтительно неоадъювантно - и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений. Раскрыто также применение вакцины и набор. Изобретение может быть использовано в медицине. 4 н. и 12 з.п. ф-лы, 23 ил., 8 пр.
1. Вакцина для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, включающая четыре РНК, каждая из которых кодирует различные антигены их фрагменты, варианты или эпитопы,
шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП),
простат-специфический антиген (ПСА),
простат-специфический мембранный антиген (ПСМА) и
антиген стволовых клеток предстательной железы (АСКП),
в которой по крайней мере одна РНК является модифицированной РНК, прежде всего стабилизированной РНК, причем модифицированная РНК включает 5'-кэп структуру и/или полиА-концевой фрагмент, содержащий предпочтительно от 10 до 200 остатков аденозина, и/или полиС-концевой фрагмент, включающий предпочтительно от 10 до 200 остатков цитозина, и/или по крайней мере одну IRES и/или по крайней мере одну стабилизирующую 5'- и/или 3'-последовательность, кроме того, содержание G/C в кодирующей области по крайней мере одной РНК повышено по сравнению с содержанием G/C в кодирующей области РНК дикого типа, а кодируемая аминокислотная последовательность по крайней мере одной РНК предпочтительно не изменена по сравнению с кодируемой аминокислотной последовательностью РНК дикого типа.
2. Вакцина по п.1, в которой длина по крайней мере одной РНК составляет от 250 до 20000 нуклеотидов.
3. Вакцина по п.1, в которой по крайней мере одной РНК является мРНК.
4. Вакцина по п.1, в которой по крайней мере одна РНК включает РНК, выбранную из РНК, которые являются идентичными или идентичными по крайней мере на 80% по сравнению с последовательностями РНК, приведенными в SEQ ID NO:2, 5, 8 или 11.
5. Вакцина по п.1, в которой содержание A/U в участках, соседних с участком связывания с рибосомой по крайней мере в одной РНК, повышено по сравнению с содержанием A/U в участках, соседних с участком связывания с рибосомой в РНК дикого типа.
6. Вакцина по п.5, в которой кодирующая область и/или нетранслируемая 5'- и/или 3'-область модифицированной мРНК изменена по сравнению с РНК дикого типа таким образом, что не содержит дестабилизирующие элементы последовательности, при этом кодируемая аминокислотная последовательность модифицированной мРНК предпочтительно не изменена по сравнению с РНК дикого типа.
7. Вакцина по п.1, в которой по крайней мере одна РНК включает РНК, выбранную из РНК, которые являются идентичными или идентичными по крайней мере на 80% последовательностями РНК, приведенным в SEQ ID NO:1, 3, 4, 6, 7, 9, 10 или 12.
8. Вакцина по п.1, в которой по крайней мере одна РНК образует комплекс с одним или более поликатионами, предпочтительно с протамином или олигофектамином, наиболее предпочтительно с протамином.
9. Вакцина по п.1, которая дополнительно включает по крайней мере один адъювант.
10. Вакцина по п.9, в которой по крайней мере один адъювант выбирают из группы, включающей:
катионные или поликатионные соединения, включающие катионные или поликатионные пептиды или белки, включая протамин, нуклеолин, спермин или спермидин, поли-L-лизин (ПLЛ), полиаргинин, основные полипептиды, пептиды проникающие в клетки (ППК), включая ВИЧ-связующие пептиды, Tat, ВИЧ-1 Tat (ВИЧ), производные Tat-пептидов, пенетратин (Penetratin), VP22-пептиды или пептиды-аналоги, HSV VP22 (простой герпес), MAP, KALA или домены белковой трансдукции (ДБТ), РрТ620, обогащенные пролином пептиды, обогащенные аргинином пептиды, обогащенные лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, пептиды сложного локуса Antennapedia (прежде всего, из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, hCT-пептиды, SAP, протамин, спермин, спермидин или гистоны, катионные полисахариды, включая хитозан, полибрен, катионные полимеры, включая полиэтиленимин (ПЭИ), катионные липиды, включая DOTMA: хлорид [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмонио)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмонийацетил)диэтаноламина, CLIP1: хлорид рац[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, включая модифицированные полиаминокислоты, включая полимеры β-аминокислот или обращенные полиамиды, модифицированные полиэтилены, включая ПВП (поли(Н-этил-4-винилпириднийбромид)), модифицированные акрилаты, включая пДМАЭМА (поли(диметиламиноэтилметилакрилат)), модифицированные амидоамины, включая пАМАМ (поли(амидоамин)), модифицированный сложный поли-β-аминоэфир (ПБАЭ), включая модифицированные в диаминоконцевом фрагменте сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола, дендримеры, включая дендримеры полипропиламина или дендримеры на основе пАМАМ, полиимин(ы), включая полиэтиленимин (ПЭИ), полипропиленимин, полиаллиламин, полимеры на основе сахаридов, включая полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., силановые полимеры, такие как сополимеры PMOXA-PDMS и т.п., блокполимеры, включающие комбинацию одного или более катионных блоков, выбранных из катионного полимера, как описано выше, и одного или более гидрофильных или гидрофобных блоков (например, полиэтиленгликоль),
или
катионные или поликатионные белки или пептиды, выбранные из следующих белков или пептидов общей формулы (I): (Arg)l, (Lys)m, (His)n, (Orn)o, (Xaa)x, где l+m+n+o+x=8-15, a l, m, n или о независимо равны любому числу, выбранному из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по крайней мере 50% в расчете на все аминокислоты в составе олигопептида, а Хаа обозначает любую аминокислоту, выбранную из природных или неприродных аминокислот, за исключением Arg, Lys, His или Orn, и х равен любому числу, выбранному из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% в расчете на все аминокислоты в составе олигопептида,
или
нуклеиновые кислоты формулы (II) GlXmGn, где G обозначает гуанозин, урацил или аналог гуанозина или урацила, Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомянутых выше нуклеотидов, индекс 1 равен целому числу от 1 до 40, причем, если 1 равен 1, G обозначает гуанозин или его аналог, если 1>1 по крайней мере 50% нуклеотидов обозначают гуанозин или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает урацил или его аналог, если m>3, то присутствуют по крайней мере 3 последовательных остатка урацила или аналога урацила, n равен целому числу от 1 до 40, при этом если n равен 1, G обозначает гуанозин или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают гуанозин или его аналог,
или
нуклеиновые кислоты формулы (III) C1XmCn, где С обозначает цитозин, урацил или аналог цитозина или урацила, Х обозначает гуанозин, урацил, аденозин, тимидин, цитозин или аналог упомянутых выше нуклеотидов, 1 равен целому числу от 1 до 40, причем, если 1 равен 1, С обозначает цитозин или его аналог, если 1>1 по крайней мере 50% нуклеотидов обозначают цитозин или его аналог, m равен целому числу и по крайней мере равен 3, причем, если m равен 3, Х обозначает урацил или его аналог, если m>3, присутствуют по крайней мере 3 последовательных остатка урацила или аналога урацила, n равен целому числу от 1 до 40, причем, если n равен 1, С обозначает цитозин или его аналог, если n>1 по крайней мере 50% нуклеотидов обозначают цитозин или его аналог.
11. Вакцина по любому из пп.1-10, в которой вакцина индуцирует приобретенный иммунный ответ.
12. Вакцина по любому из пп.1-10, которая дополнительно включает фармацевтически приемлемый носитель.
13. Применение вакцины по любому из пп.1-12 для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений.
14. Набор для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, включающий вакцину по любому из пп.1-13, а также необязательно инструкции по введению и дозировке вакцины.
15. Набор для лечения рака предстательной железы (РПЖ), предпочтительно неоадъювантно- и/или гормонорезистентного рака предстательной железы, а также родственных заболеваний или нарушений, включающий четыре РНК, каждая из которых кодирует различные антигены, их фрагменты, варианты или эпитопы,
шестой трансмембранный эпителиальный антиген предстательной железы (ШТЭАП),
простат-специфический антиген (ПСА),
простат-специфический мембранный антиген (ПСМА) и
антиген стволовых клеток предстательной железы (АСКП),
в которой по крайней мере одна РНК является модифицированной РНК, прежде всего стабилизированной РНК, причем модифицированная РНК включает 5'-кэп структуру и/или полиА-концевой фрагмент, включающий предпочтительно от 10 до 200 остатков аденозина, и/или полиС-концевой фрагмент, включающий предпочтительно от 10 до 200 остатков цитозина, и/или по крайней мере одну IRES и/или по крайней мере одну стабилизирующую 5'- и/или 3'-последовательность, кроме того содержание G/C в кодирующей области по крайней мере одной РНК повышено по сравнению с содержанием G/C в кодирующей области РНК дикого типа, а кодируемая аминокислотная последовательность по крайней мере одной РНК предпочтительно не изменена по сравнению с кодируемой аминокислотной последовательностью РНК дикого типа.
16. Набор по п.15, в котором по крайней мере одной РНК является мРНК.
| WO 2006008154 A1, 26.01.2006 | |||
| WO 2005016376 A1, 24.02.2005 | |||
| WO 2004067570 A2, 12.08.2004 | |||
| ВЫДЕЛЕННЫЙ ОПУХОЛЕВЫЙ ПОЛИПЕПТИД ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И КОДИРУЮЩИЙ ЕГО ПОЛИНУКЛЕОТИД | 1999 |
|
RU2234942C2 |
Авторы
Даты
2014-02-27—Публикация
2008-10-08—Подача