Настоящее изобретение относится к новым режимам прайм-буст, которые включают введение по меньшей мере одной конструкции мРНК, например, применение указанных конструкций для «буст»-(поддерживающего)-введения после «прайм»-(первичного)-введения определенной(ых) другой(их) антигенной(ых) композиции(й). Указанные предлагаемые в изобретении режимы можно, в частности, применять для индукции иммунного ответа у индивидуума и/или вакцинации указанного индивидуума против заражения одним или несколькими патогенами, и/или лечения или предупреждения одного или нескольких заболеваний или состояний, включая опухоль или рак, аллергию или аутоиммунные состояния, и/или заболевание или состояние, ассоциированное с заражением патогеном. В настоящем изобретении описаны также способы, применения, композиции для вакцинации, наборы и упакованные компоненты вакцин, соответствующие или пригодные для одного или нескольких из указанных режимов.
Важным «узким местом» при разработке вакцин против вызываемых патогенами инфекций или для лечения или предупреждения некоторых заболеваний или состояний, таких как опухоль или рак, аллергия или аутоиммунные состояния, является способность индуцировать сильный и эффективный иммунный ответ. При введении в качестве единственного иммуногенного компонента многие вакцины-кандидаты, находящиеся в процессе изучения и разработки, индуцируют некоторый, но недостаточно сильный и эффективный иммунный ответ. Таким образом, указанные вакцины-кандидаты, включая те, которые разрабатываются в отношении инфекций, важных с социальной, медицинской или экономической точек зрения, таких как грипп или бешенство, или рак предстательной железы или легкого, являются недостаточно эффективными для того, чтобы было оправдано их дальнейшее исследование или клиническое испытание, несмотря на их возможную более низкую токсичность или менее выраженные побочные действия по сравнению с альтернативными вакцинами или терапиями. Еще более проблематичной является ситуация с вакцинами-кандидатами, которые разрабатываются для таких инфекций как Эбола или ВИЧ, для которых в настоящее время отсутствует эффективная утвержденная и коммерчески доступная вакцинация. Фактически, для разработки обычной вакцины, начиная с доклинической фазы, требуется 10,71 года и вероятность ее попадания на рынок составляет только 6% (Pronker и др., 2013; PLoS One 8(3):е57755). Такая(ие) проблема(ы) может(гут) иметь место даже для некоторых утвержденных продуктов в виде вакцин в процессе их разработки, и их окончательная и утвержденная эффективность была достигнута только благодаря применению общепринятых и неоптимальных подходов для индукции такого иммунного ответа, который является достаточно сильным, эффективным и/или продолжительным.
Одним из общепринятых подходов к повышению иммунного ответа на вакцину-кандидата или продукт является применение адъюванта в композиции вакцины; он представляет собой дополнительный компонент, который добавляют к препарату вакцины, повышающий иммуногенность антигенов в вакцине. Утвержденные адъюванты включают квасцы, фосфат алюминия и гидроксид алюминия (Lindblad, Immunol Cell Biol 82, 2004, с. 497) и, прежде всего для вакцинации животных, определенные адъюванты на основе смеси масло-в воде, такие как сквален в воде (Brito и др., Vaccine 29, 2011, с. 6262). Однако общепринятые адъюванты, такие как квасцы, обладают рядом недостатков, включая возможные аллергические реакции и/или то, что они не могут функционировать со всеми антигенами, например, в случае малярии и туберкулеза (Leslie, Science 341, 2013, с. 26).
Другой общепринятый подход к осуществлению вакцинации, которая обеспечивает достаточно сильный, эффективный и/или продолжительный иммунный ответ, и/или защиту, включает либо: (I) введение композиции в повышенных дозах; либо (II) дополнительное осуществление одной или нескольких последующих вакцинаций (так называемых «бустерных» вакцинаций) после начальной (так называемой «прайм»-вакцинации), при этом для последующих вакцинаций можно использовать либо такой же вакцинный продукт, например, вакцину от бешенства RABIPUR®, инактивированную (Vodopija, Vaccine 17, 1999, с. 13), либо комбинацию с другими вакцинными продуктами против такой же инфекции, заболевания или состояния, например, вакцины против гриппа, содержащие другие антигены (Stephenson и др., N Engl J Med 359, 2008, с. 1631). Однако такие общепринятые подходы обладают недостатками по ряду причин, включая случаи, когда требуются повышенные количества композиции вакцины. Например, обычный срок создания общепринятой сезонной вакцины против гриппа составляет 3-6 месяцев, и для этого требуется очень специфический метод производства и оборудование, включая культивирование и выделение антигена из куриных яиц (Matthews, The Bridge 36(3), 2006, с. 17).
Стоимость на одного человека, связанная с указанным типичным временем производства и очень специализированным процессом производства общепринятых вакцин, часто является значительной. Фактическая стоимость одного курса доконтактных вакцинаций против бешенства с помощью вакцины RABIPUR® (полученной путем размножения вируса в очищенной культуре клеток куриных эмбрионов) составляет порядка сотен евро на индивидуума. Если бы такую же эффективность вакцинации удавалось достигать с использованием половинной дозы вводимой вакцины, то было бы возможно не только существенно снижать стоимость, но можно было бы также использовать такой же специализированной процесс производства (и, следовательно, ограниченное количество специализированного оборудования, пригодного для производства такой вакцины) для получения, в течение такого же промежутка времени, достаточного количества вакцины для удвоенного количества индивидуумов; указанные факторы дают существенные преимущества с точки зрения социальной службы и здравоохранения, прежде всего для стран третьего мира, где требуется вакцинация против эпидемий и пандемий.
Одним из конкретных примеров является вариант, когда композицию вакцины (или альтернативную ей композицию) требуется вводить после «прайм»-композиции и возможно осуществлять многократное ее введение. Может требоваться осуществлять указанные последующие бустерные введения через некоторое время после первичного введения, например, через несколько дней, недель или месяцев, но в последующих условиях, которые могут быть не оптимальными для какой-либо вакцинации. Например, в чрезвычайной ситуации, такой как эпидемия инфекции или случая биологической войны/терроризма, аварийные работники могут получать первую (первичную) обработку в современных медицинских условиях, но такая первичная обработка может обеспечивать лишь временную или ограниченную защиту. Только последующая бустерная обработка аварийного работника может обеспечивать достаточную и/или длительную защиту. Однако в это время аварийный работник может уже находиться в «полевых условиях», которые не пригодны для хранения, транспортировки или введения общепринятых вакцин; например, может отсутствовать холодовая цепь хранения и транспортировки, необходимая для обычных вакцин на белковой основе. Кроме того, и как указано в предыдущем параграфе, в таких чрезвычайных ситуациях целесообразно иметь запасы обычных (например, белковых) вакцин, которые можно применять по возможности для большего количества индивидуумов, которые обеспечивают начальную, но не продолжительную защиту, путем использования указанных запасов обычных вакцин для первичной вакцинации, и затем использовать новые методы для поддержания или пролонгирования указанной начальной защиты, например, с использованием режима с применением второй композиции, которую можно быстро и легко получать в случае риска другой инфекции/патогена без обширного запаса или резерва специального оборудования для производства вакцин для всех возможных рисков инфекции/патогенов.
Другим конкретным случаем может являться развитие иммунитета к вектору, ограничивающего иммуногенность вакцин на основе вирусного вектора. Например, когда используют вирусный вектор (например, аденовирусный вектор) в качестве «прайм»-композиции, у вакцинированного индивидуума могут возникать нейтрализующие антитела против вирусного вектора (Zaiss и др., J Cell Biochem 108(4), 2009, сс.778-790), и поэтому применение такого же (или сходного) вирусного вектора для последующих «бустер»-вакцинаций может становиться менее эффективным или даже приводить к проявлению побочных действий.
В WO 2003/011332 (фирма Isis Innovation Ltd) описаны методы усовершенствования стратегий вакцинации полипептидами, включающие поддержку иммунного ответа у индивидуума, предварительно примированного против или обработанного по меньшей мере одним из множества эпитопов, путем введения множества индивидуальных конструкций нуклеиновых кислот, каждая из которых кодирует один из указанного множества эпитопов.
В WO 2005/035779 (фирма Powderject Vaccines Inc) описан метод вызывания Т-клеточного ответа против Т-клеточного эпитопа у млекопитающего-хозяина; включая метод, в котором используют первое введение представляющего интерес нуклеотида (nucleotide of interest, NOI) и второе введение NOI, при этом промежуток времени между этими введениями составляет от 21 до 365 дней.
В WO 2009/056535 (фирма Genimmune NV) описаны методы и наборы для индукции CTL-ответа с использованием режима прайм-буст, при котором используют полипептидную конструкцию, содержащую по меньшей мере два эпитопа CTL, в качестве композиции для первого примирования, а затем вторую бустерную композицию, содержащую вектор, который кодирует один или несколько эпитопов CTL.
В WO 2013/006842 (фирма Novartis AG) описаны в целом иммуногенные композиции, которые содержат компонент, представляющий собой мРНК, и полипептидный компонент, а другими объектами являются наборы и методы лечения или предупреждения инфекционного заболевания, которые включают (I) примирующую композицию, содержащую самореплицирующую молекулу РНК, которая кодирует эпитоп из патогена; и (II) бустерную композицию, содержащую второй эпитоп из такого же патогена в форме полипептида. В WO 2015/189425 (фирма Glaxosmithkline Biologicals SA) описаны иммуногенные комбинации, включающие полипептидный антиген и компонент в виде нуклеиновой кислоты для одновременного введения.
В WO 2014/005643 и WO 2014/006191 (фирма Okairos AG) описаны новые режимы прайм-буст, включающие иммуногенные полипептиды, кодируемые полинуклеотидами; в частности, композиции вакцин, содержащие: (I) примирующую композицию, которая содержит первый вектор, содержащий нуклеиновую кислоту, которая кодирует иммуногенный полипептид; и (II) по меньшей мере одну бустерную композицию, которая содержит второй вектор, содержащий нуклеиновую кислоту, которая кодирует иммуногенный полипептид, где по меньшей мере один эпитоп в каждом полипептиде является иммунологически идентичным и каждую из композиций вводят интраназально или внутримышечно.
В WO 2014/139587 и WO 2014/141176 (фирма Okairos AG) описаны улучшенные поксивирусные вакцины, включая применение поксивирусных векторов для примирования иммунного ответа, а для бустинга иммунного ответа применение вектора, содержащего нуклеиновую кислоту, которая кодирует антигенный белок, второй антигенный белок или вирусоподобные частицы.
Таким образом, исходя из одной или нескольких вышеуказанных перспектив, существует потребность в улучшенных методах и/или композициях для индукции иммунного ответа у индивидуума, например, для вакцинации индивидуума против заражения одним или несколькими патогенами и/или лечения или предупреждения заболевания или состояния у указанного индивидуума.
Таким образом, в основу настоящего изобретения положена задача разработать альтернативные, улучшенные, более простые, более быстрые, более гибкие, выгодные и/или интегрированные средства, способы и/или композиции, направленные на решение одной или нескольких указанных или других проблем. Указанная задача, лежащая в основе настоящего изобретения, решается с помощью объекта изобретения указанного или определенного в настоящем описании, например, с помощью объекта изобретения, указанного в прилагаемой формуле изобретения.
В целом, и для краткости описания (х) объект, определенный в настоящем описании, представляет собой; и/или (у) основной объект настоящего изобретения может быть описан следующим образом:
Способ индукции иммунного ответа у индивидуума; где способ включает стадии, на которых:
(а) вводят индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первую антигенную композицию, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
и
(б) затем вводят индивидууму по меньшей мере однократно в эффективном количестве вторую антигенную композицию, которая содержит по меньшей мере одну конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК; и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
В частности, задача, положенная в основу настоящего изобретения, решается согласно одному из основных объектов изобретения с помощью:
второй антигенной композиции, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид, для применения для введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве второй антигенной композиции после введению индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Одним из объектов настоящего изобретения предпочтительно является:
Вторая антигенная композиция, которая содержит по меньшей мере одну конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
для применения в качестве вакцины при введении индивидууму, который нуждается в этом, когда по меньшей мере однократно вводят в эффективном количестве вторую антигенную композицию индивидууму, который нуждается в этом, после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК; и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным, идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
В частности, задача, положенная в основу настоящего изобретения, решается согласно одному из основных объектов изобретения с помощью:
первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид, для применения для введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции и перед введением индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции, которая содержит по меньшей мере одну конструкция мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Согласно следующему объекту изобретение предпочтительно относится к:
первой антигенной композиции, которая содержит
по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит
по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
для применения в качестве вакцины при введении индивидууму, который нуждается в этом, когда по меньшей мере однократно вводят в эффективном количестве первую антигенную композицию индивидууму, который нуждается в этом, перед введением индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК; и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным, идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Другим объектом изобретения является:
первая антигенная композиция, которая содержит
по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит
по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
и
вторая антигенная композиция, которая содержит
по меньшей мере одну конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК; и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
для применения в качестве вакцины, когда вводят в эффективном количестве вторую антигенную композицию по меньшей мере однократно индивидууму, который нуждается в этом,
после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции.
Более предпочтительно объектом изобретения является:
первая антигенная композиция, которая содержит
по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит
по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
и
вторая антигенная композиция, которая содержит
по меньшей мере одну конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
для применения в качестве вакцины, когда вводят в эффективном количестве вторую антигенную композицию по меньшей мере однократно индивидууму, который нуждается в этом,
после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции.
Другим основным объектом изобретения является также:
Комбинированная вакцина, содержащая:
- первую антигенную композицию или первую композицию вакцины, указанную, описанную или заявляемую в настоящем описании;
и
- вторую антигенную композицию или вторую композицию вакцины, указанную, описанную или заявляемую в настоящем описании.
Следующим основным объектом изобретения является также:
набор, предпочтительно предназначенный для индукции иммунного ответа у индивидуум; набор, содержащий несколько отдельных контейнеров, где содержимое по меньшей мере двух контейнеров полностью или частично отличается друг от друга,
первый из указанных контейнеров содержит:
- первую антигенную композицию или первую композицию вакцины, указанную, описанную или заявляемую в настоящем описании;
и
второй из указанных контейнеров содержит:
- вторую антигенную композицию или вторую композицию вакцины, указанную, описанную или заявляемую в настоящем описании.
Еще одним основным объектом изобретения является также:
упакованная вакцина, содержащая:
- первую антигенную композицию или первую композицию вакцины, указанную, описанную или заявляемую в настоящем описании;
и/или
- вторую антигенную композицию или вторую композицию вакцины, указанную, описанную или заявляемую в настоящем описании,
упаковка содержит дополнительно инструкции по:
(а) введению индивидууму, предпочтительно нуждающемуся в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции; и
(б) последующему введению индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции.
Другими объектами изобретения являются также первая композиция вакцины, содержащая первую антигенную композицию, указанную, описанную или заявляемую в настоящем описании, и вторая композиция вакцины, содержащая вторую антигенную композицию, указанную, описанную или заявляемую в настоящем описании.
Ниже настоящее изобретение и его конкретные не ограничивающие объем объекты и/или варианты его осуществления описано более подробно. Хотя настоящее изобретение дополнительно более подробно описано ниже, следует понимать, что настоящее изобретение не ограничено конкретными методологиями, протоколами и реагентами, указанными в настоящем описании, и они могут варьироваться. Также следует понимать, что применяемая в контексте настоящего описания терминология дана только с целью описания конкретных вариантов осуществления изобретения и не направлена на ограничение объема настоящего изобретения, который должен быть ограничен только прилагаемой формулой изобретения и другими заявленными особенностями.
Ниже элементы настоящего изобретения будут описаны более подробно. Эти элементы указаны для конкретных вариантов осуществления изобретения, однако, как должно быть очевидно, многие из них можно объединять любым образом и в любом количестве для создания дополнительных вариантов осуществления изобретения. Различные описанные примеры и предпочтительные варианты осуществления изобретения не следует рассматривать как ограничивающие настоящее изобретение, они приведены только для подробного описания вариантов осуществления изобретения. Следует понимать, что настоящее описание представлено для подтверждения и охвата вариантов осуществления изобретения, которые объединяют конкретно описанные варианты осуществления изобретения с любым количеством описанных и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных элементов в настоящем описании следует рассматривать как подпадающие под объем настоящего описания, если из контекста не следует иное.
Для воплощения настоящего изобретения на практике можно применять, если не указано иное, общепринятые методы химии, биохимии и рекомбинантной ДНК, которые представлены в относящейся к данной области литературе (см., например, Molecular Cloning: A Laboratory Manual, 2-ое изд., под ред. Sambrook и др., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor; 1989).
Если не указано иное, то все технические и научные понятия, применяемые в контексте настоящего описания, имеют такие же значения, которые являются общепринятыми для обычных специалистов в данной области. Например, понятия, применяемые в контексте настоящего описания, указаны в: «А multilingual glossary of biotechnological terms: (IUPAC Recommendations)», под ред. Leuenberger и др., изд-во Helvetica Chimica Acta, CH-4010, Базель, Швейцария, 1995.
При применении в контексте настоящего описания понятия «содержащий» или «состоящий из» не исключаются другие элементы. Для целей настоящего изобретения понятие «состоящий из» рассматривается в качестве конкретного варианта «содержащий». Если ниже в контексте настоящего описания указано, что группа содержит по меньшей мере определенное количество вариантов, то также должно быть очевидно, что группа состоит из всех и/или только из указанных вариантов. Если ниже в контексте настоящего описания используют «и/или», то это относится к конкретному описанию каждого из двух специфических признаков или компонентов в сочетании друг с другом или индивидуально. Например, «А и/или Б» относится к конкретному описанию каждого из следующих случаев (I) А, (II) Б и (III) А и Б, так, если бы каждый из них рассматривался индивидуально в настоящем описании. Под понятие «содержащий» подпадает понятие «состоящий практически из», которое в свою очередь, включает понятие «состоящий из». Таким образом, в каждом случае при упоминании в настоящем описании понятие «содержащий» можно заменять понятием «состоящий практически из» или «состоящий из». Аналогично этому, в каждом случае при упоминании в настоящем описании понятие «состоящий практически из» можно заменять на понятие «состоящий из».
Понятие «необязательный» или «необязательно» в контексте настоящего описания означает, что описанное ниже событие, обстоятельство или состояние может иметь место или может не происходить, и что описание включает случаи, когда указанное событие, обстоятельство или состояние встречается, и случаи, когда оно не встречается.
В контексте настоящего изобретения понятие «примерно» и «приблизительно» означают интервал точности, в котором по мнению специалиста в данной области еще гарантируется технический эффект рассматриваемого свойства. Понятие, как правило, означает отклонение от указанного численного значения на ±20%, ±15%, ±10% и, например, ±5%. Как должно быть очевидно обычному специалисту в данной области, специфичность указанного отклонения для численного значения для данного технического эффекта должна зависеть от природы технического эффекта. Например, встречающийся в естественных условиях или биологический технических эффект может, как правило, иметь большее указанное отклонение, чем в случае созданного человеком или сконструированного технического эффекта. Упоминание понятия в единственном числе включает его упоминание во множественном числе, если специально не указано иное.
В описании настоящего изобретения процитировано несколько документов. Каждый из процитированных в контексте настоящего описания документов (включая все патенты, заявки на патент, научные публикации, спецификации, инструкции производителей и т.д.), указанных выше или ниже, полностью включен в настоящее описание в качестве ссылки. Ничто из представленного в настоящем описании не должно истолковываться как допущение того, что авторы изобретения не имеют право датировать такое раскрытие на основании предшествующего изобретения.
Основным объектом изобретения является способ индукции иммунного ответа у индивидуума; где способ включает стадии, на которых:
(а) вводят индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первую антигенную композицию, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид;
и
(б) вводят затем индивидууму по меньшей мере однократно в эффективном количестве вторую антигенную композицию, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Определенные варианты осуществления изобретения (например, способы, предлагаемые в изобретении, такие как указанный выше в качестве объекта изобретения) можно применять для вакцинации индивидуума и/или лечения или предупреждения состояния, нарушения или заболевания у индивидуума.
Другим (родственным) основным объектом изобретения является вторая антигенная композиция, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид, для применения для введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве второй антигенной композиции после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Другим объектом настоящего изобретения является:
Вторая антигенная композиция, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
для применения в качестве вакцины при введении индивидууму, который нуждается в этом, когда по меньшей мере однократно вводят в эффективном количестве вторую антигенную композицию индивидууму, который нуждается в этом, после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным, идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
(Соответствующим) основным объектом изобретения является первая антигенная композиция, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид, для применения для введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции и перед введением индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции, которая содержит по меньшей мере одну конструкция мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Следующим объектом изобретения предпочтительно является
первая антигенная композиция, которая содержит
по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит
по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
для применения в качестве вакцины при введении индивидууму, который нуждается в этом, когда по меньшей мере однократно вводят в эффективном количестве первую антигенную композицию индивидууму, который нуждается в этом, перед введением индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК; и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным, идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
Следующим объектом изобретения является:
первая антигенная композиция, которая содержит
по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит
по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид, и
вторая антигенная композиция, которая содержит
по меньшей мере одну конструкцию мРНК, кодирующую
по меньшей мере один иммуногенный пептид или полипептид,
где
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 98% или по меньшей мере на 99% идентичным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
для применения в качестве вакцины, когда вводят в эффективном количестве вторую антигенную композицию по меньшей мере однократно индивидууму, который нуждается в этом,
после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции.
В частности, настоящее изобретение включает медицинские применения, предпочтительно указанные в настоящем описании, первой антигенной композиции, указанной в настоящем описании, второй антигенной композиции, указанной в настоящем описании, или комбинации первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании. Медицинские применения, указанные в настоящем описании, предпочтительно включают введение первой антигенной композиции и второй антигенной композиции в порядке, указанном в настоящем описании. Более предпочтительно медицинские применения, указанные в настоящем описании, включают введение второй антигенной композиции, указанной в настоящем описании, после введения (по меньшей мере однократно) первой антигенной композиции, указанной в настоящем описании. Более предпочтительно первую антигенную композицию и вторую антигенную композицию вводят в качестве первичной «прайм»- и «бустер»-композиции, при этом первая антигенная композиция предпочтительно представляет собой первичную («прайм») дозу, а вторая антигенная композиция предпочтительно представляет собой «бустерную» дозу.
Предпочтительными вариантами осуществления настоящего изобретения являются первая антигенная композиция, указанная в настоящем описании, вторая антигенная композиция, указанная в настоящем описании, или комбинация первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, для применения в качестве лекарственного средства, предпочтительно для применения в качестве лекарственного средства, предназначенного для индукции иммунного ответа.
Другими предпочтительными вариантами осуществления настоящего изобретения являются первая антигенная композиция, указанная в настоящем описании, вторая антигенная композиция, указанная в настоящем описании, или комбинация первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, для применения в качестве вакцины. Более предпочтительно в настоящем изобретении предложены первая антигенная композиция, указанная в настоящем описании, вторая антигенная композиция, указанная в настоящем описании, или комбинация первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, для применения в качестве вакцины, где вакцину используют в качестве лекарственного средства, предназначенного для индукции иммунного ответа.
Другим предпочтительным вариантом осуществления настоящего изобретения является первая антигенная композиция, указанная в настоящем описании, вторая антигенная композиция, указанная в настоящем описании, или комбинация первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, для применения для лечения или профилактики состояния, нарушения или заболевания, предпочтительно указанного в настоящем описании. Предпочтительно первая антигенная композиция, указанная в настоящем описании, вторая антигенная композиция, указанная в настоящем описании, или комбинация первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, предназначены для применения в качестве вакцины для лечения или профилактики состояния, нарушения или заболевания, предпочтительно указанного в настоящем описании.
Согласно особенно предпочтительному варианту осуществления изобретения первую антигенную композицию, указанную в настоящем описании, вторую антигенную композицию, указанную в настоящем описании, или комбинацию первой антигенной композиции, указанной в настоящем описании, и второй антигенной композиции, указанной в настоящем описании, применяют в качестве вакцины для лечения или профилактики состояния, нарушения или заболевания, где состояние, нарушение или заболевание выбрано из группы, состоящей из:
заражения одним или несколькими патогенами (инфекционные болезни), предпочтительно указанными в настоящем описании;
раковых или опухолевых заболеваний, предпочтительно указанных в настоящем описании;
аллергий или аллергических заболеваний, предпочтительно указанных в настоящем описании, и
аутоиммунных заболеваний, предпочтительно указанных в настоящем описании.
Для целей ясности и удобочитаемости ниже представлены основная научная информация и определения. Все технические особенности, указанные при этом, могут являться компонентом каждого и всех до единого вариантов осуществления изобретения, кроме того, в контексте указанных вариантов осуществления изобретения могут быть специально даны дополнительные информация, определения и пояснения.
Иммунологическая эквивалентность эпитопов/антигенов/полипептидов:
Два или большее количество эпитопов, антигенов и/или иммуногенных полипептидов являются «иммунологически эквивалентыми», если они распознаются одним и тем же антителом, Т-клеткой или В-клеткой. Распознавание двух или большего количества эпитопов, антигенов и/или иммуногенных полипептидов одним и тем же антителом, Т-клеткой или В-клеткой обозначают также как «перекрестная (кросс-)реактивность» указанного антитела, Т-клетки или В-клетки. Предпочтительно распознавание двух или большего количества иммунологически эквивалентных эпитопов, антигенов и/или иммуногенных полипептидов одним и тем же антителом, Т-клеткой или В-клеткой является результатом присутствия идентичных, практически идентичных или сходных эпитопов в соответствующем антигене или полипептидах. Сходные эпитопы обладают достаточными структурными характеристиками и/или характеристиками зарядов, чтобы связываться Fab-областью одного и того же антитела или В-клеточным рецептором или V-областью одного и того же Т-клеточного рецептора. Характеристики связывания антитела, Т-клеточного рецептора или В-клеточного рецептора предпочтительно определяют на основе аффинности связывания рецептора с рассматриваемым эпитопом. В контексте настоящего описания, как правило, подразумевается, что два эпитопа, антигена и/или иммуногенных полипептида являются «иммунологически эквивалентными», если константа аффинности эпитопа, антигена или полипептида, имеющего более низкую константу аффинности, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% от константы аффинности эпитопов, антигенов и/или иммуногенных полипептидов с более высокой константной аффинности. Методы определения аффинности связывания эпитопа, антигена и/или иммуногенного полипептида с антителом или рецептором, такие как равновесный диализ или твердофазный иммуноферментный анализ (ELISA), хорошо известны в данной области. Более предпочтительно понятие «иммунологический эквивалент» в контексте настоящего описания применяют касательно пептида или белка, такого как антиген или эпитоп, который является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным референс-пептиду или референс-белку. Идентичность, как правило, определяют путем сравнения аминокислотной последовательности пептида или белка. Наиболее предпочтительно понятие «иммунологический эквивалент» в контексте настоящего описания касательно пептида или белка относится к пептиду или белку, имеющему аминокислотную последовательность, которая является идентичной или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичной аминокислотной последовательности референс-пептида или -белка.
Иммунная система: Иммунная система может защищать организмы от инфекции. Если патогену удалось пройти через физический барьер организма и попасть в указанный организм, то врожденная иммунная система обеспечивает немедленный, но неспецифический ответ. На тот случай, если патоген ускользает от этого врожденного ответа, у позвоночных имеется второй уровень защиты, представляющий собой адаптивную иммунную систему. В этом случае иммунная система адаптирует свой ответ в процессе инфекции для улучшения распознавания патогена. Затем этот улучшенный ответ сохраняется после элиминации патогена в форме иммунологической памяти и позволяет адаптивной иммунной системе организовывать более быстрые и сильные атаки каждый раз при проникновении указанного патогена. Таким образом, иммунная система включает врожденную и адаптивную иммунную систему. Каждая из этих двух частей, как правило, включает так называемые гуморальный и клеточный компоненты.
Иммунный ответ: Иммунный ответ, как правило, может представлять собой либо специфическую реакцию адаптивной иммунной системы на конкретный антиген (так называемый специфический или адаптивный иммунный ответ), либо неспецифическую реакцию врожденной иммунной системы (так называемый неспецифический или врожденный иммунный ответ). Настоящее изобретение основано на специфических реакциях (адаптивные иммунные ответы) адаптивной иммунной системы; прежде всего на адаптивных иммунных ответах после экспозиции антигенов (таких как иммуногенные полипептиды). Однако специфический ответ может поддерживаться дополнительной неспецифической реакцией (врожденный иммунный ответ). Таким образом, настоящее изобретение относится также к соединению для одновременной стимуляции врожденной и адаптивной иммунной системы для вызывания эффективного адаптивного иммунного ответа. В контексте настоящего изобретения понятие «антигенная композиция» относится к соединению или смеси соединений (например, в растворе или фармацевтическом препарате), которое/которая позволяет, которое/которую применяют, можно применять, которое/которая, обладает способностью или фактически может пробуждать, повышать, создавать или вызывать иммунный ответ (предпочтительно эффективный адаптивный иммунный ответ) при введении индивидууму или иной экспозиции индивидуума.
Адаптивная иммунная система: Адаптивная иммунная система состоит из высоко специализированных клеток системы и процессов, которые элиминируют или предупреждают рост патогенов или рост опухоли. Адаптивный иммунный ответ обеспечивает способность иммунной системы позвоночных животных распознавать и запоминать специфические патогены (для создания иммунитета) и организовывать более сильную атаку в каждом случае при обнаружении патогена. Система обладает высокой способностью к адаптации вследствие соматической гипермутации (процесс ускоренных соматических мутаций) и V(D)J-рекомбинации (необратимая генетическая рекомбинация сегментов гена рецептора антигена). Этот механизм позволяет небольшому количеству генов создавать огромное количество различных рецепторов антигенов, которые затем уникальным образом экспрессируются на каждом индивидуальном лимфоците. Поскольку реаранжировка гена приводит к необратимому изменению ДНК каждой клетки, то все потомство такой клетки должно затем наследовать гены, кодирующие ту же самую рецепторную специфичность, включая В-клетки памяти и Т-клетки памяти, которые имеют решающее значение для долговременного специфического иммунитета. Теория иммунной сети представляет собой теорию, объясняющую работу адаптивной иммунной системы, основанную на взаимодействиях между вариабельными областями рецепторов Т-клеток, В-клеток и молекул, образованных Т-клетками и В-клетками, которые имеют вариабельные области.
Адаптивный иммунный ответ: Как правило, под адаптивным иммунным ответом понимают антигенспецифический ответ. Специфичность в отношении антигена позволяет вырабатывать ответы, приспособленные к специфическим антигенам, патогенам, опухолям или инфицированным патогенном или раковым клеткам. Способность создавать такие приспособленные ответы, как правило, поддерживается в организме «клетками памяти». Если патоген инфицирует организм или антиген презентируется более чем один раз, то указанные специфические клетки памяти используются для его быстрой элиминации. В этом контексте первая стадия адаптивного иммунного ответа представляет собой активацию наивных антигенспецифических Т-клеток или различных иммунных клеток, способных индуцировать антигенспецифический иммунный ответ антигенпрезентирующими клетками. Это происходит в лимфоидных тканях и органах, через которые постоянно проходят наивные Т-клетки. Типы клеток, которые могут служить в качестве антигенпрезентирующих клеток, представляют собой среди прочего дендритные клетки, макрофаги и В-клетки. Каждая из указанных клеток выполняет отдельную функцию при вызывании иммунных ответов. Дендритные клетки могут поглощать антигены посредством фагоцитоза и макропиноцитоза, и они могут стимулироваться при контакте, например, с чужим антигеном, к миграции в местную лимфоидную ткань, где происходит их дифференцировка в зрелые дендритные клетки. Макрофаги поглощают находящиеся в форме частиц антигены, такие как бактерии, и индуцируются инфекционными агентами или другими соответствующими стимулами и экспрессируют в результате этого молекулы ГКГС. Уникальная способность В-клеток к связыванию и интернализации растворимых белковых антигенов посредством своих рецепторов может иметь важное значение также и для индукции Т-клеток. Презентация антигена на молекулах ГКГС приводит к активации Т-клеток, что индуцирует их пролиферацию и дифференцировку в «вооруженные» эффекторные Т-клетки. Наиболее важной функцией эффекторных Т-клеток является уничтожение инфицированных клеток или экспонированных антигенов цитотоксическими CD8+-Т-клетками и активация макрофагов Th1-клетками, что в совокупности создает опосредованный клетками (клеточный) иммунитет, и активация В-клеток, как Th2-, так и Th1-клетками, приводящая к образованию различных классов антител, в результате чего создается гуморальный иммунный ответ. Т-клетки распознают антиген посредством своих Т-клеточных рецепторов, которые не распознают антиген и не связываются с ним непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, полученных из патогена белковых антигенов, которые связываются с молекулами ГКГС на поверхностях других клеток.
Клеточный иммунитет/клеточный иммунный ответ: Клеточный иммунитет относится, как правило, к активации макрофагов, естественных клеток-киллеров (NK), антигенспецифических цитотоксических Т-лимфоцитов и высвобождению различных цитокинов в ответ на антиген. В более общем смысле клеточный иммунитет основан не на антителах, а на активации клеток иммунной системы. Клеточный иммунный ответ характеризуется, например, активацией антигенспецифических цитотоксических Т-лимфоцитов, которые способны индуцировать апоптоз клеток организма, экспонирующих эпитопы антигенов на своей поверхности, таких как инфицированные вирусом клетки или клетки с внутриклеточными бактериями, и раковые клетки, экспонирующие опухолевые антигены; активацию макрофагов и естественных клеток-киллеров, позволяющую им разрушать патогены; и стимуляцию клеток к секреции различных цитокинов, которые влияют на функцию других клеток, участвующих в адаптивных иммунных ответах и врожденных иммунных ответах.
Гуморальный иммунитет/гуморальный иммунный ответ: Гуморальный иммунитет, как правило, относится к производству антител и необязательно к вспомогательным процессам, сопровождающим производство антител. Гуморальный иммунный ответ, как правило, может характеризоваться, например, активацией Th2 и производством цитокинов, образованием зародышевого центра и переключением изотипа, созреванием аффинности и образованием клеток памяти. Гуморальный иммунитет, как правило, может относиться также к эффекторным функциям антител, включая нейтрализацию патогенов и токсинов, классическую активацию комплемента и стимулирование опсонинами фагоцитоза и элиминации патогенов.
Врожденная иммунная система: Врожденная иммунная система, которую называют также неспецифической иммунной системой, как правило, включает клетки и механизмы, которые неспецифически защищают хозяина от инфекции другими организмами. Это означает, что клетки врожденной системы могут распознавать патогенны и другие антигены и реагировать на них обычным путем, но, в отличие от адаптивной иммунной системы, они не придают долговременный или защитный иммунитет хозяину. Врожденная иммунная система может, например, активироваться лигандами рецепторов патоген-ассоциированными молекулярных паттернов (РАМР), например, Толл-подобных рецепторов (TLR) или другими вспомогательными субстанциями, такими как липополисахариды, TNF-альфа, диганд CD40 или цитокины, монокины, лимфокины, интерлейкины или хемокины, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета, TNF-альфа, факторы роста и hGH, лиганд человеческого Toll-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, лиганд мышиного Толл-подобного рецептора TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, лиганд NOD-подобного рецептора, лиганд RIG-I-подобного рецептора, иммуностимуляторная нуклеиновая кислота, иммуностимуляторная РНК (isPHK), CpG-ДНК, антибактериальный агент или противовирусный агент. Как правило, ответ врожденной иммунной системы включает рекрутинг иммунных клеток к областям заражения посредством производства химических факторов, включая специализированные химические медиаторы, которые называют цитокинами; активацию каскада комплемента; идентификацию и удаление чужих субстанций, присутствующих в органах, тканях, крови и лимфе, специализированными лейкоцитами; активацию адаптивной иммунной системы посредством процесса, известного как презентация антигена; и/или функционирование в качестве физического и химического барьера для инфекционных агентов.
Адъювант/адъювантный компонент: Адъювант или адъювантный компонент в наиболее широком смысле, как правило, представляет собой (например, фармакологический и/или иммунологический) агент или композицию, который/которая может модифицировать, например, усиливать, эффективность других агентов, таких как лекарственное средство или вакцина. Как правило, понятие в контексте настоящего изобретения относится к соединению или композиции, которое/которая служит в качестве носителя или вспомогательной субстанции для иммуногенов и/или других фармацевтически активных соединений. Это понятие следует рассматривать в широком смысле, и оно относится к широкому спектру субстанций, которые обладают способностью повышать иммуногенность антигенов, включенных в рассматриваемый адъювант или совместно применяемых с ним. В контексте настоящего изобретения адъювант предпочтительно должен усиливать специфический иммуногенный эффект действующих веществ, предлагаемых в настоящем изобретении. Как правило, понятия «адъювант» или «адъювантный компонент» имеют одинаковое значение и их можно применять взаимозаменяемо. Адъюванты можно подразделять, например, на иммунопотенциаторы, системы доставки антигенов или даже их комбинации.
Под понятием «адъювант», как правило, понимают субстанции, которые не содержат агенты, которые сами обусловливают иммунитет. Адъювант помогает иммунной системе неспецифически усиливать антигенспецифический иммунный ответ, например, стимулируя презентацию антигена иммунной системе или индукцию неспецифического врожденного иммунного ответа. Кроме того, адъювант может предпочтительно, например, модулировать антигенспецифический иммунный ответ, например, путем сдвига доминирующего антигенспецифического ответа на основе Th2 в сторону повышения антигенспецифического ответа на основе Th1 или наоборот. Таким образом, адъювант предпочтительно может модулировать экспрессию/секрецию цитокинов, презентацию антигенов, тип иммунного ответа и т.д.
Иммуностимуляторная РНК: Иммуностимуляторная РНК (isPHK) в контексте изобретения, как правило, может представлять собой РНК, которая сама обладает способностью индуцировать врожденный иммунный ответ. Обычно она не имеет открытой рамки считывания и, таким образом, не кодирует пептид-антиген или иммуноген, но вызывает врожденный иммунный ответ, например, посредством связывания со специфическим типом Толл-подобного рецептора (TLR) или другими приемлемыми рецепторами. Однако, естественно, также и мРНК, имеющие открытую рамку считывания и кодирующие пептид/белок (например, антигенную функцию), могут индуцировать врожденный иммунный ответ.
Антиген: В контексте настоящего изобретения понятие «антиген» относится, как правило, к субстанции, которая может распознаваться иммунной системой и которая может обладать способностью запускать антигенспецифический иммунный ответ, например, посредством образования антител и/или антигенспецифических Т-клеток, в качестве компонента адаптивного иммунного ответа. Антиген может представлять собой белок или пептид. В этом контексте первая стадия адаптивного иммунного ответа представляет собой активацию наивных антигенспецифических Т-клеток антигенпрезентирующими клетками. Это происходит в лимфоидных тканях и органах, через которые постоянно проходят наивные Т-клетки. Три типа клеток, которые могут служить в качестве антигенпрезентирующих клеток, представляют собой дендритные клетки, макрофаги и В-клетки. Каждая из указанных клеток выполняет отдельную функцию при вызывании иммунных ответов. Присутствующие в ткани дендритные клетки поглощают антигены посредством фагоцитоза и макропиноцитоза, и при заражении стимулируется их миграция в местную лимфоидную ткань, где может происходить их дифференцировка в зрелые дендритные клетки. Макрофаги поглощают находящиеся в форме частиц антигены, такие как бактерии, и индуцируются инфекционными агентами, в результате чего экспрессируют молекулы ГКГС класса II. Уникальная способность В-клеток к связыванию и интернализации растворимых белковых антигенов посредством своих рецепторов может иметь важное значение для индукции Т-клеток. Презентация антигена на молекулах ГКГС приводит к активации Т-клеток, что индуцирует их пролиферацию и дифференцировку в «вооруженные» эффекторные Т-клетки. Наиболее важной функцией эффекторных Т-клеток является уничтожение (цитолиз) инфицированных клеток цитотоксическими CD8+-Т-клетками и активация макрофагов Th1-клетками, что в совокупности создает опосредованный клетками иммунитет, и активация В-клеток как Th2-, так и Th1-клетками, приводящая к образованию различных классов антител, что приводит к запуску гуморального иммунного ответа. Т-клетки распознают антиген посредством своих Т-клеточных рецепторов, которые не распознают антиген и не связываются с ним непосредственно, но вместо этого распознают короткие пептидные фрагменты, например, полученные из патогена белковых антигенов, например, которые связываются с молекулами ГКГС на поверхностях других клеток.
Т-клетки подразделяют на два основных класса, имеющих различные эффекторные функции. Два класса отличаются по экспрессии белков клеточной поверхности CD4 и CD8. Эти два типа Т-клеток отличаются классом молекулы ГКГС, которую они распознают. Известно два класса молекул ГКГС: молекулы ГКГС класса I и ГКГС класса II, которые отличаются структурой и схемой экспрессии в тканях организма. CD4+-Т-клетки связываются с молекулой ГКГС класса II, а CD8+-Т-клетки с молекулой ГКГС класса I. Молекулы ГКГС класса I и ГКГС класса II отличаются различным распределением среди клеток, что отражает различные эффекторные функции Т-клеток, которые их распознают. Молекулы ГКГС класса I презентуют пептиды цитозольного и ядерного происхождения, например, из патогенов, обычно вирусов, CD8+-Т-клеткам, которые дифференцируются в цитотоксические Т-клетки, специализацией которых является цитолиз любой клетки, которую они специфически распознают. Почти все клетки экспрессируют молекулы ГКГС класса I, хотя уровень конститутивной экспрессии варьируется от одного типа клеток к другому. Но не только патогенные пептиды из вирусов презентуются молекулами ГКГС класса I, но ими презентуются также и аутоантигены типа опухолевых антигенов. Молекулы ГКГС класса I связывают пептиды из белков, расщепленных в цитозоле, и транспортируют в эндоплазматический ретикулум. CD8+-Т-клетки, которые распознают комплексы ГКГС класса I:пептид на поверхности инфицированных клеток, специализируются в отношении цитолиза любых клеток, экспонирующих чужеродные пептиды, и поэтому избавляют организм от клеток, инфицированных вирусами и другими цитозольными патогенами. Основной функцией CD4+-Т-клеток (CD4+-Т-клетки-хелперы), которые распознают молекулы ГКГС класса II, является активация других эффекторных клеток иммунной системы. Так, молекулы ГКГС класса II в норме присутствуют на В-лимфоцитах, дендритных клетках и макрофагах, клетках, которые участвуют в иммунных ответах, но не на других клетках тканей. Макрофаги, например, активируются в отношении уничтожения находящихся внутри везикул патогенов, которые они несут, а В-клетки в отношении секреции иммуноглобулинов против чужеродных молекул. У молекул ГКГС класса II отсутствует связывание с пептидами в эндоплазматическом ретикулуме, и поэтому молекулы ГКГС класса II связывают пептиды из белков, расщепленных в эндосомах. Они могут захватывать пептиды из патогенов, внедрившихся в везикулярную систему макрофагов, или из антигенов, интернализированных незрелыми дендритными клетками или иммуноглобулиновыми рецепторами В-клеток. Патогены, которые накапливаются в больших количествах внутри везикул макрофагов и дендритных клеток, имеют тенденцию к стимуляции дифференцировки Th1-клеток, в то время как внеклеточные антигены имеют тенденцию к стимуляции производства Th2-клеток. Th1-клетки активируют микробиоцидные свойства макрофагов и индуцируют производство антител IgG-типа В-клетками, которые очень эффективно осуществляют опсонизацию внеклеточных патогенов, что приводит к их поглощению фагоцитарными клетками, в то время как Th2-клетки инициируют гуморальный ответ путем активации наивных В-клеток в отношении секреции IgM и индуцируют производство обладающих слабой опсонизирующей способностью антител, таких как IgG1 и IgG3 (мышиные) и IgG2 и IgG4 (человеческие), а также IgA и IgE (мышиные и человеческие).
Эпитоп (называемый также «антигенной детерминантой»): Т-клеточные эпитопы или участки белков в контексте настоящего изобретения могут содержать фрагменты, предпочтительно имеющие длину от примерно 6 до примерно 20 аминокислот или даже более, например, фрагменты, процессируемые и презентуемые молекулами ГКГС класса I, предпочтительно имеют длину от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10, (или даже 11 или 12 аминокислот), или фрагменты, процессируемые и презентуемые молекулами ГКГС класса II, предпочтительно имеют длину примерно 13 аминокислот или более, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже большее количество аминокислот, при этом указанные фрагменты можно выбирать из любой части аминокислотной последовательности. Указанные участки белков или фрагменты в контексте настоящего изобретения, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы ГКГС. Предпочтительно указанное распознавание опосредуется связыванием антител, В-клеток или Т-клеток с рассматриваемым эпитопом. В этом контексте понятие «связывание» предпочтительно относится к специфическому связыванию. Предпочтительно специфическое связывание антител с эпитопами опосредуется Fab-(антигенсвязывающий фрагмент) областью антитела, специфическое связывание В-клетки опосредуется Fab-областью антитела, входящей в В-клеточный рецептор, а специфическое связывание Т-клетки опосредуется вариабельной (V) областью Т-клеточного рецептора.
В-клеточные эпитопы, как правило, представляют собой фрагменты, локализованные на внешней поверхности (нативных) белковых или пептидных антигенов, указанных в настоящем описании, предпочтительно состоящие из 5-15 аминокислот, более предпочтительно состоящие из 5-12 аминокислот, еще более предпочтительно состоящие из 6-9 аминокислот, которые могут распознаваться антителами, т.е. в их нативной форме.
Такие эпитопы белков или пептидов можно, кроме того, выбирать из любых указанных вариантов таких белков или пептидов. В этом контексте антигенные детерминанты могут представлять собой конформационные или прерывистые эпитопы, состоящие из сегментов указанных в настоящем описании белков или пептидов, которые расположены с перерывами в аминокислотной последовательности белков или пептидов, указанных в настоящем описании, но которые находятся вблизи друг от друга в трехмерной структуре, или непрерывные или линейные эпитопы, состоящие из одной полипептидной цепи.
Эпитопы, как правило, состоят из расположенных на поверхности групп молекул, таких как аминокислоты или боковые цепи сахаров, и, как правило, имеют специфические характеристики трехмерной структуры, а также специфические характеристики зарядов. Понятие «эпитоп» относится к конформационным, а также неконформационным эпитопам. Конформационные и неконформационные эпитопы отличаются друг от друга тем, что связывание с первыми в отличие от последних утрачивается в присутствии денатурирующих растворителей.
Иммуногенный полипептид/пептид: Понятие «иммуногенный полипептид» (или, если это является приемлемым, «иммуногенный пептид») в контексте настоящего описания представляет собой полипептид (или пептид, если это является приемлемым), который содержит по меньшей мере один эпитоп. Таким образом, указанный «иммуногенный полипептид» (или, если это является приемлемым, «иммуногенный пептид») может вызывать иммунный ответ у индивидуума. Предпочтительные иммуногенные полипептиды индуцируют В-клеточный ответ или Т-клеточный ответ или В-клеточный ответ и Т-клеточный ответ. Иммуногенный полипептид в контексте настоящего изобретения можно получать из патогена, выбранного из группы, которая состоит из вирусов, бактерий и простейших. В конкретных вариантах осуществления изобретения он имеет происхождение из вируса. Однако в альтернативном конкретном варианте осуществления настоящего изобретения иммуногенный полипептид представляет собой полипептид или фрагмент полипептида, экспрессируемый опухолью или раком или ассоциированный с аллергией или аутоиммунным заболеванием.
Вакцина: Под вакциной, как правило, понимают предназначенный для профилактики или терации продукт, содержащий по меньшей мере один антиген или антигенную функцию. Антиген или антигенная функция может стимулировать адаптивную иммунную систему организма для вырабатывания адаптивного иммунного ответа.
Обеспечивающая образование антигена мРНК: В контексте изобретения обеспечивающая образование антигена мРНК может, как правило, представлять собой мРНК, имеющую по меньшей мере одну открытую рамку считывания, которая может транслироваться клеткой или организмом, которая/который содержит такую мРНК. Продукт указанной трансляции представляет собой пептид или белок, который может действовать в качестве антигена, предпочтительно иммуногена. Продукт может представлять собой также слитый белок, состоящий из нескольких иммуногенов, например, слитый белок, который состоит из двух или большего количества эпитопов, пептидов или белков, происходящих из одного и того же или из различных вирусных белков, при этом эпитопы, пептиды или белки могут быть связаны линкерными последовательностями.
Би/полицистронная мРНК: Би/полицистронная мРНК, как правило, может иметь две (бицистронная) или большее количество (полицистронная) открытых рамок считывания (ОРС)). В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов (кодонов), которые могут транслироваться в пептид или белок. Трансляция указанной мРНК приводит к образованию двух (бицистронная) или большего количества (полицистронная) различных продуктов трансляции (при условии, что ОРС не являются идентичными). Для экспрессии в эукариотах такие мРНК могут, например, содержать последовательность участка внутренней посадки (связывания) рибосомы (IRES).
5'-Кэп-структура: 5'-Кэп представляет собой, как правило, модифицированный нуклеотид, прежде всего гуаниновый нуклеотид, добавленный к 5'-концу молекулы РНК. Предпочтительно 5'-кэп добавляют с использованием 5'-5'-трифосфатной связи (которую обозначают также m7GpppN). Другими примерами структур 5'-кэпа являются глицерил, инвертированная дезоксигруппа (фрагмент), лишенная азотистого основания, 4',5'-метиленовый нуклеотид, 1-(бета-D-эритрофуранозильный) нуклеотид, 4'-тионуклеотид, карбоциклический нуклеотид, 1,5-ангидрогекситольный нуклеотид, L-нуклеотиды, альфа-нуклеотид, нуклеотид с модифицированным основанием, треопентофуранозильный нуклеотид, ациклический 3',4'-секонуклеотид, ациклический 3,4-дигидроксибутильный нуклеотид, ациклический 3,5-дигидроксипентильный нуклеотид, 3'-3'-инвертированный нуклеотидный фрагмент, 3'-3'-инвертированный лишенный азотистого основания фрагмент, 3'-2'-инвертированный нуклеотидный фрагмент, 3'-2'-инвертированный лишенный азотистого основания фрагмент, 1,4-бутандиолфосфатный, 3'-фосфороамидатный, гексилфосфатный, аминогексилфосфатный, 3'-фосфатный, 3'-фосфоротиоатный, фосфородитиоатный или связанный мостиком или несвязанный мостиком метилфосфонатный фрагмент. Указанные модифицированные структуры 5'-кэпа в контексте настоящего изобретения можно применять для модификации последовательности мРНК в предлагаемой в изобретении композиции. Другими модифицированными структурами 5'-кэпа, которые можно применять в контексте настоящего изобретения, являются САР1 (метилирование рибозы нуклеотида, примыкающего к m7G), САР2 (метилирование рибозы 2-ого нуклеотида, расположенного в прямом направлении относительно m7G), САР3 (метилирование рибозы 3-его нуклеотида, расположенного в прямом направлении относительно m7G), САР4 (метилирование рибозы 4-ого нуклеотида, расположенного в прямом направлении относительно m7G), ARCA (аналог кэп-структуры с правильной ориентацией), модифицированный ARCA (например, модифицированный фосфотиоатом ARCA), инозин, N1-метилгуанозин, 2'-фторгуанозин, 7-деазагуанозин, 8-оксогуанозин, 2-аминогуанозин, ЗНК-гуанозин и 2-азидогуанозин.
Фрагменты белков: В контексте настоящего изобретения «фрагменты» белков или пептидов, могут, как правило, содержать последовательность белка или пептида, как она определена в настоящем описании, которая касательно ее аминокислотной последовательности (или кодирующей ее молекулы нуклеиновой кислоты), укорочена на N-конце, С-конце и/или внутри последовательности по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей его молекулы нуклеиновой кислоты). Таким образом, указанное укорочение может иметь место либо на аминокислотном уровне, либо соответственно на уровне нуклеиновой кислоты. Следовательно, идентичность последовательности применительно к такому фрагменту, как он определен в настоящем описании, предпочтительно относится к полному белку или пептиду, как они определены в настоящем описании, или к полной (кодирующей) молекуле нуклеиновой кислоты указанного белка или пептида. Фрагменты белков или пептидов в контексте настоящего изобретения могут содержать последовательность белка или пептида, указанного в настоящем описании, на долю которой приходится по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% от полноразмерной аминокислотной последовательности.
Фрагменты белков или пептидов в контексте настоящего изобретения могут содержать также последовательность белка или пептида, указанного в настоящем описании, которая имеет длину, составляющую по меньшей мере 5 аминокислот, предпочтительно длину, составляющую по меньшей мере 6 аминокислот, предпочтительно по меньшей мере 7 аминокислот, более предпочтительно по меньшей мере 8 аминокислот, еще более предпочтительно по меньшей мере 9 аминокислот; еще более предпочтительно по меньшей мере 10 аминокислот; еще более предпочтительно по меньшей мере 11 аминокислот; еще более предпочтительно по меньшей мере 12 аминокислот; еще более предпочтительно по меньшей мере 13 аминокислот; еще более предпочтительно по меньшей мере 14 аминокислот; еще более предпочтительно по меньшей мере 15 аминокислот; еще более предпочтительно по меньшей мере 16 аминокислот; еще более предпочтительно по меньшей мере 17 аминокислот; еще более предпочтительно по меньшей мере 18 аминокислот; еще более предпочтительно по меньшей мере 19 аминокислот; еще более предпочтительно по меньшей мере 20 аминокислот; еще более предпочтительно по меньшей мере 25 аминокислот; еще более предпочтительно по меньшей мере 30 аминокислот; еще более предпочтительно по меньшей мере 35 аминокислот; еще более предпочтительно по меньшей мере 50 аминокислот; или наиболее предпочтительно по меньшей мере 100 аминокислот. Например, указанный фрагмент может содержать от примерно 6 до примерно 20 или даже большее количество аминокислот, например, фрагменты, процессированные и презентируемые молекулами ГКГС класса I, предпочтительно имеют длину от примерно 8 до примерно 10 аминокислот, например, 8, 9 или 10 (или даже 6, 7, 11 или 12 аминокислот), или фрагменты, процессированные и презентируемые молекулами ГКГС класса II, предпочтительно состоят примерно из 13 или большего количества аминокислот, например, из 13, 14, 15, 16, 17, 18, 19, 20 или даже большего количества аминокислот, при этом указанные фрагменты можно выбирать из любой области аминокислотной последовательности. Указанные фрагменты, как правило, распознаются Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекул ГКГС, т.е. фрагменты, как правило, не распознаются в их нативной форме. Фрагменты белков или пептидов могут содержать по меньшей мере один эпитоп указанных белков или пептидов. Кроме того, подразумевается, что фрагмент белка может содержать также домены белка типа внеклеточного домена, внутриклеточного домена или трансмембранного домена и укороченные или усеченные версии белка.
Варианты белков: Как следует из контекста настоящего изобретения, можно создавать «варианты» белков или пептидов, имеющие аминокислотную последовательность, которая отличается от исходной последовательности наличием одной мутации или большего количества мутаций, например, замен, инсерций и/или делеций аминокислот(ы). Предпочтительно указанные фрагменты и/или варианты обладают той же самой биологической функцией или специфической активностью, что и полноразмерный нативный белок, например, присущей ему специфической антигенной характеристикой. Как следует из контекста настоящего изобретения, «варианты» белков или пептидов могут содержать консервативную(ые) аминокислотную(ые) замену(ы) по сравнению с их нативной, т.е. не подвергнутой мутации физиологической последовательностью. Такие аминокислотные последовательности, а также, в частности, кодирующие их нуклеотидные последовательности, подпадают под указанное в настоящем описании понятие «варианты». Замены, при которых заменяют друг на друга аминокислоты, относящиеся к одному и тому же классу, называют консервативными заменами. В частности, такими классами являются аминокислоты, имеющие алифатические боковые цепи, положительно или отрицательно заряженные боковые цепи, ароматические группы в боковых цепях, или аминокислоты, боковые цепи которых могут входить в водородные мостики, например, боковые цепи которых несут гидроксильную функцию. Это означает, например, что аминокислоту, имеющую полярную боковую цепь, заменяют на другую аминокислоту, также имеющую полярную боковую цепь, или, например, аминокислоту, характеризующуюся гидрофобной боковой цепью, заменяют на другую аминокислоту, также имеющую гидрофобную боковую цепь (например, серин (треонин) на треонин (серин) или лейцин (изолейцин) на изолейцин (лейцин)). Можно осуществлять инсерции и замены, прежде всего, в тех положениях в последовательности, которые не приводят к модификации трехмерной структуры или не влияют на связывающую область. Модификации в трехмерной структуре, обусловленные инсерцией(ями) или делецией(ями), можно легко определять, например, с использованием CD-спектров (спектры кругового дихроизма) (Urry, Absorption, Circular Dichroism и ORD of Polypeptides, в: Modern Physical Methods in Biochemistry, под ред. Neuberger и др., изд-во Elsevier, Amsterdam, 1985).
Аминокислотная последовательность «варианта» белка или пептида может быть идентична по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% состоящему из 10, 20, 30, 50, 75 или 100 аминокислот участку указанного белка или пептида.
Кроме того, варианты белков или пептидов, как они указаны в настоящем описании, которые могут кодироваться молекулой нуклеиновой кислоты, могут содержать также такие последовательности, в которых нуклеотиды нуклеиновой кислоты обменены в соответствии с вырожденностью генетического кода, что не приводит к изменению соответствующей аминокислотной последовательности белка или пептида, т.е. аминокислотная последовательность или по меньшей мере ее часть могут не отличаться от исходной последовательности одной мутацией или большим количеством мутаций в указанном выше смысле.
Предпочтительно вариант белка содержит функциональный вариант белка, это означает, что вариант обладает таким же действием или такой же функциональностью, что и полный белок, из которого он получен.
Идентичность последовательности: Для определения процента идентичности двух последовательностей, например, нуклеотидных последовательностей или аминокислотных последовательностей, указанных в настоящем описании, предпочтительно аминокислотных последовательностей, кодируемых молекулой нуклеиновой кислоты полимерного носителя, указанного в настоящем описании, или самих аминокислотных последовательностей, последовательности можно выравнивать для последующего сравнения друг с другом. Так, например, положение в первой последовательности можно сравнивать с соответствующим положением во второй последовательности. Если положение в первой последовательности занято тем же компонентом (остатком), который находится в этом положении во второй последовательности, то две последовательности являются идентичными в этом положении. Если это не имеет места, то последовательности различаются в этом положении. Если во второй последовательности присутствуют инсерции по сравнению с первой последовательностью, то можно встраивать бреши в первую последовательность, что позволяет продолжать осуществление сравнительного анализа. Если во второй последовательности имеются делеции по сравнению с первой последовательностью, то можно встраивать бреши во вторую последовательность, что позволяет продолжать осуществление сравнительного анализа. Таким образом, процент идентичности двух последовательностей является функцией количества идентичных положений, деленного на общее количество положений, включая те положения, которые заняты только в одной последовательности. Процент идентичности двух последовательностей можно определять с помощью математического алгоритма. Предпочтительным примером математического алгоритма, который можно применять, является (но не ограничиваясь только им) алгоритм, предложенный Karlin и др., PNAS USA, 90, 1993, сс.5873-5877 или Altschul и др., Nucleic Acids Res., 25, 1997, сс.3389-3402. Указанный алгоритм входит в программу BLAST. С помощью этой программы можно идентифицировать последовательности, обладающие конкретной степенью идентичности с последовательностями, предлагаемыми в настоящем изобретении.
Производное белка или пептида: Под производным пептида или белка, как правило, понимают молекулу, которая происходит из другой молекулы, такой как указанный пептид или белок. Под понятие «производное» пептида или белка подпадают также слияния, содержащие пептид или белок, применяемые согласно настоящему изобретению. Например, слияние содержит метку, такую, например, как эпитоп, например, эпитоп FLAG или эпитоп V5. Например, эпитоп представляет собой эпитоп FLAG. Такую метку используют, например, для очистки слитого белка.
Моноцистронная мРНК: Моноцистронная мРНК, как правило, может представлять собой мРНК, которая кодирует только одну открытую рамку считывания. В этом контексте открытая рамка считывания представляет собой последовательность, состоящую из нескольких нуклеотидных триплетов (кодонов), которые могут транслироваться в пептид или белок.
Нуклеиновая кислота: Понятие «нуклеиновая кислота» означает любые полимерные макромолекулы, состоящие из нуклеотидных мономеров, и его используют в качестве синонима понятию «полинуклеотид». Нуклеотидные мономеры состоят из нуклеотидного основания, имеющего 5 атомов углерода сахара (такого как (но не ограничиваясь только ими) рибоза или 2'-дезоксирибоза) и 1-3 фосфатных групп. Как правило, полинуклеотид образуется с помощью фосфодиэфирных связей между индивидуальными нуклеотидными мономерами. В контексте настоящего изобретения предпочтительные молекулы нуклеиновых кислот включают (но не ограничиваясь только ими) молекулу ДНК или РНК, и, в частности, матричную РНК (мРНК). Кроме того, под понятие «нуклеиновая кислота» подпадают также искусственные аналоги ДНК или РНК, такие как пептидная нуклеиновая кислота (ПНК), а также полинуклеотиды, такие как РНК, которые включают не встречающиеся в естественных условиях нуклеотиды или нуклеотидные аналоги, такие как описанные в WO 2013/052523. Если в контексте настоящего описания упоминается нуклеиновая кислота или нуклеотидная последовательность, кодирующая конкретный белок и/или пептид, то указанная нуклеиновая кислота или нуклеотидная последовательность соответственно предпочтительно содержит также регуляторные последовательности, обеспечивающие в приемлемом хозяине, например, человеке, экспрессию, т.е. транскрипцию и/или трансляцию нуклеотидной последовательности, которая кодирует конкретный белок или пептид, и указанную нуклеиновую кислоту или нуклеотидную последовательность (содержащую последовательность, кодирующую белок и/или пептид, и одну или несколько указанных регуляторных и/или других последовательностей) можно обозначать как «конструкция нуклеиновой кислоты».
Фармацевтически эффективное количество: В контексте изобретения под фармацевтически эффективным количеством, как правило, понимают количество, достаточное для того, чтобы индуцировать иммунный ответ.
Поли(С)-последовательность: Поли (С)-последовательность, как правило, представляет собой длинную последовательность, состоящую из цитозиновых нуклеотидов, как правило, содержащую от примерно 10 до примерно 200 цитозиновых нуклеотидов, предпочтительно от примерно 10 до примерно 100 цитозиновых нуклеотидов, более предпочтительно от примерно 10 до примерно 70 цитозиновых нуклеотидов или еще более предпочтительно от примерно 20 до примерно 50 или даже от примерно 20 до примерно 30 цитозиновых нуклеотидов. Поли(С)-последовательность предпочтительно может располагаться в 3'-направлении относительно кодирующей области, содержащейся в нуклеиновой кислоте.
Поли(А)-хвост/поли(А)-последовательность: Поли(А)-хвост, который называют также «3'-поли(А)-хвостом» или «поли(А)-последовательностью», как правило, представляет собой длинную последовательность аденозиновых нуклеотидов, содержащую вплоть до примерно 400 аденозиновых нуклеотидов, например, от примерно 25 до примерно 400, предпочтительно от примерно 50 до примерно 400, более предпочтительно от примерно 50 до примерно 300, еще более предпочтительно от примерно 50 до примерно 250, наиболее предпочтительно от примерно 60 до примерно 250 аденозиновых нуклеотидов, добавленную к 3'-концу РНК.
Стабилизированная нуклеиновая кислота: Стабилизированная нуклеиновая кислота, как правило, имеет модификацию, повышающую устойчивость к расщеплению in vivo (например, расщеплению экзо- или эндонуклеазой) и/или расщеплению ex vivo (например, в процессе производства до введения вакцины, например, в процессе приготовления раствора вакцины, предназначенного для введения). Стабилизацию РНК можно, например, обеспечивать с использованием 5'-кэп-структуры, поли(А)-хвоста и/или любой другой модификации UTR. Ее можно обеспечивать также путем модификации каркаса и/или модификации содержания G/C в нуклеиновой кислоте. В данной области известны различные другие методы и их можно рассматривать в контексте изобретения.
Носитель/полимерный носитель: В контексте изобретения носитель, как правило, может представлять собой соединение, которое облегчает транспорт и/или включение в комплекс другого соединения. Указанный носитель может образовывать комплекс с указанным другим соединением. Полимерный носитель представляет собой носитель, образующий полимер.
Катионный компонент: Понятие «катионный компонент», как правило, относится к заряженной молекуле, которая является положительно заряженной (катион) при значении рН, составляющем, как правило, от 1 до 9, предпочтительно при значении рН, равном или ниже 9 (например, от 5 до 9), равном или ниже 8 (например, от 5 до 8), равном или ниже 7 (например, от 5 до 7), наиболее предпочтительно при физиологическом значении рН, например, от 7,3 до 7,4. Таким образом, согласно настоящему изобретению катионный пептид, белок или полимер является положительно заряженным в физиологических условиях, прежде всего в физиологических условиях клетки in vivo. Катионный пептид или белок предпочтительно содержит большее количество катионных аминокислот, например, большее количество Arg, His, Lys или Orn, чем других аминокислотных остатков (в частности, большее количество катионных аминокислот, чем анионных аминокислотных остатков типа Asp или Glu), или содержит блоки, сформированные преимущественно из катионных аминокислотных остатков. Понятие «катионный» может относиться также к «поликатионным» компонентам.
Наполнитель: Наполнитель представляет собой агент, например, носитель, который, как правило, можно использовать в фармацевтической композиции или вакцине для облегчения введения компонентов фармацевтической композиции или вакцины индивидууму.
3'-нетранслируемая область (3'-UTR): 3'-UTR, как правило, является частью мРНК, локализованной между кодирующей белок областью (т.е. открытой рамкой считывания) и поли(А)-последовательностью мРНК. 3'-UTR мРНК не транслируется в аминокислотную последовательность. Последовательность 3'-UTR, как правило, кодируется геном, который транскрибируется в соответствующую мРНК в процессе экспрессии гена. Геномная последовательность сначала транскрибируется в незрелую мРНК, которая содержит необязательные интроны. Незрелая мРНК затем дополнительно процессируется с образованием зрелой мРНК в процессе созревания. Указанный процесс созревания включает стадии 5'-кэпирования, сплайсинга незрелой мРНК с вырезанием необязательных интронов и модификаций 3'-конца, таких как подиаденилирование 3'-конца незрелой мРНК и необязательные расщепления эндо-/или экзонуклеазами и т.д. В контексте настоящего изобретения 3'-UTR соответствует последовательности зрелой мРНК, которая расположена с 3'-стороны стоп-кодона кодирующей белок области, предпочтительно непосредственно примыкает с 3'-стороны к стоп-кодону кодирующей белок области, и которая простирается до 5'-стороны поли(А)-последовательности, предпочтительно до нуклеотида, непосредственно примыкающего с 5'-стороны к поли(А)-последовательности. Понятие «соответствует» означает, что последовательность 3'-UTR может представлять собой последовательность РНК, такую как последовательность мРНК, указанную при определении последовательности 3'-UTR, или последовательность ДНК, которая соответствует указанной последовательности РНК. В контексте настоящего изобретения понятие «3'-UTR гена», например, «3'-UTR гена альбумина», означает последовательность, которая соответствует 3'-UTR зрелой мРНК, полученной из указанного гена, т.е. мРНК, полученной путем транскрипции гена и созревания незрелой мРНК. Понятие «3'-UTR гена» включает последовательность ДНК и последовательность РНК 3'-UTR.
5'-нетранслируемая область (5'-UTR): Под 5'-UTR, как правило, понимают конкретный сегмент матричной РНК (мРНК). Она локализована на 5'-конце открытой рамки считывания мРНК. Как правило, 5'-UTR начинается с сайта инициации транскрипции и закачивается на расстоянии одного нуклеотида до стартового кодона открытой рамки считывания. 5'-UTR может содержать элементы, предназначенные для контроля генной экспрессии, так называемые регуляторные элементы. Указанные регуляторные элементы могут представлять собой, например, сайты связывания рибосом или 5'-концевой олигопиримидиновый тракт. 5'-UTR может подвергаться посттранскрипционным модификациям, например, путем добавления 5'-кэпа. В контексте настоящего изобретения 5'-UTR соответствует последовательности зрелой мРНК, локализованной между 5'-кэпом и стартовым кодоном. Предпочтительно 5'-UTR соответствует последовательности, которая простирается от нуклеотида, расположенного с 3'-стороны 5'-кэпа, предпочтительно от нуклеотида, непосредственно примыкающего с 3'-стороны к 5'-кэпу, до нуклеотида, расположенного с 5'-стороны стартового ко дона кодирующей белок области, предпочтительно до нуклеотида, непосредственно примыкающего с 5'-стороны к стартовому ко дону кодирующей белок области. Нуклеотид, непосредственно примыкающий с 3'-стороны к 5'-кэпу зрелой мРНК, как правило, соответствует сайту инициации транскрипции. Понятие «соответствует» означает, что последовательность 5'-UTR может представлять собой последовательность РНК, такую как последовательность мРНК, указанная при определении последовательности 5'-UTR, или последовательность ДНК, которая соответствует указанной последовательности РНК. В контексте настоящего изобретения понятие «5'-UTR гена», такое как «5'-UTR ТОР-гена», обозначает последовательность, которая соответствует 5'-UTR зрелой мРНК, полученной из этого гена, т.е. мРНК, полученной путем транскрипции гена и созревания незрелой мРНК. Понятие «5'-UTR гена» включает последовательность ДНК и последовательность РНК 5'-UTR.
5'-концевой олигопиримидиновый тракт (ТОР): 5'-концевой олигопиримидиновый тракт (ТОР), как правило, обозначает сегмент пиримидиновых нуклеотидов, локализованный в 5'-концевой области молекулы нуклеиновой кислоты, например, в 5'-концевой области некоторых молекул мРНК или в 5'-концевой области функционального элемента, например, транскрибируемой области некоторых генов. Последовательность начинается с цитидина, который, как правило, соответствует сайту инициации транскрипции, и за которым следует сегмент, как правило, состоящий примерно из 3-30 пиримидиновых нуклеотидов. Например, ТОР может содержать 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или даже большее количество нуклеотидов. Пиримидиновый сегмент и, следовательно, 5'-ТОР, заканчивается одним нуклеотидом, примыкающим с 5'-стороны к первому пуриновому нуклеотиду, расположенному в прямом направлении относительно ТОР. МРНК, которая содержит 5'-концевой олигопримидиновый тракт, часто обозначают как ТОР-мРНК. Таким образом, гены, из которых получают указанные матричные РНК, обозначают как ТОР-гены. Последовательности ТОР, например, обнаружены в генах и мРНК, кодирующих пептидные факторы элонгации и рибосомные белки.
ТОР-мотив: В контексте настоящего изобретения ТОР-мотив обозначает нуклеотидную последовательность, которая соответствует 5'-ТОР, описанному выше. Таким образом, ТОР-мотив в контексте настоящего изобретения предпочтительно обозначает сегмент пиримидиновых нуклеотидов длиной 3-30 нуклеотидов. Предпочтительно ТОР-мотив состоит по меньшей мере из 3 пиримидиновых нуклеотидов, предпочтительно по меньшей мере 4 пиримидиновых нуклеотидов, предпочтительно по меньшей мере 5 пиримидиновых нуклеотидов, более предпочтительно по меньшей мере 6 нуклеотидов, более предпочтительно по меньшей мере 7 нуклеотидов, наиболее предпочтительно по меньшей мере 8 пиримидиновых нуклеотидов, при этом сегмент пиримидиновых нуклеотидов предпочтительно начинается на его 5'-конце с цитозинового нуклеотида. В ТОР-генах и ТОР-мРНК ТОР-мотив предпочтительно начинается на его 5'-конце с сайта инициации транскрипции и заканчивается одним нуклеотидом, примыкающим с 5'-стороны к первому пуриновому остатку в указанном гене или указанной мРНК. ТОР-мотив в контексте настоящего изобретения предпочтительно локализован на 5'-конце последовательности, которая представляет собой 5'-UTR, или на 5'-конце последовательности, которая кодирует 5'-UTR. Таким образом, в контексте настоящего изобретения сегмент из 3 или большего количества пиримидиновых нуклеотидов предпочтительно называют «ТОР-мотивом», если сегмент локализован на 5'-конце соответствующей последовательности, такой как мРНК, предлагаемая в изобретении, 5'-UTR-элемент мРНК, предлагаемой в изобретении, или нуклеотидная последовательность, которую получают из 5'-UTR ТОР-гена, указанного в настоящем описании. Другими словами, сегмент, состоящий из 3 или большего количества пиримидиновых нуклеотидов, который не локализован на 5'-конце 5'-UTR или 5'-UTR-элемента, но локализован где-либо внутри 5'-UTR или 5'-UTR-элемента, предпочтительно не обозначают как «ТОР-мотив».
ТОР-ген: ТОР-гены, как правило, характеризуются присутствием 5'-концевого олигопримидинового тракта. Кроме того, большинство ТОР-генов характеризуются связанной с ростом регуляцией трансляции. Однако известны также ТОР-гены с тканеспецифической регуляцией трансляции. Как указано выше, 5'-UTR ТОР-гена соответствует последовательности 5'-UTR зрелой мРНК, происходящей из ТОР-гена, которая предпочтительно простирается от нуклеотида, расположенного с 3'-стороны 5'-кэпа, до нуклеотида, расположенного с 5'-стороны стартового кодона. 5'-UTR ТОР-гена, как правило, не содержит никаких стартовых кодонов, предпочтительно не содержит расположенных в обратном направлении (u) AUG (uAUG) или расположенных в обратном направлении открытых рамок считывания (uOPC). В данном контексте под расположенными в обратном направлении AUG и расположенными в обратном направлении открытыми рамками считывания, как правило, понимают AUG и открытые рамки считывания, которые находятся с 5'-стороны относительно стартового кодона (AUG) открытой рамки считывания, которая должна транслироваться. 5'-UTR ТОР-генов, как правило, являются относительно короткими. Длины 5'-UTR ТОР-генов могут варьироваться от 20 нуклеотидов вплоть до 500 нуклеотидов и, как правило, они содержат менее чем примерно 200 нуклеотидов, предпочтительно менее чем примерно 150 нуклеотидов, более предпочтительно менее чем примерно 100 нуклеотидов. Примерами 5'-UTR ТОР-генов в контексте настоящего изобретения являются нуклеотидные последовательности, простирающиеся от нуклеотида в положении 5 до нуклеотида, непосредственно примыкающего с 5'-стороны к стартовому кодону (например, ATG), указанные последовательности представлены в SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422 международной заявки на патент WO 2013/143700, или представляют собой их гомологи или варианты, описание указанного документа включено в настоящее описание в качестве ссылки. В этом контексте наиболее предпочтительным фрагментом 5'-UTR ТОР-гена является 5'-UTR ТОР-гена без 5'ТОР-мотива. Понятие «5'-UTR ТОР-гена» предпочтительно относится к 5'-UTR встречающегося в естественных условиях ТОР-гена.
Фрагмент нуклеотидной последовательности, в частности, мРНК: Фрагмент нуклеотидной последовательности состоит из непрерывного сегмента нуклеотидов, который соответствует непрерывному сегменту нуклеотидов в полноразмерной нуклеотидной последовательности, которая является основой для нуклеотидной последовательности фрагмента, который соответствует по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% полноразмерной нуклеотидной последовательности. В контексте настоящего изобретения указанный фрагмент предпочтительно представляет собой функциональный фрагмент полноразмерной нуклеотидной последовательности. Фрагменты нуклеотидной последовательности в контексте настоящего изобретения могут содержать также последовательность нуклеотидов, указанную в настоящем описании, которая имеет длину, состоящую, например, по меньшей мере из 15 нуклеотидов, предпочтительно, состоящую, например, по меньшей мере из 18 нуклеотидов, предпочтительно по меньшей мере 21 нуклеотида, более предпочтительно по меньшей мере 24 нуклеотидов, еще более предпочтительно по меньшей мере 27 нуклеотидов; еще более предпочтительно по меньшей мере 30 нуклеотидов; еще более предпочтительно по меньшей мере 33 нуклеиновых кислот; еще более предпочтительно по меньшей мере 36 нуклеотидов; еще более предпочтительно по меньшей мере 39 нуклеотидов; еще более предпочтительно по меньшей мере 42 нуклеотидов; еще более предпочтительно по меньшей мере 45 нуклеотидов; еще более предпочтительно по меньшей мере 48 нуклеотидов; еще более предпочтительно по меньшей мере 51 нуклеотида; еще более предпочтительно по меньшей мере 54 нуклеотидов; еще более предпочтительно по меньшей мере 57 нуклеотидов; еще более предпочтительно по меньшей мере 60 нуклеотидов; еще более предпочтительно по меньшей мере 75 нуклеотидов; еще более предпочтительно по меньшей мере 90 нуклеотидов; еще более предпочтительно по меньшей мере 105 нуклеотидов; еще более предпочтительно по меньшей мере 150 нуклеотидов; или наиболее предпочтительно по меньшей мере 300 нуклеотидов или большего количества нуклеотидов, например, примерно от 300 до 500 нуклеотидов или примерно от 500 до 1000 нуклеотидов.
Вариант нуклеотидной последовательности, в частности, мРНК: Вариант нуклеотидной последовательности относится к варианту нуклеотидной последовательности, которая образует основу нуклеотидной последовательности. Например, вариант нуклеотидной последовательности может характеризоваться одной или несколькими нуклеотидными делециями, инсерциями, добавлениями и/или заменами по сравнению с нуклеотидной последовательностью, из которой вариант происходит. Предпочтительно вариант нуклеотидной последовательности идентичен по меньшей мере на 40%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%,еще более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95% нуклеотидной последовательности, из которой вариант происходит. Предпочтительно вариант представляет собой функциональный вариант.«Вариант» нуклеотидной последовательности может иметь по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных нуклеотидов в сегменте, состоящем из 10, 20, 30, 50, 75 или 100 нуклеотидов указанной нуклеотидной последовательности.
Гомолог нуклеотидной последовательности: Понятие «гомолог» нуклеотидной последовательности относится к последовательностям других видов относительно конкретной последовательности. Наиболее предпочтительно нуклеотидная последовательность представляет собой последовательность человеческого происхождения и поэтому предпочтительно, чтобы гомолог представлял собой гомолог человеческой нуклеотидной последовательности. Предпочтительно гомолог нуклеотидной последовательности идентичен по меньшей мере на 40%, предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 70%, еще более предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90%, наиболее предпочтительно по меньшей мере на 95% нуклеиновой референс-кислоте. «Гомолог» нуклеотидной последовательности может иметь по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных нуклеотидов в участке, состоящем из 10, 20, 30, 50, 75 или 100 нуклеотидов указанной нуклеотидной последовательности.
Струйная инъекция: Понятие «струйная инъекция» в контексте настоящего описания относится к методу безыгольной инъекции, при котором жидкость, содержащая по меньшей мере одну предлагаемую в изобретения последовательность мРНК и необязательно дополнительные приемлемые эксципиенты, принудительно пропускают через отверстие, создавая тем самым ультратонкую жидкую струю под высоким давлением, которая обладает способностью проникать через кожу млекопитающего и, в зависимости от условий инъекции, в подкожную ткань или мышечную ткань. В принципе жидкая струя образует отверстие в коже, через которую жидкая струя проходит в ткань-мишень. Предпочтительно струйную инъекцию применяют для внутрикожной, подкожной или внутримышечной инъекции последовательности мРНК, предлагаемой в изобретении. В предпочтительном варианте осуществления изобретения струйную инъекцию применяют для внутримышечной инъекции мРНК, предлагаемой в изобретении. В более предпочтительном варианте осуществления изобретения струйную инъекцию применяют для внутрикожной инъекции последовательности мРНК, предлагаемой в изобретении.
Белки, полипептиды и пептиды: Понятия «белок», «полипептид» и «пептид» в контексте настоящего описания применяют взаимозаменяемо, и они относятся к любой связанной пептидом цепи аминокислот вне зависимости от длины или котрансляционной или пост-трансляционной модификации. Под указанное определение конкретно и дополнительно подпадает полипептид белка или белок, который не кодируется конструкцией нуклеиновой кислоты, имеющий такие цепи, которые включают одну или несколько не встречающихся в естественных условиях аминокислот или подобных аминокислотам конструктивных элементов. В частности, указанные не кодируемые пептиды могут включать пептоиды, N-метилированные пептиды, пептидомиметики и пептидоподобные молекулы, которые включают не встречающиеся в естественных условиях аминокислоты или имеющие альтернативную хиральность. В некоторых вариантах осуществления изобретения белок или полипептид может состоять более чем примерно из 20, 30, 50, 60, 80, 100, 150, 200, 250, 300 аминокислот (или эквивалента, включающего подобные аминокислотам конструктивные элементы), а пептид может состоять менее чем примерно из 100, 80, 60, 30, 20 или 15 аминокислот (или эквивалента, включающего подобные аминокислотам конструктивные элементы), например, из примерно от 14 до 10, от 12 до 8 или от 11 до 6, а в некоторых вариантах осуществления изобретении менее чем из 5 аминокислот (или эквивалента, включающего подобные аминокислотам конструктивные элементы). Понятие «котрансляционный» в контексте настоящего описания относится к событиям, которые происходят во время процесса трансляции нуклеотидного триплета в аминокислотную цепь. Указанные события, как правило, изменяют или модифицируют химические или структурные свойства образовавшейся аминокислотной цепи. Примеры котрансляционных событий включают (но не ограничиваясь только ими) события, которые могут останавливать процесс трансляции полностью или прерывать образование пептидной связи, что приводит к образованию двух дискретных продуктов трансляции. Понятие «пост-трансляционный» в контексте настоящего описания относится к событиям, которые происходят после трансляции нуклеотидного триплета в аминокислоту и образования пептидной связи с предшествующей аминокислотной в последовательности. Указанные пост-трансляционные события могут происходить после образования полного полипептида или уже во время процесса трансляции, затрагивая уже транслированные участки полипептида. Пост-трансляционные события, как правило, изменяют или модифицируют химические или структурные свойства образовавшегося полипептида. Примеры пост-трансляционных событий включают (но не ограничиваясь только ими) такие события как гликозилирование или фосфорилирование аминокислот или расщепление пептидной цепи, например, эндопептидазой. Белки, полипептиды или пептиды, которые можно применять согласно настоящему изобретению, в частности, не кодируемые конструкцией нуклеиновой кислоты (включая производные белка, варианты белка, фрагменты белка, сегменты белка, эпитопы белка и домены белка) можно дополнительно модифицировать с помощью химической модификации. Так, в указанных вариантах осуществления изобретения химически модифицированный полипептид может содержать химические группы, отличные от остатков, присутствующих в 20 встречающихся в естественных условиях аминокислотах. Примеры указанных других химических групп включают (но не ограничиваясь только ими) гликозилированные аминокислоты и фосфорилированные аминокислоты. Химические модификации полипептида могут обеспечивать предпочтительные свойства по сравнению с родительским полипептидом, например, одно или несколько из таких свойств, как повышенная стабильность, повышенное биологическое время полужизни или повышенная растворимость в воде. Химические модификации, приемлемые для вариантов, которые можно применять согласно настоящему изобретению, включают (но не ограничиваясь только ими): ПЭГилирование, гликозилирование негликозилированных родительских полипептидов или модификацию схемы гликозилирования, присущей родительскому полипептиду. Указанные химические модификации, приемлемые для вариантов, которые можно применять согласно настоящему изобретению, могут происходить ко- или пост-трансляционно. В некоторых вариантах осуществления изобретения пептид может представлять собой полимер из аминокислотных мономеров, однако, как правило, мономеры сцеплены пептидными связями, и, таким образом, понятие «пептид» не ограничено длиной полимерной цепи аминокислот. Однако в некоторых указанных вариантах осуществления изобретения пептид может, например, содержать менее 50 мономерных звеньев. Пептиды, имеющие длину, большую, чем указанные пептиды, могут в некоторых вариантах осуществления изобретения быть обозначены как полипептиды, как правило, они содержат от 50 до 600 мономерных звеньев, более конкретно от 50 до 300 мономерных звеньев, или могут быть названы белками. В альтернативных вариантах осуществления изобретения под белком может подразумеваться молекула, которая состоит из одного или нескольких пептидов и/или полипептидов, как правило, уложенных в 3-мерную форму, например, для облегчения биологической функции.
Настоящее изобретение, в частности, способы, композиции, (упакованные) вакцины (композиции) или наборы, предлагаемые в настоящем изобретении, можно применять для введения или иного пути обработки индивидуума; в частности, если понятие «индивидуум» содержит такие понятия как «пациент», «особь» или «животное», применительно к многоклеточным животным, таким как позвоночные. Например, позвоночные в контексте настоящего изобретения представляют собой млекопитающих, птиц (например, домашняя птица), рептилий, амфибий, костных рыб и хрящевых рыб, в частности, любых вышеперечисленных одомашненных животных, а также животных (в частности, позвоночных), находящихся в неволе, таких как животные (в частности, позвоночные) в зоопарках. Млекопитающие в контексте настоящего изобретения включают (но не ограничиваясь только ими) человека, приматов кроме человека, одомашненных млекопитающих, таких как собаки, кошки, овцы, крупный рогатый скот, козы, свиньи, лошади и т.д., лабораторных животных, таких как мыши, крысы, кролики, морские свинки и т.д., а также млекопитающих, находящихся в неволе, таких как млекопитающие в зоопарках. В контексте настоящего описания под понятие «животное» подпадает также человек. Конкретными примерами птиц являются (но не ограничиваясь только ими) домашняя птица, к которой относятся такие птицы как куры, индюшки, утки, гуси, цесарки, голуби, фазаны и т.д.; а примеры костных или хрящевых рыб включают (но не ограничиваясь только ими) рыб, которые можно выращивать в агрокультуре, и они включают костных рыб, таких как лосось, форель, окунь, карп, зубатка и т.д. В конкретных вариантах осуществления всех приемлемых объектов изобретения индивидуум может представлять собой человека, например, человека, который нуждается в лечении или профилактике состояния, нарушения или заболевания; и/или в индукции иммунного ответа; и/или во введении композиции (вакцины) или компонента из набора или упакованной вакцины, предлагаемого в настоящем изобретении; и/или которого подвергают одному или нескольким из режимов лечения, указанных в настоящем описании, или применяют для осуществления указанного режима, например, с помощью способа, предлагаемого в настоящем изобретении.
Различными объектами изобретения, в целом, являются различные варианты способов, композиций, вакцин, наборов, упаковок и их компонентов, предназначенные для так называемой иммунизации и/или вакцинации с использованием режимов «прайм-буст».
При создании настоящего изобретения неожиданного было установлено, что режимы введения прайм-буст, указанные в настоящем описании, например, описанные в целом в качестве основных объектов изобретения, приводят к повышенному или улучшенному иммунному ответу по сравнению с альтернативными или известными из существующего уровня техники режимами иммунизации или вакцинации.
Прайм-буст: Во многих случаях однократное введение вакцины является недостаточным для создания иммунного ответа (например, достаточного количества или типа долговечных иммунных клеток), который требуется для эффективного лечения и/или профилактики, например, в случае заражения в будущем рассматриваемым патогенном, защиты от состояний, нарушений или заболеваний, включая опухоль, рак, аллергию или аутоиммунные состояния, нарушения или заболевания, или для терапевтического лечения состояния, нарушения или заболевания типа рака, опухоли или аутоиммунного состояния, нарушения или заболевания. Следовательно, требуется многократная провокация антигенной композицией в отношении специфического патогена или состояния, нарушения или заболевания для создания долговременного и защитного иммунного ответа и/или иммунитета против указанного патогена или состояния, нарушения или заболевания или для лечения или исцеления данного состояния, нарушения или заболевания. Режим введения, включающий многократное введение одной или нескольких антигенных композиций (например, вакцины), направленных против или влияющих на один и тот же патоген или состояние, нарушение или заболевание, в контексте настоящего описания обозначают как режим иммунизации или вакцинации «прайм-буст». Предпочтительно указанный режим иммунизации или вакцинации «прайм-буст» включает по меньшей мере два введения одной или нескольких антигенных композиций (таких как вакцина или композиция вакцины) направленных против или влияющих на специфический патоген, группу патогенов или специфическую группу состояний, нарушений или заболеваний. Первое введение указанной антигенной композиции обозначают как «первичное» или «прайм-введение» и указанную первую антигенную композицию можно обозначать как «первичную» или «прайм-композицию». Соответственно любое последующее введение такой же (или другой) антигенной композиции, направленной против такого же специфического патогена или группы патогенов, состояний, нарушений или заболеваний, что и первая антигенная композиция, можно обозначать как «бустинг (повышение, усиление)» или «бустерное введение», а указанную введенную позднее антигенную композицию можно обозначать как «усиливающая» композиция или «бустерная» композиция.
Таким образом, согласно некоторым вариантам различных объектов настоящего изобретения первую антигенную композицию и вторую антигенную композицию вводят индивидууму соответственно в режиме прайм-буст-иммунизации и/или режиме прайм-буст-вакцинации. В некоторых указанных вариантах осуществления изобретения вторую антигенную композицию вводят впоследствии (т.е. вводят после) примерно через 48 недель, 24 недели, 12 недель, 8 недель, 6 недель, 5 недель, 4 недели, 3 недели или примерно 28, 14 или 7 дней после введения первой антигенной композиции. В конкретных указанных вариантах осуществления изобретения вторую антигенную композицию вводят позднее примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день (дней) после введения первой антигенной композиции.
Некоторые варианты осуществления настоящего изобретения включают варианты, в которых первую (прайм/первичную) антигенную композицию и/или вторую (буст/бустерную) антигенную композицию вводят однократно. Однако в альтернативных вариантах осуществления настоящего изобретения подразумевается также, что первую (прайм/первичную) антигенную композицию и/или вторую (буст/бустерную) антигенную композицию вводят (или следует вводить) индивидууму более одного раза, например, с использованием двух или большего количество введений или доз.
Таким образом, настоящее изобретение включает также варианты, в которых: первую антигенную композицию вводят в виде двух или большего количества доз до введения второй антигенной композиции и/или вторую антигенную композицию вводят в виде двух или большего количества доз после введения первой антигенной композиции, например, от 2 до 7 доз, от 2 до 5 или от 3 до 5 доз (например, примерно 4 дозы). В конкретных указанных вариантах осуществления изобретения индивидууму вводят 3 последовательные дозы первой и/или второй антигенной композиции. В других указанных вариантах осуществления изобретения индивидууму вводят 2 последовательные дозы первой и/или второй антигенной композиции. В конкретных вариантах осуществления изобретения первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из 2, 3, 4, 5, 6, 7, 8, 9 и 10 доз, или в некоторых других вариантах осуществления изобретения с использованием количества доз, составляющего более 10, например, от 10 до 20.
В частности, при применении согласно настоящему изобретению в альтернативном варианте осуществления содержащую мРНК вторую антигенную композицию можно вводить для предупреждения или лечения состояния, нарушения или заболевания, указанного в настоящем описании, с использованием двух или большего количества доз, где каждая доза содержит одинаковую последовательность мРНК (или одну другую конструкцию мРНК (например, ее фрагмент, вариант или производное), кодирующую по меньшей мере эпитоп или антиген, иммунологически эквивалентный тому, который кодируется указанной выше конструкцией мРНК, или кодирующую другой эпитоп или антиген, но все еще направленную или воздействующую на то же самое состояние, нарушение или заболевание). В некоторых указанных вариантах осуществления изобретения последовательно вводят две или большее количество доз, например, в одном из вариантов осуществления изобретения позднее и вскоре друг за другом, например, менее чем через 10 мин, предпочтительно менее чем через 2 мин, и/или в одну и ту же (или в другую) область организма, для достижения такого же или сходного иммунологического действия, что и при введении одной однократной дозы (например, композиции, которая содержит обе конструкции мРНК). В других указанных вариантах осуществления изобретения две или большее количество доз вводят в пределах примерно 15 мин, 30 мин, 1 ч, 3 ч, 6 ч, 12 ч друг за другом.
В других вариантах осуществления настоящего изобретения интервал между введениями при использовании одной или большего количества пар последовательных доз первой антигенной композиции (и/или последующих доз второй антигенной композиции) составляет примерно от 1 до 180 дней, например, примерно от 5 до 120 дней, и включает варианты осуществления, в которых интервал составляет примерно от 7 до 15 дней или от 15 до 30 дней и примерно от 7 до 14 дней, от 14 до 21 дня, от 21 до 28 дней, от 28 до 35 дней, от 35 до 45 дней, от 45 до 60 дней, от 60 до 75 дней, от 75 до 90 дней или от 90 до 120 дней. Настоящее изобретение включает также варианты осуществления, в которых интервал между введением двух или большего количества доз первой антигенной композиции (и/или доз второй антигенной композиции) превышает по меньшей мере примерно 7 дней, например 28 дней. Например, для бустерного введения по меньшей мере 5 доз второй антигенной композиции (содержащей мРНК) можно вводить в пределах примерно 20-30 дней.
Различные объекты настоящего изобретения включают также варианты осуществления, в которых одна доза содержащей мРНК второй антигенной композиции (или композиции вакцины) содержит в эффективном количестве конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид, и/или в конкретном количестве указанную конструкцию РНК. Предпочтительно указанную конструкцию мРНК применяют в количестве, составляющем по меньшей мере 40 мкг на дозу, предпочтительно в количестве от 40 до 700 мкг на дозу, более предпочтительно в количестве от 80 до 400 мкг на дозу. Более конкретно, в случае внутрикожной инъекции, которую предпочтительно осуществляют с использованием обычной иглы, количество указанной конструкции мРНК в одной дозе составляет, как правило, по меньшей мере 200 мкг, предпочтительно от 200 до 1000 мкг, более предпочтительно от 300 до 850 мкг, еще более предпочтительно от 300 до 700 мкг. В случае внутрикожной инъекции, которую предпочтительно осуществляют посредством струйной инъекции (например, с помощью устройства Tropis; фирма PharmaJet Inc, Боулдер, шт. Колорадо, США) количество указанной конструкции мРНК, содержащееся в одной дозе, как правило, составляет по меньшей мере 80 мкг, предпочтительно от 80 до 700 мкг, более предпочтительно от 80 до 400 мкг. Кроме того, в случае внутримышечной инъекции, которую предпочтительно осуществляют с помощью обычной иглы или струйной инъекции, количество указанной конструкции мРНК, содержащееся к одной дозе, как правило, составляет по меньшей мере 80 мкг, предпочтительно от 80 до 1000 мкг, более предпочтительно от 80 до 850 мкг, еще более предпочтительно от 80 до 700 мкг.
Согласно предпочтительному варианту осуществления изобретения первую антигенную композицию, указанную в настоящем описании, и вторую антигенную композицию, как правило, не вводят одновременно. В данном контексте понятие «одновременно» предпочтительно относится к случаям, которые имеют место в пределах 30 мин, более предпочтительно 1 ч или еще более предпочтительно в пределах 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 24 ч. Еще более предпочтительно вводить вторую антигенную композицию в пределах примерно 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 дня (дней) после введения первой антигенной композиции.
Первую и/или вторую антигенную композицию в контексте любых объектов настоящего изобретения можно применять орально, парентерально, с помощью спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или с помощью имплантированного резервуара. Понятие «парентеральный» в контексте настоящего описания включает подкожную, внутривенную, внутримышечную, внутрисуставную, интрасиновиальную, надчревную, внутриоболочечную, внутрипеченочную, в пораженный участок, внутричерепную, чрескожную, внутрикожную, внутри легочную, внутрибрюшинную, внутрисердечную, внутриартериальную и подъязычную инъекцию или инфузию. Под объем изобретения подпадают также варианты осуществления, в которых первую и/или вторую антигенную композицию вводят интранодально или внутрь опухоли.
В конкретных вариантах осуществления изобретения первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции. Стерильные инъецируемые формы предлагаемых в изобретении фармацевтических композиций могут представлять собой водную или масляную суспензию. Такие суспензии можно приготавливать с помощью методов, известных в данной области, с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов.
Особенно предпочтительной является внутрикожная и внутримышечная инъекция. Стерильные инъецируемые формы композиций или вакцин, предлагаемых в настоящем изобретении, могут представлять собой водную или масляную суспензию. Такие суспензии можно приготавливать с помощью методов, известных в данной области, с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов.
В более конкретных указанных вариантах осуществления изобретения первую антигенную композицию и/или вторую антигенную композицию (предпочтительно по меньшей мере одну дозу содержащей мРНК второй антигенной композиции) можно вводить с помощью общепринятой игольной инъекции или безыгольной струйной инъекции; особенно предпочтительными являются варианты осуществления изобретения, в которых антигенную композицию в контексте любого из объектов настоящего изобретения вводят с помощью струйной инъекции, указанной в настоящем описании, предпочтительно внутримышечно или внутрикожно, более предпочтительно внутрикожно. Конкретные подходы, методы и особенности введения содержащей мРНК композиции, которые могут входить в некоторые дополнительные варианты осуществления настоящего изобретения, представлены в WO 2015/024667, описание которой включено в настоящее описание в качестве ссылки.
Кроме того, при создании изобретения неожиданно было установлено, что введение содержащей мРНК конструкции, включенной в антигенную композицию, указанную в настоящем описании, в частности, мРНК, которая обладает одним или несколькими определенными свойствами, указанным в настоящем описании, обеспечивает повышенный или улучшенный иммунный ответ, когда указанную содержащую мРНК антигенную композицию применяют в качестве «бустерной» композиции при введении в режиме прайм-буст.
Одним из указанных свойств конструкции мРНК, которая кодирует по меньшей мере один эпитоп иммуногенного пептида или полипептида, является то, что она модифицирована, например, химически, и/или ее последовательность модифицирована по сравнению с мРНК дикого типа, которая кодирует указанный эпитоп.
Химические модификации:
В контексте настоящего описания понятие «модификация РНК» может относиться к химическим модификациям, включающим модификации каркаса, а также модификации сахаров или модификации оснований.
В этом контексте модифицированная молекула РНК, указанная в настоящем описании, может содержать нуклеотидные аналоги/модификации, например, модификации каркаса, модификации сахаров или модификации оснований. Модификация каркаса в контексте настоящего изобретения представляет собой модификацию, при которой химически модифицируют фосфаты каркаса нуклеотидов, входящих в молекулу РНК, указанную в настоящем описании. Модификация сахаров в контексте настоящего изобретения представляет собой химическую модификацию сахара в нуклеотидах молекулы РНК, указанной в настоящем описании. Кроме того, модификация оснований в контексте настоящего изобретения представляет собой химическую модификацию основного фрагмента в нуклеотидах молекулы РНК. В этом контексте нуклеотидные аналоги или модификации предпочтительно выбирают из нуклеотидных аналогов, которые можно применять для транскрипции и/или трансляции.
Модификации сахаров:
Модифицированные нуклеозиды и нуклеотиды, которые можно включать в модифицированную молекулу РНК, представленную в настоящем описании, можно модифицировать в сахарном фрагменте. Например, 2'-гидроксильную группу (ОН) можно модифицировать или заменять рядом различных «окси»- или «дезокси»-заместителей. Примеры «окси»-модификаций 2'-гидроксильной группы включают (но не ограничиваясь только ими) алкоксигруппу или арилоксигруппу (-OR, например, R обозначает Н, алкил, циклоалкил, арил, аралкил, гетероарил или сахар); полиэтиленгликоли (ПЭГ), -O(CH2CH2O)nCH2CH2OR; «закрытые» нуклеиновые кислоты (ЗНК), в которых 2'-гидроксил соединен, например, с помощью метиленового мостика, с 4'-углеродом этого же сахара рибозы; и аминогруппы (-О-амино, в которых аминогруппа, например, NRR, может представлять собой алкиламиногруппу, диалкиламиногруппу, гетероциклил, ариламиногруппу, диариламиногруппу, гетероариламиногруппу или дигетероариламиногруппу, этилендиамин, полиаминогруппу) или аминоалкоксигруппу.
«Дезокси»-модификации включают водород, аминогруппу (например, NH2; алкиламиногруппу, диалкиламиногруппу, гетероциклил, ариламиногруппу, диариламиногруппу, гетероариламиногруппу, дигетероариламиногруппу или аминокислоту); или аминогруппа может быть присоединена к сахару через линкер, где линкер содержит один или несколько атомов С, N и О.
Сахарный фрагмент может содержать также один или несколько атомов углерода в противоположной стереохимической конфигурации относительно той, в которой соответствующий атом углерода находится в рибозе. Таким образом, модифицированная молекула РНК может включать нуклеотиды, содержащие, например, арабинозу в качестве сахара.
Модификации каркаса:
Можно также модифицировать фосфатный каркас в модифицированных нуклеозидах и нуклеотидах, которые можно включать в модифицированную молекулу РНК, представленную в настоящем описании. Фосфатные группы каркаса можно модифицировать путем замены одного или нескольких атомов кислорода на другой заместитель. Кроме того, модифицированные нуклеозиды и нуклеотиды могут включать полную замену немодифицированного фосфатного фрагмента на модифицированный фосфат, указанный в настоящем описании. Примеры модифицированных фосфатных групп включают (но не ограничиваясь только ими) фосфоротиоат, фосфороселенаты, боранофосфаты, сложные эфиры боранофосфатов, кислые фосфонаты, фосфороамидаты, алкил- или арилфосфонаты и фосфотриэфиры. В фосфородитиоатах оба несвязанных кислорода замещены серой. Фосфатную связь можно модифицировать путем замены связанного кислорода на азот (связанные мостиком фосфороамидаты), серу (связанные мостиком фосфоротиоаты) и углерод (связанные мостиком метиленфосфонаты).
Модификации оснований:
Модифицированные нуклеозиды и нуклеотиды, которые можно включать в модифицированную молекулу РНК, представленную в настоящем описании, можно модифицировать также во включающем нуклеотидное основание фрагменте. Примерами нуклеотидных оснований, встречающихся в РНК, являются (но не ограничиваясь только ими) аденин, гуанин, цитозин и урацил. Например, нуклеозиды и нуклеотиды, указанные в настоящем описании, можно модифицировать химически на поверхности большой бороздки. В некоторых вариантах осуществления изобретения химические модификации большой бороздки могут включать аминогруппу, тиольную группу, алкильную группу или галогеновую группу.
В наиболее предпочтительных вариантах осуществления настоящего изобретения нуклеотидные аналоги/модификации выбирают из модификаций оснований, которые предпочтительно выбирают из 2-амино-6-хлорпуринрибозид-5'-трифосфата, 2-аминопуринрибозид-5'-трифосфата, 2-аминоаденозин-5'-трифосфата, 2'-амино-2'-дезоксицитидинтрифосфата, 2-тиоцитидин-5'-трифосфата, 2-тиоуридин-5'-трифосфата, 2'-фтортимидин-5'-трифосфата, 2'-O-метилинозин5'-трифосфата, 4-тиоуридин-5'-трифосфата, 5-аминоаллилцитидин-5'-трифосфата, 5-аминоаллилуридин-5'-трифосфата, 5-бромцитидин-5'-трифосфата, 5-бромуридин-5'-трифосфата, 5-бром-2'-дезоксицитидин-5'-трифосфата, 5-бром-2'-дезоксиуридин-5'-трифосфата, 5-йодцитидин-5'-трифосфата, 5-йод-2'-дезоксицитидин-5'-трифосфата, 5-йодуридин-5'-трифосфата, 5-йод-2'-дезоксиуридин-5'-трифосфата, 5-метилцитидин-5'-трифосфата, 5-метилуридин-5'-трифосфата, 5-пропинил-2'-дезоксицитидин-5'-трифосфата, 5-пропинил-2'-дезоксиуридин-5'-трифосфата, 6-азацитидин-5'-трифосфата, 6-азауридин-5'-трифосфата, 6-хлорпуринрибозид-5'-трифосфата, 7-деазааденозин-5'-трифосфата, 7-деазагуанозин5'-трифосфата, 8-азааденозин-5'-трифосфата, 8-азидоаденозин-5'-трифосфата, бензимидазолрибозид-5'-трифосфата, N1-метиладенозин-5'-трифосфата, N1-метилгуанозин-5'-трифосфата, N6-метиладенозин-5'-трифосфата, О6-метилгуанозин-5'-трифосфата, псевдоуридин-5'-трифосфата или пуромицин-5'-трифосфата, ксантозин-5'-трифосфата. Наиболее предпочтительные нуклеотиды для модификаций оснований выбирают из группы нуклеотидов с модифицированными основаниями, включающей 5-метилцитидин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 5-бромцитидин-5'-трифосфат и псевдоуридин-5'-трифосфат.
В некоторых вариантах осуществления изобретения модифицированные нуклеозиды включают пиридин-4-онрибонуклеозид, 5-азауридин, 2-тио-5-аза-уридин, 2-тиоуридин, 4-тиопсевдоуридин, 2-тиопсевдоуридин, 5-гидроксиуридин, 3-метилуридин, 5-карбоксиметилуридин, 1-карбоксиметилпсевдоуридин, 5-пропинилуридин, 1-пропинилпсевдоуридин, 5-тауринометилуридин, 1-тауринометилпсевдоуридин, 5-тауринометил-2-тиоуридин, 1-тауринометил-4-тиоуридин, 5-метилуридин, 1-метилпсевдоуридин, 4-тио-1-метилпсевдоуридин, 2-тио-1-метилпсевдоуридин, 1-метил-1-деазапсевдоуридин, 2-тио-1-метил-1-деазапсевдоуридин, дигидроуридин, дигидропсевдоуридин, 2-тиодигидроуридин, 2-тиодигидропсевдоуридин, 2-метоксиуридин, 2-метокси-4-тиоуридин, 4-метоксипсевдоуридин и 4-метокси-2-тиопсевдоуридин.
В некоторых вариантах осуществления модифицированные нуклеозиды включают 5-азацитидин, псевдоизоцитидин, 3-метилцитидин, N4-ацетилцитидин, 5-формилцитидин, N4-метилцитидин, 5-гидроксиметилцитидин, 1-метил-псевдоизоцитидин, пирролоцитидин, пирролопсевдоизоцитидин, 2-тиоцитидин, 2-тио-5-метилцитидин, 4-тиопсевдоизоцитидин, 4-тио-1-метилпсевдоизоцитидин, 4-тио-1-метил-1-деазапсевдоизоцитидин, 1-метил-1-деазапсевдоизоцитидин, зебуларин, 5-азазебуларин, 5-метилзебуларин, 5-аза-2-тиозебуларин, 2-тиозебуларин, 2-метоксицитидин, 2-метокси-5-метилцитидин, 4-метоксипсевдоизоцитидин и 4-метокси-1-метилпсевдоизоцитидин.
В других вариантах осуществления изобретения модифицированные нуклеозиды включают 2-аминопурин, 2,6-диаминопурин, 7-деазааденин, 7-деаза-8-азааденин, 7-деаза-2-аминопурин, 7-деаза-8-аза-2-аминопурин, 7-деаза-2,6-диаминопурин, 7-деаза-8-аза-2,6-диаминопурин, 1-метиладенозин, N6-метиладенозин, N6-изопентениладенозин, N6-(цис-гидроксиизопентенил)аденозин, 2-метилтио-N6-(цис-гидроксиизопентенил)аденозин, N6-глицинилкарбамоиладенозин, N6-треонилкарбамоиладенозин, 2-метилтио-N6-треонилкарбамоиладенозин, N6,N6-диметиладенозин, 7-метиладенин, 2-метилтиоаденин и 2-метоксиаденин.
В других вариантах осуществления изобретения модифицированные нуклеозиды включают инозин, 1-метилинозин, виозин, вибутозин, 7-деазагуанозин, 7-деаза-8-азагуанозин, 6-тиогуанозин, 6-тио-7-деазагуанозин, 6-тио-7-деаза-8-азагуанозин, 7-метилгуанозин, 6-тио-7-метилгуанозин, 7-метилинозин, 6-метоксигуанозин, 1-метилгуанозин, N2-метилгуанозин, N2,N2-диметилгуанозин, 8-оксогуанозин, 7-метил-8-оксогуанозин, 1-метил-6-тиогуанозин, N2-метил-6-тиогуанозин и N2,N2-диметил-6-тиогуанозин. В некоторых вариантах осуществления изобретения нуклеотид можно модифицировать на поверхности большой бороздки, и он может включать замену водорода на С-5 урацила на метильную группу или галогеновую группу.
В конкретных вариантах осуществления изобретения модифицированный нуклеозид представляет собой 5'-O-(1-тиофосфат)аденозин, 5'-O-(1-тиофосфат)цитидин, 5'-O-(1-тиофосфат)гуанозин, 5'-O-(1-тиофосфат)уридин или 5'-O-(1-тиофосфат)псевдоуридин.
В других конкретных вариантах осуществления модифицированная РНК может содержать модификации нуклеозидов, выбранные из 6-азацитидина, 2-тиоцитидина, α-тиоцитидина, псевдоизоцитидина, 5-аминоаллилуридина, 5-йодуридина, N1-метилпсевдоуридина, 5,6-дигидроуридина, α-тиоуридина, 4-тиоуридина, 6-азауридина, 5-гидроксиуридина, дезокситимидина, 5-метилуридина, пирролоцитидина, инозина, α-тиогуанозина, 6-метилгуанозина, 5-метилцитидина, 8-оксогуанозина, 7-деазагуанозина, N1-метиладенозина, 2-амино-6-хлорпурина, N6-метил-2-аминопурина, псевдоизоцитидина, 6-хлорпурина, N6-метиладенозина, α-тиоаденозина, 8-азидоаденозина, 7-деазааденозина.
Липидная модификация:
Согласно другому варианту осуществления изобретения модифицированная молекула РНК, указанная в настоящем описании, может содержать липидную модификацию. Такая модифицированная липидами молекула РНК, как правило, содержит указанную в настоящем описании РНК. Такая модифицированная липидами молекула РНК, как правило, дополнительно содержит по меньшей мере один линкер, ковалентно связанный с молекулой РНК, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером. Альтернативно этому, модифицированная липидами молекула РНК содержит по меньшей мере одну молекулу РНК, указанную в настоящем описании, и по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с указанной молекулой РНК. Согласно третьей альтернативе модифицированная липидами молекула РНК содержит молекулу РНК, указанную в настоящем описании, по меньшей мере один линкер, ковалентно связанный с указанной молекулой РНК, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером, и также по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с указанной молекулой РНК. В этом контексте наиболее предпочтительно, чтобы липидная модификация присутствовала на концах линейной последовательности РНК.
Модификация 5'-конца модифицированной молекулы РНК:
Согласно другому предпочтительному варианту осуществления изобретения модифицированная молекула РНК, указанная в настоящем описании, может быть модифицирована путем добавления структуры так называемого «5'-кэпа».
5'-кэп представляет собой структуру, которая, как правило, «кэпирует» модифицированную нуклеотидную структуру на 5'-конце зрелой мРНК. 5'-кэп может, как правило, быть образован модифицированным нуклеотидом, прежде всего производным гуанинового нуклеотида. Предпочтительно 5'-кэп связан с 5'-концом через 5'-5'-трифосфатную связь. 5'-кэп может быть метилирован, например, представлять собой m7GpppN, где N обозначает концевой 5'-нуклеотид нуклеиновой кислоты, несущей 5'-кэп, как правило, 5'-конец мРНК. m7GpppN представляет собой структуру 5'-кэпа, которая встречается в естественных условиях в мРНК, которая транскрибируется с помощью полимеразы II, и поэтому предпочтительно в этом контексте не рассматривается в качестве модификации, которая содержится в модифицированной РНК. Это означает, что модифицированная РНК, предлагаемая в настоящем изобретении, может содержать m7GpppN в качестве 5'-кэпа, но кроме этого модифицированная РНК содержит по меньшей мере одну дополнительную модификацию, указанную в настоящем описании.
Другими примерами структур 5'-кэпа являются глицерил, инвертированная дезоксигруппа (фрагмент), лишенная азотистого основания, 4',5'-метиленовый нуклеотид, 1-(бета-D-эритрофуранозильный) нуклеотид, 4'-тионуклеотид, карбоциклический нуклеотид, 1,5-ангидрогекситольный нуклеотид, L-нуклеотиды, альфа-нуклеотид, нуклеотид с модифицированным основанием, треопентофуранозильный нуклеотид, ациклический 3',4'-секонуклеотид, ациклический 3,4-дигидроксибутильный нуклеотид, ациклический 3,5-дигидроксипентильный нуклеотид, 3'-3'-инвертированный нуклеотидный фрагмент, 3'-3'-инвертированный лишенный азотистого основания фрагмент, 3'-2'-инвертированный нуклеотидный фрагмент, 3'-2'-инвертированный лишенный азотистого основания фрагмент, 1,4-бутандиолфосфатный, 3'-фосфороамидатный, гексилфосфатный, аминогексилфосфатный, 3'-фосфатный, 3'-фосфоротиоатный, фосфородитиоатный или связанный мостиком или несвязанный мостиком метилфосфонатный фрагмент. В этом контексте указанные модифицированные структуры 5'-кэпа рассматриваются в качестве по меньшей мере одной модификации.
Особенно предпочтительными модифицированными структурами 5'-кэпа являются САР1 (метилирование рибозы нуклеотида, примыкающего к m7G), САР2 (метилирование рибозы 2-ого нуклеотида, расположенного в прямом направлении относительно m7G), САР3 (метилирование рибозы 3-его нуклеотида, расположенного в прямом направлении относительно m7G), САР4 (метилирование рибозы 4-ого нуклеотида, расположенного в прямом направлении относительно m7G), ARCA (аналог кэп-структуры с правильной ориентацией), модифицированный ARCA (например, модифицированный фосфоротиоатом ARCA), инозин, N1-метилгуанозин, 2'-фторгуанозин, 7-деазагуанозин, 8-оксогуанозин, 2-аминогуанозин, ЗНК-гуанозин и 2-азидогуанозин.
В других вариантах осуществления настоящего изобретения модифицируют область конструкции мРНК, которая кодирует эпитоп (например, для повышения стабильности конструкции мРНК), путем повышения содержания G (гуанозин)/С (цитозин) в мРНК, по меньшей мере в ее кодирующей области. В некоторых указанных вариантах осуществления изобретения кодирующая область мРНК имеет повышенное содержание G/C. При этом, содержание G/C в указанной (кодирующей) области мРНК повышают по сравнению с содержанием G/C в (кодирующей) области ее конкретной (кодирующей) последовательности дикого типа, т.е. немодифицированной мРНК. Однако кодируемая мРНК аминокислотная последовательность предпочтительно является немодифицированной по сравнению с аминокислотной последовательностью, кодируемой конкретной мРНК дикого типа/немодифицированной мРНК.
Таким образом, согласно различным объектам настоящего изобретения содержание G/C в области конструкции мРНК, кодирующей по меньшей мере один эпитоп иммуногенного пептида или полипептида, повышают по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида. В некоторых указанных вариантах осуществления изобретения аминокислотная последовательность иммуногенного пептида или полипептида, кодируемого мРНК, обогащенной G/C, не изменяется по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа. В других конкретных вариантах осуществления изобретения содержание G/C в области конструкции мРНК, кодирующей иммуногенный пептид или полипептид, повышают по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует иммуногенный пептид или полипептид.
Не вдаваясь в теорию, модификация содержания G/C в указанной (кодирующей) области мРНК приводит к получению конструкций РНК, имеющих повышенное содержание G (гуанозин)/С (цитозин), которые являются более стабильными, чем последовательности РНК, имеющие повышенное содержание А (аденозин)/U (урацил). Таким образом, кодоны кодирующей последовательности или полной РНК могут быть изменены по сравнению с кодирующей последовательностью или мРНК дикого типа таким образом, чтобы они содержали большее количество G/C-нуклеотидов, с сохранением транслируемой аминокислотной последовательности. Учитывая тот факт, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая вырожденность генетического кода), можно определять наиболее предпочтительные с точки зрения стабильности кодоны (так называемые альтернативные часто встречающиеся кодоны). Предпочтительно содержание G/C в (кодирующей) области конструкции мРНК, указанной во всех объектах настоящего изобретения, повышают по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, особенно предпочтительно по меньшей мере на 20% по сравнению с содержанием G/C в (кодирующей) области РНК дикого типа. Согласно конкретному варианту осуществления изобретения по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% приемлемых кодонов в области, которая кодирует белок или пептид, указанный в настоящем описании, или его фрагмент или вариант, или в полной последовательности мРНК дикого типа или кодирующей последовательности заменены, что приводит к повышению содержания G/C в указанной последовательности. В этом контексте наиболее предпочтительно повышать содержание G/C в (кодирующей) области конструкции мРНК до максимума (т.е. до 100% пригодных для замещения кодонов), прежде всего в (кодирующей) области, по сравнению с последовательностью дикого типа.
Модификация содержания G/C
Согласно другому варианту осуществления изобретения мРНК, указанную в настоящем описании, можно модифицировать и тем самым стабилизировать, путем модификации содержания гуанозина/цитозина (G/C) в мРНК, предпочтительно кодирующей последовательности мРНК.
В конкретном предпочтительном варианте осуществления настоящего изобретения содержание G/C в кодирующей области мРНК, представленной в настоящем описании, модифицируют, прежде всего повышают, по сравнению с содержанием G/C в соответствующей ей кодирующей области соответствующей РНК дикого типа, т.е. немодифицированной мРНК. Аминокислотную последовательность, кодируемую мРНК, предпочтительно не изменяют по сравнению с аминокислотной последовательностью, кодируемой соответствующей мРНК дикого типа. Указанная модификация мРНК основана на том факте, что последовательность любой области мРНК, подлежащей трансляции, является важной для эффективной трансляции указанной мРНК. Таким образом, важными являются состав мРНК и последовательность различных нуклеотидов. В частности, последовательности, имеющие повышенное содержание G (гуанозин)/С (цитозин), являются более стабильными, чем последовательности, имеющие повышенное содержание А (аденозин)/U (урацил). Таким образом, согласно изобретению кодоны мРНК изменяют по сравнению с соответствующей мРНК дикого типа таким образом, чтобы они содержали большее количество G/C-нуклеотидов с сохранением транслируемой аминокислотной последовательности. Учитывая тот факт, что несколько кодонов кодируют одну и ту же аминокислоту (так называемая вырожденность генетического кода), можно определять наиболее предпочтительные с точки зрения стабильности кодоны (так называемые альтернативные часто встречающиеся кодоны).
В зависимости от аминокислоты, кодируемой мРНК, существуют различные возможности модификации последовательности мРНК по сравнению с соответствующей кодирующей областью дикого типа. В случае аминокислот, которые кодируются кодонами, содержащими исключительно нуклеотиды G или С, никакая модификация кодона не является необходимой. В случае аминокислот, которые кодируются кодонами, содержащими исключительно нуклеотиды G или С, никакая модификация кодона не является необходимой. Так, кодоны Pro (ССС или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG) не нуждаются в модификации, поскольку в них не присутствует А или U. В противоположность этому, кодоны, которые содержат нуклеотиды А и/или U, можно модифицировать путем замены на другие кодоны, которые кодируют эти же аминокислоты, но не содержат А и/или U. Их примерами являются: кодоны CCU или ССА, кодирующие Pro, можно заменять на ССС или CCG; кодоны CGU или CGA или AGA или AGG, кодирующие Arg, можно заменять на CGC или CGG; кодоны GCU или GCA, кодирующие Ala, можно заменять на GCC или GCG; кодоны GGU или GGA, кодирующие Gly, можно заменять на GGC или GGG. В других случаях, когда нуклеотиды А или U нельзя элиминировать из кодонов, можно снижать содержание А и U с использованием кодонов, которые содержат нуклеотиды А и/или U в более низком количестве. Примерами указанных колонов являются: кодон UUU, кодирующий Phe, можно заменять на UUC; кодоны UUA, UUG, CUU или CUA, кодирующие Leu, можно заменять на CUC или CUG; кодоны UCU или UCA или AGU, кодирующие Ser, можно заменять на UCC, UCG или AGC; кодон UAU, кодирующий Tyr, можно заменять на UAC; кодон UGU, кодирующий Cys, можно заменять на UGC; кодон CAU, кодирующий His, можно заменять на САС; кодон САА, кодирующий Gln, можно заменять на CAG; кодоны AUU или AUA, кодирующие Ile, можно заменять на AUC; кодоны ACU или АСА, кодирующие Thr, можно заменять АСС или ACG; кодон AAU, кодирующий Asn, можно заменять на ААС; кодон AAA, кодирующий Lys, можно заменять на AAG; кодоны GUU или GUA, кодирующие Val, можно заменять на GUC или GUG; кодон GAU, кодирующий Asp, можно заменять на GAC; кодон GAA, кодирующий Glu, можно заменять на GAG; стоп-кодон UAA можно заменять на UAG или UGA. С другой стороны, в случае кодонов Met (AUG) и Trp (UGG), отсутствует возможность модификации последовательности. Перечисленные выше замены можно использовать либо индивидуально, либо в любых возможных комбинациях для повышения содержания G/C по меньшей мере в одной мРНК в композиции, предлагаемой в настоящем изобретении, по сравнению с конкретной мРНК дикого типа (т.е. исходной последовательностью). Так, например, все кодоны Thr, встречающиеся в последовательности дикого типа, можно модифицировать на АСС (или ACG). Однако предпочтительно, например, использовать комбинации указанных выше возможных замен:
замена всех кодонов, кодирующих Thr в исходной последовательности (мРНК дикого типа), на АСС (или ACG) и
замена всех кодонов, кодирующих в исходной последовательности Ser, на UCC (или UCG или AGC); замена всех кодонов, кодирующих в исходной последовательности Ile, на AUC, и
замена всех кодонов, кодирующих в исходной последовательности Lys, на AAG, и
замена всех кодонов, кодирующих в исходной последовательности Tyr, на UAC; замена всех кодонов, кодирующих в исходной последовательности Val, на GUC (или GUG), и
замена всех кодонов, кодирующих в исходной последовательности Glu, на GAG, и
замена всех кодонов, кодирующих в исходной последовательности Ala, на GCC (или GCG), и
замена всех кодонов, кодирующих в исходной последовательности Arg, на CGC (или CGG); замена всех кодонов, кодирующих в исходной последовательности Val, на GUC (или GUG), и
замена всех кодонов, кодирующих в исходной последовательности Glu, на GAG, и
замена всех кодонов, кодирующих в исходной последовательности Ala, на GCC (или GCG), и
замена всех кодонов, кодирующих в исходной последовательности Gly, на GGC (или GGG), и
замена всех кодонов, кодирующих в исходной последовательности Asn, на ААС; замена всех кодонов, кодирующих в исходной последовательности Val, на GUC (или GUG),
замена всех кодонов, кодирующих в исходной последовательности Phe, на UUC, и
замена всех кодонов, кодирующих в исходной последовательности Cys, на UGC, и
замена всех кодонов, кодирующих в исходной последовательности Leu, на CUG (или CUC), и
замена всех кодонов, кодирующих в исходной последовательности Gln, на CAG, и
замена всех кодонов, кодирующих в исходной последовательности Pro, на ССС (или CCG) и т.д.
Предпочтительно содержание G/C в кодирующей области мРНК, указанной в настоящем описании, повышают по меньшей мере на 7%, более предпочтительно по меньшей мере на 15%, наиболее предпочтительно по меньшей мере на 20%, по сравнению с содержанием G/C в кодирующей области мРНК дикого типа, которая кодирует антиген, указанный в настоящем описании, или его фрагмент или вариант. В конкретном варианте осуществления изобретения заменяют по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90%, 95% или даже 100% пригодных для замены кодонов в области, кодирующей антиген, указанный в настоящем описании, или его фрагмент или вариант, или всю последовательность мРНК, повышая тем самым содержание G/C в указанной последовательности. В этом контексте наиболее предпочтительно повышать содержание G/C в мРНК, предлагаемой в изобретении, предпочтительно в кодирующей области мРНК, до максимума (т.е. до 100% пригодных для замещения кодонов), прежде всего в кодирующей области, по сравнению с последовательностью дикого типа. Согласно изобретению дополнительная предпочтительная модификация мРНК основана на открытии того факта, что эффективность трансляции определяется также различной частотой встречаемости тРНК в клетках. Таким образом, если в мРНК присутствуют в повышенном количестве так называемые «редкие кодоны», то уровень трансляции соответствующей модифицированной мРНК является значимо более низким, чем в том случае, когда присутствуют кодоны, кодирующие относительно «часто встречающиеся» тРНК. Согласно изобретению в модифицированной мРНК, область, которая кодирует антиген, указанный в настоящем описании, или его фрагмент или вариант, модифицируют по сравнению с соответствующей областью мРНК дикого типа так, что по меньшей мере один кодон последовательности дикого типа, который кодирует тРНК, которая является относительно редкой в клетке, заменяют на кодон, который кодирует тРНК, которая относительно часто встречается в клетке и «несет» такую же аминокислоту, что и относительно редко встречающаяся тРНК. Посредством такой модификации последовательности РНК, предлагаемой в настоящем изобретении, модифицируют таким образом, чтобы встраивать кодоны, для которых доступны часто встречающиеся тРНК. Другими словами, согласно изобретению с помощью такой модификации все кодоны последовательности дикого типа, которые кодируют тРНК, являющуюся относительно редкой в клетке, в каждом случае можно заменять на кодон, который кодирут тРНК, относительно часто встречающуюся в клетке, и которая в каждом случае «несет» такую же аминокислоту, что и относительно редкая тРНК. тРНК, встречающиеся относительно часто в клетке, и наоборот, встречающиеся относительно редко, известны специалистам в данной области, см., например, Akashi, Curr. Opin. Genet. Dev., 11(6), 2001, cc. 660-666. Особенно предпочтительными являются кодоны, которые применяют для наиболее часто встречающейся тРНК конкретной аминокислоты, например кодон Gly, который использует тРНК, наиболее часто встречающуюся в (человеческой) клетке. Согласно изобретению наиболее предпочтительным является объединение повышения, предпочтительно до максимума, содержания G/C в мРНК с «часто встречающимися» кодонами без модификации аминокислотой последовательности белка, кодируемого кодирующей областью мРНК. Этот предпочтительный вариант осуществления изобретения позволяет наиболее эффективно транслировать и стабилизировать (модифицированную) мРНК. Определение модифицированной мРНК, описанной выше (повышенное содержание G/C; замена тРНК), можно осуществлять с использованием компьютерной программы, описанной в WO 02/098443, содержание которой включено в полном объеме в настоящее изобретение. С использованием указанной компьютерной программы нуклеотидную последовательность любой требуемой РНК можно модифицировать с помощью генетического кода или его вырожденной природы так, чтобы получать максимальное содержание G/C, в сочетании с применением кодонов, которые кодируют тРНК, встречающиеся по возможности наиболее часто в клетке, аминокислотная последовательность, кодируемая модифицированной по меньшей мере одной РНК, предпочтительно не является модифицированной по сравнению с немодифицированной последовательностью. В альтернативном варианте можно также модифицировать только содержание G/C или только часто встречающиеся кодоны по сравнению с исходной последовательностью. Исходный код в Visual Basic 6.0 (используемая операционная среда разработки: Microsoft Visual Studio Enterprise 6.0 с Servicepack 3) также описан в WO 02/098443. В другом предпочтительном варианте осуществления настоящего изобретения содержание A/U в окружении сайта связывания рибосом мРНК повышают по сравнению с содержанием A/U в окружении сайта связывания рибосом соответствующей ей мРНК дикого типа. Указанная модификация (повышенное содержание A/U вокруг сайта связывания рибосом) повышает эффективность связывания рибосом мРНК. Эффективность связывания рибосом с сайтом связывания рибосом (последовательность Козака) в свою очередь влияет на эффективность трансляции мРНК. Согласно другому варианту осуществления настоящего изобретения мРНК можно модифицировать в отношении потенциально дестабилизирующих элементов последовательности. В частности, кодирующую область и/или 5'- и/или 3'-нетранслируемую область указанной мРНК можно модифицировать по сравнению с соответствущей мРНК дикого типа так, чтобы она не содержала дестабилизирующие элементы последовательности, при этом кодируемую аминокислотную последовательность модифицированной мРНК предпочтительно не изменяют по сравнению с соответствующей последовательностью мРНК дикого типа. Известно, что, например, в последовательностях мРНК эукариотических организмов присутствуют дестабилизирующие элементы последовательности (ДЭП), с которыми связываются сигнальные белки и регулируют ферментативное расщепление РНК in vivo. Следовательно, для дополнительной стабилизации мРНК можно осуществлять одну или несколько указанных модификаций, необязательно в области, которая кодирует антиген, указанный в настоящем описании, или его фрагмент или вариант, по сравнению с соответствующей областью мРНК дикого типа таким образом, чтобы полностью или в значительной степени удалять дестабилизирующие элементы последовательности. Согласно изобретению с использованием указанных модификаций мРНК можно также удалять ДЭП, присутствующие в нетранслируемых областях (3'-UTR и/или 5'-UTR). Указанные дестабилизирующие последовательности представляют собой, например, богатые AU последовательности (AURES), которые присутствуют в областях 3'-UTR многочисленных нестабильных РНК (Caput и др., Proc. Natl. Acad. Sci. USA, 83, 1986, cc. 1670-1674). Поэтому мРНК предпочтительно модифицируют по сравнению с соответствующей мРНК дикого типа, так, чтобы мРНК, указанная в настоящем описании, не содержала указанных дестабилизирующих последовательностей. Указанное также относится к тем мотивам последовательностей, которые распознаются возможными эндонуклеазами, например, к последовательности GAACAAG, которая присутствует в сегменте 3'-UTR гена, который кодирует рецептор трансферрина (Binder и др., EMBO J., 13, 1994, сс. 1969-1980). Указанные мотивы последовательности также предпочтительно удаляют из мРНК, указанной в настоящем описании.
Последовательности, адаптированные к человеческим часто встречающимся кодонам:
Согласно изобретению дополнительная предпочтительная модификация мРНК, указанной в настоящем описании, базируется на открытии того, что кодоны, кодирующиеся одну и ту же аминокислоту, как правило, встречаются с различной частотой. Согласно изобретению в модифицированной мРНК, указанной в настоящем описании, кодирующую последовательность (кодирующую область), указанную в настоящем описании, предпочтительно модифицируют по сравнению с соответствующей областью соответствующей мРНК дикого типа так, чтобы частота кодонов, кодирующих одну и ту же аминокислоту, соответствовала встречающейся в естественных условиях у человека, которые представлены в таблице 1.
Это означает, например, что в случае аминокислоты аланина (Ala), присутствующей в аминокислотной последовательности мРНК, указанной в настоящем описании, кодирующая последовательность дикого типа адаптирована так, что кодон «GCC» применяют с частотой 0,40, кодон «GCT» применяют с частотой 0,28, кодон «GCA» применяют с частой 0,22 и кодон «GCG» применяют с частотой 0,10 и т.д. (см. таблицу 2).
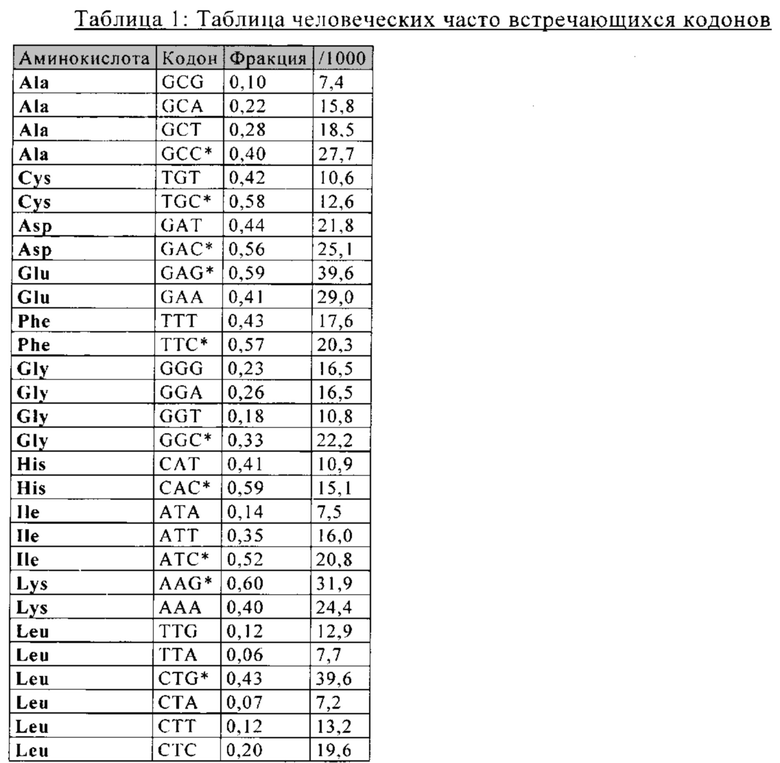
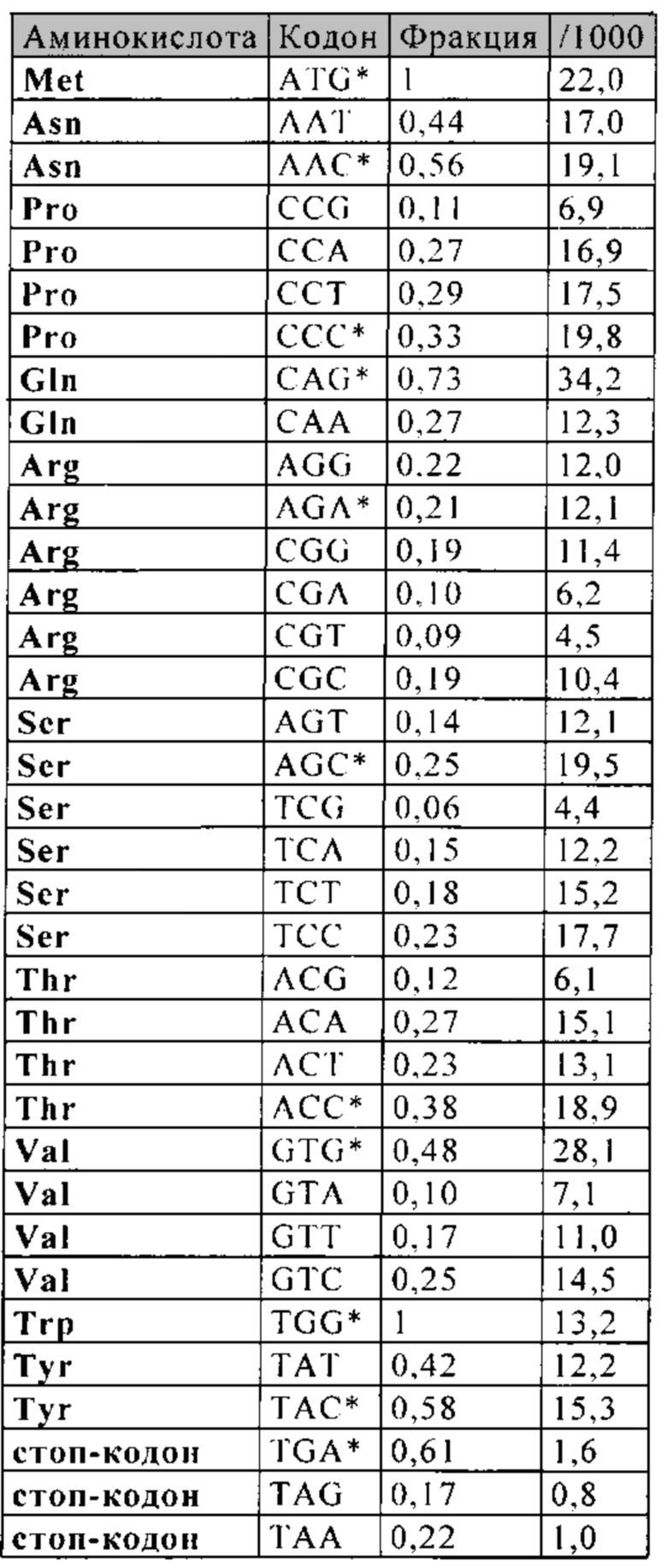
*: наиболее часто встречающийся кодон
Последовательности с оптимизированными кодонами:
Согласно описанному выше особенно предпочтительному варианту осуществления изобретения все кодоны последовательности дикого типа, которая кодирует тРНК, которая является относительно редкой в клетке, в каждом случае заменяли на кодоны, кодирующие тРНК, которая часто встречается в клетке и которая в каждом случае «несет» такую же аминокислоту, что и относительно редкая тРНК. Таким образом, особенно предпочтительно применять наиболее часто встречающиеся кодоны для каждой кодируемой аминокислоты (см. таблицу 1, в которой наиболее часто встречающиеся кодоны обозначены звездочкой). Такая процедура оптимизации повышает индекс адаптации кодонов (codon adaptation index (CAI)) и, в конце концов, повышает CAI до максимума. В контексте изобретения последовательности с повышенным или увеличенным до максимума CAI, как правило, обозначают как последовательности с «оптимизированными кодонами» и/или последовательности с повышенным или увеличенным до максимума CAI. Согласно предпочтительному варианту осуществления изобретения мРНК, указанная в настоящем описании, содержит по меньшей мере одну кодирующую последовательность, где кодирующая последовательность представляет собой указанную в настоящем описании последовательность с оптимизированными кодонами. Более предпочтительно индекс адаптации кодонов (CAI) по меньшей мере одной кодирующей последовательности составляет по меньшей мере 0,5, по меньшей мере 0,8, по меньшей мере 0,9 или по меньшей мере 0,95. Наиболее предпочтительно индекс адаптации кодонов (CAI) по меньшей мере одной кодирующей последовательности составляет 1.
Например, что в случае аминокислоты аланина (Ala), присутствующей в аминокислотной последовательности, кодируемой по меньшей мере одной кодирующей последовательности мРНК, указанной в настоящем описании, кодирующую последовательность дикого типа адаптируют таким образом, что для указанной аминокислоты всегда применяют наиболее часто встречающийся человеческий кодон «GCC», или в случае аминокислоты цистеина (Cys), последовательность дикого типа адаптируют таким образом, что для указанной аминокислоты всегда применяют наиболее часто встречающийся человеческий кодон «TGC» и т.д.
Последовательности с оптимизированным содержанием С:
Согласно другому варианту осуществления изобретения мРНК, указанную в настоящем описании, можно модифицировать путем изменения, предпочтительно повышения, содержания цитозина (С) в мРНК, предпочтительно кодирующей области мРНК.
В особенно предпочтительном варианте осуществления настоящего изобретения содержание С в кодирующей области мРНК модифицируют, предпочтительно повышают, по сравнению с содержанием С в кодирующей области соответствующей РНК дикого типа, т.е. немодифицированной мРНК.
Аминокислотную последовательность, кодируемую кодирующей областью мРНК, указанной в настоящем описании, предпочтительно не модифицируют по сравнению с аминокислотной последовательностью, кодируемой соответствующей мРНК дикого типа.
В предпочтительном варианте осуществления настоящего изобретения модифицированная мРНК модифицируют таким образом, чтобы содержание цитозина достигало по меньшей 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80% или по меньшей мере 90% от теоретически возможного максимального содержания цитозина или даже достигало максимального содержания цитозина.
В других предпочтительных вариантах осуществления изобретения по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% кодонов последовательности мРНК дикого типа, в которой «можно оптимизировать содержание цитозина» заменяют кодонами с более высоким содержанием цитозина по сравнению с присутствующими в последовательности дикого типа.
В другом предпочтительном варианте осуществления некоторые из кодонов кодирующей последовательности дикого типа можно дополнительно модифицировать таким образом, чтобы кодоны относительно редкой тРНК в клетке заменять на кодон относительно часто встречающейся тРНК в клетке, при условии, что замененный кодон относительно часто встречающейся тРНК «несет» такую же аминокислоту, что и исходный кодон, кодирующий относительно редкую тРНК дикого типа. Предпочтительно все кодоны, кодирующие относительно редкую тРНК, заменяют на кодоны, кодирующие относительно часто встречающуюся в клетке тРНК, за исключением кодонов, кодирующих аминокислоты, которые исключительно кодируются кодонами, не содержащими цитозин, или за исключением глутамина (Gln), который кодируется двумя кодонами, каждый из которых содержит одинаковое количество цитозина.
В другом предпочтительном варианте осуществления настоящего изобретения мРНК, указанную в настоящем описании, модифицируют таким образом, чтобы достигалось по меньшей 80% или по меньшей мере 90% от теоретически возможного максимального содержания цитозина или даже максимальное содержание цитозина, с использованием кодонов, которые кодируют относительно часто встречающиеся тРНК в клетке, при этом аминокислотная последовательность остается неизмененной.
Из-за встречающейся в естественных условиях вырожденности генетического кода несколько кодонов могут кодировать конкретную аминокислоту. Так, 18 из 20 встречающихся в естественных условиях аминокислот кодируются более чем 1 кодоном (кроме Tryp и Met), например, 2 кодонами (например, Cys, Asp, Glu), 3 кодонами (например, Ile), 4 кодонами (например, Al, Gly, Pro) или 6 кодонами (например, Leu, Arg, Ser). Однако не все кодоны, кодирующие одну и ту же аминокислоту, используются с одинаковой частотой в условиях in vivo. В зависимости от каждого отдельного организма, как правило, устанавливается профиль типичных часто встречающихся кодонов.
Понятие «кодон, в котором можно оптимизировать содержание цитозина (оптимизируемый кодон)» в контексте настоящего описания относится к кодонам, в которых присутствует более низкое количество цитозинов, чем в других кодонах, кодирующих такую же аминокислоту. Таким образом, любой кодон дикого типа, который можно заменять другим кодоном, кодирующим ту же самую аминокислоту и имеющим более высокое количество цитозинов внутри кодона, рассматривается в качестве кодона, в котором можно оптимизировать содержание цитозина (оптимизируемый по содержанию С). Любая такая замена кодона дикого типа, который можно оптимизировать по содержанию С, на конкретный кодон с оптимизированным содержанием С в кодирующей последовательности дикого типа повышает общее содержание С и соответствует обогащенной С модифицированной последовательности мРНК. Согласно предпочтительному варианту осуществления изобретения мРНК, указанная в настоящем описании, предпочтительно кодирующая последовательность мРНК, содержит или состоит из последовательности РНК с увеличенным до максимума содержанием С, которая содержит оптимизированные по содержанию С кодоны для всех потенциально оптимизируемых по содержанию С кодонов. Таким образом, 100% или все теоретическим поддающиеся замене оптимизируемые по содержанию С кодоны в указанных условиях предпочтительно заменены на кодоны с оптимизированным содержанием С по всей длине кодирующей области. В этом контексте кодоны, оптимизируемые по содержанию цитозина, представляют собой кодоны, которые содержат меньшее количество цитозина, чем другие кодоны, кодирующие ту же самую аминокислоту.
Любой из кодонов GCG, GGA, GCU, которые кодируют аминокислоту Ala, можно заменять на кодон GCC, кодирующий эту же аминокислоту, и/или
кодон UGU, который кодирует Cys, можно заменять на кодон UGC, кодирующий эту же аминокислоту, и/или
кодон GAU, который кодирует Asp, можно заменять на кодон GAC, кодирующий эту же аминокислоту, и/или
кодон UUU, который кодирует Phe, можно заменять на кодон UUC, кодирующий эту же аминокислоту, и/или
любой из кодонов GGG, GGA, GGU, которые кодируют Gly, можно заменять на кодон GGC, кодирующий эту же аминокислоту, и/или
кодон CAU, который кодирует His, можно заменять на кодон САС, кодирующий эту же аминокислоту, и/или
любой из кодонов AUA, AUU, которые кодируют Ile, можно заменять на кодон AUC, и/или
любой из кодонов UUG, UUA, CUG, CUA, CUU, которые кодируют Leu, можно заменять на кодон CUC, кодирующий эту же аминокислоту, и/или
кодон AAU, который кодирует Asn, можно заменять на кодон ААС, кодирующий эту же аминокислоту, и/или
любой из кодонов CCG, CCA, CCU которые кодируют Pro, можно заменять на кодон ССС, кодирующий эту же аминокислоту, и/или
любой из кодонов AGG, AGA, CGG, CGA, CGU, которые кодируют Arg, можно заменять на кодон CGC, кодирующий эту же аминокислоту, и/или
любой из кодонов AGU, AGC, UCG, UCA, UCU, которые кодируют Ser, можно заменять на кодон UCC, кодирующий эту же аминокислоту, и/или
любой из кодонов ACG, АСА, ACU, которые кодируют Thr, можно заменять на кодон АСС, кодирующий эту же аминокислоту, и/или
любой из кодонов GUG, GUA, GUU, которые кодируют Val, можно заменять на кодон GUC, кодирующий эту же аминокислоту, и/или
кодон UAU, который кодирует r Tyr, можно заменять на кодон UAC, кодирующий эту же аминокислоту.
В любом из указанных выше случаев количество цитозинов повышают на 1 в каждом заменяемом кодоне. Замена всех кодонов с неоптимизированным содержанием С (которые соответствуют кодоном, которые можно оптимизировать по содержанию С) кодирующей последовательности приводит к получению кодирующей последовательности с повышенным до максимума содержанием С. В контексте изобретения по меньшей мере 70% кодонов в кодирующей области, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90% кодонов, неоптимизированных по содержанию С, заменяют на кодоны с оптимизированным содержанием С по меньшей мере в одной кодирующей области мРНК, указанной в настоящем описании.
Может оказаться предпочтительным, чтобы для некоторых аминокислот процент кодонов, в которых можно оптимизировать содержание С, замененных на кодоны с оптимизированным содержанием С, составлял менее чем 70%, в то время как для других аминокислот процент заменяемых кодонов превышал 70% для того, чтобы общий процент оптимизации содержания С составлял по меньшей мере 70% для кодонов кодирующей области дикого типа, в которых можно оптимизировать содержание С.
Предпочтительно в мРНК с оптимизированным содержанием С, указанной в настоящем описании, по меньшей мере 50% кодонов дикого типа, в которых можно оптимизировать содержание С, для любой конкретной аминокислоты заменяют на кодоны с оптимизированным содержанием С, например, любая модифицированная обогащенная С РНК предпочтительно содержит по меньшей мере 50% кодонов с оптимизированным содержанием С в положениях кодонов дикого типа, в которых можно оптимизировать содержание С, кодирующих любую одну из указанных выше аминокислот Ala, Cys, Asp, Phe, Gly, His, Ile, Leu, Asn, Pro, Arg, Ser, Thr, Val и Tyr.
В этом контексте кодоны, кодирующие аминокислоты, в которых нельзя оптимизировать содержание цитозина, и которые при этом кодируются по меньшей мере двумя кодонами, можно применять без какого-либо дополнительного процесса отбора. Однако кодон последовательности дикого типа, который кодирует относительно редко встречающуюся тРНК в клетке, например, человеческой клетке, можно заменять на кодон, который кодирует относительно часто встречающуюся тРНК в клетке, если оба кодируют одну и ту же аминокислоту. Таким образом, относительно редкий кодон GAA, кодирующий Glu, можно заменять на относительно часто встречающийся кодон GAG, кодирующий эту же аминокислоту, и/или
относительно редкий кодон AAA, кодирующий Lys, можно заменять на относительно часто встречающийся кодон AAG, кодирующий эту же аминокислоту, и/или
относительно редкий кодон САА, кодирующий Gln, можно заменять на относительно часто встречающийся кодон CAG, кодирующий эту же аминокислоту.
В этом контексте аминокислоты Met (AUG) и Trp (UGG), каждая из которых кодируется только одним кодоном, остаются неизмененными. В стоп-кодонах нельзя оптимизировать содержание цитозина, однако относительно редкие стоп-кодоны амбер-кодон, охра-кодон (UAA, UAG) можно заменять на относительно часто встречающийся стоп-кодон опал (UGA).
Указанные выше единичные замены можно применять индивидуально, но можно использовать также все возможные их комбинации для оптимизации содержания цитозина в модифицированной мРНК по сравнению с последовательностью мРНК дикого типа.
Таким образом, кодирующую последовательность, указанную в настоящем описании, можно изменять по сравнению с кодирующей областью соответствующей РНК дикого типа таким образом, чтобы в случае аминокислоты, кодируемой по меньшей мере двумя или большим количеством кодонов, из который один содержит один дополнительный цитозин, указанный кодон можно изменять на кодон с оптимизированным содержанием С, который содержит по меньшей мере один дополнительный цитозин, при этом аминокислота не изменяется по сравнению с последовательностью дикого типа.
Таким образом, особенно предпочтительным вариантом осуществления настоящего изобретения является мРНК, содержащая по меньшей мере одну кодирующую последовательность, указанную в настоящем описании, где содержание G/C по меньшей мере в одной кодирующей последовательности РНК повышают по сравнению с содержание G/C в соответствующей кодирующей последовательности соответствующей мРНК дикого типа, и/или
содержание С по меньшей мере в одной кодирующей последовательности мРНК повышают по сравнению с содержанием С в соответствующей кодирующей последовательности соответствующей мРНК дикого типа, и/или
кодоны по меньшей мере в одной кодирующей последовательности мРНК адаптируют к человеческим часто встречающимся кодонам, при этом идекс адаптации кодонов (CAI) предпочтительно повышают или увеличивают до максимума по меньшей мере в одной кодирующей последовательности мРНК,
и при этом аминокислотная последовательность, кодируемая мРНК, предпочтительно не модифицируется по сравнению с аминокислотной последовательностью, кодируемой соответствующей мРНК дикого типа.
Другой указанной особенностью конструкции мРНК, которая кодирует по меньшей мере один эпитоп иммуногенного пептида или полипептида, является то, что ее можно модифицировать так, чтобы она включала и/или содержала, например, дополнительно, одну или несколько структур 5'-кэпа (например, m7GpppN), поли(А)-последовательность и/или поли(С)-последовательность. В конкретных указанных вариантах осуществления изобретения конструкция мРНК содержит (дополнительно) структуру 5'-кэпа и поли(А)-последовательность и необязательно поли(С)-последовательность. Конкретные примеры (но не ограничиваясь только ими) некоторых структур 5'-кэпа, поли(С)-последовательностей и поли(А)-последовательностей описаны в других местах в настоящем описании. Однако, если поли(А)-последовательность включена в конструкцию мРНК, то рассматриваются варианты указанной поли(А)-последовательности, в которых поли(А)-последовательность представляет собой последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, например, поли(А)-последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, поли(А)-последовательность, содержащую от примерно 50 до примерно 300 аденозиновых нуклеотидов, поли(А)-последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, или поли(А)-последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов; и, если поли(C)-последовательность включена в конструкцию мРНК, то рассматриваются варианты указанной поли(С)-последовательности, в которых поли(С)-последовательность содержит от примерно 10 до примерно 200 цитозиновых нуклеотидов, предпочтительно от примерно 10 до примерно 100 цитозиновых нуклеотидов, более предпочтительно от примерно 10 до примерно 70 цитозиновых нуклеотидов или еще более предпочтительно от примерно 20 до примерно 50 цитозиновых нуклеотидов или даже от примерно 20 до примерно 30 цитозиновых нуклеотидов. Поли(С)-последовательность может предпочтительно быть локализована на 3'-конце кодирующей области, содержащейся в нуклеиновой кислоте.
Другой указанной особенностью конструкции мРНК, которая кодирует по меньшей мере один эпитоп иммуногенного пептида или полипептида, является то, что она может (дополнительно) содержать по меньшей мере одну гистоновую структуру типа «стебель-петля», такую как последовательность гистоновой структуры типа «стебель-петля» и/или гистоновую структуру типа «стебель-петля». Указанные последовательности гистоновой структуры типа «стебель-петля» предпочтительно выбирают из последовательностей гистоновой структуры типа «стебель-петля», которые представлены в WO 2012/019780, содержание которой включено в настоящее описание в качестве ссылки. Гистоновая структура типа «стебель-петля» представляет собой структуру мРНК, которая может быть образована или образовалась с помощью последовательности гистоновой структуры типа «стебель-петля» РНК в физиологических условиях, например, внутри клеток и/или при включении в фармацевтическую композицию.
Последовательность гистоновой структуры типа «стебель-петля», которую можно применять в настоящем изобретении, предпочтительно выбирают по меньшей мере из одной из следующих формул (I) или (II):
формула (I) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
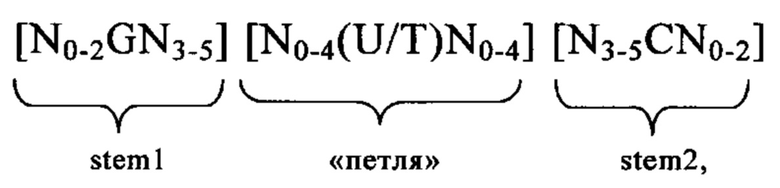
формула (II) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
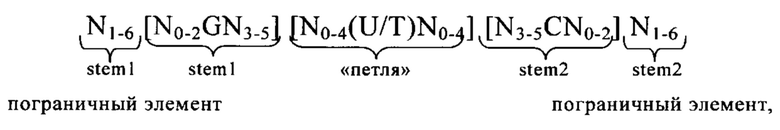
в которых:



где
у элементов stem1 и stem2 может происходить спаривание оснований друг с другом с образованием обратно комплементарной последовательности, где спаривание оснований может иметь место между stem1 и stem2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов А и U/T или G и С, или посредством спаривания оснований не по Уотсону-Крику, например, посредством спаривания «качающихся» оснований, обратного спариванию оснований по Уотсону-Крику, посредством хугстиновского спаривания оснований, посредством обратного хугстиновскому спаривания оснований, или у них может происходить спаривание оснований друг с другом с образованием частично обратно комплементарной последовательности, при этом неполное спаривание оснований может иметь место между stem1 и stem2 вследствие того, что для одного или нескольких оснований в одном стебле не имеется комплементарного основания в обратно комплементарной последовательности другого стебля.
Согласно другому предпочтительному варианту осуществления настоящего изобретения по меньшей мере одна последовательность гистоновой структуры типа «стебель-петля», если она включена в конструкцию мРНК, может соответствовать по меньшей мере одной из следующих конкретных формул (Ia) или (IIa):
формула (Ia) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
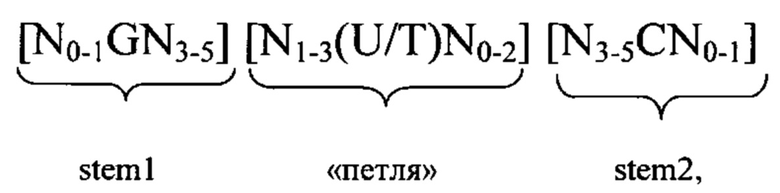
формула (IIa) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
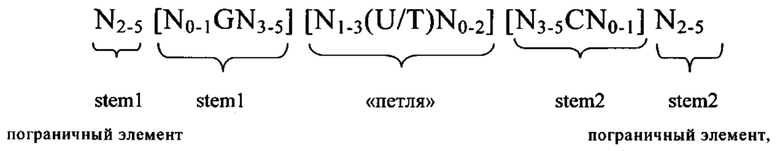
в которой:
N, С, G, T и U имеют указанные выше значения.
Согласно другому более предпочтительному варианту осуществления настоящего изобретения по меньшей мере одна последовательность гистоновой структуры типа «стебель-петля», если она включена в конструкцию мРНК, может соответствовать по меньшей мере одной из следующих конкретных формул (Ib) или (IIb):
формула (Ib) (последовательность структуры типа «стебель-петля» без пограничных элементов стебля):
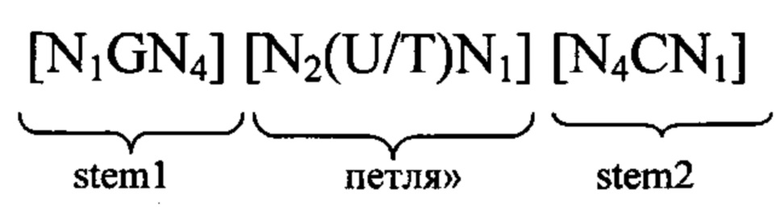
формула (IIb) (последовательность структуры типа «стебель-петля» с пограничными элементами стебля):
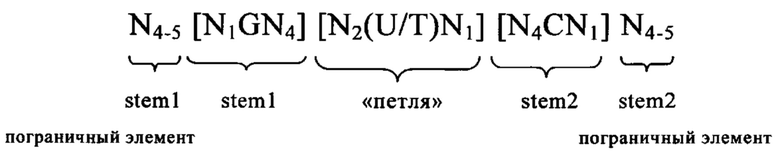
в которой:
N, С, G, T и U имеют указанные выше значения.
Наиболее предпочтительной последовательностью гистоновой структуры типа «стебель-петля» является нуклеотидная последовательность, соответствующая SEQ ID NO: 1 (или ее гомолог, фрагмент или вариант):
Нуклеотидная последовательностью гистоновой структуры типа «стебель-петля» (SEQ ID NO: 1)
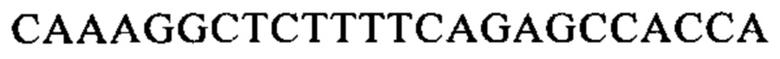
Более предпочтительно последовательностью гистоновой структуры типа «стебель-петля» является последовательность РНК, имеющая нуклеотидную последовательность, соответствующая SEQ ID NO: 2 (или ее гомолог, фрагмент или вариант):
Нуклеотидная последовательностью гистоновой структуры типа «стебель-петля» (SEQ ID NO: 2)
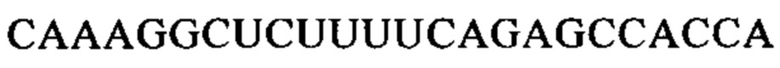
Двумя дополнительными особенностями конструкции мРНК, которая кодирует по меньшей мере один эпитоп иммуногенного пептида или полипептида, является то, что она может (дополнительно) содержать по меньшей мере один из следующих структурных элементов: элемент, представляющий собой 5'- и/или 3'-нетранслируемую область (UTR-элемент), прежде всего 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR гена ТОР или его фрагмента, гомолога или варианта, или 5'- и/или 3'-UTR-элемент, который можно получать из гена, из которого получают стабильную мРНК, или из его гомолога, фрагмента или варианта; гистоновую структуру типа «стебель-петля», предпочтительно гистоновую структуру типа «стебель-петля» в ее 3'-нетранслируемой области; 5'-кэп-структуру; поли-А-хвост (поли(А)-последовательность) или поли(С)-последовательность.
Таким образом, согласно одному указанному варианту осуществления настоящего конструкция мРНК содержит по меньшей мере один 5'- или 3'-UTR-элемент. В этом контексте UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 5'- или 3'-UTR любого встречающегося в естественных условиях гена, или которую получают из фрагмента, гомолога или варианта 5'- или 3'UTR гена. Предпочтительно 5'- или 3'UTR-элемент, применяемый согласно настоящему изобретению, является гетерологичным относительно кодирующей области конструкции мРНК. Хотя предпочтительными являются 5'- или 3'-UTR-элементы, полученные из встречающихся в естественных условиях генов, в контексте настоящего изобретения можно применять также созданные путем синтеза UTR-элементы.
Касательно 3'-UTR-элемента, то под объем настоящего изобретения подпадают также конструкции мРНК, включающие 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из 3'-UTR гена хордовых животных, предпочтительно гена позвоночных животных, более предпочтительно гена млекопитающих, наиболее предпочтительно человеческого гена, или из варианта 3'-UTR гена хордовых животных, предпочтительно гена позвоночных животных, более предпочтительно гена млекопитающих, наиболее предпочтительно человеческого гена.
Понятие «3'-UTR-элемент» относится к нуклеотидной последовательности, которая содержит или состоит из нуклеотидной последовательности, полученной из 3'-UTR или из варианта 3'-UTR. 3'-UTR-элемент в контексте настоящего изобретения может представлять собой 3'-UTR мРНК. Таким образом, в контексте настоящего изобретения предпочтительно 3'-UTR-элемент может представлять собой 3'-UTR мРНК, предпочтительно искусственной мРНК, или может представлять собой матрицу для транскрипции 3'-UTR мРНК. Таким образом, 3'-UTR-элемент предпочтительно представляет собой нуклеотидную последовательность, которая соответствует 3'-UTR мРНК, предпочтительно 3'-UTR искусственной мРНК, такой как мРНК, полученная путем транскрипции созданной с помощью генной инженерии векторной конструкции. Предпочтительно 3'-UTR-элемент осуществляет функцию 3'-UTR или кодирует последовательность, которая выполняет функцию 3'-UTR.
В одном из вариантов настоящего изобретения в конструкции мРНК, если она содержит 3'-UTR, 3'-UTR может быть получен из гена, который позволяет получать стабильную мРНК, или из его гомолога, или может представлять собой фрагмент или вариант указанного гена. В конкретном варианте осуществления изобретения конструкция мРНК содержит 3'UTR-элемент, который можно получать из гена, соответствующего мРНК с удлиненным временем полужизни (что приводит к образованию стабильной мРНК), например указанный и описанный ниже 3'-UTR-элемент.
Например, в конкретном варианте осуществления изобретения 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 3'-UTR гена, выбранного из группы, состоящей из гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), или из варианта 3'-UTR гена, выбранного из группы, состоящей из гена альбумина, гена α-глобина, гена β-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена альфа, такого как ген альфа-1-цепи коллагена типа (I), последовательности которых представлены в SEQ ID NO: 1369-1390 в заявке на патент WO 2013/143700, содержание которой включено в настоящее описание в качестве ссылки. В наиболее предпочтительном варианте осуществления изобретения 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 3'-UTR гена альбумина, предпочтительно гена альбумина позвоночных животных, более предпочтительно гена альбумина млекопитающих, наиболее предпочтительно человеческого гена альбумина, которая имеет SEQ ID NO: 1369, представленную в заявке на патент WO 2013/143700. Последовательность мРНК может содержать или состоять из нуклеотидной последовательности, которая получена из 3'-UTR человеческого гена альбумина, имеющий код доступа в GenBank NM_000477.5, или из его фрагмента или варианта.
Таким образом, в некоторых вариантах осуществления настоящего изобретения конструкция мРНК содержит 3'-UTR-элемент, которая содержит или состоит из нуклеотидной последовательности, полученной из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
Наиболее предпочтительно 3'-UTR-элемент содержит нуклеотидную последовательность, полученную из фрагмента гена человеческого альбумина, имеющего SEQ ID NO: 1376, представленную в заявке на патент WO 2013/143700, которая ниже обозначена как SEQ ID NO: 3, или его гомолога, фрагмента или варианта.
Нуклеотидная последовательность 3'-UTR-элемента гена человеческого альбумина (SEQ ID NO: 3)

В другом особенно предпочтительном варианте осуществления изобретения 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, полученной из 3'-UTR гена альфа-глобина, предпочтительно гена альфа- или бета-глобина позвоночных животных, более предпочтительно гена альфа- или бета-глобина млекопитающих, наиболее предпочтительно человеческого гена альфа- или бета-глобина, представленной в SEQ ID NO: 1370 в заявке на патент WO 2013/143700 (3'-UTR альфа-цепи гемоглобина 1 (НВА1) Homo sapiens)), или представленной в SEQ ID NO: 1371 в заявке на патент WO 2013/143700 (3'-UTR альфа-цепи гемоглобина 2 (НВА2) Homo sapiens)), и/или представленной в SEQ ID NO: 1372 в заявке на патент WO 2013/143700 (3'-UTR бета-цепи гемоглобина (НВВ) Homo sapiens).
Например, 3'-UTR-элемент может содержать или состоять из центральной, связывающей альфа-комплекс области 3'-UTR гена альфа-глобина, например, человеческого гена альфа-глобина, предпочтительно имеющей SEQ ID NO: 4 (соответствует SEQ ID NO: 1393 в заявке на патент WO 2013/143700), или его гомолога, фрагмента или варианта.
Нуклеотидная последовательность 3'-UTR-элемента гена альфа-глобина (SEQ ID NO: 4)
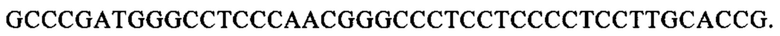
Таким образом, в некоторых вариантах осуществления изобретения 3'-UTR-элемент содержит или состоит и/или получен или его можно получать из нукелотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
Понятие «нуклеотидная последовательность, происходящая из 3'-UTR […] гена» предпочтительно относится к нуклеотидной последовательности, основой которой является 3'-UTR-последовательность […] гена или ее часть, например, 3'-UTR гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), предпочтительно гена альбумина или его части. Указанное понятие включает последовательности, соответствующие полной 3'-UTR-последовательности, т.е. полноразмерной 3'-UTR-последовательности гена, и последовательности, соответствующие фрагменту 3'-UTR-последовательности гена, например, гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), предпочтительно гена альбумина.
Понятие ««нуклеотидная последовательность, полученная из варианта 3'-UTR […] гена» предпочтительно относится к нуклеотидной последовательности, основой которой является вариант 3'-UTR-последовательности гена, например, вариант 3'-UTR гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена альфа-цепи коллагена, такого как ген альфа-1-цепи коллагена типа (I), или его части, как указано выше. Указанное понятие включает последовательности, соответствующие полной последовательности варианта 3'-UTR гена, т.е. полноразмерной 3'-UTR-последовательности варианта гена, и последовательности, соответствующие фрагменту варианта 3'-UTR-последовательности гена. Фрагмент в этом контексте предпочтительно состоит из непрерывного нуклеотидного сегмента, соответствующего непрерывному нуклеотидному сегменту полноразмерного варианта 3'UTR, на долю которого приходится по меньшей мере 20%, предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 60%, еще более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% полноразмерного варианта 3'-UTR. Указанный фрагмент варианта в контексте настоящего изобретения предпочтительно представляет собой функциональный фрагмент варианта, указанного в настоящем описании.
В конкретных вариантах различных объектов настоящего изобретения конструкция РНК содержит (например, в направлении 5'→3'): (а) структуру 5'-кэпа (например, m7GpppN); и (б) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид; и (в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из гена альфа-глобина (например, содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4, или ее гомолог, фрагмент или вариант); где любая из конструкций мРНК может дополнительно содержать одну или несколько из следующих характерных структур (г)-(е): (г) поли(А)-последовательность (например, содержащая примерно 64 аденозина); (д) поли(С)-последовательность (например, содержащая примерно 30 цитозинов); и/или (е) гистоновая структура типа «стебель-петля» (например, содержащая последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1, или ее гомолог, фрагмент или вариант).
Помимо 3'-UTR-элемента настоящее изобретение включает также варианты конструкции мРНК, которые содержат по меньшей мере один элемент 5'-нетранслируемой области, где конструкция мРНК содержит дополнительно по меньшей мере один 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR ТОР-гена, или из соответствующей последовательности РНК, ее, гомолога, фрагмента или варианта. В некоторых указанных вариантах осуществления изобретения 5'-UTR-элемент предпочтительно не содержит (например, лишен) ТОР-мотива или 5'-ТОР (как указано выше).
В дополнительных вариантах осуществления изобретения конструкция мРНК (дополнительно) содержит 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта. В некоторых указанных вариантах осуществления изобретения 5'-UTR-элемент предпочтительно не содержит (например, лишен) ТОР-мотива или 5'-ТОР (как указано выше).
В следующих вариантах осуществления изобретения 5'-UTR-элемента, которую получают из 5'-UTR ТОР-гена, оканчивается на ее 3'-конце нуклеотидом, локализованным в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в обратном направлении относительно стартового кодона (например, A(U/T)G) гена или полученной из него мРНК. Таким образом, 5'-UTR-элемент не содержит никакой части кодирующей белок области. Таким образом, предпочтительно только кодирующий белок участок конструкции мРНК представляет собой кодирующую область.
Нуклеотидную последовательность, полученную из 5'-UTR ТОР-гена, предпочтительно получают из эукариотического ТОР-гена, предпочтительно ТОР-гена растений или животных, более предпочтительно ТОР-гена хордовых животных, еще более предпочтительно ТОР-гена позвоночных животных, наиболее предпочтительно ТОР-гена млекопитающих, например, ТОР-гена человека.
Например, 5'-UTR-элемент предпочтительно выбирают из 5'-UTR-элементов, содержащих или состоящих из нуклеотидной последовательности, выбранной из группы, которая состоит из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, описание которой полностью включено в настоящее описание в качестве ссылки, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов, или предпочтительно из соответствующей РНК-последовательности. Понятие «гомологи SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700», относится к последовательностям из видов, отличных от человека (Homo sapiens), которые являются гомологами последовательностей SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700.
В предпочтительном варианте осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из нуклеотидной последовательности, простирающейся от нуклеотидного положения 5 (т.е. нуклеотида, локализованного в положении 5 в последовательности) до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к стартовому кодону (локализованному на 3'-конце последовательностей), например, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к ATG-последовательности нуклеотидной последовательности, выбранной из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов или соответствующей РНК-последовательности. Наиболее предпочтительно 5'-UTR-элемент получают из нуклеотидной последовательности, простирающейся от нуклеотидного положения, непосредственно примыкающего с 3'-стороны к 5'-ТОР, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к стартовому кодону (локализованному на 3'-конце последовательностей), например, до нуклеотидного положения, непосредственно примыкающего с 5'-стороны к ATG-последовательности нуклеотидной последовательности, выбранной из SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из гомологов SEQ ID NO: 1-1363, SEQ ID NO: 1395, SEQ ID NO: 1421 и SEQ ID NO: 1422, указанных в заявке на патент WO 2013/143700, из ее вариантов или соответствующей РНК-последовательности.
В особенно предпочтительном варианте осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из варианта 5'-UTR ТОР-гена, кодирующего рибосомный белок. Например, 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 5'-UTR нуклеотидной последовательности, представленной в любой из SEQ ID NO: 67, 170, 193, 244, 259, 554, 650, 675, 700, 721, 913, 1016, 1063, 1120, 1138 и 1284-1360, указанных в заявке на патент WO 2013/143700, соответствующей РНК-последовательности, ее гомолога или варианта, указанного в настоящем описании, предпочтительно без 5'ТОР-мотива. Как описано выше, последовательность, простирающаяся от положения 5 до нуклеотида, непосредственно примыкающего с 5'-стороны к ATG (локализованному на 3'-конце последовательностей), соответствует 5'-UTR указанных последовательностей.
Предпочтительно 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из гомолога или варианта 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL). Например, 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR нуклеотидной последовательности, представленной в любой из SEQ ID NO: 67, 259, 1284-1318, 1344, 1346, 1348-1354, 1357, 1358, 1421 и 1422, указанных в заявке на патент WO 2013/143700, соответствующей РНК-последовательности, ее гомолога или варианта, указанного в настоящем описании, предпочтительно без 5'ТОР-мотива.
В особенно предпочтительном варианте осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR, происходящей из 5'-UTR гена белка большой субъединицы рибосомы 32, предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) позвоночных животных, более предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) млекопитающих, наиболее предпочтительно из гена белка большой субъединицы рибосомы 32 (L32) человека, или из варианта 5'-UTR гена белка большой субъединицы рибосомы 32, предпочтительно гена белка большой субъединицы рибосомы 32 (L32) позвоночных животных, более предпочтительно гена белка большой субъединицы рибосомы 32 (L32) млекопитающих, наиболее предпочтительно гена белка большой субъединицы рибосомы 32 (L32) человека, при этом предпочтительно 5'-UTR-элемент не содержит 5'ТОР указанного гена.
Предпочтительная последовательность 5'-UTR-элемента соответствует SEQ ID NO: 1368 в заявке на патент WO 2013/143700 (или ее гомологу, фрагменту или варианту), и она указана ниже:
Нуклеотидная последовательность 5'-UTR-элемента (SEQ ID NO: 5)
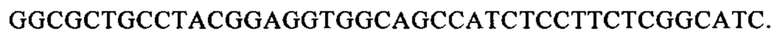
Таким образом, согласно особенно предпочтительному варианту осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична 20%, предпочтительно по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности, представленной в SEQ ID NO: 1368 заявки на патент WO 2013/143700 (5'-UTR человеческого белка большой субъединицы рибосомы 32 без 5'-концевого олигопримидинового тракта, SEQ ID NO: 5), или предпочтительно соответствующей РНК-последовательности, или в которой по меньшей мере один 5'-UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 9, или более предпочтительно соответствующей РНК-последовательности, при этом предпочтительно описанный выше фрагмент представляет собой непрерывный сегмент нуклеотидов, на долю которого приходится по меньшей мере 20% и т.д. полноразмерной 5'-UTR.
Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
В некоторых вариантах осуществления изобретения конструкция мРНК содержит 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, полученной из 5'-UTR ТОР-гена позвоночных, таких как млекопитающие, например, человеческого ТОР-гена, выбранного из RPSA, RPS2, RPS3, RPS3A, RPS4, RPS5, RPS6, RPS7, RPS8, RPS9, RPS10, RPS11, RPS12, RPS13, RPS14, RPS15, RPS15A, RPS16, RPS17, RPS18, RPS19, RPS20, RPS21, RPS23, RPS24, RPS25, RPS26, RPS27, RPS27A, RPS28, RPS29, RPS30, RPL3, RPL4, RPL5, RPL6, RPL7, RPL7A, RPL8, RPL9, RPL10, RPL10A, RPL11, RPL12, RPL13, RPL13A, RPL14, RPL15, RPL17, RPL18, RPL18A, RPL19, RPL21, RPL22, RPL23, RPL23A, RPL24, RPL26, RPL27, RPL27A, RPL28, RPL29, RPL30, RPL31, RPL32, RPL34, RPL35, RPL35A, RPL36, RPL36A, RPL37, RPL37A, RPL38, RPL39, RPL40, RPL41, RPLP0, RPLP1, RPLP2, RPLP3, RPLP0, RPLP1, RPLP2, EEF1A1, EEF1B2, EEF1D, EEF1G, EEF2, EIF3E, EIF3F, EIF3H, EIF2S3, EIF3C, EIF3K, EIF3EIP, EIF4A2, PABPC1, HNRNPA1, TPT1, TUBB1, UBA52, NPM1, ATP5G2, GNB2L1, NME2, UQCRB или из их гомолога или варианта, в которых предпочтительно 5'-UTR-элемент не содержит ТОР-мотив или 5'-ТОР указанных генов и в которых необязательно 5'-конец 5'-UTR-элемента начинается с нуклеотида, локализованного в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в прямом направлении относительно 5'-концевого олигопримидинового тракта (ТОР), и в которых также необязательно 5'-UTR-элемент, полученный из 5'-UTR ТОР-гена, оканчивается на его 3'-конце нуклеотидом, локализованным в положении 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 в обратном направлении относительно стартового кодона (A(U/T)G) гена, из которого он получен.
Согласно следующим особенно предпочтительным вариантам осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которую получают из 5'-UTR гена белка большой субъединицы рибосомы 32 (RPL32), гена белка большой субъединицы рибосомы 35 (RPL35), белка большой субъединицы рибосомы 21 (RPL21), гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1), гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4), индуцируемого андрогеном гена 1 (AIG1), гена субъединицы VIc оксидазы цитохрома с (СОХ6С) или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1), или из их варианта, предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) позвоночных животных, гена белка большой субъединицы рибосомы 35 (RPL35) позвоночных животных, гена белка большой субъединицы рибосомы 21 (RPL21) позвоночных животных, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) позвоночных животных, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) позвоночных живонтных, индуцируемого андрогеном гена 1 (AIG1) позвоночных животных, гена субъединицы VIc оксидазы цитохрома с (COX6C) позвоночных животных или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) позвоночных животных, или из их варианта, более предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) млекопитающих, гена белка большой субъединицы рибосомы 35 (RPL35) млекопитающих, гена белка большой субъединицы рибосомы 21 (RPL21) млекопитающих, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) млекопитающих, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) млекопитающих, индуцируемого андрогеном гена 1 (AIG1) млекопитающих, гена субъединицы VIc оксидазы цитохрома с (СОХ6С) млекопитающих или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) млекопитающих, наиболее предпочтительно из гена белка большой субъединицы рибосомы 32 (RPL32) человека, гена белка большой субъединицы рибосомы 35 (RPL35) млекопитающих, гена белка большой субъединицы рибосомы 21 (RPL21) человека, гена АТФ-синтазы, Н+-транспортирующей, митохондриального комплекса F1, альфа-субъединицы 1, сердечной мышцы (АТР5А1) человека, гена гидроксистероид(17-бета)дегидрогеназы 4 (HSD17B4) человека, индуцируемого андрогеном гена 1 (AIG1) человека, гена субъединицы VIc оксидазы цитохрома с (СОХ6С) человека или гена N-ацилсфингозин-амидогидролазы (кислая церамидаза) 1 (ASAH1) человека, или из их варианта, в которых предпочтительно 5'-UTR-элемент не содержит 5'-ТОР указанного гена.
Таким образом, согласно особенно предпочтительному варианту осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1368 или SEQ ID NO: 1412-1420, которые указаны в заявке на патент WO 2013/143700, или соответствующей РНК-последовательности, или в которых по меньшей мере один 5'-UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1368 или SEQ ID NO: 1412-1420, которые указаны в заявке на патент WO 2013/143700, при этом предпочтительно фрагмент представляет собой описанный выше фрагмент, т.е. является непрерывным состоящим из нуклеотидов сегментом, на долю которого приходится по меньшей мере 20% и т.д. от полноразмерной 5'-UTR. Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
Таким образом, в особенно предпочтительном варианте осуществления изобретения 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1414, указанной в заявке на патент WO 2013/143700 (5'-UTR АТР5А1, лишенная 5'-концевого олигопиримидинового тракта), или предпочтительно соответствующей РНК-последовательности, или в которой по меньшей мере один 5'-UTR-элемент содержит или состоит из фрагмента нуклеотидной последовательности, которая идентична по меньшей мере примерно на 40%, предпочтительно по меньшей мере примерно на 50%, предпочтительно по меньшей мере примерно на 60%, предпочтительно по меньшей мере примерно на 70%, более предпочтительно по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, еще более предпочтительно по меньшей мере примерно на 95%, еще более предпочтительно по меньшей мере примерно на 99% нуклеотидной последовательности SEQ ID NO: 1414, указанной в заявке на патент WO 2013/143700, или более предпочтительно соответствующей РНК-последовательности, в которой предпочтительно фрагмент представляет собой описанный выше фрагмент, т.е. является непрерывным состоящим из нуклеотидов сегментом, на долю которого приходится по меньшей мере 20% и т.д. от полноразмерной 5'-UTR. Предпочтительно фрагмент состоит по меньшей мере примерно из 20 нуклеотидов или более, предпочтительно по меньшей мере примерно из 30 нуклеотидов или более, более предпочтительно по меньшей мере примерно из 40 нуклеотидов или более. Предпочтительно фрагмент представляет собой функциональный фрагмент, указанный в настоящем описании.
Предпочтительно по меньшей мере один 5'-UTR-элемент и по меньшей мере один 3'-UTR-элемент действуют синергетически в отношении повышения производства белка с предлагаемой в изобретении последовательности мРНК, описанной выше.
Согласно описанному выше в особенно предпочтительном варианте осуществления настоящего изобретения область конструкции мРНК, которая кодирует по меньшей мере один эпитоп иммуногенного пептида или полипептида (например, (кодирующая) область, которая кодирует иммуногенный пептид или полипептид), оптимизируют для целей изобретения, при этом содержание G/C в кодирующей области повышают по сравнению с содержанием G/C в кодирующей области мРНК дикого типа. В этом контексте модифицированная нуклеотидная последовательность дикого типа, которая включает модифицированный редактированный сайт участка, состоящего из 8 аденоциновых нуклеотидов, указанный выше, следует рассматривать как мРНК дикого типа соответственно, которая является основой для оптимизации.
Для дополнительного повышения устойчивости к расщеплению in vivo (например, экзо- или эндонуклеазой) конструкцию мРНК, применяемую в контексте настоящего изобретения, получают в виде стабилизированной нуклеиновой кислоты, например, в форме модифицированной нуклеиновой кислоты. В этом контексте содержание G/C предпочтительно повышают согласно описанному выше. Согласно дополнительному варианту осуществления изобретения предпочтительно также конструкцию мРНК дополнительно стабилизируют, предпочтительно путем модификаций каркаса, модификаций сахаров и/или модификаций оснований. Все указанные модификации можно интродуцировать в конструкцию мРНК без нарушения функции мРНК, подлежащей трансляции в антигенную функцию, присущую кодируемому пептиду или полипептиду.
Модификация каркаса в контексте настоящего изобретения предпочтительно представляет собой модификацию, при которой фосфаты каркаса нуклеотидов, содержащихся в конструкции мРНК, химически модифицируют, например, с использованием анионной междуклеозидной связи, N3'→P5'-модификаций, замены не связанных мостиками атомов кислорода на бораны, нейтральной межнуклеозидной связи, амидной связи нуклеозидов, метилен(метиламино)-связей, формацетальных и тиоформацетальных связей, интродукции сульфонильных групп или т.п.
Модификация сахаров в контексте настоящего изобретения предпочтительно представляет собой химическую модификацию сахара нуклеотидов в конструкции мРНК, например, метилирование остатка рибозы или т.п.
Согласно дополнительному предпочтительному варианту осуществления изобретения конструкцию мРНК оптимизируют для трансляции, предпочтительно оптимизируют для трансляции путем замены кодонов для менее часто встречающихся тРНК данной аминокислоты на кодоны для наиболее часто встречающихся тРНК соответствующей аминокислоты. Не вдаваясь в теорию, можно предположить, что эффективность трансляции определяется также различной частотой встречаемости тРНК в клетках. Так, если так называемые «менее часто встречающиеся кодоны» присутствуют в конструкции мРНК в большем количестве, то соответствующая модифицированная РНК транслируется в существенно худшей степени, чем в случае, если присутствуют кодоны для более часто встречающихся тРНК. Таким образом, в некоторых вариантах осуществления настоящего изобретения кодирующую область конструкции мРНК модифицируют по сравнению с соответствующей областью последовательности мРНК дикого типа или кодирующей последовательностью так, чтобы по меньшей мере один кодон последовательности дикого типа, который кодирует тРНК, которая является редкой или менее часто встречается в клетке, заменять на кодон, который кодирует тРНК, которая более или наиболее часто встречается в клетке и «несет» ту же самую аминокислоту, что и относительно редкая или менее часто встречающаяся тРНК. Путем такой модификации последовательности конструкции мРНК можно модифицировать таким образом, чтобы встраивать кодоны, для которых доступны более часто встречающиеся тРНК. Другими словами, согласно настоящему изобретению с помощью такой модификации все кодоны последовательности дикого типа, которые кодируют тРНК, являющуюся относительно редкой в клетке, можно в каждом случае заменять на кодон, который кодирует тРНК, относительно часто встречающуюся в клетке, и которая в каждом случае «несет» такую же аминокислоту, что и относительно редкая тРНК. Кроме того, наиболее предпочтительно объединять повышение содержания G/C в последовательности, прежде всего до максимума, в предлагаемой в изобретении мРНК с «часто встречающимися» кодонами без модификации аминокислотной последовательности белка, кодируемого кодирующей областью конструкции мРНК. Указанный предпочтительный вариант осуществления изобретения позволяет получать наиболее эффективно транслируемую и стабилизированную (модифицированную) конструкцию мРНК.
Замены, добавления или элиминации оснований предпочтительно осуществляют с использованием ДНК-матрицы для получения молекулы нуклеиновой кислоты с помощью хорошо известных методик сайтнаправленного мутагенеза или лигирования олигонуклеотидов. В указанном процессе для получения конструкции мРНК, указанной в настоящем описании, соответствующую молекулу ДНК можно транскрибировать in vitro. Указанная ДНК-матрица предпочтительно содержит пригодный промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым располагается требуемая нуклеотидная последовательность конструкции мРНК, которую нужно получить, и сигнал терминации для транскрипции in vitro. Молекулу ДНК, которая служит матрицей для представляющей интерес мРНК, можно получать путем ферментативной пролиферации и последующего выделения в виде части плазмиды, которая может реплицироваться в бактериях. Плазмиды, которые можно рассматривать в качестве приемлемых для осуществления настоящего изобретения, представляют собой, например, плазмиды рТ7Т (GenBank, регистрационный номер U26404; Lai и др.. Development, 121, 1995, cc. 2349-2360), серии pGEM®, например, pGEM®-1 (GenBank, регистрационный номер Х65300; фирма Promega) и pSP64 (GenBank, регистрационный номер Х65327); ср. также Mezei и Storts, Purification of PCR Products в: PCR Technology: Current Innovation, под ред. Griffin и Griffin, изд-во CRC Press, Boca Raton, FL, 2001.
В конкретных вариантах различных объектов настоящего изобретения конструкция мРНК содержит (например, в направлении 5'→3') комбинацию некоторых из указанных характерных структур: (а) структуру 5'-кэпа (например, m7GpppN); и (б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, происходящей из 5'-UTR TOP-гена (например, содержит или состоит из РНК-последовательности нуклеотидной последовательности, соответствующей SEQ ID NO: 5), или его гомолога, фрагмента или варианта; и (в) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид; и (г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, происходящий из гена, образующего стабильную мРНК (например, содержит или состоит из соответствующей РНК-последовательности нуклеотидной последовательности, соответствующей SEQ ID NO: 3), или его гомолога, фрагмента или варианта; и (д) поли(А)-последовательность (например, которая содержит примерно 64 аденозина); и (е) поли(С)-последовательность (например, которая содержит примерно 30 цитозинов); и (ж) гистоновую структуру типа «стебель-петля» (например, которая содержит соответствующую РНК-последовательность нуклеотидной последовательности, соответствующей SEQ ID NO: 1) или ее гомолог, фрагмент или вариант.
Наиболее предпочтительно конструкция мРНК содержит или состоит из соответствующих последовательностей мРНК следующих оптимизированных нуклеотидных последовательностей: нуклеотидная последовательность с оптимизированным содержанием GC, которая кодирует иммуногенный пептид или полипептид с 5'-UTR: 32L TOP UTR и 3'-UTR: альбумин7-А64-М5-С30-гистонSL-N5.
Согласно различным объектам настоящего изобретения кодирующая область конструкции мРНК может присутствовать в виде моно-, ди- или даже полицистронной мРНК, т.е. последовательности мРНК, которая несет кодирующую(ие) последовательность(и) одного, двух или большего количества белков или пептидов. Указанные кодирующие последовательности би- или даже полицистронных РНК могут быть разделены по меньшей мере одной последовательностью участка внутренней посадки (связывания) рибосомы (IRES). Например, последовательность участка внутреннего связывания рибосомы можно получать из EMCV (вирус энцефаломиокардита) или из FMDV (вирус ящера). Кроме того, можно применять сигнальные пептиды, которые индуцируют расщепление образовавшегося полипептида, который содержит несколько белков или пептидов, например, последовательность сигнального пептида, полученную из пептида F2A из FMDV.
Ниже в качестве примера участка внутреннего связывания рибосомы EMCV представлена нуклеотидная последовательность SEQ ID NO: 6, пригодная в контексте настоящего изобретения.
Нуклеотидная последовательность IRES EMCV (SEO ID NO: 6)

Ниже в качестве примера участка внутреннего связывания рибосомы FMDV представлена нуклеотидная последовательность SEQ ID NO: 7 (GenBank: AJ 133357.1, GI:6318187; 5' UTR положения 578-1038; точечная мутация 86 Т→С из PMID: 8389904; точечная мутация 454 Т→А; удаление первого стартового кодона, положения 454-456), пригодная в контексте настоящего изобретения.
Нуклеотидная последовательность IRES FMDV (SEQ ID NO: 7)

Ниже в качестве примеров F2A-пептидов из FMDV, которые опосредуют котрансляционное расщепление, представлены нуклеотидные последовательности SEQ ID NO: 8 и 9, которые можно применять для целей настоящего изобретения.
Нуклеотидная последовательность F2A-пептида, версия 1, FMDV (SEQ ID NO: 8)
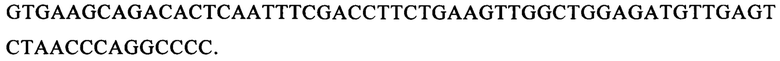
Нуклеотидная последовательность F2A-пептида, версия 2, FMDV (SEO ID NO: 9)
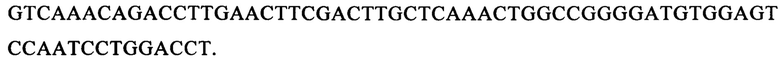
В других конкретных вариантах осуществления изобретения конструкция мРНК, которую можно применять согласно настоящему изобретению, может содержать также одну или нескольких последовательностей участка внутреннего связывания рибосомы (IRES) или IRES-мотива, которая(ые) может(гут) разделять несколько открытых рамок считывания, например, если конструкция мРНК кодирует два или большее количество антигенных пептидов или белков. IRES-последовательность может оказаться особенно ценной, если мРНК представляет собой би- или полицистронную мРНК. Наиболее предпочтительными являются IRES-последовательности, соответствующие SEQ ID NO: 6 и SEQ ID NO: 7.
В предпочтительном варианте осуществления изобретения последовательность конструкция мРНК в контексте настоящего изобретения не содержит репортерный ген или маркерный ген. Предпочтительно конструкция мРНК не кодирует, например, люциферазу; зеленый флуоресцентный белок (GFP) и его варианты (такие как eGFP, RFP или BFP); α-глобин; гипоксантин : гуанинфосфорибозилтрансферазу (HGPRT); β-галактозидазу; галактокиназу; щелочную фосфатазу; секретируемую эмбриональную щелочную фосфатазу (SEAP)) или ген, обусловливающий устойчивость (такой как ген, обусловливающий устойчивость к неомицину, пуромицину, гигромицину и зеоцину). В предпочтительном варианте осуществления изобретения конструкция мРНК не кодирует люциферазу. В другом варианте осуществления изобретения конструкция мРНК не кодирует GFP или его вариант.
В другом предпочтительном варианте осуществления изобретения конструкция мРНК не кодирует белок (или фрагмент белка), происходящий из вируса, который принадлежит к семейству Orthomyxoviridae. Предпочтительно конструкция мРНК не кодирует белок, происходящий из вируса гриппа, более предпочтительно вируса гриппа А. Предпочтительно конструкция мРНК не кодирует белок вируса гриппа А, выбранный из группы, состоящей из гемагглютинина (НА), нейраминидазы (NA), нуклеопротеина (NP), M1, M2, NS1, NS2 (NEP: белок ядерного экспорта), PA, PB1 (основная полимераза 1), PB1-F2 и РВ2. В другом предпочтительном варианте осуществления изобретения конструкция мРНК не кодирует овальбумин (OVA) или его фрагмент. Предпочтительно конструкция мРНК не кодирует белок вируса гриппа А или овальбумин.
В некоторых вариантах осуществления изобретения конструкцию мРНК, которую можно применять в контексте настоящего изобретения, можно получать с помощью любого метода, известного в данной области, включая методы синтеза, такой, например, как твердофазный синтез, а также методов in vitro, например, реакции транскрипции in vitro.
В данной области известны методы транскрипции in vitro (см., например, Geall и др., Semin. Immunol. 25(2), 2013, cc. 152-159; Brunelle и др., Methods Enzymol. 530, 2013, cc. 101-114). Реагенты, применяемые в указанном методе, как правило, включают:
1) линеаризированную ДНК-матрицу с промоторной последовательностью, которая обладает высокой аффинностью связывания с соответствующей РНК-полимеразой, такой как кодируемая бактериофагом РНК-полимераза;
2) рибонуклеозидтрифосфаты (НТФ) для четырех оснований (аденин, цитозин, гуанин и урацил);
3) аналог кэп-структуры, указанный выше (например, m7G(5')ppp(5')G(m7G));
4) ДНК-зависимую РНК-полимеразу, которая обладает способностью связывать промоторную последовательность с линеаризированной ДНК-матрицей (например, РНК-полимераза Т7, Т3 или SP6);
5) ингибитор рибонуклеазы (РНКаза) для инактивации любой загрязняющей РНКазы;
6) пирофосфатазу для расщепления пирофосфата, который может ингибировать транскрипцию;
7) MgCl2, дополняющий ионы Mg2+, в качестве кофактора для полимеразы;
8) буфер для поддержания приемлемого значения pH, который может содержать также антиоксиданты и полиамины, такие как спермидин, в оптимальных концентрациях.
В некоторых вариантах осуществления изобретения конструкцию мРНК, которую можно применять в контексте настоящего изобретения, можно очищать методом, известным в данной области, включая методы жидкостной хроматографии высокого разрешения (высокого давления) (ЖХВР (WO 2008/077592).
Согласно одному из вариантов осуществления различных объектов настоящего изобретение конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид, указанную выше, можно получать (например, вводить индивидууму) в виде «оголенной» конструкции, т.е. без ассоциации с каким-либо дополнительным наполнителем, агентом для трансфекции или комплексообразования (например, для повышения эффективности трансфекции и/или иммуностимулирующих свойств конструкции мРНК), или она может дополнительно содержать другую молекулу или конструкцию нуклеиновой кислоты.
Согласно альтернативному варианту осуществления различных объектов настоящего изобретения конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид, указанную выше, можно получать (например, вводить индивидууму) и/или включать в препаративную форму в сочетании с одним или несколькими катионными или поликатионными соединениями, предпочтительно катионными или поликатионными полимерами, катионными или поликатионными пептидами или белками, например, протамином, катионными или поликатионными полисахаридами и/или катионными или поликатионными липидами.
Согласно предпочтительному варианту осуществления изобретения конструкция мРНК, предлагаемая в настоящем изобретении, может образовывать комплекс с липидами с образованием одной или нескольких липосом, липоплексов или липидных наночастиц. Таким образом, в одном из вариантов осуществления изобретения вторая антигенная композиция содержит липосомы, липоплексы и/или липидные наночастицы, содержащие по меньшей мере одну конструкцию мРНК.
Возрастает количество данных о том, что препаративные формы на основе липидов следует рассматривать в качестве наиболее перспективных систем доставки РНК благодаря их биосовместимости и простоты крупномасштабного производства. Катионные липиды широко изучены в качестве синтетических материалов для доставки РНК. После перемешивания нуклеиновые кислоты конденсируются катионными липидами с образованием комплексов липид/нуклеиновая кислота, известных как липоплексы. Указанные липидные комплексы могут защищать генетический материал от воздействия нуклеаз и доставляться в клетки путем взаимодействия с отрицательно заряженной клеточной мембраной. Липоплексы можно получать непосредственно путем смешения положительно заряженных липидов при физиологических значениях рН с отрицательно заряженными нуклеиновыми кислотами.
Общепринятые липосомы состоят из липидного бислоя, который может состоять из катионных, анионных или нейтральных (фосфо)липидов и холестерина, который окружает водное ядро. Как липидный бислой, так и водное пространство могут включать гидрофобные или гидрофильные соединения соответственно. Характеристики и поведение липосом in vivo можно модифицировать путем добавления гидрофильного полимерного покрытия, например, из полиэтиленгликоля (ПЭГ), на поверхность липосом для придания стерической стабилизации. Кроме того, липосомы можно применять для специфического таргетинга путем присоединения лигандов (например, антител, пептидов и углеводов) к их поверхности или к концам присоединенных цепей ПЭГ (Front Pharmacol., 6, 1 декабря 2015 г., с. 286).
Липосомы представляют собой коллоидные системы доставки на основе липидов и на основе поверхностно-активных веществ, состоящие из фосфолипидного бислоя, окружающего водный компартмент. Они могут иметь форму сферических пузырьков, и диапазон их размера может составлять от 20 нм до нескольких мкм. Липосомы на основе катионных липидов могут образовывать комплекс с отрицательно заряженными нуклеиновыми кислотами посредством электростатических взаимодействий, что приводит к образованию комплексов, отличающихся биосовместимостью, низкой токсичностью и возможностью их крупномасштабного производства, необходимого для клинических применений in vivo. Липосомы могут сливаться с плазматической мембраной для проникновения; находясь внутри клетки, липосомы подвергаются процессингу посредством эндоцитозного пути и после этого генетический материал высвобождается из эндосомы/носителя в цитоплазму. Липосомы в течение долгого времени рассматриваются в качестве носителей для доставки лекарственных средств благодаря их очень высокой биосовместимости, основанной на том, что липосомы являются в целом аналогами биологических мембран и их можно получать из встречающихся в естественных условиях и синтетических фосфолипидов (Int J Nanomedicine. 9, 2014, cc. 1833-1843).
Катионные липосомы традиционно наиболее широко применяли в качестве невирусных систем доставки для олигонуклеотидов, включая плазмидную ДНК, антисмысловые олигонуклеотиды и siРНК/малую РНК-шпильку (shPHK)). Катионные липиды, такие как DOTAP (1,2-диолеоил-3-триметиламмонийпропан) и DOTMA (метилсульфат N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония) могут образовывать комплексы или липоплексы с отрицательно заряженными нуклеиновыми кислотами с образованием наночастиц посредством электростатического взаимодействия, что обеспечивает высокую эффективность трансфекции in vitro. Кроме того, разработаны нанолипосомы для доставки РНК на основе нейтрального липида, например, нанолипосомы на основе нейтрального 1,2-диолеоил-sn-глицеро-3-фосфатидилхолина (DOPC) (Adv Drug Deliv Rev. 66, февраль 2014 г., cc. 110-116.).
Таким образом, в одном из вариантов осуществления изобретения по меньшей мере одна конструкция мРНК второй антигенной композиции, предлагаемой в настоящем изобретении, образует комплекс с катионными липидами и/или нейтральными липидами и тем самым образует липосомы, липидные наночастицы, липоплексы или нанолипосомы на основе нейтральных липидов.
Таким образом, в следующем варианте осуществления изобретения предпочтительно, чтобы конструкция мРНК или любая другая нуклеиновая кислота, содержащаяся в антигенной композиции (или компоненте, представляющем собой вакцину), которая включает конструкцию мРНК, была ассоциирована или входила в комплекс с катионным или поликатионным соединением или полимерным носителем, необязательно в массовом соотношении мРНК или нуклеиновой кислоты и катионного или поликатионного соединения и/или полимерного носителя, выбранном из диапазона, составляющего от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно в соотношении, составляющем от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении азот/фосфат в мРНК или нуклеиновой кислоте и катионном или поликатионном соединении, и/или полимерном носителе, в диапазоне, составляющем по меньшей мере примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1 и наиболее предпочтительно в диапазоне примерно 0,5-1 или 0,7-1, и даже наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
Таким образом, конструкция мРНК или любая другая нуклеиновая кислота, содержащаяся в антигенной композиции (или компоненте, представляющем собой вакцину), которая включает конструкцию мРНК, может также быть ассоциирована с наполнителем, агентом для трансфекции или комплексообразования для повышения эффективности трансфекции и/или иммуностимулирующих свойств конструкции мРНК или необязательно содержащихся дополнительно включенных нуклеиновых кислот.
Катионные или поликатионные соединения, предлагаемые в изобретении, которые являются наиболее предпочтительными агентами в контексте настоящего изобретения, включают протамин, нуклеолин, спермин или спермидин или другие катионные пептиды или белки, такие как поли-L-лизин (PLL), полиаргинин, основные полипептиды, обладающие способностью проникать в клетку пептиды (СРР), такие как ВИЧ-связывающие пептиды. Tat ВИЧ-1 (ВИЧ), происходящие из Tat пептиды, пенетратин, полученные из VP22 пептиды или аналоги, VP22 HSV (вирус герпеса простого), MAP, KALA или домены трансдукции белков (PTD), РрТ620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, происходящие из Antennapedia пептиды (прежде всего, происходящие из Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, происходящие из hCT пептиды, SAP или гистоны.
Таким образом, в некоторых указанных вариантах осуществления изобретения конструкция мРНК ассоциирована или образует комплекс с катионным белком или пептидом; и в дополнительных указанных вариантах осуществления конструкция мРНК ассоциирована или образует комплекс с протамином.
В других вариантах осуществления изобретения конструкция мРНК ассоциирована или образует комплекс с катионными или поликатионными белками или пептидами, которые можно выбирать из следующих белков или пептидов, которые имеют следующую общую формулу (III):
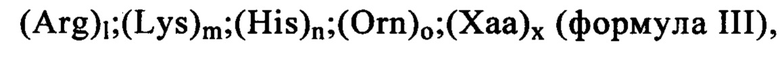
в которой 1+m+n+o+x обозначают 8-15 и 1, m, n или о каждый независимо друг от друга могут представлять собой любые числа, выбранные из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от общего содержания аминокислот в олигопептиде; а Хаа может обозначать любую аминокислоту, выбранную из нативных (т.е. встречающихся в естественных условиях) или не встречающихся в естественных условиях аминокислот за исключением Arg, Lys, His или Orn; и x может обозначать любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% от общего содержания аминокислот в олигопептиде. В этом контексте наиболее предпочтительными катионными пептидами являются, например, Arg7, Arg8, Arg9, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д., которые описаны в WO 2009/030481, которая включена в настоящее описание в качестве ссылки.
Кроме того, предпочтительные катионные или поликатионные соединения, которые можно применять в качестве агентов для трансфекции или комплексообразования, могут включать катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (PEI), катионные липиды, например, DOTMA: хлорид [1-(2,3-диолеилокси)пропил)]-N,N,N-триметиламмония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Chol, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмоний)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмонийацетил)диэтаноламина, CLIP1: хлорид рац[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметиламмония, CLIP6: рац[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как полимеры β-аминокислот или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как PVP (поли(N-этил-4-винилпириднийбромид)) и т.п., модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как рАМАМ (поли(амидоамин)) и т.п., модифицированные сложные поли-β-аминоэфиры (рВАЕ), такие как модифицированные в диаминоконцевом фрагменте сополимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как дендримеры полипропиламина или дендримеры на основе рАМАМ и т.п., полиимин(ы), такие как поли(этиленимин) (PEI), поли(пропиленимин) и т.п., полиаллиламин, полимеры на основе сахарного каркаса, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., силановые полимеры, такие как сополимеры PMOXA-PDMS и т.п., блокполимеры, включающие комбинацию одного или более катионных блоков (например, выбранных из катионных полимеров, указанных выше) и одного или нескольких гидрофильных или гидрофобных блоков (таких, например, как полиэтиленгликоль) и т.п.
Полимерный носитель, применяемый согласно изобретению, может представлять собой полимерный носитель, состоящий из сшитых дисульфидами катионных компонентов. Сшитые дисульфидами катионные компоненты могут быть одинаковыми или отличными друг от друга. Полимерный носитель может содержать также другие компоненты. Наиболее предпочтительно также, чтобы полимерный носитель, применяемый согласно настоящему изобретению, содержал смеси катионных пептидов, белков или полимеров и необязательно другие компоненты, указанные в настоящем описании, которые сшиты с помощью дисульфидных связей, как указано в настоящем описании. В этом контексте содержание WO 2012/013326 включено в настоящее описание в качестве ссылки.
В этом контексте катионные компоненты, которые в результате сшивания дисульфидами формируют основу полимерного носителя, как правило, выбирают из любых пригодных катионных или поликатионных пептидов, белков или полимеров, которые можно применять для этой цели, прежде всего из любых катионных или поликатионных пептидов, белков или полимеров, которые обладают способностью образовывать комплекс с мРНК или нуклеиновой кислотой, указанной в настоящем изобретении, и тем самым предпочтительно конденсировать мРНК или нуклеиновую кислоту. Катионный или поликатионный пептид, белок или полимер предпочтительно представляет собой линейную молекулу, однако можно применять также разветвленные катионные или поликатионные пептиды, белки или полимеры.
Каждый сшитый дисульфидами катионный или поликатионный белок, пептид или полимер полимерного носителя, который можно применять для образования комплекса с конструкцией мРНК или любой другой нуклеиновой кислотой, входящей в антигенную композицию (или представляющий собой вакцину компонент), который включает конструкцию мРНК, содержит по меньшей мере одну -SH-группу, наиболее предпочтительно по меньшей мере один цистеиновый остаток или любую другую химическую группу, несущую -SH-группу, которая способна образовывать дисульфидную связь при конденсации по меньшей мере с одним другим катионным или поликатионным белком, пептидом или полимером в качестве катионного компонента полимерного носителя, указанного в настоящем описании.
Как указано выше, полимерный носитель, который можно применять для образования комплекса с конструкцией мРНК или любой другой нуклеиновой кислотой, входящей в предлагаемые в изобретении антигенные композиции, фармацевтические композиции или вакцины, может быть образован из сшитых дисульфидами катионных (или поликатионных) компонентов.
Предпочтительно указанные катионные или поликатионные пептиды или белки или полимеры полимерного носителя, которые содержат или дополнительно модифицированы так, что они содержат по меньшей мере одну -SH-группу, выбирают из белков, пептидов и полимеров, указанных выше в качестве комлексообразующего агента.
В другом конкретном варианте осуществления изобретения полимерный носитель, который можно применять для образования комплекса с конструкцией мРНК или любой другой нуклеиновой кислотой, входящей в антигенные композиции, фармацевтические композиции или вакцины (или компоненты, представляющие собой вакцины), можно выбирать из молекулы полимерного носителя, имеющей общую форму (IV):
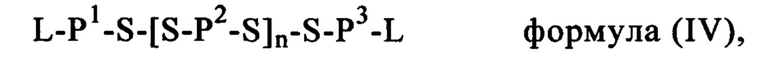
в которой
Р1 и Р3 являются различными или идентичными друг другу и представляют собой линейную или разветвленную гидрофильную полимерную цепь, каждый Р1 и Р3 несет по меньшей мере одну -SH-группу, способную образовывать дисульфидную связь при конденсации с компонентом Р2, или альтернативно этому с (АА), (АА)x или [(AA)x]z, если указанные компоненты используют в качестве линкера между Р1 и Р2 или Р3 и Р2) и/или с другими компонентами (например, (АА), (АА)x, [(AA)x]z или L), линейную или разветвленную гидрофильную полимерную цепь, выбранную независимо друг от друга из полиэтиленгликоля (ПЭГ), поли-N-(2-гидроксипропил)метакриламида, поли-2-(метакрилоилокси)этилфосфорилхолинов, поли(гидроксиалкил-L-аспарагина), поли(2-(метакрилоилокси)этилфосфорилхолина), гидроксиэтилкрахмала или поли(гидроксиалкид-L-глутамина), где гидрофильная полимерная цепь имеет молекулярную массу от примерно 1 до примерно 100 кДа, предпочтительно от примерно 2 до примерно 25 кДа или более предпочтительно от примерно 2 до примерно 10 кДа, например, от примерно 5 до примерно 25 кДа или от 5 до примерно 10 кДа;
Р2 обозначает катионный или поликатионный пептид или белок, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, и предпочтительно имеющий длину от примерно 3 до примерно 100 аминокислот, более предпочтительно имеющий длину от примерно 3 до примерно 50 аминокислот, еще более предпочтительно имеющий длину от примерно 3 до примерно 25 аминокислот, например, имеющий длину примерно от 3 до 10, от 5 до 15, от 10 до 20 или от 15 до 25 аминокислот, более предпочтительно имеющий длину от примерно 5 до примерно 20 и еще более предпочтительно имеющий длину от примерно 10 до примерно 20 аминокислот; или
обозначает катионный или поликатионный полимер, например, указанный выше для полимерного носителя, сформированного сшитыми дисульфидами катионными компонентами, как правило, имеющий молекуляную массу от примерно 0,5 до примерно 30 кДа, включая молекуляную массу от примерно 1 до примерно 20 кДа, еще более предпочтительно от примерно 1,5 до примерно 10 кДа, или имеющий молекуляную массу от примерно 0,5 до примерно 100 кДа, включая молекуляную массу от примерно 10 до примерно 50 кДа, еще более предпочтительно от примерно 10 до примерно 30 кДа;
каждый Р2 несет по меньшей мере две -SH-группы, способные образовывать дисульфидную связь при конденсации с другими компонентами Р2 или с компонентом(ами) Р1 и/или Р3, или альтернативно этому с другими компонентами (например, (АА), (АА)x или [(AA)x]z);
-S-S- обозначает (обратимую) дисульфидную связь (для удобочитаемости скобки опущены), в которой S предпочтительно представляет собой серу или несущую -SH группу, которая образует (обратимую) дисульфидную связь. (Обратимую) дисульфидную связь предпочтительно получают путем конденсации -SH-групп либо компонентов Р1 и Р2, либо Р2 и Р2, либо Р2 и Р3, либо необязательно других компонентов, указанных в настоящем описании (например, L, (АА), (АА)x, [(AA)x]z и т.д.); -SH-группа может представлять собой часть структуры указанных компонентов или может быть добавлена путем указанной модификации;
L обозначает необязательный лиганд, который может присутствовать или отсутствовать, и его можно выбирать независимо друг от друга из RGD, трансферрина, фолата, сигнального пептида или сигнальной последовательности, сигнала или последовательности локализации, сигнала или последовательности ядерной локализации (NLS), антитела, проникающего в клетку пептида (например, ТАТ или KALA), лиганда рецептора (например, цитокинов, гормонов, факторов роста и т.д.), малых молекул (например, углеводов типа маннозы или галактозы, или синтетических лигандов), агонистов малых молекул, ингибиторов или антагонистов рецепторов (например, аналогов RGD-пептидомиметиков) или любого другого белка, указанного в настоящем описании, и т.д.;
n обозначает целое число, как правило выбранное из диапазона примерно от 1 до 50, предпочтительно из диапазона примерно от 1, 2 или 3 до 30, более предпочтительно из диапазона примерно от 1, 2, 3, 4 или 5 до 25, или диапазона примерно от 1, 2, 3, 4 или 5 до 20, или диапазона примерно от 1, 2, 3, 4 или 5 до 15, или диапазона примерно от 1, 2, 3, 4 или 5 до 10, включая, например, диапазон примерно от 4 до 9, от 4 до 10, от 3 до 20, от 4 до 20, от 5 до 20 или от 10 до 20, или диапазон примерно от 3 до 15, от 4 до 15, от 5 до 15 или от 10 до 15, или диапазон примерно от 6 до 11 или от 7 до 10. Наиболее предпочтительно n находится в диапазоне примерно от 1, 2, 3, 4 или 5 до 10, более предпочтительно в диапазоне примерно от 1, 2, 3 или 4 до 9, в диапазоне примерно от 1, 2, 3 или 4 до 8, или в диапазоне примерно от 1, 2 или 3 до 7.
В этом контексте содержание WO 2011/026641 включено в настоящее описание в качестве ссылки. Каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, где по меньшей мере одна -SH-группа может образовывать дисульфидную связь при взаимодействии с компонентом Р2 или с компонентом (АА) или (АА)x, если его используют в качестве линкера между Р1 и Р2 или Р3 и Р2, как указано ниже, и необязательно с другим компонентом, например, L и/или (АА) или (АА)x, например, если он несет две или большее количество -SH-групп. Следующие подформулы «P1-S-S-Р2» и «P2-S-S-P3» в представленной выше общей формуле (V) (для большей удобочитаемости скобки опущены), в которой все S, Р1 и Р3 имеют указанные выше значения, как правило, описывают ситуацию, когда одна -SH-группа гидрофильных полимеров Р1 и Р3 сконденсирована с одной -SH-группой компонента Р2 в представленной выше общей формуле (V), где оба атома серы в указанных -SH-группах образуют дисульфидную связь -S-S-, как указано в формуле (V). Указанные -SH-группы, как правило, присутствуют в каждом из гидрофильных полимеров Р1 и Р3, например, присутствуют в локализованном внутри него цистеине или любой другой (модифицированной) аминокислоте или соединении, которая/которое несет -SH-группу. Следовательно, подформулы «P1-S-S-P2» и «P2-S-S-P3» можно записать также в виде «P1-Cys-Cys-P2» и «P2-Cys-Cys-P3», если -SH-группа присутствует в цистеине, где понятие Cys-Cys обозначает два цистеина, сцепленных дисульфидной связью, но не пептидной связью. В этом случае понятие «-S-S-» в указанных формулах можно записать также в виде «-S-Cys», в виде «-Cys-S» или в виде «-Cys-Cys-». В этом контексте понятие «-Cys-Cys-» описывает не пептидную связь, а сцепление двух цистеинов через их -SH-группы с образованием дисульфидной связи. Таким образом, понятие «-Cys-Cys-» можно записать также в общем виде как «-(Cys-S)-(S-Cys)-», где в рассматриваемом конкретном случае S обозначает атом серы -SH-группы цистеина. Аналогично этому понятия «-S-Cys» и «-Cys-S» обозначают дисульфидную связь между содержащим -SH-группу фрагментом и цистеином, которые можно записать также как «-S-(S-Cys)» и «-(Cys-S)-S». Альтернативно этому, гидрофильные полимеры Р1 и Р3 можно модифицировать -SH-группой, предпочтительно посредством химического взаимодействия с соединением, несущим -SH-группу, так, чтобы каждый из гидрофильных полимеров Р1 и Р3 нес по меньшей мере одну -SH-группу. Такое соединение, несущее -SH-группу, может представлять собой, например, (дополнительный) цистеин или любую другую (модифицированную) аминокислоту, которая несет -SH-группу. Такое соединение может представлять собой также отличное от аминокислоты соединение или группу, которое/которая содержит или дает возможность интродуцировать -SH-группу в гидрофильные полимеры Р1 и Р3, представленные в настоящем описании. Такие отличные от аминокислот соединения можно присоединять к гидрофильным полимерам Р1 и Р3 полимерного носителя формулы (VI), предлагаемого в настоящем изобретении, посредством химических взаимодействий или путем связывания с соединениями, например, путем связывания с 3-тиопропионовой кислотой или тиоимоланом, путем образования амида (например, карбоновые кислоты, сульфоновые укислоты, амины и т.д.), путем реакции присоединения по Михаэлю (например, малеимидные группы, α,β-ненасыщенные карбонилы и т.д.), с помощью клик-химии (например, азиды или алкины), с помощью метатезиса алкенов/алкинов (например, алкены или алкины), формирования иминов или гидрозонов (альдегиды или кетоны, гидразины, гидроксиламины, амины), реакций комплексообразования (авидин, биотин, белок G) или с компонентами, которые допускают реакции замещения Sn-типа (например, галогеналканы, тиолы, спирты, амины, гидразины, гидразиды, эфиры сульфоновых кислот, соли оксифосфония) или другими химическими группами, которые можно использовать для присоединения других компонентов. В этом контексте наиболее предпочтительным производным ПЭГ является альфа-метокси-омега-меркапто-поли(этиленгликоль). В каждом случае SH-группа, например, цистеина или любой другой (модифицированной) аминокислоты или соединения, может присутствовать на концах или в любом положении внутри гидрофильных полимеров Р1 и Р3. Как указано в настоящем описании, каждый из гидрофильных полимеров Р1 и Р3, как правило, несет по меньшей мере одну -SH-группу, предпочтительно на одном конце, но может содержать также две или даже большее количество -SH-групп, которые можно использовать для дополнительного присоединения других компонентов, указанных в настоящем описании, предпочтительно других функциональных пептидов или белков, например, лиганда, аминокислотного компонента (АА) или (АА)x, антител, проникающих в клетку пептидов или энхансерных пептидов (например, ТАТ, KALA) и т.д.
В этом контексте наиболее предпочтительно, если конструкция мРНК ассоциирована или образует комплекс, по меньшей мере частично, с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно катионными белками или пептидами. В этом контексте содержание WO 2010/037539 и содержание WO 2012/113513 включены в настоящее описание в качестве ссылки. «Частично» в этом контексте означает, что только часть конструкции мРНК ассоциирована или входит в состав комплекса с катионным соединением и что остальная конструкция мРНК (входящая в предлагаемую в изобретении антигенную композицию или вакцину) не входит в состав комплекса (т.е. находится в «свободной» форме). Предпочтительно соотношение входящая в комплекс мРНК : свободная мРНК (в антигенных композициях, фармацевтических композициях или композициях вакцин) выбирают из диапазона от примерно 5:1 до примерно 1:10 (мас./мас.), более предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас.), еще более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас.), и наиболее предпочтительно соотношение входящая в комплекс мРНК : свободная мРНК в предлагаемой в изобретении антигенной композиции или вакцине, выбирают из соотношения, составляющего примерно 1:1 (мас./мас.).
Таким образом, в некоторых вариантах осуществления изобретения конструкция мРНК ассоциирована или образует комплекс, по меньшей мере частично, с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно катионными белками или пептидами и более предпочтительно протамином. В конкретных указанных вариантах осуществления изобретения соотношение ассоциированная или входящая в комплекс мРНК : свободная мРНК выбирают из диапазона от примерно 5:1 до примерно 1:10 (мас./мас.), предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас.), более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас.) и наиболее предпочтительно соотношение входящая в комплекс мРНК: свободная мРНК составляет от примерно 2:1 до примерно 1:2 (мас./мас.), например, примерно 1:1 (мас./мас.).
Конструкцию включенной в комплекс мРНК, когда ее применяют в контексте настоящего изобретения, предпочтительно получают, формируя на первой стадии комплекс конструкции мРНК с катионным или поликатионным соединением и/или с полимерным носителем, предпочтительно указанным в настоящем описании, в определенном соотношении для создания стабильного комплекса. В этом контексте наиболее предпочтительно, чтобы после включения в комплекс мРНК не оставалось свободного катионного или поликатионного соединения, или полимерного носителя или чтобы оно/он присутствовал лишь в незначительном количестве в компоненте, содержащем включенную в комплекс мРНК. Следовательно, соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем в компоненте, представляющем собой включенную в комплекс мРНК, как правило, выбирают таким образом, чтобы мРНК была полностью включена в комплекс и чтобы в композиции не оставалось свободного катионного или поликатионного соединения, или полимерного носителя, или чтобы оно/он присутствовало/присутствовал лишь в незначительном количестве.
Предпочтительно соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно указанным в настоящем описании, выбирают из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.). Альтернативно этому, соотношение между мРНК и катионным или поликатионным соединением и/или полимерным носителем, предпочтительно, указанным в настоящем описании, в компоненте, содержащем включенную в комплекс мРНК, можно рассчитывать также на основе соотношения азот/фосфат (N/P-соотношение) для всего комплекса. В контексте настоящего изобретения N/P-соотношение предпочтительно находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 и наиболее предпочтительно диапазоне примерно 0,5-2 или 0,7-2 касательно соотношения: катионное или поликатионное соединение и/или полимерный носитель : мРНК в комплексе, предпочтительно, указанном в настоящем описании, и наиболее предпочтительно в диапазоне примерно 0,7-1,5, 0,5-1 или 0,7-1, и еще наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9, предпочтительно при условии, что катионное или поликатионное соединение в комплексе представляет собой катионный или поликатионный белок, или пептид и/или полимерный носитель, указанный выше. В этом конкретном варианте осуществления изобретения включенная в комплекс мРНК подпадает также под понятие «адъювантный компонент».
Другим объектом изобретения является антигенная композиция, содержащая несколько или больше одной, предпочтительно от 2 до 10, более предпочтительно от 2 до 5, наиболее предпочтительно от 2 до 4 конструкций мРНК, указанных в настоящем описании. Такие указанные вторые антигенные композиции содержат более одной конструкции мРНК, которые предпочтительно кодируют различные эпитопы из различных иммуногенных пептидов или полипептидов, которые содержат либо одинаковые, либо предпочтительно различные антигены патогенов или их фрагменты, варианты или производные.
В некоторых вариантах осуществления настоящего изобретения антигенная композиция, которая содержит по меньшей мере одну конструкцию мРНК, может содержать несколько или более одной конструкции мРНК, каждая из которых указана в настоящем описании. Например, указанная антигенная композиция может содержать две, три, четыре, пять, шесть, семь, восемь, девять, десять или более десяти (например, примерно от 10 до 20) конструкций мРНК, каждая из которых указана в настоящем описании.
В родственных конкретных вариантах осуществления настоящего изобретения антигенная композиция, которая содержит по меньшей мере один иммуногенный пептид или полипептид, может содержать несколько или более одного иммуногенного пептида или полипептида, каждый из которых указан в настоящем описании. Например, указанная антигенная композиция может содержать два, три, четыре, пять, шесть, семь, восемь, девять, десять или более десяти (например, примерно от 10 до 20) иммуногенных пептидов или полипептидов, каждый из которых указан в настоящем описании.
В других родственных конкретных вариантах осуществления настоящего изобретения антигенная композиция, которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты (которая не представляет собой конструкцию мРНК), может содержать несколько или более одной указанной конструкции нуклеиновой кислоты, каждая из которых указана в настоящем описании. Например, указанная антигенная композиция может содержать две, три, четыре, пять, шесть, семь, восемь, девять, десять или более десяти (например, примерно от 10 до 20) конструкций нуклеиновой кислоты, каждая из которых указана в настоящем описании.
Каждый элемент указанных нескольких иммуногенных пептидов или полипептидов, входящих в антигенную композицию (или кодируемых конструкцией нуклеиновой кислоты/мРНК, которая содержится в антигенной композиции), может представлять собой антиген (или эпитоп) одного и того же патогена или соответствовать одному и тому же состоянию, нарушению или заболеванию. Альтернативно этому, один или несколько (например, два, три, четыре, пять или большее количество) элементов из указанного множества может представлять собой антиген (или эпитоп) другого патогена или соответствовать другому состоянию, нарушению или заболеванию, образуя другой(ие) элемент(ы), входящий(ие) в указанную антигенную композицию. Указанные варианты осуществления изобретения являются прежде всего ценными для вакцинации или для повышения (у индивидуума) иммунного ответа против нескольких патогенов или их можно применять для лечения или профилактики нескольких состояний, нарушений или заболеваний.
Таким образом, следующим конкретным предпочтительным вариантом осуществления настоящего изобретения является также вторая антигенная композиция, которая содержит несколько конструкций мРНК, указанных в настоящем описании, и необязательно фармацевтически приемлемый носитель и/или наполнитель.
В качестве первого ингредиента вторая антигенная композиция, предлагаемая в настоящем изобретении, содержит по меньшей мере одну конструкцию мРНК, указанную в настоящем описании; а первая антигенная композиция, предлагаемая в настоящем изобретении, содержит по меньшей мере эпитоп иммуногенного пептида или полипептида (или не представляющую собой мРНК конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере указанный эпитоп). Однако либо одна (либо обе) из указанных антигенных композиций, предлагаемых в настоящем изобретении, может(гут) (дополнительно) содержать второй ингредиент в качестве фармацевтически активного компонента. В этом контексте фармацевтически активный компонент представляет собой соединение, которое обладает терапевтическим действием с позиций лечения, облегчения или предупреждения конкретного показания или заболевания, указанного в настоящем описании, предпочтительно патогена, опухоли или рака, аллергического или аутоиммунного заболевания. Указанные соединения включают (но не ограничиваясь только ими) пептиды или белки, предпочтительно указанные в настоящем описании, нуклеиновые кислоты, предпочтительно указанные в настоящем описании, (терапевтически активные) низкомолекулярные органические или неорганические соединения (с молекулярной массой менее 5000, предпочтительно менее 1000), сахара, антигены или антитела, предпочтительно указанные в настоящем описании, терапевтические средства, уже известные из существующего уровня техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточной оболочки (например, полисахариды), модифицированные, ослабленные или деактивированные (например, химически или путем облучения) патогены (вирус, бактерии и т.д.), адъюванты, предпочтительно указанные в настоящем описании, и т.д.
Касательно первой антигенной композиции (например, прайм-композиции), предлагаемой в настоящем изобретении, то согласно первому конкретному варианту осуществления изобретения указанная первая антигенная композиция содержит по меньшей мере один иммуногенный пептид или полипептид. Например, она может содержать иммуногенный белок, иммуногенный пептид и/или иммуногенный полипептид (каждый из которых может представлять собой один из указанных в другом месте в настоящем описании).
В конкретных указанных вариантах осуществления изобретения первая антигенная композиция содержит раствор по меньшей мере одного иммуногенного белка, иммуногенного пептида и/или иммуногенного полипептида. Указанный раствор может состоять из иммуногенного белка, иммуногенного пептида и/или иммуногенного полипептида, солюбилизированного (например, растворенного) в растворителе на водной основе (или другом растворителе), который необязательно может содержать дополнительные растворенные вещества, такие как соли, другие белки/полипептиды/пептиды, органические молекулы и/или загрязняющие молекулы.
В некоторых вариантах первой антигенной композиции, предлагаемой в настоящем изобретении, иммуногенный белок, иммуногенный пептид и/или иммуногенный полипептид, содержащейся в ней, является выделенным или находится в очищенной форме. Например, степень чистоты указанного белка/полипептида/пептида выбирают из следующего перечня, включающего чистоту, превышающую примерно 50%, 75%, 80%, 90, 95%, 98%, 99% или от 99% до 100%, касательно любых не требуемых или загрязняющих молекул, таких как белки. Указанную выделенную или очищенную форму белка/полипептида/пептида можно получать с помощью рекомбинантной экспрессии указанного белка/полипептида/пептида или очищать из встречающихся в естественных условиях источников. В альтернативном и конкретном варианте, когда (поли)пептид состоит из менее чем примерно 100 аминокислот или аминокислотных остатков, то такой (поли)пептид можно получать с помощью методов синтеза, известных обычному специалисту в данной области.
В других конкретных вариантах первой антигенной композиции, предлагаемой в настоящем изобретении, иммуногенный белок, иммуногенный пептид и/или иммуногенный полипептид, содержащийся в ней, входит в виде препарата или в смеси с другими молекулами (такими как пептиды/полипептиды/белки), которые включают указанный иммуногенный белок, иммуногенный пептид и/или иммуногенный полипептид. В одном из указанных вариантов осуществления изобретения указанный препарат можно выбирать из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата. Композиция вакцины, изготовленная на основе инактивированного вируса (например, RABIPUR®, полученная из инактивированного вируса бешенства), является одним из примеров (но не ограничиваясь только им) первой антигенной композиции, которая содержит вирусный препарат, включающий по меньшей мере один иммуногенный белок, иммуногенный пептид или иммуногенный полипептид.
Касательно первой антигенной композиции (например, прайм-композиции), предлагаемой в настоящем изобретении, во втором конкретном варианте осуществления изобретения указанная первая антигенная композиция содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или иммуногенный полипептид, при этом, указанная конструкция нуклеиновой кислоты не представляет собой конструкцию мРНК. За исключением мРНК в качестве примеров нуклеиновых кислот можно привести нуклеиновые кислоты, указанные в контексте настоящего описания; и в одном из конкретных вариантов осуществления изобретения указанная конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
В другом указанном варианте осуществления изобретения указанная конструкция нуклеиновой кислоты, входящая в первую антигенную композицию, предлагаемую в настоящем изобретении, представляет собой вектор.
Вектор: В контексте настоящего описания понятие «вектор» относится по меньшей мере к одному полинуклеотиду или к смеси по меньшей мере одного полинуклеотида и по меньшей мере одного белка, который обладает способностью интродуцировать содержащийся в нем полинуклеотид в клетку. По меньшей мере один полинуклеотид, содержащийся в векторе, состоит из или содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид. Помимо полинуклеотида, который состоит из или содержит конструкцию нуклеиновой кислоты, предлагаемую в настоящем изобретении, дополнительные полинуклеотиды и/или полипептиды можно интродуцировать в клетку. Добавление дополнительных полинуклеотидов и/или полипептидов является особенно целесообразным, если указанные дополнительные полинуклеотиды и/или полипептиды требуются для интродукции конструкции нуклеиновой кислоты, предлагаемой в настоящем изобретении, в клетку или если интродукция дополнительных полинуклеотидов и/или полипептидов повышает уровень экспрессии иммуногенного пептида или полипептида, кодируемого конструкцией нуклеиновой кислоты, предлагаемой в настоящем изобретении.
В контексте настоящего изобретения предпочтительно, чтобы иммуногенный пептид или полипептид, кодируемый интродуцированной конструкцией нуклеиновой кислоты, экспрессировался внутри клетки после интродукции в клетку вектора или векторов. Примеры приемлемых векторов включают (но не ограничиваясь только ими) плазмиды, космиды, фаги, вирусы или искусственные хромосомы.
В некоторых вариантах осуществления изобретения вектор, содержащий конструкцию нуклеиновой кислоты, в контексте настоящего изобретения выбирают из группы, состоящей из плазмид, космид, фагов, вирусов и искусственных хромосом. Более предпочтительно вектор, который можно применять согласно настоящему изобретению, представляет собой фаговый вектор, предпочтительно векторы на основе фага лямбда и нитчатого фага, или вирусный вектор.
Основой приемлемых вирусных векторов являются встречающиеся в естественных условиях векторы, которые, как правило, модифицируют так, чтобы они были некомпентентными в отношении репликации, их обозначают также как нереплицирующеся векторы. Для нереплицирующихся векторов требуется наличие белков в тиранс-ориентации касательно репликации. Как правило, указанные белки являются стабильными или кратковременно экспрессируются в продуцирующей вирус клеточной линии, что позволяет вирусу реплицироваться. Таким образом, вирусные векторы предпочтительно являются инфекционными и нереплицирующимися. Специалисту в данной области очевидно, как придавать различным вирусам некомпетентность в отношении репликации.
В предпочтительном варианте осуществления настоящего изобретения вектор выбирают из группы, состоящей из аденовирусных векторов, векторов на основе аденоассоциированного вируса (AAV) (например,, AAV типа 5 и типа 2), альфа-вирусных векторов (например, вирус венесуэльского энцефалита лошадей (VEE), вирус Синдбис (SIN), вирус леса Семлики (SFV) и химеры VEE-SIN), векторы на основе вируса герпеса (например, векторы, полученные из цитомегаловирусов, типа цитомегаловируса макак-резус (RhCMV)), векторы на основе аренавируса (например, векторы на основе вируса лимфоцитарного хориоменингита (LCMV)), векторы на основе вируса кори, векторы на основе поксивируса (например, вируса коровьей оспы, модифицированного вируса коровьей оспы Анкара (MVA), NYVAC (полученный из штамма Копенгаген коровьей оспы) и векторы на основе вируса птичьей оспы: векторы на основе вируса оспы канареек (ALVAC) и оспы домашней птицы (FPV)), векторы на основе вируса везикулярного стоматита, ретровируса, лентивируса, вирусоподобных частиц и бактериальных спор.
В конкретных вариантах осуществления изобретения предпочтительными векторами являются аденовирусные векторы, прежде всего аденовирусные векторы, полученные из вирусов человека или приматов кроме человека, таких как человекообразные обезьяны, и поксивирусные векторы, предпочтительно MVA. Предпочтительными человекообразными обезьянами, из которых получают аденовирусы, являются шимпанзе (Pan), гориллы (Gorilla) и орангутаны (Pongo), предпочтительно бонобо (Pan paniscus), и обыкновенные шимпанзе (Pan troglodytes). Как правило, встречающиеся в естественных условиях аденовирусы приматов кроме человека, таких как человекообразные обезьяны, выделяют из образцов стула соответствующей человекообразной обезьяны. Наиболее предпочтительными векторами являются нереплицирующиеся аденовирусные векторы на основе векторов hAd5, hAd11, hAd26, hAd35, hAd49, ChAd3, ChAd4, ChAd5, ChAd6, ChAd7, ChAd8, ChAd9, ChAd1O, ChAd11, ChAd16, ChAd17, ChAd19, ChAd20, ChAd22, ChAd24, ChAd26, ChAd30, ChAd31, ChAd37, ChAd38, ChAd44, ChAd55, ChAd63, ChAd73, ChAd82, ChAd83, ChAdl46, ChAdl47, PanAd1, PanAd2 и PanAd3 или компетентные в отношении репликации векторы Ad4 и Ad7. Аденовирусы человека hAd4, hAd5, hAd7, hAd11, hAd26, hAd35 и hAd49 хорошо известны в данной области. Векторы на основе встречающихся в естественных условиях ChAd3, ChAd4, ChAd5, ChAd6, ChAd7, ChAd8, ChAd9, ChAd1O, ChAd11, ChAd16, ChAd17, ChAd19, ChAd20, ChAd22, ChAd24, ChAd26, ChAd30, ChAd31, ChAd37, ChAd38, ChAd44, ChAd63 и ChAd82 подробно описаны в WO 2005/071093. Векторы на основе встречающихся в естественных условиях PanAd1, PanAd2, PanAd3, ChAd55, ChAd73, ChAd83, ChAdl46 и ChAdl47 подробно описаны в WO 2010/086189.
Понятие «нереплицирующийся аденовирус» относится к аденовирусу, который становится неспособным к репликации поскольку его создают так, чтобы он содержал по меньшей мере функциональную делецию или у него был полностью удален продукт гена, важный за репликации вируса, например, один или несколько аденовирусных генов, выбранных из Е1, Е2, Е3 и Е4.
Предпочтительно вектор, который применяют в контексте настоящего изобретения, представляет собой поксивирусный вектор, прежде всего MVA, или аденовирусный вектор, более предпочтительно аденовирусный вектор из приматов кроме человека, таких как человекообразные обезьяны, например, шимпанзе или бонобо, в частности нереплицирующийся аденовирусный вектор на основе ChAd3, ChAd4, ChAd5, ChAd6, ChAd7, ChAd8, ChAd9, ChAd1O, ChAd11, ChAd16, ChAd17, ChAd19, ChAd20, ChAd22, ChAd24, ChAd26, ChAd30, ChAd31, ChAd37, ChAd38, ChAd44, ChAd55, ChAd63, ChAd 73, ChAd82, ChAd83, ChAdl46, ChAdl47, PanAd1, PanAd2 и PanAd3 или компетентный в отношении репликации вектор на основе hAd4 и hAd7. Описание MVA представлено у Мауг и др., «The smallpox vaccination MVA: marker, genetic structure, experience gained with the parenteral vaccination and behavior in organisms with a debilitated defence mechanism» Zentralbl Bakteriol B; 167, 1978, с. 375 и у Mayr и др., «Abstammung, Eigenschaften und Verwendung des attenuierten Vaccinia-Stammes MV» Infection 3, 1975, с. 6.
Другие приемлемые векторы подробно описаны в РСТ/ЕР 2011/074307. Описание указанной заявки включено в настоящее описание в качестве ссылки касательно систем экспрессии, указанных в ней.
Таким образом, в некоторых вариантах осуществления изобретения конструкция нуклеиновой кислоты - когда присутствует в первой антигенной композиции - представляет собой вирусный вектор, полученный из вируса, выбранного из перечня, который включает: поксивирус, аденовирус, аденоассоциированный вирус (AAV), альфа-вирус, герпесвирус, ретровирус, лентивирус, цитомегаловирус, вирус Сендай, флавивирус, парвовирус. В конкретных указанных вариантах осуществления, указанный вирусный вектор получают из поксивируса, выбранного из перечня, который включает: вирус оспы (натуральная оспа), вирус коровьей оспы, вирус осповакцины, вирус обезьян. В следующих указанных вариантах осуществления изобретения вирусный вектор получают из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус коровьей оспы (NYVAC), ALVAC, TROVAC и модифицированный вирус коровьей оспы Анкара (MVA).
MVA представляет собой сильно ослабленный штамм вируса коровьей оспы, подвергнутый множеству полностью охарактеризованных делеций в течение более чем 570 пассажей в клетках фибробластов куриного эмбриона. Он включает спектр генов хозяина и генов, кодирующих цитокиновые рецепторы. Вирус не обладает способностью к эффективной репликации в клетках человека и большинства других млекопитающих, но дефект репликации происходит на поздней стадии сборки вириона, при этом экспрессия вирусного и рекомбинантного гена не нарушается, что делает MVA эффективным экспрессионным вектором одного цикла, который не способен заражать млекопитающих.
В одном из вариантов осуществления изобретения MVA получают из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса коровьей оспы в CEF-клетках. В другом варианте осуществления изобретения MVA получают из партии посевного материала вируса MVA 476 MG/14/78. В следующем варианте осуществления изобретения MVA был выведен или получен до 31 декабря 1978 г., и он не был загрязнен прионами.
Кроме того, касательно первой антигенной композиции (например, прайм-композиции), предлагаемой в настоящем изобретении, второй конкретный вариант первой антигенной композиции содержит по меньшей мере конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или иммуногенный полипептид, где указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
В некоторых из указанных вариантов осуществления изобретения самореплицирующуюся молекулу РНК получают или ее основой является РНК вируса или ретровируса. В некоторых указанных вариантах осуществления изобретения самореплицирующуюся молекулу РНК получают или ее основой является альфа-вирус. Самореплицирующиеся молекулы РНК хорошо известны в данной области (например, см. WO 2013/006842, содержание которой включено в настоящее описание в качестве ссылки) и их можно получать с использованием элементов репликации, полученных, например, из альфа-вирусов, и замены структурных вирусных белков нуклеотидной последовательностью, которая кодирует представляющий интерес белок.
Применяемая в контексте настоящего описания самореплицирующаяся РНК может содержать по меньшей мере один или несколько генов, выбранных из группы, которая состоит из вирусных репликаз, вирусных протеаз, вирусных геликаз и других неструктурных вирусных белков, а также содержит на 5'-и 3'-конце цис-активные последовательности, участвующие в репликации, и при необходимости гетерологичную последовательность, которая кодирует требуемую аминокислотную последовательность (например, представляющий интерес антиген). В самореплицирующуюся РНК можно включать субгеномный промотор, который обеспечивает экспрессию гетерологичной последовательности. При необходимости в самореплицирующейся РНК гетерологичную последовательность (например, представляющий интерес антиген) можно сливать с другими кодирующими областями, и/или она может находиться под контролем последовательности участка внутреннего связывания рибосомы (IRES).
В некоторых вариантах осуществления изобретения самореплицирующаяся молекула РНК не капсулирована в вирусоподобной частице. Самореплицирующиеся молекулы РНК, предлагаемые в изобретении, можно создавать так, чтобы самореплицирующаяся молекула РНК не могла индуцировать производство инфекционных вирусных частиц. Для достижения этой цели можно, например, не включать один или несколько вирусных генов, необходимые для производства вирусных частиц в самореплицирующейся РНК. Например, когда основой самореплицирующейся молекулы РНК является альфа-вирус, такой как вирус Синдбис (SIN), вирус леса Семлики (SFV) и вирус венесуэльского энцефалита лошадей (VEE), то можно не включать один или несколько генов, кодирующих структурные белки вирусов, такие как капсидные и/или оболочечные гликопротеины.
При необходимости самореплицирующиеся молекулы РНК, которые можно применять в контексте настоящего изобретения, можно создавать также так, чтобы индуцировать производство инфекционных вирусных частиц, которые являются ослабленным или вирулентными, или производство вирусных частиц, которые обладают способностью к одному циклу последующего заражения.
Одной из приемлемых систем для достижения саморепликации является применение РНК-репликона на основе альфа-вируса. Альфа-вирусы содержат набор генетически, структурно или серологически родственных переносимых членистоногими вирусов семейства Togaviridae. В роде альфа-вирусов классифицировано 26 известных вирусов и подтипов вирусов, включая вирус Синдбис, вирус леса Семлики, вирус реки Росс и вирус венесуэльского энцефалита лошадей. Так, самореплицирующаяся РНК, предлагаемая в изобретении, может содержать РНК-репликазу из вируса Синдбис (SIN), вируса леса Семлики (SFV), вируса венесуэльского энцефалита лошадей (VEE), вируса реки Росс (RRV) или других вирусов, принадлежащих к семейству альфа-вирусов.
В контексте настоящего изобретения можно применять экспрессионные векторы на основе «репликона» альфа-вирусов. Векторы на основе репликонов можно применять в нескольких форматах, включая ДНК, РНК и частицы рекомбинантного репликона. Указанные векторы на основе репликонов получали из альфа-вирусов, включая, например, вирус Синдбис (Xiong и др., Science 243,1989, cc. 1188-1191; Dubensky и др., J. Virol. 70, 1996, cc. 508-519; Hariharan и др., J. Virol. 72, 1998, cc. 950-958; Polo и др., PNAS 96, 1999, cc. 4598-4603), вирус леса Семлики (Liljestrom, Bio/Technology 9, 1991, cc. 1356-1361; Berglund и др., Nat. Biotech. 16, 1998, cc. 562-565) и вирус венесуэльского энцефалита лошадей (Pushko и др.. Virology 239, 1997, cc. 389-401).
Происходящие из альфа-вирусов репликоны в целом являются весьма сходными по всем характеристикам (например, структура, репликация), индивидуальные альфа-вирусы могут обладать некоторой конкретной особенностью (например, связывание с рецептором, чувствительность к интерферонам и профиль заболевания), которая является уникальной. При этом можно применять также химерные репликоны альфивирусов, созданные из различных семейств вирусов.
Репликоны на основе альфа-вирусов представляют собой репликоны с (+)-цепью, которые могут транслироваться после введения в клетку, давая начало репликазе (или репликазе-транскриптазе). Репликаза транслируется в виде полипротеина, который саморасщепляется с образованием комплекса репликации, который создает геномные (-)-цепочечные копии (+)-цепочечной введенной РНК. Эти (-)-цепочечные транскрипты могут сами транскрибироваться с образованием дополнительных копий (+)-цепочечной родительской РНК, а также с образованием субгеномного транскрипта, который кодирует требуемый генный продукт. Таким образом, трансляция субгеномного транскрипта приводит к in situ экспрессии требуемого генного продукта инфицированной клеткой. Приемлемые альфа-вирусные репликоны могут использовать репликазу из вируса Синдбис (SIN), вируса леса Семлики (SFV), вируса восточного энцефалита лошадей, вируса венесуэльского энцефалита лошадей и т.д.
Таким образом, самореплицирующаяся молекула РНК кодирует (I) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК с молекулы самореплицирующейся РНК, и (II) (иммуногенный) пептид или полипептид (антиген). Полимераза может представлять собой репликазу альфа-вирусов, например, содержащую альфа-вирусный белок nsP4.
Самореплицирующаяся молекула РНК, которую можно применять в контексте настоящего изобретения, может иметь две открытые рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует (иммуногенный) пептид или полипептид (антиген). В некоторых вариантах осуществления изобретения РНК может иметь дополнительные (расположенные по ходу транскрипции) открытые рамки считывания, например, которые кодируют другой указанный требуемый генный продукт. Самореплицирующаяся молекула РНК может иметь 5'-последовательность, совместимую с кодируемой репликазой.
В других вариантах осуществления изобретения самореплицирующуюся молекулу РНК получают из или ее основой является вирус, отличный от альфа-вируса, предпочтительно РНКовый вирус с позитивной цепью, и более предпочтительно пикорнавирус, флавивирус, рубивирус, пестивирус, гепацивирус, кальцивирус или коронавирус. Приемлемые последовательности альфа-вируса дикого типа хорошо известны в данной области и их можно получать из последовательностей, находящихся в депозитариях, таких как Американская коллекция типовых культур, Роквилл, шт. Мэриленд.
Репрезентативные примеры приемлемых альфа-вирусов включают вирус Аура (АТСС VR-368), вирус Бебару (АТСС VR-600, ATCC VR-1240), Кабассоу (Cabassou) (АТСС VR-922), вирус Чикунгунья (АТСС VR-64, АТСС VR-1241), вирус восточного энцефалита лошадей, (АТСС VR-65, АТСС VR-1242), Форта Морган (АТСС VR-924), вирус Гета (АТСС VR-369, АТСС VR- 1243), Кызылагач (АТСС VR-927), Майяро (АТСС VR-66), вирус Майяро (АТСС VR-1277), Миддельбург (АТСС VR-370), вирус Мукамбо (АТСС VR-580, АТСС VR-1244), Ндуму (АТСС VR-371), вирус Пиксуна (АТСС VR-372, АТСС VR-1245), вирус реки Росс (АТСС VR-373, АТСС VR-1246), вируса леса Семлики (АТСС VR-67, АТСС VR-1247), вирус Синдбис (АТСС VR-68, АТСС VR-1248), Тонате (АТСС VR-925), Тринити (АТСС VR-469), Уна (АТСС VR-374), венесуэльского энцефаломиелита лошадей (АТСС VR-69, АТСС VR-923, АТСС VR-1250 АТСС VR-1249, АТСС VR-532), западного энцефаломиелита лошадей (АТСС VR-70, АТСС VR-1251, АТСС VR-622, АТСС VR-1252), Ватароа (АТСС VR-926) и Y-62-33 (АТСС VR-375).
Самореплицирующаяся молекула РНК, которую можно применять в контексте настоящего изобретения, может быть крупнее, чем другие типы РНК (например, мРНК). Как правило, самореплицирующиеся молекулы РНК, которые можно применять в контексте настоящего изобретения, содержат по меньшей мере примерно 4 (тысяч пар нуклеотидов, т.п.н.) Например, Самореплицирующаяся РНК может содержать по меньшей мере примерно 5, по меньшей мере примерно 6, по меньшей мере примерно 7, по меньшей мере примерно, по меньшей мере примерно 9, по меньшей мере примерно 10, по меньшей мере примерно 11, по меньшей мере примерно 12 или больше чем 12 т.п.н. В некоторых примерах Самореплицирующаяся РНК содержит от примерно 4 до примерно 12 т.п.н., от примерно 5 до примерно 12 т.п.н., от примерно 6 до примерно 12 т.п.н., от примерно 7 до примерно 12 т.п.н., от примерно 8 до примерно 12 т.п.н., от примерно 9 до примерно 12 т.п.н., от примерно 10 до примерно 12 т.п.н., от примерно 11 до примерно 12 т.п.н., от примерно 5 до примерно 1 т.п.н., от примерно 5 до примерно 10 т.п.н., от примерно 5 до примерно 9 т.п.н., от примерно 5 до примерно 8 т.п.н., от примерно 5 до примерно 7 т.п.н., от примерно 5 до примерно 6 т.п.н., от примерно 6 до примерно 12 т.п.н., от примерно 6 до примерно 11 т.п.н., от примерно 6 до примерно 10 т.п.н., от примерно 6 до примерно 9 т.п.н., от примерно 6 до примерно 8 т.п.н., от примерно 6 до примерно 7 т.п.н., от примерно 7 до примерно 11 т.п.н., от примерно 7 до примерно 10 т.п.н., от примерно 7 до примерно 9 т.п.н., от примерно 7 до примерно 8 т.п.н., от примерно 8 до примерно 11 т.п.н., от примерно 8 до примерно 10 т.п.н., от примерно 8 до примерно 9 т.п.н., от примерно 9 до примерно 11 т.п.н., от примерно 9 до примерно 10 т.п.н. или от примерно 10 до примерно 11 т.п.н.
Самореплицирующаяся молекула РНК, которую можно применять в контексте настоящего изобретения, может содержать одну или несколько химических модификаций или модификаций последовательности, например, которые описаны в других местах касательно мРНК. В частности, указанные самореплицирующиеся молекулы РНК, могут содержать один или несколько модифицированных нуклеотидов (например, псевдоуридин, N6-метиладенозин, 5-метилцитидин, 5-метилуридин).
В альтернативном варианте осуществления изобретения конструкция нуклеиновой кислоты, содержащаяся в первой антигенной композиции, не представляет собой вирусный вектор (например, не представляет собой один или несколько из векторов, описанных в целом или конкретно выше), например, конструкция нуклеиновой кислоты не представляет собой MVA-вектор, в частности не представляет собой MVA, полученный из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса коровьей оспы в CEF-клетках, и/или не представляет собой MVA, полученный из партии посевного материала вируса MVA 476 MG/14/78, и/или не представляет собой MVA, выведенный или полученный до 31 декабря 1978 г., и свободный от заражения прионами.
В альтернативном или дополнительном альтернативном варианте осуществления изобретения конструкция нуклеиновой кислоты, содержащаяся в первой антигенной композиции, не представляет собой самореплицирующуюся молекулу РНК (например, не представляет собой одну или несколько из миолекул, описанных в целом или конкретно выше).
В контексте настоящего изобретения по меньшей мере один эпитоп иммуногенного пепитида или полипептид, который содержится в или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию (прайм-композицию), является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй (бустерной) антигенной композиции. В некоторых вариантах осуществления различных объектов настоящего изобретения аминокислотная последовательность эпитопа, кодируемого конструкцией мРНК, которая входит во вторую (бустерную) антигенную композицию, сходна с аминокислотной последовательностью эпитопа, кодируемого конструкцией нуклеиновой кислоты, которая входит в первую антигенную композицию (прайм-композицию); или сходна с аминокислотной последовательностью (или последовательностью подобных аминокислотам участков) эпитопа иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции (прайм-композиции).
В этом контексте одна аминокислотная последовательность (или эпитоп или пептид/полипептид/белок) «сходна» с другой аминокислотной последовательностью (или эпитопом или пептидом/полипептидом/белком), если одна является вариантом другой. Например, в некоторых вариантах осуществления изобретения аминокислотная последовательность (или эпитоп или пептид/полипептид/белок) сходна с другой аминокислотной последовательностью (или эпитопом или пептидом/полипептидом/белком), если по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% аминокислот идентичны на сегменте, состоящем примерно из 10, 20, 30, 50, 75 или 100 аминокислот указанных последовательности, эпитопа, пептида, полипептида или белка. В случае подобных аминокислотам фрагментов, которые замещают, чтобы имитировать структуру или другие особенности данной аминокислоты, обычному специалисту в данной области должно быть очевидно, что указанный(ые) подобный(ые) аминокислотам фрагмент (или фрагменты) в этом контексте следует определять как «идентичные» аминокислоте(ам), которую(ые) он(и) имитирует(ют).
Таким образом, в указанных вариантах осуществления изобретения аминокислотная последовательность по меньшей мере эпитопа иммуногенного пептида или полипептида, входящего в первую антигенную композицию или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с аминокислотной последовательностью по меньшей мере эпитопа иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции. В конкретных указанных вариантах осуществления изобретения часть аминокислотной последовательности иммуногенного пептида или полипептида, входящего в первую антигенную композицию или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с частью аминокислотной последовательности иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции. В этом контексте понятие «часть» может соответствовать примерно 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 85%, 98% или даже 100% указанного иммуногенного пептида или полипептида или может соответствовать участку смежных аминокислот, имеющему в длину примерно: от 20 до 50, от 50 до 100, от 100 до 150, от 150 до 200, от 250 до 300, 300, от 350 до 400, от 400 до 450 или свыше 450 (например, вплоть до 1000) аминокислот.
Во всех объектах настоящего изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, который можно применять согласно настоящему изобретению, может представлять собой (например, их можно выделять, получать, или они могут иметь последовательность, гомологичную или являющуюся вариантом) аминокислотную последовательность из патогена, например, инфекционного агента, который вызывает заболевание или плохое самочувствие у индивидуума. В конкретных указанных вариантах осуществления изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, который можно применять согласно настоящему изобретению, может иметь происхождение из патогена человека (например, инфекционного агента, патогенного для человека). В альтернативных вариантах осуществления изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, который можно применять согласно настоящему изобретению, может иметь происхождение из патогена животного кроме человека, такого как домашнее млекопитающее, домашняя птица или рыба из рыбоводческого хозяйства. В других вариантах осуществления изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, который можно применять согласно настоящему изобретению, может представлять собой (например, их можно выделять, получать, или они могут иметь последовательность, гомологичную или являющуюся вариантом) аминокислотную последовательность из патогенного антигена.
Таким образом, в некоторых вариантах осуществления изобретения аминокислотная последовательность по меньшей мере эпитопа может иметь происхождение из патогена или его гомолога, фрагмента или варианта. В конкретных указанных вариантах осуществления изобретения иммуногенный пептид или полипептид, содержащейся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, может иметь происхождение из патогена или патогенных антигенов или их гомолога, фрагмента или варианта.
Конкретные типы патогенов, из которых согласно всем вариантам осуществления изобретения, может иметь происхождение аминокислотная последовательность эпитопа, иммуногенного пептида и/или иммуногенного полипептида, выбирают из перечня, состоящего из: вируса, бактерии, гриба и простейшего организма, в частности любого из указанных патогенов, которые являются патогенными для человека.
Во всех указанных вариантах осуществления изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид из патогена можно в альтернативном варианте обозначать также как «патогенный антиген».
Таким образом, в различных объектах настоящего изобретения эпитоп, иммуногенный пептид и/или иммуногенный полипептид из патогена может представлять собой, может содержать или может содержаться в патогенном антигене или его фрагменте, варианте или производном. Указанные патогенные антигены получают из патогенных организмов, в частности, бактерий, вирусов, протозойных (многоклеточных) патогенных организмов, которые провоцируют иммунологическую реакцию у индивидуума, в частности индивидуума, представляющего собой млекопитающее, более конкретно человека. Более конкретно патогенные антигены предпочтительно представляют собой поверхностные антигены, например, белки (или фрагменты белков, например, наружную часть поверхностного антигена), локализованного на поверхности вируса или бактерии, или протозойного организма.
Патогенные антигены представляют собой пептидные или белковые антигены предпочтительно, полученные из патогена, ассоциированного с инфекционным заболеванием, которые предпочтительно выбирают из антигенов, имеющих происхождение из патогенов Acinetobacter baumannii, рода Anaplasma, Anaplasma phagocytophilum, Ancylostoma braziliense, Ancylostoma duodenale, Arcanobacterium haemolyticum, Ascaris lumbricoides, рода Aspergillus, Astroviridae, рода Babesi, Bacillus anthracis. Bacillus cereus, Bartonella henselae, BK-вируса, Blastocystis hominis, Blastomyces dermatitidis, Bordetella pertussis, Borrelia burgdorferi, рода Borrelia, Borrelia spp, рода Brucella, Brugia malayi, семейства Bunyaviridae, Burkholderia cepacia и другие виды Burkholderia, Burkholderia mallei, Burkholderia pseudomallei, семейства Caliciviridae, рода Campylobacter, Candida albicans, Candida spp, Chlamydia trachomatis, Chlamydophila pneumoniae, Chlamydophila psittaci, CJD-приона, Clonorchis sinensis, Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium perfringens, Clostridium spp, Clostridium tetani, Coccidioides spp, Coronavi ruses, Corynebacterium diphtheriae, Coxiella burnetii, вируса геморрагической лихорадки Крым-Конго, Cryptococcus neoformans, рода Cryptosporidium, цитомегаловируса (CMV), вируса Денге (DEN-1, DEN-2, DEN-3 и DEN-4), Dientamoeba fragilis, вируса Эбола (EBOV), рода Echinococcus, Ehrlichia chaffeensis, Ehrlichia ewingii, рода Ehrlichia, Entamoeba histolytica, рода Enterococcus, рода Enterovirus, энтеровирусов, прежде всего вируса Коксаки А и энтеровируса 71 (EV71), Epidermophyton spp, вируса Эпштейна-Барра (EBV), Escherichia coli 0157:H7, O1 1 1 и O104:H4, Fasciola hepatica и Fasciola gigantica, FFI-приона, суперсемейства Filarioidea, флавивирусов, Francisella tularensis, рода Fusobacterium, Geotrichum candidum, Giardia intestinalis, Gnathostoma spp, GSS-приона, вируса Гуанарито, Haemophilus ducreyi, Haemophilus influenzae, Helicobacter pylori, вируса генитального герпеса (вирус Хендра, вирус Нипах), вируса гепатита А, вируса гепатита В (HBV), вируса гепатита С (HCV), вируса гепатита D, вируса гепатита Е, вируса герпеса простого 1 и 2 (HSV-1 и HSV-2), Histoplasma capsulatum, ВИЧ (вирус иммунодефицита человека), Hortaea werneckii, бокавируса человека (HBoV), человеческого вируса герпеса 6 (HHV-6) и человеческого вируса герпеса 7 (HHV-7), человеческого метапневмовируса (hMPV), человеческого вируса папилломы (HPV), человеческих вирусов парагриппа (HPIV), вируса японского энцефалита, JC-вируса, вируса Хунин, Kingella kingae, Klebsiella granulomatis, приона Куру, вируса Лаоса, Legionella pneumophila, рода Leishmania, рода Leptospira, Listeria monocytogenes, вируса лимфоцитарного хориоменингита (LCMV), вируса Мачупо, Malassezia spp, вируса Марбург, вируса кори, Metagonimus yokagawai, Microsporidia phylum, вируса контагиозного моллюска (MCV), вируса эпидемического паротита, Mycobacterium leprae и Mycobacterium lepromatosis, Mycobacterium tuberculosis, Mycobacterium ulceraus, Mycoplasma pneumoniae, Naegleria fowleri, Necator americanus, Neisseria gonorrhoeae, Neisseria meningitidis, Nocardia asteroides, Nocardia spp, Onchocerca volvulus, Orientia tsutsugamushi, семейства Orthomyxoviridae (гриппа), Paracoccidioides brasiliensis, Paragonimus spp, Paragonimus westermani, парвовирусаВ19, рода Pasteurella, рода Plasmodium, Pneumocystis jirovecii, полиовируса, вируса бешенства, респираторно-синцитиального вируса (RSV), риновируса, риновирусов, Rickettsia akari, рода Rickettsia, Rickettsia prowazekii, Rickettsia rickettsii, Rickettsia typhi, вируса лихорадки долины Рифт, ротавируса, вируса краснухи, вируса Сабиа, рода Salmonella, Sarcoptes scabiei, короновируса SARS, рода Schistosoma, рода Shigella, вируса Син Номбре, хантавируса, Sporothrix schenckii, рода Staphylococcus, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes, Strongyloides stercoralis, рода Taenia, Taenia solium, вируса клещевого энцефалита (TBEV), Toxocara canis или Toxocara cati, Toxoplasma gondii, Treponema pallidum, Trichinella spiralis, Trichomonas vaginalis, Trichophyton spp, Trichuris trichiura, Trypanosoma brucei, Trypanosoma cruzi, Ureaplasma urealyticum, вируса ветряной оспы (VZV), Variola major или Variola minor, vCJD-приона, вируса венесуэльского энцефаломиелита лошадей. Vibrio cholerae, вируса Западного Нила, вируса западного энцефалита лошадей, Wuchereria bancrofti, вируса желтой лихорадки, Yersinia enterocolitica, Yersinia pestis и Yersinia pseudotuberculosis.
В этом контексте наиболее предпочтительными являются антигены из патогенов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса герпеса простого (HSV), человеческого вируса папилломы (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки.
Согласно альтернативному варианту осуществления изобретения первая антигенная композиция и/или вторая антигенная композиция, указанная в настоящем описании, не содержит антиген (или его фрагмент или вариант), полученный из RSV, предпочтительно из респираторного патогена. Альтернативно этому, первая антигенная композиция и/или вторая антигенная композиция, указанная в настоящем описании, предпочтительно не содержит антиген (или его фрагмент или вариант), полученный из ВИЧ. В этом контексте антиген может представлять собой пептид или белок или нуклеиновую кислоту, кодирующую пептид или белок, полученный из RSV или ВИЧ соответственно.
Кроме того, патогенный антиген (антиген, полученный из патогена, ассоциированного с инфекционным заболеванием) можно предпочтительно выбирать из следующих антигенов: белок наружной мембраны А OmpA, ассоциированный с биопленкой белок Вар, транспортный белок MucK (Acinetobacter baumannii, Acinetobacter infections)); вариабельный поверхностный гликопротеин VSG, ассоциированный с микротрубочками белок МАРР1 5, транссиалидаза TSA (Trypanosoma brucei, африканская сонная болезнь (африканский трипаносомоз)); антиген ВИЧ р24, оболочечные белки ВИЧ (Gp120, Gp41, Gp160), полипротеин GAG, негативный фактор белок Nef, трансактиватор транскрипции Tat (HIV (вирус иммунодефицита человека), СПИД (синдром приобретенного иммунодефицита)); белок ингибируемой галактозой адгезии GIAP, антиген 29 кДа Eh29, Gal/GalNAc-лектин, белок CRT, иммунодоминантный антиген 125 кДа, белок M17, адгезин ADH1 12, белок STIRP (Entamoeba histolytica, амебиаз); основные поверхностные белки 1-5 (MSP1 a, MSP1 b, MSP2, MSP3, MSP4, MSP5), белки системы секретина типа IV (VirB2, VirB7, VirB1 1, VirD4) (род Anaplasma, анаплазмоз); защитный антиген РА, фактор отека EF, летальный фактор LF, гомологи белков S-слоя SLH (Bacillus anthracis, сибирская язва); акранолизин, фосфолипаза D, коллагенсвязывающий белок CbpA (Arcanobacterium haemolyticum, инфекция, вызываемая Arcanobacterium haemolyticum); белок нуклеокапсида NP, предшественник гликопротеина GPC, гликопротеин GP1, глиокопротеин GP2 вируса Гунина, аргентинская геморрагическая лихорадка); белки хитин-белкового слоя, поверхностный антиген 14 кДа А 14, основной белок спермы MSP, организующий полимеризацию MSP белок МРОР, MSP-волоконный белок 2 MFP2, активирующая полимеризацию MSP киназа МРАК, АВА-1-подобный белок ALB, белок АВА-1, кутикулин CUT-1 (Ascaris lumbricoides, аскаридоз); аллерген 41 кДа Asp v13, аллерген Asp f3, основной поверхностный белок конидий rodlet А, протеаза Pepl p, GPI-заякоренный белок Gel1 p, GPI-заякоренный белок Crfl p (род Aspergillus, аспергиллез); белок семейства VP26, белок VP29 (Astroviridae, инфекция, вызываемая астровирусом); ассоциированный с роптриями белок 1 RAP-1, поверхностные антигены мерозоитов MSA-1, MSA-2 (а1, а2, b, c), 12D3, 11 С5, 21 В4, Р29, вариант поверхностного антигена эритроцитов VESA1, антиген апикальной мембраны 1 АМА-1 (род Babesia, бабезиоз); гемолизин, энтеротоксин С, РХ01-51, гликолатоксидаза, АВС-транспортер, пенициллин-связывающий белок, белок семейства транспортеров цинка, псевдоуридинсинтаза Rsu, белок, участвующий в репликации плазмиды RepX, олигоэндопептидаза F, профаговый мембранный белок, белок HemK, флагеллярный антиген Н, антиген клеточной поверхности 28,5 кДа (Bacillus cereus, инфекция, вызываемая Bacillus cereus); большой Т-антиген LT, малый Т-антиген, капсидный белок VP1, капсидный белок VP2 (вирус BK, инфекция, вызываемая вирусом BK); белок 29 кДа, каспаза-3-подобные антигены, гликопротеины (Blastocystis hominis, инфекция, вызываемая Blastocystis hominis); адгезин поверхности дрожжей WI-1 (Blastomyces dermatitidis, бластомикоз); нуклеопротеин N, полимераза L, матриксный белок Z, гликопротеин GP (вирус Мачупо, вирус боливийской геморрагической лихорадки); белок наружной поверхности A OspA, белок наружной поверхности OspB, белок наружной поверхности OspC, декорин-связывающий белок A DbpA, декорин-связывающий белок В DbpB, коровый белок флагеллярного филамента 41 кДа Fla, предшественник основного мембранного белка А BmpA (иммунодоминантный антиген Р39), предшественник липопротеина наружной поверхности 22 кДа (антиген IPLA7), вариабельный поверхностный липопротеин v1sE (род Borrelia, инфекция, вызываемая Borrelia); нейротоксины ботулина BoNT/A1, BoNT/A2, BoNT/A3, BoNT/B, BoNT/C, BoNT/D, BoNT/E, BoNT/F, BoNT/G, домен FHc рекомбинантного токсина ботулина F He (Clostridium botulinum, ботулизм (и детский ботулизм)); нуклеокапсид, предшественник гликопротеина (вирус Сабиа, бразильская геморрагическая лихорадка); медь/цинк-содержащая супероксиддисмутаза SodC, бактериоферритин Bfr, субъединица 50S рибосомного белка plL, OmpA-подобный содержащий трансмембранный домен белок Omp31, иммуногенный белок 39 кДа М5 Р39, представляющий собой транспортер цинка АВС-семейства периплазматический цинк-связывающий белок znuA, периплазматический иммуногенный белок Вр26, субъединица 30S рибосомного белка SI 2 RpsL, глицеральдегид-3-фосфатдегидрогеназа Gap, иммуногенный белок-предшественник Отр25 наружной мембраны 25 кДа, инвазивный белок В la1B, триггерный фактор Tig, молекулярный шаперон DnaK, предполагаемая пептидил-пролил-цис/трансизомераза SurA, липопротеин Omp19, белок наружной мембраны MotY Omp1 6, консервативный белок наружной мембраны D15, малатдегидрогеназа Mdh, компонент системы секреции типа IV (T4SS) VirJ, липопротеин с неизвестной функцией ВАВ1_0187 (род Brucella, бруцеллез); представители АВС-семейства транспортеров (LolC, OppA и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC E, флагеллин FliC, белок внутриклеточной подвижности Burkholderia A BimA, бактериальный Tu-фактор элонгации EF-TU, OmpA-подобный белок 17 кДа, кодирующий белок boaA, кодирующий белок boaB (Burkholderia cepacia и другие виды Burkholderia, инфекция, вызываемая Burkholderia); миколил-трансфераза Ag85A, белок теплового шока Hsp65, белок ТВ 10.4, антиген 19 кДа, белок PstS3, белок теплового шока Hsp70 (Mycobacterium ulcerans, язва Бурули); основной и минорный капсидные белки норовируса VP1 и VP2, транслируемый геномом полипротеин, капсидный белок саповируса VP1, белок Vp3, геномный полипротеин (семейство Caliciviridae, инфекция, вызываемая калицивирусом (норовирус и саповирус)); основной белок наружной мембраны PorA, флагеллин FlaA, поверхностный антиген CjaA, фибронектин-связывающий белок CadF, аспартат/глутамат-связывающий белок-транспортер АВС-семейства PebI A, белок FspA1, белок FspA2 (род Campylobacter, кампилобактериоз); гликолитический фермент энолаза, секретируемые аспартилпротеиназы SAP1-10, гликофосфатидилинозитол (GP1)-заякоренный белок клеточной мембраны, белок Hyr1, родственный рецептору комплемента 3 белок CR3-RP, адгезин Als3p, белок теплового шока 90 кДа hsp90, обусловливающий гидрофобность клеточной поверхности белок CSH (как правило, из Candida albicans и других видов Candida, кандидоз); антиген 17 кДа, белок Р26, тримерные адгезины-аутотранспортеры ТАА, адгезин A Bartonella BadA, вариабельно экспрессируемые белки наружной мембраны Vomp, белок Pap3, белок HbpA, ассоциированная с (мембранной) оболочкой протеаза HtrA, белок ОМР89, белок GroEL, белок La1B, белок ОМР43, дигидролипоамидсукцинилтрансфераза SucB (Bartonella henselae, болезнь кошачьих царапин); поверхностный белок амастигот 2, -специфичный для амастигот поверхностный белок SSP4, крузипайн, транссиалидаза TS, поверхностный гликопротеин трипомастиготы TSA-1, регуляторный белок комплемента CRP-10, белок G4, белок G2, белок параксиального тяжа PAR2, компонент парафлагеллярного тяжа Pari, муцин-ассоциированные поверхностные белки MPSP (Trypanosoma cruzi, болезнь Шагаса (американский трипаносомиоз)); оболочечные гликопротеины (gB, gC, gE, gH, gL, gK, gI) (вирус ветряной оспы (VZV), ветряная оспа); основной белок наружной мембраны МОМР, предполагаемый белок наружной мембраны РМРС, белок комплекса наружной мембраны В OmcB, белки теплового шока Hsp60 HSP10, белок IncA, белки системы секреции типа III, белок малой цепи рибонуклеотидредуктазы NrdB, плазмидный белок Pgp3, наружный белок хламидий N CopN, антиген СТ521, антиген СТ425, антиген СТ043, антиген ТС0052, антиген ТС0189, антиген ТС0582, антиген ТС0660, антиген ТС0726, антиген ТС0816, антиген ТС0828 (Chlamydia trachomatis, хламидии); белок ответа на низкий уровень кальция Е LCrE, наружный белок хламидий N CopN, серин/треониновая протеинкиназа PknD, переносящая ацил белок S-малонилтрансфераза FabD, связывающий одноцепочечную ДНК белок Ssb, основной белок наружной мембраны МОМР, белок наружной мембраны 2 Omp2, семейство полиморфных мембранных белков (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Ртр7, Ртр8, Ртр9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (Chlamydophila pneumoniae, инфекция, вызываемая Chlamydophila pneumoniae); холерный токсин В СТВ, токсин-корегулируемый пилин А ТсрА, токсин-корегулируемый пилин TcpF, белок F биосинтеза токсин-корегулируемых пилей TcpF, субъединица А холерного энтеротоксина, субъединица В холерного энтеротоксина, термостабильный энтеротоксин ST, чувствительный к маннозе гемагглютинин MSHA, белок наружной мембраны U порин ompU, порирующий белок В, полиморфный мембранный белок D (Vibrio cholerae, холера); пропионил-СоА-карбоксилаза РСС, белок 14-3-3, прогибитин, цистеинпротеазы, глутатионтрансферазы, гельзолин, катепсин-L-протеаза CatL, белок тегумента 20,8 кДа ТР20.8, белок тегумента 31,8 кДа ТР31.8, фосфатаза лизофосфатидиловой кислоты LPAP, (Clonorchis sinensis, клонорхоз); белки поверхностного слоя SLP, антиген глутаматдегидрогеназы GDH, токсин А, токсин В, цистеинпротеаза Cwp84, цистеинпротеаза Cwp13, цистеинпротеаза Cwp19, белок клеточной стенки CwpV, флагеллярный белок FliC, флагеллярный белок FliD (Clostridium difficile, инфекция, вызываемая Clostridium difficile); риновирусы: капсидные белки VP1, VP2, VP3, VP4; коронавирусы: белки sprike S, оболочечные белки Е, мембранные белки М, нуклеокапсидные белки N (как правило, риновирусы и коронавирусы, насморк (острый вирусный ринофарингит; острая инфекция верхних дыхательных путей)); прионный белок Prp (прион CJD, болезнь Крейтцфельдта-Якоба (CJD)); оболочечный белок Gc, оболочечный белок Gn, нуклеокапсидные белки (вирус геморрагической лихорадки Крым-Конго, геморрагическая лихорадка Крым-Конго (CCHF)); ассоциированная с вирулентностью DEAD-бокс-РНК-геликаза VAD1, белок галактоксиломаннан GalXM, глюкуроноксиломаннан GXM, маннопротеин МР (Cryptococcus neoformans, криптококкоз); кислый рибосомный белок Р2 СрР2, антигены муцина Muc1, Muc2, Muc3, Muc4, Мис5, Muc6, Muc7, белок поверхностной адгезии СР20, белок поверхностной адгезии СР23, поверхностный белок СР12, поверхностный белок СР21, поверхностный белок СР40, поверхностный белок СР60, поверхностный белок СР15, ассоциированные с поверхностью гликопептиды gp40, ассоциированные с поверхностью гликопептиды gp15, белок стенки ооцисты АВ, профилин PRF, апираза (род Cryptosporidium, криптоспоридиоз); связывающий жирные кислоты и ретинол белок-1 FAR-1, тканевой ингибитор металлопротеиназы TIMP (ТМР), цистеинпротеиназа ACEY-1, цистеинпротеиназа АССР-1, поверхностный антиген Ас-16, секретируемый белок 2 ASP-2, металлопротеаза 1 МТР-1, ингибитор аспартилпротеазы API-1, ассоциированный с поверхностью антиген SAA-1, специфичный для взрослых секретируемый фактор Ха, ингибитор сериновой протеазы антикоагулянт АР, катепсин D-подобная аспарагиновая протеаза ARR-1 (как правило, Ancylostoma braziliense; множество других паразитов, кожная мигрирующая личинка (CLM)); катепсин L-подобные протеазы, антиген 53/25-кДа, представители семейства 8 кДа, белок цистицерка с подобной маргинальному трипсину активностью TsAg5, белок онкосферы TSOL18, белок онкосферы TSOL45-1A, лактатдегидрогеназа А LDHA, лактатдегидрогеназа В LDHB (Taenia solium, цистицеркоз); антиген рр65, мембранный белок рр15, белок капсида-проксимального тегумента рр150, белок М45, ДНК-полимераза UL54, геликаза UL105, гликопротеин gM, гликопротеин gN, гликопротеин Н, гликопротеин В gB, белок UL83, белок UL94, белок UL99 (цитомегаловирус, инфекция, вызываемая цитомегаловирусом (CMV)); капсидный белок С, премембранный белок prM, мембранный белок М, оболочечный белок Е (домен I, домен II, домен II), белок NS1, белок NS2A, белок NS2B, белок NS3, белок NS4A, белок 2K, белок NS4B, белок NS5 (вирусы Денге (DEN-1, DEN-2, DEN-3 и DEM-4)-флавивирусы, лихорадка Денге); белок 39 кДа (Dientamoeba fragilis, диентаамебиаз; предшественник дифтерийного токсина Tox, дифтерийный токсин DT, пилин-специфичная сортаза SrtA, белок осевого пилина SpaA, бедок концевого пилина SpaC, белок минорного пилина SpaB, ассоциированный с поверхностью белок DIP1281 (Corynebacterium diphtheriae, дифтерия); гликопротеин GP, нуклеопротеин NP, минорный белок матрикса VP24, основной белок матрикса VP40, активатор транскрипции VP30, кофактор полимеразы VP35, РНК-полимераза L (вирус Эбола (EBOV), геморрагическая лихорадка Эбола); прионный белок (прион vCJD, вариант болезни Крейтцфельдта-Якоба (vCJD, nvCJD)); белок системы UvrABC В, белок Flp1, белок Flp2, белок Flp3, белок TadA, рецептор гемоглобина HgbA, наружный мембранный белок TdhA, белок CpsRA, регулятор CpxR, белок SapA, антиген 18 кДа, наружный мембранный белок NcaA, белок LspA, белок LspA1, белок LspA2, белок LspB, компонент наружной мембраны DsrA, лектин DItA, липопротеин Hlp, основной белок наружной мембраны ОМР, белок наружной мембраны OmpA2 (Haemophilus ducreyi, шанкроид); аспартилпротеаза 1 Pep1, фосфолипаза В PLB, альфа-маннозидаза 1 AMN1, глюканозилтрансфераза GEL1, уреаза URE, белок матрикса пероксисом Pmp1, богатый пролином антиген Pra, реактивный белок Т-клеток человека TcrP (Coccidioides immitis и Coccidioides posadasii, кокцидиоидомикоз); аллерген Tri r2, белок теплового шока 60 Hsp60, актин грибов Act, антиген Tri r2, антиген Tri r4, антиген Tri t1, белок IV, глицерол-3-фосфатдегидрогеназа Gpd1, осмосенсор HwShol А, осмосенсор HwShol В, гистидинкиназа HwHhk7B, аллерген Mala s 1, аллерген Mala s 11, тиоредоксин Trx Mala s 13, аллерген Mala f, аллерген Mala s (как правило, spp. Trichophyton, spp. Epidermophyton, spp. Malassezia, Hortaea werneckii, дерматофитоз); белок EG95, белок EG10, белок EG18, белок EgA31, белок ЕМ18, антиген ЕРС1, антиген В, антиген 5, белок Р29, белок 14-3-3, белок 8 кДа, миофилин, белок теплового шока 20 HSP20, гликопротеин GP-89, связывающий жирные кислоты белок FAPB (род Echinococcus, эхинококкоз); основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, MSP вариант SGV1, MSP вариант SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAP1, основной антигенный белок MAP1-2, основной антигенный белок МАР1В, основной антигенный белок MAP1-3, Erum2510-кодирующий белок, белок GroEL, белок GroES, основной белок наружной мембраны 30 кДа, белок GE 100 кДа, белок GE 130 кДа, белок GE 160 кДа (род Ehrlichia, эрлихиоз); секретируемый антиген SagA, sagA-подобные белки SalA и SalB, адгезин коллагена Scm, поверхностные белки Fmsl (EbpA(fm), Fms5 (EbpB(fm), Fms9 (EpbC(fm) и Fms10, белок EbpC(fm), иммунозащитный гликопротеин G1 96 кДа (род Enterococcus, энтерококковая инфекция); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3C (род Enterovirus, энтеровирусная инфекция); белки наружной мембраны ОМ, белок наружной мембраны 60 кДа, антиген клеточной поверхности OmpA, антиген клеточной поверхности OmpB (sca5), белок наружной мембраны 134 кДа, белок наружной мембраны 31 кДа, белок наружной мембраны 29,5 кДа, белок клеточной поверхности SCA4, белок клеточной поверхности Adr1 (RP827), белок клеточной поверхности Adr2 (RP828), белок клеточной поверхности SCA1, белок инвазии invA, белок клеточного деления fts, семейство sec О белков секреции, белки вирулентности virB, tlyA, tlyC, парвулинподобный белок Pip, транслоказа пребелка SecA, поверхностный белковый антиген 120 кДа SPA, антиген комплекса 138 кДа, основной белок 100 кДа (белок I), внутрицитоплазматический белок D, защитный поверхностный белковый антиген SPA (Rickettsia prowazekii, эпидемический сыпной тиф); ядерные антигены Эпштейна-Барра (EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, EBNA-лидерный белок (EBNA-LP)), латентные мембранные белки (LMP-1, LMP-2А, LMP-2B), ранний антиген EBV-EA, мембранный антиген EBV-MA, вирусный капсидный антиген EBV-VCA, щелочная нуклеаза EBV-AN, гликопротеин Н, гликопротеин gp350, гликопротеин gp110, гликопротеин gp42, гликопротеин gHgL, гликопротеин gB (вирус Эпштейна-Барра (EBV), (инфекционный мононуклеоз, вызываемый вирусом Эпштейна-Барра); капсидный белок VP2, капсидный белок VP1, основной белок NS1 (парвовирус В19, инфекционная эритема (пятая болезнь)); антиген рр65, гликопротеин 105, основной капсидный белок, гликопротеин оболочки Н, белок U51 (человеческий вирус герпеса 6 (HHV-6) и человеческий вирус герпеса 7 (HHV-7), внезапная экзантема); тиоредоксин-глутатионредуктаза TGR, катепсины L1 и L2, белок типа Кунитца КТМ, лейцинаминопептидаза LAP, цистеинпротеиназа Fas2, сапонин-подобный белок-2 SAP-2, тиоредоксинпероксидазы ТРх, Prx-1, Prx-2, катепсин I, цистеинпротеиназа CL3, протеаза катепсин L CL1, фосфоглицераткиназа PGK, секреторный белок 27 кДа, белок HSP35альфа 60 кДа, глутатионтрансфераза GST, антиген тегумента 28,5 кДа, 28,5 кДа ТА, катепсин В2 протеаза CatB3, цистатин типа I стефин-1, катепсин L5, катепсин L1g и катепсин В, связывающий жирные кислоты белок FABP, лейцинаминопептидазы LAP (Fasciola hepatica и Fasciola gigantica, фасциолез); прионный белок (прион FFI, спорадическая фатальная инсомния (FFI)); подобный гомологу аллергена яда белок VAL-1, преобладающий транскрипт личинок ALT-1, преобладающий транскрипт личинок ALT-2, тиоредоксинпероксидаза ТРХ, гомолог аллергена веспид VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2 и N3), ассоциированный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-S-трансферазы GST, миозин, гомолог аллергена веспид VAH, коллагеназа 175 кДа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые личиночные кислые белки SLAP, хитиназа CHI-1, связывающий мальтозу белок МВР, гликолитический фермент фруктоза-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод генный продукт OvB20, онхоцистатин CPI-2, Сох-2 (надсемейство Filarioidea, филяриоз); фосфолипаза С PLC, термолабильный энтеротоксин В, компонент токсина лота 1b, белок СРЕ1281, пируватферредоксиноксидоредуктаза, фактор элонгации G EF-G, перфринголизин О Pfo, глицеральдегид-3-фосфатдегидрогеназа GapC, фруктоза-бисфосфатальдолаза Alf2, энтеротоксин Clostridium perfringens CPE, альфа-токсин AT, альфа-токсоид ATd, эпсилон-токсоид ETd, белок HP, большой цитотоксин TpeL, эндо-бета-N-ацетилглюкозаминидаза Naglu, фосфоглицеромутаза Pgm (Clostridium perfringens, пищевое отравление, вызываемое Clostridium perfringens), лейкотоксин IktA, адгезионный FadA, белок наружной мембраны RadD, высокомолекулярный аргининсвязывающий белок (род Fusobacterium, инфекция, вызываемая Fusobacterium); фосфолипаза С PLC, термолабильный энтеротоксин В, компонент токсина лота 1b, белок СРЕ1281, пируватферредоксиноксидоредуктаза, фактор элонгации G EF-G, перфринголизин О Pfo, глицеральдегид-3-фосфатдегидрогеназа GapC, фруктоза-бисфосфатальдолаза Alf2, энтероксин Clostridium perfringens CPE, альфа-токсин AT, альфа-токсоид ATd, эпсилон-токсоид ETd, белок HP, большой цитотоксин TpeL, эндо-бета-N-ацетилглюкозаминидаза Naglu, фосфоглицеромутаза Pgm (как правило, Clostridium perfringens; другие виды Clostridium, газовая гангрена (Clostridial myonecrosis)); липаза А, липаза В, пероксидаза Decl (Geotrichum candidum, геотрихоз); прионный белок (прион GSS, синдром Герстманна-Штросслера-Шейнкера (GSS)); белки стенки цист CWP1, CWP2, CWP3, вариант поверхностного белка VSP, VSP1, VSP2, VSP3, VSP4, VSP5, VSP6, антиген 56 кДа, пируватферредоксиноксидоредуктаза PFOR, алкогольдегидрогеназа Е ADHE, альфа-жиардин, альфа8-жиардин, альфа1-жиардин, бета-жиардин, цистеинпротеазы, глутатион-S-трансфераза GST, аргининдеиминаза ADI, фруктоза-1,6-бисфосфатальдолаза FBA, антигены трофозоитов Giardia GTA (GTA1, GTA2), орнитинкарбоксилтрансфераза ОСТ, белок, подобный ассеблину исчерченных волокон SALP, уридинфосфорил-подобный белок UPL, альфа-тубулин, бета-тубулин (Giardia intestinalis, жиардиаз); представители семейства транспортеров ABC (LolC, OppA, и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC/E, флагеллин FliC, белок внутриклеточной подвижности Burkholderia A BimA, бактериальный фактор элонгации-Tu EF-Tu, OmpA-подобный белок 17 кДа, boaA-кодирующий белок (Burkholderia mallei, сап); циклофилин СуР, белок личинок третьей стадии 24 кДа GS24, продукты экскреции-секреции ESP (40, 80, 120 и 208 кДа) (Gnathostoma spinigerum и Gnathostoma hispidum, гнатостомиаз); белки пилины, минорная ассоциированная с пилином субъединица pilC, основная субъединица пилина и варианты pilE, pilS, белок вариации фаз porA, порин В PorB, белок TraD, антиген наружной мембраны Neisseria Н.8, антиген 70 кДа, основной белок наружной мембраны PI, белки наружной мембраны PIA и PIB, W-антиген, поверхностный белок A NspA, трансферрин-связывающий белок TbpA, трансферрин-связывающий белок TbpB, РВР2, кодирующий белок mtrR, кодирующий белок ponA, пермеаза мембраны FbpBC, система белков FbpABC, белки LbpAB, белок наружной мембраны Ора, транспортер наружной мембраны FetA, подавляемый железом регулятор MpeR (Neisseria gonorrhoeae, гонорея); белок наружной мембраны А OmpA, белок наружной мембраны С OmpC, белок наружной мембраны K17 OmpK17 (Klebsiella granulomatis, паховая гранулема (донованоз)); фибронектин-связывающий белок Sfb, фибронектин/фибриноген-связывающий белок FBP54, фибронектин-связывающий белок FbaA, М-белок типа 1 Emm1, М-белок типа 6 Emm6, иммуноглобулин-связывающий белок 35 Sib35, поверхностный белок R28 Spr28, супероксиддисмутаза SOD, С5а-пептидаза ScpA, антиген I/II Agl/II, адгезин AspA, G-родственный альфа2-макроглобулин-связывающий белок GRAB, поверхностный фибриллярный белок М5 (Streptococcus pyogenes, стрептококковая инфекция, группа А); β-антиген С-белка, белки аргининдеиминазы, адгезин BibA, белок BPS 105 кДа, поверхностные антигены с, поверхностные антигены R, поверхностные антигены X, резистентный к трипсину белок R1, резистентный к трипсину белок R3, резистентный к трипсину белок R4, поверхностный иммуногенный белок Sip, поверхностный белок Rib, белок с богатыми лейцином повторами LrrG, белок с богатыми серином повторами Srr-2, альфа-антиген С-белка Вса, бета-антиген Bag, поверхностный антиген эпсилон, альфа-подобный белок ALP1, альфа-подобный белок ALP5, поверхностный антиген дельта, альфа-подобный белок ALP2, альфа-подобный белок ALP3, альфа-подобный белок ALP4, белок С-бета Вас (Streptococcus agalactiae, стрептококковая инфекция группы В); трансферрин-связывающий белок 2 Tbp2, фосфатаза Р4, белок наружной мембраны Р6, пептидогликан-ассоциированный липопротеин PaI, белок D, белок Е, белок адгезии и проницаемости Нар, белок наружной мембраны 26 Omp26, белок наружной мембраны Р5 (фимбрин), белок наружной мембраны D15, белок наружной мембраны OmpP2, 5'-нуклеотидаза NucA, белок наружной мембраны Р1, белок наружной мембраны Р2, липопротеин наружной мембраны Pep, липопротеин Е, белок наружной мембраны Р4, фукулокиназа FucK, [Cu,Zn]-супероксиддисмутаза SodC, протеаза HtrA, белок O145, альфа-галактозилцерамид (Haemophilus influenzae, инфекция, вызываемая Haemophilus influenzae); полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (энтеровирусы, главным образом вирус Коксаки А и энтеровирус 71 (EV71), болезнь рук, стоп и полости рта (HFMD)); РНК-полимераза L, белок L, гликопротеин Gn, гликопротеин Gc, нуклеокапсидный белок S, оболочечный гликопротеин G1, нуклеопротеин NP, белок N, полибелок М (вирус Син Номбре, хантавирус, хантавирусный легочный синдром (HPS)); белок теплового шока HspA, белок теплового шока HspB, цитратсинтаза GltA, белок UreB, белок теплового шока Hsp60, активирующий нейтрофилы белок NAP, каталаза KatA, вакуолизирующий цитотоксин VacA, уреаза альфа UreA, уреаза бета Ureb, белок Cpn10, белок groES, белок теплового шока Hsp10, белок МорВ, ассоциированный с цитотоксичностью белок CAG 10 кДа, антиген 36 кДа, бета-лактамаза НсрА, бета-лактамаза НсрВ (Helicobacter pylori, инфекция, вызываемая Helicobacter pylori); интегральные мембранные белки, склонные к агрегации белки, О-антиген, токсин-антигены Stx2B, токсин-антиген Stx1B, фрагмент антигена адгезии Int28, белок EspA, белок EspB, интимин, белок Tir, белок IntC300, белок Еае (Escherichia coli O157:Н7, O111 и О104:Н4, гемолитико-уремический синдром (HUS)); РНК-полимераза L, белок L, гликопротеин Gn, гликопротеин Gc, нуклеокапсидный белок S, оболочечный гликопротеин G1, нуклеопротеин NP, белок N, полипротеин М (семейство Bunyaviridae, геморрагическая лихорадка с почечным синдромом (HFRS)); гликопротеин G, матриксный белок М, нуклеопротеин N, белок слияния F, полимераза L, белок W, белок С, фосфопротеин р, неструктурный белок V (хенипавирус (вирус Хендра и вирус Нипах), хенипавирусные инфекции); полипротеин, гликопротеин Gp2, поверхностный антиген гепатита A HBAg, белок 2А, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, белок Р1В, белок Р2А, белок Р3АВ, белок P3D (вирус гепатита А, гепатит А); поверхностный антиген гепатита В HBsAg, коровый антиген гепатита В HbcAg, полимераза, белок Hbx, средний поверхностный белок preS2, поверхностный белок L, большой S-белок, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4 (вирус гепатита В, гепатит В); оболочечный гликопротеин E1 gp32 gp35, оболочечный гликопротеин Е2 NS1 gp68 gp70, капсидный белок С, коровый белок Core, полипротеин, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, антиген G, белок NS3, белок NS5A, (вирус гепатита С, гепатит С); вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, большой антиген гепатита дельта, малый антиген гепатита дельта (вирус гепатита D, гепатит D); вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, капсидный белок Е2 (вирус гепатита Е, гепатит Е); гликопротеин L UL1, урацил-ДНК-гликозилаза UL2, белок UL3, белок UL4, белок ДНК-репликации UL5, портальный белок UL6, белок созревания вириона UL7, ДНК-геликаза UL8, связывающий сайт начала репликации белок UL9, гликопротеин М UL10, белок UL11, щелочная экзонуклеаза UL12, сериновая/треониновая протеинкиназа UL13, белок тегумента UL14, терминаза UL15, белок тегумента UL16, белок UL17, капсидный белок VP23 UL18, основной капсидный белок VP5 UL19, мембранный белок UL20, белок тегумента UL21, гликопротеин Н (UL22), тимидинкиназа UL23, белок UL24, белок UL25, капсидный белок Р40 (UL26, VP24, VP22A), гликопротеин В (UL27), белок ICP18.5 (UL28), основной ДНК-связывающий белок ICP8 (UL29), ДНК-полимераза UL30, ядерный матриксный белок UL31, оболочечный гликопротеин UL32, белок UL33, белок внутренней ядерной мембраны UL34, капсидный белок VP26 (UL35), большой белок тегумента UL36, белок сборки капсида UL37, белок VP19C (UL38), рибонуклеотидредуктаза (большая субъединица) UL39, рибонуклеотидредуктаза (малая субъединица) UL40, белок тегумента/белок выключения генов хозяина вирионом VHS (UL41), фактор процессивности ДНК-полимеразы UL42, мембранный белок UL43, гликопротеин С (UL44), мембранный белок UL45, белки тегумента VP11/12 (UL46), белок тегумента VP13/14 (UL47), белок созревания вириона VP16 (UL48, альфа-TIF), оболочечный белок UL49, dUTP-дифосфатаза UL50, белок тегумента UL51, белок комплекса ДНК-геликаза/праймаза UL52, гликопротеин K (UL53), белок регуляции транскрипции IE63 (ICP27, UL54), белок UL55, белок UL56, белок репликации вируса ICP22 (IE68, US1), белок US2, сериновая/треониновая протеинкиназа US3, гликопротеин G (US4), гликопротеин J (US5), гликопротеин D (US6), гликопротеин I (US7), гликопротеин Е (US8), белок тегумента US9, белок капсида/тегумента US10, белок Vmw21 (US11), белок ICP47 (IE12, US12), основной активатор транскрипции ICP4 (IE175, RS1), убиквитинлигаза Е3 ICPO (IE1 10), связанный с латентностью белок 1 LRP1, связанный с латентностью белок 2 LRP2, фактор нейровирулентности RL1 (ICP34.5), ассоциированный с латентностью транскрипт LAT (вирус герпеса простого 1 и 2 (HSV-1 и HSV-2), простой герпес); белок теплового шока Hsp60, белок клеточной поверхности H1C, дипептидилпептидаза типа IV DppIV, М-антиген, белок 70 кДа, гистон-подобный белок 17 кДа (Histoplasma capsulatum, гистоплазмоз); связывающий жирные кислоты и ретинол белок-1 FAR-1, тканевой ингибитор металлопротеиназы TIMP (ТМР), цистеинпротеиназа ACEY-1, цистеинпротеиназа АССР-1, поверхностный антиген Ас-16, секретируемый белок 2 ASP-2, металлопротеаза 1 МТР-1, ингибитор аспартилпротеазы API-1, ассоциированный с поверхностью антиген SAA-1, ассоциированный с поверхностью антиген SAA-2, специфичный для взрослых секретируемый фактор Ха, ингибирующий сериновую протеазу антикоагулянт АР, катепсин D-подобная аспарагиновая протеаза ARR-1, глутатион-S-трансфераза GST, аспарагиновая протеаза APR-1, ацетилхолинэстераза AChE (Ancylostoma duodenale и Necator americanus, анкилостомоз); белок NS1, белок NP1, белок VP1, белок VP2, белок VP3 (бокавирус человека (HBoV), инфекция, вызываемая бокавирусом человека); основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, MSP вариант SGV1, MSP вариант SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAP1, основной антигенный белок MAP1-2, основной антигенный белок MAP1B, основной антигенный белок MAP1-3, Erum2510-кодирующий белок, белок GroEL, белок GroES, основные белки наружной мембраны 30 кДа, белок GE 100 кДа, белок GE 130 к Да, белок GE 160 кДа (Ehrlichia ewingii, эрлихиоз человека, вызванный ewingii); основные поверхностные белки 1-5 (MSP1a, MSP1b, MSP2, MSP3, MSP4, MSP5), белки системы секреотина типа IV VirB2, VirB7, VirB11, VirD4 (Anaplasma phagocytophilum, гранулоцитарный анаплазмоз человека (HGA)); белок NS1, малый гидрофобный белок NS2, SH-белок, белок слияния F, гликопротеин G, матриксный белок М, матриксный белок М2-1, матриксный белок М2-2, фосфопротеин Р, нуклеопротеин N, полимераза L (метапневмовирус человека (hMPV), инфекция, вызываемая метапневмовирусом человека); основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, MSP вариант SGV1, MSP вариант SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAP1, основной антигенный белок MAP1-2, основной антигенный белок MAP1B, основной антигенный белок МАР1-3, Erum2510-кодирующий белок, белок GroEL, белок GroES, 30-кДа основные белки наружной мембраны, белок GE 100 кДа, белок GE 130 кДа, белок GE 160 кДа (Ehrlichia chaffeensis, моноцитарный эрлихиоз человека); белок репликации Е1, регуляторный белок Е2, белок Е3, белок Е4, белок Е5, белок Е6, белок Е7, белок Е8, основной капсидный белок L1, минорный капсидный белок L2 (вирус папилломы человека (HPV), инфекция, вызываемая вирусом папилломы человека (HPV)); белок слияния F, гемагглютинин-нейраминидаза HN, гликопротеин G, матриксный белок М, фосфопротеин Р, нуклеопротеин N, полимераза L (вирусы парагриппа человека (HPIV), инфекция, вызываемая вирусом парагриппа человека); гемагглютинин НА, нейраминидаза NA, нуклеопротеин NP, белок M1, белок М2, белок NS1, полимеразу комплекс PA, РВ1, РВ2, белок ядерного экспорта NEP (семейство Orthomyxoviridae, грипп (острое респираторное заболевание)); геномный полипротеин, белок Е, белок М, капсидный белок С (вирус японского энцефалита, японский энцефалит); токсин RTX, пили типа IV, основная субъединица пилуса PilA, факторы регуляции транскрипции PilS и PilR, белок сигма54, белки наружной мембраны (Kingella kingae, инфекция, вызываемая Kingella kingae); прионный белок (прион куру, куру); нуклеопротеин N, полимераза L, белок матрикса Z, гликопротеин CP (вирус Ласса, лихорадка Ласса); пептидогликан-ассоциированный липопротеин PAL, шаперонин Cpn60 60 кДа (groEL, HspB), пилин типа IV PilE, белок наружной мембраны MIP, основной белок наружной мембраны MompS, цинковая металлопротеиназа MSP (Legionella pneumophila, легионеллез (болезнь легионеров, лихорадка Понтиак)); нуклеаза Р4, белок WD, рибонуклеотидредуктаза М2, поверхностный мембранный гликопротеин Pg46, цистеинпротеиназа CP, регулируемый глюкозой белок 78 GRP-78, специфичный для стадии S антиген-подобный белок А2, АТФаза F1, бета-тубулин, белок теплового шока 70 Hsp70, KMP-11, гликопротеин GP63, белок ВТ1, нуклеозидгидролаза NH, белок клеточной поверхности В1, рибосомный белок Р1-подобный белок Р1, стерол-24-с-метилтрансфераза SMT, LACK-белок, гистон H1, белок SPB1, тиолспецифичный антиоксидант TSA, белковый антиген STI1, сигнальная пептидаза SP, гистон Н2В, поверхностный антиген PSA-2, цистеинпротеиназа b Cpb (род Leishmania, лейшманиоз); основной мембранный белок I, богатый серином антиген 45 кДа, шаперонин GroES 10 кДа, HSP-антиген, аминооксононаноатсинтаза AONS, белковая рекомбиназа A RecA, ацетил/пропионил-кофермент А-карбоксилаза альфа, аланинрацемаза, шаперонин 2 60 кДа, ESAT-6-подобный белок ЕсхВ (L-ESAT-6), белок Lsr2, белок ML0276, гепарин-связывающий гемагглютинин НВНА, белок теплового шока 65 Hsp65, mycP1- или ML0041-кодирующий белок, htrA2- или ML0176-кодирующий белок, htrA4- или ML2659-кодирующий белок, gcp- или ML0379-кодирующий белок, clpC- или ML0235-кодирующий белок (Mycobacterium leprae и Mycobacterium lepromatosis, лепра), белок наружной мембраны LipL32, мембранный белок LIC10258, мембранный белок LP30, мембранный белок LIC12238, Ompa-подобный белок Lsa66, поверхностный белок LigA, поверхностный белок LigB, основной белок наружной мембраны OmpL1, белок наружной мембраны LipL41, белок LigAni, поверхностный белок LcpA, белок адгезии LipL53, белок наружной мембраны UpL32, поверхностный белок Lsa63, флагеллин FlaB1, мембранный липопротеин LipL21, мембранный белок pL40, поверхностный адгезин лептоспиры Lsa27, белок наружной мембраны OmpL36, белок наружной мембраны OmpL37, белок наружной мембраны OmpL47, белок наружной мембраны OmpL54, ацилтрансфераза LpxA (род Leptospira, лептоспироз); предшественник листериолизина О Hly (LLO), ассоциированный с инвазией белок lap (Р60), листериолизин-регулирующий белок PrfA, цинковая металлопротеиназа MpI, фосфатидилинозитол-специфичная фосфолипаза С PLC (PlcA, PlcB), О-ацетилтрансфераза Oat, пермеаза транспортера ABC-семейства lm.G_1771, белок адгезии LAP, рецептор LAP Hsp60, адгезин LapB, гемолизин листериолизин О LLO, белок ActA, интерналин A InlA, белок InlB (Listeria monocytogenes, листериоз); наружный поверхностный белок A OspA, наружный поверхностный белок OspB, наружный поверхностный белок OspC, декорин-связывающий белок A DbpA, декорин-связывающий белок В DbpB, коровый белок флагеллярного филамента 41 кДа Fla, основный мембранный белок А BmpA (иммунодоминантный антиген Р39), предшественник липопротеина наружной поверхности 22 кДа (антиген IPLA7), вариабельный липопротеин поверхности vlsE (как правило, Borrelia burgdorferi и другие виды Borrelia, болезнь Лайма (боррелиоз Лайма)); подобный гомологу аллергена яда белок VAL-1, преобладающий личиночный транскрипт ALT-1, преобладающий личиночный транскрипт ALT-2, тиоредоксинпероксидаза ТРХ, гомолог аллергена веспид VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2 и N3), ассоциированный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-S-трансферазы GST, миозин, гомолог аллергена веспид VAH, коллагеназа 175 кДа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые кислые личиночные белки SLAP, хитиназа CHI-1, связывающий мальтозу белок МВР, гликолитический фермент фруктоза-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод генный продукт OvB20, онхоцистатин CPI-2, белок Сох-2 (Wuchereria bancrofti и Brugia malayi, лимфатический филяриотоз (элефантиаз)); гликопротеин GP, матриксный белок Z, полимераза L, нуклеопротеин N (вирус лимфоцитарного хориоменингита (LCMV), лимфоцитарный хориоменингит); тромбоспондин-родственный безымянный белок TRAP, поверхностный белок 2 спорозоита SSP2, антиген 1 апикальной мембраны АМА1, мембранный антиген роптрии RMA1, антиген с кислыми и основными повторами ABRA, проникающий в клетку белок PF, белок Pvs25, поверхностный белок 1 мерозоита MSP-1, поверхностный белок 2 мерозоита MSP-2, поверхностный антиген инфицированных кольцевыми формами эритроцитов RES А, антиген печеночной стадии 3 LSA-3, белок Eba-175, антиген 5 с сериновыми повторами SERA-5, белок CS циркумспорозоита, поверхностный белок 3 мерозоита MSP3, поверхностный белок 8 мерозоита MSP8, енолаза PF10, белок гепатоцитов и эритроцитов 17 кДа HEP17, мембранный белок 1 эритроцитов ЕМР1, белок Кбета, поверхностный белок мерозоита 4/5 MSP 4/5, белок теплового шока Hsp90, богатый глутаматом белок GLURP, поверхностный белок мерозоита 4 MSP-4, белок STARP, предшественник антигена, родственного белку циркумспорозоита CRA (род Plasmodium, малярия); нуклеопротеин N, ассоциированный с мембраной белок VP24, минорный нуклеопротеин VP30, кофактор полимеразы VP35, полимераза L, матриксный белок VP40, оболочечный гликопротеин GP (вирус Марбург, геморрагическая лихорадка Марбург (MHF)); белок С, матриксный белок М, фосфопротеин Р, неструктурный белок V, гликопротеин гемагглютинина Н, полимераза L, нуклеопротеин N, белок слияния F (вирус кори, корь); представители семейства транспортеров ABC (LolC, ОррА и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC Е, флагеллин FliC, белок А внутриклеточной подвижности Burkholderia A BimA, бактериальный фактор элонгации-Tu EF-Tu, OmpA-подобный белок 17 кДа, boaA-кодирующий белок, boaB-кодирующий белок (Burkholderia pseudomallei, мелиоидоз (болезнь Уитмора)); белки пилины, минорная ассоциированная с пилином субъединица pilC, основная субъединица пилина и варианты pilE, pilS, белок вариации фаз porA, порин В PorB, белок TraD, антиген наружной мембраны Neisseria Н.8, антиген 70 кДа, основной белок наружной мембраны PI, белки наружной мембраны PIA и PIB, W-антиген, поверхностный белок A NspA, трансферрин-связывающий белок TbpA, трансферрин-связывающий белок TbpB, РВР2, mtrR-кодирующий белок, ponA-кодирующий белок, пермеаза мембраны FbpBC, система белков FbpABC, белки LbpAB, белок наружной мембраны Ора, транспортер наружной мембраны FetA, подавляемый железом регулятор MpeR, фактор Н-связывающий белок fHbp, адгезин NadA, белок NhbA, репрессор FarR (Neisseria meningitidis, менингококковое заболевание); белок 66 кДа, белок 22 кДа (обычно Metagonimus yokagawai, метагонимоз); полярные белки трубочек (34, 75 и 170 кДа у Glugea, 35, 55 и 150 кДа у Encephalitozoon), кинезин-родственный белок, наибольшая субъединица РНК-полимеразы II, сходная с интегральным мембранным белком YIPA, белок 1 против сайленсинга, фактор транскрипции теплового шока HSF, протеинкиназа, тимидинкиназа, NOP-2-подобный ядрышковый белок (Microsporidia phylum, микроспоридиоз); CASP8 и FADD-подобный регулятор апоптоза, глутатионпероксидаза GPX1, РНК-геликаза NPH-II NPH2, каталитическая субъединица поли(А)-полимеразы PAPL, основной оболочечный белок P43K, субъединица 70 кДа раннего фактора транскрипции VETFS, субъединица 82 кДа раннего фактора транскрипции VETFL, металлоэндопептидаза G1-типа, нуклеозидтрифосфатаза I NPH1, подобный белку репликации А28 MC134L, субъединица 7 кДа РНК-полимеразы RPO7 (вирус контагиозного моллюска (MCV), контагиозный моллюск (МС)); матриксный белок М, фосфопротеин P/V, малый гидрофобный белок SH, нуклеопротеин N, белок V, гликопротеин слияния F, гемагглютинин-нейраминидаза HN, РНК-полимераза L (вирус эпидемического паротита, эпидемический паротит); белки наружной мембраны ОМ, антиген клеточной поверхности OmpA, антиген клеточной поверхности OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, внутрицитоплазматический белок D, белок поверхностного слоя кристаллина SLP, защитный поверхностный белок-антиген SPA (Rickettsia typhi, мышиный тиф (эндемический тиф)); адгезин Р1, адгезин Р30, белок p116, белок Р40, белок цитоскелета HMW1, белок цитоскелета HMW2, белок цитоскелета HMW3, MPN152-кодирующий белок, MPN426-кодирующий белок, MPN456-кодирующий белок, MPN-500-кодирующий белок (Mycoplasma pneumoniae, пневмония, вызываемая Mycoplasma pneumonia); NocA, зависимый от железа регуляторный белок, VapA, VapD, VapF, VapG, казеннолитическая протеаза, ассоциированный с кончиком филамента белок 43 кДа, белок Р24, белок Р61, белок 15 кДа, белок 56 кДа (как правило, Nocardia asteroides и другие виды Nocardia, нокардиоз); белок, подобный гомологу аллергена яда VAL-1, преобладающий личиночный транскрипт ALT-1, преобладающий личиночный транскрипт ALT-2, тиоредоксинпероксидаза ТРХ, гомолог аллергена веспид VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2 и N3), ассоциированный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-S-трансферазы GST, миозин, гомолог аллергена веспид VAH, коллагеназа 175 кДа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые личиночные кислые белки SLAP, хитиназа CHI-1, связывающий мальтозу белок МВР, гликолитический фермент фруктоза-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод генный продукт OvB20, онхоцистатин CPI-2, СОХ-2 (Onchocerca volvulus, онхоцеркоз (речная слепота)); секретируемый гликопротеин 43 кДа, гликопротеин gpO, гликопротеин gp75, антиген Pb27, антиген Pb40, белок теплового шока Hsp65, белок теплового шока Hsp70, белок теплового шока Hsp90, белок Р10, триозафосфатизомераза TPI, N-ацетилглюкозамин-связывающий лектин паракокцин, белок Pb28 28 кДа (Paracoccidioides brasiliensis, паракокцидиоидомикоз (южно-американский бластомикоз)); круципаин-подобная цистеиновая протеаза Pw28CCP 28 кДа (как правило, Paragonimus westermani и другие виды Paragonimus, парагонимоз); белок наружной мембраны OmpH, белок наружной мембраны Omp28, белок РМ1539, белок РМ0355, белок РМ1417, репарационный белок MutL, белок BcbC, белок РМ0305, формиатдегидрогеназа-N, белок РМ0698, белок РМ1422, ДНК-гираза, липопротеин PlpE, адгезивный белок Ср39, рецептор системы захвата гема HasR, капсулярный белок 39 кДа, регулируемый железом ОМР IROMP, белок наружной мембраны OmpA87, белок фимбрий Ptf, белок субъединицы фимбрий PtfA, трансферрин-связывающий белок TbpI, фермент эстераза MesA, токсин Pasteurella multocida РМТ, адгезивный белок Ср39 (род Pasteurella, пастереллез); «филаментный гемагглютинин FhaB, аденилатциклаза СуаА, предшественник субъединицы 4 коклюшного токсина PtxD, предшественник пертактина Prn, субъединица 1 токсина PtxA, белок Cpn60, белок brkA, предшественник субъединицы 2 коклюшного токсина PtxB, предшественник субъединицы 3 коклюшного токсина PtxC, предшественник субъединицы 5 коклюшного токсина PtxE, пертактин Prn, белок Fim2, белок Fim3» (Bordetella pertussis, коклюш («лающий» кашель)); «F1 капсульный антиген, ассоциированный с вирулентностью антиген V, секретируемый эффекторный белок LcrV, V-антиген, протеаза наружной мембраны Pla, секретируемый эффекторный белок YopD, предполагаемая секретируемая протеинтирозинфосфатаза YopH, основная субъединица комплекса иглы YscF, протеинкиназа YopO, предполагаемый белок аутотранспортер YapF, АВС-транспортер внутренней мембраны YbtQ (Irp7), предполагаемый сахар-связывающий белок YPO0612, белок теплового шока 90 HtpG, предполагаемый белок сульфатазы YdeN, белок-носитель липопротеина наружной мембраны LolA, шаперон секреции YerA, предполагаемый липопротеин YPO0420, белок активатор гемолизина HpmB, рецептор наружной мембраны пестицина/иерсиниябактина Psn, секретируемый эффекторный белок YopE, секретируемый эффекторный белок YopF, секретируемый эффекторный белок YopK, белок наружной мембраны YopN, белок наружной мембраны YopM, предшественник коагулазы/фибринолизина Pla»; (Yersinia pestis, чума); белок PhpA, поверхностный адгезин PsaA, пневмолизин Ply, АТФ-зависимая протеаза Clp, липоат-протеинлигаза LplA, заякоренный на поверхности клеточной стенки белок psrP, сортаза SrtA, глутамил-тРНК-синтетаза GltX, холин-связывающий белок А CbpA, пневмококковый поверхностный белок A PspA, пневмококковый поверхностный белок С PspC, 6-фосфоглюконатдегидрогеназа Gnd, связывающий железо белок PiaA, муреингидролаза LytB, протеон LytC, протеаза A1 (Streptococcus pneumoniae, пневмококковая инфекция); основной поверхностный белок В, кексин-подобная протеаза KEX1, белок А12, антиген Р55 55 кДа, основной поверхностный гликопротеин Msg (Pneumocystis jirovecii, плазмаклеточная пневмония (РСР)); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (вирус полиомиелита, полиомиелит); белок Nfa1, эксендин-3, секреторная липаза, катепсин В-подобная протеаза, цистеинпротеаза, катепсин, пероксиредоксин, белок Cry1Ac (как правило, Naegleria fowleri, первичный амебный менингоэнцефалит (РАМ)); агнопротеин, большой Т-антиген, малый Т-антиген, основной капсидный белок VP1, минорный капсидный белок Vp2 (вирус JC, прогрессирующая многоочаговая лейкоэнцефалопатия); белок низкой отвечаемости на кальций Е LCrE, наружный хламидиальный белок N CopN, серин/треониновая протеинкиназа PknD, S-малонилтрансфераза ацил-переносящего белка FabD, связывающий одноцепочечную ДНК белок Ssb, основной белок наружной мембраны МОМР, белок наружной мембраны 2 Omp2, семейство полиморфных мембранных белков (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Pmp7, Pmp8, Pmp9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (Chlamydophila psittaci, орнитоз); белок наружной мембраны P1, белок теплового шока В HspB, пептидный транспортер АВС-семейства, GTP-связывающий белок, белок IcmB, рибонуклеаза R, фосфатаза SixA, белок DsbD, белок наружной мембраны TolC, ДНК-связывающий белок PhoB, АТФаза DotB, белок теплового шока В HspB, мембранный белок Com1, белок 28 кДа, ДНК-3-метиладенингликозидаза I, белок наружной мембраны OmpH, белок наружной мембраны AdaA, Т-белок системы расщепления глицина (Coxiella burnetii, Q-риккетсиоз); нуклеопротеин N, большой структурный белок L, фосфопротеин Р, матриксный белок М, гликопротеин G (вирус бешенства, бешенство); белок слияния F, нуклеопротеин N, матриксный белок М, матриксный белок М2-1, матриксный белок М2-2, фосфопротеин Р, малый гидрофобный белок SH, основной поверхностный гликопротеин G, полимераза L, неструктурный белок 1 NS1, неструктурный белок 2 NS2 (респираторно-синцитиальный вирус (RSV), инфекция, вызываемая респираторно-синцитиальным вирусом); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (риновирус, риновирусная инфекция); белки наружной мембраны ОМ, антиген клеточной поверхности OmpA, антиген клеточной поверхности OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, белок PS120, внутрицитоплазматический белок D, антиген защитного поверхностного белка SPA (род Rickettsia, инфекция, вызываемая риккетсиями); белки наружной мембраны ОМ, антиген клеточной поверхности OmpA, антиген клеточной поверхности OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, внутрицитоплазматический белок D (Rickettsia akari, риккетсиоз); оболочечный гликопротеин GP, полимераза L, нуклеопротеин N, неструктурный белок NSS (вирус лихорадки долины Рифт, лихорадка долины Рифт (RVF)); белки наружной мембраны ОМ, антиген клеточной поверхности OmpA, антиген клеточной поверхности OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCAT, внутрицитоплазматический белок D (Rickettsia rickettsii, пятнистая лихорадка Скалистых гор (RMSF)); «неструктурный белок 6 NS6, неструктурный белок 2 NS2, промежуточный капсидный белок VP6, внутренний капсидный белок VP2, неструктурный белок 3 NS3, РНК-зависимая РНК-полимераза L, белок VP3, неструктурный белок 1 NS1, неструктурный белок 5 NS5, наружный капсидный гликопротеин VP7, неструктурный гликопротеин 4 NS4, наружный капсидный белок VP4»; (ротавирус, ротавирусная инфекция); полипротеин Р200, гликопротеин Е1, гликопротеин Е2, белок NS2, капсидный белок С (вирус краснухи, краснуха); шаперонин GroEL (МорА), инозитолфосфатфосфатаза SopB, белок теплового шока HsIU, белок шаперон DNAJ, белок TviB, белок IroN, флагеллин FliC, белок инвазии SipC, гликопротеин gp43, белок наружной мембраны LamB, белок наружной мембраны PagC, белок наружной мембраны TolC, белок наружной мембраны NmpC, белок наружной мембраны FadL, транспортный белок SadA, трансфераза WgaP, эффекторные белки SifA, SteC, SseL, SseJ и SseF (род Salmonella, сальмонеллез); белок 14, неструктурный белок NS7b, неструктурный белок NS8a, белок 9b, «белок 3а, нуклеопротеин N, неструктурный белок NS3b, неструктурный белок NS6, белок 7а, неструктурный белок NS8b, мембранный белок М, малый мембранный оболочечный белок EsM, полипротеин репликазы 1а, гликопротеин шиловидных отростков S, полипротеин репликазы 1 ab»; (коронавирус SARS, SARS (тяжелый острый респираторный синдром)); сериновая протеаза, антиген 1 атипичного саркоптеса 1 ASA1, глутатион-S-трансферазы GST, цистеиновая протеаза, сериновая протеаза, аполипопротеин (Sarcoptes scabiei, чесотка); глутатион-S-трансферазы GST, парамиозин, гемоглобиназа SM32, основной антиген яйцеклеток, связывающий жирные кислоты белок 14 кДа Sm14, основной личиночный поверхностный антиген Р37, антиген тегумента 22,6 кДа, калпаин CANP, трифосфатизомераза Tim, поверхностный белок 9В, наружный капсидный белок VP2, интегральный мембранный белок 23 кДа Sm23, Cu,Zn-супероксиддисмутаза, гликопротеин Gp, миозин (род Schistosoma, шистосоматоз (бильгарциоз)); шаперонин 60 кДа, специфичный для типа антиген 56 кДа, пируватфосфатдикиназа, 4-гидроксибензоатоктапренилтрансфераза (Orientia tsutsugamushi, цуцугамуши); дегидрогеназа GuaB, белок инвазии Spa32, инвазин IpaA, инвазин IpaB, инвазин IpaC, инвазин IpaD, инвазин IpaH, инвазин IpaJ (род Shigella, шигеллез (бактериальная дизентерия)); белок Р53, гомолог белка вириона US10, регулятор транскрипции IE63, трансактиватор транскрипции IE62, протеаза Р33, белок альфа-трансиндуцирующего фактора 74 кДа, дезоксиуридин-5'-трифосфатнуклеотидгидролаза, трансактиватор транскрипции IE4, гомолог мембранного белка UL43, гомолог ядерного фосфопротеина UL3, гомолог ядерного белка UL4, связывающий сайт начала репликации белок, мембранный белок 2, фосфопротеин 32, белок 57, фактор процессивности ДНК-полимеразы, портальный белок 54, ДНК-праймаза, гомолог белка тегумента UL14, гомолог белка тегумента UL21, гомолог белка тегумента UL55, гомолог субъединицы тройной терминазы UL33, гомолог субъединицы тройной терминазы UL15, капсид-связывающий белок 44, белок упаковки вириона 43 (вирус ветряной оспы (VZV), опоясывающий лишай (Herpes zoster)); укороченный гомолог 3-бета-гидрокси-5-ен-стероиддегидрогеназы, мембранный белок вириона А13, белок А19, белок А31, укороченный гомолог белка A35, гомолог белка А37.5, белок А47, белок А49, белок А51, семафорин-подобный белок А43, ингибитор сериновой протеиназы 1, ингибитор сериновой протеиназы 2, ингибитор сериновой протеиназы 3, белок А6, белок В15, белок С1, белок С5, белок С6, белок F7, белок F8, белок F9, белок F11, белок F14, белок F15, белок F16 (Variola major или Variola minor, натуральная оспа (оспа)); адгезин/гликопротеин gp70, протеазы (Sporothrix schenckii, споротрихоз); связывающий железо гема белок IsdB, коллаген адгезин Cna, фактор агглютинации A ClfA, белок МесА, фибронектин-связывающий белок A FnbA, энтеротоксин типа A EntA, энтеротоксин типа В EntB, энтеротоксин типа С EntC1, энтеротоксин типа С EntC2, энтеротоксин типа D EntD, энтеротоксин типа Е EntE, токсин-1 синдрома токсического шока TSST-1, стафилокиназа, пенициллин-связывающий 2а-белок РВР2а (МесА), секреторный антиген SssA (род Staphylococcus, например, spp. aureus, стафилококковое пищевое отравление); железо-связывающий белок гема IsdB, коллаген-адгезин Cna, фактор агглютинации A ClfA, белок МесА, фибронектин-связывающий белок А FnbA, энтеротоксин типа A EntA, энтеротоксин типа В EntB, энтеротоксин типа С EntC1, энтеротоксин типа С EntC2, энтеротоксин типа D EntD, энтеротоксин типа Е EntE, токсин-1 синдрома токсического шока TSST-1, стафилокиназа, пенициллин-связывающий 2а-белок РВР2а (МесА), секреторный антиген SssA (род Staphylococcus, стафилококковая инфекция); антиген Ss-IR, антиген NIE, стронгиластацин, Na+-K+-АТФаза Sseat-6, тропомизин SsTmy-1, белок LEC-5, антиген Р5 41 кДа, личиночный белок 41 кДа, личиночный белок 31 кДа, личиночный белок 28 кДа (Strongyloides stercoralis, стронгилоидоз); глицерофосфодиэфирфосфодиэстераза GlpQ (Gpd), белок наружной мембраны TmpB, белок Тр92, антиген TpF1, содержащий повторы белок Tpr, содержащий повторы белок F TprF, содержащий повторы белок G TprG, содержащий повторы белок I TprI, содержащий повторы белок J TprJ, содержащий повторы белок K TprK, мембранный белок трепонем А TmpA, липопротеин, Трр15 15 кДа, мембранный антиген 47 кДа, миниферритин TpF1, адгезин Тр0751, липопротеин ТР0136, белок TpN17, белок TpN47, белок наружной мембраны ТР0136, белок наружной мембраны ТР0155, белок наружной мембраны ТР0326, белок наружной мембраны ТР0483, белок наружной мембраны ТР0956 (Treponema pallidum, сифилис); катепсин L-подобные протеазы, 53/25 кДа антиген, представители семейства 8 кДа, белок цистицерка с подобной маргинальному трипсину активностью TsAg5, белок онкосфер TSOL18, белок онкосфер TSOL45-1А, лактатдегидрогеназа A LDHA, лактатдегидрогеназа В LDHB (род Taenia, тениоз); столбнячный токсин TetX, столбнячный токсин С ТТС, белок S-слоя 140 кДа, бета-субъединица флавопротеина СТ3, фосфолипаза (лецитиназа), белок-транспортер фосфора HPr (Clostridium tetani, столбняк (тризм челюсти)); геномный полипротеин, белок Е, белок М, капсидный белок С (вирус клещевого энцефалита (TBEV), клещевой энцефалит); антиген 58 кДа, антигены 68 кДа, экскреторный-секреторный антиген личинок Toxocara TES, гликопротеин, гликопротеин TES-70 32 кДа, гликопротеин GP31, экскреторный-секреторный антиген TcES-57, антиген околокишечной жидкости Ре, растворимые антигены экстракта Ех, экскреторные/секреторные личиночные антигены ES, антиген TES-120, полипротеиновый аллерген ТВА-1, катепсин L-подобная цистеиновая протеаза c-cpl-1, белок 26 кДа (Toxocara canis или Toxocara cati, токсокароз (глазная форма синдрома мигрирующей личинки (OLM) и висцеральная форма синдрома мигрирующей личинки (VLM))); белки микронем (MIC1, MIC2, MIC3, MIC4, MIC5, MIC6, MIC7, MIC8), белок роптрии Rop2, белки роптрии (Rop1, Rop2, Rop3, Rop4, Rop5, Rop6, Rop7, Rop16, Rop17), белок SR1, поверхностный антиген P22, основной антиген р24, основной поверхностный антиген р30, белки плотных гранул (GRA1, GRA2, GRA3, GRA4, GRA5, GRA6, GRA7, GRA8, GRA9, GRA10), антиген 28 кДа, поверхностный антиген SAG1, SAG2-родственный антиген, нуклеозидтрифосфатаза 1, нуклеозидтрифосфатаза 2, белок Stt3, белок, содержащий HesB-подобный домен, ромбоид-подобная протеаза 5, токсомепсин 1 (Toxoplasma gondii, токсоплазмоз); секретируемый гликопротеин 43 кДа, секретируемый гликопротеин 53 кДа, парамиозин, антиген Ts21, антиген Ts87, антиген р46000, антигены TSL-1, кавеолин-1 CAV-1, личиночный антиген у новорожденных 49 кДа, гомолог просапозина, сериновая протеаза, ингибитор сериновой протеиназы, гликопротеин Gp45 45 кДа (Trichinella spiralis, трихинеллез); Myb-подобные факторы транскрипции (Myb1, Myb2, Myb3), белок адгезии АР23, белок адгезии АР33, белок адгезин АР33-3, адгезины АР51, адгезин АР65, белок адгезии АР65-1, альфа-актинин, кинезин-ассоциированный белок, тенеурин, протеиназа 62 кДа, субтилизин-подобная сериновая протеаза SUB1, ген 3 цистеиновой протеиназы 3 СР3, альфа-енолаза Eno1, цистеиновая протеиназа СР30, белки теплового шока (Hsp70, Hsp60), иммуногенный белок Р270, (Trichomonas vaginalis, трихомоноз); бета-тубулин, белок 47 кДа, секреторная лейкоцитарно-подобная протеиназа-1 SLP-1, белок ТТ50 50 кДа, антиген 17 кДа, белок 43/47 кДа (Trichuris trichiura, трихоуроз (инфекция, вызываемая власоглавом)); белок ESAT-6 (EsxA), фильтрующийся антиген EsxB, секретируемый антиген 85-В FBPB 10 кДа, фибронектин-связывающий белок А FbpA (Ag85A), сериновая протеаза РерА, белок РРЕ-семейства РРЕ18, фибронектин-связывающий белок D FbpD, иммуногенный белок МРТ64, секретируемый белок МРТ51, каталаза-пероксидаза-пероксинитритаза Т KATG, периплазматический фосфат-связывающий липопротеин PSTS3 (РВР-3, Phos-1), регулируемый железом гепарин-связывающий гемагглютинин Hbha, белок РРЕ-семейства РРЕ14, белок РРЕ-семейства РРЕ68, белок Mtb72F, белок Ара, иммуногенный белок МРТ63, периплазматический фосфат-связывающий липопротеин PSTS1 (РВР-1), молекулярный шаперон DnaK, липопротеин клеточной поверхности Mpt83, липопротеин Р23, белок пермеазы системы транспорта фосфата pstA, антиген 14 кДа, фибронектин-связывающий белок С FbpC1, аланиндегидрогеназа ТВ43, глутаминсинтетаза 1, белок ESX-1, белок CFP10, белок ТВ10.4, белок МРТ83, белок МТВ12, белок МТВ8, Rpf-подобные белки, белок МТВ32, белок МТВ39, кристаллин, белок теплового шока HSP65, белок PST-S (как правило, Mycobacterium tuberculosis, туберкулез); белок наружной мембраны FobA, белок наружной мембраны FobB, локус внутриклеточного роста IgIC1, локус внутриклеточного роста IgIC2, аминотрансфераза Wbt1, шаперонин GroEL, основной мембранный белок TUL4 17 кДа, липопротеин LpnA, белок семейства хитиназы 18, изоцитратдегидрогеназа, белок семейства Nif3, белок гликозилирования пилей типа IV, белок наружной мембраны tolC, белок FAD-связывающего семейства, мультимерный белок наружной мембраны пилей типа IV, двукомпонентный сенсорный белок KdpD, белок шаперон DnaK, белок TolQ (Francisella tularensis, туляремия), !МВ-антиген, уреаза, белок GyrA, белок GyrB, белок ParC, белок ParE, липид-ассоциированные мембранные белки LAMP, тимидинкиназа TK, фосфолипаза PL-A1, фосфолипаза PL-A2, фосфолипаза PL-C, экспрессируемый на поверхности антиген 96 кДа»; (Ureaplasma urealyticum, инфекция, вызываемая Ureaplasma urealyticum); неструктурный полипротеин, структурный полибелок, капсидный белок CP, белок Е1, белок Е2, белок Е3, протеаза Р1, протеаза Р2, протеаза Р3 (вирус венесуэльского энцефалита лошадей, венесуэльский энцефалит лошадей); гликопротеин GP, матриксный белок Z, полимераза L, нуклеопротеин N (вирус Гуанарито, венесуэльская геморрагическая лихорадка); полибелок, белок Е, белок М, капсидный белок С, протеаза NS3, белок NS1, белок NS2A, белок AS2B, белок NS4A, белок NS4B, белок NS5 (вирус Западного Нила, лихорадка Западного Нила); капсидный белок CP, белок Е1, белок Е2, белок Е3, протеаза Р2 (вирус западного энцефалита лошадей, западный энцефалит лошадей); геномный полипротеин, белок Е, белок М, капсидный белок С, протеаза NS3, белок NS1, белок NS2A, белок AS2B, белок NS4A, белок NS4B, белок NS5 (вирус желтой лихорадки, желтая лихорадка); предполагаемый Yop-таргетирующий белок YobB, эффекторный белок YopD, эффекторный белок YopE, белок YopH, эффекторный белок YopJ, белок транслокации YopK, эффекторный белок YopT, белок YpkA, белок биосинтеза жгутиков FlhA, пептидаза М48, система выкачивания калия KefA, регулятор транскрипции RovA, адгезин lfp, белок транслокации LcrV, белок PcrV, инвазин Inv, белок наружной мембраны OmpF-подобный порин, адгезин YadA, протеинкиназа С, фосфолипаза С1, белок PsaA, маннозилтрансфераза-подобный белок WbyK, белок YscU, антиген YPMa (Yersinia pseudotuberculosis, инфекция, вызываемая Yersinia pseudotuberculosis); эффекторный белок YopB, шаперонин 60 кДа, белок WbcP, тирозин/протеинфосфатаза YopH, белок YopQ, энтеротоксин, галактозидпермеаза, редуктаза NrdE, белок YasN, инвазин Inv, адгезин YadA, порин наружной мембраны F OmpF, белок UspA1, белок EibA, белок Hia, белок клеточной поверхности AiI, шаперон SycD, белок LcrD, белок LcrG, белок LcrV, белок SycE, белок YopE, регуляторный белок ТуеА, белок YopM, белок YopN, белок YopO, белок YopT, белок YopD, протеаза ClpP, белок MyfA, белок FilA и белок PsaA (Yersinia enterocolitica, иерсиниоз), (в скобках указан конкретный патоген или семейство патогенов, из которого получен(ы) антиген(ы), и инфекционная болезнь, с которой ассоциирован антиген).
Таким образом, в одном из конкретных вариантов осуществления изобретения первая антигенная композиция и/или вторая антигенная композиция предназначена(ы) (или ее(их) применяют) для лечения или профилактики инфекции, вызываемой одним или несколькими указанными в настоящем описании патогенами; или она(и) предназначена(ы) (или ее(их) применяют) для лечения или профилактики состояния, нарушения или заболевания, ассоциированного с указанным патогеном.
Во всех объектах настоящего изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, которые применяют согласно настоящему изобретению, в альтернативном варианте могут представлять собой (например, их можно выделять, получать, или они могут иметь последовательность, гомологичную или являющуюся вариантом) аминокислотную последовательность из опухолевой или раковой клетки.
Понятие «опухоль» и «рак» должны быть очевидны обычному специалисту в данной области, и они относятся к количеству ткани, которая росла (или растет) аномально, и рак относится к злокачественной опухоли, т.е. группе заболеваний, включающих аномальный клеточный рост в сочетании со способностью внедряться или распространяться в другие части организма индивидуума. Однако не все опухоли являются злокачественными; доброкачественные опухоли не распространяются в другие части организма индивидуума. Таким образом, под понятие опухолевая клетка или раковая клетка подпадает клетка, которая содержится (или содержалась) в опухоли или раке соответственно, например, раковые клетки, которые образуют или приводят к развитию метастазов.
Таким образом, в некоторых вариантах осуществления изобретения в первой антигенной композиции и/или второй антигенной композиции аминокислотная последовательность по меньшей мере эпитопа имеет происхождение из раковой клетки или ее гомолога, фрагмента или варианта. В некоторых указанных вариантах осуществления изобретения иммуногенный пептид или полипептид, входящий в первую антигенную композицию или кодируемый конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, входящей во вторую антигенную композицию, имеет происхождение из раковой клетки или ее гомолога, фрагмента или варианта.
Во всех указанных вариантах осуществления изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид из опухолевой или раковой клетки можно обозначать также как «опухолевый антиген».
Опухолевые антигены предпочтительно локализованы на поверхности (опухолевой) клетки, характерной для опухоли млекопитающего, прежде всего человека (например, при системных опухолевых болезнях или солидных опухолях). Опухолевые антигены можно выбирать также из белков, для которых характерна сверхэкспрессия в опухолевых клетках по сравнению со здоровой клеткой. Кроме того, опухолевые антигены включают также антигены, экспрессируемые в клетках, которые сами не являются (не были) (или исходно не были сами) перерожденными, но ассоциированы с предполагаемой опухолью. Антигены, связанные с сосудами, которые поставляют кровь в опухоль, или с их (ре)форматированием, в частности антигены, которые ассоциированы с неоваскуляризацией, например, факторы роста, такие как VEGF, bFGF и т.д., подпадают также под объем настоящего изобретения. К антигенам, ассоциированным с опухолью, относятся также антигены из клеток или тканей, как правило, окружающих опухоль. Кроме того, некоторые субстанции (как правило, белки или пептиды) экспрессируются у пациентов, страдающих (установленным или неустановленным) раковым заболеванием, и они присутствуют в повышенных концентрациях в общей воде организма у таких пациентов. Эти субстанции также подпадают под понятие «опухолевые антигены», однако в строгом смысле они не являются антигенами, т.е. индуцирующими иммунный ответ субстанциями. Класс опухолевых антигенов можно подразделять также на специфические для опухоли антигены (TSA) и ассоциированные с опухолью антигены (ТАА). TSA могут презентироваться только опухолевыми клетками и никогда нормальными «здоровыми» клетками. Они, как правило, образуются в результате специфической для опухоли мутации. ТАА, которые являются более общими, как правило, презентуются как опухолевыми, так и здоровыми клетками. Эти антигены распознаются, в результате чего антигенпрезентирующая клетка может разрушаться цитотоксическими Т-клетками. Кроме того, опухолевые антигены могут присутствовать также на поверхности опухоли в форме, например, мутантного рецептора. В этом случае они могут распознаваться антителами.
Кроме того, ассоциированные с опухолью антигены можно классифицировать как тканеспецифические антигены, которые называют также меланоцитспецифическими антигенами, раково-тестикулярными антигенами и опухольспецифическими антигенами. Под раково-тестикулярными антигенами, как правило, понимают пептиды или белки ассоциированных с зародышевой линией генов, которые могут активироваться в широком разнообразии опухолей. Человеческие раково-тестикулярные антигены можно подразделять также на антигены, которые кодируются Х-хромосомой, так называемые СТ-Х-антигены, и антигены, которые не кодируются Х-хромосомой, так называемые (не-Х-СТ-антигены). Раково-тестикулярные антигены, которые кодируются X-хромосомой, включают, например, семейство генов антигенов меланомы, так называемое MAGE-семейство. Гены MAGE-семейства можно охарактеризовать по наличию домена гомологии MAGE (MHD). Каждый из указанных антигенов, т.е. меланоцитспецифических антигенов, раково-тестикулярных антигенов и опухольспецифических антигенов, может вызывать аутологичные клеточные и гуморальные иммунные ответы. Следовательно, опухолевый антиген, кодируемый предлагаемой в изобретении нуклеотидной последовательностью, предпочтительно представляет собой меланоцитспецифический антиген, раково-тестикулярный антиген или опухольспецифический антиген, предпочтительно он может представлять собой СТ-Х-антиген, не-Х-СТ-антиген, партнер, связывающий СТ-Х-антиген, или партнер, связывающий не-Х-СТ-антиген, или опухольспецифический антиген, более предпочтительно СТ-Х-антиген, партнер, связывающий не-Х-СТ-антиген, или опухольспецифический антиген. Наиболее предпочтительные опухолевые антигены выбирают из перечня, включающего 5Т4, 707-АР, 9D7, AFP, AlbZIP HPG1, альфа-5-бета-1-интегрин, альфа-5-бета-6-интегрин, альфа-актинин-4/m, альфа-метилацил-кофермент А-рацемазу, ART-4, ARTC1/m, B7H4, BAGE-1, BCL-2, bcr/abl, бета-катенин/m, BING-4, BRCA1/m, BRCA2/m, CA 15-3/CA 27-29, CA 19-9, CA72-4, CA125, кальретикулин, CAMEL, CASP-8/m, катепсин В, катепсин L, CD19, CD20, CD22, CD25, CDE30, CD33, CD4, CD52, CD55, CD56, CD80, CDC27/m, CDK4/m, CDKN2A/m, CEA, CLCA2, CML28, CML66, COA-1/m, коактозин-подобный белок, коллаген XXIII, COX-2, CT-9/BRD6, Cten, циклин B1, циклин D1, cyp-B, CYPB1, DAM-10, DAM-6, DEK-CAN, EFTUD2/m, EGFR, ELF2/m, EMMPRIN, EpCam, EphA2, EphA3, ErbB3, ETV6-AML1, EZH2, FGF-5, FN, Frau-1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE7b, GAGE-8, GDEP, GnT-V, gp100, GPC3, GPNMB/m, HAGE, HAST-2, гепсин, Her2/neu, HERV-K-MEL, HLA-A*0201-R17I, HLA-A11/m, HLA-A2/m, HNE, гомеобокс NKX3.1, HOM-TES-14/SCP-1, HOM-TES-85, HPV-E6, HPV-E7, HSP70-2M, HST-2, hTERT, iCE, IGF-1R, IL-13Ra2, IL-2R, IL-5, незрелый ламининовый рецептор, каллекреин-2, каллекреин-4, Ki67, KIAA0205, KIAA0205/m, KK-LC-1, K-Ras/m, LAGE-A1, LDLR-FUT, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A9, MAGE-A10, MAGE-A12, MAGE-B1, MAGE-B2, MAGE-B3, MAGE-B4, MAGE-B5, MAGE-B6, MAGE-B10, MAGE-B16, MAGE-B17, MAGE-C1, MAGE-C2, MAGE-C3, MAGE-D1, MAGE-D2, MAGE-D4, MAGE-E1, MAGE-E2, MAGE-F1, MAGE-H1, MAGEL2, маммоглобин A, MART-1/мелан-А, MART-2, MART-2/m, матриксный белок 22, MC1R, M-CSF, ME1/m, мезотелин, MG50/PXDN, MMP11, MN/CA IX-антиген, MRP-3, MUC-1, MUC-2, MUM-1/m, MUM-2/m, MUM-3/m, миозин класса I/m, NA88-A, N-ацетилглюкозаминилтрансферазу-V, Neo-PAP, Neo-PAP/m, NFYC/m, NGEP, NMP22, NPM/ALK, N-Ras/m, NSE, NY-ESO-B, NY-ESO-1, OA1, OFA-iLRP, OGT, OGT/m, OS-9, OS-9/m, остеокальцин, остеопонтин, p15, p190 минорный bcr-abl, p53, p53/m, PAGE-4, PAI-1, PAI-2, PAP, PART-1, PATE, PDEF, Pim-1-киназу, Pin-1, Pml/RAFальфа, РОТЕ, PRAME, PRDX5/m, простеин, протеиназу-3, PSA, PSCA, PSGR, PSM, PSMA, PTPRK/m, RAGE-1, RBAF600/m, RHAMM/CD168, RU1, RU2, S-100, SAGE, SART-1, SART-2, SART-3, SCC, SIRT2/m, Sp17, SSX-1, SSX-2/HOM-MEL-40, SSX-4, STAMP-1, STEAP-1, сурвивин, сурвивин-2В, SYT-SSX-1, SYT-SSX-2, TA-90, TAG-72, TARP, TEL-AML1, TGFбета, TGFбетаRII, TGM-4, TPI/m, TRAG-3, TRG, TRP-1, TRP-2/6b, TRP/INT2, TRP-p8, тирозиназу, UPA, VEGFR1, VEGFR-2/FLK-1 и WT1. Указанные опухолевые антигены предпочтительно можно выбирать из группы, состоящей из р53, СА125, EGFR, Her2/neu, hTERT, PAP, MAGE-A1, MAGE-А3, мезотелина, MUC-1, GP100, MART-1, тирозиназы, PSA, PSCA, PSMA, STEAP-1, VEGF, VEGFR1, VEGFR2, Ras, CEA или WT1, и более предпочтительно из PAP, MAGE-A3, WT1 и MUC-1. Указанные опухолевые антигены предпочтительно можно выбирать из группы, состоящей из MAGE-А1 (например, MAGE-A1, имеющий регистрационный номер М77481), MAGE-A2, MAGE-А3, MAGE-A6 (например, MAGE-A6, имеющий регистрационный номер NM_005363), MAGE-C1, MAGE-C2, мелан-А (например, мелан-А, имеющий регистрационный номер NM_005511), GP100 (например, GP100, имеющий регистрационный номер М77348), тирозиназы (например, тирозиназа, имеющая регистрационный номер NM_000372), сурвивина (например, сурвивин, имеющий регистрационный номер AF077350), СЕА (например, СЕА, имеющий регистрационный номер NM_004363), Her-2/neu (например, Her-2/neu, имеющий регистрационный номер M11730), WT1 (например, WT1, имеющий регистрационный номер NM_000378), PRAME (например, PRAME, имеющий регистрационный номер NM_006115), EGFRI (рецептор эпидермального фактора роста-1) (например, EGFRI (рецептор эпидермального фактора роста-1), имеющий регистрационный номер AF288738), MUC1, муцина-1 (например, муцин-1, имеющий регистрационный номер NM_002456), SEC61G (например, SEC61G, имеющий регистрационный номер NM_014302), hTERT (например, hTERT, имеющий регистрационный номер NM_198253), 5Т4 (например, 5Т4, имеющий регистрационный номер NM_006670), TRP-2 (например, TRP-2, имеющий регистрационный номер NM_001922), STEAP, PCA, PSA, PSMA и т.д.
Кроме того, опухолевые антигены могут включать также идиотипические антигены, Кроме того, опухолевые антигены могут включать также идиотипические антигены, ассоциированные с раковым или опухолевым заболеванием, прежде всего с лимфомой или ассоциированным с лимфомой заболеванием, где указанный идиотипический антиген представляет собой идиотип иммуноглобулина лимфоидной кровяной клетки или идиотип Т-клеточного рецептора лимфоидной кровяной клетки.
Опухолевые антигены, предназначенные для лечения раковых или опухолевых заболеваний, как правило, представляют собой белки, которые получают из организма млекопитающего, предпочтительно из организма человека. Их отбор для лечения индивидуума зависит от типа опухоли, подлежащей лечению, и профиля экспрессии индивидуальной опухоли. Человека, страдающего раком предстательной железы, например, предпочтительно лечат с использованием опухолевого антигена, который, как правило, экспрессируется (или сверхэкспрессируется) в карциноме предстательной железы или специфически сверхэкспрессируется у индивидуума, подлежащего лечению, например, любого из PSMA, PSCA и/или PSA.
В конкретных вариантах осуществления изобретения опухолевая или раковая клетка представляет собой клетку, которая присутствует (или присутствовала) при раковом или опухолевом заболевании, которое предпочтительно включает, например, острый лимфобластный лейкоз, острый миелоидный лейкоз, адренокортикальную карциному, связанные со СПИДом виды рака, связанную со СПИДом лимфому, рак анального канала, рак аппендикса, астроцитому, базальноклеточную карциному, рак желчных протоков, рак мочевого пузыря, рак кости, остеосаркому/злокачественную фиброзную гистиоцитому, глиому ствола головного мозга, опухоль головного мозга, астроцитому/злокачественную глиому мозжечка, эпендимому, медуллобластому, супратенториально расположенные примитивные нейроэктодермальные опухоли, глиому зрительных путей и гипоталамуса, рак молочной железы, бронхиальные аденомы/карциноиды, лимфому Беркитта, карциноидную опухоль у детей, карциноидную опухоль желудочно-кишечного тракта, карциному неизвестного происхождения, первичную лимфому центральной нервной системы, астроцитому мозжечка у детей, астроцитому/злокачественную глиому мозжечка у детей, рак шейки матки, различные виды детского рака, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, хронические миелопролиферативные нарушения, рак ободочной кишки, кожную Т-клеточную лимфому, дермапластическую мелкокругоклеточную опухоль, рак эндометрия, эпендимому, рак пищевода, саркому Юинга из семейства опухолей Юинга, опухоль из экстракраниальных зародышевых клеток у детей, опухоль из экстрагонадальных зародышевых клеток, рак внепеченочных желчных протоков, внутриглазную меланому, ретинобластому, рак желчного пузыря, гастральный рак (рак желудка), карциноидную опухоль желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (GIST), опухоль из экстракраниальных, экстрагонадальных или овариальных зародышевых клеток, гестационную трофобластическую опухоль, глиому ствола головного мозга, церебральную астроцитому у детей, глиому зрительного пути и гипоталамуса у детей, желудочный карциноид, волосатоклеточный лейкоз, рак головы и шеи, рак сердца, печеночно-клеточный (печени) рак, лимфому Ходжкина, рак гипофаринкса, глиому гипоталамуса и зрительного пути у детей, внутриглазную меланому, карциному из островковых клеток (эндокринная карцинома поджелудочных желез), саркому Капоши, рак почек (почечно-клеточный рак), рак гортани, лейкозы, острый лимфобластный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, волосатоклеточный лейкоз, рак губ и ротовой полости, липосаркому, рак печени, немелкоклеточный рак легких, мелкоклеточный рак легких, лимфомы, связанную со СПИДом лимфому, лимфому Беркитта, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинские лимфомы, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, злокачественную фиброзную гистиоцитому кости/остеосаркому, медуллобластому у детей, меланому, внутриглазную (глазную) меланому, карциному из клеток Меркеля, злокачественную мезотелиому взрослых, мезотелиому у детей, метастатический плоскоклеточный рак шеи с бессимптомным началом, рак ротовой полости, синдром детской множественной эндокринной неоплазии, множественную миелому/неоплазму из плазматических клеток, грибовидный микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, хронический миелогенный лейкоз, острый миелоидный лейкоз взрослых, острый миелоидный лейкоз у детей, множественную миелому (рак костного мозга), хронические миелопролиферативные нарушения, рак носовой полости и параназального синуса, носоглоточную карциному, нейробластому, оральный рак, ротоглоточный рак, остеосаркому/злокачественную фиброзную гистиоцитому кости, рак яичников, эпителиальный рак яичников (поверхностная стромально-эпителиальная опухоль), рак из овариальных зародышевых клеток, опухоль яичников с низким потенциальном злокачественности, рак поджелудочной железы, рак из островковых клеток поджелудочной железы, рак паранозального синуса и носовой полости, рак паращитовидной железы, рак пениса, рак глотки, феохромоцитому, пинеальную астроцитому, пинеальную герминому, пинеалобластому и супратенториально расположенные примитивные нейроэктодермальные опухоли у детей, аденому гипофиза, неоплазии из плазматических клеток/множественную миелому, плевролегочную бластому, первичную лимфому центральной нервной системы, рак предстательной железы, ректальный рак, почечно-клеточную карциному (рак почек), рак почечной лоханки и мочеточника, ретинобластому, рабдомиосаркому у детей, рак слюнных желез, саркому из семейства опухолей Юинга, саркому Капоши, саркому мягких тканей, саркому матки, синдром Сезари, рак кожи (не относящийся к меланоме), рак кожи (меланома), карцинома кожи из клеток Меркеля, рак тонкого кишечника, плоскоклеточную карциному, метастатический плоскоклеточный рак шеи с бессимптомным началом, супратенториально расположенную примитивную нейроэктодермальную опухоль у детей, тестикулярный рак, рак гортани, тимому у детей, тимому и карциному тимуса, рак щитовидной железы, рак щитовидной железы у детей, переходноклеточный рак почечной лоханки и мочеточника, гестационную трофобластическую опухоль, рак мочеиспускательного канала, рак эндометрия матки, саркому матки, вагинальный рак, глиому зрительного пути и гипоталамуса у детей, рак вульвы, макроглобулинемию Вальденстрема и опухоль Вильмса (рак почек) у детей.
В конкретных указанных вариантах осуществления изобретения опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
Таким образом, в другом конкретном варианте осуществления настоящего изобретения первая антигенная композиция и/или вторая антигенная композиция предназначена(ы) (или ее(их) применяют) для лечения или профилактики опухоли или рака (например, одного или нескольких из указанных в настоящем описании); или она(и) предназначена(ы) (или ее(их) применяют) для лечения или профилактики состояния, нарушения или заболевания, ассоциированного с
одной/одним или несколькими из опухолей или раков, указанных в настоящем описании.
Во всех объектах настоящего изобретения эпитоп, антиген, иммуногенный пептид и/или иммуногенный полипептид, применяемый в настоящем изобретении, в альтернативном варианте могут представлять собой (например, их можно выделять, получать, или они могут иметь последовательность, гомологичную или являющуюся вариантом) аминокислотную последовательность из аллергенного антигена или аутоиммунного аутоантигена или его фрагмента, варианта или производного.
Аллергенные антигены можно выбирать из антигенов, имеющих происхождение из различных источников, например, из животных, растений, грибов, бактерий и т.д. Источники аллергенов в этом контексте включают, например, травы, пыльцу, плесени, лекарственные средства или многочисленные факторы окружающей среды и т.д. Аллергенные антигены, как правило, принадлежат к разным классам соединений, таким как нуклеиновые кислоты и их фрагменты, белки или пептиды и их фрагменты, углеводы, полисахариды, сахара, липиды, фосфолипиды и т.д. В контексте настоящего изобретения наибольший интерес вызывают белковые или пептидные антигены и их фрагменты или эпитопы или нуклеиновые кислоты и их фрагменты, прежде всего нуклеиновые кислоты и их фрагменты, которые кодируют указанные белковые или пептидные антигены и их фрагменты или эпитопы.
Антигены, ассоциированные с аллергией или аллергическим заболеванием (аллергены или аллергенные антигены), предпочтительно имеют происхождение из источника, выбранного из перечня, включающего:
Acarus spp. (Аса s 1, Аса s 10, Аса s 10.0101, Аса s 13, Аса s 13.0101, Аса s 2, Аса s 3, Аса s 7, Аса s 8), Acanthocybium spp. (Аса so 1), Acanthocheilonema spp. (Аса v 3, Аса v 3.0101), Acetes spp. (Ace ja 1), Actinidia spp. (Act a 1, Act с 1, Act с 10, Act с 10.0101, Act с 2, Act с 4, Act с 5, Act с 5.0101, Act с 8, Act с 8.0101, Act с хитиназа, Act d 1, Act d 1.0101, Act d 10, Act d 10.0101, Act d 10.0201, Act d 11, Act d 11.0101, Act d 2, Act d 2.0101, Act d 3, Act d 3.0101, Act d 3.02, Act d 4, Act d 4.0101, Act d 5, Act d 5.0101, Act d 6, Act d 6.0101, Act d 7, Act d 7.0101, Act d 8, Act d 8.0101, Act d 9, Act d 9.0101, Act d хитиназа, Act e 1, Act e 5), Acyrthosiphon spp. (Асу pi 7, Асу pi 7.0101, Асу pi 7.0102), Adenia spp. (Ade v RIP), Aedes spp. (Aed a 1, Aed a 1.0101, Aed a 2, Aed a 2.0101, Aed a 3, Aed a 3.0101, Aed a 4, Aed a 7, Aed a 7.0101, Aed a 7.0102, Aed a 7.0103, Aed a 7.0104, Aed a 7.0105, Aed a 7.0106, Aed a 7.0107, Aed a 7.0108, Aed a 7.0109, Aed a 7.0110, Aed a 7.0111, Aed al 1, Aed al 3, Aed al 37 кДа, Aed v 37 кДа, Aed v 63 кДа), Aegilops spp. (Aeg ta 28, Aeg ta alpha_Gliadin, Aeg um 28, Aeg un 28), Aethaloperca spp. (Aet ro 1), Agropyron spp. (Agr с 7), Agrostis spp. (Agr ca 1, Agr ca 5, Agr g 1, Agr g 4, Agr s 5), Agrobacterium spp. (Agr sp CP4 EPSPS), Ailuropoda spp. (Ail me фосвитин, Ail me TCTP), Aix spp. (Aix ga 1, Aix sp 1), Aleuroglyphus spp. (Ale о 1, Ale о 10, Ale о 10.0101, Ale о 10.0102, Ale о 13, Ale о 14, Ale о 2, Ale о 20, Ale о 3, Ale о 5, Ale о 7, Ale о 8, Ale о 9), Allium spp. (All a 3, All а аллиинлиаза, All с 3, All с 30 кДа, All с 4, All с аллиинлиаза, All p аллиинлиаза, All s аллиинлиаза), Alnus spp. (Aln g 1, Aln g 1.0101, Aln g 1/Bet v 1/Cor a 1 TPC7, Aln g 1/Bet v 1/Cor a 1 TPC9, Aln g 2, Aln g 4, Aln g 4.0101), Alopochen spp. (Alo ae 1), Alopecurus spp. (Alo p 1, Alo p 5), Alternaria spp. (Alt a 1, Alt a 1.0101, Alt a 1.0102, Alt a 10, Alt a 10.0101, Alt a 12, Alt a 12.0101, Alt a 13, Alt a 13.0101, Alt a 2, Alt a 3, Alt a 3.0101, Alt a 4, Alt a 4.0101, Alt a 5, Alt a 5.0101, Alt a 6, Alt a 6.0101, Alt a 7, Alt a 7.0101, Alt a 70 кДа, Alt a 8, Alt a 8.0101, Alt a 9, Alt a MnSOD, Alt a NTF2, Alt a TCTP, Alt ar 1, Alt arg 1, Alt b 1, Alt bl 1, Alt br 1, Alt с 1, Alt ca 1, Alt се 1, Alt ch 1, Alt ci 1, Alt со 1, Alt cr 1, Alt ct 1, Alt cu 1, Alt су 1, Alt d 1, Alt du 1, Alt e 1, Alt et 1, Alt eu 1, Alt ga 1, Alt gr 1, Alt j 1, Alt l 1, Alt lo 1, Alt m 1, Alt me 1, Alt mi 1, Alt mo 1, Alt о 1, Alt p 1, Alt ph 1, Alt po 1, Alt ps 1, Alt r 1, Alt s 1, Alt se 1, Alt sm 1, Alt so 1, Alt su 1, Alt t 1, Alt te 1, Alt to 1), Amaranthus spp. (Ama r 2, Ama r 2.0101, Ama v 2, Ama v 2.0101, Ama v 2.0201), Ambrosia spp. (Amb a 1, Amb a 1.0101, Amb a 1.0201, Amb a 1.0202, Amb a 1.0301, Amb a 1.0302, Amb a 1.0303, Amb a 1.0304, Amb a 1.0305, Amb a 1.0401, Amb a 1.0402, Amb a 1.0501, Amb a 1.0502, Amb a 10, Amb a 10.0101, Amb a 3, Amb a 3.0101, Amb a 4, Amb a 4.0101, Amb a 5, Amb a 5.0101, Amb a 6, Amb a 6.0101, Amb a 7, Amb a 7.0101, Amb a 8, Amb a 8.0101, Amb a 8.0102, Amb a 9, Amb a 9.0101, Amb a 9.0102, Amb a CPI, Amb p 1, Amb p 5, Amb p 5.0101, Amb p 5.0201, Amb t 5, Amb t 5.0101, Amb t 8), Ammothea spp. (Amm h 7, Amm h 7.0101), Anadara spp. (Ana br 1), Ananas spp. (Ana с 1, Ana с 1.0101, Ana с 2, Ana с 2.0101, Ana с 2.0101 (MUXF3)), Anas spp. (Ana ca 1), Anarhichas spp. (Ana l 1), Anacardium spp. (Ana о 1, Ana о 1.0101, Ana о 1.0102, Ana о 2, Ana о 2.0101, Ana о 3, Ana о 3.0101), Anas spp. (Ana p 1, Ana p 2, Ana p 3), Anguilla spp. (Ang a 1, Ang j 1), Anisakis spp. (Ani s 1, Ani s 1.0101, Ani s 10, Ani s 10.0101, Ani s 11, Ani s 11.0101, Ani s 12, Ani s 12.0101, Ani s 2, Ani s 2.0101, Ani s 24 kD, Ani s 3, Ani s 3.0101, Ani s 4, Ani s 4.0101, Ani s 5, Ani s 5.0101, Ani s 6, Ani s 6.0101, Ani s 7, Ani s 7.0101, Ani s 8, Ani s 8.0101, Ani s 9, Ani s 9.0101, Ani s CCOS3, Ani s цитохром В, Ani s FBPP, Ani s NADHDS4L, Ani s NARaS, Ani s PEPB, Ani s тропонин), Annona spp. (Ann с хитиназа), Anopheles spp. (Ano da 17, Ano da 17.0101, Ano da 27, Ano da 27.0101, Ano da 7, Ano da 7.0101, Ano g 7, Ano g 7.0101), Anser spp. (Ans a 1, Ans a 2, Ans a 3, Ans in 1), Anthoxanthum spp. (Ant о 1, Ant о 1.0101, Ant о 12, Ant о 13, Ant о 2, Ant о 4, Ant о 5, Ant о 6, Ant о 7), Apis spp. (Api с 1, Api с 1.0101, Api с 10, Api с 2, Api с 4, Api d 1, Api d 1.0101, Api d 4, Api fl 4), Apium spp. (Api g 1, Api g 1.0101, Api g 1.0201, Api g 2, Api g 2.0101, Api g 3, Api g 3.0101, Api g 4, Api g 4.0101, Api g 5, Api g 5.0101, Api g 6, Api g 6.0101), Apis spp. (Api m 1, Api m 1.0101, Api m 10, Api m 10.0101, Api mil, Api m 11.0101, Api m 11.0201, Api m 13 кДа, Api m 2, Api m 2.0101, Api m 3, Api m 3.0101, Api m 4, Api m 4.0101, Api m 5, Api m 5.0101, Api m 6, Api m 6.0101, Api m 7, Api m 7.0101, Api m 8, Api m 8.0101, Api m 9, Api m 9.0101, Api m A1-A2, Api m A1-A2-A3, Api m аральбумин 1, Api m аральбумин 2, Api me 1, Api me 4), Arachis spp. (Ara d 2, Ara d 6, Ara f 3, Ara f 4, Ara h 1, Ara h 1.0101, Ara h 10, Ara h 10.0101, Ara h 10.0102, Ara h 11, Ara h 11.0101, Ara h 2, Ara h 2.0101, Ara h 2.0102, Ara h 2.0201, Ara h 2.0202, Ara h 3, Ara h 3.0101, Ara h 4, Ara h 4.0101, Ara h 5, Ara h 5.0101, Ara h 6, Ara h 6.0101, Ara h 7, Ara h 7.0101, Ara h 7.0201, Ara h 7.0202, Ara h 8, Ara h 8.0101, Ara h 8.0201, Ara h 9, Ara h 9.0101, Ara h 9.0201, Ara h агглютинин, Ara h олеозин 18 kD, Ara i 2, Ara i 6), Arabidopsis spp. (Ara t 3, Ara t 8, Ara t GLP), Archosargus spp. (Arc pr 1), Archaeopotamobius spp. (Arc s 8, Arc s 8.0101), Aequipecten spp. (Arg i 1), Argas spp. (Arg r 1, Arg r 1.0101), Ariopsis spp. (Ari fe 1), Armoracia spp. (Arm r HRP), Arrhenatherum spp. (Arr e 1, Arr e 5), Artemisia spp. (Art a 1, Art ар 1), Artemia spp. (Art fr 1, Art fr 1.0101, Art fr 5, Art fr 5.0101), Arthrobacter spp. (Art gl CO), Achorion spp. (Art gy 7), Artocarpus spp. (Art h 17kD, Art h 4), Arthrospira spp. (Art pl бета_фикоцианин), Artemisia spp. (Art v 1, Art v 1.0101, Art v 1.0102, Art v 1.0103, Art v 1.0104, Art v 1.0105, Art v 1.0106, Art v 1.0107, Art v 2, Art v 2.0101, Art v 3, Art v 3.0101, Art v 3.0201, Art v 3.0202, Art v 3.0301, Art v 4, Art v 4.0101, Art v 4.0201, Art v 47 кДа, Art v 5, Art v 5.0101, Art v 6, Art v 6.0101, Art v 60 кДа), Arthroderma spp. (Art va 4), Ascaris spp. (Asc l 3, Asc 1 3.0101, Asc l 3.0102, Asc l 34 кДа, Asc s 1, Asc s 1.0101, Asc s 3, Asc s 3.0101, Asc s GST), Aspergillus spp. (Asp aw Glucoamylase, Asp с 22, Asp f 1, Asp f 1.0101, Asp f 10, Asp f 10.0101, Asp f 11, Asp f 11.0101, Asp f 12, Asp f 12.0101, Asp f 13, Asp f 13.0101, Asp f 15, Asp f 15.0101, Asp f 16, Asp f 16.0101, Asp f 17, Asp f 17.0101, Asp f 18, Asp f 18.0101, Asp f 2, Asp f 2.0101, Asp f 22, Asp f 22.0101, Asp f 23, Asp f 23.0101, Asp f 27, Asp f 27.0101, Asp f 28, Asp f 28.0101, Asp f 29, Asp f 29.0101, Asp f 3, Asp f 3.0101, Asp f 34, Asp f 34.0101, Asp f 4, Asp f 4.0101, Asp f 5, Asp f 5.0101, Asp f 56 кДа, Asp f 6, Asp f 6.0101, Asp f 7, Asp f 7.0101, Asp f 8, Asp f 8.0101, Asp f 9, Asp f 9.0101, Asp f AfCalAp, Asp f AT_V, Asp f каталаза, Asp f хитозаназа, Asp f CP, Asp f DPPV, Asp f FDH, Asp f гамма_актин, Asp f глюкозидаза, Asp f GPI, Asp f GST, Asp f GT, Asp f IAO, Asp f IPMI, Asp f LPL1, Asp f LPL3, Asp f маннозидаза, Asp f MDH, Asp f PL, Asp f PUP, Asp f RPS3, Asp f SXR, Asp fl 13, Asp fl 13.0101, Asp fl 18, Asp fl 2, Asp fl 21, Asp fl 3, Asp fl 4, Asp fl 7, Asp fl 8, Asp fl 9, Asp me сеапроза (Seaprose), Asp n 14, Asp n 14.0101, Asp n 18, Asp n 18.0101, Asp n 25, Asp n 25.0101, Asp n 30, Asp n глюкоамилаза, Asp n гемицеллюлаза, Asp n пектиназа, Asp о 13, Asp о 13.0101, Asp о 21, Asp о 21.0101, Asp о 3, Asp о 4, Asp о 7, Asp о 8, Asp о лактаза, Asp о липаза, Asp ос 13, Asp r 1, Asp sa АР, Asp sp глюкоамилаза, Asp sp глюкозаоксидаза, Asp sp PL, Asp sp PME, Asp sy 13, Asp v 13, Asp v 13.0101, Asp v каталаза A, Asp v эндолаза, Asp v GAPDH, Asp v MDH, Asp v SXR), Asparagus spp. (Aspa о 1, Aspa о 1.01, Aspa о 1.02, Aspa о 17 кДа, Aspa о 4), Aspergillus spp. (Aspe ni 2, Aspe ni 3, Aspe ni 4, Aspe ni 7, Aspe ni 8, Aspe ni 9), Avena spp. (Ave s 1, Ave s 12, Ave s 13, Ave s 2, Ave s 4, Ave s 5, Ave s 7), Babylonia spp. (Bab ja 1), Bacillus spp. (Вас al субтилизин, Вас cl субтилизин, Вас l субтилизин, Вас li аА, Вас li субтилизин), Bactrocera spp. (Вас ol 27, Вас ol 27.0101), Bacillus spp. (Вас sp аА1, Вас sp аА3, Вас sp декарбоксилаза, Вас st amyM, Вас su субтилизин, Вас t Cry1Ab, Вас t Cry1Fa, Вас t Cry3Bb1, Вас t Cry9c), Bagre spp. (Bag ma 1), Batistes spp. (Bal ca 1), Balanus. spp. (Bal r 1, Bal r 1.0101), Beauveria spp. (Bea b Aid, Bea b Enol, Bea b f2, Bea b Hex), Bertholletia spp. (Ber e 1, Ber e 1.0101, Ber e 2, Ber e 2.0101), Beryx spp. (Ber sp 1), Betula spp. (Bet ab 1, Bet al 1, Bet ch 1, Bet со 1, Bet da 1, Bet gr 1, Bet hu 1, Bet le 1, Bet me 1, Bet n 1, Bet p 1, Bet pa 1, Bet po 1, Bet pu 1, Bet pu 2, Bet pu 4, Bet pu 6, Bet pu 7, Bet sc 1, Bet ut 1, Bet v 1, Bet v 1 B1-B1-B1, Bet v 1 fv Mai 4x, Bet v 1.0101, Bet v 1.0102, Bet v 1.0103, Bet v 1.0201, Bet v 1.0301, Bet v 1.0401, Bet v 1.0402, Bet v 1.0501, Bet v 1.0601, Bet v 1.0602, Bet v 1.0701, Bet v 1.0801, Bet v 1.0901, Bet v 1.1001, Bet v 1.1101, Bet v 1.1201, Bet v 1.1301, Bet v 1.1401, Bet v 1.1402, Bet v 1.1501, Bet v 1.1502, Bet v 1.1601, Bet v 1.1701, Bet v 1.1801, Bet v 1.1901, Bet v 1.2001, Bet v 1.2101, Bet v 1.2201, Bet v 1.2301, Bet v 1.2401, Bet v 1.2501, Bet v 1.2601, Bet v 1.2701, Bet v 1.2801, Bet v 1.2901, Bet v 1.3001, Bet v 1.3101, Bet v 2, Bet v 2.0101, Bet v 3, Bet v 3.0101, Bet v 4, Bet v 4.0101, Bet v 6, Bet v 6.0101, Bet v 6.0102, Bet v 7, Bet v 7.0101, Bet v 8, Bet v глюканаза), Beta spp. (Beta v 1, Beta v 1.0101, Beta v 2, Beta v 2.0101), Blattella spp. (Bla g 1, Bla g 1.0101, Bla g 1.0102, Bla g 1.0103, Bla g 1.0201, Bla g 1.0202, Bla g 2, Bla g 2.0101, Bla g 2.0201, Bla g 36 кДа, Bla g 4, Bla g 4.0101, Bla g 4.0201, Bla g 5, Bla g 5.0101, Bla g 5.0201, Bla g 6, Bla g 6.0101, Bla g 6.0201, Bla g 6.0301, Bla g 7, Bla g 7.0101, Bla g 8, Bla g 8.0101, Bla g 9, Bla g энолаза, Bla g GSTD1, Bla g RACK1, Bla g TPI, Bla g Trypsin, Bla g вителлогенин), Blatta spp. (Bla о 1, Bla о 7), Blomia spp. (Bio t 1, Bio t 1.0101, Bio t 1.0201, Bio t 10, Bio t 10.0101, Blot 10.0102, Blot 11, Blot 11.0101, Blot 12, Blot 12.0101, Blot 12.0102, Bio t 13, Bio t 13.0101, Bio t 14, Bio t 15, Bio t 18, Bio t 19, Bio t 19.0101, Bio t 2, Bio t 2.0101, Bio t 2.0102, Bio t 2.0103, Bio t 20, Bio t 21, Bio t 21.0101, Bio t 3, Bio t 3.0101, Bio 14, Bio t 4.0101, Bio t 5, Bio t 5.0101, Bio t 6, Bio t 6.0101, Bio t 7, Bio t 8, Bio t 9, Bio t HSP70), Bombus spp. (Bom ar 4, Bom hy 4, Bom p 1, Bom p 1.0101, Bom p 2, Bom p 3, Bom p 4, Bom p 4.0101, Bom t 1, Bom t 1.0101, Bom t 4, Bom t 4.0101), Bombyx spp. (Bomb m 1, Bomb m 1.0101, Bomb m 7, Bomb m 7.0101, Bomb m 7.0102, Bomb m 7.0103, Bomb m 7.0104, Bomb m 7.0105, Bomb m 7.0106), Boophilus spp. (Boo m 1, Boo m 7, Boo m 7.0101), Bos spp. (Bos d 2, Bos d 2.0101, Bos d 2.0102, Bos d 2.0103, Bos d 3, Bos d 3.0101, Bos d 4, Bos d 4.0101, Bos d 5, Bos d 5.0101, Bos d 5.0102, Bos d 6, Bos d 6 (MDA), Bos d 6.0101, Bos d 7, Bos d 7.0101, Bos d 8, Bos d 8 альфаS1, Bos d 8 альфаS2, Bos d 8 бета, Bos d 8 каппа, Bos d альфа2I, Bos d альфа2I.0101, Bos d химозин, Bos d фибрин, Bos d желатин, Bos d HG, Bos d инсулин, Bos d лактоферрин, Bos d лактопероксидаза, Bos d миоглобин, Bos d OBP, Bos d OSCP, Bos d фосвитин, Bos d PLA2, Bos d PRVB, Bos d тромбин, Bos d TI, Bos gr ALA, Bos gr миоглобин), Bothrops spp. (Bot as 1, Bot at 1), Bouteloua spp. (Bou g 1), Biting spp. (Bov ov 1), Brama spp. (Bra du 1), Brassica spp. (Bra j 1, Bra j 1.0101, Bra n 1, Bra n 1.0101, Bra n 4, Bra n 7, Bra n 8, Bra n PG, Bra ni 8, Bra о 3, Bra о 3.0101, Bra r 1, Bra r 1.0101, Bra r 2, Bra r 2.0101, Bra r 3, Bra r 4, Bra r 7), Bromus spp. (Bro a 1, Bro a 4), Brosme spp. (Bro br 1), Bromus spp. (Bro i 1, Bro i 5, Bro i 7), Brugia spp. (Bru m 3, Bru m 3.0101, Bru m Bm33), Bubalus spp. (Bub b ALA, Bub b BLG, Bub b казеин, Bub b казеин альфаS1, Bub b казеин альфаS2, Bub b казеин бета, Bub b казеин каппа), Caenorhabditis spp. (Cae b 3, Cae b 3.0101, Cae br 3, Cae br 3.0101, Cae e 3, Cae e 3.0101, Cae e 3.0102, Cae re 13, Cae re 13.0101), Cajanus spp. (Caj с 1), Caligus spp. (Cal cl 1, Cal cl 1.0101, Cal cl 1.0102), Calamus spp. (Cal le 1), Callinectes spp. (Cal s 2), Camelus spp. (Cam d ALA, Cam d казеин, Cam d казеин альфаS1, Cam d казеин альфаS2, Cam d казеин бета, Cam d казеин каппа), Camponotus spp. (Cam fl 7, Cam fl 7.0101), Canis spp. (Can f 1, Can f 1.0101, Can f 2, Can f 2.0101, Can f 3, Can f 3.0101, Can f 4, Can f 4.0101, Can f 5, Can f 5.0101, Can f 6, Can f 6.0101, Can f Feld1-подобный, Can f Homs2-подобный, Can f фосвитин, Can f TCTP), Canthidermis spp. (Can ma 1), Cancer spp. (Can mg 2, Can p 1), Cannabis spp. (Can s 3), Candida spp. (Cand a 1, Cand a 1.0101, Cand a 3, Cand a 3.0101, Cand а СААР, Cand a CyP, Cand а энолаза, Cand a FPA, Cand a MnSOD, Cand a PGK, Cand b 2, Cand b 2.0101, Cand b FDH, Cand r липаза), Capsicum spp. (Cap a 1, Cap a 1.0101, Cap a 17 кДа, Cap a 2, Cap a 2.0101, Cap a 30 кДа, Cap a Glucanase, Cap ch 17 кДа), Caprella spp. (Cap e 1), Capra spp. (Cap h ALA, Cap h BLG, Cap h казеин, Cap h казеин альфаS1, Cap h казеин альфаS2, Cap h казеин бета, Cap h казеин каппа, Cap h GSA), Capitulum spp. (Cap m 1), Carassius spp. (Car au 1), Carpinus spp. (Car b 1, Car b 1.0101, Car b 1.0102, Car b 1.0103, Car b 1.0104, Car b 1.0105, Car b 1.0106, Car b 1.0107, Car b 1.0108, Car b 1.0109, Car b 1.0110, Car b 1.0111, Car b 1.0112, Car b 1.0113, Car b 1.0201, Car b 1.0301, Car b 1.0302, Car b 2, Car b 4), Caranx spp. (Car cr 1), Carya spp. (Car i 1, Car i 1.0101, Car i 2, Car i 4, Car i 4.0101), Carcinus spp. (Car ma 2), Caryota spp. (Car mi 2), Carica spp. (Car p 1, Car p хитиназа, Car p химопапаин, Car p эндопроиеиназа), Castanea spp. (Cas с 24 кДа, Cas s 1, Cas s 1.0101, Cas s 1.0102, Cas s 1.0103, Cas s 2, Cas s 5, Cas s 5.0101, Cas s 8, Cas s 8.0101, Cas s 9, Cas s 9.0101), Catharanthus spp. (Cat r 1, Cat r 1.0101, Cat r 17 кДа, Cat r 2), Caulolatilus spp. (Cau ch 1), Cavia spp. (Cav p 1, Cav p 1.0101, Cav p 2, Cav p 2.0101, Cav p 3, Cav p 3.0101, Cav p желатин, Cav p GSA), Centropristis spp. (Cen s 1), Cephalopholis spp. (Сер so 1), Charybdis spp. (Cha f 1, Cha f 1.0101), Chaetodipterus spp. (Cha fa 1), Chamaecyparis spp. (Cha о 1, Cha о 1.0101, Cha о 2, Cha о 2.0101), Chenopodium spp. (Che a 1, Che a 1.0101, Che a 2, Che a 2.0101, Che a 3, Che a 3.0101), Chironomus spp. (Chi k 1, Chi k 10, Chi k 10.0101), Chinchilla spp. (Chi l 21 кДа_а, Chi l 21 кДа_b), Chionoecetes spp. (Chi о 1, Chi о 1.0101, Chi о 2, Chi о 4, Chi о 6, Chi о альфаактин, Chi о SERCA), Chironomus spp. (Chi t 1, Chi t 1.0101, Chi t 1.0201, Chi t 2, Chi t 2.0101, Chi t 2.0102, Chi t 3, Chi t 3.0101, Chi t 4, Chi t 4.0101, Chi t 5, Chi t 5.0101, Chi t 6, Chi t 6.0101, Chi t 6.0201, Chi t 7, Chi t 7.0101, Chi t 8, Chi t 8.0101, Chi t 9, Chi t 9.0101), Chlamys spp. (Chi n 1), Chloephaga spp. (Chi pi 1), Chortoglyphus spp. (Cho a 10), Chrysomela spp. (Chr tr 7, Chr tr 7.0101), Cicer spp. (Cic a 2S альбумин, Cic а альбумин), Cichorium spp. (Cic i 1), Cimex spp. (Cim 1 нитрофорин), Citrus spp. (Cit l 1, Cit l 3, Cit l 3.0101), Citrullus spp. (Cit la 2, Cit la MDH, Cit la TPI), Citrus spp. (Cit r 3, Cit r 3.0101, Cit s 1, Cit s 1.0101, Cit s 2, Cit s 2.0101, Cit s 3, Cit s 3.0101, Cit s 3.0102, Cit s IFR), Cladosporium spp. (Cla с 14, Cla с 14.0101, Cla с 9, Cla с 9.0101, Cla h 1, Cla h 10, Cla h 10.0101, Cla h 12, Cla h 12.0101, Cla h 2, Cla h 2.0101, Cla h 42 кДа, Cla h 5, Cla h 5.0101, Cla h 6, Cla h 6.0101, Cla h 7, Cla h 7.0101, Cla h 8, Cla h 8 CSP, Cla h 8.0101, Cla h 9, Cla h 9.0101, Cla h abH, Cla h GST, Cla h HCh1, Cla h HSP70, Cla h NTF2, Cla h TCTP), Clostridium spp. (Clo hi коллагеназа, Clo t токсоид), Clupea spp. (Clu h 1, Clu h 1.0101, Clu h 1.0201, Clu h 1.0301), Cocos spp. (Coc n 2, Coc n 4, Coc n 5), Coccidioides spp. (Coc po 8), Coffea spp. (Cof a 1, Cof a 1.0101), Columba spp. (Col l PSA), Coprinus spp. (Cop с 1, Cop с 1.0101, Cop с 2, Cop с 2.0101, Cop с 3, Cop с 3.0101, Cop с 4, Cop с 5, Cop с 5.0101, Cop с 6, Cop с 7, Cop с 7.0101), Corylus spp. (Cor a 1, Cor a 1.0101, Cora 1.0102, Cora 1.0103, Cor a 1.0104, Cor a 1.0201, Cor a 1.0301, Cor a 1.0401, Cor a 1.0402, Cor a 1.0403, Cor a 1.0404, Cor a 10, Cor a 10.0101, Cora 11, Cora 11.0101, Cor a 12, Cor a 12.0101, Cor a 13, Cor a 13.0101, Cor a 14, Cor a 14.0101, Cor a 2, Cor a 2.0101, Cor a 2.0102, Cor a 8, Cor a 8.0101, Cor a 9, Cor a 9.0101), Corynebacterium spp. (Cor d токсоид), Corylus spp. (Cor he 1), Coryphaena spp. (Cor hi 1), Coriandrum spp. (Cor s 1, Cor s 11 кДа, Cor s 2), Cotoneaster spp. (Cot l 3), Crangon spp. (Cra с 1, Cra с 1.0101, Cra с 2, Cra с 2.0101, Cra с 4, Cra с 4.0101, Cra с 5, Cra с 5.0101, Cra с 6, Cra с 6.0101, Cra с 8, Cra с 8.0101), Crassostrea spp. (Cra g 1), Cricetus spp. (Cri с HSA), Crivellia spp. (Cri pa 1), Crocus spp. (Cro s 1, Cro s 1.0101, Cro s 2, Cro s 2.0101, Cro s 3, Cro s 3.01, Cro s 3.02), Cryptomeria spp. (Cry j 1, Cry j 1.0101, Cry j 1.0102, Cry j 1.0103, Cry j 2, Cry j 2.0101, Cry j 2.0102, Cry j 3, Cry j 3.1, Cry j 3.2, Cry j 3.3, Cry j 3.4, Cry j 3.5, Cry j 3.6, Cry j 3.7, Cry j 3.8, Cry j 4, Cry j AP, Cry j хитиназа, Cry j CPA9, Cry j IFR, Cry j LTP, Cry j P1-P2), Cryphonectria spp. (Cry p AP), Ctenocephalides spp. (Cte fl, Cte f 1.0101, Cte f 2, Cte f 2.0101, Cte f 3, Cte f 3.0101), Ctenopharyngodon spp. (Cte id 1), Cucumis spp. (Cuc m 1, Cuc m 1.0101, Cuc m 2, Cuc m 2.0101, Cuc m 3, Cuc m 3.0101, Cuc m Lec17, Cuc m MDH), Cucurbita spp. (Cuc ma 18 кДа, Cuc ma 2, Cuc p 2, Cuc p AscO), Cucumis spp. (Cuc s 2), Culicoides spp. (Cul n 1, Cul n 10, Cul nil, Cul n 2, Cul n 3, Cul n 4, Cul n 5, Cul n 6, Cul n 7, Cul n 8, Cul n 9, Cul n HSP70), Culex spp. (Cul q 28 кДа, Cul q 35 кДа, Cul q 7, Cul q 7.0101, Cul q 7.0102), Culicoides spp. (Cul so 1), Cuminum spp. (Cum с 1, Cum с 2), Cupressus spp. (Cup a 1, Cup a 1.0101, Cup a 1.02, Cup a 2, Cup a 3, Cup a 4, Cup a 4.0101, Cup s 1, Cup s 1.0101, Cups 1.0102, Cup s 1.0103, Cup s 1.0104, Cup s 1.0105, Cup s 3, Cup s 3.0101, Cup s 3.0102, Cup s 3.0103, Cup s 8), Cochliobolus spp. (Cur l 1, Cur l 1.0101, Cur l 2, Cur l 2.0101, Cur l 3, Cur l 3.0101, Cur l 4, Cur l 4.0101, Cur l ADH, Cur l GST, Cur l MnSOD, Cur l оризин, Cur l Trx, Cur l ZPS1), Cyanochen spp. (Cya су 1), Cynoscion spp. (Cyn ar 1), Cynosurus spp. (Cyn cr 1, Cyn cr 5), Cynodon spp. (Cyn d 1, Cyn d 1.0101, Cyn d 1.0102, Cyn d 1.0103, Cyn d 1.0104, Cyn d 1.0105, Cyn d 1.0106, Cyn d 1.0107, Cyn d 1.0201, Cyn d 1.0202, Cyn d 1.0203, Cyn d 1.0204, Cyn d 10, Cyn d 11, Cyn d 12, Cyn d 12.0101, Cyn d 13, Cyn d 15, Cyn d 15.0101, Cyn d 2, Cyn d 22, Cyn d 22.0101, Cyn d 23, Cyn d 23.0101, Cyn d 24, Cyn d 24.0101, Cyn d 4, Cyn d 5, Cyn d 6, Cyn d 7, Cyn d 7.0101), Cynoscion spp. (Cyn ne 1), Cynomys spp. (Cyn sp липокалин), Cyprinus spp. (Сур с 1, Сур с 1.01, Сур с 1.02), Daboia spp. (Dab ru 1), Dactylis spp. (Dac g 1, Dac g 1.01, Dac g 1.0101, Dac g 1.02, Dac g 12, Dac g 13, Dac g 2, Dac g 2.0101, Dac g 3, Dac g 3.0101, Dac g 4, Dac g 4.0101, Dac g 5, Dac g 5.0101, Dac g 7), Dama spp. (Dam d CSA), Danio spp. (Dan re 1, Dan re 2, Dan re альфа2I, Dan re CK), Dasyatis spp. (Das ak 1, Das am 1, Das sa 1), Daucus spp. (Dau с 1, Dau с 1.0101, Dau с 1.0102, Dau с 1.0103, Dau с 1.0104, Dau с 1.0105, Dau с 1.0201, Dau с 1.0301, Dau с 3, Dau с 4, Dau с 4.0101, Dau с CyP), Decapterus spp. (Dec ru 1), Dendronephthya spp. (Den n 1, Den n 1.0101), Dermatophagoides spp. (Der f 1, Der f 1.0101, Der f 1.0102, Der f 1.0103, Der f 1.0104, Der f 1.0105, Der f 1.0106, Der f 1.0107, Der f 1.0108, Der f 1.0109, Der f 1.0110, Der f 10, Der f 10.0101, Der f 10.0102, Der f 11, Der f 11.0101, Der f 13, Der f 13.0101, Der f 14, Der f 14.0101, Der f 15, Der f 15.0101, Der f 16, Der f 16.0101, Der f 17, Der f 17.0101, Der f 18, Der f 18.0101, Der f 2, Der f 2.0101, Der f 2.0102, Der f 2.0103, Der f 2.0104, Der f 2.0105, Der f 2.0106, Der f 2.0107, Der f 2.0108, Der f 2.0109, Der f 2.0110, Der f 2.0111, Der f 2.0112, Der f 2.0113, Der f 2.0114, Der f 2.0115, Der f 2.0116, Der f 2.0117, Der f 20, Der f 21, Der f 22, Der f 22.0101, Der f 3, Der f 3.0101, Der f 4, Der f 5, Der f 6, Der f 6.0101, Der f 7, Der f 7.0101, Der f 8, Der f 9, Der f HSP70), Dermanyssus spp. (Der g 10, Der g 10.0101), Dermatophagoides spp. (Der m 1, Der m 1.0101, Der p 1, Der p 1.0101, Der p 1.0102, Der p 1.0103, Der p 1.0104, Der p 1.0105, Der p 1.0106, Der p 1.0107, Der p 1.0108, Der p 1.0109, Der p 1.0110, Der p 1.0111, Der p 1.0112, Der p 1.0113, Der p 1.0114, Der p 1.0115, Der p 1.0116, Der p 1.0117, Der p 1.0118, Der p 1.0119, Der p 1.0120, Der p 1.0121, Der p 1.0122, Der p 1.0123, Der p 1.0124, Der p 10, Der p 10.0101, Der p 10.0102, Der p 10.0103, Der p 11, Der p 11.0101, Der p 13, Der p 14, Der p 14.0101, Der p 15, Der p 18, Der p 2, Der p 2.0101, Der p 2.0102, Der p 2.0103, Der p 2.0104, Der p 2.0105, Der p 2.0106, Der p 2.0107, Der p 2.0108, Der p 2.0109, Der p 2.0110, Der p 2.0111, Der p 2.0112, Der p 2.0113, Der p 2.0114, Der p 2.0115, Der p 20, Der p 20.0101, Der p 21, Der p 21.0101, Der p 23, Der p 23.0101, Der p 3, Der p 3.0101, Der p 4, Der p 4.0101, Der p 5, Der p 5.0101, Der p 5.0102, Der p 6, Der p 6.0101, Der p 7, Der p 7.0101, Der p 8, Der p 8.0101, Der p 9, Der p 9.0101, Der p 9.0102, Der p P1-P2, Der p P2-P1, Der s 1, Der s 2, Der s 3), Dianthus spp. (Dia с RIP), Dicranopteris spp. (Dic l 2S альбумин), Diospyros spp. (Dio k 17 кДа, Dio k 4, Dio k IFR), Dioscorea spp. (Dio p TSP), Diplodus spp. (Dip ho 1), Distichlis spp. (Dis s 1, Dis s 7), Ditrema spp. (Dit te 1), Dolichovespula spp. (Dol a 1, Dol a 2, Dol a 5, Dol a 5.0101), Dolichos spp. (Dol b агглютинин), Dolichovespula spp. (Dol m 1, Dol m 1.0101, Dol m 1.02, Dol m 2, Dol m 2.0101, Dol m 5, Dol m 5.0101, Dol m 5.02), Drosophila spp. (Dro an 7, Dro an 7.0101, Dro er 7, Dro er 7.0101, Dro er 7.0102, Dro gr 7, Dro gr 7.0101, Dro gr 7.0102, Dro m 7, Dro m 7.0101, Dro m 7.0102, Dro m 7.0103, Dro m 7.0104, Dro m 7.0105, Dro m 7.0106, Dro m 7.0107, Dro m 7.0108, Dro m 7.0109, Dro m 7.0110, Dro m 7.0111, Dro m 7.0112, Dro m 7.0113, Dro m 9, Dro m MnSOD, Dro mo 7, Dro mo 7.0101, Dro pp 7, Dro pp 7.0101, Dro se 7, Dro se 7.0101, Dro si 7, Dro si 7.0101, Dro si 7.0102, Dro vi 7, Dro vi 7.0101, Dro wi 7, Dro wi 7.0101, Dro у 7, Dro у 7.0101, Dro у 7.0102, Dro у 7.0103), Echium spp. (Ech p цитохром С), Elaeis spp. (Ela g 2, Ela g Bd31 кДа), Elops spp. (Elo sa 1), Embellisia spp. (Emb a 1, Emb i 1, Emb nz 1, Emb t 1), Engraulis spp. (Eng e 1), Enteroctopus spp. (Ent d 1), Epinephelus spp. (Epi bl 1, Epi со 1, Epi fl 1, Epi mc 1, Epi mo 1), Epicoccum spp. (Epi p 1, Epi p 1.0101, Epi p 12 кДа, Epi p GST), Epinephelus spp. (Epi po 1, Epi un 1), Equisetum spp. (Equ а 17 кДа), Equus spp. (Equ as 4, Equ as DSA, Equ bu 4, Equ с 1, Equ с 1.0101, Equ с 2, Equ с 2.0101, Equ с 2.0102, Equ с 3, Equ с 3.0101, Equ с 4, Equ с 4.0101, Equ с 5, Equ с 5.0101, Equ с ALA, Equ с BLG, Equ с казеин, Equ с казеин бета, Equ с казеин каппа, Equ с PRVB, Equ he 4, Equ z ZSA), Erimacrus spp. (Eri i 1, Eri i 1.0101, Eri i 1.0102), Eriocheir spp. (Eri s 1, Eri s 1.0101, Eri s 2), Erwinia spp. (Erw ch аспарагиназа), Escherichia spp. (Esc с аспарагиназа, Esc с бета GAL), Esox spp. (Eso l 1), Euphausia spp. (Eup p 1, Eup p 1.0101), Euphasia spp. (Eup s 1, Eup s 1.0101), Euroglyphus spp. (Eur m 1, Eur m 1.0101, Eur m 1.0102, Eur m 1.0103, Eur m 10, Eur m 14, Eur m 14.0101, Eur m 2, Eur m 2.0101, Eur m 2.0102, Eur m 3, Eur m 3.0101, Eur m 4, Eur m 4.0101), Evynnis spp. (Evy j 1), Fagopyrum spp. (Fag e 1, Fag e 1.0101, Fag e 10 кДа, Fag e 19 кДа, Fag e 2, Fag e 2.0101, Fag e TI), Fagus spp. (Fag s 1, Fag s 1.0101, Fag s 2, Fag s 4), Fagopyrum spp. (Fag t 1, Fag t 10 кДа, Fag t 2, Fag t 2.0101), Felis spp. (Fel d 1, Fel d 1.0101, Fel d 2, Fel d 2.0101, Fel d 3, Fel d 3.0101, Fel d 4, Fel d 4.0101, Fel d 5, Fel d 5.0101, Fel d 6, Fel d 6.0101, Fel d 7, Fel d 7.0101, Fel d 8, Fel d 8.0101, Fel d IgG), Fenneropenaeus spp. (Fen с 1, Fen с 2, Fen me 1, Fen me 1.0101), Festuca spp. (Fes e 1, Fes e 13, Fes e 4, Fes e 5, Fes e 7, Fes p 1, Fes p 13, Fes p 4, Fes p 4.0101, Fes p 5, Fes r 1, Fes r 5), Ficus spp. (Fic с 17 кДа, Fic с 4, Fic с фицин), Foeniculum spp. (Foe v 1, Foe v 2), Forsythia spp. (For si), Forcipomyia spp. (For t 1, For t 1.0101, For t 2, For t 2.0101, For t 7, For t FPA, For t миозин, For t TPI), Fragaria spp. (Fra a 1, Fra a 1.0101, Fra a 3, Fra a 3.0101, Fra a 3.0102, Fra a 3.0201, Fra a 3.0202, Fra a 3.0203, Fra a 3.0204, Fra a 3.0301, Fra a 4, Fra a 4.0101, Fra с 1), Fraxinus spp. (Fra e 1, Fra e 1.0101, Fra e 1.0102, Fra e 1.0201, Fra e 12, Fra e 2, Fra e 3, Fra e 9), Fragaria spp. (Fra v 1), Fusarium spp. (Fus с 1, Fus с 1.0101, Fus с 2, Fus с 2.0101, Fus с 3, Fus s 1, Fus s 45 кДа, Fus sp липаза), Gadus spp. (Gad с 1, Gad с 1.0101, Gad с APDH, Gad m 1, Gad m 1.0101, Gad m 1.0102, Gad m 1.0201, Gad m 1.0202, Gad m 45 кДа, Gad m желатин, Gad ma 1), Gallus spp. (Gal d 1, Gal d 1.0101, Gal d 2, Gal d 2.0101, Gal d 3, Gal d 3.0101, Gal d 4, Gal d 4.0101, Gal d 5, Gal d 5.0101, Gal d 6, Gal d 6.0101, Gal d Apo I, Gal d Apo VI, Gal d GPI, Gal d HG, Gal d IgY, Gal d L-PGDS, Gal d овомуцин, Gal d фосвитин, Gal d PRVB, Gal la 4), Galleria spp. (Gal m 18 кДа, Gal m 24 кДа), Callus spp. (Gal so 4), Gammarus spp. (Gam s TM), Gelonium spp. (Gel m RIP), Geothelphusa spp. (Geo de 1), Glossina spp. (Glo m 5, Glo m 5.0101, Glo m 7, Glo m 7.0101, Glo m 7.0102, Glo m 7.0103), Glycine spp. (Gly a Bd30K, Gly ar Bd30K, Gly ca Bd30K, Gly el Bd30K, Gly cu Bd30K, Gly cy Bd30K), Glycyphagus spp. (Gly d 10, Gly d 10.0101, Gly d 13, Gly d 2, Gly d 2.0101, Gly d 2.0201, Gly d 2.03, Gly d 2/Lep d 2 L1, Gly d 2/Lep d 2 L2, Gly d 2/Lep d 2 L3, Gly d 2/Lep d 2 L4, Gly d 2/Lep d 2 R1, Gly d 2/Lep d 2 R2, Gly d 2/Lep d 2 R3, Gly d 2/Lep d 2 R4, Gly d 2/Lep d 2 R5, Gly d 20, Gly d 3, Gly d 5, Gly d 5.01, Gly d 5.02, Gly d 7, Gly d 8), Glycine spp. (Gly f Bd30K, Gly l Bd30K, Gly m 1, Gly m 1.0101, Gly m 1.0102, Gly m 2, Gly m 2.0101, Gly m 2S альбумин, Gly m 3, Gly m 3.0101, Gly m 3.0102, Gly m 39 кДа, Gly m 4, Gly m 4.0101, Gly m 5, Gly m 5.0101, Gly m 5.0201, Gly m 5.0301, Gly m 5.0302, Gly m 50 кДа, Gly m 6, Gly m 6.0101, Gly m 6.0201, Gly m 6.0301, Gly m 6.0401, Gly m 6.0501, Gly m 68 кДа, Gly m агглютинин, Gly m Bd28K, Gly m Bd30K, Gly m Bd60K, Gly m CPI, Gly m EAP, Gly m TI, Gly mi Bd30K, Gly s Bd30K, Gly t Bd30K, Gly to Bd30K), Gossypium spp. (Gos h вицилин), Haemophilus spp. (Hae in P6), Haemaphysalis spp. (Hae l 7, Hae l 7.0101, Hae q 7, Hae q 7.0101), Haliotis spp. (Hal a 1, Hal d 1, Hal di 1, Hal di PM, Hal m 1, Hal m 1.0101, Hal r 1, Hal r 49 кДа, Hal ru 1), Harmonia spp. (Har a 1, Har a 1.0101, Har a 2, Har a 2.0101), Harpegnathos spp. (Har sa 7, Har sa 7.0101, Har sa 7.0102), Helianthus spp. (Hel a 1, Hel a 1.0101, Hel a 2, Hel a 2.0101, Hel a 2S альбумин, Hel a 3, Hel a 3.0101, Hel a 4), Helix spp. (Hel ар 1, Hel as 1, Hel as 1.0101), Heligmosomoides spp. (Hel p 3, Hel p 3.0101), Helianthus spp. (Hel tu 1), Hemanthias spp. (Hem le 1), Hemifusus spp. (Hem t 1), Heterodera spp. (Het g 3, Het g 3.0101), Hevea spp. (Hev b 1, Hev b 1.0101, Hev b 10, Hev b 10.0101, Hev b 10.0102, Hev b 10.0103, Hev b 11, Hev b 11.0101, Hev b 11.0102, Hev b 12, Hev b 12.0101, Hev b 13, Hev b 13.0101, Hev b 14, Hev b 14.0101, Hev b 2, Hev b 2.0101, Hev b 3, Hev b 3.0101, Hev b 4, Hev b 4.0101, Hev b 5, Hev b 5.0101, Hev b 6, Hev b 6.01, Hev b 6.02, Hev b 6.0202, Hev b 6.03, Hev b 7, Hev b 7.01, Hev b 7.02, Hev b 7.D2, Hev b 7.S2, Hev b 8, Hev b 8.0101, Hev b 8.0102, Hev b 8.0201, Hev b 8.0202, Hev b 8.0203, Hev b 8.0204, Hev b 9, Hev b 9.0101, Hev b цитратсвязывающий белок, Hev b GAPDH, Hev b HSP80, Hev b IFR, Hev b субъедица протеосомы, Hev b ротамаза, Hev b SPI, Hev b Trx, Hev b UDPGP), Hexagrammos spp. (Hex ot 1), Hippoglossus spp. (Hip h 1), Hippoglossoides spp. (Hip pl 1), Hippoglossus spp. (Hip st 1), Hirudo spp. (Hir me гирудин), Holcus spp. (Hol l 1, Hol l 1.0101, Hol l 1.0102, Hol l 2, Hol l 4, Hol l 5, Hol l 5.0101, Hol l 5.0201), Holocnemus spp. (Hol pl 9, Hol pl гемоцианин), Homarus spp. (Hom a 1, Hom a 1.0101, Hom a 1.0102, Hom a 1.0103, Hom a 3, Hom a 3.0101, Hom a 4, Hom a 6, Hom a 6.0101, Hom g 1, Hom g 2), Homo spp. (Hom s 1, Hom s 1.0101, Hom s 2, Hom s 2.0101, Hom s 3, Hom s 3.0101, Hom s 4, Hom s 4.0101, Hom s 5, Hom s 5.0101, Hom s AAT, Hom s ACTH, Hom s адалимумаб, Hom s ALA, Hom s альфаактин, Hom s альфа-галактозидаза, Hom s APDH, Hom s арилсульфатаза В, Hom s казеин, Hom s СуР А, Hom s СуР В, Hom s СуР С, Hom s DSF70, Hom s DSG3, Hom s eIF6, Hom s этанерцепт, Hom s фактор IX, Hom s фактор VII, Hom s фактор VIII, Hom s G-CSF, Hom s глюкоцереброзидаза, Hom s глюкозидаза, Hom s HLA-DR-альфа, Hom s HSA, Hom s идуронидаза, Hom s идурсульфаза, Hom s IgA, Hom s инсулин, Hom s лактоферрин, Hom s ламинин гамма_2, Hom s MnSOD, Hom s окситоцин, Hom s Р2, Hom s фосвитин, Hom s профилин, Hom s PSA, Hom s RP1, Hom s TCTP, Hom s TL, Hom s ТРА, Hom s TPO, Hom s трансальдолаза, Hom s Trx, Hom s тубулин-альфа, Hom s/Mus m базиликсимаб, Hom s/Mus m цетуксимаб, Hom s/Mus m цетуксимаб (Gal-Gal), Hom s/Mus m инфликсимаб, Hom s/Mus m натализумаб, Hom s/Mus m омализумаб, Hom s/Mus m паливизумаб, Hom s/Mus m ритуксимаб, Hom s/Mus m тоцилизумаб, Hom s/Mus m трастузумаб), Hoplostethus spp. (Hop a 1), Hordeum spp. (Hor v 1, Hor v 12, Hor v 12.0101, Hor v 13, Hor v 14, Hor v 15, Hor v 15.0101, Hor v 16, Hor v 16.0101, Hor v 17, Hor v 17.0101, Hor v 18 кДа, Hor v 2, Hor v 21, Hor v 21.0101, Hor v 28, Hor v 33, Hor v 4, Hor v 5, Hor v 5.0101, Hor v BDAI, Hor v BTI), Humicola spp. (Hum in целлюлаза), Humulus spp. (Hum j 1, Hum j 1.0101, Hum j 10 кДа, Hum j 2), Huso spp. (Hus hi), Hylocereus spp. (Hyl un LTP), Hymenocephalus spp. (Hym st 1), Hyperoglyphe spp. (Hyp by 1), Hypophthalmichthys spp. (Hyp mo 1), Hypophthalmichthy spp. (Hyp no 1), Ictalurus spp. (Ict fu 1, Ict p 1), Imperata spp. (Imp с 4, Imp с 5, Imp с VIIIe1), Ixodes spp. (Ixo r 2, Ixo sc 7, Ixo sc 7.0101), Jasus spp. (Jas la 1, Jas la 1.0101, Jas la 1.0102), Juglans spp. (Jug ca 1, Jug ca 2, Jug ci 1, Jug ci 2, Jug n 1, Jug n 1.0101, Jug n 2, Jug n 2.0101, Jug r 1, Jug r 1.0101, Jug r 2, Jug r 2.0101, Jug r 3, Jug r 3.0101, Jug r 4, Jug r 4.0101, Jug r 5), Juniperus spp. (Jun a 1, Jun a 1.0101, Jun a 1.0102, Jun a 2, Jun a 2.0101, Jun a 3, Jun a 3.0101, Jun с 1, Jun о 1, Jun о 4, Jun о 4.0101, Jun r 3, Jun r 3.1, Jun r 3.2, Jun v 1, Jun v 1.0101, Jun v 1.0102, Jun v 3, Jun v 3.0101, Jun v 3.0102, Jun v 4), Katsuwonus spp. (Kat p 1), Kyphosus spp. (Kyp se 1), Lachnolaimus spp. (Lac ma 1), Lachesis spp. (Lac mu 1), Lactuca spp. (Lac s 1, Lac s 1.0101), Lagocephalus spp. (Lag la 1), Larus spp. (Lar a 1, Lar a 2, Lar a 3), Larimichthys spp. (Lar po 1), Lates spp. (Lat с 1), Lateolabrax spp. (Lat ja 1), Lathyrus spp. (Lat oc агглютинин), Leiostomus spp. (Lei xa 1), Lens spp. (Len с 1, Len с 1.0101, Len с 1.0102, Len с 1.0103, Len с 2, Len с 2.0101, Len с 3, Len с 3.0101, Len с агглютинин), Leopardus spp. (Leo p 1), Lepidoglyphus spp. (Lep d 10, Lep d 10.0101, Lep d 12, Lep d 13, Lep d 13.0101, Lep d 2, Lep d 2.0101, Lep d 2.0102, Lep d 2.0201, Lep d 2.0202, Lep d 3, Lep d 39 кДа, Lep d 5, Lep d 5.0101, Lep d 5.0102, Lep d 5.0103, Lep d 7, Lep d 7.0101, Lep d 8, Lep d альфа тубулин), Lepomis spp. (Lep gi 1), Leptomelanosoma spp. (Lep i 1), Lepomis spp. (Lep ma 1), Lepisma spp. (Lep s 1, Lep s 1.0101, Lep s 1.0102), Lepeophtheirus spp. (Lep sa 1, Lep sa 1.0101, Lep sa 1.0102, Lep sa 1.0103), Leptailurus spp. (Lep se 1), Lepidorhombus spp. (Lep w 1, Lep w 1.0101), Lethocerus spp. (Let in 7, Let in 7.0101, Let in 7.0102), Leuciscus spp. (Leu се 1), Lewia spp. (Lew in 1), Ligustrum spp. (Lig v 1, Lig v 1.0101, Lig v 1.0102, Lig v 2), Lilium spp. (Lil l 2, Lil l PG), Limanda spp. (Lim fe 1), Limnonectes spp. (Lim m 1), Limulus spp. (Lim p 1, Lim p 1.0101, Lim p 2, Lim p LPA), Liposcelis spp. (Lip b 1, Lip b 1.0101), Litchi spp. (Lit с 1, Lit с 1.0101, Lit с IFR, Lit с TPI), Lithobates spp. (Lit ca 1), Litopenaeus spp. (Lit se 1, Lit v 1, Lit v 1.0101, Lit v 2, Lit v 2.0101, Lit v 3, Lit v 3.0101, Lit v 4, Lit v 4.0101), Filiaria spp. (Loa lo 3, Loa lo 3.0101), Lobotes spp. (Lob su 1), Locusta spp. (Loc m 7, Loc m 7.0101), Loligo spp. (Lol b 1, Lol e 1), Lolium spp. (Lol m 2, Lol m 5, Lol p 1, Lol p 1.0101, Lol p 1.0102, Lol p 1.0103, Lol p 10, Lol p 11, Lol p 11.0101, Lol p 12, Lol p 13, Lol p 2, Lol p 2.0101, Lol p 3, Lol p 3.0101, Lol p 4, Lol p 4.0101, Lol p 5, Lol p 5.0101, Lol p 5.0102, Lol p 7, Lol p CyP, Lol p FT, Lol p легумин), Lonomia spp. (Lon о 7, Lon о 7.0101), Lophodytes spp. (Lop cu 1), Lophonetta spp. (Lop sp 1), Lupinus spp. (Lup a 1, Lup а альфа_конглутин, Lup a дельта_конглутин, Lup а гамма_конглутин, Lup an 1, Lup an 1.0101, Lup an альфа_конглутин, Lup an дельта_конглутин, Lup an гамма_конглутин, Lup l 17 кДа), Lutjanus spp. (Lut a 1, Lut с 1, Lut су 1, Lut gr 1, Lut gu 1, Lut jo 1), Lutraria spp. (Lut p 1), Lutjanus spp. (Lut pu 1, Lut sy 1), Lycopersicon spp. (Lyc e 1, Lyc e 1.0101, Lyc e 11S глобулин, Lyc e 2, Lyc e 2.0101, Lyc e 2.0102, Lyc e 3, Lyc e 3.0101, Lyc e 4, Lyc e 4.0101, Lyc e ARP60S, Lyc e хитиназа, Lyc e глюканаза, Lyc e пероксидаза, Lyc e PG, Lyc e PME, Lyc e PR23, Lyc e вицилин), Maconellicoccus spp. (Mac h 7, Mac h 7.0101), Macruronus spp. (Mac ma 1, Mac n 1), Maclura spp. (Mac po 17 кДа), Macrobrachium spp. (Mac ro 1, Mac ro 1.0101, Mac ro гемоцианин), Macropus spp. (Macr s желатин), Malus spp. (Mal d 1, Mal d 1.0101, Mal d 1.0102, Mal d 1.0103, Mal d 1.0104, Mal d 1.0105, Mal d 1.0106, Mal d 1.0107, Mal d 1.0108, Mal d 1.0109, Mal d 1.0201, Mal d 1.0202, Mal d 1.0203, Mal d 1.0204, Mal d 1.0205, Mal d 1.0206, Mal d 1.0207, Mal d 1.0208, Mal d 1.0301, Mal d 1.0302, Mal d 1.0303, Mal d 1.0304, Mal d 1.0401, Mal d 1.0402, Mal d 1.0403, Mal d 2, Mal d 2.0101, Mal d 3, Mal d 3.0101, Mal d 3.0102, Mal d 3.0201, Mal d 3.0202, Mal d 3.0203, Mal d 4, Mal d 4.0101, Mal d 4.0102, Mal d 4.0201, Mal d 4.0202, Mal d 4.0301, Mal d 4.0302), Malpighia spp. (Mal g 4, Mal g гевеин), Malus spp. (Mal p 1), Malassezia spp. (Mala f 2, Mala f 2.0101, Mala f 3, Mala f 3.0101, Mala f 4, Mala f 4.0101, Mala g 10, Mala s 1, Mala s 1.0101, Mala s 10, Mala s 10.0101, Mala s 11, Mala s 11.0101, Mala s 12, Mala s 12.0101, Mala s 13, Mala s 13.0101, Mala s 5, Mala s 5.0101, Mala s 6, Mala s 6.0101, Mala s 7, Mala s 7.0101, Mala s 8, Mala s 8.0101, Mala s 9, Mala s 9.0101), Manihot spp. (Man e 5, Man e 5.0101, Man e FPA, Man e GAPDH), Mangifera spp. (Man i 1, Man i 14 кДа, Man i 2, Man i 3, Man i 3.01, Man i 3.02, Man i хитиназа), Marsupenaeus spp. (Mar j 1, Mar j 1.0101, Mar j 2, Mar j 4), Matricaria spp. (Mat с 17 кДа), Mecopoda spp. (Mec e 7), Megalobrama spp. (Meg am 2, Meg am CK), Megathura spp. (Meg с гемоцианин), Megalops spp. (Meg sp 1), Melanogrammus spp. (Mel a 1), Meleagris spp. (Mel g 1, Mel g 2, Mel g 3, Mel g PRVB, Mel g TSA), Melicertus spp. (Mel l 1), Menticirrhus spp. (Men am 1), Mercurialis spp. (Mer a 1, Mer a 1.0101), Merluccius spp. (Mer ар 1, Mer au 1, Mer bi 1, Mer ca 1, Mer ga 1, Mer hu 1), Merlangius spp. (Mer me 1), Merluccius spp. (Mer mr 1, Mer pa 1, Mer po 1, Mer pr 1, Mer se 1), Meriones spp. (Mer un 23 кДа), Metarhizium spp. (Met a 30), Metapenaeopsis spp. (Met ba 1), Metapenaeus spp. (Met e 1, Met e 1.0101, Met e 2), Metasequoia spp. (Met gl 2), Metapenaeus spp. (Met j 1, Met j 2), Metanephrops spp. (Met ja 1), Metapenaeopsis spp. (Met la 1), Metanephrops spp. (Met t 2), Micromesistius spp. (Mic po 1), Micropogonias spp. (Mic un 1), Mimachlamys spp. (Mim n 1), Momordica spp. (Mom с RIP), Morus spp. (Mor a 17 кДа, Mor a 4), Morone spp. (Mor am 1), Morus spp. (Mor n 3, Mor n 3.0101), Morone spp. (Mor sa 1, Mor sc 1), Mugil spp. (Mug с 1), Muraenolepis spp. (Mur mi 1), Musa spp. (Mus a 1, Mus a 1.0101, Mus a 2, Mus a 2.0101, Mus a 3, Mus a 3.0101, Mus a 4, Mus a 4.0101, Mus a 5, Mus a 5.0101, Mus a 5.0102), Mus spp. (Mus m 1, Mus m 1.0101, Mus m 1.0102, Mus m 2, Mus m желатин, Mus m IgG, Mus m MSA, Mus m муромонаб, Mus m фосвитин), Mustela spp. (Mus p 17 кДа), Musa spp. (Mus xp 1, Mus xp 2, Mus xp 5), Mycteroperca spp. (Мус bo 1, Мус mi 1, Мус ph 1), Myceliophthora spp. (Мус sp лакказа), Myrmecia spp. (Myr p 1, Myr p 1.0101, Myr p 2, Myr p 2.0101, Myr p 2.0102, Myr p 3, Myr p 3.0101), Mytilus spp. (Myt e 1, Myt g 1, Myt g PM), Myzus spp. (Myz p 7, Myz p 7.0101), Nemorhedus spp. (Nae go Hya), Necator spp. (Nec a кальретикулин), Nemipterus spp. (Nem vi 1), Neosartorya spp. (Neo fi 1, Neo fi 22), Neochen spp. (Neo ju 1), Neoscona spp. (Neo n 7, Neo n 7.0101), Nephelium spp. (Nep 1 GAPDH), Nephrops spp. (Nep n 1, Nep n DF9), Neptunea spp. (Nep po 1, Nep po 1.0101), Nicotiana spp. (Nic t 8, Nic t осмотин, Nic t виллин), Nimbya spp. (Nim с 1, Nim s 1), Nippostrongylus spp. (Nip b Ag1), Nycticebus spp. (Nyc с 1), Octopus spp. (Oct f 1, Oct l 1, Oct v 1, Oct v 1.0101, Oct v PM), Ocyurus spp. (Осу ch 1), Olea spp. (Ole e 1, Ole e 1.0101, Ole e 1.0102, Ole e 1.0103, Ole e 1.0104, Ole e 1.0105, Ole e 1.0106, Ole e 1.0107, Ole e 10, Ole e 10.0101, Ole e 11, Ole e 11.0101, Ole e 11.0102, Ole e 12, Ole e 13, Ole e 2, Ole e 2.0101, Ole e 3, Ole e 3.0101, Ole e 36 кДа, Ole e 4, Ole e 4.0101, Ole e 5, Ole e 5.0101, Ole e 6, Ole e 6.0101, Ole e 7, Ole e 7.0101, Ole e 8, Ole e 8.0101, Ole e 9, Ole e 9.0101), Ommastrephes spp. (Omm b 1, Omm b 1.0101), Oncorhynchus spp. (Onc ke 1, Onc ke 18 кДа, Onc ke альфа2I, Onc ke вителлогенин, Onc m 1, Onc m 1.0101, Onc m 1.0201, Onc m альфа2I, Onc m протамин, Onc m вителлогенин, Onc ma 1, Onc ma FPA, Onc ma FSA, Onc ma TPI, Onc n 1), Onchocerca spp. (Onc о 3, Onc о 3.0101), Oncorhynchus spp. (Onc ts 1), Onchocerca spp. (Onc v 3, Onc v 3.0101), Oratosquilla spp. (Ora о 1, Ora о 1.0101), Oreochromis spp. (Ore a 1, Ore mo 1, Ore mo 2, Ore mo FPA, Ore mo SCAF7145, Ore ni 1, Ore ni 18 кДа, Ore ni 45 кДа), Ornithonyssus spp. (Orn sy 10, Orn sy 10.0101, Orn sy 10.0102), Oryctolagus spp. (Ory с 1, Ory с 1.0101, Ory с 2, Ory с Казеин, Ory с фосвитин, Ory с RSA), Oryza spp. (Ory s 1, Ory s 1.0101, Ory s 11, Ory s 12, Ory s 12.0101, Ory s 13, Ory s 14, Ory s 17 кДа, Ory s 19 кДа, Ory s 2, Ory s 23, Ory s 3, Ory s 7, Ory s aA_TI, Ory s GLP52, Ory s GLP63, Ory s глиоксилаза I, Ory s NRA), Ostrya spp. (Ost с 1, Ost с 1.0101), Ovis spp. (Ovi a ALA, Ovi a BLG, Ovi а казеин, Ovi а казеин альфаS1, Ovi а казеин альфаS2, Ovi а Казеин бета, Ovi а казеин каппа, Ovi а фосвитин, Ovi a SSA), Pachycondyla spp. (Рас с 3), Pagrus spp. (Pag m 1, Pag pa 1), Pampus spp. (Pam ar 1, Pam с 1), Pandalus spp. (Pan b 1, Pan b 1.0101), Pangasius spp. (Pan bo 1), Pandalus spp. (Pan e 1, Pan e 1.0101, Pan e 4), Panulirus spp. (Pan h 1, Pan hy 1), Pangasius spp. (Pan hy 18 кДа, Pan hy 45 кДа), Panulirus spp. (Pan j 1), Panthera spp. (Pan l 1, Pan о 1, Pan p 1), Panulirus spp. (Pan s 1, Pan s 1.0101), Panthera spp. (Pan t 1), Pan spp. (Pan tr TCTP), Papaver spp. (Pap s 17 кДа, Pap s 2, Pap s 34 кДа), Papilio spp. (Pap xu 7, Pap xu 7.0101, Pap xu 7.0102), Paralichthys spp. (Par a 1), Parasilurus spp. (Par as 1, Par с 1), Paralithodes spp. (Par с 1.0101, Par с 1.0102, Par f 1), Parthenium spp. (Par h 1), Parietaria spp. (Par j 1, Par j 1.0101, Par j 1.0102, Par j 1.0103, Par j 1.0201, Par j 2, Par j 2.0101, Par j 2.0102, Par j 3, Par j 3.0101, Par j 3.0102, Par j 4, Par j 4.0101, Par j J1-J2), Paralichthys spp. (Par le 1), Parietaria spp. (Par m 1, Par о 1, Par о 1.0101), Paralichthys spp. (Par ol 1, Par ol альфа2I), Parahucho spp. (Par ре вителлогенин), Passiflora spp. (Pas e хитиназа, Pas e гевеин), Paspalum spp. (Pas n 1, Pas n 1.0101, Pas n 13), Patinopecten spp. (Pat у 1), Pediculus spp. (Ped h 7, Ped h 7.0101), Penaeus spp. (Pen a 1, Pen a 1.0101, Pen a 1.0102, Pen a 1.0102 (103-117), Pen a 1.0102 (109-123), Pen a 1.0102 (1-15), Pen a 1.0102 (115-129), Pen a 1.0102 (121-135), Pen a 1.0102 (127-141), Pen a 1.0102 (13-27), Pen a 1.0102 (133-147), Pen a 1.0102 (139-153), Pen a 1.0102 (145-159)), Farfantepenaeus spp. (Pen a 1.0102 (151-165)), Penaeus spp. (Pen a 1.0102 (157-171), Pen a 1.0102 (163-177), Pen a 1.0102 (169-183), Pen a 1.0102 (175-189), Pen a 1.0102 (181-195), Pen a 1.0102 (187-201), Pen a 1.0102 (193-207), Pen a 1.0102 (19-33), Pen a 1.0102 (199-213), Pen a 1.0102 (205-219), Pen a 1.0102 (211-225), Pen a 1.0102 (217-231), Pen a 1.0102 (223-237), Pen a 1.0102 (229-243)), Farfantepenaeus spp. (Pen a 1.0102 (235-249)), Penaeus spp. (Pen a 1.0102 (241-255), Pen a 1.0102 (247-261), Pen a 1.0102 (253-267), Pen a 1.0102 (25-39), Pen a 1.0102 (259-273), Pen a 1.0102 (265-279), Pen a 1.0102 (270-284), Pen a 1.0102 (31-45), Pen a 1.0102 (37-51), Pen a 1.0102 (43-57), Pen a 1.0102 (49-63)), Farfantepenaeus spp. (Pen a 1.0102 (55-69)), Penaeus spp. (Pen a 1.0102 (61-75), Pen a 1.0102 (67-81), Pen a 1.0102 (7-21), Pen a 1.0102 (73-87), Pen a 1.0102 (79-93), Pen a 1.0102 (85-99), Pen a 1.0102 (91-105), Pen a 1.0102 (97-111), Pen a 1.0103), Penicillium spp. (Pen b 13, Pen b 13.0101, Pen b 26, Pen b 26.0101, Pen с 1, Pen с 13, Pen с 13.0101, Pen с 18, Pen с 19, Pen с 19.0101, Pen с 2, Pen с 22, Pen с 22.0101, Pen с 24, Pen с 24.0101, Pen с 3, Pen с 3.0101, Pen с 30, Pen с 30.0101, Pen с 32, Pen с 32.0101, Pen с MnSOD, Pen ch 13, Pen ch 13.0101, Pen ch 18, Pen ch 18.0101, Pen ch 20, Pen ch 20.0101, Pen ch 31, Pen ch 31.0101, Pen ch 33, Pen ch 33.0101, Pen ch 35, Pen ch 35.0101, Pen ch MnSOD), Penaeus spp. (Pen i 1, Pen i 1.0101, Pen m 1, Pen m 1.0101, Pen m 1.0102, Pen m 2, Pen m 2.0101, Pen m 3, Pen m 3.0101, Pen m 4, Pen m 4.0101, Pen m 6, Pen m 6.0101), Penicillium spp. (Pen о 18, Pen о 18.0101), Penaeus spp. (Pena о 1, Pena о 1.0101), Periplaneta spp. (Per a 1, Per a 1.0101, Per a 1.0102, Per a 1.0103, Per a 1.0104, Per a 1.0105, Per a 1.0201, Per a 10, Per a 10.0101, Per a 2, Per a 3, Per a 3.0101, Per a 3.0201, Per a 3.0202, Per a 3.0203, Per a 4, Per a 5, Per a 6, Per a 6.0101, Per a 7, Per a 7.0101, Per a 7.0102, Per a 7.0103, Per a 9, Per a 9.0101, Per а катепсин, Per a FABP, Per а трипсин, Per f 1, Per f 7, Per f 7.0101), Perna spp. (Per v 1), Persea spp. (Pers a 1, Pers a 1.0101, Pers a 4), Petroselinum spp. (Pet с 1, Pet с 2, Pet с 3), Phalaris spp. (Pha a 1, Pha a 1.0101, Pha a 5, Pha a 5.0101, Pha a 5.02, Pha a 5.03, Pha a 5.04), Phaseolus spp. (Pha v 3, Pha v 3.0101, Pha v 3.0201, Pha v aAI, Pha v aAI.0101, Pha v хитиназа, Pha v PHA, Pha v фазеолин), Phleum spp. (Phl p 1, Phl p 1.0101, Phl p 1.0102, Phl p 11, Phl p 11.0101, Phl p 12, Phl p 12.0101, Phl p 12.0102, Phl p 12.0103, Phl p 13, Phl p 13.0101, Phl p 2, Phl p 2.0101, Phl p 3, Phl p 3.0101, Phl p 3.0102, Phl p 4, Phl p 4.0101, Phl p 4.0102, Phl p 4.0201, Phl p 4.0202, Phl p 4.0203, Phl p 4.0204, Phl p 5, Phl p 5.0101, Phl p 5.0102, Phl p 5.0103, Phl p 5.0104, Phl p 5.0105, Phl p 5.0106, Phl p 5.0107, Phl p 5.0108, Phl p 5.0109, Phl p 5.0201, Phl p 5.0202, Phl p 5.0203, Phl p 5.0204, Phl p 5.0205, Phl p 5.0206, Phl p 5.0207, Phl p 6, Phl p 6.0101, Phl p 6.0102, Phl p 7, Phl p 7.0101, Phl p P1-P2-P5-P6, Phl p P2-P6, Phl p P5-P1, Phl p P6-P2), Phoenix spp. (Pho d 2, Pho d 2.0101, Pho d 40 кДа, Pho d 90 кДа), Phodopus spp. (Pho s 21кДа), Phoma spp. (Pho t 1), Phragmites spp. (Phr a 1, Phr a 12, Phr a 13, Phr a 4, Phr a 5), Phytolacca spp. (Phy a RIP), Pimpinella spp. (Pim a 1, Pim a 2), Pinna spp. (Pin a 1), Piper spp. (Pip n 14 кДа, Pip n 28 кДа), Pisum spp. (Pis s 1, Pis s 1.0101, Pis s 1.0102, Pis s 2, Pis s 2.0101, Pis s 5, Pis s агглютинин, Pis s альбумин), Pistacia spp. (Pis v 1, Pis v 1.0101, Pis v 2, Pis v 2.0101, Pis v 2.0201, Pis v 3, Pis v 3.0101, Pis v 4, Pis v 4.0101, Pis v 5, Pis v 5.0101), Platanus spp. (Pla a 1, Pla a 1.0101, Pla a 2, Pla a 2.0101, Pla a 3, Pla a 3.0101, Pla a 8), Platichthys spp. (Pla f 1), Plantago spp. (Pla l 1, Pla l 1.0101, Pla l 1.0102, Pla l 1.0103, Pla l цитохром С), Platanus spp. (Pla ос 1, Pla or 1, Pla or 1.0101, Pla or 2, Pla or 2.0101, Pla or 3, Pla or 3.0101, Pla or 4, Pla or CyP, Pla r 1), Plectropomus spp. (Ple ar 1), Pleospora spp. (Ple h 1), Plectropomus spp. (Ple le 1), Plodia spp. (Plo i 1, Plo i 1.0101, Plo i 2, Plo i 2.0101), Poa spp. (Poa p 1, Poa p 1.0101, Poa p 10, Poa p 12, Poa p 13, Poa p 2, Poa p 4, Poa p 5, Poa p 5.0101, Poa p 6, Poa p 7), Polistes spp. (Pol a 1, Pol a 1.0101, Pol a 2, Pol a 2.0101, Pol a 5, Pol a 5.0101, Pol d 1, Pol d 1.0101, Pol d 1.0102, Pol d 1.0103, Pol d 1.0104, Pol d 4, Pol d 4.0101, Pol d 5, Pol d 5.0101, Pol e 1, Pol e 1.0101, Pol e 2, Pol e 4, Pol e 4.0101, Pol e 5, Pol e 5.0101, Pol f 5, Pol f 5.0101, Pol g 1, Pol g 1.0101, Pol g 2, Pol g 4, Pol g 5, Pol g 5.0101, Pol he MLT, Pol m 5, Pol m 5.0101), Polypedilum spp. (Pol n 1), Pollicipes spp. (Pol po 1), Pollachius spp. (Pol vi 1), Polybia spp. (Poly p 1, Poly p 1.0101, Poly p 2, Poly p 5, Poly s 5, Poly s 5.0101), Pomatomus spp. (Pom sa 1), Pongo spp. (Pon ab HSA), Pontastacus spp. (Pon l 4, Pon l 4.0101, Pon l 7, Pon l 7.0101), Portunus spp. (Por s 1, Por s 1.0101, Por s 1.0102, Por tr 1, Por tr 1.0101), Protortonia spp. (Pro ca 38 кДа), Procumbarus spp. (Pro cl 1, Pro cl 1.0101, Pro cl 21кДа), Prosopis spp. (Pro j 20 кДа), Prunus spp. (Pru ar 1, Pru ar 1.0101, Pru ar 3, Pru ar 3.0101, Pru av 1, Pru av 1.0101, Pru av 1.0201, Pru av 1.0202, Pru av 1.0203, Pru av 2, Pru av 2.0101, Pru av 3, Pru av 3.0101, Pru av 4, Pru av 4.0101, Pru с 1, Pru d 1, Pru d 2, Pru d 3, Pru d 3.0101, Pru d 4, Pru du 1, Pru du 2, Pru du 2S альбумин, Pru du 3, Pru du 3.0101, Pru du 4, Pru du 4.0101, Pru du 4.0102, Pru du 5, Pru du 5.0101, Pru du 6, Pru du 6.0101, Pru du 6.0201, Pru du конглутин, Pru p 1, Pru p 1.0101, Pru p 2, Pru p 2.0101, Pru p 2.0201, Pru p 2.0301, Pru p 3, Pru p 3.0101, Pru p 3.0102, Pru p 4, Pru p 4.0101, Pru p 4.0201, Pru sa 3), Psilocybe spp. (Psi с 1, Psi с 1.0101, Psi с 2, Psi с 2.0101), Psoroptes spp. (Pso о 1, Pso о 10, Pso о 10.0101, Pso о 11, Pso о 13, Pso о 14, Pso о 2, Pso о 21, Pso о 3, Pso о 5, Pso о 7), Puma spp. (Pum с 1), Punica spp. (Pun g 3), Pyrus spp. (Pyr с 1, Pyr с 1.0101, Pyr с 3, Pyr с 3.0101, Pyr с 4, Pyr с 4.0101, Pyr с 5, Pyr с 5.0101, Pyr py 2), Quercus spp. (Que a 1, Que a 1.0101, Que a 1.0201, Que a 1.0301, Que a 1.0401, Que a 2, Que a 4), Rachycentron spp. (Rac ca 1), Rana spp. (Ran e 1, Ran e 1.0101, Ran e 2, Ran e 2.0101), Ranina spp. (Ran ra 1), Rangifer spp. (Ran t BLG), Rattus spp. (Rat n 1, Rat n 1.0101, Rat n казеин, Rat n желатин, Rat n IgG, Rat n фосвитин, Rat n RSA, Rat n трансферрин), Rhizomucor spp. (Rhi m AP), Rhizopus spp. (Rhi nv липаза, Rhi о липаза), Rhomboplites spp. (Rho au 1), Rhodotorula spp. (Rho m 1, Rho m 1.0101, Rho m 2, Rho m 2.0101), Ricinus spp. (Ric с 1, Ric с 1.0101, Ric с 2, Ric с 3, Ric с 8, Ric с RIP), Rivulus spp. (Riv ma 1), Robinia spp. (Rob p 2, Rob p 4, Rob p глюканаза), Rosa spp. (Ros r 3), Roystonea spp. (Roy e 2), Rubus spp. (Rub i 1, Rub i 1.0101, Rub i 3, Rub i 3.0101, Rub i хитиназа, Rub i CyP), Saccharomyces spp. (Sac с карбоксипептидаза Y, Sac с CyP, Sac с энолаза, Sac с глюкозидаза, Sac с инвертаза, Sac с MnSOD, Sac с P2, Sac с профилин), Salvelinus spp. (Sal f 1), Salsola spp. (Sal k 1, Sal k 1.0101, Sal k 1.0201, Sal k 1.0301, Sal k 1.0302, Sal k 2, Sal k 2.0101, Sal k 3, Sal k 3.0101, Sal k 4, Sal k 4.0101, Sal k 4.0201, Sal k 5, Sal k 5.0101), Salvelinus spp. (Sal le вителлогенин), Salmo spp. (Sal s 1, Sal s 1.0101, Sal s 1.0201, Sal s 2, Sal s 2.0101, Sal s желатин), Sambucus spp. (Sam n 1), Sander spp. (San lu 1), Saponaria spp. (Sap о RIP), Sardinops spp. (Sar m 1), Sarkidiornis spp. (Sar ml 1), Sardina spp. (Sar pi), Sarcoptes spp. (Sar s 1, Sar s 14, Sar s 3, Sar s GST, Sar s PM), Sardinops spp. (Sar sa 1, Sar sa 1.0101), Schistosoma spp. (Sch j GST, Sch j PM, Sch j Sj22, Sch j Sj67, Sch ma Sm20, Sch ma Sm21, Sch ma Sm22, Sch ma Sm31), Sciaenops spp. (Sci ос 1), Scomber spp. (Sco a 1), Scombermorus spp. (Sco ca 1), Scomberomorus spp. (Sco g 1), Scomber spp. (Sco j 1, Sco ma 1, Sco s 1), Scolopendra spp. (Sco у 7, Sco у 7.0101), Scylla spp. (Scy о 1, Scy о 1.0101, Scy о 2, Scy pa 1, Scy pa 2, Scy s 1, Scy s 1.0101, Scy s 2), Sebastes spp. (Seb fa 1, Seb in 1, Seb m 1, Seb m 1.0101, Seb m 1.0201), Secale spp. (Sec с 1, Sec с 12, Sec с 13, Sec с 2, Sec с 20, Sec с 20.0101, Sec с 20.0201, Sec с 28, Sec с 3, Sec с 4, Sec с 4.0101, Sec с 4.0201, Sec с 5, Sec с 5.0101, Sec с aA_TI, Sec с aA_TI.0101), Senecio spp. (Sen j MDH, Sen j PL), Sepia spp. (Sep e 1, Sep e 1.0101), Sepioteuthis spp. (Sep l 1, Sep l 1.0101), Sepia spp. (Sep m 1), Seriola spp. (Ser d 1, Ser la 1), Sergestes spp. (Ser lu 1), Seriola spp. (Ser q 1, Ser ri 1), Sesamum spp. (Ses i 1, Ses i 1.0101, Ses i 2, Ses i 2.0101, Ses i 3, Ses i 3.0101, Ses i 4, Ses i 4.0101, Ses i 5, Ses i 5.0101, Ses i 6, Ses i 6.0101, Ses i 7, Ses i 7.0101, Ses i 8), Shigella spp. (Shi bo GST, Shi dy GST), Simulia spp. (Sim vi 1, Sim vi 2, Sim vi 3, Sim vi 4, Sim vi 70 кДа), Sinapis spp. (Sin a 1, Sin a 1.0101, Sin a 1.0104, Sin a 1.0105, Sin a 1.0106, Sin a 1.0107, Sin a 1.0108, Sin a 2, Sin a 2.0101, Sin a 3, Sin a 3.0101, Sin a 4, Sin a 4.0101), Sinonovacula spp. (Sin с 1, Sin с 1.0101), Solenopsis spp. (Sol g 2, Sol g 2.0101, Sol g 3, Sol g 3.0101, Sol g 4, Sol g 4.0101, Sol g 4.0201, Sol i 1, Sol i 1.0101, Sol i 2, Sol i 2.0101, Sol i 3, Sol i 3.0101, Sol i 4, Sol i 4.0101), Solenocera spp. (Sol me 1), Solenopsis spp. (Sol r 1, Sol r 2, Sol r 2.0101, Sol r 3, Sol r 3.0101, Sol s 2, Sol s 2.0101, Sol s 3, Sol s 3.0101, Sol s 4), Solea spp. (Sol so 1, Sol so TPI), Solarium spp. (Sola t 1, Sola t 1.0101, Sola t 2, Sola t 2.0101, Sola t 3, Sola t 3.0101, Sola t 3.0102, Sola t 4, Sola t 4.0101, Sola t 8, Sola t глюканаза), Sorghum spp. (Sor b 1, Sor h 1, Sor h 1.0101, Sor h 12, Sor h 7), Sparus spp. (Spa a 1), Sphyrna spp. (Sph ti 1), Spirulina spp. (Spi mx бета_фикоцианин), Spinacia spp. (Spi о 2, Spi о RuBisCO), Squilla spp. (Squ ас 1, Squ ac 1.0101, Squ о 1, Squ о 1.0101), Staphylococcus spp. (Sta a FBP, Sta a SEA, Sta a SEB, Sta a SEC, Sta a SED, Sta a SEE, Sta a TSST), Stachybotrys spp. (Sta с 3, Sta с 3.0101, Sta с целлюлаза, Sta с гемолизин, Sta с SchS34, Sta с стахираза A), Stemphylium spp. (Ste b 1, Ste с 1, Ste v 1), Stolephorus spp. (Sto i 1), Struthio spp. (Str с 1, Str с 2, Str с 3), Streptococcus spp. (Str dy стрептокиназа), Streptomyces spp. (Str g проназа), Streptococcus spp. (Str pn PspC), Strongylocentrotus spp. (Str pu 18 кДа, Str pu вителлогенин), Streptococcus spp. (Str py SPEA, Str py SPEC, Str py стрептокиназа), Strongyloides spp. (Str st 45 кДа), Streptomyces spp. (Str v PAT), Styela spp. (Sty p 1), Suidasia spp. (Sui m 1, Sui m 13, Sui m 2, Sui m 3, Sui m 5, Sui m 5.01, Sui m 5.02, Sui m 5.03, Sui m 6, Sui m 7, Sui m 8, Sui m 9), Sus spp. (Sus s ACTH, Sus s ALA, Sus s амилаза, Sus s BLG, Sus s казеин, Sus s Казеин альфаS1, Sus s казеин альфаS2, Sus s казеин бета, Sus s казеин каппа, Sus s желатин, Sus s HG, Sus s инсулин, Sus s липаза, Sus s пепсин, Sus s фосвитин, Sus s PRVB, Sus s PSA, Sus s TCTP), Syntelopodeuma spp. (Syn у 7, Syn у 7.0101), Syringa spp. (Syr v 1, Syr v 1.0101, Syr v 1.0102, Syr v 1.0103, Syr v 2, Syr v 3, Syr v 3.0101), Tabanus spp. (Tab у 1, Tab у 1.0101, Tab у 2, Tab у 2.0101, Tab у 5, Tab у 5.0101), Tadorna spp. (Tad ra 1), Talaromyces spp. (Tal st 22, Tal st 3, Tal st 8), Taraxacum spp. (Tar о 18 кДа), Taxodium spp. (Tax d 2), Tegenaria spp. (Teg d гемоцианин), Teladorsagia spp. (Tel ci 3), Thaumetopoea spp. (Tha p 1, Tha p 1.0101, Tha p 2, Tha p 2.0101), Theragra spp. (The с 1), Thermomyces spp. (The 1 липаза, The sp липаза, The sp ксиланаза), Thunnus spp. (Thu a 1, Thu a 1.0101, Thu а коллаген, Thu al 1, Thu at 1, Thu о 1, Thu о коллаген), Thuja spp. (Thu oc 3, Thu pi), Thunnus spp. (Thu t 1, Thu to 1), Thyrsites spp. (Thy at 1), Thyrophygus spp. (Thy у 7, Thy у 7.0101), Todarodes spp. (Tod p 1, Tod p 1.0101, Tod p 1.0102), Toxoptera spp. (Tox с 7, Tox с 7.0101), Toxocara spp. (Tox ca TES120, Tox ca TES26, Tox ca TES30), Toxoplasma spp. (Tox g HSP70), Trachypenaeus spp. (Tra с 1), Trachinotus spp. (Tra ca 1), Trachurus spp. (Tra j 1, Tra j желатин, Tra tr желатин), Triticum spp. (Tri a 1, Tri а 10 кДа, Tri a 12, Tri a 12.0101, Tri a 12.0102, Tri a 12.0103, Tri a 12.0104, Tri a 13, Tri a 14, Tri a 14.0101, Tri a 14.0201, Tri a 15, Tri a 15.0101, Tri a 18, Tri a 18.0101, Tri a 19, Tri a 19.0101, Tri a 2, Tri a 21, Tri a 21.0101, Tri а 23кДа, Tri a 25, Tri a 25.0101, Tri a 26, Tri a 26.0101, Tri a 27, Tri a 27.0101, Tri a 28, Tri a 28.0101, Tri a 29, Tri a 29.0101, Tri a 29.0201, Tri a 3, Tri a 30, Tri a 30.0101, Tri a 31, Tri a 31.0101, Tri a 32, Tri a 32.0101, Tri a 33, Tri a 33.0101, Tri a 34, Tri a 34.0101, Tri a 35, Tri a 35.0101, Tri a 36, Tri a 36.0101, Tri a 37, Tri a 37.0101, Tri a 4, Tri a 4.0101, Tri a 4.0201, Tri a 5, Tri a 7, Tri a aA_SI, Tri а альфа_глиадин, Tri a bA, Tri a Bd36K, Tri а бета_глиадин, Tri а хитиназа, Tri a CM16, Tri a DH, Tri а эндохитиназа, Tri а гамма_глиадин, Tri а гермин, Tri a глиадин, Tri a GST, Tri a LMW Glu, Tri a LMW-GS В16, Tri a LMW-GS P42, Tri a LMW-GS P73, Tri a LTP2, Tri а омега2_глиадин, Tri а пероксидаза, Tri a пероксидаза 1, Tri a SPI, Tri a TLP, Tri а тритин, Tri a XI), Tritirachium spp. (Tri al протеиназа K), Tribolium spp. (Tri ca 17, Tri ca 17.0101, Tri ca 7, Tri ca 7.0101), Trichostrongylus spp. (Tri со 3, Tri со 3.0101), Trichophyton spp. (Tri eq 4), Trigonella spp. (Tri fg 1, Tri fg 2, Tri fg 3, Tri fg 4), Trichosanthes spp. (Tri k RIP), Trichiurus spp. (Tri le 1), Triticum spp. (Tri m пероксидаза), Trichophyton spp. (Tri me 2, Tri me 4), Trisetum spp. (Tri p 1, Tri p 5), Trichinella spp. (Tri ps 3, Tri ps 3.0101), Trichophyton spp. (Tri r 2, Tri r 2.0101, Tri r 4, Tri r 4.0101), Trichoderma spp. (Tri rs целлюлаза), Triticum spp. (Tri s 14), Trichophyton spp. (Tri sc 2, Tri sc 4, Tri so 2), Trichinella spp. (Tri sp 3, Tri sp 3.0101, Tri sp 3.0102, Tri sp 3.0103, Tri sp 3.0104, Tri sp 3.0105, Tri sp 3.0106), Trichophyton spp. (Tri t 1, Tri t 1.0101, Tri t 4, Tri t 4.0101), Triticum spp. (Tri td 14, Tri td aA_TI), Trichoderma spp. (Tri v целлюлаза), Trichophyton spp. (Tri ve 4), Triatoma spp. (Tria p 1, Tria p 1.0101), Triplochiton spp. (Trip s 1), Turbo spp. (Tur с 1, Tur с PM), Tyrophagus spp. (Tyr p 1, Tyr p 10, Tyr p 10.0101, Tyr p 10.0102, Tyr p 13, Tyr p 13.0101, Tyr p 2, Tyr p 2.0101, Tyr p 24, Tyr p 24.0101, Tyr p 3, Tyr p 3.0101, Tyr p 4, Tyr p 5, Tyr p 5.01, Tyr p 5.02, Tyr p 5.03, Tyr p 7, Tyr p альфа тубулин), Ulocladium spp. (Ulo a 1, Ulo at 1, Ulo b 1, Ulo с 1, Ulo со 1, Ulo cu 1, Ulo mu 1, Ulo ob 1, Ulo se 1, Ulo su 1, Ulo tu 1), Uncia spp. (Unc u 1), Urophycis spp. (Uro te 1), Vaccinium spp. (Vac m 3), Varroa spp. (Var j 13 кДа), Venerupis spp. (Ven ph 1, Ven ph 1.0101), Vespula spp. (Ves f 1, Ves f 2, Ves f 5, Ves f 5.0101, Ves g 1, Ves g 2, Ves g 5, Ves g 5.0101, Ves m 1, Ves m 1.0101, Ves m 2, Ves m 2.0101, Ves m 5, Ves m 5.0101, Ves m MLT, Ves p 1, Ves p 2, Ves p 5, Ves p 5.0101, Ves s 1, Ves s 1.0101, Ves s 2, Ves s 5, Ves s 5.0101, Ves v 1, Ves v 1.0101, Ves v 2, Ves v 2.0101, Ves v 2.0201, Ves v 3, Ves v 3.0101, Ves v 5, Ves v 5.0101, Ves v 5-Pol a 5, Ves vi 5, Ves vi 5.0101), Vespa spp. (Vesp с 1, Vesp с 1.0101, Vesp с 2, Vesp с 5, Vesp с 5.0101, Vesp с 5.0102, Vesp m 1, Vesp m 1.0101, Vesp m 5, Vesp m 5.0101, Vesp ma 1, Vesp ma 2, Vesp ma 5, Vesp ma MLT, Vesp v MLT), Vigna spp. (Vig r 1, Vig r 1.0101, Vig r 17 кДа, Vig r 5, Vig r 8S глобулин, Vig r альбумин, Vig r бета-конглицинин), Vitis spp. (Vit v 1, Vit v 1.0101, Vit v 4, Vit v 5, Vit v глюканаза, Vit v TLP), Xiphias spp. (Xip g 1, Xip g 1.0101, Xip g 25 кДа), Zea spp. (Zea m 1, Zea m 1.0101, Zea m 11, Zea m 12, Zea m 12.0101, Zea m 12.0102, Zea m 12.0103, Zea m 12.0104, Zea m 12.0105, Zea m 13, Zea m 14, Zea m 14.0101, Zea m 14.0102, Zea m 2, Zea m 20S, Zea m 22, Zea m 25, Zea m 25.0101, Zea m 27 кДа Zein, Zea m 3, Zea m 4, Zea m 5, Zea m 50 кДа зеин, Zea m 7, Zea m хитиназа, Zea m G1, Zea m G2, Zea m РАО, Zea m Zm13), Zeus spp. (Zeu fa 1), Ziziphus spp. (Ziz m 1, Ziz m 1.0101), Zoarces spp. (Zoa a ISP III), Zygophyllum spp. (Zyg f 2).
В этом контексте в скобках представлены конкретные предпочтительные аллергенные антигены (аллергены) из конкретного источника.
Наиболее предпочтительно аллергенный антиген предпочтительно имеет происхождение из источника (например, растения (например, трава или дерево), натурального продукта (например, молоко, орехи и т.д.), гриба (например, Aspergillus) или бактерии или из животного-источника или яда животного (например, кошка, собака, яд пчел и т.д.), предпочтительно выбранного из перечня, включающего пыльцу травянистых растений (например, пыльцу ржи), пыльцу деревьев (например, пыльцу ореха, березы, ольхи, ясеня), цветочную пальцу, пыльцу трав (например, пыльцу полыни обыкновенной), клеща домашней пыли (например, Der f 1, Der р 1, Eur m 1, Der m 1, Der f 2, Der p 2, Eur m 2, Tyr p 2, Lep d 2), плесень (например, аллергены Acremonium, Aspergillus, Cladosporium, Fusarium, Mucor, Penicillium, Rhizopus, Stachybotrys, Trichoderma или Alternaria), животных (например, Fel d1, Fel d 2, Fel d3 или Fel d4 кошек), пищевые продукты (например, аллергены рыб (например, окуня, трески, камбалы), морепродуктов (например, краба, лобстера, креветок), яйца, пшеница, орехи (например, арахис, миндаль, кешью, грецкий орех), соя, молоко и т.д.) или яд насекомых (например, аллергены из яда ос, пчел, шершней, муравьев, комаров или клещей).
Аутоиммунные аутоантигены, т.е. антигены, ассоциированные с аутоиммунным заболеванием, или аутоантигены, могут быть ассоциированы с аутоиммунным заболеванием, поражающим по меньшей мере одну или несколько систем органов: кровеносная система, пищеварительная система, эндокринная система, выделительная система, иммунная система, покровная система, мышечная система, нервная система, репродуктивная система, дыхательная система, скелетная система, предпочтительно сердечно-сосудистая система, нейроэндокринная система, скелетно-мышечная система или желудочно-кишечная система. Так, кровеносная система представляет собой систему органов, которая обладает способностью накачивать и направлять кровь к и из организма и легких с помощью сердца, крови и кровеносных сосудов. Пищеварительная система обладает способностью переваривать и обрабатывать пищу с помощью слюнных желез, пищевода, желудка, печени, желчного пузыря, поджелудочной железы, кишечника, ободочной кишки, прямой кишки и ануса. Эндокринная система обеспечивает коммуникацию в организме с использованием гормонов, образующихся в эндокринных железах, таких как гипоталамус, гипофиз или питуитарная железа, шишковидное тело или шишковидная железа, щитовидная железа, паращитовидная железа и надпочечники. Выделительная система включает почки, мочеточники, мочевой пузырь и мочеиспускательный канал и участвует в балансе жидкостей, балансе электролитов и выделении мочи. Иммунная система содержит структуры, участвующие в переносе лимфы между тканями и кровотоком, лимфу и узлы и сосуды, которые могут быть ответственны за транспорт клеточных и гуморальных компонентов иммунной системы. Она ответственна за защиту от болезнетворных агентов и содержит среди прочего лейкоциты, миндалины, аденоиды, тимус и селезенку. Покровная система включает кожу, волосы и ногти. Мышечная система обеспечивает движение с помощью мышц в сочетании со скелетной системой, которая включает кости, хрящи, связки и сухожилия, обеспечивает поддержку структуры. Нервная система ответственна за сбор, передачу и обработку информации и включает головной мозг, спинной мозг и нервы. Репродуктивная система включает половые органы, такие как яичники, фаллопиевы трубы, матку, вагину, молочные железы, яички, семяпровод, семенные пузырьки, предстательную железу и пенис. Дыхательная система содержит органы, необходимые для дыхания, глотку, гортань, трахеи, бронхи, легкие и диафрагму и действует вместе с кровеносной системой.
Аутоиммунные аутоантигены (антигены, ассоциированные с аутоиммунным заболеванием, или аутоантигены) предпочтительно выбирают из аутоантигенов, ассоциированных с аутоиммунными заболеваниями, выбранными из болезни Аддисона (аутоиммунного адреналита, аддисоновой болезни), очаговой алопеции, анемии Аддисона (болезни Бирмера), аутоиммунной гемолитической анемии (AIHA), аутоиммунной гемолитической анемии (AIHA) холодового типа (холодовой гемагглютининовой болезни, холодовой аутоиммунной гемолитической анемии (AIHA) (холодовой агглютининовой болезни), (CHAD)), аутоиммунной гемолитической анемии (AIHA) теплового типа (тепловой АША, тепловой аутоиммунной гемолитической анемии (AIHA)), аутоиммунной гемолитической анемии Доната-Ландштейнера (пароксизмальной холодовой гемоглобинурии), антифосфолипидного синдрома (APS), атеросклероза, аутоиммунного артрита, височного артериита, артериита Такаясу (болезни Такаясу, заболевания дуги аорты), височного артериита/узелкового периартериита, аутоиммунного хронического гастрита, аутоиммунного бесплодия, аутоиммунного заболевания внутреннего уха (AIED), базедовой болезни (Morbus Basedow), болезни Бехтерова (анкилозирующего спондилита, spondylitis ankylosans), синдрома Бехчета (болезни Бехчета), заболевания кишечника, включая аутоиммунное воспалительное заболевание кишечника (включая неспецифический язвенный колит (болезнь Крона), кардиомиопатии, в частности аутоиммунной кардиомиопатии, идиопатической дилятационной кардиомиопатии (DCM), целиакии-спру-дерматита (глутеновой энтеропатии), синдрома хронической усталости и иммунной дисфункции (CFIDS), хронической воспалительной демиелинизирующей полиневропатии (CIDP), хронического полиартрита, синдрома Черджа-Стросса, рубцующегося пемфигоида, синдрома Когана, CREST-синдрома (синдрома с кальцинозом кожи, феноменом Рейно, расстройствами моторики пищевода, склеродактилией и телеангиэктозией), болезни Крона (язвенного колита), герпетиформного дерматита Дюринга, дерматологических аутоиммунных заболеваний, дерматомиозита, диабета, сахарного диабета типа 1 (диабета типа I, инсулинозависимого сахарного диабета), сахарного диабета типа 2 (диабета типа II), эссенциальной криоглобулинемии смешанного типа, эссенциальной криоглобулинемии смешанного типа, фибромиалгии, фибромиозита, синдрома Гудпасчера (анти-GBM-опосредованного гломерулонефрита), болезни «трансплантат против хозяина», синдрома Гийена-Барре (GBM, полирадикулонейрита), гематологических аутоиммунных заболеваний, тиреоидита Хашимото, гемофилии, приобретенной гемофилии, гепатита, аутоиммунного гепатита, особых аутоиммунных форм хронического гепатита, идиопатического легочного фиброза (IPF), идиопатической тромбоцитопенической пурпуры, иммуно-тромбоцитопенической пурпуры (болезни Верхофа; ITP), IgA-нефропатии, бесплодия, аутоиммунного бесплодия, ювенильного ревматоидного артрита (болезни Стилла, синдрома Стилла), синдрома Ламберта-Итона, красного плоского лишая, склерозирующего лишая, красной волчанки, системной красной волчанки (SLE), красной волчанки (дискоидной формы), артрита Лайма (болезни Лайма, артрита при боррелиозе), болезни Меньера (заболевания Меньера); смешанного заболевания соединительной ткани (MCTD), рассеянного склероза (MS, диссеминированного энцефаломиелита, болезни Шарко), тяжелой псевдопаралитической миастении (миастении, MG), миозита, полимиозита, нервных аутоиммунных болезней, нейродермита, вульгарного пемфигуса, буллезного пемфигоида, рубцующегося пемфигоида; нодозного полиартериита (нодозного периартериита), полихондрита (панхондрита), полигландулярного (аутоиммунного) синдрома (PGA-синдрома, синдрома Шмидта), ревматической полимиалгии, первичной агаммаглобулинемии, первичного билиарного цирроза РВС, первичного аутоиммунного холангита, прогрессирующего системного склероза (PSS), псориаза, вульгарного псориаза, феномена Рейно, синдрома Рейтера (болезни Рейтера, уретро-конъюктиво-синовиального синдрома)), ревматоидного артрита (RA, хронического полиартрита, ревматоидного заболевания суставов, острой ревматической лихорадки), саркоидоза (болезни Бека, болезни Бенье-Бека-Шауманна), синдрома мышечной скованности, склеродермии, склеродермы, синдрома Шегрена, симпатической офтальмии; временной непереносимости глютена, отторжения трансплантированного органа, увеита, аутоиммунного увеита, васкулита, витилиго (лейкодермы, пестрой кожи) и болезни Вегенера (гранулематоза Вегенера).
Эти и другие белки, действующие в качестве аутоиммунных аутоантигенов, рассматриваются как терапевтические, поскольку их применяют для лечения индивидуума, в частности, млекопитающего, более предпочтительно человека, путем вакцинации аутоантигеном, который сам экспрессируется млекопитающим, например, человеком, и который запускает нежелательный иммунный ответ, который не образуется в здоровом индивидууме. Таким образом, указанные белки, действующие в качестве аутоантигенов, как правило, имеют происхождение из млекопитающего, в частности, человека.
Особенно предпочтительными в данном контексте являются аутоантигены, выбранные из:
- основного миелиного белка (МВР), протеолипидного белка (PLP) и гликопротеина миелина олигодендроцитов (MOG), в каждом случае ассоциированных с рассеянным склерозом (MS);
- CD44, препроинсулина, проинсулина, инсулина, декарбоксилазы глутаминовой кислоты (GAD65), подобного тирозиновой фосфатазе антигена инсулиномы 2 (IA2), транспортера цинка (ZnT8) и белка теплового шока 60 (HSP60), в каждом случае ассоциированного с диабетом типа I;
- межфоторецепторного ретиноид-связывающего белка (IRBP), ассоциированного с аутоиммунным увеитом;
- ацетилхолинового рецептора AchR и рецептора инсулиноподобного фактора роста-1 (IGF-1R), в каждом случае ассоциированного с тяжелой псевдопаралитической миастенией;
- М-белка из бета-гемолитических стрептококков (псевдоаутоантиген), ассоциированного с острой ревматической лихорадкой;
- фактора, ингибирующего миграцию макрофагов, ассоциированного с артритом;
- RNP-комплекса Ro/La, альфа- и бета-фодрина, аутоантигена островковых клеток, поли(АДФ)рибозаполимеразы (PARP), NuMA, NOR-90, аутоантигена Ro60 и антигена р27, в каждом случае ассоциированного с синдромом Шегрена;
- аутоантигена Ro60, липопротеинов низкой плотности, Sm-антигенов комплекса малых ядерных рибонуклеопротеинов U-1 (В/В', D1, D2, D3, Е, F, G) и RNP-рибонуклеопротеинов, в каждом случае ассоциированного с красной волчанкой;
- oxLDL, бета(2)GPI, HSP60/65 и oxLDL/бета(2)GPI, в каждом случае ассоциированного с атеросклерозом;
- бета(1)-адренергического рецептора сердца, ассоциированного с идиопатической дилятационной кардиомиопатией (DCM);
- гистидил-тРНК-синтетазы (HisRS), ассоциированной с миозитом;
- топоизомеразы I, ассоциированной со склеродермией.
Кроме того, в других вариантах осуществления изобретения указанный антиген ассоциирован с соответствующим аутоиммунным заболеванием, например, IL-17, белки теплового шока и/или любой идиотипический патогенный Т-клеточный или хемокинный рецептор, который экспрессируется иммунными клетками, вовлеченными в аутоиммунный ответ в случае указанного аутоиммунного заболевания (такого как любые аутоиммунные заболевания, указанные в настоящем описании).
В контексте каждого из различных объектов настоящего изобретения некоторые варианты способов, композиций, вакцин или наборов могут (дополнительно) содержать или они могут включать применение адъюванта. В этом контексте под адъювантом можно подразумевать любое соединение, которое можно применять для инициации или повышения иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа. Другими словами, при введении антигенные композиции, фармацевтические композиции и/или вакцины, предлагаемые в настоящем изобретении, предпочтительно вызывают врожденный иммунный ответ благодаря адъюванту, необязательно входящему в них. Предпочтительно указанный адъювант можно выбирать из адъюванта, известного специалисту в данной области и пригодного для конкретного случая, т.е. поддержания индукции врожденного иммунного ответа у млекопитающего, например, адъювантного белка, описанного выше, или адъюванта, описанного ниже.
Особенно предпочтительными в качестве адъювантов, пригодных для запасания и доставки, являются катионные или поликатионные соединения, описанные выше в качестве наполнителя, агента для трансфекции или комплексообразования для предлагаемой в изобретении РНК.
Кроме того, другие варианты осуществления различных объектов настоящего изобретения могут содержать один или несколько дополнительных адъювантов, пригодных для инициации или усиления иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа, прежде всего посредством связывания с патоген-ассоциированными молекулярными паттернами (РАМР), (или включают их применение). Другими словами, при введении фармацевтическая композиция или вакцина предпочтительно вызывает врожденный иммунный ответ благодаря адъюванту, который необязательно содержится в ней. Предпочтительно указанный адъювант можно выбирать из адъювантов, известных специалисту в данной области и пригодных для рассматриваемого случая, т.е. для поддержания индукции врожденного иммунного ответа у млекопитающего, например, адъювантного белка, описанного выше, или адъюванта, описанного ниже. Согласно одному из вариантов осуществления изобретения указанный адъювант можно выбирать из описанных выше адъювантов.
Кроме того, укаазнный адъювант можно выбирать из любого адъюванта, известного специалисту в данной области и пригодного для конкретного случая, т.е. поддержания индукции иммунного ответа у млекопитающего, и/или пригодного для запасания и доставки компонентов предлагаемой в изобретении композиции или вакцины. Предпочтительными в качестве адъювантов, пригодных для запасания и доствки, являются катионные или поликатионные соединения, описанные выше. Аналогично этому, адъювант можно выбирать из группы, состоящей, например, из катионных или поликатионных соединений, указанных выше, таких как хитозан, TDM, MDP, мурамилдипептид, плюроники, раствор квасцов, гидроксид алюминия, ADJUMER™ (полифосфазен); гель фосфата алюминия; глюканы, выделенные из водорослей; алгаммулин; гель гидроксида алюминия (квасцы); высокоадсорбирующий белки гель гидроксида алюминия; обладающий низкой вязкостью гель гидроксида алюминия; AF или SPT (эмульсия, содержащая сквалан (5%), Твин 80 (0.2%), плюроник L121 (1,25%), забуференный фосфатом физиологический раствор, рН 7,4); AVRIDINE™ (пропандиамин); BAY R1005™ ((N-(2-дезокси-2-L-леуциламиноб-D-глюкопиранозил)-N-октадециламида гидроацетат); CALCITRIOL™ (1-альфа,25-дигидрокси-витамин D3); гель фосфата кальция; САР™ (наночастицы фосфата кальция); холерный голотоксин, слитый белок холерный токсин-А1-белок-А-D-фрагмент, субъединица В холерного токсина; CRL 1005 (блок сополимер P1205); содержащие цитокин липосомы; DDA (диметилдиоктадециламмония бромид); DHEA (дегидроэпиандростерон); DMPC (димиристоилфосфатидилхолин); DMPG (димиристоилфосфатидилглицерин); комплекс DOC/квасцы (натриевая соль дезоксихолиновой кислоты); полный адъювант Фрейнда; неполный адъювант Фрейнда; инулин-гамма; адъювант Гербу (смесь, содержащая: I) N-ацетилглюкозаминил-(Р1-4)-N-ацетилмурамоил-L-аланил-D35 глутамин (GMDP), II) диметилдиоктадециламмония хлорид (DDA), III) комплекс цинк-соль L-пролина (ZnPro-8); GM-CSF); GMDP (N-ацетилглюкозаминил-(b1-4)-N-ацетилмурамил-L47 аланил-D-изоглутамин); имиквимод (1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-4-амин); ImmTher™ (N-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-изоGlu-L-Ala-глицерина дипальмитат); DRV (иммунолипосомы, приготовленные из везикул, полученных методом гидратации-регидратации); интерферон-гамма; интерлейкин-1бета; интерлейкин-2; интерлейкин-7; интерлейкин-12; ISCOMS™; ISCOPREP 7.0.3™; липосомы; LOXORIBINE™ (7-аллил-8-оксогуанозин); оральный адъювант LT 5 (лабильный энтеротоксин-протоксин из E.coli); микросферы и микрочастицы любого состава; MF59TM; (водная эмульсия сквалена); MONTANIDE ISA 51™ (очищенный неполный адъювант Фрейнда); MONTANIDE ISA 720™ (метаболизируемый масляный адъювант); MPL™ (3-Q-дезацил-4'-монофосфорил-липид А); липосомы МТР-РЕ и МТР-РЕ ((N-ацетил-L-аланил-D-изоглутаминил-L-аланин-2-(1,2-дипальмитоил-sn-глицеро-3-(гидроксифосфорилокси))этиламид, однонатриевая соль); MURAMETIDE™ (Nac-Mur-L-Ala-D-Gln-OCH3); MURAPALMITINE™ и DMURAPALMITINE™ (Nac-Mur-L-Thr-D-изoGIn-sn-глицериндипальмитоил); NAGO (нейраминидаза-галактозооксидаза); наносферы или наночастицы любого состава; NISV (везикулы из неионогенного поверхностно-активного вещества); PLEURAN™ (β-глюкан); PLGA, PGA и PLA (гомо- и сополимеры молочной кислоты и гликолевой кислоты; микросферы/наносферы); ПЛЮРОНИК L121™; РММА (полиметилметакрилат); PODDS™ (протеноидные микросферы); полиэтиленкарбаматные производные; поли-rA:поли-rU (комплекс полиадениловая кислота-полиуридиновая кислота); полисорбат 80 (Твин 80); белковые кохлеаты (фирма Avanti Polar Lipids, Inc., Алабастер, шт. Алабама); STIMULON™ (QS-21); Quil-A (сапонин Quil-A); S-28463 (4-аминоотекдиметил-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-1-этанол); SAF-1™ («композиция адъювантов фирмы Syntex»); протеолипосомы вируса Сендаи и липидные матрицы, содержащие вирус Сендаи; Спан-85 (сорбитантриолеат); Specol (эмульсия Marcol 52, Спан 85 и Твин 85); сквален или Robane® (2,6,10,15,19,23-гексаметилтетракозан и 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан); стеарилтирозин (октадецилтирозина гидрохлорид); Theramid® (М-ацетилглюкозаминил-N-ацетилмурамил-L-Ala-D-isoGlu-L-Ala-дипальмитоксипропиламид); Theronyl-MDP (Termurtide™ или [thr 1]-MDP; N-ацетилмурамил-L-треонил-D-изоглутамин); Ту-частицы (Ту-ВПЧ или вирусоподобные частицы); липосомы Уолтера-Рида (липосомы, содержащие липид А, адсорбированный на гидроксиде алюминия) и липопептиды, включая Pam3Cys, прежде всего соли алюминия, такие как адъю-фос (Adju-phos), алгидрогель, регидрагель и т.д., эмульсии, такие как CFA, SAF, IFA, MF59, провакс, TiterMax, монтанид, ваксфектин и т.д., сополимеры, такие как оптивакс (Optivax, CRL1005), L121, полоксамер 4010) и т.д., липосомы, такие как «липосомы-невидимки (Stealth)» и т.д., кохлеаты, такие как BIORAL, и т.д., адъюванты растительного происхождения, такие как QS21, Quil A, Iscomatrix, ISCOM; адъюванты, пригодные для костимуляции, включая томатин, биополимеры, такие как PLG, РММ, инулин и т.д., адъюванты микробного происхождения, такие как ромуртид, DETOX, MPL, CWS, манноза, нуклеотидные последовательности CpG, CpG7909, лиганды человеческого TLR 1-13, ISS-1018, 35 IC31, имидазохинолины, амплиген, Ribi529, IMOxine, IRIV, ВПЧ, холерный токсин, термолабильный токсин, Pam3Cys, флагеллин, GPI (гликозилфосфатидилинозитол)-якорь, LNFPIII/Левиса X, противомикробные пептиды, UC-1V150, слитый белок RSV, cdiGMP; и адъюванты, пригодные в качестве антагонистов, включая нейропептид CGRP.
Адъювант наиболее предпочтительно можно выбирать из адъювантов, которые поддерживают индукцию Th1-иммунного ответа или созревание наивных Т-клеток, таких как GM-CSF, IL-12, IFNg, любой указанной выше, предпочтительно иммуностимулирующей РНК, ДНК-CpG и т.д.
В этом контексте другие предпочтительные варианты осуществления настоящего изобретения могут содержать (или дополнительно включать применение) помимо обеспечивающей образование антигена мРНК и/или другой конструкции нуклеиновой кислоты или иммуногенного полипептида, другие компоненты, которые выбирают из группы, содержащей: другие антигены или другие обеспечивающие образование антигена нуклеиновые кислоты; другой иммунотерапевтический агент; одну или несколько вспомогательных субстанций; или любое другое соединение, в отношении которого известно, что оно обладает иммуностимулирующим действием благодаря его аффинности связывания (как лиганда) с человеческими Толл-подобными рецепторами; и/или адъювантную нуклеиновую кислоту, предпочтительно иммуностимуляторную РНК (isPHK).
В этом контексте другие предпочтительные варианты осуществления настоящего изобретения могут также содержать одну или несколько вспомогательных субстанций (или дополнительно включать применение), предназначенных для повышения при необходимости иммуногенности или иммуностимулирующей способности. Тем самым предпочтительно достигается синергетическое действие предлагаемой в изобретении последовательности мРНК, представленной в настоящем описании, и вспомогательной субстанции, которая необязательно может содержаться в предлагаемой в изобретении композиции. В зависимости от различных типов вспомогательных субстанций в этом контексте можно рассматривать различные механизмы. Например, соединения, ускоряющие созревание дендритных клеток (DC), например липополисахариды, TNF-альфа или лиганд CD40, образуют первый класс пригодных вспомогательных веществ. В целом, в качестве вспомогательной субстанции можно использовать любой агент, который оказывает влияние на иммунную систему по типу «сигнала опасности» (LPS, GP96, и т.п.), или можно использовать цитокины, такие как GM-CSF, которые позволяют целенаправленно усиливать иммунный ответ или целенаправленно влиять на него. Наиболее предпочтительными вспомогательными субстанциями являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые доплнительно стимулируют врожденный иммунный ответ, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, INF-альфа, IFN-бета, INF-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, такие как hGH.
Также рассматриваются варианты осуществления различных объектов изобретения, которые дополнительно содержат любое дополнительное соединение (или включают дополнительное его применение), для которого известна способность оказывать иммуностимулирующее действие в результате его аффинности связывания (в качестве лиганда) с человеческими Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10 или в результате его аффинности связывания (в качестве лиганда) с мышиными Толл-подобными рецепторами TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
В этом контексте особенно предпочтительным являются варианты осуществления настоящего изобретения, которые дополнительно включают или содержат адъювантного компонента (или дополнительно включают его применение), который включает (или предусматривет применение) такой же последовательности или конструкции мРНК, которая содержится во второй антигенной композиции, например, мРНК, которая кодирует такой же эпитоп (или такого же) иммуногенного пептида или полипептида или его фрагментов, вариантов или производных.
При этом различные объекты настоящего изобретения могут включать (или включают применение) дополнительных компонентов для облегчения введения и поглощения компонентов применяемой (антигенной) композиции и/или режима лечения, предлагаемого в настоящем изобретении. Указанные дополнительные компоненты могут представлять собой приемлемый носитель или наполнитель, дополнительные адъюванты для поддержания любого иммунного ответа, антибактериальные и/или противовирусные агенты.
Альтернативно этому, в контексте каждого из различных объектов настоящего изобретения, некоторые другие варианты способов, композиций, вакцин или наборов могут не содержать или не включать применение одного или нескольких адъювантов, перечисленных в настоящем описании, или могут не содержать, включать или предусматривать применение адъюванта (например, ни одного из указанных в настоящем описании). Это означает, что в указанных вариантах осуществления этих объектов изобретения его осуществляют и/или применяют без одного или нескольких из указанных дополнительных агентов или указанных дополнительных композиций, который/которая модифицирует (например, повышает) эффективность других содержащихся или применяемых агентов (таких как антигенная композиция, указанная в настоящем описании).
В некоторых вариантах осуществления каждого из различных объектов настоящего изобретения способы, композиции, вакцины или наборы могут (дополнительно) содержать или включать применение фармацевтически приемлемого носителя и/или наполнителя.
Указанный фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу композиции, содержащую компоненты предлагаемой в изобретении фармацевтической композиции. Если композиция находится в жидкой форме, то носитель, как правило, может представлять собой свободную от пирогенов воду; изотонический соляной раствор или забуференные (водные) растворы, например, растворы, забуференные фосфатом, цитратом и т.д. Предназначенный для инъекции буфер может быть гипертоническим, изотоническим или гипотоническим относительно конкретной референс-среды, т.е. содержание в буфере солей может быть выше, идентичным или ниже их содержания в конкретной референс-среде, при этом предпочтительно можно применять такие концентрации вышеуказанных солей, которые не приводят к повреждению клеток в результате осмоса или других связанных с концентрацией воздействий. Референс-среды могут представлять собой, например, жидкости, применяемые в методах «in vivo», такие как кровь, лимфа, цитозольные жидкости или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве референс-сред в методах «in vitro», такие как обычные буферы или жидкости. Указанные обычные буферы или жидкости известны специалисту в данной области. Наиболее предпочтительной жидкой основой является лактированный раствор Рингера.
Однако в предлагаемой в изобретении фармацевтической композиции можно использовать также один или несколько совместимых твердых или жидких наполнителей или разбавителей или капсулирующих соединений, которые можно применять для введения индивидууму (такому как человек), подлежащему лечению. Понятие «совместимые» в контексте настоящего описания означает, что указанные компоненты предлагаемой в изобретении фармацевтической композиции можно смешивать с компонентами предлагаемой в изобретении фармацевтической композиции таким образом, чтобы не происходило взаимодействие, которое могло бы существенно снижать фармацевтическую эффективность фармацевтической композиции в обычных условиях применения.
Дополнительным компонентом (или предназначенным для применения) согласно различным объектам настоящего изобретения может быть иммунотерапевтический агент, который можно выбирать из иммуноглобулинов, предпочтительно IgG-типа, моноклональных или поликлональных антител, поликлональной сыворотки или сывороток и т.д., наиболее предпочтительно иммуноглобулинов против патогена или опухолевой или раковой клетки, например, одной или нескольких, указанных в настоящем описании. Предпочтительно указанный дополнительный иммунотерапевтический агент может находиться в виде пептида/белка или может кодироваться нуклеиновой кислотой, предпочтительно ДНК или РНК, наиболее предпочтительно мРНК. Указанный иммунотерапевтический агент позволяет обеспечивать пассивную вакцинацию в дополнение к активной вакцинации, запускаемой предлагаемой в изобретении обеспечивающей получение антигена мРНК.
Кроме того, в конкретных вариантах осуществления изобретения в дополнение к обеспечивающей образование антигена мРНК дополнительные антигены могут быть включены или применяться в различных объектах настоящего изобретения, и они, как правило, представляют собой субстанции, такие как клетки, клеточные лизаты, вирусы, ослабленные вирусы, инактивированные вирусы, белки, пептиды, нуклеиновые кислоты или другие био- или макромолекулы или их фрагменты. Предпочтительно антигены могут представлять собой белки и пептиды или их фрагменты, такие как эпитопы указанных белков или пептидов, предпочтительно состоящие из 5-15, более предпочтительно 6-9 аминокислот. В частности, указанные белки, пептиды или эпитопы могут иметь происхождение из гликопротеина (GP) и/или матриксного белка (такого как VP40), и/или нуклеопротеина (NP) вирусного патогена или из их фрагментов, вариантов или производных. Кроме того, антигены могут содержать также любую другую биомолекулу, например, липиды, углеводы и т.д. Предпочтительно антиген представляет собой белковый или (поли-)пептидый антиген, нуклеиновую кислоту, нуклеиновую кислоту, кодирующую белковый или (поли-)пептидный антиген, полисахаридный антиген, конъюгированный с полисахаридом антиген, липидный антиген, гликолипидный антиген, углеводный антиген, бактерию, клетку (вакцину) или убитые или ослабленные вирусы. Особенно предпочтительным в этом контексте является добавление противовирусных вакцин, содержащих инактивированный вирус.
Согласно различным объектам настоящее изобретение, представленное в настоящем описании, может дополнительно содержать или включает применения других добавок или дополнительных соединений. Другими добавками, которые можно включать в состав фармацевтической композиции, являются эмульгаторы, такие, например, как Tween®; смачивающие вещества, такие, например, как лаурилсульфат натрия; красители; улучшающие вкус вещества; фармацевтические носители; наполнители для приготовления таблеток; стабилизаторы; антиоксиданты; консерванты, ингибиторы РНКазы и/или антибактериальный агент или противовирусный агент. Кроме того, предлагаемая в изобретении фармацевтическая композиция может содержать малую интерферирующую РНК (siPHK), мишенью которой являются гены патогена или опухолевой или раковой клетки, например, siPHK, направленную против гена, кодирующего гликопротеин (GP) или матриксный белок (такой как VP40), или нуклеопротеин (NP) вирусного патогена.
Различные объекты настоящего изобретения, как правило, содержат или включают применение или введение в эффективном количестве компонентов одной или другой (или обеих) антигенных композиций, прежде всего конструкции(й) мРНК, указанных в настоящем описании. В контексте настоящего описания под «эффективным количеством» подразумевается также количество конструкции(й) мРНК, указанной(ых) в настоящем описании, которое является достаточным для значимой индукции иммунного ответа и/или позитивной модификации заболевания или нарушения или для предупреждения заболевания, предпочтительно ассоциированного с патогеном заболевания, опухолевого или ракового заболевания, аллергического заболевания или аутоиммунного заболевания, указанного в настоящем описании. В других вариантах осуществления изобретения «безопасное и эффективное количество» представляет собой «эффективное количество» (как указано в настоящем описании), которое является достаточно небольшим, чтобы избегать серьезных побочных действий и обеспечивать разумное соотношение между преимуществом и риском. Определение этих пределов, как правило, находится в компетенции осуществляющего лечение врача.
Различные объекты настоящего изобретения можно применять для лечения человека, а также для целей медицинской ветеринарии, предпочтительно в медицине для лечения человека в общем случае в виде фармацевтической композиции или в виде вакцины.
В другом наиболее предпочтительном объекте изобретения первую антигенную композицию можно получать или применять в виде вакцины; и/или вторую антигенную композицию можно получать или применять в виде вакцины.
Таким образом, одним дополнительным объектом настоящего изобретения является первая композиция вакцины, которая содержит первую антигенную композицию, которая описана, определена или заявлена в настоящем описании; и другим дополнительным объектом настоящего изобретения является вторая композиция вакцины, которая содержит вторую антигенную композицию, которая описана, определена или заявлена в настоящем описании; и еще одним объектом настоящего изобретения является также комбинация вакцин, которая содержит оба из следующих двух (отдельных) компонентов: (х) первую антигенную композицию или первую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании; и (у) вторую антигенную композицию или вторую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании.
Как правило, указанная вакцина, композиция вакцины или комбинация вакцин, подпадает под указанное выше определение фармацевтических композиций. Кроме того, указанная вакцина, композиция вакцины или комбинация вакцин касательно второй антигенной композиции, как правило, содержит конструкцию мРНК, указанную в настоящем описании, или несколько конструкций мРНК, указанных в настоящем описании.
Указанные предлагаемые в изобретении вакцины, композиции вакцин или комбинации вакцин могут содержать также фармацевтически приемлемый носитель, адъювант и/или наполнитель, указанный выше в настоящем описании. В конкретном варианте вакцин, композиций вакцин или комбинаций вакцин, предлагаемых в настоящем изобретении, выбор фармацевтически приемлемого носителя определяется в основном в зависимости от пути введения указанной вакцины, композиции вакцины или комбинации вакцин. Вакцину, композицию вакцины или комбинацию вакцин, предлагаемую в настоящем изобретении, можно применять, например, системно или локально. Пути системного введения в целом включают, например, трансдермальный, оральный, парентеральный пути, включая подкожные, внутривенные, внутримышечные, внутриартериальные, внутрикожные и внутрибрюшинные инъекции, и/или интраназальный путь введения. Пути локального применения в целом включают, например, местные пути нанесения, но также и внутрикожные, чрескожные, подкожные или внутримышечные инъекции или инъекции в область повреждения, внутричерепную, внутрилегочную, внутрисердечную и подъязычную инъекции. Более предпочтительно вакцины, композиции вакцин или комбинации вакцин можно применять с использованием внутрикожного, подкожного или внутримышечного пути. Таким образом, заявляемые в изобретении вакцины, композиции вакцин или комбинации вакцин, предлагаемые в настоящем изобретении, предпочтительно приготавливать в форме жидкости (или иногда в твердой форме). Предпочтительно, вакцину, композицию вакцины или комбинацию вакцин, предлагаемую в настоящем изобретении, можно вводить с использованием общепринятой техники на основе игольной инъекции или с использованием безыгольной струйной инъекции. В предпочтительном варианте осуществления изобретения заявляемую вакцину, композицию вакцины или комбинацию вакцин можно вводить с помощью струйной инъекции, представленной в настоящем описании, предпочтительно внутримышечно или внутрикожно, более предпочтительно внутрикожно.
Вакцина, композиция вакцины или комбинация вакцин, предлагаемая в настоящем изобретении, может дополнительно содержать одну или несколько вспомогательных субстанций, предназначенных для повышения при необходимости ее иммуногенности или иммуностимуляторной способности. Особенно предпочтительными в качестве вспомогательных субстанций или добавок являются адъюванты, которые описаны для фармацевтической композиции.
Следующим объектом настоящего изобретения является набор или набор компонентов, содержащий: (х) первую антигенную композицию или первую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании; и (у) вторую антигенную композицию или вторую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании. В некоторых вариантах осуществления изобретения указанный набор или набор компонентов содержит несколько (например, два или большее количество) контейнеров, где содержание по меньшей мере двух или большего количества указанных контейнеров отличается друг от друга полностью или частично: первый из указанных контейнеров содержит первую антигенную композицию или первую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании; а второй из указанных контейнеров содержит вторую антигенную композицию или вторую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании.
В некоторых вариантах осуществления изобретения набор или набор компонентов, предлагаемый в настоящем изобретении, например, набор/набор компонентов необязательно включает (например, может дополнительно содержать) инструкции, например, инструкции, которые содержат информацию, касающуюся введения и доз одного или нескольких компонентов набора /набора компонентов.
Следующим объектом настоящего изобретения является также упакованная вакцина, которая содержит: (х) первую антигенную композицию или первую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании; и/или (у) вторую антигенную композицию или вторую композицию вакцины, которая в каждом случае описана, определена или заявлена в настоящем описании; предпочтительно, когда включены оба указанных компонента, то указанные компоненты находятся в различных контейнерах; и упаковка дополнительно содержит инструкции, например, инструкции, которые содержат информацию, касающуюся введения и доз одного или нескольких компонентов упакованной вакцины.
В конкретном варианте осуществления настоящего изобретения набор/набор компонентов или упакованная вакцина, предлагаемый/предлагаемая в настоящем изобретении; или первая или вторая антигенная композиция, предлагаемая в настоящем изобретении; или первая или вторая композиция вакцины, предлагаемая в настоящем изобретении, предназначены для применения в режиме вакцинации прайм-буст, такой как режим прайм-буст, указанный, описанный или применяемый в настоящем описании, например, в любом из способов, предлагаемых в настоящем изобретении.
В некоторых вариантах осуществления изобретения инструкции к набору/набору компонентов или упакованной вакцине, предлагаемой в настоящем изобретении, может дополнительно включать (например, может дополнительно содержать) информацию о: (а) введении индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции или первый композиции вакцины; и (б) последующем введении индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции или второй композиции вакцины. В частности, такие инструкции касаются индивидуума, представляющего собой человека и/или индивидуума, который нуждается в таком введении.
В конкретных указанных вариантах осуществления изобретения инструкции (дополнительно) содержат инструкции (например, информацию) о введении первой и/или второй антигенных композиций (или первой и/или второй композиций вакцин), указанных в настоящем описании, например, в режиме прайм-буст, который указан, описан или применяется в настоящем описании, например, в любом из способов, предлагаемых в настоящем изобретении.
В контексте настоящего описания понятие «контейнер» включает любую емкость для хранения композиции или вакцины, предлагаемой в настоящем изобретении. Например, в некоторых вариантах осуществления изобретения контейнер представляет собой упаковку, которая непосредственно содержит указанную композицию или вакцину (т.е. упаковка находится в непосредственном контакте с композицией или вакциной; «первичная упаковка»), такую как пузырек, шприц, ампула, блистерная упаковка и т.п. В других вариантах осуществления изобретения контейнер не представляет собой упаковку, которая непосредственно содержит фармацевтическую композицию, т.е. контейнер представляет собой емкость, такую как коробка или пузырек, который содержит (первично) упакованную композицию или вакцину (т.е. представляет собой «вторичную упаковку»), например, бумажную или пластиковую коробку или пакет. Методы упаковывания как первичной, так и вторичной упаковки хорошо известны в данной области.
Следует понимать, что инструкции, применяемые в сочетании с композициями, вакциной или компонентами набора/набора компонентов или упакованной вакцины, могут находиться на упаковке, содержащей указанные композиции или вакцину, и такие инструкции повышают функциональность упакованного продукта. Однако следует понимать, что инструкции могут содержать информацию, относящуюся к стабильности композиций или вакцин, требуемую для осуществления целевой функции, например, лечения, облегчения или предупреждения состояния, нарушения или заболевания у индивидуума. В альтернативном или дополнительном варианте инструкции включают по меньшей мере одну из указанных информаций: описание терапевтического агента; схема дозирования и введения для лечения или предупреждения состояния, нарушения или заболевания или их симптомов; меры предосторожности; предупреждения; показания; противопоказания; информация о передозировке; побочные реакции; фармакологические данные, полученные на животных; популяция индивидуумов, для которых возможно применение, например, возраст, пол, вес и/или состояние здоровья, физиологический или генетический статус.
Понятие «инструкции» в контексте настоящего описания включает напечатанные слова, числа и/или чертежи, публикацию, регистрацию, диаграмму или любое другое средство выражения, которое можно использовать для передачи информации о пользе или других аспектах, касающихся композиции или вакцины, предлагаемой в настоящем изобретении, в том числе набора/набора компонентов или упакованной вакцины. Указанные инструкции к набору или упаковке могут, например, быть присоединены к или находиться на поверхности контейнера, который содержит композицию или вакцину, предлагаемую в настоящем изобретении (например, такого как первичная или вторичная упаковка указанного набора/набора компонентов или упакованная вакцина), инструкции могут находиться отдельно от упаковки, но могут поставляться вместе (например, находятся внутри) с контейнером, который содержит композицию или вакцину, предлагаемую в настоящем изобретении. Примеры указанных инструкций включают листок с информацией для пациента, листовку-вкладыш в упаковку, информацию о рецептуре и/или общую характеризацию продукта. Альтернативно этому, инструкции могут поставляться отдельно от контейнера при условии, что реципиент использует указанные инструкции и композицию или вакцину, предлагаемую в настоящем изобретении, совместно. В указанном варианте осуществления изобретения предоставление инструкций может, например, осуществляться путем физического предоставления информационного листка, публикации или другого средства выражения информации о пользе или других аспектах, касающихся ее, набора, такого как содержащее информацию запоминающее устройство для чтения на компьютере, которое позволяет компьютеру отображать или записывать инструкции в понятной для человека форме, например, на экране, или произносить словесные инструкции, или альтернативно этому путем передачи в электронной форме, например, с помощью компьютера, например, с помощью электронной почты, или скачивать с веб-сайта.
Должно быть очевидно, что применение идеи настоящего изобретения к специфической проблеме или условиям и включение вариаций настоящего изобретения или дополнительных особенностей (таких как дополнительные объекты и варианты осуществления изобретения), находится в компетенции обычного специалиста в данной области с учетом информации, содержащейся в настоящем описании.
Если из контекста не следует иное, то описания и определения указанных выше признаков не ограничивают любой из объектов или вариантов осуществления изобретения и равным образом применимы ко всем описанным объектам и вариантам осуществления изобретения.
Все ссылки, патенты и публикации, процитированные в настоящем описании, полностью включены в него в качестве ссылки.
Ниже некоторые объекты и варианты осуществления изобретения проиллюстрированы с целью примера и со ссылкой на описание, чертежи и таблицы, представленные в настоящем описании. Указанные примеры способов, вариантов применения и других объектов настоящего изобретения даны только с целью иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения только указанными репрезентативными примерами.
Чертежи
Приведенные ниже чертежи представлены только для иллюстрации и предназначены для дополнительного описания настоящего изобретения. Эти чертежи не должны рассматриваться, как ограничивающие объем настоящего изобретения.
На чертежах показано:
на фиг. 1 - столбчатые диаграммы соответствующих IFN-гамма пятен в группах мышей с различными вариантами обработки, описанными в примере 1. Значимое повышение иммунного ответа у мышей (количество соответствующих IFN-гамма пятен, определенное согласно методу, описанному в примере 1) в результате конкретного порядка осуществления предлагаемого в изобретении режима вакцинации, такого как первичная (прайм) вакцинация с использованием белка:бустерная (буст) вакцинация с использованием мРНК (подопытная группа Г), в сравнении с обратным режимом вакцинации, таким как прайм с использованием мРНК:буст с использованием белка (подопытная группа В), а также в сравнении с гомологичным режимом вакцинации прайм с использованием белка:буст с использованием белка (подопытная группа Б). Подопытные группы А и Д подвергали гомологичным режимам прайм:буст с использованием лактированного буфера Рингера (в качестве контроля) и мРНК соответственно;
на фиг. 2а: - столбчатые диаграммы объемов опухолей через 14 дней после инокуляции опухолей в группах мышей с различными вариантами обработки, описанными в примере 2. Значимое повышение защиты от опухолей (объем опухолей через 14 дней после инокуляции, определенный согласно описанному ниже вкратце методу) в результате конкретного порядка осуществления режима вакцинации, а именно: прайм с использованием белка:буст с использованием мРНК, предлагаемого в изобретении (подопытная группа Г), в сравнении с обратным режимом вакцинации, таким как прайм с использованием мРНК:буст с использованием белка (подопытная группа В), а также в сравнении с гомологичным режимом вакцинации, а именно: прайм с использованием белка:буст с использованием белка (подопытная группа Б). Подопытные группы A1, A2 и Д подвергали гомологичным режимам прайм:буст с использованием лактированного буфера Рингера, адъюванта CpG-ДНК (в качестве контролей) и мРНК соответственно;
на фиг. 2б: столбчатые диаграммы таких же данных для подопытных групп Б, В и Г (соответствуют прайм (белок): буст (белок), прайм (мРНК): буст(белок) и прайм (белок): буст(мРНК), которые представлены на фиг. 1, но представленные в виде графика с логарифмической шкалой, что позволяет более наглядно представить значимое повышение защиты от опухолей, обусловленное конкретным порядком осуществления режима гетерологичной вакцинации прайм (белок): буст(мРНК), предлагаемого в настоящем изобретении (подопытная группа Г).
Примеры
Представленные ниже примеры даны только с целью иллюстрации и предназначены для описания изобретения другим образом. Эти примеры не должны рассматриваться, как ограничивающие объем изобретения.
Пример 1: Повышение Т-клеточного ответа после гетерологичной вакцинации в режиме прайм-буст, включающей введение композиции для бустерной иммунизации, которая содержит конструкцию мРНК, кодирующую по меньшей мере один иммуногенный белок
При создании изобретения неожиданно было установлено, что введение конструкции мРНК, кодирующий белок овальбумин, после (т.е. в качестве «буст»-вакцинации) введения белка овальбумина (т.е. в виде «прайм»-вакцинации) приводило к значимому повышению иммунного ответа (мерой которого была секреция IFN-гамма в спленоцитах) по сравнению с обратным режимом вакцинации, при котором конструкцию мРНК вводили в качестве прайм-вакцинации до введения белка овальбумина в качестве буст-вакцинации.
На фиг. 1 представлены данные, демонстрирующие значимое увеличение количества соответствующих IFN-гамма пятен (в качестве меры иммунного ответа и определенного согласно методу, вкратце описанному ниже) в подопытной группе, обработанной в режиме прайм (белок):буст (мРНК) (Г), по сравнению с обратным режимом вакцинации, таким как прайм (мРНК):буст (белок) (подопытная группа В) (двусторонний критерий суммы рангов Уилкинсона: р-величина = 0,01587). С учетом того, что целый ряд доступных в настоящее время терапевтических вакцинаций включают вакцинацию на основе белка, очень важными являются данные о том, что достигается еще более значимое различие между низким иммунным ответом, обусловленным гомологичным режимом вакцинации прайм (белок):буст (белок) (подопытная группа Б), по сравнению с ответом, обусловленным определенным порядком осуществления режима гетерологичной вакцинации прайм (белок): буст (мРНК), предлагаемого в настоящем изобретении (подопытная группа Г) (двусторонний критерий суммы рангов Уилкинсона: р-величина = 0,007937). Подопытные группы А и Д подвергали гомологичным режимам прайм:буст с использованием буфера и мРНК соответственно, каждый компонент вводили i.d.
В целом, метод состоял в следующем: в каждой подопытной группе 5 мышей линии C57BL/6 (возрастом 10 недель) вакцинировали внутрикожно (i.d.) с использованием OVA-RNActive (препарат вакцины в виде комплекса с протамином) R1710 (32 мкг/мышь/день вакцинации, приготовленной согласно методу, описанному в WO 2010/037539) и/или внутримышечно (i.m.) с использованием белка овальбумина с адъювантом (5 мкг/мышь/день вакцинации, в качестве адъюванта применяли адъювант на основе РНК фирмы CureVac (R711+CR12C 2:1), и приготовленного согласно методу, описанному в WO 2012/013326), согласно указанной ниже схеме вакцинации (таблица 1). В качестве контроля одной подопытной группе вводили i.d. буфер, представляющий собой лактированный раствор Рингера (RiLa).
Кодирующая OVA конструкция мРНК отличалась следующими особенностями, другими специфическими или альтернативными вариантами указанных особенностей (или другими особенностями мРНК), которые указаны в других местах в контексте настоящего описания: конструкцию получали путем модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным содержанием GC для стабилизации, затем стабилизирующей последовательности, полученной из альфа-глобин-3'-UTR (muag (мутантный альфа-глобин-3'-UTR)), состоящего из 64 аденозинов сегмента (поли-А-последовательность), состоящего из 30 цитоцинов сегмента (поли-С-последовательность), и гистоновой структуры типа «стебель-петля».
Для анализа выделяли спленоциты у каждой мыши и анализировали с помощью ELISPOT-анализа после стимуляции ГКГС I-специфическим пептидом SIINFEKL (Fotin-Mleczek и др., J Gene Med 14, 2012, с. 428). Данные визуализировали и осуществляли статистический анализ с использовании R-версии 3.1.2 (The R Foundation for Statistical Computing, 2014). Распределение количества соответствующих IFN-гамма пятен у 5 мышей в каждой подопытной группе представляли в виде столбчатых диаграмм (для каждой группы, темной линий обозначена медиана экспериментальных точек, прямоугольником обозначен межквартильный диапазон (IQR) экспериментальных точек, усы простираются до наиболее удаленных экспериментальных точек, которым соответствует IQR в пределах 1,5, а любые экспериментальные точки, лежащие вне указанного диапазона, показы индивидуально).
Пример 2: Повышение защиты от опухолей после гетерологичной противораковой прайм-буст вакцинации, включающей введение композиции для бустерной иммунизации, которая содержит конструкцию мРНК, кодирующую по меньшей мере один иммуногенный белок
При создании изобретения не только продемонстрирован повышенный иммунный ответ при использовании нового режима прайм-буст, предлагаемого в изобретении (который описан выше в примере 1), но также неожиданно было установлено, что другой новый режим прайм-буст, предлагаемый в изобретении, обеспечивает повышенную защиту от опухолей: введение конструкции мРНК, кодирующей белок овальбумин, после (т.е. в качестве «буст»-вакцинации) введения белка овальбумина (т.е. в качестве «прайм»-вакцинации) приводило к значимому повышению защиты от опухолей (мерой которой служил измеренный объем опухолей после их инокуляции) по сравнению с обратным режимом вакцинации, при котором конструкцию мРНК вводили в качестве прайм-вакцинации до введения белка овальбумина в качестве буст-вакцинации.
На фиг. 2а представлены данные, демонстрирующие значимое увеличение защиты от опухолей (по данным измерения опухолей, образовавшихся через 14 дней после инокуляции, и определенных с помощью метода, вкратце описанного ниже) в подопытной группе прайм (белок):буст (мРНК) (Г) по сравнению с обратным режимом вакцинации, таким как прайм (мРНК):буст (белок) (подопытная группа В) (двусторонний критерий суммы рангов Уилкинсона: р-величина = 0,01587). Кроме того, в то время как не обнаружено значимого различия в защите от опухолей, обусловленной гомологичным режимом вакцинации прайм (белок):буст (белок) (подопытная группа Б), и обратным режимом вакцинации, таким как прайм (мРНК):буст (белок) (подопытная группа В) (двусторонний критерий суммы рангов Уилкинсона: р-величина = 0,5476), обнаружено значимое различие в защите от опухолей, обусловленного гомологичным режимом вакцинации прайм (белок):буст (белок) (подопытная группа Б), и обусловленной определенным порядком осуществления режима гетерологичной вакцинации прайм (белок): буст (мРНК), предлагаемого в настоящем изобретении (подопытная группа Г) (двусторонний критерий суммы рангов Уилкинсона: р-величина = 0,03175). Подопытные группы A1, А2 и Д подвергали гомологичным режимам прайм:буст с использованием буфера, адъюванта и мРНК соответственно.
На фиг. 2б представлены такие же данные для подопытных групп Б, В и Г (соответственно прайм (белок):буст (белок), прайм (мРНК):буст(белок) и прайм (белок):буст (мРНК), представленные в виде графика с логарифмической шкалой, что позволяет более наглядно представить значимое повышение защиты от опухолей, обусловленное определенным порядком режима гетерологичной вакцинации прайм (белок):буст(мРНК), предлагаемого в настоящем изобретении (подопытная группа Г).
В целом, метод состоял в следующем: В каждой подопытной группе 5 мышей линии C57BL/6 (возрастом 10 недель) вакцинировали внутримышечно (i.m.) с использованием OVA-RNActive R1710 (20 мкг/мышь/день вакцинации, согласно методу, описанному в WO 2010/037539) и/или подкожно (s.c.) и/или внутримышечно (i.m.) с использованием белка овальбумина с адъювантом (10 мкг/мышь/день вакцинации плюс 10 мкг CpG-ДНК на мышь/день вакцинации и приготовленного согласно описанному ниже методу), согласно указанной ниже схеме вакцинации (таблица 2). В качестве контроля одной подопытной группе i.m. буфер, представляющий собой лактированный раствор Рингера (RiLa), а другой вводили s.c. CpG-ДНК (10 мкг/мышь/день вакцинации).
Дополнительные детали получения одной или нескольких композиций, применяемых в примере 2, описаны ниже:
Композиция мРНК: Ova-PHK 20 мкг/мышь, в виде комплекса в соотношении 1:8 с протамином (25 мкл инъецировали на мышцу), полученная согласно методу, описанному в WO 2010/037539.
Белковая композиция: Овальбумин 10 мкг/мышь + CpG-ДНК 10 мкг/мышь в неполном адъюванте Фрейнда (IFA) до 100 мкл на мышь.
Композиция CpG-ДНК: CpG-ДНК (1826) 10 мкг/мышь в неполном адъюванте Фрейнда (IFA) до 100 мкл на мышь.
CpG-ДНК (1826) получали согласно методу, описанному у Scheel и др., Eur J Immunol 34, 2004, с. 537).
Инокуляцию опухолей осуществляли практически согласно описанному ранее методу (Fotin-Mleczek и др., J Gene Med 14, 2012, с. 428). В целом, метод состоял в следующем: через 8 дней после последней вакцинации мышей инокулировали путем подкожной инъекции 1×106 сингенных опухолевых клеток E.G7-OVA в боковую область и осуществляли мониторинг роста опухолей, измеряя размер опухолей в трех направлениях с помощью кронциркуля, принимая за результат объем опухолей (в мм3) через 14 дней после инокуляции.
Визуализацию данных и статистические анализы осуществляли согласно процедуре, описанной в примере 1.
Пример 3 [Спрогнозированный]: Повышение Т-клеточного ответа после гетерологичной прайм-буст вакцинации, включающей введение примирующей композиции, которая содержит вирусный вектор, кодирующий иммуногенный белок, и последующее введение бустерной композиции, которая включает конструкцию мРНК, кодирующую иммуногенный белок
Повышение иммунного ответа также продемонстрировано с использованием дополнительного гетерогенного режима вакцинации прайм:буст, предлагаемого в настоящем изобретении, в этом случае режим включал введение примирующей композиции, которая включала вирусный вектор, кодирующий иммуногенный белок, и последующее введение бустерной композиции, которая включала конструкцию мРНК, кодирующую иммуногенный белок.
В целом, иммунный ответ на указанный предлагаемый в изобретении режим вакцинации прайм:буст практически соответствовал описанному в примере 1, за исключением того, что: (1) композиция овальбумина с адъювантом заменена на рекомбинантный аденовирусный вектор аденовируса типа 3 обезьян бонобо, PanAd3, кодирующий F-белок респираторно-синтициального вируса (RSV), и введение осуществляли внутриназально или внутримышечно (108 вирусных частиц на мышь); и (2) композиция OVA-RNActive R1710 заменена на композицию мРНК, кодирующую F-белок RSV (или мутант F-белка RSV-F (RSV-F RNActive). Аденовирусный вектор вводили в день 0, а композицию RSV-F RNActive вводили через 4 недели внутрикожно.
Первую композицию, включающую рекомбинантный аденовирус типа 3 бонобо PanAd3, которующий F-белок RSV-F, получали согласно методу, описанному в WO 2014/006191.
Вторую композицию, включающую RSV-F RNActive, кодирующую F-белок RSV-F или его мутант, получали согласно методу, описанному в WO 2015/024668. Примером мутанта RSV-F является делеционный мутант длинного белка RSV-Fdel 554-574 (Oomens и др., J Virol 80, 2006, с. 10465). Указанная конструкция мРНК отличалась следующими особенностями, другими специфическими или альтернативными вариантами указанных особенностей (или другими особенностями мРНК), которые указаны в других местах в контексте настоящего описания: конструкцию получали путем модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным содержанием GC для стабилизации, затем стабилизирующей последовательности, полученной из альфа-глобин-3'-UTR (muag (мутантный альфа-глобин-3'-UTR)), состоящего из 64 аденозинов сегмента (поли-А-последовательность), состоящего из 30 цитоцинов сегмента (поли-С-последовательность), и гистоновой структуры типа «стебель-петля».
Создание вакцины
Для создания содержащей антигены вакцины, предназначенной для применения в настоящем изобретении, белковые последовательности F0-, N- и М2-1-белков RSV создавали на основе ресурса базы данных RSV в Национальном центре биотехнологической информации (National Center for Biotechnology Information (NCBI)) (http://www.ncbi.nlm.nih.gov). Белковые последовательности выбирали из различных штаммов RSV подтипа А.
Консенсусную последовательность F0 получали путем сравнительного анализа первичной структуры всех неидентичных последовательностей F-белка, используя MUSCLE, версию 3.6 и применяя правило большинства. Консенсусную последовательность F0 вакцины создавали на основе сравнительного анализа первичной структуры различных последовательностей RSV. Сходство последовательности с консенсусной последовательностью F0 вакцины оценивали с помощью BLAST-анализа, который представляет средство поиска основного локального выравнивания (Basic Local Alignment Search Tool) и является публично доступным от NCBI. Наиболее высокое среднее сходство консенсусной последовательности, рассчитанное путем сравнения всех последовательностей RSV в базе данных, составляло 100% касательно штамма А2 человеческого респираторно-синцитиального вируса. Кроме того, в F0-последовательности вакцины отсутствует трансмембранная область (ТМ), простирающаяся от аминокислоты 525 до аминокислоты 574 (F0дельтаТМ), что позволяет секретировать F0дельтаТМ. И, наконец, осуществляли оптимизацию кодонов в последовательности F0дельтаТМ-вакцины для экспрессии в эукариотических клетках.
Консенсусную последовательность N-белка вакцины получали путем сравнительного анализа первичной структуры всех неидентичных последовательностей N-белка, используя MUSCLE, версию 3.6 и применяя правило большинства. BLAST-анализ консенсусной последовательности N-белка продемонстрировал максимальное выравнивание со штаммом А2 человеческого респираторно-синцитиального вируса. Затем осуществляли оптимизацию кодонов в последовательности N-белка вакцины для экспрессии в эукариотических клетках.
Консенсусную последовательность М2-1-белка получали путем сравнительного анализа первичной структуры всех неидентичных последовательностей М2-1-белка, используя MUSCLE, версию 3.6 и применяя правило большинства. BLAST-анализ консенсусной последовательности М2-1-белка продемонстрировал максимальное выравнивание со штаммом А2 человеческого респираторно-синцитиального вируса. И, наконец, осуществляли оптимизацию кодонов в последовательности М2-1-белка вакцины для экспрессии в эукариотических клетках.
Последовательность F0дельтаТМ и последовательность N-белка дистанцировали друг от друга с помощью расщепляющей последовательности 2А вируса ящура. Последовательность N-белка вакцины и последовательность М2-1-белка вакцины разделяли гибким линкером (GGGSGGG; SEQ ID NO: 10).
И, наконец, вирусные гены с оптимизированными кодонами клонировали в виде одной открытой рамки считывания F0дельтаТМ-NM2-1.
Создание плазмидных ДНК, кодирующих F0дельтаТМ и F0дельтаТМ-N-М2-1
Консенсусные последовательности F0дельтаТМ, N и М2-1 оптимизировали для экспрессии в млекопитающих, для чего добавляли последовательность Козака и осуществляли оптимизацию кодонов. ДНК-последовательность, кодирующую мультиантигенную вакцину, синтезировали химически и затем субклонировали с помощью приемлемых рестриктаз EcoRV и NotI в челночном векторе pVJTetOCMV под контролем промотора CMV.
Создание переносимой вирусным вектором RSV вакцины на основе PanAd3
Создавали переносимую вирусным вектором RSV вакцину PanAd3/F0дельтаТМ-N-М2-1, которая содержала состоящий из 809 аминокислот полипротеин (SEQ ID NO: 7 в WO 2014/006191), включающий консенсусные белки F0дельтаТМ, N и М2-1, слитые с помощью гибкого линкера. Аденовирус бонобо типа 3 (PanAd3) представляет собой новый описанный ранее аденовирусный штамм с улучшенной серопревалентностью.
Клонирование F0дельтаТМ-N-М2-1 из плазмидного вектора pVJTetOCMV/F0дельтаTM-N-M2-1 в PanAd3 пре-аденовирусном векторе осуществляли путем отщепления антигенных последовательностей, фланкированных гомологичными областями, и ферментативной рекомбинации in vitro. Клонирование F0дельтаTM-N-M2-1 из челночного плазмидного вектора p94-F0дельтаTM-N-M2-1 в MVA-вектор осуществляли с помощью двух стадий ферментативной рекомбинации in vitro и отбора позитивного рекомбинантного вируса с помощью флуоресцентной микроскопии.
Прайм-вакцинация мышей с помощью PanAd3-RSV и буст-вакцинация с помощью RSV-F RNActive
1. Материалы и методы
Группы из 5 мышей линии BALB/c иммунизировали с использованием 108 вирусных частиц PanAd3-RSV путем закапывания в нос или путем внутримышечной инъекции. Другую группу внутрикожно иммунизировали с использованием 20 мкг RSV-F RNActive, как описано ниже. Через 4 недели всем животным вводили внутрикожно 20 мкг RSV-F RNActive. Через 4 недели у всех животных брали образцы крови и получали сыворотку. Пул сыворотки животных в каждой группе анализировали с помощью ELISA для оценки F-белка. В целом, метод состоял в следующем: 96-луночные микропланшеты сенсибилизировали 0,5 мкг белка F (фирма Sino Biologicals Inc,. каталожный №1 1049-V08B) и инкубировали с серийными разведениями сыворотки. После интенсивной промывки специфическое связывание выявляли с помощью вторичного антитела к мышиному IgG, конъюгированного с щелочной фосфатазой. Фоновый уровень определяли с помощью неиммунной сыворотки мышей BALB/c. Титры антител выражали в виде разведения, дающего величину, равную фоновому уровню плюс 3 стандартных отклонения. Нейтрализующие антитела измеряли с помощью основанного на FACS анализа заражения. В целом, метод состоял в следующем: рекомбинантный вирус RSV-A, экспрессирующий GFP (Chen и др., J Immunological Methods 362, 2010, с. 180), применяли для заражения культивируемых Нер-2-клеток в течение 24 ч с множественностью заражения (MOI), приводящему к 20% инфицированных клеток. Серийное разведение пула мышиной сыворотки инкубировали с вирусом в течение 1 ч при 37°С перед добавлением к клеткам. Через 24 ч измеряли процент инфицированных клеток с помощью FACS-анализа цельных клеток. Титр антител выражали в виде разведения сыворотки, ингибирующего заражение на 50% (ЕС50).
Т-клеточные ответа измеряли с помощью Elispot-анализа IFN-гамма Т-клеток. В целом, метод состоял в следующем: лимфоциты селезенки и легких высевали в 96-луночные микропланшеты, сенсибилизированные антителом к IFN-гамма, и стимулировали ex vivo пулами пептидов, включающими полный антиген RSV вакцины. После интенсивной промывки пятно, образованное из секретируемого IFN-гамма на дне планшета, выявляли с помощью вторичного антитела, конъюгированного с щелочной фосфатазой. Количество пятен подсчитывали с помощью автоматического Elispot-ридера.
2. Результаты
Обезьяний аденовирус PanAd3-RSV, содержащий RSV-антигены F, N и М2-1, вводили группам мышей линии BALB/c либо внутриназальным путем, либо внутримышечным путем. Отдельную группу иммунизировали RSV-F RNActive путем внутрикожной инъекции. Через 4 недели трем группам мышей вводили в качестве бустерной вакцинации RSV-F RNActive путем внутрикожной инъекции. Через 4 недели после бустерной инъекции сыворотку мышей анализировали с помощью ELISA для F-белка, а титры нейтрализующего антитела изменяли с помощью FACS, основанного на анализе нейтрализации RSV. Т-клеточные ответы в селезенке и легком измеряли с помощью Elispot-анализа IFN-гамма Т-клеток.
Пример 4 [прогнозирующий]: Повышение Т-клеточного ответа после гетерологичной прайм-буст вакцинации, включающей введение примирующей композиции, которая содержит иммуногенный пептид, и последующее введение бустерной композиции, которая включает конструкцию мРНК, кодирующую иммуногенный пептид
Повышение иммунного ответа также продемонстрировано с использованием дополнительного гетерогенного режима вакцинации прайм:буст, предлагаемого в настоящем изобретении, в этом случае режим включал введение примирующей композиции, включающей иммуногенный пептид, и последующее введение бустерной композиции, которая включала конструкцию мРНК, кодирующую иммуногенный пептид.
Вкратце, иммунный ответ на указанный предлагаемый в изобретении режим вакцинации прайм:буст в целом соответствовал описанному в примере 1, за исключением того, что: (1) композиция овальбумина с адъювантом заменена на композицию, содержащую происходящий из овальбумина пептид, имеющий аминокислотную последовательность SIINFEKL (SIINFEKL-пептид), и ее вводили подкожно (s.c.) (10 мкг/мышь/день вакцинации); (2) композиция OVA-RNActive R1710 замена на кодирующую SIINFEKL RNActive композицию и ее вводили внутримышечно (i.m.) (20 мкг/мышь/день вакцинации); и (3) схема вакцинации соответствовал представленной ниже: пептидную вакцину вводили в день 0, а кодирующую SIINFEKL RNActive композицию вводили в день 14. В качестве контроля одной подопытной группе вводили i.d. буфер, представляющий собой лактированный раствор Рингера (RiLa).
Композицию, включающую иммуногенный происходящий из овальбумина пептид (SIINFEKL), получали следующим образом: Пептид: SIINFEKL-пептид применяли в дозе 10 мкг/мышь с неполным адъювантом Фрейнда (IFA), который добавляли до 100 мкл, на мышь.
Композицию RNActive, включающую мРНК, которая кодирует иммуногенный пептид овальбумина, приготавливали в целом таким же образом, что и композицию OVA-RNActive в примере 2, с тем различием, что открытая рамка считывания (ORF) не кодировали белок овальбумин, а только пептид SIINFEK. Конструкцию OVA-RNActive можно получать с использованием не-OVA-специфических особенностей согласно методу, описанному в примере 1 WO 2015/024668. В результате указанная конструкция OVA-мРНК должна отличаться следующими особенностями, другими специфическими или альтернативными вариантами указанных особенностей (или другими особенностями мРНК), которые указаны в других местах в контексте настоящего описания: конструкцию получали путем модификации кодирующей последовательности дикого типа посредством интродукции последовательности с оптимизированным содержанием GC для стабилизации, затем стабилизирующей последовательности, полученной из альфа-глобин-3'-UTR (muag (мутантный альфа-глобин-3'-UTR)), состоящего из 64 аденозинов сегмента (поли-А-последовательность), состоящего из 30 цитоцинов сегмента (поли-С-последовательность), и гистоновой структуры типа «стебель-петля».
В свете вышеизложенного следует иметь в виду, что изобретение относится к: (х) указанному в настоящем описании; и/или (у) настоящее изобретение относится также к следующему первому набору объектов:
1. Способ индукции иммунного ответа у индивидуума; где способ включает стадии, на которых:
(а) вводят индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первую антигенную композицию, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
и
(б) затем вводят индивидууму по меньшей мере однократно в эффективном количестве вторую антигенную композицию, которая содержит по меньшей мере одну конструкцию мРНК, которая кодирует по меньшей мере один иммуногенный пептид или полипептид,
где:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
2. Способ по п. 1, в котором первую антигенную композицию и вторую антигенную композицию вводят индивидууму соответственно в режиме прайм-буст иммунизации.
3. Способ по п. 2, в котором вторую антигенную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день(ней) после введения первой антигенной композиции.
4. Способ по одному из п.п. 1-3, в котором:
- первую антигенную композицию вводят в виде двух или большего количества доз до введения второй антигенной композиции
и/или
- вторую антигенную композицию вводят в виде двух или большего количества доз после введения первой антигенной композиции,
предпочтительно, в котором первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
5. Способ по п. 4, в котором интервал между введением одной или нескольких пар последовательных доз составляет примерно от 5 до 120 дней.
6. Способ по одному из п.п. 1-5, в котором первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
7. Способ по п. 6, в котором инъекцию осуществляют с использованием общепринятой игольной инъекции и/или с использованием струйной инъекции.
8. Способ по одному из п.п. 1-7, в котором содержание G/C в области конструкции мРНК, кодирующей по меньшей мере один эпитоп иммуногенного пептида или полипептида, повышают по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно, в котором аминокислотную последовательность иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
9. Способ по одному из п.п. 1-8, в котором конструкция мРНК дополнительно содержит:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность; и
(в) необязательно поли(С)-последовательность.
10. Способ по п. 9, в котором поли (А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
11. Способ по одному из п.п. 1-10, в котором конструкция мРНК дополнительно содержит по меньшей мере одну гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
12. Способ по одному из п.п. 1-11, в котором конструкция мРНК содержит дополнительно 3'-UTR-элемент.
13. Способ по п. 12, в котором 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
14. Способ по п. 13, в котором 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
15. Способ по п. 13 или п. 14, в котором 3'-UTR элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
16. Способ по одному из п.п. 1-15, в котором конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4 или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
17. Способ по одному из п.п. 1-16, в котором конструкция мРНК содержит дополнительно 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
18. Способ по п. 17, в котором 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
19. Способ по п. 18, в котором 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5, или ее гомологу, фрагменту или варианту.
20. Способ по п. 19, в котором конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO. 5 или ее гомологу, фрагменту или варианту.
(в) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3 или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
21. Способ по одному из п.п. 1-20, в котором конструкцию мРНК ассоциируют или включают в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас), и наиболее предпочтительно в соотношении, составляющем от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
22. Способ по п. 21, в котором конструкцию мРНК ассоциируют или включают в комплекс с катионным белком или пептидом, предпочтительно протамином.
23. Способ по одному из п.п. 1-22, в котором вторая антигенная композиция содержит несколько или более одной конструкции мРНК, каждая из которых соответствует одному из п.п. 1-22.
24. Способ по одному из п.п. 1-23, в котором конструкцию мРНК включают в комплекс, по меньшей мере частично, с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно с катионными белками или пептидами и наиболее предпочтительно с протамином.
25. Способ по п. 24, в котором соотношение между входящей в комплекс мРНК и свободной мРНК выбирают из диапазона от примерно 5:1 до примерно 1:10 (мас./мас.), предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас.), более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас.), и наиболее предпочтительно соотношение между входящей в комплекс мРНК и свободной мРНК представляет собой соотношение, составляющее от примерно 2:1 до примерно 1:2 (мас./мас.), например, примерно 1:1 (мас./мас).
26. Способ по одному из п.п. 1-25, в котором первая антигенная композиция содержит по меньшей мере один иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
27. Способ по п. 26, в котором первая антигенная композиция содержит раствор по меньшей мере одного иммуногенного пептида или полипептида, предпочтительно содержит раствор по меньшей мере одного иммуногенного белка и/или по меньшей мере одного иммуногенного пептида.
28. Способ по п. 26 или п. 27, в котором первая антигенная композиция содержит по меньшей мере один препарат, содержащий по меньшей мере один иммуногенный пептид или полипептид, где предпочтительно препарат выбирают из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
29. Способ по одному из п.п. 1-28, в котором первая антигенная композиция содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
30. Способ по п. 29, в котором указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
31. Способ по п. 30 в котором вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
32. Способ по п. 31, в котором вирусный вектор представляет собой вектор, имеющей происхождение из поксивируса, который выбран из перечня, включающего: вирус оспы (натуральная оспа), вирус коровьей оспы, вирус осповакцины, вирус обезьян.
33. Способ по п. 32, в котором вирусный вектор представляет собой вектор, имеющей происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус коровьей оспы (NYVAC), ALVAC, TROVAC и модифицированный вирус коровьей оспы Анкара (MVA).
34. Способ по п. 33, в котором вирусный вектор представляет собой вектор, имеющей происхождение из вируса MVA, который получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса коровьей оспы в клетках фибробластов куриного эмбриона, и/или получен из партии посевного материала вируса MVA 476 MG/14/78, и/или получен или произведен до 31 декабря 1978 г., и который является свободным от загрязнения прионами.
35. Способ по п. 29, в котором указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
36. Способ по п. 29, в котором указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
37. Способ по одному из п.п. 1-36, в котором аминокислотная последовательность по меньшей мере эпитопа иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с аминокислотной последовательностью по меньшей мере эпитопа иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции, предпочтительно в котором аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с аминокислотной последовательностью иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
38. Способ по одному из п.п. 1-37, в котором аминокислотная последовательность по меньшей мере эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно в котором иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеет происхождение из патогена или его гомолога, фрагмента или варианта.
39. Способ по п. 38, в котором патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
40. Способ по п. 38 или п. 39, предназначенный для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
41. Способ по одному из п.п. 1-37, в котором аминокислотная последовательность по меньшей мере эпитопа имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта, предпочтительно в котором иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта.
42. Способ по п. 41, в котором опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
43. Способ по п. 41 или п. 42, предназначенный для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
44. Способ по одному из п.п. 1-43, в котором первая и/или вторая антигенная композиция дополнительно содержит адъювант.
45. Способ по одному из п.п. 1-44 в котором первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно дополнительно содержащую фармацевтически приемлемый носитель.
Предпочтительно дополнительными объектами настоящего изобретения являются:
1. Вторая антигенная композиция, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид, предназначенная для применения путем введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве второй антигенной композиции после введения индивидууму по меньшей мере однократно в эффективном количестве первой антигенной композиции, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
в которой:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
2. Первая антигенная композиция, которая содержит по меньшей мере один иммуногенный пептид или полипептид и/или которая содержит по меньшей мере одну конструкцию нуклеиновой кислоты, кодирующую по меньшей мере один иммуногенный пептид или полипептид, предназначенная для применения путем введения индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции и до введения индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции, которая содержит по меньшей мере одну конструкцию мРНК, кодирующую по меньшей мере один иммуногенный пептид или полипептид,
в которой:
- конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
- по меньшей мере один эпитоп иммуногенного пептида или полипептида, который содержится или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является иммунологически эквивалентным по меньшей мере одному эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
3. Вторая антигенная композиция по п. 1 или первая антигенная композиция по п. 2, где первую антигенную композицию и вторую антигенную композицию вводят индивидууму соответственно в режиме прайм-буст иммунизации.
4. Вторая антигенная композиция по п. 1 или п. 3 или первая антигенная композиция по п. 2 или п. 3, где вторую антигеную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5 дней, 4, 3, 2 дня или 1 день после введения первой антигенной композиции.
5. Вторая антигенная композиция по одному из п.п. 1, 3 или 4 или первая антигенная композиция по одному из п.п. 2-4, где
- первую антигенную композицию вводят в виде двух или большего количества доз до введения второй антигенной композиции
и/или
- вторую антигенную композицию вводят в виде двух или большего количества доз после введения первой антигенной композиции,
предпочтительно, где первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
6. Первая или вторая антигенная композиция по п. 5, где интервал между введением одной или нескольких пар последовательных доз составляет примерно от 5 до 120 дней.
7. Вторая антигенная композиция по одному из п.п. 1 или 3-6 или первая антигенная композиция по одному из п.п. 2-6, где первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
8. Первая или вторая антигенная композиция по п. 7, где инъекцию осуществляют с использованием струйной инъекции.
9. Вторая антигенная композиция по одному из п.п. 1 или 3-8 или первая антигенная композиция по одному из п.п. 2-8, в которой содержание G/C в области конструкции мРНК, кодирующей по меньшей мере один эпитоп иммуногенного пептида или полипептида, повышено по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно, в которой аминокислотную последовательность эпитопа иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
10. Вторая антигенная композиция по одному из п.п. 1 или 3-9 или первая антигенная композиция по одному из п.п. 2-9, в которой конструкция мРНК содержит дополнительно:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность;
и
(в) необязательно поли(С)-последовательность.
11. Первая или вторая антигенная композиция по п. 10, в которой поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
12. Вторая антигенная композиция по одному из п.п. 1 или 3-11 или первая антигенная композиция по одному из п.п. 2-11, в которой конструкция мРНК дополнительно содержит по меньшей мере одну гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
13. Вторая антигенная композиция по одному из п.п. 1 или 3-12 или первая антигенная композиция по одному из п.п. 2-12, в которой конструкция мРНК содержит дополнительно 3'-UTR-элемент.
14. Первая или вторая антигенная композиция по п. 13, в которой 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
15. Первая или вторая антигенная композиция по п. 14, в которой 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
16. Первая или вторая антигенная композиция по п. 14 или п. 15, в которой 3'-UTR элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
17. Вторая антигенная композиция по одному из п.п. 1 или 3-16 или первая антигенная композиция по одному из п.п. 2-16, в которой конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4, или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1, или ее гомологу, фрагменту или варианту.
18. Вторая антигенная композиция по одному из п.п. 1 или 3-17 или первая антигенная композиция по одному из п.п. 2-17, в которой конструкция мРНК содержит дополнительно 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
19. Первая или вторая антигенная композиция по п. 18, в которой 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
20. Первая или вторая антигенная композиция по п. 19, в которой 5'-UTR элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5, или ее гомологу, фрагменту или варианту.
21. Первая или вторая антигенная композиция по п. 20, в которой конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5, или ее гомологу, фрагменту или варианту,
(в) кодирующую область, которая кодирует по меньшей мере один иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3, или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов;
и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1, или ее гомологу, фрагменту или варианту.
22. Вторая антигенная композиция по одному из п.п. 1 или 3-21 или первая антигенная композиция по одному из п.п. 2-21, в которой конструкция мРНК ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
23. Первая или вторая антигенная композиция по п. 22, в которой конструкция мРНК ассоциирована или включена в комплекс с катионным белком или пептидом, предпочтительно протамином.
24. Вторая антигенная композиция по одному из п.п. 1 или 3-23 или первая антигенная композиция по одному из п.п. 2-23, где вторая антигенная композиция содержит несколько или более одной конструкции мРНК, каждая из которых соответствует одному из п.п. 1-23.
25. Вторая антигенная композиция по одному из п.п. 1 или 3-24 или первая антигенная композиция по одному из п.п. 2-24, в которой конструкция мРНК включена в комплекс, по меньшей мере частично, с катионным или поликатионным соединением и/или полимерным носителем, предпочтительно катионными белками или пептидами и наиболее предпочтительно протамином.
26. Первая или вторая антигенная композиция по п. 25, в которой соотношение между входящей в комплекс мРНК и свободной мРНК выбрано из диапазона, составляющего от примерно 5:1 до примерно 1:10 (мас./мас.), предпочтительно из диапазона от примерно 4:1 до примерно 1:8 (мас./мас.), более предпочтительно из диапазона от примерно 3:1 до примерно 1:5 (мас./мас.) или 1:3 (мас./мас.), и наиболее предпочтительно соотношение между входящей в комплекс мРНК и свободной мРНК представляет собой соотношение, составляющее от примерно 2:1 до примерно 1:2 (мас./мас.), например, примерно 1:1 (мас./мас.).
27. Вторая антигенная композиция по одному из п.п. 1 или 3-26 или первая антигенная композиция по одному из п.п. 2-26, где первая антигенная композиция содержит по меньшей мере один иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
28. Первая или вторая антигенная композиция по п. 27, где первая антигенная композиция содержит раствор по меньшей мере одного иммуногенного пептида или полипептида, предпочтительно содержит раствор по меньшей мере одного иммуногенного белка и/или по меньшей мере одного иммуногенного пептида.
29. Первая или вторая антигенная композиция по п. 27 или п. 28, где первая антигенная композиция содержит по меньшей мере один препарат, содержащий по меньшей мере один иммуногенный пептид или полипептид, где препарат предпочтительно выбран из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
30. Вторая антигенная композиция по одному из п.п. 1 или 3-29 или первая антигенная композиция по одному из п.п. 2-29, где первая антигенная композиция содержит по меньшей мере одну конструкцию нуклеиновой кислоты, которая кодирует по меньшей мере один иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
31. Первая или вторая антигенная композиция по п. 30, в которой указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
32. Первая или вторая антигенная композиция по п. 31, в которой вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
33. Первая или вторая антигенная композиция по п. 32, в которой вирусный вектор представляет собой вектор, имеющей происхождение из поксивируса, который выбран из перечня, включающего: вирус оспы (натуральная оспа), вирус коровьей оспы, вирус осповакцины, вирус обезьян.
34. Первая или вторая антигенная композиция по п. 33, в которой вирусный вектор представляет собой вектор, имеющей происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус коровьей оспы (NYVAC), ALVAC, TROVAC и модифицированный вирус коровьей оспы Анкара (MVA).
35. Первая или вторая антигенная композиция по п. 34, в которой вирусный вектор представляет собой вектор, имеющей происхождение из вируса MVA, который получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса коровьей оспы в клетках фибробластов куриного эмбриона, и/или получен из партии посевного материала вируса MVA 476 MG/14/78, и/или получен или произведен до 31 декабря 1978 г., и который является свободным от загрязнения прионами.
36. Первая или вторая антигенная композиция по п. 30, в которой указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
37. Первая или вторая антигенная композиция по п. 30, в которой указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
38. Вторая антигенная композиция по одному из п.п. 1 или 3-37 или первая антигенная композиция по одному из п.п. 2-37, в которой аминокислотная последовательность по меньшей мере эпитопа иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с аминокислотной последовательностью по меньшей мере эпитопа иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции, предпочтительно в которой аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, сходна с аминокислотной последовательностью иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
39. Вторая антигенная композиция по одному из п.п. 1 или 3-38 или первая антигенная композиция по одному из п.п. 2-38, в которой аминокислотная последовательность по меньшей мере эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно в которой иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеет происхождение из патогена или его гомолога, фрагмента или варианта.
40. Первая или вторая антигенная композиция по п. 39, в которой патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
41. Первая или вторая антигенная композиция по п. 39 или п. 40, предназначенная для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
42. Вторая антигенная композиция по одному из п.п. 1 или 3-38 или первая антигенная композиция по одному из п.п. 2-38, в которой аминокислотная последовательность по меньшей мере эпитопа имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта, предпочтительно в которой иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта.
43. Первая или вторая антигенная композиция по п. 42, где опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
44. Первая или вторая антигенная композиция по п. 42 или п. 43, предназначенная для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
45. Вторая антигенная композиция по одному из п.п. 1 или 3-44 или первая антигенная композиция по одному из п.п. 2-44, где первая и/или вторая антигенная композиция содержит дополнительно адъювант.
46. Вторая антигенная композиция по одному из п.п. 1 или 3-45 или первая антигенная композиция по одному из п.п. 2-45, где первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно содержащую дополнительно фармацевтически приемлемый носитель.
47. Первая композиция вакцины, содержащая первую антигенную композицию по одному из п.п. 1-46.
48. Вторая композиция вакцины, содержащая вторую антигенную композицию по одному из п.п. 1-46.
49. Комбинация вакцин, содержащая:
- первую антигенную композицию по одному из п.п. 1-46 или первую композицию вакцины по п. 47;
и
- вторую антигенную композицию по одному из п.п. 1-46 или вторую композицию вакцины по п. 48.
50. Набор, предпочтительно для индукции иммунного ответа у индивидуума; где набор содержит несколько отдельных контейнеров, при этом содержание по меньшей мере двух контейнеров отличается друг от друга полностью или частично, где
первый из указанных контейнеров содержит:
- первую антигенную композицию по одному из п.п. 1-46 или первую композицию вакцины по п. 47;
и
второй из указанных контейнеров содержит:
- вторую антигенную композицию по одному из п.п. 1-46 или вторую композицию вакцины по п. 48.
51. Набор по п. 50, содержащий дополнительно инструкции по:
(а) введению индивидууму, предпочтительно нуждающемуся в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции;
и
(б) последующему введению индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции.
52. Упакованная вакцина, содержащая:
- первую антигенную композицию по одному из п.п. 1-46 или первую композицию вакцины по п. 47;
и/или
- вторую антигенную композицию по одному из п.п. 1-46 или вторую композицию вакцины по п. 48,
упаковку, дополнительно содержащую инструкции по:
(а) введению индивидууму, предпочтительно нуждающемуся в этом, по меньшей мере однократно в эффективном количестве первой антигенной композиции;
и
(б) последующему введению индивидууму по меньшей мере однократно в эффективном количестве второй антигенной композиции.
53. Первая композиция вакцины по п. 47, вторая композиция вакцины по п. 48, комбинация вакцин по п. 50, набор по п. 50 или п. 51 или упакованная вакцина по п. 52, предназначенные для применения в режиме прайм-буст вакцинации.
54. Набор по п.п. 50, 51 или 53 или упакованная вакцина по п. 52 или п. 54, содержащий/содержащая дополнительные инструкции по введению первой и/или второй антигенной(ых) композиции(й) по одному из п.п. 1-46.
55. Способ индукции иммунного ответа у индивидуума, где способ включает стадии, на которых:
(а) вводят индивидууму, который нуждается в этом, по меньшей мере однократно в эффективном количестве первую антигенную композицию,
и
(б) затем вводят индивидууму по меньшей мере однократно в эффективном количестве вторую антигенную композицию,
в котором первая антигенная композиция, вторая антигенная композиция и введение описаны в одном из п.п. 1-46.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КУРЕВАК АГ
<120> РЕЖИМЫ ПРАЙМ-БУСТ, ВКЛЮЧАЮЩИЕ ВВЕДЕНИЕ ПО МЕНЬШЕЙ МЕРЕ ОДНОЙ КОНСТРУКЦИИ
МРНК
<130> CU01P179WO1
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Histone stem-loop nucleotide sequence
<400> 1
caaaggctct tttcagagcc acca 24
<210> 2
<211> 24
<212> RNA
<213> Artificial Sequence
<220>
<223> Histone stem-loop RNA sequence
<400> 2
caaaggcucu uuucagagcc acca 24
<210> 3
<211> 186
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of 3'-UTR element of human albumin gene
<400> 3
catcacattt aaaagcatct cagcctacca tgagaataag agaaagaaaa tgaagatcaa 60
tagcttattc atctcttttt ctttttcgtt ggtgtaaagc caacaccctg tctaaaaaac 120
ataaatttct ttaatcattt tgcctctttt ctctgtgctt caattaataa aaaatggaaa 180
gaacct 186
<210> 4
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of 3' UTR element of an alpha-globin gene
<400> 4
gcccgatggg cctcccaacg ggccctcctc ccctccttgc accg 44
<210> 5
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence for 5'-UTR element
<400> 5
ggcgctgcct acggaggtgg cagccatctc cttctcggca tc 42
<210> 6
<211> 671
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of IRES of EMCV
<400> 6
ttgaaagccg ggggtgggag atccggattg ccagtctgct cgatatcgca ggctgggtcc 60
gtgactaccc actccccctt taattccgcc cctctccctc ccccccccct aacgttactg 120
gccgaagccg cttggaataa ggccggtgtg cgtttgtcta tatgttattt tccaccatat 180
tgccgtcttt tggcaatgtg agggcccgga aacctggccc tgtcttcttg acgagcattc 240
ctaggggtct ttcccctctc gccaaaggaa tgcaaggtct gttgaatgtc gtgaaggaag 300
cagttcctct ggaagcttct tgaagacaaa caacgtctgt agcgaccctt tgcaggcagc 360
ggaacccccc acctggcgac aggtgcctct gcggccaaaa gccacgtgta taagatacac 420
ctgcaaaggc ggcacaaccc cagtgccacg ttgtgagttg gatagttgtg gaaagagtca 480
aatggctctc ctcaagcgta ttcaacaagg ggctgaagga tgcccagaag gtaccccatt 540
gtatgggatc tgatctgggg cctcggtgca catgctttac gtgtgtttag tcgaggttaa 600
aaaacgtcta ggccccccga accacgggga cgtggttttc ctttgaaaaa cacgatgata 660
atagatctac c 671
<210> 7
<211> 461
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of IRES of EMCV
<400> 7
agcaggtttc cccaactgac acaaaacgtg caacttgaaa ctccgcctgg tctttccagg 60
tctagagggg taacactttg tactgcgttt ggctccacgc tcgatccact ggcgagtgtt 120
agtaacagca ctgttgcttc gtagcggagc atgacggccg tgggaactcc tccttggtaa 180
caaggaccca cggggccaaa agccacgccc acacgggccc gtcatgtgtg caaccccagc 240
acggcgactt tactgcgaaa cccactttaa agtgacattg aaactggtac ccacacactg 300
gtgacaggct aaggatgccc ttcaggtacc ccgaggtaac acgcgacact cgggatctga 360
gaaggggact ggggcttcta taaaagcgct cggtttaaaa agcttctatg cctgaatagg 420
tgaccggagg tcggcacctt tcctttacaa ttaaagaccc t 461
<210> 8
<211> 66
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of F2A peptide, version 1, of FMDV
<400> 8
gtgaagcaga cactcaattt cgaccttctg aagttggctg gagatgttga gtctaaccca 60
ggcccc 66
<210> 9
<211> 66
<212> DNA
<213> Artificial Sequence
<220>
<223> Nucleotide sequence of F2A peptide, version 2, of FMDV
<400> 9
gtcaaacaga ccttgaactt cgacttgctc aaactggccg gggatgtgga gtccaatcct 60
ggacct 66
<210> 10
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> linker sequence
<400> 10
Gly Gly Gly Ser Gly Gly Gly
1 5
<---
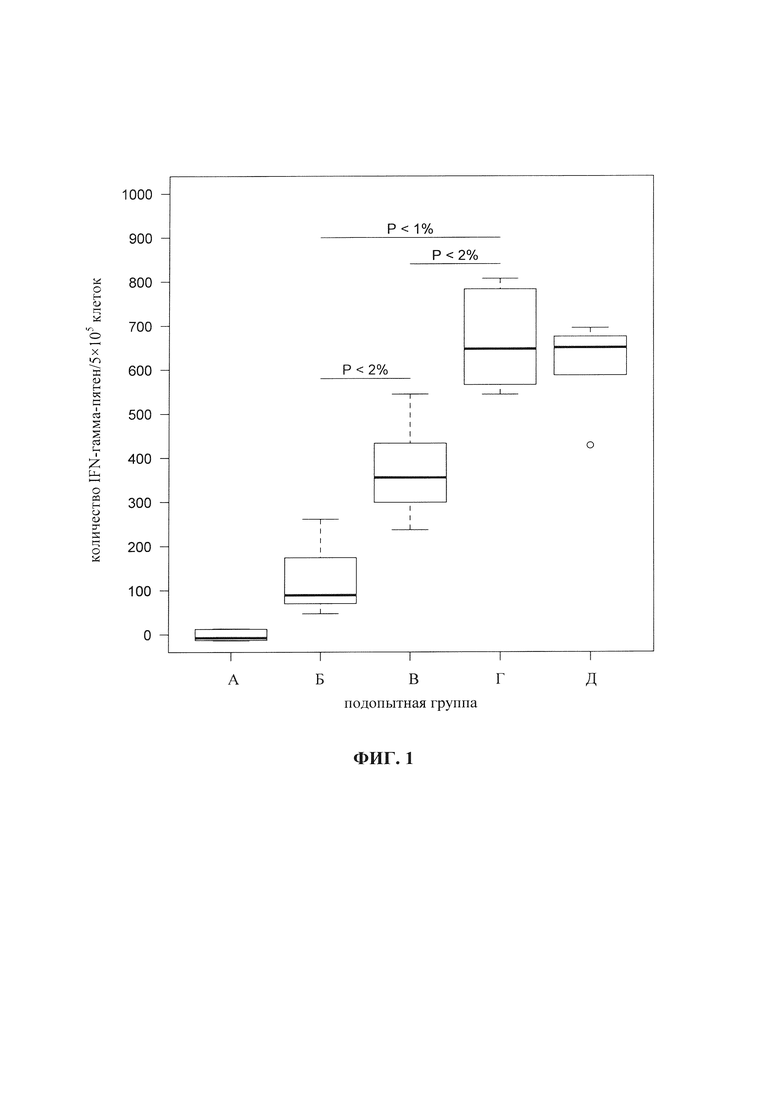
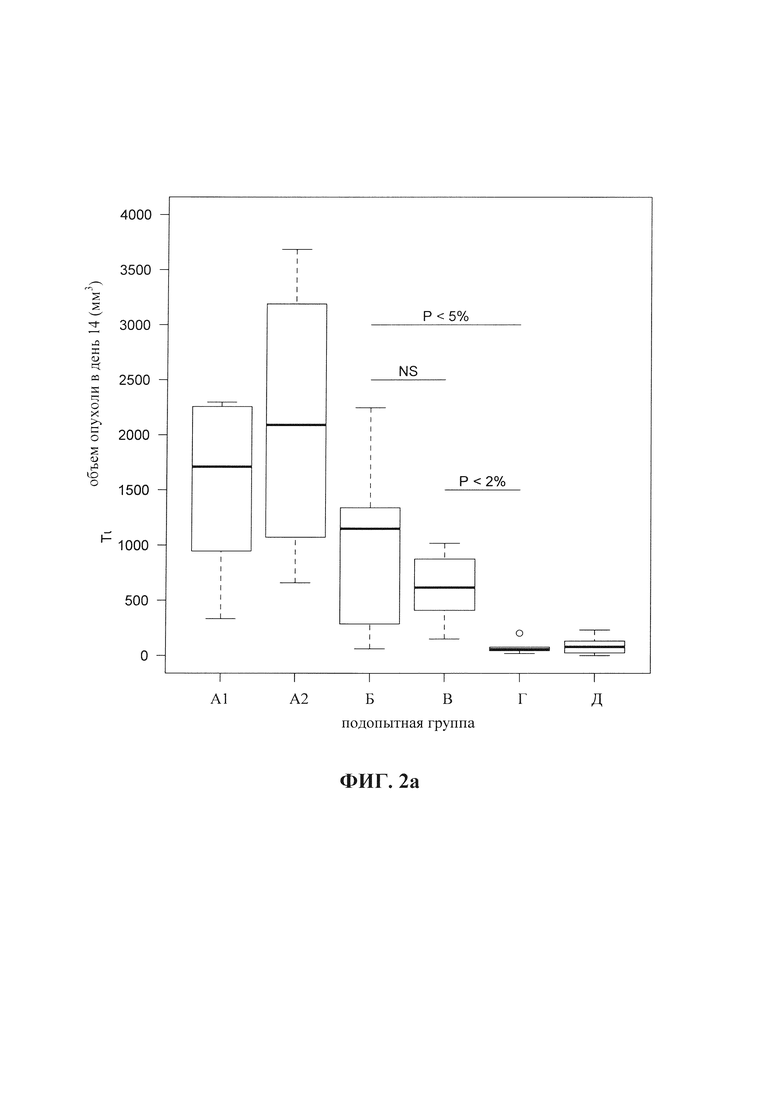
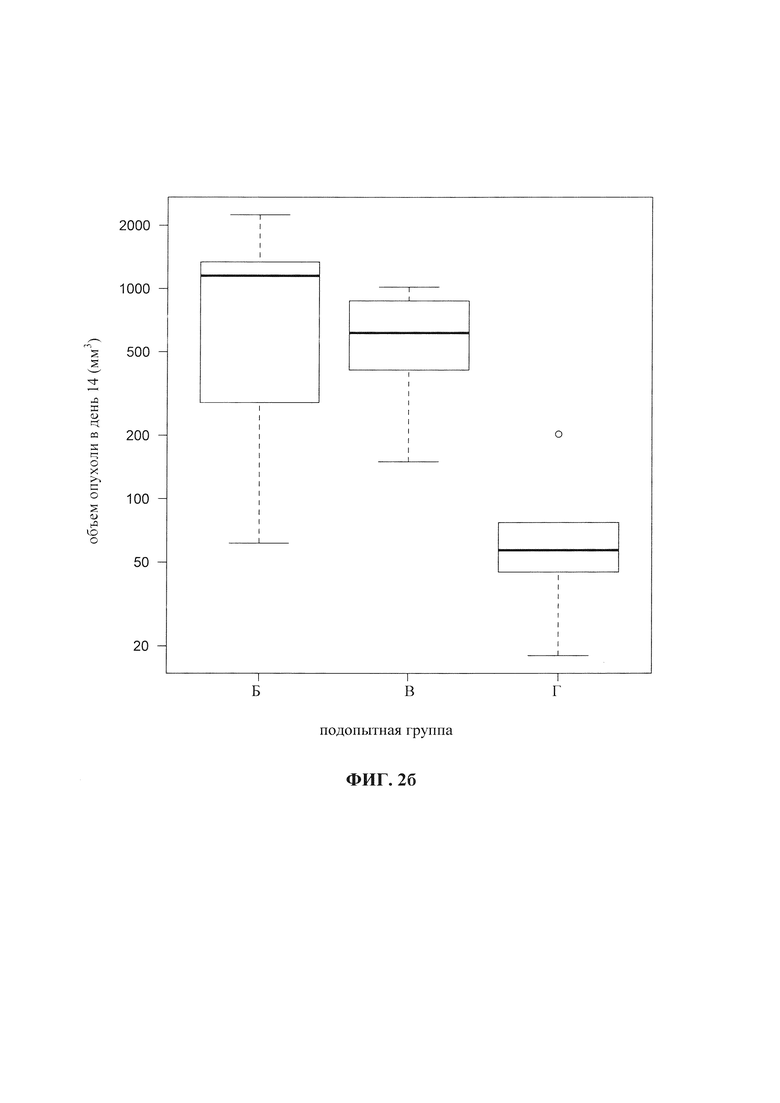
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая применение в качестве вакцины второй антигенной композиции, которая содержит эффективное количество конструкции мРНК, кодирующей иммуногенный пептид или полипептид, применение в качестве вакцины первой антигенной композиции, которая содержит иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид в эффективном количестве, при этом первую антигенную композицию вводят до введения индивидууму второй антигенной композиции, применение для вакцинации первой антигенной композиции и второй антигенной композиции, комбинацию вакцин, набор вакцин для индукции иммунного ответа у индивидуума, способ индукции иммунного ответа у индивидуума. Изобретение расширяет арсенал средств и способов для индукции иммунного ответа у индивидуума. 6 н. и 188 з.п. ф-лы, 3 ил., 3 табл., 4 пр.
1. Применение в качестве вакцины второй антигенной композиции, которая содержит эффективное количество конструкции мРНК, кодирующей иммуногенный пептид или полипептид,
причем эту антигенную композицию вводят однократно в эффективном количестве индивидууму, который нуждается в этом, после введения ему в эффективном количестве первой антигенной композиции, которая содержит иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
2. Применение в качестве вакцины первой антигенной композиции, которая содержит иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид в эффективном количестве, при этом первую антигенную композицию вводят в эффективном количестве индивидууму, который нуждается в этом, до введения индивидууму в эффективном количестве второй антигенной композиции, которая содержит конструкцию мРНК, кодирующую иммуногенный пептид или полипептид,
где:
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
3. Применение для вакцинации первой антигенной композиции, которая содержит иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид,
и
второй антигенной композиции, которая содержит
конструкцию мРНК, кодирующую иммуногенный пептид или полипептид, где
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
при этом вторую антигенную композицию вводят в эффективном количестве индивидууму, который нуждается в этом, после введения индивидууму в эффективном количестве первой антигенной композиции.
4. Применение по любому из пп. 1-3, где первую антигенную композицию и вторую антигенную композицию используют в качестве лекарственного средства для индукции иммунного ответа.
5. Применение по любому из пп. 1-4, где первую антигенную композицию и вторую антигенную композицию не вводят одновременно.
6. Применение по любому из пп. 1-5, где вторую антигенную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день(ей) после введения первой антигенной композиции.
7. Применение по любому из пп. 1-6, где:
первую антигенную композицию вводят в виде двух или более доз до введения второй антигенной композиции и/или
вторую антигенную композицию вводят в виде двух или более доз после введения первой антигенной композиции,
предпочтительно, где первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
8. Применение по п. 7, где интервал между введением одной или более пар последовательных доз составляет примерно от 5 до 120 дней.
9. Применение по любому из пп. 1-8, где первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
10. Применение по п. 9, где инъекцию осуществляют с использованием струйной инъекции.
11. Применение по любому из пп. 1-10, где вторая антигенная композиция содержит несколько или более одной конструкции мРНК.
12. Применение по любому из пп. 1-11, где содержание G/C в области конструкции мРНК, кодирующей эпитоп иммуногенного пептида или полипептида, повышено по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно в которой аминокислотную последовательность эпитопа иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
13. Применение по любому из пп. 1-12, где конструкция мРНК содержит дополнительно:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность;
и
(в) необязательно поли(С)-последовательность.
14. Применение по п. 13, где поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
15. Применение по любому из пп. 1-14, где конструкция мРНК дополнительно содержит гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
16. Применение по любому из пп. 1-15, где конструкция мРНК содержит дополнительно 3'-UTR-элемент.
17. Применение по п. 16, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
18. Применение по п. 17, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
19. Применение по п. 17 или 18, где 3'-UTR-элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
20. Применение по любому из пп. 1-19, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4 или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
21. Применение по любому из пп. 1-20, где конструкция мРНК содержит дополнительно 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
22. Применение по п. 21, где 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
23. Применение по п. 22, где 5'-UTR элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту.
24. Применение по п. 23, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена,
предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту;
(в) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта,
предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3 или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
25. Применение по любому из пп. 1-24, где конструкция мРНК ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне, составляющем примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
26. Применение по п. 25, где конструкция мРНК ассоциирована или включена в комплекс с катионным белком или пептидом, предпочтительно протамином.
27. Применение по любому из пп. 1-26, где первая антигенная композиция содержит иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
28. Применение по п. 27, где первая антигенная композиция содержит раствор иммуногенного пептида или полипептида, предпочтительно содержит раствор иммуногенного белка и/или иммуногенного пептида.
29. Применение по п. 27 или 28, где первая антигенная композиция содержит препарат, содержащий иммуногенный пептид или полипептид, где препарат предпочтительно выбран из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
30. Применение по любому из пп. 1-29, где первая антигенная композиция содержит конструкцию нуклеиновой кислоты, которая кодирует иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
31. Применение по п. 30, где указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
32. Применение по п. 31, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
33. Применение по п. 32, где вирусный вектор представляет собой вектор, имеющий происхождение из поксивируса, который выбирают из перечня, включающего: вирус оспы (натуральная оспа), вирус осповакцины, вирус коровьей оспы, вирус обезьян.
34. Применение по п. 33, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус осповакцины (NYVAC), ALVAC, TROVAC и модифицированный вирус осповакцины Анкара (MVA).
35. Применение по п. 34, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса MVA.
36. Применение по п. 35, где вирусный вектор получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса осповакцины в клетках фибробластов куриного эмбриона, или вирусный вектор получен из партии посевного материала вируса MVA 476 MG/14/78.
37. Применение по любому из пп. 34-36, где вирусный вектор свободен от загрязнения прионами.
38. Применение по п. 30, где указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
39. Применение по п. 30, где указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
40. Применение по любому из пп. 1-39, где аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, является идентичной или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичной аминокислотной последовательности иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
41. Применение по любому из пп. 1-40 для лечения или профилактики состояния, нарушения или заболевания.
42. Применение по любому из пп. 1-41, где аминокислотная последовательность эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из патогена или его гомолога, фрагмента или варианта.
43. Применение по любому из пп. 1-42, где патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
44. Применение по любому из пп. 1-42 для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
45. Применение по любому из пп. 1-41, где аминокислотная последовательность эпитопа имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта.
46. Применение по п. 45, где опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
47. Применение по п. 45 или 46 для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
48. Применение по любому из пп. 1-47, где первая и/или вторая антигенная композиция содержит дополнительно адъювант.
49. Применение по любому из пп. 1-48, где первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно содержащую дополнительно фармацевтически приемлемый носитель.
50. Применение по любому из пп. 1-49 в режиме прайм-буст вакцинации.
51. Комбинация вакцин, содержащая:
первую антигенную композицию, которая содержит
иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид в эффективном количестве, которая не представляет собой конструкцию мРНК;
и
вторую антигенную композицию, которая содержит
эффективное количество конструкции мРНК, кодирующей иммуногенный пептид или полипептид,
причем эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции.
52. Комбинация по п. 51, где ее используют в качестве лекарственного средства для индукции иммунного ответа.
53. Комбинация по п. 52, где первую антигенную композицию и вторую антигенную композицию вводят индивидууму, который нуждается в этом.
54. Комбинация по любому из пп. 51-53, где первую антигенную композицию и вторую антигенную композицию не вводят одновременно.
55. Комбинация по любому из пп. 51-54, где вторую антигенную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день(ей) после введения первой антигенной композиции.
56. Комбинация по любому из пп. 51-55, где:
первую антигенную композицию вводят в виде двух или более доз до введения второй антигенной композиции и/или
вторую антигенную композицию вводят в виде двух или более доз после введения первой антигенной композиции,
предпочтительно, где первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
57. Комбинация по п. 56, где интервал между введением одной или более пар последовательных доз составляет примерно от 5 до 120 дней.
58. Комбинация по любому из пп. 51-57, где первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
59. Комбинация по п. 58, где инъекцию осуществляют с использованием струйной инъекции.
60. Комбинация по любому из пп. 51-59, где вторая антигенная композиция содержит несколько или более одной конструкции мРНК.
61. Комбинация по любому из пп. 51-60, где содержание G/C в области конструкции мРНК, кодирующей эпитоп иммуногенного пептида или полипептида, повышено по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно в которой аминокислотную последовательность эпитопа иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
62. Комбинация по любому из пп. 51-61, где конструкция мРНК содержит дополнительно:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность; и
(в) необязательно поли(С)-последовательность.
63. Комбинация по п. 62, где поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
64. Комбинация по любому из пп. 51-63, где конструкция мРНК дополнительно содержит гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
65. Комбинация по любому из пп. 51-64, где конструкция мРНК содержит дополнительно 3'-UTR-элемент.
66. Комбинация по п. 65, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
67. Комбинация по п. 66, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
68. Комбинация по п. 66 или 67, где 3'-UTR-элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
69. Комбинация по любому из пп. 51-68, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4 или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
70. Комбинация по любому из пп. 51-69, где конструкция мРНК содержит дополнительно 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
71. Комбинация по п. 70, где 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
72. Комбинация по п. 71, где 5'-UTR элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту.
73. Комбинация по п. 72, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту;
(в) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта,
предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3 или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
74. Комбинация по любому из пп. 51-73, где конструкция мРНК ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне, составляющем примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
75. Комбинация по п. 74, где конструкция мРНК ассоциирована или включена в комплекс с катионным белком или пептидом, предпочтительно протамином.
76. Комбинация по любому из пп. 51-75, где первая антигенная композиция содержит иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
77. Комбинация по п. 76, где первая антигенная композиция содержит раствор иммуногенного пептида или полипептида, предпочтительно содержит раствор иммуногенного белка и/или иммуногенного пептида.
78. Комбинация по п. 76 или 77, где первая антигенная композиция содержит препарат, содержащий иммуногенный пептид или полипептид, где препарат предпочтительно выбран из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
79. Комбинация по любому из пп. 51-78, где первая антигенная композиция содержит конструкцию нуклеиновой кислоты, которая кодирует иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
80. Комбинация по п. 79, где указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
81. Комбинация по п. 80, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
82. Комбинация по п. 81, где вирусный вектор представляет собой вектор, имеющий происхождение из поксивируса, который выбирают из перечня, включающего: вирус оспы (натуральная оспа), вирус осповакцины, вирус коровьей оспы, вирус обезьян.
83. Комбинация по п. 82, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус осповакцины (NYVAC), ALVAC, TROVAC и модифицированный вирус осповакцины Анкара (MVA).
84. Комбинация по п. 83, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса MVA.
85. Комбинация по п. 84, где вирусный вектор получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса осповакцины в клетках фибробластов куриного эмбриона, или вирусный вектор получен из партии посевного материала вируса MVA 476 MG/14/78.
86. Комбинация по любому из пп. 82-85, где вирусный вектор свободен от загрязнения прионами.
87. Комбинация по п. 79, где указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
88. Комбинация по п. 79, где указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
89. Комбинация по любому из пп. 51-88, где аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, является идентичной или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичной аминокислотной последовательности иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
90. Комбинация по любому из пп. 51-89 для лечения или профилактики состояния, нарушения или заболевания.
91. Комбинация по любому из пп. 51-90, где аминокислотная последовательность эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из патогена или его гомолога, фрагмента или варианта.
92. Комбинация по любому из пп. 51-91, где патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
93. Комбинация по любому из пп. 51-92 для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
94. Комбинация по любому из пп. 51-91, где аминокислотная последовательность эпитопа имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта, где предпочтительно иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта.
95. Комбинация по п. 94, где опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
96. Комбинация по п. 94 или 95 для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
97. Комбинация по любому из пп. 51-96, где первая и/или вторая антигенная композиция содержит дополнительно адъювант.
98. Комбинация по любому из пп. 51-97, где первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно содержащую дополнительно фармацевтически приемлемый носитель.
99. Комбинация вакцин по п. 98 для применения в режиме прайм-буст вакцинации.
100. Набор вакцин для индукции иммунного ответа у индивидуума; где набор содержит несколько отдельных контейнеров,
первый из указанных контейнеров содержит:
первую антигенную композицию, которая содержит
иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид в эффективном количестве, которая не представляет собой конструкцию мРНК; и
второй из указанных контейнеров содержит:
вторую антигенную композицию, которая содержит
эффективное количество конструкции мРНК, кодирующей иммуногенный пептид или полипептид,
причем эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
где первая и/или вторая антигенная композиция содержит дополнительно адъювант.
101. Набор по п. 100, где первую антигенную композицию и вторую антигенную композицию вводят индивидууму, который нуждается в этом.
102. Набор по любому из пп. 100, 101, где первую антигенную композицию и вторую антигенную композицию не вводят одновременно.
103. Набор по любому из пп. 100-102, где вторую антигенную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день(ей) после введения первой антигенной композиции.
104. Набор по любому из пп. 100-103, где:
первую антигенную композицию вводят в виде двух или более доз до введения второй антигенной композиции и/или вторую антигенную композицию вводят в виде двух или более доз после введения первой антигенной композиции,
предпочтительно, где первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
105. Набор по п. 104, где интервал между введением одной или более пар последовательных доз составляет примерно от 5 до 120 дней.
106. Набор по любому из пп. 100-105, где первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
107. Набор по п. 106, где инъекцию осуществляют с использованием струйной инъекции.
108. Набор по любому из пп. 100-107, где вторая антигенная композиция содержит несколько или более одной конструкции мРНК.
109. Набор по любому из пп. 100-108, где содержание G/C в области конструкции мРНК, кодирующей эпитоп иммуногенного пептида или полипептида, повышено по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно в которой аминокислотную последовательность эпитопа иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
110. Набор по любому из пп. 100-109, где конструкция мРНК содержит дополнительно:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность; и
(в) необязательно поли(С)-последовательность.
111. Набор по п. 110, где поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
112. Набор по любому из пп. 100-111, где конструкция мРНК дополнительно содержит гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
113. Набор по любому из пп. 100-112, где конструкция мРНК содержит дополнительно 3'-UTR-элемент.
114. Набор по п. 113, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
115. Набор по п. 114, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
116. Набор по п. 114 или 115, где 3'-UTR-элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
117. Набор по любому из пп. 100-116, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4 или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
118. Набор по любому из пп. 100-117, где конструкция мРНК содержит дополнительно 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
119. Набор по п. 118, где 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
120. Набор по п. 119, где 5'-UTR элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту.
121. Набор по п. 120, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту;
(в) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта,
предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3 или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
122. Набор по любому из пп. 100-121, где конструкция мРНК ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне, составляющем примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
123. Набор по п. 122, где конструкция мРНК ассоциирована или включена в комплекс с катионным белком или пептидом, предпочтительно протамином.
124. Набор по любому из пп. 100-123, где первая антигенная композиция содержит иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
125. Набор по п. 124, где первая антигенная композиция содержит раствор иммуногенного пептида или полипептида, предпочтительно содержит раствор иммуногенного белка и/или иммуногенного пептида.
126. Набор по п. 124 или 125, где первая антигенная композиция содержит препарат, содержащий иммуногенный пептид или полипептид, где препарат предпочтительно выбран из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
127. Набор по любому из пп. 100-126, где первая антигенная композиция содержит конструкцию нуклеиновой кислоты, которая кодирует иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
128. Набор по п. 127, где указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
129. Набор по п. 128, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
130. Набор по п. 129, где вирусный вектор представляет собой вектор, имеющий происхождение из поксивируса, который выбирают из перечня, включающего: вирус оспы (натуральная оспа), вирус осповакцины, вирус коровьей оспы, вирус обезьян.
131. Набор по п. 130, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус осповакцины (NYVAC), ALVAC, TROVAC и модифицированный вирус осповакцины Анкара (MVA).
132. Набор по п. 131, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса MVA.
133. Набор по п. 132, где вирусный вектор получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса осповакцины в клетках фибробластов куриного эмбриона, или вирусный вектор получен из партии посевного материала вируса MVA 476 MG/14/78.
134. Набор по любому из пп. 132, 133, где вирусный вектор свободен от загрязнения прионами.
135. Набор по п. 127, где указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
136. Набор по п. 127, где указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
137. Набор по любому из пп. 100-136, где аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, является идентичной или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичной аминокислотной последовательности иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
138. Набор по любому из пп. 100-137 для лечения или профилактики состояния, нарушения или заболевания.
139. Набор по любому из пп. 100-138, где аминокислотная последовательность эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из патогена или его гомолога, фрагмента или варианта.
140. Набор по любому из пп. 100-139, где патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
141. Набор по любому из пп. 100-140 для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
142. Набор по любому из пп. 100-141, где аминокислотная последовательность эпитопа имеет происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта, где предпочтительно иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из опухолевой или раковой клетки или ее гомолога, фрагмента или варианта.
143. Набор по п. 142, где опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
144. Набор по п. 142 или 143 для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
145. Набор по любому из пп. 100-144, где первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно содержащую дополнительно фармацевтически приемлемый носитель.
146. Набор по п. 145, содержащий дополнительно инструкции по:
(а) введению индивидууму, предпочтительно нуждающемуся в этом, в эффективном количестве первой антигенной композиции; и
(б) последующему введению индивидууму в эффективном количестве второй антигенной композиции.
147. Набор по любому из пп. 100-146 для применения в режиме прайм-буст вакцинации.
148. Способ индукции иммунного ответа у индивидуума, где способ включает стадии, на которых:
(а) вводят индивидууму, который нуждается в этом, в эффективном количестве первую антигенную композицию, и
(б) затем вводят индивидууму в эффективном количестве вторую антигенную композицию, в котором первая антигенная композиция содержит
иммуногенный пептид или полипептид и/или которая содержит конструкцию нуклеиновой кислоты, кодирующую иммуногенный пептид или полипептид,
и
вторая антигенная композиция содержит
конструкцию мРНК, кодирующую иммуногенный пептид или полипептид, где
конструкция нуклеиновой кислоты, если она входит в первую антигенную композицию, не представляет собой конструкцию мРНК;
и
эпитоп иммуногенного пептида или полипептида, который содержится в первой антигенной композиции или кодируется конструкцией нуклеиновой кислоты, входящей в первую антигенную композицию, является идентичным или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичным эпитопу иммуногенного пептида или полипептида, кодируемого конструкцией мРНК второй антигенной композиции,
при этом вторую антигенную композицию вводят в эффективном количестве индивидууму, который нуждается в этом, после введения индивидууму в эффективном количестве первой антигенной композиции.
149. Способ по п. 148, где первую антигенную композицию и вторую антигенную композицию не вводят одновременно.
150. Способ по любому из пп. 148, 149, где вторую антигенную композицию вводят примерно через 28, 14 или 7 дней после введения первой антигенной композиции, предпочтительно примерно через 27, 24, 21, 18, 15, 12, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 день(ей) после введения первой антигенной композиции.
151. Способ по любому из пп. 148-150, где:
первую антигенную композицию вводят в виде двух или более доз до введения второй антигенной композиции и/или
вторую антигенную композицию вводят в виде двух или более доз после введения первой антигенной композиции,
предпочтительно, где первую антигенную композицию и/или вторую антигенную композицию вводят с использованием количества доз, выбранного из перечня, состоящего из: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
152. Способ по п. 151, где интервал между введением одной или более пар последовательных доз составляет примерно от 5 до 120 дней.
153. Способ по любому из пп. 148-152, где первую антигенную композицию и/или вторую антигенную композицию вводят путем подкожной, внутримышечной и/или внутрикожной инъекции.
154. Способ по п. 153, где инъекцию осуществляют с использованием струйной инъекции.
155. Способ по любому из пп. 148-154, где вторая антигенная композиция содержит несколько или более одной конструкции мРНК.
156. Способ по любому из пп. 148-155, где содержание G/C в области конструкции мРНК, кодирующей эпитоп иммуногенного пептида или полипептида, повышено по сравнению с содержанием G/C в области мРНК дикого типа, которая кодирует эпитоп иммуногенного пептида или полипептида, предпочтительно в которой аминокислотную последовательность эпитопа иммуногенного пептида или полипептида, кодируемую обогащенной G/C мРНК, не модифицируют по сравнению с аминокислотной последовательностью эпитопа иммуногенного пептида или полипептида, кодируемого мРНК дикого типа.
157. Способ по любому из пп. 148-156, где конструкция мРНК содержит дополнительно:
(а) структуру 5'-кэпа;
(б) поли(А)-последовательность; и
(в) необязательно поли(С)-последовательность.
158. Способ по п. 157, где поли(А)-последовательность содержит последовательность, содержащую от примерно 25 до примерно 400 аденозиновых нуклеотидов, предпочтительно последовательность, содержащую от примерно 50 до примерно 400 аденозиновых нуклеотидов, более предпочтительно последовательность, содержащую примерно 50 до примерно 300 аденозиновых нуклеотидов, еще более предпочтительно последовательность, содержащую от примерно 50 до примерно 250 аденозиновых нуклеотидов, наиболее предпочтительно последовательность, содержащую от примерно 60 до примерно 250 аденозиновых нуклеотидов.
159. Способ по любому из пп. 148-158, где конструкция мРНК дополнительно содержит гистоновую структуру типа «стебель-петля», предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
160. Способ по любому из пп. 148-159, где конструкция мРНК содержит дополнительно 3'-UTR-элемент.
161. Способ по п. 160, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта.
162. Способ по п. 161, где 3'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 3'-UTR гена, выбранного из группы, которая состоит из гена альбумина, гена альфа-глобина, гена бета-глобина, гена тирозингидроксилазы, гена липоксигеназы и гена коллагена альфа; или из его гомолога, фрагмента или варианта.
163. Способ по п. 161 или 162, где 3'-UTR-элемент имеет происхождение из нуклеотидной последовательности, имеющей SEQ ID NO: 3 или SEQ ID NO: 4, или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта.
164. Способ по любому из пп. 148-163, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(в) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена альфа-глобина, предпочтительно содержит последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 4 или ее гомологу, фрагменту или варианту;
(г) необязательно поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(д) необязательно поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(е) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
165. Способ по любому из пп. 148-164, где конструкция мРНК содержит дополнительно S'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена или из соответствующей последовательности РНК, ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
166. Способ по п. 165, где 5'-UTR-элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего рибосомный белок, или из соответствующей последовательности РНК или из ее гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива.
167. Способ по п. 166, где 5'-UTR элемент содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, кодирующего белок большой субъединицы рибосомы (RPL), или из его гомолога, фрагмента или варианта, предпочтительно без 5'ТОР-мотива, и более предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту.
168. Способ по п. 167, где конструкция мРНК содержит, предпочтительно в 5'→3'-направлении:
(а) структуру 5'-кэпа, предпочтительно m7GpppN;
(б) 5'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из 5'-UTR ТОР-гена, предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 5 или ее гомологу, фрагменту или варианту;
(в) кодирующую область, которая кодирует иммуногенный пептид или полипептид;
(г) 3'-UTR-элемент, который содержит или состоит из нуклеотидной последовательности, имеющей происхождение из гена, обеспечивающего получение стабильной мРНК, или из его гомолога, фрагмента или варианта,
предпочтительно содержит или состоит из последовательности РНК, соответствующей нуклеотидной последовательности SEQ ID NO: 3 или ее гомологу, фрагменту или варианту;
(д) поли(А)-последовательность, предпочтительно содержащую примерно 64 аденозина;
(е) поли(С)-последовательность, предпочтительно содержащую примерно 30 цитозинов; и
(ж) гистоновую структуру типа «стебель-петля», предпочтительно содержащую последовательность РНК, соответствующую нуклеотидной последовательности SEQ ID NO: 1 или ее гомологу, фрагменту или варианту.
169. Способ по любому из пп. 148-168, где конструкция мРНК ассоциирована или включена в комплекс с катионным или поликатионным соединением или полимерным носителем, предпочтительно в массовом соотношении мРНК к катионному или поликатионному соединению и/или полимерному носителю, выбранном из диапазона от примерно 6:1 до примерно 0,25:1 (мас./мас.), более предпочтительно от примерно 5:1 до примерно 0,5:1 (мас./мас.), еще более предпочтительно от примерно 4:1 до примерно 1:1 (мас./мас.) или от примерно 3:1 до примерно 1:1 (мас./мас.), и наиболее предпочтительно соотношение составляет от примерно 3:1 до примерно 2:1 (мас./мас.); или необязательно в соотношении, при котором соотношение азот/фосфат между мРНК и катионным или поликатионным соединением и/или полимерным носителем находится в диапазоне, составляющем примерно 0,1-10, предпочтительно в диапазоне примерно 0,3-4 или 0,3-1, более предпочтительно в диапазоне примерно 0,5-1 или 0,7-1 и наиболее предпочтительно в диапазоне примерно 0,3-0,9 или 0,5-0,9.
170. Способ по п. 169, где конструкция мРНК ассоциирована или включена в комплекс с катионным белком или пептидом, предпочтительно протамином.
171. Способ по любому из пп. 148-170, где первая антигенная композиция содержит иммуногенный пептид или полипептид, предпочтительно иммуногенный белок или иммуногенный пептид.
172. Способ по п. 171, где первая антигенная композиция содержит раствор иммуногенного пептида или полипептида, предпочтительно содержит раствор иммуногенного белка и/или иммуногенного пептида.
173. Способ по п. 171 или 172, где первая антигенная композиция содержит препарат, содержащий иммуногенный пептид или полипептид, где препарат предпочтительно выбран из перечня, состоящего из: вирусного препарата, клеточного препарата и бактериального препарата.
174. Способ по любому из пп. 148-173, где первая антигенная композиция содержит конструкцию нуклеиновой кислоты, которая кодирует иммуногенный пептид или полипептид, предпочтительно в котором конструкция нуклеиновой кислоты представляет собой конструкцию ДНК.
175. Способ по п. 174, где указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
176. Способ по п. 175, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса, который выбран из перечня, состоящего из: поксивируса, аденовируса, аденоассоциированного вируса (AAV), альфа-вируса, вируса герпеса, ретровируса, лентивируса, цитомегаловируса, вируса Сендай, флавивируса, парвовируса.
177. Способ по п. 176, где вирусный вектор представляет собой вектор, имеющий происхождение из поксивируса, который выбирают из перечня, включающего: вирус оспы (натуральная оспа), вирус осповакцины, вирус коровьей оспы, вирус обезьян.
178. Способ по п. 177, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса коровьей оспы, выбранного из перечня, который включает: Нью-Йорский ослабленный вирус осповакцины (NYVAC), ALVAC, TROVAC и модифицированный вирус осповакцины Анкара (MVA).
179. Способ по п. 178, где вирусный вектор представляет собой вектор, имеющий происхождение из вируса MVA.
180. Способ по п. 179, где вирусный вектор получен из партии посевного материала вируса 460 MG, полученной после 571-ого пассажа вируса осповакцины в клетках фибробластов куриного эмбриона, или вирусный вектор получен из партии посевного материала вируса MVA 476 MG/14/78.
181. Способ по любому из пп. 178-180, где вирусный вектор свободен от загрязнения прионами.
182. Способ по п. 174, где указанная конструкция нуклеиновой кислоты представляет собой самореплицирующуюся молекулу РНК.
183. Способ по п. 174, где указанная конструкция нуклеиновой кислоты не представляет собой вирусный вектор и/или не представляет собой самореплицирующуюся молекулу РНК.
184. Способ по любому из пп. 148-183, где аминокислотная последовательность иммуногенного пептида или полипептида, содержащегося в первой антигенной композиции или кодируемого конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, является идентичной или по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95% или по меньшей мере на 98% идентичной аминокислотной последовательности иммуногенного пептида или полипептида, кодируемого конструкцией мРНК, содержащейся во второй антигенной композиции.
185. Способ по любому из пп. 148-184 для лечения или профилактики состояния, нарушения или заболевания.
186. Способ по любому из пп. 148-185, где аминокислотная последовательность эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из патогена или его гомолога, фрагмента или варианта.
187. Способ по любому из пп. 148-186, где патоген представляет собой патоген, выбранный из перечня, который состоит из: вируса, бактерии, гриба и простейшего организма.
188. Способ по любому из пп. 148-187 для лечения или профилактики инфекции, вызываемой патогеном или состоянием, нарушением или заболеванием, ассоциированным с ним.
189. Способ по любому из пп. 148-188, где аминокислотная последовательность эпитопа имеет происхождение из патогена или его гомолога, фрагмента или варианта, предпочтительно, где иммуногенный пептид или полипептид, содержащийся в первой антигенной композиции или кодируемый конструкцией нуклеиновой кислоты, содержащейся в первой антигенной композиции, и иммуногенный пептид или полипептид, кодируемый конструкцией мРНК, содержащейся во второй антигенной композиции, имеют происхождение из опухолевой или раковой клетки или его гомолога, фрагмента или варианта.
190. Способ по п. 189, где опухолевая или раковая клетка представляет собой клетку из опухоли или рака, выбранного из следующего перечня: рак предстательной железы, рак легкого, рак молочной железы, рак головного мозга, рак ободочной кишки, рак желудка, рак печени, рак поджелудочной железы, рак яичника, лимфома, лейкоз и миелома.
191. Способ по п. 189 или 190 для лечения или профилактики опухоли или рака или состояния, нарушения или заболевания, ассоциированного с ними.
192. Способ по любому из пп. 148-191, где первая и/или вторая антигенная композиция содержит дополнительно адъювант.
193. Способ по любому из пп. 148-192, где первая антигенная композиция и/или вторая антигенная композиция представляет собой фармацевтическую композицию, необязательно содержащую дополнительно фармацевтически приемлемый носитель.
194. Способ по любому из пп. 148-193, который проводят в режиме прайм-буст вакцинации.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| МАЛЬЦЕВ В.Н | |||
| и др., "Основы микробиологии и иммунологии | |||
| Курс лекций: Учебное пособие.-М.: ОАО "Издательство "Медицина", 2005.-280 с.: ил., стр.107. | |||
Авторы
Даты
2021-02-12—Публикация
2016-05-13—Подача