Предлагаемое изобретение относится к области медицины, в частности к способу диагностики чувствительности М. tuberculosis (МБТ) к инъекционным противотуберкулезным препаратам резервного ряда (канамицину, капреомицину, амикацину и др.). Данный способ позволяет выявлять мутации в гене rrs, обусловливающие устойчивость МБТ к указанной группе препаратов, а также мутации в промоторной области гена eis, ответственные за развитие устойчивости к канамицину. Способ заключается в амплификации соответствующих последовательностей ДНК исследуемого гена МБТ с последующим анализом конформационного полиморфизма одноцепочечных фрагментов ДНК после их разделения в полиакриламидном геле.
В 2010 г. в мире насчитывалось около 650 тыс больных туберкулезом с множественной лекарственной устойчивостью (МЛУ), т.е. с устойчивостью к двум основным противотуберкулезным препаратам (ПТП) - рифампицину и изониазиду (WHO. Global Tuberculosis Control, 2011). Эпидемиологическая ситуация дополнительно осложняется распространением туберкулеза с широкой лекарственной устойчивостью (ШЛУ), т.е. с сочетанием МЛУ с устойчивостью, по крайней мере, к одному из фторхинолонов и одному из инъекционных ПТП резервного ряда. Туберкулез с МЛУ и ШЛУ плохо поддается лечению существующими ПТП; требуется проведение длительной (18-24 месяца) комплексной дорогостоящей терапии, вызывающей серьезные побочные эффекты (Haydel SE. Extensively Drug-Resistant Tuberculosis: A Sign of the Times and an Impetus for Antimicrobial Discovery. Pharmaceuticals (Basel). 2010 Jul 1; 3 (7): 2268-2290). Набор препаратов выбора в случае лекарственноустойчивого туберкулеза существенно ограничен, поэтому особенно актуальна быстрая и точная диагностика чувствительности МБТ к ПТП, в частности резервного ряда.
Культуральные методы являются «золотым стандартом» в лабораторной диагностике туберкулеза. Получение культуры МБТ и определение лекарственной чувствительности на плотной питательной среде Левенштейна-Йенсена занимает 2-3 месяца. Таким образом, длительность получения ответа не позволяет своевременно внести коррективы в режим химиотерапии. Использование жидких питательных сред в современных автоматизированных системах дает возможность сократить время получения культуры до 10-14 дней. Однако в настоящее время нет готовых наборов и единых стандартов для определения чувствительности МБТ к инъекционным ПТП резервного ряда на жидких средах, а получение антибиотикограммы на среде Левенштейна-Йенсена занимает, по меньшей мере, месяц.
Несомненным преимуществом молекулярно-генетических методов является возможность выполнения анализа в течение 1-2 суток. Таким образом, используя культуру МБТ, полученную на жидкой питательной среде, и какой-либо из молекулярных методов, можно ускорить определение чувствительности МБТ к инъекционным ПТП резервного ряда на 15-20 дней.
В бактериальных клетках мишенью инъекционных ПТП является А-сайт 30S-рибосомы. Связывание молекулы препарата с 16S-pPHK блокирует транслокацию пептидил-т РНК с А-сайта на Р-сайт, в результате трансляция белков нарушается. Отсутствие важнейших белков приводит к гибели клетки (бактерицидное действие) (Fourmy D, Recht MI, Blanchard SC et al. Structure of the A site of Escherichia coli 16S ribosomal RNA complexed with an aminoglycoside antibiotic. Science. 1996 Nov 22; 274 (5291): 1367-1371).
До недавнего времени был известен только один механизм развития устойчивости МБТ к инъекционным ПТП резервного ряда: возникновение мутации в гене 16S-pPHK (rrs). Чаще всего встречается замена А на G в 1401 положении. Для штаммов с мутациями в гене rrs показана перекрестная устойчивость МБТ к канамицину, амикацину и капреомицину (Maus СЕ, Plikaytis ВВ, Shinnick ТМ. Molecular analysis of cross-resistance to capreomycin, kanamycin, amikacin, and viomycin in Mycobacterium tuberculosis. Antimicrob Agents Chemother. 2005 Aug; 49 (8): 3192-3197). Однако генетический анализ мутаций в гене rrs не позволяет выявить устойчивость МБТ к канамицину во всех случаях.
В 2009 году М.А. Zaunbrecher и соавт. опубликовали работу, в которой показали влияние мутаций в промоторной области гена eis (Enhanced intracellular iSlirvival protein) на развитие устойчивости МБТ к невысоким дозам канамицина. Ген eis кодирует ацетилтрансферазу Eis, по всей вероятности относящуюся к суперсемейству ацетилтрансфераз GNAT. Eis специфически ацетилирует канамицин и амикацин, однако скорость ацетилирования канамицина значительно выше, чем объясняется отсутствие перекрестной устойчивости к амикацину у штаммов с мутациями в промоторной области гена eis. Появление мутаций в промоторной области гена приводит к многократному увеличению его экспрессии и, следовательно, к накоплению фермента и нарастанию его эффекта, т.е. в конечном счете, к инактивации антибиотика (Zaunbrecher MA, Sikes RD Jr, Metchock В et al. Overexpression of the chromosomally encoded aminoglycoside acetyltransferase eis confers kanamycin resistance in Mycobacterium tuberculosis. Proc Natl Acad Sci USA. 2009 Nov 24; 106 (47): 20004-20009).
Существуют различные методы определения мутаций, однако все они построены по общему принципу. С помощью ПНР нарабатывается необходимое количество копий исследуемой ДНК, после чего либо напрямую определяется ее нуклеотидная последовательность (секвенирование), либо мутацию детектируют с помощью одного из косвенных методов (анализа полиморфизма длин рестрикционных фрагментов, конформационного полиморфизма одноцепочечных фрагментов, денатурирующего градиентного гель-электрофореза и т.д.).
Аналогом данного изобретения является способ определения мутаций в гене rpoB, ответственных за резистентность МБТ к рифампицину, с помощью метода конформационного полиморфизма одноцепочечных фрагментов (Negi SS, Singh U, Gupta S et al. Characterization of RPO В gene for detection of rifampicin drug resistance by SSCP and sequence analysis. Indian J Med Microbiol. 2009 Jul-Sep; 27 (3): 226-230).
Прототипом данного изобретения является способ диагностики чувствительности штаммов Mycobacterium tuberculosis к аминогликозидам, предложенный Носовой Е.Ю. и соавт. (патент на изобретение №2409680 от 20.01.2011). Данный способ позволяет выявлять однонуклеотидные замены A1HO1G, С1402Т, С1401А и G1484T в гене rrs. Способ состоит из следующих этапов:
1. Выделение ДНК из культур МБТ прогреванием при 95°C в течение 20 мин в ТЕ буфере с 1% тритоном (рН 8,8).
2. ПЦР-амплификация участка гена rrs длиной 300 п.н. в 50 мкл реакционной среды содержащей 10 мМ Трис-HC1 рН 8,8; 50 мМ КС1; 0,5% Твин 20; 5% - формамида, 2,5 мМ MgC12, 2,5 U Taq полимеразы, по 200 мкМ каждого нуклеозидтрифосфата, по 0,5 мкМ каждого олигонуклеотидного праймера и 3 мкл образца. Используемые праймеры были предложены Suzuki Y.C. и соавт. в статье Detection of kanamycin-resistant Mycobacterium tuberculosis by identifying mutations in the 16S rRNA gene.// J. Clin. Microbiol. - 1998. - v. 36. - p. 1220-1225. Выбранные условия амплификации представляют собой следующее: 1-ый этап - 94°- 5 мин; 2-ой этап - 94° - 60 сек., 55° - 60 сек., 72° - 60 сек (35 циклов); 3-ий этап: 72° - 5 мин; 10° - хранение.
3. ПДРФ-анализ полученных продуктов амплификации с помощью рестриктаз BstDEI, BtrI, Нру99I. Разделение продуктов рестрикции проводится в 3% агарозном геле, окрашенном бромидом этидия.
Однако наш опыт определения чувствительности МБТ к инъекционным препаратам резервного ряда, а также имеющиеся литературные данные свидетельствуют о необходимости поиска мутаций не только в гене rrs, но и в промоторной области гена eis.
Отличия предлагаемого нами способа состоят в следующем:
1. Дополнительно проводится исследование промоторной области гена eis, для чего были подобраны праймеры и оптимальные условия амплификации.
2. Структурные особенности промоторной области гена eis делают невозможным использование метода ПДРФ для детекции интересующих нас мутаций, поэтому нами был выбран метод SSCP как достаточно воспроизводимый, не требующий больших затрат и позволяющий выявлять мутации в обоих исследуемых фрагментах ДНК, что упрощает и ускоряет получение результата.
Используемая нами методика включает следующие этапы:
1. Выделение ДНК из культур МБТ, полученных на жидкой питательной среде Middlebrook 7Н9 в автоматизированной системе ВАСТЕС™ MGIT™ 960 (Becton Dickinson, США), прогреванием при 95°C в течение 20 мин в ТЕ буфере с 1% тритоном (pH 8,8).
2. Для амплификации участка гена rrs использовали реакционную среду и программу амплификации, предложенные Носовой Е.Ю. и соавт., однако для повышения чувствительности метода количество вносимой в пробирки ДНК было увеличено до 5 мкл, общий объем составил 50 мкл.
3. Для амплификации промоторной области гена eis с помощью программного обеспечения Lasergene® Core Suite (DNASTAR, Inc., США) были подобраны прямой (5'CGGAGCCGTCGGGGTATGC) и обратный (5'GCCGCGGCCAGTAGGAACA) праймеры. Использовали реакционную среду, аналогичную предложенной для rrs, с той разницей, что общий объем среды составлял 30 мкл, а количество вносимой ДНК - 3 мкл. Температурный режим амплификации был следующим: 1-ый этап - 95°- 4 мин; 2-ой этап - 95° - 20 сек, 59° - 30 сек, 72° - 20 сек (30 циклов); 3-ий этап: 72° - 4 мин; 10° - хранение.
4. SSCP. Для электрофоретического разделения одноцепочечных фрагментов ДНК были подобраны условия денатурации полученных ампликонов (соотношение ампликонов и денатурирующего раствора, время денатурации), состав полиакриламидного геля (процентное содержание полиакриламида, глицерина и состав буфера), условия разделения (напряжение, время электрофореза, температура), позволяющие повысить эффективность разделения одноцепочечных исследуемых ампликонов. Выбранные условия совпадали с условиями проведения электрофоретического разделения ДНК МБТ гена gyrA, предложенными Носовой Е.Ю. и соавт. (патент на изобретение №2343197 от 20.12.2004). Выбранные условия представляют собой следующее: для денатурации смешивают по 4 мкл каждого образца ДНК с 6 мкл денатурирующего красителя (97% формамида, 20 мМ ЭДТА, 0,05% бромфенолового синего, 0,05% ксиленцианола) и проводят денатурацию при 95° в течение 10 минут, разделение денатурированных ампликонов проводят в 8% полиакриламидном геле с 5% глицерином, при напряжении 400 вольт в течение 5 часов при температуре 8°C в 2xТВЕ буфере.
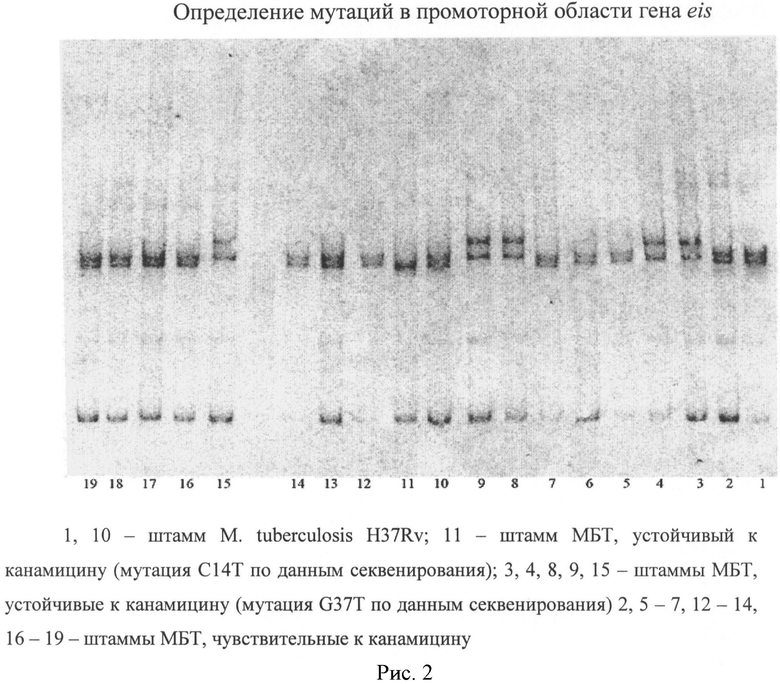
5. Для визуализации результатов электрофореза окраску геля проводили с помощью азотнокислого серебра. После окраски гель оценивали при белом свете (визуально) и фотографировали. Использованная нами методика позволила получить четкие картины разделения фрагментов ДНК и выявить мутации в анализируемых участках ДНК.
На рисунках представлены примеры выявления мутаций в гене rrs и промоторной области гена eis.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДЕТЕКЦИИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА К ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ ВТОРОГО РЯДА (ФТОРХИНОЛОНАМ, АМИНОГЛИКОЗИДАМ И КАПРЕОМИЦИНУ) | 2015 |
|
RU2633507C2 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К АМИНОГЛИКОЗИДАМ | 2009 |
|
RU2409680C1 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ Mycobacterium tuberculosis К ФТОРХИНОЛОНАМ ПО ГЕНУ gyr B | 2010 |
|
RU2439162C1 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ФТОРХИНОЛОНАМ | 2004 |
|
RU2343197C2 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ИЗОНИАЗИДУ | 2003 |
|
RU2297456C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ДНК ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА С ОДНОВРЕМЕННЫМ УСТАНОВЛЕНИЕМ ЕГО ГЕНОТИПА И ОПРЕДЕЛЕНИЕМ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ МНОЖЕСТВЕННОЙ И ШИРОКОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ, ОЛИГОНУКЛЕОТИДНЫЙ МИКРОЧИП, НАБОР ПРАЙМЕРОВ И НАБОР ОЛИГОНУКЛЕОТИДНЫХ ЗОНДОВ, ИСПОЛЬЗУЕМЫЕ В СПОСОБЕ | 2014 |
|
RU2562866C1 |
| ПРАЙМЕРЫ И ЗОНДЫ ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ MYCOBACTERIUM TUBERCULOSIS | 2015 |
|
RU2832754C1 |
| ПРАЙМЕРЫ И ЗОНДЫ ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ MYCOBACTERIUM TUBERCULOSIS | 2015 |
|
RU2717655C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА К РИФАМПИЦИНУ И ИЗОНИАЗИДУ | 2015 |
|
RU2619258C2 |
| ШТАММ Mycobacterium tuberculosis 326/18/47 В-9673 ДЛЯ ОЦЕНКИ ЭФФЕКТИВНОСТИ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТОВ И ДЕЗИНФИЦИРУЮЩИХ СРЕДСТВ | 2022 |
|
RU2785409C1 |
Изобретение относится к биотехнологии и представляет собой способ диагностики чувствительности М. tuberculosis (МБТ) к инъекционным противотуберкулезным препаратам резервного ряда. Способ включает этап выделения ДНК, амплификацию исследуемых участков ДНК методом полимеразной цепной реакции и анализ конформационного полиморфизма одноцепочечных фрагментов (SSCP). Амплифицируют участок гена rrs в 50 мкл реакционной смеси с внесением 5 мкл образца. Амплифицируют промоторную область гена eis в 30 мкл реакционной смеси, содержащей прямой 5'CGGAGCCGTCGGGGTATGC и обратный 5'GCCGCGGCCAGTAGGAACA праймеры и 3 мкл образца по программе амплификации: 1-ый этап - 95°- 4 мин; 2-ой этап - 95° - 20 сек, 59° - 30 сек, 72° - 20 сек (30 циклов); 3-ий этап: 72° - 4 мин; 10° - хранение. Разделение продуктов амплификации в соотношении 4 мкл образца и 6 мкл денатурирующего красителя проводят электрофорезом в 8% полиакриламидном геле с 5% глицерином при напряжении 400 вольт в течение 5 часов при 8°C. Окраску геля проводят с помощью азотнокислого серебра. Предложенное изобретение позволяет диагностировать чувствительность М. tuberculosis (МБТ) к инъекционным противотуберкулезным препаратам резервного ряда с высокой точностью. 2 ил.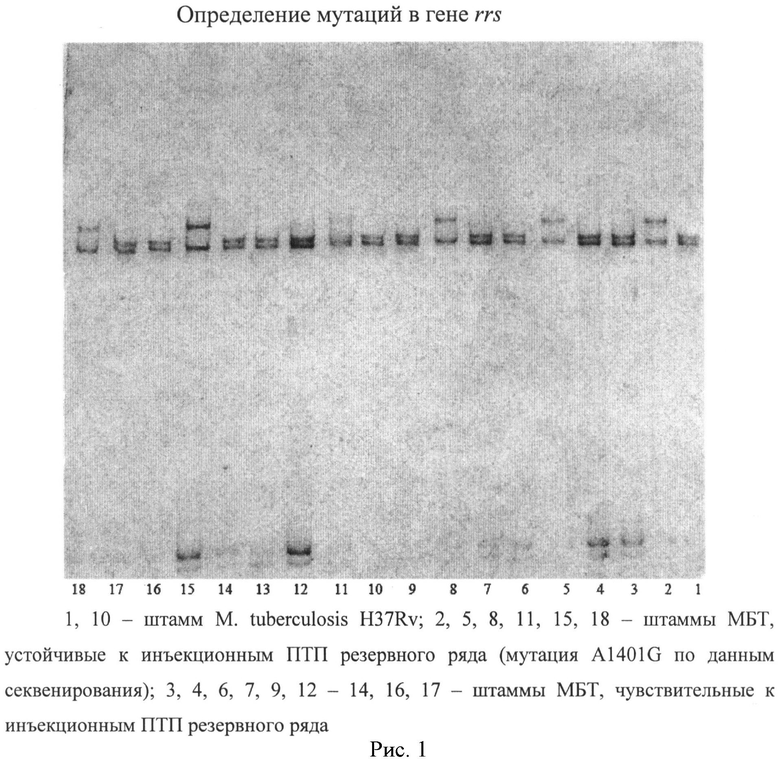
Способ диагностики чувствительности М. tuberculosis (МБТ) к инъекционным противотуберкулезным препаратам резервного ряда, включающий этапы выделения ДНК, амплификации исследуемых участков ДНК методом полимеразной цепной реакции и анализ конформационного полиморфизма одноцепочечных фрагментов (SSCP), отличающийся тем, что для повышения чувствительности метода участок гена rrs амплифицируют в 50 мкл реакционной смеси с внесением 5 мкл образца, а промоторную область гена eis амплифицируют в 30 мкл реакционной смеси, содержащей прямой 5'CGGAGCCGTCGGGGTATGC и обратный 5'GCCGCGGCCAGTAGGAACA праймеры и 3 мкл образца по программе амплификации: 1-й этап - 95°C - 4 мин; 2-й этап - 95°C - 20 с, 59°C - 30 с, 72°C - 20 с (30 циклов); 3-й этап: 72°C - 4 мин; 10°C - хранение, разделение продуктов амплификации в соотношении 4 мкл образца и 6 мкл денатурирующего красителя проводят электрофорезом в 8%-ном полиакриламидном геле с 5%-ным глицерином при напряжении 400 В в течение 5 ч при 8°C, окраску геля проводят с помощью азотнокислого серебра.
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К АМИНОГЛИКОЗИДАМ | 2009 |
|
RU2409680C1 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ФТОРХИНОЛОНАМ | 2004 |
|
RU2343197C2 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ИЗОНИАЗИДУ | 2003 |
|
RU2297456C2 |
Авторы
Даты
2014-03-10—Публикация
2012-03-21—Подача