Предлагаемое изобретение относится к области медицины, в частности к способу диагностики чувствительности М. tuberculosis (МБТ) к аминогликозидам (канамицину, капреомицину и амикацину и др). Данный способ позволяет обнаружить мутации в гене rrs, обусловливающие резистентность МБТ к этим препаратам, путем амплификации соответствующих последовательностей ДНК исследуемого гена МБТ с последующим анализом полиморфизма длин полученных рестрикционных фрагментов после их разделения в агарозе.
В связи с ростом заболеваемости туберкулезом с множественной лекарственной устойчивостью (МБТ-МЛУ), в том числе среди пациентов с впервые выявленным туберкулезом, встает вопрос о своевременном назначении таким пациентам адекватной специфической химиотерапии. Кроме того, все чаще стали регистрироваться случаи возникновения устойчивости МБТ-МЛУ к фторхинолонам, одним из эффективных препаратов резервного ряда для лечения таких больных. Появление таких штаммов создало новую проблему - возникновение штаммов МБТ с широкой лекарственной устойчивостью (МБТ-ШЛУ), а именно одновременной устойчивостью к рифампицину, изониазиду, фторхинолонам и аминогликозидам (Raviglione M.C., Smith I.M. XDR Tuberculosis - implications for Global Public Health. // The New England Journal of Medicine. - 2007, - v.7, - p.656-659). Для повышения эффективности лечения таких больных необходимо изменение режима химиотерапии с использованием препаратов второго ряда, наиболее перспективными из которых помимо фторхинолонов являются аминогликозиды (канамицин, амикацин, капреомицин и виомицин). (Keshavjee S., Gelmanova I.Y et al. Treatment of extensively drug-resistant tuberculosis in Tomsk, Russia: a retrospective cohort study. //Lancet. - 2008, - v.372, - p.1363-1365). В свою очередь, для проведения адекватной химиотерапии и мониторинга лечения необходимо в короткие сроки определить лекарственную чувствительность МБТ к аминогликозидам.
Получение культуры МБТ и определение лекарственной чувствительности на плотной среде Левенштейна-Йенсена занимает 2-3 месяца. Использование жидких питательных сред в современных автоматизированных системах позволяет сократить время получения культуры до 10-18 дней. Однако в настоящее время для анализа чувствительности МБТ к препаратам второго ряда (фторхинолонам, аминогликозидам) зарегистрированных (сертифицированных) культуральных тестов на жидких средах в мире нет, а определение чувствительности к ним на плотной среде Левенштейна-Йенсена увеличивает время анализа, по меньшей мере, дополнительно на один месяц, что не позволяет своевременно внести коррективы в режим химиотерапии.
Развитие молекулярно-биологических технологий позволило изучить молекулярные механизмы устойчивости МБТ к противотуберкулезным препаратам (ПТП) и на их основе внедрить в практику методы, позволяющие в течение 1-2 суток определять лекарственную чувствительность МБТ к ПТП. Таким образом, используя культуру МБТ, полученную с жидкой среды, и молекулярные технологии можно ускорить получение результата чувствительности МБТ к аминогликозидам на 15-20 дней.
Мишенью действия аминогликозидов является 16S рРНК, при связывании с которой происходит нарушение процесса трансляции с образованием нефункциональных белков, что приводит к гибели клетки (бактерицидное действие). Установлено, что у прокариот существует три возможных механизма развития лекарственной устойчивости к аминогликозидам:
- ферментативная инактивация - выработка бактериями ферментов, модифицирующих антибиотики;
- снижение проницаемости цитоплазматической мембраны (нарушение транспортных систем клетки);
- модификация мишени действия (рецепторный белок может отсутствовать или быть измененным в результате хромосомной мутации).
В случае развития устойчивости МБТ к аминогликозидам преобладает механизм модификации мишени действия антибиотика вследствие возникновения мутаций в гене rrs, ответственного за синтез 16S рРНК. Кроме того, установлено, что существует перекрестная устойчивость МБТ к канамицину, амикацину, капреомицину и виомицину. (Maus C.E., Plikaytis В.В., Shinnick T.M. Molecular analysis of cross-resistance to Capreomycin, Kanamycin, Amikacin and Viomycin in Mycobacterium tuberculosis. // Antimicr. Agents and Chemotherapy. - 2005. - v.49. - p.3192-3197). Наиболее часто встречающейся мутацией является замена А на G в позиции 1400 гена rrs, которая приводит к высокому уровню устойчивости к канамицину и амикацину (Alangaden G.J., Kreiswirth B.N et al. Mechanism of Resistance to Amikacin and Kanamycin in Mycobacterium tuberculosis. // Antimicr. Agents and Chemoth, - 1998, - v.42, - p.1295-1297).
В настоящее время существует ряд молекулярно-биологических подходов к выявлению мутаций в генах МБТ, ответственных за устойчивость к противотуберкулезным препаратам. Наиболее часто применяются метод конформационного полиморфизма одноцепочечных фрагментов ДНК (SSCP), гетеродуплексного анализа (ГДА), метод денатурирующего градиентного гельэлектрофореза (DGGE) и РНК/РНК гетеродуплексного анализа (RNA/RNA mismatch assay). Все они высокочувствительны и позволяют обнаружить мутации в 80-95% случаях. Но в технологическом исполнении имеют ряд недостатков, таких как сложности в постановке, в некоторых случаях использование радиоактивных меток для детекции, работу с РНК и РНКазой и т.д (Foddle R., Losekoot M. Mutation detection by denaturating gradient gel electrophoresis (DGGE). // Hum. Mutat. - 1994, - v.3, - p.83-94, Glavac D., Dean M. Optimization of the single-strand conformation polymorphism (SSCP) technique for detection of point mutations. // Hum. Mutat. - 1993, - v.2, - p.404-414).
Аналогом данного изобретения является способ определения мутаций с помощью метода полиморфизма длин рестрикционных фрагментов в генах ДНК МБТ, ответственных за резистентность к химиопрепаратам у больных туберкулезом (Ahmad S, Mokaddas E, Jaber A.A. Rapid detection of ethambutol-resistant Mycobacterium tuberculosis strains by PCR-RFLP targeting embB codons 306 and 497 and iniA codon 501 mutations. // Mol Cell Probes. - 2004, - v.18, - p.299-306).
Прототипом данного изобретения является работа Suzuki Y.C., Katsukawa A et al. Detection of kanamycin-resistant Mycobacterium tuberculosis by identifying mutations in the 16S rRNA gene.// J.Clin. Microbiol. - 1998, - v.36, - p.1220-1225, авторы которой применяли метод рестрикционного анализа для определения мутаций в гене rrs МБТ, выделенных с плотной среды Ogawa. Предлагаемый в работе метод состоит из нескольких этапов:
1. Выделение ДНК из культур МБТ включает обработку буфером с последующим очищением ДНК с помощью фенол-хлороформной экстракции.
2. Очищенную ДНК МБТ в количестве 10 нанограмм используют для амплификации определенного участка гена rrs со специфической парой праймеров в реакционной буферной системе по специальной программе амплификации.
3. Осаждение ПЦР-продукта 3М ацетатом натрия и спиртом в соотношении 0,1:2 с последующим разведением в ТЕ буфере.
4. Обработка осажденного ПЦР-продукта четырьмя рестриктазами: TaiI, Tsp45I, BstUI и DdeI.
5. Детекцию полученных рестрикционных профилей проводили после разделения в 4% агарозном геле в присутствии красителя SYBR green.
Данный способ определения мутаций, прежде всего по условиям проведения этапов, отличается длительностью (выделение ДНК из культур МБТ, осаждение полученных ампликонов, обработка одного образца ДНК МБТ четырьмя рестриктазами) и использованием дорогостоящих реагентов (краситель SYBR green), что в условиях клинико-лабораторных исследований становится не приемлемым.
Поэтому в используемой нами методике все этапы были изменены:
1) выделение ДНК из культур МБТ проводили в ТЕ буфере (рН 8,0) прогреванием при 95°С в течение 20 мин, что увеличивает сохранность ДНК, ускоряет, удешевляет и упрощает этот этап;
2) изменен состав реакционного буфера для ПЦР, а именно тип буфера, концентрация трифосфатов, ионов магния и Taq полимеразы. В 50 мкл среды содержалось: 10 мМ Трис-HCl рН 8,8; 50 мМ KCl; 0,5% Твин 20; 5% - формамида, 2,5 мМ MgCl2, 2,5 U Taq полимеразы, по 200 мкМ каждого нуклеозидтрифосфата, по 0,5 мкМ каждого олигонуклеотидного праймера и 3 мкл образца, что увеличивает чувствительность и специфичность ПЦР-реакции;
3) подобрана оптимальная программа амплификации, что увеличивает чувствительность метода и позволяет определять лекарственную чувствительность на культурах МБТ, выделенных с жидких сред в отличие от прототипа, где использовали культуры МБТ с плотных сред. В результате, данные изменения ускоряют получение результата чувствительности МБТ к аминогликозидам на 15-20 дней. Выбранные условия представляют собой следующее: 1-й этап - 94° - 5 мин; 2-й этап - 94° - 60 с, 55° - 60 с, 72° - 60 с (35 циклов); 3-й этап: 72° - 5 мин; 10° - хранение;
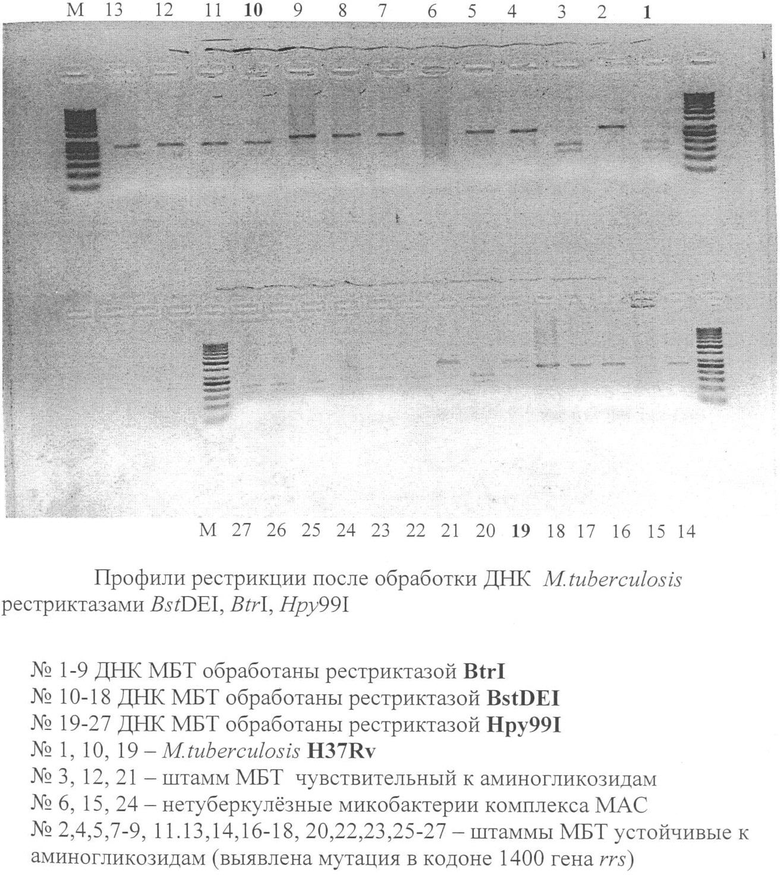
4) подобраны три рестриктазы - BstDEI, BtrI, Hpy99I с помощью программы BioEdit v.7.0.1, условия рестрикции с использованием полученных ампликонов без осаждения (объем ампликонов для рестрикции составляет 5 мкл), что позволяет анализировать большее количество образцов ДНК МБТ и ускоряет получение результата;
5) разделение продуктов рестрикции проводится в 3% агарозном геле, окрашенном бромидом этидия, что удешевляет метод.
В результате перечисленных выше изменений была получена четкая картина рестрикционного анализа определения мутаций в участке гена rrs МБТ, ответственных за устойчивость к препаратам группы аминогликозидов.
На чертеже представлена фотография профилей рестрикции при обработке рестриктазами BstDEI, BtrI, Hpy99I ДНК МБТ с выявлением мутаций в 1400 кодоне гена rrs.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ Mycobacterium tuberculosis К ИНЪЕКЦИОННЫМ ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ РЕЗЕРВНОГО РЯДА (АМИНОГЛИКОЗИДАМ И КАПРЕОМИЦИНУ) | 2012 |
|
RU2509158C2 |
| СПОСОБ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДЕТЕКЦИИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА К ПРОТИВОТУБЕРКУЛЕЗНЫМ ПРЕПАРАТАМ ВТОРОГО РЯДА (ФТОРХИНОЛОНАМ, АМИНОГЛИКОЗИДАМ И КАПРЕОМИЦИНУ) | 2015 |
|
RU2633507C2 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ Mycobacterium tuberculosis К ФТОРХИНОЛОНАМ ПО ГЕНУ gyr B | 2010 |
|
RU2439162C1 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ФТОРХИНОЛОНАМ | 2004 |
|
RU2343197C2 |
| СПОСОБ ВИДОВОЙ ИДЕНТИФИКАЦИИ МИКОБАКТЕРИЙ КОМПЛЕКСА MAIS (MYCOBACTERIUM AVIUM, M.INTRACELLULARE, M.SCROFULACEUM) И M.TUBERCULOSIS | 2004 |
|
RU2319748C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ДНК ВОЗБУДИТЕЛЯ ТУБЕРКУЛЕЗА С ОДНОВРЕМЕННЫМ УСТАНОВЛЕНИЕМ ЕГО ГЕНОТИПА И ОПРЕДЕЛЕНИЕМ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ МНОЖЕСТВЕННОЙ И ШИРОКОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ, ОЛИГОНУКЛЕОТИДНЫЙ МИКРОЧИП, НАБОР ПРАЙМЕРОВ И НАБОР ОЛИГОНУКЛЕОТИДНЫХ ЗОНДОВ, ИСПОЛЬЗУЕМЫЕ В СПОСОБЕ | 2014 |
|
RU2562866C1 |
| ПРАЙМЕРЫ И ЗОНДЫ ДЛЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ДЛЯ ОБНАРУЖЕНИЯ MYCOBACTERIUM TUBERCULOSIS | 2015 |
|
RU2832754C1 |
| СПОСОБ ЭКСПРЕССНОГО ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ К ИЗОНИАЗИДУ У МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА | 2006 |
|
RU2339040C2 |
| СПОСОБ ДИАГНОСТИКИ ЧУВСТВИТЕЛЬНОСТИ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS К ИЗОНИАЗИДУ | 2003 |
|
RU2297456C2 |
| Способ детекции генотипа Mycobacterium tuberculosis Beijing 14717-15-кластер | 2022 |
|
RU2812351C1 |
Способ диагностики чувствительности штаммов Mycobacterium tuberculosis (МВТ) к аминогликозидам включает этапы выделения ДНК, постановки. полимеразной цепной реакции (ПЦР), основанной на амплификации ДНК исследуемого и чувствительного штаммов МБТ, рестрикции ПЦР-продукта, разделения продуктов рестрикции в агарозном геле с последующим анализом профилей рестрикции. ДНК МБТ выделяют из культур, полученных с жидкой среды, прогревают в течение 20 мин при 95°С в ТЕ-буфере с 1% тритоном рН 8,8. Для проведения ПЦР выбранной последовательности используют реакционный буфер, содержащий в 50 мкл: 10 мМ Трис-HCl рН 8,8; 50 мМ KCl; 0,5% Твин 20; 5% - формамида, 2,5 мМ MgCl2, 2,5 U Taq полимеразы, по 200 мкМ каждого нуклеозидтрифосфата, по 0,5 мкМ каждого олигонуклеотидного праймера, 3 мкл образца. Программа амплификации включает: 1-й этап - 94° - 5 мин; 2-й этап - 94° - 60 с., 55° - 60 с., 72° - 60 с (35 циклов); 3-й этап - 72° - 5 мин; 10° - хранение. Полученные ПЦР-продукты в количестве 5 мкл обрабатывают тремя рестриктазами - BstDEI, BtrI, Hpy99I и проводят разделение продуктов рестрикции в 3% агарозном геле, окрашенном бромидом этидия. Способ по изобретению обеспечивает получение четкой картины рестрикционного анализа определения мутаций в участке гена rrs МБТ, ответственных за устойчивость к препаратам группы аминогликозидов. 1 ил.
Способ диагностики чувствительности Mycobacterium tuberculosis (МБТ) к аминогликозидам, включающий этапы выделения ДНК, постановки полимеразной цепной реакции (ПЦР), основанной на амплификации ДНК исследуемого и чувствительного штаммов МБТ, рестрикции ПЦР-продукта, разделения продуктов рестрикции в агарозном геле с последующим анализом профилей рестрикции, отличающийся тем, что ДНК Mycobacterium tuberculosis выделяют из культур, полученных с жидкой среды, прогреванием в течение 20 мин при 95°С в ТЕ-буфере рН 8,0, амплифицируют выбранную последовательность с использованием реакционного буфера, содержащего в 50 мкл: 10 мМ Трис-HCl рН 8,8; 50 мМ КСl; 0,5% Твин 20; 5% - формамида, 2,5 мМ MgCl2, 2,5 U Taq полимеразы, по 200 мкМ каждого нуклеозидтрифосфата, по 0,5 мкМ каждого олигонуклеотидного праймера и 3 мкл образца, по оптимальной программе амплификации:
1-й этап - 94° - 5 мин;
2-й этап - 94° - 60 с, 55° - 60 с, 72° - 60 с (35 циклов);
3-й этап - 72° - 5 мин; 10° - хранение,
полученные ПЦР-продукты в количестве 5 мкл обрабатывают тремя рестриктазами - BstDEI, BtrI, Hpy99I и проводят разделение продуктов рестрикции в 3% агарозном геле, окрашенном бромидом этидия.
| CN 1341752, 27.02.2002 | |||
| JP 2005087132, 07.04.2005 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОЧЕЧНЫХ НУКЛЕОТИДНЫХ ЗАМЕН В ДНК МИКОБАКТЕРИЙ, СПОСОБ ДИАГНОСТИКИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ К РИФАМПИЦИНУ, БИОЧИП ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТИХ СПОСОБОВ | 2000 |
|
RU2175015C1 |
| СПОСОБ ЭКСПРЕССНОГО ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ К РИФАМПИЦИНУ У МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА | 2003 |
|
RU2287586C2 |
| Способ настройки и проверки строя музыкальных инструментов | 1931 |
|
SU36142A1 |
| RU 2200323 C1, 10.03.2003. | |||
Авторы
Даты
2011-01-20—Публикация
2009-07-20—Подача