Изобретение относится к медицине, онкологии и может быть использовано для прогнозирования кумулятивной кардиотоксичности антрациклиновых антибиотиков.
Кардиотоксичность химиотерапевтических препаратов является одним из серьезных осложнений лекарственного лечения злокачественных новообразований и требует пристального внимания к больным, получающим антрациклины и антраценоны [1]. В основе повреждающего действия химиопрепаратов на миокард лежит прямое повреждение кардиомиоцита [2, 3]. Кардиальные эффекты могут развиваться непосредственно после введения антрациклинового антибиотика, а могут проявляться через месяцы и годы после лечения.
В зависимости от сроков развития и механизма повреждающего действия кардиотоксичность может быть острая и хроническая (кумулятивная). Острая кардиотоксичность может развиваться в момент введения химиопрепарата или непосредственно после него (через несколько часов), как правило, изменения являются обратимыми и регрессируют в течение 1 месяца. Однако, в ряде случаев острая кардиотоксичность является угрожающим жизни осложнением и предшествует развитию сердечной недостаточности [4, 5, 6, 7, 8]. Хроническая кардиотоксичность развивается в период от 1 мес. до 30 лет, подразделяется на раннюю - диагностируемую в течение первого года и позднюю - в период от 1-го года до 30 лет (пик 7-10 лет). Основным проявлением кумулятивной токсичности является нарушение сократительной способности миокарда, развитие дегенеративной кардиомиопатии с левожелудочковой недостаточностью, вплоть до дилятационной застойной кардиомиопатии.
Предсказывающим фактором для развития кардиотоксичности при лечении доксорубицином является снижение ФВЛЖ, более, чем на 4 абсолютных % после достижения кумулятивной дозы препарата 200 мг/м2 [9]. Данный фактор имеет 90% чувствительности и 72% специфичности в прогнозировании поздней кардиотоксичности и, по мнению авторов, может быть использован в идентификации пациентов, имеющих высокий и низкий риск развития антрациклиновой кардиотоксичности.
Диагностическая ценность исследования функции миокарда именно на дозе 200 мг/м2 подтверждена и в других исследованиях [7, 9]. Ряд исследователей считают, что кумулятивная доза 200 мг/м2 является критической для выявления кардиотоксичности [10]. Даже на низких кумулятивных дозах антрациклинов у значительного числа пациентов может развиваться дисфункция сердца [11]. Исследователи из клиники Мауо (США) при проведении стандартного режима химиотерапии АС при раке молочной железы установили, что часто наблюдаемое снижение ФВЛЖ регистрируется у больных через 3 недели после завершения 4-го курса химиотерапии [12], т.е. при достижении уже упоминавшейся дозы 200 мг/м2.
Вместе с тем, до сих пор отсутствуют методы, позволяющие с высокой степенью достоверности выявлять группы риска уже на момент начала терапии антрациклиновыми антибиотиками, что позволило бы предупреждать развитие тяжелых осложнений со стороны сердечно-сосудистой системы в процессе проведения противоопухолевого лечения.
Известен способ определения кардиотоксических осложнений при помощи равновесной радионуклидной вентрикулографии (РРВГ) [13]. Популярность этого метода обусловлена высокой воспроизводимостью при определении параметров сократительной способности сердца, которая практически не зависит от квалификации врача, выполняющего исследование [14]. Исследование выполняется по общепринятой стандартной методике: запись РРВГ выполняют в планарном ЭКГ-синхронизированном режиме через 10 мин после инъекции 550 МБк радиофармпрепарата в положении больного лежа на спине с запрокинутыми за голову руками. Для оценки систолической функции левого желудочка в течение каждого сердечного цикла, включенного в исследование, регистрируют 32 сцинтиграммы в матрицу 64х64. В итоге формируется единый усредненный цикл изменений уровня сцинтилляционного счета в процессе расслабления и сокращения левого желудочка. Регистрацию РРВГ проводят в левой передней косой проекции в позиции наилучшего визуального разделения правого и левого желудочков с небольшим (около 10°) каудальным наклоном детектора. Такой наклон позволяет максимально избежать взаимного «наложения» левого предсердия и левого желудочка. Запись проводят при настройке гамма-камеры на фотопик 140 кэВ при ширине дифференциального дискриминатора 20% с использованием параллельного низкоэнергетического коллиматора. Для получения качественной РРВГ необходимо зарегистрировать не менее 20-350 тыс. импульсов на кадр за минимальный период времени с целью снижения вероятности движения пациента во время исследования.
Недостаток данного метода: по общепринятым мировым стандартам РРВГ выполняется пациентам, получающим химиотерапевтическое лечение антрациклинами, при достижении дозы 200 мг/м2. Это в свою очередь позволяет, выделить группы риска, скоррегировать лечение и назначить кардиопротективную терапию, однако, как показывает практика, данные действия оказываются уже несвоевременными.
Новая техническая задача-повышение точности способа и снижение числа осложнений.
Для решения поставленной задачи в способе прогнозирования кумулятивной кардиотоксичности химиотерапевтических препаратов, путем исследования фракции выброса левого желудочка с помощью радионуклидной равновесной вентрикулографии (РРВГ), регистрацию РРВГ проводят дважды: перед первым введением антрациклинов, затем через 1 час после в/в ведения химиопрепарата в дозе 50 мг/м2 выполняют повторное исследование в планарном ЭКГ-синхронизированном режиме, по стандартной методике и при снижении фракции выброса левого желудочка в ответ на первое введение антрациклинов на 10% и более, по сравнению с исходным значением, прогнозируют кумулятивную кардиотоксичность..
Способ осуществляют следующим образом. Проводят исследование фракции выброса левого желудочка с помощью радионуклидной равновесной вентрикулографии (РРВГ), запись РРВГ выполняют в планарном ЭКГ-синхронизированном режиме через 10 мин после инъекции 550 МБк радиофармпрепарата в положении больного лежа на спине с запрокинутыми за голову руками. Регистрацию РРВГ проводят трижды: перед первым введением антрациклинов, затем через 1 час после в/в ведения химиопрепарата в дозе 50 мг/м2 и после окончания химиотерапевтического лечения, регистрацию РРВГ проводят исследование в планарном ЭКГ-синхронизированном режиме, по стандартной методике [15] и при снижении фракции выброса левого желудочка в ответ на первое введение антрациклинов на 10% и более, по сравнению с исходным значением, прогнозируют кумулятивную кардиотоксичность.
Отсроченное исследование выполняется для того, чтобы подтвердить или опровергнуть наличие кардиологических осложнений после проведенной полихимиотерапии.
Клинический пример 1 Пациент, А История болезни N 139158\05020. В - диффузная крупноклеточная лимфома с поражением всех групп периферических л/узлов, КС III.
Состояние после ПХТ по пр CHOP N4.
Гистология + ИГХ N3082к/08(5105в/08 от 17.11.08: Гистологическая структура и иммунофенотип соответствуют В-крупноклеточной лимфоме.
По морфологическим препаратам верифицирована лимфома. В НИИО обратился самостоятельно. При поступлении состояние относительно удовлетворительное. Шейно-надключичные л\у до 1-2 см, аксиллярные до 4-5 см справа, слева до 2-3 см. Паховые справа до 2 см, слева, в области п\о рубца до 4*2 см. Печень, селезенка по ребру. По данным УЗИ от 20.11.08: Шейные л\у единичные до 15*3 мм, надключичные л\у не выявлены. Аксиллярные л\у слева с сохраненной структурой, макс 17* 10 мм, справа несколько л\у диаметром 16 мм до 49*59 мм, кол-во 6-7 штук. Паховые л\у слева: 3-4, в зоне п\о рубца л\у 74*37 мм. На видимых участках печень обычной эхогенности, очаговых образований не выявлено. Селезенка 111*3 7 мм, однородная. Забрюшинные л\у и по ходу подвздошных сосудов не выявлены.
25.11.08, 25.12.08, 23.01.09, 20.02.09 курсы ПХТ по пр. CHOP с эффектом частичной ремиссии: шейно-надключичные л\у до 0,5 см, аксиллярные до 2-2,5 см справа, слева до 1,5 см. Паховые справа «тяжами». Печень, селезенка по ребру.
УЗИ от 19.02.09: Шейные л\у единичные до 5*3 мм, надключичные л\у не выявлены. Аксиллярные л\у слева с сохраненной структурой, макс 22* 15 мм, справа л\у до 27* 11 мм. Паховые л\у с сохраненной структурой слева 43*9 мм, справа 19*8 мм. Другие группы л\у не увеличены. Печень обычной эхогенности, очаговых образований не выявлено. Селезенка 119*3 7 мм, однородная. Забрюшинные л\у и по ходу подвздошных сосудов не выявлены.
Р-графия от 24.07.08 и 19.02.09: Легкие без очагово-инфильтративных изменений. Данных за увеличение внутригрудных л\узлов не выявлено.
Гематологические показатели без клинически значимых изменений.
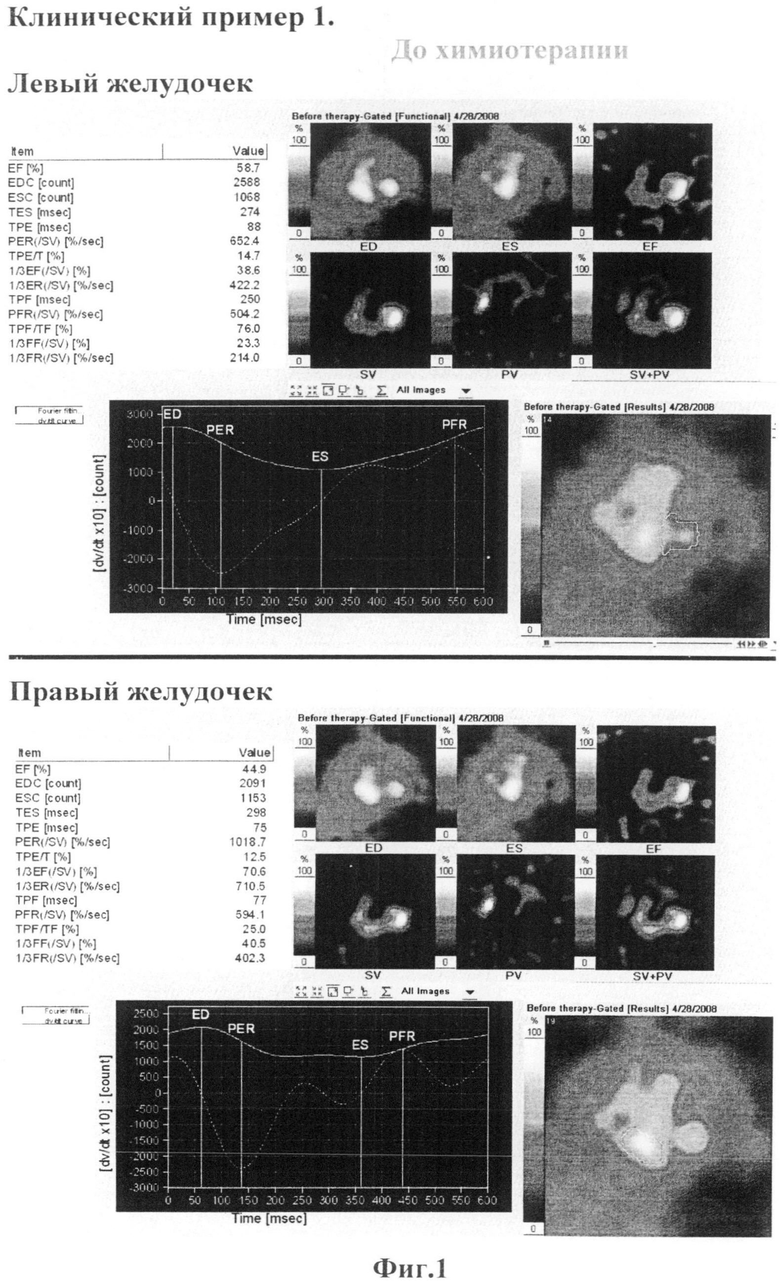
Проведено исследование согласно предлагаемому способу: радиоизотопные исследования миокарда до начала химиотерапии и непосредственно после введения химиопрепарата антрациклинового ряда в дозе 50 мг/м2, а также после окончания полихимиотерапии.
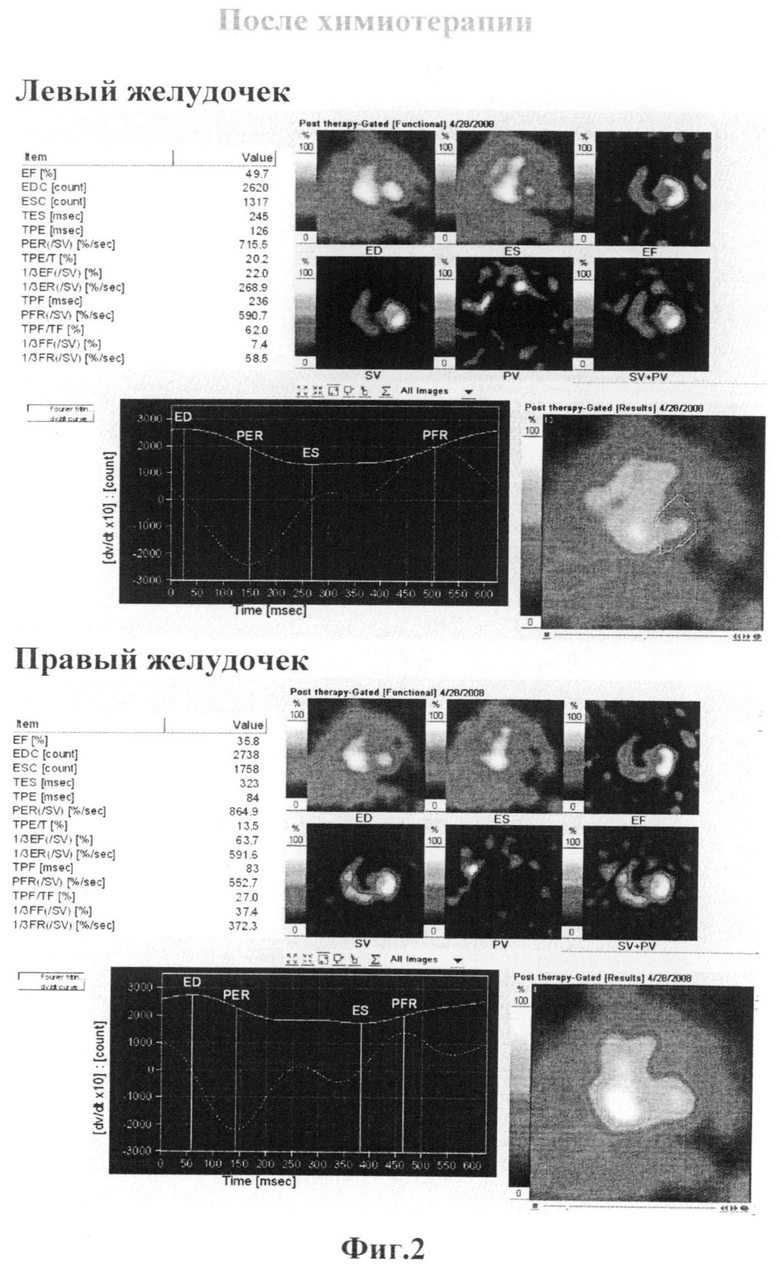
Заключение: Сократительная способность левого и правого желудочков в пределах нормы (ФВЛЖ=58,7%, ФВПЖ=44,9%).(Фиг.1) В ответ на химиотерапевтическую процедуру контрактильная функция сердца снижается (ФВЛЖ=49,7%, ФВПЖ=35,8%). (Фиг.2)
Таким образом, мы видим, что в ответ на первое введение доксорубицина отмечается выраженное снижение фракции выброса левого желудочка (≈10%). Опираясь на эти данные мы можем предположить развитие кумулятивной кардиотоксичности у данного пациента. Что и подтвердилось при отсроченном исследование после окончания лекарственной терапии.
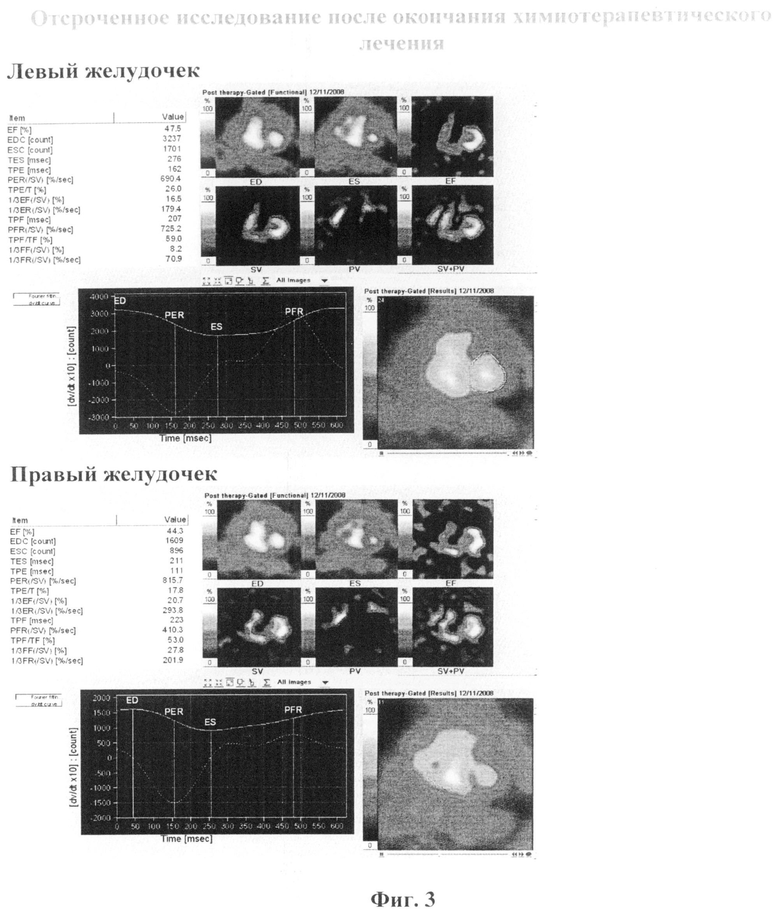
Заключение: Сократительная способность левого желудочка умеренно снижена, правого в пределах нормы (ФВЛЖ=47,4%, ФВПЖ=44,3%). По сравнению с исследованием от 15.04.2008 отрицательная динамика. (Фиг.3)
Клинический пример 2
Пациент, Б
История болезни N 133647.
Диффузная В-крупноклеточная лимфома с поражением всех групп периферических л/у, селезенки. КС III Бб. Состояние после химиолучевой терапии.
Гистология + ИГХ от 12.01.07 N 6114 (НИИО г.Томск). Гистологическая структура и иммунофенотип опухолевых элементов соответствуют Диффузной В-крупноклеточной лимфоме с высокой пролиферативной активностью.
Трепанобипсия N 627-629 от 17.01.07: В трепанобиоптате преобладает клеточный к\м над жировым, который представлен всеми ростками. Данных за специфическое поражение к\м не выявлено.
Анамнез: Считает себя больным с октября 2006 г, когда отметил увеличение шейных, аксиллярных л/у, периодическое повышение t до 38. Обращался по месту жительства, 28.12.06 в клинике пропедтерапии СГМУ была выполнена биопсия лимфоузла, и верифицирован диагноз лимфомы. В январе 2007 г обратился к гематологу в НИИО, по данным ИГХ-В-ДККЛ. В условиях отделения ХТО с 17.01.07 по 8.04.07 проведено 4 курса химиотерапии по R-CHOP с эффектом частичной ремиссии.
Объективно: Состояние к относительно удовлетворительному. Кожные покровы обычной окраски. Периферические л/у: шейные л\у мелкие, аксиллярный справа до 8-9 см, паховые б\о. Гемодинамика стабильная. Живот мягкий, б/б. Печень +2-3 см из-под края реберной дуги, селезенка по ребру.
УЗИ от 20.06.07: 3-е: Значительное уменьшение размеров л\узлов в правой аксиллярной области.
Р-графия от 14.05.07: Легочная ткань без очагово-инфильтративных изменений, диффузный пневмофиброз. Сердце, аорта б/о. Тень средостения б\о.
Проведено радионуклидное исследование по предлагаемому алгоритму:
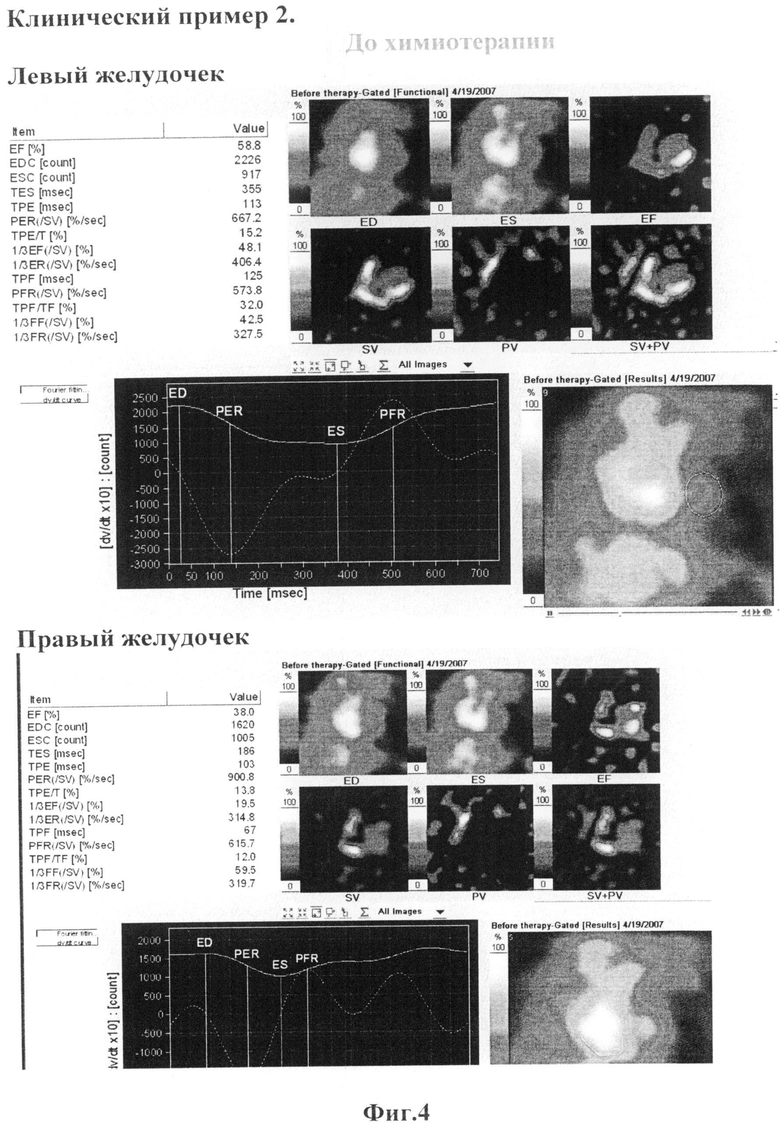
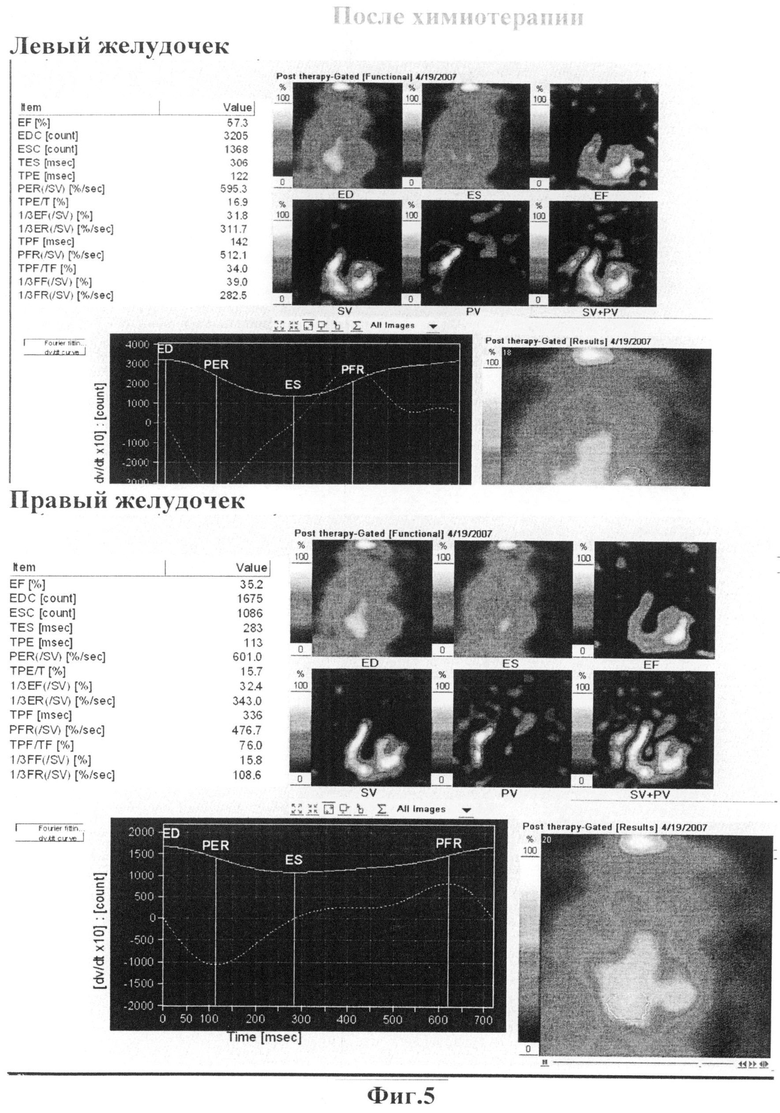
Заключение: Сократительная способность левого и правого желудочков в пределах нормы (ФВЛЖ=58,8%, ФВПЖ=38,7%). (Фиг.4) В ответ на химиотерапевтическую процедуру контрактильная функция сердца практически не меняется (ФВЛЖ=57,3%, ФВПЖ=35,2%). (Фиг.5)
По результатам исследования мы видим, что в ответ на введение химиопрепарата не происходит выраженного снижения сократительной функции сердца.
Отсроченное исследование
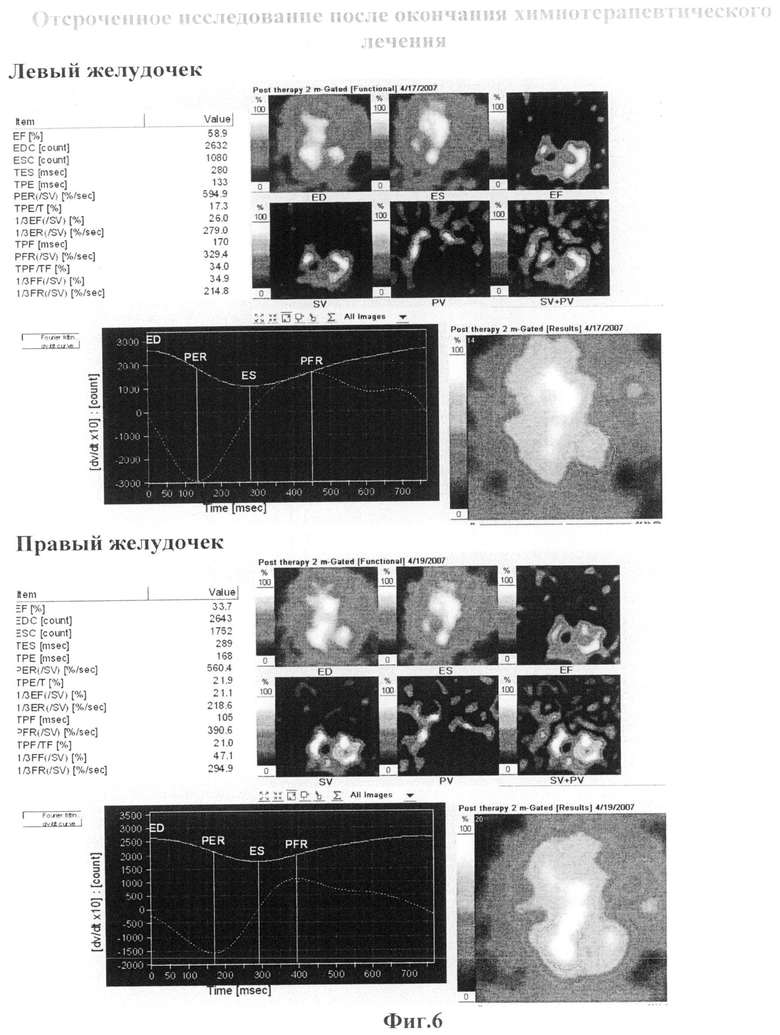
Заключение: Сократительная способность левого желудочка в пределах нормы (ФВЛЖ=58,9%), правого - несколько снижена (ФВПЖ=33,7). По сравнению с исходным исследованием (19.01.2007) - незначительная отрицательная динамика. (Фиг.6)
Согласно полученным результатам, мы можем судить о том, что у данного пациента в отсроченный период не проявились кардиотоксические эффекты химиотерапевтических препаратов антрациклинового ряда.
Предлагаемые критерии способа основаны на анализе клинических данных, полученных при проведении исследований в отделении радионуклидной диагностики, совместно с отделением химиотерапии ФГБУ «НИИ онкологии СО РАМН» с целью оценки кардиотоксических эффектов химиотерапевтических препаратов антрациклинового ряда.
В исследование включены 40 пациентов (36 женщин и 4 мужчины) (средний возраст 42:1:2,1 лет) со злокачественными новообразованиями без существенной патологии со стороны сердечно-сосудистой системы. У 32 пациентов был диагностирован рак молочной железы, у 7 человек - неходжкинская лимфома и у 1 - лимфома Ходжкина. Больные получали цитостатическую лекарственную терапию на основе доксорубицина (50 мг/м2 на курс). Всем обследуемым трижды выполнялась РРВГ в ЭКГ-синхронизированом режиме - до начала комбинированной химиотерапии, через 1 час после первого введения доксорубицина (до введения других цитостатиков), а также после завершения 4-го курса цитостатического лечения.
По результатам анализа данных ЭКГ-РРВГ на фоне введения доксорубицина в дозе 50 мг/м2 оказалось, что у 16 пациентов (40%) происходит весьма значительное (на 10% и более) снижение фракции выброса левого желудочка (ФВЛЖ). Указанные лица были выделены в первую группу - с проявлением «острой» кардиотоксичности. Двадцать четыре пациента с отсутствием значимых изменений фракции выброса левого желудочка (менее 10%) составили вторую группу - без признаков «острой» кардиотоксичности.
По исходным показателям сократительной способности левого желудочка группы статистически не отличались между собой. После первого введения доксорубицина помимо снижения ФВЛЖ в группе с проявлением «острой» кардиотоксичности наблюдалось значимое увеличение конечно-систолического объема левого желудочка (КСО) и снижение максимальной скорости изгнания (МСИ). Значимые изменения указанных показателей сохранялась и после завершения 4-го курса лечения. Введение доксорубицина в дозе 50 мг/м2 вызывало также нарушение локальной сократимости левого желудочка, что проявлялось в преходящем увеличении показателя размера нарушения движения стенки левого желудочка. При индивидуальном анализе результатов сцинтиграфии, выполненной после завершения 4-го курса химиотерапии на суммарной дозе доксорубицина 200 мг/м2 оказалось, что критерий снижения ФВЛЖ на 10% и более в ответ на первое введение доксорубицина позволяет с чувствительностью 50% и специфичностью 92% прогнозировать развитие кумулятивной кардиотоксичности.
Таким образом, предлагаемый способ позволяет после проведения 1 курса химиотерапии антрациклинами, выполнив пациенту РРВГ прогнозировать развитие кумулятивной кардиотоксичности у данного пациента с чувствительностью 50% и специфичностью 92%, что позволяет незамедлительно начать профилактику кардиологических осложнений, развивающихся в различные временные промежутки.
Список источников информации, использованных при составлении описания
1. Орел Н.Ф. Кардиотоксичность антрациклинов: возможности преодоления // Современная онкология, 2004. - Т.6. - №3. - С.121-124.
2. Ferrans VJ. Overview of cardiac pathology in relation to anthracycline cardiac toxicity // Canc Treat Rep 1978; 62: 955-61.
3. Urbanova D, Urban L, Carter A et al. Cardiac troponins - biochemical markers of cardiac toxicity after cytostatic therapy // Neoplasma. 2006; 53(3): 183-90.
4. Pai VB, Nahata MC. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention // Drug Saf. 2000 Apr; 22(4): 263-302.
5. Simbre VC, Duffy SA, Dadlani GH et al. Cardiotoxicity of cancer chemotherapy: implications for children // Paediatr Drugs. 2005; 7(3): 187-202.
6. Suzuki Y, Tokuda Y. Cardiovascular complications in oncology patients // Nippon Rinsho. 2003 Jun; 61(6): 984-9.
7. Drimal J, Zurova-Nedelcevova J, Knezl V et al. Cardiovascular toxicity of the first line cancer chemotherapeutic agents: doxorubicin, cyclophosphamide, streptozotocin and bevacizumab // Neuro Endocrinol Lett. 2006 Dec 22; 27(suppl2): 176-9.
8. Yeh ET. Cardiotoxicity induced by chemotherapy and antibody therapy // Annu Rev Med. 2006; 57: 485-98.
9. Nousiainen T, Vanninen E, Jantunen E, et al.. Comparison of echocardiography and radionuclide ventriculography in the follow-up of left ventricular systolic function in adult lymphoma patients during doxorubicin therapy. J Intern Med. 2001; 249: 297-303.
10. Chaladze T, Megreladze I, Zodelava M. Early cardiotoxicity induced by treatment of hematologic malignancies and the risk-factors of its manifestation // Georgian Med News. 2005 dec; 129: 117-9.
11. Aggarwal S, Pettersen MD, Bhambhani K et al. B-type natriuretic peptide as a marker for cardiac dysfunction in anthracycline-treated children // Pediatr Blood Cancer. 2007 Nov; 49(6): 812-816.
12. Perez EA, Suman VJ, Davidson NE et al. Effect of doxorubicin plus cyclophosphamide on left ventricular ejection fraction in patients with breast cancer in the North Central Cancer Treatment Group N9831 Intergroup Adjuvant Trial // J Clin Oncol. 2004 Sep 15; 22(18): 3700-4.
13. de Geus-Oei LF, Mavinkurve-Groothuis AM, Bellersen L, Gotthardt M, Oyen WJ, Kapusta L, van Laarhoven HW. Scintigraphic techniques for early detection of cancer treatment-induced cardiotoxicity. J Nucl Med. 2011 Apr; 52(4): 560-71. Epub 2011 Mar 18.
14. Национальное руководство по радионуклидной диагностике/под ред. Ю.Б. Лишманова, В.И. Чернова. - В 2-х т. - Томск: STT, 2010. T.1. - 290 с.
15. de Geus-Oei LF, Mavinkurve-Groothuis AM, Bellersen L, Gotthardt M, Oyen WJ, Kapusta L, van Laarhoven HW. Scintigraphic techniques for early detection of cancer treatment-induced cardiotoxicity. J Nucl Med. 2011 Apr; 52(4): 560-71. Epub 2011 Mar 18.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ АНТРАЦИКЛИНОВОЙ КАРДИОТОКСИЧНОСТИ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2546399C1 |
| Способ прогнозирования развития подострой антрациклин-опосредованной кардиотоксичности у онкологических пациентов | 2020 |
|
RU2744682C1 |
| Способ прогнозирования антрациклин-индуцированной кардиотоксичности у женщин с раком молочной железы | 2019 |
|
RU2714683C1 |
| Способ прогнозирования развития кардиотоксичности у больных HER2 позитивным раком молочной железы исходно низкого/умеренного сердечно-сосудистого риска, получающих таргетную терапию трастузумабом после антрациклин-содержащей химиотерапии | 2020 |
|
RU2741371C1 |
| Способ персонифицированного отбора больных с антрациклин-индуцированной кардиомиопатией после полихимиотерапии рака молочной железы для эффективного лечения карведилолом | 2021 |
|
RU2778612C1 |
| Способ прогнозирования прогрессирования хронической сердечной недостаточности, индуцированной антрациклинами, у пациенток с раком молочной железы в течение 24 месяцев | 2022 |
|
RU2793672C1 |
| Способ прогнозирования развития кардиотоксичности у пациенток с раком молочной железы в течение 12 месяцев после химиотерапии препаратами антрациклинового ряда | 2018 |
|
RU2680139C1 |
| СПОСОБ УЛЬТРАЗВУКОВОЙ ОЦЕНКИ КАРДИОТОКСИЧНОСТИ ИНДУЦИРОВАННОЙ АНТРАЦИКЛИНАМИ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 2002 |
|
RU2225166C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ АНТАГОНИСТОВ ВАЗОПРЕССИНА С АНТРАЦИКЛИНОВЫМИ ХИМИОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ ДЛЯ СНИЖЕНИЯ КАРДИОТОКСИЧНОСТИ И/ИЛИ УЛУЧШЕНИЯ ВЫЖИВАНИЯ | 2008 |
|
RU2470643C2 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2003 |
|
RU2243774C1 |
Изобретение относится к медицине, онкологии, кардиологии и может быть использовано для прогнозирования кумулятивной кардиотоксичности химиотерапевтических препаратов антрациклинового ряда. Перед внутривенным введением антрациклина в дозе 50 мг/м2, затем через 1 час после ведения выполняют исследование фракции выброса левого желудочка с помощью радионуклидной равновесной вентрикулографии в планарном ЭКГ-синхронизированном режиме по стандартной методике. При снижении фракции выброса левого желудочка в ответ на первое введение препарата 10% и более, по сравнению с исходным значением, прогнозируют кумулятивную кардиотоксичность. Способ позволяет прогнозировать развитие кумулятивной кардиотоксичности у пациента после проведения одного курса химиотерапии антрациклинами, с чувствительностью 50% и специфичностью 92%, что обеспечивает возможность незамедлительного начала профилактики кардиологических осложнений, развивающихся в различные временные промежутки лечения опухоли. 2 пр., 6 ил.
Способ прогнозирования кумулятивной кардиотоксичности химиотерапевтических препаратов антрациклинового ряда путем исследования фракции выброса левого желудочка с помощью радионуклидной равновесной вентрикулографии, отличающийся тем, что исследование проводят перед первым введением препарата, затем через 1 ч после внутривенного введения химиопрепарата в дозе 50 мг/м2 выполняют повторное исследование в планарном ЭКГ-синхронизированном режиме по стандартной методике и при снижении фракции выброса левого желудочка в ответ на первое введение антрациклинов на 10% и более по сравнению с исходным значением прогнозируют кумулятивную кардиотоксичность.
| КАЗЮЛИН А.Н | |||
| и др | |||
| Кардиотоксичность при проведении химиотерапии онкологических заболеваний | |||
| Медицина критических состояний, 2010, №1, с.62-70 | |||
| RU 2010102566 A, 10.08.2011 | |||
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ НАРУШЕНИЙ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ МИОКАРДА ПРИ НОРМАЛЬНОЙ ЭКГ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2389431C2 |
| ALTENA R et al | |||
| Cardiovascular toxicity caused by cancer treatment: strategies for early detection | |||
| J | |||
| Lancet Oncol., 2009, Apr; 10(4): 391-9. | |||
Авторы
Даты
2014-03-27—Публикация
2012-04-03—Подача