Изобретение относится к медицине и может быть использовано в кардиологии, ангиологии, кардиохирургии, онкологии, терапии, реабилитологии для прогнозирования риска развития кардиотоксичности, обусловленной гибелью клеток миокарда (некроз, апоптоз), ремоделированием сердца и прогрессирующей сердечной недостаточностью, возникающей после химиотерапии препаратами антрациклинового ряда.
Кардиоонкология - стала новой медицинской дисциплиной по нескольким причинам. Во-первых, выжившие с опухолевыми заболеваниями имеют риск сердечнососудистых заболеваний, так как заболевания сердечно-сосудистой системы широко распространены среди населения в целом. Во-вторых, как традиционные, так и новые методы лечения рака связаны с кардиотоксичностью. Эти неблагоприятные последствия включают в себя различные осложнения, такие как кардиомиопатия, коронарные и периферические сосудистые поражения, нарушения сердечной проводимости, тромбоз, артериальная гипертония, манифестация и прогрессирование сердечной недостаточности. Появление новых классов химиотерапевтических препаратов часто не снижает, а порой даже повышает риск развития кардиотоксичности. Кардиотоксичность является особенно важным вопросом, учитывая большое количество женщин с раком молочной железы, получавших терапию антрациклинами при химиотерапии. По данным Rickard J. с соавт. (2010), кардиомиопатия, вызванная приемом антрациклинов, имеет худший прогноз, чем вызванная другими причинами, и имеет менее 50% выживаемости в течение 2-х лет. Механизмы, в результате которых антрациклины вызывают кардиотоксичность остается неизвестными [1, 2], и на сегодняшний день не существует надежных методов прогнозирования риска ее развития [3-7]. Раннее выявление вызванной химиотерапией кардиотоксичности дает возможность менять дозировку и/или скорость введения препарата, использовать препараты, сопоставимые по эффективности противоопухолевого лечения, но менее кардиотоксичные, применять новые комбинации лекарственных препаратов. В настоящее время проводятся многочисленные исследования по раннему выявлению кардиотоксичных повреждений химиотерапией, разработки и внедрению в клиническую практику новых более эффективных алгоритмов, программ эффективной и безопасной химиотерапии, способных защитить от возможного повреждающего действия сердце и другие внутренние органы человека [8-11].
В проанализированной патентной и научной медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является разработка объективного неинвазивного высокоинформативного способа прогнозирования риска развития кардиотоксичности, на фоне химиотерапии препаратами антрациклинового ряда по содержанию в крови растворимого Fas-лиганда.
Поставленная задача решается путем определения растворимого Fas-лиганда в сыворотке крови посредством иммуноферментного метода. При наличии уровня растворимого Fas-лиганда более 95,8 пг/мл у пациенток с раком молочной железы после химиотерапии антрациклинами прогнозируют высокий риск развития кардиотоксичности в течение последующих 12 месяцев наблюдения.
Новым в предлагаемом способе является то, что для прогнозирования риска развития кардиотоксичности на фоне химиотерапии препаратами антрациклинового ряда в сыворотке крови определяют содержание растворимого Fas-лиганда.
Предложенный способ прогнозирования развития кардиотоксичности после химиотерапии препаратами антрациклинового ряда с использованием растворимого Fas-лиганда основан на участии Fas-лиганда в апоптоз-индуцированном ремоделировании миокарда и последующих манифестации и прогрессировании сердечной недостаточности. Данный механизм потенцируется экспрессией провоспалительных цитокинов, активность которых повышена при лечении антрациклинами [12]. В настоящее время установлено важное значение апоптоза, играющего ключевую роль в регуляции деятельности сердечно-сосудистой системы. Согласно современным представлениям, при ХСН апоптоз индуцируется ишемией, реперфузией, цитокинами, нейрогормонами [13]. Гибель клеток путем апоптоза происходит также при уменьшении кровоснабжения органа [14-16]. В силу того, что кардиомиоциты являются клетками конечно детерминированными, их потеря в значительной мере определяет степень нарушения сократительной способности оставшегося миокарда [17]. Отмечена прямая зависимость между выраженностью хронической сердечной недостаточности и количеством погибших кардиомиоцитов. На фоне хронической ишемии миокарда апоптоз кардиомиоцитов запускается по внешнему (рецепторному) пути [17]. Основанием для этого может служить как повышение содержания проапоптотических лигандов (sFas-L), фактора некроза опухоли-α (ФНО-α) в плазме крови, так и повышение количества рецепторов к соответствующим факторам на поверхности кардиомиоцитов (Fas-R, ФНО-R1) [18]. Следовательно, оценка содержание белка апоптоз-опосредуемого фактора - растворимого Fas-лиганда является ранним предиктором стратификации риска развития ишемического ремоделирования ЛЖ и апоптоза миокарда, приводящих кардиотоксическому повреждению кардиомиоцитов препаратами антрациклинового ряда.
Преимуществом предлагаемого изобретения является повышение точности прогнозирования развития кардиотоксичности после химиотерапии препаратами антрациклинового ряда.
Преимущество способа достигается путем определения в сыворотке крови методом иммуноферментного метода растворимого Fas-лиганда и дает возможность:
- оценить персональный риск развития кардиотоксичности в течение 12 месяцев наблюдения после химиотерапии препаратами антрациклинового ряда и назначить соответствующую патогенетическую профилактическую терапию, направленную на ингибирование процессов ремоделирования левого желудочка;
- снизить большие финансовые затраты, связанные с использованием дорогостоящего визуализирующего кардиальную дисфункцию метода - ЭХОКГ;
- определить приоритетную группу больных с раком молочной железы в течение 12 месяцев после введения антрациклинов для диспансерного наблюдения и оптимизации эффективных целевых профилактических мероприятий, направленных на профилактику развития кардиотоксичности, связанной с химиотерапией антрациклинами.
Существенные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не очевидные для специалиста. Идентичной совокупности признаков в проанализированной литературе не обнаружено. Предлагаемое изобретение может быть использовано в здравоохранении.
Исходя из вышеизложенного, следует считать изобретение соответствующим условиям патентоспособности "Новизна", "Изобретательский уровень", "Промышленная применимость".
Изобретение будет понятно из следующего описания и приложенной к нему фигуры.
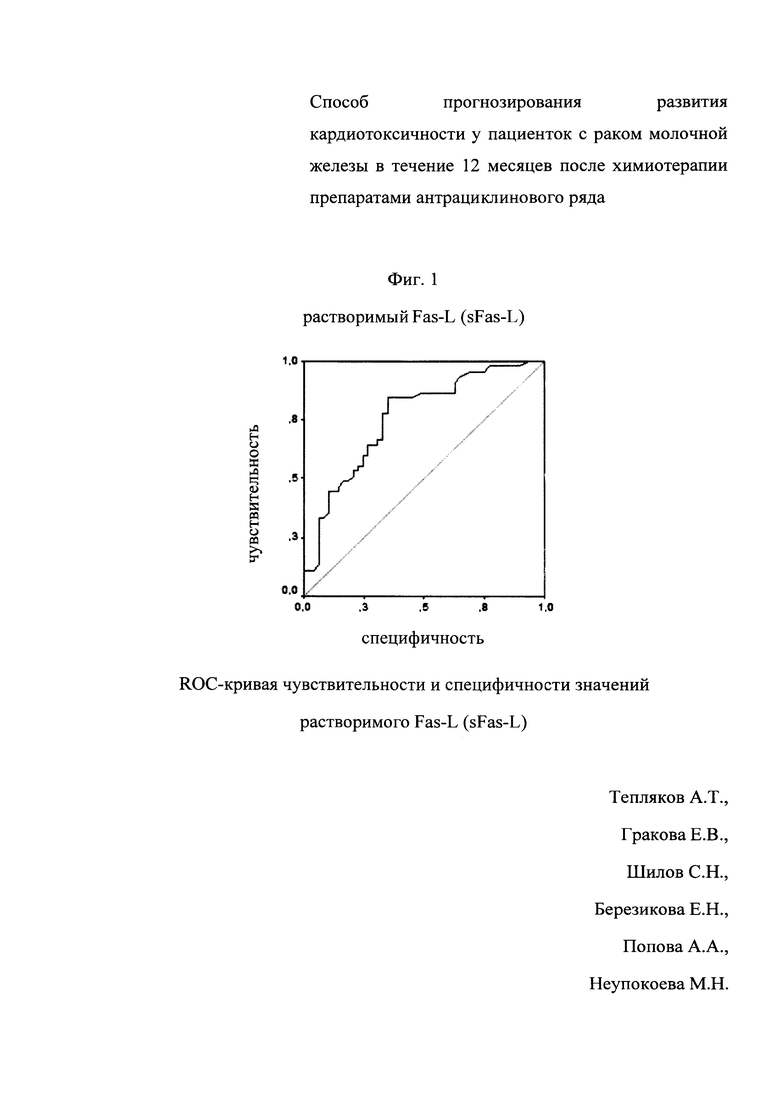
На фигуре представлены результаты ROC-анализа. Изображена характерологическая кривая (ROC-кривая) чувствительности и специфичности значений плазменной концентрации растворимого Fas-лиганда риск развития кардиотоксичности после химиотерапии антрациклинами. По оси абсцисс отложены значения специфичности (%), по оси ординат - чувствительности (%). По данным анализа следует, что «точкой отсечения» - cut off, характеризующей риск развития кардиотоксичности после химиотерапии антрациклинами с чувствительностью данного критерия 78% при специфичности 83%), является плазменная концентрация растворимого ST2 95,8 пг/мл (AUC - 0,77, р=0,0005).
Способ осуществляется следующим образом:
После завершения курса химиотерапии у пациенток с раком молочной железы в сыворотке крови определяют содержание растворимого Fas-лиганда. Определение уровня растворимого Fas-лиганда в сыворотке крови проводят методом иммуноферментного твердофазного анализа (ELISA), используется коммерческий набор фирмы Bender MedSystems (Австрия).
Всего обследовано 176 пациенток с раком молочной железы, получавших препараты антрациклинового ряда в качестве химиотерапевтического лечения. Ни у одной из пациенток, участвующих в данном исследовании, до начала химиотерапии не было диагностировано патологии со стороны сердечно-сосудистой системы. Отсутствие кардиологической патологии было подтверждено данными анамнеза, ЭКГ, ЭхоКГ.
На каждого больного заполнялась специально разработанная клиническая карта. Все пациенты давали свое письменное информированное согласие для участия в исследовании. Состояние больных оценивали исходно, в динамике лечения рака молочной железы с использованием антрациклинов и через 12 месяцев после завершения химиотерапии. Оценивали в динамике показатели ЭхоКГ - конечный диастолический размер (КДР), конечный систолический размер (КСР), фракция выброса ЛЖ (ФВ ЛЖ). межжелудочковая перегородка (МЖП), задняя стенка ЛЖ (ЗСЛЖ). Проявлениями кардиотоксичности в соответствии с рекомендациями Американского общества по ЭхоКГ (2005) считали: развитие кардиопатии со снижением ФВ ЛЖ более чем на 5%, до уровня ФВ ЛЖ менее 55% с признаками ХСН или бессимптомное снижение ФВ ЛЖ более 10%) до уровня ФВ ЛЖ менее 55%.
Через 12 месяцев после включения в исследование пациентки ретроспективно были разделены на две группы: больные с развитием кардиотоксичности (группа 1, n=52) и женщины без доказанной кардиотоксичности через 12 месяцев после химиотерапии антрациклинами (группа 2, n=124).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ SPSS 11.5 for Windows. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0.05. Описание качественных данных проводилось путем построения таблиц сопряженности с указанием абсолютных и относительных частот встречаемости признаков. Оценку значимости межгрупповых различий проводили при помощи критерия χ2.
По сравнению с исходными данными, после завершения химиотерапии между группами не было различий в ЭхоКГ-показателях, тяжести ХСН, оцениваемой по количеству баллов по ШОКС и результатам теста 6-минутной ходьбы, (таблица 1).
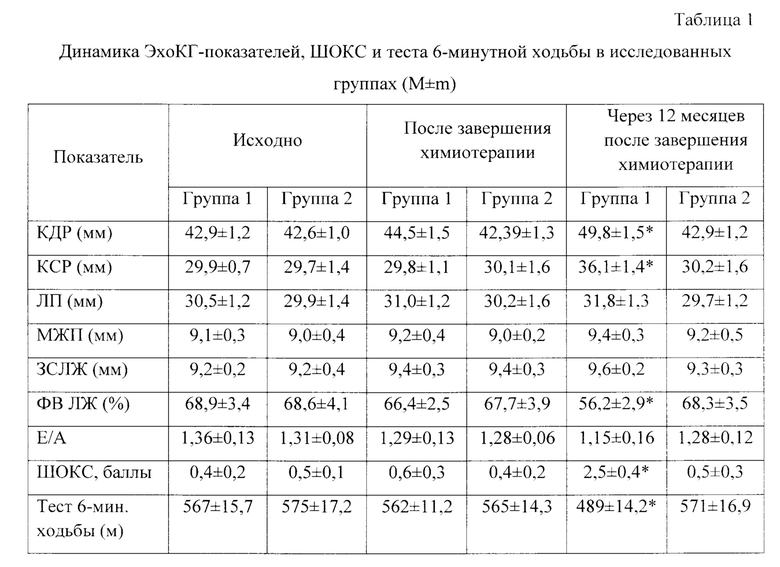
Примечание. *р<0,05 - статистическая значимость различий по сравнению с исходным показателем; КДР - конечный диастолический размер, КСР - конечный систолический размер, ЛП - левое предсердие, МЖП - межжелудочковая перегородка, ЗСЛЖ - задняя стенка левого желудочка, ФВ ЛЖ - фракция выброса левого желудочка, ШОКС - шкала оценки клинического состояния.
Проведенный анализ ЭхоКГ-параметров у пациенток через 12 месяцев после химиотерапии в сравнении с данными до начала химиотерапевтического лечения показал явное различие КСР и КДР, а также достоверное снижение фракции выброса левого желудочка в группе женщин с развившейся антрациклиновой кардиомиопатией. При этом количество баллов по ШОКС у больных первой группы через 12 месяцев после завершения химиотерапии составило 2,5±0,4, а тест 6-минутной ходьбы - 489±14,2 м, что соответствовало манифестации хронической сердечной недостаточности и верификации диагноза ХСН 1 ФК по NYHA, установленному пациенткам 1-й группы впервые.
Установлено, что после окончания химиотерапии у больных 1-й группы (с установленной кардиотоксичностью) концентрация растворимого Fas-L на 41,7% превышала (р-0,0001) аналогичный показатель по сравнению с пациентками 2-й группы - 71,3±4,1 пг/мл. ROC-анализ показателей чувствительности и специфичности стратификации риска развития кардиотоксичности после химиотерапии препаратами антрациклинового ряда по значениям растворимого Fas-L выявил высокую прогностическую значимость данного маркера (чувствительность - 78%, специфичность - 83%), площадь под кривой - 77%, р=0,0005).
Результаты нашего исследования убедительно продемонстрировали, что у пациенток с раком молочной железы после химиотерапии препаратами антрациклинового ряда уровень в крови растворимого Fas-лиганда, превышающий 95,8 пг/мл, прогнозирует развитие антрациклиновой кардиомиопатии, что обосновывает целесообразность его пользования в качестве неинвазивного маркера высокого риска развития антрациклиновой кардиомиопатии.
Способ прогнозирования кардиотоксичности у пациенток, страдающих раком молочной железы после химиотерапии антрациклинами по анализу содержания растворимого Fas-лиганда иллюстрируется следующими клиническими примерами, свидетельствующими о том, что определение его уровня в сыворотке крови обеспечивает объективную оценку тяжести процесса, а содержание растворимого Fas-лиганда более 95,8 пг/мл, является важным прогностическим тестом течения ХСН у больных ИБС.
ПРИМЕР 1: Пациентка Г., 56 лет (70 кг)
По поводу рака молочной железы проведена терапия доксорубицином 60 мг/м2 (каждые 3 недели до достижения суммарной дозы 360 мг/м2) и циклофосфамидом 600 мг/м2 (каждые 3 недели до достижения суммарной дозы 3600 мг/м2).
Исходно жалоб не предъявляет. Толерантность к нагрузке умеренная, ходит в быстром темпе, свободно понимается на 4 этаж. При объективном исследовании: кожные покровы бледные, чистые, обычной окраски, влажности. Язык влажный, чистый. АД - 120/70, ЧСС - 68 в минуту, тоны сердца ясные, ритмичные. Дыхание везикулярное, проводится по всем отделам, хрипов нет. Живот не увеличен, при пальпации мягкий, безболезненный, перистальтика выслушивается. Печень, селезенка не увеличены. Периферических отеков нет. Мочеиспускание свободное.
Уровень sFas-L в сыворотке крови после завершения курса химиотерапии составил 105,4 пг/мл.
Через 12 мес. после проведенной химиотерапии состояние больной клинически ухудшилось: толерантность к нагрузке снизилась, появилась слабость, одышка при умеренной физической нагрузке. При объективном исследовании: кожные покровы бледные, чистые, обычной окраски, влажности, умеренный цианоз губ. Язык влажный, чистый. АД 100/60 мм рт.ст., тоны сердца приглушенные, ритмичные 82 уд/мин. Дыхание жесткое, проводится по всем отделам, частота дыхания 20 в минуту. Живот не увеличен, при пальпации мягкий, безболезненный, перистальтика выслушивается. Отеки на уровне нижней трети голени. Мочеиспускание свободное. По данным теста 6-мин. ходьбы впервые установлен диагноз «ХСН ФК I по NYHA». По данным Эхо-КГ: ФВ ЛЖ уменьшилась на 20,9%, увеличились КСР и КСР ЛЖ, параметры толщины ЗСЛЖ и МЖП (таблица 2).
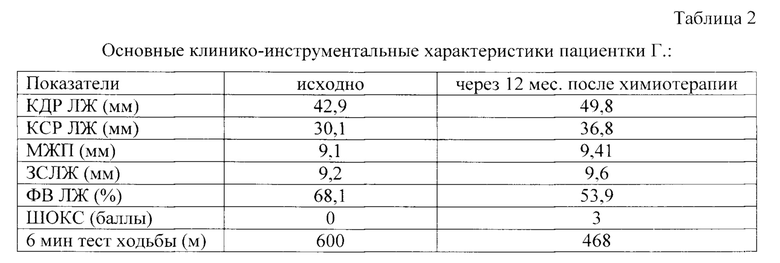
Примечание. Здесь и ниже в таблице: КДР - конечный диастолический размер, КСР - конечный систолический размер, МЖП - межжелудочковая перегородка, ЗСЛЖ - задняя стенка левого желудочка, ФВ ЛЖ - фракция выброса левого желудочка, ШОКС - шкала оценки клинического состояния.
Таким образом, у пациентки с раком молочной железы через 12 месяцев после химиотерапии препаратами антрациклинового ряда и уровнем растворимого Fas-лиганда после химиотерапии, превышающим 95,8 пг/мл (105,4 пг/мл), диагностировано развитие кардиотоксичности, выражающееся в развитии кардиопатии со снижением ФВ ЛЖ более чем на 5%, до уровня ФВ ЛЖ менее 55% с признаками ХСН.
ПРИМЕР 2: Пациентка П., 57 лет (71 кг)
По поводу рака молочной железы проведена терапия доксорубицином 60 мг/м2 (каждые 3 недели до достижения суммарной дозы 360 мг/м2) и циклофосфамидом 600 мг/м2 (каждые 3 недели до достижения суммарной дозы 3600 мг/м2.
Исходно жалоб не предъявляла. Толерантность к нагрузке умеренная, ходит в быстром темпе, свободно понимается на 4 этаж. При объективном исследовании: кожные покровы бледные, чистые, обычной окраски, влажности. Язык влажный, чистый. АД - 110/70 мм рт.ст., ЧСС 72 в минуту, тоны сердца ясные, ритмичные. Дыхание везикулярное, проводится по всем отделам, хрипов нет. Живот не увеличен, при пальпации мягкий, безболезненный, перистальтика выслушивается. Печень, селезенка не увеличены. Периферических отеков нет. Мочеиспускание свободное.
Уровень sFas-L в сыворотке крови после завершения курса химиотерапии антрациклинами составил 75,6 пг/мл.
Через 12 мес. после химиотерапии жалоб не предъявляет, состояние больной стабильное, субъективно без ухудшения. Толерантность к нагрузке осталась на прежнем уровне. При объективном исследовании: кожные покровы бледные, чистые, обычной окраски, влажности. Язык влажный, чистый. АД - 110/60 мм рт.ст., тоны сердца приглушенные, ритмичные, 78 уд/мин. Дыхание жесткое, проводится по всем отделам, хрипы не выслушиваются, частота дыхания 18 в минуту. Живот не увеличен, при пальпации мягкий, безболезненный, перистальтика выслушивается. Печень по краю реберной дуги, размеры по Курлову 10-9-8 см. Отеков нет. Мочеиспускание свободное. По данным Эхо-КГ: по сравнению с исходным периодом ФВ ЛЖ, КСР и КСР ЛЖ. толщина ЗСЛЖ и МЖП отрицательной динамики не претерпевали (таблица 3).
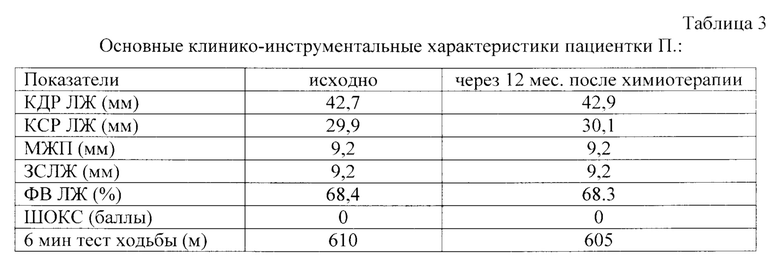
Таким образом, у пациентки с раком молочной железы через 12 месяцев после химиотерапии препаратами антрациклинового ряда и уровнем растворимого Fas-лиганда после химиотерапии, не превышающим 95,8 пг/мл (75,6 пг/мл), симптомов и признаков развития кардиотоксичности не установлено.
Предлагаемый способ апробирован на 176 пациентках и позволяет прогнозировать высокий риск развития кардиомиопатии после химиотерапии препаратами антрациклинового ряда. Это дает возможность выделить приоритетную группу пациенток с раком молочной железы после химиотерапии антрациклинами для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития у них кардиотоксичности, проявляющейся манифестацией и неуклонным прогрессированием хронической сердечной недостаточности и снижением ФВ ЛЖ с целью предотвращения у этих пациенток исключительно высокой преждевременной смертности.
СПИСОК ЛИТЕРАТУРЫ
1. Sawyer DB, Peng X, Chen В et al. Mechanisms of anthracycline cardiac injury: can we identify strategies for cardioprotection? Progress in Cardiovascular Diseases 2010; 53: 105-113.
2. Kalam K, Marwick TH. Role of cardioprotective therapy for prevention of cardiotoxicity with chemotherapy: a systematic review and meta-analysis. Eur J Cancer 2013; 49: 2900-2909.
3. Plana JC, Galderisi M, Barac A et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal - Cardiovascular Imaging 2014; 15: 1063-1093.
4. Lipshultz SE, Miller TL, Scully RE et al. Changes in cardiac biomarkers during doxorubicin treatment of pediatric patients with high-risk acute lymphoblastic leukemia: associations with long-term echocardiographic outcomes. J Clin Oncol 2012; 30: 1042-1049.
5. Gimeno E,  ,
,  JR et al. NT-proBNP: a cardiac biomarker to assess prognosis in non-Hodgkin lymphoma. Leuk Res 2011; 35: 715-720.
JR et al. NT-proBNP: a cardiac biomarker to assess prognosis in non-Hodgkin lymphoma. Leuk Res 2011; 35: 715-720.
6. De Iuliis F, Salerno G, Taglieri L et al. Serum biomarkers evaluation to predict chemotherapy-induced cardiotoxicity in breast cancer patients. Tumour Biol 2016; 37: 3379-3387.
7. Stevens PL, Lenihan DJ. Cardiotoxicity due to Chemotherapy: the Role of Biomarkers. Curr Cardiol Rep 2015; 17: 603.
8. DeSantis CE, Lin CC, Mariotto AB et al. Cancer treatment and survivorship statistics, 2014. CA Cancer J Clin 2014; 64: 252-271.
9. Albini A, Pennesi G, Donatelli F et al. Cardiotoxicity of anticancer drugs: the need for cardio-oncology and cardio-oncological prevention. Journal of the National Cancer Institute 2010; 102: 14-25.
10. Bovelli D, Plataniotis G, Roila F. ESMO Guidelines Working Group. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Ann Oncol 2010; 21: 277-282.
11. Armstrong GT, Kawashima T, Leisenring W et al. Aging and risk of severe, disabling, life-threatening, and fatal events in the Childhood Cancer Survivor Study. J Clin Oncol 2014; 32: 1218-1227.
12. Тепляков А.Т., Шилов С.Н., Попова А.А. и др. Состояние сердечно-сосудистой системы у больных с антрациклиновой кардиомиопатией. Бюллетень сибирской медицины 2017; 16(3): 127-136.
13. Stamatis A., John Т.P., Michael G. et al. Growth hormone administration reduces circulating proinflammatory cytokines and soluble Fas/soluble Fas ligand system in patients with chronic heart failure secondary to idiopathic dilated cardiomyopathy. Am Heart J 2002; 144(2): 359-364.
14. Takemura G., Kanoh M., Minatoguchi S., Fujiwara H. Cardiomyocyte apoptosis in the failing heart - a critical review from definition and classification of cell death. Int J Cardiol 2013; 167(6): 2373-2386.
15. Lee Y., Gustafsson A.B. Role of apoptosis in cardiovascular disease. Apoptosis 2009; 14(4): 536-548.
16. Ricci C., Pastukh V., Schaffer S.W. Involvement of the mitochondrial permeability transition pore in angiotensin II mediated apoptosis. Exper and Clin Cardiology 2005; 10 (3): 160-164.
17. Mughal W., Dhingra R., Kirshenbaum L.A. Striking a balance: autophagy, apoptosis, and necrosis in a normal and failing heart. Curr Hypertens Rep 2012; 14(6); 540-547.
18. Garg S., Narula J., Chandrashekhar Y. Apoptosis and heart failure: clinical relevance and therapeutic target. J of Molecular and Cellular Cardiology 2005; 38: 73-79.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования прогрессирования хронической сердечной недостаточности, индуцированной антрациклинами, у пациенток с раком молочной железы в течение 24 месяцев | 2022 |
|
RU2793672C1 |
| Способ прогнозирования антрациклин-индуцированной кардиотоксичности у женщин с раком молочной железы | 2019 |
|
RU2714683C1 |
| Способ прогнозирования развития подострой антрациклин-опосредованной кардиотоксичности у онкологических пациентов | 2020 |
|
RU2744682C1 |
| Способ персонифицированного отбора больных с антрациклин-индуцированной кардиомиопатией после полихимиотерапии рака молочной железы для эффективного лечения карведилолом | 2021 |
|
RU2778612C1 |
| Способ прогнозирования прогрессирования хронической сердечной недостаточности у пациенток с раком молочной железы после химиотерапии антрациклинами | 2022 |
|
RU2790788C1 |
| СПОСОБ ПРОФИЛАКТИКИ АНТРАЦИКЛИНОВОЙ КАРДИОТОКСИЧНОСТИ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2014 |
|
RU2546399C1 |
| Способ прогнозирования развития кардиотоксичности у больных HER2 позитивным раком молочной железы исходно низкого/умеренного сердечно-сосудистого риска, получающих таргетную терапию трастузумабом после антрациклин-содержащей химиотерапии | 2020 |
|
RU2741371C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2014 |
|
RU2599501C1 |
| ПРИМЕНЕНИЕ КОМПЛЕКСА АНТИОКСИДАНТНЫХ ВИТАМИНОВ И АМИНОКИСЛОТ В КАЧЕСТВЕ ДОПОЛНЕНИЯ К СТАНДАРТНЫМ МЕТОДАМ ТЕРАПИИ И СПОСОБ ЛЕЧЕНИЯ ПАПИЛЛОМАВИРУС-АССОЦИИРОВАННЫХ ПРЕДРАКОВЫХ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ И ПРОФИЛАКТИКИ КАНЦЕРОГЕНЕЗА ПРИ ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ | 2013 |
|
RU2537233C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КАРДИОТОКСИЧНОСТИ ХИМИО- И ТАРГЕТНОЙ ТЕРАПИИ С ПОМОЩЬЮ ЭХОКАРДИОГРАФИЧЕСКОЙ ДИАГНОСТИКИ | 2023 |
|
RU2828824C1 |
Изобретение относится к медицине и может быть использовано в кардиологии, ангиологии, кардиохирургии, онкологии, терапии, реабилитологии. Задача изобретения - разработка объективного высокоинформативного способа прогнозирования кардиотоксичности после химиотерапии препаратами антрациклинового ряда у пациенток с раком молочной железы по содержанию в крови растворимого Fas-лиганда (sFas-L). Поставленная задача решается путем определения растворимого Fas-лиганда в сыворотке крови посредством иммуноферментного метода. При наличии уровня растворимого Fas-лиганда более 95,8 пг/мл у пациенток с раком молочной железы после химиотерапии антрациклинами прогнозируют высокий риск развития кардиотоксичности в течение последующих 12 месяцев наблюдения. Предлагаемый способ позволяет прогнозировать в течение 12 месяцев наблюдения после химиотерапии антрациклинами высокий риск развития кардиотоксичности, обусловленной гибелью клеток миокарда (некроз, апоптоз), ремоделированием сердца и прогрессирующей сердечной недостаточностью, путем определения в сыворотке крови активатора Fas-опосредованного апоптоза - растворимого Fas-лиганда (sFas-L), что позволяет выделить приоритетную группу больных с повышенным риском кардиоваскулярных осложнений для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития кардиотоксичности. 2 пр., 3 табл., 1 ил.
Способ прогнозирования развития кардиотоксичности у пациенток с раком молочной железы в течение 12 месяцев после химиотерапии препаратами антрациклинового ряда, характеризующийся тем, что в сыворотке крови после химиотерапии антрациклинами определяют содержание растворимого Fas-лиганда и при наличии уровня растворимого Fas-лиганда более 95,8 пг/мл прогнозируют высокий риск развития кардиотоксичности.
| КРАВЧУК Т.Л | |||
| Ранняя диагностика кардиотоксичности противоопухолевой химиотерапии у больных со злокачественными новообразованиями с использованием радионуклидных методов исследования, автореферат диссертации, 2013, найдено 14.12.2018, найдено в Интернет http://www.dissercat.com/content/rannyaya-diagnostika-kardiotoksichnosti-protivoopukholevoi-khimioterapii-u-bolnykh-so-zlokac#ixzz5Ze1w20L8 | |||
| KAWAKAMI H | |||
| Increased circulating soluble form of Fas in patients with dilated cardiomyopathy, Jpn Circ J | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| найдено в Интернет https://www.ncbi.nlm.nih.gov/pubmed/9890197 | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ КУМУЛЯТИВНОЙ КАРДИОТОКСИЧНОСТИ ХИМИОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2012 |
|
RU2510240C2 |
| RU 2010102566 A, 10.08.2011 | |||
| ALTENA R et al | |||
| Cardiovascular toxicity caused by cancer treatment: strategies for early detection | |||
| J | |||
| Lancet Oncol., 2009, Apr; 10(4): 391-9, найдено 13.12.2018 | |||
| найдено в Интернет https://www.ncbi.nlm.nih.gov/pubmed/19341970. | |||
Авторы
Даты
2019-02-18—Публикация
2018-04-17—Подача