Изобретение относится к области медицины, а именно оториноларингологии, и касается лечения компенсированной формы неспецифического хронического тонзиллита.
Хронический неспецифический тонзиллит занимает лидирующие позиции в перечне тонзиллярной патологии. При общей заболеваемости населения тонзиллитами, достигающей 35% (по данным комплексной проверки поликлиник Москвы), на долю хронического тонзиллита в структуре распространенности заболеваний глотки приходится 23,7% случаев [1]. По другим оценкам заболеваемость хроническим тонзиллитом в различных возрастных группах составляет от 22,1% до 40,1% [2] и даже 5,6-37% и 15-63% у взрослых и детей соответственно [3]. Обращает на себя внимание то, что показатель заболеваемости хроническим тонзиллитом на территории бывшего СССР в 1925 г. колебался в пределах 4-10% [4], т.е. на протяжении почти столетнего периода несмотря на все достижения медицины (а может быть и благодаря им) прослеживается восходящий тренд динамики морбидности. Особая актуальность данной патологии обусловлена не только распространенностью, но и тем, что более сотни соматических заболеваний, по данным ВОЗ [5], могут быть ассоциированы с хроническим тонзиллитом. Весьма значимо, учитывая демографическую ситуацию в Российской Федерации, что у женщин детородного возраста на фоне хронического тонзиллита может формироваться эндокринное бесплодие (частота достигает 60%) вплоть до возникновения необратимых изменений в функционировании репродуктивной системы [6, 7]. Хронический тонзиллит патогенетически связан с острой ревматической лихорадкой [8], почечной патологией [9, 10], заболеваниями сердечно-сосудистой системы [11], PANDAS-синдромом [12], РРР-синдромом [13], множеством других соматических заболеваний и негативным образом влияет на качество жизни больных [14, 15]. К этому следует добавить, что нет общепринятой теории патогенеза, отсутствует единая классификация, не определена тактика по профилактике и консервативному лечению хронического тонзиллита, не разработан республиканский стандарт (стандарты) медицинской помощи больным с хроническим тонзиллитом [16].
Все это свидетельствует о том, что хроническое воспаление небных миндалин представляет собой актуальную проблему клинической медицины и организации здравоохранения [1, 17]. Поэтому остаются злободневными вопросы разработки патогенетически обоснованных подходов к терапии, поиска средств и способов лечения хронического тонзиллита.
Предложено и апробировано множество методик органосохраняющего (консервативного) лечения хронического тонзиллита, базирующихся на локальном либо системном применении различных фармакологических препаратов и рецептур, факторов физической природы и физиотерапевтических процедур, назначении иммунокорригирующих средств и адаптогенов. Но всем известным способам консервативного лечения хронического тонзиллита присущ один и тот же недостаток - все они малоэффективны и не позволяют достичь стойкого клинического эффекта. По мнению В.Т.Пальчуна: «… вернуть активность воспалительного процесса в небных миндалинах после его хронизации в прежнюю, так называемую физиологическую активность, практически не представляется возможным. Речь, как известно, может идти лишь о некотором временном улучшении у части больных, пролеченных с помощью тех или иных консервативных методик» [17].
Наиболее близким по технической сущности к заявляемому изобретению является способ лечения хронического тонзиллита с курсовым назначением антигистаминных препаратов системного действия и местным частым применением антисептиков и иммуностимулятора в виде смеси лизатов бактерий [18].
Недостатки способа-прототипа:
1. При реализации способа-прототипа достигается лишь временное клиническое улучшение при сохранении очага инфекции и воспалительного процесса в небных миндалинах [17].
2. Антисептики, оказывая бактерицидное действие, способствуют углублению и консервации дисбиотического состояния слизистой оболочки верхних дыхательных путей, что является условием и причиной возникновения и поддержания хронического воспаления небных миндалин [19].
Цель изобретения - повышение эффективности терапии компенсированной формы неспецифического хронического тонзиллита путем применения способа лечения, обеспечивающего комплексное корригирующее воздействие на основные патогенетические механизмы формирования и поддержания хронического воспалительного процесса в небных миндалинах и позволяющего подавить вегетирование нерезидентной микрофлоры, стимулировать местную противовирусную защиту и рост симбионтных микроорганизмов.
Данная цель достигается тем, что комплексно в течение трех недель проводят:
1. Диетотерапию. Основным содержанием диетотерапии является включение в рацион питания утренней и вечерней порций овсяной каши объемом 0,2-0,3 литра, каждую порцию готовят из 100-125 г овсяных хлопьев; в обеденное меню включают кашу из гречневой крупы и один сырой яичный белок; из рациона исключают моносахариды, дисахариды и блюда, их содержащие, напитки и продукты, в состав которых входят ингибиторы фосфодиэстераз (шоколад, какао, кофе, чай); для приготовления первых, вторых блюд, десертов и напитков используют только профильтрованную воду.
2. Витаминотерапию. Витамины группы «В» назначают в составе препарата «Нейромультивит» ежедневно перорально один раз в день по одной таблетке, каждая из которых содержит тиамина гидрохлорида (витамин В1) 100,0 мг, пиридоксина гидрохлорида (витамин В6) 200,0 мг, цианокобаламина (витамин В12) 200,0 мкг; витамин А (ретинола ацетат) в течение первой недели назначают ежедневно перорально один раз в день по одной капсуле, содержащей 33000 ME ретинола ацетата, и через день перорально один раз в день по одной капсуле, содержащей 33000 ME ретинола ацетата, в течение последующих двух недель; витамин Е (α-токоферол) назначают ежедневно перорально три раза в день по 1 капсуле (100,0 мг) в течение первой недели и по 1 капсуле (100,0 мг) ежедневно перорально два раза в день в течение последующих двух недель; витамин D3 (кальцитриол) назначают ежедневно перорально один раз в день в дозе 4000 ME (100,0 мкг); витамин С (аскорбиновую кислоту) назначают ежедневно перорально три раза в день по два драже, каждое из которых содержит по 50,0 мг аскорбиновой кислоты, в течение первой недели и по два драже (всего 100,0 мг аскорбиновой кислоты) ежедневно перорально два раза в день в течение последующих двух недель.
3. Пробиотикотерапию. Ежедневно перорально после приема пищи назначают пробиотик третьего поколения «Бифиформ» по одной капсуле три раза в день.
4. Антиоксидантную терапию. В качестве антиоксидантов, дополнительно к витаминам-антиоксидантам (ретинолу ацетату, α-токоферолу и аскорбиновой кислоте) назначают: липоевую (тиоктовую) кислоту - ежедневно перорально три раза в день после приема пищи по одной таблетке (25,0 мг); N-ацетилцистеин (препарат «АЦЦ») -ежедневно перорально три раза в день по одной шипучей таблетке (200,0 мг) после растворения в воде; дигидрокверцетин - ежедневно перорально три раза в день по одной таблетке (25 мг) во время еды в течение первой недели и по одной таблетке (25 мг) два раза в день во время еды в течение последующих двух недель; мелатонин (препарат «Мелаксен») - ежедневно перорально один раз в день по одной таблетке (3 мг мелатонина) за тридцать минут до отхода ко сну; селен (препарат «Селен-актив») - ежедневно перорально один раз в день по одной таблетке (50 мкг) в течение трех недель.
5. Терапию препаратами, обладающими пребиотик-подобной активностью. В качестве пребиотик-подобных препаратов назначают: новокаин - ежедневно перорально три раза в день после приема пищи по 5,0 мл 0,25% раствора; эмоксипина сукцинат (препарат «Мексидол») - ежедневно перорально три раза в день по одной таблетке (125 мг); амброксола гидрохлорид (препарат «Лазолван») - ежедневно перорально три раза в день во время приема пищи по одной таблетке (30 мг); препарат «Энтеросгель» - ежедневно перорально три раза в день через два часа после приема пищи и лекарственных препаратов по 15 г (по одной столовой ложке); кальция глицерофосфат - ежедневно перорально три раза в день после приема пищи по одной таблетке (0,2 г).
6. Стресс-протективную терапию. В качестве стресс-протектора, усиливающего эффекты мексидола и мелатонина, назначают трициклический антидепрессант амитриптилин - ежедневно перорально три раза в день в субтерапевтической дозе 6,25-12,5 мг (1/4-1/2 таблетки).
7. Местную иммунокорригирующую терапию. Для стимуляции местного иммунитета небных миндалин назначают ежедневно шесть раз в день (через два часа) поливалентный антигенный комплекс в форме таблеток для рассасывания - препарат «Имудон».
8. Топическую эрадикационную терапию. Для элиминации патогенов, вегетирующих внутри клеток и в составе бактериальных биопленок в ткани небных миндалин, ежедневно один раз в день в течение трех недель лакуны небных миндалин последовательно промывают сначала 0,05% раствором пероксида водорода, а затем, через 15 минут, повторно промывают 1,67% раствором эмоксипина сукцината («Мексидола») и 0,25% раствором амброксола гидрохлорида («Лазолвана») в 0,33% растворе новокаина. Раствор (0,05%) пероксида водорода для промывания небных миндалин изготовляют непосредственно перед его применением путем смешивания 59,0 мл 0,9% раствора натрия хлорида и 1,0 мл 3% раствора (официнального) пероксида водорода. Используемый при реализации заявляемого способа лечения компенсированной формы неспецифического хронического тонзиллита многокомпонентный раствор для повторного промывания лакун небных миндалин, включающий эмоксипина сукцинат, амброксола гидрохлорид и новокаин, изготовляют также непосредственно перед его применением, посредством смешивания в одном флаконе равных объемов официнальных 1% ампульного раствора новокаина, 5% ампульного раствора эмоксипина сукцината («Мексидола») и 0,75% ампульного раствора амброксола гидрохлорида («Лазолвана»).
В качестве базиса заявляемого способа лечения (терапии) компенсированной формы неспецифического хронического тонзиллита предлагается новое видение патогенеза хронического воспаления небных миндалин.
Хронический тонзиллит может быть следствием как первичных воспалительных процессов в небных миндалинах (острых ангин), так и вторичного воспаления (безангинная форма хронического тонзиллита [20, 21]) при частых ОРВИ, стоматитах, пародонтозе и т.п. К хронизации воспаления небных миндалин приводит прогредиентное падение (после каждого эпизода острых ангин, в процессе вторичного воспаления) колонизационной резистентности слизистой оболочки ротоглотки и небных миндалин в результате:
- нарушения целостности эпителиальной выстилки крипт небных миндалин [22];
- уменьшения объема продукции эпителиоцитами небных миндалин антибактериальных катионных пептидов (β-дефензин-1,-2,-3, LL-37, LEAP-1,2) [23];
- локального дефицита секреторного IgA (как следствие снижения стимулирующих экспрессию иммуноглобулина эффектов симбионтов при микроэкологическом дисбалансе [24] и дефекта созревания В-лимфоцитов [25]), обеспечивающего иммунную эксклюзию патогенов и бактериальных токсинов на слизистых оболочках и внутри клеток без повреждения клеточных элементов эпителиальных барьеров [26];
- модулирующего влияния факторов, ассоциированных с воспалением, на эпигенетическую регуляцию экспрессии гликозилтрансфераз клеточными элементами ткани небных миндалин, что проявляется изменением спектра гликополимеров, экспонируемых на цитоплазматических мембранах эпителиоцитов, аберрантным гликозилированием муцина, гипогликозилированием IgA [28-32] и увеличением уровня обсемененности слизистой оболочки небных миндалин нерезидентной микрофлорой, подавлением вегетирования симбионтов, т.е. в виде дисбиотического состояния [19, 33, 34];
- формирования патогенной микрофлорой бактериальных биопленок и внутриклеточного резервуара инфекции, резко увеличивающих ее устойчивость к воздействию неблагоприятных факторов (антител, антибактериальных пептидов, антибиотиков, антисептиков) [22, 35, 36].
Еще в 1683 г. А. Левенгуком были описаны две формы существования бактерий: в виде подвижных свободноживущих организмов и в виде стационарных ассоциаций (биопленок). Однако под гипнотизирующим влиянием достижений культуральных бактериологических методов идентификации возбудителей острых инфекционных заболеваний и эффективности антибактериальной терапии инфекционной патологии сам факт существования биопленок длительное время попросту игнорировался. Повторное открытие биопленок состоялось только в 1978 г. [37]. И это вызвало волну неослабевающего интереса к проблеме широкого круга специалистов [38]. В настоящее время под термином «биопленка» принято понимать различные неподвижные сообщества микроорганизмов (вегетирующих при достаточной влажности), погруженных в матрикс полимерных субстанций (продуцируемых ими же), прикрепленных друг к другу и к поверхности (с которой контактируют) и обладающих измененным фенотипом в отношении скорости роста и спектра экспрессируемых генов [39]. В зависимости от условий, 99,9% видов бактерий способны быстро переходить от вегетирования в составе биопленок к существованию в форме планктона и обратно. По данным специалистов агентств CDC (Center for Disease Control and Prevention, CDC) и NIH (National Institutes of Health, NIH) США в 65-80% случаев инфекционные заболевания ассоциированы с бактериальными биопленками [40, 41]. Допускается, что вегетирование микроорганизмов в виде биопленки (бактериального мата) представляет собой более эволюционно древнюю форму существования прокариот, нежели в виде планктона [40, 42, 43]. Распространенность и эволюционную древность бактериальных пленок как биологического феномена в мире прокариот можно объяснить лишь исходя из того, что они обеспечивают ряд преимуществ их обитателям [44, 45].
В жизненном цикле (генезисе) бактериальных биопленок принято выделять пять главных событий [46, 47]:
1. Первичное (обратимое) прикрепление к поверхности. На этой стадии микроорганизмы демонстрируют видоспецифическое поведение [48] и начинают изменять профиль фенотипа [49]. При достижении критической плотности организмов на единице площади поверхности (за счет деления уже прикрепившихся и поступления вновь прикрепляющихся бактерий) феномен межбактериальной коммуникации, известный как «чувство кворума» [50], посредством автоиндукторов - высоко консервативных сигнальных молекул внутри- и межвидового взаимодействия прокариот [51-53] - индуцирует последующие фенотипические изменения бактерий, трансформируя обратимое прикрепление в необратимое. Важно заметить, адгезионное взаимодействие поверхностных структур клеточной стенки бактерий с лектинами и гликанами цитоплазматической мембраны эпителиоцитов небных миндалин, создающее критическую плотность микроорганизмов, может происходить лишь в условиях утраты колонизационной резистентности эпителиального барьера, т.е. в условиях дисбиотического состояния.
2. Окончательное (необратимое) прикрепление к поверхности обеспечивается посредством экспрессии множества адгезинов, регулируемой на уровне транскрипции автоиндукторами. Основа матрикса бактериальной биопленки представлена сложной смесью высокомолекулярных (>10000 Da) полисахаридов. Разные виды бактерий синтезируют разные экзополисахариды [54-56]. Полисахаридные адгезины обеспечивают неспецифическое и рецептор-зависимое взаимодействие как между бактериальными клетками, так и с эпителиоцитами [60, 61]. Важным компонентом матрикса биопленок являются также внеклеточная ДНК [62, 63], протеины и амфифильные полимеры [64, 65], активно секретируемые микроорганизмами [66, 67] и обеспечивающие формирование трехмерной структуры биопленки, селективную доступность субстратов для вегетирующих микроорганизмов [68].
3. Созревание и 4. Рост бактериальной биопленки. В течение этих стадий увеличивается плотность микроорганизмов в матриксе, наращивается объем и осуществляется структурирование биопленки. При этом фенотип микроорганизмов, обитающих в составе биопленки, радикальным образом отличается от планктонных форм тех же видов бактерий [46, 69-71]. Следует заметить, что новый паттерн экспрессии генов (после достижения критической плотности микроорганизмов на единице площади поверхности) формируется очень быстро - в течение четверти часа [72].
5. Дисперсия (рассеивание) бактерий. Когда бактериальная биопленка достигает критических характеристик, определяющих условия обитания прокариот (перфузионные ограничения доступности нутриентов и возможности удаления продуктов метаболизма), микроорганизмы периферических частей биопленки начинают трансформироваться в планктонные формы и рассеиваться в окружающей среде [73].
Все процессы формирования и развития бактериальной биопленки определяются соответствующими профилями экспрессии генов, формируемыми под влиянием молекул межклеточной сигнализации, в частности ацилгомосеринлактонов [74, 75]. Кроме того, дисперсия бактерий контролируется присутствием неканонических аминокислот (D-Met, D-Leu) [76-78] и триамина норспермидина [79], продуцируемых обитателями биопленки.
Бактериальные биопленки как стратегия выживания прокариот в неблагоприятных условиях (при воздействии антибактериальных факторов различной химической природы, продуцируемых конкурирующими прокариотами и защищающимися эукариотами) за миллиарды лет эволюции доказали свою эффективность. Бактериальные патогены в составе биопленок на два-три порядка более устойчивы к воздействию антибиотиков и антисептиков относительно их планктонных форм [80, 81]. Возрастание резистентности микроорганизмов, обитающих в составе биопленок, к воздействию бактерицидных и бактериостатических средств обусловлено:
- резким замедлением процесса пенетрации аминогликозидных, (β-лактамных, глико-пептидных антибиотиков в толщу биопленки в результате электростатического связывания катионных группировок антибактериальных препаратов с анионными центрами полимеров матрикса, что предоставляет микроорганизмам необходимое время для адаптивного стрессорного ответа [82-84];
- накоплением в составе матрикса биопленок энзимов деградации антибактериальных субстанций [85, 86] и соединений, иммобилизирующих (сорбирующих) антимикробные агенты [87, 88];
- наличием апикально-базального градиента величины рН, содержания кислорода, нутриентов и продуктов обмена, замедляющего метаболические процессы в микроорганизмах и в силу этого увеличивающего их устойчивость к воздействию неблагоприятных факторов [83, 89-91];
- изменением паттерна экспрессии биофильм-специфических генов резистентности (стимуляция экспрессии эффлюкс-помп, периплазматических глюкоконъюгатов); мутациями генов, экспрессирующих молекулы-мишени антибиотиков [81, 92-94];
- наличием в составе бактериальной биопленки субпопуляции микроорганизмов-персистеров, отличающихся фенотипом, сходным со споровыми формами прокариот, как результат активации экспрессии генов персистенции, что позволяет биопленкам восстанавливаться даже после массивной антибактериальной терапии [95, 96];
- способностью матрикса бактериальных биопленок обеспечивать защиту патогенов от воздействия местных, гуморальных и клеточных факторов иммунной системы макроорганизма [97-100].
Высокая генетическая пластичность этиологически значимой при хроническом тонзиллите патогенной микрофлоры (Staphylococcus aureus, Haemophilus sp., Streptococcus sp., Pseudomonas aeruginosa) [34, 101], позволяющая ей экспрессировать фенотип, обеспечивающий внутриклеточное персистирование, так же, как и образование бактериальных биопленок, способствует хронизации инфекции в силу уклонения внутриклеточных патогенов от факторов иммунной защиты. В большинстве случаев (если не во всех) наличие бактериальной биопленки при хроническом воспалении верхних отделов дыхательных путей ассоциировано с внутриклеточным вегетированием инфекционных агентов [102-110]. Следует особо акцентировать внимание на том, что массированное адгезионное взаимодействие болезнетворных бактерий с клеточной мембраной эпителиоцитов, интернализация микроорганизмов в эпителиоциты и их последующее внутриклеточное вегетирование, формирование бактериальных пленок на элементах эпителиальной выстилки крипт небных миндалин возможны только в условиях микроэкологического дисбаланса. По-видимому, именно данные феномены и предопределяют низкую эффективность традиционных способов консервативной терапии хронического тонзиллита.
В качестве терапевтической стратегии при хроническом тонзиллите в самое последнее время предлагается использование антибиотиков, активных относительно внутриклеточных патогенов [110]. Надо полагать, что данный подход так же, как и существующие, усугубляя и стабилизируя дисбиотическое состояние организма, способен обеспечить лишь временный (непродолжительный) положительный эффект.
Проблема микроэкологического дисбаланса все отчетливее ассоциируется с проблемой хронического стресса. Длительная стимуляция активности гипоталамогипофизарно-надпочечниковой стресс-реализующей системы, в частности,
проявляется [111-113]:
- дисбалансом нейро-гуморальных факторов, определяющих колонизационную резистентность эпителиальных барьеров и непосредственно влияющих на фенотип микроорганизмов;
- дефицитом медиаторов стресс-лимитирующей системы, обусловливающим патогенетическую весомость подпороговых в обычных условиях стресс-индуцирующих стимулов;
- частичным замещением симбионтного микробиома нерезидентной микрофлорой, сопровождающимся активным соперничеством между микроорганизмами за доминирование в микроэкологических нишах;
- формированием порочного круга самоподдержания микроэкологического дисбаланса вследствие стресс-индуцирующей природы аберрантного кишечного микробиома на фоне несостоятельности механизмов стресс-лимитирующей системы.
При этом, антибиотики, диетические погрешности, инфекции ЛОР-органов и пародонта могут выступать как в качестве самостоятельных этиологических факторов формирования дисбиотического состояния, так и в роли эффекторов, потенцирующих действие хронического стресса.
Дисбиотическое состояние слизистой оболочки небных миндалин как локальное проявление системного микроэкологического дисбаланса представляет собой необходимое условие и причину возникновения хронического тонзиллита. Поэтому в качестве облигатной базисной части программы терапии хронического воспаления небных миндалин следует рассматривать мероприятия по купированию дисбиотического состояния.
С целью снижения тонуса гипоталамо-гипофизарно-надпочечниковой стресс-реализующей системы показано назначение трициклического антидепрессанта амитриптилина в субтерапевтической дозе 6,25-12,5 мг (1/4-1/2 таблетки) два раза в день [114]. Значимым аспектом фармакологической активности амитриптилина представляется и его способность блокировать биологические эффекты липополисахарида грам-негативных бактерий посредством ингибирования TLR-4-зависимой сигнальной трансдукции [115].
Несомненна роль диетотерапии при дисбиотических состояниях. С целью оптимизации условий вегетирования симбионтов показано употребление продуктов, отличающихся высоким содержанием пищевых волокон. Наиболее подходящими для восстановления эубиоза можно считать овсяные хлопья и гречневую крупу. В зернах овса доля пищевой клетчатки составляет до 10-12%, которая примерно наполовину представлена наиболее ценными для человеческого организма Р-глюканами. В 1997 г. Администрация США по контролю за пищевыми продуктами и медикаментами (US FDA) признала овсяные отруби первым продуктом, снижающим уровень холестерина в крови (по-видимому, за счет нормализации кишечного микробиоценоза) [116]. А Национальная академия наук США рекомендует суточную дозу овсяной клетчатки на уровне 25-28 г для здоровых молодых женщин и мужчин [117]. Рекомендованная доза пищевых волокон содержится в 200-250 г овсяных хлопьев, из которых следует готовить утреннюю и вечернюю порцию овсяной каши равных объемов (200-300 мл) для осуществления диетической коррекции дисбиотического состояния. В обеденное время целесообразно употребление каши из гречневой крупы в качестве самостоятельного блюда или гарнира (порция 200-300 г).
Пищевые волокна (совокупность различных водорастворимых полисахаридов) не перевариваются (не расщепляются на моносахариды) эндогенными секретами желудочно-кишечного тракта человека и в неизмененном виде достигают толстой кишки, где метаболизируются анаэробной («травоядной») симбионтной микрофлорой до короткоцепочечных жирных кислот. Короткоцепочечные жирные кислоты (ацетат, пропионат, бутират, валерат) являются основным энергетическим субстратом для эпителиоцитов слизистой оболочки толстой кишки [118], стимулирующим пролиферацию, дифференциацию клеток и образование муциновой слизи. Кроме того, пищевые волокна, фиксируя на своей обширной поверхности симбионтные микроорганизмы, способствуют резкому увеличению их содержания в единице внутрикишечного объема и возрастанию метаболической активности внутрикишечной среды.
Эффекты короткоцепочечных жирных кислот, в определенной степени, опосредуются протеин-G-зависимыми рецепторами GPR41 и GPR43 (локализованы на эпителиоцитах дистального отдела тонкой кишки, толстой кишки, энтероэндокринных и тучных клетках слизистой оболочки кишечника (119, 120]), активация которых сопровождается возрастанием уровня цитозольного Са2+ и соответствующим снижением содержания внутриклеточного циклического аденозинмонофосфата (цАМФ) [121]. Поэтому во избежание блокирования рецептор-зависимых эффектов короткоцепочечных жирных кислот посредством подавления активности фосфодиэстераз, обеспечивающих гидролитическое расщепление цАМФ [122], при диетотерапии микроэкологического дисбаланса следует избегать употребления продуктов и напитков (шоколад, какао, кофе, чай), содержащих ингибиторы фосфодиэстераз - кофеин, теофилин, теобромин и другие метилированные ксантины.
Лучше всего β-глюканы овсяной каши следует принимать на тощий желудок, что в оптимальном режиме обеспечивает их кишечный пассаж и транспорт через эпителиальный барьер в лимфу. Пероральное поступление в организм β-глюканов также физиологически эффективно, как и их парентеральное введение [123]. Бета-глюканы чрезвычайно устойчивы и поэтому в процессе кулинарной обработки не теряют физиологической активности [124], которая проявляется в их способности:
-модулировать активность иммунной системы дозозависимым образом без эффектов избыточной стимуляции [125, 126], и, следовательно, не имеется противопоказаний у субъектов с аутоиммунными, аллергическими и грибковыми заболеваниями [127];
- предотвращать развитие септических состояний при профилактическом назначении [128];
- специфически связываться с лектиновым сайтом CR3 (Complement Receptor-3, CR3) макрофагов, усиливая их бактерицидность, включая защиту от опухолевых клеток [129];
- улучшать моторную функцию кишечника [130] и проявлять антиоксидантные свойства [131].
С целью предупреждения (купирования) синдрома избыточного роста бактерий в тонкой кишке из диеты исключаются простые сахариды (моно- и дисахариды - глюкоза, фруктоза, сахароза и т.п.) и их содержащие продукты (мед, варенье, сиропы и т.п.). Следует избегать употребления любых алкогольных напитков и продуктов, в состав которых входят подсластители, красители, ароматизаторы, консерванты.
Целесообразно употребление сырого яичного белка, содержащего значительное количество железо-связывающего протеина овотрансферрин. Овотрансферрин способен резко снижать уровень ионов железа во внутрикишечной среде, являющихся «фактором роста» для условно-патогенной и патогенной микрофлоры, что, естественно, благоприятствует восстановлению эубиоза [132, 133].
Вода, используемая для приготовления первых блюд и напитков, должна быть обязательно профильтрована с целью удаления остаточного хлора, оксидов железа и других загрязнителей. Предназначенная для питья вода после фильтрации обязательно подвергается кипячению [134].
В исследованиях последних лет убедительно продемонстрировано, что время персистенции пробиотических штаммов микроорганизмов в дистальных отделах желудочно-кишечного тракта ограничено несколькими сутками, ассоциировано с экспрессией специфических полипептидов, лектинов, гликопротеинов энтероцитами [135, 136] и, кроме того, определяется палитрой декорирующих бактериальную клетку в качестве факторов адгезии полисахаридов, тейхоевых кислот и протеинов (в т.ч. углеводсвязывающих) [137, 138]. Разнообразие профилей, экспонируемых на клеточной стенке молекул адгезии, даже внутри каждого вида симбионтных микроорганизмов весьма велико [139]. Наличие потрясающе широкого субъект-специфического разнообразия спектров декорирующих элементов, локализованных на плазматической мембране эпителиоцитов млекопитающих, и штамм-специфического паттерна молекул адгезии на клеточной стенке бактерий предопределяют селективность их взаимоотношений. Биологическая целесообразность такой «расточительности» заключается в обеспечении резистентности многоклеточных эукариот к воздействию различных патогенов на видовом и индивидуальном уровнях посредством затруднения взаимодействия микроорганизмов со структурными элементами плазматической мембраны клеток покровных тканей. Поэтому цель пробиотикотерапии при лечении компенсированной формы неспецифического хронического тонзиллита заключается не в субституции нерезидентных микроорганизмов аберрантного микробиоценоза желудочно-кишечного тракта и других микроэкологических ниш пробиотическими штаммами симбионтных бактерий, а в создании условий для восстановления эубиоза посредством заселения различных биотопов организма частично сохранившейся прежней и новой резидентной микрофлорой. И это предопределяет длительность пробио-тикотерапии, составляющую несколько недель. Воздействие пробиотиков на организм человека, способствующее восстановлению эубиоза, проявляется [140-144]:
- эффектами общего характера (синтез нутриентов и физиологически активных субстанций, модулирование состояния кишечного микробиоценоза и иммунной системы);
- изменениями локального характера (восстановление структурно-функциональной полноценности эпителиальных барьеров, индуцирование благоприятной динамики физико-химических параметров среды биотопов);
- клеточно-гуморальными эффектами (модулирование экспрессии иммуноглобулинов, цитокинов, гликоконъюгатов, функционального состояния эпителиоцитов и клеток MALT-системы).
При лечении компенсированной формы неспецифического хронического тонзиллита пробиотикотерапию следует проводить курсом длительностью три недели, назначая один из препаратов-пробиотиков третьего поколения «Бифиформ» (внутрь по 1 капсуле три раза в день) и дополняя ее топическим применением смеси лизата бактерий с целью стимулирования местного иммунитета (препарат «Иммудон» в форме таблеток для рассасывания, по 1 таблетке шесть раз в день).
Важный аспект программы купирования дисбиотического состояния - включение в перечень мероприятий по коррекции микроэкологического дисбаланса назначения фармакологических средств, обладающих пребиотик-подобной активностью (новокаин, эмоксипина сукцинат, амброксола гидрохлорид).
Новокаин, попадая в биосреды организма, относительно быстро гидролизуется, распадаясь на пара-аминобензойную кислоту и диэтиламиноэтанол [145]. Пара-аминобензойная кислота (витамин В10) представляет собой «фактор роста» для представителей симбионтной микрофлоры [146], способствующий подавлению вегетирования нерезидентных микроорганизмов [147]. Кроме того, будучи индуктором интерферона, пара-аминобензойная кислота - эффективное противовирусное средство [148] и стимулятор экспрессии полимерного рецептора иммуноглобулина A (plgR), обеспечивающего трансцитоз slgA через эпителиальные клетки (в условиях достаточной обеспеченности организма витамином А), что способствует увеличению уровня slgA на слизистых оболочках [149, 150]. В плане рассматриваемого вопроса значимо, что в процессе трансцитоза полимерная форма slgA нейтрализует внутриклеточные патогены и их токсины [151]. Кроме того, витамин В10 способен оказывать нормализующее воздействие на обменные процессы в соединительной ткани и оптимизировать усвоение других витаминов группы В. Новокаин как предшественник пара-аминобензойной кислоты - также эффективный индуктор интерферона [152]. Противовирусная активность новокаина, как индуктора интерферона, значима в связи с тем, что на фоне подавления микрофлорой биопленки способности клеточных элементов эпителиального барьера небных миндалин экспрессировать данный противовирусный фактор [153, 154], персистирующая риновирусная инфекция индуцирует дальнейшее распространение биопленки и внутриклеточное вегетирование бактериальных патогенов [155-158].
В качестве стимулятора роста симбионтной микрофлоры и индуктора интерферона целесообразно как пероральное назначение 0,25% раствора новокаина в объеме 5,0 мл три раза в день после еды, так и локальное его применение для промывания лакун небных миндалин.
Эмоксипина сукцинат (препарат «Мексидол») достаточно давно известен и с успехом применяется в терапии критических состояний [159]. «Мексидол» имеет широкий спектр фармакологической активности: является антигипоксическим, стресс-протективным, ноотропным, противосудорожным и анксиолитическим средством, эффективно ингибирующим процессы свободнорадикального окисления. Данный лекарственный препарат обладает противовоспалительным действием, улучшает микроциркуляцию и стимулирует репаративно-регенераторные процессы. Столь широкая палитра фармакологической активности «Мексидола» (эмоксипина сукцината) обусловлена способностью препарата стимулировать сукцинатоксидазное окисление (компенсаторный путь синтеза АТФ) [160, 161], фосфорилироваться в биологических системах и оказывать ингибирующее воздействие на сериновые, металлозависимые протеиназы [162], ингибировать свободнорадикальные стадии синтеза простагландинов [163], а также хелатировать ионы железа, исключая тем самым каталитическую продукцию прооксидантов с участием данного металла переменной валентности и его доступность для нерезидентной микрофлоры. Важно, что фармакологическая активность «Мексидола» проявляется, помимо прочего, эффектами стимуляции экспрессии секреторного IgA и лизоцима в полости рта [165].
При хроническом тонзиллите бактериальная инфекция в большинстве случаев ассоциирована с латентной вирусной инфекцией [166-168]. Поэтому, в контексте рассматриваемой проблемы, важный аспект фармакологической активности эмоксипина сукцината - способность продуктов биотрансформации данной субстанции ингибировать различные протеиназы. Это, с одной стороны, обусловливает (отчасти) его противовоспалительные эффекты, а с другой - может предопределять и противовирусную активность. Известно, например, что для интернализации оболочечных вирусов необходим предварительный процессинг гликопротеинов оболочки вирусной частицы, который осуществляется трипсин-подобными лейкопротеиназами [169, 170]. Естественно, что при ингибировании протеиназ фосфорилированными производными эмоксипина возможно снижение вирулентности оболочечных вирусов, т.е. подавление процесса их мультициклической репликации. Кроме того, известно, что воспалительная реакция обеспечивает и поддерживает в зоне воспаления присутствие свободных ионов железа, стимулирующих процессы пероксидации и вегетирования патогенной микрофлоры [171]. Особо значима способность фосфорилированных производных эмоксипина хелатировать ионы железа и ингибировать активность протеиназ в связи с тем, что на фоне хронического воспаления небных миндалин локально подавляется активность лактоферрина [172] вследствие его протеолитической деградации под влиянием эластаз и катепсинов нейтрофилов и патогенных микроорганизмов [173, 174].
Лактоферрин - гликопротеин, обильно экспрессируемый клеточными элементами слизистых оболочек [175, 176], обладает выраженной противовоспалительной активностью и способностью блокировать формирование бактериальных биопленок вследствие:
- эффективного железо-хелатирующего действия, поддерживающего бактериостатический статус биосред организма [177];
- прямого связывания липополисахарида и его рецептора CD14 [178, 179];
- блокирования TLR-зависимой сигнальной трансдукции [189, 181];
- ингибирования образования и лизиса существующих бактериальных биопленок, прямого железо-независимого разрушения структурных элементов клеточной стенки микроорганизмов и оболочечных вирусных частиц [182-185].
Противовирусное действие новокаина (как индуктора интерферона), эмоксипина сукцината (как ингибитора протеиназ) при лечении хронического тонзиллита целесообразно усиливать за счет эффектов муколитика амброксола гидрохлорида (препарат «Лазолван»). «Лазолван» при местном применении, оказывая местноанестезирующее действие [186], стимулирует выделение секреторного ингибитора лейкопротеиназ, повышает экспрессию секреторного IgA [169, 187] и индуцирует активность щелочной фосфатазы - энзима детоксикации липополисахарида грам-негативных бактерий [188].
Вероятно, именно противовирусные и антибактериальные проявления фармакологической активности метаболитов эмоксипина могут быть приняты в качестве объяснения его эффективности в качестве средства терапии хронического фарингита [189], повторных тонзиллитов [190], хронического катарального гингивита [165] и пневмоний при острых экзогенных отравлениях [191].
Адгезионные свойства бактерий определяются палитрой углевод-связывающих белков клеточной стенки микроорганизмов и зависят от спектра гликановой декорации полипептидных цепей муцина и белковых молекул цитоплазматической мембраны эпителиальных клеток [192-194]. Для обеспечения колонизационной резистентности индигенные микроорганизмы оказывают влияние на профиль спектра лектинов и гликанов, экспрессируемых эпителиоцитами [195-198]. Вместе с тем хорошо известно, что структура цепей гликополимеров (в отличие от полипептидов) не кодируется в геноме эукариот, а определяется паттерном экспрессии и активности гликозилтрансфераз, участвующих в синтезе полисахаридов. Тем не менее, качественно-количественные характеристики гликанов, синтезируемых в организме млекопитающих, видоспецифичны и индивидуальны для каждого организма. То есть спектр экспрессируемых гликанов все же находится под жестким контролем. В данной связи следует обратить внимание на то, что фенотип отдельной клетки и многоклеточного организма в целом определяется, главным образом, внегеномной частью ДНК (не содержащей информации об аминокислотных последовательностях полипептидных цепей), управляющей экспрессией генов [199]. Эпигенетическое управление транскрипционной активностью генов, соответственно современным представлениям, включает механизмы метилирования ДНК [200, 201], различные обратимые ковалентные модификации структуры гистонов хроматина: фосфорилирование, убиквитинирование, ацетилирование, метилирование, сумоилирование, АДФ-рибозилирование, гликозилирование [202, 203] и регуляторные эффекты некодирующих РНК (miRNAs, piRNAs, esiRNAs)^oKHpyioi4Hx экспрессию генов [204, 205]. Считается, что эпигенетическая наследственная система менее стабильна, чем геном, и более чувствительна к различным возмущающим влияниям [206]. Постепенно приходит понимание того, что эпигенетическое перепрограммирование - ключевой патогенетический механизм многих заболеваний [207, 208].
Лимитирующим звеном процессов метилирования ДНК и гистонов в условиях витамин В12-дефицитных состояний может становиться метионин. Метионин (главный донор метальных групп в организме) - незаменимая аминокислота, синтезируемая из ее деметилированной формы (гомоцистеина) при участии витамин В12-зависимой метионин-синтазы [209, 210]. Если учитывать распространенность В12-гиповитаминоза [211, 212], дефицита витаминов группы «В», А (ретинола) и С (аскорбата) у пациентов с хроническим тонзиллитом [213, 214], ассоциированность поливитаминной недостаточности с формированием/поддержанием микроэкологического дисбаланса слизистой оболочки ротоглотки, опосредованного, в том числе, модулированием эпигенетической регуляции экспрессии факторов колонизационной резистентности, становится вполне очевидной патогенетическая значимость витаминотерапии.
Исходя из того что даже без участия в процессе абсорбции витамина В12 специфического механизма трансфера (фактора Кастла) около 1% от общего количества цианокобаламина, поступившего в кишечник, успешно резорбируется, при лечении компенсированной формы неспецифического хронического тонзиллита следует ежедневно однократно внутрь назначать данный витамин в дозе 200 мкг. Физиологическая суточная потребность взрослого человека в витамине В12 составляет всего 1,0-1,25 мкг, поэтому пероральное поступление цианокобаламина в указанной дозе способно адекватно восполнить запрос организма [215]. Другие витамины группы «В» также следует назначать ежедневно перорально однократно в дозах, покрывающих суточную потребность организма (витамин B1 - 100,0 мг/день, В6 - 200,0 мг/день).
Для хронического тонзиллита характерны интенсификация процессов пероксидации и снижение эффективности антиоксидантной защиты, что требует назначения адекватной антиоксидантной терапии [216-219]. Также известно, что фармакологическая коррекция проявлений оксидативного стресса эффективна только при комплексном применении водо-, жирорастворимых витаминов-антиоксидантов и восстанавливающих их тиолов [220]. Придерживаясь данной концепции, в программе терапии компенсированной формы неспецифического хронического тонзиллита целесообразно использовать: водорастворимую аскорбиновую кислоту, жирорастворимый α-токоферол, в качестве восстанавливающего их тиола - липоевую (тиоктовую) кислоту, а для восполнения пула эндогенного глутатиона - аминокислоту-прекурсор N-ацетилцистеин. В протекции биологических мембран от повреждающего действия прооксидантов, в кооперации с α-токоферолом (формируя в липидном бислое мембран динамичные сенсорно-проводящие комплексы, каждый из которых защищает 300-500 молекул фосфолипидов [221]) принимает участие и ретинол (витамин А), потенцирующий эффекты витамина Е [222]. Кроме того, витамин А обеспечивает поддержание целостности эпителиальных барьеров и стимулирует иммунореактивность [223, 224], оказывая тормозящее действие на индуцированное липополисахаридом биоконвертирование арахидоновой кислоты в провоспалительные простагландины, обладает противовоспалительной активностью [225-227]. Спектр физиологической активности витамина Е, помимо канонического антиоксидантного действия, включает и его способность регулировать экспрессию генов как на уровне транскрипции, так и на этапе трансляции [228-230]. Антиоксидантные эффекты витамина Е и ретинола усиливаются в присутствии селена.
Липоевая (тиоктовая) кислота синтезируется в организме в минимально необходимом для покрытия метаболических потребностей объеме. С возрастом и на фоне патологических состояний эндогенная продукция липоевой кислоты снижается [231]. Поэтому в условиях оксидативного стресса формируется дефицит липоевой кислоты, который может/должен быть купирован за счет поступления дитиола из внешних источников [232]. Как восстанавливающий дитиол, липоевая кислота обладает уникальным (эталонным) комплексом антиоксидантных свойств:
- тиоктовая кислота, будучи тропной и к полярным, и к неполярным средам, легко преодолевает биологические барьеры [233] и эффективно ингибирует свободнорадикальные реакции как в липидном бислое биологических мембран, так и в цитозоле клеток [234];
- антиоксидантные эффекты присущи как восстановленной, так и окисленной формам липоевой кислоты (в отличие от большинства других антиоксидантов) [235, 236];
- дигидролипоевая кислота как редуцирующий агент (ОВП - 320 mV [237]) способна восстанавливать окисленный глутатион (ОВП - 250 mV [237]) и антиоксидантные витамины (ОВП аскорбата - 282 mV [237]), выступая в качестве их синергиста [238], рециклируя аскорбиновую кислоту эффективнее восстановленного глутатиона [239];
- под влиянием липоевой кислоты в результате увеличения импорта клетками цистеина и стимуляции экспрессии γ-глутамилцистеинлигазы ускоряется синтез глутатиона в организме [233];
- липоевая кислота не только эффективно восстанавливает различные прооксиданты, но и ингибирует экспрессию провоспалительных цитокинов [240];
- окисленная и восстановленная формы липоевой кислоты эффективно хелатируют катионы металлов переменной валентности [241], лишая их каталитической активности;
- альфа-липоевая кислота эффективна и безопасна как терапевтическое средство при фармакологической коррекции патологических состояний, сопровождающихся интенсификацией процессов пероксидации [242, 243].
Оксидативный стресс, ассоциированный с хроническим тонзиллитом, помимо прочего, в клетках зоны воспаления может индуцировать митохондриальную дисфункцию, ведущую к гибели клеток [244, 245]. Поэтому, в силу недоступности внутримитохондриального компартмента для канонических антиоксидантов, при лечении хронического тонзиллита целесообразно использовать мелатонин в качестве митохондриального антиоксиданта. Мелатонин - уникальный стехиометрический гаситель свободных радикалов:
- мелатонин синтезируется в различных органах и тканях организма человека, его уровень существенно превышает концентрацию глутатиона в клетках эпителия, непосредственно контактирующих с внешней средой [246], и его содержание значительно снижается в ткани небных миндалин на фоне хронического воспаления [247];
- в отличие от витаминов-антиоксидантов, будучи амфифильным соединением, мелатонин способен восстанавливать свободные радикалы как в полярной (цитозоль), так и в неполярной (липидный бислой мембран) средах и легко преодолевать различные биологические барьеры [248];
- мелатонин способен избирательно накапливаться в мембранах митохондрий [249, 250], взаимодействовать с комплексами I и II электрон-транспортной цепи и блокировать утечку электронов, образование прооксидантов [251, 252], предотвращая тем самым пероксидацию кардиолипина - критически важного фосфолипида, обеспечивающего оптимальное функционирование комплексов III и IV цепи переноса электронов [253];
-мелатонин в два раза эффективнее α-токоферола ингибирует пероксидацию липидов биомембран [254], в пять раз активнее глутатиона нейтрализует гидроксильный радикал [255] и особенно надежно (связываясь, экранируя) защищает от свободнорадикальных повреждений ДНК [256];
- помимо гидроксильных и пероксильных радикалов, мелатонин эффективно восстанавливает супероксидный анион-радикал, синглетный кислород, пероксид водорода и гипохлорит-анион [257];
- мелатонин и некоторые из его метаболитов блокируют продукцию оксида азота и, следовательно, подавляют генерирование пероксинитрита, оказывая ингибирующее воздействие на активность митохондриальной изоформы NO-синтазы [258];
- мелатонин при восстановлении прооксидантов передает сразу два электрона и в последующем, в отличие от витаминов-антиоксидантов, не трансформируется в свободнорадикальные продукты; первичные и вторичные окси-производные мелатонина также обладают выраженными антиоксидантными свойствами; в результате окислительных превращений одной молекулы мелатонина может быть восстановлено до десяти молекул прооксидантов [259];
- рецептор-опосредованным путем (с участием в трансдукции сигнала плазмомембранных и ядерных рецепторов нейрогормона) мелатонин (в фармакологическом диапазоне доз) индуцирует экспрессию антиоксидантных энзимов, при этом наиболее значимо (4-8-кратно) увеличивается активность митохондриальной глутатион-пероксидазы [260, 261];
- стимулируя экспрессию лимитирующего синтез глутатиона фермента (γ-глутамилцистеинсинтетазы), мелатонин увеличивает объем продукции глутатиона, обеспечивая поддержание его концентрации в клетках на оптимальном уровне [262];
- блокируя активацию, транслокацию в ядро и связывание с промоторными участками ДНК провоспалительного фактора транскрипции NF-kB, мелатонин оказывает противовоспалительное действие, ингибируя экспрессию индуцибельных циклооксигеназы-2 и iNOS [263-265];
- контролируя тонус гипоталамо-гипофизарно-надпочечниковой системы, мелатонин способен минимизировать неблагоприятные последствия хронических стрессорных воздействий [266, 267];
- мелатонин оптимизирующе влияет на функциональное состояние иммунной системы [268, 269] и увеличивает экспрессию секреторного иммуноглобулина А [270].
Учитывая распространенность нарушений процесса засыпания и сна среди больных хроническим тонзиллитом и физиологичность снотворного действия мелатонина, при лечении хронического тонзиллита его следует назначать в виде препарата «Мелаксен» непосредственно перед отходом ко сну внутрь в дозе 3 мг.
В последние годы стала очевидной плейотропность физиологических эффектов витамина D3 (кальцитриола) и, в частности, его роль в осуществлении защитных функций эпителиальных барьеров [271-273]. Выявлены новые аспекты (ассоциированные с кальцитриолом) участия в реализации этих протективных функций симбионтных микроорганизмов [274]. Установлено, в частности, что эпителиоциты при контакте с нерезидентными микроорганизмами потенциально способны резко увеличить экспрессию таких полипептидных факторов защиты, как кателицидины и дефензин-β-2, обладающих широким спектром противомикробного действия, активных в отношении многих вирусов, грибков и отличающихся способностью нейтрализовать липополисахарид грам-негативных бактерий [275, 276]. Кателицидины, кроме того, стимулируя ангиогенез и митотическую активность клеток, способствует поддержанию структурно-функциональной полноценности эпителиальных барьеров [277]. Следует особо обратить внимание на то, что кателицидин LL-37, стимулируя экспрессию генов Beclin-1 и Atg5, индуцирует слияние бактериальных фагосом с лизосомами. Таким образом, в условиях достаточной обеспеченности организма витамином D3 стимулируется процесс макроаутофагии, ведущий к элиминации внутриклеточных патогенов [278, 279]. Но эти защитные реакции эпителиоцитов эффективно реализуются только в присутствии активной формы витамина D3. Превращение 25-гидроксивитамина D3 в его активную форму (1α,25(OH)2D3) катализируется 1α-гидроксилазой CYP27B1, а катаболическая трансформация 1α,25(OH)2D3 осуществляется при участии монооксигеназы CYP24A1 [280]. Экспрессия данных изоформ цитохрома Р-450 (CYP27B1,CYP24A1), рецептора витамина D3 контролируется эпигенетичекими регуляторными механизмами [281, 282]. В физиологических условиях активная форма витамина D3 (1α,25(OH)2D3) аутокринно/паракринным образом участвует в регуляции пролиферации, дифференциации и апоптозе эпителиоцитов [280]. In vivo оптимальный уровень энзимов (синтеза и катаболизма) витамин D3-зависимой регуляторной системы в эпителиальных клетках индуцируется только при контакте резидентных микроорганизмов с соответствующими рецепторами распознавания эпителиоцитов (симбионтные микроорганизмы стимулируют поддержание фоновой 1α-гидроксилазной активности клеточных элементов эпителиальных барьеров) [283]. Иммуномодулирующее действие 1,25-дигидроксивитамина D3 опосредуется его рецепторами и осуществляется путем влияния на активность факторов транскрипции NF-AT и NF-kB, либо реализуется при взаимодействии лиганд-рецепторного комплекса с воспринимающими витамин D3 элементами промоторных областей генов. В условиях витамин D3-дефицита подавляется продукция антибактериальных пептидов клеточными элементами слизистых барьеров, что, например, проявляется 50-кратным увеличением показателя бактериальной обсемененности ткани кишечной стенки [284]. При использовании витамина D3 в программе терапии хронического тонзиллита значимы и антиоксидантные эффекты кальцитриола. Витамин D3, стимулируя генную экспрессию глюкозо-6-фосфатдегидрогеназы (ключевой фермент пентозофосфатного пути окисления глюкозы), обеспечивающей редуцирование пиридиновых нуклеотидов [NAD(P)+] в цитозоле клеток, способствует более быстрому восстановлению окисленных форм водо- и жирорастворимых антиоксидантов. То есть витамин D3, интенсифицируя процесс рециклизации антиоксидантов, увеличивает их относительную антирадикальную емкость, поддерживая тем самым активность системы неферментативного гашения свободно-радикальных реакций. Кроме того, 1,25-дигидроксивитамин D3 существенным образом увеличивает уровень глутатиона, активность супероксиддисмутазы и глутатион-пероксидаз в цитозоле клеток [285, 286]. Поэтому, учитывая распространенность гиповитаминоза D3 в осенне-зимне-весенний период среди населения умеренных широт [287] и ассоциированность функционального состояния эпителиальных барьеров с обеспеченностью организма кальцитриолом, пероральное назначение витамина D3 ежедневно однократно в дозе 4000 ME (100 мкг), обеспечивающей суточную физиологическую потребность организма человека [288], представляется вполне целесообразным и необходимым при лечении хронического тонзиллита.
Параоксоназы (семейство энзимов PON1, PON2, PON3) - эволюционно древние [289], отличающиеся широким спектром субстратной специфичности ферменты [290], обладающие лактоназной активностью и особенно эффективно гидролизующие N-ацилгомосеринлактоны [291-293]. N-ацилгомосеринлактоны - сигнальные молекулы «чувства кворума» внутри- и межвидового общения грам-негативных бактерий, обеспечивающие координацию фенотипических изменений микроорганизмов, включая экспрессию факторов вирулентности и формирования бактериальных биопленок [294, 295]. Параоксоназы синтезируются в различных тканях млекопитающих, обильно секретируются слюнными железами, экспрессируются эпителиоцитами и способны разрушать бактериальные биопленки [296]. Уровень PON1 в крови снижается под влиянием прооксидантов [297], провоспалительных цитокинов [298] и эндотоксина грам-негативных микроорганизмов [299].
В метаболической трансформации N-ацилгомосеринлактонов принимают участие монооксигеназы и глюкуронилтрансферазы [300], но доминирующим фактором деградации этих сигнальных субстанций являются параоксоназы [301]. Поэтому на фоне снижения уровня экспрессии параоксоназ увеличивается восприимчивость организма к воздействию грам-негативных бактерий [302-304].
В связи с вышеизложенным, привлекает внимание способность некоторых фармакологических средств и пищевых продуктов стимулировать экспрессию параоксоназ [305], и наиболее активным индуктором PON1 оказался кверцетин.
Кверцетин - представитель группы флавоноидов, ранее обозначавшихся как витамин Р, обладает, помимо прочего, выраженными антиоксидантными и антибактериальными эффектами, способностью ингибировать активность альдозоредуктазы, протеинкиназ, ДНК-топоизомераз, блокировать формирование митохондриальной дисфункции и оказывать регулирующее влияние на экспрессию ряда генов (в т.ч. параоксоназ) [306-309]. Весьма значимыми аспектами физиологической активности кверцетина являются его способность ингибировать активность ксантиноксидоредуктазы, как источник супероксидного анион-радикала [310, 311], блокировать процесс нитрирования протеинов посредством связывания диоксида азота [312] и хелатировать ионы меди и железа во внеклеточных жидкостях и цитозоле, образуя редокс-неактивные комплексы (исключая тем самым участие ионов переходных металлов в каталитической продукции прооксидантов и их доступность для патогенных микроорганизмов) [313-315]. В плане рассматриваемой проблемы особенно весомы такие эффекты кверцетина как: ингибирование репликации риновирусов [316]; блокирование липополисахарид-индуцированной экспрессии эпителиоцитами провоспалительных цитокинов и металлопротеиназ ММР9, ММР12 посредством стимулирования экспрессии гистондеацетилазы Sirt-1, обеспечивающей деацетилирование промотора Н4 генов [317, 318]; подавление экспрессии кортикотропин-релизинг фактора, проявляющееся стресс-протективными феноменами [319, 320].
Неудивительно, что при таком перечне физиологических эффектов кверцетин оказался эффективным средством купирования метаболического синдрома [321] и терапии заболеваний пародонта [322, 323]. Гидрированный аналог кверцетина - дигидрокверцетин - при местном курсовом применении в виде 0,5% раствора способствовал быстрому купированию симптоматики хронического тонзиллита [218]. Исходя из вышеизложенного, можно полагать, что включение в программу консервативной терапии компенсированной формы неспецифического хронического тонзиллита дигидрокверцетина (внутрь 25 мг в виде таблетки два-три раза в день во время еды) патогенетически обосновано и целесообразно.
В качестве антибактериальных средств при лечении хронического тонзиллита традиционно использовались антибиотики. Однако в силу разных причин (внутриклеточная персистенция патогенов, вегетирование микроорганизмов в составе бактериальных биопленок, конституитивная антибиотикорезистентность или ассоциированность патогенного микроба с бактериями, продуцирующими антибиотик-деградирующие ферменты) антибиотикотерапия чаще всего оказывалась неэффективной. Поэтому считается, что основной способ лечения хронического тонзиллита - плановая тонзилэктомия [1]. Но в то же время, нет исследований, результаты которых убедительно доказывали бы эффективность тонзилэктомии при хроническом/рецидивирующем тонзиллите [324, 325].
Вместе с тем известно, что патогенные бактерии, ассоциированные с воспалением небных миндалин, лизогенны, т.е. содержат в составе генома один или более профагов [326-328]. Профаги, обогащая геном микроорганизма, обеспечивают вариабельность свойств штаммов патогенных бактерий [329], часто кодируют факторы вирулентности [330, 331] и наделяют способность эффективно создавать бактериальные биопленки [332]. Вероятно, не случайно то, что наиболее широко лизогения распространена среди бактериальных культур, выделяемых от пациентов с хроническим тонзиллитом [333].
Также хорошо известно, что пероксид водорода, будучи водорастворимым неполярным соединением, способен быстро диффундировать через биологические мембраны [334] и проникать в клетки эукариот и бактериальные биопленки [335, 336]. Воздействуя в микромолярном диапазоне концентраций (не оказывающих бактерицидного действия на нелизогенные микроорганизмы при экспозиции в десятки минут [337]) на лизогенные штаммы бактерий, пероксид водорода стимулирует экспрессию комплекса энзимов экстренной репарации бактериальной ДНК (SOS-регулона) [338]. Индукция SOS-регулонов лизогенных патогенов сопровождается активацией их резидентных профагов, мультипликацией вирусных частиц и последующей гибелью бактерий [339], что может обеспечить весьма быстрый клиренс зоны воспаления от патогенной микрофлоры при хроническом тонзиллите. Одновременно в эукариотических клетках под влиянием пероксида водорода (как вторичного мессенджера [340]) наблюдаются:
- при уровне Н2О2 в цитозоле клеток, превышающем 12,5 мкМ, стимуляция активности ядерного фактора транскрипции NF-kB сменяется его ингибированием и, следовательно, блокированием экспрессии провоспалительных факторов [341, 342];
- под влиянием микромолярных концентраций Н2О2 (физиологические уровни пероксида водорода в цитозоле до 100 мкМ, токсические эффекты не обнаруживаются и в диапазоне концентраций 100-200 мкМ) стимулируются транскрипция и трансляция ядерного фактора транскрипции Nrf2 (в течение 1-2 часов уровень Nrf2 в цитозоле увеличивается на 100%), его активация и транслокация в ядро клетки, что сопровождается стимуляцией экспрессии противовоспалительных факторов [343, 344];
- ингибирование формирования митохондриальной транзитной проницаемости посредством увеличения проводимости митохондриальных АТФ-чувствительных К+-каналов под влиянием микромолярных концентраций Н2О2, что проявляется цитопротективными эффектами [345].
Продукция Н2О2 в качестве бактерицидного агента, обеспечивающего дистантно контролируемую индукцию профагов в лизогенных микроорганизмах, - широко распространенная в мире прокариот стратегия вытеснения конкурентов из микроэкологических ниш [346-349]. Экспрессия Н2О2 симбионтной микрофлорой желудочно-кишечного тракта - действенный фактор колонизационной резистентности, обеспечивающий трансформацию профагов нерезидентных микроорганизмов в их литическую форму. Симбионтные лактобациллы и лактококки в условиях аэробной среды (приэпителиальная зона кишечной трубки) флавин-зависимым путем способны продуцировать пероксид водорода [350]. Поскольку молочнокислые бактерии относятся к группе каталаза-негативных микроорганизмов, постольку Н202 может аккумулироваться в среде их вегетирования до аутоингибиторных концентраций [351]. Симбионтные штаммы молочнокислых бактерий являются носителями дефектных профагов, которые не способны трансформироваться в их литическую форму при индукции SOS-регулонов данных прокариот. Поэтому они на порядок менее чувствительны к действию пероксида водорода, чем нерезидентные микроорганизмы (Staphylococcus, Pseudomonas) [352-355]. Следовательно, 0,01-0,03 М (0,03-0,1%) раствор пероксида водорода, не оказывая бактериостатического или бактерицидного действия на симбионтов слизистой оболочки ротоглотки и небных миндалин, не только не формирует (не усугубляет) микроэкологический дисбаланс, но и способствует восстановлению эубиоза путем селективной элиминации нерезидентных бактерий. Значимо, что элиминации подвергаются как внутриклеточные патогены, так и микроорганизмы, персистирующие в составе бактериальных биопленок. Также важно, что пероксид водорода, не стимулируя экспрессию фактора ингибирования миграции макрофагов клеточными элементами слизистой оболочки дыхательных путей (в отличие от других тканей) [356], выполняет роль аттрактанта для лейкоцитов, что способствует разрешению воспаления [357].
Важный аспект лечения хронического тонзиллита - антиэндотоксиновая терапия. Именно эндотоксинемия при микроэкологических нарушениях формирует провоспалительный (стресс-индуцирующий) фон, метаболический синдром, дисфункцию эндокринной системы и нарушения барьерных функций слизистых оболочек. В частности, липополисахарид драматически изменяет функциональное состояние щитовидной железы, понижает уровень тиреоидных гормонов в тканях и представляет собой патогенетически значимый фактор возникновения аутоиммунного тиреоидита [358-360]. Подобной направленностью действия, реализуемой посредством влияния на центральный участок гипоталамо-гипофизарно-тиреоидной системы, отличается и индуцируемый липополисахаридом провоспалительный цитокин IL-18 [361]. Снижается экспрессия гормонов щитовидной железы, тиреоидных рецепторов и при бактериальных инфекциях [362], включая хронический тонзиллит [363].
Тиреоидные гормоны оказывают существенное влияние на функциональное состояние эпителиальных барьеров [364, 365]. В частности, гормон щитовидной железы трийодтиронин (ТЗ) представляет собой основной регуляторный фактор экспрессии щелочной фосфатазы энтероцитами [364, 366]. Долгое время относительно физиологических функций обильно экспрессируемой кишечной щелочной фосфатазы (ЩФ) трудно было сказать что-то определенное. И только в последние годы установлено, что ЩФ - энзим детоксикации эндотоксина грам-негативных бактерий, обеспечивающий дефосфорилирование липополисахарида [367] и тем самым поддерживающий толерантность макроорганизма к присутствию грам-негативных комменсалов [367, 368]. В случае понижения активности ЩФ наблюдается увеличение концентрации эндотоксина и падение уровня фосфат-аниона [Pi] во внутрикишечной среде. Последнее условно-патогенной микрофлорой желудочно-кишечного тракта воспринимается как знак физиологического неблагополучия макроорганизма и служит сигналом для экспрессии вирулентного фенотипа (продукция токсинов, факторов увеличивающих проницаемость эпителиальных барьеров и устойчивость к воздействию неблагоприятных влияний). Такое изменение фенотипа комменсалов полностью предотвращается или обращается вспять при пероральном (но не при парентеральном) назначении фосфатов [369-371]. В качестве средства повышения уровня [Pi] в кишечнике при лечении компенсированной формы неспецифического хронического тонзиллита следует использовать кальция глицерофосфат (внутрь по 1 таблетке, содержащей 200 мг субстанции, три раза в день). В условиях достаточной обеспеченности фосфат-анионом комменсалы желудочно-кишечного тракта становятся относительно мало чувствительными к воздействию других факторов, индуцирующих вирулентный фенотип.
Кроме того, гормоны щитовидной железы регулируют экспрессию Se-зависимых пероксидаз (в т.ч. тиреопероксидаз, обеспечивающих синтез тиреоидных гормонов) и Se-зависимой монодейодиназы, осуществляющей конверсию тироксина (Т4) в активную форму гормона (Т3) [372]. В свою очередь, доступность селена определяет функциональное состояние щитовидной железы. При дефиците селена в организме может развиваться состояние недостаточности тиреоидных гормонов [373]. Поэтому, учитывая тот факт, что до 80% населения Российской Федерации имеет селенодефицитный статус [374], при лечении компенсированной формы неспецифического хронического тонзиллита целесообразно использование физиологических суточных доз микроэлемента селена (1 таблетка препарата «Селен-Актив», содержащей 50 мкг селена, внутрь один раз в день).
Эффективный способ снижения уровня эндотоксина грам-негативных бактерий в кишечном содержимом, а стало быть и в крови, - пероральное назначение энтеро-сорбентов. Среди множества энтеросорбентов привлекает внимание препарат «Энтеросгель» - кремнийорганический сорбент, применяемый в виде гидрогеля. Помимо сорбции бактериальных токсинов, энтеросгель избирательно стимулирует рост симбионтньгх микроорганизмов, подавляет вегетирование нерезидентной микрофлоры и способствует регенерации слизистой оболочки кишечника [375, 376]. При лечении компенсированной формы неспецифического хронического тонзиллита «Энтеросгель» следует назначать перорально три раза в день через два часа после приема пищи и лекарственных средств по одной столовой ложке курсом две-три недели.
Для оценки влияния лечения (терапии) компенсированной формы неспецифического хронического тонзиллита заявляемым способом и по способу-прототипу на носительство патогенов на небных миндалинах выполняли вирусологическое и микробиологическое исследования [377, 378]. Забор материала для исследования с поверхности небных миндалин производили до лечения, а затем через одну, две и три недели после начала лечения при помощи стерильного ватного тампона, который затем помещали в транспортную среду Amies для доставки в лабораторию.
Заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита обеспечивал выраженное сокращение носительства патогенов на небных миндалинах. Как видно из таблицы 1, заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита обеспечивал полную санацию поверхности небных миндалин от носительства ОРВИ. В отличие от этого лечение (терапия) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу не обеспечивало санации поверхности небных миндалин от носительства ОРВИ.
Заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита обеспечивал выраженное (почти полное) сокращение распространенности носительства патогенов бактериальной природы на поверхности небных миндалин (таблица 2). Как видно, лечение (терапия) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу мало влияло на носительство патогенов бактериальной природы на небных миндалинах.
Важным следствием лечения (терапии) компенсированной формы неспецифического хронического тонзиллита заявляемым способом (таблица 3) следует признать нормализацию показателей колонизации поверхности небных миндалин симбионтными микроорганизмами, т.е. восстановление эубиоза. Лечение (терапия) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу не только не приводило к купированию микроэкологического дисбаланса, но даже несколько усугубляло дисбиотическое состояние.
При хроническом тонзиллите подавлена местная иммунореактивность [379] и динамика уровней IgA, slgA, лизоцима в ротовой жидкости, что достаточно адекватно отражает эффективность проводимого лечения. Для сравнительной оценки эффективности лечения (терапии) компенсированной формы неспецифического хронического тонзиллита заявляемым способом и по способу-прототипу проводили количественное определение иммуноглобулинов в ротовой жидкости методом радиальной диффузии в геле [380], а содержания лизоцима - по Бухарину О.Б. и Васильеву Н.В. [381].
Как видно из таблицы 4 и таблицы 5, под влиянием лечения (терапии) компенсированной формы неспецифического хронического тонзиллита заявляемым способом имело место статистически значимое изменение уровней IgA, slgA и лизоцима в ротовой жидкости. По окончании курса лечения (терапии) уровни slgA и лизоцима даже имели тенденцию превышать величины референтных показателей нормы. В отличие от этого, при лечении (терапии) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу динамика уровней IgA, slgA и лизоцима в ротовой жидкости проявлялась лишь в виде тенденции.
Объективными неспецифическими показателями выраженности воспаления и интоксикации, используемыми в качестве критериев эффективности терапии, считаются уровни малонового диальдегида и среднемолекулярных пептидов в крови больных [382, 383]. Уровень малонового диальдегида в плазме крови определяли по Michara М. и Uchiyama М. [384], а концентрацию среднемолекулярных пептидов - по Николайчику В.В. и соавт. [385] в модификации Габрилович М.И. [386].
Как видно из таблицы 6 и таблицы 7, лечение (терапия) компенсированной формы неспецифического хронического тонзиллита заявляемым способом уже к 14 суткам сопровождалось нормализацией уровней малонового диальдегида и среднемолекулярных пептидов в плазме крови больных. Лечение (терапия) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу не приводило к нормализации значений указанных показателей и к 21 суткам.
Интегральным показателем выраженности микроэкологического дисбаланса и дисфункции эпителиальных барьеров является уровень липополисахарида (эндотоксина) грам-негативных микроорганизмов в системном кровотоке [387-389]. Уровень липополисахарида в крови определяли с помощью набора «Микро-ЛАЛ-тест» [390].
Как видно из таблицы 8, уровень эндотоксина грам-негативных микроорганизмов в системном кровотоке у всех больных высоко значимо (р<0,001) превышал референтный показатель нормы. Под влиянием лечения (терапии) компенсированной формы неспецифического хронического тонзиллита по способу-прототипу имела место лишь тенденция к снижению эндотоксинемии. В отличие от этого, заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита обеспечивал высоко достоверное (р<0,001) снижение концентрации липополисахарида в крови у всех пациентов (до уровня физиологической нормы).
В процессе реализации заявляемого способа лечения (терапии) компенсированной формы неспецифического хронического тонзиллита ни у одного из пациентов никаких побочных эффектов и осложнений не возникло. Динамика частоты обострений компенсированной формы неспецифического хронического тонзиллита под влиянием лечения (терапии) заявляемым способом и по способу-прототипу представлена в таблице 9. Как видно, подавляющее большинство больных основной группы (92%) в течение года за медицинской помощью не обращались, а у остальных пациентов данной группы (8%) имело место снижение частоты обращений. При лечении по способу-прототипу за медицинской помощью в течение года не обращались только два пациента (8,7%).
Таким образом, заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита путем комплексного корригирующего воздействия на основные патогенетические механизмы формирования и поддержания воспалительного процесса в небных миндалинах не только более эффективен в сравнении со способом-прототипом, но и достаточно прост в исполнении, хорошо переносится больными, не вызывает каких-либо побочных эффектов и для осуществления предполагает использование доступных отечественных официнальных препаратов. Совокупность представленных данных доказывает возможность реализации заявляемого изобретения.
Заявляемое изобретение удовлетворяет критерию «новизна», так как впервые предлагается способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита, основанный на комплексном корригирующем воздействии на основные патогенетические механизмы формирования и поддержания хронического воспалительного процесса в небных миндалинах посредством проведения стресс-протективной терапии, диетотерапии, пробиотикотерапии, терапии пребиотик-подобными препаратами, витаминотерапии, местной иммунокорригирующей терапии и топической эрадикационной терапии, позволяющий подавлять вегетирование нерезидентной микрофлоры, стимулировать местную противовирусную защиту и рост симбионтных микроорганизмов, купировать воспаление.
Заявляемое изобретение удовлетворяет критерию «изобретательский уровень», так как в известных и доступных источниках информации, содержащих описание способов лечения (терапии) компенсированной формы неспецифического хронического тонзиллита, нет сведений, из которых была бы очевидна возможность стимулирования локальной противовирусной защиты, подавления вегетирования нерезидентной микрофлоры, стимулирования роста симбионтных бактерий и купирования воспаления в небных миндалинах посредством системного и местного комплексного назначения лекарственных средств и диетотерапии, а также пригодность данного подхода для лечения (терапии) компенсированной формы неспецифического хронического тонзиллита.
Соответствие критерию «пригодность для применения» доказывается результатами клинических исследований, из которых видно, что заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита обеспечивает достижение выраженного клинического эффекта посредством использования доступных в Российской Федерации официнальных лекарственных препаратов. Заявляемый способ лечения (терапии) компенсированной формы неспецифического хронического тонзиллита достаточно прост в исполнении и может осуществляться как в стационарных, так и амбулаторных условиях.
СПИСОК ЛИТЕРАТУРЫ
1. Крюков А.И., Изотова Т.Н., Захарова Т.Н. и др. Актуальность проблемы хронического тонзиллита. Вестн. оториноларингол. 2009; 5: 4-6.
2. Цветков Э.А., Науменко Н.Н. Лимфоэпителиальное глоточное кольцо в иммунной системе организма. Росс.Оториноларингол. 2003; 3(6): 7-14.
3. Пальчун В.Т. Оториноларингология: Национальное руководство. М.: ГЕОТАР-Медиа. 2008. 960 с.
4. Давыдовский А.Г., Песоцкая М.В. Гипотеза функциональной системы хронической тонзиллярной и метатонзиллярной патологии. Мед. Журн. 2011; 2: 138-141.
5. Богомильский М.Р., Чистякова В.Р. Детская оториноларингология. М.: Медицина. 2005. т.1: 308-314.
6. Антипина И.Н. Состояние репродуктивной системы у девочек и женщин с нарушением менструальной функции (МФ) на фоне хронического тонзиллита (XT). Дисс.… докт.мед. наук. Москва. 2004. 296 с.
7. Славский А.Н. Роль хронического тонзиллита в формировании патологии репродуктивной системы у женщин детородного возраста. Вестн. Оториноларингол. 2009; 4: 40-44.
8. Tewfik T.L., Al Garni М. Tonsillopharingitis: clinical highlights. J. Otolaryngol. 2005; 43(1): S45-S49.
9. Кропинов П.И. О взаимосвязи пиелонефрита с хроническим тонзиллитом. Автореф. дисс.… канд. мед. наук. Одесса. 1973. 23 с.
10. Morijama Т., Nitta К. Tonsillectomy and steroid pulse therapy for IgA nephropathy. Tohoku J. Exp.Med. 2011; 224(4): 243-250.
11. Черныш A.B., Гофман B.P., Хубулава Г.Г. Влияние хронического тонзиллита на состояние сердечно-сосудистой системы. Журн. Ушн. Нос.Горл. Бол. 1995; 1: 39-42.
12. Shulman S.T. Pediatric autoimmune neuropsychiatric disorders associated with streptococci (PANDAS): update. Curr. Opin. Pediatr. 2009; 21(1): 127-130.
13. Murakata H., Harabuchi Y. Analysis of serum antibodies to alpha-streptococci in patients with tonsil-related pustulosis palmaris et plantaris. J. Otolaryngol. Japan. 1999; 102(2): 226-235.
14. Witsell D.L., Orvidas L.J., Stewart M.G. et al. Quality of life after tonsillectomy in adults with recurrent or chronic tonsillitis. Otolaryngol. Head Neck Surg. 2008; 138(1): S1-S8.
15. Skevas Т., Klingmann C, Sertel S. et al. Measuring quality of life in adult patients with chronic tonsillitis. Open Otorhinolaryngol. J. 2010; 4: 34-46.
16. Перечень стандартов медицинской помощи при различных заболеваниях (по состоянию на 31.08.2011). .
17. Пальчун В.Т. Развитие проблемы хронического тонзиллита. Вестн. Оториноларингол. 2006; 6: 7-8.
18. Региональный стандарт медицинской помощи больным с хроническим тонзиллитом. Приложение №2 к приказу министерства здравоохранения и социального развития Оренбургской области от 25. 02. 2010 г. №101.
19. Mora R., Dellepiane М., Crippa В., Salami A. Ribosomal therapy in the prophylaxis of recurrent pharyngotonsillitis in children. Int. J. Pediatr. Otorhinolaryngol. 2007; 71(2): 257-261.
20. Страчунский Л.С., Богомильский A.H. Антибактериальная терапия стрептококкового тонзиллита и фарингита. Детский Доктор. 2000; 3: 32-33.
21. Викулов В.В. Патогенез, диагностика и лечение безангинной формы хронического тонзиллита. Дисс.… канд. мед. наук. СПб. 2006.125 с.
22. Mai R.K., Oluwasanmi A.F., Mitchard J.R. Tonsillar crypts and bacterial invasion of tonsils, a pilot study. Internet J. Otorhinolaryngol. 2009; 9(2).
23. Ball S.L., Siou G.P., Wilson J.A. et al. Expression and immunolocalisation of antimicrobial peptides within human palatine tonsils. J. Laryngol. Otol. 2007; 121(10): 973-978.
24. Macpherson A.J., McCoy K.D., Johansen F.E., Brandtzaeg P. The immune geography of IgA induction and function. Muc. Immun. 2008; 1(1): 11-22.
25. Yel L. Selective IgA deficiency. J. Clin. Immunol. 2010; 30(1): 10-16.
26. Brandtzaeg P. Role of secretory antibodies in the defense against infection. Int. J. Med. Microbiol. 2003; 293(1): 3-15.
27. Macpherson A.J., Geuking M.B., McCoy K.D. Homeland security: IgA immunity at the frontiers of the body. Trends Immunol. 2012; 33(4): 160-167.
28. Chaturvedi P., Singh A.P., Batra S.K. Structure, evolution, and biology of the MUC4 mucin. FASEB J. 2008; 22(4): 966-981.
29. Haezlewood C.K., Cook M.C., Eri R. et al. Aberrant mucin assembly in mice causes endoplasmic reticulum stress and spontaneous resembling ulcerative colitis. PLoS Med. 2008; 5(3): e54.
30. Horic A., Hiki Y., Odami H. et al. IgA molecules produced by tonsillar lymphocytes are under-O-glycosylated in IgA nephropathy. Am. J. Kidney Dis. 2003; 42(3): 486-496.
31. Smith A.C., de Wolff J.F., Molyneux K. et al. O-glycosylation of serum IgD in IgA nephropathy. J. Am. Soc. Nephrol. 2006; 17(4): 1192-1199.
32. Tan L., Psaltis A., Baker L.M. et al. Aberrant mucin glycoprotein patterns of chronic rhinosinusitis patients with bacterial biofilms. Am. J. Rhinol. Allergy. 2010; 24(5): 319-324.
33. Gaffney R.J., Cafferkey M.T. Bacteriology of normal and diseased tonsils assessed by fine-needle aspiration: Haemophilus influenzae and the pathogenesis of recurrent acute tonsillitis. Clin. Otolaryngol. 1998; 23(2): 181-185.
34. Lindroos R. Bacteriology of the tonsil core in recurrent tonsillitis and tonsillar hyperplasia - a short review. Acta Otolaryngol. 2000; 120(543): 206-208.
35. O'sterlund A., Popa R., Nikkila T. et al. Intracellular reservoir of Streptococcus pyogenes in vivo: a possible explanation for recurrent pharyngotonsillitis. Laryngoscope. 1997; 107: 640-647.
36. Chole R.A., Fadds B.T. Anatomical evidence of microbial biofilms in tonsillar tissue: a possible mechanism to explain chronicity. Arch. Otolaryngol. Head Neck Surgery. 2003; 129(6): 634-636.
37. Costerton J.W., Geesey G.G., Cheng K.J. How bacteria stick. Sci. Am. 1978; 238(1);
86-95.
38. Morris D.P., Hagr A. Biofilm: why the sudden interest? J. Otolaryngol. 2005; 34(2): S56-S59.
39. Donlan R.M., Costerton J.W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 2002; 15(2): 167-193.
40. Hall-Stoodley L., Costerton J.W., Stoodley P. Bacterial biofilms: from the natural environment to infectious diseases. Nat. Rev. Microbiol. 2004; 2(2): 95-108.
41. Dongari-Bagtzoglou A. Pathogenesis of mucosal biofilm infections: challenges and progress. Exp.Rev. Anti-Infect. Ther. 2008; 6(2): 201-208.
42. Jefferson K.K. What drives bacteria to produce a biofilm? FEMS Microbiol. Lett. 2004; 236(2): 163-173.
43. Bhinu V.S. Insight into biofilm-associated microbial life. J. Mol. Microbiol. Biotechnol. 2005; 10(1): 15-21.
44. Morris J.J., Lenski R.E., Zinser E.R. The black queen hypothesis: evolution of dependencies through adaptive gene loss. MBio. 2012; 3(2): pii: e00036-12.
45. Sachs J.L., Hollowell A.C. The origins of cooperative bacterial communities. MBio. 2012; 3(3): pii: e00099-12.
46. Sauer K., Camper A.K., Ehrlich G.D. et al. Pseudomonas aeruginosa displays multiple phenotypes during development as abiofilm. J. Bacteriol. 2002; 184(4): 1140-1154.
47. Stoodley P., Sauer K., Davies D.G., Costerton J.W. Biofilms as complex differentiated communities. Annu. Rev. Microbiol. 2002; 56: 187-209.
48. Korber D.R., Lawrence J.R., Lappin-Scott H.M., Costerton J.W. Growth of microorganisms on surfaces. In: Microbial biofilms. H.M.Lappin-Scott, J.W.Costerton (Eds.) 1995. Cambridge UK: Cambridge Univ. Press. P. 15-45.
49. Jain A., Gupta Y., Agrawal R. et al. Biofilms - a microbial life perspective: a critical review. Crit. Rev. Ther. Drug Carrier Syst. 2007; 24(5): 393-443.
50. Wuertz S., Okabe S., Hausner M. Microbial communities and their interactions in biofilm systems: an overview. Water Sci. Technol.2004; 49(11-12): 327-336.
51. Falcao J.P., Sharp F., Sperandio V. Cell-to-cell signaling in intestinal pathogens. Curr. Issues Intest. Microbiol. 2004; 5(1): 9-17.
52. Reading N.C., Sperandio V. Quorum sensing: the many languages of bacteria. FEMS Microbiol. Lett. 2006; 254(1): 1-11.
53. Asad S., Opal S.M. Bench-to-bedside review: quorum sensing and the role of cell-to-cell communication during invasive bacterial infection. Crit. Care. 2008; 12(6): 236. doi: 10.1186/CC7101.
54. Hussain M., Wilcox M.H., White P.J. The slime of coagulase negative staphylococci: biochemistry and relation to adherence. FEMS Microbiol. Rev. 1993; 104(3-4): 191-207.
55. Flemming H.C., Wingender J., Criegbe Mayer C. Physico-chemical properties of biofilms. In: L.V.Evans (Ed.) Biofilms: recent advances in their study and control. Amsterdam: Harwood Academic Publisher. 2000. P. 19-34.
56. Lasa I. Towards the identification of the common features of bacterial biofilm development. Int. Microbiol. 2006; 9(1): 21-28.
57. Otto M. Staphylococcal biofilms. Curr. Top.Microbiol. Immunol. 2008;322: 207-228.
58. Conover M.S., Mishra M., Deora R. Extracellular DNA is essential for maintaining Bordetella biofilm integrity on abiotic surfaces and in the upper respiratory tract of mice. PLoS ONE. 2011; 6(2): el6861.
59. Serra D.O., Conover M.S., Arnal L. et al. FHA-mediated cell-substrate and cell-cell adhesions are critical for Bordetella pertussis biofilm formation on abiotic surfaces and in the mouse nose and the trachea. PLoS ONE. 2011; 6(12): e28811.
60. Ziebuhr W., Krimmer V., Rachid S. et al. A novel mechanism of phase variation of virulence in Staphylococcus epidermidis: evidence for control of the polysaccharide intercellular adhesion synthesis by alternating insertion and excision of the insertion sequence element IS256. Mol. Microbiol. 1999; 32(2): 345-356.
61. Dunne W.M.Jr. Bacterial adhesion: seen any good biofilms lately? Clin. Microbiol. Rev. 2002; 15(2): 155-166.
62. Spoering A.L., Gilmore M.S. Quorum sensing and DNA release in bacterial biofilms. Curr. Opin. Microbiol. 2006; 9(2): 133-137.
63. Wu J., Xi C. Evaluation of different methods for extracting extracellular DNA from the biofilm matrix. Appl. Environment Microbiol. 2009; 75(16): 3390-3395.
64. Neu T.R. Significance of bacterial surface-active compounds in interactions of bacteria with interfaces. Microbiol. Rev. 1996; 60(1): 151-166.
65. Neu T.R., Lowrence J.R. Lectin-binding analysis in biofilm systems. Methods Enzymol. 1999; 310: 145-152.
66. Whitchurch C.B., Tolker-Nielsen Т., Ragas P.C., Mattick J.S. Extracellular DNA required for bacterial biofilm formation. Science. 2002; 259(5559): 1487.
67. Staudt С, Horn H., Hempel D.C., Neu T.R. Volumetric measurements of bacterial cells and extracellular polymeric substance glycoconjugates in biofilms. Biotechnol. Bioeng. 2004; 88(55): 585-592.
68. Flemming H.C., Wingender J. The biofilm matrix. Nat. Rev. Microbiol. 2010; 8(9):
623-633.
69. Whiteley M., Bangera M.G., Bumgarner R.E. et al. Gene expression in Pseudomonas aeruginosa biofilms. Nature. 2001; 413(6858): 860-864.
70. Dotsch A., Eckweiler D., Schiederjans M. et al. The Pseudomonas aeruginosa transcriptome in planktonic cultures and static biofilm using RNA sequencing. PLoS ONE. 2010; 7(2):e31092.
71. Paluch-Oles J., Magrys A., Koziol-Montewka M. et al. The phenotypic and genetic biofilm formation characteristics of coagulase-negative staphylococci isolates in children with otitis media. Int. J. Pediatr. Otorhinolaryngol. 2011; 75(1): 126-130.
72. Davies D.G., Geesey G.G. Regulation of the alginate biosynthesis gene algC in Pseudomonas aeruginosa during biofilm development in continuous culture. Appl. Environ. Microbiol. 1995; 61(3): 860-867.
73. Kaplan J.B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. J. Dental Res. 2010; 89(3): 205-218.
74. Davies D.G., Parsek M.R., Pearson J.P. et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 1998; 280(5361): 295-298.
75. Camps J., Pujol I., Ballester F. et al. Paraoxonases as potential antibiofilm agents: their relationship with quorum-sensing signals in gram-negative bacteria. Antimicrob. Agents Chemother. 2011;55(4(: 1325-1331.
76. Lam H., Oh D.C., Cava F. et al. D-amino acids govern stationary phase cell wall remodeling in bacteria. Science. 2009; 325(5947): 1552-1555.
77. Kolodkin-Gal I., Romero D., Cao S. et al. D-amino acids trigger biofilm disassembly. Science. 2010; 328(5978): 627-629.
78. Cava F., Lam H., de Pedro M.A., Waldor M.K. Emerging knowledge of regulatory roles of D-amino acids in bacteria. Cell. Mol. Life Sci. 2011; 68(5): 817-831.
79. Kolodkin-Gal I., Cao S., Chai L. et al. A self-produced trigger for biofilm disassembly that targets exopolysaccharide. Cell. 2012; 149(3): 684-692.
80. Luppens S.B., Reij M.W., van der Heijden R.W. et al. Development of a standard test to assess the resistance of Staphylococcus aureus biofilm cells to disinfectants. Appl. Environ. Microbiol. 2002; 68(9): 4194-4200.
81. Hoiby N., Bjarnsholt Т., Givskov M. et al. Antibiotic resistance of bacterial biofilms. Int. J. Antimicrob. Agents. 2010; 35(4): 322-332.
82. Stewart P.S. Theoretical aspects of antibiotic diffusion into microbial biofilms. Antimicrob. Agents Chemother. 1996;40(11): 2517-2522.
83. Andersen G.G., OToole G.A. Innate and induced resistance mechanisms of bacterial biofilms. Curr. Top Microbiol. Immunol. 2008; 322: 85-105.
84. Singh R., Ray P., Das A., Sharma M. Penetration of antibiotics through Staphylococcus aureus and Staphylococcus epidermidis biofilms. J. Antimicrob. Chemother. 2010; 65(9): 1955-1958.
85. Balasubramanian D., Kong K.F., Jayawardena S.R. et al. Co-regulation of (3-lactam resistance, alginate production and quorum sensing in Pseudomonas aeruginosa. J. Med. Microbiol. 2011; 60(2): 147-156.
86. Lazar V., Chifiriuc M.C. Medical significance and new therapeutical strategies for biofilm associated infections. Roum. Arch. Microbiol. Immunol. 2010; 69(3): 125-138.
87. Souli M., Giamarellou H. Effects of slime produced by clinical isolates of coagulase-negative staphylococci on activities of various antimicrobial agents. Antimicrob. Agents Chemother. 1998; 42(4): 939-941.
88. Wunder D.B., Bosscher V.A., Сок R.C., Hozalski R.M. Sorption of antibiotics to biofilm. 2011; 45(6): 2270-2280.
89. Venglarcik J.S., Blair L.L., Dunkle L.M. pH-dependent oxacillin tolerance of Staphylococcus aureus. Antimicrob. Agents Chemother. 1983; 23(2): 232-235.
90. Tack K.J., Sabath L.D. Increased minimum inhibitory concentrations with anaerobiasis for tobramycin, gentamicin, and amicacin, compared to latamoxef, piperacillin, chloramphenicol, and clindamycin. Hemotherapy. 1985; 31(3): 204-210.
91. Xu K.D., Stewart P.S., Xia F. et al. Spatial physiological heterogeneity in Pseudomonas aeruginosa biofilm is determined by oxygen availability. Appl. Environ. Microbiol. 1998; 64(10): 4035-4039.
92. Brooun A., Liu S., Lewis K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob. Agents Chemother. 2000; 44(3): 640-646.
93. Mah T.F., Pitts В., Pellock B. et al. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 2002; 426(6964): 306-310.
94. Rodriguez-Rojas A., Oliver A., Blazques J. Intrinsic and environmental mutagenesis drive diversification and persistence of Pseudomonas aeruginosa in chronic lung infections. J. Infect. Dis. 2012; 205(1): 121-127.
95. Lewis K. Persister cells and the riddle of biofilm survival. Biochemistry. 2005; 70(2): 267-274.
96. Lewis K. Multidrug tolerance of biofilms and persister cells. Curr. Top.Microbiol. Immunol. 2008; 322: 107-131.
97. Hornef M.W., Wick M.J., Rhen M., Normark S. Bacterial strategies for overcoming host innate and adaptive immune responses. Nat. Immunol. 2002; 3(11): 1033-1040.
98. Vuong C, Voyich J.M., Fischer E.R. et al. Polysaccharide intercellular adhesin (PIA) protects Staphylococcus epidermidis against major components of the human innate system. Cell Microbiol. 2004; 6(3): 269-275.
99. Jesaitis A.J., Franklin M.J., Berglund D. et al. Compromised host defense on Pseudomonas aeruginosa biofilms: characterization of neutrophil and biofilm interactions. J. Immunol. 2003; 171(8): 4329-4339.
100. Leid J.G., Willson C.J., Shirfliff M.E. et al. The exopolysaccharide alginate protects Pseudomonas aeruginosa biofilm bacteria from IFN-gamma-mediated macrophage killing. J. Immunol. 2005; 171(11): 7512-7518.
101. Hammouda M., Abdel-Khalek Z., Awad S. et al. Chronic tonsillitis bacteriology in Egyptian children including antimicrobial susceptibility. Australian J. Basic Appl. Sci. 2009; 3(3): 1948-1953.
102. Forsgren J., Samuelson A., Ahlin A. et al. Haemophilus influenzae resides and multiplies intercellularly in human adenoid tissue as demonstrated by in situ hybridization and bacterial viability assay. Infect. Immun. 1994; 62(2): 673-679.
103. Osterlund A., Engstrand L. An intracellular sanctuary for Streptococcus pyogenes in human tonsillar epithelium - studies of asymptomatic carriers and in vitro cultured biopsies. Acta Otolaryngologica. 1997; 117(6): 883-888.
104. Garcia-Medina R., Dunne W.M., Singh P.K., Brody S.L. Pseudomonas aeruginosa acquires biofilm-like properties within airway epithelial cells. Infect. Immun. 2005; 73(12): 8298-8305.
105. Angus A.A., Lee A.A., Augustin D.K. et al. Pseudomonas aeruginosa induces membrane blebs in epithelial cells, which are utilized as a niche for intracellular replication and motility. Infect. Immun. 2008; 76(5): 1992-2001.
106. Tuchscherr L., Loffler В., Buzzola F., Sordelli D.O. Staphylococcus aureus adaptation to the host and persistence: role of loss of capsular polysaccharide expression. Future Microbiol. 2010; 5(12): 1823-1832.
107. Salcedo S.P., Cid V.J. Nontypable Haemophilus influenzae: an intracellular phase within epithelial cells might contribute to persistence. Microbiol. 2011; 157(1): 1-2.
108. Roberts A.L., Connoly K.L., Kirse D.J. et al. Detection of group A Streptococcus in tonsils from pediatric patients reveals high rate of asymptomatic streptococcal carriage. BMC Pediatrics. 2012; 12: 3.
109. Tan N.C.W., Foreman A., Jardeleza C. et al. The multiplicity of Staphylococcus aureus in chronic rhinosinusitis: correlating surface biofilm and intracellular resistance. Laryngoscope. 2012; 122(5): doi: 10.1002/lary.23317.
110. Zautner A.E. Adenotonsillar disease. Recent Pat. Inflamm. Allergy Drug Discov. 2012; 6(2): 121-129.
111. Hawrelak J.A., Myers S.P. The causes of intestinal dysbiosis: a review. Alternat. Med. Rev. 2004; 9(2): 180-197.
112. Несвижский Ю.В., Богданова E.A., Воробьев A.A. Изучение влияния Staphylococcus aureus на микробиоценоз желудочно-кишечного тракта крыс.Вестник РАМН. 2006; 9-10: 82-88.
113. Микроэкология (фундаментальные и прикладные проблемы). Под. Ред. Н.Н.Плужникова, Я.А.Накатиса, О.Г.Хурцилавы. СПб.: Изд. Сев.-Зап.Мед. Университета. 2012.
114. Stengel A., Tache Y. Neuroendocrine control of the gut during stress: corticotropin-releasing factor signaling pathways in the spotlight. Annu. Rev. Physiol. 2009; 71: 219-239.
115. Hutchinson M.R., Loran L.C., Zhang Y. et al. Evidence that tricyclic small molecules may possess Toll-like receptor and MD-2 activity. Neurosci. 2010; 168(2): 551-563.
116. Food and Drug Administration. Food labeling: healthy claims; oats and coronary heart disease: proposed rule. 01.23.1997. Federal Register. 1997; 62(15): 3584-3601.
117. Lupton J.R., Turner N.D. Dietary fiber and coronary disease: does the evidence support an association. Curr. Atheroscler. Rep.2003; 5(6): 500-505.
118. Andoh A., Tsujikawa Т., Fujiyama Y. Role of dietary fiber and short-chain fatty acids in the colon. Curr. Pharm. Des. 2003; 9(4): 347-358.
119. Tazoe H., Otomo Y., Kaji I. et al. Roles of short-chain fatty acids receptor, GPR41 and GPR43, on colonic functions. J. Physiol. Pharmacol. 2008; 59(2): 251-262.
120. Karaki S.I., Mitsui R., Hayashi H. et al. Short-chain fatty acids receptor GPR43 is expressed by enteroendocrine cells and mucosal mast cells in rat intestine. Cell Tissue Res. 2006; 324(3): 353-360.
121. Le Poul E., Loison C, Struyf S. et al. Functional characterization of human receptors for short-chain fatty acids and their role in polymorphonuclear cell activation. J. Biol. Chem. 2003; 278(28): 25481-25489.
122. Dayl J.W. Alkylxanthines as research tools. J. Auton. Nerv. Syst. 2000; 81(1-3):
44-52.
123. Rice P.J., Adams E.L., Ozmet-Scelton T. et al. Oral delivery and gastrointestinal absorption of soluble glucans stimulate increased resistance to infectious challenge. J. Pharm. Exp.Ther. 2005; 314(3): 1079-1086.
124. Бета-глюкан. http://www.nazdorovye.ru/glucan.html.
125. Babineau T.J., Hackford A., Kenler A. et al. A phase II multicenter, double-blind, randomized, placebo-controlled study of three dosages of an immunomodulator (PGG-glucan) in high-risk surgical patients. Arch. Surg. 1994; 129(11): 1204-1210.
126. Miura N.N., Ohno N., Aketagawa J. et al. Blood clearance of (l->3)-beta-glucan in MLR lpr/lpr mice. FEMS Immun. Med. Microbiol. 1996; 13(1): 51-57.
127. Chihara G. Recent progress in immunopharmacology and therapeutic effects of polysaccharides. Dev. Biol. Stand. 1992; 77: 191-197.
128. Tzianabos A.O., Gibson F.C., Cisneros R.L., Rfsper D.L. Protection against experimental intraabdominal sepsis by two polysaccharide immunomodulators. J. Infect. Dis. 1998; 178(1): 200-206.
129. Vetvicka V., Thornton B.P., Ross G.D. Soluble beta-glucan polysaccharide binding to the lectin site of neutrophil or natural killer cell complement receptor type 3(CD116/CD18) generates a primed state of the receptor capable of mediating cytotoxicity of iC3b-opsonised target cells. J. Clin. Invest. 1996; 98(1): 50-61.
130. Dongowaki G., Huth M., Gebhardt E., Flamme W. Dietary Fiber-rich barley products beneficially affect the intestinal tract of rats. J. Nutr. 2002; 132(12): 3704-3714.
131. Senoglu N., Yuzbasioglu M.F., Aral M. et al. Protective effects of N-acethylcysteine and (3-glucan pretreatment on oxidative stress. J. Intensive Surg. 2008; 21(5): 237-243.
132. Stevens L. Egg white protein. Сотр. Biochem. Physiol. B. 1991; 100(1): 1-9.
133. Corda R., Biddau P., Corrias A., Puxeddu E. Conalbumin in the treatment of acute enteritis in the infant. Int. J. Tissue React. 1983; 5(1): 117-123.
134. Kotanko P., Carter M., Levin N.W. Intestinal bacterial microflora - a potential source of chronic inflammation in patients with chronic kidney disease. Nephrol. Dial. Transplant. 2006; 21(8): 2057-2060.
135. Маянский A.H. Дисбиоз: иллюзии и реальность. Педиатрия. 2004; 4: 80-88.
136. Dennou Е., Pridmore R.D., Berger В. et al. Identification of genes associated with the long-gut-persistence phenotype of the probiotic Lactobacillus johnsonii strain NCC533 using a combination of genomics and transcriptome analysis. J. Bacteriol. 2008; 190(9): 3161-3168.
137. Marraffini L.A., DeDent A.C., Schneewind O. Sortases and the art of anchoring proteins to the envelopes of gram-positive bacteria. Microbiol. Mol. Biol. Rev. 2006; 70(1): 192-221.
138. Lebeer S., Vanderleyder J., De Keersmaecker C.J. Genes and molecules of Lactobacilli supporting probiotic action. Microbiol. Mol. Biol. Rev. 2008; 72(4): 728-764.
139. Kleerebezem M., Vaughan E.E. Probiotic and gut Lactobacilli and Bifidobacteria: molecular approach to study diversity and activity. Annu. Rev. Microbiol. 2009; 63: 269-290.
140. Ried G., Jass J., Sebulsky M.T., McCormic J.K. Potential uses of probiotics in clinical practice. Clin. Microbiol. Rev. 2003; 16(4): 658-672.
141. De Vrese M., Schrezenmeir J. Probiotics, prebiotics, and synbiotics. Adv. Biochem. Eng. Biotechnol. 2008; 111: 1-66.
142. Rauch M., Lynch S.V. Probiotic manipulation of the gastrointestinal microbiota. Gut Microbes. 2010; 1(5): 335-338.
143. Ohland C.L., Mac Naughton W.K. Probiotic bacteria and intestinal epithelial barrier function. Gastrointest. Liver Physiol. 2010; 298(6): G807-G819.
144. Johansen F.E., Kaetzel C. Regulation of the polymeric immunoglobulin receptor and IgA transport: new advances in environmental factors that stimulate plgA expression and its role in mucosal immunity. Mucosal Immun. 2011; 4(6): 598-602.
145. Машковский М.Д. Лекарственные средства. M.: Новая Волна. 2005. 1200 с.
146. Ефремов В.В., Спиричев В.Б., Симакова Р.А. Витамины. Большая Медицинская Энциклопедия. М.: Советская Энциклопедия. 1976. Т.4. с.270-275.
147. Патент РФ 2339389.
148. Патент РФ 2132681.
149. Loman S., Jansen Н.М., Out Т.A., Lutter R. Interleukin-4 synergistically increase secretory component gene expression, but are additive in stimulating secretory immunoglobulin A release by Calu-3 airway epithelial cells. 1994; 96(4): 537-543.
150. Sarkar J., Gangopadhyay N.N., Moldoveanu Z. et al. Vitamin A is required for regulation of polymeric immunoglobulin receptor (plgR) expression by interleukin-4 and interferon-gamma in a human intestinal epithelial cells line. J. Nutr. 1998; 128(7): 1063-1069.
151. Kaetzel C.S. The polymeric immunoglobulin receptor: bridging innate and adaptive immune responses at mucosal surfaces. Immunol. Rev. 2005; 206(1): 83-99.
152. Патент РФ 2116788.
153. Dasgupta M.K. Biofilm causes decreased production of interferon-gamma. J. Am. Soc. Nephrol. 1996; 7(6): 877-882.
154. Chattoray S.S., Ganesan S., Faris A. et al. Pseudomonas aeruginosa suppresses interferon response to rhinovirus infection in cystic fibrosis but not in normal bronchial epithelial cells. Infect. Immun. 2011; 79(10): 4131-4145.
155. Passariello C, Schippa S., Conti C. et al. Rhino viruses promote internalization of Staphylococcus aureus into non-fully permissive cultured pneumocytes. Microb. Infect. 2006; 8(3): 758-766.
156. Sajjan U., Wang Q., Zhao Y. et al. Ruinovirus disrupt the barrier function of polarized airway epithelial cells. Am. J. Respir. Grit. Care Med. 2008; 178(12): 1271-1281.
157. Comstock A.T., Ganesan S., Chattoraj A. et al. Rhinovirus-induced barrier dysfunction in polarized airway epithelial cells is mediated by NADPH oxidase 1. J. Virol. 2011; 85(13): 6795-6808.
158. Chattoraj S.S., Ganesan S., Jones A.M. et al. Rhinovirus infection liberates planktonic bacteria from biofilm and increases chemokine responses in cystic fibrosis airway epithelial cells. Thorax. 2011; 66(4): 333-339.
159. Садчиков Д.В., Куликова Т.Н., Лопатин И.В. Мексидол в терапии критических состояний. Саратов. 2004. 14 с.
160. Лукьянова Л.Д., Атабаева Р.Е., Шепелева СЮ. Биоэнергетические механизмы антигипоксического действия сукцинатсодержащего производного 3-оксипиридина. Бюлл. Эксперимент.Биол. Мед. 1993; 115(3): 259-260.
161. Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции. Бюлл. Эксперимент.Биол. Мед. 1997; 124(9): 245-254.
162. Золотов Н.Н., Смирнов Л.Д., Кузьмина В.И. и др. Производные 3-оксипиридина как ингибиторы протеолитических ферментов. Хим.-Фарм. Журнал. 1989; 23(2): 133-135.
163. Эфендиев A.M., Помойнецкий СВ., Смирнов Л.Д., Лубатиев A.M. Влияние антиоксидантов на синтез простагландинов, простациклина и тромбоксана в разных слоях почек старых крыс.Фармакол. Токсикол. 1986; 49(3): 60-63.
164. Клебанов Г.И., Любицкий О.Б., Ильина СУ. и др. Антиоксидантная активность ингибиторов свободнорадикальных реакций, используемых в перевязочном материале для лечения ран. Биол. Мед. Фармац. Химия. 2006; 52(1): 69-82.
165. Казарина Л.Н. Элларян Л.К. Влияние зубной пасты «Мексидол Дент актив» на состояние местного иммунитета полости рта при хроническом катаральном гингивите. Стоматолог-практик. 2011; 2: 58-59.
166. Гудима И.А., Васильева Л.И., Братина Л.Е., Сучков И.Ю. Вирусно-бактериально-грибковые ассоциации при хроническом тонзиллите у детей. Журн. Микробиол. Эпидемиол. Иммунобиол. 2001; 5: 16-19.
167. Modena J., Arruda Е., Tamashiro Е., Valera F. The role of virus infection in chronic adenoiditis. Otolaryngol. Head Neck Surg. 2010; 143(2): 294.
168. Красницкая A.C, Боровская H.A. Иммунологические аспекты хронического тонзиллита, ассоциированного с Эпштейн-Барра-инфекцией. Фундам. Иссл. 2012; 4: 299-305.
169. Kido Н., Okumura Y., Yamada Н. et al. Secretory leukoprotease inhibitor and pulmonary surfactant serve as principal defenses against influenza A virus in the airway and chemical agents up-regulating their levels hove therapeutic potential. Biol. Chem. 2004; 385(11): 1029-1034.
170. Абатуров A.E. Роль местных ингибиторов протеаз в неспецифической защите респираторного тракта. Теоретична медицина. 2011; 4(31): 117-123.
171. Lagan A.L., Melley D.D., Evans T.W., Quilan G.J. Pathogenesis of the systemic inflammatory syndrome and acute lung injury: role of iron mobilization and decompartmentalization. Am. J. Lung Cell Mol. Physiol. 2008; 294(2): L161-L174.
172. Psaltis A.J. The role of bacterial biofilms in chronic rhinosinusitis. A thesis submitted for the degree of doctor philosophy. Adelaide. 2008. 200p.
173. Britigan B.E., Hayek M.B., Doebbeling N.B., Fick R.B. Transferrin and lactoferrin undergo proteolytic cleavage in the Pseudomonas aeruginosa-infected lungs of patients with cystic fibrosis. Infect. Immunol. 1993; 61(12): 5049-5055.
174. Rogan M.P., Taggart C.C., Green CM. Loss of microbicidal activity and increased formation of biofilm due to decreased lactoferrin activity in patients with cystic fibrosis. J. Infect. Dis. 2004; 190(7): 1245-1253.
175. Legrand D., Pierce A., Elass E. et al. Lactoferrin structure and functions. Adv. Exp.Med. Biol. 2008; 606: 163-194.
176. Latorre D., Puddu P., Valenti P., Gessani S. Reciprocal interactions between lactoferrin and bacterial endotoxins and their role in the regulation of the immune response. ToXins. 2010; 2(1): 54-68.
177. Baker H.M., Baker E.N. Lactoferrin and iron: structural and dynamic aspects of binding and release. Biometals. 2004; 13(3): 209-216.
178. Munford R.S. Detoxifying endotoxin: time, place and person. J. Endotoxin Res. 2005; 11(2): 69-84.
179. Valenti P., Antonini G. Lactoferrin: an important host defense against microbial and viral attack. Cell. Vol.Life Sci. 2005; 62(22): 2576-2587.
180. Puddu P., Lattore D., Carollo M. et al. Bovine lactoferrin counteracts Toll-like receptor mediated activation signals in antigen presenting cells. PLoS ONE. 2011; 6(7): 22504.
181.Legrand D. Lactoferrin, a key molecule in immune and inflammatory process. Biochem. Cell. Biol. 2012; 90(3): 252-268.
182. Bellamy W., Wakabayashi H., Takase M. et al. Killing of Candida albicans by lactoferrin B, a potent antimicrobial peptide derived from N-terminal region of bovine lactoferrin. Med. Microbiol. Immunol. 1993; 182(2): 97-105.
183. Qiu J., Hendrixson D.R., Baker E.N. et al. Human milk lactoferrin inactivates two putative colonization factors expressed by Haemophilus influenzae. Proc. Natl. Acad. Sci. USA. 1998; 95(21): 12641-12646.
184. Singh P.K. Iron sequestration by human lactoferrin stimulates P.aeruginosa surface motility and blocks biofilm formation. Biometals. 2004; 17(3): 267-270.
185. Berlutti F., Pantanella F., Natalizi T. et al. Antiviral properties of lactoferrin - a natural immunity molecule. Molecules. 2011; 16(8): 6992-7018.
186. Molerba M., Ragnoli B. Ambroxol in the 21st century: pharmacological and clinical update. Exp.Opin. Drug Metab. Toxicol. 2008; 4(8): 1119-1129.
187. Княжеская Н.П. Обоснование выбора препарата для лечения кашлевого синдрома и заболеваний, сопровождающихся выделением мокроты. Русский Мед. Журн. 2007; 15(18): 1-4.
188. Koyama I., Matsunaga Т., Harada Т. et al. Ambroxol reduces LPS toxicity mediated by induction of alkaline phosphatase in rat lung. Clin. Biochem. 2004; 37(8): 688-693.
189. Патент РФ 2281760.
190. Щипакина СВ. Влияние эмоксипина и мексидола на динамику клинико-лабораторных показателей при повторных тонзиллитах. Дисс.... канд. мед. наук. Саранск. 2010. 135 с.
191. Патент РФ 2205641.
192. Hooper L.V., Gordon J.I. Glycans as legislator of host-microbial interactions: spanning the spectrum from symbiosis to pathogenicity. Glycobiology. 2001; 11(2): 1R-10R.
193. Imberty A., Wimmerova M., Mitchell E.P., Gilboa-Garber N. Structures of the lectins from Pseudomonas aeruginosa: insights into the molecular basis for host glycan recognition. Micr. Infect. 2004; 6(2): 221-228.
194. Bucior I., Moston K., Engel J.N. Pseudomonas aeruginosa-mediated damage requires distinct receptors at the apical and basolateral surfaces of the polarized epithelium. Infect. Immun. 2010; 78(3): 939-953.
195. Freitas M., Axellson L.G., Cayuela С.et al. Microbial-host interactions specifically control the glycosylation pattern in intestinal mouse mucosa. Histochem. Cell. Biol. 2002; 118(2): 149-161.
196. Freitas M, Axellson L.G., Cayuela C. et al. Indigenous microbes and their soluble factors differentially modulate intestinal glycosylation steps in vivo. Use of a «lectin assay» to survey in vivo glycosylation changes. Histochem. Cell. Biol. 2005; 124(5): 423-433.
197. Cash H.L., Whitham C.V., Behrendt C.L., Hooper L.V. Symbiotic bacteria direct expression of an intestinal lectin. Science. 2006; 313(5790): 1126-1130.
198. Ley R.E., Peterson D.A., Gordon J.I. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell. 2006; 124(4): 837-848.
199. Jablonka E., Lamb M.E. Evolution in four dimensions: genetic, epigenetic, behavioral, and symbolic variation in the history of life. Bradford Books/MIT Press. 2005. pll3-154.
200. Lan J., Hua S., He X., Zhang Y. DNA methyltransferases and methylbiding proteins of mammals. Acta Biochim. Biophys. Sin. 2010; 42(4): 243-252.
201. Lim D.H.K., Maher E.R. DNA methylation: a form of epigenetic control of gene expression. Obstetrician Gynaecologist. 2010; 12(1): 37-42.
202. Van Vliet J., Oates N.A., Whitelaw E. Epigenetic mechanisms in the context of complex disease. Cell. Mol. Life Sci. 2007; 64(12): 1531-1538.
203. Gluckman P.D., Hanson M.A., Buklijas T. et al. Epigenetic mechanisms that underpin metabolic and cardiovascular disease. Nat. Rev. Endocrinol. 2009; 5(7): 401-408.
204. Mattick J.S. The functional genomics of noncoding RNA. Science. 2005; 309(5740): 1527-1528.
205. Chang S., Wen S., Chen D., Jin P. Small regulatory RNAs in neurodevelopmental disorders. Human Mol. Genetics. 2009; 18(1): R18-R26.
206. Bombail V., Moggs J.G., Orphandes G. Perturbation of epigenetic status by toxicant. Toxicol. Lett. 2004; 149(1-3): 51-58.
207. Bronner C, Chataigneau Т., Schini-Kerth V.B., Landry Y. The "Epigenetic code replication machinery", ECREM: a promising target of the epigenetic cell memory. Curr. Med. Chem. 2007; 14(25): 2629-2641.
208. Coward W.R., Watts K., Feghali-Bostwick C.A. et al. Repression of IP-10 by interactions between histone deacetylation and hypermethylation in idiopatic pulmonary fibrosis. Mol. Cell. Biol. 2010; 30(12): 2874-2886.
209. Lechner K., Fodinger M., Grisold W. et al. Vitamin B12 deficiency. New data on an old theme. Wien Klin. Wochenschr. 2005; 117(17): 579-591.
210. Schneider E., Pliushch G., Hajj N.B. et al. Spatial, temporal and interindividual epigenetic variation of functionally important DNA methylation patterns. Oxford J. Life Sci. 2010; 38(12): 3380-3390.
211. Rufenacht P., Mach-Pascual S., Iten A. Vitamin B12 deficiency: a challenging diagnosis and treatment. Rev. Med. Suisse. 2008; 4(175): 2212-2214; 2216-2217.
212. Allen L.H. How common is vitamin B-12 deficiency? Am. J. Clin. Nutr. 2009; 89(2): 693S-696S.
213. Aleszczyk J., Mielanjin W., Chomicz T. Evaluation of vitamin and immune status of patients with chronic palatal tonsillitis. Otolaryngol. Pol. 2001; 55(1): 65-67.
214. Aleszczyk J. Connection between changing the vitamin and immune status and the character of the throat microflora in patients with chronic tonsillitis. Otolaryngol. Pol. 2003; 57(2): 221-224.
215. Verhaeverbeke I., Mets Т., Mulkens K., Vandewoude M. Normalization of low vitamin B-12 serum levels in older people by oral treatment. J. Am. Geriatr. Soc. 1997; 45(1): 124-125.
216. Лифанова H.A. Перекисное окисление липидов как показатель интенсивности воспаления при хроническом тонзиллите. Российская Оториноларингология. 2005; 2(15): 62-65.
217. Cvetkovic Т., Vlahovic P., Todorovic М., Stankovic М. Investigation of oxidative stress in patients with chronic tonsillitis. Auris Nasus Larynx. 2009; 36(3): 340-344.
218. Антипенко B.B. Консервативное и хирургическое лечение хронического неспецифического тонзиллита. Дисс.... канд. мед. наук. СПб. 2009. 160 с.
219. Рязанов В.Д. Оценка антиоксидантного статуса и оптических спектров гемоглобина для диагностики клинических форм хронического тонзиллита. Автореф. дисс.... канд. мед. наук. Москва. 2012. 26 с.
220. Плужников Н.Н., Чиж СИ., Юзвинкевич Л.С и др. Оксидативный стресс.Фундаментальные и прикладные проблемы. В сб.: Актуальные проблемы и перспективы развития военной медицины: Научн. Тр. НИИИЦ (МБЗ) ГНИИ ВМ МО РФ. т.2. СПб. 2000. с.193-223.
221. Плужников Н.Н., Бакулина Л.С, Легеза В.И. и др. Некоторые аспекты антирадикальной защиты биомембран. В сб.: Актуальные проблемы и перспективы развития военной медицины: Научн. Тр. НИИЦ (МБЗ) ГНИИИ ВМ МО РФ, т.4. СПб. 2003. с.123-139.
222. Tesoriere L., Bongiorno A., Pintaudi A.M. et al. Synergistic interactions between vitamin A and vitamin E against lipid peroxidation in phosphatidylcholine liposomes. Arch. Biochem. Biophys. 1996; 326(1): 57-63.
223. Villamor E., Fawzi W.W. Effects of vitamin A supplementation on immune responses and correlation with clinical outcomes. Clin. Microbiol. Rev. 2005; 18(3): 446-464.
224. Ross A.C Vitamin A supplementation and retinoic acid treatment in the regulation of antibody responses in vivo. Vitam. Horm. 2007; 75: 197-222.
225. El Attar T.M., Lin H.S. Effect of retinoids and carotenoids on prostaglandin formation by oral squamous carcinoma cells. Prostagl. Leukot. Essent. Fatty Acids. 1991; 43(3): 175-178.
226. Kampmann E., Johann S., van Neerven S. et al. Anti-inflammatory effect of retinoic acid on prostaglandin synthesis in cultured cortical astrocytes. J. Neurochem. 2008; 106(1): 320-332.
227. Keino H., Watanabe Т., Sato Y., Okada A. Anti-inflammatory effect of retinoic acid on experimental autoimmune uveoretinitis. Br. J. Ophtalmol. 2010; 94(6): 802-807.
228. Gaedicke S., Zhang X., Schmelzer C. et al. Vitamin E dependent microRNA regulation in rat liver. FEBS Lett. 2008; 582(23-24): 3542-3546.
229. Rimbach G., Moehring J., Huebbe P., Lodge J.K. Gene-regulatory activity of alpha-tocopherol. Molecules. 2010; 15(3): 1746-1761.
230. Li C, Li R.W., Elsasser Т.Н. Alpha-tocopherol modulates transcriptional activities that affect essential biological progress in bovine cells. Gene Regul. Syst. 2010; 4(4): 109-124.
231. Ross S.M. Clinical applications of lipoic acid in type II diabetes mellitus. Holist. Nurs. Pract. 2006; 20(6): 305-306.
232. Carreau J.P. Biosynthesis of lipoic acid via unsaturated fatty acids. Meth. Enzymol. 1979; 62: 152-158.
233. Biewenga G.P., Haenen G.P., Bast A. The pharmacology of the antioxidant lipoic acid. Gen. Pharmacol. 1997; 29(3): 315-331.
234. Kagan V.E., Shvedova A., Serbinova E. et al. Dihydrolipoic acid - an universal antioxidant both in the membrane and in the aqueous phase. Reduction of peroxyl, ascorbyl and chromanoxyl radicals. Biochem. Pharmacol. 1992; 44(8): 1637-1649.
235. Bast A., Haenen G.R. Lipoic acid: a multifunctional antioxidant. Biofactors. 2003; 17(1-4): 207-213.
236. Барабой В.А. Альфа-липоевая - дигидролипоевая кислота - активная биоантиоксидантная и биорегуляторная система. Укр. Бкшм. Журн. 2005; 77(3): 20-26.
237. Lee J., Коо N., Min D.B. Reactive oxygen species, aging, and antioxidative nutraceuticals. CRFSFS. 2004; 3(1): 21-33.
238. Bilska A., Wlodek L. Lipoic acid - the drug of the future? Pharmacol. Rep.2005; 57(5): 570-577.
239. Suh J.H., Shenvi S.V., Dixon B.M. et al. Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid. Proc. Natl. Acad. Sci. USA. 2004; 101(10): 3381-3386.
240. Alleva R., Nasole E., Di Donato R. et al. a-Lipoic acid supplementation inhibits oxidative damage, accelerating chronic wound healing in patients undergoing hyperbaric oxygen therapy. Biochem. Biophys. Res. Commun. 2005; 333(2): 404-410.
241. Sigel H., Prijs В., McCormick D.B., Shih J.C. Stability and structure of binary and ternary complexes of a-lipoate and lipoate derivatives with Mn2+, Cu2+, and Zn2+in solution. Arch. Biochem. Biophys. 1978; 187(1): 208-214.
242. Cremer D.R., Rabeler R., Roberts A., Lynch B. Safety evaluation of alpha-lipoic acid (ALA). Regul. Toxicol. Pharmacol. 2006; 46(1): 29-41.
243. Goraca A., Huk-Kolega H., Piechota A. et al. Lipoic acid - biological activity and therapeutic potential. Pharmacol. Rep.2011; 63(4): 849-858.
244. Cui H., Kong Y., Zhang H. Oxidative stress, mitochondrial dysfunction and aging. J. Signal Transd. 2012; doi: 10.1155/2012/646354.
245. Reddy P.H. Mitochondrial dysfunction and oxidative stress in astma: implications for mitochondria-targeted antioxidant therapeutics. Pharmaceuticals. 2011; 4(3): 429-456.
246. Tan D.X., Manchester L.C., Terron M.P. et al. One molecule, many derivatives: a never-ending interaction of melatonin with reactive oxygen and nitrogen species? J. Pineal Res. 2007; 42(1): 28-42.
247. Lopez Gonzalez M.A., Guerrero J.M., Ceballo Pedraja J.M., Delgado Moreno F. Melatonin in palate tonsils with recurrent acute tonsillitis and tonsillar hypertrophy. Acta Otorrinolaringol. Esp.1998; 49(8): 625-628.
248. Reiter R.J., Tan D.X., Leon J. et al. When melatonin gets on your nerves: its beneficial effects in experimental models of stroke. Exp.Biol. Med. 2005; 230(2): 104-117.
249. Messner M., Hardeland R., Rodenbeck G., Huether G. Tissue retention and subcellular distribution of continuously infused melatonin in rats under near physiological conditions. J. Pineal. Res. 1998; 25(4): 251-259.
250. Srinivasan V., Spence D.W., Pandi-Perumal S.R. et al. Melatonin in mitochondrial dysfunction and related disorders. Int. J. Alzheimers Dis. 2011; 2011:326320.
251. Hardeland R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance. Endocrine. 2005; 27(2): 119-130.
252. Lopez A., Garcia J.A., Escames G. et al. Melatonin protects the mitochondria from oxidative damage reducing oxygen consumption, membrane potential, and superoxide anion production. J. Pineal Res. 2009; 46(2): 188-198.
253. Petrosillo G., Fattoretti P., Matera M. et al. Melatonin prevents age-related mitochondrial dysfunction in rat brain via cardiolipin protection. Rejuvenation Res. 2008; 11(5): 935-943.
254. Pieri C., Marra M., Moroni F. et al. Melatonin: a peroxyl radical scavenger more effective than vitamin E. Life Sci. 1994; 55(15): PL271-PL276.
255. Sofic E., Rimpapa Z., Kundorovic Z. et al. Antioxidant capacity of the neurohormone melatonin. J. Neurol. Transm. 2005; 112(3): 349-358.
256. Qi W., Reiter R.J., Tan D.X. et al. Chromium (Ill)-induced 8-hydroxy-deoxyguanosine in DNA and its reduction by antioxidants: comparative effects of melatonin, ascorbate, and vitamin E. Environ. Health. Respect. 2000; 108(5): 399-402.
257. Reiter R.J., Tan D.X., Manchester L.C., El-Sawi M. Melatonin reduces oxidant damage and promotes mitochondrial respiration: implications for aging. Annu. N.Y. Acad. Sci. USA. 2002; 259: 238-250.
258. Escames G., Lopez L.C., Tapias V. et al. Melatonin counteracts inducible mitochondrial nitric oxide synthase-dependent mitochondrial dysfunction in skeletal muscle of septic mice. J. Pineal Res. 2006; 40(1): 71-78.
259. Reiter R.J., Paredes S.D., Korkmaz A. et al. Melatonin combats molecular terrorism at the mitochondrial level. Interdisc. Toxicol. 2008; 1(2): 137-149.
260. Acuna-Castroviejo D., Escames G., Rodriguez M.I., Lopez L.C. Melatonin role in the mitochondrial function. Front Biosci. 2007; 12: 947-963.
261. Rodriguez M.I., Escames G., Lopez L.C. et al. Improved mitochondrial function and increased life span after chronic melatonin treatment in senescent prone mice. Exp.Gerontol. 2008; 43(8): 749-756.
262. Winiarska K., Fraczyk Т., Melinska D. et al. Melatonin attenuates diabetes-induced oxidative stress in rabbits. J. Pineal. Res. 2006; 40(2): 168-176.
263. Gilad E., Wong H.R., Zingarelli B. et al. Melatonin inhibits expression of the inducible isoform of nitric oxide synthase in murine macrophages: role of inhibition of NF-kB activation. FASEB J. 1998; 12(9): 685-693.
264. Deng W.G., Tang ST., Tseng H.P., Wu K.K. Melatonin suppresses macrophage cyclooxygenase-2 and inducible nitric oxide synthase expression by inhibiting p52 acetylation and binding. Blood. 2006; 108(2): 518-524.
265. Murakami Y., Yuhara K., Takada N. et al. Effect of melatonin on cyclooxygenase-2 expression and Nuclear Factor-kappa В activation in RAW264.7 macrophage-like cells stimulated with fimbriae of Porphyronas gingivalis. In Vivo Int. J. Exp.Clin. Pathophysiol. Drug Res. 2011; 25(4): 641-647.
266. Konakchieva R., Mitev Y., Almeida O.F.X., Patchev V.K. Chronic melatonin treatment and the hypothalamo-pituitary-adrenal axis in the rat: attenuation of the secretory response to stress and effects on hypothalamic neuropeptide content and release. Biol. Cell. 1997; 89(9): 587-596.
267. Sejian V., Srivastava S. Effects of melatonin on adrenal cortical function of indian goats under thermal stress. Vet. Med. Inter. 2010; doi: 10.4061/2010/348919.
268. Carrillo-Vico A., Reiter R.J., Lardone P.J. et al. The modulatory role of melatonin on immune responsiveness. Curr. Opin. Invest. Drugs. 2006; 7(5): 423-431.
269. Radogna F., Diederich M., Ghibelli L. Melatonin: a pleiotropic molecule regulating inflammation. Biochem. Pharmacol. 2010; 80(12): 1844-1852.
270. Park S.J., Tokura H. Bright light exposure during the daytime affects circadian rhythms of urinary melatonin and salivary immunoglobulin A. Chronobiol. Intern. 1999; 16(3): 359-371.
271. Yin Z., Pintea V., Lin Y. et al. Vitamin D enhances corneal epithelial barrier function. Invest. Ophthalmol. Vis. Sci. 2011; 52(10): 7359-7364.
272. Schwalfenberg G.K. A review of the critical role of vitamin D in the functioning of the immune system and the clinical implications of vitamin D deficiency. Mol. Nutr. Food Res. 2011;55:96-108.
273. Kong J., Zhang Z., Mussch M.W. et al. Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier. Am. J. Physiol. Gastrointest. Liver Physiol. 2007; 294(1): G208-G216.
274. Zasloff M. Fighting infection with vitamin D. Nat. Med. 2006; 12(4): 388-390.
275. Zanetti M. Cathelicidins, multifunctional peptides of the innate immunity. J. Leuk. Biol. 2004; 75(1): 39-48.
276. Liu P.T., Stenger S., Li H. et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006; 311(5768): 1770-1773.
277. Tiabringa G.S., Aarbiou J., Ninaber D.K. et al. The antimicrobial peptide LL-37 activate innate immunity at the airway surface by transactivation of the epithelial growth factor receptor. J. Immunol. 2003; 171(2): 6690-6696.
278. Yuk J.M., Shin D.M., Lee H.M. et al. Vitamin D induces autophagy in human monocytes/macrophages via cathelicidin. Cell Host Microbe. 2009; 6(3): 231-243.
279. Wu S., Sun J. Vitamin D, vitamin D receptor, and macroautophagy in inflammation and infection. Discov. Med. 2011; 11(59): 325-335.
280. Cross H.S., Kallay E. Regulation of the colonic vitamin D system for prevention tumor progression: an update. Future Oncology. 2009; 5(4): 493-507.
281. Khorchide M., Lechner D., Cross H.S. Epigenetic regulation of vitamin D hydroxylase expression and activity in normal and malignant human prostate cells. J. Steroid. Biochem. Mol. Biol. 2005; 93(2-5): 167-172.
282. Essa D., Denzer N., Mahlknecht U. et al. VDR microRNA expression and epigenetic silencing of vitamin signaling in melanoma cells. J. Steroid. Biochem. Mol. Biol. 2010; 121(1-2): 110-113.
283. Carmel J.J., Zasloff M., Gardland C. et al. On the epidemiology of influenza. Virology J. 2008; 5(1): 29-41.
284. Lagishetty V., Misharin A.V., Liu N.Q. et al. Vitamin D deficiency in mice impairs colonic antibacterial activity and predisposes to colitis. Endocrinol. 2010; 151(6): 2423-2432.
285. Sardar S., Chakraborty A., Chatterjee M. Comparative effectiveness of vitamin D3 and dietary vitamin E on lipids and enzymes of the hepatic antioxidant system in Sprague-Dawley rats. Int. J. Vitam. Nutr. Res. 1996; 66(1): 39-45.
286. Bao B.Y., Ting H.J., Hsu J.W., Lee Y.F. Protective role of 1,25-dihydroxyvitamin D3 against oxidative stress in nonmalignant human prostate epithelial cells. Int. J. Cancer. 2009; 122(12): 2699-2706.
287. Wejse C, Gomes V.F., Rabna P. et al. Vitamin D as a supplementary treatment for tuberculosis: a double-blind, randomized, placebo-controlled trial. Am. J. Crit. Care Med. 2009; 179(9): 843-850.
288. Ahmed M.S., Shoker A. Vitamin D metabolites, protective versus toxic properties: molecular and cellular perspectives. Nephr. Rev. 2010; 2: p.5.
289. Furlong C.E. Paraoxonases: an historical perspective. In: B.Mackness, M.Mackness, M.Aviram, G.Paragh (Eds.). The paraoxonases: their role in disease development and xenobiotic metabolism. Springer, Dordrecht, Netherlands. 2008. p.3-31.
290. Bornscheuer U.T., Kazlauskas R.J. Catalytic promiscuity in biocatalysis: using old enzymes to form new bonds and follow new pathways. Angew. Chem. Int. Ed. Engl. 2004; 43(45): 6032-6040.
291. Aharini A., Gaidukov L., Yagur S. et al. Directed evolution of mammalian paraoxonases PON1 and PON3 for bacterial expression and catalytic specialization. Proc. Natl. Acad. Sci. USA. 2004; 101(2): 482-487.
292. Khersonsky О., Tawfik D.S. Structure-reactivity studies of serum paraoxonase PON1 suggest that native activity is lactonase. Biochemistry. 2005; 44(16): 6371-6382.
293. Khersonsky O., Roodveldt C, Tawfik D.S. Enzyme promiscuity: evolutionary and mechanistic aspects. Curr. Opin. Chem. Biol. 2006; 10(5): 498-508.
294. Parsek M.R., Greenberg E.P. Acyl-homoserine lactone quorum sensing in gram-negative bacteria: a signaling mechanism involved in associations with higher organisms. Proc. Natl. Acad. Sci. USA. 2000; 97(16): 8789-8793.
295. Estin M.L., Stolz D.A., Zabner J. Paraoxonase 1, quorum sensing, and P.aeruginosa infection: a novel model. Adv. Exp.Med. Biol. 2010; 660: 183-193.
296. Rodriguez-Sanabria F., Rull A., Beltran-Debon R. et al. Tissue distribution and expression of paraoxonases and chemokines in mouse: the ubiquitous and joint localization suggest a systemic and coordinated role. J. Mol. Histol. 2010; 41(6): 379-386.
297. Aviram M., Rosenblat M., Billecke S. at al. Human serum paraoxonase (PON1) is inactivated by oxidized low density lipoprotein and preserved by antioxidants. Free Radic. Biol. Med. 1999; 26(7-8): 892-904.
298. Kumon Y., Nakauchi Y., Suehiro T. et al. Proinflammatory cytokines but not acute phase serum amyloid A or C-reactive protein, downregulate paraoxonase 1 (PON1) expression by HepG2 cells. Amyloid. 2002; 9(3): 160-164.
299. Feingold K.R., Memon R.A., Moser A.H., Grunfeld C. Paraoxonase activity in the serum and hepatic mRNA levels decrease during the acute phase response. Atheroscler. 1998; 139(2): 307-315.
300. Davis A.M., Haines D.C. Defending against infection: quorum quenching by enzymes in human liver microsomes. FASEB J. 2010; 24(meeting abstracts): Ib209.
301. Teiber J.F., Yorke S., Haines D.C. et al. Dominant role of paraoxonases in inactivation of the Pseudomonas aeruginosa quorum-sensing signal N-(3-oxododecanoyl)-L-homoserine lactone. Infect. Immun. 2008; 76(6): 2512-2519.
302. Stoltz D.A., Ozer E.A., Ng C.J. et al. Paraoxonase-2 deficiency enhances Pseudomonas aeruginosa quorum sensing in murine tracheal epithelia. Am. J. Physiol. Lung Cell. Mol. Physiol. 2007; 292(4): L852-L860.
303. Asian M., Nazligul Y., Horoz M. et al. Serum paraoxonase-1 activity in Helicobacter pylori infected subjects. Atheroscler. 2008; 196(1): 270-274.
304. Camps J., Pujol I., Ballester F. et al. Paraoxonases as potential antibiofilm agents: their relationship with quorum-sensing signals in gram-negative bacteria. Antimicrob. Agents Chemoter. 2011; 55(4): 1325-1331.
305. Costa L.G., Giordano G., Furlong C.E. Pharmacological and dietary modulators of paraoxonase 1 (PON1) activity and expression: the hunt goes on. Biochem. Pharmacol. 2011; 81(3): 337-344.
306. Moskaug J.Q., Carlsen H., Myhrstadt M., Blomhoff R. Molecular imaging of the biological effects of quercetin and quercetin-rich foods. Mech. Ageing Dev. 2004; 125(4): 315-324.
307. Bischoff S.C. Quercetin potentials in the prevention and therapy of diseases. Curr. Opin. Clin. Nutr. Metab. Care. 2008; 11(6): 733-740.
308. Romero M., Jemenez R., Sanchez M. et al. Quercetin inhibits vascular superoxide production induced by endothelin-1: role of NADPH oxidase, uncoupled eNOS and PKC. Atheroscler. 2009; 202(1): 58-67.
309. Carrasco-Pozo C, Mizgier M.L., Speisky H., Gotteland M. Differential protective effects of quercetin, resveratrol, rutin and epigallocatechin against mitochondrial dysfunction induced by indomethacin in Caco-2 cells. Chem. Biol. Interact. 2012. 195(3): 199-205.
310. Bindoli A., Vakente M., Cavallini L. Inhibitory action of quercetin on xanthine oxidase and xanthine dehydrogenase activity. Pharmacol Res. Commun. 1985; 17(9): 831-839.
311. Pauf J.M., Hille R. Inhibition studies of bovine xanthine oxidase by luteolin, silibinin, quercetin and curcumin. J. Nat. Prod. 2009; 72(4): 725-731.
312. Hirota S., Takahama U., Ly T.N., Yamauchi R. Quercetin-dependent inhibition of nitration induced by peroxidase/H202/nitrite systems in human saliva and characterization of an oxidation product of quercetin formed during the inhibition. J. Agric. Food Chem. 2005; 53(9): 3265-3272.
313. Mird L., Fernandez M.T., Santos M. et al. Interactions of flavonoids with iron and copper ions: a mechanism for their antioxidant activity. Free Radic. Res. 2002; 36(11): 1199-1208.
314. Pekal A., Biesaga M., Pyrzinska K. Interaction of flavonoids with copper ions: complexation, oxidation and reactivity towards radicals. Biometals. 2011; 24(1): 41-49.
315. Baccan M.M., Chiarelli-Neto O., Pereira R.M., Esposito B.P. Quercetin as shuttle for labile iron. J. Inorg. Biochem. 2012; 107(1): 34-39.
316. Ganesan S., Fans A.N., Comstock A.T. et al. Quercetin inhibits rhinovirus replication in vitro and in vivo. Antiviral Res. 2012; 94(3): 258-271.
317. Nanua S., Zick S.M., Andrade J.E. et al. Quercetin blocks airway epithelial cells chemokine expression. Am. J. Respir. Cell. Mol. Biol. 2006; 35(5): 602-610.
318. Ganesan S., Faris A.N., Comstock A.T. et al. Quercetin prevents progression of disease in elastase/LPS-exposed mice by negatively regulating MMP expression. Respir. Res. 2010; 11(1): 131.
319. Kawabata K., Kawai Y., Terao J. Suppressive effect of quercetin on acute stress-induced hypothalamic-pituitary-adrenal axis response in Wistar rats. J. Nutr. Biochem. 2010; 21(5): 374-380.
320. Davis J.M., Murphy E.A., McClellan J.L. et al. Quercetin reduces susceptibility to influenza infection following stressful exercise. Regul. Integr. Compar. Physiol. 2008; 295(2): R505-R509.
321. Rivera L., Moron R., Sanchez M. et al. Quercetin ameliorates metabolic syndrome and improves the inflammatory status in obese Zucher rats. Obesity. 2008; 16(9): 2081-2087.
322. US Patent application 20100292287.18.11.2010.
323. Geoghegan F., Wong R.W., Rabie A.B. Inhibitory effect of quercetin on periodontal pathogens in vitro. Phytother. Res. 2010; 24(6): 817-820.
324. Burton M.J., Towler В., Glasziou P. Tonsillectomy versus non-surgical treatment for chronic/recurrent acute tonsillitis. Cochrane Database Syst. Rev. 2000; 2: CD001802.
325. Burton M.J., Glasziou P.P. Tonsillectomy or adeno-tonsillectomy versus nonsurgical treatment for chronic/recurrent acute tonsillitis. Cochrane Database Syst. Rev. 2009; 1: CD001802.
326. Canchaya C, Fournous G., Brussow H. The impact of prophages on bacterial chromosomes. Mol. Microbiol. 2004; 53(1): 8-9.
327. Zueva V.S., Nesterenko L.N., Dmitrienko O.A., Akatov A.K. Lysogeni of methicillin-resistant Staphylococcus aureus and the role of prophages in transfer of conjugative and nonconjugative plasmids. J. Chemother. 1991; 3(5): 279-282.
328. Fischetti V.A. In vivo acquisition of prophage in Streptococcus pyogenes. Trends Microbiol. 2007; 15(7): 297-300.
329. Kuroda M., Ohta Т., Uchiyama I. et al. Whole genome sequence of methicillin-resistant Staphylococcus aureus. Lancet. 2001; 357(2964): 1225-1240.
330. Beres S.B., Sylva G.L., Barbian K.D. et al. Genome sequence of a serotype M3 strain of group A Streptococcus: phage-encoded toxins, the high-virulence phenotype, and clone emergence. Proc. Natl. Acad. Sci. USA. 2002; 99(15): 10078-10083.
331. Wagner P.L., Waldor M.K. Bacteriophage control of bacterial virulence. Infect. Immun. 2002; 70(8): 3985-3993.
332. Carrolo M., Frias M.J., Pinto F.R. et al. Prophage spontaneous activation promotes DNA release enhancing biofilm formation in Streptococcus pneumonia. PLoS ONE. 2010; 5(12): el5678.
333. Асоскова Т.К., Аксенова A.B., Лямперт И.М. Фагочувствительность и лизогения культур Streptococcus pyogenes группы Аб выделенных при различных стрептококковых инфекциях. Журн. Микробиол. Эпидемиол. Иммунобиол. 1996; 5:7-10.
334. Янковский О.Ю. Токсичность кислорода и биологические системы (эволюционные, экологические и медико-биологические аспекты). СПб.: Игра. 2000. 294 с.
335. Malinouski М., Zhou Y., Belousov V.V. et al. Hydrogen peroxide probes directed to different cellular compartments. PloS ONE. 2011; 6(1): el4564.
336. Baldeck J.D., Marguis R.E. Targets for hydrogen-peroxide-induced damage to suspension and biofilm cells of Streptococcus mutants. Can. J. Microbiol. 2008; 54(10): 868-875.
337. Thomas E.L., Milligan T.W., Joyner R.E., Jefferson M.M. Antibacterial activity of hydrogen peroxide and the lactoperoxidase-hydrogenperoxide-thiocyanate system against oral streptococci. Infect. Immun. 1999; 62(2): 529-535.
338. Konaba J.T., Sargent K.E., Gow J.B. Efficient repair of hydrogen peroxide-induced DNA damage by Escherichia coli requires SOS induction of RecA and RuvA proteins. Mutat. Res. 2000; 459(3): 187-194.
339. Selva L., Viana D., Regev-Yochay G. et al. Killing niche competitors by remote-control bacteriophage induction. Proc. Natl. Acad. Sci. USA. 2009; 106(4): 1234-1238.
340. Плужников H.H., Гайдар Б.В., Чепур C.B. и др. Редокс регуляция: фундаментальные и прикладные проблемы. В сб.: Актуальные проблемы и перспективы развития военной медицины. СПб. 2003. НИИЦ МБЗ ГНИИИИ ВМ МО РФ. т4. с.139-175.
341. Oliveira-Marques V., Marinho H.S., Cyrne L., Antunes F. A quantitative study of NF-kappa В activation by H202: relevance in inflammation and synergy with TNF-alpha. J. Immunol. 2007; 178(6): 3893-3902.
342. Oliveira-Maeques V., Cyrne L., Marinho H.S., Antunes F. Role of hydrogen peroxide in NF-kappa В activation: from inducer to modulator. Antioxid. Redox Signal. 2009; 11(9): 2223-2243.
343. Purdon-Dickenson S.E., Sheveleva E.V., Sun H., Chen Q.M. Translation control of Nrf2 protein in activation of antioxidant response by oxidants. Mol. Pharmacol. 2007; 72(4): 1074-1081.
344. Bell K.F., Al-Mubarak В., Fowler J.H. et al. Mild oxidative stress activates Nrf2 in astrocytes, wich contributes to neuroprotective ischemic preconditioning. Proc. Natl. Acad. Sci. USA. 2011; 108(1): E1-E2.
345. Costa A.D.T., Jakob R., Costa C.L. et al. The mechanism by which the mitochondrial ATP-sensitive K+channel opening and H202 inhibit the mitochondrial permeability transition. J. Biol. Chem. 2006; 281(30): 20801-20808.
346. Goerlich O., Quillardet P., Hofnung M. Induction of the SOS response by hydrogen peroxide in various Escherichia coli mutants with altered protection against oxidative DNA damage. J. Bacteriol. 1989; 171(11): 6141-6147.
347. Pericine CD., Overweg K., Hermans P.W.M., Weiser J.N. Inhibitory and bactericidal effects of hydrogen peroxide production by Streptococcus pneumonia on other inhabitants of the upper respiratory tract. Infect. Immunol. 2000; 68(7): 3990-3997.
348. Park В., Niset V., Liu G.Y. Role of Staphylococcus aureus catalase in niche competition against Streptococcus pneumoniae. J. Bacteriol. 2008; 190(7): 2275-2278.
349. Regev-Yochay G., Trzcinski K., Thompson CM. et al. Interference between Streptococcus pneumonia and Staphylococcus aureus: in vitro hydrogen peroxide-mediated killing by Streptococcus pneumonia. J. Bacteriol. 2006; 188(13): 4996-5001.
350. Daeschel M.A. Antimicrobial substances from lactic acid bacteria for use as food preservatives. Food Technol. 1989; 43(1): 164-167.
351. Anders R.F., Hogg D.M., Jago G.R. Formation of hydrogen peroxide by group N streptococci and its effect on their growth and metabolism. Appl. Microbiol. 1970; 19(4): 602-612.
352. Condon S. Responses of lactic acid bacteria to oxygen. FEMS Microbiol. Rev. 1987; 43(6): 269-280.
353. Martin R., Soberon N., Escobedo S., Suarez J.E. Bacteriophage induction versus vaginal homeostasis: role of H202 in the selection of Lactobacillus defective prophages. Int. Microbiol. 2009; 12(2): 131-136.
354. Martin R., Soberon N., Vaneechoutte M. et al. Characterization of indigenous vaginal lactobacilli from healthy women as probiotic candidates. Int. Microbiol. 2008; 11(4): 261-266.
355. Martin R., Suarez J.E. Biosynthesis and degradation of H202 by vaginal lactobacilli. Appl. Environ. Microbiol. 2010; 76(2): 400-405.
356. Yoshida Y., Marayama M., Fujita T. et al. Reactive oxygen intermediates stimulate interleukin-6 production in human bronchial epithelial cells. Am. J. Physiol. 1999; 276(6): L900-L908.
357. Feng Y., Santoriello C, Mione M. et al. Live imaging of innate immune cell sensing of transformed cells in Zebrafish larve: parallels between tumor initiation and wound inflammation. PLoS Biol. 2010; 8(12): el000562.
358. Okayasu I., Hatakeyama S. A combination of necrosis of autologous thyroid gland and injection of lipopolysaccharide induces autoimmune Thyroiditis. Clin. Immunol. Immunopathol. 1984; 31(3): 344-352.
359. Van der Poll Т., Endert E., Coyle S.M. et al. Neutralization of TNF does not influence endotoxin-induced changes in thyroid hormone metabolism in humans. Am. J. Physiol. 1999; 276(2 Pt2): R357-R362.
360. Van der Poll Т., Van Zee K.J., Endert E. et al. Interleukin-1 receptor blockade does not affect endotoxin-induced changes in plasma thyroid hormone and thyrotropin concentration in man. J. Clin. Endocrinol. Metab. 1995; 80(4): 1341-1346.
361. Boelen A., Kwakkel J., Platvoet-ter Schiphorst M. et al. Interleukin-18, a proinflammatory cytokine, contributes to the pathogenesis of non-thyroidal illness mainly via central part of the hypothalamus-pituitary-thyroid axis. Eur. J. Endocrinol. 2004; 151(4): 497-502.
362. Beigneux A.P., Moser A.H., Shigenaga J.K. et al. Sick euthyroid syndrome is associated with decreased TR expression and DNA binding in mouse liver. Am. J. Physiol. Endocrinol. Metab. 2003; 284(1): E228-E236.
363. Власова B.B., Ланцов Ф.Л., Хмельницкая H.M. Состояние обмена веществ и функциональной активности щитовидной железы у больных хроническим тонзиллитом с избыточной массой тела. Вестн. Оториноларингол. 1998; 4: 43-46.
364. Malo M.S., Zhang W., Alkhoury F. et al. Thyroid hormone positively regulates the enterocyte differentiation marker intestinal alkaline phosphatase gene via an atypical response element. Mol. Endocrinol. 2004; 18(8): 1941-1962.
365. Plateroli M., Kress E., Mori J.I., Samarut J. Thyroid hormone receptor alpha 1 directly controls transcription of the beta-catenin gene in intestinal epithelial cells. Mol. Cell. Biol. 2006; 26(8): 3204-3214.
366. Hodin R.A., Chamberlain S.M., Upton M.P. Thyroid hormone differentially regulates rat intestinal brush border enzyme gene expression. Gastroenterol. 1992; 103(5): 1529-1536.
367. Lalles J.P. Intestinal alkaline phosphatase: multiple biological roles in maintenance of intestinal homeostasis and modulation by diet. Nutr. Rev. 2010; 68(6): 323-332.
368. Vaishnava S., Hooper L.V. Alkaline phosphatase: keeping the peace at the gut epithelial surface. Cell Host Microbe. 2007; 2(6): 365-367.
369. Long J., Zaborina O., Holbrook C. et al. Depletion of intestinal phosphate after operative injury activates the virulence of Pseudomonas aeruginosa causing lethal gut-derived sepsis. Surgery. 2008; 144(2): 189-197.
370. Romanowski K., Zaborin A., Fernandez H. et al. Prevention of siderofore-mediated gut-derived sepsis due to P.aeruginosa can be achieved without iron provision by maintaining local phosphate abundance: role of pH. BMC Microbiol. 2011; 11:212. Doi: 10.1186/1471-2180-11-212.
371. Zaborin A., Romanowski K., Morozowa I. et al. Intestinal phosphate depletion develops during human critical illness and activates the virulence of key pathogens associated with gut-derived sepsis. Surgical Infection Society Thirtieth Annual Meeting. 2010. Nevada, Las Vegas, http://sisna.org/abstracts/2010/10.cgi.
372. Mittag J., Behrends Т., Hoefig C.S. et al. Thyroid hormones regulate selenoprotein expression and selenium status in mice. PLoS ONE. 2010; 5(9): el2931.
373. Liu M.L., Xu G., Huang Z. Y. et al. Euthyroid sick syndrome and nutritional status are correlated with hyposelenemia in hemodialysis patients. Int. J. Artif. Organs. 2011; 34(7): 577-583.
374. Баранова T.A. Гигиеническое и эпидемиологическое обоснование системы профилактики селенодефицитных состояний у населения Омской области. Дисс.... канд. мед. наук. Омск. 2008. 134 с.
375. Боярская A.M., Осадчая О.И., Коваленко О.Н. Применение энтеросорбента энтеросгель в комплексном лечении дисбиоза кишечника у детей с ожоговой болезнью. Мед. Неотл. Состояний. 2006; 1(2): 50-52.
376. Немцов В.И. Нарушения состава кишечной микрофлоры и метаболический синдром. Клинико-Лаб. Консилиум. 2010; 1(32): 4-12.
377. Частная вирусология: руководство. Ред. Жданова В.М., Гайдамович С.Я. М.: Медицина. 1982. т.2. 520 с.
378. Медицинская микробиология. Гл. Ред. Покровский В.И., Поздеев O.K. М.: ГЕОТАР Медицина. 1999. 1200 с.
379. Плужников М.С., Ловренова Г.В., Левин М.Я. и др. Тонзиллит: клинические и иммунологические аспекты. СПб.: Диалог.2004. 222 с.
380. Mancini G., Carbonara A., Heremans J. Immunochemical quantitation of antigens by single radial immunodiffusion. Immunochem. 1965; 2(3): 235-254.
381. Бухарин О.Б., Васильев H.B. Лизоцим и его роль в биологии и медицине. Томск: Изд-во Томск. Ун-та. 1974. 208 с.
382. Нагоева М.Х. Патогенетические аспекты состояния свободно-радикального статуса, иммунитета, цитокинового профиля и среднемолекулярных пептидов у больных ангиной. Автореф. дисс.... докт.мед. наук. М. 2010. 28 с.
383. Сабанчиева Ж.Х. Клинико-прогностическое значение функционально-метаболической активности лейкоцитов, среднемолекулярных пептидов и про-антиоксидантной защиты крови у больных ВИЧ-инфекцией. Дисс.... докт.мед. наук. М. 2007. 261 с.
384. Michara М., Uchiyama М. Determination of malonaldehyde precursor in tissues by thiobarbitiric acid test. Anal. Biochem. 1978; 86(1): 271-278.
385. Николайчик B.B., Моин B.M., Кирковский B.B. и др. Способ определения «средних молекул». Лаб. Дело. 1991; 10: 13-18.
386. Габрилович М.И. Определение концентрации молекул средней массы плазмы крови скрининговым методом. Нальчик: КБГУ. 1998. 8 с.
387. Воробьев А.А., Минаев В.И., Бондаренко В.М. и др. Бактериальная эндотоксинемия у детей с дисбиозом кишечника. Журн. Микробиол. Эпидемиол. Иммунобиол. 1999; 3: 67-70.
388. Каган Л.Г. Гиперэндотоксинемия при дисбиозах, вызванных антибиотико-терапией, и ее коррекция в гериатрической практике. Автореф. дисс.... канд. мед. наук. М. 2000. 24 с.
389. Гараева З.Ш., Сафина Н.А., Тюрин Ю.А. и др. Дисбиоз кишечника как причина системной эндотоксинемии у больных псориазом. Вестн. Дерматол. Венерол. 2007; 1:23-27.
390. Патент РФ 2169367.
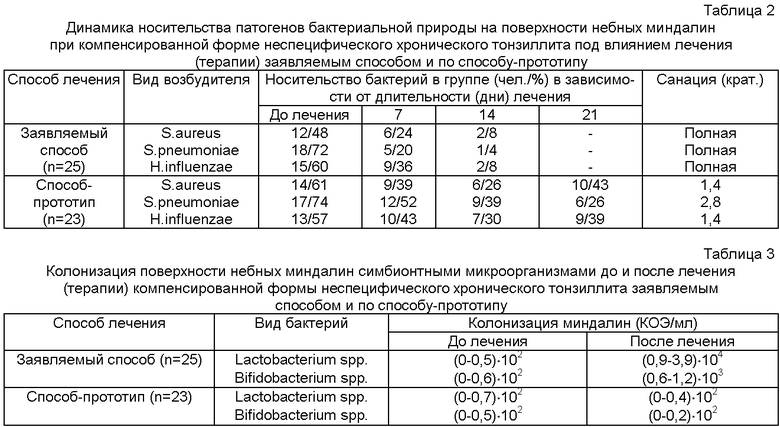
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ОБОСТРЕНИЙ РЕЦИДИВИРУЮЩЕГО РИНОСИНУСИТА | 2013 |
|
RU2562537C2 |
| СПОСОБ ЛАЗЕРНОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА С ПРИМЕНЕНИЕМ ФОТОСЕНСИБИЛИЗАТОРА | 2007 |
|
RU2379073C2 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА | 2003 |
|
RU2235568C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОЙ АНГИНЫ (ОСТРОГО ТОНЗИЛЛИТА) | 2011 |
|
RU2456986C1 |
| Способ лечения ладонно-подошвенного пустулеза | 2020 |
|
RU2749360C1 |
| Способ лечения местно-распространенного рака ротоглотки | 2020 |
|
RU2739294C1 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОГО ВЛИЯНИЯ НА БИОПЛЕНКООБРАЗОВАНИЕ МИКРООРГАНИЗМАМИ | 2016 |
|
RU2646488C2 |
| СПОСОБ КОМПЛЕКСНОЙ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ ОСТРЫХ ФОРМ ВИРУСНОГО ГЕПАТИТА В И МИКСТ-ГЕПАТИТОВ (В+С, В+D, В+С+D) | 2010 |
|
RU2440128C1 |
| Способ лечения хронического тонзиллита, протекающего на фоне хронического описторхоза | 2023 |
|
RU2817977C1 |
| СПОСОБ ДИАГНОСТИКИ РАЗЛИЧНЫХ ФОРМ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА | 2009 |
|
RU2429477C2 |
Изобретение относится к области медицины и предназначено для лечения компенсированной формы неспецифического хронического тонзиллита. Способ включает стресс-протективную терапию, диетотерапию, витаминотерапию, пробиотикотерапию, антиоксидантную терапию, терапию пребиотик-подобными препаратами, местную иммунокорригирующую терапию и топическую эрадикационную терапию. Способ высокоэффективен при лечении компенсированной формы неспецифического хронического тонзиллита, обеспечивает нормализацию эпигенетической регуляции экспрессии генов и окислительно-восстановительных процессов в организме человека, создание условий для купирования микроэкологического дисбаланса и восстановления колонизационной резистентности слизистых оболочек верхних дыхательных путей, эрадикацию инфекционных агентов бактериальной и вирусной природы на фоне восстановления эубиоза слизистых оболочек верхних дыхательных путей, нормализацию функций желудочно-кишечного тракта, блокирование эффектов липополисахарида грам-негативных бактерий, полное исчезновение обострений в течение одного года у подавляющего большинства пациентов. 9 табл., 1 пр.
Способ лечения компенсированной формы неспецифического хронического тонзиллита посредством курсового назначения препаратов системного и местного действия, отличающийся тем, что комплексно в течение трех недель проводят корригирующее воздействие на основные патогенетические механизмы формирования и поддержания хронического воспалительного процесса в небных миндалинах, включающее стресс-протективную терапию, диетотерапию, витаминотерапию, пробиотикотерапию, антиоксидантную терапию, терапию пребиотик-подобными препаратами, местную иммунокорригирующую терапию и топическую эрадикационную терапию, при этом при проведении стресс-протективной терапии в качестве стресс-протектора назначают ежедневно перорально три раза в день трициклический антидепрессант амитриптилин в субтерапевтической дозе 6,25-12,5 мг - 1/4-1/2 таблетки; при проведении диетотерапии в рацион питания включают утреннюю и вечернюю порции овсяной каши по 200-300 мл, каждую из которых готовят из 100-125 г овсяных хлопьев, а в обеденное меню включают 200-300 г каши из гречневой крупы в качестве самостоятельного блюда или гарнира и один сырой белок куриного яйца, из рациона исключают моносахариды, дисахариды и содержащие их блюда, а также продукты и напитки в виде шоколада, какао, кофе, чая, в состав которых входят ингибиторы фосфодиэстераз, причем для приготовления первых, вторых блюд, десертов и напитков используют только профильтрованную воду, а для питья - еще и кипяченую; при проведении витаминотерапии назначают:
- витамины группы «B» в составе препарата «Нейромультивит» ежедневно перорально один раз в день по одной таблетке, содержащей 100,0 мг витамина B1, 200,0 мг витамина B6, 200,0 мкг витамина B12;
- витамин A - ретинола ацетат - в течение первой недели ежедневно перорально один раз в день по одной капсуле, содержащей 33000 ME ретинола ацетата, и затем в течение последующих двух недель через день перорально однократно по одной капсуле, содержащей 33000 ME ретинола ацетата;
- витамин E - α-токоферол - в течение первой недели ежедневно перорально три раза в день по 1 капсуле, содержащей 100,0 мг α-токоферола, и затем в течение последующих двух недель ежедневно перорально два раза в день по 1 капсуле, содержащей 100,0 мг α-токоферола;
- витамин D3 - кальцитриол - ежедневно перорально один раз в день в дозе 4000 ME - 100,0 мкг;
- витамин C - аскорбиновую кислоту - в течение первой недели ежедневно перорально три раза в день по два драже, каждое из которых содержит по 50,0 мг аскорбиновой кислоты, и затем в течение последующих двух недель ежедневно перорально два раза в день по два драже, каждое из которых содержит по 50,0 мг аскорбиновой кислоты; при проведении пробиотикотерапии назначают ежедневно перорально после приема пищи пробиотик третьего поколения «Бифиформ» по одной капсуле три раза в день; при проведении антиоксидантной терапии назначают:
- липоевую (тиоктовую) кислоту ежедневно перорально после приема пищи три раза в день по одной таблетке, содержащей 25,0 мг тиоктовой кислоты;
- N-ацетилцистеин в виде препарата «АЦЦ» ежедневно перорально три раза в день по одной шипучей таблетке, содержащей 200,0 мг N-ацетилцистеина, после предварительного растворения ее в воде;
- дигидрокверцетин в течение первой недели ежедневно перорально три раза в день во время еды по одной таблетке, содержащей 25 мг дигидрокверцетина, и затем в течение последующих двух недель ежедневно перорально два раза в день во время еды по одной таблетке, содержащей 25 мг дигидрокверцетина;
- мелатонин в виде препарата «Мелаксен» ежедневно перорально один раз в день по одной таблетке, содержащей 3,0 мг мелатонина, за тридцать минут до отхода ко сну;
- селен в виде препарата «Селен-актив» ежедневно перорально один раз в день по одной таблетке, содержащей 50,0 мкг селена; при проведении терапии пребиотик-подобными препаратами назначают:
- новокаин ежедневно перорально после приема пищи три раза в день по 5,0 мл 0,25% раствора;
- эмоксипина сукцинат в виде препарата «Мексидол» ежедневно перорально три раза в день по одной таблетке, содержащей 125,0 мг эмоксипина сукцината;
- амброксола гидрохлорид в виде препарата «Лазолван» ежедневно перорально во время приема пищи три раза в день по одной таблетке, содержащей 30,0 мг амброксола гидрохлорида;
- препарат «Энтеросгель» ежедневно перорально три раза в день через два часа после приема пищи и лекарственных препаратов по 15 г - одной столовой ложке;
- кальция глицерофосфат ежедневно перорально после приема пищи три раза в день по одной таблетке, содержащей 0,2 г кальция глицерофосфата; при проведении местной иммунокорригирующей терапии назначают препарат «Имудон» в форме таблеток для рассасывания ежедневно шесть раз в день через каждые два часа; при проведении топической эрадикационной терапии назначают ежедневное однократное последовательное промывание лакун небных миндалин сначала 0,05% раствором пероксида водорода, а затем, через 15 минут, повторное промывание 1,67% раствором эмоксипина сукцината в виде препарата «Мексидол» и 0,25% раствором амброксола гидрохлорида в виде препарата «Лазолван» в 0,33% растворе новокаина, растворы для промывания небных миндалин изготовляют непосредственно перед их применением, причем 0,05% раствор пероксида водорода изготовляют путем смешивания 59,0 мл 0,9% раствора натрия хлорида и 1,0 мл официнального 3% раствора пероксида водорода, а многокомпонентный раствор для повторного промывания лакун небных миндалин изготовляют путем смешивания в одном флаконе равных объемов официнальных 1% ампульного раствора новокаина, 5% ампульного раствора эмоксипина сукцината в виде препарата «Мексидол» и 0,75% ампульного раствора амброксола гидрохлорида в виде препарата «Лазолван».
| КРЮКОВ А.И | |||
| и др | |||
| Тонзиллофарингиты: диагностика и лечение// Справочник поликлинического врача, 2007, N1, с.38-43) | |||
| КАЗАКОВА С.П | |||
| Клинико-лабораторные особенности, методы коррекции гнойно-воспалительного поражения ротоглотки у детей, больных инфекционным мононуклеозом и ангиной | |||
| Автореф | |||
| дисс | |||
| на соиск.уч.степ | |||
| к.м.н | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RU | |||
Авторы
Даты
2014-04-10—Публикация
2012-09-17—Подача