ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области биологии и химии, более конкретно, к области молекулярной биологии и генетики человека. Изобретение относится к области определения метилированных участков в ДНК человека, в особенности метилированных участков в некоторых определенных последовательностях, которые в тех случаях, когда метилированы, являются признаком рака яичников.
УРОВЕНЬ ТЕХНИКИ
Рак яичников является пятой основной причиной смертности от злокачественных опухолей у женщин, основной причиной смертности от гинекологических злокачественных заболеваний и вторым чаще всего диагностируемым гинекологическим злокачественным заболеванием (The Merck Manual of Diagnosis and Therapy Section 18. Gynecology And Obstetrics Chapter 241. Gynecologic Neoplasms).
Оно является идиопатическим, что означает, что точная причина обычно неизвестна. Это заболевание больше распространено в промышленно развитых странах, за исключением Японии. В Соединенных Штатах Америки риск возникновения рака яичников у женщин за время жизни составляет от 1,4% до 2,5% (1 из 40-60 женщин).
Более половины смертей от рака яичников имеет место у женщин в возрасте от 55 до 74 лет, и приблизительно одна четверть смертей от рака яичников имеет место у женщин в возрасте от 35 до 54 лет.
На риск возникновения рака яичников, по-видимому, влияют несколько факторов.
Зависимость от использования средства для лечения бесплодия, такого как цитрат кломифена, являлась неоднозначной. Анализ в 1991 году увеличил вероятность того, что использование лекарственных средств может увеличить риск возникновения рака яичников. С тех пор было проведено несколько групповых исследований и исследования методом случай-контроль, не предоставляющих убедительное доказательство для такой зависимости.
Существуют достоверные сведения, что важную роль играют генетические факторы. Носители определенных мутаций гена BRCA1 или BRCA2, чаще встречаемых в некоторых популяциях (например, еврейские женщины ашкенази), находятся в группе более высокого риска возникновения как рака молочной железы, так и рака яичников, часто в более раннем возрасте, чем в основной популяции. У пациентов с раком молочной железы в анамнезе или с раком молочной железы и/или яичников в семейном анамнезе, особенно если в молодом возрасте, может иметь место повышенный риск. Тяжелый семейный анамнез в отношении рака матки, рака толстого кишечника или других злокачественных образований желудочно-кишечного тракта может указывать на наличие синдрома, известного как наследственный неполипозный колоректальный рак (HNPCC, также известного как синдром Линча II), который придает более высокий риск возникновения рака яичников.
Другие факторы, которые были исследованы, такие как использование талька, воздействие асбеста, высокое содержание жира в пище и инфицирование свинкой в детстве, являются неоднозначными и не были окончательно доказаны.
Рак яичников классифицируют в зависимости от гистологии опухоли (коды ICD-O). Гистология определяет множество аспектов клинической терапии, коррекции и прогноза.
Опухоли яичников можно классифицировать по их предполагаемой клетке-предшественнице. Основные категории представляют собой поверхностные эпителиально-стромальные опухоли, опухоли стромы полового тяжа яичников (ICD-O 8590), герминогенные опухоли (ICD-O 9060-9090) и вторичные или метастатические опухоли.
Поверхностные эпителиально-стромальные опухоли являются наиболее распространенными и типичными видами рака яичников. Они, как полагают, происходят из поверхностной выстилки яичника и включают в себя серозную цистаденокарциному (8441/3) и муцинозную цистаденокарциному (8470/3). Брюшная полость выстлана такими же клетками, которые составляют поверхностную выстилку яичника, и возможно, что рак начался там, в таком случае его называют первичным перитонеальным раком. Лечение, однако, в основном такое же, как и лечение рака яичников.
Опухоли стромы полового тяжа яичников (8590) включают в себя поражения, которые являются гормонально активными, такие как эстроген-продуцирующая гранулезоклеточная опухоль (8620/3) и вирилизирующая опухоль из сертолилейдиговских клеток или арренобластома.
Герминогенные опухоли (9060-9090) яичника происходят из половых клеток и имеют тенденцию возникать у молодых женщин и девочек. Эти опухоли составляют приблизительно 5% случаев рака яичников. Они имеют тенденцию хорошо инкапсулироваться, и большинство является доброкачественными, таким образом, прогноз, чем для других опухолей яичников.
Существуют также смешанные опухоли, вторичные или метастатические опухоли.
Рак яичников часто является первичным, но также может быть вторичным, то есть быть результатом метастазов от первичных злокачественных опухолей в других местах организма, например от рака молочной железы или рака желудочно-кишечного тракта, и в этом случае рак яичников является раком Крукенберга.
Исторически рак яичников называли «тихим убийцей», поскольку считалось, что симптомы не проявлялись до тех пор, пока шанс на излечение не становился мал. Тем не менее, недавние исследования показали, что этот термин неверный и что следующие ниже симптомы, по всей вероятности, имеют место у женщин с раком яичников, чем у женщин в основной популяции. Такие симптомы включают в себя вздутие, тазовую или брюшную боль, затрудненное питание или быстрое чувство насыщения, симптомы со стороны мочевой системы (императивные позывы или частота).
Диагностика на ранней стадии связана с улучшенным прогнозом.
Женщины с раком яичников обычно сообщали о нескольких других симптомах. Эти симптомы включают в себя утомляемость, расстройство пищеварения, позвоночную боль, боль при половом контакте, запор и нарушение менструального цикла. Однако эти другие симптомы не применимы при распознавании рака яичников, поскольку их также обнаруживают с одинаковой частотой у женщин из основной популяции, у которых нет рака яичников.
Рак яичников на его ранних стадиях (I/II) трудно диагностировать, пока он не распространится и не перейдет на более поздние стадии (III/IV). Это происходит вследствие того, что большинство обычных симптомов являются неспецифичными.
Рак яичников имеет неблагоприятный прогноз. Он непропорционально летален, поскольку симптомы смазаны и неспецифичны, таким образом диагностирование запаздывает. Более чем у 60% пациентов, страдающих этим раком, уже имеет место рак III стадии или IV стадии, когда он уже распространился за пределы яичников.
Из видов рака яичников, которые являются злокачественными, клетки отслаиваются в естественную жидкость в брюшной полости. Эти клетки могут имплантироваться в другие брюшные (перитонеальные) структуры, включающие в себя матку, мочевой пузырь, кишечник, выстилку стенок кишечника (сальник) и даже может распространиться в легкие. Эти клетки могут начать формировать новый опухолевый рост прежде, чем даже начнут подозревать наличие рака.
Более чем 50% женщинам с раком яичников диагноз ставят на поздних стадиях заболевания, поскольку не существует экономичного по стоимости скрининг-теста в отношении рака яичников. Пятилетняя выживаемость для всех стадий составляет только от 35% до 38%. Если, тем не менее, диагноз поставили на ранней стадии заболевания, пятилетняя выживаемость может достигать от 90% до 98%.
Таким образом, было бы полезно обладать способом анализа нарушений, связанных с раком яичников, а также способом выявления рака яичников у пациента.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении описан способ анализа нарушений, связанных с раком яичников, включающий определение в панели последовательностей ДНК геномного статуса метилирования одного или нескольких CpG-динуклеотидов в каждой последовательности, где последовательности ДНК выбраны из группы SEQ ID NO:1-91 и в особенности из группы последовательностей согласно SEQ ID NO:1-10 и/или SEQ ID NO:50-60.
Изучаемые области обозначены в таблице 1A и таблице 1B («начало» и «конец»).
CpG-островки представляют собой области, где присутствует большое количество цитозина и гуанина, расположенных рядом друг с другом в основной цепи ДНК (то есть связаны фосфодиэфирными связями). Они расположены в промоторах или поблизости приблизительно 40% промоторов генов млекопитающих (приблизительно в 70% промоторов человека). «p» в условном обозначении CpG обозначает фосфодиэфирную связь между цитозином и гуанином.
Размер CpG-островка обычно составляет 100-3000 нуклеотидных пар. Эти области характеризуются содержанием CpG-динуклеотида равным или большим, чем статистически ожидалось бы (≈6%), тогда как у остальной части генома имеет место намного более низкая частота CpG (≈1%), явление, называемое супрессией CG. В отличие от CpG-участков в кодирующей области гена, в большинстве случаев, CpG-участки в CpG-островах промоторов неметилированны, если гены экспрессируются. Это наблюдение привело к предположению, что метилирование CpG-участков в промоторе гена может блокировать экспрессию гена. Метилирование является основным для импринтинга наряду с модификациями гистонов. Обычным формальным определением CpG-островка является область по меньшей мере из 200 н.п. и с процентным содержанием CG, которое больше 50%, и с соотношением наблюдаемых/ожидаемых CpG, которое больше 0,6.
В настоящем изобретении CpG-динуклеотид представляет собой CpG-динуклеотид, который можно обнаружить в метилированном и неметилированном состоянии in vivo, в частности, у человека.
Изобретение относится к способу, где первичное злокачественное новообразование выявляют, используя паттерн метилирования одной или нескольких описываемых в настоящем документе последовательностей, и также, где полученный паттерн метилирования используют для предсказания терапевтического ответа при лечении рака яичников.
В настоящем изобретении под пациентом понимают всех лиц, пациентов, животных, безотносительно того, проявляются ли у них или нет патологические изменения. В толковании по изобретению любой образец, полученный из клеток, тканей, органов, организмов или тому подобного, может представлять собой образец пациента, которому необходимо поставить диагноз. В предпочтительном варианте осуществления пациент по изобретению является человеком. В дополнительном предпочтительном варианте осуществления изобретения пациент является человеком, у которого, как полагают, имеет место заболевание, выбранное из группы первичного рака яичников, вторичного рака яичников, поверхностной эпителиально-стромальной опухоли, опухоли стромы полового тяжа яичников, герминогенной опухоли.
Способ предназначен для применения при усовершенствованной диагностике, лечении и отслеживании пролиферативных нарушений в клетках яичника, например, обеспечивая улучшенную идентификацию и дифференцирование между подклассами указанного нарушения и генетической предрасположенности к указанным нарушениям. Изобретение представляет собой усовершенствования существующего уровня техники, в котором оно обеспечивает высокоспецифичную классификацию пролиферативных нарушений в клетках яичника, таким образом позволяя проводить усовершенствованное и информированное лечение пациентов.
В настоящем изобретении заявленные последовательности также охватывают последовательности, которые обратно комплементарны обозначенным последовательностям.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
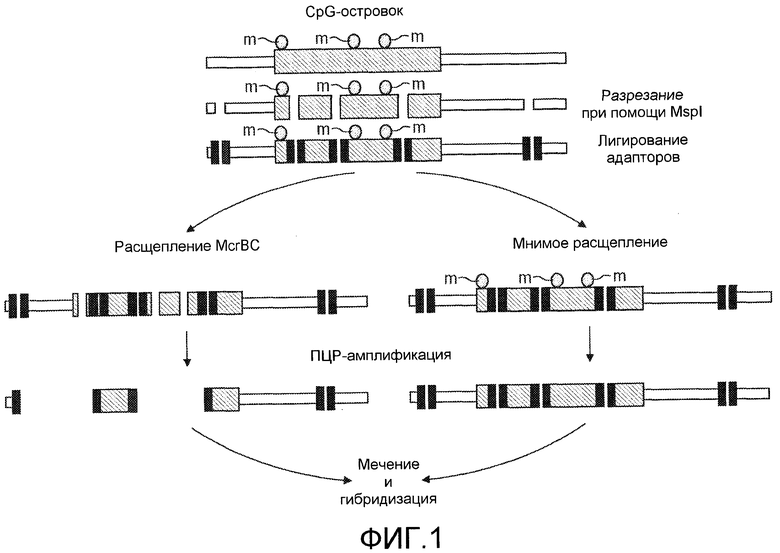
На фиг.1 показан способ определения дифференциально метилированных областей генома. Этот способ более подробно описан в примерах.
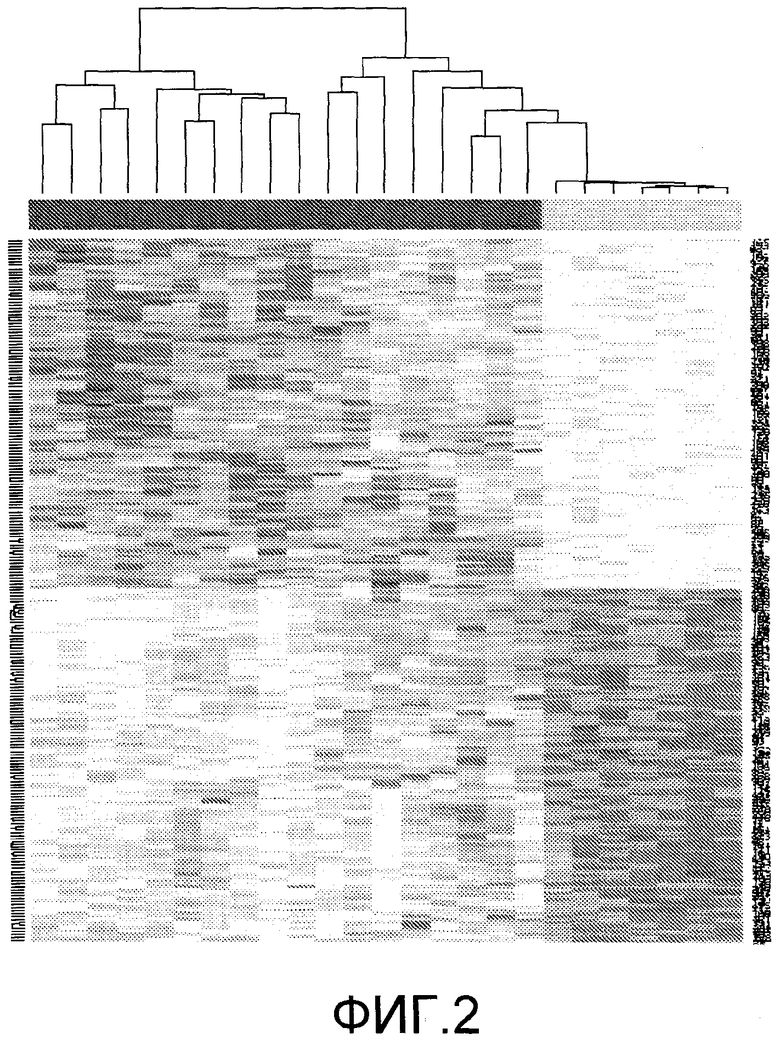
На фиг.2 показаны разделенные на кластеры образцы (колонки) в зависимости от локусов метилирования (строки). Характерные признаки метилирования могут отличаться между опухолями (левая часть шкалы сверху) и нормальной тканью (правая часть шкалы сверху).
На фиг.3 показана кластеризация образцов яичника на основании характеристик метилирования. Неконтролируемая кластеризация может отличать нормальные и опухолевые образцы.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Авторы изобретения неожиданно обнаружили, что небольшую подборку последовательностей ДНК можно использовать для анализа нарушений, связанных с раком яичников. Это осуществили, определяя геномный статус метилирования одного или нескольких CpG-динуклеотидов в любой из последовательностей, описываемых в настоящем документе, или ее обратно комплементарной последовательности. Идентифицировали всего приблизительно 900 последовательностей, которые подходят для такого анализа. Оказалось, что 91 последовательность особенно подходят.
На основе только 10 последовательностей, таких как первые десять из таблицы 1A или B (p-значение 0,0001), возможно достичь точности классификации 94%. Последовательности можно обнаружить в генах, как можно увидеть в таблице 1A ниже.
Последовательности можно также обнаружить в межгенных областях, как можно увидеть в таблице 1В ниже.
Гены, которые образуют основу настоящего изобретения, необходимо предпочтительно использовать для создания «панели генов», то есть коллекции, включающей определенные генетические последовательности по настоящему изобретению и/или их соответствующие информативные участки метилирования. Создание панели генов позволит проводить быстрый и специфичный анализ определенных аспектов рака яичника. Панель(и) генов, как описано и используется в изобретении, можно использовать с удивительно высокой производительностью для диагностики, лечения и отслеживания и также анализа предрасположенности к пролиферативным нарушениям в клетках яичника, в особенности, тем не менее, для выявления опухоли яичника.
Кроме того, применение множества CpG-участков из различных чипов генов предусматривают относительно высокую степень чувствительности и специфичности по сравнению со средствами диагностики и выявления и отдельного гена.
Изобретение относится к способу анализа нарушений, связанных с раком яичников, включающему определение в панели по меньшей мере из четырех последовательностей ДНК геномного статуса метилирования одного или нескольких CpG-динуклеотидов в каждой последовательности, выбранной из группы последовательностей согласно SEQ ID NO:1-10 и/или SEQ ID NO:50-60.
В одном из вариантов осуществления предпочтительно, что статус метилирования определяют по меньшей мере в четырех последовательностях согласно SEQ ID NO:1-91, где последовательности характеризуются p-значением, которое меньше 0,0001, как указано в таблице 1A или 1B.
Статус метилирования CpG-островков указывает на рак яичников. Предпочтительно, тем не менее, статус метилирования определяют для каждого CpG и определяют дифференциальный паттерн метилирования, поскольку не все CpG-островки обязательно должны быть метилированы.
В одном из вариантов осуществления способа по изобретению анализ представляет собой выявление рака яичников у пациента и где осуществляют следующие ниже стадии: (a) получение образца у пациента, который необходимо проанализировать, (b) определение в панели по меньшей мере из четырех последовательностей ДНК статуса метилирования одного или нескольких CpG-динуклеотидов в каждой последовательности, выбранной из группы последовательностей согласно SEQ ID NO:1-10 и/или SEQ ID NO:50-60.
Необязательно, осуществляют дополнительные следующие ниже стадии: (a) один или несколько результатов из анализа статуса метилирования является входными данными для классификатора, который получают из многомерной диагностической модели, (b) вычисляют вероятность того, происходит ли образец от нормальной ткани или из ткани рака яичника и/или (c) вычисляют соответствующее p-значение для достоверности предсказания.
Например, авторы изобретения используют классификатор на основе метода опорных векторов для «обучения» в отношении важных отличительных признаков для опухолевого или нормального образца основываясь на предварительно определенной выборке тканей пациента. В настоящее время алгоритм выдает в результате классификатор (уравнение, в котором переменными являются степени метилирования из выборки используемых отличительных признаков). Степени метилирования в образцах от новых пациентов затем вводят в классификатор. Результат может представлять собой 1 или 0. Расстояние от минимального уровня используют для определения p-значения.
Предпочтительно, что дополнительно геномный статус метилирования определяют для одной или нескольких последовательностей ДНК, выбранных из группы последовательностей согласно SEQ ID NO:11-49 и/или SEQ ID NO:61-91.
В одном из вариантов осуществления статус метилирования ДНК определяют по меньшей мере для десяти последовательностей, двадцати последовательностей, тридцати последовательностей, сорока последовательностей или более сорока последовательностей из последовательностей согласно SEQ ID NO:1-91. Особенно предпочтительно, что статус метилирования определяют для всех последовательностей согласно SEQ ID NO:1-91.
В одном из вариантов осуществления статус метилирования ДНК определяют для последовательностей согласно SEQ ID NO:1-10 и SEQ ID NO:50-60. По существу, изобретение также относится к определению статуса метилирования только в одной из последовательностей согласно SEQ ID NO:1-91.
Существует большое количество способов для определения статуса метилирования молекулы ДНК. Предпочтительно, что статус метилирования определяют при помощи одного или нескольких способов, выбранных из группы бисульфитного секвенирования, пиросеквенирования, чувствительного к метилированию конформационного анализа однонитевой ДНК (MS-SSCA), высокоточного анализа кинетики плавления (HRM), чувствительной к метилированию однонуклеотидной достройки праймера (MS-SnuPE), специфичного для основания расщепления/MALDI-TOF, специфичной к метилированию ПЦР (MSP), основанных на микрочипах способов, расщепления MspI. Общее представление о дополнительных известных способах выявления 5-метилцитозина можно получить из обзорной статьи: Rein, T., DePamphilis, M. L., Zorbas, H., Nucleic Acids Res. 1998, 26, 2255. Дополнительные способы описаны в способы US 2006/0292564A1.
В предпочтительном варианте осуществления статус метилирования определяют посредством расщепления MspI, лигирования адапторов, расщепления McrBC, ПЦР-амплификации, мечения и последующей гибридизации.
Предпочтительно, что образец, который необходимо проанализировать, происходит из типа ткани, выбранной из группы тканей, таких как биопсия ткани из анализируемой ткани, вагинальная ткань, язык, поджелудочная железа, печень, селезенка, яичник, мышцы, соединительная ткань, нервная ткань, ткань желудочно-кишечного тракта, опухолевая ткань, биологические жидкости, кровь, сыворотка, слюна и моча.
В предпочтительном варианте осуществления определяют первичный рак яичника.
В одном из вариантов осуществления способа по изобретению получаемый паттерн метилирования применяют для предсказания терапевтического ответа при лечении рака яичников.
Изобретение относится к зондам, таким как олигонуклеотиды, которые находятся в области перед CpG-участками. Олигомеры по настоящему изобретению обычно применяют в так называемых «наборах», которые содержат по меньшей мере один олигонуклеотид для каждого из CpG-динуклеотидов в последовательностях SEQ ID NO:1-91 включительно или по меньшей мере для 10, предпочтительно, 20, более предпочтительно, 30 и наиболее предпочтительно для более 50 указанных последовательностей. Изобретение также относится к обратно комплементарной последовательности олигонуклеотидов, которые находятся в области CpG-участков.
Зонды, которые используют для такого анализа, определяют на основе одного или нескольких из следующих ниже критериев: (1) последовательность зонда встречается только один раз в геноме человека; (2) содержание в зонде нуклеотидов C/G находится в диапазоне от 30% до 70%; (3) характеристики плавления гибридизация и другие критерии соответствуют Mei R et al, Proc Natl Acad Sci US A. 2003 Sep 30; 100(20):11237-42.
В самом предпочтительном варианте осуществления ссылка относится к набору олигонуклеотидов, которые специфичны для последовательностей согласно SEQ ID NO:1-10 и/или SEQ ID NO:50-60. Олигонуклеотид по изобретению может быть специфичен для последовательности, которая встречается in vivo, или он может быть специфичен для последовательности, которую обрабатывали бисульфитом. Такой зонд содержит от 10 до 80 нуклеотидов в длину, более предпочтительно, от 15 до 40 нуклеотидов в длину.
В случае наборов олигонуклеотидов по настоящему изобретению, предпочтительно, что по меньшей мере один олигонуклеотид связан с твердой фазой. Дополнительно предпочтительно, что все олигонуклеотиды из одного набора(ряда) связаны с твердой фазой.
Настоящее изобретение дополнительно относится к набору по меньшей мере из 10 зондов (олигонуклеотиды и/или PNA-олигомеры), используемых для определения метилированного состояния цитозина геномной ДНК посредством анализа указанной последовательности или обработанных вариантов указанной последовательности (согласно последовательностям SEQ ID NO:1-91 включительно и комплементарных им последовательностям).
Эти зонды позволяют проводить усовершенствованное выявление, диагностику, лечение и отслеживание пролиферативных нарушений в клетках яичника.
Набор олигонуклеотидов также можно использовать для определения однонуклеотидных полиморфизмов (SNP) посредством анализа указанной последовательности или обработанного варианта указанной последовательности согласно одной из последовательностей SEQ ID NO:1-91 включительно.
По настоящему изобретению, предпочтительно, что множество различных олигонуклеотидов и/или PNA-олигомеров (так называемый «чип»), предлагаемых настоящим изобретением, представлено таким способом, что они также связаны с твердой фазой.
Этот чип с различными олигонуклеотидными и/или PNA-олигомерными последовательностями может отличаться тем, что он размещен на твердой фазе в виде прямоугольной или шестиугольной решетки. Поверхность твердой фазы предпочтительно состоит из кремния, стекла, полистирола, алюминия, стали, железа, меди, никеля, серебра или золота. Тем не менее, нитроцеллюлоза, а также пластмассы, такие как нейлон, который может находиться в виде шариков, или также матрицы из смолы, являются подходящими альтернативами.
Следовательно, дополнительный объект по настоящему изобретению представляет собой способ промышленного получения чипа, присоединенного к материалу носителя, для усовершенствованного выявления, диагностики, лечения и отслеживания пролиферативных нарушений в клетках яичника и/или выявления предрасположенности к пролиферативным нарушениям в клетках яичника. В указанном способе по меньшей мере один олигонуклеотид по настоящему изобретению присоединен к твердой фазе. Известны, например, из патента США № 5744305 способы промышленного производства таких чипов посредством твердофазной химии и светочувствительных защитных групп. Дополнительный объект настоящего изобретения относится к ДНК-чипу для усовершенствованного выявления диагностики, лечения и отслеживания пролиферативных нарушений в клетках яичника. Более того, ДНК-чип позволяет выявить предрасположенность к пролиферативным нарушениям в клетках яичника.
ДНК-чип содержит по меньшей мере одну нуклеиновую кислоту и/или олигонуклеотид по настоящему изобретению. ДНК-чипы известны, например, в патенте США № 5837832.
Изобретение также относится к композиции или чипу, содержащему нуклеиновые кислоты с последовательностями, которые идентичны по меньшей мере 10 из последовательностей согласно SEQ ID NO:1-91, где композиция или чип содержит не более 100 различных молекул нуклеиновой кислоты.
Настоящее изобретение относится к композиции или чипу, содержащему по меньшей мере 5 последовательностей с совокупным p-значением менее 0,001, предпочтительно, менее 0,0001.
Кроме того, объектом по настоящему изобретению является набор, который можно составить, например, из содержащих бисульфит реагентов, ряда олигонуклеотидов праймеров, содержащих по меньшей мере два олигонуклеотида, чьи последовательности в каждом случае соответствуют или комплементарны сегменту длиной по меньшей мере 15 оснований из последовательностей оснований, определенных в последовательности SEQ ID NO:1-91. Предпочтительно, что праймеры представляют собой последовательности SEQ ID NO:1-10 включительно и/или последовательности SEQ ID NO:50-60 включительно.
ПРИМЕРЫ
ОБРАЗЦЫ
Образцы от пациентов получали из Norwegian Radium Hospital в Осло, Норвегия и согласие пациентов получали в соответствии с законодательными требованиями.
CPG-ОСТРОВКИ
Аннотированные CpG-островки получили из программного средства для просмотра генома UCSC. Эти островки предсказали, используя опубликованное определение Гардинер-Гардена (Gardiner- Garden, M. and M. Frommer (1987). "CpG islands in vertebrate genomes". J MoI Biol 196(2): 261-82), применяя следующие ниже критерии: длина ≥200 н.п., %GC≥50%, наблюдаемое/ожидаемое количество CpG≥0,6. В геноме существует ~26219 CpG-островков в диапазоне от 200 н.п. до 2000 н.п. Эти островки хорошо покрываются при рестрикционной фрагментации Msp I.
Чипы производились Nimblegen Systems Inc, используя формат 390K со следующей ниже спецификацией. Аннотацию для CpG-островка из генома человека сборки 33 (hgl7) использовали для конструирования чипа с мозаичным размещением 50-меров. 50-меры смещали в обе стороны относительно координат последовательности островка для того, чтобы равномерно распределить островок. Формат 390K обладает 367658 доступными элементами, которые бы не охватили все островки при мозаичном размещении 50-меров. Поэтому авторы изобретения, исходя из размера, сократили островки, которые будут предоставлены так, что будут анализировать только CpG-островки размером 200-2000 н. Контрольные зонды конструировали для отражения фонового сигнала. Приготовление образца: способ был описан ранее (Lucito, R., J. Healy, et al. (2003). "Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation". Genome Res 13(10): 2291-305.) со следующими ниже изменениями. Основной используемой рестрикционной эндонуклеазой является MspI. После расщепления лигировали следующие ниже линкеры (MspI24-мер и MSPI12-мер). 12-мер нефосфорилирован и его не лигируют. После лигирования продукт очищают фенолом, хлороформом, осаждают, центрифугируют и ресуспендируют. Продукт разделяют на две половины, причем половину расщепляют эндонуклеазой McrBC и для другой половины проводят мнимое расщепление. Четыре пробирки объемом 250 мкл использовали для каждой пары образца для амплификации каждого материала в объеме реакции 100 мкл. Условия в цикле представляли собой 95°C в течение 1 мин, 72°C в течение 3 мин, в течение 15 циклов, после чего следовало удлинение в течение 10 мин при 72°C. Содержание пробирок для каждой пары объединяли, как только заканчивали. Материалы очищали экстракцией в смеси фенол:хлороформ, осаждали, ресуспендировали и определяли концентрацию. ДНК метили, как описано, с небольшими изменениями (Lucito, R., J. Healy, et al. (2003). "Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation". Genome Res 13(10): 2291-305). В кратком изложении, 2 мкг матричной ДНК помещали (растворенной в TE при pH 8) в пробирки для ПЦР объемом 0,2 мл. Добавляли 5 мкл случайных нонамеров (Sigma Genosys), доводили до объема 25 мкл при помощи dH2O и перемешивали. Пробирки помещали в Tetrad при 100°C в течение 5 мин, затем на лед в течение 5 мин. К данной смеси добавляли 5 мкл NEB буфера 2, 5 мкл dNTP (0,6 нМ dCTP, 1,2 нМ dATP, dTTP, dGTP), 5 мкл метки (Cy3-dCTP или Cy5-dCTP) от GE Healthcare, 2 мкл NEB фрагмента Кленова и 2 мкл dH2O. Процедуры гибридизации и отмывки проводили, как описано ранее (Lucito, R., J. Healy, et al. (2003). "Representational oligonucleotide microarray analysis: a high-resolution method to detect genome copy number variation." Genome Res 13(10): 2291-305) за исключением того, что температуру в печи при гибридизации увеличивали до 50°C. Чипы сканировали при помощи сканера Axon GenePix 4000B с размером пикселя 5 мкм. Программное обеспечение GenePix Pro 4,0 использовали для количественного определения интенсивности на чипах. Данные с чипов импортировали в S-PLUS для дальнейшего анализа.
АНАЛИЗ ДАННЫХ
Изображения микрочипов сканировали на сканере GenePix 4000B и данные экстрагировали, используя программное обеспечение Nimblescan (Nimblegen Systems Inc). Для каждого зонда вычисляли геометрическое среднее для соотношений (GeoMeanRatio) обработанных McrBc и контрольных образцов для каждого эксперимента и ассоциированных с ними изменений окрашивания. GeoMeanRatios для всех образцов в выборке затем нормализовали, используя способ квантильной нормализации (Bolstad, B. M., R. A. Irizarry, et al. (2003). "A comparison of normalization methods for high density oligonucleotide array data based on variance and bias" Bioinformatics 19(2): 185-93). Нормализованные соотношения для каждого эксперимента затем сжимали для того, чтобы получить одно значение для всех зондов в каждом фрагменте MspI, используя модель медианного сглаживания. Сжатые данные затем использовали для дальнейшего анализа.
Дисперсионный анализ применяли для идентификации наиболее значимых островков. Для того чтобы определить наиболее постоянно встречающиеся изменения при метилировании между опухолевыми и нормальными образцами, авторы изобретения применяли подход с критерием Стьюдента. Используя отсечение по p-значению 0,001 после коррекции при множественном тестировании (вероятность обнаружения ложной зависимости, Benjamini и Hotchberg (Benjamini 1995)), авторы изобретения получили список из 916 MspI-фрагментов, для которых показано дифференциальное метилирование.
Обучение с учителем: Авторы изобретения использовали классификатор на основе машинного обучения с учителем для определения количества признаков, необходимых для того, чтобы отличить опухолевые образцы от нормальных образцов. Общедоступную библиотеку метода опорных векторов (SVM) (LibSVM Ver 2,8) использовали для получения точности классификации, применяя способ исключения по одному (Lin, C.J. and Chang C.C. (2001). LIBSVM: a library for support vector machines). Отличительные признаки метилирования для классификации первоначально выбирали, используя критерий Стьюдента среди одних только данных режима обучения. Затем SVM обучали на лучших 10, 50 и 100 отличительных признаках, используя ядрорадиальную базисную функцию (RBF).
Для N образцов критерий Стьюдента определяли для (N-1) образцов, чтобы определить фрагменты со значимыми различиями по степени метилирования. Для выборки по яичникам данную процедуру проводили 18 раз для всех 18 образцов из яичников, так что каждый образец исключали один раз при вычислениях критерия Стьюдента. Степени метилирования для 10 лучших отличительных признаков для фрагментов из (N-1) образцов затем использовали для обучения SVM и степень метилирования для одного не участвующего в обучении образца использовали для тестирования. На основе только лишь 10 признаков авторы изобретения смогли достичь точности классификации 94%. Примечательно, что два опухолевых образца, которые были классифицированы как нормальные в этом анализе, были также наиболее похожи на нормальные как при анализе экспрессии генов, так и ROMA-анализе.
ВЫЯВЛЕНИЕ МЕТИЛИРОВАННЫХ УЧАСТКОВ
В предпочтительном варианте осуществления способ включает в себя следующие ниже стадии: на первой стадии способа необходимо выделить геномную ДНК образца из исходных материалов, таких как клеточные линии, образцы ткани или крови. Выделение ДНК можно проводить при помощи способов, которые являются стандартными для специалиста в данной области, они включают в себя применение лизатов после обработки детергентом, озвучивание и встряхивание со стеклянными шариками. Сразу же после выделения нуклеиновых кислот геномную двухцепочечную ДНК используют для анализа.
В предпочтительном варианте осуществления ДНК можно расщепить до следующей стадии способа, эту процедуру можно проводить при помощи способов, которые являются стандартными в данной области, в частности, но не ограничиваясь этим, при помощи рестрикционных эндонуклеаз.
На второй стадии способа образец геномной ДНК обрабатывают таким образом, что цитозиновые основания, которые неметилированы в 5'-положении, превращают в урацил, тимин или другое основание, которое не похоже на цитозин в отношении свойств гибридизации. Далее в настоящем документе это будут понимать как «предварительную обработку».
Описанную выше обработку геномной ДНК предпочтительно осуществляют при помощи бисульфита (сульфита, дисульфита) и последующего щелочного гидролиза, который приводит к превращению неметилированных цитозиновых нуклеиновых оснований в урацил или в другое основание, которое не похоже на цитозин в отношении изменения свойств основания. Если для реакции используют раствор бисульфита, то имеет место присоединение к неметилированным цитозиновым основаниям. Кроме того, может присутствовать денатурирующий реагент или растворитель, а также улавливатель радикалов. Последующий щелочной гидролиз затем обуславливает превращение неметилированных цитозиновых нуклеиновых оснований в урацил. Измененную ДНК затем используют для выявления метилированных цитозинов.
Фрагменты амплифицируют. Из-за статистических и практических факторов, которые необходимо учитывать, предпочтительно амплифицируют более десяти различных фрагментов, имеющих 100-2000 нуклеотидных пар в длину. Амплификацию нескольких сегментов ДНК можно проводить одновременно в одном и том же сосуде для реакции. Обычно, амплификацию проводят посредством полимеразной цепной реакции (ПЦР). Конструирование таких праймеров очевидно для специалиста в данной области. Следует включить по меньшей мере два олигонуклеотида, последовательности каждого из которых обратно комплементарны или идентичны по меньшей мере сегменту длиной 15 нуклеотидных пар основной последовательности, определенной в приложении (SEQ ID NO:1-91 включительно). Указанные олигонуклеотиды праймеров предпочтительно отличаются тем, что они не содержат никаких CpG-динуклеотидов. В особенно предпочтительном варианте осуществления способа последовательности указанных олигонуклеотидов праймеров сконструированы так, чтобы выборочно отжечь и амплифицировать только интересующую ДНК, специфичную для клеток яичника, таким образом сводя к минимуму амплификацию фоновой или не имеющей значение ДНК. В контексте настоящего изобретения под фоновой ДНК подразумевают геномную ДНК, которая не имеет соответствующего тканеспецифического паттерна метилирования, причем в данном случае соответствующей тканью являются клетки яичника как здоровые, так и нездоровые.
По настоящему изобретению предпочтительно, что по меньшей мере один олигонуклеотид праймера связан с твердой фазой во время амплификации. Различные олигонуклеотидные и/или PNA-олигомерные последовательности можно разместить на плоской поверхности твердой фазы в виде прямоугольной или шестиугольной решетки, причем поверхность твердой фазы предпочтительно состоит из кремния, стекла, полистирола, алюминия, стали, железа, меди, никеля, серебра или золота, также возможно использование других материалов, таких как нитроцеллюлоза или пластмассы. Фрагменты, полученные посредством амплификации, могут содержать метку, обнаруживаемую прямыми или косвенными способами. Предпочтительными являются метки в виде флуоресцентных меток, радионуклидов или отщепляемых фрагментов молекул, обладающих типичной массой, которую можно детектировать в масс-спектрометре, причем предпочтительно, что фрагменты, которые получаются, несут единичный положительный или отрицательный суммарный заряд для лучшего определения в масс-спектрометре. Определение можно осуществить и визуализировать при помощи масс-спектрометрии с лазерной ионизацией и десорбцией в присутствии матрицы (MALDI) или используя масс-спектрометрию с распылением электронов (ESI).
На следующей стадии ампликоны нуклеиновых кислот анализируют для того, чтобы определить статус метилирования геномной ДНК до обработки.
Анализ нуклеиновых кислот после обработки можно проводить, используя альтернативные способы. Известно несколько способов для специфичного в отношении статуса метилирования анализа обработанных нуклеиновых кислот, другие альтернативные способы станут очевидны специалисту в данной области.
Используя несколько известных в данной области способов, анализ можно провести во время стадии амплификации данного способа. В одном таком варианте осуществления статус метилирования предварительно выбранных положений CpG в нуклеиновых кислотах, содержащих SEQ ID NO:1-91 включительно, можно определить, используя специфичные для метилирования олигонуклеотиды праймера. Данная технология описана в патенте США № 6265171.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АНАЛИЗА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2492243C2 |
| Способы скрининга рака | 2012 |
|
RU2700088C2 |
| ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ | 2012 |
|
RU2614254C2 |
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2770928C1 |
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2775177C1 |
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для выявления эпигенетических маркеров рака шейки матки | 2021 |
|
RU2760573C1 |
| Способ определения метилирования сайтов PuCGPy регуляторных областей генов-онкомаркеров колоректального рака методом GLAD-ПЦР-анализа и набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для осуществления указанного способа | 2016 |
|
RU2630669C1 |
| СПОСОБ IN VITRO ДИАГНОСТИКИ ИЛИ ПРОГНОЗИРОВАНИЯ КОЛОРЕКТАЛЬНОГО РАКА ИЛИ ЕГО ПРЕДРАКОВОЙ СТАДИИ | 2020 |
|
RU2831090C2 |
| СПОСОБ ОБНАРУЖЕНИЯ МЕТИЛИРОВАНИЯ ЦИТОЗИНА В ОБРАЗЦАХ ДНК | 2002 |
|
RU2332462C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2000 |
|
RU2245149C2 |





























Изобретение относится к области генной инженерии, конкретно к анализу нарушений, связанных с раком яичников, и может быть использовано в медицине. Способ включает определение геномного статуса метилирования CpG-динуклеотидов в каждой последовательности из группы последовательностей SEQ ID NO:1-10 с использованием набора зондов, специфичных для указанных последовательностей и способных гибридизоваться с последовательностью по всей длине. Указанные последовательности используются в составе чипа для детекции, диагностики или мониторинга пролиферативных нарушений, связанных с пролиферацией клеток яичника, а также для детекции предрасположенности к пролиферативным нарушениям или лечения пролиферативных нарушений яичника. Изобретение позволяет проводить идентификацию пролиферативных нарушений в клетках яичника и выявлять генетическую предрасположенность к указанным нарушениям. 4 н. и 6 з.п. ф-лы, 3 ил., 2 табл., 1 пр.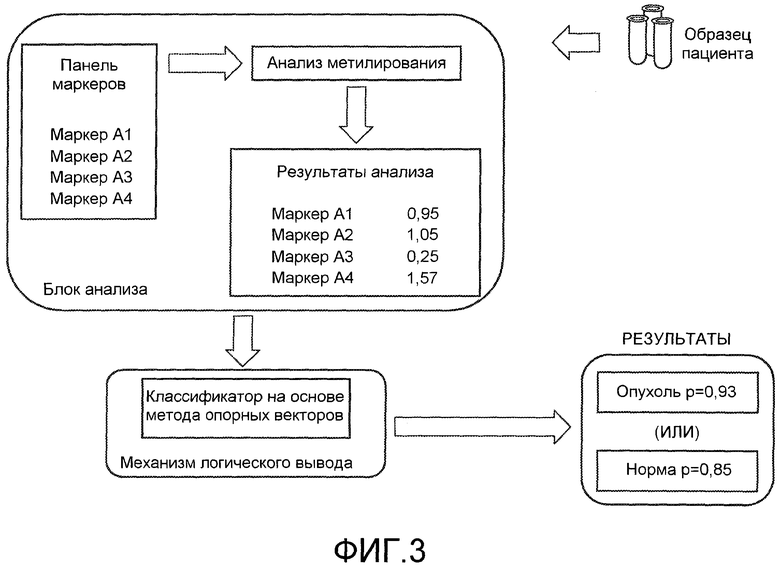
1. Способ анализа нарушений, связанных с раком яичников, включающий определение геномного статуса метилирования CpG-динуклеотидов, отличающийся тем, что определяют геномный статус метилирования CpG-динуклеотидов в каждой последовательности из группы последовательностей SEQ ID NO:1-10.
2. Способ по п.1, дополнительно включающий получение образца ткани яичника или образца вагинальной ткани у пациента, который необходимо проанализировать.
3. Способ по п.1, дополнительно включающий определение геномного статуса метилирования одного или нескольких CpG-динуклеотидов в одной или нескольких последовательностях ДНК, выбранной из группы последовательностей согласно SEQ ID NO:11-49 и/или SEQ ID NO:61-100.
4. Способ по п.1, где геномный статус метилирования определяют для панели последовательностей согласно SEQ ID NO:1-10.
5. Способ по п.1, где геномный статус метилирования определяют посредством одного или нескольких способов, выбранных из группы
(a) бисульфитного секвенирования,
(b) пиросеквенирования,
(c) чувствительного к метилированию конформационного анализа одноцепочечной ДНК (MS-SSCA),
(d) высокоточного анализа кинетики плавления (HRM),
(e) чувствительной к метилированию однонуклеотидной достройки праймера (MS-SnuPE),
(f) специфичного для основания расщепления/MALDI-TOF,
(g) специфичной к метилированию ПЦР (MSP),
(h) основанных на микрочипах способов и
(i) расщепления Msp I.
6. Способ по п.2, где рак яичника, подлежащий выявлениию, является первичным злокачественным новообразованием.
7. Способ по п.1, где полученный геномный паттерн метилирования используют для предсказания терапевтического ответа на лечение рака яичников.
8. Набор молекул зондов для определения метилированного состояния цитозина в геномной ДНК в способе анализа нарушений, связанных с раком яичников, где набор содержит молекулы зондов, специфичные для последовательности ДНК SEQ ID NO:1-10 и способные гибридизоваться по всей длине последовательности.
9. Чип для улучшенной детекции, диагностики или мониторинга пролиферативных нарушений, связанных с пролиферацией клеток яичника, и/или детекции предрасположенности к пролиферативным нарушениям, связанным с пролиферацией клеток яичника, содержащий молекулы нуклеиновых кислот с последовательностями, которые идентичны последовательностям ДНК согласно SEQ ID NO:1-10, причем чип содержит не более 100 различных молекул нуклеиновых кислот.
10. Чип для улучшенного лечения пролиферативных нарушений, связанных с пролиферацией клеток яичника, содержащий молекулы нуклеиновых кислот с последовательностями, которые идентичны последовательностям ДНК согласно SEQ ID NO:1-10, причем чип содержит не более 100 различных молекул нуклеиновых кислот.
| WEI S.H | |||
| et al., Prognostic Methylation Biomarkers in Ovarian Cancer, Clin | |||
| Cancer Res., 2006, v.12, n.9, p | |||
| Электрическое устройство для световой рекламы | 1925 |
|
SU2788A1 |
| US 20070087365 A1, 19.04.2007 | |||
| US 20070087358 A1, 19.04.2007 | |||
| WO 2005068664 A2, 28.07.2005 | |||
| МУТАЦИИ ГЕНА МТS В ЗАРОДЫШЕВОЙ ЛИНИИ И СПОСОБ ВЫЯВЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ЗЛОКАЧЕСТВЕННЫМ ОПУХОЛЯМ В ГЕНЕ МТS | 1995 |
|
RU2161309C2 |
Авторы
Даты
2014-04-10—Публикация
2008-09-16—Подача