Изобретение относится к области ветеринарии, в частности к ветеринарной диагностике. Способ позволяет обнаружить ДНК возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobacterium) в материале от рыб и из объектов окружающей среды, и может быть использован в научно-исследовательских учреждениях, региональных, областных ветеринарных лабораториях и службах санэпиднадзора.
В настоящее время в России в основе лабораторной диагностики возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobacterium) лежат культуральные методы исследования. При необходимости определения инфекционного агента с целью принятия немедленных противоэпизоотических мер, использование длительных и трудоемких методов не эффективно. Полимеразная цепная реакция (ПЦР) применяется в качестве ускоренного метода для детекции возбудителей.
За рубежом одним из наиболее перспективных методов диагностики вирусных и бактериальных заболеваний животных (в частности, рыб) при индикации их возбудителей широко используются ПЦР-анализ, основанный на выявлении ДНК возбудителя.
Известен способ оперативной детекции Aeromonas и Aeromonas hydrophila в двухраундовой ПЦР, при котором проводят выделение ДНК с использованием реакции ПЦР-амплификации и делают анализ продуктов ПЦР с применением набора реагентов. Способ позволяет осуществить быстрое обнаружение патогенов водных организмов [Патент 101736073 CN, МПК C12Q 1/04; C12Q 1/68. Rapid detection kit of Aeromonas and Aeromonas hydrophila by double PCR and detection method. / Заявка CN 20081122380; Заявл. 24.11.2008; Опубл.: 16.06.2010.] [1].
Недостатком этого способа и набора является то, что с их помощью осуществить мультиплексный анализ представителей родов Aeromonas и Flavobacterium невозможно. Применение известного способа к решаемой задаче замедляет процесс исследования материала.
Известен способ для определения ДНК Aeromonas caviae с использованием изотермической реакции амплификации и набор для его осуществления. Основная суть способа заключается в использовании техники изотермической реакции амплификации с четырьмя парами праймеров, высокоспецифичных к шести зонам ITS-11 региона [Патент 101235411 CN, МПК C12Q 1/04; C12Q 1/68. Kit for detecting guinea pig aeromonas by utilizing Loop-mediated isothermal amplification technique. / UNIV NANKAI [CN]. - Заявка CN 20081052321; Опубл.: 26.02.2008.] [2].
Известен способ обнаружения патогенных бактерий в воде и в рыбах и набор для определения ДНК Flavobacterium columnare, который включает пару специфичных праймеров для амплификации фрагмента ДНК Flavobacterium columnare [Патент 102010896 CN, МПК C12Q 1/68; C12R 1/20. Method for detecting pathogenic bacteria columnar flavobacterium of alepidote fish and detection kit. / TONGWEI CO LTD. Заявка CN CN 20101180832 Заявл. 05.05.2010; Опубл.: 13.04.2011.] [3].
Известные способы и наборы компонентов для их осуществления разработаны для детекции определенных видов бактерий. Узкая специфичность их не позволяет распространить известные решения на оперативное определение иных представителей родов Aeromonas и Flavobacterium - возбудителей инфекционных заболеваний рыб.
Задачей предлагаемого изобретения является создание высокоспецифичного, чувствительного, простого и быстрого в исполнении способа с соответствующим ему набором праймеров для детекции и идентификации представителей родов Aeromonas и Flavobacterium в материале от больных рыб и объектов окружающей среды, позволяющего одновременно выявить двух возбудителей бактериального язвенного синдрома рыб.
Техническим результатом заявляемого изобретения является сокращение сроков выявления возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobacterium), повышение качества диагностики для своевременного принятия соответствующих мер.
Технический результат достигается способом, при котором для индикации и идентификации возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobacterium) в материале от больных рыб и из объектов окружающей среды для постановки одноэтапной ПЦР выбраны и синтезированы две пары праймеров:
к участку гена малой субъединицы рРНК Aeromonas,
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
- А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
обеспечивающие амплификацию фрагмента размером 920 п.н. с температурой плавления 85,21±0,05°С;
к участку гена малой субъединицы рРНК Flavobacterium,
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3',
обеспечивающие образование фрагмента размером 242 п.н. с температурой плавления 81,23±0,50°С, с использованием термоциклеров с детекцией продуктов амплификации в режиме реального времени по программе: предварительная денатурация 95°С - 5 мин, 40 циклов 95°С - 15 с, 66°С - 60 с, с учетом результатов реакции по наличию или отсутствию специфических пиков амплифицированной ДНК при сравнении с контрольными образцами.
Способ осуществляют с использованием набора, включающего компоненты для проведения ПЦР, содержащего праймеры, специфичные к участкам гена малой субъединицы рибосомальной РНК (16S rRNA) представителей родов Aeromonas:
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
- А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
и Flavobacterium:
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3',
в концентрации А1-А2 4 пикомоль/мкл, F1-F2 20 пикомоль/мкл, а также положительные контрольные образцы:
на представителей Aeromonas - раствор ДНК плазмиды со вставкой целевого ампликона в концентрации 105 ГЭ/мкл,
на представителей Flavobacterium - раствор ДНК плазмиды со вставкой целевого ампликона в концентрации 105 ГЭ/мкл,
и отрицательный контрольный образец, представляющий собой H2O стерильную деионизованную, свободную от нуклеаз.
Обоснование выбора праймеров.
На основании представленных в базе данных NCBI GenBank нуклеотидных последовательностей выбранных генов, с помощью программы алгоритма BLAST подобранны олигонуклеотидные праймеры А1-А2 на фрагмент гена малой субъединицы рРНК представителей Aeromonas, а также праймеры F1-F2 фрагмент гена малой субъединицы рРНК представителей Flavobacterium.
Праймеры А1-А2 обеспечивают амплификацию фрагмента размером 920 п.н. с температурой плавления 85,21±0,05°С (Фиг.1, 3);
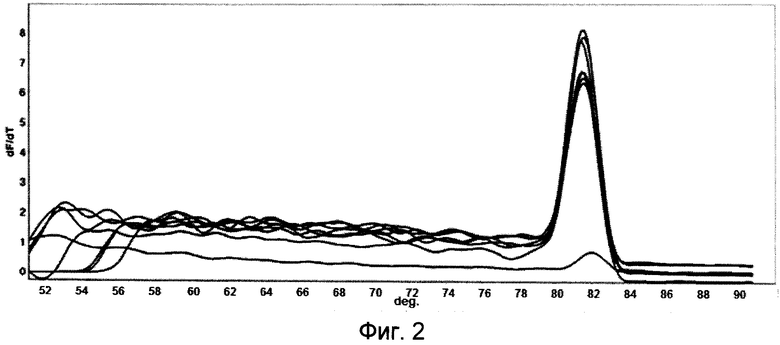
Праймеры F1-F2 обеспечивают образование фрагмента размером 242 п.н. с температурой плавления 81,23±0,50°С (Фиг.2, 3).
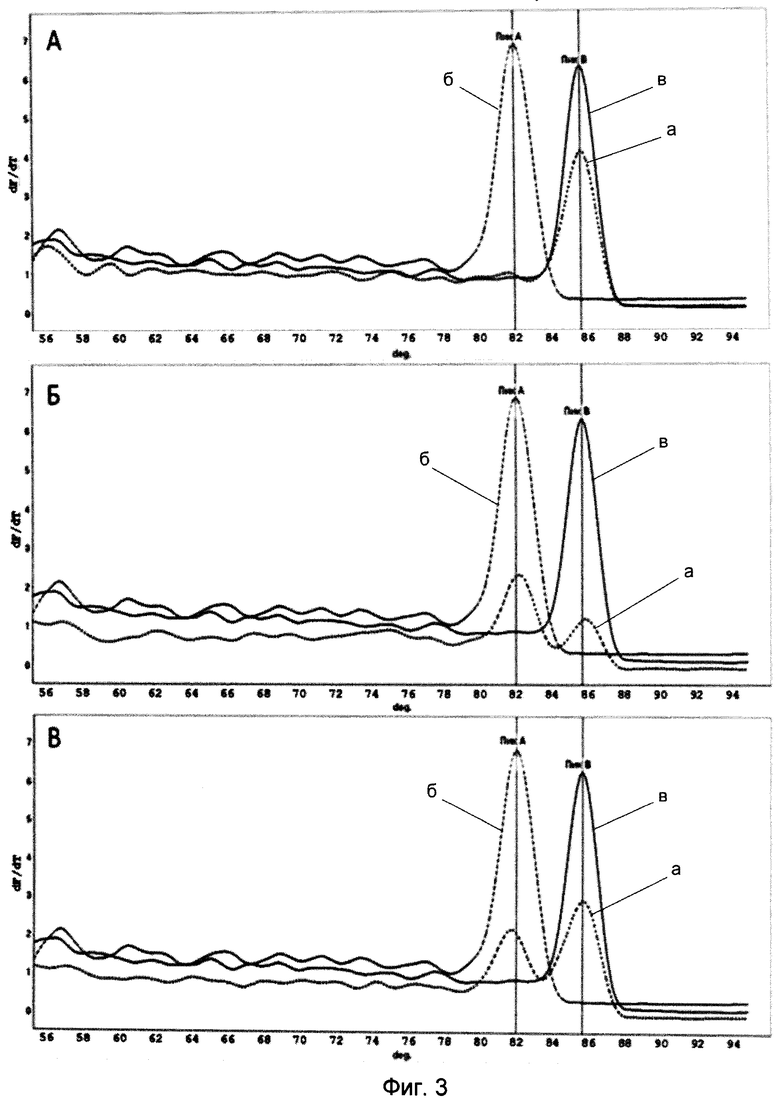
Экспериментально установлен оптимальный состав реакционной смеси для выполнения мультиплексной ПЦР. Концентрации праймеров в реакции варьировали от 0,2 до 2 пикомоль/мкл (Фиг.3). Подобранная концентрация праймеров: А1-А2 по 0,4 пикомоль/мкл, F1-F2 по 2,0 пикомоль/мкл, необходима и достаточна для обеспечения высокой специфичности и эффективности проведения реакции и позволяет получить легко детектируемые количества ампликонов (Фиг.3).
Экспериментальная оценка чувствительности и специфичности мультиплексной ПЦР проведена методом 10-кратных разведений следующих культур: Aeromonas salmonicida subsp. achromogenes, A. salmonicida subsp. salmonicida, A. salmonicida, A. punctate, A. sobria, A. media, A. veronii, A. ichthiosmia, Aeromonas sp., Flavobacterium branchiophilum, F. psychrophilum, F. columnare, Flavobacterium sp., Brevundimonas sp., Kaistobacter koreensis, Sphingomonas sp. и Methylobacterium brachiatum - Класс Альфапротеобактерии, Duganella sp., Janthinobacterium sp., Massilia timonae, Massilia sp., Hydrogenophaga sp. и Gulbenkiania mobilis - Класс Бетапротеобактерии, Pseudomonas putida, P. rhizosphaerae, P. fluorescens, P. fragi, P. aeruginosa, Pseudomonas sp., Acinetobacter Iwoffii, A.johnsonii, A. radioresistens, Acinetobacter sp., Psychrobacter faecalis, Psychrobactersp., Enhydrobactersp., Serratia grimesii, Serratia sp., Buttiauxella sp., Klebsiella sp., Escherichia hermannii, Stenotrophomonas sp., Vibrio sp. и Shewanella sp. - Класс Гаммапротеобактерии, Carnobacterium maltaromaticum, Enterococcus faecalis, Aerococcus sp., Lactococcus sp., Bacillus sp., Macrococcus caseolyticus, Staphylococcus warneri, S. vitulinus, S. succinus, Staphylococcus sp. и Exiguobacterium sp. - Фила Вирмикуты, Arthrobacter oxydans, Arthrobactersp., Rothia sp., Microbacterium sp., Rhodococcus erythropolis, Rhodococcus sp., Corynebactehum sp. и Dietzia sp. - Фила Актинобактерии, Chryseobacterium sp. - Фила Бактероидес.
В результате проведенной оценки установлено, что выбранные праймеры для мультиплексной детекции представителей Aeromonas и Flavobacterium
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
- А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3',
обладают высокой чувствительностью - 103 ГЭ/мл и специфичностью - 100%.
На Фиг.1 представлены графики детекции SybrGreen целевого ампликона на праймерах А1-А2 в препаратах ДНК, выделенных из идентифицированных штаммов аэромонад (85,21±0,05°С).
Фиг.2 показывает детекцию SybrGreen целевого ампликона на праймерах F1-F2 в препаратах ДНК, выделенных из идентифицированных штаммов флавобактерий (81,23±0,50°С).
На Фиг.3А, Б и В показана мультиплексная детекция аэромонад (А1-А2) и флавобактерий (F1-F2) в препарате ДНК из нативного образца при разной концентрации праймеров в реакционной смеси.
Фиг.3А - концентрация праймеров А1-А2 по 0,2 пикомоль/мкл; F1-F2 по 0,4 пикомоль/мкл;
Фиг.3Б - то же, А1-А2 по 0,2 пикомоль/мкл, F1-F2 по 0,8 пикомоль/мкл,
Фиг.3В - А1-А2 по 0,4 пикомоль/мкл, F1-F2 по 2,0 пикомоль/мкл.
Линия с мелким пунктиром (а) - мультиплексная детекция аэромонад и флавобактерий в препарате ДНК, выделенной из язвенных проявлений на внешних покровах карпа.
Линия с крупным пунктиром (б) отражает положительный контроль на флавобактерии (пик 81,23±0,50°С).
Сплошная линия (в) показывает положительный контроль на аэромонады (пик 85,21±0,05°С).
Осуществление заявляемого способа детекции представителей Aeromonas и Flavobacterium включает следующие этапы:
Этап 1. Проведение ПЦР-амплификации ДНК.
- В отдельной микропробирке на 1,5 мл готовят реакционную смесь, содержащую из расчета на одну реакцию в объеме 20 мкл: 2 мкл 10×ПЦР-буфера, 2 мкл 25 мМ раствора магния сульфата, 2 мкл 10×дНТФ-mix, 2 мкп готовой смеси праймеров А1/А2 и F1/F2 (концентрация 4 и 20 пикомоль/мкл, соответственно), 0,1 мкл 100×SybrGreen, H2O стерильная деионизованная свободная от нуклеаз 9,5 мкл, 0,4 мкл Taq ДНК-полимеразы (5 ед.акт./мкл). Смесь встряхивают на вортексе 3-5 сек и осаждают в микроцентрифуге 20 сек при 5000 об/мин.
- Одноразовые полипропиленовые микропробирки для ПЦР на 0,2 или кюветы 0,1 мл в количестве, соответствующем числу исследуемых проб, а также 2 для положительного и 1 для отрицательного контроля, маркируют и выставляют в штатив. Приготовленную реакционную смесь расфасовывают по пробиркам по 19 мкл.
- В пробирки в реакционную смесь вносят по 1 мкл ДНК из исследуемых проб, положительных контрольных образцов для Aeromonas и Flavobacterium и отрицательного контрольного образца (H2O стерильная деионизованная свободная от нуклеаз).
- Микропробирки переносят в термоциклер и проводят амплификацию по соответствующей программе для термоциклеров с регулировкой температуры по матрице: предварительная денатурация 95°С - 5 мин, 40 циклов 95°С - 15 сек, 66°С - 60 сек, детекцию флуоресценции ведут на канале Green в конце элонгации.
Время проведения ПЦР составляет 1 ч 50 мин.
Этап 2. Анализ результатов диагностики.
- Для детекции специфичного продукта амплифицированной ДНК после ПЦР проводят плавление в следующем режиме: повышение температуры от 45 до 99°С, увеличение на 0,5°С за один шаг, ждать 90 сек при температуре первого шага плавления, ждать 5 сек для каждого последующего шага, детекцию флуоресценции ведут на канале Green.
- В программном обеспечении термоциклера есть функция «Анализ данных». Провести анализ кривой плавления амплифицированной ДНК в виде графика первой производной изменения флуоресценции от температуры. Значения максимумов первых производных принимают за температуру плавления ампликонов.
- Учет результатов ПЦР-анализа проводят по наличию или отсутствию на кривой плавления специфических пиков амплифицированной ДНК по сравнению с контрольными образцами: праймеры А1-А2 обеспечивают образование фрагмента с температурой плавления 85,21±0,05°С (Фиг.1, 3); праймеры F1-F2 обеспечивают образование фрагмента с температурой плавления 81,23±0,50°С (Фиг.2, 3). Оценка полученных данных представлена на Фиг.1, 2, 3.
Время проведения анализа составляет 25 мин.
Пример конкретного выполнения.
Материалом для исследования служили соскобы из язвенных проявлений на внешних покровах карпа.
ДНК выделяли коммерческим набором ДНК-сорб (АмплиСенс, Москва) по протоколу производителя.
Амплификацию проводили на термоциклере Rotor Gene 2000 (Qiagen).
Для этого из морозильной камеры достали 10×ПЦР-буфер, 25 мМ раствор магния сульфата, 10×дНТФ-mix, готовую смесь праймеров А1/А2 и F1/F2 (концентрация 4 и 20 пикомоль/мкл, соответственно), 100×SybrGreen, N20 стерильная деионизованная свободная от нуклеаз. Все реагенты размораживали в холодных штативах, фермент Taq ДНК-полимеразу (5 ед.акт./мкл) выставили в штатив с хладагентом, поддерживающим температуру - 20°С.
В отдельной микропробирке на 1,5 мл приготовили реакционную смесь, из расчета на 4 реакции в объеме 20 мкл: 1 - для исследуемой пробы; 2 - для положительного и 1 - для отрицательного контроля. Для этого смешали 8 мкл 10×ПЦР-буфера, 8 мкл раствора 25 мМ раствора магния сульфата, 8 мкл 10×дНТФ-mix, 8 мкп готовой смеси праймеров А1/А2 и F1/F2 (концентрация 4 и 20 пикомоль/мкл, соответственно), 0,4 мкл 100×SybrGreen, H2O стерильная деионизованная свободная от нуклеаз - 44 мкл, 1,6 мкл Taq ДНК-полимеразы (5 ед.акт./мкл). Смесь встряхивали на вортексе 3-5 сек и осаждали в микроцентрифуге 20 сек при 5000 об/мин.
В холодный штатив выставили 4 одноразовых полипропиленовых кюветы для ПЦР объемом 0,1 мл, промаркировали. Приготовленную реакционную смесь расфасовывали по 19 мкл и внесли в 1 кюветы 1 мкл ДНК исследуемой пробы, в 2 - по 1 мкл ДНК положительных контрольных образцов для Aeromonas и Flavobacterium и в одну - 1 мкл отрицательного контроля.
Микропробирки перенесли в термоциклер Rotor Gene 2000 (Qiagen) и провели амплификацию по соответствующей программе для амплификаторов с регулировкой температуры по матрице: предварительная денатурация 95°С - 5 мин, 40 циклов 95°С - 15 сек, 66°С - 60 сек, детекцию флуоресценции вели на канале Green в конце элонгации.
После окончания программы провели плавление амплифицированной ДНК в следующем режиме: повышение температуры от 45 до 99°С, увеличение на 0,5°С за один шаг, ждать 90 сек при температуре первого шага плавления, ждать 5 сек для каждого последующего шага, детекцию флуоресценции вели на канале Green.
Учет и документирование результатов осуществляли с помощью программного обеспечения термоциклера Rotor Gene 2000 (Qiagen) (Фиг.3В).
Интерпретация результатов:
Проба ДНК, выделенная из язвенных проявлений на внешних покровах карпа, концентрация праймеров в реакционной смеси: А1-А2 по 0,4 пикомоль/мкл, F1-F2 по 2,0 пикомоль/мкл. Зафиксированы два пика с температурой плавления 85,21±0,05°С - специфичный для Aeromonas и 81,23±0,50°С - специфичный для Flavobacterium, что свидетельствует о детекции Aeromonas и Flavobacterium.
Положительный контроль для Aeromonas. Зафиксирован пик с температурой плавления 85,21±0,05°С - специфичный для Aeromonas, что свидетельствует о детекции Aeromonas.
Положительный контроль для Flavobacterium. Зафиксирован пик с температурой плавления 81,23±0,50°С - специфичный для Flavobacterium, что свидетельствует о детекции Flavobacterium.
Отрицательный контроль не показал сигнала флуоресценции, что свидетельствует об отсутствии ДНК в исходной реакционной смеси.
Преимуществом заявляемого изобретения является то, что реакцию проводят в один этап, что облегчает проведение анализа, сокращает время получения результатов в два раза и снижает риск контаминации проб ампликонами, повышает информативность ПЦР-анализа. Подобранные высокоспецифичные праймеры позволяют одновременно выявлять возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobacterium).
Таким образом, предлагаемые способ и набор обладают преимуществами: подобраны специфичные праймеры для ограничения участков генома представителей родов Aeromonas и Flavobacterium; оптимальный состав реакционной смеси для выполнения мультиплексной ПЦР; оптимальные условия отжига, что позволяет одновременно выявлять возбудителей бактериального язвенного синдрома рыб (представителей родов Aeromonas и Flavobactehum), а также значительно сокращать время анализа, достигать высокого уровня чувствительности и специфичности.
Источники информации
1. Патент 101736073 CN, МПК C12Q 1/04; C12Q 1/68. Rapid detection kit of Aeromonas and Aeromonas hydrophila by double PCR and detection method. / Заявка CN 20081122380; Заявл. 24.11.2008; Опубл.: 16.06.2010.
2. Патент 101235411CN, МПК C12Q 1/04; C12Q 1/68.Kit for detecting guinea pig aeromonas by utilizing Loop-mediated isothermal amplification technique. / UNIV NANKAI [CN]. - Заявка CN 20081052321; Опубл.: 26.02.2008.
3. Патент 102010896 CN, МПК C12Q 1/68; C12R 1/20. Method for detecting pathogenic bacteria columnar flavobacterium of alepidote fish and detection kit. / TONGWEI CO LTD. Заявка CN CN 20101180832 Заявл. 05.05.2010; Опубл.: 13.04.2011.
Перечень последовательностей праймеров:
к участку гена малой субъединицы рРНК Aeromonas,
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
- А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
к участку гена малой субъединицы рРНК Flavobacterium,
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3'.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЦР-ИДЕНТИФИКАЦИИ ФИТОПАТОГЕННОГО ГРИБА FUSARIUM OXYSPORUM | 2022 |
|
RU2816852C1 |
| СПОСОБ ПЦР-ИДЕНТИФИКАЦИИ ФИТОПАТОГЕННОГО ГРИБА ALTERNARIA SOLANI | 2022 |
|
RU2804687C1 |
| СПОСОБ ДИАГНОСТИКИ ЙЕРСИНИОЗА ЛОСОСЕВЫХ РЫБ, ВЫЗЫВАЕМОГО Yersinia ruckeri, МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И ДИАГНОСТИЧЕСКИЙ НАБОР ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 2014 |
|
RU2560570C1 |
| СПОСОБ ДЕТЕКЦИИ И ОПРЕДЕЛЕНИЯ БИОТИПА, СЕРОГРУППЫ И ТОКСИГЕННОСТИ ВОЗБУДИТЕЛЯ ХОЛЕРЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2007 |
|
RU2360972C1 |
| СИСТЕМА ДЕТЕКЦИИ НАИБОЛЕЕ ЗНАЧИМЫХ ПРОКАРИОТИЧЕСКИХ ПРЕДСТАВИТЕЛЕЙ МИКРОБИОТЫ КИШЕЧНИКА ЧЕЛОВЕКА НА ОСНОВЕ ПЦР ПАНЕЛИ | 2017 |
|
RU2680268C1 |
| Способ идентификации значимых для сельского хозяйства представителей рода Bacillus - B. subtilis, B. megaterium и B. thuringiensis на основе рестрикционного анализа гена 165S рРНК | 2023 |
|
RU2822737C1 |
| Набор реагентов для выявления Streptococcus mutans методом изотермической петлевой амплификации | 2022 |
|
RU2796603C1 |
| Способ диагностики мутации 167delT (rs80338942) гена GJB2 | 2020 |
|
RU2739943C1 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ РНК ВИРУСА ЛИХОРАДКИ ДОЛИНЫ РИФТ МЕТОДОМ ОТ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2014 |
|
RU2552795C1 |
| Способ диагностики светлоклеточного почечно-клеточного рака | 2016 |
|
RU2643586C1 |

Изобретение относится к области биотехнологии. Способ мультиплексной детекции представителей родов Aeromonas и Flavobacterium предусматривает постановку ПЦР в один этап с использованием двух пар синтезированных праймеров к участкам гена малой субъединицы рибосомальной РНК (16S rRNA) в режиме реального времени к участку гена малой субъединицы рРНК Aeromonas: А1 - 5'-TTCGGGCCTTGCGCGATTGG-3' и А2 - 5'-CGTGCTGGCAACAAAGGACAG-3', обеспечивающие амплификацию фрагмента размером 920 п.н. с температурой плавления 85,21±0,05°С и к участку гена малой субъединицы рРНК Flavobacterium F1 - 5'-CGATGGATACTAGCTGTTGGG-3' и F2 - 5'-GACGACAACCATGCAGCACC-3',обеспечивающие образование фрагмента размером 242 п.н. с температурой плавления 81,23±0,50°С. При этом используют термоциклеры по программе: предварительная денатурация при температуре 95°С 5 мин, 40 циклов амплификации 95°С - 15 сек, 66°С - 60 сек; анализ результатов детектирования и определения искомых микроорганизмов по наличию или отсутствию специфических пиков амплифицированной ДНК. Способ обеспечивает быстрое, простое, точное выявление представителей родов Aeromonas и Flavobacterium в исследуемом образце. 1 з.п. ф-лы, 3 ил.
1. Способ детекции представителей родов Aeromonas и Flavobacterium методом мультиплексной полимеразной цепной реакции (ПЦР), включающий постановку ПЦР в один этап с использованием двух пар синтезированных праймеров:
к участку гена малой субъединицы рРНК Aeromonas,
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
- А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
обеспечивающие амплификацию фрагмента размером 920 п.н. с температурой плавления 85,21±0,05°С;
к участку гена малой субъединицы рРНК Flavobacterium,
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3',
обеспечивающие образование фрагмента размером 242 п.н. с температурой плавления 81,23±0,50°С;
с использованием термоциклеров с детекцией продуктов амплификации в режиме реального времени по программе: предварительная денатурация 95°С - 5 мин, 40 циклов 95°С - 15 с, 66°С - 60 с, с одновременной оценкой результатов детектирования и определения по наличию или отсутствию специфических пиков амплифицированной ДНК в сравнении с положительным и отрицательным контрольными образцами.
2. Способ по п.1, отличающийся тем, что его осуществляют с использованием набора, включающего компоненты для проведения ПЦР, содержащего праймеры, специфичные к участкам гена малой субъединицы рибосомальной РНК (16S rRNA) представителей родов Aeromonas:
- А1 - 5'-TTCGGGCCTTGCGCGATTGG-3',
-А2 - 5'-CGTGCTGGCAACAAAGGACAG-3',
и Flavobacterium:
- F1 - 5'-CGATGGATACTAGCTGTTGGG-3',
- F2 - 5'-GACGACAACCATGCAGCACC-3',
в концентрации А1-А2 4 пикомоль/мкл, F1-F2 20 пикомоль/мкл,
а также положительные контрольные образцы:
- на представителей Aeromonas - раствор ДНК плазмиды со вставкой целевого ампликона в концентрации 105 ГЭ/мкл,
- на представителей Flavobacterium - раствор ДНК плазмиды со вставкой целевого ампликона в концентрации 105 ГЭ/мкл,
и отрицательный контрольный образец, представляющий собой воду, стерильную деионизованную, свободную от нуклеаз.
| CN 101736073 A 16.06.2010 | |||
| CN 102010896 A 13.04.2011 | |||
| ДЗЮБА Е.В | |||
| и др., Высокочувствительная детекция возбудителей | |||
| бактериального язвенного синдрома байкальского омуля | |||
| Coregonus migratorius (Georgi, 1775), журнал Известия Иркутского государственного университета, Серия Биология | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Т | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2014-04-27—Публикация
2012-11-06—Подача