Изобретение относится к области органической химии, в частности к способу получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина.
1-[(2E,4E)-Дека-2,4-диеноил]пирролидин (сарментин), впервые выделенный из плодов Piper sarmentosum, проявляет противотуберкулезную, седативную, анальгетическую и антибактериальную активность.
Результаты изобретения могут быть использованы в химии, медицинской химии и фармации.
Основной задачей в синтезе сарментина является стереоселективное построение сопряженной (2E,4E)-диеновой системы, связанной с амидной функцией.
Известен способ получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина (T.Mandai, T.Moriyama, K.Tsujimoto, M.Kawada, J.Otera, Tetrahedron Lett., 1986, vol.27, p.603-606), основанный на элиминировании ацетокси- и сульфоновой групп соответствующего амида с низкой стереоселективностью.
Известен способ получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина (F.Babudri, V.Fiandanese, F.Naso, A.Punzi, Tetrahedron Lett., 1994, vol.35, p.2067-2070), основанный на гомологенизации тиофенилового эфира 5-иодо-2E,4E-пентадиеновой кислоты. Конверсия тиоэфирной группы в амидную с последующим кросс-сочетанием с соответствующим реактивом Гриньяра в присутствии комплекса никеля приводит к целевому 1-[(2E,4E)-дека-2,4-диеноил]пирролидину с низким общим выходом (12%).
Известен способ получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина (M.C.Bernabeu, R.Chinchilla, C.Najera, Tetrahedron Lett., 1995, vol.36, p.3901), основанный на стереоселективном иодосульфонилировании труднодоступного 1-[(2E)-пента-2,4-диеноил]пирролидина с последующим кросс-сочетанием с н-пентилмагнийбромидом с низким общим выходом продукта (10%).
Таким образом, известные способы получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина характеризуются низкими общими выходами целевого продукта и используют труднодоступные реагенты.
Выбранный нами за прототип способ получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина (1) (Р.Н.Шахмаев, А.У.Ишбаева, А.Ш.Сунагатуллина, В.В.Зорин, Стереонаправленный синтез сарментина, ЖОХ, 2011, т.81, вып.9, с.1578-1580) основан на доступном сырье (1-гептине и акрилхлориде), отличается высокой стереоселективностью, приводит к образованию целевого продукта с 83% общим выходом и включает следующие стадии:
1) гидроалюминирование-иодирование 1-гептана (2) с получением (1E)-1-иодгепт-1-ена (3);
2) амидирование акрилхлорида (4) пирролидином с получением 1-акрилоилпирролидина (5);
3) сочетание (1E)-1-иодгепт-1-ена (3) с 1-акрилоилпирролидином (5) в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в ДМФА с получением 1-[(2E,4E)-дека-2,4-диеноил]пирролидина.
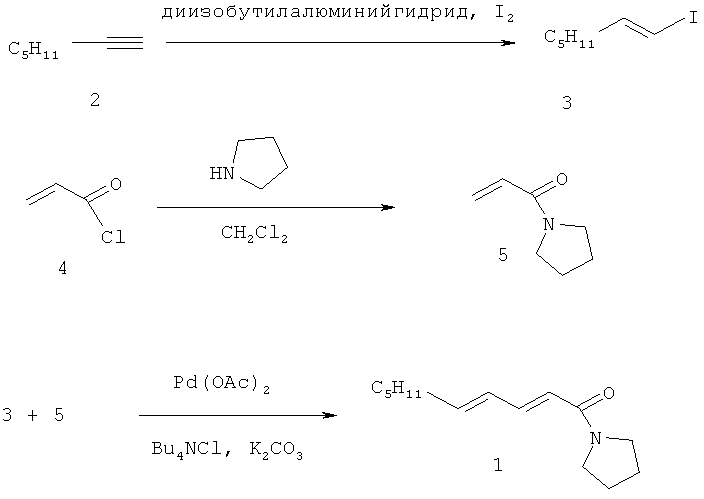
Недостатком способа на конечной стадии сочетания (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в ДМФА с получением 1-[(2E,4E)-дека-2,4-диеноил]пирролидина является недостаточно высокий выход продукта.
Задачей изобретения является создание более эффективного способа получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина с более высоким выходом.
Указанная задача решается тем, что в способе получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина, включающем гидроалюминирование-иодирование 1-гептана с получением (1E)-1-иодгепт-1-ена, амидирование акрилхлорида пирролидином с получением 1-акрилоилпирролидина, сочетание (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в полярном апротонном растворителе с получением 1-[(2E,4E)-дека-2,4-диеноил]пирролидина, согласно изобретению, синтез 1-[(2E,4E)-дека-2,4-диеноил]пирролидина осуществляется сочетанием (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в среде N-метилпирролидона при следующем мольном соотношении [(1E)-1-иодгепт-1-ен]:[1-акрилоилпирролидин]:[Pd(OAc)2]:[K2CO3]:[Bu4NCl]:[N-метилпирролидон]=1:1,5:0,02:2,5:1:7,7 в течение 5 ч в атмосфере аргона при 70°C.
Способ осуществляется следующим образом. Смесь (1E)-1-иодгепт-1-ена, 1-акрилоилпирролидина, Pd(OAc)2, K2CO3 и Bu4NCl в среде N-метилпирролидона при следующем мольном соотношении реагентов [(1E)-1-иодгепт-1-ен]:[1-акрилоилпирролидин]:[Pd(OAc)2]:[K2CO3]:[Bu4NCl]:[N-метилпирролидон]=1:1,5:0,02:2,5:1:7,7 перемешивают в атмосфере аргона в течение 5 ч в при 70°C. Дальнейшие операции по выделению и очистке полученного 1-[(2E,4E)-дека-2,4-диеноил]пирролидина не отличаются от прототипа.
В результате изобретения выход 1-[(2E,4E)-дека-2,4-диеноил]пирролидина на стадии сочетания (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином повышается до 98% (у прототипа - 94%). Общий выход 1-[(2E,4E)-дека-2,4-диеноил]пирролидина в расчете на исходный 1-гептин составляет 86% (у прототипа - 83%).
Пример 1. Получение (1E)-1-иодгепт-1-ена. К раствору 0.96 г (0.01 моль) 1-гептина в 10 мл абсолютного гексана приливали 15 мл 1М раствора диизобутилалюминийгидрида в гексане и перемешивали 6 ч при 55°C в атмосфере аргона. Реакционную смесь охлаждали до -50°C и прибавляли раствор 2.79 г (0.011 моль) иода в 10 мл безводного тетрагидрофурана в течение 30 мин. Затем реакционную смесь нагревали в течение 1 ч до комнатной температуры, перемешивали при этой температуре еще 12 ч и приливали при охлаждении льдом 25 мл 10%-ного раствора серной кислоты. Органический слой отделяли, водный экстрагировали гексаном (3×15 мл). Объединенные органические слои промывали насыщенным раствором NaCl, сушили над Na2SO4 и концентрировали. Продукт выделяли методом колоночной хроматографии (SiO2, гексан-хлороформ, 6:1). Выход 1.98 г (88%). ИК-спектр, ν, см-1: 2955, 2924, 2855, 1605, 1458, 1209, 1173, 939. Спектр ЯМР 1H, δ, м.д.: 0.87 т (3H, СН3), 1.21-1.43 м (6Н, 3СН2), 2.03 к (2Н, СН2СН=, J 6.9 Гц), 5.96 д (1Н, С1Н=, J 14.4 Гц), 6.45-6.54 м (1Н, C2H=). Спектр ЯМР 13C, δ, м.д.: 13.91 (C7), 22.33 (C6), 27.96 (C4), 31.02 (C5), 35.93 (C3), 74.24 (C1), 146.65 (С2). Масс-спектр, m/z (Iотн, %): 224 (34) [M]+, 167 (24), 154 (55), 97 (22), 69 (13), 55 (100), 41 (23), 39 (13).
Пример 2. Получение 1-акрилоилпирролидина. К 1.81 г (0.02 моль) акрилхлорида в 20 мл абсолютного дихлорэтана медленно приливали 2.84 г (0.04 моль) пирролидина в 15 мл абсолютного дихлорэтана при 0-5°C. Реакционную смесь перемешивали на магнитной мешалке в течение 3 ч при комнатной температуре. Выпавший осадок фильтровали и промывали дихлорметаном (2×10 мл). Органический слой последовательно промывали 10 мл воды, 2 мл 5%-ного раствора HCl, 2 мл насыщенного раствора NaHCO3 и сушили Na2SO4. Растворитель концентрировали на роторном испарителе, сырой продукт очищали методом колоночной хроматографии (SiO2, гексан-этилацетатат, 5:1→1:1). Выход 1.38 г (55%). ИК-спектр, ν, см-1: 2972, 2872, 1647, 1609, 1436, 1375, 982, 797. Спектр ЯМР 1H, δ, м.д.: 1.65-1.85 м (4Н, 2СН2), 3.31-3.40 м (4Н, 2CH2N), 5.48 д (1Н, СН2=, J 10.1 Гц), 6.12-6.35 м (2Н, СН2=, СН=). Спектр ЯМР 13C, δ, м.д.: 23.67 (CH2), 25.53 (CH2), 45.24 (CH2N), 45.96 (CH2N), 126.46 (CH2=), 128.38 (CH=), 163.76 (C=O). Масс-спектр, m/z (Iотн, %): 125 (75) [M]+, 124 (36), 97 (14), 96 (24), 70 (39), 69 (32), 68 (18), 56 (13), 55 (100), 43 (12), 42 (19), 41 (22), 39 (14).
Пример 3. Получение 1-[(2E,4E)-дека-2,4-диеноил]пирролидина. К смеси 0.46 г (3.3 ммоль) K2CO3, 0.37 г (1.34 ммоль) Bu4NCl, 0.3 г (1.34 ммоль) (1E)-1-иодгепт-1-ена и 0.25 г (2 ммоль) 1-акрилоилпирролидина в 0.9 мл N-метилпирролидона приливали раствор 0.006 г (0.027 ммоль) Pd(OAc)2 в 0.1 мл N-метилпирролидона. Реакционную смесь продували аргоном и нагревали при перемешивании в течение 5 ч при 70°C. После полной конверсии (1E)-1-иодгепт-1-ена (контроль по ТСХ) добавляли 3 мл воды и 3 мл гексана. Органический слой отделяли, а водный экстрагировали гексаном (2×3 мл). Объединенный органический слой промывали водой (5 мл), сушили над Na2SO4 и концентрировали. Сырой продукт очищали методом колоночной хроматографии (SiO2, гексан-этилацетат, 9:1→4:6). Выход 0.292 г (98%). ИК-спектр, ν, см-1: 2955, 2926, 2870, 1653, 1624, 1600, 1425, 999. Спектр ЯМР 1H, δ, м.д.: 0.89 т (3H, CH3), 1.26-1.47 м (6Н, 3CH2), 1.81-2.03 м (4Н, 2CH2CH2N), 2.15 к (2Н, CH2CH=J 7.0 Гц), 3.46-3.58 м (4Н, 2CH2N), 6.02-6.23 м (2Н, 2СН=), 6.10 д внутри мультиплета (1Н, C2H=, J 14.7 Гц), 7.22-7.35 м (1H, CH=). Спектр ЯМР 13C, δ, м.д.: 13.76 (C10), 22.24 (C9), 24.10 (CH2CH2N), 25.86 (CH2CH2N), 28.23 (C7), 31.11 (C8), 32.69 (C6), 45.57 (CH2N), 46.17 (CH2N), 119.66 (C2), 128.50 (С4), 141.86 (C5 или C3), 142.79 (C3 или C5), 164.89 (C1). Масс-спектр, m/z (Iотн, %): 221 (22) [M]+, 151 (29), 150 (100), 98 (27), 95 (26), 81 (76), 70 (46), 69 (30), 67 (27), 55 (36), 53 (23), 41 (28).
Преимуществом предлагаемого способа является более высокий выход 1-[(2E,4E)-дека-2,4-диеноил]пирролидина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ (2Е,4Е)-N-ИЗОБУТИЛДЕКА-2,4-ДИЕНАМИДА | 2012 |
|
RU2500664C1 |
| СПОСОБ ПОЛУЧЕНИЯ (2Е,4Е)-ДОДЕКА-2,4-ДИЕН-1-ИЛИЗОВАЛЕРАТА | 2011 |
|
RU2473534C1 |
| СПОСОБ ПОЛУЧЕНИЯ (4Е)-ТРИДЕЦ-4-ЕН-1-ИЛАЦЕТАТА | 2013 |
|
RU2538753C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУНАРИЗИНА | 2015 |
|
RU2600450C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛ(4Е)-5-ХЛОРПЕНТ-4-ЕНОАТА | 2014 |
|
RU2550510C1 |
| Способ получения этил (2E)-5-фенилпент-2-ен-4-иноата | 2020 |
|
RU2756762C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАФТИФИНА | 2013 |
|
RU2539654C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИННАРИЗИНА | 2014 |
|
RU2570112C1 |
| СПОСОБ ПОЛУЧЕНИЯ (4E, 6Z)-ГЕКСАДЕКА-4,6-ДИЕН-1-ОЛА | 2015 |
|
RU2582619C1 |
| АМИДЫ НЕНАСЫЩЕННЫХ КИСЛОТ ИЛИ ИХ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИНСЕКТИЦИДНАЯ ИЛИ АКАРИЦИДНАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2086539C1 |
Изобретение относится к способу получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина (сарментина), включающем гидроалюминирование-иодирование 1-гептана с получением (1E)-1-иодгепт-1-ена, амидирование акрилхлорида пирролидином с получением 1-акрилоилпирролидина, сочетание (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в полярном апротонном растворителе N-метилпирролидона с получением целевого продукта, при следующем мольном соотношении [(1E)-1-иодгепт-1-ен]:[1-акрилоилпирролидин]:[Pd(OAc)2]:[K2CO3]:[Bu4NCl]:[N-метилпирролидон] = 1:1,5:0,02:2,5:1:7,7 в течение 5 ч в атмосфере аргона при 70°C. Способ обеспечивает получение целевого продукта с общим выходом 86%. 3 пр.
Способ получения 1-[(2E,4E)-дека-2,4-диеноил]пирролидина, включающий гидроалюминирование-иодирование 1-гептина с получением (1E)-1-иодгепт-1-ена, амидирование акрилхлорида пирролидином с получением 1-акрилоилпирролидина, сочетание (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином в присутствии Pd(OAc)2, K2CO3 и тетрабутиламмонийхлорида в полярном апротонном растворителе с получением 1-[(2E,4E)-дека-2,4-диеноил]пирролидина, отличающийся тем, что сочетание (1E)-1-иодгепт-1-ена с 1-акрилоилпирролидином осуществляют в среде N-метилпирролидона при следующем мольном соотношении [(1E)-1-иодгепт-1-ен]:[1-акрилоилпирролидин]:[Pd(OAc)2]:[K2CO3]:[Bu4NCl]:[N-метилпирролидон] = 1:1,5:0,02:2,5:1:7,7 в течение 5 ч в атмосфере аргона при 70°C.
| Р.Н | |||
| Шахмаев и др., Стереоселективный синтез сарментина, ЖОХ, 2011, т | |||
| Горный компас | 0 |
|
SU81A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Tetrahedron Lett., v | |||
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| ПРИБОР ДЛЯ АВТОМАТИЧЕСКОГО ПРИВЕДЕНИЯ В ДЕЙСТВИЕ ПЕСОЧНИЦ У ВЕДУЩИХ ПОДВИЖНОЙ СОСТАВ ПОВОЗОК | 1926 |
|
SU3901A1 |
| Р.Н.Шахмаев и др., Стереонаправленный синтез природных (2Е, 4Е)-диенамидов и их синтетических аналогов, Ж | |||
| Органической Химии, 2012, т | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Плавучий цепной ветро-водяной двигатель | 1923 |
|
SU913A1 |
Авторы
Даты
2014-05-10—Публикация
2012-12-06—Подача