Изобретение относится к области органической химии, в частности к способу получения 1-[бис(4-фторфенил)метил]-4-[(2E)-3-фенилпроп-2-ен-1-ил]пиперазина (флунаризина).
Флунаризин (сибелиум) - широко известный лекарственный препарат, относящийся к группе блокаторов кальциевых каналов. Он обладает сосудорасширяющим эффектом, улучшает мозговое кровообращение, а также проявляет антигистаминную активность. Флунаризин особенно эффективен при лечении мигрени, вестибулярных нарушений и эпилепсии [Calcium Regulation by Calcium Antagonists. (ACS Symp. 201). Ed. R.G. Rahwan, D.T. Witiak, 1982; Holmes В., Brogden R.N., Heel R.C., Speight T.M., Avery G.S. Drugs 1984, 27, 6; Ashton D., Reid K., Willems R., Marrannes R., Wauquier A. Drug. Dev. Res. 1986, 8, 397; Straub H., Köhling R., Speckmann E.-J. Brain Res. 1994, 658, 119].
Результаты изобретения могут быть использованы в химии, медицинской химии и фармакологической промышленности.
Известны способы получения флунаризина на основе конденсации N-циннамилпиперазина с бис(4-фторфенил)хлорметаном или циннамилхлорида с 1-[бис(4-фторфенил)метил]пиперазином [Janssen P.A.J. патент DE 1929330 (1970); Janssen P.A.J. патент US 3773939 (1973)]. Способы характеризуются недостаточно высоким выходом и использованием относительно труднодоступных циннамилсодержащих предшественников.
Наиболее близким к предлагаемому изобретению по типу металло-катализируемой реакции сочетания и взятому нами за прототип является способ получения флунаризина на основе региоселективного аминирования циннамилового спирта 1-[бис(4-фторфенил)метил]пиперазином в присутствии каталитической системы Pd(OAc)2/1,10-фенантролин [Banerjee D., Jaga-deesh R.V., Junge K., Junge H., Beller M. ChemSusChem. 2012, 5, 2039-2044].
Данный метод имеет следующие недостатки:
- недостаточно высокий выход флунаризина;
- высокая стоимость и токсичность Pd-катализатора.
Задачей изобретения является создание более эффективного и практичного способа получения флунаризина с более высоким выходом.
Указанная задача решается тем, что флунаризин (1) получают, согласно изобретению, Fe-катализируемым сочетанием 1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазина (2), полученного аллилированием 1-[бис(4-фторфенил)метил]пиперазина (3) промышленно доступным (E)-1,3-дихлорпропеном (4), с фенилмагнийгалогенидом в апротонном растворителе в атмосфере инертного газа в присутствии соли железа.
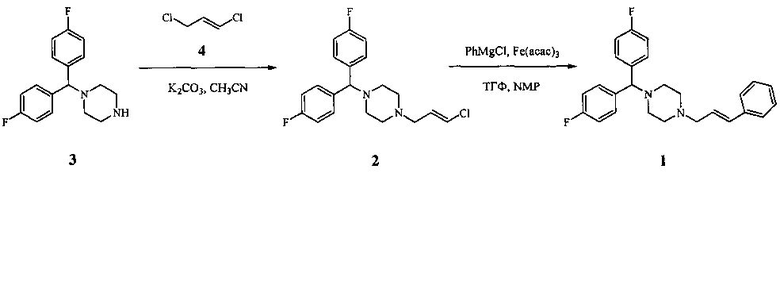
Способ осуществляют следующим образом. Смесь 1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазина (2), катализатора (соли железа) в апротонном растворителе и 0.5-3 М раствора фенилмагнийгалогенида в органическом растворителе [предпочтительно 1-2 М раствор фенилмагнийхлорида (PhMgCl) в тетрагидрофуране (ТГФ)] перемешивают при температуре от минус 40°C до плюс 50°C (предпочтительно при 0-25°C) в течение 0.1-8 ч (предпочтительно в течение 1-2 ч) в атмосфере инертного газа при следующем мольном соотношении реагентов {1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазин}:{соль железа}:{фенилмагнийгалогенид}=1:0.001-0.1:1-4 (предпочтительно 1:0.02:1.8).
В качестве катализатора используют соли железа (II) или (III), в частности Fe(acac)3, FeCl3, Fe(acac)2, FeCl2 [предпочтительно Fe(acac)3] (acac = ацетилацетонат).
В качестве апротонного растворителя используют простые эфиры [тетрагидрофуран (ТГФ), диметиловый эфир диэтиленгликоля (диглим), диэтиловый эфир] или их смеси с N-содержащими растворителями [N-метилпирролидон (NMP), N,N-диметилформамид (ДМФА), N,N,N′,N′-тетраметилэтилендиамин (ТМЭДА)] (предпочтительно смесь ТГФ и NMP в объемном соотношении 300:1).
Пример 1. Получение 1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазина (2). К суспензии 1.22 г (0.011 моль) (E)-1,3-дихлорпропена (4) и 2.07 г (0.015 моль) K2CO3 в 50 мл абсолютного ацетонитрила добавили 2.88 г (0.01 моль) 1-[бис(4-фторфенил)метил]пиперазина (3). Перемешивали 0.5 ч при комнатной температуре, затем еще 4 ч при кипении до полной конверсии амина (3) (контроль методом ГЖХ). После охлаждения раствор фильтровали, осадок промывали этилацетатом и объединенные органические слои концентрировали. Продукт реакции очищали методом колоночной хроматографии (SiO2, гексан - этилацетат, 9:1→2:1). Выход 3.31 г (91%), бесцветные кристаллы, т.пл. 89°C. ИК спектр, ν, см-1: 1609, 1506, 1453, 1288, 1226, 1153, 1137, 1008, 828. Спектр ЯМР 1H, δ, м.д.: 7.38-7.28 (м, 4H, CHаром.), 6.96 (т, 4H, CHаром., J 8.5 Гц), 6.15 (д, 1H, ClCH=, Jтранс 13.2 Гц), 5.98 (д.т, 1H, CH2CH=, Jтранс 13.2, 7 Гц), 4.23 (с, 1H, CHAr2), 3.04 (д, 2H, CH2CH=, J 7 Гц), 2.51 (уш.с, 4H, CH2N), 2.43 (уш.с, 4H, CH2N). Спектр ЯМР 13C, δ, м.д.: 163.40 и 160.17 (д, 2C, CFаром., 1JC-F 244.2 Гц), 138.11 (2C, Cаром.), 129.96 (C2), 129.25 и 129.16 (д, 4C, CHаром., 3JC-F 6.8 Гц), 120.59 (C3), 115.47 и 115.20 (д, 4C, CHаром., 2JC-F 20 Гц), 74.33 (CHAr2), 58.10 (C1), 52.97 (2C, CH2N), 51.51 (2C, CH2N). Масс-спектр, m/z (Iотн, %): 362 (0.8) [M]+, 203 (41), 201 (19), 183 (30), 161 (31), 159 (100), 132 (13), 123 (32), 75 (34), 56 (15), 42 (22).
Пример 2. Получение 1-[бис(4-фторфенил)метил]-4-[(2E)-3-фенилпроп-2-ен-1-ил]пиперазина (флунаризина) (1).
К раствору 0.363 г (1 ммоль) соединения (2), 7 мг (0.02 ммоль) Fe(acac)3 и 9.6 мкл (0.1 ммоль) NMP в 3 мл ТГФ медленно добавили при 0°C в атмосфере аргона 0.9 мл 2 М раствора PhMgCl в ТГФ. Перемешивали при комнатной температуре в течение 1 ч. Затем приливали 2 мл воды и 8 мл этилацетата, органический слой отделяли, водный слой обрабатывали этилацетатом (2×5 мл). Объединенные органические слои промывали насыщенным раствором NaCl, сушили Na2SO4 и концентрировали. Продукт реакции очищали методом колоночной хроматографии (SiO2, гексан - этилацетат, 9:1→2:1). Выход 0.361 г (89%), бесцветные кристаллы, т.пл. 96-99°C. ИК спектр, ν, см-1: 1601, 1507, 1455, 1377, 1220, 1155, 1138, 1003, 968, 825. Спектр ЯМР 1H, δ, м.д.: 7.38-7.16 (м, 9H, CHаром.), 6.95 (т, 4H, CHаром., J 8.7 Гц), 6.51 (д, 1H, PhCH=, Jтранс 15.8 Гц), 6.26 (д.т, 1H, CH2CH=, Jтранс 15.8, 6.8 Гц), 4.23 (с, 1H, CHPh2), 3.16 (д, 2H, CH2CH=, J 6.8 Гц), 2.53 (уш.с, 4H, CH2N), 2.41 (уш.с, 4H, CH2N). Спектр ЯМР 13C, δ, м.д.: 163.39 и 160.13 (д, 2C, CFаром., 1JC-F 246.4 Гц), 138.17 (2C, Cаром.), 136.88 (Cаром.), 133.08 (C3), 129.27 и 129.18 (д, 4C, CHаром., 3JC-F 6.9 Гц), 128.49 (2C, CHаром.), 127.42 (CHаром.), 126.34 (C2), 126.25 (2C, CHаром.), 115.43 и 115.13 (д, 4C, CHаром., 2JC-F 22.6 Гц), 74.36 (CHAr2), 60.85 (C1), 53.30 (2C, CH2N), 51.60 (2C, CH2N). Масс-спектр, m/z (Iотн, %): 404 (3) [М]+, 287 (13), 203 (22), 202 (16), 201 (100), 183 (14), 118 (8), 117 (77), 115 (26), 91 (13), 42 (6).
Пример 3. Получение флунаризина (1).
К раствору 0.363 г (1 ммоль) соединения (2), 7 мг (0.02 ммоль) Fe(acac)3 и 15 мкл (0.1 ммоль) ТМЭДА в 3 мл ТГФ медленно добавили при 0°C в атмосфере аргона 0.75 мл 2 М раствора PhMgCl в ТГФ. Перемешивали при комнатной температуре в течение 2 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 0.353 г (87%).
Пример 4. Получение флунаризина (1).
К раствору 0.363 г (1 ммоль) соединения (2), 4 мг (0.025 ммоль) FeCl3 и 9.6 мкл (0.1 ммоль) NMP в 3 мл ТГФ медленно добавили при 0°C в атмосфере аргона 0.9 мл 2 М раствора PhMgCl в ТГФ. Перемешивали при комнатной температуре в течение 2 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 0.351 г (87%).
Пример 5. Получение флунаризина (1).
К раствору 0.363 г (1 ммоль) соединения (2) и 7 мг (0.02 ммоль) Fe(acac)3 в 3 мл ТГФ медленно добавили при 0°C в атмосфере аргона 0.9 мл 2 М раствора PhMgCl в ТГФ. Перемешивали при комнатной температуре в течение 3 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 0.339 г (84%).
Пример 6. Получение флунаризина (1).
К раствору 0.363 г (1 ммоль) соединения (2), 7 мг (0.02 ммоль) Fe(acac)3 и 9.6 мкл (0.1 ммоль) NMP в 3 мл ТГФ медленно добавили при 0°C в атмосфере аргона 1.8 мл 1 М раствора PhMgBr в ТГФ. Перемешивали при комнатной температуре в течение 1 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 0.349 г (86%).
Предлагаемый способ имеет следующие преимущества:
- более высокий выход флунаризина (до 89%);
- низкая стоимость и малотоксичность катализатора.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЦИННАРИЗИНА | 2014 |
|
RU2570112C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАФТИФИНА | 2013 |
|
RU2539654C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬВЕРИНА | 2017 |
|
RU2656858C1 |
| СПОСОБ ПОЛУЧЕНИЯ (4Е)-ТРИДЕЦ-4-ЕН-1-ИЛАЦЕТАТА | 2013 |
|
RU2538753C1 |
| ПРОИЗВОДНЫЕ АЗАИНДАЗОЛА ИЛИ ДИАЗАИНДАЗОЛА В КАЧЕСТВЕ МЕДИКАМЕНТА | 2012 |
|
RU2600976C2 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| СОЕДИНЕНИЯ ТРИАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТРИАЗОЛА И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 2002 |
|
RU2276670C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНДИОНА, ТРИАЗИНДИОНА, ТЕТРАГИДРОХИНАЗОЛИНДИОНА В КАЧЕСТВЕ АНТАГОНИСТОВ α-АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2175322C2 |
| Алкинсодержащий амидофосфит для функционализации синтетических олигонуклеотидов и способ его получения | 2021 |
|
RU2781226C1 |
| КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С KIT | 2014 |
|
RU2706235C2 |
Изобретение относится к способу получения 1-[бис(4-фторфенил)метил]-4-[(2E)-3-фенилпроп-2-ен-1-ил]пиперазина (флунаризина). Сущность изобретения заключается в том, что флунаризин получают Fe-катализируемым сочетанием 1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазина, полученного аллилированием 1-[бис(4-фторфенил)метил]пиперазина промышленно доступным (E)-1,3-дихлорпропеном, с фенилмагнийгалогенидом в апротонном растворителе в атмосфере инертного газа в присутствии соли железа. Технический результат - высокий выход флунаризина (до 89%), снижение стоимости процесса и снижение токсичности катализатора. 4 з.п. ф-лы, 5 пр.
1. Способ получения флунаризина, включающий металлокатализируемую реакцию сочетания, отличающийся тем, что флунаризин получают Fe-катализируемым сочетанием 1-[бис(4-фторфенил)метил]-4-[(2E)-3-хлорпроп-2-ен-1-ил]пиперазина с фенилмагнийгалогенидом в апротонном растворителе в атмосфере инертного газа в присутствии соли железа.
2. Способ получения флунаризина по п. 1, отличающийся тем, что апротонный растворитель выбирают из группы, включающей тетрагидрофуран, диметиловый эфир диэтиленгликоля, диэтиловый эфир, или используют их смеси с N-содержащими растворителями N-метилпирролидоном, N,N-диметилформамидом, N,N,N′,N′-тетраметилэтилендиамином.
3. Способ получения флунаризина по п. 1, отличающийся тем, что соль железа выбирают из группы, включающей Fe(acac)3, FeCl3, Fe(acac)2, FeCl2.
4. Способ получения флунаризина по п. 1, отличающийся тем, что в качестве фенилмагнийгалогенида используют фенилмагнийхлорид.
5. Способ получения флунаризина по п. 1, отличающийся тем, что в качестве апротонного растворителя используют смесь тетрагидрофурана и N-метилпирролидона в объемном соотношении 300:1.
| Banerjee, Debasis; Jagadeesh, Rajenahally V.; Junge, Kathrin; Junge, Henrik; Beller, Matthias "An efficient and convenient palladium catalyst system for the synthesis of amines from allylic alcohols", ChemSusChem, 5(10), 2039-2044, 2012;Шахмаев Р.Н., Сунагатуллина А.Ш., Зорин В.В | |||
| "Fe-катализируемый синтез циннаризина", Журнал органической химии, |
Авторы
Даты
2016-10-20—Публикация
2015-07-14—Подача