Область техники, к которой относится изобретение
Изобретение относится к молекулярной иммунологии и лечению заболеваний человека. В частности, оно относится к антителам к человеческому S100A4, фармацевтическим композициям, содержащим данные антитела, и их терапевтическому и диагностическому применению.
Уровень техники
Рак представляет собой наиболее распространенный тип злокачественных заболеваний у человека, и летальный исход при раке в основном обусловлен диссеминацией первичных опухолевых клеток в отдаленные области и последующим образованием метастазов.
Причинная роль индуцирующего метастазы белка S100A4, члена семейства 8100 связывающих кальций белков, в развитии, ангиогенезе и метастатической диссеминации опухоли продемонстрирована с помощью нескольких подходов.
S100A4 играет центральную роль во взаимодействии опухоль-строма, которое происходит между клетками опухоли и их стромой (включая фибробласты, эндотелиальные клетки, клетки гладкой мускулатуры, воспалительные и нервные клетки), главным образом опосредованном непосредственным контактом клетки с клеткой или передачей сигнала аутокринного/паракринного цитокина и фактора роста. Например, эпителиальный фактор роста, опухолевый фактор роста-β1 и фактор роста фибробластов-2 способный стимулировать экспрессию S100A4 (см. статью Strutz et al. Kidney Int. 2002; 61(5):1714-1728); S100A4, высвобождающийся либо клетками опухоли, либо клетками стромы в среду, окружающую опухоль, включает прометастатические каскады в клетках опухоли (см. статью Grum-Schwensen et al. Cancer Res. 2005; 65(9):3772-3780); клетки опухоли или ассоциированные с опухолью фибробласты, в противоположность нормальным фибробластам, экспрессируют высокие уровни S100A4 (см. статью Ambartsumian et al. Oncogene. 1996; 13(8):1621-1630); другие происходящие от хозяина клетки стромы опухоли, такие как лимфоциты и макрофаги, повышают уровень экспрессии S100A4 путем активации (см. статью Grigorian et al. Electrophoresis. 1994; 15(3-4):463-468).
S100A4 влияет также на ангиогенез опухоли посредством стимуляции и ремоделирования экстрацеллюлярного матрикса (продукция разлагающих ферментов) и подвижности эндотелиальных клеток, действуя как проангиогенный фактор (см. статью Schmidt-Hansen et al. J. Biol. Chem. 2004; 279(23):24498-24504).
Сам ген S100A4 изначально выделен как ген дифференцированно экспрессирующийся в мышиной аденокарциноме молочной железы с высоким метастатическим потенциалом (см. статью Ebralidze et al. Genes Dev. 1989; 3(7):1086-1093). Показано, что интродукция гена S100A4 в неметастатические опухолевые клеточные линии, а также супрессия собственного гена в метастатических линиях модифицирует онкогенный и метастатический путь развития данных клеток, приводя, вследствие этого, к включению в развитие опухоли и формированию метастазов (см. статью Lloyd et al. Oncogene. 1998; 17(4):465-473).
В клинике положительная корреляция между высокими уровнями экспрессии S100A4 и неблагоприятным прогнозом у онкологических пациентов продемонстрирована для карциномы молочной железы (см. статью Rudland PS et al. Cancer Res 2000. 60(6):1595-1603), карциномы простаты карциномы (см. статью Saleem M et al. PNAS 2006. 103(40):14825-30), карциномы легкого (см. статью Tsuna M et al. Anticancer Res 2009. 29(7):2547-54), колоректальной карциномы (см. статью Cho Y et al. World J Gastroent 2005. 11(31):4852-6), карциномы поджелудочной железы (см. статью Rosty С et al. Am J Pathol 2002. 160(1):45-50), почечной карциномы (см. статью Bandiera A et al. World J Surg 2009. 33(7):1414-20), карциномы желудка (см. статью Yonemura Y et al. Clin Cancer Res 2000. 6(11):4234-42), карциномы яичника (см. статью Maelandsmo GM et al. Tumor Biol 2009. 30(1):15-25), папиллярной карциномы щитовидной железы (см. статью Min HS et al. Mod Pathol 2008. 21(6):748-55), меланомы (см. статью Andersen K et al. Mod Pathol 2004. 17(8):990-997), гепатоцеллюларной карциномы (см. статью Cui J et al. J Can Res Clin Oncol 2004. 130(10):615-22), карциномы мочевого пузыря (см. статью Agerbaek M et al. Eur Urol 2006. 50(4):777-785), инвазивной карциномы липосаркомы (см. статью Pazzaglia L et al. Anticancer Res 2004. 24(2B):967-972), нейробластомы (см. статью Bjornland K et al. J Pediatr Surg 2001. 36(7):1040-44), карциномы сквамозных клеток пищевода (см. статью Ninomiya I et al. Int J Oncol 2001. 18(4):715-20), остеосаркомы (см. статью Mathisen В et al. Clin Exp Metastasis 2003. 20(8):701-11), карциномы желчного пузыря (см. статью Nakamura Т et al. Int J Oncol 2002. 20(5):937-41), карциномы сквамозных клеток полости рта (см. статью Moriyama-Kita M et al. Oral Oncol 2004. 40(5):496-500), эндометриальной карциномы (см. статью Xie R et al. Lab Invest 2009. 89(8):937-947) и медуллобластомы (см. статью Hernan R et al. Cancer Res 2003. 63(1):140-148) в числе прочих.
Участие S100A4 в различных незлокачественных патологических состояниях также продемонстрировано рядом исследовательских коллективов, в частности, в таких патологиях, как аутоиммунное воспаление и нарушения сердечно-сосудистой, нервной и дыхательной систем (см. статью Grigorian M et al. Current Molecular Medicine 2008. 8(6):492-6). Вследствие этого S100A4 является потенциальной мишенью для клинического применения. Однако, вследствие сложности биологической функции S100A4 и его неизвестного в целом механизма действия, пока на существует никаких ингибиторов, которые блокируют либо внутриклеточные, либо внеклеточные функции данного белка.
Лекарственный препарат на основе антител появляется как интегральная часть эффективных препаратов против ряда заболеваний. За последнее десятилетие моноклональные антитела становятся основными лечебными средствами для лечения злокачественных и незлокачественных заболеваний.
В настоящее время моноклональные и поликлональные антитела, возникающие к S100A4 представлены различными компаниями и исследовательскими коллективами (см. статью Zhang et al, Calcium Binding Proteins 2006. 1:4, 219-223; ABIN 167355 и ABIN171123 антитела в режиме онлайн GmbH, Germany; A5114 фирмы DakoCytomation, Denmark в числе прочих). Хотя в научных и патентных материалах обсуждают терапевтическое применение данных антител, что касается всех знаний изобретателей, пока они не включают зарегистрированные доказательства того, что антитела, соответствующие уровню техники, действительно решают проблему лечения рака и незлокачественных заболеваний.
WO2000064475 (Research Corporation Technologies, Inc.) раскрывает способ диагностики злокачественного рака (i) путем ингибирования белка mts-1 антителами, направленными на белок mts-1 (антитела могут быть конъюгированными с токсином) или (ii) путем получения нуклеиновой кислоты, кодирующей антисмысловую нуклеотидную последовательность mts-1.
Вследствие этого в уровне техники существует потребность создания новых терапевтических подходов к лечению рака, особенно к лечению ангиогенеза и метастазов путем получения направленности на белок S100A4.
Кроме того, на диагностическом уровне S100A4 можно считать подходящим маркером в процессе дифференцировки нормальной клетки в опухолевую клетку, и, вследствие этого, он является подходящим биомаркером в цитологическом исследовании опухолей. Однако выявление экспрессии S100A4 в раковой ткани имеет недостаток в том, что необходимо сделать биопсию пациенту. Вследствие этого в уровне техники существует потребность создания более простого и менее инвазивного способа клинической диагностики рака посредством детекции уровней S100A4 в
организме пациента.
Раскрытие изобретения
В первом аспекте изобретение относится к специфическому антителу к S100A4, обладающему антиангиогенной активностью, или его фрагменту, который в существенной степени сохраняет антиангиогенную активность указанного антитела, причем антитело выбрано из группы, включающей:
(i) антитело, которое распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3),
(ii) антитело, которое распознает эпитоп S100A4 содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(iii) антитело, продуцируемое гибридомой ЕСАСС 11051804.
В другом аспекте изобретение относится к гидридомной клеточной линии, выбранной из группы, включающей клеточные линии, депонированные под регистрационным номером ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество по меньшей мере одного антитела или его фрагмента, соответствующего изобретению, и по меньшей мере один фармацевтически приемлемый носитель.
В еще одном аспекте изобретение относится к антителу или его фрагменту, соответствующему изобретению, предназначенному для применения в целью предупреждения и/или лечения заболевания, выбранного из метастаза (метастазирования) или заболевания, ассоциированного с нежелательным ангиогенезом.
В дополнительных аспектах изобретение относится к конъюгату, содержащему антитело или его фрагмент, соответствующих изобретению, и второй компонент, выбранный из группы:
(a) антиангиогенного средства,
(b) антиметастатического средства,
(c) цитотоксического средства,
(d) противовоспалительного средства, а также его применению для предупреждения и/или лечения заболевания, выбранного из метастаза (метастазирования), заболевания, ассоциированного с нежелательным ангиогенезом, и заболевания, ассоциированного с воспалением.
В другом аспекте изобретение относится к способу получения моноклонального антитела, соответствующего изобретению, который предусматривает культивирование гидридомной клеточной линии, выбранных из данных клеточных линий, депонированных под регистрационным номером ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804 в условиях, которые обеспечивают продукцию данного антитела.
В дополнительных аспектах изобретение относится к композиции, содержащей специфическое антитело к S100A4 и антиметаболит, а также к их применению для предупреждения и/или лечения рака или метастазов.
В другом аспекте изобретение относится к применению антитела, которое специфически связывается с белком S100A4, или его фрагментом, обладающим способностью связываться с антигеном, для получения лекарственного средства для предупреждения и/или лечения заболевания, ассоциированного с воспалением.
В еще одном аспекте изобретение относится к способу in vitro диагностики рака или заболевания, ассоциированного с воспалением, у пациента, который предусматривает:
(a) детекцию уровней белка S100A4 или его варианта в биожидкости данного пациента при использовании моноклонального антитела, продуцируемого гибридомой, выбранной из группы, включающей ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функциональный вариант указанного антитела,
(b) сравнение указанных уровней в эталонной величиной,
причем повышенные уровни белка S100A4 или его варианта относительно эталонной величины указывают на то, что пациент страдает от рака или заболевания, ассоциированного с воспалением.
В еще одном аспекте изобретение относится к способу детекции S100A4 в образце, который предусматривает:
(i) контактирование образца, предположительно содержащего S100A4 со специфическим антителом к S100A4 или его фрагментом, как определено в изобретении,
(ii) детекцию формирования иммунных комплексов между S100A4 и антителом или его фрагментом,
причем детекция иммунных комплексов между S100A4 и антителом является показателем присутствия S100A4 в образце.
В другом аспекте изобретение относится к набору для диагностики рака или заболевания, ассоциированного с воспалением, в биологической жидкости, которая содержит по меньшей мере одно антитело или его фрагмент, соответствующие изобретению.
В другом аспекте изобретение относится к способу in vitro создания индивидуальной терапии для пациента с диагностированным раком, который предусматривает детекцию уровней белка S100A4 или его варианта в биологической жидкости указанного пациента при использовании моноклонального антитела, продуцируемого гибридомой, выбранной из группы, включающей ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функционального варианта указанного антитела до и после лечения тем же самым моноклональным антителом, причем повышение уровней белка S100A4 или его варианта после лечения относительно уровней S100A4 или его варианта перед лечением является показателем того, что пациент нуждается в альтернативном препарата относительно первоначально вводимого препарата.
Объектом настоящего изобретения является получение антител, которые специфически связываются с человеческим или мышиным S100A4, а не с другими белками семейства S100.
Объектом настоящего изобретения является получение антител, которые с чувствительностью связываются с человеческим или мышиным S100A4 при лимите детекции, лежащем в нанограммовом, даже пикограммовом диапазоне.
Важно, что объектом настоящего изобретения является получение терапевтических антител к S100A4 с продемонстрированной активностью в отношении злокачественных и незлокачественных заболеваний.
Важно, что объектом настоящего изобретения является получение терапевтических антител к S100A4 с продемонстрированной активностью in vivo в отношении злокачественных и незлокачественных заболеваний, не подвергающихся метаболизации или разложению перед реализацией своей функции в организме.
Важно, что объектом настоящего изобретения является получение терапевтических антител к S100A4 с продемонстрированной активностью в отношении злокачественных и незлокачественных заболеваний при проявлении минимального или без проявления токсических эффектов.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять рост опухоли.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять развитие опухоли.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять ангиогенез и ангиогенез опухоли.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять миграцию эндотелиальных клеток.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять раковые стволовые клетки.
Объектом настоящего изобретения является получение антитела к S100A4, которое может подавлять воспалительные процессы. Краткое описание чертежей
Фигуры 1-3. Экспрессия белка S100A4, определяемая анализом вестерн-блоттинг. На Фигуре 1 представлены уровни экспрессии S100A4 в общих экстрактах опухолевых клеточных линий различной природы и мышиной клеточной линии эмбриональных фибробластов NIH3T3. На Фигуре 2 представлены уровни экспрессии S100A4 в общем экстракте опухоли, полученном на моделях ксенотрансплантатов НСТ116, MiaPACA-2 и ВхРС3. На Фигуре 3 представлены уровни экспрессии S100A4 в общем экстракте, полученном из опухолевой клеточной линии MDA-MB-231 и раковых стволовых клеток, выделенных из данной клеточной линии.
Фигуры 4-11. Иммуногистохимический анализ экспрессии S100A4. Сравнительный Иммуногистохимический анализ экспрессии и распространения S100A4 в опухолях, полученных из двух клеточных линий аденокарциномы поджелудочной железы Panc1 и ВхРСЗ, между 5С3 и наиболее часто упоминаемым кроличьим поликлональным антителом (фирмы Dako) к S100A4, используемым для гистологии. Фигуры 4-7 выполнены при увеличении Х 40. Фигуры 8-11 выполнены при увеличении Х 120. На Фигуре 4 представлен пример, показывающий более высокий уровень экспрессии S100A4 в инвазивных передних частях, чем в центре опухоли в образце, полученном на модели ксенотрансплантата клеточной линии ВхРС3, окрашенном с использованием мышиного моноклонального антитела 5С3. На Фигуре 5 представлен пример, показывающий более высокий уровень экспрессии S100A4 в инвазивных передних частях, чем в центре опухоли в образце, полученном на модели ксенотрансплантата клеточной линии ВхРС3, окрашенном с использованием кроличьего поликлонального антитела фирмы Dako. На Фигуре 6 представлено окрашивание неродственным мышиным моноклональным антителом к полигистидину, используемое в качестве отрицательного контроля в опухоли, полученной на модели ксенотрансплантата клеточной линии ВхРС3. На Фигуре 7 представлено отрицательное контрольное окрашивание без первичного антитела в образце опухоли, полученной на модели ксенотрансплантата клеточной линии ВхРС3. На Фигуре 8 представлен высокий уровень экспрессии S100A4 в цитоплазме и ядрах опухоли, полученной на модели ксенотрансплантата клеточной линии Panc-1, окрашенной мышиным моноклональным антителом 5С3. На Фигуре 9 представлен высокий уровень экспрессии S100A4 в цитоплазме и ядрах опухоли, полученной на модели ксенотрансплантата клеточной линии Panc-1, окрашенной кроличьим поликлональным антителом фирмы Dako. На Фигуре 10 представлено окрашивание неродственным мышиным моноклональным антителом к полигистидину, используемое в качестве отрицательного контроля в опухоли, полученной на модели ксенотрансплантата клеточной линии Panc-1. На Фигуре 11 представлено отрицательное контрольное окрашивание без первичного антитела в образце опухоли, полученной на модели ксенотрансплантата клеточной линии Panc-1.
Фигуры 12 и 13. 5С3 нейтрализует протеолитическую активность ММР9, индуцируемую S100A4. Протеолитическая активность матрикс металлопротеиназы (ММР) в кондиционированных средах, содержащих человеческие эндотелиальные клетки пуповинной вены (HUVEC). Среды HUVEC обрабатывают различными стимулирующими препаратами в течение 24 часов. Супернатанты центрифугируют с целью удаления дебриса и анализируют с помощью желатиновой зимографии. Более прозрачная полоса представляет активность ММР9 и ММР2. На Фигуре 12 представлено, что S100A4 повышает уровень секреции активных форм ММР9 дозозависимым образом. На Фигуре 13 представлено, что моноклональное антитело 5С3 нейтрализует продукцию активных форм ММР9, индуцируемую рекомбинантным белком S100A4.
Фигуры 14 и 15. Ингибирующий эффект ряда моноклональных антител к S100A4 на миграцию HUVEC. Перед индукцией миграции антитела инкубируют с белком S100A4 в течение 2 час. при 37°С. HUVEC обрабатывают S100A4 (1 мкМ), VEGF (3 нг/мл), комбинацией VEGF с S100A4 или комбинацией данных белков с антителами (5С3, 1Е2, 8В6, 6В9, 5А3, 5Н4) в течение 24 час. На Фигуре 14 представлены клетки, обработанные 5С3 (0,25, 0,5, 1, 2 и 4 мкМ) и 5Н4 (4 мкМ) в течение 24 час. Данные в каждой точке нормируют относительно положительного контроля (левый столбик), который представляет собой 100% миграцию. Положительный контроль соответствует клеткам, инкубируемым в основной среде для эндотелиальных клеток (ЕВМ) и добавками гемцитабина (EGM) и сыворотки телячьих эмбрионов (FCS) (полная среда). На Фигуре 15 представлены клетки, обработанные 5С3, 1Е2, 8В6, 6В9, 5А3 (2 мкМ) в течение 24 час. Данные в каждой точке нормируют относительно миграции, индуцируемой VEGF с S100A4, которая представляет собой 100% миграцию. Столбики показывают среднее ± с.о. (стандартное отклонение). ** p<0,005 ("U-критерий Манна-Уитни").
Фигуры 16 и 17. Противоопухолевая активность антитела 5C3 в опухолях человеческой поджелудочной железы (Mia РАСА-2). Самкам бестимусных голых мышей инокулируют подкожно 5×106 клеток MiaPACA-2 в 0,1 мл культуральной жидкости без добавок в верхнюю часть правого бока мышей в день 0. Когда опухоли достигают размера 65-160 мм3 для клеток MiaPACA-2, начинают лечение. Группы, подвергаемые лечению, содержат 10 животных. Натрий-фосфатный буфер (PBS), используемый в качестве отрицательного контроля, или 5C3 (25 мг/кг) вводят внутрибрюшинно три раза в неделю (1010100). Буфер конечного состава вводят в качестве контроля носителя. Размер опухоли измеряют три раза в неделю и объем опухоли рассчитывают согласно уравнению: размер опухоли = ширина2 * длина/2. В конце эксперимента (день 30 для клеток MiaPACA-2) мышей, несущих опухоли, умерщвляют и опухоли удаляют и взвешивают. Результаты для эксперимента с использованием MiaPACA-2. Графики относительного объема опухоли и массы опухоли показывают среднее ± с.о. без уточнения p>0,05, * p<0,05, *** p<0,001 ("U-критерий Манна-Уитни").
Фигура 18. Схема дозирования моноклонального антитела 5C3 у голых мышей.
Фигуры 19 и 20. Количественная оценка микрососудистой сети опухоли. Иммуногистологический анализ микрососудистой сети (мышиное моноклональное антитело CD31) из опухолей MiaPACA-2. Уровни сосудистой сети измеряют в конце эксперимента (день 30), сравнивая контрольную группу, получающую PBS, и животных, леченных моноклональным антителом 5C3. На Фигуре 19 представлена густота сосудов на определенной площади опухоли (MVD) выраженная как среднее сосудистых профилей (v.p.) на мм2. На Фигуре 20 представлена количественная оценка площади сосудов в опухоли.
Количественные оценки делают, анализируя от 8 до 39 фотографий/срез в зависимости от размера опухолей при увеличении Х 120. Изображения анализируют, используя пакет программ для получения изображений NIH ImageJ. На графиках показывают среднее ± с.о. * p<0,05 ("критерий Манна-Уитни").
Фигуры 21 и 22. Моноклональное антитело 5C3 показывает отсутствие токсических эффектов in vivo. Самкам бестимусных голых мышей инокулируют подкожно 5×106 клеток MiaPACA-2 (Фигура 21) или 1×106 клеток НСТ116 (Фируга 22) в 0,1 мл культуральной жидкости без добавок в верхнюю часть правого бока мышей в день 0. Когда опухоли достигают размера 65-160 мм3 для клеток MiaPACA-2 или 155-370 мм3 для клеток НСТ116, начинают лечение. Группы, подвергаемые лечению, содержат либо 10, либо 7 животных для клеток MiaPACA-2 (Фигура 21) или НСТ116 (Фигура 22), соответственно. PBS (отрицательный контроль) или 5C3 (25 мг/кг) вводят внутрибрюшинно три раза в неделю (1010100). Буфер конечного состава вводят в качестве контроля носителя. Массу тела измеряют три раза в неделю в течение эксперимента. На графике массы тела показывают среднее ± с.о.
Фигура 23. Определение уровней S100A4 в плазме. Уровни белка S100A4 в плазме на нескольких моделях ксенотрасплантатов на бестимусных мышах (MiaPACA-2, НСТ11 6, MDAMB-231, Colo205) по сравнению с уровнями S100A4 у животных, не имеющих опухолей (Basal-02) определяют способом сэндвичевого ELISA (твердофазный иммуноферментный анализ). Состояния MiaPACA-2+5C3 и HCT116+5C3 представляют собой уровни S100A4 в плазме, не связанного с моноклональным антителом 5C3. Уровни в плазме измеряют в конце эксперимента. На графике уровня в плазме показывают среднее ± с.о.
Фигура 24. Синергический эффект гемцитабина в комбинации с моноклональным антителом 5C3 на выживаемость клеток. Эффект гемцитабина в виде монопрепарата или в комбинации с моноклональным антителом 5C3 на жизнеспособность клеток измеряют по активности гексозаминидазы. Цитотоксический дозозависимый эффект гемцитабина синергически повышается в комбинации с моноклональным антителом 5C3. Клетки MiaPACA-2 инкубируют химиотерапевтическим препаратом в различных дозах с добавлением или без добавления 5C3 в постоянной концентрации 40 нМ или 100 нМ в течение 72 час. Выживаемость нормируют относительно положительного контроля, клеток без добавления соединений (гемцитабина или 5C3), который представляет собой 100% выживаемость.
Фигуры 25 и 26. Ингибирующий эффект моноклонального антитела 5C3 на высвобождение ИЛ-8, индуцируемое S100A4 в моноцитах ТНР-1. На Фигуре 25 представлен ответ на дозу S100A4, показанный по ИЛ-8, секретируемым моноцитами ТНР-1 через 24 часа инкубирования по сравнению с секрецией, индуцируемой липополисахаридом (ЛПС), используемым в качестве положительного контроля. На Фигуре 26 представлен эффект 5C3 на высвобождение ИЛ-8 в моноцитах ТНР-1, обработанных S100A4 в концентрации 3 мкМ в течение 24 часов. Клетки всегда обрабатывают IgG к мыши (Fc-специфическим), чтобы избежать индуцируемого Fc-рецептором высвобождения ИЛ-8. ИЛ-8 из супернатантов анализируют с помощью ELISA. Значения представляют собой среднее ± с.о.
Осуществление изобретения
Авторы настоящего изобретения неожиданно обнаруживают, что моноклональные антитела, направленные против белка S100A4, способны нейтрализовать индуцированную S100A4 миграцию эндотелиальных клеток в анализе подвижности in vitro (см. примеры ниже), а также нейтрализовать антиангиогенную способность, индуцируемую S100A4, причем оба эффекта на модели ксенотрансплантата опухоли (см. примеры ниже). Данные результаты показывают, что антитела к S100A4 эффективны в плане предупреждения и/или лечения заболеваний, ассоциированных с нежелательным ангиогенезом и метастазами, таких как рак.
Настоящее изобретение предусматривает моноклональные антитела, направленные против человеческого и мышиного белка S100A4, обозначаемые 5C3, 1Е2, 6В9, 5А3 и 8В6, которые специфически взаимодействуют с S100A4 и блокируют его ангиогенную активность. Авторы неожиданно обнаруживают, что данные антитела обладают ценной фармакологической активностью, поскольку они блокируют развитие опухоли, ангиогенез опухоли и, более того, не имеют или имеют минимальные токсические побочные эффекты in vivo. Интересно, что работа, осуществленная авторами, показывает новый блокирующий механизм действия указанных антител при миграции эндотелиальных клеток, индуцируемой S100A4.
Авторы настоящего изобретения, кроме того, продемонстрировали, что уровни S100A4 в биологической жидкости подходят в качестве диагностического маркера для раннего выявления рака. Вследствие этого настоящее изобретение также относится к способу in vitro и наборам для диагностики рака у пациента посредством определения уровней S100A4 в биологической жидкости с помощью указанных антител.
Антиангиогенные антитела, соответствующие изобретению
В первом аспекте изобретение относится к специфическому антителу к S10A4, обладающему антиангиогенной активностью, или его фрагменту, который в существенной степени сохраняет антиангиогенную активность указанного антитела, причем антитело выбрано из группы, включающей:
(i) антитело, которое распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3),
(ii) антитело, которое распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(iii) антитело, продуцируемое гибридомой ЕСАСС 11051804.
Как используют в данном контексте, в первом аспекте изобретения термин "антитело" относится к мономерному или мультимерному белку, который содержит по меньшей мере один полипептид, обладающий способностью связываться с определенным антигеном и содержащий полностью или часть вариабельной области легкой или тяжелой цепи молекулы иммуноглобулина. Термин антитело включает любой тип известного антитела, такой как, например, поликлональные антитела, моноклональное антитела и генно-инженерные антитела, такие как химерные антитела, гуманизированные антитела, приматизированные антитела, человеческие антитела и биспецифическое антитела. Более широкое определение термина "антитело" приведено ниже.
Термины "поликлональные антитела" и "моноклональное антитело" определены ниже. В конкретном варианте осуществления антитело представляет собой моноклональное антитело.
Термин "химерные антитела" понимают как антитела, сконструированные с вариабельными областями антитела одного вида животного (обычно млекопитающего, в организме которого генерируют моноклональное антитело) и константными областями другого вида животного (того вида, у которого химерное антитело предполагают использовать). Цель указанной конструкции состоит в получении антитела на основе оригинального моноклонального антитела, но которое менее иммуногенно и лучше переносится пациентом, которого предполагают лечить, с увеличенным полупериодом существования в сыворотке и которое может распознаваться иммунологическими эффекторными механизмами, т.е. комплементом, Fc-рецептором цитотоксических клеток или другими специфическими иммуноглобулиновыми рецепторами, которые проявляют видоспецифичность. В предпочтительном варианте осуществления химерные антитела формируют из мышиных вариабельных областей и человеческих константных областей.
Термин "гуманизированное антитело" понимают как антитело, выделенное из организма, отличного от человека, как правило, мышиное антитело, которое сохраняет антигенсвязывающие свойства родительского антитела, но которое менее иммуногенно в организме человека. Это может быть достигнуто с помощью различных способов, которые включают (а) прививание полных нечеловеческих вариабельных доменов в человеческие константные области с генерацией химерных антител; (b) прививание только нечеловеческих участков, определяющих комплементарность (CDR) в человеческий скелет и константные области при сохранении или без сохранения важных остатков скелета и (с) трансплантацию полных нечеловеческих вариабельных доменов, но "маскирование из" участком, подобным человеческому вариабельному домену, путем замены поверхностных остатков.
Термин "приматизированное антитело" понимают как рекомбинантное антитело, с которым проведены генетические манипуляции, чтобы оно содержало тяжелый и легкий вариабельные домены обезьяньего антитела (или антитело другого примата), в частности, антитело макака-крабоеда, и содержащее последовательности человеческого константного домена, предпочтительно константный домен человеческого γ 1 или -4 иммуноглобулина (или вариант РЕ). Получение данных антител описано в статье Newman et al., Biotechnology, 10:1458-1460 (1992) и патентных документах US 5658570 и US 6113898. Описано, что данные антитела демонстрируют высокую степень гомологии с человеческими антителами, т.е. 85-98%, они имеют человеческие эффекторные функции, они обладают пониженной иммуногенностью и могут показывать высокую аффинность к человеческим антигенам. Другие очень эффективные средства генерации рекомбинантных антител описаны в статье Newman, Biotechnology, 10:1455-1460 (1992).
Термин "человеческое антитело" понимают как антитело, полностью содержащее человеческие легкую и тяжелую цепи, а также константные области, полученные с помощью любого из известных стандартных способов. Более широкое определение представлено ниже Определения".
Термин "биспецифические антитела" или "бифункциональные антитела" раскрыты ниже.
Изобретение также охватывает применение вышеупомянутых фрагментов различных типов антител, которые в существенной степени сохраняют антиангиогенную активность антитела. Термин "фрагмент антитела" включает фрагменты антитела, такие как Fab, F(ab’)2, Fab’, одноцепочечные фрагменты Fv (scFv), диатела и нанотела.
Разложение антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых фрагментами "Fab", каждый с одним антигенсвязывающим центром, и один остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab’)2, который имеет два антигенсвязывающих центра и который еще способен к перекрестному связыванию с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный антигенсвязывающий и распознающий антиген центр. Данный участок состоит из димера вариабельного домена вариабельной легкой цепи и тяжелой цепи, находящихся в сильной нековалентной ассоциации. В данной конфигурации три гипервариабельных участка каждого вариабельного домена взаимодействуют для определения антигенсвязывающего центра на поверхности димера VH-VL В целом шесть гипервариабельных участков придают антителу специфичность антиген-антитело. Однако, даже один вариабельный домен (или половина Fv, который содержит только три гипервариабельных участка, специфических в отношении антигена) обладает способностью распознавания и связывания антигена, хотя при более низкой аффинности, чем полный центр связывания.
Фрагмент Fab содержиттакже константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab’ отличаются от фрагментов Fab тем, что дополнены несколькими остатками по карбокси-концу домена СН1 тяжелой цепи, включая один или более остатков цистеина шарнирной области антитела.
Фрагменты антитела "одноцепочечный Fv" или "scFv" содержат домены VH и VL антитела, где указанные домены находятся в одной полипептидной цепи. Предпочтительно, когда полипептид Fv дополнительно содержит линкерный полипептид между доменами VH и VL, который позволяет scFv формировать необходимую структуру для связывания антигена. В плане обзора scFv, см. раздел, написанный Pluckthun в монографии The Pharmacology of Monoclonal Antibodies, т.113, под ред. Rosenburg and Moore, Springer-Verlag, N.Y., стр.269-315 (1994).
Термин "диатела" относится к маленьким фрагментами антитела с двумя антигенсвязывающими центрами, причем данные фрагменты содержат вариабельный домен тяжелой цепи (VH), соединеный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким, чтобы обеспечить возможность спаривания двух доменов в одно и той же цепи, домены заставляют спариваться с комплементарными доменами другой цепи и создают два антигенсвязывающих центра. Диатела описаны более подробно, например, в документах ЕР 404097, WO 93/11161 и статье Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
Термин "нанотела" означает структуры маленького размера (15 кД), образованные только антигенсвязывающим участком тяжелой цепи (фрагмент VH) иммуноглобулинов. Данные нанотела в основном получают после иммунизации животных семейства Camelidae, таких как верблюды, ламы и дромадеры, в основном лам, а также семейства акул, характерной чертой которых является наличие антител, у которых в природе отсутствует легкая цепь и которые распознают антиген с помощью вариабельного домена тяжелой цепи. Тем не менее, для нанотел, полученных из данных источников, необходим процесс гуманизации для их терапевтического применения. Другим потенциальным источником получения нанотел является получение из антител, выделенных из различных человеческих образцов, путем разделения доменов вариабельной области VH и VL. Нанотела дают преимущества, такие как снижение стоимости получения относительно целых антител, стабильность и снижение иммуногенности.
Другие фрагменты антитела перечислены ниже.
Антитела, соответствующие настоящему изобретению, обладают антиангиогенной активностью. Выражение "обладающий антиангиогенной активностью", как используют в данном контексте, относится к способности антител ингибировать индуцированный S100A4 ангиогенез. Антиангиогенную активность можно определить in vitro по определению способности антитела или его фрагмента блокировать индуцированную S100A4 миграцию клеток HUVEC, как показано, например, в примере ниже настоящей заявки, или in vivo по определению способности антитела блокировать формирование сосудистой сети опухоли в карциномах, полученных при имплантации опухолевых клеток, обладающих сверхэкспрессией S100A4, как описано в примере 11 настоящего изобретения. Соответствующее настоящему изобретению антитело к S100A4 считают антиангиогенным, если оно блокирует по меньшей мере 100%, по меньшей мере 90%, по меньшей мере 80%, по меньшей мере 70%, по меньшей мере 60%, по меньшей мере 50%, по меньшей мере 40%, по меньшей мере 30%, по меньшей мере 20% или по меньшей мере 10% ангиогенной активности белка S100A4.
Фрагменты антитела, включенные в первый аспект настоящего изобретения, сохраняют способность связываться с антигеном S100A4 полного антитела, из которого они выделены, и они осуществляют, а также сохраняют функцию ингибирования ангиогенной активности белка S100A4.
Термин "сохраняет антиангиогенную активность специфического белка к S100A4", как используют в данном контексте, относится к способности фрагмента антитела проявлять в существенной степени антиангиогенную активность полного антитела. Антиангиогенную активность можно определить in vitro по определению способности антитела или его фрагмента блокировать индуцированную S100A4 миграцию клеток HUVEC, как показано, например, в примере 9 настоящей заявки или in vivo по определению способности антитела блокировать формирование сосудистой сети опухоли в карциномах, полученных при имплантации опухолевых клеток, обладающих сверхэкспрессией S100A4, как описано ниже в примерах настоящего изобретения. Ингибирование формирования сосудистой сети опухоли можно измерить как уменьшение количества микрососудов по сравнению с животными, не леченными антителом или как уменьшение густоты микрососудов по сравнению с животными, на леченными антителом. Фрагмент антитела сохраняетантиангиогенную активность антитела, если оно показывает по меньшей мере 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55% или 50% активности антитела.
Антитела, используемые в изобретении, должны быть специфическими в отношении белка S100A4. Термин "специфическое" относится к способности антител специфически связываться с белком S100A4 и не связываться с другими белками семейства S100.
Для идентификации антител с требуемой специфичностью можно использовать иммунохимические анализы, такие как иммунофлуоресценция, проточная цитометрия, вестерн-блоттинг и анализы ELISA, радиоиммуноанализа, иммуногистохимические анализы, реакции иммунопреципитации или другие иммунохимические анализы, известные в области техники. Ряд протоколов конкурентного связывания или иммунорадиометрических анализов известен в уровне техники. Указанные иммуноанализы, как правило, включают измерение формирования комплекса между антителом и иммуногеном белка S100A4.
Антитело или его фрагмент, соответствующие первому аспекту изобретения, выбраны из группы, включающей:
(i) антитело, которое распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3),
(ii) антитело, которое распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(iii) антитело, продуцируемое гибридомой ЕСАСС 11051804.
Выражение "антитело, которое распознает эпитоп S100A4", указывает на то, что антитело способно показывать специфическое связывание с эпитопом без проявления связывания в существенной степени с другими эпитопами, не содержащими данную последовательность. Подходящие средства для определения, способно ли антитело специфически связываться с эпитопом, показаны ниже в примерах настоящего изобретения, в котором пептиды, представляющие собой полную последовательность белка-мишени, тестируют в отношении антитела или его фрагмента. Считают, что антитело специфически связывается с заданным эпитопом, если оно связывается с пептидом, содержащим последовательность эпитопа с существенно более высокой аффинностью, чем с пептидом, который не содержит последовательность данного эпитопа. Термин "существенно более высокая аффинность", как используют в данном контексте, относится к уровню аффинности для определенной последовательности аминокислот, который отличается от уровня другой последовательности аминокислот при определении с использованием заданного измерительного устройства или способа. Предпочтительно, когда аффинность связывания антитела и пептида, содержащего эпитоп, по меньшей мере на один порядок величины выше, по меньшей мере на два порядка величины, по меньшей мере на три порядка величины выше, по меньшей мере на четыре порядка величины, по меньшей мере на пять порядков величины выше, по меньшей мере на шесть порядков величины выше, чем аффинность связывания антитела и пептида, который не содержит последовательность эпитопа. Константа ассоциации (Ka) связывания с существенно высокой аффинностью составляет, например, по меньшей мере 107 M-1, предпочтительно по меньшей мере 108 М-1 и более предпочтительно по меньшей мере 109 М-1 или ниже.
Термин "S100A4" определяют в разделе "Определения". Термин также включает все физиологически приемлемые формы посттрансляционных химических модификаций, например, гликозилирование, фосфорилирование или ацетилирование и т.п., при условии, что сохраняется функциональность белка. Указанный термин охватывает S100A4 любого вида млекопитающих, включая, но без ограничения перечисленным, домашних и сельскохозяйственных животных (коров, лошадей, свиней, овец, коз, собак, кошек или грызунов), приматов и человека. Предпочтительно, когда S100A4 является человеческим.
Первый аспект изобретения предусматривает применение функционально эквивалентных вариантов S100A4. Как используют в данном контексте, термин "функционально эквивалентный вариант S100A4" понимают как любую молекулу, имеющую общую с S100A4 по меньшей мере ангиогенную функцию, описанную в настоящее изобретении, как ассоциированную с S100A4, как in vitro, так и in vivo, и имеющую минимальную идентичность в последовательности аминокислот. Варианты S100A4 могут быть как природными, так и искусственными.
Выражение "природный вариант" относится ко всем тем вышеописанным вариантам человеческого S100A4, которые в естественных условиях присутствуют у других видов, т.е. ортологам S100A4. Указанные природные варианты включают, но без ограничения перечисленным S100A4 коров, соответствующий предсказанной последовательности с регистрационным номером DAA31755.1 (вариант от 21 мая 2010 г.), S100A4 крыс, соответствующий предсказанной последовательности с регистрационным номером NP_036750.1 (вариант от 10 апреля 2011 г.), S100A4 мыши, соответствующий предсказанной последовательности с регистрационным номером NP_035441.1 (вариант от 29 мая 2011 г.), S100A4 собак, соответствующий предсказанной последовательности с регистрационным номером NP_001003161.1 (вариант от 19 февраля 2011 г.). Природные варианты S100A4, подходящие для применения в первом аспекте настоящего изобретения, могут быть также получены из указанных последовательностей путем инсерции, замены или делеции одной или более аминокислот и включают природные аллели, варианты, возникающие в результате альтернативного процессинга, а также секретируемые и укороченные формы, существующие в естественных условиях.
S100A4, используемый в настоящем изобретении, может быть, следовательно, природной последовательностью, когда она содержит полипептид, имеющий последовательность аминокислот, как S100A4, выделенный из природы. Данные полипептиды природной последовательности можно выделить из природного источника или их можно получить рекомбинантными и/или синтетическими способами. Таким образом S100A4, соответствующий изобретению, может представлять собой рекомбинантный белок, полученный путем экспрессии полинуклеотида, кодирующего S100A4 или его функционально эквивалентный вариант, в гетерологичном организме, таком как бактерия, дрожжи или клетка насекомого или млекопитающего. Данный рекомбинантный белок можно получить в виде слитого белка в амино-концевым хвостом из остатков гистидина, облегчающим его дальнейшую очистку. Экспрессию и очистку указанных белков можно осуществить согласно способам, известным компетентному специалисту в области техники и описанным в уровне техники.
В предпочтительном варианте осуществления S100A4 имеет человеческую природу, предпочтительно последовательность SEQ ID NO:21. В другом предпочтительном варианте осуществления S100A4 является результатом экспрессии слитого белка, содержащего последовательность человеческого S100A4 с амино-концевым хвостом из трех дополнительных аминокислот, последовательность которого представляет собой SEQ ID NO:25.
SEQ ID NO:25

Альтернативно S100A4 может представлять собой искусственный функционально эквивалентный вариант S100A4, который можно получить рекомбинантными и/или синтетическими способами.
Дополнительная информация относительно термина "вариант" раскрывается ниже.
Варианты S100A4, предусматриваемые в первом аспекте настоящего изобретения, демонстрируют по меньшей мере одну из функций S100A4, такую как без ограничения перечисленным:
- Способность к стимуляции активности металлопротеиназы матрикса ММР9, которую можно определить с помощью способа, описанного ниже в примерах настоящего изобретения.
- Способность к индукции миграции эндотелиальных клеток, которую можно определить с помощью способа, описанного ниже в примерах настоящего изобретения.
- Способность к индукции развития опухоли у голых мышей, которую можно определить с помощью способа, описанного ниже в примерах настоящей заявки.
- Ангиогенная способность или способность формирования микрососудистой сети опухоли, которую можно определить с помощью способа, описанного ниже в примерах настоящей заявки.
- Способность вызывать воспалительную реакцию в моноцитах, опосредованную секрецией ИЛ-8, которую можно определить с помощью способа, описанного ниже в примерах настоящей заявки.
Кроме того, функционально эквивалентные варианты S100A4, предусматриваемые в первом аспекте изобретения, включают полипептиды, показывающие близость или идентичность по меньшей мере 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 90%, 95%, 97%, 99% с различными вышеописанными природными вариантами S100A4. Степень идентичности между двумя полипептидами определяют при использовании алгоритмов, имеющихся в компьютере и способов, которые широко известны компетентным специалистам в области техники. Предпочтительно, когда идентичность между двумя последовательностями аминокислот определяют с помощью алгоритма BLASTP (см. работу BLAST Manual (Руководство по BLAST), Altschul, S. etal., NCBI NLM NIH Bethesda, Md. 20894, статью Altschul, S., et al., J., 1990, Mol. Biol. 215:403-410). Способ расчета степени идентичности приведен в разделе "Определения".
Выражение "экспрессия в существенной степени сохраняет антиангиогенную активность указанного антитела" означает, что антитело, соответствующее первому аспекту изобретения, не может полностью потерять антиангиогенную активность.
Как правило, предусматривают также модификации в последовательности аминокислот антитела, соответствующего изобретению. Например, может потребоваться улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты последовательностей аминокислот антитела получают путем интродукции подходящих изменений нуклеотидов в нуклеиновую кислоту, кодирующую антитело, или посредством синтеза пептидов. Данные модификации включают, например, удаления и/или инсерции и/или замены остатков в последовательностях аминокислот антитела. Любую комбинацию удаления, инсерции и замены осуществляют для достижения конечной конструкции при условии, что конечная конструкция обладает требуемыми характеристиками, т.е. специфичностью связывания S100A4 и антагонистической антиангиогенной активностью указанного белка. Изменения аминокислот могут также изменить пост-трансляционные процессы антитела, такие как изменение количества или положения центров гликозилирования.
Некоторые инсерции в последовательности аминокислот включают слияния по аминоконцу и/или карбоксиконцу, варьирующие по длине от одного остатка до полипептидов, содержащих одну сотню или более остатков, а также инсерции в последовательность из одного или нескольких остатков аминокислот. Некоторые примеры концевых инсерции включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие варианты на основе инсерции молекулы антитела включают слияние фермента или полипептида, увеличивающего полупериод существования антитела в сыворотке, с N- или С-концом антитела.
Другим типом варианта является вариант, полученный заменой аминокислот. Данные варианты имеют по меньшей мере один остаток аминокислоты антитела, замещенный другим остатком. Центры, представляющие большой интерес в плане проведения мутагенеза посредством замены в антителе, включают гипервариабельные участки, но предусматривают также изменения в FR (каркасные участки).
В контексте настоящего изобретения, термин "антиген" относится к S100A4.
Специфическое антитело к S100A4, соответствующее первому аспекту изобретения, распознает эпитоп антигена S100A4. Авторы обнаруживают, что антиангиогенные антитела, соответствующие изобретению, распознают эпитопы, содержащиеся на участке, определяемом последовательностью ELPSFLGKRT (SEQ ID NO:3) или последовательностью EGFPDKQPRKK (SEQ ID NO:24) S100A4. Таким образом, в предпочтительном варианте осуществления антитело распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3). В другом предпочтительном варианте осуществления антитело распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24).
Выражение "распознают эпитоп" означает, что антитело может связываться с эпитопом, как определено в разделе "Определения". Эпитоп может быть сформирован полной последовательностью ELPSFLGKRT (SEQ ID NO:3) или EGFPDKQPRKK (SEQ ID NO:24) либо несколькими аминокислотами данных последовательностей.
Специфическое антитело к S100A4, соответствующее первому аспекту изобретения, может также представлять собой моноклональное антитело, как определено ранее в разделе "Определения". Таким образом в предпочтительном варианте осуществления специфическое антитело к S100A4, соответствующее первому аспекту изобретения, или его фрагмент представляет собой моноклональное антитело.
Настоящее изобретение предусматривает моноклональные антитела, продуцируемые различными гидридомными клеточными линиями. В предпочтительном варианте осуществления специфическое антитело к S100A4 или его фрагмент продуцирует гибридома, выбранная из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804 или ее фрагмента.
В контексте настоящего изобретения, термин "гибридная клетка" или "гибридома" понимают как продукт слияния клона В-клеток, происходящего из одной уникальной стволовой клетки. В частности, моноклональные антитела по первому аспекту изобретения, соответствуют моноклональным антителам к S100A4, обозначенным в экспериментальной части настоящего документа как 5C3, 6В9, 5А3, 1Е2 и 8В6, которые получают из гибридом, генерированных авторами и идентифицированными как 5C3-1B8-1F4, 6В9-1Е8-2А8, 5А3-4А6-5 В6, 1E2-2H4-2G8 и 8B6-2F6-1Н9-1Н10, соответственно. Данные гибридомы депонированы перед подачей настоящей патентной заявки в Европейской коллекции клеточных культур (ЕСАСС), Porton Down, Salisbury, SP4 OJG, United Kingdom, как юридически признанном учреждении для данной цели в соответствии с Будапештским договором от 28 апреля 1977 по международному признанию депозита микроорганизмов.
Депозиторами являются Francesc Mitjans и Marc Masa из Leitat Technological Center, находящего по адресу Baldiri Reixach 15-21 Helix Building, Barcelona, 08028, Spain.
Европейская коллекция клеточных культур (ЕСАСС) дает гибридомам 5C3-1B8-1F4, 6В9-1Е8-2А8, 5А3-4А6-5В6, 1E2-2H4-2G8 и 8B6-2F6-1H9-1H10 соответствующие номера депозитов ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804. Условия культивирования указанных гибридомных линий, которые позволяют получить моноклональные антитела к S100A4, соответствующие изобретению, описаны в контексте способа получения моноклональных антител, соответствующих изобретению.
В настоящем документе гибридомы 5C3-1B8-1F4, 6В9-1Е8-2А8, 5А3-4А6-5В6, 1E2-2H4-2G8 и 8B6-2F6-1H9-1H10, а также антитела, продуцируемыеданными гибридомами, обозначают сокращенным названием 5C3, 6В9, 5А3, 1Е2 и 8В6, соответственно.
Изобретение также предусматривает фрагменты указанных специфических моноклональных антител к S100A4, соответствующих первому аспекту изобретения, которые сохраняют способность ксвязыванию с S100A4, а также антиангиогенную способность. Способность к связыванию можно проверить с помощью способов, известных компетентному специалисту в области техники, таких как ELISA или вестерн-блоттинг, как описано ниже в примерах настоящего изобретения. Способность к сохранению антиангиогенной способности можно проверить с помощью способов, известных компетентному специалисту в области техники, таких как описанные ниже в примерах настоящего изобретения.
Указанный "фрагмент" относится к фрагменту последовательности антитела, который соответствует одной или нескольким частям последовательности аминокислот упомянутого моноклонального антитела, которое сохраняет способность связывания с S100A4, и, вследствие этого, полипептид должен включать последовательность 6 участков CDR, которые можно использовать для получения антител, определенных в контексте первого аспекта изобретения, таких как, без ограничения перечисленным, генно-инженерные антитела, например, химерные антитела, гуманизированные антитела или биспецифическое антитела. Указанный "фрагмент" можно также использовать для получения фрагментов антитела, таких как Fab, F(ab’)2, Fab’, одноцепочечные фрагменты Fv(scFv), диатела или нанотела. Кроме того, фрагмент сохраняет способность блокирования ангиогенеза.
Фрагменты Fab и F(ab’)2 можно получить с помощью ферментного или химического расщепления интактных моноклональных антител, соответствующих первому аспекту изобретения.
Расщепление папаином моноклонального антитела, соответствующего изобретению, дает два идентичных антигенсвязывающих фрагмента, обозначаемых как фрагменты "Fab", каждый с одним антигенсвязывающим центром. В свою очередь, фрагмент "F(ab’)2", который имеет два антигенсвязывающих центра, получают путем обработки пепсином.
Кроме того, "фрагмент" дает возможность получить фрагменты антитела другого типа, такие как фрагменты Fab’, одноцепочечные фрагменты Fv (scFv) или диатела, с помощью способов генетической инженерии.
В предпочтительном варианте осуществления специфическое антитело к S100A4 или его фрагмент продуцирует гибридома ЕСАСС 10022401.
Настоящее изобретение предусматривает выделенную последовательность аминокислот, содержащую SEQ ID NO:1. Данная последовательность аминокислот охватывает FR и CDR вариабельной области легкой цепи моноклонального антитела, направленного против S100A4. В частности, последовательности вариабельной области легкой цепи, а также соответствующие FR и CDR являются следующими:
Настоящее изобретение предусматривает выделенную последовательность аминокислот, содержащую SEQ ID NO:2. данная последовательность аминокислот охватывает FRs и CDRs вариабельные области тяжелой цепи моноклонального антитела, направленного против человеческого или мышиного S100A4. В частности, последовательности вариабельной области тяжелой цепи, а также соответствующие FR и CDR являются следующими:
Указанные последовательности соответствуют антителу, продуцируемому гибридомой ЕСАСС 10022401. Таким образом, в предпочтительном варианте осуществления антитело или его фрагмент содержит по меньшей мере область VL, содержащую последовательность SEQ ID NO:1, и по меньшей мере область VH, содержащую последовательность SEQ ID NO:2, либо его функционально эквивалентный вариант, который сохраняет в существенной степени антиангиогенную активность.
Термин "VL" относится к вариабельной области легкой цепи антитела, тогда как термин "область VH" относится к вариабельной области тяжелой цепи антитела.
Выражение "его функционально эквивалентный вариант, который сохраняет в существенной степени антиангиогенную активность", относится к любой молекуле, имеющей общую с антителом, соответствующим изобретению, антиангиогенную функцию как in vitro, так и in vivo, и обладающей минимальной идентичностью с последовательностью аминокислот. Функционально эквивалентные варианты антитела, соответствующие изобретению, можно получить из указанных последовательностей путем инсерции, замены или делеции одной или более аминокислот, а также можно получить рекомбинантными и/или синтетическими способами.
Функционально эквивалентные варианты антител, соответствующих изобретению, должны сохранять свою способность связывания с антигеном S100A4, а также способность ингибирования ангиогенной функции белка S100A4. Данную функцию можно проверить с помощью способов, известных компетентным специалистам в области техники, например, посредством анализа эндотелиальной миграции с использованием VEGF и S100A4, как описано в примере 9 настоящей заявки.
Функционально эквивалентные варианты антител, соответствующих изобретению, включают полипептиды, показывающие идентичность по меньшей мере 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 90%, 95%, 97%, 99% с вышеупомянутыми полипептидными последовательностями. Степень идентичности между двумя полипептидами определяют при использовании алгоритмов, имеющихся в компьютере, и способов, которые широко известны компетентным специалистам в области техники. Предпочтительно, когда идентичность между двумя последовательностями аминокислот определяют с помощью алгоритма BLASTP (см. работу BLAST Manual (Руководство по BLAST), Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, статью Altschul, S., et al., J., 1990, Mol. Biol. 215:403-410). Степень идентичности рассчитывают согласно способу, описанному в разделе "Определения".
Настоящее изобретение предусматривает выделенную последовательность аминокислот, содержащую SEQ ID NO:3. Данная аминокислота соответствует эпитопу или антигенной детерминанте человеческого или мышиного S100A4.
SEQ ID NO:3 ELPSFLGKRT
В одном варианте осуществления настоящего изобретения предусматривают антитело или его фрагмент, который специфически связывается с полипептидом, содержащим SEQ ID NO:3.
В одном варианте осуществления настоящего изобретения предусматривают антитело или его фрагмент, который специфически связывает человеческий или мышиный полипептид S100A4, продуцируемый путем иммунизации млекопитающего полипептидом, содержащим SEQ ID NO:3.
В одном варианте осуществления настоящего изобретения антитело или его фрагмент выбраны из человеческого антитела или его фрагмента, гуманизированного антитела или его фрагмента, поликлонального антитела или его фрагмента, моноклонального антитела или его фрагмента, антитела Fab и химерного антитела или его фрагмента.
В одном варианте осуществления настоящего изобретения предусматривают моноклональное антитело, содержащее полипептид легкой цепи, включающий SEQ ID NO:1.
В одном варианте осуществления настоящего изобретения предусматривают моноклональное антитело, содержащее полипептид тяжелой цепи, включающий SEQ ID NO:2.
В одном варианте осуществления настоящего изобретения предусматривают моноклональное антитело, содержащее каркасные участки (FR) и участки, определяющие комплементарность (CDR), причем моноклональное антитело содержит легкую цепь, включающую SEQ ID NO:1, и тяжелую цепь, включающую SEQ ID NO:2.
В одном варианте осуществления настоящего изобретения моноклональное антитело выбрано из человеческого антитела, гуманизированного антитела и химерного антитела или его фрагмента.
В одном варианте осуществления настоящего изобретения моноклональное антитело:
a) реагирует только с человеческим или мышиным белком S100A4 или
b) блокирует механизм действия человеческого или мышиного белка S100A4 или
c) блокирует in vitro или in vivo функциональную активность человеческого или мышиного белка S100A4 или
d) блокирует промиграционный эффект, индуцируемый человеческим или мышиным белком S100A4 или человеческим или мышиным белком S100A4, в комбинации с VEGF в эндотелиальных клетках или
е) блокирует рост опухоли или
f) блокирует развитие опухоли или
g) блокирует ангиогенез опухоли или
h) блокирует диссеминацию клеток и образование метастазов или
i) блокирует воспалительные процессы или
j) блокирует раковые стволовые клетки или
k) имеет любую комбинацию вышеуказанных а) - j).
В одном варианте осуществления настоящего изобретения предусматривают моноклональное антитело или его фрагмент включающий SEQ ID NO:1 и SEQ ID NO:2, причем указанное антитело или фрагмент является моновалентным или бивалентным. Настоящее изобретение, кроме того, предусматривает гидридомную клеточную линию, способную продуцировать моноклональное антитело, соответствующее любому из представленных в данном контексте вариантов осуществления.
Настоящее изобретение, крометого, предусматривает моноклональное антитело, получаемое с помощью гидридомной клеточной линии, депонированной под регистрационным номером 10022401 в Европейской коллекции клеточных культур (ЕСАСС).
В одном варианте осуществления настоящего изобретения предусматривают выделенный полинуклеотид, содержащий SEQ ID NO:4, кодирующий FR и CDR вариабельной области легкой цепи моноклонального антитела.
SEQ ID NO:4

В одном варианте осуществления настоящего изобретения предусматривают выделенный полинуклеотид, содержащий SEQ ID NO:5, кодирующую FR и CDR вариабельной области тяжелой цепи моноклонального антитела.
SEQ ID NO:5

В одном варианте осуществления настоящего изобретения предусматривают выделенный полинуклеотид, содержащий SEQ ID NO:6, кодирующий участок эпитопа человеческого белка S100A4.
SEQ ID NO:6 GAGCTGCCCAGCTTCTTGGGGAAAAGGACA
В другом предпочтительном варианте осуществления специфическое антитело к S100A4, соответствующее изобретению, или его фрагмент продуцирует гибридома ЕСАСС 11051801.
В другом предпочтительном варианте осуществления специфическое антитело к S100A4, соответствующее изобретению, или его фрагмент продуцирует гибридома ЕСАСС 11051802.
В другом предпочтительном варианте осуществления специфическое антитело к S100A4, соответствующее изобретению, или его фрагмент продуцирует гибридома ЕСАСС 11051803.
В другом предпочтительном варианте осуществления специфическое антитело к S100A4, соответствующее изобретению, или его фрагмент представляет собой антитело, продуцируемое гибридомой ЕСАСС 11051804.
Моноклональные антитела, соответствующие первому аспекту изобретения, демонстрируют, что они способны блокировать способность к миграции человеческих эндотелиальных клеток. Вследствие этого в конкретном варианте осуществления изобретение относится к специфическому антителу к S100A4, обладающему антиангиогенной активностью, или его фрагменту, который в существенной степени сохраняет антиангиогенную активность указанного антитела, которое способно блокировать способность к миграции человеческих эндотелиальных клеток.
Выражение "блокировать способность к миграции человеческих эндотелиальных клеток" понимают как ингибирование способности к миграции указанных клеток по меньшей мере на 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 99%, 100%, предпочтительно по меньшей мере на 20%, более предпочтительно по меньшей мере на 30%, еще более предпочтительно по меньшей мере на 45%. Данное ингибирование способности миграции или блокирования миграции можно оценить с помощью анализов, описанных в примерах ниже настоящего изобретения.
Выражение "способность к миграции человеческих эндотелиальных клеток" относится к способности указанных клеток к движению, которое является ключевой стадией формирования неососудистой сети. Человеческие эндотелиальные клетки представляют собой клетки, выстилающие все сосуды организма млекопитающего. Человеческие эндотелиальные клетки включенные в данное определение, представляют собой, без ограничения перечисленным, человеческие эндотелиальные клетки пуповинной вены (HUVEC). В предпочтительном варианте осуществления человеческие эндотелиальные клетки представляют собой клетки HUVEC.
Гидридомные клеточные линии и способ получения моноклональных антител, соответствующих изобретению
В другом аспекте изобретение относится к способу получения моноклонального антитела, соответствующего первому аспекту изобретения, который предусматривает культивирование гидридомной клеточной линии, выбранной из тех клеточных линий, которые депонированы под регистрационным номером ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, в условиях, которые обеспечивают продукцию указанного антитела.
Способ получения моноклональных антител, соответствующих первому аспекту изобретения, можно осуществить согласно принятым способам, известным в уровне техники. В основном способ состоит из культивирования гидридомной клеточной линии в среде для культивирования, подходящей для гибридомных клеток, с целью продукции антител и секретирования их в среду, а также последующего сбора супернатанта культуральной среды, содержащей продуцируемые моноклональное антитела. Указанные антитела можно необязательно очистить принятыми средствами, такими как аффинная хроматография, белок А-сефароза, хроматография на гидроксиапатите, гель-электрофорез или диализ.
Термин "моноклональное антитело" уже определен в предшествующем аспекте.
Термин "культивирование" гидридомной клеточной линии понимают как инкубирование гибридомных клеток в присутствии подходящей среды во флаконах для инкубирования в течение необходимого времени и в условиях, подходящих для того, чтобы происходило размножение указанных клеток и продукция моноклональных антител, соответствующих изобретению. Указанное культивирование может включать использование сред для культивирования различного состава. Предпочтительно, когда на первой стадии клетки культивируют в среде, содержащей сыворотку, чтобы способствовать их размножению, и, после сбора клеток и их промывания, их культивируют в бессывроточной среде, чтобы получить антитела. Среды для культивирования, подходящие для получения антител, соответствующих данному способу, представляют собой, без ограничения перечисленным, DMEM/F12 с добавлением L-глутамина и сыворотки телячьих эмбрионов, чтобы способствовать размножению клеток, и смесь на основе среды DMEM/F12 с добавлением L-глутамина, но без сыворотки телячьих эмбрионов ("безбелковая среда") как среда для сбора антител. Среда для получения антител может также состоять из любой среды или смеси синтетических сред для культивирования клеток, состав которых и последующие добавки к ним не включают белки ("безбелковая среда") или указанные белки находятся в очень низком соотношении ("безсывороточная среда" или "среда с низким содержанием белка"), и они не принадлежат к группе иммуноглобулинов. Указанная среда должна обеспечить рост и поддержание клеток, а также секрецию антител гидридомной клеточной линией, предварительно адаптированной к росту в отсутствие сыворотки телячьих эмбрионов. В предпочтительном варианте осуществления среда, подходящая для культивирования указанных клеток, представляет собой среду, содержащую DMEM/F12 и L-глутамин. Предпочтительно, когда условия, в которых поддерживают данную культуру, предусматривают влажную среду и температуру 37°С при стандартной воздушной атмосфере или воздухе, обогащенном 5% CO2.
Вследствие этого в другом аспекте изобретение относится к гидридомной клеточной линии, выбранной из группы, включающей клеточные линии, депонированные под регистрационным номером ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804. Предпочтительно, когда клеточная линия имеет регистрационный номер ЕСАСС 10022401. В другом варианте осуществления гидридомная клеточная линия выбрана из группы, включающей клеточные линии, депонированные под регистрационным номером ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804.
Выражение "гидридомная клеточная линия" относится к клеточной линии, образованной гибридными клетками или гибридомами, как ранее определено в первом аспекте изобретения. Указанная гидридомная клеточная линия получена стандартными способами, как описано ниже в примерах настоящего изобретения. Вкратце, мышей иммунизируют человеческим рекомбинантным белком S100A4 и выделяют клетки из селезенки иммунизированной мыши, которые сливают с клетками миеломы в присутствии индуктора слияния, такого как ПЭГ-1500. Гибридомыселектируют в среде HAT и каждый отобранный клон субклонируют путем ограничивающего разведения. Клоны, подходящие для размножения, адаптируют к среде Игла в модификации Дульбекко (DMEM/F12) и замораживают, составляют гидридомные клеточные линии ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804.
В предпочтительных вариантах осуществления изобретения моноклональное антитело, полученное данным способом, может представлять собой любое из продуцируемых гибридомными клеточными линиями, описанными в контексте настоящего изобретения.
Настоящее изобретение, кроме того, предусматривает способ получения моноклонального антитела согласно любому из вариантов осуществления, представленных с данном контексте, причем указанный способ предусматривает:
(i) иммунизацию мыши очищенным человеческим или мышиным белком S100A4 или очищенным человеческим или мышиным белком S100A4 в комбинации с препаратом, эффективно индуцирующим иммунный ответ в отношении антигена;
(ii) получение одной или более клеток гибридомы,
(iii) отбор одной или более клеток, супернатанты которых:
a) реагируют только с человеческим или мышиным белком S100A4 или
b) блокируют механизм действия человеческого или мышиного белка S100A4 или
c) блокирует in vitro или in vivo функциональную активность человеческого или мышиного белка S100A4 или
d) блокирует промиграционный эффект, индуцируемый человеческим или мышиным белком S100A4 или человеческим или мышиным белком S100A4, в комбинации с VEGF в эндотелиальных клетках или
e) блокирует рост опухоли или
f) блокирует развитие опухоли или
g) блокирует ангиогенез опухоли или
h) блокирует диссеминацию клеток и образование метастазов или
i) блокирует воспалительные процессы или
j) блокирует раковые стволовые клетки или
k) имеет любую комбинацию вышеуказанных а) - j).
(iv) Получение специфической клеточной линии из любой из отобранных клеток, полученных на стадии iii), и
(v) Выделение моноклонального антитела из указанной клеточной линии.
Фармацевтические композиции, содержащие специфические антитела к S100A4, соответствующие изобретению.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество по меньшей мере одного антитела, соответствующего первому аспекту изобретения, или его фрагмента и по меньшей мере один фармацевтически приемлемый наполнитель.
В предпочтительном варианте осуществления антитело, соответствующее первому аспекту изобретения, или его фрагмент продуцирует гибридома, выбранная из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС11051802, ЕСАСС 11051803 и ЕСАСС 11051804, предпочтительно ЕСАСС 10022401.
Как используют в настоящем изобретении, выражение "фармацевтическая композиция" относится к составу, который адаптирован для введения в заданной дозе одного или нескольких терапевтически эффективных препаратов в клетку, группу клеток, орган, ткань или животному, где происходит сверхэкспрессия белка S100A4.
Выражение "фармацевтически эффективное количество" понимают как количество, способное обеспечить терапевтический эффект и которое может определить компетентный специалист в области техники с помощью обычно используемых средств.
Композиции, соответствующие изобретению, могут содержать одно или более антител, соответствующих первому аспекту изобретения, или один или более из его фрагментов, которые в существенной степени сохраняют антиангиогенную активность указанного антитела.
Композиции, соответствующие изобретению, могут также содержать одно или несколько дополнительных соединений, предназначенных для предупреждения и/или лечения патологий, при которых происходит сверэкспрессия белка S100A4, таких как рак или заболевания, ассоциированные с воспалением. Данные дополнительные соединения, такие как цитотоксические препараты, антиангиогенные препараты, антиметастатические препараты или противовоспалительные препараты, могут образовывать часть фармацевтической композиции в виде независимых структур моноклональных антител или, кроме того, формируя конъюгаты с данными антителами.
Фармацевтические композиции получают принятыми способами с одним или более фармацевтически приемлемым наполнителем.
Под выражением "фармацевтически приемлемый наполнитель понимают терапевтически неактивную субстанцию, которую, как говорят, используют для введения активного ингредиента и которая приемлема для пациента с фармакологической/токсикологической точки зрения и для фармацевта, который изготавливает его с физической/химической точки зрения в отношении композиции, состава, стабильности, приемлемости для пациента и биодоступности.
Количество и природа фармацевтически приемлемых наполнителей зависит от требуемой лекарственной формы. Фармацевтически приемлемые наполнители известны компетентному специалисту в области техники (см. монографию Fauli у Trillo С.(1993) "Tratado de Farmacia Galenica" (Справочник по фармакологии галеновых препаратов), Luzan 5, S.A. Ediciones, Madrid). Указанные композиции можно получить принятыми способами, известными в уровне техники (см. "Remington: The Science and Practice of Pharmacy" (Ремингтоновский справочник по научной и практической фармации), 20 изд. (2003), под ред. Genaro A.R., Lippincott Williams & Wilkins, Philadelphia, US).
Фармацевтические композиции, соответствующие изобретению, можно вводить подходящим путем любого типа, например, пероральным путем, местным путем, ингаляционным или парентеральным путем, так что будут включены фармацевтически приемлемые наполнители, необходимые для состава требуемой лекарственной формы. Предпочтительным путем введения фармацевтической композиции является внутривенный путь.
Выражение "пероральный путь" понимают как введение фармацевтической композиции в организм после проматывания. В конкретном варианте осуществления фармацевтическая композиция, соответствующая изобретению, может находиться в лекарственной форме, подходящей для введения пероральным путем, как в твердом виде, так и в форме жидкости. Лекарственные формы, подходящие для введения пероральным путем, могут представлять собой таблетки, капсулы, сиропы или растворы и могут содержать любой принятый наполнитель, известный в области техники, такой как связующие компоненты, например, сироп, акация, желатин, сорбит или поливинилпирролидон, наполнители, например, лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин, смазывающие компоненты для прессования, например, стеарат магния; разрыхлители, например крахмал, поливинилпирролидон, натрий гликолят крахмала или микрокристаллическая целлюлоза, либо фармацевтически приемлемые смачивающие компоненты, такие как лаурилсульфат натрия. Твердые пероральные композиции можно получить принятыми способами смешивания, наполнения или прессования. Повторные операции смешивания можно использовать для полного распределения активного ингредиента в данных композициях, где используют большие количества наполнителей. Указанные операции приняты в области техники. Таблетки можно получить, например, посредством мокрой или сухой грануляции и необязательного покрытия их согласно способам, известным в обычной фармацевтической практике, в частности, энтеросолюбильного покрытия.
С другой стороны, термин "местный путь" понимают как введение несистемным путем, и он включает нанесение фармацевтической композиции, соответствующей изобретению, наружно на эпидермис, в полость рта и закапывание указанной композиции в уши, глаза и нос, и при котором композиция в существенной степени не проникает в кровоток. Термин "системный путь" понимают как введение пероральным путем, внутривенным путем, внутрибрюшинным путем и внутримышечным путем. Количество антитело, необходимое для получения лечебного или профилактического эффекта будет, конечно, варьировать в соответствии с выбранным антителом, природой и тяжестью заболевания, которое предполагают лечить, и пациентом.
Термин "ингаляция" понимают как введение интраназальным путем и пероральной ингаляцией. Лекарственные формы, подходящие для данного введения, такие как препарат в аэрозоле или дозированном ингаляторе, можно получить с помощью принятых способов.
Как используют в данном контексте, термин "парентеральный" включает введение внутривенным путем, внутрибрюшинным путем, внутримышечным путем или подкожным путем. Как правило, предпочтительны подкожные, внутримышечные и внутривенные лекарственные формы, предназначенные для парентерального введения.
В одном варианте осуществления фармацевтические композиции, соответствующие изобретению, могут быть адаптированы для парентерального введения, такие как стерильные растворы, суспензии или лиофилизированные продукты в подходящей унифицированной лекарственной форме. Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (когда они растворимы в воде) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. Для их введения внутривенным путем служит ряд подходящих носителей, который включает солевой раствор, забуференный фосфатом (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей до той степени, при которой существует простая возможность ее инъекции. Она должна быть стабильной в плане получения и условий хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, которая содержит, например, воду, этанол, фармацевтически приемлемый многоатомный спирт, такой как глицерин, пропиленгликоль, жидкий полиэтиленгликоль и их подходящие смеси. Подходящую сыпучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания размера частиц, требуемого в случае дисперсии, и путем использования поверхностно-активных веществ. Предупреждение действия микроорганизмов может быть достигнуто с помощью различных антибактериальных и антифунгальных препаратов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тиомерсала и т.п. В большинстве случаев предпочтительно включение в композицию изотонических компонентов, например, Сахаров, полиспиртов, таких как маннит, сорбит, или хлорида натрия. Пролонгированное всасывание инъекционных композиций может быть вызвано включением препарата, который замедляет всасывание, например, алюминия и желатинмоностеарата.
Инъекционные стерильные растворы можно получить введением активного соединения в необходимом количестве в подходящий растворитель, содержащий один или комбинацию вышеупомянутых ингредиентов, как требуется, с последующей стерилизацией путем фильтрации через стерильные мембраны. Как правило, дисперсии получают включением активного соединения в стерильный носитель, содержащий базовую дисперсионную среду и остальные необходимые ингредиенты из числа ранее перечисленных. В случае стерильных порошков для получения инъекционных стерильных растворов предпочтительные способы получения представляют собой вакуумную сушку и лиофилизацию, при которых получают порошок, содержащий активный ингредиент и любой необходимый дополнительный ингредиент из его предварительно профильтрованного стерильного раствора. Антитело обычно хранят в лиофилизированной форме или в растворе. Композиции терапевтического антитела, как правило, помещают в упаковку, которая имеет стерильное входное отверстие, например, упаковку для внутривенного раствора или флакон с адаптором, который позволяет восстанавливать препарат, такой как пробка, которую можно проткнуть гиподермической инъекционной иглой.
Фармацевтическую композицию можно удобно ввести посредством импульсной инфузии, например, снижающихся доз антитела. Предпочтительно, когда дозу вводят путем инъекций, более предпочтительно - внутривенных или подкожных инъекций, отчасти зависимых от того, является ли введение срочным или постоянным.
В одном варианте осуществления фармацевтическую композицию, которая содержит антитело, соответствующее первому аспекту изобретения, получают с носителями, которые будут защищать указанное антитело от быстрого выведения из организма, например, препарат с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы введения. Могут быть использованы биоразрушаемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения данных препаратов будут понятны для компетентных специалистов в области техники. Материалы можно также получить коммерческим путем в фирмах Alza Corporation и Nova Pharmaceuticals, Inc.
Композиции с замедленным высвобождением также включают препараты кристаллов антител, суспендированные с подходящих составах, которые могут поддерживать кристаллы с суспензии. Данные препараты при введении подкожным или внутрибрюшинным путем могут давать эффект замедленного высвобождения. Другие композиции также включают антитела, заключенные в липосомах. Липосомы, содержащие данные антитела, получают с помощью известных способов, например, описанных в работах Epstein et al., Proc. Natl. Acad. Sci. USA, (1985) 82:3688-3692; Hwang et at., Proc. Natl. Acad. Sci. USA, (1980) 77:4030-4034; EP 52,322; EP 36,676; EP 88,046; EP 143,949.
Композиции, соответствующие изобретению, подходят для введения млекопитающему любого вида, предпочтительно человеку.
Настоящее изобретение далее предусматривает фармацевтическую композицию, содержащую моноклональное антитело, соответствующее любому из вариантов осуществления, представленных в данном контексте, и фармацевтически приемлемый носитель.
В одном варианте осуществления настоящего изобретения фармацевтическая композиция, кроме того, содержит химиотерапевтический препарат.
В другом варианте осуществления настоящего изобретения фармацевтическая композиция, кроме того, содержит противовоспалительный препарат.
Фармацевтические композиции, содержащие специфические антитела к S100A4 и антиметаболиты
Авторы неожиданно обнаруживают, что комбинация специфических антител к S100A4 с антиметаболитным лекарственным препаратом обладает синергическим эффектом в качестве цитотоксического препарата для лечения рака (см. ниже примеры настоящего изобретения).
Таким образом, одним аспектом настоящего изобретения является фармацевтическая композиция, содержащая специфическое антитело к S100A4 и антиметаболит.
Как используют в настоящем изобретении, выражение "фармацевтическая композиция" относится к составу, который адаптирован для введения предварительно заданной дозы одного или нескольких терапевтически эффективных препаратов в клетку, группу клеток, орган, ткань или животному, страдающему от рака.
Термин "специфическое антитело к S100A4", в контексте данного аспекта изобретения, относится к любому антителу, которое специфически распознает белок S100A4, включая антитела, ранее описанные в предшествующем уровне техники.
Термин "антиметаболит", как используют в данном контексте, относится в широком смысле к субстанциям, которые нарушают нормальный метаболизм, и субстанциям, которые ингибируют систему переноса электронов, препятствуя продукции энергетически богатых промежуточных продуктов вследствие их структурной или функциональной близости к метаболитам, которые важны для живых организмах (такие как витамины, коферменты, аминокислоты и сахариды).
Антиметаболиты, подходящие для использования в настоящем изобретении, включают, без ограничения перечисленным, антиметаболиты фолиевой кислоты (аминоптерин, деноптерин, метотрексат, эдатрексат, триметрексат, нолатрексед, лометрексол, пеметрексед, ралтитрексед, пиритрексим, птероптерин, лейковорин, 10-пропаргил-5,8-дидезазафолат (PDDF, CB3717)), аналоги пурина (кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин) и аналоги пиримидина (капецитабин, цитарабинилиара-С, децитабин, фторурацил, 5-фторурацил,доксифлуридин, флоксиридин и гемцитабин). В предпочтительном варианте осуществления антиметаболит выбран из 5-фторурацила и гемцитабина, более предпочтительно, гемцитабин. Когда пациент страдает от рака толстой кишки, химиотерапевтическими препаратами первой линии являются антиметаболиты, предпочтительно 5-фторурацил. Когда пациент страдает от рака поджелудочной железы, рака мочевого пузыря или рака желчного пузыря химиотерапевтическими препаратами первой линии являются антиметаболиты, предпочтительно гемцитабин.
В предпочтительном варианте осуществления антитело представляет собой специфическое антитело к S100A4, обладающее антиангиогенной активностью, или его фрагмент, который в существенной степени сохраняет антиангиогенную активность указанного антитела, причем антитело выбрано из группы, включающей:
(i) антитело, которое распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3),
(ii) антитело, которое распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(iii) антитело, продуцируемое гибридомой ЕСАСС 11051804.
В предпочтительном варианте осуществления антитело, соответствующее данному аспекту, представляет собой моноклональное антитело, предпочтительно представляет собой моноклональное антитело, продуцируемое гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или его фрагмент, более предпочтительно ЕСАСС 10022401.
Авторы демонстрируют, что комбинация антитела к S100A4 и антиметаболита может снизить выживаемость опухолевых клеток. Так, в предпочтительном варианте осуществления композиция способна снизить выживаемость опухолевых клеток.
Выражение "снижение выживаемости опухолевых клеток" понимают как уменьшение способности клеток к выживаемости, росту и размножению по меньшей мере на 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99%, 100%; предпочтительно по меньшей мере на 60%, еще более предпочтительно по меньшей мере на 65%, наиболее предпочтительно по меньшей мере на 70%. Данное снижение выживаемости можно оценить с помощью анализа, описанного ниже в примерах настоящего изобретения.
Термин "опухолевая клетка" понимают как злокачественная клетка, известная также как раковая или канцерогенная клетка, которая растет и делится сверх нормальных ограничений, проникая в окружающую ткань и в ряде случаев вызывая метастазы. Опухолевые клетки, которые можно лечить антителами, соответствующими настоящему изобретению, представляют собой клетки, которые способны к сверхэкспрессии белка S100A4. Данные клетки включают опухолевые клетки из известных и адаптированных клеточных линий и опухолевые клетки, находящиеся в организме пациента, страдающего от рака. Некоторыми иллюстративными неограничивающими примерами опухолевых линий, которые способны к сверхэкспрессии S100A4, являются опухолевая линия аденокарциномы толстой кишки Colo 205, клеточная линия аденокарциномы поджелудочной железы человека MiaPACA-2, клеточная линия карциномы поджелудочной железы человека Panc1, клеточная линия аденокарциномы толстой кишки НСТ116, раковые стволовые клетки, выделенные из культуры клеточной линии аденокарциномы молочной железы MDA-MB-231. Иллюстративными неограничивающими примерамиопухолевых клеток, присутствующих у пациента, страдающего от рака, и способных к сверхэкспрессии S100A4, являются опухолевые клетки из карциномы молочной железы (см. статью Rudland PS et al. Cancer Res 2000. 60(6):1595-1603), карциномы простаты (см. статью Saleem M et al. PNAS 2006. 103(40):14825-30), карциномы легкого (см. статью Tsuna M et al. Anticancer Res 2009. 29(7):2547-54), колоректальной карциномы (см. статью Cho Y et al. World J Gastroent 2005. 11(31): 4852-6), карциномы поджелудочной железы (см. статью Rosty С et al. Am J Pathol 2002. 160(1):45-50), карциномы почки (см. статью Bandiera A et al. World J Surg 2009. 33(7):1414-20), карциномы желудка (см. статью Yonemura Y et al. Clin Cancer Res 2000. 6(11):4234-42), карциномы яичников (см. статью Maelandsmo GM et al. Tumor Biol 2009. 30(1):15-25), папиллярной карциномы щитовидной железы (см. статью Min HS et al. Mod Pathol 2008. 21(6):748-55), меланомы (см. статью Andersen K et al. Mod Pathol 2004. 17(8):990-997), гепатоцеллюларной карциномы (см. статью Cui J et al. J Can Res Clin Oncol 2004. 130(10):615-22), карциномы мочевого пузыря (см. статью Agerbaek M et al. Eur Urol 2006. 50(4):777-785), инвазивной карциномы липосаркомы (см. статью Pazzaglia L et al. Anticancer Res 2004. 24(2B):967-972), нейробластомы (см. статью Bjornland K et al. J Pediatr Surg 2001. 36(7):1040-44), карциномы сквамозных клеток пищевода (см. статью Ninomiya I et al. Int J Oncol 2001. 18(4):715-20), остеосаркомы (см. статью Mathisen В et al. Clin Exp Metastasis 2003. 20(8):701-11), карциномы желчного пузыря (см. статью Nakamura Т et al. Int J Oncol 2002. 20(5):937-41), карциномы сквамозных клеток полости рта (см. статью Moriyama-Kita M et al. Oral Oncol 2004. 40(5):496-500), эндометральной карциномы (см. статью Xie R et al. Lab Invest 2009. 89(8):937-947) и медуллобластомы (см. статью Hernan R et al. Cancer Res 2003. 63(1):140-148) в числе прочих.
Опухолевые клетки, которые экспрессируют белок S100A4, можно идентифицировать принятыми способами, такими как ELISA или вестерн-блоттинг, согласно способу, описанному в настоящем изобретении.
В одном варианте осуществления опухолевые клетки, выживаемость которых понижена с помощью антител, соответствующих данному аспекту изобретения, представляют собой опухолевые клетки, выделенные из рака поджелудочной железы или рака толстой кишки, предпочтительно из рака поджелудочной железы.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей специфическое антитело к S100A4 и метаболит, предназначенной для использования с целью предупреждения и/или лечения рака или метастазов.
В другом аспекте изобретение относится к применению фармацевтической композиции, содержащей специфическое антитело к S100A4 и метаболит, для получения лекарственного средства для предупреждения и/или лечения рака или метастазов.
В другом аспекте изобретение относится к способу лечения или предупреждения рака или метастазов у пациента, который предусматривает введение данному пациенту фармацевтической композиции, содержащей специфическое антитело к S100A4 и метаболит.
Термины "предупреждение", "лечение", "рак" и "метастаз" будут определены ниже в контексте терапевтического применения антител, соответствующих изобретению.
Все конкретные варианты осуществления предшествующих аспектов применимы для данных аспектов.
Терапевтическое применение антител, соответствующих изобретению
Ангиогенез и рак
Настоящее изобретение, кроме того, предусматривает антитело или его фрагмент либо моноклональное антитело, соответствующее любому из вариантов осуществления, представленных в данном контексте, предназначенное для применения в качестве лекарственного средства.
Настоящее изобретение также предусматривает антитело или его фрагмент либо моноклональное антитело, соответствующее любому из вариантов осуществления, представленных в данном контексте, предназначенное для применения в качестве лекарственного средства для лечения опухолей.
Настоящее изобретение также предусматривает применение антитела или его фрагмента либо моноклонального антитела, соответствующего любому из вариантов осуществления, представленных в данном контексте, для изготовления лекарственного средства для лечения опухолей.
Настоящее изобретение также предусматривает способ лечения опухолей, включающий введение пациенту, нуждающемуся в данном лечении, фармацевтически эффективного количества антитела или его фрагмента либо моноклонального антитела, соответствующее любому из вариантов осуществления, представленных в данном контексте.
Антитела к S100A4, способные специфически связываться с белком S100A4, имеют применение при тех заболеваниях, при которых происходит сверхэкспрессия указанного белка.
В частности, белок S100A4 экспрессируется, как описано выше, в широком круге форм рака.
В результате лиганды белка S100A4 и, более конкретно, антитела, специфические в отношении данного белка, представляют собой потенциальные лекарственные препараты для использования в терапевтических средствах для лечения указанного заболевания.
Таким образом, в одном аспекте изобретение относится к антителу или его фрагменту, соответствующему первому аспекту изобретения, предназначенному для использования с целью предупреждения и/или лечения заболевания, выбранного из метастазов и заболевания, ассоциированного с нежелательным ангиогенезом.
В другом аспекте изобретение относится к применению антитела или его фрагмента, соответствующее го первому аспекту изобретения, для получения лекарственного средства для предупреждения и/или лечения заболевания, выбранного из метастазов и заболевания, ассоциированного с нежелательным ангиогенезом.
В другом аспекте изобретение относится к способу лечения или предупреждения заболевания, выбранного из метастазов и заболевания, ассоциированного с нежелательным ангиогенезом, у пациента, который предусматривает введение данному пациенту антитела или его фрагмента, соответствующего первому аспекту изобретения.
Термины "антитело" и "фрагмент" ранее определены в контексте первого аспекта изобретения.
Термин "предупреждение" понимают как введение антитела или его фрагмента, соответствующего первому аспекту изобретения, или содержащего его лекарственного средства на начальной или ранней стадии заболевания или для того, чтобы также предупредить его возникновение.
Термин "лечение" используют для обозначения введения антитела или его фрагмента, соответствующего первому аспекту изобретения, или содержащего его лекарственного средства для контроля развития заболевания до или после появления клинических признаков. Контроль развития заболевания понимают как благоприятные или желательные клинические результаты, которые включают, но без ограничения перечисленным, уменьшение симптомов, уменьшение продолжительности заболевания, стабилизацию патологических состояний (в частности, избежание дальнейшего ухудшения), задержка развития заболевания, улучшение патологического состояния и ремиссию (как частичную, так и полную). Контроль развития заболевания также включает увеличение продолжительности выживания по сравнению с ожидаемым выживанием, если не проводят лечение.
Термин "лекарственное средство" понимают как фармацевтическую композицию, содержащую антитело или его фрагмент, соответствующий первому аспекту изобретения.
Термин "метастаз" понимают как удаленное распространение, по существу посредством лимфо- или кровотока, клеток, вызывающих рак, и рост новых опухолей на участках, куда дошел указанный метастаз.
В контексте настоящего изобретения термин "ангиогенез", как понимают, означает физиологический процесс, который состоит из формирования новых кровеносных сосудов из существующих кровеносных сосудов. Ангиогенез известен также как неоваскуляризация.
Выражение "заболевания, ассоциированные с нежелательным ангиогенезом" относится ко всем тем заболеваниям, при которых имеет место патогенный ангиогенез, т.е. когда данный процесс вреден или нежелателен, независимо от того, раковый он или нет. Таким образом, объем настоящего изобретения исключает лечение ангиогенеза в случаях, когда он необходим, например, при заживлении ран. Заболевания, ассоциированные с нежелательным ангиогенезом, которые можно лечить соединениями, соответствующими настоящему изобретению, без ограничения перечисленным представляют собой воспалительные заболевания, в частности, хронические воспалительные заболевания, такие как ревматоидный артрит, псориаз, саркоидоз и т.п.; аутоиммунные заболевания; вирусные заболевания; генетические заболевания; аллергические заболевания; бактериальные заболевания; глазные, такие как диабетическая ретинопатия, ретинопатия недоношенных, пролиферативная атриальная ретинопатия, закупорка вены сетчатки, дегенерация желтого пятна, сенильная дисковидная дегенерация желтого пятна, глаукома, связанная с неоваскуляризацией глаза, заболевания, связанные с хориоидальной неоваскуляризацией, заболевания, связанные с неоваскуляризацией сетчатки, покраснение (угловая неоваскуляризация), отторжение трансплантата роговицы, ретролентальная фиброплазия, эпидермальный кератоконъюнктивит, дефицит витамина А, утомление от контактных линз, атопический кератит, верхний лимбический кератит, крыловидный сухой глаз, синдром Шегрена, розовые угри, фликтенулез, сифилис, микобактериальные инфекции, дегенерация липидов, ожоги разъедающими веществами, бактериальные язвы, микотические язвы, инфекции простейших, саркома Калоши, язва Мурена, краевая дегенерация Терьена, краевой кератолиз, склерит, хроническое отслоение сетчатки и т.п.; атеросклероз; эндометриоз; ожирение; сердечную недостаточность; прогрессирующую почечную недостаточность; эндотоксемию; синдром токсического шока; менингит; фиброз, вызываемый силиконом; фиброз, вызываемый асбестом; апоплекию; периодонтоз; гингивит; маскроцитозную анемию; рефракторную анемию; синдром делеции 5q; состояния, при которых васкуляризация изменяется, например, ВИЧ-инфекция, гепатит, геморрагическая телангиэктазия или болезнь Рандю-Вебера-Ослера.
В предпочтительном варианте осуществления заболевание, ассоциированное с нежелательным ангиогенезом представляет собой заболевание, выбранное из рака, ревматоидного артрита, псориаза, саркоидоза, диабетической ретинопатии, ретинопатии недоношенных, закупорки вены сетчатки, сенильной дисковидной дегенерации желтого пятна, атеросклероза, эндометриоза и ожирения, предпочтительно рак.
В конкретном варианте осуществления заболевания, ассоциированные с нежелательным ангиогенезом, представляют собой воспалительные заболевания. Термин "воспалительное заболевание" понимают как любое заболевание, при котором имеется избыточная или измененная воспалительная реакция, которая приводит к воспалительным симптомам. Данные воспалительные заболевания, которые можно лечить соединениями, соответствующим изобретению, включают, без ограничения перечисленным, болезнь Аддисона, обыкновенные угри, очаговую алопецию, амилоидоз, анкилозирующий спондилит, язвы, афтозный стоматит, артрит, артериосклероз, остеоартрит, ревматоидный артрит, бронхиальную астму, болезнь Бечета, болезнь Бека, кишечную воспалительную болезнь, болезнь Крона, хороидит, язвенный колит, глютеновую болезнь, криоглобулинемию, дегенерацию желтого пятна, дерматит, герпетиформный дерматит, дерматомиозит, инсулинозависимый диабет, ювенильный диабет, воспалительное демиелинизирующее заболевание, контрактуру Дюпюитрена, энцефаломиелит, аллергический энцефаломиелит, эндофтальмию, аллергический энтерит, синдром аутоиммунной энтеропатии, чешуйчатую узелковую эритему, анкилозирующий спондилит, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматическую лихорадку, кистозный фиброз, гингивит, гломерулонефрит, синдром Гудпасчура, синдром Грейвса, болезньХашимото, хронический гепатит, гистиоцитоз, региональный илеит, ирит, диссеминированную красную волчанку, системную красную волчанку, кожную красную волчанку, лимфогранулему, инфекционный мононуклеоз, злокачественную миастению, поперечный миелит, первичную идиопатическую микседему, нефроз, ожирение, симпатическую офтальмию, грануломатозный орхит, панкератит, панникулит, обыкновенную пузырчатку, периодонтит, узелковый полиартериит, хронический полиартрит, полимиозит, острый полирадикулит, псориаз, хроническое обструктивное легочное заболевание, пурпуру, гангренозную пиодермию, синдром Рейтера, диабетическую ретинопатию, розацею, саркоидоз, атаксический склероз, прогрессивный системный склероз, склерит, склеродермию, рассеянный склероз, диссеминированный склероз, острый передний увеит, витилиго, болезнь Виппла, заболевания, ассоциированные со СПИДом, тяжелым комбинированным иммунодефицитом и вирусом Эпштейна-Барр, такие как синдром Шегрена, остеоартикулярный туберкулез и паразитарные заболевания, такие как лейшманиоз. Предпочтительными воспалительными заболеваниями являются ревматоидный артрит, псориаз, саркоидоз, диабетическая ретинопатия, дегенерация желтого пятна, артериосклероз и ожирение.
В другом предпочтительном варианте осуществления болезнь представляет собой рак.
Термины "рак" и "опухоль" относятся к физиологическому состоянию у млекопитающих, характеризующемуся нарушением регуляции роста клеток. Антитела, специфически связывающиеся с белком S100A4, соответствующие первому аспекту изобретения, или их фрагменты используют для лечения любой формы рака или опухоли, такой как, без ограничения перечисленным, опухоли молочной железы, сердца, легкого, тонкой кишки, толстой кишки, селезенки, почки, мочевого пузыря, головы, шеи, яичника, простаты, головного мозга, поджелудочной железы, кожи, кости, костного мозга, крови, тимуса, матки, яичка и печени. В частности, опухоли, которые можно лечить указанными антителами, включают, но без ограничения перечисленным, аденому, ангиосаркому, астроцитому, эпителиальную карциному, герминому, глиобластому, глиому, гемангиоэндотелиому, гемангоисаркому, гематому, гепатобластому, лейкоз, лимфому, медуллобластому, меланому, нейробластому, остеосаркому, ретинобластому, рабдомиосаркому, саркому и тератому. В частности, форма опухоли/рака выбрана из группы акральной лентигинозной меланомы, старческой кератозной аденокарциномы, аденоидной кистозной карциномы, аденом, аденосаркомы, аденосквамозной карциномы, астроцитарных опухолей, карциномы бартолиновой железы, карциномы базальных клеток, карциномы бронхиальной железы, капиллярного карциноида, карциномы, карциносаркомы, холангиокарциномы, цистаденомы, опухоли желточного мешка, эндометриальной гиперплазии, саркомы эндометриальной стромы, эндометриоидной аденокарциномы, эпендимнои саркомы, саркомы Свинга, фокальной узелковой гиперплазии, опухолей зародышевой линии, глиобластомы, глюкагономы, гемангиобластомы, гемангиоэндотелиомы, гемангиомы, гепатоаденомы, аденоматоза печени, гепатоцеллюлярной карциномы, инсулиномы, интраэпителиальной неоплазии, интерэпителиальной неоплазии сквамозных клеток, инвазивной карциномы сквамозных клеток, крупноклеточной карциномы, лейомиосаркомы, меланомы, злокачественной меланомы, злокачественной мезотелиальной опухоли, медуллобластомы, медуллоэпителиомы, мукоэпидермоидной карциномы, нейробластомы, нейроэпителиальной аденокарциномы, узелковой меланомы, остеосаркомы, папиллярной серозной аденокарциномы, опухолей гипофиза, плазмоцитомы, псевдосаркомы, легочной бластомы, карциномы почечных клеток, ретинобластомы, рабдомиосаркомы, саркомы, серозной карциномы, мелкоклеточной карциномы, карциномы мягких тканей, опухоли, секретирующей соматостатин, сквамозной карциномы, карциномы сквамозных клеток, недифференцированной карциномы, увеальной меланомы, веррукозной карциномы, випомы, опухоли Вильмса. В одном варианте осуществления настоящего изобретения опухоль выбрана из группы, включающей карциному молочной железы, карциному простаты, карциному легкого, колоректальную карциному, карциному поджелудочной железы, карциному почки, карциному желудка, карциному яичника, папиллярную карциному щитовидной железы, меланому, гепатоцеллюлярную карциному, карциному мочевого пузыря, инвазивную карциному липосаркомы, нейробластому, карциному сквамозных клеток пищевода, остеосаркому, карциному желчного пузыря, сквамозную карциному полости рта, эндометриальную карциному и медуллобластому. В другом варианте осуществления опухоль выбрана из колоректальной карциномы, карциномы поджелудочной железы и других опухолей, опосредованных S100A4.
В предпочтительном варианте осуществления изобретения опухоль/рак, который предупреждают или лечат с помощью указанных антител, выбран из рака поджелудочной железы и колоректального рака, предпочтительно рака поджелудочной железы.
Термин "рак поджелудочной железы" понимают как любое злокачественное новообразование поджелудочной железы, включая аденокарциномы и ряд их вариантов.
Термин "колоректальный рак" понимают как рак, характеризующийся новообразованием в толстой кишке, прямой кишке или червеобразном отростке. Колоректальный рак клинически отличается от анального рака, который поражает анус.
В одном варианте осуществления настоящего изобретения лекарственный препарат содержит одно или более антител, соответствующих первому аспекту изобретения, в виде единственного лечебного средства. Однако, лекарственное средство, соответствующее изобретению, может также содержать одно или несколько дополнительных соединений, предназначенных для лечения рака. Вследствие этого в другом варианте осуществления настоящего изобретения получают лекарственное средство для комбинированного введения антитела, соответствующего изобретению, и одного или более лечебных средств, используемых для лечения указанного заболевания.
Термин "лечебное средство, используемое для лечения указанного заболевания" относится к препарату, подходящему для использования при лечении рака.
Для лечения рака антитело, соответствующее изобретению, можно использовать в комбинации с дополнительным терапевтически активным соединением, таким как цитотоксический препарат, антиангиогенный препарат или антиметастатический препарат.
Цитотоксические препараты, которые можно использовать в комбинации с антителами, соответствующими изобретению, для лечения рака, включают, но без ограничения перечисленным, антрациклиновые антибиотики, такие как доксорубицин и даунорубицин, таксаны, такие как Таксол™ и доцетаксел, алкалоиды барвинка, такие как винкристин и винбластин, 5-фторурацил (5-ФУ), лейковорин, иринотекан, идарубицин, митомицин С, оксалиплатин, ралтитрексед, тамоксифен, цисплатин, карбоплатин, метотрексат, актиномицин D, митоксантрон, бленоксан или митрамицин. Антиангиогенные препараты, которые можно использовать в комбинации с антителами, соответствующими изобретению, для лечения рака, включают, но без ограничения перечисленным антиангиогенный препарат, выбранный из группы паклитаксела, 2-метоксиэстрадиола, приноастата, батимастата, BAY 12-9566, карбокиамидотриазола, СС-1088, декстрометорфан уксусной кислоты, диметилксантенон уксусной кислоты, эндостатина, IM-862, маримастата, пеницилламина, PTK787/ZK 222584, RPI.4610, скваламинлактата, SU5416, талидомида, комбрестатина, тамоксифена, COL-3, неовастата, BMS-275291, SU6668, антител к VEGF, Меди-522 (витаксина II), CAI, интерейкина-12, IM862, амилорида, ангиостатина, ангиостатина KI-3, ангиостатина KI-5, каптоприла, DL-альфа-дифторметилорнитина, DL-альфа-дифторметилорнитина HCl, эндостатина, фумагиллина, хербимицина А, 4-гидроксифенилретинамида, джуглона, ламинина, гексапептид ламинина, пентапептид ламинина, лавендастина А, медроксипрогестерона, миноциклина, ингибитора плацентарной рибонуклеазы, сурамина, тромбоспондина, антител, направленных против проангиогенных факторов (например, авастина, эрбитакса, вектибикса, херцептина); низкомолекулярных ингибиторов тирозинкиназы, проангиогенных факторов роста (например, тарцевы, нексавара, сутента, ирессы); ингибиторов mTOR (например, торисела); α-, β- и γ-интерферона, ИЛ-12, ингибиторов металлопротеиназы матрикса (например, COL3, маримастата, батимастата); ZD6474, SUI1248, витаксина; ингибиторов PDGFR (например гливека); NM3 и 2-МЕ2; циклопептидов, такие как силенгитид. Антиметастатические препараты, которые можно использовать в комбинации с антителами, соответствующими изобретению, для лечения рака, включают, но без ограничения перечисленным, любой препарат, способный действовать как антиметастатический препарат, такой как алкилирующие препараты, антиметаболиты, такие как 5-фторурацил, пеметрексед (МТА), ралтитрексед (TDX); платиновые цитотоксические препараты, такие как цисплатин или оксаплатин; ингибиторы топоизомеразы; препараты, действующие на микротрубочки; антрациклины; растительные алкалоиды; ингибиторы ГТФазы; ингибиторы ангиогенеза; ингибиторы металлопротеиназы матрикса; ингибиторы киназы, регулирующий клеточный цикл, такие как ингибиторы циклин-зависимой киназы и циклина; ингибиторы передачи сигнала Wnt; ингибиторы фактора транскрипции E2F; ингибиторы гистондезацетилазы; ингибиторы киназы AKT или АТФазы.
Термин "комбинированное введение" понимают как то, что антитело, соответствующее изобретению, можно вводить совместно или раздельно, одновременно, в то же время или последовательно с лечебным средством, используемым для лечения рака в любом порядке. Например, введение антитела, соответствующего изобретению, можно осуществить сначала, после введения одного или более лечебных средств, используемых для лечения указанной патологии, или введение антитела, соответствующего изобретению, можно осуществить в последнюю очередь, предваряя введением одного или более лечебных средств, используемых для лечения указанной патологии, или введение антитела, соответствующего изобретению, можно осуществить в то же время, что введение одного или более лечебных средств, используемых для лечения указанной патологии.
Компетентный специалист в области техники будет иметь в виду, что в контексте настоящего изобретения лечебное средство для комбинированного введения антитела, соответствующего изобретению, и дополнительного лечебного средства, используемого для лечения рака, можно получить в виде одной лекарственной формы или в раздельных лекарственных формах.
В предпочтительном варианте осуществления специфическое антитело к S100A4, обладающее антиангиогенной активностью, представляет собой моноклональное антитело, предпочтительно антитело, продуцируемое гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804; более предпочтительно продуцируемое гибридомой ЕСАСС 10022401.
В другом аспекте изобретение относится к специфическому антителу к S100A4 или его фрагменту, продуцируемому гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или его фрагменту, предназначенному для применения в медицине.
Настоящее изобретение также предусматривает антитело или его фрагмент либо моноклональное антитело, соответствующее любому из вариантов осуществления, представленных в данном контексте, предназначенное для использования в качестве лекарственного средства для лечения любых опосредованных S100A4 заболеваний.
Настоящее изобретение также предусматривает применение антитела или его фрагмента либо моноклонального антитела, соответствующего любому из вариантов осуществления, представленных в данном контексте, для изготовления лекарственного средства для лечения любых опосредованных S100A4 заболеваний.
Настоящее изобретение также предусматривает способ лечения опосредованных S100A4 заболеваний, включающий введение пациенту, нуждающемуся в указанном лечении, фармацевтически эффективного количества антитела или его фрагмента либо моноклонального антитела, соответствующего любому из вариантов осуществления, представленных в данном контексте.
Воспаление
Авторы обнаруживают, что специфические антитела к S100A4 эффективны в плане предупреждения и/или лечения заболеваний, ассоциированных с воспалением. Так, один аспект изобретения относится к применению антитела, которое специфически связывается с белком S100A4, или его фрагмента, обладающего способностью связываться с антигеном, для получения лекарственного средства для предупреждения и/или лечения заболевания, ассоциированного с воспалением.
В другом аспекте изобретение относится к антителу, которое специфически связывается с белком S100A4, или его фрагменту, обладающему способностью связываться с антигеном, предназначенному для применения для предупреждения и/или лечения заболевания, ассоциированного с воспалением.
В другом аспекте изобретение относится к способу лечения или предупреждения у пациента заболевания, ассоциированного с воспалением, который предусматривает введение данному пациенту антитела, которое специфически связывается с белком S100A4, или его фрагмента, обладающего способностью связываться с антигеном.
Выражение "антитело, которое специфически связывается с белком S100A4", в контексте данного аспекта изобретения относится к любому антителу, которое специфически распознает белок S100A4, не распознавая другие белки семейства S100. Данное выражение включает антитела, ранее описанные с предшествующем уровне техники.
Термин "фрагмент" относится к фрагменту антитела, обладающему способностью связываться с антигеном. Не является необходимым, чтобы указанный фрагмент обладал антиангиогенной активностью.
Выражение "заболевание, ассоциированное с воспалением" относится ко всем тем заболеваниям, при которых имеет место патогенное воспаление, т.е. когда указанный процесс вреден или нежелателен, независимо от того, является ли он раковым или нет. Заболевания, ассоциированные с воспалением, включают воспалительные заболевания, при которых существует избыточная или измененная воспалительная реакция, которая приводит к симптомам воспаления. Указанные воспалительные заболевания, которые можно лечить антителами, соответствующими изобретению, включают, без ограничения перечисленным, болезнь Аддисона, обыкновенные угри, очаговую алопецию, амилоидоз, анкилозирующий спондилит, язвы, афтозный стоматит, артрит, артериосклероз, остеоартрит, ревматоидный артрит, бронхиальную астму, болезнь Бечета, болезнь Бека, кишечную воспалительную болезнь, болезнь Крона, хороидит, язвенный колит, глютеновую болезнь, криоглобулинемию, дегенерацию желтого пятна, дерматит, герпетиформный дерматит, дерматомиозит, инсулинозависимый диабет, ювенильный диабет, воспалительное демиелинизирующее заболевание, контрактуру Дюпюитрена, энцефаломиелит, аллергический энцефаломиелит, эндофтальмию, аллергический энтерит, синдром аутоиммунной энтеропатии, чешуйчатую узелковую эритему, анкилозирующий спондилит, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматическую лихорадку, кистозный фиброз, гингивит, гломерулонефрит, синдром Гудпасчура, синдром Грейвса, болезнь Хашимото, хронический гепатит, гистиоцитоз, региональный илеит, ирит, диссеминированную красную волчанку, системную красную волчанку, кожную красную волчанку, лимфогранулему, инфекционный мононуклеоз, злокачественную миастению, поперечный миелит, первичную идиопатическую микседему, нефроз, ожирение, симпатическую офтальмию, грануломатозный орхит, панкератит, панникулит, обыкновенную пузырчатку, периодонтит, узелковый полиартериит, хронический полиартрит, полимиозит, острый полирадикулит, псориаз, хроническое обструктивное легочное заболевание, пурпуру, гангренозную пиодермию, синдром Рейтера, диабетическую ретинопатию, розацею, саркоидоз, атаксический склероз, прогрессивный системный склероз, склерит, склеродермию, рассеянный склероз, диссеминированный склероз, острый передний увеит, витилиго, болезнь Виппла, заболевания, ассоциированные со СПИДом, тяжелым комбинированным иммунодефицитом и вирусом Эпштейна-Барр, такие как синдром Шегрена, остеоартикулярный туберкулез и паразитарные заболевания, такие как лейшманиоз. Предпочтительными воспалительными заболеваниями являются ревматоидный артрит, артериосклероз, псориаз, воспалительная болезнь кишки и болезнь трансплантат против хозяина.
Термины "лекарственное средство", "предупреждение" и "лечение" определяют ниже в контексте терапевтического применения антител, соответствующих изобретению.
В предпочтительном варианте осуществления антитело, которое специфически связывается с белком S100A4, или его фрагмент представляет собой антитело к S100A4, обладающее антиангиогенной активностью, или его фрагмент, который в существенной степени сохраняет антиангиогенную активность указанного антитела, причем антитело выбрано из группы, включающей:
(i) антитело, которое распознает эпитоп S100A4, содержащий последовательность ELPSFLGKRT (SEQ ID NO:3),
(ii) антитело, которое распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(iii) антитело, продуцируемое гибридомой ЕСАСС 11051804.
В более предпочтительном варианте осуществления антитело продуцирует гибридома, выбранная из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804; более предпочтительно гибридома представляет собой ЕСАСС 10022401.
Конъюгаты антител, соответствующих изобретению, и их применение
Принимая, что антитела, соответствующие первому аспекту изобретения, способны связываться с белком S100A4 и что данный белок демонстрирует сверхэкспрессию при раке, специфическое антитело к S1 ООА4, обладающее антиангиогенной активностью, или его фрагмент, соответствующие первому аспекту изобретения, составляют препараты, подходящие для того, чтобы нести соединения с терапевтической активностью к центрам экспрессии S100A4.
Белок S100A4 экспрессируется, как подробно описано выше, в широком круге форм рака. Данный белок также экспрессируется при заболеваниях, ассоциированных с воспалением, таких как ревматоидный артрит.
Вследствие этого в другом аспекте изобретение относится к конъюгату, содержащему антитело или его фрагмент, соответствующие первому аспекту изобретения, и второй компонент, выбранный из группы:
a) антиангиогенного препарата,
b) антиметастатического препарата,
c) цитотоксического препарата,
d) противовоспалительного препарата.
В предпочтительном варианте осуществления второй компонентвыбран из группы а) антиангиогенного препарата, b) антиметастатического препарата и с) цитотоксического препарата.
Термин "конъюгат" в контексте настоящего изобретения понимают как комплекс, сформированный антителом, соответствующим первому аспекту изобретения, связанным, присоединенным или ассоциированным с по меньшей мере одним вторым компонентом.
Антитела или их фрагмент, соответствующие первому аспекту изобретения, описаны в контексте данного первого аспекта.
Термин "второй компонент" понимают как молекулу с терапевтической активностью, которая направлена на центр своего действия посредством моноклонального антитела, соответствующего изобретению.
Белок S100A4 проявляет сверхэкспрессию в опухолевых клетках. Вследствие этого антитела, соответствующие изобретению, можно использовать для того, чтобы направлять противоопухолевые лекарственные препараты в центры экспрессии.
Как используют в настоящем изобретении, термин "цитотоксический препарат" относится к препарату, который способен стимулировать гибель клеток и который обладает способностью снижать уровень роста, блокировать рост или разрушать клетки и, особенно, быстро пролиферирующие клетки и, еще точнее, опухолевые клетки. Гибель клеток может быть вызвана любым механизмом, таким как, например, апоптоз, хотя он не ограничен данным случаем, посредством ингибирования метаболизма, интерференцией с организацией цитоскелета или химической модификацией ДНЕ. Термин цитотоксический препарат содержит любой химиотерапевтический препарат, включая маленькие органические молекулы, пептиды, олигонуклеотиды и т.п., токсины, ферменты, цитокины, радиоизотопы или радиотерапевтические препараты.
Термин "химиотерапевтические препараты" понимают как химические соединения, такие как, без ограничения перечисленным, антрациклиновые антибиотики, такие как доксорубицин и даунорубицин, таксаны, такие как Таксол™ и доцетаксел, алкалоиды барвинка, такие как винкристин и винбластин, 5-фторурацил (5-ФУ), лейковорин, иринотекан, идарубицин, митомицин С, оксалиплатин, ралтитрексед, тамоксифен, цисплатин, карбоплатин, метотрексат, актиномицин D, митоксантрон, бленоксан или митрамицин, антиметаболиты, такие как гемцитабин.
Термин "токсин" понимают как токсический препарат, который конъюгируется с антителом, соответствующим изобретению, формируя иммунотоксин. Конъюгирование определенных токсинов с антителами снижает токсичность первых, создавая возможность для их применения в качестве лечебных средств, поскольку в противном случае они были слишком токсичными. Связывание токсина и антитела проводят химическим путем, сохраняя его биологическую активность. Их разделение, как правило, происходит в лизосомах клеток-мишеней, распознаваемых антителом, так что упомянутое химическое связывание разрушается только в замкнутой кислой клеточной среде, образуемой лизосомами. Токсины, используемые в контексте настоящего изобретения, представляют собой растительные токсины, бактериальные токсины, токсины грибной или животной природы и их фрагменты, например, без ограничения перечисленным, А-цепь рицина, сапонин, дифтерийная А-цепь, активные несвязывающиеся фрагменты дифтерийного токсина, А-цепь экзотоксина Pseudomonas aeruginosa, А-цепь абрина, А-цепь модецина, α-сарцин, А-белки Leurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогелин, рестриктоцин, феномицин, эномицин и трихотецины.
Термин "ферменты" понимают в контексте настоящего изобретения ферменты, активирующие токсин или лекарственный препарат, такие как, без ограничения перечисленным, щелочная фосфатаза, которая активирует этопозид и доксорубицин, карбоксипептидаза G2, которая активирует азотистые иприты, β-лактамаза, которая активирует доксорубицин, паклитаксел и митомицин.
Термин "цитокины" понимают как пептиды разного размера и молекулярной массы, которые синтезируют клетки иммунной системы с целью регуляции иммунного ответа, и они могут представлять собой гормоны, факторы роста, факторы некроза и т.п. Они могут быть естественного происхождения или быть выделенными из рекомбинантных клеточных культур и представлять собой биологически активные эквиваленты природных последовательностей цитокинов. Их конъюгирование с антителами приводит к получению иммуноцитокинов. Цитокинами, используемыми в настоящем изобретении, являются, без ограничения перечисленным, фактор α-ФНО, γ-ИФН, фактор GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) или ИЛ-2.
Термин "радиоизотопы" понимают как радиоактивные изотопы, такие как, без ограничения перечисленным, 131I, 90Y, 177Lu, 188Re, 67Cu, 211At, 213Bi, 125I, 111In.
Термин "антиангиогенный препарат" понимают как химическую или биологическую субстанцию, которая ингибирует или снижает уровень образования новых кровеносных сосудов, т.е. ангиогенеза. Примеры антиангиогенных препаратов, которые можно конъюгировать с антителами, соответствующими первому аспекту изобретения, включают, без ограничения перечисленным, антиангиогенный препарат, выбранный из группы паклитаксела, 2-метоксиэстрадиола, приномастата, батимастата, BAY 12-9566, карбоксиамидотриазола, СС-1088, декстрометорфана уксусной кислоты, диметилксантенона уксусной кислоты, эндостатина, IM-862, маримастата, пеницилламина, PTK787/ZK 222584, RPI-4610, скваламинлактата, SU5416, талидомида, комбрестатина, тамоксифена, COL-3, неовастата, BMS-275291, SU6668, антител к VEGF, Меди-522 (витаксина II), CAI, интерейкина-12, IM862, амилорида, ангиостатина, ангиостатина KI-3, ангиостатина KI-5, каптоприла, DL-альфа-дифторметилорнитина, DL-альфа-дифторметилорнитина HCI, эндостатина, фумагиллина, хербимицина А, 4-гидроксифенилретинамида, джуглона, ламинина, гексапептид ламинина, пентапептид ламинина, лавендастина А, медроксипрогестерона, миноциклина, ингибитора плацентарной рибонуклеазы, сурамина, тромбоспондина, антител, направленных против проангиогенных факторов (например, авастина, эрбитакса, вектибикса, херцептина); низкомолекулярных ингибиторов тирозинкиназы проангиогенных факторов роста (например, тарцевы, нексавара, сутента, ирессы); ингибиторов mTOR (например, торисела); α-, β- и γ-интерферона, ИЛ-12, ингибиторов металлопротеиназы матрикса (например, COL3, маримастата, батимастата); ZD6474, SUI1248, витаксина; ингибиторов PDGFR (например гливека); NM3 и 2-МЕ2; циклопептидов, таких как силенгитид.
Термин "антиметастатические препараты" понимают как химическую или биологическую субстанцию, которая ингибирует или уменьшает метастаз, т.е. удаленное распространение, по существу посредством лимфо- или кровотока, клеток, вызывающих рак, и рост новых опухолей на участках, куда дошел указанный метастаз.
Антиметастатические препараты, которые можно конъюгировать с антителами, соответствующими первому аспекту изобретения, включают, без ограничения перечисленным, любой цитотоксический препарат, способный действовать как антиметастатический препарат, такой как алкилирующие препараты, антиметаболиты, такие как 5-фторурацил, пеметрексед (МТА), ралтитрексед (TDX); платиновые цитотоксические препараты, такие как цисплатин или оксаплатин; ингибиторы топоизомеразы; препараты, действующие на микротрубочки; антрациклины; растительные алкалоиды; ингибиторы ГТФазы; ингибиторы ангиогенеза; ингибиторы металлопротеиназы матрикса; ингибиторы киназы, регулирующий клеточный цикл, такие как ингибиторы циклин-зависимых киназ и циклина; ингибиторы передачи сигнала Wnt; ингибиторы фактора транскрипции E2F; ингибиторы гистондезацетилазы; ингибиторы киназы AKT или АТФазы.
Конъюгаты антитела и других препаратов можно создать при использовании ряда связывающих агентов или бифункциональных белковых линкеров. Линкер может представлять собой "отделяемый линкер", который дает возможность высвобождения препарата в клетке, такой как кислотолабильный линкер, линкер, чувствительный к пептидазе, диметиловый линкер или линкер, содержащий дисульфид.
Белок S100A4 экспрессируется также при заболеваниях, ассоциированных с воспалением. Вследствие этого антитела, соответствующие изобретению, можно использовать для того, чтобы направлять противовоспалительные лекарственные препараты в области экспрессии.
Термин "противовоспалительный препарат" означает любой противовоспалительный препарат, который ингибируетили блокирует синтез простагландинов. Используемые противовоспалительные препараты представляют собой, без ограничения перечисленным, 5-аминосалициловую кислоту и содержащие ее лекарственные средства (сульфасалазин, месаламин, месалазин, олсалазин); ацетилсалициловую кислоту; кортикостероиды, такие как гидрокортизон, кортизон, триамцинолон, будесонид, преднизон, дефлазакорт, метотрексат; инфликсимаб; адалимумаб.
В предпочтительном варианте осуществления специфическое антитело к S100A4 конъюгата, соответствующего изобретению, представляет собой моноклональное антитело, предпочтительно моноклональное антитело или его фрагмент, продуцируемые гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или его фрагмент; более предпочтительно продуцируемое гибридомой ЕСАСС 10022401.
Так, в другом аспекте изобретение относится к конъюгатам, содержащим антитело или его фрагмент, соответствующие первому аспекту изобретения, предназначенным для использования в медицине.
В другом аспекте изобретение относится к применению конъюгата, содержащего специфическое антитело к S100A4, обладающее антиангиогенной активностью, или его фрагмент, соответствующие первому аспекту изобретения, для получения лекарственного средства для предупреждения и/или лечения заболевания, выбранного из метастаза, заболевания, ассоциированного с нежелательным ангиогенезом и заболевания, ассоциированного с воспалением; предпочтительно заболевание выбрано из метастаза и заболевания, ассоциированного с нежелательным ангиогенезом.
В другом аспекте изобретение относится к конъюгату, содержащему специфическое антитело к S100A4, обладающее антиангиогенной активностью, или его фрагмент, соответствующие первому аспекту изобретения, предназначенному для предупреждения и/или лечения заболевания, выбранного из метастаза, заболевания, ассоциированного с нежелательным ангиогенезом, и заболевания, ассоциированного с воспалением; предпочтительно заболевание выбрано из метастаза и заболевания, ассоциированного с нежелательным ангиогенезом.
В другом аспекте изобретение относится к способу лечения или предупреждения заболевания у пациента, страдающего от заболевания, выбранного из метастаза, заболевания, ассоциированного с нежелательным ангиогенезом, и заболевания, ассоциированного с воспалением, который предусматривает введение указанному пациенту конъюгата, содержащего специфическое антитело к S100A4, обладающее антиангиогенной активностью, или его фрагмент, соответствующие первому аспекту изобретения. В предпочтительном варианте осуществления заболевание выбрано из метастаза и заболевания, ассоциированного с нежелательным ангиогенезом.
В предпочтительных вариантах осуществления специфическое антитело к S100A4 представляет собой моноклональное антитело, предпочтительно моноклональное антитело или его фрагмент, продуцируемые гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804 или его фрагмент; более предпочтительно продуцируемое гибридомой ЕСАСС 10022401.
Термин "лекарственное средство" в контексте данных аспектов изобретения понимают как фармацевтическую композицию, содержащую конъюгат антитела, соответствующего первому аспекту изобретения, или его фрагмента с соединениям, используемым для лечения рака, в частности, для лечения заболевания, выбранного из метастаза и заболевания, ассоциированного с нежелательным ангиогенезом, или с соединением, используемым для лечения заболевания, ассоциированного с воспалением.
Термины "предупреждение", "лечение", "метастаз", "заболевание, ассоциированное с нежелательным ангиогенезом" и "заболевание, ассоциированное с воспалением" ранее определены в контексте терапевтического применения изобретения.
Диагностический способ, соответствующий изобретению
Поскольку белок S100A4 секретируется во внеклеточную среду опухолевыми клетками и его присутствие можно выявить в различных биожидкостях, его можно использовать для диагностики рака. Указанный белок обнаруживают также в плазме и синовиальной жидкости суставов пациентов, страдающих от заболеваний, ассоциированных с воспалением, таких как ревматоидный артрит.
Так, в одном аспекте изобретение относится к способу in vitro диагностики рака или заболевания, ассоциированного с воспалением, у пациента, который предусматривает:
(а) определение уровней белка S100A4 или его варианта в биологической жидкости указанного пациента при использовании моноклонального антитела, продуцируемого гибридомой, выбранной из группы, включающей ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функционального варианта указанного антитела
(b) сравнение указанных уровней с эталонным значением,
причем повышенные уровни белка S100A4 или его варианта относительно эталонного значения указывают на то, что пациент страдает от рака или заболевания, ассоциированного с воспалением.
В контексте настоящего изобретения выражение "способ диагностики рака in vitro" понимают как способ, который позволяет показать наличие злокачественной опухоли у пациента посредством выявления присутствия белка S100A4, растворимого в биологической жидкости, выделенной у пациента. Способ также используют для документального подтверждения экспрессии S100A4, продуцируемого опухолью, перед введением лекарственных препаратов, избирательных в отношении S100A4, чтобы получить возможность соответствующего отбора пациентов и определения оптимальной дозы.
В контексте настоящего изобретения, "способ диагностики заболевания, ассоциированного с воспалением, in vitro" понимают как способ, который дает возможность показать наличие воспалительного заболевания у пациента путем определения присутствия белка S100A4, растворимого в биологической жидкости, выделанной у пациента.
Термин "пациент" в настоящем изобретении понимают как любое животное, относящееся к млекопитающим, и он включает, но без ограничения перечисленным, домашних и сельскохозяйственных животных, приматов и человека, например, человека, приматов, отличных от человека, коров, лошадей, свиней, овец, коз, собак, кошек или грызунов. Предпочтительно, когда пациента является женщиной или мужчиной любой расы или возраста. В контексте настоящего изобретения пациент является пациентом, который потенциально страдает от рака или заболевания, ассоциированного с воспалением, или пациентов, у которого ранее диагностирован рак или заболевание, ассоциированное с воспалением.
Первая стадия способа, соответствующего изобретению, предусматривает определение уровней белка S100A4 или его варианта в биологической жидкости исследуемого пациента с использованием моноклональных антител, соответствующих изобретению.
Термин "биожидкость" в контексте настоящего изобретения относится к любому биологическому секрету или жидкости, физиологическим или патологическим, которые образуются в организме пациента. Данные биожидкости включают, без ограничения перечисленным, кровь, плазму, сыворотку, бронхоальвеолярную омывающую жидкость, мочу, носовые выделения, ушные выделения, выделения уретры, спинно-мозговую жидкость, плевральную жидкость, синовиальную жидкость, перитонеальную жидкость, асцитную жидкость, перикардиальную жидкость, амниотическую жидкость, желудочный сок, лимфатическую жидкость, интерстициальную жидкость, слюну, мокроту, жидкость отеков, слезы, слизь, пот, молоко, сперму, вагинальные выделения, жидкость, выделяемую язвами, волдырями, абсцессами и другими поверхностными повреждениями. Данные образцы можно получить принятыми способами, используя процессы, известные в уровне техники компетентному специалисту в области техники, такие как отбор крови, инстилляция и аспирация жидкости при бронхофиброскопии, цистернальная, вентрикулярная или люмбарная пункция, плевральная пункция или торакоцентез, суставная или синовиальная чрезкожная пункция, абдоминальная пункция, амниоцентез, отхаркивание, перитонеальная чрескожная пункция, перикардиальная чрескожная пункция и т.п. или путем сбора проб.
В предпочтительном варианте осуществления биожидкость выбрана из крови, плазмы и сыворотки, предпочтительно сыворотки, более предпочтительно плазмы. Пробу крови, как правило, отбирают путем пункции артерии или вены, обычно вены внутренней стороны локтя или тыльной стороны руки, причем пробу крови собирают в герметичный флакон или шприц. Можно провести пункцию капилляров обычно на дистальном конце или дистальных фалангах пальцев для анализа с помощью микрометода. Сыворотку можно получить из пробы цельной крови и в отсутствие противосвертывающего препарата, оставляя пробу для осаждения в течение 10 минут, так что она свертывается, с последующим центрифугированием ее при 1500 об./мин. в течение 10 минут с целью отделения клеток (осадок) от сыворотки (супернатант). В свою очередь, для получения образца плазмы цельную кровь приводят в контакт с противосвертывающим препаратом и центрифугируют при 3000 об./мин в течение 20 минут. Осадок, полученный при данном центрифугировании, соответствует форменным элементам, и супернатант соответствует плазме.
Полученную сыворотку или плазму можно перенести в пробирку для хранения для анализа пробы с помощью способа, соответствующего изобретению.
В другом предпочтительном варианте осуществления биожидкость представляет собой суставную синовиальную жидкость.
Уровни экспрессии белка S100A4 можно выявить и количественно определить с помощью принятых способов. Указанные способы включают, без ограничения перечисленным, детекцию S100A4 путем измерения его аффинности к одному из его лигандов, таких как RAGE, и последующего количественного определения комплекса S100A4-лиганд, или при использовании моноклональных антител со способностью специфически связываться с белком S100A4 (или его фрагментами, которые содержат антигенные детерминанты), продуцируемых гибридомой, выбранной из группы, включающей ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функционального варианта указанного антитела. Затем полученные в результате комплексы антиген-антитело количественно оценивают. В предпочтительном варианте осуществления изобретения используемое антитело представляет собой антитело, продуцируемое гибридомой ЕСАСС 10022401.
Изобретение предусматривает также использование функциональных вариантов указанных антител. Термин "функциональный вариант" моноклональных антител, соответствующих изобретению, понимают как любую молекулу, имеющую одинаковую с указанным моноклональным антителом одну или более функций, описанных в настоящем изобретении, ассоциированных с указанными моноклональными антителами, как in vitro, так и in vivo, и имеющих минимальную идентичность последовательности аминокислот. Функциональные варианты моноклональных антител, соответствующих изобретению, можно получить из указанных последовательностей посредством инсерции, замены или делеции одной или более аминокислот и можно получить рекомбинантными и/или синтетическими средствами.
Функциональные варианты моноклональных антител, соответствующих изобретению, должны сохранять свою способность к связыванию антигена S100A4, а также способность к ингибированию одной или более характерных функций белка S100A4, такую как ангиогенез. Данные функции можно определить с помощью способов, описанных в примерах настоящего изобретения.
Функциональные варианты моноклональных антител, соответствующих изобретению, включают полипептиды, показывающие по меньшей мере 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 90%, 95%, 97%, 99% близость или идентичность в полипептидной последовательностью указанных антител. Степень идентичности между двумя полипептидами определяют при использовании алгоритмов, имеющихся в компьютере и способов, которые широко известны компетентным специалистам в области техники. Предпочтительно, когда идентичность между двумя последовательностями аминокислот определяют с помощью алгоритма BLASTP (см. работу BLAST Manual (Руководство по BLAST), Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, статью Altschul, S., et al., J., 1990, Mol. Biol. 215:403-410).
Кроме того, антитела, используемые в способе, соответствующем изобретению, могут быть или не быть меченными определяемым агентом. В конкретном варианте осуществления используемое антитело конъюгируют с определяемым агентом.
В контексте настоящего изобретения термины "определяемый агент" и "мечение" являются синонимами, и они относятся к агенту, природа которого позволяет определять их с помощью ферментных, радиоактивных и флуоресцентных способов. Определяемое соединение может представлять собой фермент, соединение с радиоактивной меткой или радиоактивный изотоп, флуорохром, хемолюминесцентный реагент, ферментный субстрат или кофактор, ферментный ингибитор, частица, краситель и т.п.
Соединения радиоактивно меченные с помощью радиоактивных изотопов, называемые также радиоизотопами или радионуклидами, могут включать, без ограничения перечисленным, 3H, 14С, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I. Флуоресцентные метки могут включать, без ограничения перечисленным, родамин, фосфор-лантаниды или флуоресцеин изоцианат (FITC. Ферментные метки могут включать, без ограничения перечисленным, пероксидазу хрена, β-галактозидазу, люциферазу или щелочную фосфатазу. Предпочтительная метка включает, но без ограничения перечисленным, флуоресцеин, фосфатазу, такую как щелочная фосфатаза, биотин, авидин, пероксидазу, такую как пероксидаза хрена, и соединения, родственные биотину, или соединения, родственные авидину (например, стрептавидин или ImmunoPure® NeutrAvidin, доступный в фирме Pierce, Rockford, IL).
Существует широкий круг хорошо известных анализов, которые можно использовать в настоящем изобретении, причем в данных анализах используют первичные немеченые антитела и вторичные меченые антитела: данные способы включают вестерн-блоттинг или вестерн трансфер, ELISA (твердофазный иммуноферментный анализ), RIA (радиоиммуноанализ), конкурентный EIA (конкурентный ферментный иммуноанализ), DAS-ELISA (сэндвичевый ELISA с двойным антителом) или способы, основанные на использовании микрорядов белков или биочипов, которые включают специфические антитела, или анализы на основе коллоидной преципитации в таких формах, как реактивные полоски. Другие пути детекции белка S100A4 включают такие способы, как аффинная хроматография, анализы связывания лигандов и т.п.
В конкретном варианте осуществления количественную оценку S100A4 проводят с помощью вестерн-блота или ELISA.
В еще одном конкретном варианте осуществления уровни белка S100A4 или его вариантов определяют вестерн-блоттингом. Вестерн-блоттинг основан на детекции ранее выделенных белков с помощью электрофореза в геле в денатурирующих условиях при иммобилизации на мембране, как правило, нитроцеллюлозе, с помощью инкубирования с антителом, специфическим в отношении S100A4 и системы проявления (например, хемолюминесцентной).
В другом предпочтительном варианте осуществления диагностику проводят с помощью ELISA. Данный способ основан на детекции белка S100A4 в образце с помощью антитела к S100A4, иммобилизованного на субстрате, и последующей детекции комплекса S100A4-антитело с помощью второго антитела.
Термин "белок", как используют в данном контексте, относится к молекулярной цепи аминокислот, связанных ковалентными и нековалентными связями. Термин, кроме того, включает все физиологически соответствующие формы пост-трансляционной химической модификации. Пост-трансляционные модификации, которые входят в объем настоящего изобретения, включают, например, расщепление сигнального пептида, гликозилирование, ацетилирование, фосфорилирование, изопренилирование, протеолиз, миристоилирование, укладка белка и протеолитический процесс и т.п. Кроме того, белки могут включать неприродные аминокислоты, образованные путем пост-трансляционных модификаций или путем интродукции неприродных аминокислот во время трансляции.
Термин "S100A4" определен в контексте первого изобретательского аспекта изобретения. Для диагностического способа, соответствующего изобретению, определяемый S100A4 является таким, который соответствует виду, к которому принадлежит пациент, у которого получают пробу биожидкости, предназначенную для анализа.
Как отмечено выше, варианты указанного белка также можно использовать для измерения уровней белка S100A4 в способе, соответствующем изобретению.
Вследствие этого, варианты белка S100A4 могут представлять собой: (i) такие, в которых один или более остатков аминокислот замещены консервативным или неконсервативным остатком аминокислоты (предпочтительно консервативной аминокислотой) и данный замещенный оста то к аминокислоты может или не может кодироваться генетическим кодом, (ii) такие, которые содержат один или более модифицированных остатков аминокислот, например, остатки, которые модифицированы присоединением замещающих групп, (iii) такие, в которых белок представляет собой альтернативный сплайсинг-вариант S100A4 и/или (iv) фрагменты белка. Фрагменты в ключа ют белки, генерированные посредством протеолитической обработки (включая протеолиз по множеству центров) исходной последовательности. Данные варианты входят в объем настоящего изобретения.
Варианты, соответствующие настоящему изобретению, включают последовательности аминокислот, которые по меньшей мере на 60%, 70%, 80%, 90%, 95% или 96% близки или идентичны исходной последовательности аминокислот. Как известно, "сходство" между двумя белками определяют путем сравнения последовательности аминокислот белка с последовательностью второго белка. Степень идентичности между двумя белками определяют, используя компьютерные алгоритмы и способы, которые широко известны компетентному специалисту в области техники, предпочтительно используя алгоритм BLASTP [см. работы BLASTManual, Altschul, S., et. al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S., et. al., J. Mot. Biol. 215:403-410 (1990)].
В конкретном варианте осуществления вариант представляет собой вариант, полученный от млекопитающего, предпочтительно человеческий вариант, более предпочтительно с по меньшей мере 60%, 70%, 80%, 90%, 95% или 96% сходством или идентичностью с исходной последовательностью аминокислот.
Компетентный специалист в области техники будет иметь в виду, что способ, соответствующий изобретению, может быть внедрен в практику при использовании как абсолютного уровня, так и относительного уровня экспрессии белка S100A4. Так, в настоящем изобретении выражение "уровни белка S100A4" используют для обозначения обоих, абсолютных уровней и относительных уровней указанного белка.
Выражение "абсолютные уровни" относится к общему количеству представляющего интерес белка в образце. Указанная величина может быть представлена как концентрация белка, экспрессируемого в единицах массы на единицу объема (например, в нг/мл образца), в количестве молекул белка на единицу объема (например в пмоль белка/мл образца), в единицах массы белка S100A4 на единицу массы общего белка (пг S100A4/мг общего белка) или в количестве молекул S100A4 на единицу массы общего белка (например. в пмоль S100A4/мг общего белка).
Выражение "относительные уровни" относится к связи между уровнями экспрессии белка S100A4, объекта исследования, и эталонного белка, т.е. определяют концентрацию белка S100A4 в нормализованной форме относительно указанного эталонного белка.
Для нормализации значений белка между различными образцами можно сравнить уровни белка S100A4 в анализируемых образцах с уровнем экспрессии контрольного белка. Выражение "контрольный белок" в настоящем изобретении понимают как белок, уровни экспрессии которого не изменяются или изменяются только в ограниченных количествах в опухолевых клетках относительно неопухолевых клеток. Предпочтительно, когда контрольный белок представляет собой белок, кодируемый генами, которые конститутивно экспрессируется, т.е. данные гены всегда активны или постоянно транскрибируется, так что данные белки конститутивно экспресируются и несут основные клеточные функции. Предпочтительные контрольные белки, которые можно использовать в настоящем изобретении, включают, без ограничения перечисленным, β-2-микроглобулин (В2М), убиквитин, 18-S рибосомный белок, циклофилин, глицеральдегидфосфатдегидрогеназа (GAPDH), протеасома бета 4 (PSMB4), тубулин и актин.
Компетентный специалист в области техники понимает, что мутации в последовательности аминокислот белка S100A4 не влияют на детекцию его экспрессии и, вследствие этого, варианты данного белка, генерированные мутациями последовательности аминокислот, входят в объем настоящего изобретения.
После определения уровня экспрессии S100A4 в образце, имеет место стадия (b) изобретения, которая состоит из сравнения уровней S100A4, полученных на стадии (а) с эталонным значением.
Термин "эталонное значение" происходит от коллекции образцов, предпочтительно образованной смесью анализируемой биожидкости, полученной от нормальных лиц, не пораженных раком. Данное эталонное значение можно определить с помощью способов, хорошо известных в области техники, например, определяя среднее значение для уровней белка S100A4, измеряемое в биожидкостях, полученных от здоровых лиц. Эталонное значение можно также получить для конститутивно экспрессирующихся белков, полученных у того же пациента, анализ которого предусматривают.
После установления эталонного значения можно сравнить значение уровней S100A4, полученное на стадии (а) сданным эталонным значением и, вследствие этого получить возможность определения изменений в уровнях белка S100A4 пациента относительно эталонного значения. Точнее, в способе, соответствующем изобретению, повышение уровней S100A4 относительно эталонного значения указывает на то, что пациент страдает от рака или заболевания, ассоциированного с воспалением.
В контексте настоящего изобретения, термин "повышенные уровни" относительно эталонного значения понимают как вариацию уровней S100A4, превышающую эталонное значение по меньшей мере в 1,1 раза, 1,5 раза, 5 раз, 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз или даже более раз по сравнению с эталонным значением.
Вследствие этого после проведения указанного сравнения способ, соответствующий изобретению, позволяет диагностировать, страдает ли пациент раком или заболеванием, ассоциированным с воспалением. В конкретном варианте осуществления способ подходит для диагностики рака, в частности рака поджелудочной железы и колоректального рака.
В другом конкретном варианте осуществления способ подходит для диагностики заболевания, ассоциированного с воспалением, предпочтительно ревматоидного артрита.
Термины "рак" и "заболевание, ассоциированное с воспалением" определены ранее.
Способы выявления S100A4
Антитела, как определено в первом аспекте изобретения, можно также использовать для детекции S100A4 в биологических образцах другого типа, отличных от биожидкости. Данные способы выявления преимущественно используют для диагностики и/или прогноза рака или заболевания, ассоциированного с воспалением клеток, среди которых клетки, которые экспрессируют белок S100A4.
Данные антитела можно использовать для идентификации клеток и тканей, которые экспрессируют белок S100A4, с помощью стандартных способов, таких как иммунофлуоресценция, проточная цитометрия, аффинная хроматография и иммунопреципитация. Например, моноклональное антитело, соответствующее изобретению, может облегчить идентификацию опухолевой клетки, которая экспрессирует белок S100A4 и дает возможность диагностики рака у пациента.
Так, в другом аспекте изобретение относится к способу in vitro диагностики рака или заболевания, ассоциированного с воспалением у пациента, который предусматривает:
(i) детекцию уровней белка S100A4 или его варианта в клетке или ткани указанного пациента с помощью специфического моноклонального антитела S100A4, продуцируемого гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функционального варианта указанного антитела;
(ii) сравнение указанных уровней с эталонным значением,
причем повышенные уровни белка S100A4 или его варианта относительно эталонного значения указывают на то, что пациент страдает от рака или заболевания, ассоциированное с воспалением.
Термин "способ in vitro" означает, что указанный способ осуществляют в биологическом образце, выделенном у пациента, у которого он взят. Данный биологический образец может представлять собой клетку, такую как клетка крови, эпителиальная клетка, половая клетка и т.п. или, кроме того, биоптат ткани.
Термины "уровни белка S100A4", "вариант", "эталонное значения" и "повышенные уровни" уже определены в контексте диагностического способа, соответствующего изобретению.
Определение можно облегчить путем присоединения (т.е. физического связывания) антитела с группой метки.
В другом аспекте изобретение относится к способу выявления S100A4 в образце, который предусматривает:
(i) контактирование образца, предположительно содержащего S100A4, со специфическим антителом к S100A4 или его фрагментом, как определено в первом аспекте изобретения, и
(ii) определение формирования иммунных комплексов между S100A4 и антителом или его фрагментом,
причем определение иммунных комплексов между S100A4 и антителом указывает на присутствие S100A4 в образце.
В предпочтительном варианте осуществления способа определения S100A4 специфическое антитело к S100A4 представляет собой моноклональное антитело, продуцируемое гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функциональный вариант указанного антитела.
Принимая, что моноклональные антитела, соответствующие изобретению, распознают белок S100A4, их можно использовать для очистки указанного белка из образца.
Предпочтительно, когда для применения при очистке S100A4 моноклональные антитела, соответствующие первому аспекту изобретения, используют путем связывания их с носителем или субстратом. В принципе в способах, соответствующих изобретению, можно использовать любой тип носителя, хотя использование носителей полимерного типа, таких как сефадекс, декстран, полиаминокислоты, растворимые в воде, полэтиленгликоль (ПЭГ), полиглутаминовая кислота (ПГК), полимолочная кислота (ПМК), сополимер молочной и гликолевой кислот (СМГК), поли(D,L-лактид-со-гликолид) (ПМК/ПМГК), поли(гидроксиалкилметакриламид), полиглицерин, полиамидоамин (ПАА) и полиэтиленимин (ПЭИ), является предпочтительным.
Как правило, очистку S100A4 с использованием моноклональных антител, соответствующих первому аспекту изобретения, проводят с помощью способа, который предусматривает стадии:
(i) контактирования образца, из которого предусматривают очистить белок S100A4, с антителом, продуцируемым гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, 11051803 и ЕСАСС 11051804, или его фрагментом, иммобилизованном на носителе, в условиях, подходящих для того, чтобы происходило связывание антитела и белка S100A4;
(ii) промывание комплексов, сформированных на стадии (i) для удаления из образца всех тех соединений, которые неспецифически связываются с конъюгатом носитель-антитело, и элюции белка S100A4, который связан с соединением.
Способ очистки белка S100A4, соответствующего изобретению, можно осуществить при использовании любого известного способа очистки белка с помощью аффинности, включая, например, колонки для аффинной хроматограф и и, стационарная фаза которых сформирована моноклональными антителами, соответствующими первому аспекту изобретения, конъюгированными с твердым носителем.
Наборы, соответствующие изобретению, и их применение
В другом аспекте изобретение относится к набору для диагностики рака или заболевания, ассоциированного с воспалением, в биологической жидкости, который содержит по меньшей мере одно антитело или его фрагмент, соответствующие первому аспекту изобретения. В предпочтительном варианте осуществления антитело представляет собой антитело продуцируемое гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, 11051803 и ЕСАСС 11051804, или его фрагмент. В конкретном варианте осуществления болезнь представляет собой рак, предпочтительно рак поджелудочной железы или колоректальный рак. В другом предпочтительном варианте осуществления болезнь представляет собой заболевание, ассоциированное с воспалением, предпочтительно ревматоидный артрит.
В другом аспекте изобретение относится к применению набора, как ранее определено, для диагностики рака или заболевания, ассоциированного с воспалением, в биожидкости пациента. В конкретном варианте осуществления заболевание представляет собой рак, предпочтительно рак поджелудочной железы или колоректальный рак. В другом предпочтительном варианте осуществления болезнь представляет собой заболевание, ассоциированное с воспалением, предпочтительно ревматоидный артрит.
Термин "набор", как используют в настоящем документе, относится к комбинации набора реагентов, подходящей для определения уровней S100A4 вместе с одним или более типов элементов или компонентов (например, другими типами биохимических реагентов, контейнерами, упаковкой, подходящей для коммерческой продажи, субстратами, с которыми связаны реагенты, компонентами электронной аппаратуры и т.п.).
В настоящем изобретении выражение "реагент, подходящий для определения уровней S100A4", понимают как а специфическое моноклональное антитело к S100A4, продуцируемое гибридомой, выбранной из группы ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или его фрагмент и, необязательно, реагенты для определения одного или более конститутивных белков.
Как будет понимать компетентный специалист в области техники, антитела из набора, соответствующего изобретению, можно использовать во всех способах определения уровней белка, которые, как известно, подходят для анализа биожидкости, таких как вестерн-блоттинг или вестерн трансфер, ELISA, RIA, конкурентный EIA, DAS-ELISA, способах на основе использования биочипов, микрорядов белков, анализов коллоидной преципитации на реакционных полосках и т.п.
Антитела можно фиксировать на твердом носителе, таком как мембрана, пластик или стекло, необязательно обработанных так, чтобы облегчить фиксацию указанных антител на носителе. Указанный твердый носитель содержит по меньшей мере набор антител, которые специфически распознают белок S100A4 и которые можно использовать для определения уровней экспрессии указанного белка.
Наборы, соответствующие изобретению, дополнительно содержат реагенты для детекции белка, кодируемого конститутивным геном. Доступность данных дополнительных реагентов позволяет нормализовать измерения, проведенные на различных стадиях (например, анализируемый образец и контрольный образец), чтобы исключить, что разница в уровне экспрессии биомаркеров обусловлена в большей степени общим количеством белка в образце, чем действительной разницей относительных уровней экспрессии. Конститутивные гены в настоящем изобретении представляют собой гены, которые всегда активны или постоянно транскрибируются и которые кодируют белки, которые конститутивно экспрессируются и несут основные клеточныефункции. Белки, которые конститутивно экспрессируются и могут быть использованы в настоящем изобретении, включают, без ограничения перечисленным, β-2-микроглобулин (В2М), убиквитин, 18-S рибосомный белок, циклофилин, GAPDH, PSMB4, тубулин и актин.
Все конкретные варианты осуществления способа, соответствующего настоящему изобретению, применимы к наборам, соответствующим изобретению, и их использованию.
Способы подбора лечения
Авторы обнаруживают, что лечение пациента, страдающего от рака, моноклональным антителом, соответствующим изобретению, блокирует большую часть циркулирующего белка S100A4, уровень которого был выше до лечения.
Таким образом, в другом аспекте изобретение относится к способу in vitro создания соответствующего индивидуальным потребностям препарата для пациента с диагностированным раком, который предусматривает
(i) определение уровней белка S100A4 или его варианта в биологической жидкости указанного пациента и
(ii) сравнение уровней белка S100A4 с эталонным значением, причем повышенные уровни белка S100A4 или его варианта относительно эталонного уровня указывают на то, что пациента следует лечить специфическим антителом к S100A4, обладающим антиангиогенной активностью, или его фрагментом, который в существенной степени сохраняет антиангиогенную активность указанного антитела, причем антитело выбрано из группы, включающей
(a) антитело, которое распознает эпитоп S100A4, содержащий последовательносто ELPSFLGKRT (SEQ ID NO:3),
(b) антитело, которое распознает эпитоп S100A4, содержащий последовательность EGFPDKQPRKK (SEQ ID NO:24), и
(c) антитела, продуцируемого гибридомой ЕСАСС 11051804.
Термин "создание соответствующего индивидуальным потребностям препарата" означает, что результаты, полученные данным способом, используют для решения, является ли пациент кандидатом для лечения моноклональными антителами, соответствующими изобретению.
Термин "пациент" означает человека и отличных от человека животных, у которых диагностирован рак. Отличные от человека животные включают всех позвоночных, например, млекопитающих и немлекопитающих, таких как приматы и отличные от человека приматы, овцы, собака, кролики, крысы, мыши, корова, куры, амфибии и рептилии.
Термины "рак", "белок S100A4", "вариант данного белка", "биожидкость", "моноклональное антитело", "гибридома", "функциональный вариант антитела" определены ранее.
В контексте настоящего аспекта пациента выбирают для лечения по меньшей мере одним моноклональным антителом, соответствующим изобретению, и то же самое антитело используют для мониторирования уровней S100A4. Когда уровни белка S100A4 превышают эталонный уровень, пациент является кандидатом на лечение введением моноклонального антитела, соответствующего изобретению.
Уровень экспрессии белка S100A4 можно количественно определить любым принятым способом, который дает возможность выявления и количественного определения указанного белка в пробе, полученной от пациента. Антитела, которые используют в данных анализах, могут быть мечеными или немечеными. Иллюстративные примеры маркеров, которые можно использовать, включают радиоактивные изотопы, ферменты, флуорофоры, хемолюминесцентные реагенты, ферментные субстраты или кофакторы, ферментные ингибиторы, частицы, красители и т.п. Существует широкий круг известных анализов, которые можно использовать в настоящем изобретении, в которых используют немеченые антитела (первичное антитело) и меченые антитела (вторичное антитело); данные способы включают вестерн-блоттинг, ELISA (твердофазный иммуноферментный анализ), RIA (радиоиммуноанализ), конкурентный Е1А (конкурентный ферментный иммуноанализ), DAS-ELISA (сэндвичевый ELISA с двойным антителом), иммуноцитохимические и иммуногистохимические способы, способы, основанные на использовании биочипов или микрорядов белков, включающих специфические антитела или анализы на основе коллоидной преципитации в таких форматах, как измерительные стержни.
В предпочтительном варианте осуществления определение уровней белка S100A4 на стадии (I) осуществляют при использовании моноклонального антитела, продуцируемого гибридомой, выбранной из группы, включающей ЕСАСС 10022401, ЕСАСС 11051801, ЕСАСС 11051802, ЕСАСС 11051803 и ЕСАСС 11051804, или функционального варианта указанного антитела.
В конкретном варианте осуществления уровни белка S100A4 количественно определяют с помощью вестерн-блоттинга, иммуногистохимического анализа или ELISA.
Другие аспекты изобретения
Настоящее изобретение далее предусматривает применение антитела или его фрагмента либо моноклонального антитела, соответствующего любому из вариантов осуществления, представленных в данном контексте, в качестве маркера для идентификации, определения местоположения, оценки, диагноза, прогноза или мониторирования опухоли или любого другого опосредованного S100A4 заболевания у пациента.
Настоящее изобретение далее предусматривает продукт, содержащий антитело или его фрагмент либо моноклональное антитело, соответствующего любому из вариантов осуществления, представленных в данном контексте, и противораковый препарат, в качестве комбинированного препарата для одновременного, раздельного или последовательного применение при лечении опухолей.
Настоящее изобретение далее предусматривает продукт, содержащий антитело или его фрагмент либо моноклональное антитело соответствующего любому из вариантов осуществления, представленных в данном контексте, и лечебное средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного применение при лечении опосредованного S100A4 заболевания.
Антитело или его фрагмент, которые специфически связывают человеческий или мышиный полипептид S100A4, предназначены для применения в качестве лекарственного средства для лечения опухолей.
Определения
Термины "S100A4", "Белок S100A4", "связывающий кальций белок А4 S100", "кальциевый белок", "кальваскулин", "метастазин", "мышиный плацентарный гомолог", "MTS1", "CAPL", "p9Ka", "18A2", "pEL98", "42A", "FSP1", "фибробласт-специфический белок-1", "белок супрессии злокачественной трансформации 1", "белок, ассоциированный с множественной лекарственной устойчивостью лейкоза", "OTTHUMP00000015469", "OTTHUMP00000032895" используют взаимозаменяемо, и они включают также варианты, изоформы, видовые гомологи человеческого или мышиного S100A4 и аналоги, имеющие по меньшей мере один общий эпитоп с человеческим или мышиным S100A4.
Полная последовательность кДНК человеческого S100A4 имеет регистрационный номер Genbank M80563 (31 октября 1994 г.).
Полная последовательность кДНК мышиного S100A4 имеет регистрационный номер Genbank D00208 (5 декабря 1997 г.).
Полная последовательность белка человеческого S100A4 имеет регистрационный номер UniProt P26447 (1 августа 1992 г.):
SEQ ID NO:21
MACPLEKALDVMVSTFHKYSGKEGDKFKLNKSELKELLTRELPSFLGKRTDEAAFQKLMSNLDSNRDNEVDFQEYCVFLSCIAMMCNEFFEGFPDKQPRKK
Полная последовательность белка мышиного S100A4 имеет регистрационный номер UniProt P07091 (1 апреля 1988 г.).
Термин "антитело" используют в данном контексте в самом широком смысле, и он покрывает моноклональные антитела (включая моноклональные антитела полной длины (непроцессированные)), поликлональные антитела, мультиспецифические антитела (например биспецифические антитела) и фрагменты антител, пока они проявляют требуемую биологическую активность.
Интактное "антитело" включает гетеромультимерные гликопротеины, содержащие по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные друг с другом дисульфидными связями. Как правило, каждая легкая цепь присоединена к тяжелой цепи посредством одной ковалентной дисульфидной связи, тогда как количество дисульфидных связей между тяжелыми цепями различных изотипов иммуноглобулина варьирует. Каждая тяжелая и легкая цепь также имеет дисульфидные мостики внутри цепи. Каждая тяжелая цепь имеет на одном конце вариабельную область тяжелой цепи (сокращенно обозначают в данном контексте как HCVR или VH), после которой следует константная область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов СН1, СН2 и СН3. Каждая легкая цепь имеет вариабельную область легкой цепи (сокращенно обозначают в данном контексте как LCVR или VL) и константную область легкой цепи на своем другом конце. Константная область легкой цепи состоит из одного домена CL Области VH и VL могут далее подразделяться на участки гипервариабельности, называемые участками, определяющими комплементарность (CDR), перемежаемые участками, которые более консервативны, называемыми каркасными участками (FR). Каждая VH и VL состоит из трех CDR и четырех FR, аранжированных в направлении от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие в зависимой от антитела опосредованной клетками цитотоксичности (ADCC), фагоцитоз посредством связывания рецептора Fcγ, полупериод существования/скорость выведения посредством неонатального рецептора Fc (FcRn) и комплементзависимая цитотоксичность посредством компонента C1q каскада комплемента.
Термин "фрагмент" в отношении антитела означает антигенсвязывающие фрагменты антитела, содержащие частично вариабельный последовательность тяжелой или легкой цепи, которая сохраняет способность к связыванию человеческого или мышиного S100A4. Примеры фрагментов включают, без ограничения перечисленным, (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; (ii) фрагмент F(ab’)2, бивалентный фрагмент, содержащий два фрагмента Fab, соединенные дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и СН1; (iv) фрагмент Fv, состоящий из доменов VL и VH одной ветви антитело; (v) фрагмент dAb (см. статью Ward et al., (1989) Nature 341:544-546), который состоит из домена VH, и (vi) выделенный участок, определяющий комплементарность (CDR). Фрагменты можно получить рекомбинантными способами или ферментным либо химическим расщеплением и нтактных антител, например, разложением папаином (см., например, WO94/29348).
Более того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, их можно связать с помощью рекомбинантных способов синтетическим линкером, который дает возможность получить их в виде одной белковой цепи, в которой области VL и VH спариваются с формированием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, статьи Bird et al. (1988) Science 242:423-426 и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Данные одноцепочечные антитела включены путем ссылки на термин "антитело".
Термин "моноклональное антитело" относится к препарату молекул антитела однородной молекулярной композиции, т.е. индивидуальные антитела, составляющие популяцию, идентичны за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Композиция моноклональных антител проявляет одну специфичность связывания и аффинность в отношении определенного эпитопа или антигенсвязывающего центра. Моноклональные антитела продуцируются гибридным клеточным продуктом слияния клона В-клеток, происходящего от одной уникальной родительской клетки и опухолевой плазматической клетки. Кроме того, в противоположность препаратам поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена.
Термин "диклональное антитело" относится к препарату из по меньшей мере двух антител к мышиному или человеческому S100A4. Как правило, различные антитела связывают различные эпитопы.
Термин "олигоклональное" относится к препарату из 3-100 различных антител к мышиному или человеческому S100A4. Как правило, антитела в данном препарате связываются с рядом различных эпитопов.
Термин "поликлональные антитело" относится к препарату из более чем 1 (двух или более) различных антитела к мышиному или человеческому S100A4, выделенных из различных В-клеточных линий, т.е. антитела, которые представляют собой смесь иммуноглобулинов, секретируемых к специфическому антигену (S100A4). Данный препарат включает антитела, связывающие ряд различных эпитопов.
Термин "биспецифическое антитело" относится к такому антителу, которое имеет две различные специфичности связывания, см., например, патенты США 5922845 и 5837243; статьи Zeilder (1999) J. Immunol. 163:1246-1252; Somasundaram (1999) Hum. Antibodies 9:47-54; Keler (1997) Cancer Res. 57:4008-4014. Например, биспецифическое антитело может иметь один центр связывания для клеточного поверхностного антигена и второй центр связывания для Fc-рецептора на поверхности эффекторной клетки. Иллюстративные биспецифические антитела могут связываться с двумя различными эпитопами В-клеточного поверхностного маркера. Другие из указанных антител могут связываться с первым В-клеточным маркером и дополнительно связываться со вторым В-клеточным поверхностным маркером. Альтернативно связывающее плечо антитела к В-клеточному маркеру можно скомбинировать с плечом, которое связывается с переключающей молекулой в лейкоците, такой как молекула Т-клеточного рецептора (например, CD2 или CD3) или Fc-рецепторы для IgG (FcyR), такие как FcyRI (CD64), FcyRII (CD32) и FcyRIII (CD16), так что механизмы клеточной защиты концентрируются в В-клетке. Биспецифические антитела можно также использовать для определения местонахождения цитотоксических препаратов против В-клетки. Данные антитела имеют связывающее плечо маркера лимфоцитов и плечо, которое связывается с цитотоксическим препаратом (например, сапонином, антителом к α-интерферону, алкалоидом барвинка, А-цепью рицина, метотрексатом или радиоактивным гаптеновым изотопом). Биспецифические антитела можно получить в виде целых антител или как фрагменты антитела (например, биспецифические антитела F(ab)2).
Биспецифическое антитела, кроме того, включают диатела. Диатела представляют собой бивалентные биспецифическое антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но при использовании линкера, который является слишком коротким, чтобы обеспечить возможность спаривания двух доменов на одной цепи, заставляя тем самым домены спариваться с доменами комплементарности другой цепи и создавая два антигенсвязывающих центра (см., например, статьи Holliger, Р., et al.. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, RJ., et al.. (1994) Structure 2:1121-1123).
Термин "мультиспецифическое антитело" относится к такому антителу, которое имеет по меньшей мере три связывающих центра или специфичности.
Термин "эпитоп" относится к белковой детерминанте, способной к специфическому связыванию с антителом или местом, где антитело связывает свой Ag, либо, путем удлинения, с пептидом, презентируемым в молекуле МНС, с которой связывается Т-клеточный рецептор. Эпитопы состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы отличаются тем, что связывание с первыми, но не последними утрачивается в присутствии денатурирующих растворителей.
Термин "выделенный" означает идентифицированный и отделенный или удаленный из своей естественной среды. Например, полинуклеотид или полипептид, в естественных условиях присутствующий в живом организме, не является "выделенным", но тот же полинуклеотид или полипептид, выделенный из материалов, сосуществующих с ним в его природном состоянии, является "выделенным", включая, но без ограничения перечисленным, состояние, когда данный полинуклеотид или полипептид интродуцируют назад в клетку, даже если клетка принадлежит к тому же виду или типу, как та, из которой получен полинуклеотид или полипептид.
Выражение "препарат, эффективный в плане индукции иммунного ответа в отношении антигена" относится к субстанции, отличной от моноклонального антитела, соответствующего настоящему изобретению, которая действует как стимулятор иммунных ответов, повышая тем самым ответ на вакцину без какого-либо собственного специфического антигенного эффекта. Данный препарат известен также в области техники как адъювант. Примеры включают липид А, белки, выделенные из Bordetella pertussis или Mycobacterium tuberculosis, неполный адъювант и полный адъювант Фрейнда (Difco Laboratories, Detroit, Mich.); Адъювант Merck 65 (Merck and Company, Inc., Rahway, N.J.); соли алюминия, такие как гель гидроксида алюминия (алюм) или фосфат алюминия; соли кальция, железа или цинка; нерастворимую суспензию ацилированного тирозина ацилированныхсахаров; катионно или анионно дериватизированных полисахаридов; полифосфазиновые биоразрушаемые микросферы; монофосфориллипид А и квил А. Цитокины, такие как GM-CSF или интерлейкин-2, -7 или -12 также могут быть использованы в качестве адъювантов.
Выражение "специфически связывает" в отношении антител и их антигенсвязывающих фрагментов означает, что антитело связывает мышиный или человеческий S100A4 при отсутствии или несущественном уровне связывания с другими мышиными или человеческими белками. Термин, однако, не исключает тот факт, что антитела, соответствующие изобретению, могут быть также перекрестно реактивными с другими формами S100A4. Выражение "специфически связывается" относится к реакции связывания, которая определяет присутствие белка в неоднородной популяции белков и других биологических компонентов. Как правило, антитело связывается с константой ассоциации (Ka) по меньшей мере приблизительно 1×106 М-1 или 107 М-1 или приблизительно 108 М-1 - 109 М-1 или приблизительно 1010 М-1 - 1011 М-1 или выше, и связывается с заданным антигеном с аффинностью, которая по меньшей мере в два раза выше, чем его аффинность связывания с неспецифическим антигеном (например, BSA, казеином), отличным от заданного антигена или близкородственным антигеном. Выражения "антитело, распознающее антиген" и "антитело, специфическое в отношении антигена" используют взаимозаменяемо в данном контексте с термином "антитело, которое специфически связывается с антигеном".
Выражение "специфически связывают(ет)" или "связывают(ет) специфически" касательно пептида относится кпептидной молекуле, которая имеет среднюю или высокую аффинность связывания, исключительную или преимущественную, с молекулой-мишенью. Выражение "специфически связывается с" относится к реакции связывания, которая определяет наличие белка-мишени в присутствии гетерогенной популяции белков или других биологических компонентов. Таким образом, в разработанных условиях анализа определенные связывающие молекулы преимущественно связываются с конкретным белком-мишенью и не связываются в существенном количестве с другими компонентами, находящимися в тестируемом образце. Для специфического связывания с белком-мишенью в данных условиях может потребоваться связывающая молекула, которая выбрана по своей специфичности в отношении антигена-мишени. Ряд форматов анализа может быть выбран для выбора лигандов, которые специфически реактивны с конкретным белком. Например, твердофазные иммуноанализы ELISA, иммунопреципитацию, Biacore и вестерн-блоттинг используют для идентификации пептидов, которые специфически реагируют с человеческим или мышиным S100A4. Как правило, специфическая или избирательная реакция будет по меньшей мере в два раза выше фонового сигнала и, более типично, более, чем в 10 раз выше фона.
Термин "блокирует", как используют на протяжении настоящего описания в отношении антител и их антигенсвязывающих фрагментов, соответствующих изобретению, означает, что биологическая активность человеческого или мышиного S100A4 снижается в присутствии антител и их антигенсвязывающих фрагментов, соответствующих настоящему изобретению, по сравнению с активностью человеческого или мышиного S100A4 в отсутствие данных антител и их антигенсвязывающих фрагментов. Блокирование может быть обусловлено, но без ограничения перечисленным, нейтрализующим связыванием одного или более лигандов, предупреждая активацию рецептора лигандом, понижающей регуляцией человеческого или мышиного S100A4 или воздействия на функциональность эффектора. Уровни блокирования можно измерить несколькими путями, например, при использовании анализов, как представлено ниже в примерах, протеолитической активности, миграции клеток, развития опухоли, ангиогенеза опухоли и диссеминации опухоли (метастазирования).
Если антитело или его антигенсвязывающий фрагмент способны к блокированию, то это указывает на ингибирование взаимодействия между белком, связывающим мышиный или человеческий S100A4, и его рецептором.
Выражение "механизм действия человеческого или мышиного белка S100A4" относится к каждой из внутриклеточной и внеклеточной функцией белка S100A4. Внутриклеточные функции белка S100A4 включают функции нарушения витальных клеточных функций, таких как клеточная подвижность, инвазия, деление клетки и выживаемость (см. статьи Kriajevska MV et al. J Biol Chem 1994. 269(31):19679-82 и Grigorian M et al. J Biol Chem 2001. 276(25):22699-708); связывания с некоторыми внутриклеточными белками-мишенями и модуляции их функции, например, с тяжелой цепью немышечного миозина II (см. статьи Kriajevska MV et al. J Biol Chem 1994. 269(31):19679-82 и Ford HL et al. Oncogene 1995. 10(8):1597-1605) и липрином-β1 (см. статью Kriajevska M et al. J Biol Chem 2002. 277(7):5229-35); взаимодействия с опухолевым супрессором белком р53 и регуляции его трансактивационной функции, таким образом, дифференцированной модуляции экспрессии генов-мишеней р53 специфическим для клетки образом (см. статью Grigorian M et al. J Biol Chem 2001. 276(25):22699-708). Внеклеточные функции белка S100A4 включают функции специфического в отношении клетки модулятора подвижности опухолевой клетки, выживаемости и апоптоза; действия в качестве ангиогенного фактора (см. статьи Ambartsumian N et al. Oncogene 2001. 20(34):4685-95; Pedersen MV et al. J Neurosci Res 2004. 77(6):777-86; Belot N et al. Biochim Biophys Acta 2002. 1600(1-2):74-83 и Pedersen KB et al. BMC Cancer 2004. 19; 452); промотора метастазов; активатора сети кровеносных сосудов опухолей; стимулятора неоваскуляризации; повышения подвижности эндотелиальных клеток; ремоделирования цитоскелета опухолевых клеток; стимуляции клеточной подвижности и адгезии; облегчения деградации клеточного матрикса посредством индукции протеолитически активных ММР. Внеклеточные функции S100A4 включают также функции направленности опухолевых эндотелиальных клеток путем связывания с рецептором RAGE и запуска каскада событий либо через сигнальную трансдукцию, либо интернализацию с последующим взаимодействием с внутриклеточными белками-мишенями (р53, немышечный миозин и другие). В результате опухолевые клетки приобретают активность более развитого метастатического фенотипа. Дополнительные внеклеточные функции S100A4 включают направленность эндотелиальных клеток, стимулируя тем самым их подвижность, повышение уровня ангиогенеза опухоли и, вследствие этого, получение путей метастатической диссеминации (см. статьи Schmidt-Hansen В et al. J Biol Chem 2004. 279(23):24498-504).
Термин "высокая аффинность" для антитела IgG относится к константе равновесия ассоциации (Ka) по меньшей мере приблизительно 107 M-1, по меньшей мере приблизительно 108 M-1, по меньшей мере приблизительно 109 M-1, по меньшей мере приблизительно 1010 М-1, по меньшей мере приблизительно 1011 М-1 или по меньшей мере приблизительно 1012 М-1 или выше, например, до 1013 M-1 или 1014 М-1 или выше. Однако, "высокая аффинность" связывания может варьировать для других изотипов антитела.
Термин "Ka", как используют в данном контексте, предназначен для обозначения константы равновесия ассоциации определенного взаимодействия антитело-антиген. Данная константа имеет единицы измерения 1/М.
Термин "Kd", как используют в данном контексте, предназначен для обозначения константы равновесия диссоциации определенного взаимодействия антитело-антиген. Данная константа имеет единицы измерения М.
Термин "ka", как используют в данном контексте, предназначен для обозначения кинетической константы ассоциации определенного взаимодействия антитело-антиген. Данная константа имеет единицы измерения 1/Мс.
Термин "kd", как используют в данном контексте, предназначен для обозначения кинетической константы диссоциации определенного взаимодействия антитело-антиген. Данная константа имеет единицы измерения 1/с.
Выражение "определенное взаимодействие антитело-антиген" относится к экспериментальным условиям, при которых измеряют константу равновесия и кинетическую константу.
Термин "изотип" относится к классу антител (например, IgM или IgG1), который кодируется генами константной области тяжелой цепи.
Термин "нуклеиновая кислота" или "полинуклеотид" предусматривает включение молекул ДНК и молекул РНК. Нуклеиновая кислота может быть одноцепочечной или двухцепочечной.
Термин "выделенная нуклеиновая кислота" или "выделенный полинуклеотид" в плане нуклеиновых кислот, кодирующих антитела или фрагменты данных антител (например, VR, VL, CDR3), которые связываются с человеческим или мышиным S100A4, предназначены для обозначения нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или часть антитела, свободны от других нуклеотидных последовательностей, кодирующих антитела или части антител, которые связывают антигены, отличные от человеческого или мышиного S100A4, причем данные другие последовательности могут в естественных условиях фланкировать нуклеиновую кислоту в человеческой геномной ДНК.
Термин "стабильность", как используют касательно антител и их фрагментов, относится к активности антитела или антигенсвязывающего фрагмента при определении посредством ELISA с прямым связыванием, сравниваемой после 12 дней инкубирования в сыворотке с исходными значениями EC50 при -20°С, 4°С или 37°С.
Термин "человеческое антитело" включает антитела, имеющие вариабельный and константные области (если присутствуют), полученные из последовательностей иммуноглобулина человеческой зародышевой линии. Антитела с человеческой последовательностью, соответствующие изобретению, могут включать остатки аминокислот, не кодируемые последовательностями иммуноглобулина человеческой зародышевой линии (например, мутации, интродуцированные ненаправленным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo). Однако, термин "человеческое антитело", как используют в данном контексте, не предусматривает включение антител, в которых последовательности CDR выделенные из зародышевой линии млекопитающего другого вида, например, мыши, привиты на человеческие каркасные последовательности (т.е., гуманизированные антитела).
Термин "химерное антитело" относится к типу инженерного антитела, которое содержит природный вариабельный домен (легкую цепь и тяжелые цепи), выделенный из донорного антитела, связанный с константными областями легкой и тяжелой цепи, выделенными из акцепторного антитела.
Термин "гуманизированное антитело" относится к типу инженерного антитела, имеющего CDR, выделенные из нечеловеческого донорного иммуноглобулина, причем остальные выделенные из иммуноглобулина части молекулы выделяют из одного (или более) человеческого иммуноглобулина(ов). Кроме того, остатки каркасного носителя можно изменить так, что они сохраняют аффинность связывания (см., например, статьи Queen et al., Proc. Natl Acad Sci USA, 86:10029-10032 (1989), Hodgson et al., Bio/Technology, 9:421 (1991)). Подходящее человеческое акцепторное антитело можно выбрать из традиционной базы данных, например, базы данных КАВАТ®, базы данных Los Alamos и базы данных Swiss Protein no гомологии с последовательностями нуклеотидов и аминокислот донорного антитела. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на основе аминокислот) могут подходить для получения константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для инсерции донорных CDR. Подходящее акцепторное антитело, способное давать константные или вариабельные каркасные области легкой цепи, можно выбрать аналогичным образом. Следует отметить, что необязательно, чтобы тяжелая и легкая цепи акцепторного антитела происходили из одного и того же акцепторного антитела. В предшествующем уровне техники описывают ряд путей получения данных гуманизированных антител, см., например, ЕР-А-0239400 и ЕР-А-054951.
Термин "донорное антитело" относится к антителу (моноклональному и/или рекомбинантному), которое делает вклад в последовательности аминокислот своих вариабельных доменов, CDR или других функциональных фрагментов или их аналогов для первого иммуноглобулинового партнера, чтобы получить измененную иммуноглобулиновую кодирующую область и образованное в результате экспрессируемое измененное антитело с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин "акцепторное антитело" относится к антителу (моноклональному и/или рекомбинантному), гетерологичному относительно донорного антитела, которое делает вклад во все (или любую часть, но предпочтительно все) последовательности аминокислот, кодирующие его каркасные области тяжелой и/или легкой цепей и/или его константные области тяжелой и/или легкой цепей, для первого иммуноглобулинового партнера. Человеческое антитело представляет собой акцепторное антитело.
Сокращение "CDR" относится к последовательностям аминокислот участка антитела, определяющего комплементарность, которые представляют собой гипервариабельные домены тяжелой и легкой цепей иммуноглобулина. См., например, монографию Kabat et al., Sequences of Proteins of Immunological Interest (Последовательности белков, представляющие иммунологический интерес), 4 изд., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной части иммуноглобулина имеется три CDR тяжелой цепи и три CDR легкой цепи (или участки CDR) в вариабельной области иммуноглобулина. Таким образом "CDR", как используют в данном контексте, относится ко всем трем CDR тяжелой цепи или все три CDR легкой цепи (или как всех CDR тяжелой, так и всех CDR легкой цепи, если необходимо). Структура и укладка белка антитела могут означать, что другие остатки представляют собой рассматриваемую часть участка связывания антигена, и компетентному специалисту следует иметь это в виду. См., например статью Chothia et al., (1989) Conformations of immunoglobulin hypervariable domains (Конформации гипервариабельных доменов иммуноглобулина); Nature 342, p877 -883. CDR дают большинство контактирующих остатков для связывания антитела с антигеном или эпитопом. CDR, представляющие интерес в данном изобретении, получены из вариабельных последовательностей тяжелой и легкой цепей донорного антитело и включают аналоги природных CDR, причем аналоги имеют такую же или сохраняют такую же специфичность связывания антигена и/или нейтрализующую активность, что донорное антитело, из которого они получены.
На протяжении данного описания остатки аминокислот в последовательностях антитела нумеруют согласно схеме Kabat. Аналогично термины "CDR", "CDRL1", "CDRL2", "CDRL3", "CDRH1", "CDRH2", "CDRH3" соответствуют системе нумерации Kabat, как приведено в работе Kabat et al; Sequences of proteins of Immunological Interest (Последовательности белков, представляющие иммунологический интерес), NIH, 1987. Для компетентных специалистов в области техники будет очевидно, что имеются альтернативные определения последовательностей CDR, такие как, например, приведенные в работе Chothia et al. (1989).
Для компетентных специалистов в области техники будет очевидно, что термин "выделенный" предназначен для определения не только источника в том смысле, что он является физической природой материала, но также для определения материала, который структурно идентичен (в отношении первичной последовательности аминокислот) материалу, но не происходит из эталонного источника. Так, например, "остатки, обнаруженные в донорном антителе, из которого выделен CDRH3" не обязательно должны быть очищены из донорного антитела.
Термины "VH" и "VL" относятся, соответственно, к вариабельному домену тяжелой цепи и вариабельному домену легкой цепи антитела.
Термин "эффекторная функция", как используют в данном контексте, означает, что она относится к одной или более функций из зависимой от антитела опосредованной клеткой цитотоксической активности (ADCC) и ответов, опосредованной комплемент-зависимой цитотоксической активностью (CDC), Fc-опосредованным фагоцитозом и рециклингом антитела посредством рецептора FcRn. Взаимодействие между константной областью антитела и различными Fc-рецепторами (FcR), как считают, опосредует эффекторные функции антитела. Существенные биологические эффекты могут быть следствием эффекторной функциональности, в частности, зависимой от антитела клеточной цитотоксичности (ADCC), фиксации комплемента (комплемент-зависимой цитотоксичности или CDC), фагоцитоза (антитело-зависимого опосредованного клеткой фагоцитоза или ADCP) и полупериода существования/выведения антитела. Как правило, для способности опосредовать эффекторную функцию необходимо связывание антитела с антигеном, и не все антитела будут опосредовать каждую эффекторную функцию. Эффекторную функцию можно измерить рядом способов, в том числе, например, посредством связывания FcyR111 с натуральными клетками-киллерами или посредством связывания FcyRI с моноцитами/макрофагами для измерения эффекторной функции ADCC.
Различные модификации константной области тяжелой цепи антител можно осуществить в зависимости от требуемого эффекторного свойства. Человеческие константные области, в которых в основном отсутствуют функции а) активации комплемента по классическому пути и b) опосредования зависимой от антитела клеточной цитотоксичности, включают константную область IgG4 и константную область IgG2. Константные области IgG1, содержащие специфические мутации, как отдельно описано, уменьшают связывание с Fc-рецепторами и, следовательно, снижают ADCC и CDC (см. статьи Duncan et al. Nature 1988, 332; 563-564; Lund et al. J. Immunol. 1991, 147; 2657-2662; Chappel et al. PNAS 1991, 88; 9036-9040; Burton and Woof, Adv. Immunol. 1992, 51; 1-84; Morgan et al., Immunology 1995, 86; 319-324; Hezareh et al., J. Virol. 2001, 75(24); 12161-12168). Константные области человеческого IgG1, содержащие специфические мутации или измененное гликозилирование на остатке Asn297, как описано, повышают уровень связывания с Fc-рецепторами. Показано также, что они в ряде случаев повышают ADCC и CDC (см. статьи Lazar et al. PNAS 2006, 103; 4005-4010; Shields et al. J Bioi Chem 2001, 276; 6591-6604; Nechansky et al. Mollmmunol, 2007, 44; 1815-1817).
Для антител IgG эффекторные функциональности, в том числе ADCC и ADCP опосредуются взаимодействием константной области тяжелой цепи с семейством рецепторов Fcγ, присутствующих на поверхности иммунных клеток. У человека они включают FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). Взаимодействие между антителом, связанным с антигеном, и образование комплекса Fc/Fcγ вызывает ряд эффектов, включая цитотоксичности, активацию иммунных клеток, фагоцитоз и высвобождение воспалительных цитокинов. Специфические замены в константной области (включая S239D/I332E), как известно, повышают аффинность константной области тяжелой цепи к некоторым Fc-рецепторам, повышая, таким образом, эффекторную функциональность антитела (см. статью Lazar et al. PNAS 2006).
Термин "гомология" или "гомология последовательностей" относится к степени сходства между последовательностями, которая обусловлена общим источником их происхождения. Существуют инструменты для поиска сходства в различных базах данных последовательностей, известные компетентным специалистам в области техники, такие как FASTA, BLAST, предназначенные для расчета гомологии.
Термин "идентичность" или "идентичность последовательностей" означает для полинуклеотидов и полипептидов, соответственно, сравнение, рассчитанное при использовании алгоритма, представленного в (1) и (2) ниже:
(1) Идентичность полинуклеотидов рассчитывают, умножая общее число нуклеотидов с заданной последовательности на целое число, определяющее процент идентичности, деленное на 100 с последующим вычитанием данного результата из указанного общего числа нуклеотидов в данной последовательности, или:
nn≤xn-(xn*y),
где nn означает число изменений нуклеотидов, xn означает общее число нуклеотидов в заданной последовательности, у означает 0,95 для 95%, 0,97 для 97% или 1,00 для 100%, и * представляет собой символ знака умножения, и где любое значение xn и y, выраженное нецелым числом, округляют в сторону уменьшения до ближайшего целого числа перед вычитанием из xn. Изменения полинуклеотидной последовательности, кодирующей полипептид, могут создать нонсенс-, миссенс-мутации или мутации со сдвигом рамки считывания в данной кодирующей последовательности и, следовательно, изменяют полипептид, кодируемый полинуклеотидом после данных изменений.
(2) Идентичность для полипептидов рассчитывают, умножая общее число аминокислот на целое число, определяющее процент идентичности, деленный на 100 с последующим вычитанием данного результата из указанного общего числа аминокислот, или:
na≤ха-(ха*y),
где na означает число изменений аминокислот, xa означает общее число аминокислот в последовательности, y означает 0,95 для 95%, 0,97 для 97% или 1,00 для 100%, и * представляет собой символ знака умножения и где любое значение xa и y, выраженное нецелым числом, округляют в сторону уменьшения до ближайшего целого числа перед вычитанием xa.
Термин "вариант(ы)" относится к полинуклеотиду или полипептиду, который отличается от эталонного полинуклеотида или полипептида, соответственно, но сохраняет основные свойства. Типичный вариант полинуклеотида отличается по нуклеотидной последовательности от другого, эталонного полинуклеотида. Изменения в нуклеотидной последовательности преобладающего варианта не могут изменить последовательность аминокислот полипептида, кодируемого эталонным полинуклеотидом. Изменения нуклеотидов могут в результате привести к заменам, добавлениям, делециям аминокислот, слитым белкам и укорочениям полипептида, кодируемым эталонной последовательностью, как обсуждают ниже. Типичный вариант полипептида отличается по последовательности аминокислот от другого, эталонного полипептида. Как правило, отличия ограничены, так что последовательности эталонного полипептида и варианта в целом очень близки и на многих участках идентичны. Вариант и эталонный полипептид могут отличаться по последовательности аминокислот одной или более замен, добавлений, делеций в любой комбинации. Замещенный или введенный остаток преобладающей аминокислоты может не быть остатком, кодируемым генетическим кодом. В области техники вполне признают, что определенные замены аминокислот рассматривают как "консервативные". Аминокислоты делят на группы на основе общих свойств боковой цепи, и замены внутри групп, которые поддерживают всю или практически всю аффинность связывания антитела, соответствующего изобретению, или его антигенсвязывающего фрагмента считают консервативными заменами, см. таблицу ниже:
В ряде аспектов изобретения могут быть включены варианты, в которых несколько, например, 5-10, 1-5, 1-3, 1-2 остатка аминокислот или 1 остаток аминокислоты замещены, делегированы или добавлены в любой комбинации. Вариант полинуклеотида или полипептида может быть природным, таким как аллельный вариант, или он может представлять собой вариант, о котором неизвестно, существует ли он в природе. Неприродные варианты полинуклеотидов и полипептидов можно получить способами мутагенеза, прямым синтезом и другими рекомбинантными способами, известными компетентным специалистам.
Получение химерных и гуманизированных антител
Применение интактных нечеловеческих антител при лечении человеческих заболеваний или нарушений несет в себе потенциальные установленные в настоящее время проблемы иммуногенности, т.е. иммунная система пациента может распознавать нечеловеческое интактное антитело как несобственное и вызвать нейтрализующий ответ. Это особенно очевидно при множественном введении нечеловеческого антитела пациенту-человеку. В течение ряда лет разработаны различные способы преодоления данных проблем, и они в основном включают уменьшение композиции нечеловеческих последовательностей аминокислот в интактном антителе при сохранении относительной простоты получения нечеловеческих антител от иммунизированного животного, например, мыши, крысы или кролика. В общих чертах для достижения этого используют два подхода. Первый представляет собой химерные антитела, которые в основном содержат нечеловеческий (например, грызунов, таких как мышь) вариабельный домен, слитый с человеческой константной областью. Поскольку антигенсвязывающий центр антитела локализован в вариабельных доменах, химерное антитело сохраняет свою аффинность связывания в отношении антигена, но приобретает эффекторные функции человеческой константной области и, вследствие этого, способно осуществлять эфекторные функции, такие, как описано выше. Химерные антитела, как правило, получают при использовании способов рекомбинантной ДНК. ДНК, кодирующую антитела (например, кДНК) выделяют и секвенируют, используя принятые способы (например, используя олигонуклеотидные зонды, которые способны специфически связываться с генами, кодирующими Н- и L-цепи антитела, соответствующего изобретению. Гибридомные клетки служат типичным источникам данной ДНК. После выделения ДНК помещают в экспрессирующие векторы, которыми затем трансфицируют клетки-хозяева, такие как Е.coli, клетки COS, клетки СНО или клетки миеломы, которые в иных случаях не продуцируют белок иммуноглобулина, чтобы получить синтез антитела. ДНК может быть модифицирована заменой кодирующими последовательностями человеческих L- и Н-цепей соответствующих нечеловеческих (например, мышиных) Н- и L-константных областей, см., например, статью Morrison; PNAS 81, 6851 (1984).
Второй подход включает генерацию гуманизированные антитела, где нечеловеческое содержание антитела уменьшают гуманизацией вариабельных доменов. Приобретают популярность два способа гуманизации. Первый представляет собой гуманизацию путем прививания CDR. CDR образует петли около N-конца антитела, где они формируют поверхность, возвышающуюся в основе, образуемом каркасными участками. Специфичность антитела в плане связывания антигена в основном определена топографией и химическими характеристиками поверхности его CDR. Данные признаки, в свою очередь, определяются конформацией индивидуальных CDR, относительным расположением CDR, а также природой и расположением боковых цепей остатков, содержащих CDR. Сильного снижения иммуногенности достигают прививанием только CDR нечеловеческих (например, мышиных) антител ("донорные" антитела) на человеческие каркасные ("акцепторные каркасные") и константные области (см. статьи Jones et al (1986) Nature 321, 522-525 и Verhoeyen M et al (1988) Science 239, 1534-1536). Однако, само по себе прививание CDR может не привести в результате к полному сохранению антигенсвязывающих свойств, и часто обнаруживают, что некоторые каркасные остатки (иногда обозначаемые как "обратные мутации") донорного антитела необходимо сохранить в гуманизированной молекуле, если следует восстановить существенную аффинность связывания антигена (см. статьи Queen С et al (1989) PNAS 86, 10029-10033, Со, M et al (1991) Nature 351, 501-502). В данном случае, из базы данных выбирают человеческие вариабельные домены, показывающие максимальную гомологию последовательности с нечеловеческим донорным антителом, чтобы получить человеческий скелет (FR). Выбор человеческих FRs можно осуществить либо из человеческих консенсусных, либо из индивидуальных человеческихантител. При необходимости ключевые остатки из донорного антитела заменяют в человеческом акцепторном скелете, чтобы сохранить конформации CDR. Компьютерное моделирование антитела может быть использовано, чтобы помочь идентифицировать данные структурно важные остатки, см. WO99/48523.
Альтернативно, гуманизация может быть достигнута способом "вениринга". Статистический анализ уникальных вариабельных доменов тяжелой и легкой цепей человеческого и мышиного иммуноглобулина показывает, что точные типы представляемых остатков различны в человеческих и мышиных антителах, и наиболее индивидуальные поверхностные положения имеют большое преимущество в отношении маленького числа различных остатков (см. статьи Padlan E.A. et al; (1991) Mol. Immunol. 28, 489-498 и Pedersen J.T. et al (1994) J. Mol. Biol. 235; 959-973).
Вследствие этого возможно уменьшить иммуногенность нечеловеческого Fv путем замены представляемых остатков в его каркасных участках, которые отличаются от обычно обнаруживаемых в человеческих антителах. Поскольку иммуногенность белка можно коррелировать с поверхностной доступностью, замены поверхностных остатков может быть достаточно для того, чтобы сделать мышиный вариабельный домен "невидимым" для человеческой иммунной системы (см. также раздел Mark G.E. et al (1994) в Handbook of Experimental Pharmacology (Справочник по экспериментальной фармакологии) т.113: The pharmacology of monoclonal Antibodies, (Фармакология моноклональных антител) Springer-Verlag, стр.105-134). Данный способ гуманизации называют "венирингом", поскольку изменяют только поверхность антитела, причем поддерживающие остатки остаются неизменными.
Получение человеческих антител
Моноклональные антитела (MAT), соответствующие изобретению, можно получить рядом способов, включая принятую технологию моноклональных антител, например, стандартную технологию гибридизации соматических клеток Kohler и Milstein, см. Nature 256:495 (1975). Можно использовать любой способ получения моноклонального антитела, например, вирусную или онкогенную трансформацию В-лимфоцитов. Одной системой получения гибридом с использованием животных является система на мышах. Получение гибридом в мыши представляет собой хорошо разработанный способ. Протоколы иммунизации и способы выделения иммунизированных спленоцитов для слияния известны с области техники. Партнеры слияния (например, клетки мышиной миеломы) и способы слияния также известны (см., например, монографию Harlow and Lane (1988), Antibodies, A Laboratory Manual (Лабораторное руководство по антителам), Cold Spring Harbor Laboratory Press, Cold Spring Harbor New York).
Человеческие моноклональное антитела, направленные против мышиного или человеческого S100A4 можно генерировать с использованием трансгенных мышей, несущих человеческую иммунную систему, а не мышиную систему. В настоящее время доступны некоторые линии трансгенных мышей, где их мышиные иммуноглобулиновые локусы замещены сегментами гена человеческого иммуноглобулина (см. статьи see Tomizuka K, (2000) PNAS 97, 722-727; Fishwild D.M (1996) Nature Biotechnol. 14, 845-851, Mendez MJ, 1997, Nature Genetics, 15, 146-156). При введении антигена данные мыши способны продуцировать репертуар человеческих антител, из которого можно отобрать антитела, представляющие интерес. Следует особо отметить систему Trimera™ (см. статью Eren R et al, (1998) Immunology 93:154-161), в которой человеческие лимфоциты трансплантируют облученным мышам, Систему выбранных лимфоцитарных антител (SLAM, см. статью Babcooketal, PNAS (1996) 93:7843-7848), в которой человеческие (или другого вида) лимфоциты эффективно проводят через процедуру генерации массивного пула антител in vitro с последующим деконволюционным ограничивающим разведением и процедурой отбора и Xenomouse IITM (Abgenix Inc). Альтернативный подход доступен в фирме Morphotek Inc при использовании технологии Morphodoma™.
Детальные способы генерации полностью человеческих моноклональных антител к человеческому или мышиному S100A4 описаны в Примерах ниже. Накопленный опыт с использованием различных антигенов показывает, что трансгенные мыши отвечают при исходной внутрибрюшинной иммунизации (IP) антигеном в полном адъюванте Фрейнда с последующими еженедельными IP иммунизациями (в целом до 6) антигеном в неполном адъюванте Фрейнда. Однако обнаружено, что адъюванты, отличные от адъюванта Фрейнда, также эффективны. Кроме того, обнаружено, что целые клетки в отсутствие адъюванта высокоиммуногенны. Иммунный ответ можно мониторировать в ходе протокола иммунизации с помощью образцов плазмы, получаемых путем ретрорбитальных заборов крови. Плазму можно подвергать скринингу с помощью ELISA, и мышей с достаточными титрами человеческого иммуноглобулина к S100A4 можно использовать для слияний. Мышам можно бустерно вводить внутривенно антиген за 3 дня до умерщвления и удаления селезенки. Ожидают, что может понадобиться получить 2-3 слияния для каждой иммунизации. Как правило, для каждого антигена иммунизируют от 6 до 24 мышей.
Для очистки человеческих антител к S100A4 можно выращивать отобранные гибридомы в двухлитровых роллерных колбах для очистки моноклональных антител. Супернатанты можно отфильтровать и концентрировать перед аффинной хроматографией с белок А-сефарозой (Pharmacia, Piscataway, NJ). Элюированный IgG можно проверить гель-электрофорезом и высокоэффективной жидкостной хроматографией, чтобы убедиться в чистоте. Буферный раствор можно заменить на PBS, и концентрацию можно определить по OD (оптической плотности) 280 при использовании коэффициента экстинкции 1,43. Можно взять аликвоты моноклональных антител и хранить при -80°С.
Чтобы определить, связываются ли отобранные человеческие моноклональные антитела к S100A4 с уникальными эпитопами, каждое антитело можно биотинилировать с использованием коммерчески доступных реагентов (Pierce, Rockford, IL). Конкурентные анализы с использованием немеченых моноклональных антител и биотинилированных моноклональных антител можно провести с помощью планшетов для ELISA, покрытых человеческим или мышиным S100A4. Связывание биотинилированных MAb можно определить при использовании зонда стрептавидин-щелочная фосфатаза.
Для определения изотипа очищенных антител можно получить изотипы ELISA. Лунки планшетов для микротитрования можно покрыть 1 мкг/мл антитела к человеческому IgG в течение ночи при 4°С. После блокирования 1% BSA проводят реакцию планшетов с 1 мкг/мл или меньше моноклональных антител или очищенных контролей изотипов при комнатной температуре в течение одного- двух часов. Затем проводят реакцию лунок либо с человеческим IgG1, либо со специфическими в отношении человеческого IgM зондами, конъюгированными с щелочной фосфатазой. Планшеты проявляют и анализируют, как описано выше.
Для того, чтобы продемонстрировать связывание моноклональных антител с живыми клетками, экспресирующими человеческий или мышиный S100A4, можно использовать проточную цитометрию. Вкратце, клеточные линии, экспрессирующие человеческий или мышиный S100A4 (выращенные в стандартных условиях роста) смешивают с различными концентрациями моноклональных антител в PBS, содержащим 0,1% BSA и 10% сыворотки телячьих эмбрионов, и инкубируют при 37°С в течение 1 часа. После промывания проводят реакцию клеток с меченным флуоресцеином антителом к человеческому IgG в тех же условиях, при которых проводят окрашивание первичного антитела. Образцы можно анализировать на приборе FACScan, используя свойства светового и бокового рассеяния для пропускания отдельных клеток. Альтернативный анализ с помощью флуоресцентной микроскопии можно использовать в дополнение или вместо) анализа проточной цитометрии. Клетки можно окрасить точно, как описано выше, и исследовать с помощью флуоресцентной микроскопии. Данный способ позволяет визуализировать отдельные клетки, но может иметь пониженную чувствительность в зависимости от густоту антигена.
Человеческие IgG к S100A4 можно далее тестировать на реактивность с человеческим или мышиным S100A4 с помощью вестерн-блоттинга. Вкратце, можно получить клеточные экстракты из клеток, экспрессирующих человеческий или мышиный S100A4, и подвергнуть электрофорезу на полиакриламидном геле с додецилсульфатом натрия. После электрофореза выделенные антигены переносят на нитроцеллюлозные мембраны, блокируют 10% сывороткой телячьих эмбрионов и зондируют тестируемыми моноклональными антителами. Связывание человеческого IgG можно определить с использованием антитела к человеческому IgG - щелочной фосфатазы и проявить с использованием таблеток субстрата BCIP/NBT (Sigma Chem. Co., St. Louis, МО).
Способ представления на фагах можно использовать для получения человеческих антител (и их фрагментов), см. статьи McCafferty; Nature, 348, 552-553 (1990) и Griffiths AD et al (1994) EMBO 13:3245-3260. Согласно данному способу гены вариабельного домена антитело клонируют в рамке считывания гена либо главного либо минорного гена белка оболочки филаментозного бактериофага, такого как М13 или fd и представляют (обычно с помощью хелперного фага) как его функциональные антигенсвязывающие фрагменты на поверхности фаговой частицы. Отбор на основе функциональных свойств антитела приводит в результате к селекции гена, кодирующего антитело, демонстрирующее данные свойства. Способ представления на фагах можно использовать для отбора антигенспецифических антител из библиотек, полученных из человеческих В-клеток, выделенных у пациентов, пораженных болезнью или нарушением, описанным выше, или, альтернативно, у иммунизированных доноров-людей (см. статью Marks; J.Mol.Bio. 222, 581-597, 1991). Когда требуется интактное человеческое антитело, содержащее константный домен, необходимо реклонировать представляемый на фаге выделенный фрагмент в экспрессрующие векторы млекопитающих, содержащие требуемые константные области, и создать стабильные экспрессирующие клеточные линии.
Способ созревания аффинности (см. статью Marks, Bio/technol 10, 779-783 (1992)) можно использовать для повышения аффинности связывания, где аффинность первичного человеческого антитела повышают путем последовательной замены вариабельных доменов Н- и L-цепи природными вариантами и отбора на основе повышенной аффинности связывания. Варианты данного способа, такие как "импринтинг эпитопа" также доступны: см. WO93/06213. См. также Waterhouse; Nucl. Acids Res 21, 2265-2266 (1993).
Фармацевтические композиции
Настоящее изобретение предусматривает фармацевтические композиции, содержащие одно или комбинацию моноклональных антител или их фрагментов, полученные вместе с фармацевтически приемлемым носителем. Некоторые композиции включают комбинацию множества (например, двух или более) выделенных антител или их фрагментов, соответствующих изобретению. В ряде композиций каждое из антител или их фрагментов в композиции представляет собой моноклональное антитело, которое связывается с отдельным предварительно выбранным эпитопом человеческого или мышиного S100A4.
Независимо от выбранного пути введения соединения, соответствующие настоящему изобретению, которые могут быть использованы в подходящей гидратированной форме, или фармацевтические композиции, соответствующие настоящему изобретению, готовят в фармацевтически приемлемых лекарственных формах принятыми способами, известными компетентным специалистам в области техники.
Для введения антитела используют интервалы доз от приблизительно 0,0001 до 100 мг/кг, чаще от 0,01 до 5 мг/кг массы тела хозяина. Например дозы могут составлять 1 мг/ кг массы тела или 10 мг/кг массы тела или лежать в интервале 1-10 мг/кг. Дозы нуклеиновых кислот, кодирующих иммуногены, лежат в интервале от приблизительно 10 нг до 1 г, от 100 нг до 100 мг, от 1 мкг до 10 мг или 30-300 мкг ДНК на пациента. Дозы инфекционных вирусных векторов варьируют от 10-100 или более вирионов/дозу.
Для терапевтического применения фармацевтические композиции вводят пациенту, страдающему от установленного заболевания, в количестве, достаточном для остановки или ингибирования дальнейшего развития или обратного развития либо устранения заболевания, его симптомов или биохимических маркеров. Для профилактического применения фармацевтические композиции вводят пациенту, чувствительному или находящемуся в группе риска развития заболевания, в количестве, достаточном для задержки, подавления или предупреждения развития заболевания, его симптомов и биохимических маркеров. Количество, соответствующее для осуществления этого, определяют как "терапевтическим" или "профилактически эффективную дозу". Доза зависит от заболевания, которое лечат, размера пациента, тяжести симптомов у пациента и конкретной композиции или выбранного пути введения. В частности, при лечении опухолей "терапевтически эффективная доза" может подавлять рост опухоли по меньшей мере приблизительно на 20% или по меньшей мере приблизительно на 40% или по меньшей мере приблизительно на 60% или по меньшей мере приблизительно на 80% относительно нелеченых пациентов. Способность соединения подавлять рак можно оценить в системе модели на животном, предсказывающей эффективность на опухолях человека. Альтернативно данное свойство композиции можно оценивать путем исследования способности соединения к ингибированию с помощью принятых анализов in vitro. Терапевтически эффективное количество лекарственного соединения может уменьшить размер опухоли или иным образом облегчить симптомы у пациента.
Композицию, соответствующую настоящему изобретению, можно вводить множеством способов, известных в области техники. Путь и способ введения варьируют в зависимости от требуемых результатов. В плане терапевтических композиций препараты, соответствующие настоящему изобретению, включают подходящие для перорального, назального, местного (включая защечное и подъязычное), ректального, вагинального и парентерального введения. Препараты можно получить любыми способами, известными в области фармации, предпочтительно в полном соответствии с инструкциями по Надлежащей практике организации производства (GMP) Администрации по контролю за продуктами питания и лекарствами США.
Выражения "парентеральное введение" и "введенный парентерально" означает способы введения, отличные от энтерального и местного введения, как правило, путем инъекции, и включают, без ограничения перечисленным, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсульную, субарахноидальную, интраспинальную, эпидуральную и внутригрудинную инъекцию и инфузию.
Фармацевтически приемлемые носители включают растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые препараты, изотонические и замедляющие всасывания препараты и т.п., которые физиологически приемлемы. Носитель может подходить для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии). В зависимости от пути введения активное соединение, т.е. антитело или его фрагмент, биспецифическая и мультиспецифическая молекула могут быть покрыты материалом, предназначенным для защиты соединения от действия кислот или других естественных условий, которые могут инактивировать соединение.
Активные соединения можно получить с носителями, которые защищают соединение от быстрого высвобождения, такие как препарат с контролируемым высвобождением, включая имплантаты, чрескожные пластыри и микроинкапсулированные системы доставки. Можно использовать биоразрушаемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы получения данных препаратов описаны, например, в монографии Sustained and Controlled Release Drug Delivery Systems (Системы доставки лекарственных препаратов с замедленным и контролируемым высвобождением), под ред. J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Для введения соединения, соответствующего изобретению, определенными путями введения может быть необходимым покрыть соединение или ввести соединении совместно с материалом, предназначенным для предупреждения его инактивации. Например, соединение можно ввести пациенту в подходящем носителе, например, в липосомах или разбавителе. Фармацевтически приемлемые разбавители включают солевые и водные буферные растворы. Липосомы включают эмульсии типа вода в масле в воде CGF, а также традиционные липосомы (см. статью Strejan et al. (1984) J. Neuroimmunol. 7:27). Когда активное соединение защищено соответствующим образом, как описано выше, соединение можно вводить перорально, например, с инертным разбавителем или ассимилирующимся съедобным носителем.
Типичные фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления инъекционных растворов или дисперсии. Применение данных сред и компонентов для фармацевтически активных субстанций известны в области техники. За исключением случаев, когда какие-либо принятые среды или компоненты несовместимы с активным соединением, предусматривают их использованием в фармацевтических композициях, соответствующих изобретению. Дополнительные активные соединения также могут быть включены в композиции.
Терапевтические композиции, как правило, должны быть стерильными, в существенной степени изотоническими и стабильными в условиях изготовления и хранения. Они должны быть текучими до той степени, чтобы обеспечить легкое инъекционное введение, и должны быть защищены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Композиция может быть получена в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного препарата. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, изотонический забуференный солевой раствор, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла, такие как оливковое масло, и подходящие для инъекций органические сложные эфиры, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, при использовании покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и при использовании поверхностно-активных веществ. Во многих случаях предпочтительно включение в композицию изотонических компонентов, например, Сахаров, многоатомных спиртов, таких как маннит, сорбит или хлорид натрия. Пролонгированное всасывание инъекционных композиций можно получить путем включения в композицию компонента, который задерживает всасывание, например, солей моностеарата и желатина.
Стерильные инъекционные растворы можно получить введением активного соединения в необходимом количестве в соответствующий растворитель с одним или комбинацией вышеперечисленных ингредиентов, как требуется, с последующей стерилизацией микрофильтрацией. Как правило, дисперсии получаю путем введения активного соединения в стерильный носитель, который содержит базовую дисперсионную среду и необходимые другие ингредиенты их вышеперечисленных. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента с любым дополнительным требуемым ингредиентом из их предварительно простерилизованного фильтрованием раствора.
Данные композиции могут также содержать наполнители, такие как консерванты, смачивающие средства, антиоксиданты, эмульгаторы и диспергаторы. Предупреждение присутствия микроорганизмов можно гарантировать как способами стерилизации (см. выше), так и включением различных антибактеральных и противогрибковых препаратов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые атиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) антиоксиданты, растворимые в масле, такие какаскорибилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, α-токоферол и т.п. и (3) хелаторы металлов, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислот и т.п.
Терапевтические композиции можно также вводить с помощью медицинских устройств, известных в области техники. Например, в предпочтительном варианте осуществления терапевтическую композицию, соответствующую изобретению, можно ввести с помощью безыгольного гиподермического инъекционного устройства, имплантируемого микроинфузионного насоса для дозирования лекарственного средства с контролируемой скоростью и т.п.
Когда соединения, соответствующие настоящему изобретению, вводят в виде фармацевтических препаратов человеку и животным, их могут давать в виде монопрепарата или в виде фармацевтической композиции, содержащей, например, 0,01-99,5% (или 0,1-90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Способы и варианты применения изобретения
Моноклональные антитела к человеческому или мышиному S100A4 и их производные или конъюгаты, соответствующие настоящему изобретению, имеют диагностическое и терапевтическое применение in vitro и in vivo. Например, данные молекулы можно ввести в клетки в культуре, ткани, органы, например, in vitro или ex vivo либо пациенту, например, in vivo, с целью лечения, предупреждения, мониторирования или диагностики ряда нарушений.
Термин "пациент" включает человека и отличных от человека животных. Отличные от человека животные включают всех позвоночных, например, млекопитающих и немлекопитающих, таких как приматы и приматы, отличные от человека, овцы, собаки, кролики, крысы, мыши, коровы, куры, амфибии и рептилии. За исключением случаев, когда это указано, термины "пациент" или "субъект" используют взаимозаменяемо.
Способы можно использовать для лечения любого рода рака, включая, но без ограничения перечисленным, рак молочной железы, рак простаты, лейкоз, рак кожи, рак поджелудочной железы, рак толстой кишки, меланому, злокачественную меланому, рак яичников, рак головного мозга, первичную карциному головного мозга, рак головы и шеи, глиому, глиобластому, рак печени, рак мочевого пузыря, немелкоклеточный рак легкого, карциному головы или шеи, карциному яичников, карциному легкого, мелкоклеточную карциному легкого, опухоль Вильмса, карциному шейки матки, карциному яичка, карциному мочевого пузыря, карциному поджелудочной железы, карциному желудка, карциному толстой кишки, карциному простаты, карциному мочеполовых органов, карциному щитовидной железы, карциному пищевода, миелому, множественную миелому, карциному надпочечников, карциному почечных клеток, карциному эндометрия, карциному коры надпочечников, злокачественную инсулиному поджелудочной железы, злокачественную карциноидную карциному, хориокарциномы, грибовидный микоз, злокачественную гиперкальцемию, гиперплазию шейки матки, лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, хронический гранулоцитарный лейкоз, острый гранулоцитарный лейкоз, лейкоз волосковых клеток, нейробластому, рабдомиосаркому, саркому Капоши, болезнь Вакеза, общий тромбоцитоз, болезнь Ходжкина, лимфома не-Ходжкина, саркому мягких тканей, остеогенную саркому, первичную макроглобулинемию и ретинобластому. В некоторых вариантах осуществления раковые клетки, которые лечат, являются метастатическими. В других вариантах осуществления раковые клетки, которые лечат, устойчивы к противораковым или антиангиогенным препаратам.
В частности, антитела и их фрагменты, соответствующие настоящему изобретению, можно использовать для лечения опухолей, причем опухоль выбрана из группы, включающей карциному молочной железы, карциному простаты, карциному легкого, колоректальную карциному, карциному поджелудочной железы, карциному почки, карциному желудка, карциному яичника, папиллярную карциному щитовидной железы, меланому, гепатоцеллюлярную карциному, карциному мочевого пузыря, инвазивную карциному липосаркому, нейробластому, карциному сквамозных клеток пищевода, остеосаркому, карциному желчного пузыря, сквамозную карциному полости рта, эндометриальную карциному, медуллобластому и любые другие опухолии, экспрессирующие S100A4.
В частности, антитела и их фрагменты, соответствующие настоящему изобретению, можно использовать для лечения нефропатии, ревматоидного артрита, легочной гипертензии, псориаза и других опосредованных S100A4 заболеваний.
Доказательство роли S100A4 в развитии или опосредовании нефропатии представлено, в числе прочих, в работах Inoue, Т., Okada, Н., Takenaka, Т., Watanabe, Y. & Suzuki, H. 2009 (A case report suggesting the occurrence of epithelial-mesenchymal transition in obstructive nephropathy (История болезни, позволяющая предположить наличие эпителиально-мезенхимного перехода при обструктивной нефропатии). Clin. Exp. Nephrol 13, 385-388); Yamaguchi, Y. et al. 2009 (Epithelial-mesenchymal transition as a potential explanation for podocyte depletion in diabetic nephropathy (Эпителиально-мезенхимный переход как возможное объяснение истощения подоцитов при диабетической нефропатии). Am. J. Kidney Dis 54, 653-664); Le Hir, M., Hegyi, I., Cueni-Loffing, D., Loffing, J. & Kaissling, B. 2005 (Characterization of renal interstitial fibroblast-specific protein 1/S100A4-positive cells in healthy and inflamed rodent kidneys (Характеризация белка, специфического для почечных интерстициальных фибробластов 1/S100A4-положительных клеток в здоровых и воспаленных почках грызунов)). Histochem. Cell Biol 123, 335-346).
Доказательство роли S100A4 в развитии или опосредовании ревматоидного артрита представлено, в числе других, в работах Во, G. et al. 2009 (Analyses of differential proteome of human synovial fibroblasts obtained from arthritis (Анализы отличительных протеом человеческих синовиальных фибробластов, полученных при артрите). Clin. Rheumatol 28, 191-199); Oslejskova, L et al. 2009 (Metastasis-inducing Protein S100A4 is associated with the disease activity of rheumatoid arthritis. Вызывающий метастазы белок S100A4 ассоциирован с активностью заболевания при ревматоидном артрите). Rheumatology (Oxford) 48, 1590-1594); Masuda, K. et al. 2002 (Molecular profile of synovial fibroblasts in rheumatoid arthritis depends on the stage of proliferation. (Молекулярный профиль синовиальных фибробластов при ревматоидном артрите зависит от стадии пролиферации) Arthritis Res 4, R8).
Доказательство роли S100A4 в развитии или опосредовании легочной гипертензии представлено, в числе прочих, в работах Peng, Т. et al. 2009 (Plasma levels of S100A4 in portopulmonary hypertension (Уровни в плазме S100A4 при портопульмонарной гипертензии). Biomarkers 14, 156-160); Hodge, S. et al. 2009 (Posttransplant bronchiolitis obliterans syndrome is associated with bronchial epithelial to mesenchymal transition (Посттрансляционный бронхиолитический облитерирующий синдром ассоциирован с бронхиальным переходом в мезенхимный). Am. J. Transplant 9, 727-733); Spiekerkoetter, E. et al. 2008 (Reactivation of gammaHV68 induces neointimal lesions in pulmonary arteries of S100A4/Mts1-overexpressing mice in association with degradation of elastin. (Реактивация γHV68 вызывает поражения неоинтимы в легочных артериях у мышей со сверхэспрессией S100A4/Mts1 в ассоциации с деградацией эластина) Am. J. Physiol. Lung Cell Mol. Physiol 294, L276-289); Brisset, A.C. et al. 2007 (Intimal smooth muscle cells of porcine and human coronary artery express S100A4, a marker of the rhomboid phenotype in vitro (Клетки гладкой мускулатуры интимы коронарной артерии свиньи и человека экспрессируют S100A4, маркер ромбоидного фенотипа in vitro). Circ. Res 100, 1055-1062); Lawrie, A. et al. 2005 (Interdependent serotonin transporter and receptor pathways regulate S100A4/Mts1, a gene associated with pulmonary vascular disease (Взаимозависимые пути серотонинового транспортера и рецептора регулируют S100A4/Mts1, ген, ассоциированный с легочным сосудистым заболеванием). Circ. Res 97, 227-235); Merklinger, S.L et al. 2005 (Increased fibulin-5 and elastin in S100A4/Mts1 mice with pulmonary hypertension (Повышенный уровень фибулина-5 и эластина в мышей S100A4/Mts1 с легочной гипертензией). Circ. Res 97, 596-604); Greenway, S. et al. 2004 (S100A4/Mts1 produces murine pulmonary artery changes resembling plexogenic arteriopathy and is increased in human plexogenic arteriopathy (S100A4/Mts1 вызывает изменения мышиной легочной артерии, напоминающие плексогенную артериопатию и повышен при плексогенной артериопатии у человека). Am. J. Pathol 164, 253-262).
Доказательство роли S100A4 в развитии или опосредовании псориаза представлено, в числе прочих, в работах Zibert, JR, Skov, L Thyssen JP, Jacobsen GK, Grigorian M. 2010 (Significance of the protein S100A4 in psoriasis (Важная роль белка S100A4 при псориазе). J Invest Dermatology. 130(1):150-60); Eckert RL, Broome AM, Ruse M, Robinson N, Ryan D, Lee K. 2004 (J Invest Dermatol. 123(1):23-33).
Термин "лечение" включает введение соединений или препаратов, соответствующих настоящему изобретению, с целью предупреждения или задержки начала симптомов, осложнений или биохимических показателей заболевания, облегчения симптомов или блокирования либо подавления дальнейшего развития заболевания, состояния или нарушения. Лечение может быть профилактической (для предупреждения или задержки начала заболевания или для предупреждения проявления его клинических или субклинических симптомов) или терапевтической супрессией или облегчением симптомов после проявления заболевания.
Наборы по настоящему изобретению
Настоящее изобретение далее относится к продукту, содержащему антитело или его фрагмент либо моноклональное антитело, соответствующее любому из вариантов осуществления, представленных в данном контексте, и противораковый препарат, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении опухолей.
При введении антител к S100A4 вместе с другим препаратом данные два компонента можно вводить одновременно, раздельно или последовательно. Так, антитела и их фрагменты, соответствующие изобретению, можно также ввести в комбинированном препарате, т.е. комбинированном с другими компонентами. Например, при лечении рака комбинированный препарат может включать композицию антител, соответствующую настоящему изобретению, с по меньшей мере одним противоопухолевым препаратом или другим лечением, таим как радиотерапия.
Данный противоопухолевый препарат или другое принятое лечение включают, без ограничения перечисленным, модуляторы апоптоза, химиотерапевтические противоопухолевые препараты, иммунотерапевтические препараты, антимикробные препараты, антивирусные препараты, противогрибковые препараты, противовоспалительные препараты, а также хирургическое вмешательство и радиотерапию.
Предусматривают ряд подходящих противораковых препаратов для комбинированного или совместного введения с целью лечения, предупреждения или облегчения любого из вышеупомянутых заболеваний, расстройств или нарушений, таких как препараты, которые вызывают апоптоз; полинуклеотиды (например, антисмысловые, рибозимы, миРНК); полипептиды (например, ферменты и антитела); биологические миметики (например, госсипол или миметики ВН3); агенты, которые связываются (например, олигомеризуют или комплексируют) с S100A4; алкалоиды; алкилирующие препараты; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные или поликлональные антитела (например, антитела, конъюгированные с противораковыми препаратами, токсинами, дефенсинами), токсины; радионуклиды; модификаторы биологического ответа (например, интерфероны (например, α-ИФН) и интерлейкины (например, ИЛ-2)); адоптивные иммунотерапевтические препараты; гемопоэтические факторы роста; препараты, которые индуцируют дифференцировку опухолевых клеток (например, полностью транс-ретиноевая кислота); генотерапевтические реагенты (например, антисмысловые терапевтические реагенты и нуклеотиды); противоопухолевые вакцины; ингибиторы ангиогенеза; ингибиторы протеасом: ингибиторы NF-KB; соединения ингибирующие циклин-зависимые киназы (ЦЗК); ингибиторы гистоновой деацетилазы (ГДАЦ) и т.п.
Модуляторы апоптоза включают, без ограничения перечисленным, облучение (например, рентгеновские лучи, γ-лучи, УФ); факторы, родственные фактору некроза опухоли (ФНО) (например, белки рецептора семейства ФНО, лиганды семейства ФНО, TRAIL, антитела KTRAILR1 или TRAILR2); ингибиторы киназы (например, ингибитор киназы рецептора эпидермального фактора роста (EGFR), ингибитор киназы рецептора сосудистого фактора роста (VGFR), ингибитор киназы рецептора фактора роста фибробластов (FGFR), ингибиторы киназы рецептора тромбоцитарного фактора роста (PDGFR) и ингибиторы киназы Bcr-Abl (такие как мезилат иматиниба); антисмысловые молекулы; антитела (например, трастузумаб, ритуксимаб, ибритумомаб тиуксетан и бевацицумаб); антиэстрогены (например, ралоксифен и тамоксифен); антиандрогены (например, флутамид, бикалутамид, финастерид, аминоглутетамид, кетоконазол и кортикостероиды); ингибиторы циклооксигеназы 2 (ЦОГ-2) (например, целекоксиб, мелоксикам, NS-398 и нестероидные противовоспалительные лекарственные препараты (НПВЛС)); апротивовоспалительные лекарственные препараты (например, бутазолидин, дексаметазон, гидроксихлороквин, оксифенбутазон, фенилбутазон, преднизолон, преднизон) и противораковые химиотерапевтические препараты (например, иринотекан, флударабин, дакарбазин, митоксантрон, гемтуцумаб озогамицин, этопозид фосфат, цисплатин, карбоплатин, оксалиплатин, фторурацил, доксорубицин, гемцитабин, бортецомиб, гефитиниб, бевацицумаб или паклитаксел); молекулы передачи клеточного сигнала, керамиды и цитокины, стауроспорин и т.п.
Антинеоплатические или антигиперпролиферативные препараты включают алкилирующие препараты, антиметаболиты и природные продукты (например, травы и другие соединения, выделенные из растений и животных).
Алкилирующие препараты включают, без ограничения перечисленным: 1) азотистые иприты (например, меклоретамин, циклофосфамид, ифосфамид, мелфалин (L-сарколизин) и хлорамбуцил); 2) этиленимины и метилмеламины (например, гексаметилмеламин и тиотепа); 3) алкилсульфонаты (например, бусульфан); 4) нитрозомочевины (например, кармустин, ломустин, семустин и стрептозоцин) и 5) триазены (например, дакарбазин; диметилтриазеноимид-азолкарбоксамид).
Антиметаболиты включают, без ограничения перечисленным: 1) аналоги фолиевой кислоты (например, метотрексат (аметоптерин)); 2) аналоги пиримидина (например, фторурацил, флоксуридин и цитарабин (цитозинарабинозид)) и 3) аналоги пурина (например, меркаптопурин, тиогуанин и пентостатин).
Химиотерапевтические препараты включают, без ограничения перечисленным: 1) алкалоиды барвинка (например, винбластин (ВБл), винкристин); 2) эпиподофиллотоксины (например, этопозид и тенипозид); 3) антибиотики (например, дактиномицин (актиномицин D), даунорубицин (дауномицин, рубидомицин), доксорубицин, блеомицин, пликамицин (митрамицин) и митомицин (митомицин С)); 4) ферменты (например, L-аспарагиназа); 5) модификаторы биологического ответа (например, α-интерферон); 6) координационные комплексы платины (например, цисплатин (цис-ДДП) и карбоплатин); 7) антрацендионы (например, митоксантрон); 8) замещенные мочевины (например, гидроксимочевина); 9) метилгидразиновые производные (например, прокарбазин, N-метилгидразин (MIH); 10) адренокортикальные супрессанты (например, митотан (о,п’-ДДД) и аминоглутетимид); 11) адренокортикостероиды (например, преднизон); 12) прогестины (например, гидроксипрогестерон капроат, медроксипрогестерон ацетат и мегестрол ацетат); 13) эстрогены (например, диэтилстилбестрол и этинилэстрадиол); 14) антиэстрогены (например, тамоксифен); 15) андрогены (например, тестостерон пропионат и флуоксиместерон); 16) антиандрогены (например, флутамид) и 17) аналоги гонадолиберина (например, лейпролид).
Другие принятые противораковые препараты включают, без ограничения перечисленным, адриамицин, 5-фторурацил, этопозид, камптотецин, актиномицин D, митомицин С, цисплатин, доцетаксел, гемцитабин, карбоплатин, оксиплатин, бортехомиб, гефитиниб, бевацицумаб, деметилирующие препараты, ингибиторы HER-2, ингибиторы IGF-IR, сосудистый эндотелиальный фактор роста (VEGF), ингибиторы VEGFR, ингибиторы mTOR, митотические ингибиторы, ингибиторы SMAD и таксаны. Данные препараты можно получить и использовать в виде монопрепаратов, в комбинированных терапевтических композициях, в наборах или в комбинации с иммунотерапевтическими препаратами и т.п.
Облучение любого типа можно применить к пациенту до тех пор, пока пациент переносит дозу облучения без неприемлемых отрицательных побочных эффектов. Подходящие типы радиотерапии включают, например, ионизирующую (электромагнитную) радиотерапию (например, рентгеновские лучи или γ-лучи) или радиационную терапию с использованием пучка частиц (например, обучение высокой линейной энергией).
Настоящее изобретение также направлено на:
[1] Выделенную последовательность аминокислот, содержащую последовательность, выбранную из SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3.
[2] Антитело или его фрагмент, которые специфически связываются с полипептидом, содержащим SEQ ID NO:3.
[3] Антитело или его фрагмент, которые специфически связывают полипептид человеческого или мышиного S100A4, продуцируемый при иммунизации млекопитающего полипептидом, содержащим SEQ ID NO:3.
[4] Антитело или его фрагмент по [2] или [3], где антитело или его фрагмент выбраны из человеческого антитела или его фрагмента, гуманизированного антитела или его фрагмента, поликлонального антитела или его фрагмента, моноклонального антитела или его фрагмента, антитела Fab и химерного антитела или его фрагмента.
[5] Моноклональное антитело, которое содержит полипептид легкой цепи, включающий SEQ ID NO:1, или полипептид тяжелой цепи, включающий SEQ ID NO:2.
[6] Моноклональное антитело, содержащее каркасные участки (FRs) и участки, определяющие комплементарность (CDR), где моноклональное антитело содержит легкую цепь, включающую SEQ ID NO:1, и тяжелую цепь, включающую SEQ ID NO:2.
[7] Моноклональное антитело по [5] или [6], которое выбрано из человеческого антитела, гуманизированного антитела и химерного антитела или их фрагментов.
[8] Моноклональное антитело по [5], [6] или [7], которое:
a) реагирует только с человеческим или мышиным белком S100A4, или
b) блокирует механизм действия человеческого или мышиного белка S100A4, или
c) блокирует in vitro или in vivo функциональную активность человеческого или мышиного белка S100A4, или
d) блокирует промиграционный эффект, индуцируемый человеческим или мышиным белком S100A4 или человеческим или мышиным белком S100A4, комбинированным с фактором роста сосудистого эндотелия (VEGF) в эндотелиальных клетках, или
e) блокирует рост опухоли, или
f) блокирует развитие опухоли, или
g) блокирует ангиогенез опухоли, или
h) блокирует клеточную диссеминацию и образование метастазов, или
i) блокирует раковые стволовые клетки, или
j) любую комбинацию вышеуказанных а) - i).
[9] Моноклональное антитело или его фрагмент, включающий SEQ ID N0: 1 и SEQ ID NO:2, где указанное антитело или фрагмент является моновалентным или бивалентным.
[10] Гидридомная клеточная линия, способная продуцировать моноклональное антитело по [5], [6], [7], [8] или [9].
[11] Моноклональное антитело, полученная с помощью гидридомной клеточной линии, депонированной под регистрационным номером 10022401 в Европейской коллекции клеточных культур (ЕСАСС).
[12] Выделенный полинуклеотид, причем указанный выделенный полинуклеотид содержит SEQ ID NO:4, кодирующую FR и CDR вариабельной области легкой цепи моноклонального антитела, или указанный выделенный полинуклеотид содержит SEQ ID NO:5, кодирующую FR и CDR тяжелой цепи вариабельной области моноклонального антитела.
[13] Выделенный полинуклеотид, содержащий SEQ ID NO:6, кодирующую участок эпитопа человеческого белка S100A4.
[14] Способ получения моноклонального антитела по [5], [6], [7], [8], [9] или [11], причем указанный способ предусматривает:
(i) иммунизацию мыши очищенным человеческим или мышиным белком S100A4 или очищенным человеческим или мышиным белком S100A4, комбинированным с препаратом, эффективным в плане индукции иммунного ответа в отношении антигена;
(ii) получение одной или более гибридомных клеток;
(iii) отбор одной или более клеток, супернатанты которых:
a) реагируют только с человеческим или мышиным белком S100A4, или
b) блокируют механизм действия человеческого или мышиного белка S100A4, или
c) блокирует in vitro или in vivo функциональную активность человеческого или мышиного белка S100A4, или
d) блокирует промиграционный эффект, индуцируемый человеческим или мышиным белком S100A4 или человеческим или мышиным белком S100A4, комбинированным с фактором роста сосудистого эндотелия (VEGF), в эндотелиальных клетках, или
e) блокирует рост опухоли, или
f) блокирует развитие опухоли, или
g) блокирует ангиогенез опухоли, или
h) блокирует клеточную диссеминацию и образование метастазов, или
i) блокирует раковые стволовые клетки, или
j) любую комбинацию вышеуказанных а) - i).
(iv) получение специфической клеточной линии из любой одной из клеток, отобранных на стадии iii), и
(v) выделение моноклонального антитела из указанной клеточной линии.
[15] Фармацевтическая композиция, содержащая моноклональное антитело по [5], [6], [7], [8], [9] или [11] и фармацевтически приемлемый носитель.
[16] Фармацевтическая композиция по [15], дополнительно содержащая химиотерапевтический препарат.
[17] Антитело или его фрагмент по [2], [3] или [4], либо моноклональное антитело по [5], [6], [7], [8], [9] или [11], предназначенное для применения в качестве лекарственного средства.
[18] Антитело или его фрагмент по [2], [3] или [4], либо моноклональное антитело по [5], [6], [7], [8], [9] или [11], предназначенное для применения в качестве лекарственного средства для лечения опухолей.
[19] Применение антитела или его фрагмента по [2], [3] или [4] либо моноклонального антитела по [5], [6], [7], [8], [9] или [11] для изготовления лекарственного средства для лечения опухолей.
[20] Способ лечение опухолей, предусматривающий введение пациенту, нуждающемуся в указанном лечении, фармацевтически эффективного количества моноклонального антитела по [5], [6], [7], [8], [9] или [11].
[21] Антитело или его фрагмент либо моноклональное антитело по [18], применение по [19] или способ лечения опухолей по [20], где опухоль выбрана из группы, включающей карциному молочной железы, карциному простаты, карциному легкого, колоректальную карциному, карциному поджелудочной железы, карциному почки, карциному желудка, карциному яичника, папиллярную карциному щитовидной железы, меланому, гепатоцеллюлярную карциному, карциному мочевого пузыря, инвазивную карциному липосаркомы, нейробластому, карциному сквамозных клеток пищевода, остеосаркому, карциному желчного пузыря, сквамозную карциномы полости рта, эндометриальную карциному, медуллобластому и любые другие опухоли, опосредованные S100A4.
[22] Применение антитела или его фрагмента по [2], [3] или [4], либо моноклонального антитела по [5], [6], [7], [8], [9] или [11] в качестве маркера для идентификации, определения местоположения, оценки, диагностики, прогноза или мониторирования опухоли или любых других заболеваний, опосредованных S100A4, у пациента.
[23] Продукт, содержащий антитело или его фрагмент по [2], [3] или [4], либо моноклональное антитело по [5], [6], [7], [8], [9] или [11] и противораковый препарат, в виде комбинированного препарат для одновременного, раздельного или последовательного применения при лечении опухолей.
[24] Антитело или его фрагмент, которые специфически связывают полипептид человеческого или мышиного S100A4, предназначенные для применения в качестве лекарственного средства для лечения опухолей.
Далее изобретение описывают посредством следующих примеров, которые следует истолковывать, как только иллюстративные, а не ограничивающие изобретение.
Примеры
Получение рекомбинантного человеческого белка S100A4 и моноклонального антитела
Пример 1. Происхождение и получение опухолевых клеточных линий и культур.
Человеческие эндотелиальные клетки пуповинной вены (HUVEC, фирмы Lonza) культивируют на 1% желатине типа В из кожи крупного рогатого скота (фирмы Sigma) в основной среде для эндотелиальных клеток (ЕВМ, фирмы Lonza) с добавлением человеческого эпидермального фактора роста, гидрокортизона, экстракта бычьего головного мозга и гемцитабина (EGM, фирмы Lonza), а также 10% сыворотки телячьих эмбрионов (FCS, фирмы Invitrogen). HUVEC используют между пассажами 6-9, и все эксперименты проводят при 80-85% конфлюэнтности с одной и той же партией клеток.
Клеточные линии аденокарциномы толстой кишки НСТ-116 (АТСС, No.:CCL-247) и аденокарциномы поджелудочной железы MiaPACA-2 (ECACC, No.:85062806) культивируют в среде Игла в модификации Дульбекко с высоким содержанием глюкозы (фирмы РАА) с добавлением 10% сыворотки телячьих эмбрионов (FCS, фирмы Invitrogen) и 2 мМ L-глютамина.
Клетки миеломы культивируют в среде RPMI 1640 (фирмы РАА) с добавлением 10% сыворотки телячьих эмбрионов (FCS, фирмы РАА; Австралийского происхождения) и 2 мМ GlutaMAX™-I (фирмы Invitrogen).
Все клетки культивируют при 37°С в увлажненной атмосфере с 5% CO2, и они, соответственно, свободны от микоплазмы, как оценивают с помощью теста-набора на микроплазму EZ-ПЦР (Biological Industries).
Пример 2. Происхождение и получение животных.
Мышей для продукции антител (самки BALB/cAnNHsd); в возрасте 6 недель) и для моделей опухолей ("голые мыши": бестимусные самки (Hsd:Athymic Nude (Бестимусные Голые)-Foxn1nu; в возрасте 6-7 недель) получают от фирмы Harlan Laboratories Models, S.L (Barcelona, Spain). Голых мышей содержат в стерильном помещении в клетках-микроизоляторах и дают стерилизованную пищу и воду по потребности. Все манипуляции проводят в ламинарном боксе.
Пример 3. Получение рекомбинантного человеческого белка S100A4.
Фрагмент, кодирующий человеческий S100A4 полной длины, получают с помощью ОТ-ПЦР (полимеразная цепная реакция с использованием обратной транскриптазы) из мРНК клеточной линии НСТ-116, выделенной из аденокарциномы толстой кишки человека. Специфическими праймерами, используемыми в ПЦР, являются:
SEQ ID NO:22 5’-ACTCACATATGGCGTGCCCTCTGGAGAAGGCCCTGGATGTG-3’ и
SEQ ID NO:23 5’-ACTCATGAGCTCATCATTTCTTCCTGGGCTGCTTATCTGGGAA-3’
kДHKS100A4 клонируют в сайт NdeI бактериального экспрессирующего вектора рЕТ28а(+) (фирмы Novagen) и отбирают положительные клоны и подтверждают секвенированием ДНК. Данной конструкцией трансформируют компетентные клетки Е.coli Tuner™ (DE3) (фирмы Novagen), и индуцируют белок 1 мМ изопропил-D-тиогалакто-пиранозидом (ИПТГ; фирмы Sigma) в течение 6 часов. Затем бактерии собирают и лизируют обработкой ультразвуком в буфере А (100 мкг/мл лизоцима, 0,5 М NaCl, 10 мМ Na2HPO4*2H2O, 10 мМ NaH2PO4*2H2O и 10 мМ имидазола рН 7,5). Лизат осветляют центрифугированием и фильтруют через хелатирующую аффинную колонку HiTrapTM (Amersham). Белок элюируют буфером В (0,5 М NaCl, 10 мМ Na2HPO4*2H2O, 10 мМ NaH2PO4*2H2O и 300 мМ имидазол, рН 7,5). В ряде экспериментов гистидиновую метку отщепляют с использованием протеазы Тромбин (Novagen, распознаваемой последовательностью является Leu-Val-Pro-Arg-Gly-Ser, центр расщепления между Arg и Gly). Вследствие этого конечный рекомбинантный белок S100A4 полной длины имеет дополнительный Gly-Ser-His на N-конце. После расщепления оставшуюся цепь поли-his удаляют на хелатирующей аффинной колонке HiTrapTM (фирмы Amersham), используя метку последовательности полигистидина, и чистота супенатанта, содержащего рекомбинантный белок S100A4 проверяют с помощью лаурилсульфатнатрия-12% (масс./об.) электрофореза на полиакриламидном геле.
Пример 4. Получение моноклональных антител к S100A4.
Слияние моноклонального антитела (MAT), скрининг с помощью ELISA и субклонирование проводят с использованием стандартных способов. Поддержание, распространение и масштабирование культур проводят в увлажненной атмосфере (94% воздуха и 6% CO2) при 37°С.
Для каждого моноклонального антитела пять животных иммунизируют человеческим рекомбинантным S100A4 согласно следующему протоколу. Пятьдесят мкг белка S100A4, разведенных в PBS (натрий-фосфатном буфере) (137 мМ NaCl, 2,8 мМ KCl, 8,1 мМ Na2HPO4, 1,5 мМ KH2PO4; pH 7,2) используют в виде эмульсии с полным адъювантом Фрейнда (фирмы Sigma) для начальной подкожной (s.c.) иммунизации и с неполным адъювантом Фрейнда (фирмы Sigma) для последующих инъекций в дни 19 и 35 (s.c.). Через десять дней после третьей инъекции получают и тестируют сыворотку. В день 51 конечный бустер 25 мкг белка S100A4, разведенного в натрий-фосфатном буфере, вводят внутривенно мыши с самым высоким титром сыворотки.
Слияние проводят через четыре дня после последней инъекции. Полученные MAT выделяют из одного слияния клеток миеломы с клетками селезенки, выделенными у выбранной мыши, в соотношении 1/10, соответственно, при использовании ПЭГ-1500 (фирмы Roche Diagnostics) в качестве индуктора слияния. После этого клетки помещают в 96-луночные планшеты в среду, содержащую гистон-ацетил трансферазу (ГАТ) (фирмы Invitrogen), для отбора гибридов.
Проводят скрининг супернатантов гибридомы на реактивность с помощью рекомбинантного человеческого S100A4 посредством ELISA. 50 мкл белка S100A4 (3 мкг/мл в натрий-фосфатного буфера) покрывают планшеты с 96 микролунками MaxiSorp (фирмы NUNC) в течение ночи при 4°С. После промывания натрий-фосфатным буфером и блокирования (1% обезжиренного молока в натрий-фосфатном буфере; 1 час.; 37°С), 50 мкл супернатантов гибридомы добавляют к каждой лунке и инкубируют в течение двух часов при 37°С. После пятикратного промывания при комнатной температуре натрий-фосфатным буфером, свободным от кальция-магния (274 мМ NaCl, 2,8 мМ KCl, 8,1 мМ Na2HPO4, 1,5 мМ KH2PO4, 0,1% Твин-20; рН 7,2) связанные иммуноглобулины определяют с помощью конъюгированного с HRP (пероксидазой хрена) козьего IgG/IgM к мыши (фирмы Jackson ImmunoResearch) с использованием тетраметилбензидина 3,3 5,5 (ТМП, фирмы Sigma) в качестве субстрата.
Лунки с оптической плотностью, превышающей больше чем в три раза фон планшета выбирают для клонирования. Клоны, соответствующие моноклональному антителу 5C3 (внутренний код 5C3-1B8-1F4; ЕСАСС 10022401), 1Е2 (внутренний код 1E2-2H4-2G8; ЕСАСС 11051803), 6В9 (внутренний код 6В9-1Е8-2А8; ЕСАСС 11051801), 8 В6 (внутренний код 8B6-2F6-1H9-1H10; ЕСАСС 11051804) и 5А3 (внутренний код 5А3-4А6-5 В6; ЕСАСС 11051802), отбирают для анализа in vitro и in vivo и субклонируют путем ограничивающего разведения. Только те субклоны, которые растут при концентрации 0,1 и0,01 клетка/лунку, считают подходящими для размножения и адаптируют к среде Игла в модификации Дульбекко/Р12 (DMEM/F12) (фирмы РАА) и замораживают.
Для крупномасштабной очистки клетки гибридомы культивируют в DMEM/F12, содержащей 10% сыворотки телячьих эмбрионов (фирмы РАА, австралийского происхождения) и 2 мМ L-глутамина (GlutaMAX™-I, фирмы Invitrogen) в колбе для культивирования 175 см2. Когда концентрация клеток достигает 0,8×106 клеток/мл (выживаемость больше 85%), культуральную среду удаляют и клетки дважды промывают средой DMEM/F12 без сыворотки. После этого 50 мл среды, содержащей 80% DMEM/F12, 20% CDHybridoma (фирмы Invitrogen) и 2 мМ L-глутамина, добавляют в каждую колбу и инкубируют в течение 96 часов. В конце бессывороточную среду собирают, центрифугируют и замораживают до очистки.
Получают шесть литров бессывороточного супернатанта из гибридомы. После фильтрования проводят очистку с использованием аффинной колонки HiTrap Protein G HP объемом 5 мл (фирмы Amersham). Элюированное антитело концентрируют и проводят диафильтрацию в натрий-фосфатном буфере с помощью устройств для фильтрования при центрифугировании Amicon® Ultra-15 с мембранами Ultracel® с низким связыванием (30000 NMWL, фирмы Millipore). Конечные кондиционированные антитела количественно определяют при длине волны 280 нм.
Пример 5. Характеризация перекрестной реактивности моноклональных антител 5C3, 1Е2, 6В9, 8В6, 5А3: моноклональные антитела реагируют только с S100A4.
Проводят скрининг моноклональных антител 5C3, 1Е2, 6В9, 8В6 и 5А3 на перекрестную реакцию в отношении других членов семейства S100: рекомбинантного человеческого S100A1, S100A2, S100A6 (фирмы Abnova), рекомбинантного человеческого S100A7, S100P (клонированы из клеточной линии аденокарциномы молочной железы MDA-MD-468 и клеточной линии аденокарциномы шейки матки HeLa, соответственно, в фирме Leitat Biomed Division) и рекомбинантного мышиного S100A4 (клонирован из клеточной линии аденокарциномы фибробластов мышиных эмбрионов NIH/3T3 производства Leitat Biomed Division). Изотип иммуноглобулина для моноклональных антител к S100A4 определяют с использованием Набора для субтипирования мышиного иммуноглобулина (фирм Sigma).
Скрининг антител с помощью ELISA на очищенном человеческом S100A4, человеческом S100A1, человеческом S100A2, человеческом S100A6, человеческом S100A7, человеческом S100P и мышином S100A4 показывает, что моноклональное антитело 5C3, 1Е2, 8В6 и 5А3 реагирует с человеческим и мышиным S100A4 и с одинаковой интенсивностью, тогда как 6В9 распознают только человеческий S100A4 (см. Таблицу 1).
Пример 6. Иммунохарактеризация 5C3 с помощью вестерн-блоттинга.
Образцы клеток и опухолей дважды промывают натрий-фосфатном буфере и сразу лизируют ледяным буфером для лизиса клеток (150 мМ NaCl, 1% IGEPAL CA630, 5 мМ ЭДТА, 100 мкг/ил PMSF, 1 мМ Na3VO4, 1 мМ NaF и 50 мМ Трис рН 7,4). Лизаты осветляют центрифугированием и количественно определяют концентрацию белка с помощью реагента Бредфорда (фирмы Bio-Rad). Общие экстракты (50 мкг) разделяют в 12% лаурилсульфат натриевом (SDS) электрофорезе в полиакриламидном геле (PAGE) в восстановленных условиях и переносят на мембраны BioTrace™ PVDF (PALL corporation). Мембраны блокируют в течений 1 часа в TBS с 0,1% Твин-20 с 5% обезжиренным сухим молоком, инкубируют в течение ночи с соответствующим первичным антителом и затем с вторичными антителами в течение 1 часа в блокирующем буфере, промывают три раза в течение 10 мин. в TBS с добавлением 0,1% Твин-20 после каждого инкубирования. Сигналы проявляют с использованием реагентов для детекции вестерн-блоттингом ECL™ (фирмы Amersham) и обрабатывают Hyperfilm™ ECL (фирмы Amersham).
Концентрации антитела являются следующими: моноклональное мышиное антитело к человеческому S100A4 5C3 (фирмы Leitat Biomed Division) в концентрации 1 мкг/мл; поликлональное кроличье антитело к тубулину (фирмы ICN Biomedicals) в разведении 1:5000; козье антитело к мыши (фирмы Jackson ImmunoResearch) в концентрации 0,04 мкг/мл и козье антитело к кролику (фирмы Sigma) в разведении 1:25000 в качестве вторичных антител.
На Фигурах 1 и 2 показывают тип экспрессии белка S100A4 в ряде опухолевых клеточных линий, в клеточной линии фибробластов мышиных эмбрионов NIH3T3 и образцах опухолей, полученных на моделях ксенотрансплантатов клеточных линий НСТ116, MiaPACA-2 и ВхРС3. Клеточные линии аденокарциномы поджелудочной железы человека MiaPACA-2 и Panc1 показывают более высокие уровни экспрессии, чем ВхРС3, другой клеточной линии аденокарциномы поджелудочной железы человека Как можно видеть на Фигуре 2, опухоли, полученные из ВхРС3, показывают более высокие уровни экспрессии S100A4, чем сама ВхРС3 в культуре. Данное повышение уровней S100A4 может указывать на непосредственное участие белка в генерации злокачественных инвазивных опухолей (которую также наблюдают в иммуногистохимических срезах). Данные повышенные уровни можно получить либо с использованием самих опухолей, либо с использованием клеток опухолевой стромы. Клеточные линии аденокарциномы молочной железы MDA-MB-231 и 468 демонстрируют несущественные уровни белка S100A4, но можно видеть на Фигуре 3, что раковые стволовые клетки, полученные из культуры MDA-MB-231 показывают повышенные уровни экспрессии S100A4. Клеточные линии аденокарциномы толстой кишки Colo 205 и опухоли, выделенные из НСТ116, другой клеточной линии аденокарциномы толстой кишки, показывают высокие уровни экспрессии белка. На Фигуре 1 показывают, что 5C3 реагирует не только с человеческим S100A4, но также с мышиным S100A4 (мышиный фибробласт NIH-3T3).
Такие же результаты, полученные с 5C3, можно распространить также на другие MAT за исключением 8В6, которое не реагирует с денатурализованным белком S100A4 (данные не показаны).
Пример 7. Иммунохарактеризация 5C3 с помощью иммуногистохимических способов.
Срезы толщиной четыре микрометра из блоков опухоли депарафинируют, регидратируют в градиенте спиртов и обрабатывают. Вкратце, восстановление антигена проводят в микроволновой печи в течение 15 минут в 10 мМ цитрате натрия, рН 6,0 с 0,05% Твин-20. Активность эндогенной пероксидазы блокируют 3% H2O2 в дистиллированной воде, и срезы инкубируют в 5% нормальной козьей сыворотке в течение 30 мин., чтобы предотвратить неспецифическое окрашивание. Затем их инкубируют в течение ночи при 4°C с разведенными соответствующим образом первичными антителами. Используют следующие антитела were used: мышиное моноклональное антитело 5C3 (1 мкг/мл), кроличье поликлональное антитело к S100A4 фирмы Dako (разведение 1:200) и мышиное моноклональное антиполигистидиновое антитело из систем R&D (5 мкг/мл). Затем срезы инкубируют с соответствующим образом биотинилированным козьим IgG к мыши (H+L) (фирмы Vector Laboratories) в концентрации 2 мкг/мл, и биотинилированным козьим IgG к кролику (H+L) (фирмы Vector Laboratories) в концентрации 2 мкг/мл в течение 60 мин и комплексом ABC (фирмы Dako) в течение 30 мин. при комнатной температуре. В качестве хромогена используют NovaRed (фирмы Dako). В качестве отрицательного контроля первичное антитело заменяют неродственным моноклональным антителом (антиполигистидиновым).
Иммуногистохимический анализ (см. Фигуры 4-11) с использованием моноклонального антитела 5C3 показывает более высокий уровень экспрессии S100A4 в инвазивном фронте, чем в центре опухоли, выделенной из моделей ксенотрансплантата аденоарциномы поджелудочной железы либо Panc 1, либо ВхРС3. Кроме того, анализы с высоким разрешением (Х120) показывают присутствие белка не только в цитоплазме, но также в ядрах опухолевых клеток. Когда для иммуногистохимического анализа используют наиболее распространенное антитело к S100A4 (кроличье поликлональное антитело фирмы Dako), наблюдают такой же тип распределения.
Вместе взятые данные результаты подтверждают, что тестированные моноклональные антитела можно использовать в качестве инструмента в диагностических анализах.
Пример 8. 5C3 модулирует активность металлопротеиназы матрикса ММР9, индуцированную S100A4.
Способ количественной зимографии белкового субстрата утвержден как показатель разрушения экстрацеллюларного матрикса, мобилизации факторов роста, процессинга поверхностных молекул, и он коррелирует с процессом миграции и инвазии клеток стромы и опухоли. У онкологических пациентов данный стандартный лабораторный способ, по-видимому, отражает меру клинических стадий заболевания. Анализы активности ММР в сыворотке пациентов может иметь диагностическое значение для разделения подгрупп рака и определения высокого метастатического потенциала.
HUVEC выращивают в основной среде для эндотелиальных клеток (ЕВМ) с добавками гемцитабина (EGM) и 10% сыворотки телячьих эмбрионов (FCS) в 24-луночных планшетах для культивирования. Перед стимуляцией клетки поддерживают в течение 4 часов в основной среде для эндотелиальных клеток (ЕВМ) в отсутствие сыворотки и других добавок. Затем к культуре добавляют S100A4 (0,3-1-3 мкМ) и ЕВМ с целью анализа их способности повышать уровень секреции активных форм металлопротеиназ матрикса (ММР). Для тестирования ингибирующего эффекта блокирования 5C3 стимуляции S100A4 1-2 мкМ антитела инкубируют в течение одного часа с S100A4 (1 мкМ) перед добавлением культуры. Через 24 часа при 37°С супернатанты центрифугируют для удаления дебриса. Затем 10 мкл буфера для образцов Леммли без восстановителя (80 мМ Трис-HCl, рН 6,8, 4% лаурилсульфат натрия (SDS), 10% глицерина, 0,01% бромфенолового синего) добавляют к 10 мкл каждого из осветленных супернатантов, которые нагружают без кипячения в 8% лаурилсульфат натриевый-полакриламидный гель, сополимеризованный с желатином типа А и свиной кожи (фирмы Sigma) в конечной концентрации 1 мг/мл. После электрофореза лаурилсульфат натрия удаляют промыванием геля три раза по 15 минут 2,5% Тритон Х-100 в Н2О. Активацию обнаруживают в течение 48 часов инкубирования геля при 37°С в присутствии 50 мМ Трис-HCl, рН 7,5, 10 мМ CaCl2 и 0,02% NaN3. Окрашивание осуществляют в течение 1 часа при комнатной температуре 0,1% нафтоламидо черным (фирмы Sigma) в уксусной кислоте, метаноле и воде в соотношении 1:3:6 по объему. Затем гели промывают раствором, удаляющим краситель до получения прозрачных полос, наблюдаемых на темном фоне. Полосы количественно оценивают с использованием пакета программ для визуализации NIH Imaged.
Делают попытку определить частично механизм действия S100A4 в индукции миграции эндотелиальных клеток, анализируя продукцию и активацию ММР в кондиционированных средах от HUVEC. Кондиционированные среды от клеток, обработанных S100A4 (0,3-1-3 мкМ), содержат существенно больше активных форм белка ММР9, чем от необработанных клеток. Данная активность дозозависима (см. Фигуру 12). Данные разницы определяют через 24 часа обработки. Активность ММР9 в средах полностью восстанавливается, когда добавляют антитело 5C3 к S100A4 вместе с белком S100A4 (см. Фигуру 13). S100A4 не индуцирует изменений в активности ММР2 в данной модели на клетках.
Можно предположить, что повышенная протеолитическая активность, определяемая в кондиционированных средах от HUVEC, обработанных S100A4, коррелирует со стимуляцией миграции, когда VEGF и S100A4 добавляют к культуре. Эффект должен по меньшей мере частично зависеть от активности ММР9.
Пример 9. S100A4 и VEGF проявляют синергический эффект на миграцию HUVEC и моноклональные антитела 5C3, 1Е2, 6В9, 8В6 и 5А3 блокируют данную активность.
Эндотелиальные клетки (ЭК) выстилают все сосуды организм любого млекопитающего. ЭК представляют собой клетки, ответственные за инициацию формирования новых сосудов под действием специфического стимула, который может быть обусловлен патологической или физиологический ситуацией. Миграцию ЭК в настоящее время считают ключевой стадией в данном формировании неососудистой сети. Соответственно, исследования миграции ЭК полностью отражают профиль терапевтической активности антиангиогенных лекарственных препаратов.
Планшеты для культур клеток с двадцатью четырьмя лунками с вложенными фильтрами из светонепроницаемой PET мембраной с порами 8 мкМ (Transwell HTS FluoroBlokTM Multiwell Insert Systems from Becton Dickinson) используют для тестирования миграционной активности. Верхнюю и нижнюю поверхности мембран Transwell покрывают в течение 2 часов при 37°С 15 мкг/мл коллагена типа I (фирмы Upstate). Эндотелиальные клетки (5×104 HUVEC), суспендированные в 100 мкл основной среды для эндотелиальных клеток (ЕВМ) в отсутствие сыворотки или других добавок, высевают после покрытия коллагеном на верхнюю сторону каждой камеры Transwell и инкубируют в течение 4 часов при 37°С. Затем S100A4 (1 мкМ) в виде монокомпонента или в комбинации с VEGF (3 нг/мл) в ЕВМ добавляют в нижнее отделение 24-луночных планшетов для тестирования их хемотаксической способности. Для тестирования ингибирующего эффекта моноклональных антител к S100A4 (5C3, 1Е2, 6В9, 8В6, 5А3) (фирмы Leitat Biomed Division), различные концентрации (см. Фигуры 14 и 15) антител инкубируют в течение 2 часов с S100A4 и VEGF или VEGF в виде монокомпонента перед добавлением обоих в нижнюю камеру транслунки для инициации миграции. Для сравнения активности используют другое моноклональное антитело к S100A4, обозначаемое 5Н4 (фирмы Leitat Biomed Division). Через 24 часа при 37°С клетки, которые мигрируют на нижнюю сторону транслунки, инкубируют с 5 мкМ Кальцеина-АМ (фирмы Calbiochem) в течение 25-30 минут при 37°С. Мигрировавшие клетки подсчитывают в световом микроскопе при увеличении Х10. Сравнения между группами проводят с использованием двустороннего непараметрического U-критерия Манна-Уитни. Разницы, при которых значение Р составляет меньше 0,05, считают статистически достоверными.
Данный эксперимент впервые демонстрирует, что комбинация S100A4 и другого ангиогенного фактора (VEGF) синергически повышает способность к миграции HUVEC. S100A4, тестированный в дозе 1 мкМ, не проявляет существенной активности по сравнению с контролем - ЕВМ. Инкубирование HUVEC с 3 нг/мл VEGF в виде монокомпонента повышает уровень миграции в 2,4 раза, соответственно, по сравнению с ЕВМ. Когда VEGF (3 нг/мл) комбинируют с S100A4 (1 мкМ), наблюдают синергический эффект (см. Фигуры 14 и 15). В частности, когда рекомбинантный S100A4 (1 мкМ) добавляют вместе с VEGF (3 нг/мл), уровень миграции повышается до 235% по сравнению с эффектом VEGF в виде монокомпонента.
Для ингибирования промиграционной активности S100A4 используют также моноклональные антитела к S100A4 (5C3, 1Е2, 6В9, 8В6, 5А3). Как показано на Фигуре 14, 250 нМ 5C3 аннулирует синергический эффект комбинации VEGF (3 нг/мл) и S100A4 (1 мкМ) на миграцию HUVEC. Ингибирование миграции посредством 5C3 дозозависимо. Антитело не влияет на миграцию, индуцируемую VEGF в виде монокомпонента. Напротив, другое моноклональное антитело к S100A4, обозначаемое 5Н4 не проявляет нейтрализующего эффекта. Фигура 15 показывает ингибирующую активность других моноклональных антител к S100A4 по сравнению с 5C3, все из которых действуют в концентрации 2 мкМ. В совокупности с биохимическими данными данные результаты демонстрируют, что 5C3, 1Е2, 6В9, 8В6 и 5А3 специфически связывают S100A4 и демонстрируют in vitro нейтрализующую активность, индуцируемую S100A4 в отношении миграции HUVEC.
Пример 10. 5C3 блокирует развитие опухоли MiaPACA-2 и НСТ116 у голых мышей.
Ксенотрансплантаты опухолей обычно используют для оценки ответа, когда химиотерапевтические результаты имеют потенциальную клиническую важность в плане химиотерапии рака. Ксенотрансплантаты опухолей, таким образом, представляют собой хорошие модели для соотнесения данных по ксенотрансплантатам с клиническими результатами. Тестирование лекарственных препаратов на различных типах ксенотрансплантированных опухолей показывает, что ответ ксенотрансплантатов, полученный на животных с иммунодефицитом, сравним с реакцией в клинической практике. Кроме того, ксенотрансплантаты определенного типа опухоли дают возможность идентифицировать препараты с известной клинической активностью в отношении данного заболевания.
Клеточную линию аденокарциномы поджелудочной железы человека MiaPACA-2 и Клеточную линию колоректальной аденокарциномы человека НСТ116 в фазе экспоненциального роста собирают с помощью трипсина-ЭДТА(0,05%/0,02%) (фирмы Invitrogen), промывают и исследуют на выживаемость по исключению красителя трипанового синего. Выживаемость превышает 95%. Для роста первичной опухоли клетки (либо 5×106 либо 1×106 клеток MiaPACA-2 или НСТ116, соответственно, в 0,1 мл DMEM с высоким содержанием глюкозы) инъецируют подкожно в бока голых мышей. Объемы опухоли 65-160 мм3 для MiaPACA-2 и объемы 155-370 мм3 для НСТ116 используют для деления мышей на две группы либо по десять мышей (MiaPACA-2), либо по семь мышей (НСТ116), так что средний размер опухоли одинаков в группах (приблизительно 100 мм3 для MiaPACA-2 или 220 мм3 для НСТ116). После роста опухоли измеряют диаметры опухолей штангенциркулем и объем опухоли рассчитывают с использованием аппроксимированной формулы для сжатого эллипсоида:
Объем = (Dxd2)/2
где D означает самую длинную ось опухоли и d - самую короткую. Мышей лечат либо носителем (натрий-фосфатным буфером), либо антителом, внутрибрюшинно, три раза в неделю в дозе 25 мг/кг/100 мкл стерильного натрий-фосфатного буфера, начиная лечение при определенном объеме опухоли (100 мм3 и 220 мм3). В конце эксперимента животных умерщвляют, опухоли хирургически удаляют, взвешивают, и половину опухоли погружают в соединение ОСТ для последующих анализов иммуноокрашивания CD31, и другую половину опухоли фиксируют в формальдегиде для последующих анализов. Пробы крови, полученные у животных, несущих опухоли MiaPACA-2 или НСТ116, собирают в конце эксперимента (все животные), используя материал, покрытый ЭДТА. Сразу после этого образцы плазмы центрифугируют в течение 10 мин. при 5000 об./мин. при комнатной температуре и хранят при -20°С до проведения анализа.
Сравнения между группами делают с использованием двустороннего непараметрического U-критерия Манна-Уитни. Разницы, при которых значение Р составляет меньше 0,05 считают статистически достоверными.
Исследуют эффект 5C3 на подкожное развитие опухолей MiaPACA-2 (см. Фигуры 16 и 17) или НСТ116 у бестимусных голых мышей. Либо клеточные линии MiaPACA-2/HCTI16, либо развитые опухоли MiaPACA-2/HCT116 у голых мышей показывают высокие уровни экспрессии и секреции белка S100A4 в культуральную среду и в кровь, соответственно (данные не приводят). Вследствие роли S100A4 в опухолях поджелудочной железы и колоректальных опухолях и доказательства того, что белок секретируется данными клеточными линиями, решают испытать данную модель в плане тестирования активности in vivo представленного моноклонального антитела 5C3.
Ксенотрансплантатаы имплантируют и выращивают, несущих опухоли животных случайным образом распределяют и лечат, как описано выше. Лечение начинают через 17 дней после имплантации клеток для MiaPACA-2 (средний объем опухоли в каждой группе превышает 100 мм3) (день 0), и опухоли собирают в день 30 после лечения. Лечение начинают через 23 дня после имплантации клеток для НСТ116 (средний объем опухоли в каждой группе превышает 220 мм3) (день 0). 5C3 дают внутрибрюшинным путем (25 мг/кг), вводят три раза в неделю при схеме дозирования, как показано на Фигуре 18 (примере для MiaPACA-2).
На Фигуре 16 представляют сравнительный анализ противоопухолевой активности 5C3 в течение времени для мышей, несущих опухоль MiaPACA. Контрольная группа (носитель) демонстрирует максимальный рост опухоли при среднем относительном объеме опухоли 592% относительно исходного объема (перед лечением). Изменения объема опухоли у мышей, которым инъецирован 5C3, показывают максимальный средний относительный объем опухоли 274% (день 30) относительно исходного объема. В связи сданными результатами отмечают (см. Фигуру 17), что лечение с помощью 5C3 вызывает также статистически достоверное снижение массы опухоли по сравнению с контрольной группой в конце эксперимента (день 30). Кроме того, данные разницы отражаются на соотношениях Т/С рассчитанных объема опухоли и массы опухоли, 46% и 38%, соответственно.
Противоопухолевая активность 5C3 в течение времени у мышей, несущих опухоль НСТ116. Контрольная группа (носитель) демонстрирует максимальный рост опухоли при среднем относительном объеме опухоли 557% относительно исходного объема (перед лечением). Изменения объема опухоли у мышей, которым инъецирован 5C3, показывают максимальный средний относительный объем опухоли 511% (день 21) относительно исходного объема. В связи с данными результатами отмечают (данные не приведены), что лечение с помощью 5C3 вызывает снижение массы опухоли по сравнению с контрольной группой в конце эксперимента (день 21), которое больше наблюдаемого при оценке объема опухоли. Кроме того, данные разницы отражаются на соотношениях Т/С (группа лечения относительно контрольной), рассчитанных объема опухоли и массы опухоли, 91% и 74%, соответственно.
Вследствие этого впервые демонстрируют, что лечение моноклональным антителом к S100A4 вызывает статистически достоверную заметную задержку роста опухоли по сравнению с нелеченой группой (носитель) для опухоли поджелудочной железы человека MiaPACA-2 и повышает уровень внутриопухолевого некроза у колоректальной опухоли человека НСТ116, действующего на массу опухоли.
Пример 11. 5C3 блокирует формирование микрососудистой сети опухоли.
Экспериментальные данные позволяют предполагать, что для роста опухоли больше определенного размера необходим ангиогенез, который также может позволить метастаз. Для того, чтобы исследовать, какангиогенез опухоли коррелирует с метастазами при карциномах, авторы подсчитывают микрососуды (капилляры и венулы) и определяют степень густоты микрососудов в исходных инвазивных карциномах. Количество микрососудов и степень густоты также коррелируют с отдаленными метастазами. Оценка опухолевого ангиогенез может, таким образом, оказаться ценной при отборе пациентов с ранней стадией карциномы молочной железы для интенсивного лечения.
Опухоли из модели опухоли с использованием ксенотрансплантата MiaPACA-2 погружают в ОСТ (Tissue-Tek™, фирмы Sakura) и замораживают. Анализируют один криосрез (5 мкм), соответствующий центральной части каждой опухоли. Срезы фиксируют в ацетон/хлороформе (1:1) при -20°С в течение 5 минут, сушат в течение ночи при комнатной температуре, промывают натрий-фосфатным буфером и обрабатывают в течение 10 минут при 4°С в темной камере H2O2 (0,03%) в натрий-фосфатном буфере. Затем срезы промывают натрий-фосфатным буфером и блокируют в течение 20 минут при 4°C с использованием натрий-фосфатного буфера с бычьим сывороточным альбумином (PBS-BSA) (2%) с добавлением кроличьей сыворотки (5%) (фирмы Vector) и раствором, блокирующим авидин-биотин (фирмы Dako) в течение 10 минут каждый при 4°С. Образцы инкубируют в течение 1 часа при комнатной температуре с первичным антителом, моноклональным крысиным антителом к мыши, направленным к CD31 (разведение 1:200, фирмы BD PharMingen), разведенном в блокирующем буфере. После инкубирования срезы инкубируют с поликлональным биотинилированным антителом к крысе к качестве вторичного антитела (разведение 1:500, фирмы Vector) в течение 30 минут при комнатной температуре и инкубируют с реагентом ABC (фирмы Pierce) в течение 30 минут при комнатной температуре. Наконец, срезы инкубируют с NovaRed (фирмы Vector) в течение 20 минут при 4°С, окрашивают гематоксилином Харриса (фирмы Sigma) в течение 10 секунд и готовят препарат с использованием неводной среды для изготовления препаратов DPX (фирмы Sigma).
Количественную оценку ангиогенеза проводят с использованием двух критериев:

Делают 8 и 39 снимков/срез в зависимости от размера опухолей и проводят анализ с использованием пакета программ визуализации NIH Imaged.
Сравнения между группами проводят с использованием двустороннего непараметрического U-критерия Манна-Уитни. Разницы, при которых значение Р составляет меньше 0,05, считают статистически достоверными.
Исследуют, действительно ли 5C3 действует на ангиогенез опухоли in vivo. Оценку ангиогенеза опухоли проводят на основе иммуноокрашивания CD31 и двух аналитических аппроксимациях: Густота микрососудов (M.V.D.) и фракционная площадь сосудов (А.А.).
В Таблице 2 показывают все полученные данные, животное за животным, в связи с числом анализируемых снимков для каждой подкожной опухоли MiaPACA-2, общей площади сосудов, количества сосудов, общей площади опухоли, и количественными оценками M.V.D. и % А.А.
Опухоли, полученные от животных, леченных моноклональным антителом 5C3, демонстрируют уменьшение приблизительно на 40% по густоте микрососудов и на 30% площади среза, занятой сосудами, по сравнению с животными из контрольной группы (носитель). Как показано на Фигурах 19 и 20, данные разницы во внутри опухолевых сосудах статистически достоверны.
Полученные экспериментальные данные показывают, что эффект блокирования посредством 5C3 развития опухоли может быть частично обусловлен сильнейшим снижением уровня ангиогенеза опухоли.
Пример 12. Лечение 5C3 не вызывает потерю массы тела или вредных побочных эффектов.
Профиль массы тела в день введения в леченной 5C3 и получающей носитель контрольной группе мониторируют до введения во время эксперимента. Потерю массы тела не наблюдают ни в одной группе, и лечение не прерывают.
На Фигурах 21 и 22 показывают профиль массы тела животных в течение эксперимента. 5C3 хорошо переносится в дозе 25 мг/кг при схеме дозирования три раза в неделю до конца эксперимента.
Макроскопические анализы животных не выявляют патологий в органах. Ни у одного животного в течение эксперимента не наблюдают вредных побочных эффектов (некоординированность движений, паралич, атаксия, судороги, диаррея, кахексия, эритема, гипотермия, летальность).
Пример 13. Количественное определение S100A4 в плазме на модели ксенотрансплантата опухоли.
Существует необходимость ранней детекции опухолей и метастазов, важного способа усовершенствования лечения онкологических пациентов. Выявление молекулярных биомаркеров с использованием неинвазивных простых тестов, таких как способы количественной оценки на базе крови, являются одной из важнейших клинических потребностей в плане выявления присутствия опухоли и мониторирования лечения рака.
Уровни в плазме S100A4 количественно оценивают способом сэндвичевого ELISA. Вкратце, 96-луночные планшеты для микротитрования (Maxisorb, фирмы NUNC) покрывают 10 мкг/мл моноклонального антитела 5C3, разведенного в натрий-фосфатном буфере (100 мкл/лунку), в течение 24 часов при 4°С. После удаления покрытия планшета дважды промывают натрий-фосфатным буфером (PBS) и инкубируют в течение 1 часа при 37°С в блокирующем буфере (PBS, содержащий 1% обезжиренного молока).
Образцы плазмы, разведенные 1:4 в буфере для разведения (PBS-4% BSA), наносят на лунки (100 мкл/лунку) и инкубируют 2 часа при 37°С.Планшеты промывают восемь раз буфером для промывания (PBS-0,1% Твин-20) и вторичное кроличье поликлональное антитело к S100A4 (Dako) в подходящем разведении наносят на лунки (100 мкл/лунку) и инкубируют в течений 1 часа при 37°С.
Планшеты промывают восемь раз буфером для промывания и конъюгированное с пероксидазой козье IgG к кролику (Sigma) в подходящем разведении добавляют в каждую лунку (100 мкл/лунку) инкубируют в течение 1 часа при 37°С. После промывания восемь раз буфером для промывания поводят ELISA, добавляя 100 мкл тетраметилбензидинового субстрата (Sigma) и инкубируют в течение 30 минут при комнатной температуре до остановки реакции 1М HCl. Поглощение читают при длине волны 450 нм.
Стандартную кривую для исходных образцов плазмы (животные без опухоли) получают путем серийных разведении мышиного рекомбинантного S100A4 в буфере для разведении. Стандартную кривую для конечных образцов плазмы (животные с опухолью в конце эксперимента) получают путем серийных разведении человеческого рекомбинантного S100A4 в буфере для разведении.
На Фигуре 23 показывают количественную оценку уровней S100A4 в плазме у животных, несущих подкожную опухоль (среднее объемом опухолей составляет приблизительно 600-1000 мм3) нескольких клеточных линий MiaPACA-2, Colo205, MDA-MB-231 и НСТ116. Экспериментальные данные демонстрируют согласующуюся разницу между исходным уровнем экспрессии белка S100A4 у животных без опухолей (исходный-02) и уровнем экспрессии в конце эксперимента, когда животные представляют опухоли.
На Фигуре 23 также показывают уровни белка S100A4 у животных, леченных моноклональным антителом 5C3 (модель ксенотрасплантата опухоли MiaPACA-2 и НСТ116), демонстрируя, что соответствующее лечение (см. пример 10) блокирует весь циркулирующий белок S100A4 в плазме.
Пример 14. Определение эпитопа моноклональных антител 5C3, 1Е2, 6В9, 8В6 и 5А3.
Определение эпитопного участка распознавания антитела оценивают с помощью ELISA. Вкратце, последовательность полной длины человеческого белка S100A4 фракционируют с получением девяти перекрывающихся пептидов. 96-луночные планшеты для микротитрования (Maxisorb, фирмы NUNC) покрывают 3 мкг/мл каждого пептида, разведенного в натрий-фосфатном буфере (PBS) (100 мкл/лунку), в течение 24 часов при 4°С.
Антитела к S100A4, разведенные до 5 мкг/мл в буфере для разведении (PBS-1% бычий сывороточный альбумин (БСА)), вносят в лунки (100 мкл/лунку) и инкубируют в течение 90 минут при 37°С. Планшеты промывают восемь раз буфером для промывания (PBS-0,1% Твин-20) и конъюгированное с пероксидазой козье IgG к мыши (фирмы Jackson Immunoresearch) в подходящем разведении добавляют в каждую лунку (100 мкл/лунку) и инкубируют в течение 30 минут при 37°С. После промывания восемь раз буфером для промывания проводят ELISA, добавляя 100 мкл тетраметилбензидинового субстрата (фирмы Sigma), и инкубируют в течение 15 минут при комнатной температуре перед остановкой реакции 1М HCl. Поглощение читают при длине волны 450 нм.
В Таблице 3 показывают участок человеческого S100A4, распознаваемого функциональными моноклональными антителами 5C3, 1 Е2, 6В9, 8В6 и 5А3. Отмечают, что антитело 8 В6 не распознает ни один из девяти созданных линейных пептидов, представляя вероятность того, что оно распознает конформационный участок белка. Другое моноклональное антитело к человеческому S100A4, обозначаемое 5Н4, используемое в качестве отрицательного контроля в анализах миграции, распознает другой участок (VMVSTFHKYSGKEGDKFKLN) (SEQ ID NO:26).
Пример 15. Цитотоксический эффект гемцитабина и 5C3.
Рак представляет собой многостадийный и многофакторный процесс и, вследствие этого, стратегии лечения, направленные на различные молекулярные мишени отделов опухоли, являются в настоящее время наилучшими вариантами борьбы с данным заболеванием. Принятую химиотерапию, такую как гемцитабин, стандартный препарат первой линии, предназначенный для лечения запущенного рака поджелудочной железы, широко используют, но она дает только слабый положительный эффект вследствие приобретения резистентности в химиотерапии и множества вредных эффектов. Таким образом, необходимо идентифицировать менее токсичные направленные препараты, которые могут сенсибилизировать ряд отделов опухоли и которые в комбинации со стандартной химиотерапией будут более эффективно уничтожать клетки опухоли. Для повышения противоопухолевого эффекта и идентификации новых реагентов для лечения рака поджелудочной железы исследуют эффекты моноклонального антитела 5C3 в комбинации с гемцитабином на пролиферацию и выживаемость клеток в клеточной линии человеческого рака поджелудочной железы MiaPACA-2.
Цитотоксический эффект гемцитабина и моноклонального антитела 5C3 измеряют по активности гексозоаминидазы. Вкратце, клетки MiaPACA-2 выращивают на 96-луночных планшетах для культивирования клеток (5×103 клеток/лунку) в 50 мкл среды DM ЕМ. Через двадцать четыре часа 50 мкл среды с несколькими концентрациями гемцитабина как монопрепарата или в комбинации с 5C3 (40 нМ, 100 нМ) добавляют к каждой лунке и культивируют в течение 72 часов. После удаления культуральной среды клетки однократно промывают натрий-фосфатным буфером. Шестьдесят микролитров раствора субстрата (р-нитрофенол-N-ацетил-β-D-глюкозамид 7,5 мМ, цитрат натрия 0,1 М, 0,25% Тритон Х-100, рН 5,0,) добавляют в каждую лунку и инкубируют планшеты при 37°С в течение 2 часов; после данного периода инкубирования появляется светло-желтое окрашивание и планшеты проявляют добавлением 90 мкл проявляющего раствора (глицин 50 мМ, ЭДТА 5 мМ, рН 10,4), и измеряют поглощение при длине волны 450 нм при использовании многолуночного сканирующего спектрофотометра. Проводят анализ данных, нормализуя результаты относительно отрицательного контроля (необработанные клетки), который принимают за 100% выживаемость.
Кривые подводят, используя сигмоидное уравнение доза-ответ (вариабельный наклон), и значения ЕС50 получают из уравнения:
Y = нижняя точка + (верхняя точка - нижняя точка)/(1+10^ ((LogEC50-X) * наклон)), где Х означает логарифм концентрации и Y означает ответ. Y начинается в нижней точке и проходит до верхней точки, имея сигмоидную форму.
Для оценки уровня взаимодействия (синергический, аддитивный или антагонистический эффект) между гемцитабином и 5C3, используют вариант способа, предложенного Чу-Талалей. Вкратце, эффект гемцитабина с 5C3 количественно оценивают по коэффициенту комбинации (CI):
CI=(D)1/(Dm)1
где (Dm)1 = концентрация лекарственного препарата 1 ЕС50 и (D)1 = EC50 (лекарственный препарат 1 + лекарственный препарат 2)
На Фигуре 24 показывают эффект на выживаемость клеток, индуцируемый обработками гемцитабином в виде монопрепарата и комбинацией гемцитабина и двух концентраций моноклонального антитела 5C3 на клеточной линии MiaPACA-2. EC50 для гемцитабина составляет 8,356 нМ. Комбинация с 5C3 показывает EC50 5,161 нМ и 4,586 нМдля40нМ и 100 нМ MAT, соответственно.
Определение коэффициента CI показывает значения 0,61 и 0,54 для комбинации гемцитабина с 40 нМ и 100 нМ 5C3, демонстрируя синергический эффект двух соединений.
Данный эксперимент впервые демонстрирует, что комбинация моноклонального антитела к S100A4 химиотерапевтическим препаратом гемцитабином может синергически повысить эффект лекарственного препарата, применяемого как монотерапия. По данной причине моноклональные антитела к S100A4 можно рассматривать, как новые кандидаты для применения в комбинации с химиотерапетическими препаратами для лечения рака у пациентов.
Пример 16. S100A4 индуцирует секрецию ИЛ-8 в моноцитах ТНР1, и моноклональное антитело 5C3 блокирует данный эффект.
Хронические воспалительные заболевания содержат большую группу нарушений, характеризующуюся активацией мононуклеарных клеток, таких как моноциты и лимфоциты. Одним из признаков хронического воспаления и аутоиммунных заболеваний является интенсивная активация и накопление клеток моноцитов/макрофагов. Активированные моноциты и макрофаги являются наиболее важным источником цитокинов при большинстве хронических воспалительных нарушений. Принимая во внимание все данные факты, исследуют, может ли блокирование S100A4 быть полезным в плане лечения хронических воспалительных заболеваний, при которых активация моноцитов играет центральную роль.
Для оценки эффекта 5C3 на активацию моноцитов ТНР-1, человеческую моноцитарную клеточную линию обрабатывают S100A4 и уровни секретируемого ИЛ-8 используют как показатель активации моноцитов.
Клетки клеточной линии человеческого моноцитарного лейкоза ТНР-1 (АТСС) выращивают в среде для культивирования RPMI 1640 с добавлением 10% FCS и 1% пенициллина/стрептомицина при 37°С в 5% CO2 в термостате с увлажнением. Клетки высевают в концентрации 5,0×105 клеток/лунку. S100A4 и антитело 5C3 инкубируют вместе в течение 1 часа перед добавлением моноцитов. IgG к мыши (Fc-специфическое) всегда добавляют во всех случаях для предупреждения ответа Fc-рецептора. Супернатанты культуры клеток собирают через 24 часа и хранят при -20°С. Уровни ИЛ-8 анализируют сэндвичевым ELISA.
Активированные S100A4 человеческие моноциты дозозависимым образом индуцируют высвобождение цитокинов (см. Фигуру 25). Данный ответ можно блокировать моноклональным антителом 5C3 (см. Фигуру 26). Как 5C3, так и IgG к мыши в отсутствие S100A4 не проявляют эффект на уровни ИЛ-8 (данные не приводят).
Данные факты позволяют предположить, что 5C3 может быть полезен при лечении всех хронических воспалительных заболеваний, таких как ревматоидный артрит, псориатический артрит, псориаз, воспалительная болезнь кишки, артериосклероз, рассеянный склероз и т.п., где активация моноцитов играет центральную роль в их патофизиологии.
Депозиты биологического материала
Гибридома, которая продуцирует моноклональное антитело к S100A45C3-1B8-1F4, депонирована в Европейской коллекции клеточных культур (ЕСАСС) (Porton Down, Salisbury, SP4 OJG, United Kingdom) при условиях, оговоренных Будапештским договором. Она депонирована 24 февраля 2010 г., и данному депозиту присвоен номер 10022401.
Гибридома, которая продуцирует моноклональное антитело к S100A4 6В9-1Е8-2А8, депонирована в Европейской коллекции клеточных культур (ЕСАСС) (Porton Down, Salisbury, SP4 OJG, United Kingdom) при условиях, оговоренных Будапештским договором. Она депонирована 18 мая 2011 г., и данному депозиту присвоен номер ЕСАСС 11051801.
Гибридома, которая продуцирует моноклональное антитело к S100A4 5А3-4А6-5 В6, депонирована в Европейской коллекции клеточных культур (ЕСАСС) (Porton Down, Salisbury, SP4 OJG, United Kingdom) при условиях, оговоренных Будапештским договором. Она депонирована 18 мая 2011 г., и данному депозиту присвоен номер ЕСАСС 11051802.
Гибридома, которая продуцирует моноклональное антитело к S100A4 1E2-2H4-2G8, депонирована в Европейской коллекции клеточных культур (ЕСАСС) (Porton Down, Salisbury, SP4 OJG, United Kingdom) при условиях, оговоренных Будапештским договором. Она депонирована 18 мая 2011 г., и данному депозиту присвоен номер ЕСАСС 11051803.
Гибридома, которая продуцирует моноклональное антитело к S100A4 8B6-2F6-1Н9-1Н10, депонирована в Европейской коллекции клеточных культур (ЕСАСС) (Porton Down, Salisbury, SP4 OJG, United Kingdom) при условиях, оговоренных Будапештским договором. Она депонирована 18 мая 2011 г., и данному депозиту присвоен номер ЕСАСС 11051804.
SEQ CHAPTER \h \r 1
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2678127C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ РАКА | 2009 |
|
RU2533460C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2676731C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ РЕЦЕПТОР 1 ТИПА ФАКТОРА РОСТА ФИБРОБЛАСТОВ, ПРИМЕНЕНИЕ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ, СПОСОБ ПОЛУЧЕНИЯ АНТИТЕЛ | 2015 |
|
RU2638457C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ И РАКА | 2016 |
|
RU2761980C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2816850C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2639540C2 |
| АНТИТЕЛА К CXCR4 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2009 |
|
RU2573897C2 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |












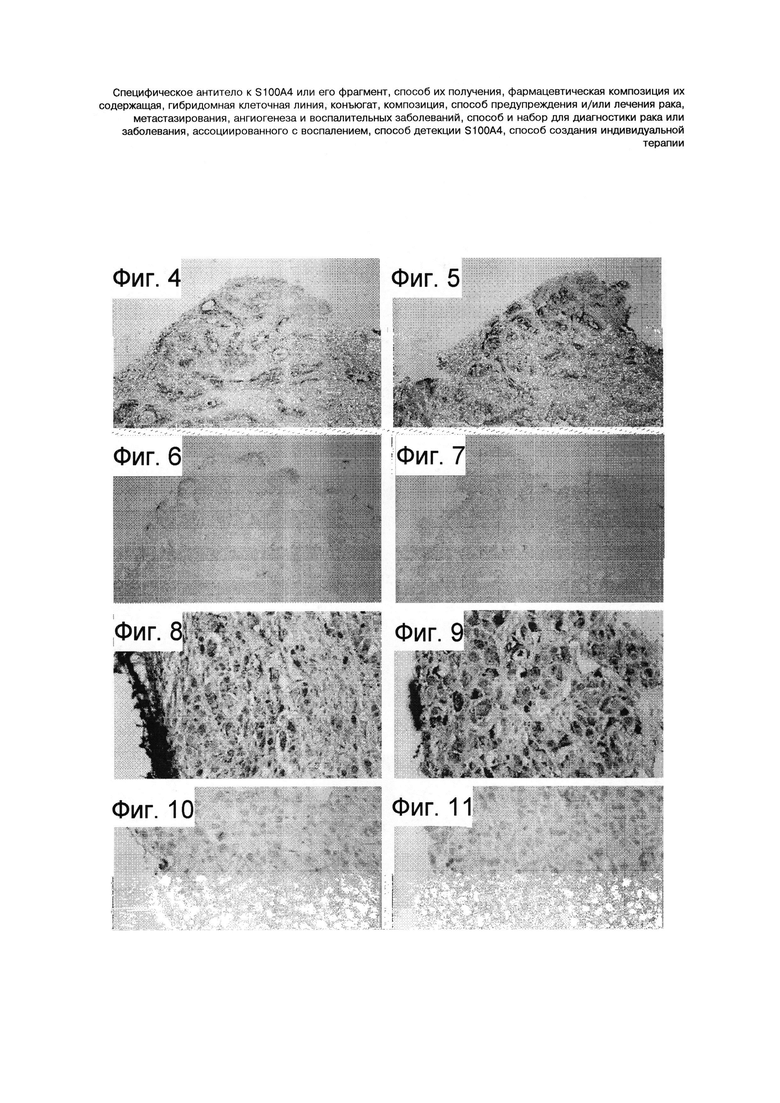
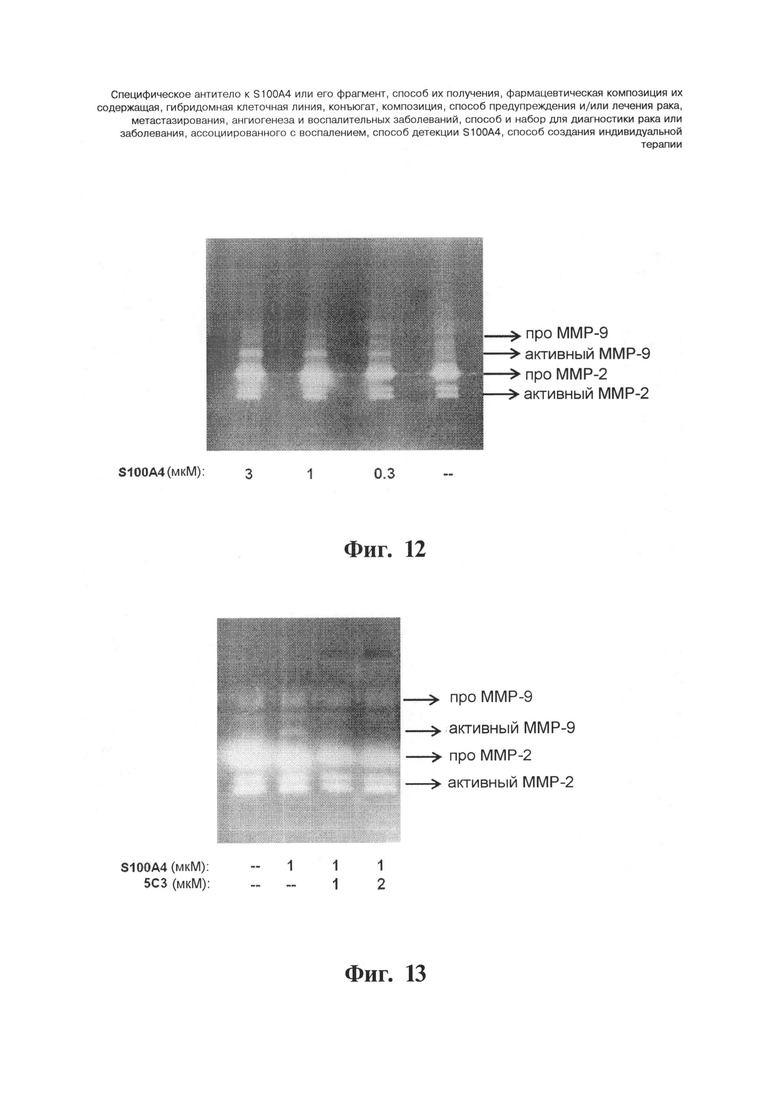
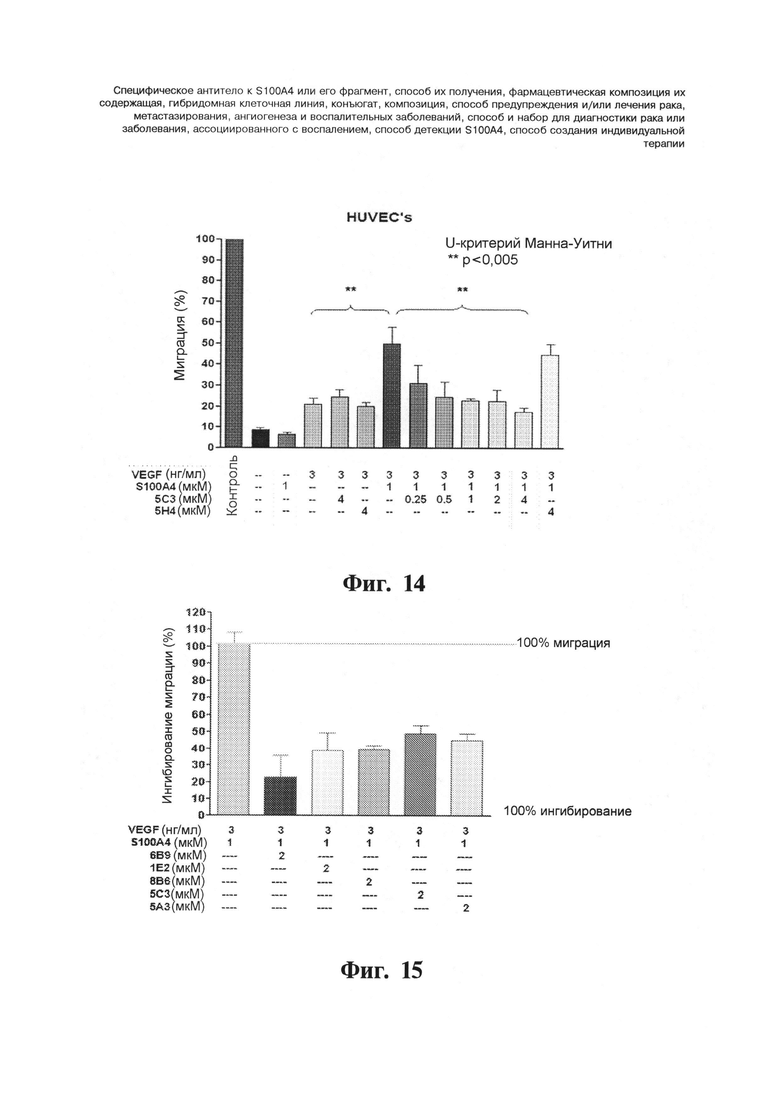
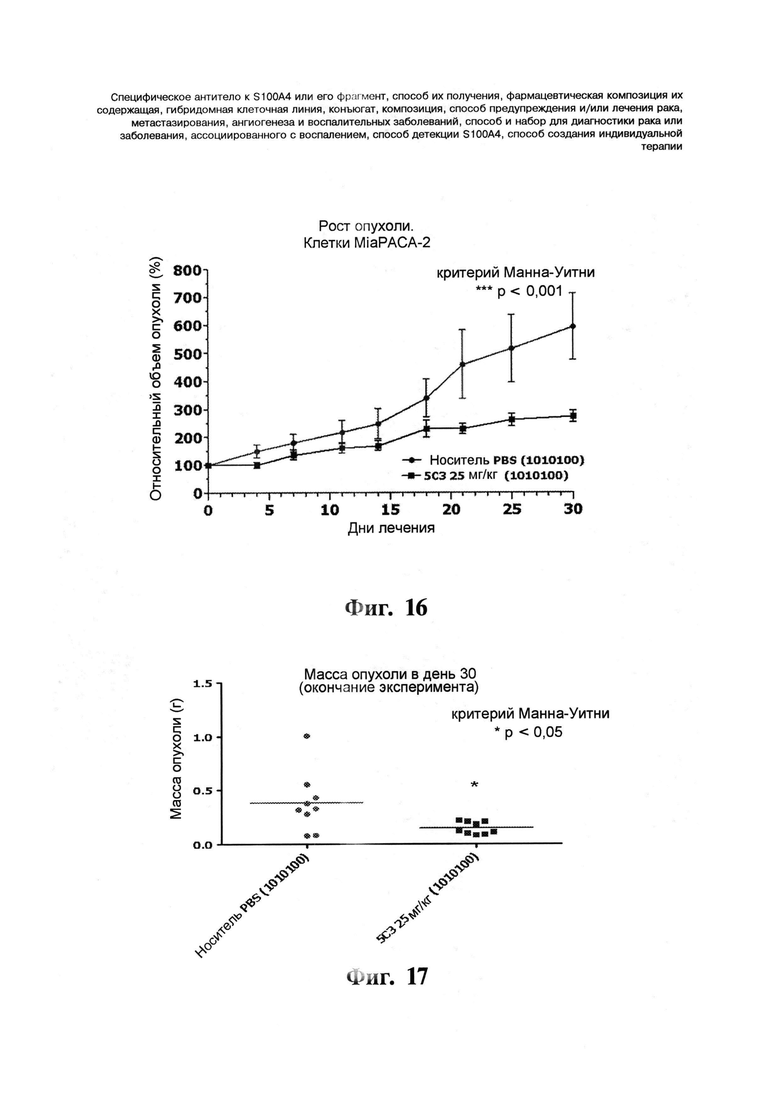
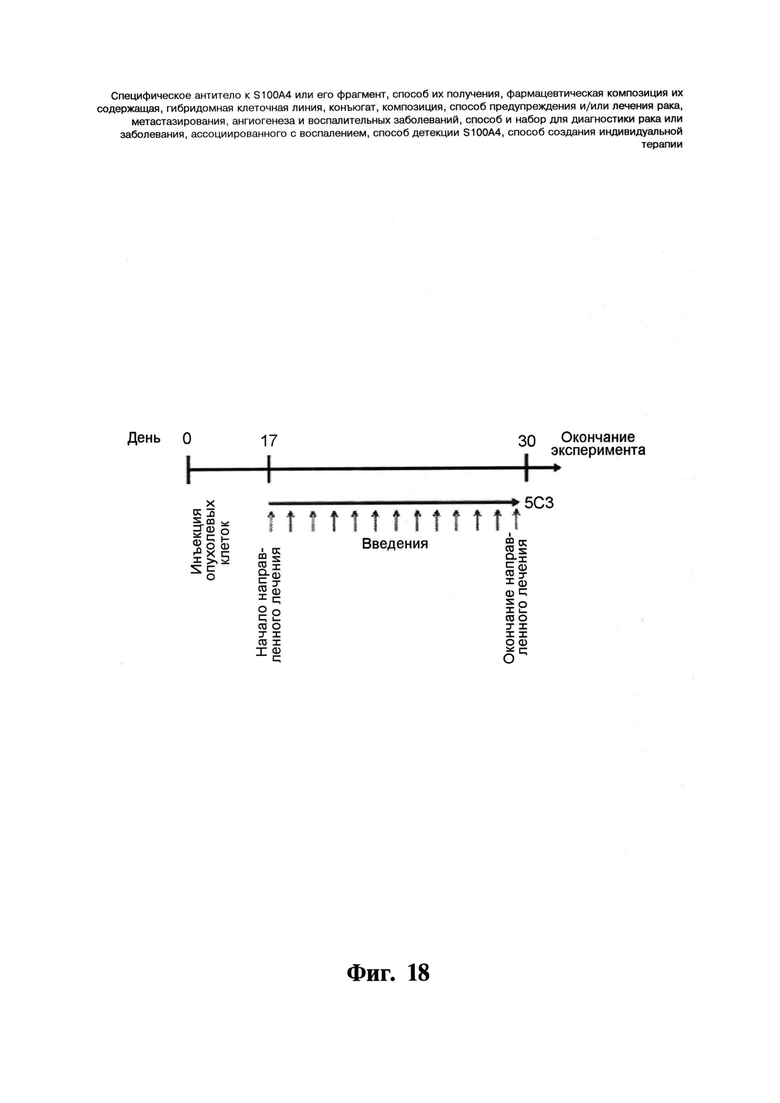

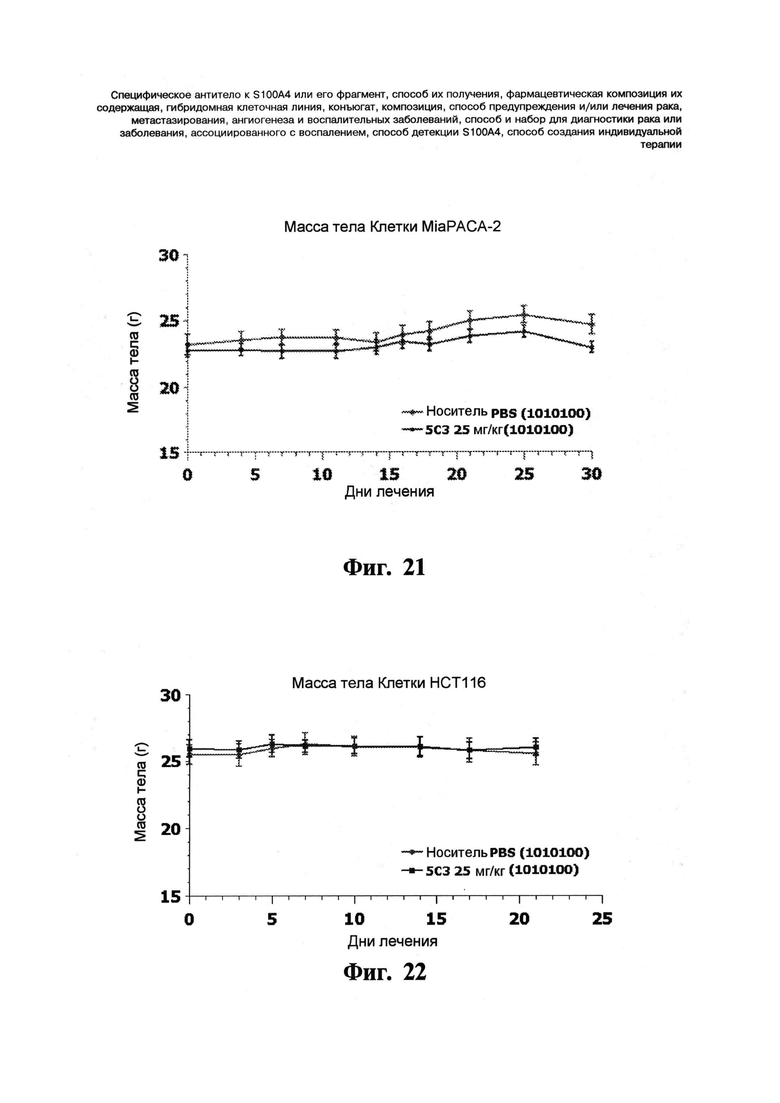
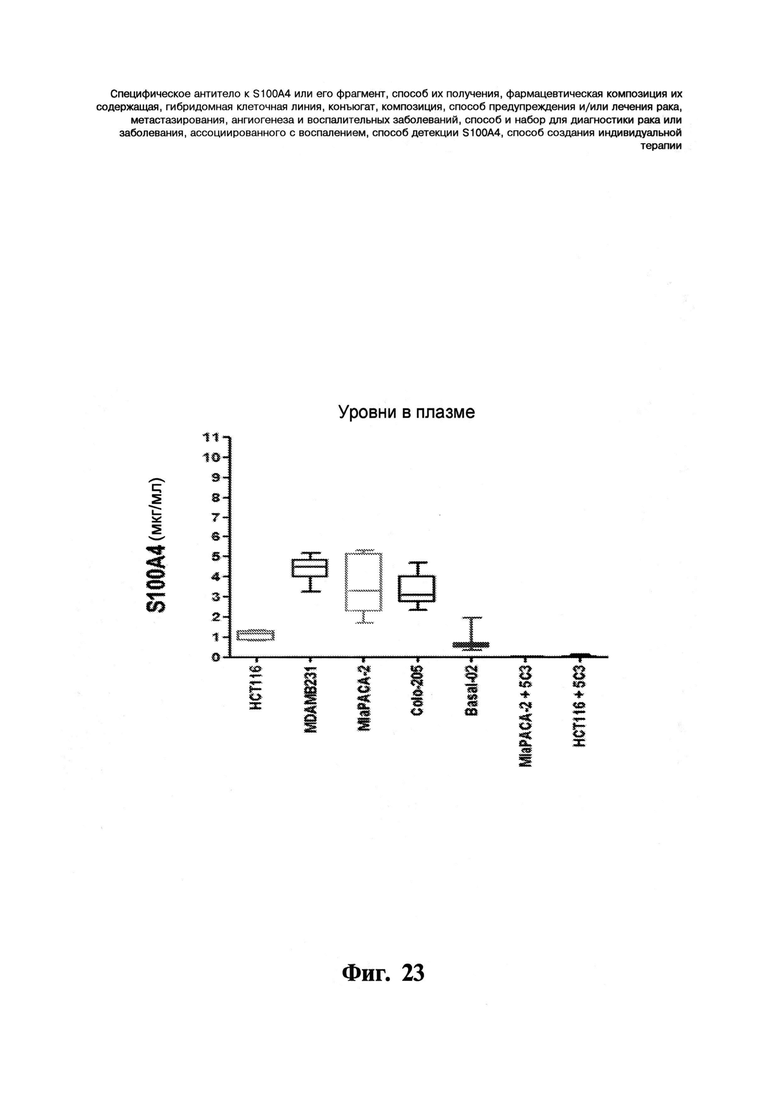
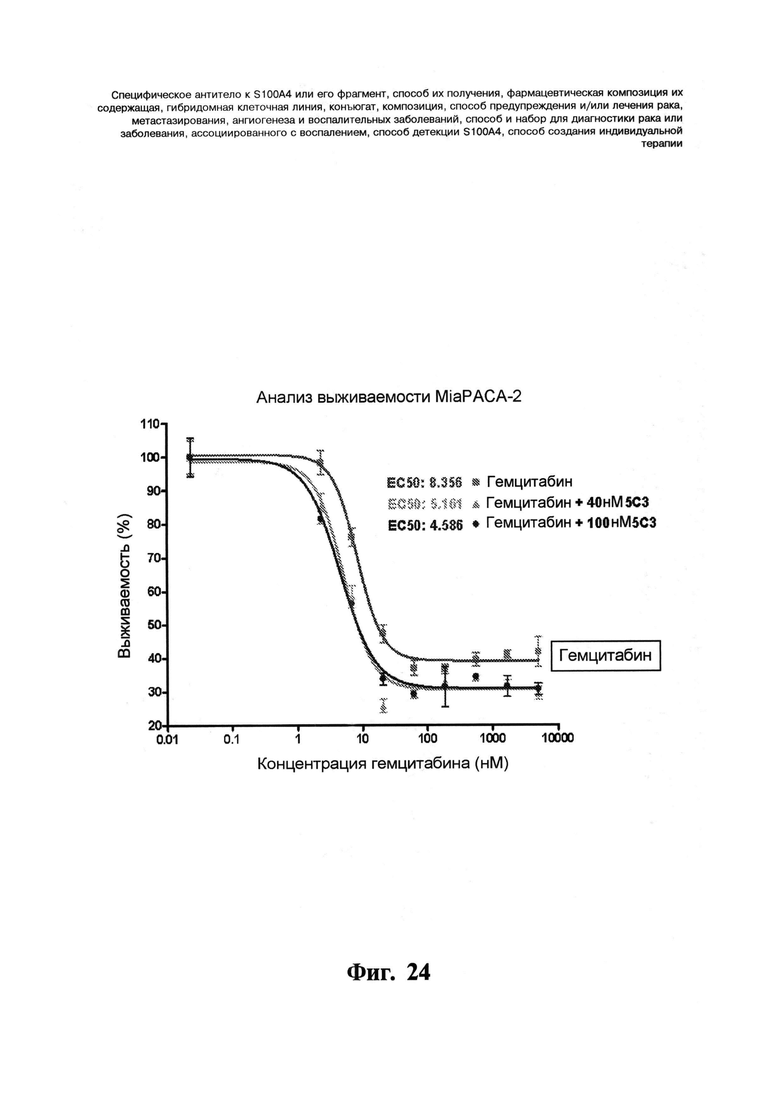
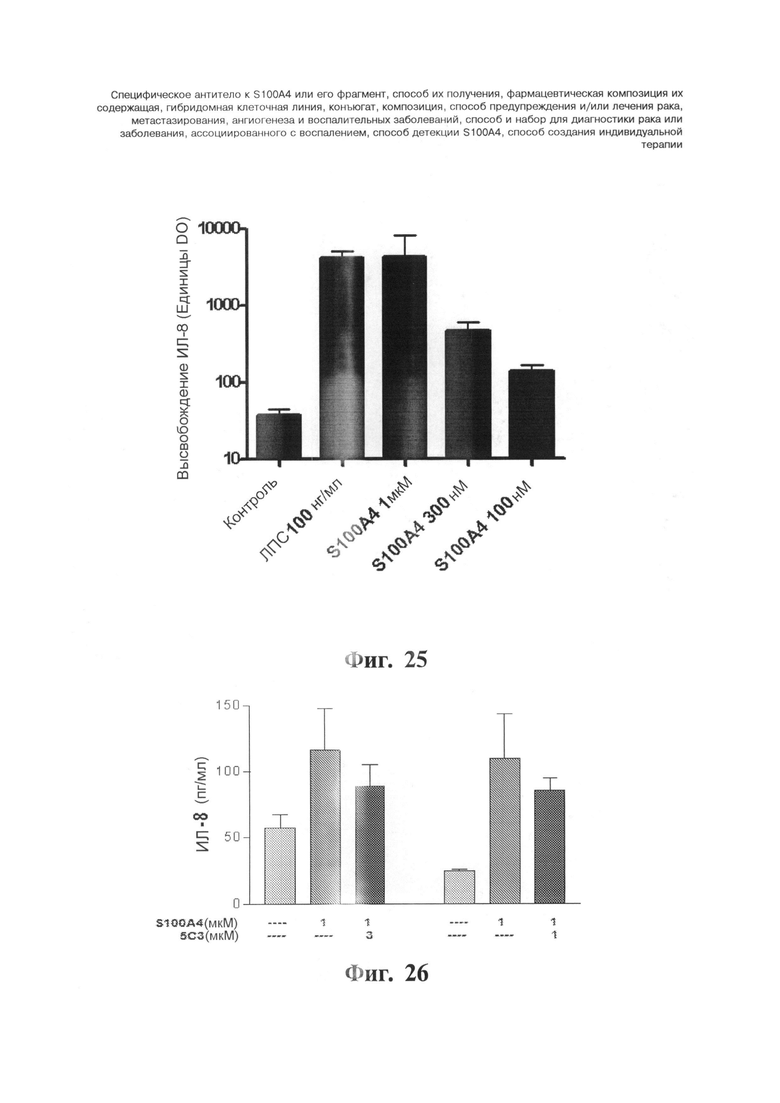
Изобретение относится к биохимии. Описано антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела, причем антитело продуцировано гибридомой ЕСАСС 10022401. Антитело содержит по меньшей мере область VL, включающую последовательность SEQ ID NO: 1, и по меньшей мере область VH, включающую последовательность SEQ ID NO: 2, и распознает эпитоп, содержащий последовательность SEQ ID NO: 3, и характеризуется профилем активности, представленным на фиг. 15. Также описано антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела, причем антитело продуцировано гибридомой, выбранной из группы, включающей ЕСАСС 11051801, ЕСАСС 11051802 и ЕСАСС 11051803, распознает эпитоп, содержащий последовательность SEQ ID NO: 24, и характеризуется профилем активности, представленным на фиг. 15. Также описано применение указанных антител по ряду назначений. Изобретение расширяет арсенал средств для предупреждения и/или лечения рака, метастазирования, ангиогенеза и воспалительных заболеваний. 27 н. и 9 з.п. ф-лы, 26 ил., 4 табл., 16 пр.
1. Специфическое антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела, причем антитело продуцировано гибридомой ЕСАСС 10022401, содержащее по меньшей мере область VL, включающую последовательность SEQ ID NO: 1, и по меньшей мере область VH, включающую последовательность SEQ ID NO: 2, распознающее эпитоп, содержащий последовательность SEQ ID NO: 3, и характеризующееся профилем активности, представленным на фиг. 15.
2. Антитело или его фрагмент по п. 1, которое характеризуется блокировкой человеческих эндотелиальных клеток к миграции.
3. Специфическое антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела, причем антитело продуцировано гибридомой, выбранной из группы, включающей ЕСАСС 11051801, ЕСАСС 11051802 и ЕСАСС 11051803, распознает эпитоп, содержащий последовательность SEQ ID NO: 24, и характеризуется профилем активности, представленным на фиг. 15.
4. Антитело или его фрагмент по п. 3, которое характеризуется блокировкой человеческих эндотелиальных клеток к миграции.
5. Гибридомная клеточная линия для получения моноклонального антитела, включающая клеточную линию, депонированную под регистрационным номером ЕСАСС 10022401.
6. Гибридомная клеточная линия для получения моноклонального антитела, включающая клеточную линию, депонированную под регистрационным номером ЕСАСС 11051801.
7. Гибридомная клеточная линия для получения моноклонального антитела, включающая клеточную линию, депонированную под регистрационным номером ЕСАСС 11051802.
8. Гибридомная клеточная линия для получения моноклонального антитела, включающая клеточную линию, депонированную под регистрационным номером ЕСАСС 11051803.
9. Фармацевтическая композиция для предупреждения и/или лечения рака, метастазирования, ангиогенеза и воспалительных заболеваний, включающая фармацевтически эффективное количество по меньшей мере одного антитела или его фрагмента по любому из пп. 1-4 и по меньшей мере один фармацевтически приемлемый носитель.
10. Применение специфического антитела к S100A4, характеризующегося антиангиогенной активностью, или его фрагмента, по существу сохраняющего антиангиогенную активность указанного антитела по пп. 1-4 в качестве средства предупреждения и/или лечения метастазов.
11. Применение специфического антитела к S100A4, характеризующегося антиангиогенной активностью, или его фрагмента, по существу сохраняющего антиангиогенную активность указанного антитела по пп. 1-4 в качестве средства предупреждения и/или лечения заболевания, ассоциированного с нежелательным ангиогенезом.
12. Применение специфического антитела к S100A4, характеризующегося антиангиогенной активностью, или его фрагмента, по существу сохраняющего антиангиогенную активность указанного антитела по пп. 1-4 в качестве средства предупреждения и/или лечения заболевания, ассоциированного с воспалением.
13. Применение специфического антитела к S100A4, характеризующегося антиангиогенной активностью, или его фрагмента, по существу сохраняющего антиангиогенную активность указанного антитела по пп. 1-4 в качестве средства предупреждения и/или лечения рака.
14. Применение антитела или его фрагмента по п. 13, в котором указанный рак выбран из группы, включающей рак поджелудочной железы и колоректальный рак.
15. Конъюгат для предупреждения и/или лечения рака, метастазирования, ангиогенеза и воспалительных заболеваний, включающий специфическое антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела по пп. 1-4, и второй компонент, выбранный из группы, включающей антиангиогенное средство, антиметастатическое средство, цитотоксическое средство и противовоспалительное средство.
16. Применение конъюгата по п. 15 для предупреждения и/или лечения метастазов.
17. Применение конъюгата по п. 15 для предупреждения и/или лечения заболевания, ассоциированного с нежелательным ангиогенезом.
18. Применение конъюгата по п. 15 для предупреждения и/или лечения заболевания, ассоциированного с воспалением.
19. Способ получения антитела по любому из пп. 1-2, включающий культивирование гидридомной клеточной линии по п. 5 в условиях, обеспечивающих продуцирование указанного антитела.
20. Способ получения антитела по любому из пп. 3-4, включающий культивирование гидридомной клеточной линии по любому из пп. 6-8 в условиях, обеспечивающих продуцирование указанного антитела.
21. Композиция для предупреждения и/или лечения рака, метастазирования, ангиогенеза и воспалительных заболеваний, включающая специфическое антитело к S100A4, характеризующееся антиангиогенной активностью, или его фрагмент, по существу сохраняющий антиангиогенную активность указанного антитела, по любому из пп. 1-4 и антиметаболит.
22. Композиция по п. 21, в которой антиметаболит представляет собой гемцитабин.
23. Композиция по п. 21, в которой специфическое антитело к S100A4 представляет собой моноклональное антитело по любому из пп. 1-2.
24. Композиция по любому из пп. 21-23, которая характеризуется снижением выживаемости опухолевых клеток.
25. Применение композиции по любому из пп. 21-23 в качестве средства предупреждения и/или лечения рака.
26. Применение композиции по любому из пп. 21-23 в качестве средства предупреждения и/или лечения метастазов.
27. Применение специфического антитела к S100A4 по любому из пп. 1-4, характеризующегося антиангиогенной активностью, или его фрагмента, по существу сохраняющего антиангиогенную активность указанного антитела в качестве средства получения лекарственного средства для предупреждения и/или лечения заболевания, связанного с воспалением.
28. Применение по п. 27, в котором специфическое антитело к S100A4 представляет собой антитело по любому из пп. 1-2.
29. Способ in vitro диагностики рака у пациента, включающий детекцию уровней белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, в биожидкости, полученной от указанного пациента, посредством моноклонального антитела по любому из пп. 1-4 или его функционального варианта, характеризующегося по меньшей мере 60% идентичностью последовательности с указанным антителом, и сравнение указанных уровней с эталонным значением, причем повышенные уровни белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, относительно эталонного значения указывают на наличие у пациента рака.
30. Способ по п. 29, в котором указанная биожидкость выбрана из группы, включающей кровь, плазму и сыворотку.
31. Способ in vitro диагностики заболевания, ассоциированного с воспалением, у пациента, включающий детекцию уровней белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, в биожидкости, полученной от указанного пациента, посредством моноклонального антитела по любому из пп. 1-4 или его функционального варианта, характеризующегося по меньшей мере 60% идентичностью последовательности с указанным антителом, и сравнение указанных уровней с эталонным значением, причем повышенные уровни белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, относительно эталонного значения указывают на наличие у пациента заболевания, ассоциированного с воспалением.
32. Способ по п. 31, в котором указанная биожидкость выбрана из группы, включающей кровь, плазму и сыворотку.
33. Способ детекции S100A4 в образце, включающий контактирование образца, предположительно содержащего S100A4, со специфическим антителом к S100A4 или его фрагментом по любому из пп. 1-4, и детекцию формирования иммунных комплексов между S100A4 и антителом или его фрагментом, причем детекция указанных комплексов иммунных комплексов между S100A4 и антителом характеризует присутствие S100A4 в образце.
34. Набор для диагностики рака в биожидкости, включающий по меньшей мере одно антитело или его фрагмент по любому из пп. 1-4 и по меньшей мере один дополнительный компонент.
35. Набор для диагностики заболевания, ассоциированного с воспалением в биожидкости, включающий по меньшей мере одно антитело или его фрагмент по любому из пп. 1-4 и по меньшей мере один дополнительный компонент.
36. Способ in vitro создания индивидуальной терапии для пациента с диагностированным раком, включающий определение уровней белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, в биожидкости указанного пациента и сравнение уровней белка S100A4 с эталонным значением, причем повышенные уровни белка S100A4 или его варианта, характеризующегося по меньшей мере 70% идентичностью последовательности с S100A4, относительно эталонного уровня указывают на необходимость лечения пациента специфическим антителом к S100A4, характеризующимся антиангиогенной активностью, или его фрагментом, по существу сохраняющим антиангиогенную активность указанного антитела, по любому из пп. 1-4.
| WO2007071248 A2, 28.07.2007 | |||
| WO2007071248 A2, 28.07.2007 | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| ZHANG et al., "A Novel Monoclonal Antibody Against Human S100A4 Its Production, Characterization and Application", Calcium Binding Proteins 1:4, 219-223, 2006 | |||
| СИНГЕР и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пер с англ.-М.: Мир, 1998, 373 с., стр.63. | |||
Авторы
Даты
2017-04-06—Публикация
2011-06-14—Подача